Sperling Nội tiết học Nhi khoa, Ấn bản thứ 5 – Biên dịch: Ths.Bs. Lê Đình Sáng
Sperling Pediatric Endocrinology, Fifth Edition
Tác giả: Sperling, Mark A., MD – Nhà xuất bản: Elsevier Inc.
PHẦN III. NỘI TIẾT HỌC TRẺ EM VÀ THANH THIẾU NIÊN
Chương 12. Rối Loạn Thùy Sau Tuyến Yên
Abhinash Srivatsa; Joseph A. Majzoub
Disorders of the Posterior Pituitary
Sperling Pediatric Endocrinology, 12, 357-394
Giới thiệu
Việc duy trì trương lực của dịch ngoại bào trong một phạm vi rất hẹp là cực kỳ quan trọng đối với chức năng bình thường của tế bào. Áp lực thẩm thấu ngoại bào điều chỉnh hình dạng tế bào, cũng như nồng độ nội bào của các ion và các chất thẩm thấu khác. Hơn nữa, nồng độ ion ngoại bào phù hợp là cần thiết cho hoạt động chính xác của các kênh ion, điện thế hoạt động và các phương thức giao tiếp giữa các tế bào khác. Trương lực dịch ngoại bào được điều chỉnh gần như hoàn toàn bởi lượng nước nhập vào và bài tiết ra, trong khi thể tích ngoại bào được điều chỉnh bởi lượng natri clorua nhập vào và bài tiết ra. Ở trẻ em và người lớn, trương lực máu bình thường được duy trì ổn định dù lượng nước uống vào có thể thay đổi gấp 10 lần, nhờ vào sự tương tác phối hợp giữa cảm giác khát, vasopressin và hệ thống thận. Rối loạn chức năng ở bất kỳ hệ thống nào trong số này đều có thể dẫn đến việc điều hòa áp lực thẩm thấu máu bất thường, nếu không được nhận biết và điều trị đúng cách có thể gây ra rối loạn chức năng đe dọa tính mạng ở tế bào thần kinh và các tế bào khác.
Thùy sau tuyến yên, hay còn gọi là thùy thần kinh của tuyến yên (neurohypophysis), tiết ra các hormone nonapeptide là vasopressin (còn gọi là hormone chống bài niệu [ADH]) và oxytocin. Vasopressin kiểm soát cân bằng nội môi nước, và oxytocin điều hòa sự co bóp của cơ trơn trong quá trình sinh con và cho con bú. Các rối loạn về bài tiết và hoạt động của vasopressin dẫn đến những xáo trộn quan trọng trên lâm sàng trong chuyển hóa nước. Trong chương này, chúng tôi tóm tắt sinh lý của việc điều hòa nước và thể tích, trình bày một cách tiếp cận dựa trên triệu chứng để chẩn đoán phân biệt các bệnh về cân bằng nội môi nước, và cung cấp một cái nhìn tổng quan về bệnh học và điều trị các rối loạn liên quan đến các hệ thống này.
Sinh lý điều hòa thẩm thấu và thể tích
Việc kiểm soát trương lực huyết tương và thể tích nội mạch liên quan đến một sự tích hợp phức tạp của các con đường nội tiết, thần kinh và cận tiết. Các con đường cảm biến và đáp ứng thẩm thấu kiểm soát việc điều hòa giải phóng và truyền tín hiệu vasopressin, trong khi cân bằng nội môi thể tích được quyết định phần lớn thông qua hoạt động của hệ renin-angiotensin-aldosterone, với sự đóng góp của cả vasopressin và họ peptide bài niệu natri. Sự hiểu biết sâu hơn về các cấu trúc giải phẫu và các phân tử liên quan đã được phát triển thông qua các nghiên cứu sinh học phân tử và sinh lý học gần đây.
Các con đường cảm biến và đáp ứng thẩm thấu
Hóa sinh của Vasopressin và Oxytocin
Vasopressin và oxytocin là các peptide có liên quan về mặt tiến hóa (paralog), phát sinh từ sự nhân đôi gen của một phân tử chung về mặt phát sinh loài khoảng 450 triệu năm trước. Cả hai peptide đều bao gồm một vòng disulfide 6 axit amin, cộng với một đuôi 3 axit amin, với sự amit hóa ở đầu cuối carboxy. Ngay từ năm 1895, một nguyên lý sinh học mạnh mẽ—bao gồm hoạt động co mạch, “thúc đẻ” và tác dụng tiết sữa—đã được nhận biết trong các chiết xuất từ thùy sau tuyến yên. Trình tự của các peptide riêng lẻ có khả năng co mạch và chống bài niệu (vasopressin) và khả năng gây co bóp tử cung (oxytocin) đã được du Vigneaud và các đồng nghiệp xác định vào giữa những năm 1950, đỉnh cao là việc tổng hợp mỗi hormone ở dạng có hoạt tính sinh học. Ở hầu hết các loài động vật có vú, vasopressin và oxytocin chỉ khác nhau ở hai axit amin—một sự thay thế trong vòng và một trong cấu trúc đuôi (Hình 12.1). Việc khám phá mối quan hệ cấu trúc-chức năng của các axit amin cụ thể, trong cả vasopressin và oxytocin, đã cho phép mô tả các phân tử có công dụng lâm sàng quan trọng. Mặc dù hoạt tính co mạch giảm đi đáng kể khi thay thế L-arginine bằng D-arginine ở vị trí thứ 8 của phân tử vasopressin, thời gian tác dụng lại được kéo dài, và tác dụng chống bài niệu được tăng cường bởi sự deamit hóa ở đầu amino, tạo ra chất tương tự desmopressin (desamino-D-arginine vasopressin [dDAVP]) (xem Hình 12.1). Trong khi tỷ lệ chống bài niệu:co mạch của vasopressin là 1:1, tỷ lệ này ở dDAVP là từ 2000:1 đến 3000:1. Sự khác biệt này gần như hoàn toàn là do sự gắn kết khác biệt của dDAVP với các thụ thể V2 và V1 (2054:1). dDAVP, với hiệu lực chống bài niệu mạnh gấp 2 đến 3 lần so với vasopressin gốc, hiện được sử dụng thường quy trong thực hành lâm sàng.
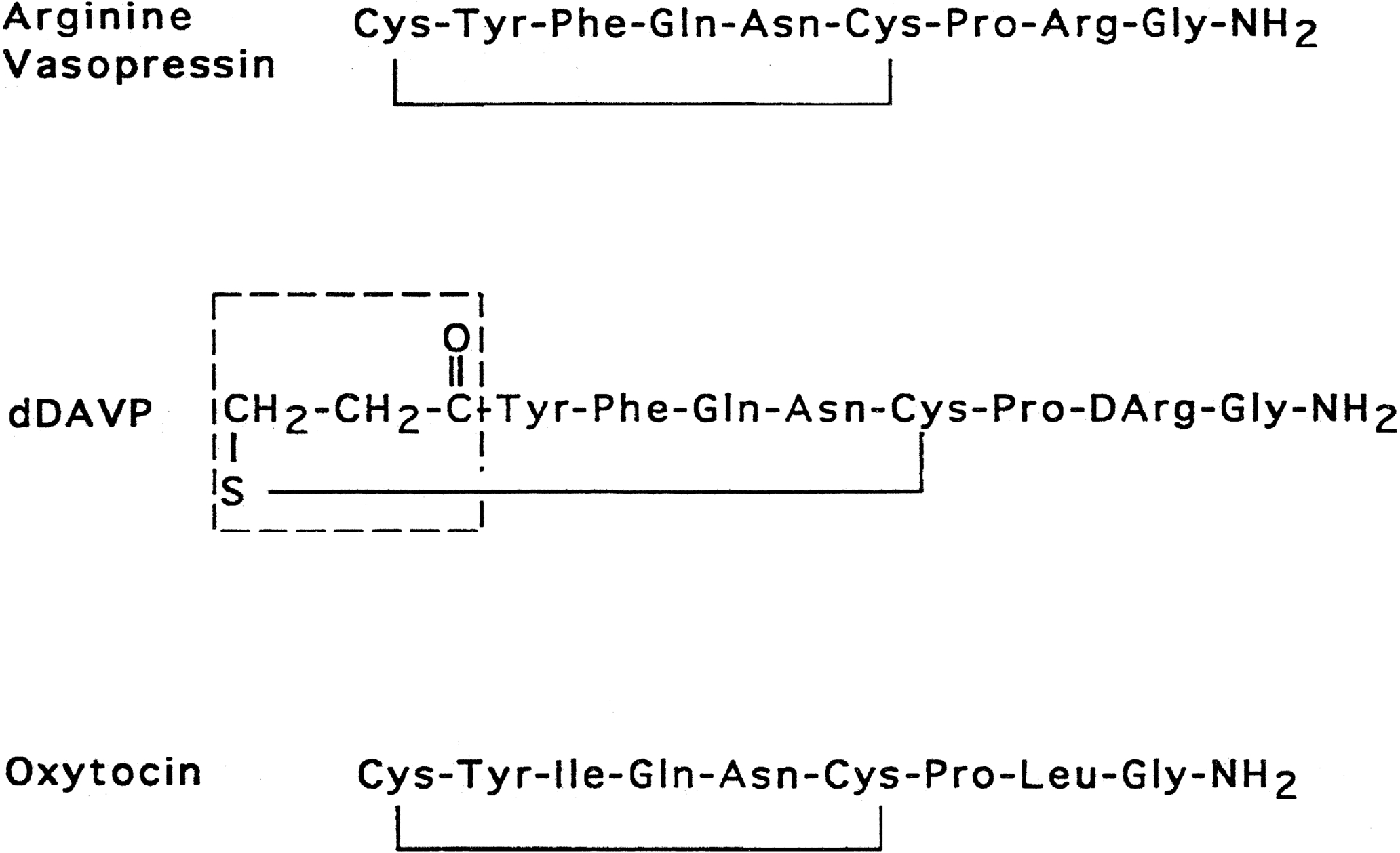
Hình 12.1 Cấu trúc của vasopressin, desamino-D-arginine vasopressin (dDAVP), và oxytocin. Ở dDAVP, cysteine đã được deamit hóa được đóng trong khung.
Sự liên kết của vasopressin và oxytocin với các protein đặc hiệu, các neurophysin, trong khi được lưu trữ ở thùy sau tuyến yên đã được ghi nhận từ những năm 1900. Việc phân lập và mô tả các neurophysin sau đó đã cho thấy hai dạng riêng biệt, một loại chỉ liên kết với vasopressin và loại kia chỉ liên kết với oxytocin. Cả hai đều là các chuỗi polypeptide đơn có trọng lượng phân tử 10.000 dalton. Mặc dù đã được mô tả đặc tính sinh lý hóa sâu rộng, bao gồm cả tinh thể học của phức hợp oxytocin-neurophysin, chức năng sinh học của các neurophysin vẫn chưa được biết rõ. Các vai trò có thể có của neurophysin bao gồm ổn định hormone chống lại sự phân hủy trong quá trình lưu trữ nội bào, đóng gói hiệu quả hơn trong các hạt bài tiết, tăng cường quá trình xử lý sau dịch mã bởi các proenzyme convertase, và vận chuyển hormone trong máu. Gần đây, copeptin, một đoạn của neurophysin liên kết với vasopressin, đã được phát triển như một chỉ số cho sự bài tiết vasopressin.
Nguồn gốc chung của vasopressin và neurophysin của nó từ một tiền chất lớn hơn lần đầu tiên được Sachs và các đồng nghiệp đề xuất, những người đã cho thấy sự gia tăng tích hợp của cysteine đánh dấu 35S, được tiêm vào não thất ba của chó, vào vasopressin được phân lập từ vùng dưới đồi so với vasopressin được phân lập từ thùy sau tuyến yên. Việc phân lập tiền chất lớn hơn từ vùng dưới đồi, sau đó tiêu hóa bằng trypsin, tạo ra các mảnh có kích thước tương tự như vasopressin và neurophysin của nó, với khả năng phản ứng miễn dịch của vasopressin trong thành phần 1000-dalton.
Từ năm 1990, các phân tích di truyền phân tử đã nâng cao sự hiểu biết về quá trình tổng hợp, xử lý và tiến hóa của các tiền-prohormone vasopressin và oxytocin. Tất cả các gen vasopressin và oxytocin của động vật có vú đều bao gồm ba exon (Hình 12.2). Exon đầu tiên mã hóa cho peptide tín hiệu gồm 19 axit amin, tiếp theo là các nonapeptide vasopressin hoặc oxytocin. Sau đó là một vị trí cắt protease gồm 3 axit amin, dẫn vào chín axit amin đầu tiên của neurophysin II (cho vasopressin) hoặc neurophysin I (cho oxytocin). Sau khi vùng mã hóa bị gián đoạn bởi một intron, exon 2 tiếp tục với các trình tự mã hóa neurophysin. Exon thứ ba hoàn thành trình tự của neurophysin và, chỉ đối với vasopressin, được theo sau bởi thông tin mã hóa cho một glycopeptide gồm 39 axit amin bổ sung (copeptin) mà chức năng của nó chưa rõ ràng. Preprovasopressin chứa 16 cysteine, có khả năng tham gia vào tám cầu disulfide quyết định cấu trúc bậc ba của protein (Hình 12.3). Một cặp cysteine có mặt trong peptide vasopressin, trong khi phần còn lại nằm trong neurophysin.
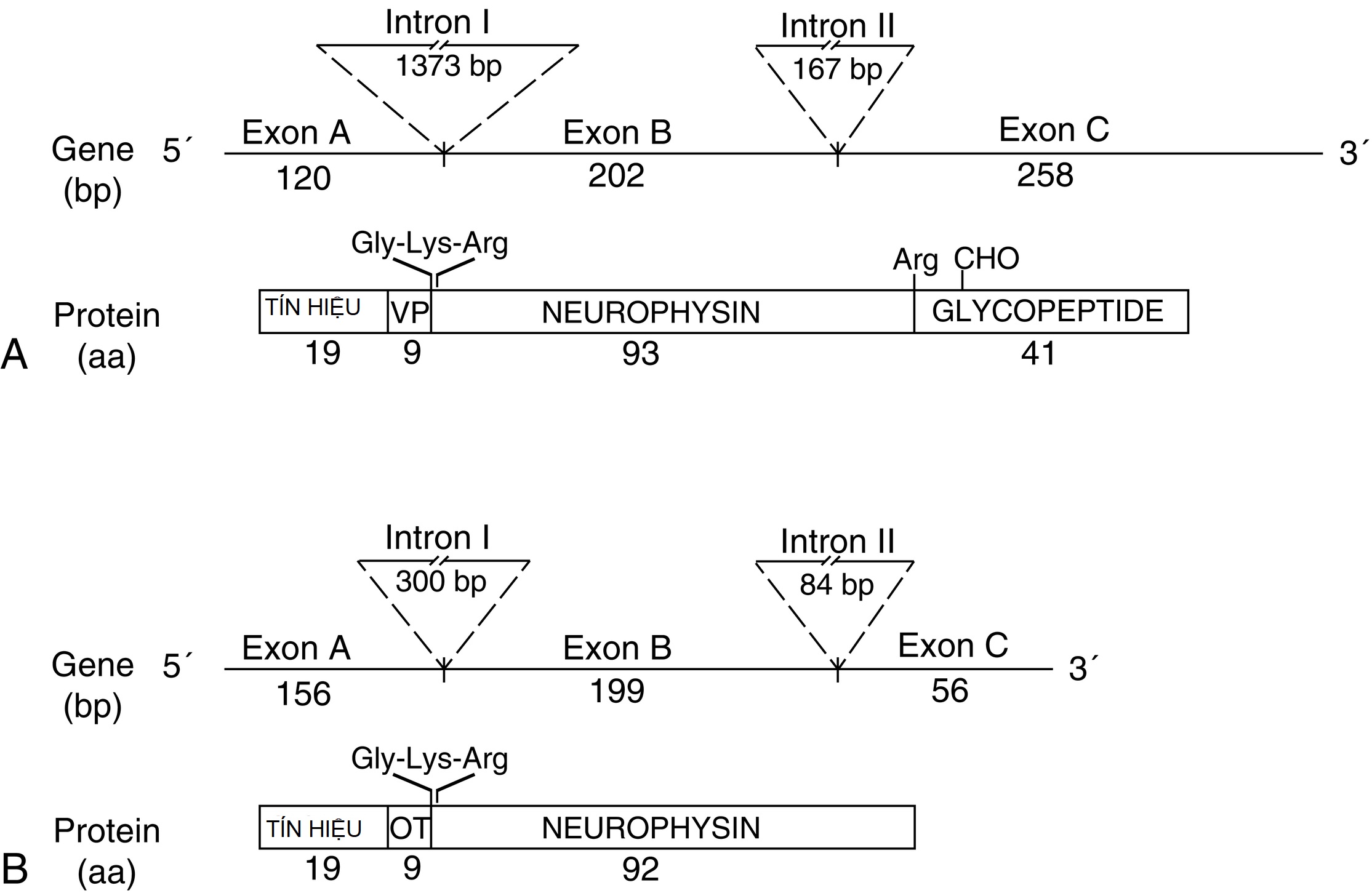
Hình 12.2 Cấu trúc của gen người và các sản phẩm peptide của vasopressin (VP) (A) và oxytocin (OT) (B). Thể hiện kích thước của các exon và intron, tính bằng cặp base nucleotide (bp) và các sản phẩm peptide tính bằng axit amin (aa). Mô tả tín hiệu cắt dibasic-amit hóa (Gly-Lys-Arg) ở đầu cuối carboxy của vasopressin và oxytocin, và tín hiệu cắt monobasic ở cuối neurophysin. CHO, Carbohydrate; signal, peptide tín hiệu.
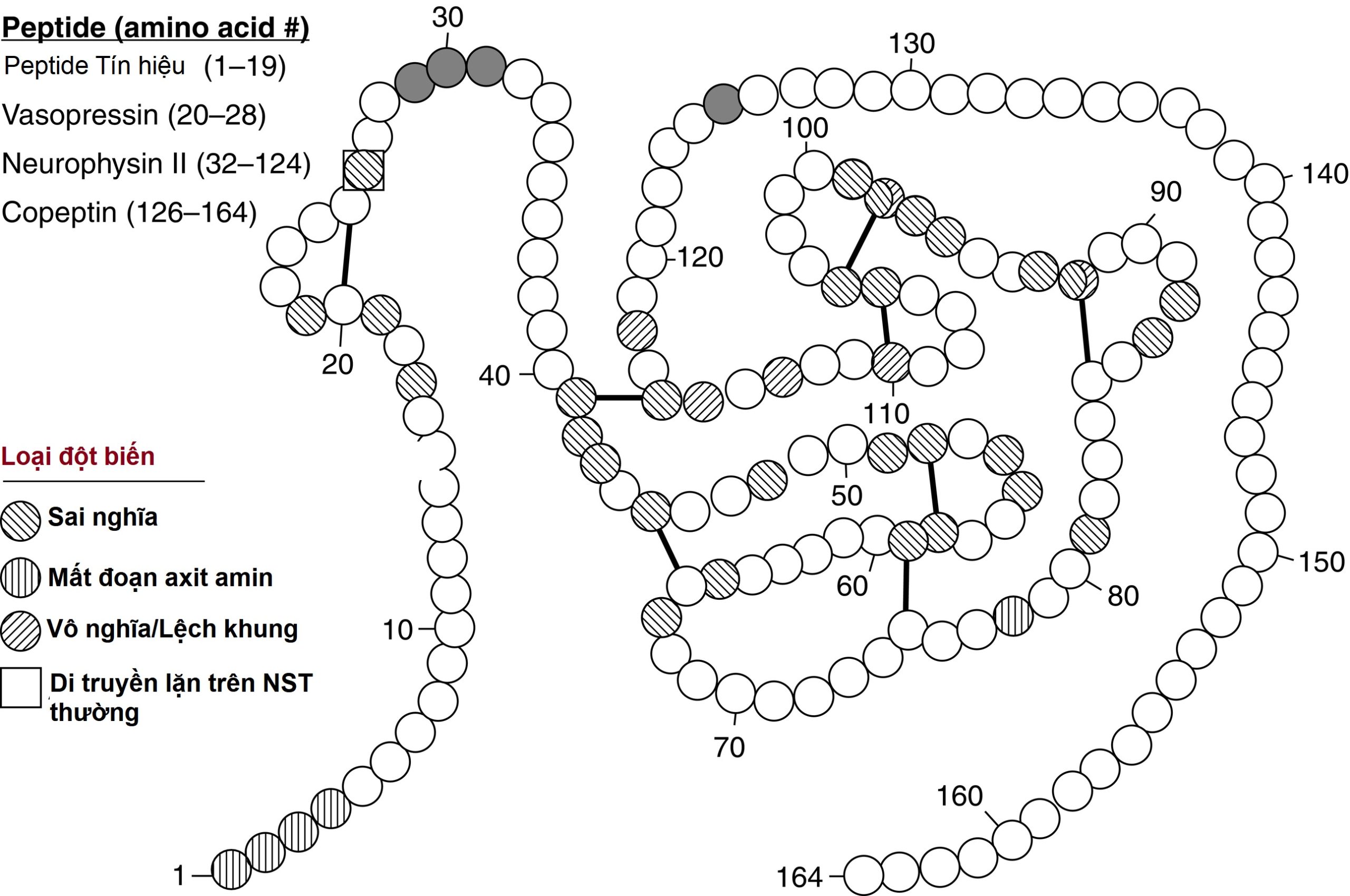
Hình 12.3 Cấu trúc của peptide preprovasopressin và các đột biến AVP thường gặp nhất trong bệnh đái tháo nhạt trung ương. Peptide preprovasopressin 164 axit amin bao gồm peptide tín hiệu, vasopressin, neurophysin II, và copeptin. Vasopressin và neurophysin II được ngăn cách bởi ba gốc kiềm (màu xám), đóng vai trò là vị trí cắt peptide và amit hóa. 16 cysteine trong preprovasopressin được nối với nhau bởi tám cầu disulfide giả định, nhiều trong số đó bị đột biến trong bệnh đái tháo nhạt di truyền trội trên nhiễm sắc thể thường. Các đột biến axit amin được phân loại là đột biến sai nghĩa (missense), đột biến mất đoạn (deletion), hoặc đột biến vô nghĩa/lệch khung (nonsense/frameshift). Hầu hết các đột biến được di truyền theo kiểu trội trên nhiễm sắc thể thường, ngoại trừ ở axit amin 26, có kiểu di truyền lặn trên nhiễm sắc thể thường.
Ở tất cả các loài động vật có vú đã được phân tích cho đến nay, các gen oxytocin và vasopressin nằm liền kề nhau trên nhiễm sắc thể (nhiễm sắc thể 20 ở người) và liên kết theo kiểu đuôi-đuôi, theo hướng phiên mã ngược nhau. Ở người, chúng cách nhau chỉ 12 kb. Điều này có thể giải thích nguồn gốc của chúng từ sự nhân đôi cổ xưa của một gen tổ tiên chung. Việc liên kết liền kề này có ý nghĩa về mặt điều hòa hay không vẫn chưa rõ.
Sự biểu hiện của gen vasopressin và oxytocin xảy ra ở các nhân cạnh não thất và nhân trên thị của vùng dưới đồi. Các thành phần tế bào lớn (magnocellular) của mỗi nhân này là các quần thể tế bào thần kinh chính tham gia vào cân bằng nước, với vasopressin được tổng hợp ở những khu vực này được vận chuyển qua trục thần kinh đến thùy sau tuyến yên, nơi lưu trữ và giải phóng chính của nó vào tuần hoàn hệ thống (Hình 12.4). Các nhân cạnh não thất và nhân trên thị của vùng dưới đồi được ghép đôi đối xứng và cách nhau một khoảng cách tương đối lớn (khoảng 1 cm). Các sợi trục của chúng chạy về phía đuôi, hội tụ tại cuống tuyến yên, và kết thúc ở các mức độ khác nhau trong cuống tuyến yên và tuyến yên sau (xem Hình 12.4). Vasopressin cũng được tổng hợp trong các tế bào thần kinh parvocellular (tế bào nhỏ) riêng biệt của nhân cạnh não thất, nơi nó có vai trò điều hòa hoạt động của trục dưới đồi-tuyến yên-thượng thận. Tại vị trí này, vasopressin cùng tồn tại trong các tế bào tổng hợp hormone giải phóng corticotropin (CRH), và cả hai đều được tiết ra ở lồi giữa và được vận chuyển qua hệ thống mao mạch cửa dưới đồi-tuyến yên đến thùy trước tuyến yên, nơi chúng cùng nhau hoạt động như những chất điều hòa chính của quá trình tổng hợp và giải phóng hormone vỏ thượng thận (ACTH). Vasopressin cũng có mặt trong nhân trên chéo thị giác của vùng dưới đồi, cơ quan tạo nhịp sinh học của cơ thể, nơi chức năng của nó vẫn chưa được biết.
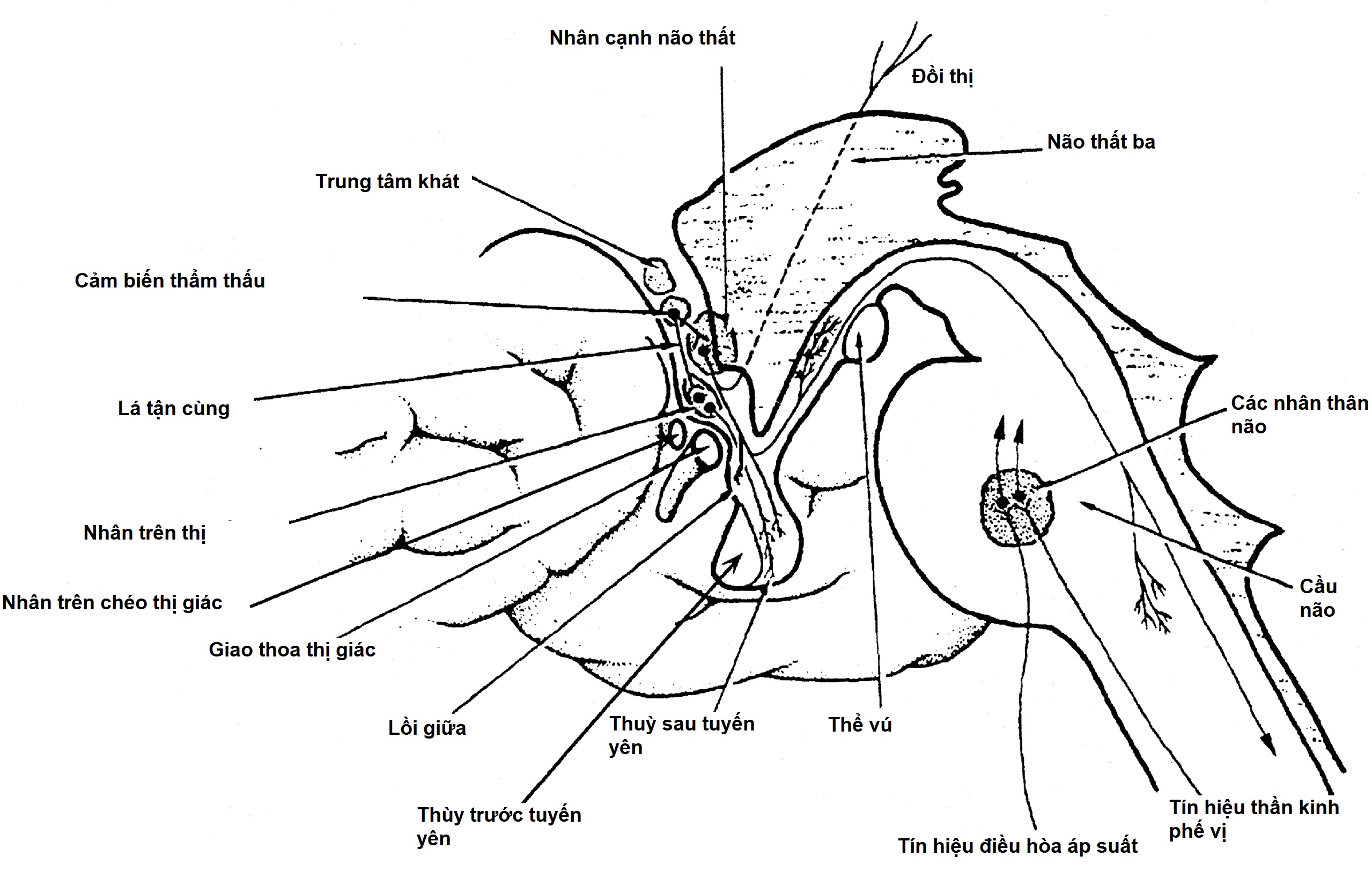
Hình 12.4 Các tế bào vasopressin ở vùng dưới đồi. Sơ đồ các thân tế bào vasopressin trong các nhân trên thị, cạnh não thất, và trên chéo thị giác của vùng dưới đồi, và sự kết thúc của sợi trục ở thùy sau tuyến yên và lồi giữa. Bởi vì các sợi trục vasopressin kết thúc ở các mức độ khác nhau trong cuống tuyến yên và thùy sau tuyến yên, mức độ mất tế bào vĩnh viễn, sau tổn thương phẫu thuật thần kinh, được quyết định bởi mức độ tổn thương cao nhất, điều này sẽ quyết định mức độ cắt đứt sợi trục vasopressin và thoái hóa ngược dòng của tế bào thần kinh. (Chỉnh sửa với sự cho phép từ Baylis, P.H. (1989). Vasopressin and its neurophysin. In: Degroot, L.D. (ed). Endocrinology, 2nd ed. WB Saunders, Philadelphia, p. 213.)
Điều hòa bài tiết Vasopressin và Cảm giác khát
Điều hòa thẩm thấu
Tốc độ bài tiết vasopressin từ các nhân cạnh não thất và nhân trên thị bị ảnh hưởng bởi một số biến số sinh lý, bao gồm áp lực thẩm thấu huyết tương và thể tích nội mạch, cũng như buồn nôn và một số tác nhân dược lý. Các thành phần chính có hoạt tính thẩm thấu trong máu là natri, clorua và glucose (khi thiếu insulin). Áp lực thẩm thấu máu bình thường dao động trong khoảng 280 đến 290 mOsm/kg H2O.
Công trình của Verney lần đầu tiên chứng minh mối quan hệ giữa sự gia tăng giải phóng vasopressin để đáp ứng với áp lực thẩm thấu huyết tương tăng lên, khi bị thay đổi bởi việc truyền natri clorua hoặc sucrose. Vào thời điểm đó, người ta đã giả định rằng có tồn tại các cảm biến nội sọ nhạy cảm với những thay đổi trong áp lực thẩm thấu huyết tương. Nhiều nhà nghiên cứu sau đó đã xác nhận rằng nồng độ vasopressin huyết tương tăng lên để đáp ứng với sự gia tăng trương lực huyết tương, với vị trí của cảm biến thẩm thấu, có khả năng nằm trong cơ quan quanh não thất, các nhân thần kinh bao quanh não thất ba, nơi không có hàng rào máu não. Cơ quan mạch của lá tận cùng (OVLT) và cơ quan dưới vòm (SFO), các khu vực của vùng dưới đồi trước thị nằm ngoài hàng rào máu não, có khả năng là vị trí của cả cảm biến thẩm thấu, bởi vì các tổn thương ở OVLT dẫn đến suy giảm bài tiết vasopressin và tăng natri máu. Đây cũng là nơi tác động của angiotensin II, được tiêm vào não hoặc ngoại vi, để tạo ra sự bài tiết vasopressin và chống bài niệu, nằm trong OVLT.
Mô hình bài tiết vasopressin vào máu đã được mô tả rộng rãi ở những người bình thường và những người có bất thường về cân bằng nội môi nước. Thông thường, ở áp lực thẩm thấu huyết thanh dưới 280 mOsm/kg, nồng độ vasopressin huyết tương ở mức hoặc dưới 1 pg/mL, giới hạn phát hiện dưới của hầu hết các xét nghiệm miễn dịch phóng xạ. Trên 283 mOsm/kg—ngưỡng bình thường để giải phóng vasopressin—nồng độ vasopressin huyết tương tăng tỷ lệ thuận với áp lực thẩm thấu huyết tương, lên đến nồng độ tối đa khoảng 20 pg/mL ở áp lực thẩm thấu máu khoảng 320 mOsm/kg (Hình 12.5). Cảm biến thẩm thấu có thể phát hiện sự thay đổi nhỏ chỉ 1% trong áp lực thẩm thấu máu. Nồng độ huyết tương vượt quá 5 pg/mL cũng được tìm thấy khi buồn nôn, hạ huyết áp, giảm thể tích máu, và hạ đường huyết do insulin, nhưng không có sự gia tăng thêm về nồng độ nước tiểu, bởi vì hiệu quả chống bài niệu tối đa đã đạt được ở mức 5 pg/mL. Tốc độ tăng nồng độ vasopressin huyết tương, và do đó là độ nhạy của cảm biến thẩm thấu, cho thấy sự thay đổi đáng kể (lên đến 10 lần) giữa các cá nhân khi áp lực thẩm thấu huyết tương tăng lên. Điểm đặt (set-point) cho sự bài tiết vasopressin thay đổi ở một cá nhân, liên quan đến những thay đổi về tình trạng thể tích và môi trường nội tiết tố (ví dụ, mang thai) hoặc tình trạng glucocorticoid. Sau tuần thứ bảy của thai kỳ, ngưỡng thẩm thấu cho cả việc giải phóng vasopressin và cảm giác khát giảm khoảng 10 mOsm/kg (xem Hình 12.5), do đó áp lực thẩm thấu máu bình thường trong thai kỳ là khoảng 273 mOsm/kg (natri huyết thanh 135 mEq/L). Tương tự, ngưỡng giải phóng vasopressin và cảm giác khát trong giai đoạn hoàng thể của chu kỳ kinh nguyệt thấp hơn khoảng 5 mOsm/kg so với giai đoạn nang noãn. Human chorionic gonadotropin (hCG) trong thai kỳ, và hormone tạo hoàng thể (LH) trong nửa sau của chu kỳ kinh nguyệt, có thể góp phần vào những thay đổi này trong ngưỡng thẩm thấu.
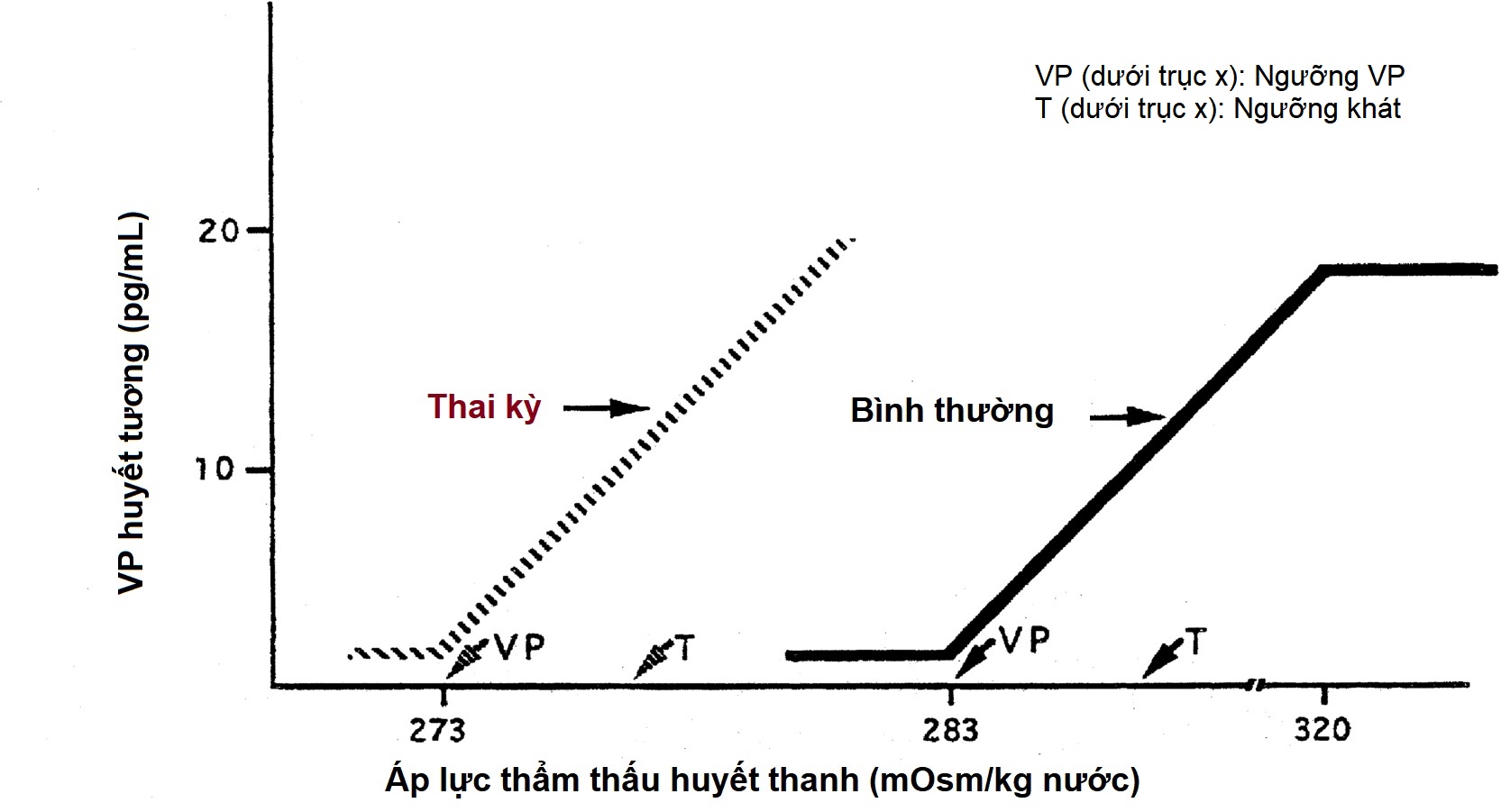
Hình 12.5 Ngưỡng thẩm thấu cho vasopressin và cảm giác khát. Ngưỡng giải phóng vasopressin thấp hơn ngưỡng của cảm giác khát. Ở những người không mang thai, có sự gia tăng tuyến tính trong việc giải phóng vasopressin (VP) lên đến áp lực thẩm thấu huyết thanh 320 mOsm/kg, sau đó không có sự gia tăng nào nữa. Trong thai kỳ, có sự giảm ngưỡng giải phóng vasopressin và cảm giác khát, không có sự thay đổi về độ nhạy (độ dốc) của mối quan hệ vasopressin-áp lực thẩm thấu. Sự bài tiết vasopressin trong thai kỳ có lẽ cũng đạt đến mức bão hòa ở một mức độ tăng áp lực thẩm thấu nào đó, mặc dù điều này chưa được nghiên cứu. Người bình thường không mang thai, đường liền và mũi tên; phụ nữ mang thai, đường đứt và mũi tên. T, Ngưỡng cho cảm giác khát; VP, ngưỡng cho sự bài tiết vasopressin.
Cảm giác khát, một hoạt động vỏ não tích hợp hơn, được quyết định bởi các tế bào thần kinh vùng dưới đồi khác biệt về mặt giải phẫu, với các sợi hướng tâm liên quan đến nhân bụng giữa và cơ quan dưới vòm. Sự kích hoạt cơ chế khát có thể được trung gian bởi angiotensin II. Liệu cảm biến thẩm thấu cho cảm giác khát và giải phóng vasopressin có giống nhau hay không vẫn chưa chắc chắn, mặc dù điều này được gợi ý bởi các tổn thương ở vùng bụng trước của não thất ba làm mất cả cảm giác khát và giải phóng vasopressin. Về mặt sinh lý, việc ngưỡng của cảm giác khát (293 mOsm/kg) cao hơn khoảng 10 mOsm/kg so với ngưỡng giải phóng vasopressin là hợp lý (xem Hình 12.5). Nếu không, trong quá trình phát triển tình trạng tăng áp lực thẩm thấu, sự kích hoạt ban đầu của cảm giác khát và việc uống nước sẽ dẫn đến đa niệu, mà không kích hoạt giải phóng vasopressin, gây ra tình trạng lợi tiểu kéo dài. Ngay sau khi uống nước, trước khi có sự thay đổi về áp lực thẩm thấu máu hoặc thể tích, nồng độ vasopressin giảm xuống và cảm giác khát chấm dứt. Mức độ ức chế liên quan trực tiếp đến độ lạnh và thể tích của chất lỏng được uống vào. Nước đi qua mà không tiếp xúc với hầu họng không có tác dụng này. Tác dụng này có thể được trung gian bởi các thụ thể hóa học có trong hầu họng, truyền tín hiệu đến cơ quan dưới vòm, dẫn đến giảm cảm giác khát và giải phóng vasopressin. Sự điều hòa “tiền hệ thống” này của cảm giác khát và bài tiết vasopressin, trước khi có những thay đổi về áp lực thẩm thấu, giúp bảo vệ chống lại cả việc uống quá nhiều nước một cách nhanh chóng sau cơn khát dữ dội trước đó, và sự đảo ngược tình trạng chống bài niệu khi bắt đầu uống nước.
Như đã lưu ý trước đó, cân bằng nước được điều chỉnh theo hai cách: (1) bài tiết vasopressin kích thích tái hấp thu nước bởi thận, do đó làm giảm lượng nước mất đi trong tương lai, và (2) cảm giác khát kích thích việc uống nước, do đó phục hồi lượng nước đã mất trước đó. Lý tưởng nhất, hai hệ thống này hoạt động song song để điều chỉnh hiệu quả trương lực dịch ngoại bào (Hình 12.6); tuy nhiên, mỗi hệ thống tự nó có thể duy trì áp lực thẩm thấu huyết tương trong phạm vi gần như bình thường. Ví dụ, trong trường hợp không có bài tiết vasopressin nhưng được tiếp cận tự do với nước, cảm giác khát thúc đẩy việc uống nước lên đến 5 đến 10 L/m2 lượng nước tiểu thải ra như thấy ở bệnh nhân thiếu hụt vasopressin. Ngược lại, một hệ thống bài tiết vasopressin nguyên vẹn có thể bù đắp cho một mức độ rối loạn điều hòa cảm giác khát. Tuy nhiên, khi cả bài tiết vasopressin và cảm giác khát đều bị tổn hại, do bệnh tật hoặc do can thiệp y tế, có nguy cơ lớn xảy ra các bất thường đe dọa tính mạng về áp lực thẩm thấu huyết tương.
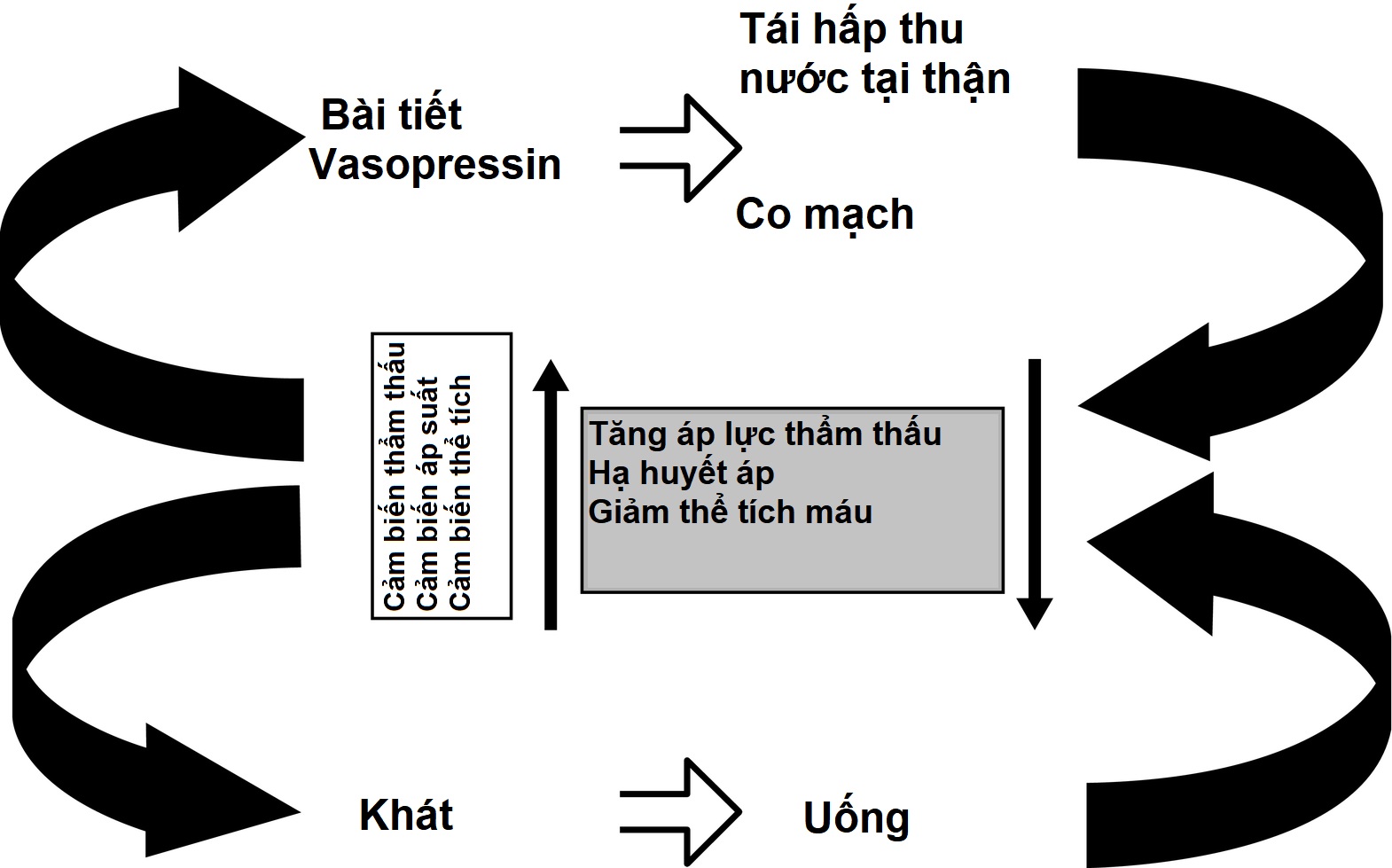
Hình 12.6 Điều hòa bài tiết vasopressin và áp lực thẩm thấu huyết thanh. Tăng áp lực thẩm thấu, giảm thể tích máu, hoặc hạ huyết áp được cảm nhận bởi các cảm biến thẩm thấu, cảm biến thể tích, hoặc cảm biến áp suất, tương ứng. Những điều này kích thích cả sự bài tiết vasopressin và cảm giác khát. Vasopressin, tác động lên thận gây tăng tái hấp thu nước (chống bài niệu) và tác động lên mạch máu, gây co mạch. Cảm giác khát gây ra việc tăng uống nước. Kết quả của các vòng phản hồi âm kép này gây ra sự giảm tăng áp lực thẩm thấu hoặc hạ huyết áp/giảm thể tích máu. Các kích thích bổ sung cho sự bài tiết vasopressin bao gồm buồn nôn, hạ đường huyết và đau.
Điều hòa không do thẩm thấu
Tách biệt với điều hòa thẩm thấu, vasopressin đã được chứng minh là được bài tiết để đáp ứng với những thay đổi trong thể tích nội mạch. Các con đường áp cảm thụ hướng tâm phát sinh từ tâm nhĩ phải và trái và cung động mạch chủ (xoang động mạch cảnh) được kích thích bởi sự gia tăng thể tích nội mạch và sự căng của thành mạch, và chúng gửi tín hiệu thông qua các dây thần kinh phế vị và lưỡi hầu, tương ứng, đến nhân bó đơn độc ở thân não. Các sợi noradrenergic từ nhân bó đơn độc tạo khớp thần kinh với nhân cạnh não thất và nhân trên thị của vùng dưới đồi và, khi bị kích thích, sẽ ức chế bài tiết vasopressin.
Mô hình bài tiết vasopressin để đáp ứng với thể tích, trái ngược với các kích thích thẩm thấu, khác biệt rõ rệt (Hình 12.7). Mặc dù những thay đổi nhỏ trong áp lực thẩm thấu huyết tương trên 280 mOsm/kg gây ra sự gia tăng tuyến tính của vasopressin huyết tương, cần phải có sự thay đổi đáng kể về thể tích nội mạch để làm thay đổi lượng vasopressin tiết ra. Không có sự thay đổi nào trong bài tiết vasopressin được thấy cho đến khi thể tích máu giảm khoảng 8%. Với sự thiếu hụt thể tích nội mạch vượt quá 8%, nồng độ vasopressin tăng theo cấp số nhân. Hơn nữa, các kích thích thẩm thấu và huyết động có thể tương tác theo kiểu hiệp đồng với nhau, do đó phản ứng với một trong hai kích thích có thể được tăng cường bởi sự hiện diện đồng thời của kích thích kia (xem Hình 12.7). Khi thể tích máu hoặc huyết áp giảm khoảng 25%, nồng độ vasopressin rõ ràng cao hơn bình thường từ 20 đến 30 lần, và vượt xa mức cần thiết để chống bài niệu tối đa. Chuột bị xóa gen thụ thể V1a vasopressin, Avpr1, cho thấy rằng vasopressin tác động thông qua thụ thể này là cần thiết để duy trì huyết áp bình thường, ngay cả ở nồng độ vasopressin trong máu thấp.
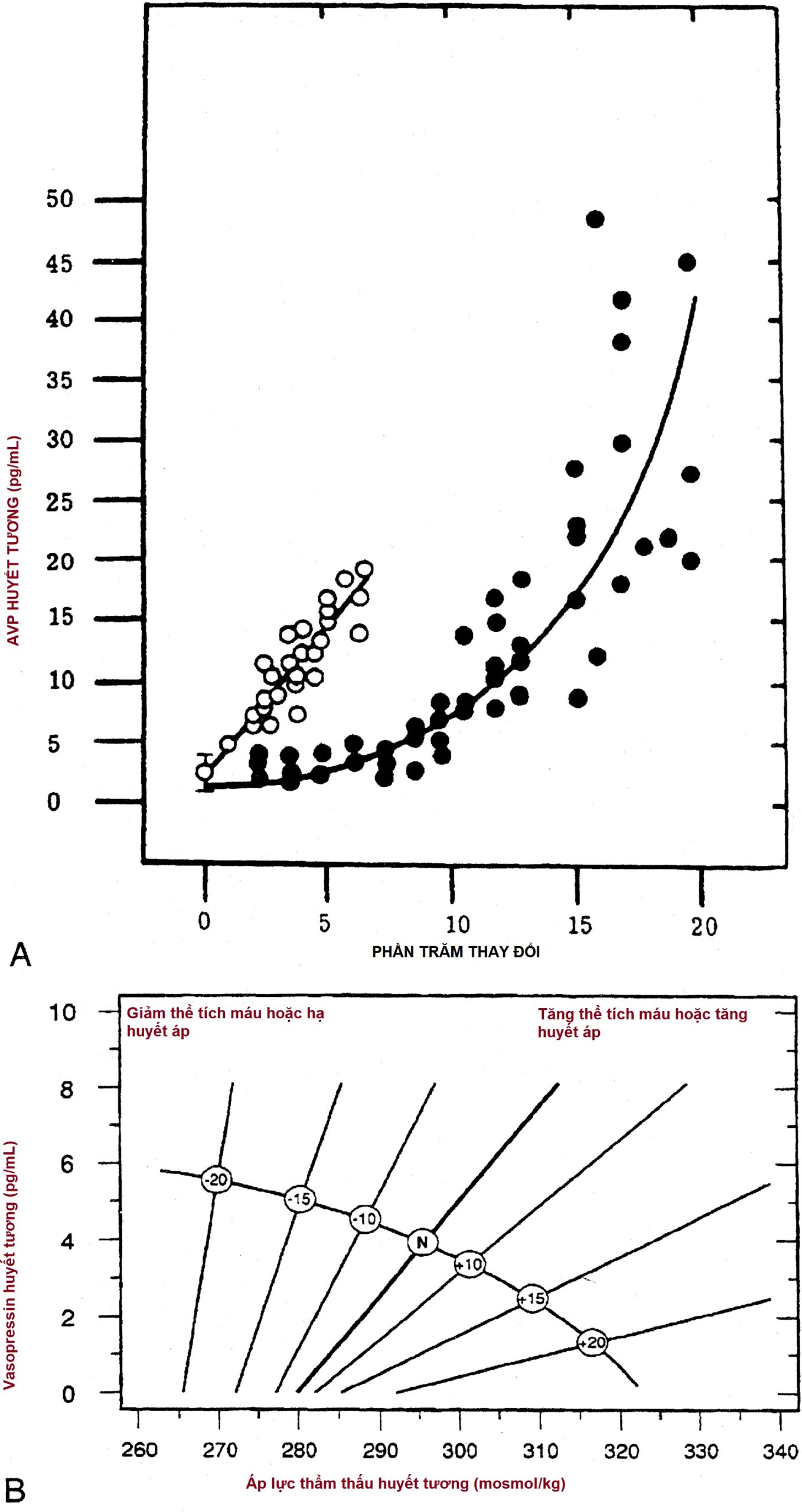
Hình 12.7 Mối quan hệ giữa các kích thích thẩm thấu và không thẩm thấu đối với việc giải phóng vasopressin. A, Mối quan hệ của nồng độ vasopressin huyết tương (AVP) với phần trăm tăng áp lực thẩm thấu máu (vòng tròn mở) hoặc giảm thể tích máu (vòng tròn đóng). B, Sự thay đổi độ nhạy của kích thích thẩm thấu đối với bài tiết vasopressin bởi các kích thích thể tích hoặc áp suất. (Từ Shaikh, Z.H.A., Taylor, H.C., Maroo, P.V., Llerena, L.A. (2000). Syndrome of inappropriate antidiuretic hormone secretion associated with lisinopril. Ann Pharmacother, 34, 176–179; van Laar, T., Lammers, G-J., Roos, R.A.C., Gerritsen, J.J., Meinders, A.E. (1998). Antiparkinsonian drugs causing inappropriate antidiuretic hormone secretion. Mov Disord, 13, 176–178. Với sự cho phép.)
Buồn nôn, do apomorphine, say tàu xe, hoặc các phản ứng phế vị-phế vị gây ra, là một kích thích rất mạnh mẽ cho sự bài tiết vasopressin. Tác dụng này có khả năng được trung gian bởi các sợi hướng tâm từ vùng postrema của thân não và có thể dẫn đến nồng độ vasopressin cao gấp hai đến ba bậc độ lớn so với mức cơ bản. Nicotine cũng là một chất kích thích mạnh mẽ cho việc giải phóng vasopressin. Các con đường này có lẽ không liên quan đến các hệ thống cảm biến thẩm thấu hoặc huyết động, bởi vì việc phong tỏa kích thích gây nôn, bằng các chất đối kháng dopamine hoặc opioid, không làm thay đổi phản ứng của vasopressin đối với tăng natri máu hoặc giảm thể tích máu.
Sự bài tiết vasopressin bị ức chế bởi glucocorticoid; do đó, sự mất điều hòa âm tính của bài tiết vasopressin xảy ra trong bối cảnh suy giảm glucocorticoid nguyên phát hoặc thứ phát. Sự chèn aquaporin-2 (AQP2) vào màng đỉnh của tế bào ống thận được kích thích bởi oxit nitric. Glucocorticoid ức chế oxit nitric synthase, do đó cung cấp một cơ chế mà chúng có thể tạo điều kiện cho việc thanh thải nước tự do, bằng cách ức chế sự chèn AQP2 vào màng đỉnh do oxit nitric gây ra. Tác động của việc mất cortisol vừa làm tăng sản xuất vasopressin ở vùng dưới đồi vừa làm suy giảm trực tiếp sự bài tiết nước tự do là những cân nhắc quan trọng trong việc đánh giá bệnh nhân bị hạ natri máu, như sẽ được thảo luận sau.
Chuyển hóa Vasopressin
Một khi vào tuần hoàn, vasopressin có thời gian bán hủy chỉ từ 5 đến 10 phút, do sự phân hủy nhanh chóng của nó bởi một peptidase đầu amino cysteine được gọi là vasopressinase. Một chất tương tự tổng hợp của vasopressin, desmopressin, không nhạy cảm với sự phân hủy ở đầu amino và do đó có thời gian bán hủy dài hơn nhiều, từ 8 đến 24 giờ. Trong thai kỳ, nhau thai tiết ra một lượng lớn vasopressinase này, dẫn đến tăng gấp 4 lần tốc độ thanh thải chuyển hóa của vasopressin. Phụ nữ bình thường bù đắp bằng cách tăng bài tiết vasopressin, nhưng những phụ nữ có tiền sử thiếu hụt bài tiết hoặc tác dụng của vasopressin, hoặc những người có nồng độ vasopressinase nhau thai tăng cao, liên quan đến rối loạn chức năng gan hoặc đa thai, có thể phát triển bệnh đái tháo nhạt trong tam cá nguyệt cuối, và bệnh này sẽ tự khỏi ngay sau khi sinh. Như dự đoán, dạng đái tháo nhạt này đáp ứng với điều trị bằng desmopressin nhưng không đáp ứng với vasopressin.
Các vị trí tác động của Vasopressin
Thụ thể Vasopressin
Vasopressin, được giải phóng từ thùy sau tuyến yên và lồi giữa, ảnh hưởng đến chức năng của một số loại mô bằng cách gắn vào các thành viên của một họ thụ thể bề mặt tế bào kết hợp với protein G, sau đó chuyển đổi tín hiệu gắn kết phối tử thành những thay đổi trong các con đường truyền tin thứ hai nội bào. Các nghiên cứu hóa sinh và sinh học tế bào đã xác định ba loại thụ thể, được đặt tên là V1, V2, và V3 (hoặc V1b). Các vị trí chính biểu hiện thụ thể V1 là trên cơ trơn mạch máu và tế bào gan, nơi sự kích hoạt thụ thể dẫn đến co mạch và ly giải glycogen, tương ứng. Hoạt động ly giải glycogen có thể được tăng cường bởi sự kích thích bài tiết glucagon từ tuyến tụy. Thụ thể V1 trên tiểu cầu cũng kích thích sự kết tập tiểu cầu. Sự kích hoạt thụ thể V1 huy động các kho dự trữ canxi nội bào thông qua quá trình thủy phân phosphatidylinositol. Mặc dù ban đầu được mô tả như một tác nhân co mạch mạnh, nồng độ vasopressin cần thiết để tăng huyết áp đáng kể cao hơn vài lần so với nồng độ cần thiết để chống bài niệu tối đa, mặc dù sự co mạch đáng kể trong các mạch máu thận và tạng có thể xảy ra ở nồng độ thấp hơn. Việc nhân bản thụ thể V1 đã làm sáng tỏ mối quan hệ của các thụ thể vasopressin (và oxytocin), và thông qua phân tích lai tại chỗ nhạy cảm, đã xác định thêm vị trí biểu hiện của V1 ở gan và mạch máu của tủy thận, cũng như ở nhiều vị trí trong não, bao gồm hồi hải mã, hạch hạnh nhân, vùng dưới đồi, và thân não. So với các con chuột bình thường, những con chuột được biến đổi gen để thiếu thụ thể V1 (V1a KO) đã được phát hiện có tình trạng kháng insulin, tăng sản xuất glucose ở gan, giảm hàm lượng glycogen ở gan, và giảm bài tiết aldosterone, mặc dù có thể tích huyết tương thấp hơn, huyết áp cơ bản thấp hơn, mức độ ly giải mỡ cao hơn, và suy giảm vận chuyển nhân của thụ thể mineralocorticoid ở ống thận. Thụ thể V3 (hoặc V1b) có mặt trên các tế bào corticotroph ở thùy trước tuyến yên và hoạt động thông qua con đường phosphatidylinositol để tăng bài tiết hormone vỏ thượng thận (ACTH). Hồ sơ gắn kết của nó đối với các chất tương tự vasopressin giống với thụ thể V1 hơn là thụ thể V2. Cấu trúc của thụ thể này đã được xác định ở người bằng cách nhân bản DNA bổ sung (cDNA) của nó. Cấu trúc của nó tương tự như thụ thể V1 và oxytocin, và nó được biểu hiện ở thận, cũng như ở tuyến yên. Chuột bị xóa gen thụ thể V1b (V3) (V1bKO) đã được tạo ra và nghiên cứu. Như mong đợi, chúng có sự kích hoạt khiếm khuyết của trục tuyến yên-thượng thận, sau một số căng thẳng cấp tính và mãn tính. Chuột đực V1bKO cũng được phát hiện có sự hung hăng và động lực xã hội giảm sút.
Việc điều chỉnh cân bằng nước xảy ra thông qua tác động của vasopressin lên các thụ thể V2, nằm chủ yếu ở ống góp của thận, cùng với các vị trí khác trong thận, bao gồm nhánh lên dày của quai Henle và các ống lượn gần cầu thận. Nó cũng có mặt trên các tế bào nội mô mạch máu ở một số giường mạch hệ thống, nơi vasopressin kích thích giãn mạch, có thể thông qua việc kích hoạt oxit nitric synthase. Vasopressin cũng kích thích yếu tố von Willebrand, yếu tố VIIIa, và chất hoạt hóa plasminogen mô thông qua các tác động qua trung gian V2. Do đó, desmopressin được sử dụng để cải thiện thời gian chảy máu kéo dài đặc trưng của urê huyết, bệnh von Willebrand loại I, và bệnh hemophilia. Thụ thể V2 bao gồm 370 axit amin mã hóa bảy vùng xuyên màng đặc trưng của các thụ thể kết hợp với protein G. Các vùng xuyên màng này có chung khoảng 60% trình tự tương đồng với thụ thể V1, nhưng ít hơn đáng kể so với các thành viên khác của họ này (Hình 12.8). Không giống như các thụ thể V1 và V3, thụ thể V2 hoạt động thông qua adenylate cyclase để tăng nồng độ adenosine monophosphate vòng (cAMP) nội bào. Gen thụ thể V2 ở người nằm trên nhánh dài của nhiễm sắc thể X (Xq28), tại locus liên quan đến bệnh đái tháo nhạt kháng vasopressin bẩm sinh, liên kết X. Chuột bị xóa gen V2R có kiểu hình đái tháo nhạt do thận tương tự.
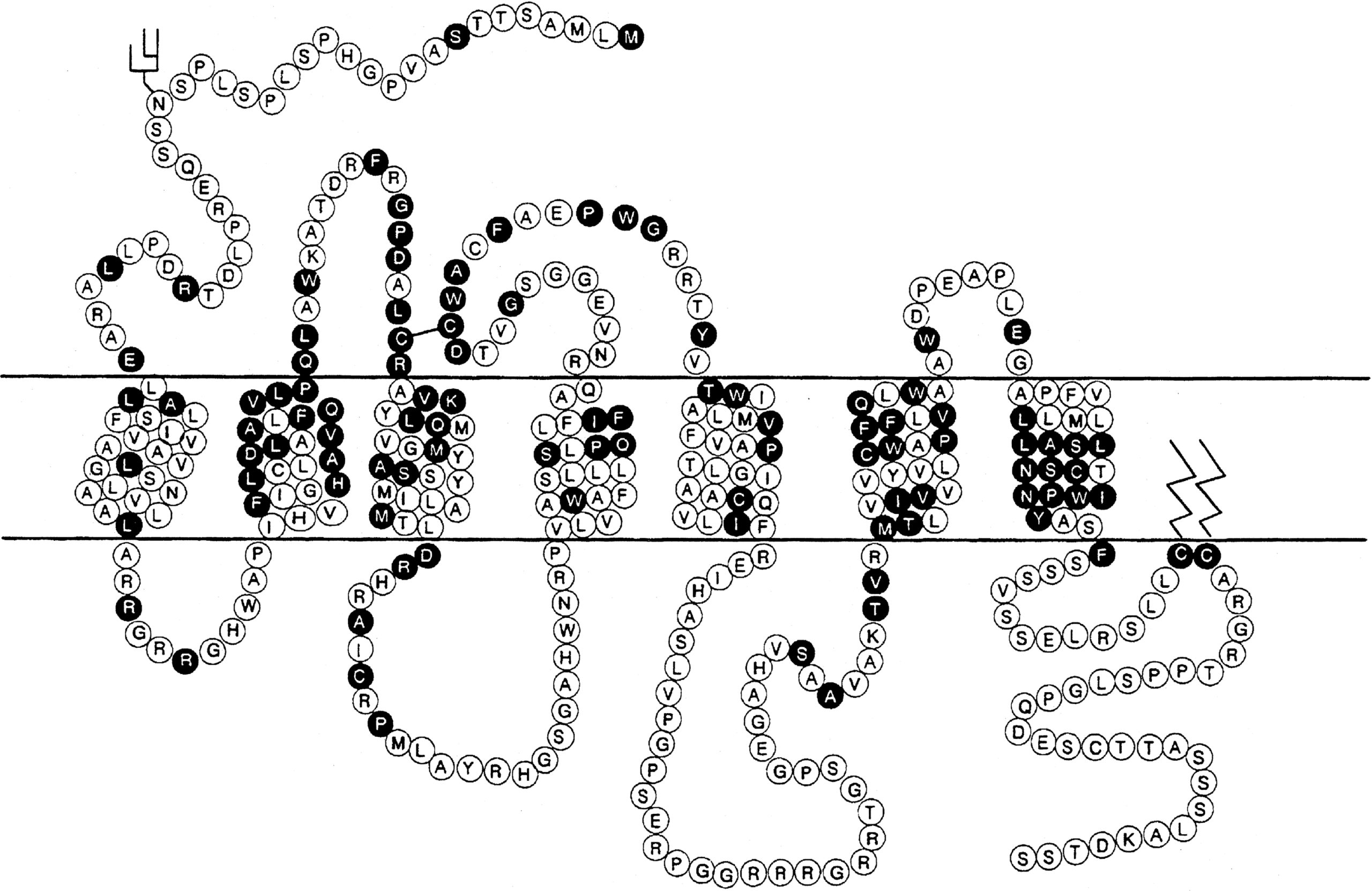
Hình 12.8 Cấu trúc của các thụ thể vasopressin V1 và V2, và thụ thể oxytocin. Mô tả cấu trúc liên kết màng dự đoán, với miền ngoại bào ở phía trên của hình và các axit amin theo mã một chữ cái. Các axit amin trong vòng tròn mở mã hóa cho thụ thể V1, trong khi những axit amin trong vòng tròn đen là chung cho cả ba thụ thể. (Baylis, P.H. (1989). Vasopressin and its neurophysin. In: Degroot, L.J., ed. Endocrinology. 2nd ed. WB Saunders, Philadelphia, p. 213. Với sự cho phép.)
Chuỗi phản ứng của Vasopressin tại thận
Sự gia tăng cAMP nội bào do vasopressin gây ra, qua trung gian của thụ thể V2, khởi động một chuỗi các sự kiện phức tạp dẫn đến tăng tính thấm của ống góp đối với nước và vận chuyển nước hiệu quả qua một lớp biểu mô vốn có tính thấm tối thiểu (Hình 12.9). Sự kích hoạt của một protein kinase phụ thuộc cAMP gây ra sự tái cấu trúc các vi ống và vi sợi của bộ xương tế bào, đỉnh điểm là sự chèn các tập hợp kênh nước vào màng đỉnh. Các cơ chế này có thể liên quan đến một protein giống VAMP-2 (vesicle-associated membrane protein-2), cũng điều chỉnh hoạt động của túi synap ở các đầu cuối thần kinh, và thụ thể liên quan của nó là syntaxin-4.
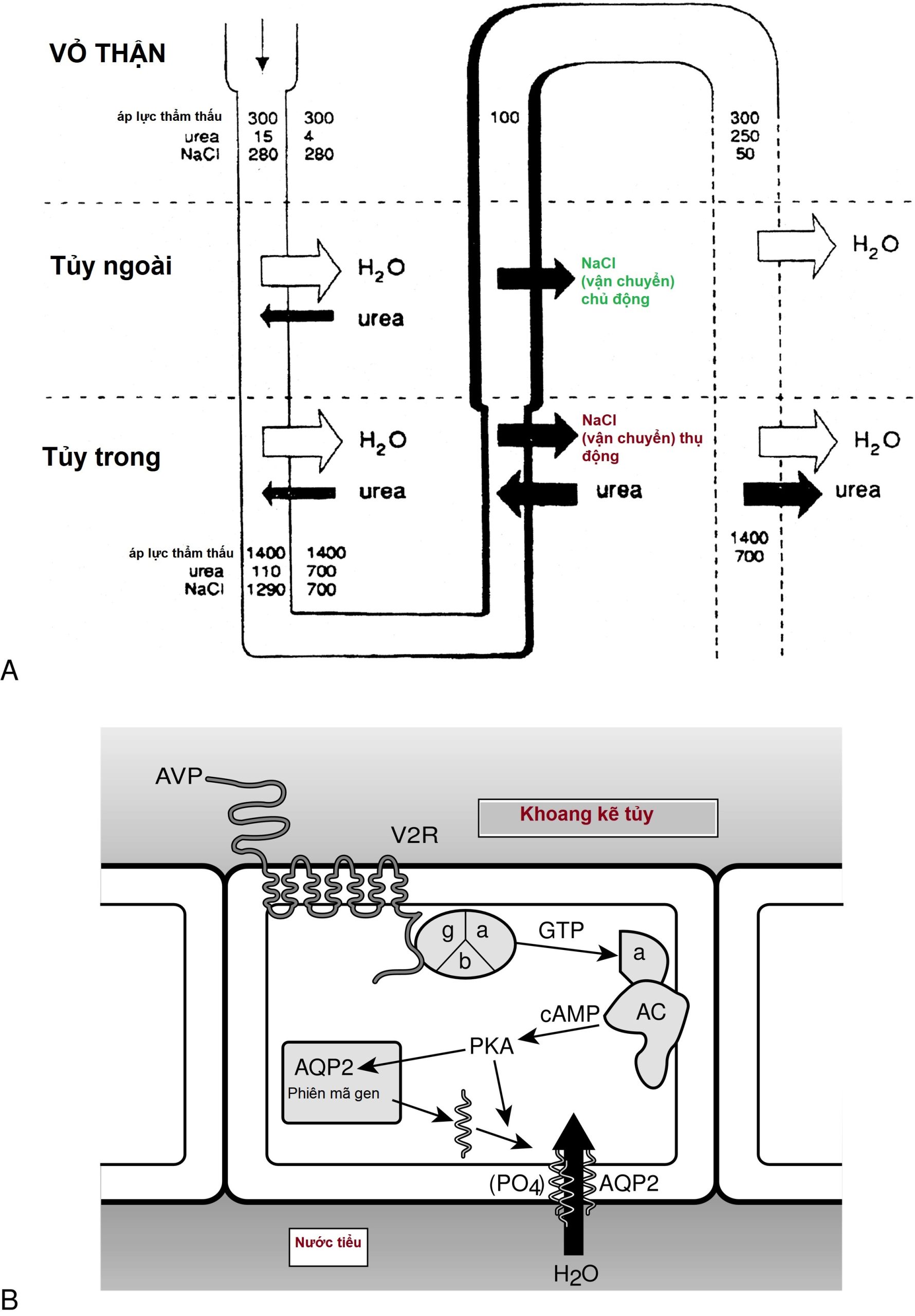
Hình 12.9 Tác động của Vasopressin ở thận. A, Xử lý chất tan và nước ở thận. B, Tác động của vasopressin trong tế bào ống góp. Vasopressin (AVP) gắn vào thụ thể V2 (V2R), gây ra sự gắn kết của guanosine triphosphate (GTP) vào tiểu đơn vị alpha G kích thích (α). Điều này kích hoạt adenylate cyclase (AC), dẫn đến sự gia tăng adenosine monophosphate vòng (cAMP) và kích hoạt protein kinase A (PKA). Tiểu đơn vị xúc tác của PKA, thông qua quá trình phosphoryl hóa serine 256 của kênh nước, aquaporin-2 (AQP2), gây ra sự tập hợp các homotetramer AQP2 trong các túi màng và sự hợp nhất của chúng với màng đỉnh của ống góp, dẫn đến sự gia tăng dòng nước từ nước tiểu vào khoảng kẽ tủy thận. Demeclocycline, lithium, canxi cao, và kali thấp cản trở các quá trình này, có thể ở mức độ tạo ra cAMP và tổng hợp hoặc hoạt động của AQP2. a, Gs alpha; b, Gs beta; g, Gs gamma. (A từ van Laar, T., Lammers, G-J., Roos, R.A.C., Gerritsen, J.J., Meinders, A.E. (1998). Antiparkinsonian drugs causing inappropriate antidiuretic hormone secretion. Mov Disord, 13, 176–178. Với sự cho phép.)
Sự chèn các kênh nước làm tăng tính thấm nước của màng đỉnh lên đến 100 lần, cho phép nước di chuyển theo gradient thẩm thấu của nó vào khoảng kẽ tủy trong ưu trương từ lòng ống và bài tiết nước tiểu cô đặc (xem Hình 12.9). Phân tích phân tử của các kênh nước đã tiết lộ một họ các protein liên quan, được đặt tên là aquaporin, khác nhau về vị trí biểu hiện và mô hình điều hòa. Mỗi protein bao gồm một chuỗi polypeptide đơn với sáu miền xuyên màng (Hình 12.10). Mặc dù hoạt động như các monomer, chúng tạo thành các homotetramer trong màng plasma.
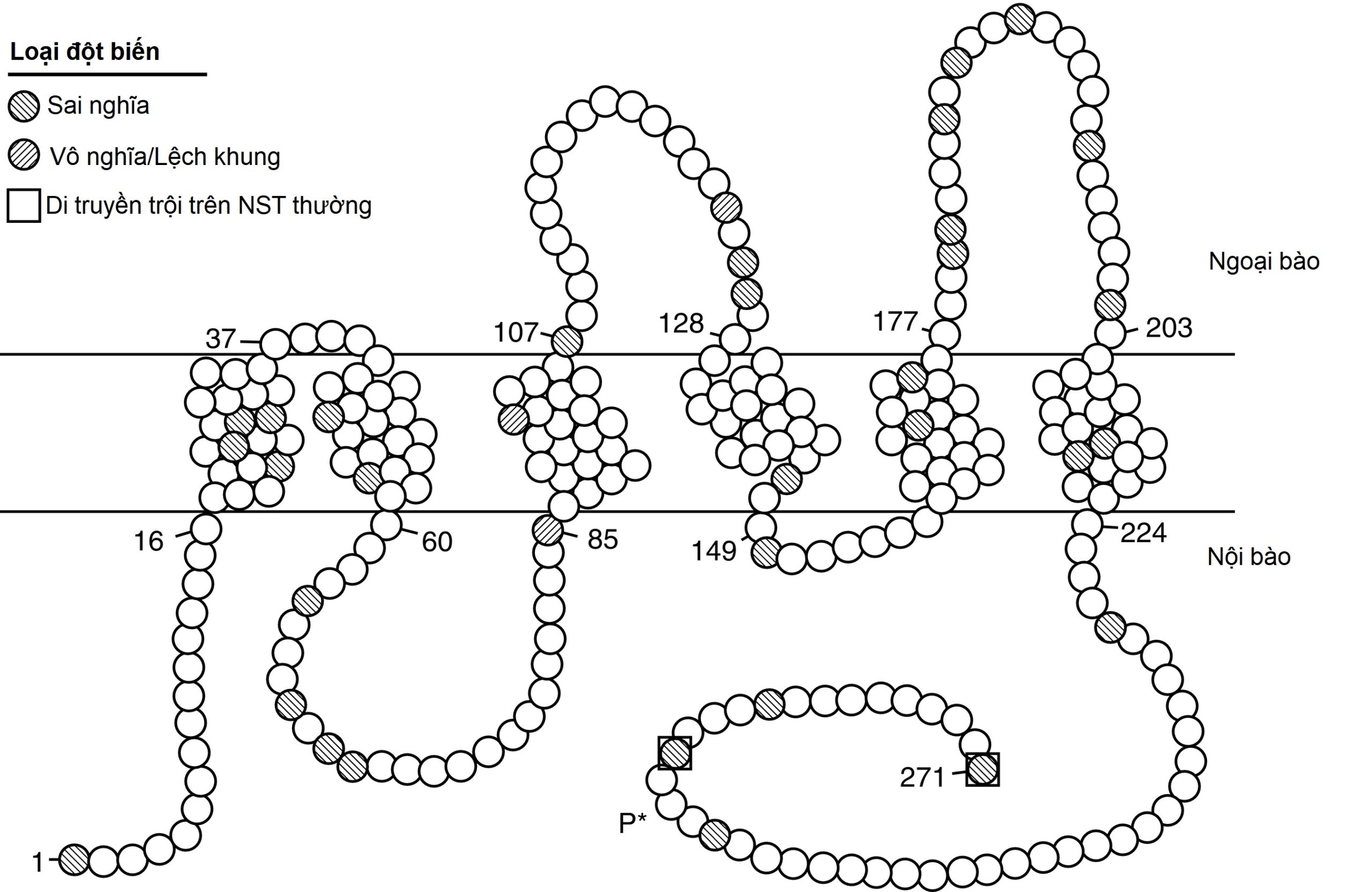
Hình 12.10 Cấu trúc của protein aquaporin-2 (AQP2) được chèn vào màng đỉnh của ống lượn xa và các đột biến AQP2 gây ra bệnh đái tháo nhạt do thận di truyền trên nhiễm sắc thể thường. Mô tả cấu trúc liên kết màng dự đoán, với miền ngoại bào ở phía trên của hình. Protein 271 axit amin bao gồm năm miền xuyên màng, bốn miền nội bào, và ba miền ngoại bào. Các đột biến axit amin được phân loại là sai nghĩa hoặc vô nghĩa/lệch khung. Hầu hết các đột biến được truyền theo kiểu lặn trên nhiễm sắc thể thường, với sự di truyền trội trên nhiễm sắc thể thường được ghi nhận bởi các axit amin được đóng khung. Quá trình phosphoryl hóa serine ở axit amin 256 (P) phụ thuộc vasopressin, qua trung gian protein kinase A được ghi nhận.*
AQP2 được biểu hiện chủ yếu trong thận, chủ yếu trong ống góp. Nó cũng được biểu hiện trong ống dẫn tinh, ít nhất là ở chuột, mặc dù nó không được điều hòa bởi vasopressin ở vị trí này. Các nghiên cứu bằng kính hiển vi điện tử miễn dịch đã chứng minh một lượng lớn AQP2 trong màng plasma đỉnh và các túi dưới đỉnh của ống góp, phù hợp với mô hình “con thoi màng” về việc chèn tập hợp kênh nước vào màng đỉnh sau khi kích thích bằng vasopressin. Các nghiên cứu phân tích cơ chế mà AQP2 di chuyển đến màng plasma đỉnh đã chứng minh rằng quá trình phosphoryl hóa serine ở axit amin 256 do vasopressin gây ra, qua trung gian protein kinase A, là cần thiết cho quá trình xuất bào của nó, một quá trình cũng cần một protein G dị tam thể của họ G i. Để đáp ứng với việc hạn chế nước hoặc truyền desmopressin ở người, hàm lượng AQP2 trong nước tiểu ở cả dạng hòa tan và dạng gắn màng đã được phát hiện là tăng lên. Chuột bị xóa gen AQP2 đích đã được tạo ra. Như mong đợi, chúng mắc bệnh đái tháo nhạt do thận không đáp ứng với điều trị bằng vasopressin.
Tăng canxi niệu có liên quan đến đa niệu mặc dù nồng độ vasopressin đầy đủ. Sự kích hoạt của canxi trong lòng ống đối với thụ thể cảm biến canxi (CaSR) trên màng đỉnh của các tế bào ống góp của thận có liên quan đến sự đề kháng với tác động của vasopressin. Việc sản xuất nước tiểu loãng khi có sự gia tăng nồng độ canxi trong nước tiểu được giả thuyết là một cơ chế bảo vệ để giảm thiểu nguy cơ kết tủa canxi trong thận. Các cơ chế mà sự kích hoạt CaSR làm giảm mức AQP2 trong các tế bào ống góp bao gồm giảm tổng hợp AQP2 bằng cách tạo ra microribonucleic acid (miRNA) nhắm mục tiêu AQP2, và sự bất hoạt và phân hủy AQP2 thông qua quá trình ubiquitin hóa và phosphoryl hóa tại serine261.
Ngoài AQP2, các aquaporin khác dường như có liên quan đến các khía cạnh khác của việc xử lý nước ở thận. Trái ngược với sự định vị ở màng đỉnh của AQP2, aquaporin-3 và aquaporin-4 được biểu hiện trên màng đáy-bên của biểu mô ống góp. Chúng tham gia vào dòng chảy của nước và urê từ bên trong tế bào ống góp vào không gian tủy thận ngoại bào. Chuột bị thiếu hụt aquaporin-4 về mặt di truyền cho thấy một khiếm khuyết cô đặc nước tiểu nhẹ, trong khi những con bị thiếu hụt chỉ aquaporin-3, hoặc cùng với aquaporin-4, cho thấy khả năng cô đặc nước tiểu bị suy giảm nghiêm trọng hơn. Chuột bị thiếu hụt aquaporin-1 về mặt di truyền cho thấy một khiếm khuyết cô đặc nước tiểu do giảm tính thấm nước ở ống lượn gần.
Các con đường cảm biến và đáp ứng thể tích
Hệ Renin-Angiotensin-Aldosterone
Trái ngược với hệ thống vasopressin, hệ thống renin-angiotensin cổ điển, hay ngoại vi, chủ yếu ảnh hưởng đến việc duy trì thể tích nội mạch chứ không phải trương lực huyết tương. Ngoài hệ thống điều hòa nội tiết đã được thiết lập rõ ràng, một số hệ thống renin-angiotensin cục bộ đã xuất hiện, với cả tác động tự tiết và cận tiết trong mô tổng hợp của chúng, mà sự điều hòa của chúng độc lập với hệ thống cổ điển. Cuối cùng, các hệ thống angiotensin trong não và tuyến yên liên quan đến huyết áp, chức năng tự chủ, và cân bằng dịch đã được mô tả với sự tương tác sâu rộng với hệ thống vasopressin, và vasopressin đã được phát hiện có vai trò trong hoạt động bình thường của aldosterone trên biểu mô ống thận.
Hệ Endocrine Renin-Angiotensin-Aldosterone
Giải phẫu và Hóa sinh
Renin, được tổng hợp bởi bộ máy cạnh cầu thận, là một enzyme phân giải protein xúc tác cho quá trình phân cắt angiotensinogen, do tế bào gan tổng hợp, thành decapeptide angiotensin I. Angiotensin I không có hoạt tính co mạch nội tại hay hoạt tính kích thích tiết mineralocorticoid, nhưng được enzyme chuyển angiotensin (ACE) ở phổi cũng như các vị trí ngoại vi khác phân cắt hiệu quả để tạo ra octapeptide angiotensin II. Angiotensin II được chuyển hóa thêm thành heptapeptide angiotensin III bằng cách loại bỏ một axit amin ở đầu amino. Angiotensin II có hoạt tính co mạch mạnh hơn và có nồng độ cao hơn khoảng 4 lần so với angiotensin III. Angiotensin II và III có hoạt tính kích thích tiết mineralocorticoid tương đương trên các tế bào lớp cầu của vỏ thượng thận.
Angiotensin II và III tác động thông qua các thụ thể trên bề mặt tế bào (AT1) trên các tế bào lớp cầu của vỏ thượng thận để kích hoạt con đường phospholipase C/protein kinase C. Sự kích hoạt này dẫn đến tăng sản xuất pregnenolone từ cholesterol bởi enzyme cắt chuỗi bên (20,22-desmolase) và aldosterone từ corticosterone bởi các hoạt động corticosterone methyloxidase I và II đặc hiệu của lớp cầu (hydroxyl hóa và khử hydro ở vị trí 18, tương ứng). Một phân nhóm thụ thể riêng biệt cho angiotensin II và III, thụ thể AT2, không kết hợp với protein G và có ý nghĩa sinh lý không rõ ràng ở ngoại vi, nhưng có thể chống lại tác dụng của AT1 bằng cách gây bài niệu natri. Aldosterone, mineralocorticoid nội sinh chính và mạnh nhất được giải phóng bởi lớp cầu, tác động lên các mô đích biểu hiện thụ thể mineralocorticoid nhân (hoặc thụ thể glucocorticoid loại I) để thúc đẩy hấp thu natri và bài tiết kali. Để kiểm soát thể tích nội mạch, mục tiêu tác động chính của aldosterone là nephron xa. Tại đây, aldosterone làm tăng tổng hợp các kênh natri ở màng đỉnh, các enzyme ty thể liên quan đến sản xuất adenosine triphosphate, và các thành phần của Na+, K+ adenosine triphosphatase để gây tăng tái hấp thu natri và bài tiết kali.
Điều hòa bài tiết
Giảm thể tích nội mạch được cảm nhận bởi bộ máy cạnh cầu thận dẫn đến giải phóng renin. Hoạt độ renin huyết tương tăng sau đó cho phép tăng chuyển đổi angiotensinogen thành angiotensin I, và angiotensin I lại được chuyển đổi ở ngoại vi thành angiotensin II và III. Hoạt độ angiotensin II tăng gây co mạch và tăng huyết áp, trong khi cả angiotensin II và III đều kích thích giải phóng aldosterone từ lớp cầu và sau đó là giữ muối, nước và bài tiết kali bởi ống lượn xa của thận. Ngược lại, thể tích nội mạch tăng gây giảm sản xuất renin và giảm tái hấp thu natri và nước ở thận, có tác dụng làm giảm thể tích nội mạch và phục hồi cân bằng nội môi.
Sự thay đổi thể tích mạch máu không phải là yếu tố điều hòa duy nhất của hệ renin-angiotensin-aldosterone. Nồng độ kali huyết thanh trực tiếp điều chỉnh việc giải phóng aldosterone bởi lớp cầu của vỏ thượng thận thông qua tác động của nó lên điện thế màng plasma và sự kích hoạt các kênh canxi phụ thuộc điện thế. Bằng cách khử cực màng, kali huyết thanh tăng dẫn đến tăng tổng hợp aldosterone, thúc đẩy bài tiết kali qua thận, trong khi kali huyết thanh thấp làm giảm tổng hợp aldosterone và giảm mất kali qua nước tiểu. Hormone vỏ thượng thận của tuyến yên (ACTH) và vasopressin tác động thông qua các thụ thể tương ứng trên các tế bào lớp cầu để tăng bài tiết aldosterone cấp tính. Các tác dụng này có thời gian ngắn vì việc truyền mạn tính dài hạn không làm tăng nồng độ aldosterone một cách mạn tính. Các chất ức chế trực tiếp bài tiết aldosterone, và do đó là chất thúc đẩy bài niệu natri, bao gồm peptide lợi niệu nhĩ (ANP), somatostatin, và dopamine.
Các hệ Renin-Angiotensin cục bộ
Giải phẫu và Hóa sinh
Ngoài vòng tuần hoàn nội tiết đã được xác định rõ ràng, các thành phần của hệ renin-angiotensin đã được tìm thấy trong nhiều loại mô, bao gồm não, tuyến yên, thành động mạch, tim, buồng trứng, thận và tuyến thượng thận, nơi các chức năng điều hòa cận tiết và tự tiết đã được giả định, trải qua sự điều hòa độc lập với hệ thống toàn thân tương ứng. Từ quan điểm điều hòa cân bằng nội môi nước và thể tích, hệ renin-angiotensin trong não cần được mô tả thêm. Từ lâu người ta đã biết rằng angiotensin II được tổng hợp ở ngoại vi có thể làm tăng huyết áp bằng cách tác động lên não bên ngoài hàng rào máu não, tại các vị trí như OVLT, SFO, vùng postrema, và lồi giữa, như được tiết lộ qua các nghiên cứu gắn kết phối tử. Trong thập kỷ qua, rõ ràng là hệ thống hoàn chỉnh để tạo ra angiotensin II có mặt trong não. Angiotensinogen đã được định vị ở các tế bào hình sao bằng cả phương pháp định vị peptide miễn dịch huỳnh quang và phân tích lai tại chỗ của mRNA. Ngược lại, renin đã được tìm thấy ở nồng độ cao trong các đầu cuối thần kinh, với sự giải phóng tăng cường khi dây thần kinh bị khử cực. Enzyme chuyển angiotensin đã được tìm thấy trong các thành phần mạch máu, đám rối màng mạch, và thần kinh của hệ thần kinh trung ương, đáng chú ý nhất là SFO và nhiều nhân dưới đồi, các vị trí biểu hiện thụ thể angiotensin II nội sinh, chủ yếu là phân nhóm AT1, cũng như các vị trí không biểu hiện thụ thể angiotensin II, chẳng hạn như hạch nền. Phân tử tác động chính, angiotensin II, đã được định vị đặc biệt ở các tế bào thần kinh và ở cấp độ dưới tế bào là các túi synap. Hai trong số các vị trí quan trọng nhất bao gồm các cơ quan quanh não thất và nhân cạnh não thất của vùng dưới đồi. Trong nhân cạnh não thất, khả năng phản ứng miễn dịch của angiotensin II đồng định vị với vasopressin tế bào lớn, trong khi các thụ thể của nó nằm trong vùng tế bào nhỏ của nhân cạnh não thất.
Điều hòa bài tiết
Con đường angiotensin II ở não trước, trong đó nhân cạnh não thất là một thành phần, và con đường angiotensin II ở cơ quan quanh não thất là những trung tâm kiểm soát quan trọng để duy trì cân bằng nội môi thẩm thấu và thể tích. Nồng độ angiotensin II ngoại vi tăng, như mong đợi trong tình trạng suy giảm thể tích nội mạch, sẽ kích thích hành vi uống nước. Tác động này của angiotensin II ngoại vi có thể bị loại bỏ bằng cách phá hủy OVLT hoặc SFO, những vùng mà sự phá hủy từ lâu đã được công nhận là gây ra chứng mất khát. Các tác động khác của hoạt động angiotensin II trung ương bao gồm tăng cường cảm giác thèm natri và kích thích giải phóng vasopressin, tất cả đều có tác dụng, giống như angiotensin II ngoại vi, để phục hồi thể tích nội mạch và duy trì huyết áp. Tín hiệu giảm thể tích máu được truyền qua dây thần kinh phế vị từ các cảm biến thể tích đến thân não và vùng nhân bó đơn độc. Các sợi ly tâm từ các trung tâm thân não này chiếu đến nhân trước thị giữa và nhân cạnh não thất, cũng như con đường angiotensin II ở não trước, nơi gây ra các tác động uống nước và co mạch, cũng như giải phóng vasopressin.
Các con đường riêng biệt để giải phóng vasopressin trung gian cho phản ứng với angiotensin II ngoại vi hoặc kích thích thẩm thấu thuần túy của các cảm biến thẩm thấu. Việc giải phóng vasopressin để đáp ứng với kích thích thẩm thấu không bị tăng lên bởi angiotensin II ngoại vi, và kích thích thẩm thấu thuần túy không làm tăng cảm giác thèm muối. Ngược lại, angiotensin II trung ương có thể hoạt động như một chất truyền dẫn trong mạch cảm biến thẩm thấu, dẫn đến giải phóng vasopressin.
Hệ Peptide Lợi niệu Natri (Natriuretic Peptide)
Ngoài các hệ thống vasopressin và renin-angiotensin-aldosterone cổ điển, các họ peptide lợi niệu natri và các thụ thể của chúng bổ sung thêm tiềm năng điều chỉnh cân bằng muối và nước. Sự tương tác của hệ peptide lợi niệu natri xảy ra cả trong hệ thần kinh trung ương thông qua tác động lên bài tiết vasopressin, và ở ngoại vi, thông qua khả năng vừa trực tiếp thúc đẩy bài niệu natri ở thận vừa gián tiếp ức chế sản xuất aldosterone ở tuyến thượng thận.
Giải phẫu và Hóa sinh
ANP ban đầu được phát hiện là một thành phần của cơ nhĩ tim có khả năng gây bài niệu natri, giảm huyết áp, và tăng hematocrit khi tiêm vào chuột.
Dạng có hoạt tính sinh học của ANP bao gồm một peptide 28 axit amin có cấu trúc vòng 17 axit amin (Hình 12.11). Trình tự chính của peptide đã được bảo tồn giữa các loài động vật có vú và, ngoài việc được tổng hợp trong mô nhĩ tim, đã được phát hiện trong não, tủy sống, tuyến yên, và tuyến thượng thận. Trong não, sự tổng hợp ANP xảy ra ở một số vị trí điều hòa thần kinh nội tiết quan trọng, bao gồm các nhân quanh não thất, nhân cung, nhân trước thị bụng trước, và nhân dưới đồi bên. ANP được tổng hợp dưới dạng một tiền-prohormone 151 axit amin và được lưu trữ dưới dạng một prohormone 126 axit amin sau khi loại bỏ trình tự peptide tín hiệu. Cùng với việc bài tiết pro-ANP là sự phân cắt của nó giữa các axit amin 98 và 99 để tạo ra đoạn 99–126 gồm 28 axit amin trưởng thành.

Hình 12.11 Thành phần axit amin của các peptide lợi niệu natri ở người. Các axit amin giống hệt nhau giữa ba peptide được chỉ định bằng các chữ cái in đậm, và liên kết disulfide giữa các gốc Cys được thể hiện.
Nghiên cứu sau đó đã xác định một peptide thứ hai từ não lợn có sự tương đồng về cấu trúc với ANP. Peptide này, được đặt tên là peptide lợi niệu não (BNP), sau đó cũng được phát hiện là do tim tiết ra, trong trường hợp này, từ cả mô thất và nhĩ. BNP ở người bao gồm 32 axit amin được xử lý từ một tiền-prohormone lớn hơn, có chung cấu trúc vòng trung tâm với ANP (xem Hình 12.11), mặc dù nó ít được bảo tồn giữa các loài hơn ANP.
Một thành viên thứ ba của họ này, peptide lợi niệu loại C (CNP), cũng được phân lập từ não lợn. Trong não, CNP là thành viên phong phú nhất của họ peptide lợi niệu natri. Trong vùng dưới đồi, các vị trí tổng hợp cụ thể phần lớn chồng chéo với các vị trí biểu hiện ANP. Rất ít CNP có thể được phát hiện trong huyết tương, và trái ngược hoàn toàn với ANP và BNP, CNP không tăng trong huyết tương trong bối cảnh suy tim. Bên ngoài não, CNP được tổng hợp trong tế bào nội mô và cơ trơn mạch máu. Trong các mô có khả năng biểu hiện gen CNP, hai dạng của peptide được tạo ra, một peptide 53 axit amin và một phân tử 22 axit amin ít phong phú hơn (xem Hình 12.11).
Tồn tại ba thụ thể nội sinh riêng biệt cho các peptide lợi niệu natri. Thụ thể đầu tiên trong số này được phân lập (thụ thể peptide lợi niệu natri [NPR]-A hoặc guanylyl cyclase [GC]-A) đã được nhân bản nhờ sự tương đồng của nó với guanylyl cyclase của tinh trùng nhím biển và sau đó được phát hiện có ANP và BNP là các phối tử bình thường của nó. Một thụ thể loại guanylyl cyclase thứ hai (NPR-B) có sự tương đồng đáng kể với NPR-A; tuy nhiên, nó gắn kết với CNP với ái lực lớn hơn đáng kể so với ANP hoặc BNP. Một thụ thể thứ ba (NPR-C) không có hoạt tính guanylyl cyclase và có lẽ có chức năng thanh thải cả ba peptide lợi niệu natri khỏi tuần hoàn. Các nghiên cứu lai tại chỗ sử dụng các đầu dò có khả năng phân biệt các loại thụ thể khác nhau đã cho thấy một số khác biệt về sự phân bố giữa các loài. Thụ thể NPR-A đã được định vị ở thận, tuyến thượng thận, tuyến yên, não, và tim ở khỉ, với NPR-B chỉ giới hạn ở tuyến thượng thận, tuyến yên, và não. Ở chuột, sự phân bố rộng rãi trong các mô của cả NPR-A và NPR-B đã được mô tả. Thụ thể NPR-C tương tự đã được tìm thấy ở tuyến thượng thận, tim, não, và tuyến yên.
Điều hòa bài tiết và tác động
Sự bài tiết ANP của mô tim xảy ra để đáp ứng với sự gia tăng áp lực xuyên thành nhĩ, từ cả tâm nhĩ trái và phải. Các nghiên cứu sử dụng phương pháp mở rộng thể tích nội mạch, tập thể dục, và thiếu oxy cho thấy nồng độ ANP huyết tương tăng sau những kích thích này trong cả mô hình động vật và người. Nhịp tim tăng, đặc biệt là tần số co bóp nhĩ tăng, cũng dẫn đến tăng bài tiết ANP. Trong bối cảnh nhịp nhanh trên thất, nồng độ ANP huyết tương cao, cũng như nồng độ vasopressin bị ức chế (cả hai có lẽ do sự gia tăng thể tích và áp lực nhĩ) góp phần vào tình trạng đa niệu liên quan đến hội chứng này. Việc sản xuất ANP ở thất cũng đã được chứng minh; nó tăng lên trong các trạng thái quá tải thất trái liên quan đến phì đại thất. ANP được tổng hợp trong hệ thần kinh trung ương thay đổi theo cách phụ thuộc vào thể tích, tương tự như ANP ngoại vi, cho thấy chức năng tương tự.
Hệ quả sinh lý của việc tăng sản xuất ANP có một số khía cạnh. Việc truyền ANP trong bối cảnh thể tích máu bình thường gây ra bài niệu natri, lợi tiểu, và một sự gia tăng nhỏ trong bài tiết cation hóa trị hai. ANP, thông qua thụ thể NPR-A, chủ yếu ức chế tái hấp thu natri trong ống góp tủy trong của thận, nhưng cũng chống lại tác dụng giữ muối của angiotensin II ở mức ống lượn gần. ANP tương tự cũng ức chế tác động của vasopressin và aldosterone trong các ống thận. Các tác động tim mạch trực tiếp của ANP bao gồm giãn cơ trơn động mạch, cả cấp tính và khi dùng mạn tính. Một phần, tác động này có thể được trung gian thông qua việc chống lại tác động của angiotensin II.
ANP điều chỉnh sản xuất mineralocorticoid theo cách dẫn đến giảm thể tích hoặc áp lực nội mạch. Mặc dù đã có mô tả về việc giảm trực tiếp hoạt độ renin huyết tương khi truyền ANP, phản ứng rõ rệt nhất với ANP xảy ra ở mức tế bào lớp cầu của vỏ thượng thận. ANP ức chế sản xuất aldosterone bằng cách ức chế hoạt động của hầu hết các chất kích thích tiết aldosterone, với sự giảm rõ rệt nhất là hoạt động của angiotensin II. Nồng độ ANP huyết thanh mà tại đó các tác động lên hoạt độ renin huyết tương và sản xuất aldosterone xảy ra nằm trong phạm vi sinh lý, mặc dù tầm quan trọng của con đường này trong sinh lý học bình thường của con người vẫn chưa được xác định đầy đủ.
Việc tiêm trực tiếp ANP vào hệ thần kinh trung ương của động vật đã cho thấy vai trò quan trọng của ANP (hoặc CNP) trong cân bằng nội môi tim mạch và muối. Hạ huyết áp và nhịp tim chậm đều đã được quan sát, cũng như sự ức chế bài tiết vasopressin, hormone vỏ thượng thận, và hormone giải phóng gonadotropin. Do đó, tác động đối kháng của ANP và angiotensin II lên thể tích nội mạch và huyết áp vẫn tương đồng giữa hệ thống trung ương và ngoại vi.
Sự tổng hợp và bài tiết BNP từ mô thất tim được tăng cường trong suy tim sung huyết, và, cũng như đối với ANP, với tăng huyết áp, suy thận mạn, và suy gan mạn. BNP gắn vào thụ thể NPR-A, nơi nó có khả năng kích thích sản xuất cyclic guanosine monophosphate. Việc truyền BNP ức chế sản xuất aldosterone và dẫn đến bài niệu natri tương tự như đã báo cáo đối với ANP. Với tốc độ truyền tạo ra nồng độ BNP cao gấp 10 lần so với mức cơ bản, cũng đã thấy có sự giảm huyết áp. Ngoài việc điều chỉnh cân bằng nội môi natri, ANP và BNP, thông qua các thụ thể NPR-A, kích thích sự chuyển đổi của mỡ trắng thành mỡ màu be, và do đó có thể liên quan đến điều hòa thân nhiệt và cân bằng năng lượng.
Trái ngược với ANP và BNP, sự biểu hiện của CNP chủ yếu gây ra sự kích hoạt của thụ thể NPR-B. Nồng độ CNP huyết tương không thay đổi đáng kể khi quá tải thể tích, và người ta tin rằng phần lớn tác động của CNP xảy ra theo kiểu cận tiết, cả trong não và mạch máu. CNP được tổng hợp trong nội mô mạch máu tác động lên các thụ thể trong cơ trơn mạch máu để gây giãn mạch. Việc truyền CNP ở chó làm giảm huyết áp và áp lực nhĩ phải một cách cấp tính, nhưng không dẫn đến bài niệu natri, trong khi ở người, liều cao hơn mức sinh lý một cách vừa phải không gây hạ huyết áp cũng không gây bài niệu natri. Trái ngược với ANP, việc truyền CNP vào não thất dẫn đến giảm huyết áp, cho thấy vai trò của CNP trong việc kiểm soát trung ương của áp lực động mạch. CNP ức chế bài tiết vasopressin do angiotensin II kích thích nhưng lại kích thích cảm giác khát. Tầm quan trọng tổng thể của các con đường trung ương của CNP trong việc điều chỉnh cân bằng nước ở người vẫn cần được xác định.
Tiếp cận bệnh nhân: Chẩn đoán phân biệt các rối loạn chuyển hóa nước
Hạ Natri máu (Hình 12.12)
Hạ natri máu (natri huyết thanh < 135 mEq/L) ở trẻ em thường liên quan đến các rối loạn hệ thống nghiêm trọng. Nguyên nhân thường gặp nhất là do suy giảm thể tích nội mạch hoặc mất muối quá mức và cũng gặp phải khi quá tải dịch nhược trương, đặc biệt ở trẻ sơ sinh. Tăng vasopressin không phù hợp là một trong những nguyên nhân ít phổ biến nhất gây hạ natri máu ở trẻ em, ngoại trừ sau khi dùng vasopressin để điều trị bệnh đái tháo nhạt.
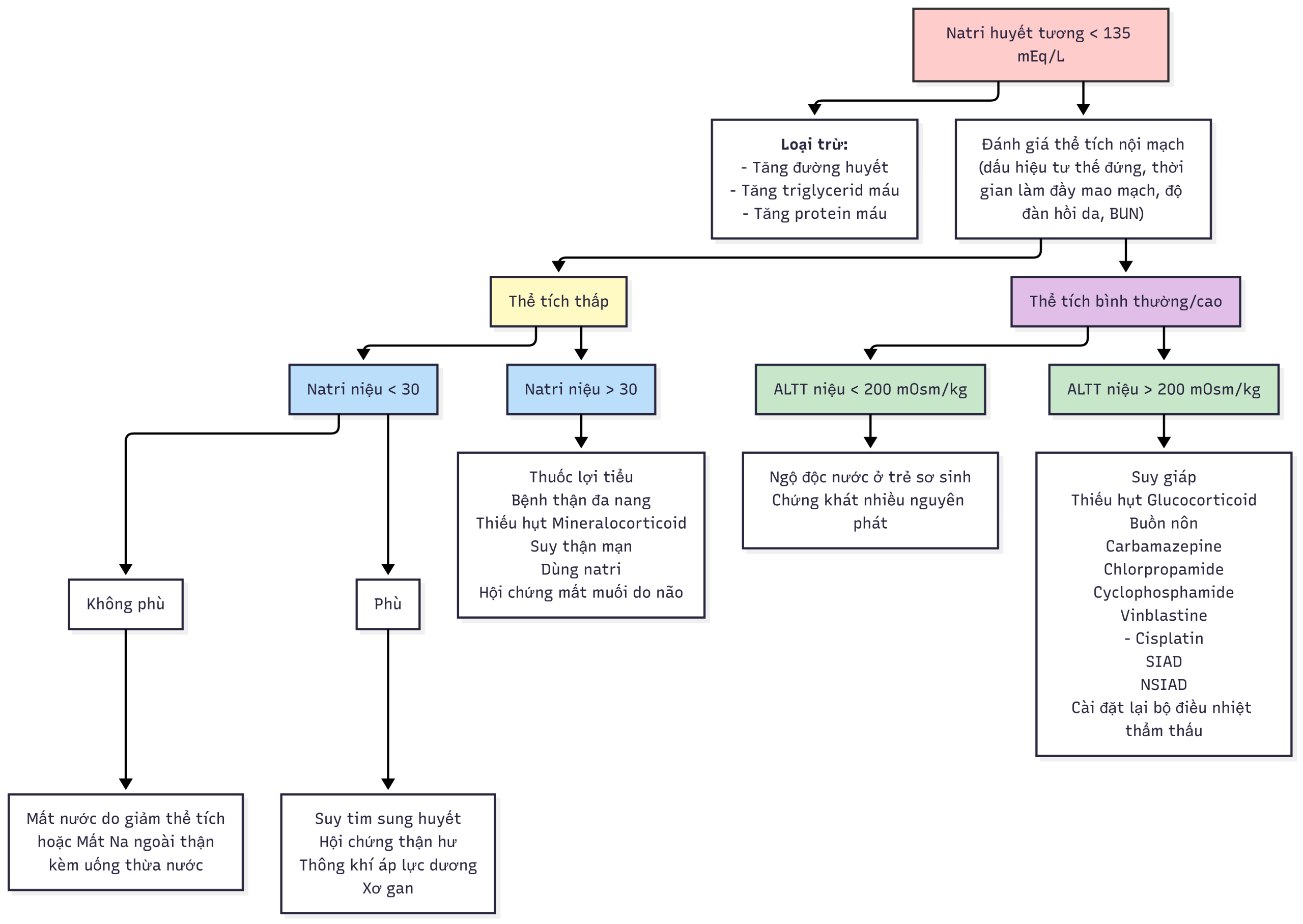
Hình 12.12 Lược đồ chẩn đoán hạ natri máu.
Khi đánh giá nguyên nhân hạ natri máu, trước tiên cần xác định xem bệnh nhân có bị mất nước và giảm thể tích máu hay không. Điều này thường rõ ràng qua khám thực thể (giảm cân, độ đàn hồi da, áp lực tĩnh mạch trung tâm) và dữ liệu xét nghiệm (ure máu cao, renin, aldosterone, axit uric). Khi mức lọc cầu thận giảm, tái hấp thu natri và nước ở ống lượn gần sẽ cao, dẫn đến giá trị natri niệu thường dưới 10 mEq/L. Bệnh nhân bị giảm thể tích nội mạch “hiệu dụng” do suy tim sung huyết, xơ gan, hội chứng thận hư, hoặc bệnh phổi sẽ có dữ liệu xét nghiệm tương tự, nhưng cũng sẽ có các dấu hiệu rõ ràng của bệnh nền, thường bao gồm phù ngoại vi. Bệnh nhân mất muối nguyên phát cũng sẽ có biểu hiện giảm thể tích. Nếu mất muối từ thận (ví dụ, điều trị lợi tiểu hoặc bệnh thận đa nang), nồng độ natri niệu sẽ tăng, cũng như thể tích nước tiểu. Mất muối từ các vùng khác (ví dụ, ruột trong viêm dạ dày ruột hoặc da trong bệnh xơ nang) sẽ làm natri niệu thấp, như trong các dạng mất nước toàn thân khác. Hội chứng mất muối do não đã được cho là xảy ra với các tổn thương hệ thần kinh trung ương, và dẫn đến nồng độ ANP huyết thanh cao, dẫn đến natri niệu và bài tiết nước tiểu cao và mất nước toàn thân. Sự tồn tại của nó còn gây tranh cãi, và được nhiều chuyên gia cho là hiếm gặp hoặc không tồn tại.
Hội chứng bài niệu không phù hợp (SIADH) tồn tại khi sự gia tăng nguyên phát trong bài tiết vasopressin hoặc sự kích hoạt không phù hợp của thụ thể V2 vasopressin là nguyên nhân của hạ natri máu. Nó được đặc trưng bởi hạ natri máu, nước tiểu cô đặc không phù hợp (> 100 mOsm/kg), thể tích huyết tương bình thường hoặc tăng nhẹ, và natri niệu bình thường đến cao (do ức chế aldosterone và tăng ANP do tăng thể tích). Axit uric huyết thanh thấp ở bệnh nhân SIADH, trong khi nó cao ở những người bị hạ natri máu do mất nước toàn thân hoặc các nguyên nhân khác gây giảm thể tích nội mạch. Đo nồng độ vasopressin huyết tương thường không hữu ích lắm vì nó tăng trong gần như tất cả các nguyên nhân gây hạ natri máu, ngoại trừ tăng tiết ANP nguyên phát hoặc các đột biến trong thụ thể vasopressin dẫn đến sự kích hoạt không phù hợp của nó. Bởi vì thiếu hụt cortisol và tuyến giáp gây hạ natri máu do một số cơ chế, được thảo luận sau đây, chúng nên được xem xét ở tất cả các bệnh nhân hạ natri máu. Hạ natri máu do thuốc nên được xem xét ở những bệnh nhân đang dùng các loại thuốc có khả năng gây ra, như sẽ được thảo luận sau. Ở trẻ em bị SIADH không có nguyên nhân rõ ràng, cần xem xét việc tìm kiếm cẩn thận một khối u (u tuyến ức, u thần kinh đệm, carcinoid phế quản). Gần đây, việc đo copeptin, kết hợp với truyền nước muối ưu trương, đã được sử dụng để phân loại SIADH thành các phân nhóm khác nhau.
Đa niệu, Khát nhiều, và Tăng Natri máu (Hình 12.13)
Ở trẻ em, trước tiên phải xác định xem có tình trạng đa niệu hoặc khát nhiều bệnh lý (cả hai đều vượt quá 2 L/m2/ngày) hay không. Các câu hỏi sau được đặt ra: Có lý do tâm lý xã hội nào cho đa niệu hoặc khát nhiều không? Có thể định lượng được chúng không? Đa niệu hoặc khát nhiều có cản trở các hoạt động bình thường không? Có tiểu đêm hoặc đái dầm không? Nếu có, bệnh nhân có uống nước sau khi thức dậy vào ban đêm không? Tiền sử (bao gồm cả dữ liệu tăng trưởng theo chiều dọc) hoặc khám thực thể có gợi ý sự thiếu hụt hoặc dư thừa bài tiết nội tiết khác hoặc một khối u nội sọ không?
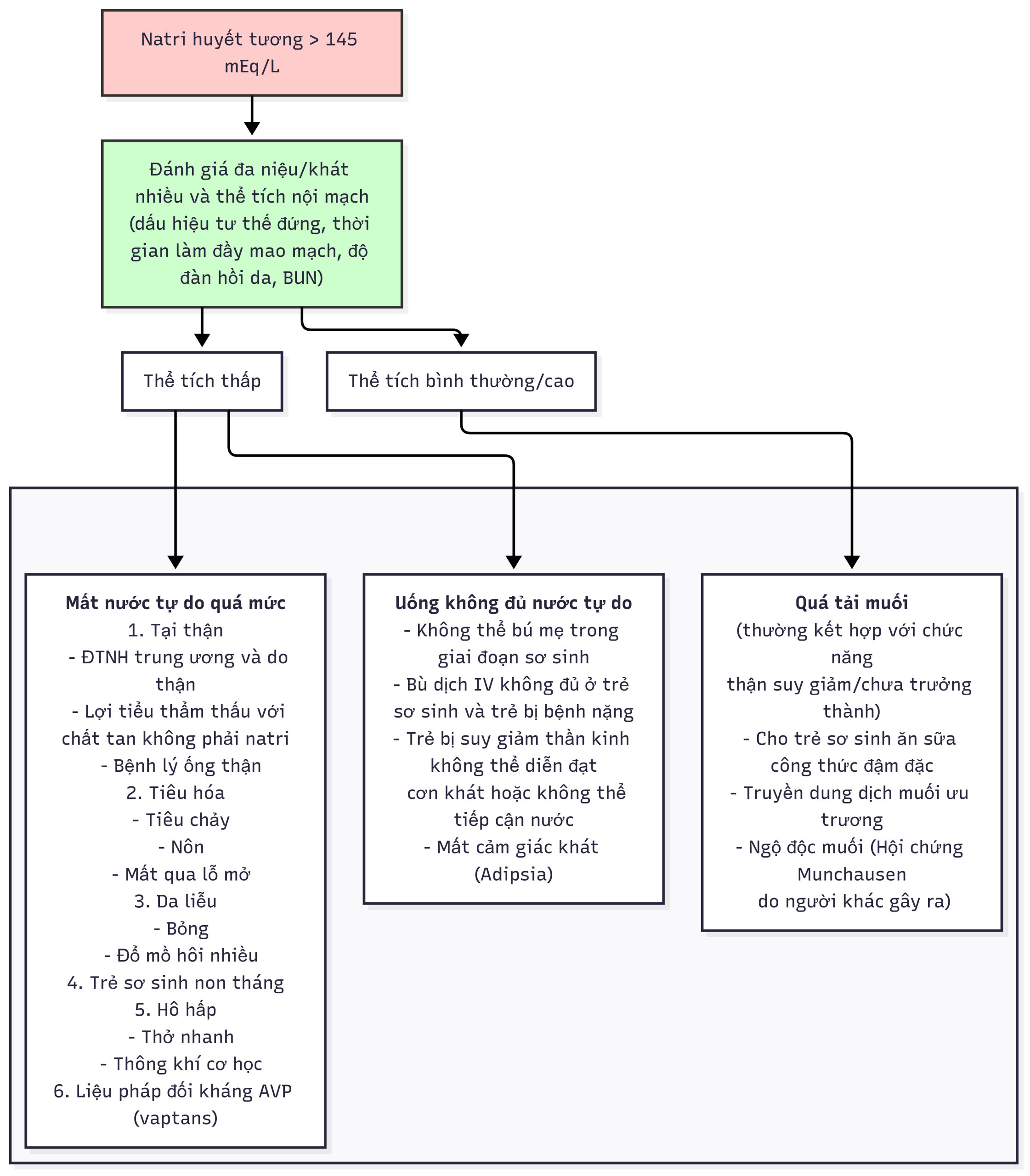
Hình 12.13 Lược đồ chẩn đoán tăng natri máu.
Nếu có đa niệu hoặc khát nhiều bệnh lý, cần thực hiện các xét nghiệm sau. Trong môi trường ngoại trú: áp lực thẩm thấu huyết thanh; nồng độ natri, kali, glucose, canxi, và ure máu trong huyết thanh; và phân tích nước tiểu, bao gồm đo áp lực thẩm thấu nước tiểu, tỷ trọng, và nồng độ glucose. Áp lực thẩm thấu huyết thanh lớn hơn 300 mOsm/kg, với áp lực thẩm thấu nước tiểu nhỏ hơn 300 mOsm/kg, xác định chẩn đoán đái tháo nhạt. Nếu áp lực thẩm thấu huyết thanh nhỏ hơn 270 mOsm/kg, hoặc áp lực thẩm thấu nước tiểu lớn hơn 600 mOsm/kg, chẩn đoán đái tháo nhạt là không chắc chắn. Nếu, khi sàng lọc ban đầu, bệnh nhân có áp lực thẩm thấu huyết thanh nhỏ hơn 300 mOsm/kg, nhưng ghi chép lượng dịch vào/ra tại nhà cho thấy đa niệu và khát nhiều đáng kể không thể quy cho chứng khát nhiều nguyên phát (tức là, áp lực thẩm thấu huyết thanh lớn hơn 270 mOsm/kg), bệnh nhân nên được thực hiện nghiệm pháp nhịn nước để xác định chẩn đoán đái tháo nhạt và phân biệt nguyên nhân trung ương và do thận.
Sau một đêm nhịn ăn được dung nạp tối đa (dựa trên tiền sử ngoại trú), trẻ được nhập viện vào trung tâm xét nghiệm ngoại trú vào sáng sớm của một ngày mà có thể thực hiện một nghiệm pháp kéo dài 8 đến 10 giờ, và trẻ bị nhịn uống nước. Các dấu hiệu thực thể và các thông số sinh hóa được trình bày trong quy trình đi kèm được đo lường (Hình 12.14). Nếu bất cứ lúc nào trong quá trình nghiệm pháp, áp lực thẩm thấu nước tiểu vượt quá 1000 mOsm/kg, hoặc 600 mOsm/kg và ổn định trong hơn 1 giờ, bệnh nhân không bị đái tháo nhạt. Nếu bất cứ lúc nào áp lực thẩm thấu huyết thanh vượt quá 300 mOsm/kg và áp lực thẩm thấu nước tiểu nhỏ hơn 600 mOsm/kg, bệnh nhân bị đái tháo nhạt. Nếu áp lực thẩm thấu huyết thanh nhỏ hơn 300 mOsm/kg và áp lực thẩm thấu nước tiểu nhỏ hơn 600 mOsm/kg, nghiệm pháp nên được tiếp tục trừ khi các dấu hiệu sinh tồn cho thấy giảm thể tích máu. Điều này có thể khó khăn ở một đứa trẻ nhỏ có thể không dung nạp được một thời gian nhịn ăn dài.

Hình 12.14 Quy trình đánh giá đái tháo nhạt bằng cách sử dụng nghiệm pháp nhịn nước. IV, tĩnh mạch; OSM, áp lực thẩm thấu; S.G., tỷ trọng nước tiểu; SQ, dưới da.
Một sai lầm phổ biến là dừng nghiệm pháp quá sớm, dựa trên lượng cân nặng cơ thể bị mất, trước khi áp lực thẩm thấu nước tiểu đạt đến trạng thái ổn định trên 600 mOsm/kg hoặc áp lực thẩm thấu huyết thanh trên 300 mOsm/kg đã đạt được. Trừ khi áp lực thẩm thấu huyết thanh tăng trên ngưỡng giải phóng vasopressin, việc thiếu tác động của vasopressin (như suy ra từ nước tiểu không cô đặc) không thể được coi là bệnh lý. Thay thế cho việc nhịn nước, có thể truyền nước muối ưu trương vào tĩnh mạch để nâng áp lực thẩm thấu huyết thanh lên trên ngưỡng giải phóng vasopressin. Nếu chẩn đoán đái tháo nhạt được xác định, nên tiêm vasopressin dạng nước (Pitressin, 1 U/m2) dưới da. Nếu bệnh nhân bị đái tháo nhạt trung ương, thể tích nước tiểu sẽ giảm và áp lực thẩm thấu sẽ tăng ít nhất gấp đôi trong giờ tiếp theo, so với giá trị trước khi điều trị bằng vasopressin. Nếu có sự gia tăng áp lực thẩm thấu nước tiểu ít hơn 2 lần sau khi dùng vasopressin, bệnh nhân có thể bị đái tháo nhạt do thận. Không nên sử dụng Desmopressin cho nghiệm pháp này, vì nó có liên quan đến ngộ độc nước ở trẻ nhỏ trong bối cảnh này. Bệnh nhân mắc chứng khát nhiều nguyên phát kéo dài có thể bị đái tháo nhạt do thận nhẹ do sự pha loãng khoảng kẽ tủy thận. Điều này không nên bị nhầm lẫn với đái tháo nhạt do thận nguyên phát, vì bệnh nhân mắc chứng khát nhiều nguyên phát sẽ có xu hướng hạ natri máu, thay vì tăng natri máu, ở trạng thái cơ bản. Hơn nữa, dạng đái tháo nhạt do thận thứ phát này sẽ đảo ngược sau khi ngừng uống quá nhiều nước. Bệnh nhân có tiền sử gia đình bị đái tháo nhạt do thận liên kết X, hoặc hiếm hơn là các đột biến lặn trên nhiễm sắc thể thường trong kênh nước AQP2 (thường gặp nhất nhưng không phải lúc nào cũng thấy ở các gia đình có quan hệ huyết thống), có thể được đánh giá cho các rối loạn này trong giai đoạn trước sinh hoặc chu sinh bằng phân tích trình tự DNA, do đó cho phép bắt đầu điều trị mà không chậm trễ.
Nghiệm pháp nhịn nước sẽ đủ ở hầu hết các bệnh nhân để xác định chẩn đoán đái tháo nhạt và phân biệt nguyên nhân trung ương và do thận. Nồng độ vasopressin huyết tương có thể được lấy trong quá trình thực hiện (xem Hình 12.14), mặc dù chúng hiếm khi cần thiết cho mục đích chẩn đoán ở trẻ em. Chúng đặc biệt hữu ích trong việc phân biệt giữa đái tháo nhạt trung ương một phần và đái tháo nhạt do thận, vì chúng thấp trong trường hợp đầu và cao trong trường hợp sau. Nếu áp lực thẩm thấu nước tiểu cô đặc bình thường, nhưng chỉ sau khi áp lực thẩm thấu huyết thanh cao hơn 300 mOsm/kg, bệnh nhân có thể có ngưỡng giải phóng vasopressin bị thay đổi, còn được gọi là bộ điều nhiệt thẩm thấu bị cài đặt lại (reset osmostat). Điều này có thể xảy ra sau chấn thương đầu, phẫu thuật thần kinh, hoặc các khối u não. Gần đây hơn, một xét nghiệm miễn dịch cho copeptin, đầu cuối carboxy của tiền chất vasopressin, đã được phát triển, có thể thay thế việc đo vasopressin trong đánh giá đái tháo nhạt. Copeptin ổn định hơn vasopressin, và nồng độ trong máu của hai peptide này có tương quan cao. Nồng độ copeptin tương quan tốt với nồng độ vasopressin và cho thấy phản ứng tương tự như nồng độ vasopressin đối với các thay đổi thẩm thấu và huyết động.
Độ chính xác chẩn đoán của việc sử dụng giá trị ngưỡng copeptin là 4,9 pmol/L (đái tháo nhạt trung ương nếu ≤ 4,9 pmol/L; khát nhiều nguyên phát nếu > 4,9 pmol/L), sau khi tăng nồng độ natri huyết tương lên trên 150 mmol/L bằng một liều bolus sau đó là truyền tĩnh mạch (IV) dung dịch muối 3%, để phân biệt giữa khát nhiều nguyên phát, đái tháo nhạt trung ương và đái tháo nhạt do thận, được phát hiện là cao hơn đáng kể so với nghiệm pháp nhịn nước gián tiếp (96,5% so với 76,6%). Nghiệm pháp truyền nước muối ưu trương đã phân biệt chính xác giữa đái tháo nhạt một phần và đa niệu nguyên phát trong 95,2% các trường hợp, trái ngược với tỷ lệ thành công 73,3% khi sử dụng nghiệm pháp nhịn nước gián tiếp trong cùng một nghiên cứu. Đái tháo nhạt do thận có thể được chẩn đoán mà không cần nhịn nước, khi nồng độ copeptin cơ bản lớn hơn 21,4 pmol/L.
Chụp cộng hưởng từ (MRI) không hữu ích lắm trong việc phân biệt đái tháo nhạt trung ương và đái tháo nhạt do thận. Thông thường, thùy sau tuyến yên được thấy như một vùng tăng sáng trên hình ảnh T1 sau khi tiêm gadolinium. “Điểm sáng” của thùy sau tuyến yên bị giảm hoặc không có trong cả hai dạng đái tháo nhạt, có lẽ do giảm tổng hợp vasopressin ở bệnh trung ương, và tăng giải phóng vasopressin ở bệnh do thận. Trong chứng khát nhiều nguyên phát, điểm sáng là bình thường, có lẽ vì vasopressin tích tụ ở thùy sau tuyến yên trong quá trình uống nước mạn tính, trong khi nó giảm ở SIADH, có lẽ do tăng bài tiết vasopressin. Sự hiện diện của tín hiệu tăng trên MRI T1 ở cuống tuyến yên, và sự vắng mặt của nó ở vùng thùy sau tuyến yên, đã được liên kết với đái tháo nhạt cấp tính sau phẫu thuật thần kinh. Phân tích MRI động, khung hình nhanh, đã cho phép ước tính lưu lượng máu đến thùy sau tuyến yên. Với kỹ thuật này, cả đái tháo nhạt trung ương và do thận đều liên quan đến sự tăng cường muộn ở vùng thùy sau tuyến yên.
Trong bối cảnh nội trú sau phẫu thuật thần kinh, đái tháo nhạt trung ương có khả năng xảy ra nếu tăng áp lực thẩm thấu (áp lực thẩm thấu huyết thanh > 300 mOsm/kg) đi kèm với áp lực thẩm thấu nước tiểu thấp hơn áp lực thẩm thấu huyết thanh. Cần phải cẩn thận với tình trạng quá tải dịch trong phẫu thuật với đa niệu nhược trương sau đó giả dạng như đái tháo nhạt. Nồng độ copeptin tăng trong vòng 24 giờ sau phẫu thuật thần kinh, ở vùng dưới đồi-tuyến yên, dự đoán khả năng không xảy ra đái tháo nhạt trung ương sau đó, trong khi nồng độ copeptin thấp lại ủng hộ điều đó.
Các rối loạn chuyển hóa nước cụ thể
Hạ Natri máu với điều hòa Vasopressin bình thường
Hạ Natri máu với bài tiết Vasopressin giảm phù hợp
Tăng uống nước (Chứng khát nhiều nguyên phát)
Trong trạng thái nhược trương với sự bài tiết vasopressin bị ức chế bình thường, thận có thể bài tiết nước tiểu với áp lực thẩm thấu thấp tới 50 mOsm/kg. Trong những điều kiện này, một lượng chất tan hàng ngày là 500 mOsm/m2 có thể được bài tiết trong 10 L/m2 nước tiểu mỗi ngày. Trẻ sơ sinh không thể pha loãng nước tiểu đến mức độ này và dễ bị ngộ độc nước ở mức uống nước trên 4 L/m2/ngày (khoảng 60 mL/giờ ở trẻ sơ sinh). Điều này có thể xảy ra khi sữa công thức đậm đặc được pha loãng với quá nhiều nước, do tai nạn hoặc trong một nỗ lực sai lầm để làm cho nó dùng được lâu hơn. Sự gia tăng nguyên phát về cảm giác khát, không có nguyên nhân rõ ràng, dẫn đến hạ natri máu, đã được báo cáo ở trẻ sơ sinh chỉ mới 5 tuần tuổi. Ở trẻ lớn hơn, với thận bình thường và khả năng ức chế bài tiết vasopressin, hạ natri máu không xảy ra trừ khi lượng nước uống vào vượt quá 10 L/m2/ngày, một việc gần như không thể thực hiện được. Việc uống một lượng lớn nước kéo dài sẽ làm giảm độ ưu trương trong khoảng kẽ tủy thận, điều này sẽ làm suy giảm tái hấp thu nước và bảo vệ chống lại ngộ độc nước. Hạ natri máu sẽ xảy ra ở tốc độ uống nước thấp hơn khi khả năng thanh thải nước của thận bị suy giảm, do bài tiết vasopressin tăng không phù hợp hoặc vì các lý do khác.
Bệnh nhân hiếm hoi mà ngưỡng thẩm thấu cho cảm giác khát và giải phóng vasopressin bị đảo ngược minh họa tầm quan trọng của mối quan hệ bình thường giữa hai phản ứng này đối với kích thích thẩm thấu. Nếu cảm giác khát được kích hoạt dưới ngưỡng giải phóng vasopressin, việc uống nước và tình trạng nhược trương sẽ xảy ra và ức chế bài tiết vasopressin, dẫn đến khát nhiều và đa niệu kéo dài. Miễn là lượng dịch uống hàng ngày nhỏ hơn 10 L/m2, hạ natri máu sẽ không xảy ra. Mặc dù có đa niệu và khát nhiều, thực thể này không nên bị nhầm lẫn với đái tháo nhạt do không có tăng natri máu, mặc dù điều trị bằng desmopressin cho một bệnh nhân như vậy có thể làm giảm áp lực thẩm thấu huyết thanh xuống dưới ngưỡng cảm giác khát, ức chế việc uống nước và do đó là đa niệu.
Giảm thanh thải nước tự do của thận
Suy thượng thận, nguyên phát hoặc thứ phát, từ lâu đã được biết là dẫn đến suy giảm bài tiết nước tự do. Các cơ chế mà glucocorticoid và mineralocorticoid điều chỉnh lợi tiểu nước đã là chủ đề của nhiều nghiên cứu. Một số nghiên cứu đã chứng minh hoạt độ vasopressin huyết tương tăng trong bối cảnh thiếu hụt glucocorticoid, phù hợp với bằng chứng sinh học phân tử gần đây hơn cho thấy glucocorticoid ức chế phiên mã gen vasopressin. Tuy nhiên, các nhà điều tra khác đã không phát hiện được vasopressin trong huyết tương của bệnh nhân suy thượng thận và thanh thải nước bất thường. Phù hợp với các tác động không phụ thuộc vasopressin của steroid thượng thận lên chuyển hóa nước, chuột Brattleboro bị đái tháo nhạt dưới đồi biểu hiện suy giảm bài tiết một lượng nước sau khi cắt bỏ tuyến thượng thận. Ở chuột Brattleboro đã cắt bỏ tuyến thượng thận, việc dùng glucocorticoid đã phục hồi tốc độ dòng nước tiểu nhưng không phục hồi khả năng pha loãng nước tiểu tối đa. Ngược lại, việc dùng mineralocorticoid đã phục hồi khả năng pha loãng nước tiểu tối đa nhưng không phục hồi tốc độ dòng chảy. Do đó, cả mineralocorticoid và glucocorticoid đều cần thiết cho việc thanh thải nước tự do bình thường. Một phần, những tác động không phụ thuộc vasopressin này của mineralocorticoid và glucocorticoid đã được quy cho việc tăng mức lọc cầu thận phát sinh từ sự tái giãn nở của thể tích dịch ngoại bào (giảm do mất muối) và cải thiện trương lực tim mạch, tương ứng. Bằng cách phục hồi mức lọc cầu thận, nhiều nước tự do hơn được đưa đến ống lượn xa để bài tiết. Ngoài ra, việc bổ sung thể tích làm giảm các kích thích không thẩm thấu đối với việc giải phóng vasopressin do giảm thể tích và hạ huyết áp. Gần đây, oxit nitric đã được phát hiện kích thích sự chèn AQP2 vào màng tế bào biểu mô thận phụ thuộc cyclic guanosine monophosphate. Bởi vì glucocorticoid đã được chứng minh là ức chế endothelial nitric oxide synthase, có thể trong điều kiện thiếu hụt glucocorticoid, nồng độ cao của nitric oxide synthase dẫn đến nồng độ cao của oxit nitric nội mô trong mạch máu thận, mà trong ống lượn xa của thận sẽ kích thích tăng hoạt độ AQP2 không phụ thuộc vasopressin và giảm thanh thải nước tự do.
Các tác động trực tiếp của thiếu hụt glucocorticoid hoặc mineralocorticoid lên biểu hiện và chức năng của aquaporin chưa được báo cáo. Ngoài việc làm suy giảm khả năng pha loãng tối đa của thận, suy thượng thận còn làm suy giảm khả năng cô đặc nước tiểu tối đa. Tác động này đã được chứng minh là do giảm đáp ứng của ống thận với vasopressin.
Hormone tuyến giáp cũng cần thiết cho việc thanh thải nước tự do bình thường, và sự thiếu hụt của nó cũng dẫn đến giảm thanh thải nước của thận và hạ natri máu. Mặc dù một số nghiên cứu cho thấy rằng vasopressin trung gian cho tình trạng hạ natri máu của suy giáp vì ethanol làm tăng bài tiết nước tự do ở bệnh nhân suy giáp, tác động này không được tìm thấy trong các báo cáo khác. Ngoài ra, trong suy giáp nặng, không có giảm thể tích máu và hạ natri máu đi kèm với sự ức chế phù hợp của vasopressin. Tương tự như hậu quả của thiếu hụt glucocorticoid đơn độc được mô tả trước đó, suy giáp làm suy giảm thanh thải nước tự do nhiều hơn khả năng pha loãng nước tiểu tối đa. Sự giảm thanh thải nước tự do này có thể do giảm mức lọc cầu thận và giảm cung cấp nước tự do đến đoạn pha loãng của nephron xa, như được gợi ý bởi cả các nghiên cứu trên động vật và người.
Do các dấu hiệu lâm sàng thường tinh vi liên quan đến suy thượng thận và tuyến giáp, tất cả bệnh nhân hạ natri máu nên bị nghi ngờ mắc các bệnh này và được thực hiện các xét nghiệm chẩn đoán phù hợp nếu có chỉ định. Hơn nữa, bệnh nhân bị suy thượng thận và đái tháo nhạt đồng thời có thể không có triệu chứng của bệnh sau cho đến khi liệu pháp glucocorticoid bộc lộ nhu cầu thay thế vasopressin. Tương tự, sự thuyên giảm của bệnh đái tháo nhạt ở những bệnh nhân đa niệu và khát nhiều mạn tính có thể gợi ý việc bổ sung glucocorticoid không đủ hoặc không tuân thủ thay thế glucocorticoid.
Một số loại thuốc có thể gây hạ natri máu bằng cách ức chế bài tiết nước của thận mà không kích thích bài tiết vasopressin (Bảng 12.1), một tác động có thể được gọi là SIADH do thận. Ngoài việc tăng cường giải phóng vasopressin, cả carbamazepine và chlorpropamide đều làm tăng phản ứng của tế bào với vasopressin. Acetaminophen cũng làm tăng phản ứng của thận với vasopressin; tuy nhiên, điều này không được phát hiện là gây hạ natri máu. Điều trị cyclophosphamide liều cao (15 đến 20 mg/kg tiêm tĩnh mạch bolus) thường liên quan đến hạ natri máu, đặc biệt khi sau đó là lợi tiểu nước bắt buộc để ngăn ngừa viêm bàng quang xuất huyết. Nồng độ vasopressin huyết tương bình thường, cho thấy tác động trực tiếp của thuốc làm tăng tái hấp thu nước. Tương tự, vinblastine, độc lập với việc tăng nồng độ vasopressin huyết tương hoặc tác động của vasopressin, và cisplatin gây hạ natri máu. Những loại thuốc này có thể làm hỏng các tế bào ống góp, vốn thường có tính thấm nước rất cao, hoặc có thể tăng cường hoạt động của kênh nước AQP2 và do đó làm tăng tái hấp thu nước theo gradient thẩm thấu của nó vào khoảng kẽ thận ưu trương.
Bảng 12.1 Thuốc làm suy giảm thanh thải nước tự do
| Lớp thuốc | Thuốc | Tăng bài tiết AVP | Tăng tác dụng AVP | Tác dụng thận độc lập AVP | Hạ Natri máu |
|---|---|---|---|---|---|
| Thuốc ức chế men chuyển Angiotensin | Lisinopril | Có | |||
| Thuốc chống co giật | Carbamazepine/ oxcarbazepine | Có | Có | Có thể | Có |
| Axit Valproic | Có | ||||
| Thuốc chống ung thư | Cis-platinum | Có | Có | ||
| Cyclophosphamide | Không | Có | Có | ||
| Vinblastine | Có | Có | Có | ||
| Vincristine | Có | Có | |||
| Thuốc chống Parkinson | “Amantadine, trihexyphenidyl” | Có | Có | ||
| Thuốc chống loạn thần | “Haloperidol, thioridazine” | Có | |||
| Thuốc hạ sốt | Acetaminophen | Có | |||
| Thuốc hạ lipid máu | Clofibrate | Có | Không | ||
| Thuốc hạ đường huyết uống | “Chlorpropamide, tolbutamide” | Có | Có | Không | Có |
| Thuốc ức chế tái hấp thu serotonin có chọn lọc | “Fluoxetine, sertraline, autres” | Có khả năng | Có | ||
| Thuốc chống trầm cảm ba vòng | “Imipramine, amitriptyline” | Có | Có |
AVP, Arginine vasopressin. Các tác động đã được chứng minh của thuốc, nếu biết, và liệu thuốc có dẫn đến hạ natri máu ở người hay không, được chỉ định.
Điều trị
Hạ natri máu do thiếu hụt cortisol hoặc hormone tuyến giáp sẽ đảo ngược nhanh chóng sau khi bắt đầu thay thế hormone. Vì hạ natri máu thường là mạn tính, nên tránh tăng nồng độ natri huyết thanh quá nhanh nếu có thể, như sẽ được thảo luận sau. Khi phải sử dụng các loại thuốc làm suy giảm bài tiết nước tự do, nên hạn chế lượng nước uống vào, như thể bệnh nhân bị SIADH, ở mức 1 L/m2/24 giờ, sử dụng chế độ đã thảo luận.
Hạ Natri máu với bài tiết Vasopressin tăng phù hợp
Tăng bài tiết vasopressin gây hạ natri máu có thể là một phản ứng phù hợp hoặc một phản ứng không phù hợp với một trạng thái bệnh lý. Bài tiết vasopressin không phù hợp hoặc hoạt động của thụ thể V2 (SIADH) là thực thể ít phổ biến hơn nhiều trong hai loại. Dù nguyên nhân là gì, hạ natri máu là một dấu hiệu đáng lo ngại thường liên quan đến tăng tỷ lệ mắc bệnh và tử vong.
Mất nước toàn thân
Mất nước toàn thân (nước nhiều hơn mất muối) ban đầu dẫn đến tăng natri máu, tăng áp lực thẩm thấu, và kích hoạt bài tiết vasopressin, như đã thảo luận trước đó. Ngoài ra, sự sụt giảm liên quan đến mức lọc cầu thận dẫn đến tăng tái hấp thu natri và nước ở ống lượn gần, đồng thời giảm bài tiết nước ở ống lượn xa. Điều này hạn chế khả năng tạo ra nước tiểu loãng và, cùng với sự kích thích liên quan của hệ renin-angiotensin-aldosterone và ức chế bài tiết ANP, dẫn đến bài tiết nước tiểu có nồng độ natri rất thấp. Khi tình trạng mất nước tiến triển, giảm thể tích máu và/hoặc hạ huyết áp trở thành những kích thích chính cho việc giải phóng vasopressin, mạnh hơn nhiều so với tăng áp lực thẩm thấu. Tác động này, bằng cách cố gắng bảo tồn thể tích, làm giảm thêm khả năng thanh thải nước tự do và có thể dẫn đến giữ nước và hạ natri máu, đặc biệt nếu việc bù nước nhiều hơn muối được thực hiện. Các yếu tố không thẩm thấu khác có thể kích thích giải phóng vasopressin ở một đứa trẻ bị bệnh, bao gồm đau, buồn nôn, căng thẳng và các tình trạng cụ thể, chẳng hạn như viêm phổi hoặc viêm màng não. Trong nhiều trường hợp, hạ natri máu do giảm thể tích nội mạch là rõ ràng từ các dấu hiệu thực thể và xét nghiệm, chẳng hạn như giảm độ đàn hồi da, áp lực tĩnh mạch trung tâm thấp, cô đặc máu, và nồng độ ure máu tăng. Tuy nhiên, chẩn đoán có thể tinh vi. Ví dụ, bệnh nhân viêm màng não hoặc viêm phổi có thể có hạ natri máu, mà việc hạn chế nước đã được khuyến nghị với niềm tin rằng nó là do SIADH trung ương. Một số nghiên cứu đã phát hiện ra rằng giảm thể tích, chứ không phải SIADH, thường là nguyên nhân của hạ natri máu, và nó giải quyết dễ dàng hơn khi bổ sung, thay vì hạn chế, dịch và chất tan. Ở những bệnh nhân bị hạ natri máu sau chấn thương đầu, giảm thể tích chứ không phải SIADH trung ương là nguyên nhân trong khoảng một nửa số trường hợp. Tương tự, nhiều bệnh nhân viêm dạ dày ruột có hạ natri máu nhẹ và nồng độ vasopressin huyết tương tăng có những điều này trên cơ sở mất nước toàn thân chứ không phải SIADH, và được hưởng lợi từ việc mở rộng thể tích thay vì hạn chế dịch. Tổng quát hơn, hầu hết bệnh nhân nhi nhập viện bị hạ natri máu được hưởng lợi từ việc thay thế dịch đẳng trương thay vì nhược trương, cho thấy nguyên nhân cơ bản của rối loạn điện giải là mất nước. Các phân tích tổng hợp của một số nghiên cứu đã cho thấy tỷ lệ hạ natri máu ở trẻ em nhập viện nhận dịch truyền tĩnh mạch duy trì nhược trương cao hơn đáng kể so với những trẻ nhận dịch truyền tĩnh mạch duy trì đẳng trương. Do đó, các hướng dẫn hiện hành về quản lý dịch cho trẻ em nhập viện khuyến cáo sử dụng dịch truyền tĩnh mạch đẳng trương ngoại trừ trong các tình huống lâm sàng đặc biệt.
Mất Natri Clorua nguyên phát
Muối có thể bị mất từ thận, chẳng hạn như ở bệnh nhân bị bệnh thận đa nang bẩm sinh, viêm thận kẽ cấp tính, và suy thận mạn. Thiếu hụt mineralocorticoid, giả cường aldosteron (đôi khi thấy ở trẻ em bị tắc nghẽn hoặc nhiễm trùng đường tiết niệu), sử dụng thuốc lợi tiểu, và bệnh đường tiêu hóa (thường là viêm dạ dày ruột với tiêu chảy và/hoặc nôn) cũng có thể dẫn đến mất natri clorua quá mức. Hạ natri máu cũng có thể do mất muối trong mồ hôi ở bệnh xơ nang, mặc dù bệnh phổi tắc nghẽn với sự gia tăng vasopressin huyết tương có lẽ đóng một vai trò nổi bật hơn, như đã được thảo luận. Với sự khởi đầu của việc mất muối, bất kỳ xu hướng nào đối với hạ natri máu ban đầu sẽ được chống lại bằng cách ức chế vasopressin và tăng bài tiết nước. Với việc mất muối tiếp tục, giảm thể tích máu và/hoặc hạ huyết áp xảy ra, gây ra kích thích không thẩm thấu của vasopressin. Điều này, cộng với cảm giác khát tăng, dẫn đến việc uống các chất lỏng nhược trương với hàm lượng chất tan thấp, dẫn đến hạ natri máu. Giảm cân thường rõ ràng, cũng như nguồn gốc của việc lãng phí natri. Nếu đó là thận, nó đi kèm với tốc độ sản xuất nước tiểu và hàm lượng natri trong nước tiểu lớn hơn so với hầu hết các nguyên nhân khác gây hạ natri máu, ngoại trừ sự gia tăng nguyên phát trong bài tiết ANP.
Giảm thể tích huyết tương hiệu dụng
Suy tim sung huyết, xơ gan, hội chứng thận hư, thông khí cơ học áp lực dương, bỏng nặng, bệnh phổi (loạn sản phế quản phổi [ở trẻ sơ sinh]), xơ nang với tắc nghẽn, và hen suyễn nặng đều được đặc trưng bởi sự giảm thể tích nội mạch “hiệu dụng”. Điều này xảy ra do suy giảm cung lượng tim, không có khả năng giữ dịch trong không gian mạch máu, hoặc suy giảm lưu lượng máu vào tim, tương ứng. Như với mất nước toàn thân, trong nỗ lực bảo tồn thể tích nội mạch, bài tiết nước và muối của thận bị giảm; và giảm kích thích cảm biến áp suất dẫn đến sự gia tăng bù trừ, phù hợp trong bài tiết vasopressin, dẫn đến trạng thái chống bài niệu và hạ natri máu. Do sự kích thích liên quan của hệ renin-angiotensin-aldosterone, những bệnh nhân này cũng có sự gia tăng tổng lượng natri clorua trong cơ thể và có thể bị phù ngoại vi, điều này phân biệt họ với những người bị mất nước toàn thân. Ở những bệnh nhân bị suy giảm cung lượng tim và tăng thể tích nhĩ (ví dụ, suy tim sung huyết hoặc bệnh phổi), nồng độ ANP tăng, góp phần gây hạ natri máu bằng cách thúc đẩy bài niệu natri.
Điều trị
Bệnh nhân bị mất nước toàn thân và giảm thể tích máu nên được bù nước bằng các dung dịch chứa muối, chẳng hạn như nước muối sinh lý hoặc dung dịch Ringer’s lactate. Do sự kích hoạt của hệ renin-angiotensin-aldosterone, natri được cung cấp sẽ được bảo tồn một cách mạnh mẽ và lợi tiểu nước sẽ nhanh chóng xảy ra, khi thể tích được phục hồi và nồng độ vasopressin giảm. Trong những điều kiện này, phải thận trọng để ngăn ngừa việc điều chỉnh hạ natri máu quá nhanh, điều này tự nó có thể dẫn đến tổn thương não.
Hạ natri máu do giảm thể tích huyết tương hiệu dụng từ rối loạn chức năng tim, gan, thận, hoặc phổi khó đảo ngược hơn. Liệu pháp hiệu quả nhất là liệu pháp khó đạt được nhất: điều trị rối loạn hệ thống cơ bản. Bệnh nhân được cai thở máy áp lực dương sẽ trải qua một đợt lợi tiểu nước nhanh chóng và giải quyết hạ natri máu, khi cung lượng tim được phục hồi và nồng độ vasopressin giảm. Con đường hiệu quả duy nhất khác là hạn chế lượng nước uống vào mức cần thiết cho việc bài tiết qua thận lượng chất tan bắt buộc hàng ngày khoảng 500 mOsm/m2 và để bù đắp các tổn thất không cảm nhận được. Trong trạng thái chống bài niệu một phần với áp lực thẩm thấu nước tiểu là 750 mOsm/kg H2O và tổn thất không cảm nhận được là 500 mL/m2, lượng dịch uống vào sẽ phải được giới hạn ở khoảng 1200 mL/m2/ngày. Do cường aldosteron đồng thời, việc hạn chế natri clorua trong chế độ ăn uống cần thiết để kiểm soát phù ngoại vi ở bệnh nhân suy tim có thể làm giảm lượng chất tan hàng ngày và hạn chế thêm lượng nước có thể uống vào mà không làm trầm trọng thêm tình trạng hạ natri máu. Hạ natri máu trong những bối cảnh này thường phát triển chậm, hiếm khi gây ra triệu chứng, và thường không cần điều trị. Nếu natri huyết thanh giảm xuống dưới 125 mEq/L, việc hạn chế nước ở mức 1 L/m2/ngày thường có hiệu quả trong việc ngăn ngừa sự sụt giảm thêm. Vì giữ nước trong các rối loạn này là một phản ứng bù trừ đối với giảm thể tích nội mạch, một nỗ lực để đảo ngược nó bằng thuốc, chẳng hạn như demeclocycline hoặc các chất đối kháng thụ thể V2 đặc hiệu (gây ra đái tháo nhạt do thận như sẽ được thảo luận sau) có thể dẫn đến tình trạng giảm thể tích máu tồi tệ hơn, với những hậu quả có thể nghiêm trọng.
Nói chung, bệnh nhân bị hạ natri máu do mất muối cần được bổ sung liên tục natri clorua và dịch. Ban đầu, có thể cần thay thế thể tích nước tiểu bằng dịch truyền tĩnh mạch chứa natri clorua (150 đến 450 mEq/L tùy thuộc vào mức độ mất muối); sau đó có thể cần bổ sung muối đường uống. Điều trị này trái ngược với điều trị SIADH, trong đó hạn chế nước mà không bổ sung natri là phương pháp chính.
Thận trọng trong điều trị cấp cứu hạ natri máu
Hầu hết trẻ em bị hạ natri máu phát triển rối loạn này dần dần, không có triệu chứng, và nên được điều trị chỉ bằng cách hạn chế nước. Sự phát triển của hạ natri máu cấp tính, hoặc nồng độ natri huyết thanh dưới 120 mEq/L, có thể liên quan đến hôn mê, rối loạn tâm thần, hôn mê, hoặc co giật toàn thể, đặc biệt ở trẻ nhỏ. Hạ natri máu cấp tính gây phù tế bào do nước đi vào tế bào (Hình 12.15), có thể dẫn đến rối loạn chức năng thần kinh do thay đổi môi trường ion hoặc thoát vị não do não bị bao bọc trong hộp sọ. Nếu tồn tại hơn 24 giờ, phù tế bào sẽ kích hoạt sự giảm bù trừ các chất thẩm thấu hữu cơ nội bào, dẫn đến việc phục hồi một phần thể tích tế bào bình thường trong hạ natri máu mạn tính.
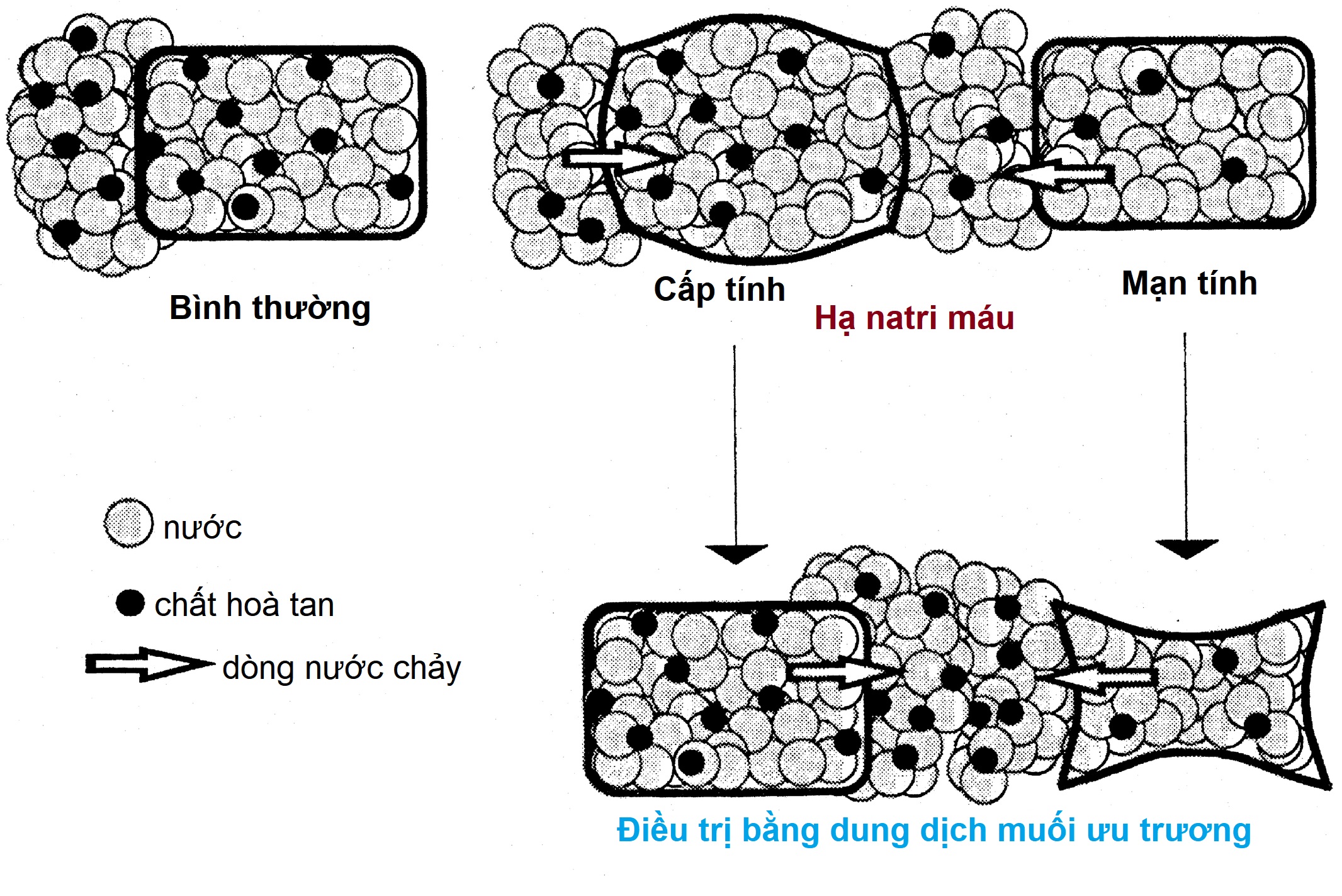
Hình 12.15 Những thay đổi về chất thẩm thấu hữu cơ khi bị hạ natri máu và sau khi điều chỉnh. Trong điều kiện bình thường, tồn tại sự cân bằng thẩm thấu giữa khoang ngoại bào và nội bào. Với hạ natri máu cấp tính, nước đi vào tế bào, gây phù tế bào. Sau khoảng 24 giờ tiếp tục hạ natri máu, các chất thẩm thấu hữu cơ nội bào giảm, phục hồi thể tích tế bào về gần mức bình thường. Điều trị bằng nước muối ưu trương cho hạ natri máu cấp tính dẫn đến phục hồi thể tích tế bào bình thường, trong khi cùng một phương pháp điều trị cho hạ natri máu mạn tính dẫn đến teo tế bào. Vòng tròn lớn, nước; vòng tròn nhỏ đóng, chất tan; mũi tên, hướng dòng nước chảy.
Việc điều trị cấp cứu rối loạn chức năng não phụ thuộc vào việc hạ natri máu là cấp tính hay mạn tính. Trong mọi trường hợp, nên thực hiện hạn chế nước. Nếu hạ natri máu là cấp tính, và do đó có thể không liên quan đến sự giảm nồng độ chất thẩm thấu hữu cơ nội bào, việc điều chỉnh nhanh chóng bằng dung dịch natri clorua 3% ưu trương, tiêm tĩnh mạch, có thể được chỉ định. Theo hướng dẫn chung, dung dịch này, được cung cấp với lượng 12 mL/kg, sẽ dẫn đến sự gia tăng nồng độ natri huyết thanh khoảng 10 mEq/L. Nếu hạ natri máu là mạn tính, việc điều trị bằng nước muối ưu trương phải được thực hiện một cách thận trọng, vì nó có thể dẫn đến cả teo tế bào (xem Hình 12.15) và hội chứng hủy myelin cầu não trung tâm liên quan. Hội chứng này, ảnh hưởng đến phần trung tâm của cầu não đáy, cũng như các vùng não khác, được đặc trưng bởi sự hủy myelin sợi trục, với sự bảo tồn của các tế bào thần kinh. Nó trở nên rõ ràng trong vòng 24 đến 48 giờ sau khi điều chỉnh hạ natri máu quá nhanh, có hình ảnh đặc trưng trên chụp cắt lớp vi tính và MRI, và thường gây tổn thương não không hồi phục. Nếu tiến hành điều trị bằng nước muối ưu trương, nồng độ natri huyết thanh chỉ nên được nâng lên đủ cao để gây ra sự cải thiện về trạng thái tinh thần, và trong mọi trường hợp không nhanh hơn 0,5 mEq/L/giờ hoặc 12 mEq/L/ngày. Trong trường hợp mất nước toàn thân, sự gia tăng nồng độ natri huyết thanh có thể xảy ra rất nhanh khi sử dụng chế độ này. Tình trạng cường aldosteron liên quan sẽ gây ra sự giữ lại mạnh mẽ natri được cung cấp, dẫn đến phục hồi nhanh chóng thể tích và ức chế bài tiết vasopressin và dẫn đến lợi tiểu nước nhanh và tăng nồng độ natri huyết thanh.
Điều trị cấp tính hạ natri máu khó khăn hơn ở bệnh nhân có thể tích huyết tương hiệu dụng giảm. Điều này là do cả rối loạn cơ bản làm cho việc duy trì dịch được cung cấp trong không gian nội mạch trở nên khó khăn và do sự gia tăng liên quan của ANP thúc đẩy bài niệu natri và mất muối được cung cấp. Hơn nữa, bệnh nhân mắc bệnh tim được cung cấp nước muối ưu trương có thể cần điều trị đồng thời bằng thuốc lợi tiểu, chẳng hạn như furosemide, để ngăn ngừa tình trạng suy tim trở nên tồi tệ hơn, điều này cũng sẽ làm tăng bài niệu natri.
Hạ Natri máu với điều hòa Vasopressin bất thường
Hạ Natri máu với tăng bài tiết Vasopressin không phù hợp hoặc tăng hoạt động thụ thể V2 Vasopressin (Hội chứng bài niệu không phù hợp)
Nguyên nhân của SIADH
SIADH không phổ biến ở trẻ em. Nó có thể xảy ra với viêm não, u não, chấn thương đầu, dị tật não, trong bệnh tâm thần, và trong giai đoạn sau cơn co giật toàn thể; sau khi buồn nôn kéo dài; viêm phổi; hoặc hội chứng suy giảm miễn dịch mắc phải. Nhiều loại thuốc đã được liên kết với việc suy giảm thanh thải nước tự do như được chỉ ra trong Bảng 12.1. Suy giảm thanh thải nước tự do có thể do thay đổi trong việc giải phóng vasopressin, tăng tác dụng của vasopressin ở cùng nồng độ vasopressin huyết tương, hoặc những thay đổi không phụ thuộc vasopressin trong tính thấm nước của ống góp xa. Các loại thuốc phổ biến đã được chứng minh là gây hạ natri máu bao gồm carbamazepine, chlorpropamide, vinblastine, vincristine, và thuốc chống trầm cảm ba vòng. Các thuốc sulfonylurea mới hơn, bao gồm glyburide, không liên quan đến SIADH. Các nguyên nhân hiếm gặp khác của SIADH ở trẻ em được liệt kê trong Bảng 12.2. Mặc dù nó được cho là nguyên nhân của hạ natri máu liên quan đến viêm màng não do virus, giảm thể tích thường là nguyên nhân. Ngược lại, phần lớn trẻ em bị viêm màng não do lao có hạ natri máu và SIADH (trong một báo cáo được cho là do mất muối do não), dự đoán bệnh nặng hơn và kết quả xấu. SIADH là nguyên nhân của giai đoạn hạ natri máu thứ hai trong phản ứng ba pha được thấy sau phẫu thuật vùng dưới đồi-tuyến yên. Hạ natri máu với bài tiết vasopressin tăng được tìm thấy ở tới 35% bệnh nhân 1 tuần sau phẫu thuật tuyến yên qua xương bướm. Cơ chế rất có thể là thoái hóa thần kinh ngược dòng với chết tế bào và giải phóng vasopressin. Suy thượng thận thứ phát gây kích thích giải phóng vasopressin cũng có thể đóng một vai trò, vì hạ natri máu thường xảy ra nhất sau khi cắt bỏ các adenoma corticotroph tiết hormone vỏ thượng thận. Ở đại đa số trẻ em bị SIADH, nguyên nhân là do sử dụng quá nhiều vasopressin, cho dù để điều trị đái tháo nhạt trung ương, hay ít phổ biến hơn, các rối loạn chảy máu (như đã thảo luận trước đây), hoặc, hiếm gặp nhất, sau khi điều trị bằng dDAVP cho chứng đái dầm.
Bảng 12.2 Nguyên nhân của Hội chứng bài tiết Vasopressin không phù hợp
| Hệ Thần kinh Trung ương | Ung thư | Nhiễm trùng | Phổi |
|---|---|---|---|
| Chấn thương đầu | Tế bào nhỏ của phổi | Herpes zoster | Viêm phổi do virus |
| Xuất huyết dưới nhện | Tá tràng | Virus hợp bào hô hấp | Viêm phổi do vi khuẩn |
| Áp xe não | Tụy | Bệnh lao | Áp xe |
| Hội chứng Guillain-Barre | U tuyến ức | Bệnh Aspergillosis | |
| Não úng thủy | Bàng quang | Ngộ độc thịt | |
| Viêm màng não | Niệu quản | ||
| U lympho | |||
| Sarcoma Ewing |
Hai trẻ sơ sinh không có quan hệ họ hàng với các đột biến trong thụ thể V2 vasopressin có biểu hiện hạ natri máu nặng trong những tháng đầu đời đã báo hiệu một nguyên nhân di truyền mới của hạ natri máu. Hai trẻ sơ sinh này có các đột biến sai nghĩa ở codon 137 đã chuyển đổi arginine thành cysteine hoặc leucine và dẫn đến sự kích hoạt cấu thành của thụ thể V2 với nồng độ arginine vasopressin huyết tương bị ức chế phù hợp. Rối loạn di truyền này đã được đặt tên là “hội chứng bài niệu không phù hợp do thận (NSIADH).” Vẫn chưa rõ phần nào của SIADH mạn tính khởi phát sớm đơn độc là do các đột biến kích hoạt của thụ thể V2, mặc dù tỷ lệ này có khả năng rất thấp. Điều thú vị là, cùng một codon này cũng là vị trí của một đột biến mất chức năng (R137H), dẫn đến bệnh đái tháo nhạt do thận liên kết X. Hơn một chục bệnh nhân NSIADH đã được báo cáo, bao gồm một bệnh nhân có biểu hiện ở tuổi 38.
Điều trị SIADH
SIADH mạn tính được điều trị tốt nhất bằng cách hạn chế dịch uống mạn tính. Dưới tác dụng chống bài niệu hoàn toàn của vasopressin (áp lực thẩm thấu nước tiểu 1.000 mOsm/L), một lượng chất tan bắt buộc qua thận hàng ngày bình thường là 500 mOsm/m2 sẽ được bài tiết trong 500 mL/m2 nước. Điều này, cộng với lượng nước mất không qua thận hàng ngày là 500 mL/m2, sẽ yêu cầu lượng dịch uống vào phải được giới hạn ở 1000 mL/m2/ngày để tránh hạ natri máu, như đã được thảo luận đầy đủ hơn. Ở trẻ nhỏ, mức độ hạn chế dịch này có thể không cung cấp đủ calo để tăng trưởng. Trong tình huống này, việc tạo ra đái tháo nhạt do thận có thể được chỉ định để cho phép đủ lượng dịch uống vào cho sự tăng trưởng bình thường. Lithium và demeclocycline trước đây được khuyến nghị để gây ra đái tháo nhạt do thận trong tình huống này nhưng có liên quan đến các độc tính đáng kể, hạn chế việc sử dụng chúng ở bệnh nhân nhi. Urê đường uống đã được sử dụng hiệu quả để điều trị cho bệnh nhân người lớn bị SIADH mạn tính nhờ khả năng gây ra lợi tiểu thẩm thấu hiệu quả. Liệu pháp này cũng được chứng minh là an toàn và hiệu quả ở bốn trẻ em bị SIADH mạn tính, bao gồm hai trẻ có đột biến trong thụ thể V2 vasopressin. Các chất đối kháng thụ thể V2 không peptide đặc hiệu (vaptan) cũng đã được phát triển để sử dụng trong SIADH bán cấp hoặc mạn tính do tăng bài tiết vasopressin không phù hợp. Việc sử dụng chúng không được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) chấp thuận ở trẻ em. Các tác dụng phụ bao gồm tăng cảm giác khát, khô miệng, tăng nồng độ transaminase gan, độc tính gan, và điều chỉnh quá mức đáng kể tình trạng hạ natri máu. Các tác dụng lợi tiểu nước của các vaptan, sau khi dùng đường tiêm hoặc đường uống, có khởi phát tác dụng nhanh, phát huy tác dụng cao nhất trong vòng vài giờ, và giảm dần trong vòng 24 giờ. Trong một loạt lớn các bệnh nhân người lớn bị hạ natri máu đẳng tích hoặc tăng tích do xơ gan, suy tim, hoặc SIADH, các chất đối kháng thụ thể vasopressin này có hiệu quả trong việc nâng cao bền vững nồng độ natri huyết thanh. Một nghiên cứu khác ở người lớn, chỉ giới hạn ở các đối tượng bị SIADH phát sinh từ bài tiết vasopressin không phù hợp, đã chứng minh hiệu quả của việc điều trị dài hạn bằng một vaptan có hoạt tính đường uống, kết hợp với việc hạn chế dịch ở mức 1,5 L mỗi ngày. Tuy nhiên, đã quan sát thấy sự thay đổi đáng kể về mức độ tăng natri huyết thanh. Sự thay đổi này là do cả sự khác biệt giữa các cá nhân về hiệu quả/phân bố thuốc, và việc không hạn chế đủ lượng nước tiêu thụ. Tác dụng phụ chính từ các tác nhân này là viêm tại vị trí truyền, mặc dù cũng đã thấy có sự gia tăng natri huyết thanh trên mức khuyến nghị để ngăn ngừa hủy myelin. Kinh nghiệm rất hạn chế với các vaptan đã được báo cáo ở trẻ em, mặc dù chúng đã được sử dụng để thúc đẩy hydrat hóa trong quá trình hóa trị, với SIADH liên quan đến bệnh ác tính. Các tác nhân này không có hiệu quả trong điều trị các đột biến kích hoạt của thụ thể V2, mặc dù urê liều thấp đã hữu ích. Vì khả năng dự đoán của việc dùng nước muối ưu trương cho các dạng SIADH cấp tính, nặng lớn hơn so với các vaptan, việc truyền nước muối ưu trương cho hạ natri máu có triệu chứng do bài tiết vasopressin không phù hợp vẫn là can thiệp được khuyến nghị. Đáng chú ý, một số chất đối kháng thụ thể V2 này tạo điều kiện cho việc vận chuyển đúng các đột biến thụ thể V2 mất chức năng đến bề mặt tế bào.
Điều trị cấp tính hạ natri máu do SIADH chỉ được chỉ định nếu có rối loạn chức năng não. Trong trường hợp đó, việc điều trị được quyết định bởi thời gian hạ natri máu và mức độ rối loạn chức năng não. Vì bệnh nhân bị SIADH có tình trạng tăng thể tích, việc cung cấp muối không hiệu quả lắm trong việc nâng cao natri huyết thanh vì nó được bài tiết nhanh chóng qua nước tiểu do aldosterone bị ức chế và nồng độ ANP tăng.
Hạ Natri máu với bài tiết Vasopressin giảm không phù hợp, do tăng bài tiết Peptide Lợi niệu Nhĩ
Mặc dù ANP thường không đóng vai trò chính trong cơ chế bệnh sinh của các rối loạn chuyển hóa nước, nó có thể có một vai trò thứ yếu quan trọng. Bệnh nhân bị SIADH có nồng độ ANP tăng, có lẽ do tăng thể tích máu, có thể góp phần vào tình trạng bài niệu natri tăng của SIADH và sẽ giảm khi lượng nước uống vào bị hạn chế. Tương tự, nồng độ ANP bị ức chế được tìm thấy trong bệnh đái tháo nhạt trung ương, có lẽ do giảm thể tích máu liên quan, sẽ tăng sau khi điều trị bằng dDAVP. Tuy nhiên, hạ natri máu ở một số bệnh nhân, chủ yếu là những người bị rối loạn hệ thần kinh trung ương, bao gồm u não, chấn thương đầu, não úng thủy, phẫu thuật thần kinh, tai biến mạch máu não, và chết não, đã được giả định là do tăng tiết ANP nguyên phát. Hội chứng này, được gọi là mất muối do não, được định nghĩa bởi hạ natri máu đi kèm với bài tiết natri niệu tăng (thường hơn 150 mEq/L), sản lượng nước tiểu quá mức, giảm thể tích máu, ức chế vasopressin, và nồng độ ANP tăng (> 20 pmol/L). Do đó, nó được phân biệt với SIADH, trong đó sản lượng nước tiểu bình thường hoặc giảm, thể tích máu bình thường, nồng độ natri niệu chỉ tăng khiêm tốn, và nồng độ vasopressin tăng xảy ra. Đo lường trực tiếp tình trạng thể tích nội mạch bằng một đường truyền tĩnh mạch trung tâm thường hữu ích. Sự phân biệt này rất quan trọng vì các liệu pháp của hai rối loạn này khác nhau rõ rệt. Như đã lưu ý trước đây, có sự tranh cãi về tỷ lệ phổ biến của hội chứng mất muối do não, với hầu hết bệnh nhân thực sự bị SIADH, mất nước, tăng glucocorticoid, hoặc sự kết hợp của những yếu tố này. Ở những bệnh nhân trong môi trường chăm sóc đặc biệt, với chẩn đoán ban đầu là mất muối do não, không ai trong số họ khi điều tra thêm bị giảm thể tích máu, một trong những tiêu chí chính của hội chứng.
Điều trị Hội chứng mất muối do não
Điều trị bệnh nhân bị hội chứng mất muối do não bao gồm việc phục hồi thể tích nội mạch bằng natri clorua và nước, tương tự như điều trị các nguyên nhân khác gây mất nước toàn thân. Nguyên nhân cơ bản của rối loạn, thường do tổn thương não cấp tính, cũng nên được điều trị nếu có thể. Một sai lầm phổ biến là thay thế natri bằng dung dịch muối sinh lý IV trong bối cảnh nước tiểu ưu trương. Nếu áp lực thẩm thấu nước tiểu cao hơn áp lực thẩm thấu của dung dịch muối được truyền, tình trạng hạ natri máu có thể trở nên tồi tệ hơn. Thay vào đó, nên sử dụng dung dịch muối ưu trương hơn nước tiểu, hoặc natri clorua đường ruột, để tránh vấn đề này.
Các nguyên nhân khác của hạ natri máu thật và giả
Hạ natri máu thật sự có liên quan đến tăng đường huyết, gây ra sự di chuyển của nước vào không gian nội mạch. Natri huyết thanh sẽ giảm khoảng 1.6 mEq/L cho mỗi 100 mg/dL tăng đường huyết trên 100 mg/dL. Glucose thường không phải là một tác nhân hoạt động thẩm thấu, và không kích thích giải phóng vasopressin, có lẽ vì nó có thể cân bằng tự do qua màng huyết tương. Tuy nhiên, khi có sự thiếu hụt insulin và tăng đường huyết, glucose hoạt động như một tác nhân thẩm thấu, có lẽ vì sự tiếp cận nội bào bình thường của nó đến các vị trí cảm biến thẩm thấu bị ngăn cản. Trong những trường hợp này, tồn tại một gradient thẩm thấu, và điều này kích thích giải phóng vasopressin. Trong nhiễm toan ceton do đái tháo đường, điều này, cùng với tình trạng giảm thể tích máu do lợi tiểu thẩm thấu thứ phát sau glycosuria, dẫn đến sự kích thích rõ rệt của bài tiết vasopressin. Việc điều chỉnh nhanh chóng hạ natri máu có thể xảy ra ngay sau khi bắt đầu liệu pháp dịch và insulin. Liệu điều này có góp phần vào cơ chế bệnh sinh của phù não, đôi khi thấy sau khi điều trị nhiễm toan ceton do đái tháo đường, vẫn chưa được biết. Nồng độ triglyceride tăng có thể gây hạ natri máu giả, cũng như việc lấy mẫu máu ở hạ lưu từ một đường truyền tĩnh mạch dịch nhược trương.
Tăng natri máu với sự bài tiết hoặc hoạt động của Vasopressin giảm không phù hợp
Đái tháo nhạt trung ương
Đái tháo nhạt trung ương (dưới đồi, thần kinh-tuyến yên, do thần kinh, hoặc nhạy cảm với vasopressin) có thể do các rối loạn về cấu trúc gen vasopressin; các hội chứng dẫn đến mất các tế bào thần kinh vasopressinergic; chấn thương do tai nạn hoặc phẫu thuật đối với các tế bào thần kinh vasopressin; các khuyết tật giải phẫu bẩm sinh ở vùng dưới đồi hoặc tuyến yên; các khối u; các bệnh thâm nhiễm, tự miễn, và nhiễm trùng ảnh hưởng đến các tế bào thần kinh hoặc các bó sợi vasopressin; và tăng chuyển hóa vasopressin. Nguyên nhân của đái tháo nhạt trung ương không rõ ràng ở khoảng từ 9% đến 55% trẻ em và thanh niên trong các loạt bài khác nhau được công bố trong y văn. Việc theo dõi lâu dài có thể xác định được nguyên nhân cơ bản không rõ ràng tại thời điểm chẩn đoán ban đầu, đôi khi sau tới 21 năm.
Nguyên nhân di truyền
Đái tháo nhạt trung ương di truyền trội trên nhiễm sắc thể thường biểu hiện trong nửa đầu của thập kỷ đầu tiên của cuộc đời. Sự bài tiết vasopressin, ban đầu bình thường, giảm dần cho đến khi bệnh đái tháo nhạt với mức độ nghiêm trọng khác nhau xảy ra. Bệnh nhân đáp ứng tốt với liệu pháp thay thế vasopressin. Bệnh có độ xâm nhập cao, nhưng có thể có mức độ nghiêm trọng khác nhau trong một gia đình, và có thể tự cải thiện ở tuổi trung niên. Các tế bào thần kinh chứa vasopressin không có ở các tế bào thần kinh magnocellular cạnh não thất, nhưng có mặt ở các vùng parvocellular. Một số đột biến oligonucleotide khác nhau trong gen cấu trúc vasopressin đã được phát hiện là nguyên nhân gây bệnh. Cho đến nay, đã có hơn 75 đột biến được phát hiện trong vùng mã hóa của gen vasopressin, với phần lớn là các đột biến sai nghĩa ở trong hoặc xung quanh các cysteine (xem Hình 12.3). Hầu hết các đột biến nằm ở phần neurophysin của tiền chất vasopressin, ngoại trừ năm đột biến ở vùng peptide tín hiệu hoặc peptide vasopressin của gen. Điều này cho thấy neurophysin đột biến có chức năng gây hại, có thể bị gấp khúc sai và chặn sự phân loại hoặc đóng gói nội bào đúng đắn của vasopressin vào các hạt bài tiết (xem sau). Không có đột biến gây bệnh nào trong vùng copeptin của tiền chất vasopressin. Điều này cho thấy hoặc vùng này có tỷ lệ đột biến thấp, nó không phục vụ một chức năng quan trọng trong sinh học vasopressin, hoặc các đột biến trong đó không gây rối loạn cho sức khỏe tế bào.
Một gia đình có đột biến sai nghĩa trong vùng peptide vasopressin (Proline ➔ Leucine ở axit amin 7) của gen, gây giảm đáng kể hoạt tính sinh học, đã được báo cáo. Bệnh trong gia đình này được di truyền theo kiểu lặn trên nhiễm sắc thể thường. Điều này chỉ ra rằng suy giảm đơn bội không phải là cơ sở cho tính chất trội trên nhiễm sắc thể thường của bệnh ở các gia đình có các đột biến phổ biến hơn trong vùng neurophysin của gen. Một bệnh nhân khác bị đái tháo nhạt trung ương di truyền lặn trên nhiễm sắc thể thường có biểu hiện ở tuổi còn rất trẻ (5 tháng), với các đột biến dị hợp tử phức hợp ở cả hai bản sao của AVP, một được thừa hưởng từ mỗi cha mẹ bình thường, một lần nữa chỉ ra rằng chỉ cần một bản sao hoạt động là đủ cho sinh lý bình thường.
Mặt khác, với bệnh đái tháo nhạt trung ương gia đình di truyền trội trên nhiễm sắc thể thường, sản phẩm gen bất thường có thể cản trở quá trình xử lý và bài tiết sản phẩm của alen bình thường, hoặc gây thoái hóa thần kinh và chết tế bào. Để hỗ trợ điều này, các tiền chất vasopressin đột biến làm suy giảm sự bài tiết của protein bình thường trong các mô hình tế bào, và trong một mô hình chuột chuyển gen của bệnh, sự mất dần các tế bào thần kinh chứa vasopressin ở vùng dưới đồi xảy ra khi chuột phát triển bệnh đái tháo nhạt. Chuột dị hợp tử có đột biến (C67X) trong gen vasopressin được biết là gây ra bệnh đái tháo nhạt thần kinh-tuyến yên gia đình di truyền trội trên nhiễm sắc thể thường ở người, đã phát triển bệnh đái tháo nhạt khi được 2 tháng tuổi. Chúng được phát hiện có sự lưu giữ tiền chất của vasopressin trong các tế bào thần kinh và sự cảm ứng của một protein chaperone của lưới nội chất (BiP). Tuy nhiên, những người có biểu hiện dưới 1 tuổi bị đái tháo nhạt trung ương ít có khả năng bị đái tháo nhạt trung ương di truyền trội trên nhiễm sắc thể thường, và có nhiều khả năng bị khuyết tật cấu trúc não.
Thiếu hụt vasopressin cũng được tìm thấy trong hội chứng DIDMOAD, bao gồm đái tháo nhạt (diabetes insipidus), đái tháo đường (diabetes mellitus), teo thị giác (optic atrophy), và điếc (deafness). Gen gây ra phức hợp hội chứng này, còn được gọi là hội chứng Wolfram, đã được định vị trên nhiễm sắc thể 4p16 của người bằng phân tích liên kết đa hình. Gen hội chứng Wolfram, WFS1, mã hóa một protein xuyên màng tetrameric 890 axit amin chủ yếu định vị ở lưới nội chất. Nó được cho là có chức năng như một kênh canxi hoặc một chất điều hòa kênh canxi. Bệnh nhân có đột biến trong proconvertase PCSK1, cần thiết cho việc phân cắt tiền chất vasopressin thành vasopressin và neurophysin trưởng thành, có nhiều bệnh nội tiết bao gồm đái tháo nhạt trung ương.
Chấn thương
Các sợi trục của các tế bào thần kinh magnocellular chứa vasopressin kéo dài không bị gián đoạn đến thùy sau tuyến yên trên một khoảng cách khoảng 10 mm. Chấn thương ở nền sọ có thể gây sưng quanh hoặc cắt đứt các sợi trục này, dẫn đến đái tháo nhạt tạm thời hoặc vĩnh viễn. Đái tháo nhạt vĩnh viễn có thể xảy ra sau chấn thương dường như nhỏ. Khoảng một nửa số bệnh nhân bị gãy xương hố yên sẽ phát triển đái tháo nhạt vĩnh viễn, có thể bị trì hoãn tới 1 tháng sau chấn thương, trong thời gian đó các tế bào thần kinh của các sợi trục bị cắt đứt có thể bị thoái hóa ngược dòng. Sốc nhiễm trùng và xuất huyết sau sinh, liên quan đến nhồi máu tuyến yên (hội chứng Sheehan), có thể liên quan đến thùy sau tuyến yên với các mức độ đái tháo nhạt khác nhau. Đái tháo nhạt không bao giờ liên quan đến xạ trị sọ não vùng dưới đồi-tuyến yên, mặc dù phương pháp điều trị này có thể gây ra sự thiếu hụt trong tất cả các hormone giải phóng của vùng dưới đồi được vận chuyển bởi hệ thống cửa-tuyến yên đến thùy trước tuyến yên. Bởi vì vasopressin được vận chuyển trực tiếp đến thùy sau tuyến yên thông qua vận chuyển sợi trục magnocellular, có thể bức xạ ảnh hưởng đến chức năng hormone giải phóng của vùng dưới đồi bằng cách làm gián đoạn tuần hoàn cửa-tuyến yên, vốn không có trong mạch vasopressin.
Can thiệp phẫu thuật thần kinh
Một trong những nguyên nhân phổ biến nhất của đái tháo nhạt trung ương là sự phá hủy phẫu thuật thần kinh của các tế bào thần kinh vasopressin sau phẫu thuật tuyến yên-dưới đồi. Điều quan trọng là phải phân biệt đa niệu liên quan đến sự khởi phát của đái tháo nhạt trung ương cấp tính sau phẫu thuật với đa niệu do lợi tiểu bình thường của các chất lỏng được cung cấp trong quá trình phẫu thuật. Trong cả hai trường hợp, nước tiểu có thể rất loãng và có thể tích lớn, vượt quá 200 mL/m2/giờ. Tuy nhiên, trong trường hợp đầu, áp lực thẩm thấu huyết thanh sẽ cao, trong khi trong trường hợp sau, nó sẽ bình thường. Việc kiểm tra cẩn thận hồ sơ trong phẫu thuật cũng sẽ giúp phân biệt giữa hai khả năng này. Các sợi trục vasopressin đi từ vùng dưới đồi đến thùy sau tuyến yên kết thúc ở các mức độ khác nhau trong cuống và tuyến (xem Hình 12.4). Vì sự gián đoạn phẫu thuật của các sợi trục này có thể dẫn đến thoái hóa ngược dòng của các tế bào thần kinh dưới đồi, các tổn thương gần vùng dưới đồi hơn sẽ ảnh hưởng đến nhiều tế bào thần kinh hơn và gây mất bài tiết hormone vĩnh viễn nhiều hơn. Không hiếm khi, một phản ứng “ba pha” được thấy. Mặc dù tỷ lệ chính xác của hiện tượng này vẫn chưa được biết, trong một nghiên cứu nhỏ, gần một trong ba trẻ em trải qua phẫu thuật u sọ hầu đã phát triển nó. Sau phẫu thuật, một giai đoạn đầu của đái tháo nhạt thoáng qua được quan sát, kéo dài 1.5 đến 2 ngày, và có thể do phù nề trong khu vực cản trở sự bài tiết vasopressin bình thường. Nếu sự phá hủy tế bào vasopressin đáng kể đã xảy ra, điều này thường được theo sau bởi một giai đoạn thứ hai của SIADH, có thể kéo dài tới 10 ngày, và là do sự giải phóng không được điều chỉnh của vasopressin bởi các tế bào thần kinh đang chết. Một giai đoạn thứ ba của đái tháo nhạt vĩnh viễn có thể xảy ra nếu hơn 90% tế bào vasopressin bị phá hủy. Thông thường, một mức độ SIADH rõ rệt trong giai đoạn thứ hai báo hiệu đái tháo nhạt vĩnh viễn đáng kể trong giai đoạn cuối của phản ứng này. Ở những bệnh nhân bị thiếu hụt vasopressin và cortisol đồng thời (ví dụ, trong suy tuyến yên trước và sau kết hợp, sau điều trị phẫu thuật thần kinh u sọ hầu), các triệu chứng của đái tháo nhạt có thể bị che giấu vì thiếu hụt cortisol làm suy giảm khả năng thanh thải nước tự do của thận, như sẽ được thảo luận sau. Trong những trường hợp như vậy, chỉ cần bắt đầu liệu pháp glucocorticoid có thể gây ra đa niệu, dẫn đến chẩn đoán đái tháo nhạt.
Các khuyết tật giải phẫu bẩm sinh
Các bất thường giải phẫu não đường giữa, chẳng hạn như loạn sản vách-thị với bất sản thể chai, hội chứng Kabuki, holoprosencephaly, và thiểu sản tuyến yên gia đình với cuống không có có thể liên quan đến đái tháo nhạt trung ương. Những bệnh nhân này không nhất thiết phải có bằng chứng bên ngoài về các bất thường sọ mặt. Đái tháo nhạt trung ương do các bất thường não đường giữa thường đi kèm với các khuyết tật trong nhận thức cảm giác khát, cho thấy rằng một cảm biến thẩm thấu chung có thể kiểm soát cả việc giải phóng vasopressin và nhận thức cảm giác khát. Một số bệnh nhân nghi ngờ có khuyết tật về chức năng cảm biến thẩm thấu nhưng có các tế bào thần kinh vasopressin nguyên vẹn có thể bị đái tháo nhạt khi nằm, với việc giải phóng vasopressin qua trung gian áp cảm thụ khi đứng thẳng, và đa niệu do thiếu vasopressin khi nằm ngửa.
Các khối u
Một số ý nghĩa lâm sàng quan trọng xuất phát từ kiến thức về giải phẫu của hệ thống vasopressin. Bởi vì các tế bào thần kinh vasopressin dưới đồi được phân bố trên một khu vực rộng lớn trong vùng dưới đồi, các khối u gây ra đái tháo nhạt phải rất lớn hoặc thâm nhiễm hoặc nằm ở vị trí chiến lược tại điểm hội tụ của bó sợi trục dưới đồi-thần kinh-tuyến yên trong cuống tuyến yên. Các u mầm và u tuyến tùng thường phát sinh gần nền của vùng dưới đồi nơi các sợi trục vasopressin hội tụ trước khi đi vào thùy sau tuyến yên, và vì lý do này, chúng là một trong những khối u não nguyên phát phổ biến nhất liên quan đến đái tháo nhạt. Các u mầm gây bệnh có thể rất nhỏ và không thể phát hiện được bằng MRI trong vài năm sau khi khởi phát đa niệu. Vì lý do này, việc đo lường định lượng tiểu đơn vị beta của gonadotropin màng đệm người, thường được tiết ra bởi các u mầm và u tuyến tùng, và chụp MRI lặp lại thường xuyên nên được thực hiện ở trẻ em bị đái tháo nhạt vô căn hoặc không giải thích được. Hội chứng hố yên rỗng, có thể do nhồi máu tuyến yên không được nhận biết, có thể liên quan đến đái tháo nhạt ở trẻ em. Các u sọ hầu và u thần kinh đệm thị giác cũng có thể gây ra đái tháo nhạt trung ương khi rất lớn, mặc dù đây thường là một biến chứng sau phẫu thuật của việc điều trị các khối u này. Các bệnh ác tính về huyết học có thể gây ra đái tháo nhạt. Trong một số trường hợp, chẳng hạn như với bệnh bạch cầu dòng tủy cấp tính, nguyên nhân là do sự thâm nhiễm của cuống tuyến yên và hố yên. Tuy nhiên, hơn 30 bệnh nhân bị monosomy hoặc mất đoạn nhiễm sắc thể 7 liên quan đến chuyển dạng blast cấp tính của hội chứng loạn sản tủy có biểu hiện đái tháo nhạt trung ương, mà không có bằng chứng về sự thâm nhiễm của thùy sau tuyến yên bởi các tế bào tân sinh, khiến nguyên nhân của bệnh đái tháo nhạt vẫn chưa được giải quyết.
Các bệnh thâm nhiễm, tự miễn và nhiễm trùng
U mô bào Langerhans và viêm tuyến yên lympho bào là những loại rối loạn thâm nhiễm phổ biến nhất gây ra đái tháo nhạt trung ương. Khoảng 10% bệnh nhân bị u mô bào sẽ bị đái tháo nhạt. Những bệnh nhân này có xu hướng mắc bệnh đa hệ thống, nghiêm trọng hơn trong thời gian dài hơn so với những người không bị đái tháo nhạt, và sự thiếu hụt tuyến yên trước thường đi kèm với sự thiếu hụt tuyến yên sau. MRI đặc trưng cho thấy sự dày lên của cuống tuyến yên. Một báo cáo cho thấy ở những bệnh nhân bị u mô bào Langerhans, xạ trị vùng tuyến yên trong vòng 14 ngày kể từ khi bắt đầu các triệu chứng đái tháo nhạt có thể dẫn đến sự trở lại của chức năng vasopressin ở hơn một phần ba số bệnh nhân bị ảnh hưởng.
Viêm thần kinh-tuyến yên-cuống tuyến yên lympho bào có thể chiếm hơn một nửa số bệnh nhân bị đái tháo nhạt “vô căn”. Thực thể này có thể liên quan đến các bệnh tự miễn khác. Phân tích hình ảnh cho thấy tuyến yên to và cuống dày, và sinh thiết thùy sau tuyến yên cho thấy sự thâm nhiễm lympho bào của tuyến, cuống, và các nhân dưới đồi magnocellular. Một dạng hoại tử của thực thể này đã được mô tả, cũng gây ra suy tuyến yên trước và đáp ứng với điều trị bằng steroid. Đái tháo nhạt cũng có thể liên quan đến các bệnh u hạt ở phổi, bao gồm cả bệnh sarcoidosis. Việc sử dụng các chất ức chế điểm kiểm soát như liệu pháp miễn dịch chống ung thư gây ra một loại viêm tuyến yên tự miễn không chỉ có thể dẫn đến rối loạn chức năng tuyến yên trước, mà còn cả đái tháo nhạt trung ương, có thể hồi phục khi ngừng thuốc.
Liệu sự phá hủy các tế bào vasopressin qua trung gian kháng thể có xảy ra hay không vẫn còn gây tranh cãi. Hơn một nửa số bệnh nhân bị đái tháo nhạt trung ương do nguyên nhân không do chấn thương có kháng thể chống lại các tế bào chứa vasopressin, và bệnh nhân mắc các bệnh tự miễn khác có các kháng thể như vậy mà không có bằng chứng về đái tháo nhạt. Nhiều bệnh nhân bị đái tháo nhạt trung ương cũng có kháng thể kháng peptide vasopressin, mặc dù sự xuất hiện của chúng thường theo sau việc bắt đầu điều trị bằng vasopressin. Rất có thể các kháng thể chống lại các tế bào chứa vasopressin hoặc vasopressin không gây bệnh, mà thay vào đó là dấu hiệu của sự phá hủy tế bào thần kinh trước đó.
Các bệnh nhiễm trùng liên quan đến nền sọ, chẳng hạn như viêm màng não do não mô cầu, Streptococcus pneumoniae, cryptococcus, listeria, viêm màng não do toxoplasmosis, nhiễm cytomegalovirus bẩm sinh, giang mai bẩm sinh, và bệnh viêm não không đặc hiệu có thể gây ra đái tháo nhạt trung ương. Bệnh thường thoáng qua, cho thấy rằng nó là do viêm chứ không phải do sự phá hủy các tế bào thần kinh chứa vasopressin.
Chết não
Đái tháo nhạt trung ương có thể xuất hiện trong bối cảnh chết não do thiếu oxy. Mặc dù sự hiện diện của nó đã được đề xuất như một dấu hiệu cho chết não ở trẻ em, trong một số nghiên cứu, chỉ có một số ít bệnh nhân chết não biểu hiện rối loạn này, và có tới 15% bệnh nhân bị tổn thương não và đái tháo nhạt cuối cùng đã phục hồi chức năng não. Đa niệu trong bối cảnh chết não có thể đi kèm với nồng độ vasopressin huyết tương cao, cho thấy một số trường hợp bị nhầm lẫn với đái tháo nhạt thực sự là do các nguyên nhân khác, chẳng hạn như mất muối do não với đa niệu, như sẽ được thảo luận sau.
Tăng chuyển hóa Vasopressin
Tốc độ thanh thải chuyển hóa của vasopressin tăng gấp 4 lần trong thai kỳ do nhau thai sản xuất ra một loại vasopressinase. Nếu người mẹ không thể đáp ứng bằng cách tăng đồng thời hoạt động của vasopressin do đái tháo nhạt trung ương hoặc do thận tiềm ẩn từ trước, bệnh sẽ biểu hiện rõ ràng, thoáng qua, thường vào đầu tam cá nguyệt thứ ba (mặc dù đôi khi sớm hơn), và sẽ tự khỏi trong vòng 1 tuần sau khi sinh. Ngay cả khi không có các khiếm khuyết trước đó về chức năng vasopressin, sự gia tăng cực độ nồng độ vasopressinase ở những người mang thai lần đầu bị tiền sản giật, rối loạn chức năng gan, hoặc đa thai, có thể dẫn đến sự phát triển của hội chứng này. Đái tháo nhạt trung ương đáp ứng với dDAVP, không thể được chuyển hóa bởi vasopressinase, và không có hoạt tính co bóp tử cung hoặc tăng huyết áp, vì nó đặc hiệu cho AVPR2.
Thuốc
Tác nhân phổ biến nhất liên quan đến việc ức chế giải phóng vasopressin và suy giảm khả năng cô đặc nước tiểu là ethanol. Vì sự ức chế giải phóng vasopressin bởi ethanol có thể được khắc phục trong bối cảnh giảm thể tích máu đồng thời, đái tháo nhạt quan trọng trên lâm sàng do uống ethanol là không phổ biến. Phenytoin, các chất đối kháng opiate, ketamine, halothane, và các tác nhân alpha-adrenergic cũng đã được liên kết với sự suy giảm giải phóng vasopressin.
Trẻ em bị đái dầm nguyên phát
Mặc dù trẻ em bình thường có sự gia tăng vasopressin huyết tương vào ban đêm, liên quan đến sự gia tăng áp lực thẩm thấu nước tiểu, và giảm thể tích nước tiểu, những trẻ bị đái dầm nguyên phát có sự gia tăng vasopressin bị cùn hoặc không có, và bài tiết một lượng nước tiểu cao hơn với trương lực thấp hơn. Điều này đã gợi ý rằng trẻ em đái dầm bị thiếu hụt nguyên phát trong bài tiết vasopressin, mặc dù kết quả tương tự có thể chỉ do việc uống quá nhiều nước ở những trẻ này. Việc sử dụng chất chủ vận V2 dDAVP có hiệu quả cao trong việc loại bỏ các đợt đái dầm, mặc dù tỷ lệ tái phát cao sau khi ngừng điều trị. Lượng dịch uống vào phải được hạn chế trong khi trẻ tiếp xúc với tác dụng chống bài niệu của dDAVP để đề phòng ngộ độc nước. Do đó, tốt nhất là nên uống thuốc (chỉ có ở dạng viên ở Hoa Kỳ) vào giờ đi ngủ, không uống thêm gì cho đến sáng, sau khi tác dụng chống bài niệu đã giảm. Thuốc xịt mũi dDAVP không còn được chấp thuận để sử dụng cho trẻ em đái dầm vì lo ngại về an toàn này, trong khi viên nén dDAVP được FDA chấp thuận. Hiệu quả của dDAVP so với chuông báo đái dầm là tương tự, cũng như tỷ lệ tái phát của chúng. Do lo ngại về an toàn, chuông báo đái dầm có thể được ưu tiên hơn.
Điều trị đái tháo nhạt trung ương
Liệu pháp dịch
Bệnh nhân bị đái tháo nhạt không được điều trị khác thèm đồ uống lạnh, đặc biệt là nước. Với đái tháo nhạt trung ương hoàn toàn, khả năng cô đặc nước tiểu tối đa là khoảng 100 mOsm/kg. Vì cần 5 L nước tiểu để bài tiết một lượng chất tan trung bình hàng ngày là 500 mOsm/m2, lượng dịch uống vào phải tương ứng với lượng này để duy trì trương lực huyết tương bình thường. Với cơ chế khát còn nguyên vẹn và được tiếp cận tự do với các chất lỏng đường uống, một người bị đái tháo nhạt hoàn toàn có thể duy trì áp lực thẩm thấu và natri huyết tương ở mức cao bình thường, mặc dù rất bất tiện. Hơn nữa, việc uống một lượng lớn chất lỏng này trong thời gian dài ở trẻ em có thể dẫn đến ứ nước niệu quản, và thậm chí là nhiễm fluorosis ở những cộng đồng cung cấp nước có fluor. Chỉ với việc quản lý dịch hoặc với việc sử dụng các loại thuốc khác ngoài vasopressin hoặc các chất tương tự của nó, những trẻ này có thể phát triển ứ nước niệu quản-thận không do tắc nghẽn, dày thành bàng quang và bè hóa, tiểu không tự chủ do tràn đầy và suy giảm chức năng thận cần thủ thuật dẫn lưu. Những biến chứng này có nhiều khả năng xảy ra ở trẻ em bị đái tháo nhạt do thận, trái ngược với đái tháo nhạt trung ương vì điều trị bằng các chất tương tự vasopressin được sử dụng hầu hết thời gian ở trẻ em bị đái tháo nhạt trung ương.
Có hai tình huống mà đái tháo nhạt trung ương có thể được điều trị chỉ bằng cách uống nhiều dịch, không dùng vasopressin. Liệu pháp vasopressin kết hợp với việc uống quá nhiều dịch (thường lớn hơn 1 L/m2/ngày như sẽ được thảo luận sau) có thể dẫn đến hạ natri máu không mong muốn. Vì trẻ sơ sinh và trẻ nhỏ nhận tất cả dinh dưỡng dưới dạng lỏng, nhu cầu uống dịch bắt buộc cao ở lứa tuổi này (3 L/m2/ngày), kết hợp với điều trị bằng vasopressin có khả năng dẫn đến biến chứng nguy hiểm này. Ở trẻ sơ sinh, viên uống và dung dịch xịt mũi desmopressin không chỉ khó dùng chính xác mà còn liên quan đến những biến động đáng kể về nồng độ natri huyết thanh. Những trẻ sơ sinh như vậy có thể được quản lý tốt hơn chỉ bằng liệu pháp dịch. Một chế độ ăn giảm chất tan sẽ hỗ trợ trong vấn đề này. Sữa mẹ là tốt nhất cho mục đích này (75 mOsm/kg H2O), trong khi sữa bò là tệ nhất (230 mOsm/kg H2O). Ví dụ, ở một trẻ sơ sinh bị đái tháo nhạt với áp lực thẩm thấu nước tiểu cố định là 100 mOsm/kg H2O, cần 300 mL nước tiểu mỗi ngày để bài tiết lượng chất tan tiêu thụ trong sữa mẹ, trong khi cần 900 mL nước tiểu mỗi ngày để bài tiết lượng chất tan cao hơn tiêu thụ trong sữa bò. Sữa công thức Similac PM 60/40 có tải lượng chất tan qua thận là 92 mOsm/kg H2O. Ngoài ra, có thể cần bổ sung nước tự do, tùy thuộc vào mức độ nghiêm trọng của bệnh đái tháo nhạt. Các lựa chọn, chẳng hạn như 20 đến 30 mL nước tự do bổ sung cho mỗi 120 đến 160 mL sữa công thức, hoặc pha loãng sữa công thức với nước tự do đã được sử dụng. Mặc dù trẻ em được quản lý bằng chế độ như vậy có thể bị khát mạn tính, cha mẹ có thể gặp khó khăn trong việc theo kịp lượng dịch uống vào và lượng nước tiểu thải ra rất lớn, và có thể xảy ra tình trạng kém tăng trưởng nếu không cung cấp đủ calo cùng với nước, những vấn đề này dễ giải quyết hơn là tình trạng hạ natri máu đe dọa tính mạng. Ngoài ra, có thể thêm thiazide (chlorothiazide, 5–10 mg/kg/liều), hai hoặc ba lần mỗi ngày, và/hoặc thuốc lợi tiểu amiloride để tạo điều kiện tái hấp thu natri và nước ở ống lượn gần của thận và do đó làm giảm nhu cầu uống dịch. Liệu pháp này có thể đi kèm với một mức độ mất nước nhẹ. Gần đây hơn, desmopressin tiêm (0.02–0.08 mcg/liều dùng một hoặc hai lần mỗi ngày) đã được tiêm dưới da ở trẻ sơ sinh với kết quả tốt, mặc dù điều này không được FDA chấp thuận. Việc sử dụng thành công desmopressin dưới da kết hợp với chế độ dịch theo thang trượt đã được báo cáo để điều trị cho một trẻ sơ sinh bị đái tháo nhạt trung ương và không có cơ chế khát. Liều desmopressin, được điều chỉnh dựa trên nồng độ natri huyết tương được theo dõi tại nhà, dao động từ 0.01 mcg đến 0.024 mcg mỗi liều, dùng hai lần mỗi ngày. Desmopressin tiêm ban đầu được bào chế ở nồng độ 4 mcg/mL, để sử dụng với liều 0.3 mcg/kg/liều để điều trị các bệnh rối loạn chảy máu, chẳng hạn như hemophilia A và bệnh von Willebrand loại 1. Do đó, cần phải cẩn thận nếu nó được sử dụng ở liều 1/40 đến 1/4 liều này để điều trị cho trẻ sơ sinh bị đái tháo nhạt. Việc dùng dDAVP dạng xịt mũi pha loãng qua đường miệng (10 mcg/mL; 1–5 mcg hai lần mỗi ngày) ở trẻ sơ sinh bị đái tháo nhạt trung ương, có tuổi trung bình là 4.5 tháng, đã dẫn đến bình thường hóa và ổn định nồng độ natri trong vòng vài ngày sau khi bắt đầu điều trị. Trẻ sơ sinh bị đái tháo nhạt trung ương đã được điều trị thành công bằng công thức dDAVP xịt mũi pha loãng dùng đường uống (10 mcg/mL) với liều lượng từ 2 đến 5 mcg hai lần mỗi ngày. Không cần phải hạn chế khối lượng thức ăn của chúng, trong khi theo chế độ điều trị này.
Trong quản lý cấp tính sau phẫu thuật của đái tháo nhạt trung ương xảy ra sau phẫu thuật thần kinh ở trẻ em, liệu pháp vasopressin có thể được sử dụng thành công, nhưng phải hết sức thận trọng khi sử dụng. Khi đang chịu tác dụng chống bài niệu hoàn toàn của vasopressin, bệnh nhân sẽ có áp lực thẩm thấu nước tiểu khoảng 1000 mOsm/kg và sẽ bị hạ natri máu nếu nhận một lượng dịch quá lớn, tùy thuộc vào tải lượng chất tan và lượng nước mất không qua thận. Với sự bài tiết chất tan là 500 mOsm/m2/ngày, chức năng thận bình thường, và lượng dịch mất không qua thận là 500 mL/m2/ngày, lượng dịch uống vào lớn hơn 1 L/m2/ngày (hai phần ba nhu cầu dịch duy trì bình thường) sẽ dẫn đến hạ natri máu. Ngoài ra, liệu pháp vasopressin sẽ che giấu sự xuất hiện của giai đoạn SIADH trong phản ứng thần kinh-tuyến yên ba pha đối với tổn thương phẫu thuật thần kinh (như đã được thảo luận).
Do những lo ngại liên quan đến việc sử dụng vasopressin trong giai đoạn chu phẫu, hai cách tiếp cận khác nhau để quản lý đái tháo nhạt trung ương ở bệnh nhân phẫu thuật đã được sử dụng. Cách tiếp cận đầu tiên có thể đặc biệt hữu ích để quản lý đái tháo nhạt cấp tính sau phẫu thuật ở trẻ nhỏ. Nó chỉ sử dụng dịch và tránh sử dụng vasopressin. Phương pháp này bao gồm việc cân bằng lượng vào và ra hàng giờ bằng cách sử dụng từ 1 đến 3 L/m2/ngày (40–120 mL/m2/giờ). Nếu sử dụng liệu pháp IV, nên truyền 40 mL/m2/giờ cơ bản dưới dạng dextrose 5% (D5) trong một phần tư dung dịch muối sinh lý (dung dịch muối sinh lý = 0.9% natri clorua) và phần còn lại, tùy thuộc vào lượng nước tiểu, dưới dạng dextrose 5% trong nước. Có thể thêm kali clorua (40 mEq/L) nếu việc uống sẽ bị trì hoãn trong vài ngày. Không nên truyền thêm dịch cho lượng nước tiểu hàng giờ dưới 40 mL/m2/giờ. Đối với lượng nước tiểu hàng giờ trên 40 mL/m2/giờ, nên bù thêm thể tích bằng dextrose 5% cho đến tổng tối đa là 120 mL/m2/giờ. Ví dụ, ở một đứa trẻ có diện tích bề mặt là 1 m2 (khoảng 30 kg), tốc độ truyền cơ bản sẽ là 40 mL/giờ dextrose 5% trong một phần tư dung dịch muối sinh lý. Đối với lượng nước tiểu hàng giờ là 60 mL, sẽ truyền thêm 20 mL/giờ dextrose 5%, cho tổng tốc độ truyền là 60 mL/giờ. Đối với lượng nước tiểu trên 120 mL/giờ, tổng tốc độ truyền sẽ là 120 mL/giờ. Khi có đái tháo nhạt, điều này sẽ dẫn đến natri huyết thanh trong khoảng 150 mEq/L và tình trạng co rút thể tích nhẹ, điều này sẽ cho phép đánh giá cả cảm giác khát, cũng như sự trở lại của chức năng vasopressin bình thường hoặc sự xuất hiện của SIADH. Bệnh nhân có thể bị tăng đường huyết nhẹ với chế độ này, đặc biệt nếu họ cũng đang được dùng glucocorticoid sau phẫu thuật. Tuy nhiên, vì nó không sử dụng vasopressin, quy trình quản lý dịch này ngăn chặn bất kỳ khả năng nào gây hạ natri máu.
Vasopressin và các chất tương tự Vasopressin
Bằng chứng cho thấy việc sử dụng vasopressin IV chu phẫu ở trẻ em bị đái tháo nhạt trung ương có thể là phương thức điều trị được lựa chọn trong hầu hết các tình huống, dẫn đến sự dao động của natri huyết thanh ở mức độ nhỏ hơn và ít di chứng bất lợi. Mặc dù liệu pháp IV với vasopressin tổng hợp dạng nước (Pitressin) đã được chứng minh là hữu ích trong việc quản lý đái tháo nhạt trung ương khởi phát cấp tính, vẫn còn lo ngại về sự an toàn của việc sử dụng nó trong quá trình phức tạp, thay đổi nhanh chóng của trẻ đang hồi phục sau phẫu thuật dưới đồi/tuyến yên. Nếu truyền vasopressin liên tục, lượng dịch uống vào phải được giới hạn ở 1 L/m2/ngày hoặc hai phần ba lượng dịch duy trì (giả sử lượng chất tan và lượng nước mất không qua thận bình thường như đã mô tả). Hiệu lực của vasopressin tổng hợp vẫn được đo bằng phương pháp sinh học và được biểu thị bằng đơn vị hoạt tính sinh học, với một mili đơn vị (mU) tương đương với khoảng 2.5 ng vasopressin. Đối với liệu pháp vasopressin IV, 1.5 mU/kg/giờ dẫn đến nồng độ vasopressin trong máu khoảng 10 pg/mL, gấp đôi mức cần thiết cho hoạt động chống bài niệu hoàn toàn. Tác dụng của vasopressin đạt tối đa trong vòng 2 giờ sau khi bắt đầu truyền, và phải cẩn thận với việc nó dính vào chai và ống truyền IV. Đôi khi, sau phẫu thuật dưới đồi (nhưng không phải qua xương bướm), cần có nồng độ vasopressin ban đầu cao hơn để điều trị đái tháo nhạt cấp tính, có thể là do sự giải phóng một chất liên quan đến vasopressin từ hệ thống dưới đồi-thần kinh-tuyến yên bị tổn thương, hoạt động như một chất đối kháng với hoạt động của vasopressin bình thường. Nên tránh tốc độ truyền vasopressin cao hơn nhiều, dẫn đến nồng độ huyết tương trên 1000 pg/mL, vì chúng có thể gây hoại tử da, tiêu cơ vân, và rối loạn nhịp tim.
Dựa trên những cân nhắc được mô tả trong đoạn trước, một thuật toán hiệu quả và an toàn để quản lý đái tháo nhạt trung ương chu phẫu bằng truyền IV vasopressin đã được sử dụng với những kết quả đáng khích lệ. Thuật toán này bắt đầu với việc trẻ nhận một đường truyền IV dung dịch muối sinh lý ở mức hai phần ba duy trì hoặc 1 L/m2/ngày. Chẩn đoán sơ bộ đái tháo nhạt trung ương trong hoặc sau phẫu thuật được thực hiện bằng cách ghi nhận natri huyết thanh lớn hơn 145 mEq/L, cùng với lượng nước tiểu lớn hơn 4 mL/kg/giờ. Bằng chứng xác nhận bổ sung bao gồm áp lực thẩm thấu huyết tương trên 300 mOsm/kg H2O và nước tiểu tương đối nhược trương. Khi có được các thông số phù hợp với đái tháo nhạt trung ương, bắt đầu truyền IV vasopressin dạng nước ở mức 0.5 mU/kg/giờ, không thay đổi việc truyền dịch IV. Liều vasopressin được điều chỉnh tăng dần theo từng nấc 0.5 mU/kg/giờ để thiết lập tốc độ sản xuất nước tiểu dưới 2 mL/kg/giờ trong khoảng 10 phút. Việc truyền vasopressin và dịch IV sau đó vẫn ổn định ở các tốc độ này, với dung dịch muối sinh lý bổ sung, hoặc các dung dịch mở rộng thể tích tương đương, chỉ được cung cấp để thay thế lượng máu mất liên tục hoặc để duy trì sự ổn định huyết động. Sau phẫu thuật, mô hình quản lý này đòi hỏi sự theo dõi của đơn vị chăm sóc đặc biệt, với việc đánh giá thường xuyên các chất điện giải (ban đầu hàng giờ), lượng nước tiểu và áp lực thẩm thấu/tỷ trọng, và các dấu hiệu sinh tồn. Lược đồ quản lý này cũng có thể được tuân theo đối với những bệnh nhân bị đái tháo nhạt trung ương đã được xác định cần phẫu thuật tổng quát và hạn chế uống kéo dài. Trong tình huống này, liều vasopressin tác dụng kéo dài, mạn tính thông thường được giữ lại hoặc giảm ngay trước khi phẫu thuật, tùy thuộc vào thời gian phẫu thuật liên quan đến thời gian dùng thuốc thông thường. Để chuẩn bị cho phẫu thuật, dung dịch muối sinh lý được truyền ở mức hai phần ba duy trì (1 L/m2/ngày). Khi có được các biện pháp phù hợp với sự xuất hiện của đái tháo nhạt trung ương do hết hiệu lực của liều trước phẫu thuật, vasopressin IV được bắt đầu và điều chỉnh như đã mô tả trước đó.
Bệnh nhân được điều trị bằng vasopressin cho bệnh đái tháo nhạt sau phẫu thuật thần kinh nên được chuyển từ đường truyền IV sang đường uống càng sớm càng tốt, vì cảm giác khát, nếu còn nguyên vẹn, sẽ giúp điều chỉnh áp lực thẩm thấu máu, như đã thảo luận. Với sự vắng mặt đồng thời của bài tiết vasopressin và cảm giác khát, bác sĩ lâm sàng phải thực hiện việc cung cấp dịch và một tác nhân chống bài niệu. Điều này phải được thực hiện với sự cẩn trọng tối đa, vì cửa sổ điều trị cho việc cung cấp dịch rất hẹp khi bệnh nhân không thể tự điều chỉnh hoạt động chống bài niệu của mình. Hoặc bệnh nhân có thể được đưa vào trạng thái chống bài niệu liên tục, với dDAVP hoặc vasopressin, và dịch được giới hạn nghiêm ngặt ở mức 1 L/m2/ngày, hoặc bệnh nhân có thể được dùng dDAVP ngắt quãng với sự “đột phá” nước tiểu rõ ràng giữa các liều, và một lượng dịch cố định được xác định theo kinh nghiệm để dẫn đến nồng độ điện giải trong máu bình thường. Không nên sử dụng dDAVP (desmopressin) IV trong quản lý cấp tính của đái tháo nhạt trung ương sau phẫu thuật, vì nó không mang lại lợi thế nào so với vasopressin, và thời gian bán hủy dài của nó (8–12 giờ) so với của vasopressin (5–10 phút) là một bất lợi rõ rệt, vì nó có thể làm tăng khả năng gây ngộ độc nước. Trên thực tế, việc sử dụng dDAVP IV, 0.3 mcg/kg, để rút ngắn thời gian chảy máu trong một loạt các rối loạn chảy máu (như đã được thảo luận), đã được liên kết với ngộ độc nước, đặc biệt ở trẻ nhỏ có nhu cầu uống dịch bắt buộc cao.
Một vấn đề đặc biệt nảy sinh khi một bệnh nhân bị đái tháo nhạt trung ương đã được xác định phải nhận một lượng lớn dịch vì lý do điều trị, ví dụ, đi kèm với hóa trị liệu ung thư. Những bệnh nhân như vậy có thể được quản lý bằng cách ngừng điều trị chống bài niệu và tăng lượng dịch uống vào lên 3 đến 5 L/m2/ngày (làm cho bệnh nhân tăng natri máu vừa phải). Điều này sẽ tương tự như những gì sẽ xảy ra ở một bệnh nhân có bài tiết vasopressin còn nguyên vẹn, mà trong đó việc quá tải nước đến mức độ này sẽ ức chế bài tiết vasopressin nội sinh. Tuy nhiên, mặc dù 5 L/m2/ngày thường đủ để duy trì nồng độ natri huyết thanh trong khoảng 150 mEq/L ở trẻ em bị đái tháo nhạt trung ương, tốc độ này có thể không đủ trong bối cảnh dùng hóa trị liệu khi bài tiết chất tan tăng do chết tế bào và giải phóng các thành phần tế bào. Bằng cách sử dụng một liều thấp vasopressin IV (0.08–0.1 mU/kg/giờ, khoảng một phần tám liều chống bài niệu đầy đủ, điều chỉnh tăng dần khi cần thiết), một tác dụng chống bài niệu một phần cho phép cung cấp lượng dịch cao hơn mà không gây hạ natri máu. Trong khi quản lý đái tháo nhạt, chỉ bằng dịch, có thể được sử dụng cho hóa trị liệu với ifosfamide (có liên quan đến độc tính thận và viêm bàng quang xuất huyết), dữ liệu gần đây cho thấy rằng bài tiết nước tiểu nhược trương, như sẽ xảy ra ở bệnh nhân bị đái tháo nhạt được quản lý chỉ bằng dịch, làm tăng nguy cơ phát triển độc tính thận trong quá trình điều trị bằng các tác nhân chống ung thư dựa trên bạch kim. Bằng cách cho phép cung cấp dung dịch muối 0.45% với tốc độ khoảng 3 L/m2/ngày, việc truyền vasopressin liều thấp mang lại áp lực thẩm thấu nước tiểu cao hơn so với mức có thể đạt được chỉ bằng dịch, và có thể có thêm lợi ích là bảo vệ thận.
Trong môi trường ngoại trú, điều trị đái tháo nhạt trung ương ở trẻ lớn nên bắt đầu bằng dDAVP đường uống (xem sau) hoặc đường mũi (10 mcg/0.1 mL), 0.025 mL (2.5 mcg) dùng qua ống mũi vào giờ đi ngủ và tăng liều đến lượng thấp nhất có tác dụng chống bài niệu. Nếu liều có hiệu quả, nhưng có thời gian tác dụng quá ngắn, nên tăng thêm, hoặc nên thêm một liều thứ hai vào buổi sáng. Bệnh nhân nên thoát khỏi tác dụng chống bài niệu ít nhất 1 giờ trước liều tiếp theo, để đảm bảo rằng bất kỳ lượng nước dư thừa nào cũng sẽ được bài tiết. Nếu không, ngộ độc nước có thể xảy ra. dDAVP cũng có sẵn dưới dạng thuốc xịt mũi ở cùng nồng độ, với mỗi lần xịt cung cấp 10 mcg (0.1 mL). Đây là chế phẩm tiêu chuẩn được sử dụng để điều trị đái dầm nguyên phát trước khi chỉ định này bị loại bỏ. Viên nén dDAVP đường uống và viên nén hòa tan hiện đang được sử dụng rộng rãi và phần lớn đã thay thế liệu pháp đường mũi. Mặc dù, khi dùng đường uống, dDAVP có hiệu lực thấp hơn ít nhất 20 lần so với khi dùng qua đường mũi, dDAVP đường uống với liều từ 25 đến 300 mcg mỗi 8 đến 12 giờ được báo cáo là có hiệu quả cao và an toàn ở trẻ em. Thuốc xịt mũi Lysine vasopressin (Diapid) (50 đơn vị/mL) có thể được sử dụng nếu muốn có thời gian tác dụng ngắn hơn so với dDAVP. Một lần xịt cung cấp 2 đơn vị (0.04 mL), với thời gian tác dụng từ 2 đến 8 giờ.
Như đã lưu ý trước đó, thiếu hụt cortisol có thể gây giảm thanh thải nước tự do bằng cách kích thích một con đường qua trung gian oxit nitric, dẫn đến sự chèn các kênh AQP2 vào màng đỉnh của các tế bào ống góp, theo một cách không phụ thuộc vasopressin. Ngược lại, có thể lượng cortisol quá mức, do giải phóng nội sinh trong lúc căng thẳng, hoặc do điều trị bằng thuốc ngoại sinh, có thể ức chế sự chèn các kênh nước. Điều này có thể giải thích tại sao bệnh nhân, bị đái tháo nhạt trung ương được điều trị bằng desmopressin, trở nên “kháng thuốc”, và cần tăng liều, trong thời gian căng thẳng hoặc điều trị bằng glucocorticoid.
Ngoài đa niệu và khát nhiều, mật độ khoáng xương giảm đã được báo cáo ở bệnh nhân bị đái tháo nhạt trung ương. Mật độ xương giảm không được điều chỉnh chỉ bằng điều trị bằng chất tương tự vasopressin, cho thấy việc bắt đầu sử dụng bisphosphonate hoặc các liệu pháp khác được thiết kế để ngăn ngừa mất xương có thể mang lại lợi ích lâu dài trong điều trị đái tháo nhạt.
Mất cảm giác khát gây tăng Natri máu (Adipsic Hypernatremia)
Một nhóm nhỏ bệnh nhân bị đái tháo nhạt trung ương cũng có các rối loạn về cơ chế khát. Các tổn thương ảnh hưởng đến các cơ quan quanh não thất cảm giác của vùng dưới đồi, bao gồm cơ quan mạch của lá tận cùng, cơ quan dưới vòm, và vùng postrema, có thể dẫn đến mất cảm giác khát hoặc ngưỡng thẩm thấu tăng đối với nhận thức cảm giác khát. Những khu vực này nằm ngoài hàng rào máu não và liên tục đo áp lực thẩm thấu và nồng độ natri. Bệnh nhân bị đái tháo nhạt và cơ chế khát còn nguyên vẹn hiếm khi bị tăng natri máu đáng kể vì cơ chế khát đảm bảo rằng lượng nước uống vào của họ phù hợp với lượng nước mất qua nước tiểu quá mức. Tuy nhiên, bệnh nhân bị đái tháo nhạt và mất cảm giác khát có thể bị tăng natri máu nặng và các biến chứng, chẳng hạn như tiêu cơ vân, suy thận cấp, và huyết khối tĩnh mạch. Nguyên nhân gây tăng natri máu do mất cảm giác khát bao gồm các dị tật bẩm sinh, chẳng hạn như holoprosencephaly và chuỗi loạn sản vách-thị; các tổn thương mạch máu, chẳng hạn như phình động mạch thông trước; các khối u, chẳng hạn như u sọ hầu và u mầm trên yên; các tình trạng u hạt, chẳng hạn như u mô bào và sarcoidosis; và các tình trạng khác, chẳng hạn như nang màng nhện và não úng thủy. Gần đây, đã có một loạt trường hợp được báo cáo về tăng natri máu do mất cảm giác khát, không có bất kỳ bất thường nào trên MRI của vùng dưới đồi và tuyến yên. Những trẻ bị ảnh hưởng có liên quan đến tăng prolactin máu, béo phì thời thơ ấu, và suy giảm bài tiết hormone tăng trưởng. Sự hiện diện của các kháng thể nhắm vào cơ quan dưới vòm ở những bệnh nhân này gợi ý mạnh mẽ một nguyên nhân tự miễn cho tình trạng tăng natri máu do mất cảm giác khát của họ. Việc điều trị tăng natri máu do mất cảm giác khát bao gồm việc cung cấp một liều dDAVP cố định hàng ngày với lượng dịch uống vào được kiểm soát hàng ngày và theo dõi chặt chẽ cân bằng dịch, trọng lượng cơ thể, và nồng độ natri huyết tương. Việc điều trị thành công cho một trẻ sơ sinh bị đái tháo nhạt và không có cảm giác khát đã được báo cáo bằng cách sử dụng chế độ dịch theo thang trượt và dDAVP dưới da, được hướng dẫn bởi việc theo dõi thường xuyên nồng độ natri huyết tương tại nhà.
Đái tháo nhạt do thận
Nguyên nhân của Đái tháo nhạt do thận
Đái tháo nhạt do thận (kháng vasopressin) có thể do nguyên nhân di truyền hoặc mắc phải. Nguyên nhân di truyền ít phổ biến hơn nhưng nghiêm trọng hơn các dạng mắc phải của bệnh, mặc dù nguyên nhân di truyền phổ biến hơn ở trẻ em so với người lớn.
Nguyên nhân di truyền
Đái tháo nhạt bẩm sinh, liên kết X: Đột biến thụ thể V2
Đái tháo nhạt do thận bẩm sinh, liên kết X là do các đột biến bất hoạt của thụ thể V2 vasopressin. Khoảng 250 đột biến, chủ yếu là sai nghĩa, đã được báo cáo có liên quan đến đái tháo nhạt do thận. Do phương thức di truyền của nó, đây là một bệnh của nam giới, mặc dù hiếm khi phụ nữ có thể bị ảnh hưởng, có lẽ là do sự bất hoạt nhiễm sắc thể X cực đoan. Phù hợp với một đột biến dòng mầm, trái ngược với đột biến soma trong thụ thể V2, những bệnh nhân này bị thiếu hụt trong tất cả các hoạt động qua trung gian thụ thể V2 toàn thân, và có các phản ứng qua trung gian thụ thể V1 còn nguyên vẹn. Như mong đợi, khiếm khuyết thụ thể V2 xảy ra trước sự kích hoạt của adenylate cyclase ở thận. Không giống như chức năng của các thụ thể bảy lần xuyên màng kết hợp với protein G khác, chẳng hạn như thụ thể hormone cận giáp và hormone kích thích tuyến giáp, chức năng của thụ thể V2 không bị ảnh hưởng ở bệnh nhân bị giả suy cận giáp, những người có đột biến bất hoạt trong tiểu đơn vị alpha của G s.
Do sự đề kháng với vasopressin trong đái tháo nhạt do thận bẩm sinh, thận sản xuất ra một lượng lớn nước tiểu nhược trương, với áp lực thẩm thấu dao động từ 50 đến 100 mOsm/kg. Các biểu hiện của bệnh thường có mặt trong vài tuần đầu đời, nhưng có thể chỉ trở nên rõ ràng sau khi cai sữa. Các triệu chứng chủ yếu là đa niệu và khát nhiều. Cảm giác khát có thể khó thỏa mãn hơn so với đái tháo nhạt trung ương. Nhiều trẻ sơ sinh ban đầu có biểu hiện sốt, nôn, và mất nước, thường dẫn đến việc đánh giá nhiễm trùng. Suy dinh dưỡng ở trẻ không được điều trị có thể là thứ phát sau việc uống một lượng lớn nước, mà trẻ có thể thích hơn sữa và các chất có hàm lượng calo cao hơn khác. Chậm phát triển trí tuệ với mức độ nghiêm trọng khác nhau có thể do các đợt mất nước lặp đi lặp lại. Vôi hóa nội sọ ở thùy trán và hạch nền không phải là hiếm ở trẻ em bị đái tháo nhạt do thận liên kết X. Vì điều này xuất hiện sớm và không thấy ở trẻ em bị đái tháo nhạt trung ương có mức độ nghiêm trọng tương đương, vôi hóa não có lẽ không liên quan đến mức độ mất nước hoặc can thiệp điều trị. Có thể nồng độ vasopressin tăng, tác động qua các thụ thể V1 hoặc V3 còn nguyên vẹn, góp phần vào một số biểu hiện độc đáo của đái tháo nhạt do thận liên kết X, chẳng hạn như vôi hóa não, khát dữ dội, nôn, và suy dinh dưỡng. Trẻ lớn hơn có thể có biểu hiện đái dầm hoặc tiểu đêm. Chúng có thể học cách giảm lượng thức ăn (và do đó là tải lượng chất tan) để giảm đa niệu, điều này có thể góp phần gây suy dinh dưỡng. Sau khi uống và bài tiết một lượng lớn nước trong thời gian dài, bệnh nhân có thể phát triển ứ nước thận-niệu quản không do tắc nghẽn, và bàng quang lớn.
Mặc dù ban đầu một người sáng lập (đến Bắc Mỹ từ Scotland vào năm 1761 trên con tàu Hopewell) được cho là tổ tiên của hầu hết các đối tượng ở Bắc Mỹ bị đái tháo nhạt do thận bẩm sinh, liên kết X, hàng trăm đột biến độc lập trong thụ thể V2 đã được tìm thấy, với một số dường như đã phát sinh độc lập nhiều hơn một lần (Hình 12.16). Đây chủ yếu là các đột biến base đơn gây ra sự thay thế axit amin, lệch khung dịch mã, hoặc chấm dứt tổng hợp peptide, và được phân bố khá đều khắp protein thụ thể. Các đột biến có thể ảnh hưởng đến việc gắn kết vasopressin, tạo ra cyclic AMP, hoặc có thể là điều hòa phiên mã. Bệnh nhân có các đột biến khác nhau có thể sẽ biểu hiện tính không đồng nhất về kiểu hình, bao gồm cả mức độ nghiêm trọng của bệnh và đáp ứng với điều trị. Sự không đồng nhất về di truyền có thể là nguyên nhân cơ bản cho sự đáp ứng khác nhau của bệnh nhân bị đái tháo nhạt liên kết X đối với điều trị bằng dDAVP. Trong một gia đình có đột biến đã biết, sàng lọc DNA trước sinh hoặc sau sinh sớm có thể xác định rõ ràng những người nam bị ảnh hưởng, cho phép bắt đầu liệu pháp phù hợp.
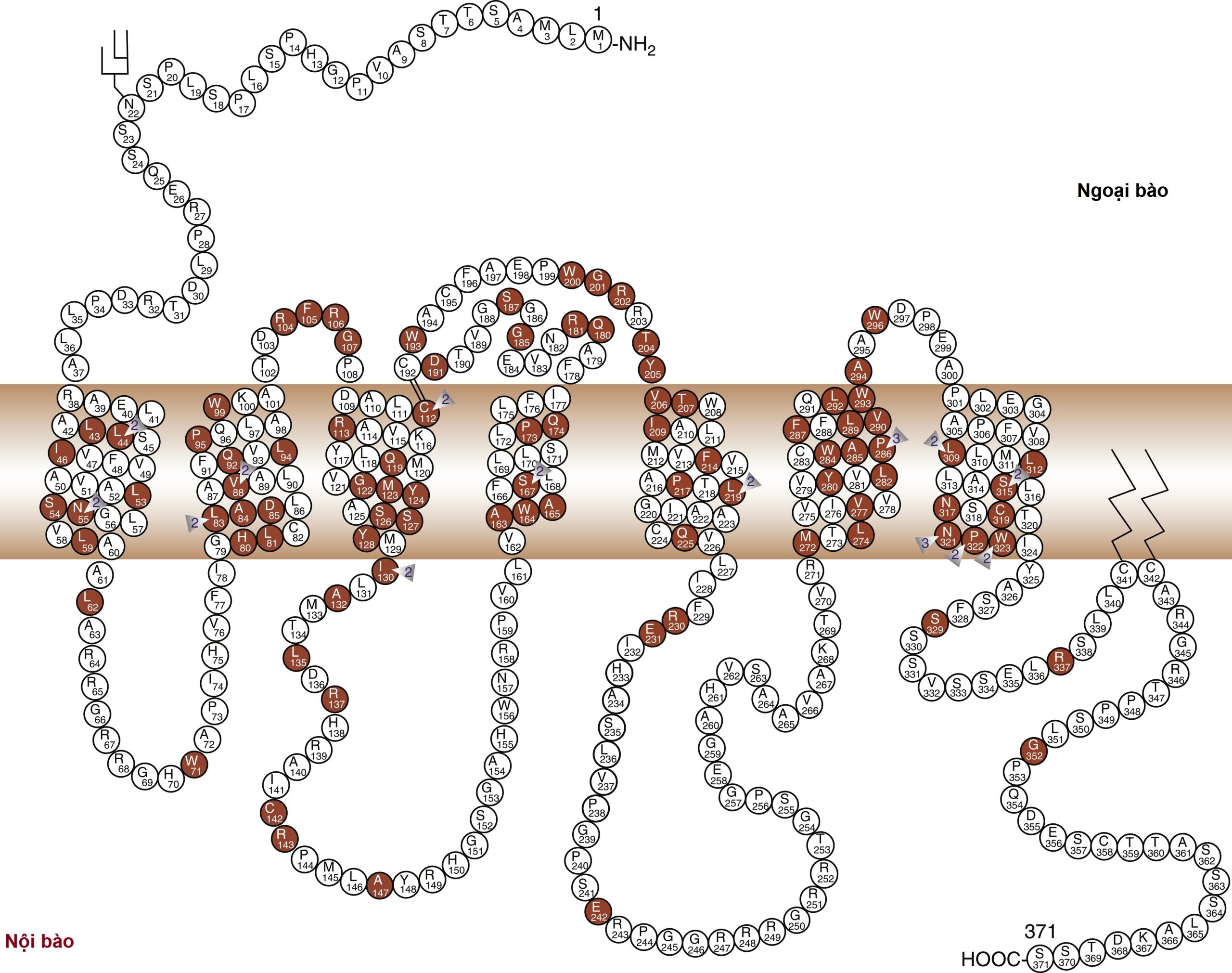
Hình 12.16 Cấu trúc dự đoán của thụ thể V2 vasopressin (AVPR2) và các đột biến gây ra đái tháo nhạt do thận liên kết X. Mô tả cấu trúc liên kết màng dự đoán, với miền ngoại bào ở phía trên của hình và các axit amin theo mã một chữ cái. Các axit amin được tô bóng mô tả các đột biến, với các con số cho biết có nhiều hơn một đột biến ở vị trí đó. (Từ Bichet, D.G., Bockenhauer, D. (2016). Genetic forms of nephrogenic diabetes insipidus (NDI): vasopressin receptor defect (X-linked) and aquaporin defect (autosomal recessive and dominant). Best Pract Res Clin Endocrinol Metabol, 30, 263–276. Với sự cho phép.).
Đái tháo nhạt do thận bẩm sinh, di truyền trên nhiễm sắc thể thường: Đột biến AQP2
Sau mô tả ban đầu về đái tháo nhạt do thận liên kết X, một số bệnh nhân đã được báo cáo có các dấu hiệu lâm sàng tương tự ngoại trừ việc bệnh được di truyền lặn trên nhiễm sắc thể thường, hoặc chức năng thụ thể V2 bình thường bên ngoài thận. Với việc nhân bản DNA bổ sung cho kênh nước của thận, AQP2, nhiều bệnh nhân bị đái tháo nhạt do thận di truyền lặn trên nhiễm sắc thể thường đã được báo cáo có tổng cộng 57 đột biến khác nhau trong gen này. Hầu hết là các đột biến sai nghĩa, mặc dù bốn là các đột biến vô nghĩa hoặc lệch khung. Chúng nằm rải rác khắp phân tử, bao gồm trong bốn trong năm miền xuyên màng, hai trong ba miền ngoại bào, và hai trong bốn miền nội bào (xem Hình 12.10). Gần đây, một phương thức di truyền trội trên nhiễm sắc thể thường cho bệnh đái tháo nhạt do thận đã được mô tả, liên quan đến các đột biến trong AQP2. Một trong những đột biến trội này dẫn đến các tetramer hỗn hợp của các alen kiểu dại và đột biến bị giữ lại trong bộ máy Golgi. Các đột biến AQP2 làm suy giảm khả năng của màng đỉnh trải qua sự gia tăng tính thấm nước, sau khi truyền tín hiệu qua thụ thể V2. Chúng có thể bao gồm những bệnh nhân đã được mô tả trước đây có sự gia tăng bình thường của cyclic AMP trong nước tiểu để đáp ứng với vasopressin, mà không có sự gia tăng đồng thời của áp lực thẩm thấu nước tiểu. Protein AQP2 được bài tiết trong nước tiểu ở cả dạng hòa tan và dạng gắn màng. Sự bài tiết AQP2 thấp ở bệnh đái tháo nhạt trung ương và do thận không được điều trị, nhưng sau khi dùng dDAVP, tăng rõ rệt ở bệnh đầu tiên, nhưng không tăng ở bệnh sau. Vì lý do này, việc đo lường nó trong nước tiểu đã được đề xuất như một phương tiện hỗ trợ trong chẩn đoán phân biệt đái tháo nhạt.
Nguyên nhân mắc phải
Các nguyên nhân mắc phải của đái tháo nhạt do thận phổ biến hơn và ít nghiêm trọng hơn các nguyên nhân di truyền. Đái tháo nhạt do thận có thể do thuốc, chẳng hạn như lithium và demeclocycline, cả hai đều được cho là cản trở việc tạo ra hoặc hoạt động của cyclic AMP do vasopressin kích thích. Khoảng 50% bệnh nhân dùng lithium bị suy giảm khả năng cô đặc nước tiểu, mặc dù chỉ có 10% đến 20% trong số họ phát triển đái tháo nhạt do thận có triệu chứng, hầu như luôn đi kèm với sự giảm mức lọc cầu thận. Nguy cơ tăng theo thời gian điều trị. Lithium làm suy giảm khả năng của vasopressin kích thích adenylate cyclase, dẫn đến giảm 90% biểu hiện mRNA của AQP2 trong ống góp thận, đây có thể là cơ sở gây ra đái tháo nhạt do thận.
Điều trị bằng demeclocycline gây ra đái tháo nhạt do thận bằng cách ức chế vận chuyển nước qua biểu mô. Vì lý do này, nó hữu ích trong điều trị hạ natri máu pha loãng liên quan đến bài tiết vasopressin không phù hợp, như đã thảo luận trước đây. Các tác nhân khác gây đái tháo nhạt do thận bao gồm tăng canxi máu, tăng kali máu, và điều trị bằng foscarnet (được sử dụng trong điều trị nhiễm cytomegalovirus ở bệnh nhân suy giảm miễn dịch), clozapine, amphotericin, methicillin, hoặc rifampin. Liệu bất kỳ tác nhân nào trong số này có gây đái tháo nhạt do thận bằng cách cản trở sự biểu hiện hoặc chèn vào màng ống góp đỉnh của các kênh nước AQP2 hay không vẫn chưa được biết. Tắc niệu quản, suy thận mạn, bệnh thận đa nang, bệnh nang tủy, hội chứng Sjogren, và bệnh hồng cầu hình liềm cũng có thể làm suy giảm khả năng cô đặc của thận. Lợi tiểu thẩm thấu do glycosuria trong đái tháo đường, hoặc do bài tiết natri với liệu pháp lợi tiểu, sẽ cản trở việc bảo tồn nước của thận. Chứng khát nhiều nguyên phát có thể dẫn đến đái tháo nhạt do thận thứ phát vì việc bài tiết mạn tính nước tiểu loãng làm giảm áp lực thẩm thấu của khoảng kẽ tủy thận ưu trương, do đó làm giảm khả năng cô đặc của thận. Cuối cùng, việc giảm lượng protein hoặc natri cũng có thể dẫn đến giảm trương lực của khoảng kẽ tủy thận và đái tháo nhạt do thận.
Điều trị Đái tháo nhạt do thận
Việc điều trị đái tháo nhạt do thận mắc phải tập trung vào việc loại bỏ, nếu có thể, rối loạn cơ bản, chẳng hạn như các loại thuốc gây bệnh, tăng canxi máu, hạ kali máu, hoặc tắc niệu quản. Đái tháo nhạt do thận bẩm sinh thường khó điều trị. Các mục tiêu chính nên là đảm bảo cung cấp đủ calo để tăng trưởng và tránh mất nước nghiêm trọng. Nên ăn các loại thực phẩm có tỷ lệ hàm lượng calo trên tải lượng thẩm thấu cao nhất, để tối đa hóa sự tăng trưởng và giảm thiểu thể tích nước tiểu cần thiết để bài tiết chất tan trong nước tiểu. Tuy nhiên, ngay cả khi bắt đầu điều trị sớm, suy dinh dưỡng và chậm phát triển trí tuệ không phải là hiếm.
Thuốc lợi tiểu thiazide, kết hợp với amiloride hoặc indomethacin, là những tác nhân dược lý hữu ích nhất trong điều trị đái tháo nhạt do thận. Thiazide hoạt động bằng cách tăng cường bài tiết natri với cái giá là nước, cũng như bằng cách gây ra sự sụt giảm mức lọc cầu thận, dẫn đến tái hấp thu natri và nước ở ống lượn gần. Indomethacin, 2 mg/kg/ngày, tăng cường thêm tái hấp thu natri và nước ở ống lượn gần, mặc dù tác dụng này không qua trung gian ức chế cyclooxygenase. Sự kết hợp của thuốc lợi tiểu thiazide và amiloride là chế độ được sử dụng phổ biến nhất để điều trị đái tháo nhạt do thận bẩm sinh, liên kết X, vì amiloride chống lại tình trạng hạ kali máu do thiazide gây ra, tránh được độc tính thận liên quan đến liệu pháp indomethacin, và được dung nạp tốt, ngay cả ở trẻ sơ sinh. Ngoài ra, amiloride làm giảm sự hấp thu lithium của các tế bào biểu mô thận, và vì lý do bổ sung này đã được đề xuất kết hợp với thiazide để điều trị đái tháo nhạt do thận do lithium gây ra. Liệu pháp dDAVP liều cao, kết hợp với indomethacin, đã được báo cáo là hữu ích trong điều trị một số đối tượng bị đái tháo nhạt do thận. Điều trị này có thể hữu ích ở những bệnh nhân có khiếm khuyết di truyền trong thụ thể V2, làm giảm ái lực gắn kết với vasopressin.
Một liệu pháp cho đến nay chỉ được sử dụng ở chuột và chưa có sẵn cho người, trong đó các codon dừng bất thường bị bỏ qua, có thể hữu ích để điều trị cho bệnh nhân có các đột biến vô nghĩa trong AVPR2 và AQP2.
Lời kết
Sự điều hòa chính xác cân bằng nước là cần thiết cho hoạt động bình thường của nhiều con đường tế bào. Vasopressin được giải phóng từ thùy sau tuyến yên, được kích thích bởi cả các yếu tố ưu trương và không thẩm thấu, tác động thông qua thụ thể V2 vasopressin ở thận để kích thích cả sự gia tăng biểu hiện AQP2 và sự chèn của nó vào màng đỉnh của ống góp, do đó tăng cường tái hấp thu nước của thận để giảm thiểu sự mất nước sau đó. Cảm giác khát kiểm soát phản ứng sinh lý chính thứ hai đối với tình trạng ưu trương và dẫn đến tăng lượng nước uống vào để bù đắp cho lượng nước đã mất. Các hệ thống renin-angiotensin-aldosterone và ANP cũng có những đóng góp quan trọng vào việc điều hòa nước và thể tích bằng cách điều chỉnh lượng natri vào và ra.
Việc chẩn đoán đúng các rối loạn do thiếu hụt và thừa tác dụng của vasopressin đòi hỏi sự hiểu biết thấu đáo về sự điều hòa sinh lý của hormone này. Những tiến bộ gần đây trong y học phân tử đã tiết lộ các đột biến trong gen vasopressin, và các gen thụ thể V2 hoặc AQP2, chịu trách nhiệm tương ứng cho bệnh đái tháo nhạt trung ương và do thận có tính gia đình. Các phương pháp phân tử cho phép chẩn đoán các rối loạn này trong giai đoạn trước sinh hoặc sau sinh sớm. Tuy nhiên, nguyên nhân thường gặp nhất của đái tháo nhạt trung ương vẫn là một tổn thương phá hủy của hệ thần kinh trung ương do khối u hoặc tổn thương phẫu thuật thần kinh, và độc tính dược lý vẫn là nguyên nhân phổ biến nhất của đái tháo nhạt do thận.
Hạ natri máu là một hiện tượng phổ biến ở trẻ em, nhưng hiếm khi do sự gia tăng nguyên phát trong bài tiết vasopressin hoặc tăng hoạt động nội tại của thụ thể V2 (SIADH). Nguyên nhân phổ biến hơn là do giảm thể tích máu (nguyên phát hoặc thứ phát sau giảm thể tích mạch máu hiệu dụng), mất muối, uống quá nhiều dịch nhược trương, hoặc thiếu hụt cortisol. Hạ natri máu do tăng tác dụng của vasopressin thường do sử dụng quá nhiều vasopressin trong quá trình điều trị đái tháo nhạt trung ương hoặc các bệnh đông máu.
Ở trẻ sơ sinh, đái tháo nhạt trung ương được điều trị tốt nhất bằng liệu pháp dịch, tránh sử dụng vasopressin hoặc chất tương tự thụ thể V2 của nó, dDAVP, trong khi ở trẻ lớn hơn, dDAVP là thuốc được lựa chọn. Đái tháo nhạt do thận vẫn là một thách thức điều trị. Hạ natri máu do SIADH được quản lý tốt nhất bằng cách hạn chế lượng nước uống vào, trong khi việc thay thế muối và nước được chỉ định khi hạ natri máu do giảm thể tích máu hoặc bài tiết ANP quá mức, như xảy ra trong hội chứng mất muối do não. Hạ natri máu gây rối loạn chức năng hệ thần kinh trung ương là một cấp cứu y tế. Natri máu phải được nâng lên kịp thời, nhưng với tốc độ không lớn hơn 0.5 mEq/L/giờ để tránh xảy ra hủy myelin cầu não trung tâm.
BẢNG CHÚ GIẢI THUẬT NGỮ ANH – VIỆT – CHƯƠNG 12
| STT | Thuật ngữ tiếng Anh | Phiên âm IPA | Nghĩa Tiếng Việt |
|---|---|---|---|
| 1 | Posterior Pituitary | /pəˈstɪəriər pɪˈtjuːɪtəri/ | Thùy sau tuyến yên |
| 2 | Tonicity | /toʊˈnɪsəti/ | Trương lực |
| 3 | Extracellular fluids | /ˌɛkstrəˈsɛljələr ˈfluːɪdz/ | Dịch ngoại bào |
| 4 | Cell function | /sɛl ˈfʌŋkʃən/ | Chức năng tế bào |
| 5 | Extracellular osmolality | /ˌɛkstrəˈsɛljələr ˌɒzməˈlæləti/ | Áp lực thẩm thấu ngoại bào |
| 6 | Intracellular concentrations | /ˌɪntrəˈsɛljələr ˌkɒnsənˈtreɪʃənz/ | Nồng độ nội bào |
| 7 | Ions | /ˈaɪənz/ | Ion |
| 8 | Osmolytes | /ˈɒzməlaɪts/ | Chất thẩm thấu |
| 9 | Ionic concentrations | /aɪˈɒnɪk ˌkɒnsənˈtreɪʃənz/ | Nồng độ ion |
| 10 | Ion channels | /ˈaɪən ˈʧænəlz/ | Kênh ion |
| 11 | Action potentials | /ˈækʃən pəˈtɛnʃəlz/ | Điện thế hoạt động |
| 12 | Intercellular communication | /ˌɪntərˈsɛljələr kəˌmjuːnɪˈkeɪʃən/ | Giao tiếp giữa các tế bào |
| 13 | Water intake | /ˈwɔːtər ˈɪnteɪk/ | Lượng nước uống vào |
| 14 | Excretion | /ɪkˈskriːʃən/ | Sự bài tiết |
| 15 | Extracellular volume | /ˌɛkstrəˈsɛljələr ˈvɒljuːm/ | Thể tích ngoại bào |
| 16 | Sodium chloride | /ˈsoʊdiəm ˈklɔːraɪd/ | Natri clorua |
| 17 | Blood tonicity | /blʌd toʊˈnɪsəti/ | Trương lực máu |
| 18 | Thirst | /θɜːrst/ | Cảm giác khát |
| 19 | Vasopressin | /ˌveɪzoʊˈprɛsɪn/ | Vasopressin |
| 20 | Renal systems | /ˈriːnəl ˈsɪstəmz/ | Hệ thống thận |
| 21 | Dysfunction | /dɪsˈfʌŋkʃən/ | Rối loạn chức năng |
| 22 | Blood osmolality | /blʌd ˌɒzməˈlæləti/ | Áp lực thẩm thấu máu |
| 23 | Neuronal activities | /njʊəˈroʊnəl ækˈtɪvətiz/ | Hoạt động thần kinh |
| 24 | Neurohypophysis | /ˌnjʊəroʊhaɪˈpɒfəsɪs/ | Thùy thần kinh tuyến yên |
| 25 | Nonapeptide hormones | /ˌnoʊnəˈpɛptaɪd ˈhɔːrmoʊnz/ | Hormone nonapeptide |
| 26 | Antidiuretic hormone (ADH) | /ˌæntiˌdaɪjʊˈrɛtɪk ˈhɔːrmoʊn/ | Hormone chống bài niệu (ADH) |
| 27 | Oxytocin | /ˌɒksɪˈtoʊsɪn/ | Oxytocin |
| 28 | Water homeostasis | /ˈwɔːtər ˌhoʊmiəˈsteɪsɪs/ | Cân bằng nội môi nước |
| 29 | Smooth muscle contraction | /smuːð ˈmʌsəl kənˈtrækʃən/ | Sự co cơ trơn |
| 30 | Parturition | /ˌpɑːrtjʊˈrɪʃən/ | Sự sinh đẻ |
| 31 | Lactation | /lækˈteɪʃən/ | Sự tiết sữa |
| 32 | Derangements | /dɪˈreɪnʤmənts/ | Sự xáo trộn, rối loạn |
| 33 | Water metabolism | /ˈwɔːtər mɪˈtæbəlɪzəm/ | Chuyển hóa nước |
| 34 | Physiology | /ˌfɪziˈɒləʤi/ | Sinh lý học |
| 35 | Volume regulation | /ˈvɒljuːm ˌrɛɡjʊˈleɪʃən/ | Điều hòa thể tích |
| 36 | Differential diagnosis | /ˌdɪfəˈrɛnʃəl ˌdaɪəɡˈnoʊsɪs/ | Chẩn đoán phân biệt |
| 37 | Pathology | /pəˈθɒləʤi/ | Bệnh học |
| 38 | Treatment | /ˈtriːtmənt/ | Điều trị |
| 39 | Osmotic regulation | /ɒzˈmɒtɪk ˌrɛɡjʊˈleɪʃən/ | Điều hòa thẩm thấu |
| 40 | Plasma tonicity | /ˈplæzmə toʊˈnɪsəti/ | Trương lực huyết tương |
| 41 | Intravascular volume | /ˌɪntrəˈvæskjələr ˈvɒljuːm/ | Thể tích nội mạch |
| 42 | Endocrine pathways | /ˈɛndoʊkrɪn ˈpɑːθweɪz/ | Con đường nội tiết |
| 43 | Neural pathways | /ˈnjʊərəl ˈpɑːθweɪz/ | Con đường thần kinh |
| 44 | Paracrine pathways | /ˈpærəkrɪn ˈpɑːθweɪz/ | Con đường cận tiết |
| 45 | Osmotic sensor | /ɒzˈmɒtɪk ˈsɛnsər/ | Cảm biến thẩm thấu |
| 46 | Effector pathways | /ɪˈfɛktər ˈpɑːθweɪz/ | Con đường đáp ứng (effector) |
| 47 | Signal transduction | /ˈsɪɡnəl trænsˈdʌkʃən/ | Sự truyền tín hiệu |
| 48 | Volume homeostasis | /ˈvɒljuːm ˌhoʊmiəˈsteɪsɪs/ | Cân bằng nội môi thể tích |
| 49 | Renin-angiotensin-aldosterone system | /ˈriːnɪn ˌænʤioʊˈtɛnsɪn ælˈdɒstəroʊn ˈsɪstəm/ | Hệ Renin-Angiotensin-Aldosterone |
| 50 | Natriuretic peptide | /ˌneɪtriˌjʊəˈrɛtɪk ˈpɛptaɪd/ | Peptide bài niệu natri |
| 51 | Anatomic structures | /ˌænəˈtɒmɪk ˈstrʌkʧərz/ | Cấu trúc giải phẫu |
| 52 | Molecular biologic studies | /məˈlɛkjələr ˌbaɪəˈlɒʤɪk ˈstʌdiz/ | Nghiên cứu sinh học phân tử |
| 53 | Physiologic studies | /ˌfɪziəˈlɒʤɪk ˈstʌdiz/ | Nghiên cứu sinh lý học |
| 54 | Biochemistry | /ˌbaɪoʊˈkɛmɪstri/ | Hóa sinh |
| 55 | Evolutionarily-related peptides | /ˌiːvəˈluːʃənəri rɪˈleɪtɪd ˈpɛptaɪdz/ | Peptide liên quan về mặt tiến hóa |
| 56 | Paralogs | /ˈpærəlɒɡz/ | Paralog (gen cùng nguồn gốc) |
| 57 | Gene duplication | /ʤiːn ˌdjuːplɪˈkeɪʃən/ | Sự nhân đôi gen |
| 58 | Phylogenetically | /ˌfaɪloʊʤəˈnɛtɪkli/ | Về mặt phát sinh loài |
| 59 | Disulfide ring | /daɪˈsʌlfaɪd rɪŋ/ | Vòng disulfide |
| 60 | Amino-acid | /əˈmiːnoʊ ˈæsɪd/ | Axit amin |
| 61 | Amidation | /ˌæmɪˈdeɪʃən/ | Sự amit hóa |
| 62 | Carboxy terminus | /kɑːrˈbɒksi ˈtɜːrmɪnəs/ | Đầu cuối carboxy |
| 63 | Biologic principle | /ˌbaɪəˈlɒʤɪk ˈprɪnsəpəl/ | Nguyên lý sinh học |
| 64 | Vascular pressor activity | /ˈvæskjələr ˈprɛsər ækˈtɪvəti/ | Hoạt động co mạch |
| 65 | Neurohypophyseal extracts | /ˌnjʊəroʊˌhaɪpəˈfɪziəl ˈɛkstrækts/ | Chiết xuất thùy sau tuyến yên |
| 66 | Antidiuretic capacity | /ˌæntiˌdaɪjʊˈrɛtɪk kəˈpæsəti/ | Khả năng chống bài niệu |
| 67 | Oxytocic capacity | /ˌɒksɪˈtoʊsɪk kəˈpæsəti/ | Khả năng gây co tử cung |
| 68 | Biologically active form | /ˌbaɪəˈlɒʤɪkli ˈæktɪv fɔːrm/ | Dạng có hoạt tính sinh học |
| 69 | Structure-function relationship | /ˈstrʌkʧər ˈfʌŋkʃən rɪˈleɪʃənʃɪp/ | Mối quan hệ cấu trúc-chức năng |
| 70 | l-arginine | /ɛl ˈɑːrʤɪniːn/ | L-arginine |
| 71 | d-arginine | /diː ˈɑːrʤɪniːn/ | D-arginine |
| 72 | Amino-terminal deamidation | /əˈmiːnoʊ ˈtɜːrmɪnəl diːˌæmɪˈdeɪʃən/ | Sự deamit hóa đầu amino |
| 73 | Analogue | /ˈænəlɒɡ/ | Chất tương tự |
| 74 | Desmopressin (dDAVP) | /ˌdɛsmoʊˈprɛsɪn/ | Desmopressin (dDAVP) |
| 75 | Antidiuretic:pressor ratio | /ˌæntiˌdaɪjʊˈrɛtɪk ˈprɛsər ˈreɪʃioʊ/ | Tỷ lệ chống bài niệu:co mạch |
| 76 | Differential binding | /ˌdɪfəˈrɛnʃəl ˈbaɪndɪŋ/ | Sự gắn kết khác biệt |
| 77 | V2 and V1 receptors | /viː tuː ænd viː wʌn rɪˈsɛptərz/ | Thụ thể V2 và V1 |
| 78 | Antidiuretic potency | /ˌæntiˌdaɪjʊˈrɛtɪk ˈpoʊtənsi/ | Hiệu lực chống bài niệu |
| 79 | Clinical practice | /ˈklɪnɪkəl ˈpræktɪs/ | Thực hành lâm sàng |
| 80 | Neurophysins | /ˌnjʊəroʊˈfaɪsɪnz/ | Neurophysin |
| 81 | Polypeptide chains | /ˌpɒliˈpɛptaɪd ʧeɪnz/ | Chuỗi polypeptide |
| 82 | Molecular weight | /məˈlɛkjələr weɪt/ | Trọng lượng phân tử |
| 83 | Biophysical characterization | /ˌbaɪoʊˈfɪzɪkəl ˌkærəktəraɪˈzeɪʃən/ | Đặc tính sinh lý hóa |
| 84 | Crystallography | /ˌkrɪstəˈlɒɡrəfi/ | Tinh thể học |
| 85 | Biologic function | /ˌbaɪəˈlɒʤɪk ˈfʌŋkʃən/ | Chức năng sinh học |
| 86 | Hormone stabilization | /ˈhɔːrmoʊn ˌsteɪbəlaɪˈzeɪʃən/ | Sự ổn định hormone |
| 87 | Intracellular storage | /ˌɪntrəˈsɛljələr ˈstɔːrɪʤ/ | Lưu trữ nội bào |
| 88 | Secretory granules | /sɪˈkriːtəri ˈɡrænjuːlz/ | Hạt bài tiết |
| 89 | Posttranslational processing | /poʊsttrænsˈleɪʃənəl ˈproʊsɛsɪŋ/ | Xử lý sau dịch mã |
| 90 | Proenzyme convertases | /proʊˈɛnzaɪm ˈkɒnvərteɪsɪz/ | Proenzyme convertase |
| 91 | Hormone transport | /ˈhɔːrmoʊn ˈtrænspɔːrt/ | Vận chuyển hormone |
| 92 | Copeptin | /koʊˈpɛptɪn/ | Copeptin |
| 93 | Precursor | /priːˈkɜːrsər/ | Tiền chất |
| 94 | 35S cysteine | /ˈθɜːrti faɪv ɛs ˈsɪstiːn/ | Cysteine đánh dấu 35S |
| 95 | Canine third ventricle | /ˈkeɪnaɪn θɜːrd ˈvɛntrɪkəl/ | Não thất ba của chó |
| 96 | Hypothalamus | /ˌhaɪpoʊˈθæləməs/ | Vùng dưới đồi |
| 97 | Trypsin digestion | /ˈtrɪpsɪn daɪˈʤɛsʧən/ | Tiêu hóa bằng trypsin |
| 98 | Immunoreactivity | /ɪˌmjunoʊriːækˈtɪvəti/ | Phản ứng miễn dịch |
| 99 | Molecular genetic analyses | /məˈlɛkjələr ʤəˈnɛtɪk əˈnæləsiːz/ | Phân tích di truyền phân tử |
| 100 | Preprohormones | /priːproʊˈhɔːrmoʊnz/ | Tiền-prohormone |
| 101 | Exons | /ˈɛksɒnz/ | Exon |
| 102 | Protease cleavage site | /ˈproʊtiˌeɪz ˈkliːvɪʤ saɪt/ | Vị trí cắt protease |
| 103 | Intron | /ˈɪntrɒn/ | Intron |
| 104 | Coding region | /ˈkoʊdɪŋ ˈriːʤən/ | Vùng mã hóa |
| 105 | Preprovasopressin | /priːproʊˌveɪzoʊˈprɛsɪn/ | Preprovasopressin |
| 106 | Disulfide bridges | /daɪˈsʌlfaɪd ˈbrɪʤɪz/ | Cầu disulfide |
| 107 | Tertiary structure | /ˈtɜːrʃəri ˈstrʌkʧər/ | Cấu trúc bậc ba |
| 108 | Chromosomal location | /ˌkroʊməˈsoʊməl loʊˈkeɪʃən/ | Vị trí nhiễm sắc thể |
| 109 | Transcriptional orientation | /trænsˈkrɪpʃənəl ˌɔːriɛnˈteɪʃən/ | Hướng phiên mã |
| 110 | Ancestral gene | /ænˈsɛstrəl ʤiːn/ | Gen tổ tiên |
| 111 | Paraventricular nuclei | /ˌpærəvɛnˈtrɪkjələr ˈnjuːkliaɪ/ | Nhân cạnh não thất |
| 112 | Supraoptic nuclei | /ˌsuːprəˈɒptɪk ˈnjuːkliaɪ/ | Nhân trên thị |
| 113 | Magnocellular components | /ˌmæɡnoʊˈsɛljələr kəmˈpoʊnənts/ | Thành phần tế bào lớn |
| 114 | Axonal transport | /ækˈsɒnəl ˈtrænspɔːrt/ | Vận chuyển qua sợi trục |
| 115 | Systemic circulation | /sɪˈstɛmɪk ˌsɜːrkjəˈleɪʃən/ | Tuần hoàn hệ thống |
| 116 | Parvocellular neurons | /ˌpɑːrvoʊˈsɛljələr ˈnjʊərɒnz/ | Tế bào thần kinh nhỏ |
| 117 | Hypothalamic-pituitary-adrenal axis | /ˌhaɪpoʊθəˈlæmɪk pɪˈtjuːɪtəri əˈdriːnəl ˈæksɪs/ | Trục dưới đồi-tuyến yên-thượng thận |
| 118 | Corticotropin-releasing hormone | /ˌkɔːrtɪkoʊˈtroʊpɪn rɪˈliːsɪŋ ˈhɔːrmoʊn/ | Hormone giải phóng corticotropin (CRH) |
| 119 | Median eminence | /ˈmiːdiən ˈɛmɪnəns/ | Lồi giữa |
| 120 | Hypothalamic-hypophyseal portal capillary system | /ˌhaɪpoʊθəˈlæmɪk ˌhaɪpoʊˈfɪziəl ˈpɔːrtl ˈkæpɪləri ˈsɪstəm/ | Hệ mao mạch cửa dưới đồi-tuyến yên |
| 121 | Adrenocorticotropic hormone (ACTH) | /əˌdriːnoʊˌkɔːrtɪkoʊˈtroʊpɪk ˈhɔːrmoʊn/ | Hormone vỏ thượng thận (ACTH) |
| 122 | Suprachiasmatic nucleus | /ˌsuːprəˌkaɪæzˈmætɪk ˈnjuːkliəs/ | Nhân trên chéo thị giác |
| 123 | Circadian pacemaker | /sərˈkeɪdiən ˈpeɪsˌmeɪkər/ | Cơ quan tạo nhịp sinh học |
| 124 | Physiologic variables | /ˌfɪziəˈlɒʤɪk ˈvɛəriəbəlz/ | Biến số sinh lý |
| 125 | Pharmacologic agents | /ˌfɑːrməkəˈlɒʤɪk ˈeɪʤənts/ | Tác nhân dược lý |
| 126 | Osmotically active constituents | /ɒzˈmɒtɪkli ˈæktɪv kənˈstɪʧuənts/ | Thành phần hoạt động thẩm thấu |
| 127 | Insulin deficiency | /ˈɪnsjʊlɪn dɪˈfɪʃənsi/ | Thiếu hụt insulin |
| 128 | Radioimmunoassays | /ˌreɪdioʊˌɪmjʊnoʊˈæseɪz/ | Xét nghiệm miễn dịch phóng xạ |
| 129 | Circumventricular organ | /ˌsɜːrkəmvɛnˈtrɪkjələr ˈɔːrɡən/ | Cơ quan quanh não thất |
| 130 | Blood-brain barrier | /blʌd breɪn ˈbæriər/ | Hàng rào máu não |
| 131 | Organ vasculosum of the lamina terminalis (OVLT) | /ˈɔːrɡən ˌvæskjəˈloʊsəm əv ðə ˈlæmɪnə ˌtɜːrmɪˈneɪlɪs/ | Cơ quan mạch của lá tận cùng (OVLT) |
| 132 | Subfornical organ (SFO) | /sʌbˈfɔːrnɪkəl ˈɔːrɡən/ | Cơ quan dưới vòm |
| 133 | Preoptic hypothalamus | /priːˈɒptɪk ˌhaɪpoʊˈθæləməs/ | Vùng dưới đồi trước thị |
| 134 | Hypernatremia | /ˌhaɪpərnəˈtriːmiə/ | Tăng natri máu |
| 135 | Angiotensin II | /ˌænʤiəˈtɛnsɪn tuː/ | Angiotensin II |
| 136 | Intracerebrally | /ˌɪntrəsəˈriːbrəli/ | Trong não |
| 137 | Peripherally | /pəˈrɪfərəli/ | Ngoại vi |
| 138 | Antidiuresis | /ˌæntidaɪjʊˈriːsɪs/ | Chống bài niệu |
| 139 | Interindividual variation | /ˌɪntərˌɪndɪˈvɪʤuəl ˌvɛəriˈeɪʃən/ | Biến thiên giữa các cá nhân |
| 140 | Hormonal environment | /hɔːrˈmoʊnəl ɪnˈvaɪərənmənt/ | Môi trường nội tiết tố |
| 141 | Glucocorticoid status | /ˌɡluːkoʊˈkɔːrtɪkɔɪd ˈsteɪtəs/ | Tình trạng glucocorticoid |
| 142 | Gestation | /ʤɛˈsteɪʃən/ | Thai kỳ |
| 143 | Osmotic thresholds | /ɒzˈmɒtɪk ˈθrɛʃhoʊldz/ | Ngưỡng thẩm thấu |
| 144 | Luteal phase | /ˈluːtiəl feɪz/ | Giai đoạn hoàng thể |
| 145 | Menstrual cycle | /ˈmɛnstruəl ˈsaɪkəl/ | Chu kỳ kinh nguyệt |
| 146 | Follicular phase | /fəˈlɪkjələr feɪz/ | Giai đoạn nang noãn |
| 147 | Human chorionic gonadotropin | /ˈhjuːmən ˌkɔːriˈɒnɪk ɡoʊˌnædəˈtroʊpɪn/ | Gonadotropin màng đệm người (hCG) |
| 148 | Luteinizing hormone | /ˈluːtɪənaɪzɪŋ ˈhɔːrmoʊn/ | Hormone tạo hoàng thể (LH) |
| 149 | Cortical activity | /ˈkɔːrtɪkəl ækˈtɪvəti/ | Hoạt động vỏ não |
| 150 | Ventromedial nucleus | /ˌvɛntroʊˈmiːdiəl ˈnjuːkliəs/ | Nhân bụng giữa |
| 151 | Polyuria | /ˌpɒliˈjʊəriə/ | Đa niệu |
| 152 | Diuretic state | /ˌdaɪjʊˈrɛtɪk steɪt/ | Tình trạng lợi tiểu |
| 153 | Pharynx | /ˈfærɪŋks/ | Hầu họng |
| 154 | Chemoreceptors | /ˌkiːmoʊrɪˈsɛptərz/ | Thụ thể hóa học |
| 155 | Oropharynx | /ˌɔːroʊˈfærɪŋks/ | Hầu miệng |
| 156 | Presystemic regulation | /priːsɪˈstɛmɪk ˌrɛɡjʊˈleɪʃən/ | Điều hòa tiền hệ thống |
| 157 | Iatrogenic means | /ˌaɪətroʊˈʤɛnɪk miːnz/ | Can thiệp y tế |
| 158 | Baroreceptor pathways | /ˌbæroʊrɪˈsɛptər ˈpɑːθweɪz/ | Con đường áp cảm thụ |
| 159 | Atria | /ˈeɪtriə/ | Tâm nhĩ |
| 160 | Aortic arch | /eɪˈɔːrtɪk ɑːrʧ/ | Cung động mạch chủ |
| 161 | Vagus nerve | /ˈveɪɡəs nɜːrv/ | Dây thần kinh phế vị |
| 162 | Glossopharyngeal nerves | /ˌɡlɒsoʊfəˈrɪnʤiəl nɜːrvz/ | Dây thần kinh lưỡi hầu |
| 163 | Noradrenergic fibers | /ˌnɔːrædrəˈnɜːrʤɪk ˈfaɪbərz/ | Sợi noradrenergic |
| 164 | Hemodynamic stimuli | /ˌhiːmoʊdaɪˈnæmɪk ˈstɪmjəlaɪ/ | Kích thích huyết động |
| 165 | Apomorphine | /ˌæpoʊˈmɔːrfiːn/ | Apomorphine |
| 166 | Motion sickness | /ˈmoʊʃən ˈsɪknəs/ | Say tàu xe |
| 167 | Vasovagal reactions | /ˌveɪzoʊˈveɪɡəl riˈækʃənz/ | Phản ứng phế vị-phế vị |
| 168 | Emetic stimulus | /ɪˈmɛtɪk ˈstɪmjələs/ | Kích thích gây nôn |
| 169 | Dopamine antagonists | /ˈdoʊpəmiːn ænˈtæɡənɪsts/ | Chất đối kháng dopamine |
| 170 | Opioid antagonists | /ˈoʊpiɔɪd ænˈtæɡənɪsts/ | Chất đối kháng opioid |
| 171 | Aquaporin-2 (AQP2) | /ˌækwəˈpɔːrɪn tuː/ | Aquaporin-2 (AQP2) |
| 172 | Renal luminal membrane | /ˈriːnəl ˈluːmɪnəl ˈmɛmbreɪn/ | Màng đỉnh của tế bào ống thận |
| 173 | Nitric oxide | /ˈnaɪtrɪk ˈɒksaɪd/ | Oxit nitric |
| 174 | Free water clearance | /friː ˈwɔːtər ˈklɪərəns/ | Thanh thải nước tự do |
| 175 | Cortisol loss | /ˈkɔːrtɪsɒl lɒs/ | Mất cortisol |
| 176 | Hyponatremia | /ˌhaɪpoʊnəˈtriːmiə/ | Hạ natri máu |
| 177 | Half-life | /hɑːf laɪf/ | Thời gian bán hủy |
| 178 | Vasopressinase | /ˌveɪzoʊˈprɛsɪneɪs/ | Vasopressinase |
| 179 | Metabolic clearance rate | /ˌmɛtəˈbɒlɪk ˈklɪərəns reɪt/ | Tốc độ thanh thải chuyển hóa |
| 180 | Liver dysfunction | /ˈlɪvər dɪsˈfʌŋkʃən/ | Rối loạn chức năng gan |
| 181 | Multiple gestations | /ˈmʌltɪpəl ʤɛˈsteɪʃənz/ | Đa thai |
| 182 | G protein–coupled cell surface receptors | /ʤiː ˈproʊtiːn ˈkʌpəld sɛl ˈsɜːrfəs rɪˈsɛptərz/ | Thụ thể bề mặt tế bào kết hợp protein G |
| 183 | V3 (or V1b) receptor | /viː θriː ɔːr viː wʌn biː rɪˈsɛptər/ | Thụ thể V3 (hoặc V1b) |
| 184 | Vascular smooth muscle | /ˈvæskjələr smuːð ˈmʌsəl/ | Cơ trơn mạch máu |
| 185 | Hepatocytes | /hɪˈpætoʊsaɪts/ | Tế bào gan |
| 186 | Glycogenolysis | /ˌɡlaɪkoʊʤəˈnɒlɪsɪs/ | Ly giải glycogen |
| 187 | Platelet aggregation | /ˈpleɪtlət ˌæɡrɪˈɡeɪʃən/ | Kết tập tiểu cầu |
| 188 | Phosphatidylinositol hydrolysis | /ˌfɒsfəˌtaɪdəlɪˈnɒsɪtɒl haɪˈdrɒlɪsɪs/ | Thủy phân phosphatidylinositol |
| 189 | In situ hybridization analysis | /ɪn ˈsaɪtjuː ˌhaɪbrɪdaɪˈzeɪʃən əˈnæləsɪs/ | Phân tích lai tại chỗ |
| 190 | Renal medulla | /ˈriːnəl məˈdʌlə/ | Tủy thận |
| 191 | Insulin resistance | /ˈɪnsjʊlɪn rɪˈzɪstəns/ | Kháng insulin |
| 192 | Aldosterone secretion | /ælˈdɒstəroʊn sɪˈkriːʃən/ | Bài tiết aldosterone |
| 193 | Lipolysis | /laɪˈpɒlɪsɪs/ | Ly giải mỡ |
| 194 | Corticotrophs | /ˈkɔːrtɪkoʊtrɒfs/ | Tế bào corticotroph |
| 195 | Renal collecting tubule | /ˈriːnəl kəˈlɛktɪŋ ˈtjuːbjuːl/ | Ống góp của thận |
| 196 | Uremia | /jʊəˈriːmiə/ | Urê huyết |
| 197 | Hemophilia | /ˌhiːməˈfɪliə/ | Bệnh hemophilia |
| 198 | Transmembrane domains | /trænzˈmɛmbreɪn doʊˈmeɪnz/ | Vùng xuyên màng |
| 199 | Cyclic adenosine monophosphate (cAMP) | /ˈsaɪklɪk əˈdɛnəsiːn ˌmɒnoʊˈfɒsfeɪt/ | Adenosine monophosphate vòng (cAMP) |
| 200 | X chromosome | /ɛks ˈkroʊməsoʊm/ | Nhiễm sắc thể X |
| 201 | Nephrogenic diabetes insipidus | /ˌnɛfroʊˈʤɛnɪk ˌdaɪəˈbiːtiːz ɪnˈsɪpɪdəs/ | Đái tháo nhạt do thận |
| 202 | Apical membrane | /ˈeɪpɪkəl ˈmɛmbreɪn/ | Màng đỉnh |
| 203 | Water permeability | /ˈwɔːtər ˌpɜːrmiəˈbɪləti/ | Tính thấm nước |
| 204 | Aquaporins | /ˌækwəˈpɔːrɪnz/ | Aquaporin |
| 205 | Homotetramers | /ˌhoʊmoʊˈtɛtrəmərz/ | Homotetramer |
| 206 | Exocytosis | /ˌɛksoʊsaɪˈtoʊsɪs/ | Xuất bào |
| 207 | Hypercalciuria | /ˌhaɪpərkælsɪˈjʊəriə/ | Tăng canxi niệu |
| 208 | Calcium-sensing receptor (CaSR) | /ˈkælsiəm ˈsɛnsɪŋ rɪˈsɛptər/ | Thụ thể cảm biến canxi |
| 209 | Microribonucleic acid (miRNA) | /ˌmaɪkroʊˌraɪboʊnjuːˌkliːɪk ˈæsɪd/ | Microribonucleic acid (miRNA) |
| 210 | Ubiquitination | /juːˌbɪkwɪtɪˈneɪʃən/ | Sự Ubiquitin hóa |
| 211 | Basolateral membrane | /ˌbeɪsoʊˈlætərəl ˈmɛmbreɪn/ | Màng đáy-bên |
| 212 | Proximal tubule | /ˈprɒksɪməl ˈtjuːbjuːl/ | Ống lượn gần |
| 213 | Renal juxtaglomerular apparatus | /ˈriːnəl ˌʤʌkstəɡləˈmɛrʊlər ˌæpəˈreɪtəs/ | Bộ máy cạnh cầu thận |
| 214 | Proteolytic enzyme | /ˌproʊtiəˈlɪtɪk ˈɛnzaɪm/ | Enzyme phân giải protein |
| 215 | Angiotensinogen | /ˌænʤioʊtɛnˈsɪnoʊʤən/ | Angiotensinogen |
| 216 | Decapeptide | /ˌdɛkəˈpɛptaɪd/ | Decapeptide |
| 217 | Octapeptide | /ˌɒktəˈpɛptaɪd/ | Octapeptide |
| 218 | Heptapeptide | /ˌhɛptəˈpɛptaɪd/ | Heptapeptide |
| 219 | Adrenal glomerulosa cells | /əˈdriːnəl ˌɡloʊmərjəˈloʊsə sɛlz/ | Tế bào lớp cầu của vỏ thượng thận |
| 220 | Pregnenolone | /prɛɡˈnɛnəloʊn/ | Pregnenolone |
| 221 | Cholesterol | /kəˈlɛstərɒl/ | Cholesterol |
| 222 | Corticosterone | /ˌkɔːrtɪkoʊˈstɪəroʊn/ | Corticosterone |
| 223 | Natriuresis | /ˌneɪtriˌjʊəˈriːsɪs/ | Bài niệu natri |
| 224 | Distal nephron | /ˈdɪstəl ˈnɛfrɒn/ | Nephron xa |
| 225 | Voltage-gated calcium channels | /ˈvoʊltɪʤ ˈɡeɪtɪd ˈkælsiəm ˈʧænəlz/ | Kênh canxi phụ thuộc điện thế |
| 226 | Atrial natriuretic peptide (ANP) | /ˈeɪtriəl ˌneɪtriˌjʊəˈrɛtɪk ˈpɛptaɪd/ | Peptide lợi niệu nhĩ (ANP) |
| 227 | Somatostatin | /ˌsoʊmətəˈstætɪn/ | Somatostatin |
| 228 | Astrocytes | /ˈæstroʊsaɪts/ | Tế bào hình sao |
| 229 | Choroid plexus | /ˈkɔːrɔɪd ˈplɛksəs/ | Đám rối màng mạch |
| 230 | Basal ganglia | /ˈbeɪsəl ˈɡæŋɡliə/ | Hạch nền |
| 231 | Adipsia | /əˈdɪpsiə/ | Chứng mất khát |
| 232 | Pressor effects | /ˈprɛsər ɪˈfɛkts/ | Tác động co mạch |
| 233 | Salt appetite | /sɔːlt ˈæpɪtaɪt/ | Cảm giác thèm muối |
| 234 | Hematocrit | /hɪˈmætoʊkrɪt/ | Hematocrit |
| 235 | Brain natriuretic peptide (BNP) | /breɪn ˌneɪtriˌjʊəˈrɛtɪk ˈpɛptaɪd/ | Peptide lợi niệu não (BNP) |
| 236 | C-type natriuretic peptide (CNP) | /siː taɪp ˌneɪtriˌjʊəˈrɛtɪk ˈpɛptaɪd/ | Peptide lợi niệu loại C (CNP) |
| 237 | Guanylyl cyclase | /ˌɡwɑːnəˈlɪl ˈsaɪkleɪz/ | Guanylyl cyclase |
| 238 | Atrial transmural pressure | /ˈeɪtriəl trænzˈmjʊərəl ˈprɛʃər/ | Áp lực xuyên thành nhĩ |
| 239 | Hypoxia | /haɪˈpɒksiə/ | Thiếu oxy |
| 240 | Atrial contractile frequency | /ˈeɪtriəl kənˈtræktaɪl ˈfriːkwənsi/ | Tần số co bóp nhĩ |
| 241 | Supraventricular tachycardia | /ˌsuːprəvɛnˈtrɪkjələr ˌtækɪˈkɑːrdiə/ | Nhịp nhanh trên thất |
| 242 | Ventricular hypertrophy | /vɛnˈtrɪkjələr haɪˈpɜːrtrəfi/ | Phì đại thất |
| 243 | Divalent cation excretion | /daɪˈveɪlənt ˈkætaɪən ɪkˈskriːʃən/ | Bài tiết cation hóa trị hai |
| 244 | Inner medullary collecting duct | /ˈɪnər məˈdʌləri kəˈlɛktɪŋ dʌkt/ | Ống góp tủy trong |
| 245 | Mineralocorticoid production | /ˌmɪnərəloʊˈkɔːrtɪkɔɪd prəˈdʌkʃən/ | Sản xuất mineralocorticoid |
| 246 | Bradycardia | /ˌbrædɪˈkɑːrdiə/ | Nhịp tim chậm |
| 247 | Gonadotropin-releasing hormone | /ɡoʊˌnædəˈtroʊpɪn rɪˈliːsɪŋ ˈhɔːrmoʊn/ | Hormone giải phóng gonadotropin |
| 248 | Congestive heart failure | /kənˈʤɛstɪv hɑːrt ˈfeɪljər/ | Suy tim sung huyết |
| 249 | Cyclic guanosine monophosphate | /ˈsaɪklɪk ˈɡwɑːnəsiːn ˌmɒnoʊˈfɒsfeɪt/ | Cyclic guanosine monophosphate |
| 250 | Thermoregulation | /ˌθɜːrmoʊˌrɛɡjʊˈleɪʃən/ | Điều hòa thân nhiệt |
| 251 | Energy balance | /ˈɛnərʤi ˈbæləns/ | Cân bằng năng lượng |
| 252 | Paracrine fashion | /ˈpærəkrɪn ˈfæʃən/ | Theo kiểu cận tiết |
| 253 | Intracerebroventricular infusion | /ˌɪntrəsəˌriːbroʊvɛnˈtrɪkjələr ɪnˈfjuːʒən/ | Truyền vào não thất |
| 254 | Arterial pressure | /ɑːrˈtɪəriəl ˈprɛʃər/ | Áp lực động mạch |
| 255 | Hypovolemic | /ˌhaɪpoʊvoʊˈliːmɪk/ | Giảm thể tích máu |
| 256 | Glomerular filtration rate | /ɡloʊˈmɛrʊlər fɪlˈtreɪʃən reɪt/ | Mức lọc cầu thận |
| 257 | Cirrhosis | /səˈroʊsɪs/ | Xơ gan |
| 258 | Nephrotic syndrome | /nəˈfrɒtɪk ˈsɪndroʊm/ | Hội chứng thận hư |
| 259 | Peripheral edema | /pəˈrɪfərəl ɪˈdiːmə/ | Phù ngoại vi |
| 260 | Polycystic kidney disease | /ˌpɒliˈsɪstɪk ˈkɪdni dɪˈziːz/ | Bệnh thận đa nang |
| 261 | Gastroenteritis | /ˌɡæstroʊˌɛntəˈraɪtɪs/ | Viêm dạ dày ruột |
| 262 | Cystic fibrosis | /ˈsɪstɪk faɪˈbroʊsɪs/ | Bệnh xơ nang |
| 263 | Cerebral salt wasting | /səˈriːbrəl sɔːlt ˈweɪstɪŋ/ | Mất muối do não |
| 264 | Syndrome of inappropriate antidiuresis (SIAD) | /ˈsɪndroʊm əv ˌɪnəˈproʊpriət ˌæntidaɪjʊˈriːsɪs/ | Hội chứng bài niệu không phù hợp (SIAD) |
| 265 | Serum uric acid | /ˈsɪərəm ˈjʊərɪk ˈæsɪd/ | Axit uric huyết thanh |
| 266 | Thymoma | /θaɪˈmoʊmə/ | U tuyến ức |
| 267 | Glioma | /ɡlaɪˈoʊmə/ | U thần kinh đệm |
| 268 | Bronchial carcinoid | /ˈbrɒŋkiəl ˈkɑːrsɪnɔɪd/ | Carcinoid phế quản |
| 269 | Hypertonic saline infusion | /ˌhaɪpərˈtɒnɪk ˈseɪliːn ɪnˈfjuːʒən/ | Truyền nước muối ưu trương |
| 270 | Polydipsia | /ˌpɒliˈdɪpsiə/ | Chứng khát nhiều |
| 271 | Pathologic polyuria | /ˌpæθəˈlɒʤɪk ˌpɒliˈjʊəriə/ | Đa niệu bệnh lý |
| 272 | Psychosocial reason | /ˌsaɪkoʊˈsoʊʃəl ˈriːzən/ | Lý do tâm lý xã hội |
| 273 | Nocturia | /nɒkˈtjʊəriə/ | Tiểu đêm |
| 274 | Enuresis | /ˌɛnjʊəˈriːsɪs/ | Đái dầm |
| 275 | Intracranial neoplasm | /ˌɪntrəˈkreɪniəl ˈniːoʊplæzəm/ | Khối u nội sọ |
| 276 | Urinalysis | /ˌjʊərɪˈnæləsɪs/ | Phân tích nước tiểu |
| 277 | Specific gravity | /spɪˈsɪfɪk ˈɡrævəti/ | Tỷ trọng |
| 278 | Water deprivation test | /ˈwɔːtər ˌdɛprɪˈveɪʃən tɛst/ | Nghiệm pháp nhịn nước |
| 279 | Vital signs | /ˈvaɪtəl saɪnz/ | Dấu hiệu sinh tồn |
| 280 | Water intoxication | /ˈwɔːtər ɪnˌtɒksɪˈkeɪʃən/ | Ngộ độc nước |
| 281 | Renal medullary interstitium | /ˈriːnəl məˈdʌləri ˌɪntərˈstɪʃəm/ | Khoảng kẽ tủy thận |
| 282 | Reset osmostat | /riːˈsɛt ˈɒzmoʊstæt/ | Cài đặt lại bộ điều nhiệt thẩm thấu |
| 283 | Immunoassay | /ˌɪmjʊnoʊˈæseɪ/ | Xét nghiệm miễn dịch |
| 284 | Gadolinium | /ˌɡædəˈlɪniəm/ | Gadolinium |
| 285 | Pituitary “bright spot” | /pɪˈtjuːɪtəri braɪt spɒt/ | “Điểm sáng” tuyến yên |
| 286 | Hypoosmolar polyuria | /ˌhaɪpoʊˈɒzmoʊlər ˌpɒliˈjʊəriə/ | Đa niệu nhược trương |
| 287 | Primary polydipsia | /ˈpraɪməri ˌpɒliˈdɪpsiə/ | Chứng khát nhiều nguyên phát |
| 288 | Renal free water clearance | /ˈriːnəl friː ˈwɔːtər ˈklɪərəns/ | Thanh thải nước tự do của thận |
| 289 | Adrenal insufficiency | /əˈdriːnəl ˌɪnsəˈfɪʃənsi/ | Suy thượng thận |
| 290 | Water diuresis | /ˈwɔːtər ˌdaɪjʊˈriːsɪs/ | Lợi tiểu nước |
| 291 | Adrenalectomy | /əˌdriːnəˈlɛktəmi/ | Cắt bỏ tuyến thượng thận |
| 292 | Cardiovascular tone | /ˌkɑːrdioʊˈvæskjələr toʊn/ | Trương lực tim mạch |
| 293 | Thyroid hormone | /ˈθaɪrɔɪd ˈhɔːrmoʊn/ | Hormone tuyến giáp |
| 294 | Hypothyroidism | /ˌhaɪpoʊˈθaɪrɔɪdɪzəm/ | Suy giáp |
| 295 | Nephrogenic SIAD | /ˌnɛfroʊˈʤɛnɪk ɛs aɪ eɪ diː/ | SIAD do thận |
| 296 | Carbamazepine | /ˌkɑːrbəˈmæzəpiːn/ | Carbamazepine |
| 297 | Chlorpropamide | /klɔːrˈproʊpəmaɪd/ | Chlorpropamide |
| 298 | Acetaminophen | /əˌsiːtəˈmɪnəfən/ | Acetaminophen |
| 299 | Cyclophosphamide | /ˌsaɪkloʊˈfɒsfəmaɪd/ | Cyclophosphamide |
| 300 | Hemorrhagic cystitis | /ˌhɛməˈræʤɪk sɪˈstaɪtɪs/ | Viêm bàng quang xuất huyết |
| 301 | Vinblastine | /vɪnˈblæstiːn/ | Vinblastine |
| 302 | Cisplatin | /sɪsˈplætɪn/ | Cisplatin |
| 303 | Hemoconcentration | /ˌhiːmoʊˌkɒnsənˈtreɪʃən/ | Cô đặc máu |
| 304 | Bronchopulmonary dysplasia | /ˌbrɒŋkoʊˈpʌlmənəri dɪsˈpleɪʒə/ | Loạn sản phế quản phổi |
| 305 | Asthma | /ˈæzmə/ | Hen suyễn |
| 306 | Demeclocycline | /ˌdɛməkləˈsaɪkliːn/ | Demeclocycline |
| 307 | V2 receptor antagonists (vaptans) | /viː tuː rɪˈsɛptər ænˈtæɡənɪsts (ˈvæptænz)/ | Chất đối kháng thụ thể V2 (vaptan) |
| 308 | Lethargy | /ˈlɛθərʤi/ | Hôn mê, ngủ lịm |
| 309 | Psychosis | /saɪˈkoʊsɪs/ | Rối loạn tâm thần |
| 310 | Coma | /ˈkoʊmə/ | Hôn mê |
| 311 | Generalized seizures | /ˈʤɛnərəlaɪzd ˈsiːʒərz/ | Co giật toàn thể |
| 312 | Cerebral herniation | /səˈriːbrəl ˌhɜːrniˈeɪʃən/ | Thoát vị não |
| 313 | Central pontine myelinolysis | /ˈsɛntrəl ˈpɒntaɪn ˌmaɪəlɪˈnɒlɪsɪs/ | Hủy myelin cầu não trung tâm |
| 314 | Axonal demyelination | /ækˈsɒnəl diːˌmaɪəlɪˈneɪʃən/ | Hủy myelin sợi trục |
| 315 | Furosemide | /fjʊəˈroʊsəmaɪd/ | Furosemide |
| 316 | Encephalitis | /ɛnˌsɛfəˈlaɪtɪs/ | Viêm não |
| 317 | Brain malformations | /breɪn ˌmælfɔːrˈmeɪʃənz/ | Dị tật não |
| 318 | Postictal period | /poʊstˈɪktəl ˈpɪəriəd/ | Giai đoạn sau cơn co giật |
| 319 | Acquired immunodeficiency syndrome | /əˈkwaɪərd ˌɪmjʊnoʊdɪˈfɪʃənsi ˈsɪndroʊm/ | Hội chứng suy giảm miễn dịch mắc phải (AIDS) |
| 320 | Vincristine | /vɪnˈkrɪstiːn/ | Vincristine |
| 321 | Tricyclic antidepressants | /traɪˈsaɪklɪk ˌæntidɪˈprɛsənts/ | Thuốc chống trầm cảm ba vòng |
| 322 | Sulfonylurea agents | /ˌsʌlfəˈnɪljʊəriə ˈeɪʤənts/ | Thuốc nhóm sulfonylurea |
| 323 | Tuberculous meningitis | /təˌbɜːrkjələs ˌmɛnɪnˈʤaɪtɪs/ | Viêm màng não do lao |
| 324 | Transsphenoidal pituitary surgery | /trænzsfiːˈnɔɪdəl pɪˈtjuːɪtəri ˈsɜːrʤəri/ | Phẫu thuật tuyến yên qua xương bướm |
| 325 | Corticotroph adenomas | /ˈkɔːrtɪkoʊtrɒf ˌædɪˈnoʊməz/ | U tuyến tế bào corticotroph |
| 326 | Coagulopathies | /koʊˌæɡjəˈlɒpəθiz/ | Bệnh đông máu |
| 327 | Constitutive activation | /kənˈstɪʧuətɪv ˌæktɪˈveɪʃən/ | Kích hoạt cấu thành |
| 328 | Nephrogenic syndrome of inappropriate antidiuresis (NSIAD) | /ˌnɛfroʊˈʤɛnɪk ˈsɪndroʊm əv ˌɪnəˈproʊpriət ˌæntidaɪjʊˈriːsɪs/ | Hội chứng bài niệu không phù hợp do thận (NSIAD) |
| 329 | Urea | /jʊəˈriːə/ | Urê |
| 330 | Osmotic diuresis | /ɒzˈmɒtɪk ˌdaɪjʊˈriːsɪs/ | Lợi tiểu thẩm thấu |
| 331 | Aquaretic effects | /ˌækwəˈrɛtɪk ɪˈfɛkts/ | Tác dụng lợi tiểu nước |
| 332 | Hydrocephalus | /ˌhaɪdroʊˈsɛfələs/ | Não úng thủy |
| 333 | Cerebral vascular accidents | /səˈriːbrəl ˈvæskjələr ˈæksɪdənts/ | Tai biến mạch máu não |
| 334 | Brain death | /breɪn dɛθ/ | Chết não |
| 335 | Euvolemia | /juːvoʊˈliːmiə/ | Tình trạng thể tích máu bình thường |
| 336 | Factitious hyponatremia | /fækˈtɪʃəs ˌhaɪpoʊnəˈtriːmiə/ | Hạ natri máu giả |
| 337 | Hyperglycemia | /ˌhaɪpərɡlaɪˈsiːmiə/ | Tăng đường huyết |
| 338 | Diabetic ketoacidosis | /ˌdaɪəˈbɛtɪk ˌkiːtoʊˌæsɪˈdoʊsɪs/ | Nhiễm toan ceton do đái tháo đường |
| 339 | Glycosuria | /ˌɡlaɪkoʊˈsjʊəriə/ | Glucose niệu |
| 340 | Cerebral edema | /səˈriːbrəl ɪˈdiːmə/ | Phù não |
| 341 | Triglycerides | /traɪˈɡlɪsəraɪdz/ | Triglyceride |
| 342 | Central Diabetes Insipidus | /ˈsɛntrəl ˌdaɪəˈbiːtiːz ɪnˈsɪpɪdəs/ | Đái tháo nhạt trung ương |
| 343 | Vasopressinergic neurons | /ˌveɪzoʊprɛsɪˈnɜːrʤɪk ˈnjʊərɒnz/ | Tế bào thần kinh vasopressinergic |
| 344 | Infiltrative diseases | /ɪnˈfɪltrətɪv dɪˈziːzɪz/ | Bệnh thâm nhiễm |
| 345 | Autoimmune diseases | /ˌɔːtoʊɪˈmjuːn dɪˈziːzɪz/ | Bệnh tự miễn |
| 346 | Infectious diseases | /ɪnˈfɛkʃəs dɪˈziːzɪz/ | Bệnh nhiễm trùng |
| 347 | Autosomal dominant | /ˌɔːtəˈsoʊməl ˈdɒmɪnənt/ | Di truyền trội trên nhiễm sắc thể thường |
| 348 | Penetrance | /ˈpɛnɪtrəns/ | Độ xâm nhập (gen) |
| 349 | Autosomal recessive | /ˌɔːtəˈsoʊməl rɪˈsɛsɪv/ | Di truyền lặn trên nhiễm sắc thể thường |
| 350 | Haploinsufficiency | /ˌhæploʊɪnsəˈfɪʃənsi/ | Suy giảm đơn bội |
| 351 | Allele | /əˈliːl/ | Alen |
| 352 | Transgenic mouse model | /trænzˈʤɛnɪk maʊs ˈmɒdl/ | Mô hình chuột chuyển gen |
| 353 | Endoplasmic reticulum | /ˌɛndoʊˈplæzmɪk rɪˈtɪkjələm/ | Lưới nội chất |
| 354 | Chaperone protein | /ˈʃæpəroʊn ˈproʊtiːn/ | Protein chaperone |
| 355 | DIDMOAD syndrome | /dɪdˈmoʊæd ˈsɪndroʊm/ | Hội chứng DIDMOAD |
| 356 | Optic atrophy | /ˈɒptɪk ˈætrəfi/ | Teo thị giác |
| 357 | Deafness | /ˈdɛfnəs/ | Điếc |
| 358 | Wolfram syndrome | /ˈwʊlfrəm ˈsɪndroʊm/ | Hội chứng Wolfram |
| 359 | Polymorphic linkage analysis | /ˌpɒliˈmɔːrfɪk ˈlɪŋkɪʤ əˈnæləsɪs/ | Phân tích liên kết đa hình |
| 360 | Proconvertase | /proʊˈkɒnvərteɪs/ | Proconvertase |
| 361 | Endocrinopathies | /ˌɛndoʊkrɪˈnɒpəθiz/ | Bệnh nội tiết |
| 362 | Sella turcica | /ˈsɛlə ˈtɜːrsɪkə/ | Hố yên |
| 363 | Retrograde degeneration | /ˈrɛtroʊɡreɪd diːˌʤɛnəˈreɪʃən/ | Thoái hóa ngược dòng |
| 364 | Septic shock | /ˈsɛptɪk ʃɒk/ | Sốc nhiễm trùng |
| 365 | Pituitary infarction (Sheehan syndrome) | /pɪˈtjuːɪtəri ɪnˈfɑːrkʃən (ˈʃiːən ˈsɪndroʊm)/ | Nhồi máu tuyến yên (hội chứng Sheehan) |
| 366 | Cranial irradiation | /ˈkreɪniəl ɪˌreɪdiˈeɪʃən/ | Xạ trị sọ não |
| 367 | Hypothalamic releasing hormones | /ˌhaɪpoʊθəˈlæmɪk rɪˈliːsɪŋ ˈhɔːrmoʊnz/ | Hormone giải phóng của vùng dưới đồi |
| 368 | Septooptic dysplasia | /ˌsɛptoʊˈɒptɪk dɪsˈpleɪʒə/ | Loạn sản vách-thị |
| 369 | Agenesis of the corpus callosum | /əˈʤɛnəsɪs əv ðə ˈkɔːrpəs kəˈloʊsəm/ | Bất sản thể chai |
| 370 | Kabuki syndrome | /kəˈbuːki ˈsɪndroʊm/ | Hội chứng Kabuki |
| 371 | Holoprosencephaly | /ˌhoʊloʊˌproʊzənˈsɛfəli/ | Holoprosencephaly (não trước không phân chia) |
| 372 | Familial pituitary hypoplasia | /fəˈmɪliəl pɪˈtjuːɪtəri ˌhaɪpoʊˈpleɪʒə/ | Thiểu sản tuyến yên gia đình |
| 373 | Craniofacial abnormalities | /ˌkreɪnioʊˈfeɪʃəl ˌæbnɔːrˈmælətiz/ | Bất thường sọ mặt |
| 374 | Germinomas | /ˌʤɜːrmɪˈnoʊməz/ | U mầm |
| 375 | Pinealomas | /ˌpaɪniəˈloʊməz/ | U tuyến tùng |
| 376 | Infundibulum | /ˌɪnfənˈdɪbjʊləm/ | Cuống tuyến yên |
| 377 | Empty sella syndrome | /ˈɛmpti ˈsɛlə ˈsɪndroʊm/ | Hội chứng hố yên rỗng |
| 378 | Craniopharyngiomas | /ˌkreɪnioʊfəˌrɪnʤiˈoʊməz/ | U sọ hầu |
| 379 | Optic gliomas | /ˈɒptɪk ɡlaɪˈoʊməz/ | U thần kinh đệm thị giác |
| 380 | Acute myelocytic leukemia | /əˈkjuːt ˌmaɪəloʊˈsɪtɪk luːˈkiːmiə/ | Bệnh bạch cầu dòng tủy cấp tính |
| 381 | Monosomy | /ˌmɒnoʊˈsoʊmi/ | Monosomy (thể một nhiễm) |
| 382 | Myelodysplastic syndrome | /ˌmaɪəloʊdɪsˈplæstɪk ˈsɪndroʊm/ | Hội chứng loạn sản tủy |
| 383 | Langerhans cell histiocytosis | /ˈlæŋərhænz sɛl ˌhɪstioʊsaɪˈtoʊsɪs/ | U mô bào Langerhans |
| 384 | Lymphocytic hypophysitis | /ˌlɪmfoʊˈsɪtɪk ˌhaɪpoʊfɪˈsaɪtɪs/ | Viêm tuyến yên lympho bào |
| 385 | Lymphocytic infundibuloneurohypophysitis | /ˌlɪmfoʊˈsɪtɪk ɪnˌfʌndɪbjʊloʊˌnjʊəroʊˌhaɪpoʊfɪˈsaɪtɪs/ | Viêm cuống-thần kinh-tuyến yên lympho bào |
| 386 | Sarcoidosis | /ˌsɑːrkɔɪˈdoʊsɪs/ | Bệnh sarcoidosis |
| 387 | Checkpoint inhibitors | /ˈʧɛkpɔɪnt ɪnˈhɪbɪtərz/ | Chất ức chế điểm kiểm soát |
| 388 | Hypophysitis | /ˌhaɪpoʊfɪˈsaɪtɪs/ | Viêm tuyến yên |
| 389 | Meningococcal | /məˌnɪnʤəˈkɒkəl/ | (Viêm màng não) do não mô cầu |
| 390 | Cryptococcal | /ˌkrɪptəˈkɒkəl/ | (Viêm màng não) do Cryptococcus |
| 391 | Toxoplasmosis meningitis | /ˌtɒksoʊplæzˈmoʊsɪs ˌmɛnɪnˈʤaɪtɪs/ | Viêm màng não do Toxoplasma |
| 392 | Congenital cytomegalovirus infection | /kənˈʤɛnɪtəl ˌsaɪtoʊˌmɛɡəloʊˈvaɪrəs ɪnˈfɛkʃən/ | Nhiễm cytomegalovirus bẩm sinh |
| 393 | Congenital syphilis | /kənˈʤɛnɪtəl ˈsɪfɪlɪs/ | Giang mai bẩm sinh |
| 394 | Preeclampsia | /ˌpriːɪˈklæmpsiə/ | Tiền sản giật |
| 395 | Oxytocic activity | /ˌɒksɪˈtoʊsɪk ækˈtɪvəti/ | Hoạt tính gây co tử cung |
| 396 | Hypertensive activity | /ˌhaɪpərˈtɛnsɪv ækˈtɪvəti/ | Hoạt tính tăng huyết áp |
| 397 | Ethanol | /ˈɛθənɒl/ | Ethanol (cồn) |
| 398 | Phenytoin | /ˈfɛnɪtoʊɪn/ | Phenytoin |
| 399 | Opiate antagonists | /ˈ |
