Khí máu và các Xét nghiệm trong Hồi sức Cấp cứu, Ấn bản thứ 3
(Blood Gases and Critical Care Testing, Third Edition)
Tác giả: Toffaletti, John G., PhD – Nhà xuất bản Elsevier – Biên dịch: Ths.Bs Lê Đình Sáng
Chương 10: Lấy và xử lý mẫu: ảnh hưởng đến các phân tích khí máu, Na, K, Ca ion hóa, Mg, lactate và phốt phát
Collection and handling of samples: effects on blood gases, Na, K, ionized Ca, Mg, lactate, and phosphate analyses
John G. Toffaletti, PhD; Craig R. Rackley, MD
Blood Gases and Critical Care Testing, Chapter 10, 205-223
Các nguồn gây lỗi tiền phân tích trong xét nghiệm khí máu và điện giải
Giới thiệu
Có rất nhiều nguồn gây ra lỗi tiền phân tích trong xét nghiệm. Trong số đó có những lỗi sau:
- Chỉ định sai xét nghiệm
- Lấy mẫu sai bệnh nhân
- Lỗi trong quá trình lấy mẫu, bao gồm cả việc chuẩn bị bệnh nhân không đúng cách
- Lỗi trong quá trình vận chuyển mẫu
- Lỗi trong quá trình xử lý mẫu
Chương này sẽ chỉ đề cập đến ba lỗi cuối cùng trong số này. Như Karon và Azman và cộng sự đã lưu ý, năm lý do hàng đầu cho việc lấy lại mẫu được trình bày trong Bảng 10.1.
Bảng 10.1. Những lý do thường gặp nhất cho việc lấy lại máu từ bệnh nhân tại khoa Cấp cứu (ED).
| Lý do lấy lại mẫu từ ED | % số lần lấy lại mẫu ở ED |
|---|---|
| Tan máu | 70 |
| Mẫu bị đông | 11 |
| Nghi ngờ mẫu bị nhiễm bẩn | 4 |
| Mẫu không bao giờ đến phòng xét nghiệm | 2 |
Rõ ràng, tan máu và rò rỉ hoặc vỡ tế bào là những nguyên nhân chính gây ra lỗi tiền phân tích. Việc nhiễm bẩn mẫu có thể bao gồm chất chống đông không phù hợp, bọt khí trong mẫu và nhiễm bẩn từ dịch truyền tĩnh mạch, chẳng hạn như nước muối, chất chống đông hoặc thuốc.
Tan máu
Tan máu trong ống nghiệm (in vitro) là vấn đề tiền phân tích phổ biến nhất trong xét nghiệm lâm sàng. Nó gây ra các vấn đề trong (a) việc ngăn ngừa tan máu trong quá trình lấy mẫu, (b) phát hiện tan máu trong các mẫu máu, và (c) cả việc diễn giải kết quả và quyết định có báo cáo kết quả cho nhiều xét nghiệm hay không, đáng chú ý nhất là kali.
Ngăn ngừa tan máu trong ống nghiệm. Để ngăn ngừa tan máu, có thể tuân theo một số hướng dẫn:
- Sử dụng kim có cỡ 23 gauge trở lên. Kim có cỡ nhỏ hơn có thể làm hỏng hồng cầu đi qua kim.
- Lấy máu qua đường truyền tĩnh mạch thường gây ra tỷ lệ tan máu cao hơn.
- Khi trộn máu với chất chống đông, hãy đảo ống nhẹ nhàng. Không bao giờ lắc ống.
- Vì một số lý do, các ống lấy máu nên được đổ đầy đến dung tích quy định.
- Không bao giờ đẩy máu mạnh từ ống tiêm vào ống, đặc biệt là ống chân không.
Phát hiện tan máu: huyết tương/huyết thanh hoặc máu toàn phần. Trong những năm trước, huyết thanh hoặc huyết tương bị tan máu trong các ống chân không thường được phát hiện bằng mắt thường của các nhà khoa học phòng thí nghiệm lâm sàng có tay nghề, những người xử lý thủ công các mẫu máu đã được ly tâm. Tuy nhiên, việc phát hiện tan máu bằng mắt thường có thể thay đổi tùy theo cá nhân. Hơn nữa, bilirubin tăng cao, một hiện tượng phổ biến ở trẻ sơ sinh, có thể làm phức tạp thêm việc diễn giải tan máu bằng mắt thường.
Khi tự động hóa trở nên phổ biến, các mẫu được ly tâm, phân tích và thường được báo cáo mà không cần kiểm tra trực quan. Vấn đề này phần lớn đã được giải quyết bằng các máy phân tích hiện đại sử dụng phương pháp đo quang phổ để phát hiện tan máu và gán một cấp độ số cho mức độ nghiêm trọng của nó để cảnh báo phòng xét nghiệm nếu mức độ tan máu ảnh hưởng đáng kể đến bất kỳ kết quả xét nghiệm nào.
Việc phát hiện tan máu là một mối quan tâm đáng kể đối với các mẫu khí máu được lấy trong ống tiêm và phải được phân tích ngay lập tức mà không cần ly tâm. Do đó, việc phát hiện tan máu bằng mắt thường không phải là một lựa chọn thực tế trước khi phân tích mẫu. Một lựa chọn ít lý tưởng hơn là ly tâm nhanh mẫu sau khi phân tích nếu kết quả (tức là K tăng) hoặc các mẫu trước đó của bệnh nhân cho thấy có tan máu.
Tan máu trong cơ thể (in vivo) xảy ra khi hồng cầu bị vỡ trong tuần hoàn. Nguyên nhân bao gồm các phản ứng miễn dịch với tế bào, thiếu máu tan máu và vỡ cơ học từ các thiết bị tim mạch, ECMO hoặc van tim. Mặc dù tan máu trong ống nghiệm ảnh hưởng sai lệch đến kết quả xét nghiệm phổ biến hơn nhiều và chiếm 98%–99% các mẫu bị tan máu, kết quả trên các mẫu có tan máu trong cơ thể có khả năng cho thấy sự gia tăng sinh lý thực sự của các chất phân tích trong máu.
Báo cáo kết quả trên các mẫu bị tan máu. Thông thường, phòng xét nghiệm không báo cáo bất kỳ kết quả nào bị ảnh hưởng đáng kể bởi tan máu trong ống nghiệm và yêu cầu lấy lại một mẫu khác. Vấn đề khó khăn hơn là khi không thể lấy lại mẫu phù hợp và bác sĩ gọi điện đến phòng xét nghiệm với nhu cầu cấp thiết về kết quả.
Lấy và xử lý mẫu đúng cách
Khí máu
Máu được lấy để phân tích khí máu dễ bị thay đổi, đặc biệt là pO₂. Điều kiện yếm khí trong quá trình lấy và xử lý là cần thiết vì không khí trong phòng có pCO₂ gần bằng 0 và pO₂ ~150 mmHg. Các yếu tố phải được kiểm soát là:
- Loại bỏ tất cả bọt khí
- Sử dụng chất chống đông phù hợp
- Sử dụng ống tiêm nhựa phù hợp (ống tiêm thủy tinh hiếm khi được sử dụng nữa)
- Nhiệt độ bảo quản trước khi phân tích
- Thời gian trì hoãn giữa việc lấy và phân tích máu
- Bất kỳ sự khuấy trộn nào của mẫu
Việc loại bỏ hoàn toàn tất cả các bọt khí là đặc biệt quan trọng trước khi gửi máu trong ống tiêm bằng hệ thống vận chuyển khí nén, điều này sẽ làm khuấy trộn mẫu và ảnh hưởng rõ rệt đến pO₂, trong khi pCO₂ ít bị ảnh hưởng bởi bọt khí hơn.
Ảnh hưởng của heparin lỏng ở nồng độ <10% (thể tích/thể tích) của thể tích máu có tác động khác nhau đến khí máu và các chất phân tích khác. Dường như có ít ảnh hưởng đến pH và ảnh hưởng tương đối nhỏ (~3%) đến pO₂. pCO₂, bicarbonate và kiềm dư bị ảnh hưởng tương ứng bởi sự pha loãng, giảm khoảng 10%. Do đó, chỉ nên sử dụng heparin khô làm chất chống đông.
Lấy và vận chuyển máu để đo oxy
Vì pO₂ trong máu dễ dàng thay đổi, có một số biện pháp phòng ngừa tiền phân tích quan trọng cần thiết để ngăn ngừa sai sót trong các phép đo lâm sàng về kết quả oxy và co-oximetry.
Trì hoãn trong xử lý mẫu. Nói chung, việc bảo quản máu trong ống tiêm nhựa ở nhiệt độ phòng là chấp nhận được nếu phân tích trong vòng 15 phút, với sự thay đổi trung bình của pH <0,01 đơn vị, pCO₂ dưới 1 mmHg và pO₂ dưới 2 mmHg.
Thời gian bảo quản mẫu sau khi lấy: Nhiệt độ phòng so với làm lạnh. Mặc dù việc bảo quản máu ở nhiệt độ phòng có thể làm giảm pO₂, pH và glucose, và tăng pCO₂ và lactate, việc bảo quản kéo dài các ống tiêm nhựa trong nước đá cũng có thể làm tăng pO₂. Theo hướng dẫn chung, nếu một mẫu sẽ được phân tích trong vòng 30 phút hoặc ít hơn, không nên làm lạnh mẫu. Nếu việc phân tích sẽ bị trì hoãn hơn 30 phút, ống tiêm nên được đặt trong nước đá.
Lượng máu thải bỏ từ đường truyền không đủ. Các catheter động mạch và tĩnh mạch phải được rửa sạch đầy đủ trước khi lấy mẫu máu để xét nghiệm khí máu. Theo một quy tắc chung, thể tích máu thải bỏ nên gấp 2 lần thể tích chết của catheter.
Trộn không đủ máu có heparin. Có ít nhất hai lý do quan trọng để trộn đúng cách các mẫu máu sau khi chúng được lấy vào ống tiêm: để hòa tan và trộn chất chống đông heparin, và để duy trì sự phân bố đều của các tế bào máu.
Pha loãng bằng heparin lỏng. Mặc dù việc sử dụng heparin lỏng trong ống tiêm đã gần như được thay thế hoàn toàn bằng các chế phẩm heparin khô, nhưng nếu bất kỳ heparin lỏng nào còn lại trong ống tiêm trước khi lấy máu, nó sẽ làm loãng các chất phân tích cần xét nghiệm.
Không khí bị kẹt trong ống tiêm. Bọt khí bị kẹt trong ống tiêm có thể làm tăng hoặc giảm đáng kể pO₂, %O₂Hb và sO₂, và hàm lượng O₂ của máu.
Vận chuyển mẫu bằng khí nén. Vì việc vận chuyển mẫu máu khí nén có thể làm khuấy trộn các mẫu máu, bất kỳ bọt khí nào bị kẹt trong ống tiêm sẽ được cân bằng với máu và gây ra những thay đổi đáng kể trong kết quả pO₂.
Lấy mẫu mao mạch. Mặc dù máu mao mạch được động mạch hóa đúng cách có thể cho kết quả pH và pCO₂ gần với kết quả động mạch, sự tương đồng của kết quả pO₂ giữa máu mao mạch và máu động mạch lại biến thiên hơn. pO₂ từ máu mao mạch sẽ luôn thấp hơn máu động mạch, có thể chỉ thấp hơn một chút, do đó một pO₂ mao mạch bình thường hoặc bình thường thấp đảm bảo rằng bệnh nhân không bị thiếu oxy máu.
Lấy mẫu máu dây rốn (UC). Có hai kỹ thuật chung để lấy mẫu máu UC. Trong Phương pháp 1, máu dây rốn được lấy khi UC vẫn còn gắn liền và trong vòng 1 phút sau khi sinh. Trong Phương pháp 2, một đoạn của UC được kẹp lại trong vòng 1 phút sau khi sinh.
Hình 10.1 Kỹ thuật đúng để lấy máu động mạch và tĩnh mạch UC. Lưu ý tầm quan trọng của việc đưa kim vào một góc để tránh đâm xuyên qua mạch máu dự định.
Natri
Heparin. Mặc dù một số chế phẩm heparin cũ hơn ở nồng độ >150 U/mL đã được báo cáo là gây nhiễu cho các phép đo Na, nhưng không có tác dụng nào được ghi nhận đối với các ống tiêm và ống chân không gần đây hơn chứa <50 U/mL.
Các phép đo natri trực tiếp so với gián tiếp. Một số báo cáo đã ghi nhận sự khác biệt giữa kết quả natri bằng các phương pháp ISE trực tiếp so với các phương pháp pha loãng mẫu trong phân tích (“phương pháp gián tiếp”).
Ảnh hưởng của tan máu đến kết quả natri, kali và canxi được thể hiện trong Bảng 10.2.
Bảng 10.2. Sự thay đổi kết quả xét nghiệm do mức độ tan máu
| Mức độ tan máu | Kali (mmol/L) | Natri (mmol/L) | Canxi (mmol/L) |
|---|---|---|---|
| Không phát hiện | 4,0 | 140 | 1,20 |
| 0,5% (0,08 g/dL Hb) | 4,5 | 140 | 1,20 |
| 5% (0,8 g/dL Hb) | 7,0 | 136 | 1,10 |
| 10% (1,5 g/dL Hb) | 10,0 | 133 | 1,00 |
Kali
Kali là một trong những xét nghiệm được chỉ định thường xuyên hơn trong phòng xét nghiệm lâm sàng, và có lẽ có nhiều vấn đề nhất với các kết quả giả do các biến số tiền phân tích.
- Chuẩn bị bệnh nhân: bệnh nhân nên bình tĩnh nhất có thể và tránh nắm chặt tay quá mức.
- Ly giải hồng cầu, bạch cầu hoặc tiểu cầu: ly giải tế bào là nguyên nhân thường gặp nhất gây tăng nồng độ K một cách sai lầm.
- Đông máu: trong quá trình đông máu, tiểu cầu giải phóng một lượng K tương đối nhỏ vào huyết thanh.
- Nồng độ bạch cầu cao: nếu số lượng bạch cầu trong khoảng 100.000 hoặc cao hơn, chúng có thể có tác động đáng kể đến nồng độ K trong huyết tương.
- Thời gian và nhiệt độ bảo quản: nếu một mẫu máu toàn phần được bảo quản ở nhiệt độ phòng, K có thể tăng 0,2 mmol/L sau 1,5 giờ.
Canxi ion hóa
Ảnh hưởng của chất chống đông và đông máu đến nồng độ canxi ion hóa Việc xác định chính xác nồng độ canxi ion hóa trong máu bị ảnh hưởng bởi một số nguyên nhân tiền phân tích. Các chất chống đông thông thường như EDTA, citrate và oxalate hoạt động bằng cách liên kết với các ion canxi, điều này sẽ làm giảm đáng kể nồng độ canxi ion hóa.
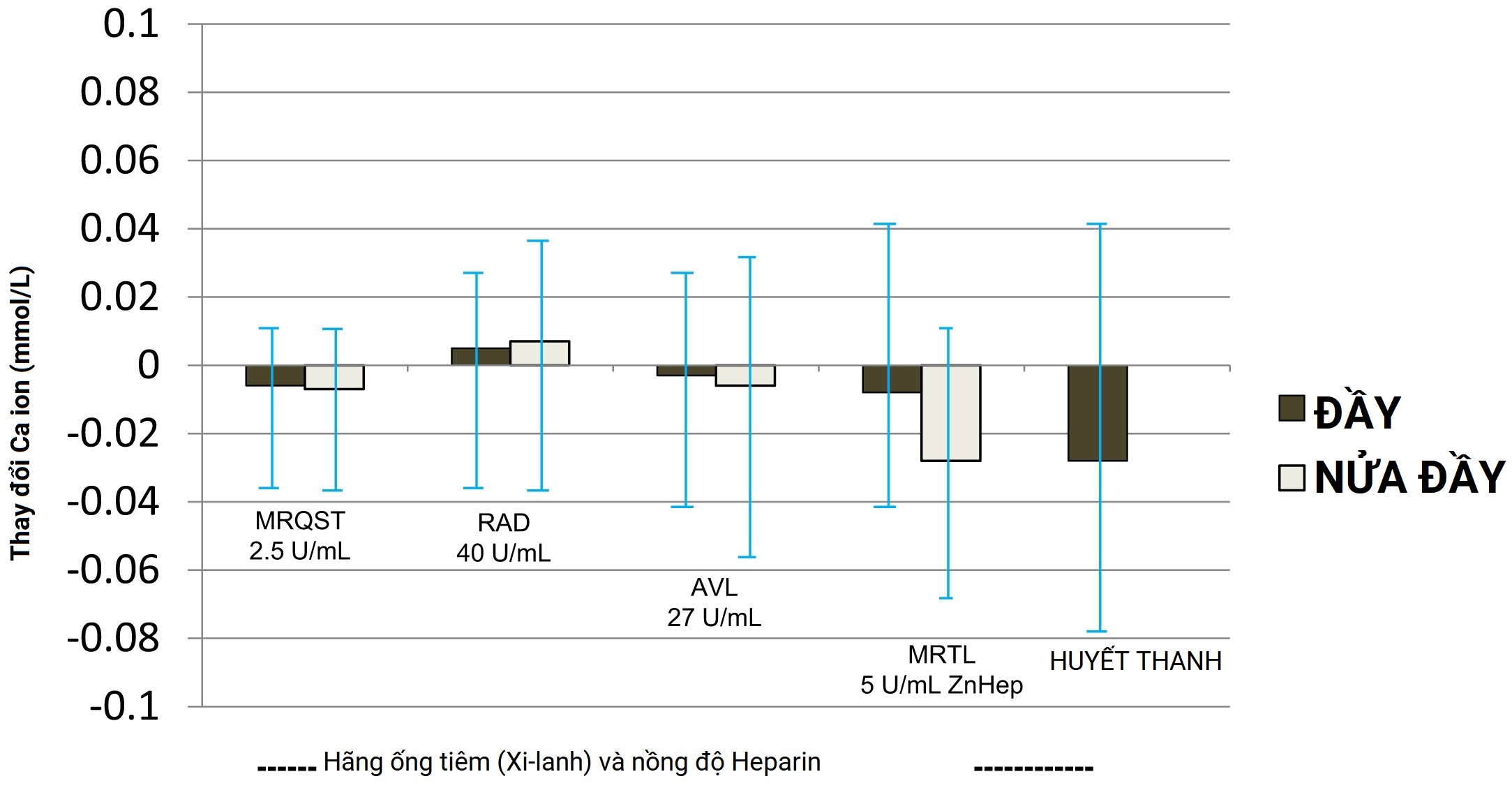
Hình 10.2 Sự thay đổi nồng độ canxi ion hóa từ máu với các chất chống đông khác nhau và từ huyết thanh. Thay đổi tương đối so với máu toàn phần không chứa chất chống đông được phân tích ngay sau khi lấy. Huyết thanh được chuẩn bị từ máu được lấy trong ống chân không không có chất chống đông sau khi đông và ly tâm.
Bởi vì pH ảnh hưởng đến sự liên kết của các ion Ca với albumin và các protein khác, những thay đổi về pH sẽ ảnh hưởng đến nồng độ canxi ion hóa trong máu. Bảng 10.3 liệt kê các giới hạn chấp nhận được gần đúng cho việc bảo quản các mẫu máu để đo canxi ion hóa trong các loại vật chứa mẫu khác nhau.
Bảng 10.3. Giới hạn chấp nhận được cho sự ổn định của canxi ion hóa trong các vật chứa mẫu khác nhau
| Vật chứa mẫu | <30 phút | 30–60 phút | 1–2 giờ | 2–8 giờ |
|---|---|---|---|---|
| Ống tiêm chưa mở | OK | OK | OK | OK |
| Ống tiêm mở trong thời gian ngắn | OK | OK | KHÔNG | KHÔNG |
| Vacutainer chưa mở > 1/2 đầy | OK | OK | OK | OK |
| Ống mao quản có heparin | OK | KHÔNG | KHÔNG | KHÔNG |
Lactate
Lactate trong máu là một trong những chất phân tích dễ bị ảnh hưởng bởi các yếu tố tiền phân tích có thể làm tăng nồng độ lactate.
- Chuẩn bị bệnh nhân: Trước khi lấy máu để phân tích lactate, bệnh nhân nên nghỉ ngơi và ngồi ít nhất 5 phút.
- Nhiệt độ bảo quản: Ở nhiệt độ phòng, máu toàn phần làm tăng nồng độ lactate 0,3–0,5 mmol/L sau 30 phút.
- Sử dụng chất chống đông: Mặc dù fluoride và/hoặc oxalate (Ox) có thể gây nhiễu, những chất bảo quản này (đặc biệt là fluoride) giảm thiểu sự gia tăng lactate xuống mức rất thấp.
- Thời gian bảo quản: Một số nghiên cứu đã chỉ ra rằng lactate trong máu có heparin tăng trung bình khoảng 0,01 mmol/L mỗi phút ở nhiệt độ phòng.
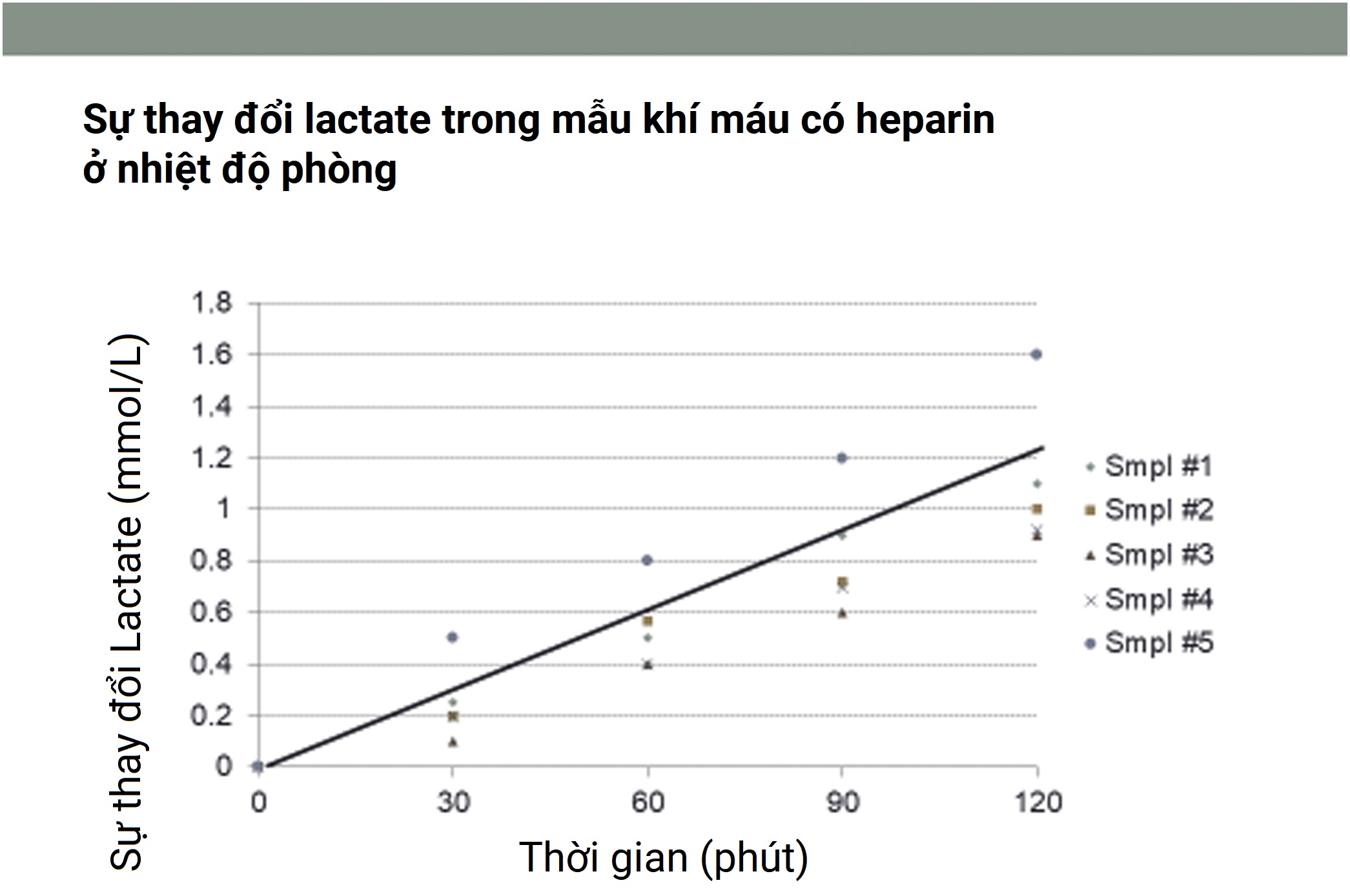
Hình 10.3 Sự thay đổi lactate trong năm mẫu máu có heparin được giữ ở nhiệt độ phòng. Điều này cho thấy sự thay đổi trung bình là khoảng 0,3 mmol/L mỗi 30 phút, nhưng các thay đổi thực sự thay đổi từ khoảng 0,2 đến 0,4 mmol/L mỗi 30 phút.
Phốt phát
Bởi vì nồng độ phốt phát tự do nội bào (~10 mmol/L) cao hơn nhiều lần so với trong máu (~0,8–1,5 mmol/L), bất kỳ loại ly giải tế bào hoặc rò rỉ tế bào nào cũng sẽ làm tăng nồng độ PO₄ trong huyết tương hoặc huyết thanh.
Magie
Nếu có thể, bệnh nhân nên nhịn ăn trước khi lấy máu. Tương tự như phốt phát, nồng độ magie nội bào cao hơn khoảng ba lần so với trong máu (~0,65–1,05 mmol/L).
TỰ LƯỢNG GIÁ
Câu hỏi tự đánh giá
- Xét nghiệm nào là thách thức nhất để phát hiện tan máu trong ống nghiệm? a. Lactate dehydrogenase b. Lactate c. Khí máu d. Canxi e. Magie
- Xét nghiệm khí máu nào nhạy cảm nhất với bọt khí trong mẫu? a. pCO₂ b. pH c. CO-Hb d. O₂-Hb e. pO₂
- Đúng-Sai: Làm lạnh luôn là một thực hành tốt để ổn định các mẫu để phân tích khí máu.
- Đúng-Sai: Một kết quả pO₂ là 86 mmHg trên một mẫu máu mao mạch được lấy đúng cách có thể được sử dụng để diễn giải lâm sàng.
- Đúng-Sai: Nếu kết quả pH trên máu động mạch và tĩnh mạch rốn giống nhau, điều đó khẳng định rằng các mẫu máu đã được lấy không đúng cách.
- Đúng-Sai: Ly giải hoặc rò rỉ từ các tế bào bạch cầu và/hoặc tiểu cầu có thể làm thay đổi kết quả kali nhiều như ly giải hồng cầu.
- Đúng-Sai: Bởi vì tất cả các chất chống đông đều có ảnh hưởng đáng kể đến kết quả canxi ion hóa, huyết thanh là lựa chọn tốt nhất để đo lường chính xác.
- Đúng-Sai: Sử dụng heparin lỏng làm chất chống đông để xét nghiệm khí máu sẽ có ảnh hưởng lớn nhất đến kết quả pH.
- Mẫu huyết tương/huyết thanh nào từ các mẫu máu sau đây có khả năng cho kết quả lactate chính xác nhất? a. Máu không có chất chống đông để ở nhiệt độ phòng trong 45 phút b. Máu không có chất chống đông được bảo quản trên đá trong 120 phút c. Máu được lấy bằng heparin và được bảo quản trong 30 phút ở nhiệt độ phòng. d. Máu được lấy trong ống chứa fluoride/oxalate để ở nhiệt độ phòng trong 60 phút.
Đáp án: 1-c, 2-e, 3-Sai, 4-Đúng, 5-Sai, 6-Đúng, 7-Sai, 8-Sai, 9-d
TÀI LIỆU THAM KHẢO
- Karon B.: Preanalytical Variables. August 26, 2019.
- Azman W.N.W., Omar J., Koon T.S., Ismail T.S.T.: Hemolyzed Specimens: Major Challenge for Identifying and Rejecting Specimens in Clinical Laboratories. Oman Med. J. 2019; 34 (2): pp. 94-98.
- Astles J.R., Lubarsky D., Loun B., Sedor F.A., Toffaletti J.G.: Pneumatic Transport Exacerbates Interference of Room Air Contamination of Blood Gas Samples. Arch. Pathol. Lab Med. 1996; 120: pp. 642-647.
- Toffaletti J.G., McDonnell E.H.: Effect of Small Air Bubbles on Changes in Blood pO₂ and Blood Gas parameters: Calculated vs Measured Effects. July 2012. http://acutecaretesting.org.
- Hutchinson A.S., Ralston S.H., Dryburgh F.J., Small M., Fogelman I.: Too Much Heparin: Possible Source of Error in Blood Gas Analysis. Br. Med. J. 1983; 287: pp. 1131-1132.
- Ordog G.J., Wasserberger J., Balasubramaniam S.: Effect of Heparin in Arterial Blood Gases. Ann. Emerg. Med. 1985; 14 (3): pp. 233-238.
- Chhapola V., Kuman S., Goyal P.: Is Liquid Heparin Comparable to Dry Heparin for Blood Gas Sampling in Intensive Care Unit?. Indian J. Crit. Care Med. 2014; 18 (1): pp. 14-20.
- Mahoney T.J., Harvey J.A., Wong R.J., Van Kessel A.L.: Changes in Oxygen Measurements When Whole Blood is Stored in Iced Plastic or Glass Syringes. Clin. Chem. 1991; 37: pp. 1244-1248.
- Rajasekaran R., Arthur H.S., Peter J.V.: Arterial Blood Gas Tensions- Effect of Storage Time and Temperature. Indian J. Resp. Care Med. 2014; 3 (1): pp. 350-356.
- Knowles T.P., Mullin R.A., Hunter J.A., Douce F.H.: Effects of Syringe Material, Sample Storage Time, and Temperature on Blood Gases and Oxygen Saturation in Arterialized Human Blood Samples. Respir. Care 2006; 51 (7): pp. 732-736.
- Beaulieu M., Lapointe Y., Vinet B.: Stability of pO₂, PCO₂, and pH in Fresh Blood Samples Stored in Plastic Syringe with Low Heparin in Relation to Various Blood-Gas and Hematological Parameters. Clin. Biochem. 1999; 32 (3): pp. 101-107.
- Prasad K.N., Manjunath P., Priya L., Sasikumar S.: Overcoming the Problem of Pseudohypoxemia in Myeloproliferative Disorders: Another Trick in the Bag. Indian J. Crit. Care Med. 2012; 16 (4): pp. 210-212.
- Narayanan S.: The Preanalytical Phase- An Important Component of Laboratory Medicine. Am. J. Clin. Pathol. 2000; 113: pp. 429-452.
- Rickard C., Couchman B., Schmidt S.: A Discard Volume of Twice the Deadspace Ensures Clinically Accurate Arterial Blood Gases and Electrolytes and Prevents Unnecessary Blood Loss. Crit. Care Med. 2003; 31 (6): pp. 1654-1658.
- Narayanan S.: Preanalytical Issues Related to Blood Sample Mixing. October 2005. www.acutecaretesting.org.
- Cousineau J.: Neonate Capillary Blood Gas Reference Values. January 2006. www.acutecaretesting.org.
- McLain B.I., Evans J., Dear P.R.F.: Comparison of Capillary and Arterial Blood Gas Measurement in Neonates. Arch. Dis. Child. 1988; 63: pp. 743-747.
- Higgins C.: Capillary Blood Gases- to Arterialize or Not. July 2008. www.acutecaretesting.org.
- CLSI: Collection of Capillary Blood Specimens. CLSI Standard GP42., 7th ed. 2020. Clinical and Laboratory Standards Institute,
- Higgins C.: Umbilical-Cord Blood Gas Analysis. October 2014. www.acutecaretesting.org.
- Jorgensen J.S.: Umbilical-Cord Blood Gas Analysis in Obstetrical Practice. July 2015. Radiometer Webinar,
- Saneh H., Mendez M.D., Srinivasan V.N.: Cord Blood Gas. April 20, 2020. NCBI Bookshelf, www.ncbi.nlm.nih.gov/books/NBK545290.
- Dimeski G., Badrick T., St John A.: Ion Selective Electrodes (IEs) and Interferences- A Review. Clin. Chim. Acta 2010; 411: pp. 309-317.
- Dimeski G., et al.: Disagreement between Ion Selective Electrode Direct and Indirect Sodium Measurements: Estimation of the Problem in a Tertiary Referral Hospital. J. Crit. Care 2012; 27 (326): pp. e9-16.
- Chow E., Fox N., Gama R.: Effect of Low Serum Protein on Na an K Measurement by ISE in Critically Ill Patients. Br. J. Biomed. Sci. 2008; 65: pp. 128-131.
- Wennecke G.: Useful Tips to Avoid Preanalytical Errors in Blood Gas Testing: Metabolites. January 2004.www.acutecaretesting.org.
- Stankovic A.K., Smith S.: Elevated Serum Potassium Values: The Role of Preanalytical Variables. Am. J. Clin. Pathol. 2004; 121 (Suppl. 1): pp. S105-S112.
- Don B.R., Sebastian A., Cheitlin M., Christiansen M., Schambelan M.: Pseudohyperkalemia Caused by Fist Clenching During Phlebotomy. N. Engl. J. Med. 1990; 322: pp. 1290-1292.
- Scott M., LeGrys V.A., Klutts S.: Electrolytes and Blood Gases. Tietz Textbook of Clinical Chemistry and Molecular Diagnostics., 4th ed. 2006. Elsevier Saunders,
- Haverstick D.M., Brill L.B., Scott M.G., Bruns D.E.: Preanalytical Variables in Measurement of Free (Ionized) Calcium in Lithium Heparin-Containing Blood Collection Tubes. Clin. Chim. Acta 2009; 403: pp. 102-104.
- Toffaletti J.G., Wildermann R.F.: The Effects of Heparin Anticoagulants and Fill Volume in Blood Gas Syringes on Ionized Calcium and Magnesium Measurements. Clin. Chim. Acta 2001; 304: pp. 147-151.
- Perovic A., Braticevic M.N.: Time-Dependent Variation of Ionized Calcium in Serum Samples. Biochem. Med. 2019; 29 (3): pp. 030708.
- Desai T.K., Carlson R.W., Thill-Baharozian M., Geheb M.A.: A Direct Relationship between Ionized Calcium and Arterial Pressure Among Patients in an Intensive Care Unit. Crit. Care Med. 1988; 16: pp. 578-582.
- Toffaletti J., Abrams B.: Effects of In Vivo and In Vitro Production of Lactic Acid on Ionized, Protein-Bound, and Complex-Bound Calcium in Blood. Clin. Chem. 1989; 35: pp. 935-938.
- Wang S., McDonnell E.H., Sedor F.A., Toffaletti J.G.: pH Effects on Measurements of Ionized Calcium and Ionized Magnesium in Blood. Arch. Pathol. Lab Med. 2002; 126: pp. 947-950.
- Toffaletti J.G.: Use of Novel Preparations of Heparin to Eliminate Interference in Ionized Calcium Measurements: Have All the Problems Been Solved?. Clin. Chem. 1994; 40: pp. 508-509.
- Ljunghall S., Joborn H., Benson L., Fellstrom B., Wide L., Akerstrom G.: Effects of Physical Exercise on Serum Calcium and Parathyroid Hormone. Eur. J. Clin. Invest. 1984; 14: pp. 469-473.
- Markowitz M.D., Arnaud S., Rosen J.F., et al.: Temporal Interrelationships between the Circadian Rhythms of Serum Parathyroid Hormone and Calcium Concentrations. J. Clin. Endocrinol. Metab. 1988; 67: pp. 1068-1073.
- Baird G.S.: Ionized Calcium. Clin. Chim. Acta 2011; 412 (9-10): pp. 696-701.
- Toffaletti J., Savory J., Gitelman H.J.: Use of Gel Filtration to Examine the Distribution of Calcium Among Serum Proteins. Clin. Chem. 1977; 23: pp. 2306-2310.
- Toffaletti J., Hammes M.E., Gray R., Lineberry B., Abrams B.: Lactate Measured in Diluted and Undiluted Whole Blood and Plasma: Comparison of Methods and Effect of Hematocrit. Clin. Chem. 1992; 38: pp. 2430-2434.
- Astles R., Williams C.P., Sedor F.: Stability of Plasma Lactate In Vitro in the Presence of Antiglycolytic Agents. Clin. Chem. 1994; 40: pp. 1327-1330.
- Calatayud O., Tenias J.M.: Effects of Time, Temperature, and Blood Cell Count on Levels of Lactate in Heparinized Whole Blood Gas Samples. Scand. J. Clin. Lab. Invest. 2003; 63: pp. 311-314.
- Bazydlo L.A.L., Needham M., Harris N.S.: Calcium, Magnesium, Phosphate: Review. Lab. Med. 2014; 45 (1): www.labmedicine.com.
- Ritter C., Ghahramani M., Marsoner H.J.: More on the Measurement of Ionized Magnesium in Whole Blood. Scand. J. Clin. Lab. Invest. 1996; 56 (Suppl. 224): pp. 275-280.
- Zoppi F., de Gasperi A., Guagnellini E., et al.: Measurement of Ionized Magnesium with AVL 988/4 Electrolyte Analyzer: Preliminary Analytical and Clinical Results. Scand. J. Clin. Lab. Invest. 1996; 56 (Suppl. 224): pp. 259-274.
