Sách Dịch: Các Trường Hợp Cấp Cứu Về Nội Tiết, Ấn Bản Thứ Nhất
Dịch & Chú Giải: Ths.Bs. Lê Đình Sáng
CHƯƠNG 12. Cấp Cứu Tăng Huyết Áp do Bệnh lý Tuyến Thượng Thận: U Tủy Thượng Thận, Hội chứng Cushing, Cường Aldosteron
Monika Akula ■ Raquel Kristin S. Ong ■ Alexander L. Shifrin ■ William F. Young, Jr.
MỤC LỤC CHƯƠNG
Giới thiệuU tủy thượng thận/U cận hạch (PPGL) Cường Aldosteron Nguyên phát Hội chứng Cushing |
Giới thiệu
Cơn tăng huyết áp cấp cứu được định nghĩa là tình trạng huyết áp tăng nhanh và đáng kể với huyết áp tâm thu lớn hơn 180 mmHg và/hoặc huyết áp tâm trương lớn hơn 120 mmHg, kèm theo bằng chứng tổn thương thần kinh, tim mạch, thận và các cơ quan đích khác. Các cơn tăng huyết áp cấp cứu do các bệnh lý nội tiết và chuyển hóa, thay vì tăng huyết áp vô căn phổ biến hơn, chỉ chiếm dưới 5% các trường hợp, nhưng khi đã xảy ra, chúng có thể gây ra bệnh suất và tử suất nghiêm trọng. Việc nhận biết kịp thời là rất quan trọng để có thể bắt đầu điều trị nhắm đích và tránh các biến chứng đe dọa tính mạng như đột quỵ và nhồi máu cơ tim. Cần khai thác bệnh sử và khám thực thể chi tiết về thời điểm khởi phát tăng huyết áp, tiền sử gia đình, các loại thuốc đang sử dụng và các triệu chứng liên quan đến tổn thương cơ quan đích.
Các bệnh lý nội tiết phổ biến nhất có thể gây ra cơn tăng huyết áp cấp cứu bao gồm:
|
U tủy thượng thận/U cận hạch (PPGL)
PPGL chiếm khoảng 0,1% các trường hợp tăng huyết áp. U tủy thượng thận (Pheochromocytoma) là các khối u tuyến thượng thận phát sinh từ các tế bào ưa crôm của tủy thượng thận (80% đến 85% các trường hợp PPGL), trong khi u cận hạch (Paraganglioma) là các khối u ngoài tuyến thượng thận phát sinh từ các hạch chuỗi giao cảm ở ngực, bụng hoặc xương chậu (15% đến 20% các trường hợp PPGL). Tỷ lệ hiện mắc của u tủy thượng thận là khoảng 3% trong các khối u tuyến thượng thận được phát hiện tình cờ. Các khối u tủy thượng thận có khả năng sản xuất epinephrine cùng với một lượng norepinephrine và dopamine khác nhau, trong khi các khối u tiết catecholamine ngoài tuyến thượng thận từ ngực, bụng và xương chậu sản xuất norepinephrine, ít thường xuyên hơn là dopamine, nhưng không sản xuất epinephrine. Đây là một yếu tố chẩn đoán phân biệt quan trọng để xác định nguồn gốc của catecholamine, vì phenylethanolamine-N-methyl transferase, enzyme chịu trách nhiệm chuyển đổi từ norepinephrine thành epinephrine, chủ yếu được tổng hợp ở tủy thượng thận chứ không phải ở các tế bào ưa crôm ngoài tuyến thượng thận. Epinephrine, còn được gọi là adrenaline, chủ yếu làm tăng cung lượng tim và tăng glucose để đáp ứng với một stress cấp tính nhằm chuẩn bị cho cá nhân đối phó với phản ứng “chiến đấu hay bỏ chạy”. Tương tự, norepinephrine cũng làm tăng cung lượng tim nhưng đặc biệt còn gây co mạch. Các PPGL dẫn đến sản xuất quá mức các hormone này có thể gây ra tăng huyết áp đe dọa tính mạng.
Các u cận hạch có nguồn gốc từ nền sọ và cổ thuộc hệ đối giao cảm và không sản xuất catecholamine, trừ những trường hợp hiếm gặp chúng sản xuất dopamine và chất chuyển hóa của nó là 3-methoxytyramine. Chúng thường lành tính, nhưng trong 17% trường hợp có thể chuyển dạng thành khối u ác tính. Nguy cơ ác tính cao hơn 30% đến 40% ở những bệnh nhân có biến thể dòng mầm bệnh lý của gen succinate dehydrogenase subunit B (SDHB). Các biến thể dòng mầm bệnh lý của gen SDHB cũng liên quan đến vị trí ngoài tuyến thượng thận, kích thước khối u lớn, khối u xâm lấn, tuổi trẻ, tiền sử gia đình dương tính, khối u đa ổ và kiểu hình sinh hóa tiết dopamine.
ĐẶC ĐIỂM LÂM SÀNG
Đặc điểm lâm sàng của các PPGL tiết quá nhiều catecholamine rất đa dạng. Tam chứng kinh điển gồm đau đầu, đánh trống ngực và vã mồ hôi hiện nay là một biểu hiện ít phổ biến hơn. Ở giai đoạn đầu, một số người có thể có các triệu chứng tối thiểu, không đặc hiệu và một số có thể không có triệu chứng gì cả. Tăng huyết áp được thấy ở 90% trường hợp; tăng huyết áp kịch phát ở những người trẻ, khỏe mạnh chiếm 50% trường hợp và có thể là dấu hiệu đầu tiên của tình trạng thừa catecholamine. Tăng huyết áp kịch phát sau đó có thể biểu hiện dưới dạng đau ngực cấp tính dữ dội từng cơn do co thắt mạch tim, và có thể bị nhầm lẫn với nhồi máu cơ tim hoặc bóc tách động mạch chủ cấp. Cơn u tủy thượng thận là một trường hợp cấp cứu hiếm gặp được định nghĩa là cơn tăng huyết áp hoặc hạ huyết áp kèm theo sốt cao (lớn hơn 104°F hay 40°C), bệnh não, suy đa tạng, với phù phổi và trụy tuần hoàn.
Chỉ định xét nghiệm U tủy thượng thận/U cận hạch
|
CHẨN ĐOÁN

Thuật toán chẩn đoán và điều trị u tủy thượng thận. Vẽ lược đồ: Bs Lê Đình Sáng
Theo các hướng dẫn gần đây của Hiệp hội Nội tiết, xét nghiệm sàng lọc ban đầu là xét nghiệm sinh hóa – metanephrine tự do trong huyết tương hoặc metanephrine phân đoạn trong nước tiểu sử dụng phương pháp sắc ký lỏng với điện hóa hoặc khối phổ. Metanephrine phân đoạn trong huyết tương cùng với chất chuyển hóa dopamine là 3-methoxytyramine có độ nhạy cao hơn (95%) so với metanephrine phân đoạn trong nước tiểu. PPGL có triệu chứng có thể được loại trừ nếu nồng độ metanephrine phân đoạn trong huyết tương nằm trong giới hạn tham chiếu bình thường. Độ đặc hiệu của metanephrine phân đoạn trong huyết tương và nước tiểu lần lượt là 96% và 89%. Khi đo metanephrine phân đoạn trong huyết tương, máu nên được lấy khi bệnh nhân ở tư thế nằm ngửa ít nhất 20 phút và sử dụng các tiêu chuẩn tham chiếu ở cùng tư thế để giảm thiểu kết quả dương tính giả. Kết quả xét nghiệm dương tính giả phổ biến hơn kết quả dương tính thật. Nguyên nhân phổ biến nhất của kết quả dương tính giả là các loại thuốc như levodopa, thuốc chống trầm cảm ba vòng và thuốc chống loạn thần làm tăng giả tạo nồng độ metanephrine phân đoạn. Dương tính giả về mặt sinh hóa cũng phổ biến trong các điều kiện căng thẳng cực độ như đau dữ dội, thiếu máu cục bộ cơ tim, và hạ đường huyết, và ở những bệnh nhân trong các đơn vị chăm sóc đặc biệt. Do đó, trong những trường hợp này, nếu bác sĩ lâm sàng nghi ngờ cao về PPGL, chẩn đoán hình ảnh cắt lớp vi tính vùng bụng và xương chậu có thể được chỉ định.
Để giải thích kết quả xét nghiệm một cách thích hợp, người ta phải tính đến xác suất bệnh trước xét nghiệm và mức độ tăng trên giới hạn trên của mức bình thường. Nếu nồng độ tăng hơn hai lần giới hạn trên của mức bình thường, thì rất có khả năng bệnh nhân có PPGL (giả sử các loại thuốc gây nhiễu đã được loại trừ). Nhưng, nếu nồng độ thấp hơn hai lần giới hạn trên của mức bình thường, thì rất khó phân biệt giữa dương tính giả và dương tính thật. Trong những trường hợp đó, bác sĩ lâm sàng nên xem xét các loại thuốc và điều kiện có thể gây ra kết quả dương tính giả. Nếu nghi ngờ lâm sàng cao và normetanephrine huyết tương tăng, có thể thực hiện nghiệm pháp ức chế clonidine để loại trừ khối u tiết catecholamine.
CHẨN ĐOÁN HÌNH ẢNH
Sau khi có bằng chứng sinh hóa rõ ràng về PPGL, bước tiếp theo là xác định vị trí khối u. Chụp cắt lớp vi tính (CT) được ưu tiên hơn chụp cộng hưởng từ (MRI) vì độ phân giải không gian vượt trội ở ngực, bụng và xương chậu. MRI được ưu tiên trong những trường hợp có u cận hạch ở cổ hoặc nền sọ, mang thai, hoặc lo ngại về bệnh di căn. Một tổn thương tuyến thượng thận với giá trị đậm độ CT không tiêm thuốc cản quang dưới 10 đơn vị Hounsfield (HU) có thể loại trừ một cách đáng tin cậy u tủy thượng thận. Mặc dù chụp CT có độ nhạy cao hơn (lớn hơn 90%), nhưng nó có độ đặc hiệu thấp hơn (75% đến 80%). Chụp CT chỉ cung cấp vị trí giải phẫu của khối u nhưng không cung cấp bất kỳ thông tin nào về chức năng của khối u. Kích thước u tủy thượng thận có thể thay đổi từ 1 đến 15 cm và trung bình khoảng 4 đến 6 cm khi được chẩn đoán. Các khối u nhỏ hơn bao gồm mô đặc, đồng nhất, trong khi ở các khối u lớn hơn, thường thấy hoại tử trung tâm với một vành mô u ở ngoại vi. U tủy thượng thận thường có hình cầu, với bờ trơn láng và về mặt hình thái có thể giống các khối u tuyến thượng thận khác. Chẩn đoán phân biệt nên bao gồm adenoma nghèo lipid, ung thư biểu mô tuyến thượng thận và di căn. Không giống như adenoma giàu lipid, đậm độ của u tủy thượng thận luôn từ 10 HU trở lên do không có lipid nội bào tương. Trong các phác đồ CT tuyến thượng thận chuyên biệt, bao gồm cả các lần quét cản quang thì muộn, adenoma thể hiện sự thải thuốc nhanh. Thật không may, đậm độ CT không cản quang và đặc điểm thải thuốc không thể phân biệt được giữa ung thư biểu mô tuyến thượng thận và di căn.
Ở những bệnh nhân nghi ngờ PPGL di căn, chẩn đoán hình ảnh chức năng là bước tiếp theo. Chẩn đoán hình ảnh chức năng không cần thiết nếu bệnh nhân trên 40 tuổi, không có tiền sử gia đình, khối u tuyến thượng thận có kích thước dưới 3 cm chủ yếu tiết metanephrine, hoặc có kết quả xét nghiệm di truyền âm tính. Đối với các khối u ngoài tuyến thượng thận, bất kể kích thước khối u hay kết quả xét nghiệm di truyền, chẩn đoán hình ảnh chức năng là cần thiết để phân giai đoạn khối u và xác định xem có thêm các u cận hạch khác hay không. Xạ hình với Iodine-123-metaiodobenzylguanidine (¹²³I-MIBG) và chụp cắt lớp phát xạ positron (PET) CT với gallium 68 (⁶⁸Ga) 1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid (DOTA)-octreotate (DOTATATE) có thể được sử dụng để xác định các PPGL bổ sung và phân giai đoạn cho PPGL đã biết. Chụp PET CT với ¹⁸F-fluorodeoxyglucose (¹⁸F-FDG) cũng hữu ích trong việc phát hiện các vị trí bệnh di căn và được ưu tiên hơn xạ hình ¹²³I-MIBG ở những bệnh nhân đã biết có PPGL di căn.
XÉT NGHIỆM DI TRUYỀN
Khoảng 40% PPGL là do di truyền hoặc có tính chất gia đình và liên quan đến các biến thể bệnh lý trong 15 gen nhạy cảm. Các gen bị đột biến phổ biến nhất là tiền-oncogen RET (đa u nội tiết týp 2), von Hippel-Lindau (VHL), các phân đơn vị B (SDHB), C (SDHC), D (SDHD) của succinate dehydrogenase, và u xơ thần kinh týp 1 (NF1) (Bảng 12.1). Các biến thể bệnh lý của gen SDHB có liên quan đến bệnh di căn xâm lấn (40% đến 60%).
Xét nghiệm di truyền được khuyến nghị cho tất cả bệnh nhân PPGL, đặc biệt là những người có tiền sử gia đình dương tính, u tuyến thượng thận hai bên, u cận hạch và ở độ tuổi trẻ hơn. Cũng khuyến nghị tư vấn cho các thành viên trong gia đình về khả năng mắc PPGL di truyền và đề nghị đánh giá cho những người thân cấp một.
Bảng 12.1 Các đột biến gen thường gặp liên quan đến PPGL
| Hội chứng | Gen | Loại khối u |
|---|---|---|
| MEN2a và MEN2b: Đa u nội tiết | RET | U tủy thượng thận; kiểu hình sinh hóa adrenergic; liên quan đến ung thư tuyến giáp thể tủy và trong MEN2a với cường cận giáp nguyên phát |
| VHL: Von Hippel Lindau | VHL | U tủy thượng thận hoặc u cận hạch; kiểu hình sinh hóa noradrenergic; liên quan đến ung thư biểu mô tế bào thận tế bào sáng và u nguyên bào mạch máu của hệ thần kinh trung ương |
| U cận hạch gia đình, Týp 1 | SDHD | U cận hạch (giao cảm, đối giao cảm) hoặc u tủy thượng thận |
| U cận hạch gia đình, Týp 2 | SDHAF2 | U cận hạch (đối giao cảm) |
| U cận hạch gia đình, Týp 3 | SDHC | U cận hạch (đối giao cảm, hiếm khi giao cảm) |
| U cận hạch gia đình, Týp 4 | SDHB | U cận hạch (đối giao cảm hoặc giao cảm) liên quan đến ung thư biểu mô tế bào thận và các khối u tuyến giáp |
| Hội chứng Carney-Stratakis | SDHB, SDHC, SDHD | U cận hạch (giao cảm và đối giao cảm); liên quan đến các khối u mô đệm đường tiêu hóa |
| U xơ thần kinh Týp 1 | NF1 | U tủy thượng thận; u xơ thần kinh; u tế bào thần kinh đệm |
ĐIỀU TRỊ NỘI KHOA TRƯỚC PHẪU THUẬT
Điều trị và chuẩn bị nội khoa trước phẫu thuật là rất cần thiết để giảm thiểu nguy cơ tăng vọt catecholamine trong quá trình phẫu thuật, có thể gây tử vong. Trọng tâm là kiểm soát việc bù dịch, tăng huyết áp và nhịp tim nhanh để tránh bất ổn huyết động trong mổ. Cần thực hiện điện tâm đồ như một phần của đánh giá trước phẫu thuật; nên yêu cầu siêu âm tim nếu có bất kỳ lo ngại nào về chức năng tim. Khuyến nghị sử dụng thuốc chẹn α-adrenergic trước phẫu thuật ít nhất 7 đến 14 ngày. Khoảng thời gian chẹn α-adrenergic nên dài hơn ở những bệnh nhân có tổn thương cơ quan do thừa catecholamine kéo dài.
Các thuốc chẹn α-adrenergic được sử dụng phổ biến nhất là phenoxybenzamine và doxazosin. Phenoxybenzamine là một thuốc chẹn α-adrenergic không cạnh tranh, không chọn lọc, liên kết với các thụ thể alpha-1 và alpha-2, có thời gian bán hủy dài (24 đến 48 giờ) và không dễ bị vượt qua bởi gánh nặng catecholamine của khối u. Liều khởi đầu là 10 mg một hoặc hai lần mỗi ngày đường uống và có thể tăng thêm 10 đến 20 mg sau mỗi 2 đến 3 ngày. Liều cuối cùng thường là 1 mg/kg mỗi ngày nhưng có thể cao tới 240 mg/ngày. Các tác dụng phụ bao gồm hạ huyết áp tư thế, nhịp tim nhanh, chóng mặt, mệt mỏi, và xuất tinh ngược dòng ở nam giới, và nghẹt mũi nặng. Phenoxybenzamine kiểm soát huyết áp tâm thu tốt hơn một chút so với chẹn alpha-1 chọn lọc, và nó có thể liên quan đến hạ huyết áp sau phẫu thuật 24 đến 48 giờ sau khi ngừng điều trị; do đó, có thể cần hỗ trợ thuốc vận mạch và dịch truyền tĩnh mạch sau phẫu thuật.
Doxazosin, prazosin và terazosin là các thuốc chẹn alpha-1 chọn lọc, ưu tiên liên kết với các thụ thể alpha-1, sau đó gây giãn mạch. Vì các thuốc này không liên kết với thụ thể alpha-2, nhịp tim nhanh xảy ra ít thường xuyên hơn so với phenoxybenzamine. Do thời gian bán hủy ngắn, liều cuối cùng nên được dùng vào buổi sáng ngày phẫu thuật vì chúng có nguy cơ không kiểm soát được sự giải phóng catecholamine trong mổ một cách đầy đủ. Ngược lại, so với phenoxybenzamine, hạ huyết áp sau phẫu thuật ít có khả năng xảy ra hơn. Các tác dụng phụ bao gồm chóng mặt, đau đầu, các triệu chứng tiêu hóa và hạ huyết áp tư thế. Doxazosin có thời gian bán hủy 12 giờ và thường được dùng một đến hai lần mỗi ngày với liều khởi đầu là 1 đến 2 mg/ngày và liều tối đa là 16 mg/ngày. Prazosin được bắt đầu với liều 0,5 đến 1 mg mỗi 4 đến 6 giờ và điều chỉnh đến liều trung bình từ 2 đến 5 mg hai đến ba lần một ngày với tổng liều tối đa là 20 đến 24 mg/ngày. Terazosin có thể được bắt đầu với liều 1 mg/ngày, với liều trung bình từ 2 đến 5 mg/ngày và liều tối đa là 20 mg/ngày.
Các thuốc chẹn kênh canxi như nicardipine, amlodipine, nifedipine và verapamil cũng có thể được sử dụng như một liệu pháp bổ sung trong việc kiểm soát huyết áp trước phẫu thuật. Các thuốc chẹn kênh canxi ức chế dòng canxi qua màng vào tế bào cơ trơn/cơ tim qua trung gian norepinephrine và do đó hỗ trợ đáng kể trong việc kiểm soát tăng huyết áp và rối loạn nhịp tim nhanh, mà không gây gánh nặng hạ huyết áp trong trạng thái huyết áp bình thường. Chúng hữu ích như liệu pháp bổ trợ cho những bệnh nhân không kiểm soát được huyết áp đầy đủ để tránh phải tăng liều các thuốc chẹn α-adrenergic. Các thuốc chẹn kênh canxi có thể được sử dụng thay thế cho những bệnh nhân không dung nạp được chẹn α-adrenergic do tác dụng phụ của nó hoặc ở những bệnh nhân bị tăng huyết áp không liên tục. Các thuốc chẹn kênh canxi cũng rất hữu ích trong việc ngăn ngừa co thắt mạch vành do catecholamine.
Thuốc chẹn β-adrenergic có thể được sử dụng để chống lại nhịp tim nhanh do thuốc chẹn α-adrenergic gây ra nhưng không bao giờ được sử dụng trước khi bắt đầu chẹn α-adrenergic vì tác dụng α-adrenergic không bị đối kháng có thể gây co mạch nghiêm trọng với hậu quả là suy tim cấp, cơn tăng huyết áp và phù phổi. Metoprolol (bắt đầu với 12,5 mg giải phóng kéo dài một lần mỗi ngày và điều chỉnh để đạt nhịp tim mục tiêu 80 nhịp/phút) và atenolol (bắt đầu với 12,5 mg mỗi ngày) là các thuốc đối kháng β-adrenergic chọn lọc trên tim và có ít tác dụng phụ hơn các thuốc đối kháng β-adrenergic không chọn lọc.
Huyết áp mục tiêu nên ở mức thấp-bình thường đối với tuổi và các bệnh đi kèm. Ví dụ, ở một người 20 tuổi, huyết áp tâm thu 100 mmHg là hợp lý, trong khi ở một bệnh nhân 75 tuổi bị bệnh thận mạn tính, huyết áp tâm thu 130 mmHg sẽ là mục tiêu hợp lý. Hạ huyết áp tư thế không phải là mục tiêu của liệu pháp, mà là tác dụng phụ của việc chẹn adrenergic. Tình trạng hạ huyết áp tư thế có thể được đảo ngược một phần bằng chế độ ăn nhiều natri (5000 mg/ngày). Có nguy cơ hạ huyết áp sau phẫu thuật do các thuốc chẹn α-adrenergic, do đó chế độ ăn nhiều natri (đã đề cập trước đó) và tăng lượng dịch uống để tăng thể tích được khuyến nghị để giảm bệnh suất và tử suất chu phẫu.
ĐIỀU TRỊ NỘI KHOA CẤP CỨU PPGL GÂY CƠN TĂNG HUYẾT ÁP
Cơn tăng huyết áp cấp cứu do PPGL nên được quản lý tại đơn vị chăm sóc đặc biệt với các loại thuốc tiêm tĩnh mạch có thời gian bán hủy ngắn. Thuốc được lựa chọn cho cơn tăng huyết áp cấp cứu do PPGL là thuốc chẹn α-adrenergic phentolamine (thời gian bán hủy 19 phút), có thể được bắt đầu bằng một liều bolus tĩnh mạch 5 mg, và các liều bolus bổ sung có thể được tiêm mỗi 10 phút để giảm huyết áp xuống mức mục tiêu. Ngoài ra, một thuốc chẹn kênh canxi tiêm tĩnh mạch (ví dụ, nicardipine tiêm tĩnh mạch) có thể được sử dụng do đặc tính giãn mạch ngoại vi và mạch vành và khả năng ngăn ngừa co thắt mạch vành. Tốc độ truyền ban đầu của nicardipine tiêm tĩnh mạch là 5 mg/giờ, tăng thêm 2,5 mg/giờ sau mỗi 15 phút, với liều tối đa là 30 mg/giờ. Clevidipine cũng là một thuốc chẹn kênh canxi có sẵn để sử dụng tiêm tĩnh mạch (liều ban đầu 1 đến 2 mg/giờ), có thời gian bán hủy ngắn hơn; tuy nhiên, nó đắt tiền và ít có sẵn hơn, nhưng có thể đạt được kiểm soát huyết áp chặt chẽ hơn với ít nguy cơ hạ huyết áp quá mức. Cuối cùng, sodium nitroprusside IV là một thuốc giãn mạch có tác dụng khởi phát nhanh và thời gian tác dụng ngắn và có thể được bắt đầu với tốc độ rất thấp (0,3 μg/kg mỗi phút) và điều chỉnh sau mỗi vài phút cho đến khi đạt được huyết áp mục tiêu; tốc độ truyền khuyến nghị tối đa là 10 μg/kg mỗi phút.
PHẪU THUẬT
Phương pháp phẫu thuật tốt nhất cho u tủy thượng thận là cắt tuyến thượng thận nội soi xâm lấn tối thiểu, trừ khi khối u lớn hơn 6 cm hoặc xâm lấn, trong trường hợp đó phẫu thuật mở được khuyến nghị. Phẫu thuật cắt tuyến thượng thận nội soi sau phúc mạc là phương pháp tiếp cận thuận lợi và trực tiếp nhất đến tuyến thượng thận với thời gian phẫu thuật ngắn nhất do loại bỏ được việc phẫu tích trong phúc mạc. Sự hài lòng của bệnh nhân cao hơn và phục hồi nhanh hơn với phương pháp sau phúc mạc. Điều này là do ít đau hơn và tránh được việc phẫu tích lớn trong ổ bụng (chẳng hạn như phẫu tích gan ở bên phải, hoặc lách và đại tràng ở bên trái) cần thiết để tiếp cận tuyến thượng thận nếu phẫu thuật được thực hiện qua đường bụng qua phúc mạc. Tuy nhiên, nếu có bất kỳ lo ngại nào về khả năng u tủy thượng thận ác tính, dựa trên các nghiên cứu hình ảnh học, phẫu thuật nên được thực hiện qua đường bụng, bắt đầu bằng nội soi và chuyển sang mở nếu cần thiết. Đối với u cận hạch, phẫu thuật mở thường được khuyến nghị. Cắt tuyến thượng thận bán phần (bảo tồn vỏ) được đề xuất cho bệnh nhân có bệnh hai bên, hoặc u tủy thượng thận di truyền, chẳng hạn như hội chứng MEN2, do khả năng cao có khối u hai bên. Bằng cách bảo tồn mô vỏ thượng thận khỏe mạnh, có thể tránh được việc thay thế glucocorticoid và mineralocorticoid suốt đời.
Sau phẫu thuật, bệnh nhân cần được theo dõi chặt chẽ về tình trạng bất ổn huyết động và hạ đường huyết trong 24 đến 48 giờ. Có thể cần truyền tĩnh mạch dung dịch muối sinh lý có dextrose cũng như các thuốc vận mạch/tăng co bóp tim để bù dịch. Việc ngừng đột ngột catecholamine sau khi cắt bỏ khối u cũng dẫn đến tăng insulin máu phản ứng và sau đó là hạ đường huyết phản ứng. Cần theo dõi đường huyết thường xuyên trong 24 giờ đầu sau phẫu thuật.
GIẢI PHẪU BỆNH
Tất cả các PPGL đều có khả năng ác tính. Khoảng 10% u tủy thượng thận và 20% u cận hạch tiết catecholamine trở thành di căn. Hệ thống tính điểm được sử dụng nhiều nhất để phân tầng nguy cơ ác tính là Thang điểm PASS (Pheochromocytoma of Adrenal Gland Scaled Score) do Thompson đề xuất năm 2002. Điểm PASS từ 4 trở lên cho thấy tổn thương ác tính. Một điểm được cho cho sự xâm lấn vỏ bao, xâm lấn mạch máu, đa hình thái nhân sâu sắc hoặc tăng sắc tố, và hai điểm được cho cho sự xâm lấn mô mỡ quanh tuyến thượng thận, hoại tử khu trú hoặc hợp lưu, mật độ tế bào cao, các cụm tế bào lớn hoặc phát triển lan tỏa, tế bào hình thoi, ≥ 4 phân bào trên 10 quang trường độ phóng đại lớn (hpf), các đặc điểm phân bào không điển hình, hoặc sự đơn điệu của tế bào.
THEO DÕI SAU ĐIỀU TRỊ
Nên đo metanephrine phân đoạn trong huyết tương hoặc nước tiểu 24 giờ vào thời điểm 2 đến 6 tuần sau phẫu thuật để xác nhận xem khối u đã được cắt bỏ thành công hay chưa. Trong trường hợp nồng độ metanephrine phân đoạn vẫn còn tăng, khuyến nghị thực hiện chẩn đoán hình ảnh thêm. Hướng dẫn Thực hành Lâm sàng của Hiệp hội Nội tiết Châu Âu khuyến nghị theo dõi nồng độ metanephrine phân đoạn trong huyết tương hoặc nước tiểu hàng năm trong ít nhất 10 năm. Tuy nhiên, nhiều chuyên gia khuyến nghị theo dõi suốt đời. Một phân tích tổng hợp cho thấy nguy cơ tái phát là khoảng 5% trong 5 năm theo dõi.
Cường Aldosteron Nguyên phát
Tế bào lớp cầu của vỏ thượng thận sản xuất aldosterone. Aldosterone đóng một vai trò quan trọng trong tăng huyết áp ở chỗ nó không chỉ liên kết với các thụ thể mineralocorticoid ở các tế bào biểu mô thận để thúc đẩy tái hấp thu natri và nước và bài tiết kali mà còn liên kết với các thụ thể mineralocorticoid ở các tế bào cơ tim, nguyên bào sợi tim và tế bào cơ trơn mạch máu để gây co mạch và sau đó là tăng huyết áp. Cường aldosteron nguyên phát (PA), còn được gọi là hội chứng Conn, được Jerome Conn mô tả lần đầu tiên vào năm 1954 ở một bệnh nhân bị tăng huyết áp kháng trị kèm hạ kali máu do u tuyến thượng thận sản xuất aldosterone (APA). PA là một trong những nguyên nhân phổ biến nhất của tăng huyết áp thứ phát. PA thường do tăng sản tuyến thượng thận hai bên (BAH) ở khoảng 60% đến 65% bệnh nhân và do APA một bên ở 30% đến 40% bệnh nhân. Rất hiếm khi, nó được sản xuất từ tăng sản tuyến thượng thận một bên, ung thư biểu mô vỏ thượng thận, u tuyến sản xuất aldosterone lạc chỗ, hoặc các tình trạng di truyền của cường aldosteron gia đình.
ĐẶC ĐIỂM LÂM SÀNG
Bệnh nhân PA có thể có các triệu chứng không đặc hiệu như mệt mỏi, yếu cơ, chuột rút, tiểu đêm và đau đầu. Về mặt lâm sàng, bệnh nhân sẽ bị tăng huyết áp nhưng không phải lúc nào cũng bị hạ kali máu. PA hiếm khi có thể biểu hiện dưới dạng cơn tăng huyết áp cấp cứu, với tỷ lệ hiện mắc không chắc chắn, vì có ít trường hợp được báo cáo. Chẩn đoán sớm PA là rất cần thiết, vì PA kéo dài gây ra sự gia tăng xơ hóa và sản xuất collagen ở vách liên thất tim và mạch máu ngoại vi và sau đó liên quan đến phì đại thất trái, bệnh tim mạch, nhồi máu cơ tim và đột quỵ (những nguyên nhân gây tử vong phổ biến nhất).
Hiệp hội Nội tiết khuyến nghị sàng lọc PA ở những bệnh nhân đáp ứng một trong các tiêu chí sau:
|
CHẨN ĐOÁN
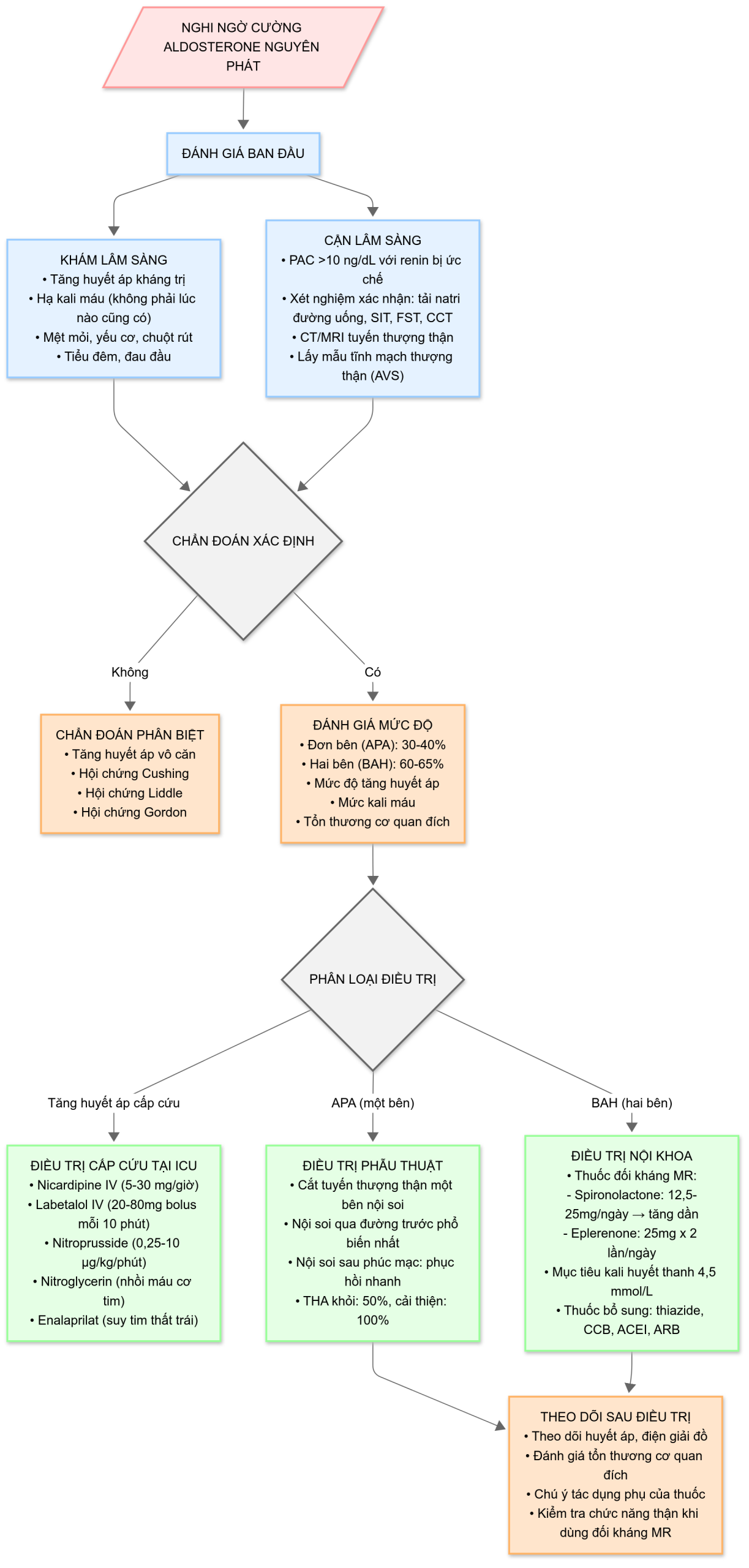
Thuật toán chẩn đoán và điều trị Cường Aldosteron Nguyên phát. Vẽ lược đồ: Bs Lê Đình Sáng
Sàng lọc PA bao gồm đo nồng độ aldosterone và renin huyết tương vào buổi sáng ở bệnh nhân đi lại, ở tư thế ngồi. Nồng độ aldosterone huyết tương (PAC) lớn hơn 10 ng/dL kết hợp với nồng độ renin huyết tương bị ức chế dưới 1 ng/mL mỗi giờ hoặc nồng độ renin dưới giới hạn dưới của khoảng tham chiếu là một xét nghiệm phát hiện ca bệnh dương tính cho PA.
Tuy nhiên, xét nghiệm phát hiện ca bệnh thiếu độ nhạy và độ đặc hiệu. Tất cả các bệnh nhân có xét nghiệm phát hiện ca bệnh dương tính nên được xác nhận PA bằng một xét nghiệm bổ sung. Xét nghiệm xác nhận có thể được hoàn thành bằng một trong bốn phương pháp được khuyến nghị: nghiệm pháp tải natri đường uống với đo lường bài tiết aldosterone qua nước tiểu 24 giờ, nghiệm pháp truyền muối sinh lý (SIT) trong 4 giờ, nghiệm pháp ức chế fludrocortisone (FST), hoặc nghiệm pháp thử thách captopril (CCT). Không có xét nghiệm nào vượt trội hơn xét nghiệm nào, và xét nghiệm thường được chọn dựa trên sở thích của bệnh nhân, chi phí và chuyên môn của địa phương. Tuy nhiên, ở những bệnh nhân bị hạ kali máu tự phát với nồng độ renin không thể phát hiện được và PAC lớn hơn 20 ng/dL, không cần xét nghiệm xác nhận thêm.
Đối với nghiệm pháp tải natri đường uống, lượng muối ăn vào được tăng lên 5 g/ngày trong 3 ngày (được xác nhận bằng hàm lượng natri trong nước tiểu 24 giờ lớn hơn 200 mmol) và kali clorua giải phóng chậm được cung cấp để duy trì kali huyết tương trong giới hạn bình thường. Aldosterone trong nước tiểu được đo trong mẫu nước tiểu 24 giờ thu thập từ sáng ngày 3 đến sáng ngày 4. Nồng độ aldosterone lớn hơn 12 μg/24 giờ ở bệnh nhân có renin bị ức chế xác nhận chẩn đoán PA. SIT nên được thực hiện ở tư thế ngồi với 2 L dung dịch muối sinh lý được truyền trong 4 giờ bắt đầu từ 8:00 sáng. Nồng độ renin, aldosterone, cortisol và kali huyết tương được lấy máu tại thời điểm 0 và 4 giờ. PAC lớn hơn 10 ng/dL xác nhận PA và nồng độ trên 5 ng/dL nhưng dưới 10 ng/dL đại diện cho vùng xám và rất gợi ý đến PA.
FST đòi hỏi phải nhập viện trong 4 ngày và hiện nay hiếm khi được thực hiện.
Đối với CCT, bệnh nhân nhận 25 hoặc 50 mg captopril đường uống khi ngồi. Nồng độ renin, aldosterone và cortisol huyết tương được lấy máu tại thời điểm 0 và 2 giờ sau khi dùng captopril. Ở những bệnh nhân bị PA, aldosterone vẫn tăng cao và renin vẫn bị ức chế sau thử thách.
CHẨN ĐOÁN HÌNH ẢNH
Sau khi chẩn đoán PA được xác nhận, tất cả bệnh nhân nên trải qua chụp CT tuyến thượng thận để xác định vị trí khối u như một xét nghiệm phân loại dưới nhóm ban đầu. Chụp CT cũng cung cấp chi tiết về kích thước của adenoma tuyến thượng thận và bất kỳ đặc điểm nào của ác tính như bờ không đều, thải thuốc chậm, xâm lấn tại chỗ, v.v. Trong tăng sản tuyến thượng thận hai bên, chụp CT có thể cho thấy tuyến thượng thận có vẻ bình thường hoặc có những thay đổi dạng nốt, trong khi APA một bên thường biểu hiện dưới dạng microadenoma (dưới 1 cm) và có thể không nhìn thấy được trên CT. Do đó, chụp CT có thể không chính xác trong gần một nửa các trường hợp với nguy cơ bỏ sót APA hoặc BAH. Nếu một nốt được tìm thấy trên phim CT, nó có thể không có chức năng và không liên quan đến chẩn đoán PA. Nhiều nghiên cứu đã chứng minh rằng chụp CT hoặc MRI nên được sử dụng kết hợp với lấy máu tĩnh mạch tuyến thượng thận (AVS) để xác định chính xác nguồn gốc của PA. Do đó, ở hầu hết tất cả bệnh nhân, AVS là điều kiện tiên quyết trước khi tiến hành phẫu thuật. Mặc dù có một ngoại lệ là không sử dụng AVS ở những bệnh nhân dưới 40 tuổi có PA được xác nhận và hạ kali máu với chức năng thận bình thường, các báo cáo gần đây hơn đã khuyến nghị sử dụng AVS ở tất cả bệnh nhân PA.
LẤY MÁU TĨNH MẠCH TUYẾN THƯỢC THẬN
AVS nên được thực hiện bởi một bác sĩ X-quang can thiệp có kinh nghiệm. Nó có thể được thực hiện đồng thời hoặc tuần tự có hoặc không có sử dụng cosyntropin. Cosyntropin làm tăng lưu lượng máu đến tuyến thượng thận, và do đó các tĩnh mạch thượng thận có thể được đặt ống thông dễ dàng hơn. Kết quả xét nghiệm AVS được giải thích bằng cách đo nồng độ aldosterone trên cortisol (A/C) trong tĩnh mạch thượng thận hai bên và nồng độ A/C trong tĩnh mạch ngoại vi. Tỷ lệ A/C của bên trội so với bên không trội được gọi là chỉ số lệch bên của aldosterone (LI). Nếu AVS được thực hiện sau khi dùng cosyntropin, LI lớn hơn 4 cho thấy nguồn tăng tiết aldosterone một bên. Nếu LI nhỏ hơn 2, thì không có sự lệch bên, điều này cho thấy tăng sản tuyến thượng thận hai bên. Nếu AVS được thực hiện mà không có cosyntropin, thì tỷ lệ LI aldosterone lớn hơn 2 được một số chuyên gia sử dụng như là sự lệch bên dương tính. Khi A/C của tuyến thượng thận không trội thấp hơn A/C của tĩnh mạch ngoại vi, nó được gọi là sự ức chế đối bên và thường được tìm thấy ở những bệnh nhân có bệnh tuyến thượng thận một bên. Khi LI aldosterone nằm trong khoảng từ 2 đến 4, nếu có sự ức chế đối bên, bệnh nhân có khả năng được hưởng lợi từ phẫu thuật cắt tuyến thượng thận một bên.
ĐIỀU TRỊ
Điều trị dựa trên nhiều yếu tố bao gồm sở thích của bệnh nhân, các bệnh đi kèm, tuổi tác và PA một bên so với hai bên. Đối với tăng sản tuyến thượng thận một bên hoặc APA một bên, phẫu thuật cắt tuyến thượng thận một bên qua nội soi được ưu tiên nếu bệnh nhân sẵn lòng phẫu thuật với nguy cơ chấp nhận được. Phương pháp nội soi qua đường trước là phương pháp được thực hiện phổ biến nhất, mặc dù một số trung tâm chuyên khoa cũng thực hiện phương pháp nội soi sau phúc mạc, đây là phương pháp tiếp cận trực tiếp nhất đến tuyến thượng thận với thời gian phẫu thuật ngắn hơn và bệnh nhân phục hồi nhanh hơn (xem phần trước về điều trị phẫu thuật PPGL). Ở gần một nửa số bệnh nhân, tăng huyết áp được chữa khỏi sau khi cắt tuyến thượng thận một bên và tăng huyết áp được cải thiện ở 100% bệnh nhân.
Đối với BAH hoặc những ứng cử viên phẫu thuật kém, liệu pháp nội khoa với thuốc đối kháng thụ thể mineralocorticoid (MR) được khuyến nghị. Spironolactone và eplerenone là hai thuốc đối kháng MR có sẵn. Liều khởi đầu cho spironolactone nên là 12,5 mg đến 25 mg mỗi ngày; cần tăng liều dần dần để tìm ra liều hiệu quả thấp nhất. Liều khởi đầu cho eplerenone nên là 25 mg hai lần mỗi ngày. Liều của thuốc đối kháng MR nên được điều chỉnh để đạt nồng độ kali huyết thanh mục tiêu là 4,5 mmol/L mà không cần bổ sung kali. Với mỗi lần thay đổi liều lượng của thuốc đối kháng MR, nên kiểm tra kali và creatinine huyết thanh sau 7 đến 10 ngày. Cần thận trọng nếu thuốc đối kháng MR được sử dụng ở bệnh nhân bị bệnh thận mạn tính và nên tránh ở bệnh nhân bị bệnh thận giai đoạn IV hoặc cao hơn do nguy cơ tăng kali máu đe dọa tính mạng. Tình trạng tăng thể tích có thể là một cản trở trong việc sử dụng thuốc đối kháng MR như một liệu pháp đơn trị, và ở khoảng 50% bệnh nhân, một thuốc thứ hai, chẳng hạn như lợi tiểu thiazide liều thấp, thuốc chẹn kênh canxi, thuốc ức chế men chuyển angiotensin và thuốc chẹn thụ thể angiotensin, đã được sử dụng như các thuốc thứ cấp trong PA.
ĐIỀU TRỊ NỘI KHOA CẤP CỨU CƠN TĂNG HUYẾT ÁP DO CƯỜNG ALDOSTERON NGUYÊN PHÁT
Việc lựa chọn liệu pháp trong trường hợp cơn tăng huyết áp cấp cứu phụ thuộc vào tổn thương cơ quan đích liên quan. Cần theo dõi chặt chẽ tại đơn vị chăm sóc đặc biệt và sử dụng truyền liên tục các thuốc hạ huyết áp tiêm tĩnh mạch có tác dụng ngắn, có thể điều chỉnh liều để giảm huyết áp nhằm hạn chế thêm tổn thương cơ quan đích. Nicardipine tiêm tĩnh mạch (5 đến 30 mg/giờ) là một thuốc chẹn kênh canxi có thể ngăn ngừa co thắt mạch và rất hữu ích trong các trường hợp bệnh não do tăng huyết áp và đột quỵ xuất huyết. Labetalol (20 đến 80 mg tiêm bolus tĩnh mạch mỗi 10 phút hoặc truyền liên tục với tốc độ 0,5 đến 2 mg/phút) hoặc nitroprusside (0,25 đến 10 μg/kg mỗi phút) cũng là những thuốc được ưu tiên. Trong bối cảnh nhồi máu cơ tim cấp, nitroglycerin (5 đến 100 μg/phút), labetalol (20 đến 80 mg tiêm bolus tĩnh mạch mỗi 10 phút hoặc truyền liên tục 0,5 đến 2 mg/phút), hoặc nitroprusside (0,25 đến 10 μg/kg mỗi phút) có thể được sử dụng để tăng tưới máu mạch vành và giảm hậu gánh. Việc hạ huyết áp tâm trương xuống dưới 60 mmHg có thể có nguy cơ làm giảm tưới máu mạch vành và thận và làm trầm trọng thêm tình trạng thiếu máu cục bộ cơ tim và tổn thương thận cấp, tương ứng. Đối với suy tim trái cấp, nitroglycerin (5 đến 100 μg/phút), nitroprusside (0,25 đến 10 μg/kg mỗi phút), hoặc enalaprilat (1,25 đến 5 mg mỗi 6 giờ) được sử dụng để giảm hậu gánh. Trong suy tim cấp, nên tránh dùng thuốc chẹn β-adrenergic.
Hội chứng Cushing
Hội chứng Cushing (CS) là một nguyên nhân nội tiết hiếm gặp khác của cơn tăng huyết áp cấp cứu. Nó là kết quả của tình trạng tăng cortisol máu, thường do sử dụng glucocorticoid ngoại sinh hoặc do thầy thuốc. Sản xuất nội sinh rất hiếm, với tỷ lệ mắc ước tính là 2 đến 3 trường hợp trên một triệu người mỗi năm. Tăng cortisol máu nội sinh thường do các khối u sản xuất corticotropin (ACTH) ở tuyến yên (bệnh Cushing – CD) trong 70% đến 85% các trường hợp. CS nội sinh do sản xuất ACTH lạc chỗ chiếm 15% các trường hợp và do bệnh lý tuyến thượng thận không phụ thuộc ACTH chiếm 15% các trường hợp.
BIỂU HIỆN LÂM SÀNG
Đặc điểm lâm sàng thay đổi từ bệnh nhân này sang bệnh nhân khác, có thể bao gồm béo phì trung tâm, mặt tròn như mặt trăng, phân bố mỡ ở hố trên đòn, vết rạn da rộng màu tím đỏ, yếu cơ gốc chi, loãng xương, không dung nạp glucose, tăng huyết áp, rối loạn lipid máu, béo phì, dễ bầm tím, rối loạn tâm thần, vô kinh, rậm lông và giảm ham muốn tình dục. Tăng huyết áp phổ biến ở 75% đến 80% các trường hợp CS. Các cơ chế được đề xuất cho tăng huyết áp bao gồm tăng sản xuất deoxycorticosterone, tăng nhạy cảm với catecholamine, angiotensin II, tăng cung lượng tim, tăng sản xuất angiotensinogen ở gan và tác dụng mineralocorticoid của cortisol. Tăng huyết áp trong CS có tương quan đáng kể với thời gian tăng cortisol máu và việc nhận biết sớm là quan trọng. Bệnh tim mạch, nhiễm trùng và huyết khối tĩnh mạch là những nguyên nhân gây tử vong phổ biến nhất trong CS. Rất hiếm khi, CS biểu hiện bằng cơn tăng huyết áp cấp cứu, có thể liên quan đến phù phổi cấp và bệnh não do tăng huyết áp, với chỉ một vài trường hợp được báo cáo.
CHẨN ĐOÁN

Thuật toán chẩn đoán và điều trị Hội chứng Cushing. Vẽ lược đồ: Bs Lê Đình Sáng
Sàng lọc CS nên được xem xét ở những bệnh nhân có các dấu hiệu và triệu chứng phù hợp với tình trạng tăng cortisol máu. Ngoài ra, tất cả các bệnh nhân có khối u tuyến thượng thận phát hiện tình cờ nên được sàng lọc về sự tiết glucocorticoid tự chủ. Hiệp hội Nội tiết khuyến nghị một trong bốn xét nghiệm làm xét nghiệm sàng lọc ban đầu: nghiệm pháp ức chế dexamethasone 1 mg qua đêm (DST); cortisol tự do trong nước tiểu 24 giờ (UFC, hai lần đo); cortisol nước bọt đêm muộn (LNSC, hai lần đo); và nghiệm pháp DST liều thấp 2 ngày chính thức (0,5 mg dexamethasone mỗi 6 giờ × 8 lần). DST qua đêm yêu cầu dùng 1 mg dexamethasone từ 11:00 tối đến nửa đêm và lấy máu đo nồng độ cortisol lúc 8:00 sáng hôm sau. LNSC có thể được thực hiện tại nhà bằng cách sử dụng ống Salivette chuyên dụng (của nhiều nhà sản xuất) để bệnh nhân thu thập mẫu nước bọt lúc 11:00 đêm vào hai đêm riêng biệt. Cortisol huyết thanh lúc 8:00 sáng sau DST 1 mg lớn hơn 1,8 μg/dL, LNSC lớn hơn 145 ng/dL, hoặc nồng độ UFC 24 giờ trên giới hạn trên của mức bình thường được coi là kết quả phát hiện ca bệnh dương tính. Nếu một trong các kết quả xét nghiệm nói trên là dương tính, hãy xem xét thực hiện một hoặc hai xét nghiệm khác và lặp lại xét nghiệm bất thường. Kết quả xét nghiệm dương tính giả có thể thấy trong thai kỳ, trầm cảm, nghiện rượu, đái tháo đường kiểm soát kém, căng thẳng thể chất, tập thể dục cường độ cao, v.v. Nếu hai xét nghiệm dương tính, thì khuyến nghị xét nghiệm thêm để xác định nguyên nhân của CS. Bước đầu tiên là kiểm tra ACTH huyết thanh. Nồng độ ACTH bị ức chế (dưới 10 pg/mL) gợi ý CS không phụ thuộc ACTH do bệnh lý tuyến thượng thận nguyên phát. Chụp CT hoặc MRI vùng bụng được thực hiện trong những trường hợp như vậy để xác định tổn thương tuyến thượng thận một bên hoặc hai bên và giúp phân biệt giữa lành tính và ác tính. CS không phụ thuộc ACTH do adenoma tuyến thượng thận tiết cortisol một bên chiếm 60% và ung thư biểu mô vỏ thượng thận (ACC) chiếm 40% các trường hợp, và rất hiếm khi do bệnh tuyến thượng thận nốt sắc tố nguyên phát (PPNAD) và tăng sản tuyến thượng thận nốt lớn hai bên (BMAH). Trên CT, adenoma tuyến thượng thận tiết cortisol thường có hình tròn đến bầu dục với bờ trơn láng và thường nghèo lipid (lớn hơn 10 HU). Các đặc điểm của ACC trên phim CT bao gồm: kích thước lớn (đường kính trung bình 9 cm) với bờ không đều; hoại tử trong u; xuất huyết và vôi hóa (30% các trường hợp); và nghèo lipid (lớn hơn 20 HU). Trong 9% đến 19% các trường hợp, ACC có thể xâm lấn tĩnh mạch thận hoặc tĩnh mạch chủ dưới. Trên CT có tiêm thuốc cản quang, tỷ lệ thải thuốc cản quang tuyệt đối lớn hơn 60% và tỷ lệ thải thuốc cản quang tương đối lớn hơn 40% cho thấy adenoma tuyến thượng thận với độ nhạy và độ đặc hiệu cao. PPNAD biểu hiện dưới dạng tuyến thượng thận bình thường hoặc hơi to với nhiều nốt nhỏ dưới 6 mm, trong khi BMAH biểu hiện với tuyến thượng thận to lớn và đa nốt.
| Nồng độ ACTH bình thường không phù hợp hoặc tăng cao hơn 20 pg/mL ở bệnh nhân tăng cortisol máu phù hợp với CS phụ thuộc ACTH. Nồng độ ACTH huyết thanh từ 10 đến 20 pg/mL được coi là không xác định và có thể do CS theo chu kỳ hoặc nhẹ hoặc dương tính giả do lỗi phòng xét nghiệm hoặc kháng thể dịophile. |
Dehydroepiandrosterone sulfate (DHEA-S) là một androgen tuyến thượng thận được điều hòa bởi ACTH. Do đó, nồng độ DHEA-S huyết thanh là bình thường hoặc cao trong CD, trong khi nó thấp trong các nguyên nhân lành tính của CS không phụ thuộc ACTH. Đo nồng độ DHEA-S đặc biệt hữu ích ở những bệnh nhân bị tăng cortisol máu dưới lâm sàng (SH) với u tuyến thượng thận phát hiện tình cờ hoặc nồng độ ACTH không xác định. SH là một tình trạng tăng cortisol máu nhưng không có các triệu chứng và dấu hiệu điển hình của tăng cortisol máu. Trong một nghiên cứu, DHEA-S được phát hiện thấp đáng kể ở bệnh nhân SH so với nhóm chứng phù hợp theo tuổi, và nồng độ DHEA-S thấp (dưới 40 μg/dL) có thể được sử dụng như một dấu hiệu chẩn đoán cho SH.
Khi CS phụ thuộc ACTH được xác nhận, bác sĩ lâm sàng phải xác định vị trí nguồn tiết ACTH. CS phụ thuộc tuyến yên thường xảy ra ở phụ nữ và khởi phát chậm và tương đối nhẹ về mức độ dấu hiệu và triệu chứng và mức độ thừa cortisol (ví dụ, UFC 24 giờ dưới 500 μg), trong khi CS phụ thuộc ACTH lạc chỗ xảy ra như nhau ở nam và nữ và thường khởi phát nhanh hơn, với các dấu hiệu và triệu chứng nghiêm trọng hơn và mức độ thừa cortisol cao hơn (ví dụ, UFC 24 giờ lớn hơn 1000 μg). Chụp MRI chuyên biệt cho tuyến yên là bước đầu tiên để phân biệt CS phụ thuộc tuyến yên với ACTH lạc chỗ. Khi một adenoma tuyến yên rõ ràng được phát hiện ở một phụ nữ có khởi phát chậm và CS từ nhẹ đến trung bình, có thể không cần thêm các nghiên cứu định vị nào, trong khi nếu một adenoma tuyến yên nhỏ được phát hiện ở một bệnh nhân bị CS nặng, nó có thể là một khối u tuyến yên không chức năng và cần xét nghiệm thêm. Lấy máu xoang đá dưới hai bên (BIPSS) là xét nghiệm tiêu chuẩn vàng để phân biệt giữa CS phụ thuộc tuyến yên và hội chứng ACTH lạc chỗ; độ nhạy và độ đặc hiệu lớn hơn 95%. Dựa trên kết quả BIPSS, nếu có gradient ACTH trung ương-ngoại vi từ 2,0 trở lên trước khi dùng hormone giải phóng corticotrophin (CRH) và từ 3,0 trở lên sau CRH, thì CD được xác nhận.
| CT hoặc MRI ngực, bụng và xương chậu là bước đầu tiên trong chẩn đoán hình ảnh để xác định vị trí nguồn tiết ACTH lạc chỗ (EAS). CT hoặc MRI không phát hiện được bất kỳ nguồn nào trong khoảng 50% các trường hợp và chẩn đoán hình ảnh chức năng với xạ hình octreotide hoặc PET/CT ⁶⁸Ga-DOTATATE là bước tiếp theo. Chẩn đoán hình ảnh PET/CT ⁶⁸Ga-DOTATATE đã cho thấy kết quả hứa hẹn trong việc xác định nguồn EAS ở 18 trong số 22 bệnh nhân trong một nghiên cứu gần đây. |
ĐIỀU TRỊ
Phẫu thuật
Phẫu thuật tuyến yên là phương pháp điều trị ban đầu được khuyến nghị cho CD với tỷ lệ thuyên giảm chung là 80%, trong khi phẫu thuật nhắm vào tuyến thượng thận là lựa chọn điều trị cho tất cả các dạng CS nguyên phát tại tuyến thượng thận. Nếu có nghi ngờ về ung thư biểu mô vỏ thượng thận, nên thử phương pháp nội soi qua đường trước với ngưỡng chuyển sang phẫu thuật cắt tuyến thượng thận mở thấp. Bác sĩ phẫu thuật nên chuẩn bị cho việc cắt bỏ phẫu thuật rộng hơn trong trường hợp xâm lấn vào các cơ quan xung quanh như tĩnh mạch chủ dưới (IVC) hoặc gan (bên phải), và lách, tụy, dạ dày, hoặc đại tràng (bên trái). Trong trường hợp ung thư biểu mô vỏ thượng thận sản xuất cortisol rõ ràng, khả năng huyết khối IVC lan đến tâm nhĩ phải cần được đánh giá trước phẫu thuật bằng các nghiên cứu hình ảnh. Nếu có, một bác sĩ phẫu thuật tim mạch nên tham gia với sự hiểu biết rằng việc loại bỏ huyết khối tâm nhĩ có thể cần đến tuần hoàn ngoài cơ thể. Cắt tuyến thượng thận một bên là phương pháp điều trị được ưu tiên ở những bệnh nhân có adenoma tuyến thượng thận tiết cortisol. Cắt tuyến thượng thận hai bên qua nội soi có thể cần thiết cho những bệnh nhân mắc bệnh phụ thuộc tuyến yên khi bệnh nhân không được chữa khỏi bằng phẫu thuật tuyến yên hoặc ở những bệnh nhân có hội chứng ACTH lạc chỗ khi khối u tiết ACTH không thể được định vị hoặc không thể cắt bỏ. Trong những trường hợp đó, việc thay thế glucocorticoid và mineralocorticoid suốt đời là cần thiết. Ở những bệnh nhân mắc bệnh phụ thuộc tuyến yên và những người mắc bệnh phụ thuộc tuyến thượng thận một bên, việc thay thế glucocorticoid sau phẫu thuật là cần thiết cho đến khi trục hạ đồi-tuyến yên-tuyến thượng thận phục hồi (thường từ 6 đến 12 tháng).
Xạ trị
Khi phẫu thuật tuyến yên không chữa khỏi bệnh ở bệnh nhân CD, xạ trị có thể được xem xét nếu mức độ CS nhẹ. Xạ trị được thực hiện tối ưu bằng phương pháp lập thể. Điều trị nội khoa là cần thiết cho đến khi xạ trị có hiệu quả. Tác dụng phụ của xạ trị tuyến yên là các mức độ suy tuyến yên khác nhau.
Điều trị nội khoa
Điều trị nội khoa là lựa chọn điều trị hàng thứ hai ở những bệnh nhân mà phẫu thuật không chữa khỏi hoặc cho những người là ứng cử viên phẫu thuật kém. Các phương pháp điều trị nội khoa có sẵn bao gồm: thuốc ức chế sinh tổng hợp steroid (ví dụ: ketoconazole, metyrapone, mitotane, etomidate); chất chủ vận thụ thể somatostatin; chất chủ vận dopamine; và thuốc đối kháng thụ thể glucocorticoid (ví dụ: mifepristone). Liệu pháp phối hợp được yêu cầu trong một số trường hợp ở liều thấp để đạt được kiểm soát cortisol. Bệnh nhân được điều trị bằng liệu pháp nội khoa có nguy cơ bị suy thượng thận và nên được tư vấn về nguy cơ khủng hoảng thượng thận và việc sử dụng glucocorticoid khẩn cấp. Bảng 12.2 cho thấy các loại thuốc khác nhau, cơ chế tác dụng, liều lượng và ảnh hưởng của chúng đối với cortisol và huyết áp.
Bảng 12.2 Các loại thuốc thông thường cho tình trạng tăng Cortisol máu nội sinh
| Thuốc | Cơ chế tác dụng | Kiểm soát hormone Liều | Kiểm soát HA |
|---|---|---|---|
| Cabergoline | Chất chủ vận Dopamine | 25%-40% Uống 0,5-7 mg/tuần | Giảm |
| Pasireotide | Chất tương tự Somatostatin, SSRT5 | 20%-62% TC DD 0,3-1,8 mg/ngày Hai lần một ngày | Giảm |
| Metyrapone | Chất ức chế 11β-hydroxylase | 45%-100% Uống, 0,5-6 g/ngày 3-4 lần/ngày | Trung tính |
| Ketoconazole | Chất ức chế 11β-hydroxylase và 17α-hydroxylase | ~50% Uống 200-1200 mg/ngày 2-3 lần/ngày | Giảm |
| Osilodrostat | Chất ức chế 11β-hydroxylase và aldosterone synthase | ~90% Uống, 4-60 mg/ngày 2 lần/ngày | Trung tính |
| Mitotane | Ức chế tổng hợp steroid, chất gây độc tế bào thượng thận | ~70% Uống, 2-5 g/ngày 2-3 lần/ngày | Giảm |
| Mifepristone | Chất đối kháng thụ thể Glucocorticoid | Không áp dụng Uống, 300-1200 mg/ngày một lần mỗi ngày | Tăng/ giảm |
HA, Huyết áp; TC DD, tiêm dưới da.
ĐIỀU TRỊ NỘI KHOA CẤP CỨU CƠN TĂNG HUYẾT ÁP DO TĂNG CORTISOL MÁU
Phù phổi cấp hoặc bệnh não do tăng huyết áp, mặc dù rất hiếm, là những biểu hiện phổ biến hơn của cơn tăng huyết áp cấp cứu ở bệnh nhân CS. Trong những trường hợp này, việc quản lý tại đơn vị chăm sóc đặc biệt là cần thiết để ngăn ngừa thêm tổn thương cơ quan đích. Các loại thuốc hạ huyết áp tiêm tĩnh mạch cho phù phổi cấp và bệnh não do tăng huyết áp bao gồm: nicardipine (5 đến 30 mg/giờ), có thể làm giảm co thắt mạch; labetalol (20 đến 80 mg tiêm bolus tĩnh mạch mỗi 10 phút hoặc truyền liên tục 0,5 đến 2 mg/phút); và nitroprusside (0,25 đến 10 μg/kg mỗi phút). Nitroglycerin (5 đến 100 μg/phút), nitroprusside (0,25 đến 10 μg/kg mỗi phút), hoặc enalaprilat (1,25 đến 5 mg mỗi 6 giờ) có thể được sử dụng để giảm hậu gánh.
Đã có các nghiên cứu báo cáo về việc truyền liên tục etomidate để kiểm soát CS nặng. Etomidate, một dẫn xuất imidazole tương tự như ketoconazole, thường được sử dụng như một thuốc khởi mê để đặt nội khí quản, làm giảm nhanh quá trình sinh tổng hợp steroid bằng cách ức chế 11β-hydroxylase và ức chế enzyme cắt chuỗi bên. Trong một nghiên cứu, etomidate được bắt đầu với tốc độ 0,02 đến 0,04 mg/kg mỗi giờ (tăng liều theo từng bậc 0,01 đến 0,02 mg/kg mỗi giờ) và cortisol huyết thanh được đo mỗi 6 giờ để nhắm đến nồng độ cortisol từ 10 đến 20 μg/dL và như một cầu nối đến phẫu thuật.
TÀI LIỆU THAM KHẢO
- Brathwaite L, Reif M. Hypertensive emergencies: a review of common presentations and treatment options. Cardiol Clin. 2019;37(3):275-286.
- Pappachan JM, Buch HN. Endocrine hypertension: a practical approach. Adv Exp Med Biol. 2017; 956:215-237.
- Davison AS, Jones DM, Ruthven S, Helliwell T, Shore SL. Clinical evaluation and treatment of phaeochromocytoma. Ann Clin Biochem. 2018;55(1):34-48.
- Jacques WML, Graeme E. Update on modern management of pheochromocytoma and paraganglioma. Endocrinol Metab. 2017;32(2):152-161.
- Pappachan JM, Tunn NN, Arunagirinathan G, Sodi R, Hanna FWF. Pheochromocytomas and hypertension. Curr Hyperten Rep. 2018;20(1):3.
- Eisenhofer G, Peitzsch M. Laboratory evaluation of pheochromocytoma and paraganglioma. Chem. 2014;60:1486-1499.
- van Berkel A, Lenders JW, Timmers HJ. Diagnosis of endocrine disease: biochemical diagnosis of phaeochromocytoma and paraganglioma. Eur J Endocrinol. 2014;170(3):R109-R119.
- Buitenwerf E, Berends AMA, van Asselt ADI, et al. Diagnostic accuracy of computed tomography to exclude pheochromocytoma: a systematic review, meta-analysis, and cost analysis. Mayo Clin Proc. 2019;94(10):2040-2052.
- Filip C, Pavel K, Schovneck J. Current diagnostic imaging of pheochromocytomas and implications for therapeutic strategy. Exp Ther Med. 2018;15(4):3151-3160.
- Taieb D, Timmers HJ, Hindie E, et al. EANM 2012 guidelines for radionuclide imaging of phaeochromocytoma and paraganglioma. Eur J Nucl Med Mol Imaging. 2012;39:1977-1995.
- Dahia PL. Pheochromocytoma and paraganglioma pathogenesis: learning from genetic heterogeneity. Nat Rev Cancer. 2014;14(2):108-119.
- Challis BG, Casey RT, Simpson HLD, Gurnell M. Is there optimal preoperative management strategy for phaeochromocytoma/paraganglioma? Clin Endocrinol (Oxf). 2017;86(2):163-167.
- van der Zee PA, de Boer A. Pheochromocytoma: a review on preoperative treatment with phenoxybenzamine or doxazosin. Neth J Med. 2014;72:190-201.
- Muiesan ML, Salvetti M, Amadoro V, et al. An update on hypertensive emergencies and urgencies. J Cardiovasc Med. 2015;16(5):372-382.
- Neumann HPH, Tsoy U, Bancos I, et al. International Bilateral-Pheochromocytoma-Registry Group. Comparison of pheochromocytoma-specific morbidity and mortality among adults with bilateral pheochromocytomas undergoing total adrenalectomy vs cortical-sparing adrenalectomy. JAMA Netw Open. 2019;2(8):e198898.
- Walz MK, Alesina PF, Wenger FA, et al. Laparoscopic and retroperitoneoscopic treatment of pheochromocytomas and retroperitoneal paragangliomas: results of 161 tumors in 126 patients. World J Surg. 2006;30(5):899-908.
- Thompson LD. Pheochromocytoma of the adrenal gland scaled score (PASS) to separate benign from malignant neoplasms: a clinicopatholoci and immunopheotypic study of 100 cases. Am J Surg Pathol. 2002;26(5):551-566.
- Plouin PF, Amar L, Dekkers OM, et al. European Society of Endocrinology clinical practice guideline for long-term follow-up of patients operated on for a phaeochromocytoma or a paraganglioma. Eur J Endocrinol. 2016;174:G1-G10.
- Amar L, Lussey-Lepoutre C, Lenders JW, Djadi-Prat J, Plouin PF, Steichen O. Management of endocrine disease: recurrence or new tumors after complete resection of pheochromocytomas and paragangliomas: a systematic review and meta-analysis. Eur J Endocrinol. 2016;175:R135-R145.
- John WF, Robert MC, Franco M, et al. The management of primary aldosteronism: case detection, diagnosis, and treatment. J Clin Endocrinol Metab. 2016;101:1889-1916.
- Aronova A, Fahey III TJ, Zarnegar R. Management of hypertension in primary aldosteronism. World J Cardiol. 2014;6(5):227-233.
- Vaidya A, Malchoff CD, Auchus RJ. An individualized approach to the evaluation and management of primary aldosteronism. Endocr Pract. 2017;23(6):680-689.
- Mathur A, Kemp CD, Dutta U, et al. Consequences of adrenal venous sampling in primary hyperaldosteronism and predictors of unilateral adrenal disease. J Am Coll Surg. 2010;211(3):384-390.
- Rossi GP, Rossitto G, Amar L, et al. Clinical outcomes of 1625 patients with primary aldosteronism subtyped with adrenal vein sampling. Hypertension. 2019;74(4):800-808.
- Asmar M, Wachtel H, Yan Y, Fraker DL, Cohen D, Trerotola SO. Reversing the established order: should adrenal venous sampling precede cross-sectional imaging in the evaluation of primary aldosteronism? J Surg Oncol. 2015;112(2):144-148.
- Vilela LAP, Almeida MQ. Diagnosis and management of primary aldosteronism. Arch Endocrinol Metgab. 2017;61(3):305-312.
- Walz MK, Gwosdz R, Levin SL, et al. Retroperitoneoscopic adrenalectomy in Conn’s syndrome caused by adrenal adenomas or nodular hyperplasia. World J Surg. 2008;32(5):847-853.
- Williams TA, Reincke M. Management of endocrine disease: diagnosis and management of primary aldosteronism: the Endocrine Society guideline 2016 revisited. Eur J Endocrinol. 2018;179(1):R19-R29.
- Nieman LK, Biller BMK, Findling JW, et al. Treatment of Cushing’s syndrome: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2015;100(8):2807-2831.
- Young Jr WF, Calhoun DA, Lenders JWM, Stowasser S, Textor SC. Screening for endocrine hypertension: an Endocrine Society scientific statement. Endocrine Rev. 2017;38(2):103-122.
- Alagoma I, Arthur O. Hypertensive encephalopathy as the initial manifestation of Cushing’s syndrome. J Med Res. 2016;2(6):144-145.
- Isidori AM, Sbardella E, Zatelli MC. Conventional and nuclear medicine imaging in ectopic Cushing’s syndrome: a systematic review. J Clin Endocrinol Metab. 2015;100(9):3231-3244.
- Nicolaus AWB, Ali B, Mouhammed AH, et al. Cushing syndrome: diagnostic workup and imaging features, with clinical and pathological correlation. Am J Roentgenol. 2017;209(1):19-32.
- Dennedy MC, Annamalai AK, Prankerd-Smith O, et al. Low DHEAS: a sensitive and specific test for the detection of subclinical hypercortisolism in adrenal incidentalomas. J Clin Endocrinol Metab. 2017;102(3):786-792.
- Yener S, Yilmaz H, Demir T, Secil M, Comlekci A. DHEAS for the prediction of subclinical Cushing’s syndrome: perplexing or advantageous? Endocrine. 2015;48(2):669-676.
- Susmeeta TS. An individualized approach to the evaluation of Cushing syndrome. Endocr Pract. 2017; 23(6):726-737.
- Andre L, Richard AF, Constatine AS, Lynnette KN. Cushing’s syndrome. Lancet. 2015;386(9996):913-927.
- Marina SZ, Lynnette KN. Utility of various functional and anatomic imaging modalities for detection of ectopic adrenocorticotropin-secreting tumors. J Clin Endocrinol Metab. 2010;95(3):1207-1219.
- Barbot M, Ceccato F, Scaroni C. The pathophysiology and treatment of hypertension in patient with Cushing’s syndrome. Front Endocrinol (Lausanne). 2019;10:321.
- Lenders JW, Duh QY, Eisenhofer G, et al. Pheochromocytoma and paraganglioma: an endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2014;99:1915-1942.
- Carroll Ty B, Peppard WJ, Hermann DJ, et al. Continuous etomidate infusion for management of severe Cushing syndrome: validation of a standard protocol. J Endocr Soc. 2019;3(1):1-12.
Bảng chú giải thuật ngữ Y học Anh – Việt
| STT | Thuật ngữ tiếng Anh | Cách phát âm | Nghĩa Tiếng Việt |
|---|---|---|---|
| 1 | Hypertensive emergency | /ˌhaɪ.pərˈtɛn.sɪv ɪˈmɜːr.dʒən.si/ | Cơn tăng huyết áp cấp cứu |
| 2 | Systolic blood pressure | /sɪˈstɒl.ɪk blʌd ˈprɛʃ.ər/ | Huyết áp tâm thu |
| 3 | Diastolic blood pressure | /ˌdaɪ.əˈstɒl.ɪk blʌd ˈprɛʃ.ər/ | Huyết áp tâm trương |
| 4 | End organ damage | /ɛnd ˈɔːr.ɡən ˈdæm.ɪdʒ/ | Tổn thương cơ quan đích |
| 5 | Endocrine conditions | /ˌɛn.doʊ.krɪn kənˈdɪʃ.ənz/ | Bệnh lý nội tiết |
| 6 | Essential hypertension | /ɪˈsɛn.ʃəl ˌhaɪ.pərˈtɛn.ʃən/ | Tăng huyết áp vô căn |
| 7 | Morbidity | /mɔːrˈbɪd.ə.ti/ | Bệnh suất |
| 8 | Mortality | /mɔːrˈtæl.ə.ti/ | Tử suất |
| 9 | Targeted therapy | /ˈtɑːr.ɡɪ.tɪd ˈθɛr.ə.pi/ | Điều trị nhắm đích |
| 10 | Stroke | /stroʊk/ | Đột quỵ |
| 11 | Myocardial infarction | /ˌmaɪ.oʊˈkɑːr.di.əl ɪnˈfɑːrk.ʃən/ | Nhồi máu cơ tim |
| 12 | Physical examination | /ˈfɪz.ɪ.kəl ɪɡˌzæm.ɪˈneɪ.ʃən/ | Khám thực thể |
| 13 | Hypertension (HTN) | /ˌhaɪ.pərˈtɛn.ʃən/ | Tăng huyết áp |
| 14 | Pheochromocytoma | /ˌfiː.oʊˌkroʊ.moʊ.saɪˈtoʊ.mə/ | U tủy thượng thận |
| 15 | Paraganglioma (PPGL) | /ˌpær.əˌɡæŋ.ɡliˈoʊ.mə/ | U cận hạch |
| 16 | Primary hyperaldosteronism | /ˈpraɪ.mər.i ˌhaɪ.pərˌæl.doʊˈstɛr.əˌnɪz.əm/ | Cường aldosteron nguyên phát |
| 17 | Cushing’s syndrome (CS) | /ˈkʊʃ.ɪŋz ˈsɪn.droʊm/ | Hội chứng Cushing |
| 18 | Cushing’s disease (CD) | /ˈkʊʃ.ɪŋz dɪˈziːz/ | Bệnh Cushing |
| 19 | Adrenal glands | /əˈdriː.nəl ɡlændz/ | Tuyến thượng thận |
| 20 | Chromaffin cells | /ˈkroʊ.mə.fɪn sɛlz/ | Tế bào ưa crôm |
| 21 | Adrenal medulla | /əˈdriː.nəl məˈdʌl.ə/ | Tủy thượng thận |
| 22 | Extra-adrenal tumors | /ˈɛk.strə əˈdriː.nəl ˈtuː.mərz/ | Khối u ngoài tuyến thượng thận |
| 23 | Sympathetic chain ganglia | /ˌsɪm.pəˈθɛt.ɪk tʃeɪn ˈɡæŋ.ɡli.ə/ | Hạch chuỗi giao cảm |
| 24 | Adrenal incidentaloma | /əˈdriː.nəl ɪn.sɪˌdɛn.təˈloʊ.mə/ | U tuyến thượng thận phát hiện tình cờ |
| 25 | Epinephrine | /ˌɛp.ɪˈnɛf.rɪn/ | Epinephrine |
| 26 | Norepinephrine | /ˌnɔːr.ˌɛp.ɪˈnɛf.rɪn/ | Norepinephrine |
| 27 | Dopamine | /ˈdoʊ.pə.miːn/ | Dopamine |
| 28 | Phenylethanolamine-N-methyl transferase | /ˌfɛn.əlˌɛθ.əˈnoʊl.əˌmiːn ɛn ˈmɛθ.əl ˈtræns.fəˌreɪs/ | Phenylethanolamine-N-methyl transferase |
| 29 | Adrenaline | /əˈdrɛn.əl.ɪn/ | Adrenaline |
| 30 | Cardiac output | /ˈkɑːr.di.æk ˈaʊt.pʊt/ | Cung lượng tim |
| 31 | Acute stress | /əˈkjuːt strɛs/ | Stress cấp tính |
| 32 | “Fight or flight” response | /faɪt ɔːr flaɪt rɪˈspɒns/ | Phản ứng “chiến đấu hay bỏ chạy” |
| 33 | Vasoconstriction | /ˌveɪ.zoʊ.kənˈstrɪk.ʃən/ | Co mạch |
| 34 | Skull base | /skʌl beɪs/ | Nền sọ |
| 35 | Parasympathetic origin | /ˌpær.əˌsɪm.pəˈθɛt.ɪk ˈɒr.ɪ.dʒɪn/ | Nguồn gốc đối giao cảm |
| 36 | 3-methoxytyramine | /θriː mɛˌθɒk.siˈtaɪ.rəˌmiːn/ | 3-methoxytyramine |
| 37 | Benign tumors | /bɪˈnaɪn ˈtuː.mərz/ | Khối u lành tính |
| 38 | Malignant tumors | /məˈlɪɡ.nənt ˈtuː.mərz/ | Khối u ác tính |
| 39 | Germline pathogenic variants | /ˈdʒɜːrm.laɪn ˌpæθ.əˈdʒɛn.ɪk ˈvɛər.i.ənts/ | Biến thể dòng mầm bệnh lý |
| 40 | Succinate dehydrogenase subunit B (SDHB) | /ˈsʌk.sɪˌneɪt diːˌhaɪˈdrɒdʒ.əˌneɪs ˈsʌbˌjuː.nɪt biː/ | Phân đơn vị B của succinate dehydrogenase |
| 41 | Tumor invasion | /ˈtuː.mər ɪnˈveɪ.ʒən/ | Khối u xâm lấn |
| 42 | Multifocal tumors | /ˌmʌl.tiˈfoʊ.kəl ˈtuː.mərz/ | Khối u đa ổ |
| 43 | Dopaminergic biochemical phenotype | /ˌdoʊ.pə.mɪˈnɜːr.dʒɪk ˌbaɪ.oʊˈkɛm.ɪ.kəl ˈfiː.noʊ.taɪp/ | Kiểu hình sinh hóa tiết dopamine |
| 44 | Classic triad | /ˈklæs.ɪk ˈtraɪ.æd/ | Tam chứng kinh điển |
| 45 | Headache | /ˈhɛd.eɪk/ | Đau đầu |
| 46 | Palpitations | /ˌpæl.pɪˈteɪ.ʃənz/ | Đánh trống ngực |
| 47 | Excessive sweating | /ɪkˈsɛs.ɪv ˈswɛt.ɪŋ/ | Vã mồ hôi |
| 48 | Paroxysmal hypertension | /ˌpær.əkˈsɪz.məl ˌhaɪ.pərˈtɛn.ʃən/ | Tăng huyết áp kịch phát |
| 49 | Catecholamine excess | /ˌkæt.əˈkoʊ.ləˌmiːn ɪkˈsɛs/ | Thừa catecholamine |
| 50 | Cardiac vasospasm | /ˈkɑːr.di.æk ˈveɪ.zoʊˌspæz.əm/ | Co thắt mạch tim |
| 51 | Acute aortic dissection | /əˈkjuːt eɪˈɔːr.tɪk daɪˈsɛk.ʃən/ | Bóc tách động mạch chủ cấp |
| 52 | Pheochromocytoma crisis | /ˌfiː.oʊˌkroʊ.moʊ.saɪˈtoʊ.mə ˈkraɪ.sɪs/ | Cơn u tủy thượng thận |
| 53 | Hyperthermia | /ˌhaɪ.pərˈθɜːr.mi.ə/ | Sốt cao |
| 54 | Encephalopathy | /ɛnˌsɛf.əˈlɒp.ə.θi/ | Bệnh não |
| 55 | Multiorgan failure | /ˌmʌl.tiˈɔːr.ɡən ˈfeɪl.jər/ | Suy đa tạng |
| 56 | Pulmonary edema | /ˈpʊl.məˌnɛr.i əˈdiː.mə/ | Phù phổi |
| 57 | Circulatory collapse | /ˈsɜːr.kjə.ləˌtɔː.ri kəˈlæps/ | Trụy tuần hoàn |
| 58 | Lipid poor | /ˈlɪp.ɪd pʊər/ | Nghèo lipid |
| 59 | Normotensive | /ˌnɔːr.moʊˈtɛn.sɪv/ | Huyết áp bình thường |
| 60 | β-adrenergic blocker | /ˈbeɪ.tə ˌæd.rəˈnɜːr.dʒɪk ˈblɒk.ər/ | Thuốc chẹn β-adrenergic |
| 61 | Corticosteroids | /ˌkɔːr.tɪ.koʊˈstɛr.ɔɪdz/ | Corticosteroid |
| 62 | Anesthesia | /ˌæn.əsˈθiː.ʒə/ | Gây mê |
| 63 | Hereditary risk | /həˈrɛd.ɪˌtɛr.i rɪsk/ | Nguy cơ di truyền |
| 64 | First-degree relatives | /fɜːrst dɪˈɡriː ˈrɛl.ə.tɪvz/ | Người thân cấp một |
| 65 | Biochemical testing | /ˌbaɪ.oʊˈkɛm.ɪ.kəl ˈtɛst.ɪŋ/ | Xét nghiệm sinh hóa |
| 66 | Plasma free metanephrines | /ˈplæz.mə friː ˌmɛt.əˈnɛf.rɪnz/ | Metanephrine tự do trong huyết tương |
| 67 | Urinary fractionated metanephrines | /ˈjʊər.ɪˌnɛr.i ˈfræk.ʃəˌneɪ.tɪd ˌmɛt.əˈnɛf.rɪnz/ | Metanephrine phân đoạn trong nước tiểu |
| 68 | Liquid chromatography | /ˈlɪk.wɪd ˌkroʊ.məˈtɒɡ.rə.fi/ | Sắc ký lỏng |
| 69 | Mass spectrometric | /mæs ˌspɛk.trəˈmɛt.rɪk/ | Khối phổ |
| 70 | Sensitivity | /ˌsɛn.sɪˈtɪv.ə.ti/ | Độ nhạy |
| 71 | Specificity | /ˌspɛs.ɪˈfɪs.ə.ti/ | Độ đặc hiệu |
| 72 | Supine position | /ˈsuː.paɪn pəˈzɪʃ.ən/ | Tư thế nằm ngửa |
| 73 | False positive results | /fɔːls ˈpɒz.ə.tɪv rɪˈzʌlts/ | Kết quả dương tính giả |
| 74 | Levodopa | /ˌliː.voʊˈdoʊ.pə/ | Levodopa |
| 75 | Tricyclic antidepressants | /ˌtraɪˈsaɪ.klɪk ˌæn.ti.dɪˈprɛs.ənts/ | Thuốc chống trầm cảm ba vòng |
| 76 | Antipsychotics | /ˌæn.ti.saɪˈkɒt.ɪks/ | Thuốc chống loạn thần |
| 77 | Cardiac ischemia | /ˈkɑːr.di.æk ɪˈskiː.mi.ə/ | Thiếu máu cục bộ cơ tim |
| 78 | Hypoglycemia | /ˌhaɪ.poʊ.ɡlaɪˈsiː.mi.ə/ | Hạ đường huyết |
| 79 | Intensive care units | /ɪnˈtɛn.sɪv kɛər ˈjuː.nɪts/ | Đơn vị chăm sóc đặc biệt |
| 80 | Clonidine suppression test | /ˈklɒn.ɪ.diːn səˈprɛʃ.ən tɛst/ | Nghiệm pháp ức chế clonidine |
| 81 | Computed tomography (CT) | /kəmˈpjuː.tɪd təˈmɒɡ.rə.fi/ | Chụp cắt lớp vi tính |
| 82 | Magnetic resonance imaging (MRI) | /mæɡˈnɛt.ɪk ˈrɛz.ə.nəns ˈɪm.ɪ.dʒɪŋ/ | Chụp cộng hưởng từ |
| 83 | Spatial resolution | /ˈspeɪ.ʃəl ˌrɛz.əˈluː.ʃən/ | Độ phân giải không gian |
| 84 | Metastatic disease | /ˌmɛt.əˈstæt.ɪk dɪˈziːz/ | Bệnh di căn |
| 85 | CT attenuation value | /siː tiː əˌtɛn.juˈeɪ.ʃən ˈvæl.juː/ | Giá trị đậm độ CT |
| 86 | Hounsfield units (HU) | /ˈhaʊnz.fiːld ˈjuː.nɪts/ | Đơn vị Hounsfield |
| 87 | Anatomic location | /ˌæn.əˈtɒm.ɪk loʊˈkeɪ.ʃən/ | Vị trí giải phẫu |
| 88 | Homogeneous tissue | /ˌhoʊ.məˈdʒiː.ni.əs ˈtɪʃ.uː/ | Mô đồng nhất |
| 89 | Central necrosis | /ˈsɛn.trəl nɛˈkroʊ.sɪs/ | Hoại tử trung tâm |
| 90 | Peripheral rim | /pəˈrɪf.ər.əl rɪm/ | Vành ngoại vi |
| 91 | Adrenal carcinoma | /əˈdriː.nəl ˌkɑːr.sɪˈnoʊ.mə/ | Ung thư biểu mô tuyến thượng thận |
| 92 | Metastasis | /məˈtæs.tə.sɪs/ | Di căn |
| 93 | Lipid-rich adenomas | /ˈlɪp.ɪd rɪtʃ ˌæd.əˈnoʊ.məz/ | Adenoma giàu lipid |
| 94 | Intracytoplasmic lipids | /ˌɪn.trəˌsaɪ.toʊˈplæz.mɪk ˈlɪp.ɪdz/ | Lipid nội bào tương |
| 95 | Contrast washout | /ˈkɒn.træst ˈwɒʃ.aʊt/ | Thải thuốc cản quang |
| 96 | Functional imaging | /ˈfʌŋk.ʃən.əl ˈɪm.ɪ.dʒɪŋ/ | Chẩn đoán hình ảnh chức năng |
| 97 | Iodine-123-metaiodobenzylguanidine (¹²³I-MIBG) | /…/ | Iodine-123-metaiodobenzylguanidine |
| 98 | Scintigraphy | /sɪnˈtɪɡ.rə.fi/ | Xạ hình |
| 99 | Gallium 68 (⁶⁸Ga) DOTATATE PET CT | /…/ | Chụp PET CT với Gallium 68 DOTATATE |
| 100 | ¹⁸F-fluorodeoxyglucose (¹⁸F-FDG) PET CT | /…/ | Chụp PET CT với ¹⁸F-fluorodeoxyglucose |
| 101 | Susceptibility genes | /səˌsɛp.tɪˈbɪl.ə.ti dʒiːnz/ | Gen nhạy cảm |
| 102 | RET proto-oncogene | /…/ | Tiền-oncogen RET |
| 103 | Multiple endocrine neoplasia (MEN) | /ˈmʌl.tɪ.pəl ˈɛn.doʊ.krɪn ˌniː.oʊˈpleɪ.ʒə/ | Đa u nội tiết |
| 104 | Von Hippel-Lindau (VHL) | /vɒn ˈhɪp.əl ˈlɪn.daʊ/ | Von Hippel-Lindau |
| 105 | Neurofibromatosis type 1 (NF1) | /ˌnʊər.oʊ.faɪˌbroʊ.məˈtoʊ.sɪs taɪp wʌn/ | U xơ thần kinh týp 1 |
| 106 | Aggressive metastatic disease | /əˈɡrɛs.ɪv ˌmɛt.əˈstæt.ɪk dɪˈziːz/ | Bệnh di căn xâm lấn |
| 107 | Bilateral adrenal tumors | /baɪˈlæt.ər.əl əˈdriː.nəl ˈtuː.mərz/ | U tuyến thượng thận hai bên |
| 108 | Preoperative medical management | /ˌpriːˈɒp.ər.ə.tɪv ˈmɛd.ɪ.kəl ˈmæn.ɪdʒ.mənt/ | Điều trị nội khoa trước phẫu thuật |
| 109 | Catecholamine surge | /ˌkæt.əˈkoʊ.ləˌmiːn sɜːrdʒ/ | Tăng vọt catecholamine |
| 110 | Hemodynamic instability | /ˌhiː.moʊ.daɪˈnæm.ɪk ˌɪn.stəˈbɪl.ə.ti/ | Bất ổn huyết động |
| 111 | Electrocardiogram | /ɪˌlɛk.troʊˈkɑːr.di.oʊ.ɡræm/ | Điện tâm đồ |
| 112 | Echocardiogram | /ˌɛk.oʊˈkɑːr.di.oʊ.ɡræm/ | Siêu âm tim |
| 113 | α-adrenergic blocking agents | /ˈæl.fə ˌæd.rəˈnɜːr.dʒɪk ˈblɒk.ɪŋ ˈeɪ.dʒənts/ | Thuốc chẹn alpha-adrenergic |
| 114 | Phenoxybenzamine | /fəˌnɒk.siˈbɛn.zəˌmiːn/ | Phenoxybenzamine |
| 115 | Doxazosin | /dɒkˈseɪ.zə.sɪn/ | Doxazosin |
| 116 | Half-life | /ˈhæf laɪf/ | Thời gian bán hủy |
| 117 | Orthostasis | /ˌɔːr.θəˈsteɪ.sɪs/ | Hạ huyết áp tư thế |
| 118 | Tachycardia | /ˌtæk.ɪˈkɑːr.di.ə/ | Nhịp tim nhanh |
| 119 | Retrograde ejaculation | /ˌrɛt.roʊ.ɡreɪd ɪˌdʒæk.jəˈleɪ.ʃən/ | Xuất tinh ngược dòng |
| 120 | Vasopressor support | /ˌveɪ.zoʊˈprɛs.ər səˈpɔːrt/ | Hỗ trợ thuốc vận mạch |
| 121 | Vasodilation | /ˌveɪ.zoʊ.daɪˈleɪ.ʃən/ | Giãn mạch |
| 122 | Calcium channel blocking agents | /ˈkæl.si.əm ˈtʃæn.əl ˈblɒk.ɪŋ ˈeɪ.dʒənts/ | Thuốc chẹn kênh canxi |
| 123 | Tachyarrhythmia | /ˌtæk.i.əˈrɪð.mi.ə/ | Rối loạn nhịp tim nhanh |
| 124 | Coronary vasospasm | /ˈkɒr.əˌnɛr.i ˈveɪ.zoʊˌspæz.əm/ | Co thắt mạch vành |
| 125 | Metoprolol | /məˈtoʊ.prəˌlɒl/ | Metoprolol |
| 126 | Atenolol | /əˈtɛn.əˌlɒl/ | Atenolol |
| 127 | Cardio-selective | /ˌkɑːr.di.oʊ sɪˈlɛk.tɪv/ | Chọn lọc trên tim |
| 128 | Comorbidities | /ˌkoʊ.mɔːrˈbɪd.ə.tiz/ | Bệnh đi kèm |
| 129 | Chronic kidney disease | /ˈkrɒn.ɪk ˈkɪd.ni dɪˈziːz/ | Bệnh thận mạn tính |
| 130 | Perioperative morbidity | /ˌpɛr.iˈɒp.ər.ə.tɪv mɔːrˈbɪd.ə.ti/ | Bệnh suất chu phẫu |
| 131 | Phentolamine | /fɛnˈtoʊ.ləˌmiːn/ | Phentolamine |
| 132 | Intravenous bolus | /ˌɪn.trəˈviː.nəs ˈboʊ.ləs/ | Tiêm bolus tĩnh mạch |
| 133 | Nicardipine | /naɪˈkɑːr.dəˌpiːn/ | Nicardipine |
| 134 | Clevidipine | /kləˈvɪd.ɪˌpiːn/ | Clevidipine |
| 135 | Sodium nitroprusside | /ˈsoʊ.di.əm ˌnaɪ.troʊˈprʌs.aɪd/ | Sodium nitroprusside |
| 136 | Minimally invasive laparoscopic adrenalectomy | /…/ | Phẫu thuật cắt tuyến thượng thận nội soi xâm lấn tối thiểu |
| 137 | Open resection | /ˈoʊ.pən rɪˈsɛk.ʃən/ | Phẫu thuật cắt bỏ mở |
| 138 | Posterior retroperitoneoscopic adrenalectomy | /…/ | Phẫu thuật cắt tuyến thượng thận nội soi sau phúc mạc |
| 139 | Intraperitoneal dissection | /ˌɪn.trəˌpɛr.ɪ.təˈniː.əl daɪˈsɛk.ʃən/ | Phẫu tích trong phúc mạc |
| 140 | Partial adrenalectomy | /ˈpɑːr.ʃəl əˌdriː.nəˈlɛk.tə.mi/ | Cắt tuyến thượng thận bán phần |
| 141 | Cortical sparing | /ˈkɔːr.tɪ.kəl ˈspɛər.ɪŋ/ | Bảo tồn vỏ |
| 142 | Glucocorticoid replacement | /ˌɡluː.koʊˈkɔːr.tɪ.kɔɪd rɪˈpleɪs.mənt/ | Thay thế glucocorticoid |
| 143 | Mineralocorticoid replacement | /ˌmɪn.ər.ə.loʊˈkɔːr.tɪ.kɔɪd rɪˈpleɪs.mənt/ | Thay thế mineralocorticoid |
| 144 | Inotrope agents | /ˈaɪ.nəˌtroʊp ˈeɪ.dʒənts/ | Thuốc tăng co bóp tim |
| 145 | Rebound hyperinsulinemia | /ˈriː.baʊnd ˌhaɪ.pərˌɪn.sə.lɪˈniː.mi.ə/ | Tăng insulin máu phản ứng |
| 146 | Rebound hypoglycemia | /ˈriː.baʊnd ˌhaɪ.poʊ.ɡlaɪˈsiː.mi.ə/ | Hạ đường huyết phản ứng |
| 147 | Malignant potential | /məˈlɪɡ.nənt pəˈtɛn.ʃəl/ | Tiềm năng ác tính |
| 148 | PASS Score | /pæs skɔːr/ | Thang điểm PASS |
| 149 | Capsular invasion | /ˈkæp.sjə.lər ɪnˈveɪ.ʒən/ | Xâm lấn vỏ bao |
| 150 | Vascular invasion | /ˈvæs.kjə.lər ɪnˈveɪ.ʒən/ | Xâm lấn mạch máu |
| 151 | Nuclear pleomorphism | /ˈnuː.kli.ər ˌpliː.oʊˈmɔːr.fɪz.əm/ | Đa hình thái nhân |
| 152 | Hyperchromasia | /ˌhaɪ.pər.kroʊˈmeɪ.ʒə/ | Tăng sắc tố |
| 153 | Periadrenal adipose tissue | /ˌpɛr.i.əˈdriː.nəl ˈæd.ɪ.poʊs ˈtɪʃ.uː/ | Mô mỡ quanh tuyến thượng thận |
| 154 | Mitotic figures | /maɪˈtɒt.ɪk ˈfɪɡ.jərz/ | Hình ảnh phân bào |
| 155 | Recurrence | /rɪˈkɜː.rəns/ | Tái phát |
| 156 | Zona glomerulosa cells | /ˈzoʊ.nə ɡloʊˌmɛr.jəˈloʊ.sə sɛlz/ | Tế bào lớp cầu |
| 157 | Mineralocorticoid receptors | /ˌmɪn.ər.ə.loʊˈkɔːr.tɪ.kɔɪd rɪˈsɛp.tərz/ | Thụ thể mineralocorticoid |
| 158 | Renal epithelial cells | /ˈriː.nəl ˌɛp.ɪˈθiː.li.əl sɛlz/ | Tế bào biểu mô thận |
| 159 | Sodium reabsorption | /ˈsoʊ.di.əm ˌriː.əbˈsɔːrp.ʃən/ | Tái hấp thu natri |
| 160 | Potassium secretion | /pəˈtæs.i.əm sɪˈkriː.ʃən/ | Bài tiết kali |
| 161 | Cardiomyocytes | /ˌkɑːr.di.oʊˈmaɪ.oʊ.saɪts/ | Tế bào cơ tim |
| 162 | Cardiac fibroblasts | /ˈkɑːr.di.æk ˈfaɪ.broʊ.blæsts/ | Nguyên bào sợi tim |
| 163 | Vascular smooth muscle cells | /ˈvæs.kjə.lər smuːð ˈmʌs.əl sɛlz/ | Tế bào cơ trơn mạch máu |
| 164 | Conn’s syndrome | /kɒnz ˈsɪn.droʊm/ | Hội chứng Conn |
| 165 | Resistant hypertension | /rɪˈzɪs.tənt ˌhaɪ.pərˈtɛn.ʃən/ | Tăng huyết áp kháng trị |
| 166 | Hypokalemia | /ˌhaɪ.poʊ.kəˈliː.mi.ə/ | Hạ kali máu |
| 167 | Aldosterone-producing adrenal adenoma (APA) | /ælˌdɒs.təˈroʊn prəˈduː.sɪŋ əˈdriː.nəl ˌæd.əˈnoʊ.mə/ | U tuyến thượng thận sản xuất aldosterone |
| 168 | Secondary hypertension | /ˈsɛk.ənˌdɛr.i ˌhaɪ.pərˈtɛn.ʃən/ | Tăng huyết áp thứ phát |
| 169 | Bilateral adrenal hyperplasia (BAH) | /baɪˈlæt.ər.əl əˈdriː.nəl ˌhaɪ.pərˈpleɪ.ʒə/ | Tăng sản tuyến thượng thận hai bên |
| 170 | Adrenocortical carcinoma | /əˌdriː.noʊˈkɔːr.tɪ.kəl ˌkɑːr.sɪˈnoʊ.mə/ | Ung thư biểu mô vỏ thượng thận |
| 171 | Ectopic aldosterone-producing adenoma | /ɛkˈtɒp.ɪk ælˌdɒs.təˈroʊn prəˈduː.sɪŋ ˌæd.əˈnoʊ.mə/ | U tuyến sản xuất aldosterone lạc chỗ |
| 172 | Familial hyperaldosteronism | /fəˈmɪl.i.əl ˌhaɪ.pərˌæl.doʊˈstɛr.əˌnɪz.əm/ | Cường aldosteron gia đình |
| 173 | Muscle cramps | /ˈmʌs.əl kræmps/ | Chuột rút |
| 174 | Nocturia | /nɒkˈtjʊər.i.ə/ | Tiểu đêm |
| 175 | Left ventricular hypertrophy | /lɛft vɛnˈtrɪk.jə.lər haɪˈpɜːr.trə.fi/ | Phì đại thất trái |
| 176 | Sustained blood pressure | /səˈsteɪnd blʌd ˈprɛʃ.ər/ | Huyết áp duy trì |
| 177 | Diuretic | /ˌdaɪ.jʊˈrɛt.ɪk/ | Thuốc lợi tiểu |
| 178 | Sleep apnea | /sliːp ˈæp.ni.ə/ | Ngưng thở khi ngủ |
| 179 | Plasma aldosterone concentration (PAC) | /ˈplæz.mə ælˌdɒs.təˈroʊn ˌkɒn.sənˈtreɪ.ʃən/ | Nồng độ aldosterone huyết tương |
| 180 | Suppressed plasma renin concentration | /səˈprɛst ˈplæz.mə ˈriː.nɪn ˌkɒn.sənˈtreɪ.ʃən/ | Nồng độ renin huyết tương bị ức chế |
| 181 | Case detection test | /keɪs dɪˈtɛk.ʃən tɛst/ | Xét nghiệm phát hiện ca bệnh |
| 182 | Confirmatory testing | /kənˈfɜːr.məˌtɔː.ri ˈtɛst.ɪŋ/ | Xét nghiệm xác nhận |
| 183 | Oral sodium loading | /ˈɔː.rəl ˈsoʊ.di.əm ˈloʊ.dɪŋ/ | Nghiệm pháp tải natri đường uống |
| 184 | Saline infusion test (SIT) | /ˈseɪ.liːn ɪnˈfjuː.ʒən tɛst/ | Nghiệm pháp truyền muối sinh lý |
| 185 | Fludrocortisone suppression test (FST) | /ˌfluː.droʊˈkɔːr.tɪ.zoʊn səˈprɛʃ.ən tɛst/ | Nghiệm pháp ức chế fludrocortisone |
| 186 | Captopril challenge test (CCT) | /ˈkæp.tə.prɪl ˈtʃæl.ɪndʒ tɛst/ | Nghiệm pháp thử thách captopril |
| 187 | Adrenal venous sampling (AVS) | /əˈdriː.nəl ˈviː.nəs ˈsæm.plɪŋ/ | Lấy máu tĩnh mạch tuyến thượng thận |
| 188 | Cosyntropin | /ˌkoʊ.sɪnˈtroʊ.pɪn/ | Cosyntropin |
| 189 | Lateralization index (LI) | /ˌlæt.ər.əl.aɪˈzeɪ.ʃən ˈɪn.dɛks/ | Chỉ số lệch bên |
| 190 | Contralateral suppression | /ˌkɒn.trəˈlæt.ər.əl səˈprɛʃ.ən/ | Sự ức chế đối bên |
| 191 | Mineralocorticoid receptor (MR) antagonists | /…/ | Thuốc đối kháng thụ thể mineralocorticoid |
| 192 | Spironolactone | /ˌspaɪ.rə.noʊˈlæk.toʊn/ | Spironolactone |
| 193 | Eplerenone | /əˈplɛr.əˌnoʊn/ | Eplerenone |
| 194 | Hyperkalemia | /ˌhaɪ.pər.kəˈliː.mi.ə/ | Tăng kali máu |
| 195 | Angiotensin-converting enzyme inhibitors | /…/ | Thuốc ức chế men chuyển angiotensin |
| 196 | Angiotensin receptor blockers | /…/ | Thuốc chẹn thụ thể angiotensin |
| 197 | Hypertensive encephalopathy | /ˌhaɪ.pərˈtɛn.sɪv ɛnˌsɛf.əˈlɒp.ə.θi/ | Bệnh não do tăng huyết áp |
| 198 | Hemorrhagic stroke | /ˌhɛm.əˈrædʒ.ɪk stroʊk/ | Đột quỵ xuất huyết |
| 199 | Afterload | /ˈæf.tərˌloʊd/ | Hậu gánh |
| 200 | Enalaprilat | /əˈnæl.ə.prɪˌlæt/ | Enalaprilat |
