Sổ tay Phục hồi chức năng Lâm sàng Braddom, Ấn bản thứ hai (2026)
Nhà xuất bản: ELSEVIER, 2026
Tác giả: David Cifu, Henry L. Lew – Dịch và chú giải: Ths.Bs. Lê Đình Sáng
(C) Bản dịch tiếng Việt bởi THƯ VIỆN Y HỌC MEDIPHARM
Chương 29. Phục hồi chức năng Ung thư
Cancer rehabilitation
Terence Pugh; Charles Mitchell
Braddom’s Rehabilitation Care: A Clinical Handbook, 29, 273-288.e18
Hướng dẫn nhanh
Phục hồi chức năng Ung thư
|
Điểm cần lưu ý lâm sàng
|
PHỤC HỒI CHỨC NĂNG UNG THƯ
Phục hồi chức năng ung thư giải quyết các suy yếu về thể chất và tình trạng khuyết tật tiến triển mà bệnh nhân ung thư gặp phải. Phần lớn các suy yếu liên quan trực tiếp đến ung thư hoặc việc điều trị; tuy nhiên, nhiều suy yếu phát sinh từ các quá trình bệnh lý đồng thời, ngày càng phổ biến trong dân số bệnh nhân ung thư đang già đi. Việc phục hồi chức năng thành công cho họ đòi hỏi phải xem xét các mối quan tâm đặc thù của ung thư (tiên lượng hạn chế, các tổn thương động, gánh nặng triệu chứng nặng nề và các độc tính liên quan đến điều trị) trong việc xây dựng các kế hoạch điều trị nhân văn và thực tế (Hộp 29.1).
CÁC CÂN NHẮC VỀ BỆNH LÝ
Các giai đoạn của Ung thư
Một mục tiêu phục hồi chức năng chính trong quá trình điều trị ung thư ban đầu là hạn chế tác động chức năng của các phương pháp điều trị ung thư: phẫu thuật, xạ trị và hóa trị. Bệnh nhân được điều trị ung thư tái phát cực kỳ dễ bị suy yếu chức năng lâu dài vì các phương pháp điều trị ung thư thường được áp dụng cho các mô đã được điều trị trước đó, và các độc tính tích lũy có thể rất nghiêm trọng (Bảng 29.1). Các liệu pháp chống ung thư được cung cấp khi ung thư không được coi là có thể chữa khỏi sau khi tái phát và nhằm mục đích giảm gánh nặng triệu chứng, sự lây lan của ung thư và sự phát triển của các bệnh lý đi kèm. Bệnh nhân thường trải qua các đợt hóa trị nối tiếp, có thể góp phần vào tình trạng suy nhược và khuyết tật tiến triển. Khi bệnh nhân bước vào giai đoạn cuối, giai đoạn chăm sóc giảm nhẹ của điều trị ung thư, trọng tâm là tối đa hóa sự thoải mái, sức khỏe tâm lý và sự độc lập trong vận động và thực hiện các hoạt động sinh hoạt hàng ngày (ADL) của bệnh nhân. Dữ liệu liên quan đến tỷ lệ sống sót sau 5 năm (Hình 29.1) có thể cung cấp thông tin cho việc đặt mục tiêu phục hồi chức năng, xác định sự nhấn mạnh vào các phương pháp điều trị theo triệu chứng so với các phương pháp điều trị thay đổi bệnh, và cho phép các bác sĩ lâm sàng phục hồi chức năng đánh giá sự phù hợp của kỳ vọng của bệnh nhân.
|
Hộp 29.1 Các ưu tiên Phục hồi chức năng trong các Giai đoạn Ung thư CHẨN ĐOÁN BAN ĐẦU
THEO DÕI
TÁI PHÁT
ĐIỀU TRỊ TẠM THỜI
CHĂM SÓC GIẢM NHẸ
|
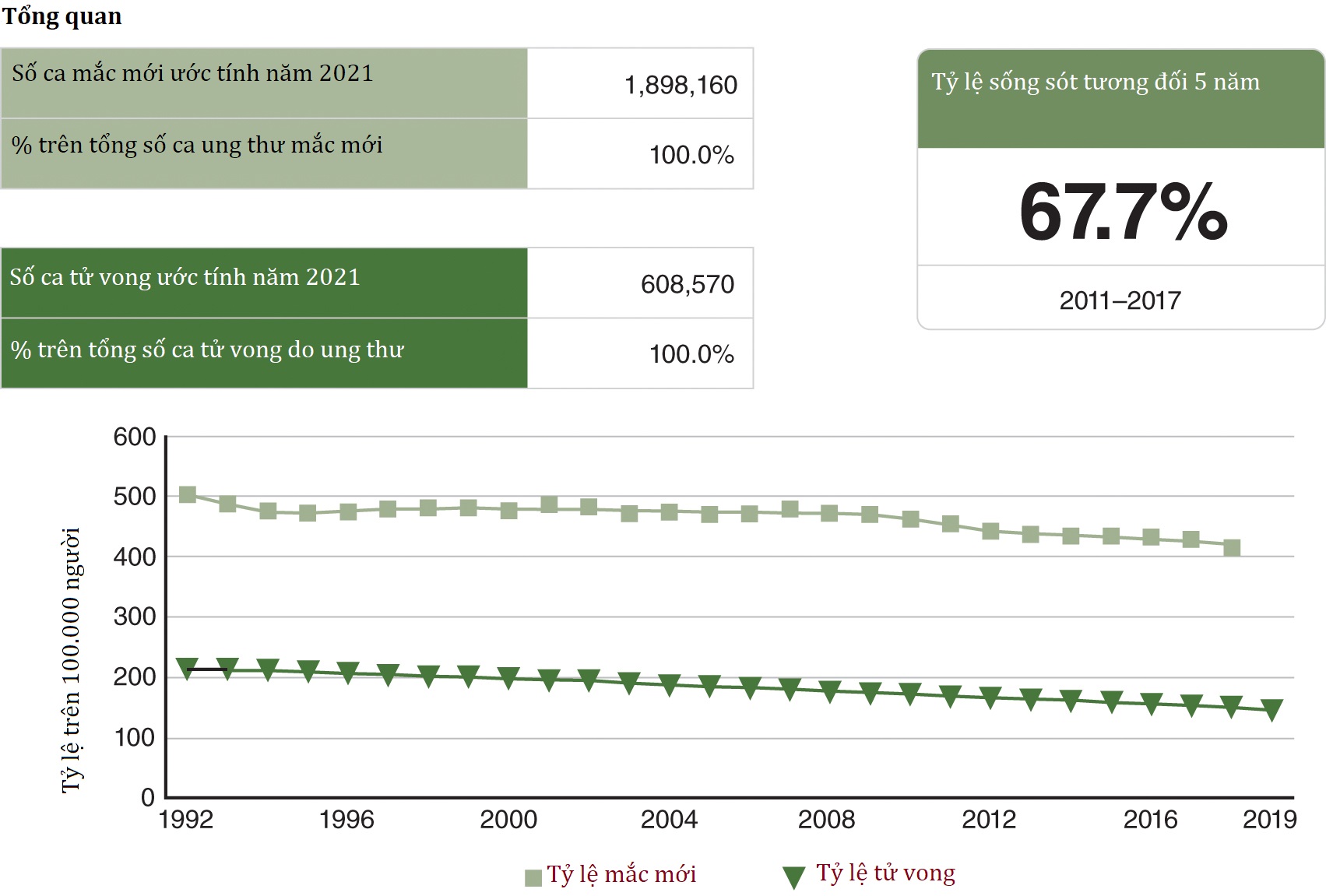
Hình 29.1 Thống kê Tỷ lệ sống sót sau 5 năm đối với các loại Ung thư khác nhau, 2011 đến 2017. Từ Cơ sở dữ liệu SEER của NIH. Dữ liệu thống kê Ung thư: Dữ liệu về Ung thư tại bất kỳ vị trí nào.
Xu hướng bảo tồn cơ quan trong chăm sóc ung thư ban đầu đã dẫn đến việc sử dụng rộng rãi liệu pháp đa phương thức. Xu hướng sử dụng liệu pháp đa phương thức có liên quan đến phục hồi chức năng vì hầu hết bệnh nhân ung thư đều nhận được một sự kết hợp nào đó giữa hóa trị, xạ trị hoặc phẫu thuật tùy thuộc vào loại và giai đoạn của ung thư. Điều này làm cho bệnh nhân dễ bị các độc tính tích lũy trên mô bình thường liên quan đến mỗi phương thức (Bảng 29.2, 29.3, 29.4 và 29.5).
Hộp 29.2 Các suy yếu liên quan đến Can thiệp Phẫu thuật Ung thư
|
Hộp 29.3 Các suy yếu liên quan đến Xạ trị Ung thư
|
Hộp 29.4 Các suy yếu liên quan đến Hóa trị Ung thư
|
Bảng 29.5 Đặc điểm của Bệnh lý thần kinh ngoại biên do Hóa trị
| Đặc điểm | Vinca Alkaloids | Hợp chất Platin | Taxanes |
|---|---|---|---|
| Triệu chứng ban đầu | Dị cảm ở các chi xa; mất phản xạ gân cơ chi dưới. | Cảm giác đau nhói và nóng rát; chủ yếu ảnh hưởng sợi cảm giác lớn. | Dị cảm; mất phản xạ gân cơ; giảm cảm giác rung. |
| Yếu cơ | Có thể yếu cơ duỗi cổ tay và ngón tay. | Chức năng vận động tương đối được bảo tồn. | Yếu cơ gốc chi nhẹ, thường hồi phục. |
| Tổn thương thần kinh tự chủ | Phổ biến – có thể gây liệt ruột, hạ huyết áp tư thế, liệt dương. | Hiếm khi ảnh hưởng thần kinh tự chủ. | Không phổ biến. |
| Phản xạ gân sâu | Mất phản xạ gân cơ chi dưới. | Phản xạ gân sâu chi dưới thường biến mất. | Mất phản xạ gân cơ. |
| Kết quả dẫn truyền thần kinh | Giảm điện thế hoạt động thần kinh vận động và cảm giác ở đầu xa; tốc độ dẫn truyền chỉ giảm nhẹ → tổn thương sợi trục là chủ yếu. | Giảm điện thế hoạt động thần kinh cảm giác; kéo dài độ trễ cảm giác đầu xa; tốc độ dẫn truyền giảm tối thiểu. | Giảm điện thế hoạt động thần kinh cảm giác và vận động; giảm tốc độ dẫn truyền cảm giác và vận động. |
CÁC TRIỆU CHỨNG TOÀN THÂN
Mệt mỏi
Mệt mỏi là triệu chứng phổ biến nhất mà bệnh nhân ung thư gặp phải. Các cơ chế gây ra thường là đa yếu tố. Thường thì mệt mỏi liên quan đến ung thư xảy ra khi không có thiếu máu hoặc đang điều trị ung thư (Bảng 29.6). Trong trường hợp các nguyên nhân gây mệt mỏi có thể hồi phục đã được loại bỏ, một phương pháp tiếp cận đa phương thức được chỉ định bao gồm tăng cường tập luyện/hoạt động, các can thiệp tâm lý xã hội và các phương pháp điều trị (Hộp 29.2).
Bảng 29.1 Các tình trạng gây ra bởi Độc tính Xạ trị Muộn
| Hệ thống | Tác dụng phụ muộn |
|---|---|
| Nội tiết | Suy giáp, suy sinh dục, suy thượng thận, không dung nạp glucose do suy tụy |
| Ngoại tiết | Khô miệng, thiếu hụt enzyme tụy |
| Thần kinh | Bệnh tủy sống, bệnh lý đám rối, thiếu máu cục bộ mạch máu não, sa sút trí tuệ, bệnh não chất trắng, bệnh lý thần kinh sọ |
| Bạch huyết | Hoại tử hạch bạch huyết, phù bạch huyết |
| Tiêu hóa | Rối loạn vận động, kém hấp thu, táo bón do thần kinh, tắc nghẽn, thủng, rối loạn vị giác |
| Da | Teo, loét, chậm lành, tăng sắc tố |
| Thính giác | Mất thính lực tiến triển, ù tai |
| Mạch máu | Xơ vữa động mạch sớm, xơ cứng tĩnh mạch |
| Phổi hoặc hô hấp trên | Xơ hóa nhu mô, hẹp khí quản, khàn giọng thứ phát do xơ hóa thanh quản |
| Cơ xương khớp | Xơ hóa, hoại tử xương, loãng xương, hoại tử mô mềm, co rút khớp, xơ hóa bao cơ |
| Mắt | Loét giác mạc, bệnh võng mạc, hoại tử củng mạc |
| Niệu – Dục | Bàng quang thần kinh, suy thận, tắc nghẽn, thủng |
|
Hộp 29.2 Các Nguồn gốc có thể hồi phục của Mệt mỏi do Ung thư
|
Bảng 29.6 Các Nguyên nhân phổ biến của Mệt mỏi liên quan đến Ung thư
| Rối loạn chức năng | Nguyên nhân |
|---|---|
| Trục thượng thận, tuyến giáp và/hoặc buồng trứng | Cắt bỏ bằng hóa chất. Cắt bỏ bằng phẫu thuật. Xạ trị. |
| Suy nhược và/hoặc các yếu tố liên quan đến tâm trạng | Lo âu. Trầm cảm. |
| Các thuốc tác động trung ương | Opioids. Benzodiazepines. Thuốc chống nôn. Thuốc kháng histamine. Thuốc chống trầm cảm ba vòng. Thuốc chống co giật (ví dụ: carbamazepine, gabapentin, oxcarbazepine). Thalidomide. Thuốc chủ vận alpha₂-adrenergic (ví dụ: tizanidine). |
Đau
Kiểm soát đau có thể đòi hỏi việc sử dụng tích hợp các phương pháp điều trị chống ung thư, các tác nhân từ nhiều nhóm thuốc giảm đau, các kỹ thuật can thiệp, các tác nhân tại chỗ, các phương pháp thủ công và các phương thức vật lý (Hộp 29.3). Các thuốc giảm đau có đường dùng qua da, ngoài đường tiêu hóa, trực tràng và qua niêm mạc nên được ưu tiên sử dụng khi đường tiêu hóa có thể bị mất. Một số nguyên nhân có thể góp phần gây đau do ung thư (Bảng 29.7), và nhiều loại thuốc không gây nghiện và các kỹ thuật can thiệp có thể được xem xét (Bảng 29.8).
|
Hộp 29.3 Các cân nhắc trong Quản lý Đau do Ung thư
|
Bảng 29.7 Các nguyên nhân phổ biến của Đau do Ung thư
| Nguyên nhân | Điều trị |
|---|---|
| Tác động của khối u | Liệu pháp chống ung thư làm thay đổi tiến triển bệnh. |
| Chèn ép thần kinh | Thuốc giảm đau hỗ trợ. |
| Lo âu và trầm cảm liên quan đến ung thư | Thuốc chống trầm cảm và thuốc giải lo âu. |
| Di căn xương | Xạ trị và thuốc giảm đau. |
Hộp 29.8 Thuốc giảm đau không gây nghiện cho Đau xương Thuốc giảm đau không gây nghiện
|
Dược trị liệu dựa trên opioid là tiêu chuẩn chăm sóc hiện tại để quản lý đau do ung thư từ trung bình đến nặng. Liều lượng opioid mà nhiều bệnh nhân ung thư yêu cầu vượt xa các mức thông thường được các bác sĩ phục hồi chức năng sử dụng. Những loại được sử dụng phổ biến nhất trong quản lý đau do ung thư bao gồm morphin, hydromorphon, oxycodon, oxymorphon, fentanyl và methadon. Nhận thấy rằng hầu hết bệnh nhân đều trải qua cơn đau nền liên tục bị ngắt quãng bởi cơn đau thoáng qua hoặc đau đột xuất, việc sử dụng kết hợp các chế phẩm opioid giải phóng bình thường và giải phóng kéo dài hoặc liên tục được khuyến nghị. Để ước tính nhanh các yêu cầu về liều ban đầu, bệnh nhân nên được cung cấp quyền truy cập tự do vào một công thức opioid giải phóng bình thường. Khi việc sử dụng của họ đã ổn định, mức tiêu thụ trung bình hàng ngày hoặc hàng giờ có thể được tính toán và một chế phẩm giải phóng kéo dài đường uống hoặc qua da có thể được bắt đầu. Việc điều chỉnh liều liên tục nên được dựa trên việc sử dụng các liều cứu hộ giải phóng bình thường bổ sung của bệnh nhân. Thông thường, liều cứu hộ chiếm 10% đến 15% tổng liều hàng ngày. Các khuyến nghị hiện tại kêu gọi dùng một loại thuốc duy nhất để đạt hiệu quả hoặc tác dụng phụ, và mỗi loại thuốc nên được thử nghiệm đầy đủ. Một opioid thay thế nên được xem xét khi một thử nghiệm đầy đủ của một loại thuốc cụ thể đã thất bại trong việc kiểm soát đau hoặc đã gây ra các tác dụng phụ khó chữa. Chuyển đổi liều opioid đòi hỏi phải tính toán liều tương đương giảm đau của loại thuốc mới (Bảng 29.9) và giảm 50% do dung nạp chéo không hoàn toàn.
Bảng 29.9 Chuyển đổi liều Opioid
| Opioid (Tên gốc) | Tên biệt dược | Đường dùng | Liều tương đương |
|---|---|---|---|
| Morphine | MS Contin, Avinza, Kadian, Oramorph SR, Roxanol | – Uống (viên nén): 30 mg – Uống (dung dịch): 30 mg – Tiêm tĩnh mạch hoặc tiêm bắp: 10 mg |
30 mg (uống) = 10 mg (tiêm) |
| Fentanyl | Actiq, Duragesic | – Qua niêm mạc: 500 μg – Tiêm tĩnh mạch hoặc tiêm bắp: 250 μg – Qua da: 250 μg |
≈ 100 lần mạnh hơn Morphine |
| Hydromorphone | Dilaudid | – Uống (viên nén): 7,5 mg – Tiêm tĩnh mạch hoặc tiêm bắp: 1,5 mg |
7,5 mg (uống) = 1,5 mg (tiêm) |
| Oxycodone | OxyContin | – Uống (viên nén): 20 mg – Uống (dung dịch): 20 mg |
20 mg (uống) ≈ 30 mg Morphine (uống) |
| Methadone | Dolophine | – Uống: 20 mg – Tiêm tĩnh mạch hoặc tiêm bắp: 10 mg |
20 mg (uống) ≈ 30 mg Morphine (uống)* |
| Oxymorphone | — | – Tiêm tĩnh mạch hoặc tiêm bắp: 1 mg | 1 mg (tiêm) ≈ 10 mg Morphine (tiêm) |
* Lưu ý: Tỷ lệ chuyển đổi của Methadone so với Morphine có thể thay đổi tùy tổng liều opioid nền — cần tham khảo hướng dẫn chuyên biệt khi chuyển đổi liều.
Các loại thuốc không opioid khác đã được chứng minh là có lợi ở bệnh nhân ung thư với các cân nhắc về (các) can thiệp đã được sử dụng để điều trị. Đối với đau sau phẫu thuật, một phương pháp tiếp cận đa phương thức, bao gồm thuốc chống viêm không steroid và acetaminophen, đã được khuyến nghị. Thuốc chống trầm cảm ba vòng, thuốc ức chế tái hấp thu serotonin-norepinephrine, thuốc chống co giật, thuốc giảm đau tại chỗ, corticosteroid, bisphosphonat và cannabinoid đã được sử dụng để điều trị bệnh lý thần kinh gây đau. Một đánh giá năm 2015 cho thấy miếng dán lidocain tại chỗ an toàn và dung nạp tốt ở những người bị đau thần kinh; tuy nhiên, những nghiên cứu này cho thấy thời gian hiệu quả kéo dài dưới 3 tuần. Capsaicin tại chỗ (miếng dán hoặc kem) có thể hiệu quả trong bệnh lý thần kinh gây đau, với độc tố botulinum loại A cũng cho thấy hiệu quả trong đau thần kinh ngoại biên.
Các suy yếu do Tác động của Khối u
DI CĂN XƯƠNG
Di căn xương rất phổ biến vì xương là vị trí di căn lan rộng phổ biến nhất. Khoảng 60% đến 84% bệnh nhân có khối u đặc sẽ phát triển di căn xương. Mối quan tâm lớn nhất về mặt phục hồi chức năng là các tổn thương liên quan đến cột sống và các xương dài. Các cấu trúc này rất quan trọng để chịu trọng lượng và vận động và dễ bị gãy nhất. Di căn xương được quản lý bằng thuốc, dược phẩm phóng xạ, dụng cụ chỉnh hình, xạ trị hoặc ổn định phẫu thuật (Bảng 29.10). Việc lựa chọn (các) can thiệp sẽ phụ thuộc vào vị trí tổn thương, mức độ đau liên quan, sự hiện diện hoặc nguy cơ gãy xương, khả năng đáp ứng với bức xạ và tổn thương thần kinh liên quan. Hệ thống tính điểm của Mirel có thể là một công cụ hữu ích cho các bác sĩ phục hồi chức năng trong việc xác định nguy cơ gãy xương ở bệnh nhân và có thể được sử dụng để xác định kế hoạch phục hồi chức năng. Bối cảnh lâm sàng tổng thể (ví dụ, tiên lượng, mức độ nghiêm trọng của các bệnh đi kèm và nguy cơ phẫu thuật) cũng phải được xem xét. Bisphosphonat là loại thuốc chính được sử dụng để quản lý di căn xương. Việc sử dụng các tác nhân này làm giảm sự lây lan và tiến triển của di căn xương ngoài việc giảm đau liên quan. Các tổn thương tiêu xương gây đau chủ yếu chịu trách nhiệm cho các ca gãy xương bệnh lý. Tỷ lệ gãy xương bệnh lý trong tất cả các loại ung thư là 8%. Sáu mươi phần trăm tất cả các ca gãy xương dài liên quan đến xương đùi, với 80% trong số này nằm ở phần gần. Việc định lượng chính xác nguy cơ gãy xương là một thách thức dai dẳng trong ung thư chỉnh hình; tuy nhiên, các hệ thống xếp hạng tồn tại để tính toán nguy cơ gãy xương (Bảng 29.11).
Bảng 29.10 Quản lý Ung thư Di căn Xương
| Phẫu thuật | Xạ trị |
|---|---|
| • Áp dụng cho gãy xương bệnh lý nhằm giảm đau, bảo tồn và phục hồi chức năng.
• Giúp ổn định xương và kiểm soát khối u tại chỗ. • Được đề nghị cho đau dai dẳng vùng chậu sau xạ trị. • Khuyến nghị thực hiện để ổn định hoặc giải nén các gãy thân đốt sống gây đau dai dẳng, không đáp ứng với điều trị giảm đau. |
• Giúp kiểm soát đau tại chỗ và ức chế sự phát triển của khối u.
• Có thể trì hoãn sau phẫu thuật ổn định xương để giảm nguy cơ biến chứng. • Ức chế sự phát triển của khối u tại vùng có vi thuyên tắc sau phẫu thuật. • Có thể điều trị các tổn thương xương không phẫu thuật hoặc không gãy. |
BẢNG 29.11. Hệ thống Xếp hạng Mirel để Tính toán Nguy cơ Gãy xương
(Tổng điểm > 8 gợi ý nên cố định dự phòng)
| Đặc điểm | 1 điểm | 2 điểm | 3 điểm |
|---|---|---|---|
| Vị trí giải phẫu | Chi trên | Chi dưới | Vùng mấu chuyển (quanh mấu chuyển) |
| Loại tổn thương | Tạo xương | Hỗn hợp (tạo xương và tiêu xương) | Tiêu xương |
| Kích thước tổn thương (so với đường kính vỏ xương) | ≤ 1/3 | 1/3 – 2/3 | ≥ 2/3 |
| Cường độ đau | Nhẹ | Vừa | Đau khi vận động hoặc đau chức năng |
Diễn giải:
-
Điểm tối đa: 12
-
Nguy cơ gãy cao: Tổng điểm > 8 → chỉ định cố định dự phòng (phẫu thuật).
-
Nguy cơ trung bình: 7–8 điểm → cân nhắc cố định dự phòng tùy theo tình trạng toàn thân và tiên lượng.
-
Nguy cơ thấp: < 7 điểm → theo dõi định kỳ, kiểm soát đau và điều trị nguyên nhân.
Việc xây dựng một kế hoạch quản lý dài hạn, tích hợp liên ngành cho di căn xương mang lại cho bệnh nhân cơ hội tốt nhất để duy trì sự thoải mái và chức năng. Các phương pháp tiếp cận phục hồi chức năng có thể được nhóm lại thành việc sử dụng dụng cụ chỉnh hình, thiết bị hỗ trợ, bài tập trị liệu và sửa đổi môi trường. Tất cả về cơ bản là giảm tải, giảm áp lực hoặc bất động các xương bị tổn thương. Các dụng cụ chỉnh hình có thể được chế tạo để ổn định xương ở các vị trí hạn chế các lực có khả năng gây hại và bảo vệ và giảm tải các vị trí gãy xương hoặc sắp gãy. Phải hết sức thận trọng ở những bệnh nhân bị di căn xương lan tỏa trong khi phân phối lại trọng lượng và các kiểu tải trọng. Các thiết bị hỗ trợ và hướng dẫn các chiến lược bù trừ có thể tương tự như vậy để giảm tải các xương bị tổn thương. Gậy, nạng và khung tập đi thường được sử dụng để giảm thiểu nguy cơ gãy xương. Bệnh nhân nên được hướng dẫn để giảm thiểu các lực bằng cách thực hiện các hoạt động gần cơ thể, do đó hạn chế mô-men xoắn trên các xương dài.
Một chương trình tập luyện toàn diện nên bao gồm luyện tập tư thế và thăng bằng cũng như tăng cường sức mạnh thân mình. Những sửa đổi môi trường đơn giản có thể làm giảm đáng kể nguy cơ gãy xương của bệnh nhân. Thảm chùi chân và các mối nguy hiểm khác làm tăng nguy cơ té ngã nên được loại bỏ. Tay vịn có thể được thêm vào cầu thang và phòng tắm khi thích hợp. Tiên lượng của bệnh nhân nên cung cấp thông tin cho quyết định thực hiện các sửa đổi như vậy.
U NÃO: NGUYÊN PHÁT VÀ DI CĂN
Di căn não là các khối u nội sọ phổ biến nhất. Sự phân bố của di căn phản ánh lưu lượng máu não, với 90% nằm ở vùng trên lều và 10% ở hố sau. Di căn não là đa ổ trong khoảng 50% đến 75% các trường hợp. Các triệu chứng biểu hiện tại thời điểm chẩn đoán với di căn não thay đổi đáng kể (Bảng 29.12).
BẢNG 29.12. Biểu hiện Lâm sàng của Di căn Não
| Tần suất các Triệu chứng (theo Bệnh sử) | Tần suất các Dấu hiệu (theo Khám thực thể) |
|---|---|
| Đau đầu (49%) | Liệt nửa người (59%) |
| Rối loạn tâm thần (32%) | Suy giảm chức năng nhận thức (58%) |
| Yếu khu trú (30%) | Mất cảm giác nửa người (21%) |
| Thất điều dáng đi (21%) | Phù gai thị (20%) |
| Co giật (18%) | Thất điều dáng đi (19%) |
| Khó nói (12%) | Mất ngôn ngữ (18%) |
| Rối loạn thị giác (6%) | Mất thị trường (7%) |
| Rối loạn cảm giác (6%) | Thất điều chi (4%) |
| Thất điều chi (6%) | — |
Corticosteroid là phương pháp điều trị hàng đầu, với dexamethasone là thuốc được lựa chọn. Corticosteroid làm giảm phù nề quanh khối u và đảo ngược sự chèn ép não cục bộ và các thiếu hụt liên quan. Điều trị thường bao gồm xạ trị toàn não với phẫu thuật xạ trị định vị hoặc cắt bỏ phẫu thuật qua mở sọ. Hóa trị bổ trợ có thể được sử dụng, tùy thuộc vào tình trạng hoạt động của bệnh nhân, loại ung thư và việc tiếp xúc trước đó với các thuốc chống ung thư. Cân nhắc dự phòng huyết khối tĩnh mạch sâu và dự phòng co giật cũng phải được xem xét ở những bệnh nhân có khối u ác tính nội sọ.
Nhu cầu phục hồi chức năng của bệnh nhân di căn não được xác định tốt nhất bằng cách hiểu tình trạng chức năng cơ bản, tiên lượng, vị trí và số lượng di căn, và kế hoạch điều trị chống ung thư (Bảng 29.2). Các đặc điểm di căn não liên quan đến mất khả năng vận động đáng kể trong thời gian ngắn là: (1) vị trí tiểu não hoặc thân não, (2) hình ảnh cho thấy di căn mới và đang mở rộng, và (3) điều trị bằng xạ trị toàn não.
Bảng 29.2 Các nhóm thuốc chống ung thư
| Nhóm thuốc | Cơ chế tác dụng | Các tác nhân thường dùng | Độc tính chính |
|---|---|---|---|
| Các tác nhân chống khối u, alkyl hóa và các chất tương tự | Tạo liên kết cộng hóa trị giữa nhóm alkyl và DNA → hình thành các chất trung gian phản ứng tấn công các vị trí ái nhân → DNA không còn hoạt động như khuôn mẫu. Các hợp chất platin gây “platination” DNA, cảm ứng apoptosis hoặc bắt giữ tế bào ở pha G₂, phá vỡ các con đường tín hiệu nội bào. | Mustards: chlorambucil, cyclophosphamide, ifosfamide. Nitrosoureas: carmustine. Tetrazines: dacarbazine. Aziridines: mitomycin C, thiotepa. Tác nhân alkyl hóa không cổ điển: procarbazine. Hợp chất platin: cisplatin, carboplatin, oxaliplatin. | Ức chế tủy (tất cả); viêm niêm mạc (busulfan); độc gan (busulfan, carmustine, dacarbazine); xơ phổi (busulfan, carmustine); viêm bàng quang (ifosfamide, cyclophosphamide); rụng tóc (cyclophosphamide); bệnh tắc tĩnh mạch gan (busulfan, carmustine, mitomycin C). Platin: độc thận, độc tai, bệnh lý thần kinh ngoại biên, ức chế tủy. |
| Chất chống chuyển hóa | Can thiệp vào tổng hợp tiền chất của DNA và RNA hoặc ức chế DNA polymerase → ngăn sao chép DNA/RNA. | Antifolates: methotrexate. Fluoropyrimidines: 5-fluorouracil. Tương tự pyrimidine: azacitidine, gemcitabine. 6-thiopurines: 6-mercaptopurine, 6-thioguanine. Nucleoside arabinose: cytarabine. Kháng sinh chống khối u: actinomycin D. | Ức chế tủy, viêm niêm mạc tiêu hóa (tất cả); độc gan (methotrexate, cytarabine, azacitidine, gemcitabine, 6-thiopurines); độc thận (methotrexate); độc thần kinh (methotrexate, cytarabine, azacitidine). |
| Các tác nhân tương tác với Topoisomerase | Ức chế enzyme DNA topoisomerase (điều hòa xoắn và tháo xoắn DNA) → bắt giữ tế bào ở pha G₂ hoặc gây apoptosis ở pha S. | Epipodophyllotoxins: etoposide. Anthracyclines: doxorubicin, daunorubicin, epirubicin, idarubicin. Camptothecins: topotecan, irinotecan. | Ức chế tủy, viêm niêm mạc (tất cả). Anthracyclines: độc tim (doxorubicin), loét mô mềm khi thoát mạch. |
| Các tác nhân chống vi ống (microtubule inhibitors) | Phá vỡ cấu trúc vi ống tạo nên thoi phân bào, ức chế phân chia tế bào. | Vinca alkaloids: vincristine, vinblastine, vinorelbine. Taxanes: paclitaxel, docetaxel. Khác: estramustine. | Độc thần kinh ngoại biên (vinca alkaloids, taxanes); rối loạn tự chủ tiêu hóa (vinca alkaloids); giảm bạch cầu trung tính (vinca alkaloids); ức chế tủy (taxanes); đau cơ (taxanes); nhịp tim chậm (paclitaxel); giữ nước, độc da (docetaxel); nôn (estramustine); suy tim sung huyết (estramustine). |
| Các tác nhân hóa trị khác | Fludarabine: ức chế enzyme tổng hợp và sửa chữa DNA. L-asparaginase: khai thác việc tế bào ung thư không tổng hợp được asparagine → ức chế tổng hợp protein. Bleomycin: tạo gốc tự do gây đứt gãy DNA. | Fludarabine, L-asparaginase, bleomycin. | Ức chế tủy (fludarabine), ức chế miễn dịch (fludarabine), độc thần kinh (fludarabine), phản ứng quá mẫn (L-asparaginase), xơ phổi (bleomycin), độc da – niêm mạc (bleomycin). |
CHÈN ÉP TỦY SỐNG NGOÀI MÀNG CỨNG
Chèn ép tủy sống ác tính (SCC) xảy ra ở tối đa 5% bệnh nhân. Hầu hết các khối u có triệu chứng chèn ép tủy sống hoặc chùm đuôi ngựa từ khoang ngoài màng cứng. Các tổn thương ngoài màng cứng thường phát sinh từ di căn đốt sống và hiếm khi phá vỡ màng cứng.
Đau là triệu chứng ban đầu (94%) và biểu hiện (97% đến 99%) phổ biến nhất của SCC ác tính. Nếu SCC ác tính được phát hiện khi đau là triệu chứng duy nhất, các nỗ lực bảo tồn chức năng thông qua giải nén phẫu thuật hoặc xạ trị có tỷ lệ thành công cao. Yếu cơ có ở 74% đến 76% bệnh nhân, rối loạn chức năng tự chủ ở 52% đến 57% và mất cảm giác ở 51% đến 53%. Cột sống ngực là vị trí phổ biến nhất của SCC ngoài màng cứng, tiếp theo là cột sống thắt lưng-cùng và cột sống cổ theo tỷ lệ 4:2:1. Steroid liều cao và giải nén phẫu thuật là phương pháp điều trị được lựa chọn cho những bệnh nhân có thể phẫu thuật. Xạ trị là phương pháp điều trị được lựa chọn cho những bệnh nhân không thể phẫu thuật.
Các khối u gây tiến triển nhanh chóng các thiếu hụt thần kinh có liên quan đến kết quả chức năng kém hơn sau khi giải nén. Nói chung, bệnh nhân vẫn có thể đi lại nếu có thể đi bộ tại thời điểm điều trị dứt điểm. Các thiếu hụt vận động và phối hợp hiếm khi giải quyết khi có mặt tại chẩn đoán. Tỷ lệ tái phát đối với SCC ngoài màng cứng di căn sau khi điều trị thành công lần chèn ép ban đầu là 7% đến 14%. Các bác sĩ phục hồi chức năng có thể hữu ích trong việc quản lý các suy yếu như ruột/bàng quang thần kinh, loét do tỳ đè, nẹp hoặc các nhu cầu thiết bị khác.
ĐÁM RỐI THẦN KINH
Đám rối cánh tay và thắt lưng-cùng thường bị chèn ép hoặc xâm lấn bởi khối u. Các nguồn phổ biến nhất của bệnh lý đám rối cánh tay là các khối u ở đỉnh phổi và sự lan rộng tại chỗ của ung thư vú. Vì ung thư thường phát triển lên trên để xâm lấn đám rối cánh tay dưới, thân dưới và bó trong thường bị liên quan nhất.
Đau ở vùng vai và cánh tay gần xảy ra ở 89% bệnh nhân bị bệnh lý đám rối cánh tay ác tính và là triệu chứng biểu hiện phổ biến nhất. Sự hiện diện của đau giúp phân biệt bệnh lý đám rối ác tính với bệnh lý đám rối do bức xạ. Chỉ 18% bệnh nhân bị bệnh lý đám rối do bức xạ bị đau. Bệnh lý đám rối do bức xạ cũng khác ở xu hướng gây yếu cơ tiến triển ở các myotome C5 đến C6 trái ngược với các mức cổ dưới. Sự hiện diện của hội chứng Horner gợi ý khả năng xâm lấn lỗ gian đốt sống và SCC. Tê và dị cảm liên quan đến bệnh lý đám rối ác tính thường được cảm nhận ở dermatome C8, đặc biệt là các ngón 4 và 5. Mất khéo léo và sức mạnh của bàn tay có thể là phàn nàn vận động ban đầu. Yếu cơ sau đó lan rộng lên trên để liên quan đến các cơ gập ngón tay, các cơ duỗi và gập cổ tay, và các cơ duỗi khuỷu tay.
Nếu các khối u nguyên phát trong chậu không phải là nguyên nhân, thì đám rối thắt lưng-cùng thường bị xâm lấn từ di căn bạch huyết và xương. Bệnh lý đám rối cùng phổ biến hơn so với vùng thắt lưng. Bệnh lý đám rối thắt lưng và cùng cũng có thể xảy ra đồng thời, với biểu hiện lâm sàng đa dạng (Bảng 29.13).
Bảng 29.13 Biểu hiện Lâm sàng của Bệnh lý đám rối
| Bệnh lý đám rối Cánh tay | Bệnh lý đám rối Thắt lưng – cùng |
|---|---|
| Bệnh lý đám rối ác tính biểu hiện với các thiếu hụt thần kinh. Đau ở vùng vai và cánh tay gần ở 89% bệnh nhân. Yếu ở các mức cổ dưới. Mất khéo léo và sức mạnh bàn tay có thể là biểu hiện ban đầu, lan đến các cơ gập ngón tay, cơ duỗi và gập cổ tay, và cơ duỗi khuỷu tay. Tê và dị cảm ở dermatome C8, đặc biệt là ngón 4 và 5. Bệnh lý đám rối do bức xạ gây đau ở 18% bệnh nhân và yếu ở myotome C5–C6. Hội chứng Horner gợi ý xâm lấn lỗ gian đốt sống hoặc chèn ép tủy sống. | Biểu hiện hai bên ở 25% bệnh nhân; thường kèm tiểu không tự chủ và liệt dương. Đau lưng, mông hoặc chân ở 98% bệnh nhân bị bệnh lý đám rối thắt lưng–cùng ác tính. Thiếu hụt thần kinh ở 60% bệnh nhân. Yếu chân (86%), mất cảm giác (73%). Dấu hiệu Lasègue dương tính (50%). “Bàn chân nóng khô” ở 33% bệnh nhân, do tổn thương các thành phần giao cảm. |
Chụp cộng hưởng từ với gadolinium là xét nghiệm chẩn đoán được lựa chọn để đánh giá đám rối cánh tay và thắt lưng-cùng. Điện cơ đồ có thể phân biệt bệnh lý đám rối với bệnh lý rễ thần kinh bằng cách xác định sự phân bố của sự mất phân bố thần kinh. Sự hiện diện của rung giật cơ trên kim khám được cho là đặc trưng cho bệnh lý đám rối do bức xạ.
Điều trị cấp tính nên bao gồm steroid để bảo tồn chức năng thần kinh. Xạ trị có thể làm giảm đau hiệu quả từ bệnh lý đám rối ác tính nhưng ít hữu ích trong việc phục hồi chức năng đã mất. Hóa trị thường được bắt đầu hoặc thay đổi khi sự liên quan của đám rối báo hiệu sự tiến triển của ung thư. Đau khó chữa đòi hỏi phải phối hợp積極 sử dụng opioid và các thuốc giảm đau hỗ trợ và có khả năng là phẫu thuật cắt tủy cổ cao hoặc cắt rễ thần kinh. Phong bế hạch sao có thể làm giảm đau được duy trì bởi hệ giao cảm.
HỘI CHỨNG CẬN UNG THƯ
Hội chứng cận ung thư có liên quan đến phục hồi chức năng vì chúng tạo ra các thiếu hụt thần kinh khó chữa và khuyết tật nghiêm trọng. Tỷ lệ mắc các rối loạn thần kinh cận ung thư (PND) thấp, xảy ra ở dưới 1% tất cả bệnh nhân ung thư; một số chẩn đoán là kinh điển cho PND (Bảng 29.14). Các hội chứng này được tạo ra khi các kháng thể được tạo ra chống lại các khối u biểu hiện protein của hệ thần kinh. Hầu hết các PND được kích hoạt trong giai đoạn đầu của ung thư, khi các khối u nguyên phát và di căn có thể không thể phát hiện được bằng các kỹ thuật hình ảnh thông thường. Sự xuất hiện của PND ở một bệnh nhân đã biết bị ung thư nên kích hoạt việc kiểm tra để tìm bệnh tái phát hoặc tiến triển. PND được đặc trưng bởi các triệu chứng phát triển và tiến triển nhanh chóng trong vài ngày đến vài tuần, và sau đó ổn định.
Bảng 29.14 Các Rối loạn Cận ung thư Kinh điển
| Rối loạn Thần kinh Cận ung thư Kinh điển | Bệnh ác tính liên quan | Dấu hiệu và Triệu chứng Biểu hiện |
|---|---|---|
| Thoái hóa tiểu não | Ung thư phổi tế bào nhỏ, u lympho Hodgkin, ung thư phụ khoa, ung thư vú | Rối loạn chức năng toàn tiểu não với thất điều thân và chi. |
| Viêm não limbic | Các khối u tế bào mầm của tinh hoàn | Lo âu, trầm cảm, lú lẫn, mê sảng, ảo giác, co giật, mất trí nhớ ngắn hạn, sa sút trí tuệ. |
| Rung giật nhãn cầu – rung giật cơ | Ung thư vú, ung thư phụ khoa, ung thư phổi tế bào nhỏ, u nguyên bào thần kinh | Các chuyển động mắt nhanh, liên hợp, không đều nhịp và đa hướng hỗn loạn; rung giật cơ; thất điều thân. |
| Bệnh lý nơron cảm giác | Ung thư phổi tế bào nhỏ | Đau, tê, thiếu hụt cảm giác của các dây thần kinh sọ và cột sống. |
| Hội chứng nhược cơ Lambert–Eaton | Ung thư phổi tế bào nhỏ | Yếu cơ gốc chi, các triệu chứng tự chủ, tăng sức mạnh trong lần co cơ tự nguyện ban đầu. |
| Viêm não – tủy | Ung thư phổi tế bào nhỏ, u tuyến ức, ung thư vú | Các triệu chứng tương tự viêm não limbic và thoái hóa tiểu não; thiếu hụt cảm giác; thất điều; thiếu hụt hành não; yếu cơ. |
DI CĂN TIM-PHỔI
Tràn dịch màng phổi ác tính nên được dẫn lưu khi bệnh nhân có triệu chứng. Sự tái tích tụ của dịch ác tính có thể được quản lý thông qua chọc dò màng phổi ngắt quãng hoặc gây dính màng phổi, hoặc đặt một ống thông màng phổi lưu. Gây dính màng phổi bằng hóa chất có tỷ lệ đáp ứng hoàn toàn tổng thể là 64% khi xem xét tất cả các tác nhân gây xơ hóa.
Oxy bổ sung nên được bắt đầu ngay khi khó thở trở nên hạn chế chức năng. Nếu dung nạp được, điều hòa hiếu khí tăng dần, từ từ sẽ tối ưu hóa điều hòa ngoại biên, giảm tỷ lệ % cần thiết cho các hoạt động. Tương tự như cả phục hồi chức năng tim và phổi, điều hòa hiếu khí có tác động có lợi hạn chế đối với sinh lý tim hoặc phổi. Sự cải thiện về sức bền và gắng sức cảm nhận được là do các tác dụng luyện tập cơ bắp.
CÁC TIẾP CẬN PHỤC HỒI CHỨC NĂNG
Các cân nhắc lâm sàng
TẬP LUYỆN
Các nghiên cứu trên các quần thể ung thư vú và các loại ung thư khác đang được điều trị hoặc sau khi điều trị ung thư đã liên tục ghi nhận sự cải thiện gánh nặng triệu chứng: mệt mỏi, mất ngủ, buồn nôn và căng thẳng cảm xúc. Chỉ riêng điều hòa hiếu khí đã làm giảm gánh nặng triệu chứng và giảm thiểu tác động sinh lý của hóa trị liều cao được cung cấp trong bối cảnh cấy ghép tủy xương. Thực hiện đạp xe tim mạch ở mức 50% dự trữ nhịp tim làm giảm sự suy giảm hiệu suất thể chất của người tham gia (ví dụ, khoảng cách và tốc độ đi bộ), các biến số sinh lý, giảm bạch cầu trung tính và giảm tiểu cầu, và căng thẳng tâm lý so với nhóm đối chứng. Các thử nghiệm ngẫu nhiên, có đối chứng và đủ mạnh gần đây đã liên tục chứng minh sự cải thiện rõ rệt về mệt mỏi, hoạt động thể chất và sức khỏe tâm thần. Các phương pháp tiếp cận luyện tập thể chất tích hợp dường như vượt trội hơn các phương pháp tiếp cận tâm lý-nhận thức trong việc tăng cường sức khỏe thể chất và chất lượng cuộc sống. Những người sống sót sau ung thư nên tham gia ít nhất 30 phút tập thể dục hiếu khí cường độ trung bình ít nhất 5 ngày mỗi tuần để thấy được những lợi ích này.
Các hoạt động để tăng cường tầm vận động (ROM) rất quan trọng cho việc phục hồi chức năng các co rút mô mềm sau phẫu thuật và sau xạ trị. Cơ sở lý luận cho việc kéo giãn chủ động và thụ động là theo kinh nghiệm. Có bằng chứng giai thoại cho thấy kéo giãn có thể ngăn ngừa, giảm và đảo ngược các co rút do bức xạ. Các hoạt động linh hoạt nên được điều chỉnh tối ưu theo cổng bức xạ và các cơ bị chiếu xạ.
QUẢN LÝ PHÙ BẠCH HUYẾT
Phù bạch huyết là một tình trạng mạn tính và hiện không thể chữa khỏi, thường làm phức tạp hóa liệu pháp ung thư. Sau khi cắt bỏ hoặc chiếu xạ các hạch và mạch bạch huyết, tắc nghẽn bạch huyết có thể phát triển ở bất kỳ vùng nào của cơ thể được dẫn lưu bởi các mạch bạch huyết bị ảnh hưởng. Nếu tắc nghẽn trở nên đủ nghiêm trọng, sưng có thể là kết quả của sự tích tụ dịch giàu protein.
Liệu pháp giải nghẽn toàn diện (CDT) là một hệ thống đa phương thức, hai giai đoạn kết hợp dẫn lưu bạch huyết thủ công (MLD), băng ép co giãn ngắn, chăm sóc da, bài tập trị liệu và quần áo nén đàn hồi. Giai đoạn ban đầu (I) có mục tiêu chính là giảm thể tích phù bạch huyết. Trong các buổi CDT giai đoạn I hàng ngày, bệnh nhân nhận được khoảng 45 phút MLD, sau đó là quấn băng nén và thực hiện các bài tập khắc phục. Băng nén được để nguyên từ 21 đến 24 giờ một ngày. Sau khi giảm thể tích tối đa, bệnh nhân được chuyển dần sang chương trình duy trì dài hạn (giai đoạn II). Trong giai đoạn này, quần áo nén được sử dụng vào ban ngày, với việc quấn băng nén qua đêm. Bệnh nhân thực hiện các bài tập khắc phục hàng ngày trong khi được băng bó và nhận MLD khi cần thiết. Các bài tập khắc phục phù bạch huyết đề cập đến các chuyển động lặp đi lặp lại được thiết kế để khuyến khích các cơn co cơ nhịp nhàng, nối tiếp ở các vùng bị phù bạch huyết. Luyện tập sức mạnh tăng dần khi được giám sát và tiến triển dần dần làm giảm các đợt bùng phát phù bạch huyết, và do đó luyện tập sức mạnh nên được tích hợp vào việc quản lý thường quy phù bạch huyết liên quan đến ung thư vú.
Chăm sóc da được nhấn mạnh trong các phương pháp tiếp cận thủ công đối với phù bạch huyết. Mục tiêu của việc chăm sóc da bao gồm kiểm soát sự xâm chiếm của vi khuẩn và nấm trên da, loại bỏ sự phát triển quá mức ở các kẽ da và hydrat hóa da để loại bỏ các vết nứt nhỏ. Làm sạch hàng ngày bằng xà phòng gốc dầu khoáng sẽ loại bỏ mảnh vụn và vi khuẩn đồng thời giữ ẩm cho da. Theo dõi sự phát triển của viêm mô tế bào là mối quan tâm chính đối với bệnh nhân và các nhà cung cấp dịch vụ chăm sóc phù bạch huyết vì điều này đã được chứng minh là làm tăng đáng kể nguy cơ làm trầm trọng thêm phù bạch huyết ở bệnh nhân ung thư vú.
Phục hồi chức năng cho các Nhóm Bệnh nhân Ung thư Cụ thể
UNG THƯ VÚ
Các suy yếu chức năng đặc thù đối với bệnh nhân ung thư vú phát triển sau các thủ thuật phẫu thuật để loại bỏ khối u và tái tạo vú. Vật lý trị liệu đa yếu tố (tức là kéo giãn và các bài tập) và các bài tập chủ động có hiệu quả để điều trị đau sau phẫu thuật và suy giảm ROM sau khi điều trị ung thư vú. Vật lý trị liệu sau phẫu thuật ung thư vú mang lại một số lợi ích hấp dẫn, bao gồm giảm đau, hạn chế vai (Bảng 29.3), phù bạch huyết và tăng cường sức khỏe tâm lý.
Bảng 29.3 Thiếu hụt Tầm vận động Vai sau Phẫu thuật Nách vì Ung thư Vú | Thời gian đã trôi qua sau Phẫu thuật Ung thư Vú
| Thời gian sau phẫu thuật ung thư vú | 6 tuần | 3 tháng | 6 tháng | 9–12 tháng | 24 tháng | >2 năm |
|---|---|---|---|---|---|---|
| Chỉ số kết quả | ALND/SLNB | SLNB | ALND/SLNB | ALND/SLNB | ALND/SLNB | ALND/SLNB |
| Giảm trung bình so với đường nền (dạng cùng bên) | 26,4° / 24,7° | 21,0° / 5,5° | ||||
| Chênh lệch trung bình so với vai không được điều trị (dạng) | 4,2° | 2,3° / 1,5° | 6,3° / 3,1° | 6,4° | ||
| ROM <160° dạng | 1,9° | 1,9° / 2,5° | ||||
| ROM <20° so với giá trị bình thường ≥1 mặt phẳng | 14% | 8% | ||||
| Tự báo cáo hạn chế ROM | 11,3% | 16% / 34% | 8% | |||
| ROM < giá trị tiêu chuẩn ở bất kỳ mặt phẳng nào | 27% / 0% | 21% / 0% | 35% | |||
| ROM trung bình (bình thường 180°) | 156,6° / 143,8° (dạng) |
Ung thư Đầu và Cổ Điều trị ung thư đầu và cổ tiếp tục tạo ra một số suy yếu thách thức nhất trong phạm vi phục hồi chức năng ung thư. Nhiều suy yếu trực tiếp làm suy yếu khả năng giao tiếp xã hội của bệnh nhân do biến dạng khuôn mặt, mất khả năng nói tự nhiên hoặc dễ hiểu và không thể ăn uống bình thường. Các vấn đề phục hồi chức năng phổ biến bao gồm liệt dây thần kinh phụ, khô miệng do bức xạ, co rút mô mềm của cổ và các mô mềm thành ngực trước, khó nuốt, khàn giọng, cứng khít hàm và rối loạn chức năng cân cơ. Các suy yếu phát triển trong quá trình điều trị và phục hồi ung thư đầu và cổ. Các can thiệp phục hồi chức năng phải được điều chỉnh cho phù hợp (Bảng 29.15).
Bảng 29.15 Các suy yếu về Phát âm
| Nguyên nhân gây suy giảm phát âm | Các chiến lược bù trừ |
|---|---|
| Sưng và xơ hóa họng/thanh quản do bức xạ | Mấp máy môi |
| Mở khí quản | Cử chỉ |
| Cắt lưỡi một phần hoặc toàn bộ | Viết |
| Giảm duỗi miệng thứ phát do cứng khít hàm | Gật đầu |
| Tiết dịch nhiều | Nói bằng giọng thực quản |
| Liệt họng/thanh quản do tổn thương thần kinh | Nói bằng giọng khí quản–thực quản |
| Thanh quản điện |
LIỆT DÂY THẦN KINH PHỤ
Việc công nhận rằng tỷ lệ chữa khỏi tương đương có thể đạt được với phẫu thuật cắt bỏ bảo tồn hơn đã thúc đẩy sự chuyển đổi từ phẫu thuật cắt bỏ cổ triệt để sang chức năng. Phẫu thuật cắt bỏ cổ chức năng bảo tồn tất cả các cấu trúc có thể được để lại một cách an toàn, tạo ra tỷ lệ bệnh suất vai sau phẫu thuật thấp hơn đáng kể.
Các yếu tố quan trọng của phục hồi chức năng dây thần kinh phụ nên giải quyết việc ngăn ngừa vai đông cứng thông qua ROM chủ động và ROM chủ động-hỗ trợ, tăng cường sức mạnh của các cơ nâng và kéo lại xương vai thay thế, hướng dẫn các kỹ thuật bù trừ cho các hoạt động đòi hỏi dạng vai và gập về phía trước kéo dài, và sửa đổi tư thế (Bảng 29.4).
Bảng 29.4 Lịch trình Vận động Vai
| Ngày sau phẫu thuật | Gập | Dạng | Xoay trong / Xoay ngoài |
|---|---|---|---|
| 1–3 | 40–45° | 40–45° | Theo khả năng chịu đựng |
| 4–6 | 45–90° | 45° | Theo khả năng chịu đựng |
| ≥ 7 | Theo khả năng chịu đựng | Theo khả năng chịu đựng | Theo khả năng chịu đựng |
CO RÚT CỔ
Xơ hóa tiến triển của mô mềm cổ trước và bên có thể rất có vấn đề đối với bệnh nhân ung thư đầu và cổ. Do liều bức xạ cao được cung cấp cho một số bệnh nhân ung thư đầu và cổ, ROM chủ động ở tất cả các mặt phẳng chuyển động của cổ nên được bắt đầu ngay khi có thể một cách an toàn. ROM cổ có thể tiếp tục trong suốt quá trình xạ trị nếu không có sự phá vỡ da đáng kể. Lý tưởng nhất, các hoạt động tầm vận động nên bắt đầu ngay sau phẫu thuật trước khi xạ trị. Sự cân bằng tinh tế giữa tính linh hoạt và việc lành vết thương sau phẫu thuật phải được tôn trọng.
Các kỹ thuật giải phóng xơ hóa thủ công được chỉ định khi ROM bị hạn chế bởi xơ hóa mô mềm mạnh hoặc sự dính của da vào các mô dưới da. Bệnh nhân có thể được dạy tự xoa bóp để tăng cường hiệu quả của các hoạt động ROM. Nén các vùng bị xơ hóa nghiêm trọng làm phá vỡ mô sẹo đã hình thành và ức chế sự tái hình thành của nó. Tiêm độc tố botulinum có thể được thử trong các trường hợp khó chữa. Nếu xơ hóa do bức xạ là một mối quan tâm, kích thích điện thần kinh cơ (NMES) đã được chứng minh là có hiệu quả trong điều trị bệnh nhân ung thư đầu và cổ.
THẬN TRỌNG TRONG PHỤC HỒI CHỨC NĂNG UNG THƯ
Các phương thức vật lý
Phục hồi chức năng nội trú có thể sử dụng một số phương thức để cải thiện khả năng dung nạp trị liệu và kiểm soát đau. Các phương thức trị liệu cụ thể bao gồm áp dụng túi nóng/lạnh, siêu âm, châm cứu khô, kích thích điện và thuốc tại chỗ trong quá trình trị liệu thủ công và xoa bóp. Các bác sĩ phục hồi chức năng nên trao đổi với các nhà trị liệu về sự phù hợp và an toàn của các phương thức đó trước khi thực hiện vì có tranh cãi về sự an toàn trong quần thể ung thư, đặc biệt là liệu các phương thức đó có làm tăng nguy cơ tiến triển của ung thư hay không.
Mặc dù nguy cơ lý thuyết là có thật, điều quan trọng cần lưu ý là phần lớn bằng chứng ủng hộ nguy cơ đó là ý kiến chuyên gia hoặc các mô hình động vật kích thích trực tiếp các tế bào ung thư và chứng minh sự gia tăng lưu lượng máu. Bằng chứng hạn chế ủng hộ rủi ro được phản ánh bởi bằng chứng hạn chế ủng hộ sự an toàn với con người. Có một vài nghiên cứu trường hợp trong quần thể ung thư chứng minh sự an toàn với NMES hoặc kích thích thần kinh điện qua da; tuy nhiên, những nghiên cứu này là ở các quần thể bệnh nhân ung thư tiến triển và chăm sóc giảm nhẹ.
Việc lựa chọn cẩn thận phương thức, vị trí cung cấp phương thức và phân tầng rủi ro so với lợi ích của bệnh nhân là cần thiết (Bảng 29.5). Có thể thận trọng hơn khi tích cực kiểm soát đau cho những bệnh nhân đang ở giai đoạn cuối đời với các mục tiêu chăm sóc được đội ngũ ung thư vạch ra rõ ràng. Đối với những bệnh nhân này, có thể áp dụng quan điểm chăm sóc nhân ái với mục tiêu chính là cải thiện cơn đau và khả năng dung nạp trị liệu để đạt được các lợi ích chức năng cần thiết cho việc sắp xếp và an toàn dự định của họ. Mặc dù hầu hết có thể đồng ý về việc chăm sóc nhân ái với những bệnh nhân về nhà với dịch vụ chăm sóc cuối đời, nhưng ít người có thể đồng ý về rủi ro so với lợi ích đối với những bệnh nhân mới được chẩn đoán và đang ở giai đoạn đầu của quá trình điều trị ung thư. Mối lo ngại về sự tiến triển của ung thư là có thật ngay cả với các phương pháp điều trị ung thư tiêu chuẩn, do đó lợi ích kiểm soát đau ngắn hạn của các phương thức trị liệu bổ trợ nên được đánh giá theo từng trường hợp cụ thể.
Bảng 29.5 Chương trình Phục hồi chức năng sau thủ thuật TRAM
| Tuần | Hoạt động |
|---|---|
| 0–3 | Giáo dục bệnh nhân: Các biện pháp phòng ngừa phù bạch huyết, cơ học cơ thể, an toàn lưng. – Cho phép lái xe sau 3–4 tuần. |
| 3–5 | Vận động: ROM chủ động chi trên (theo khả năng chịu đựng): gập về phía trước nằm ngửa với gậy, xoay ngoài nằm ngửa với gậy, dạng đứng hoặc đi bộ trên tường. Cơ học tư thế: Kéo vai ra sau (quan sát gương), đứng thẳng, ngẩng đầu hoặc gập cằm. Kỹ thuật thủ công khi cần: Dẫn lưu bạch huyết thủ công, vận động sẹo (nếu vết thương đã lành). |
| 6–7 | Giải phóng cân cơ nhẹ nhàng nếu có hạn chế đáng kể. Tập đi bộ nếu cần. Cơ học tư thế: Tiếp tục kéo vai ra sau chủ động trước gương, kéo giãn cơ ngực (bài tập kéo giãn góc tường). Nếu tư thế và căn chỉnh tốt, có thể bắt đầu tăng cường kháng lực nhẹ với dây TheraBand màu vàng (bài tập kéo vai ra sau). |
| 8–12 | Tư thế: Đứng thẳng, nghiêng xương chậu ra sau khi nằm ngửa. Tập ổn định và tăng cường sức mạnh: – Nằm sấp; ổn định xương chậu/thắt lưng đẳng trường (nằm ngửa). – Tăng cường hoặc ổn định cơ duỗi thắt lưng, cơ bụng, cơ chéo. Tập dụng cụ: Bóng vật lý, dây kháng lực. Tập thể dục hiếu khí: Đạp xe, máy chạy bộ. Kỹ thuật thủ công: Vận động sẹo thủ công, giải phóng cân cơ. |
Giảm tế bào máu (Cytopenias)
Giảm bạch cầu và giảm tiểu cầu thường xảy ra sau khi dùng hóa trị. Thời gian và mức độ nghiêm trọng của giảm tế bào máu đã giảm đáng kể thông qua việc giới thiệu các yếu tố kích thích dòng tế bào giúp đẩy nhanh quá trình phục hồi của tủy xương.
Có những hướng dẫn không nhất quán về việc hạn chế hoạt động thể chất khi đối mặt với giảm tế bào máu do hóa trị. Giảm bạch cầu ít được quan tâm hơn giảm tiểu cầu, do nguy cơ liên quan đến xuất huyết nội sọ hoặc chảy máu sau khi té ngã. Tuy nhiên, bệnh nhân trải qua cấy ghép tủy xương đồng loại và tự thân thường trải qua 7 đến 21 ngày với số lượng tiểu cầu từ 5000 đến 12,000. Trong khoảng thời gian này, hầu hết bệnh nhân thực hiện ADL một cách độc lập, đi lại, di chuyển và nâng vật nặng hơn 10 lb nhiều lần mà không bị xuất huyết. Khi chảy máu tự phát xảy ra, nó thường không liên quan đến hoạt động thể chất. Việc hạn chế vật lý trị liệu và tập thể dục không phù hợp ở quần thể này có thể góp phần làm suy nhược nhanh chóng, mất khoáng xương và co rút.
TÓM TẮT
Phục hồi chức năng ung thư là một lĩnh vực đa dạng và đầy thách thức có tầm quan trọng ngày càng tăng đối với sức khỏe cộng đồng. Một cơ sở bằng chứng ngày càng tăng cho thấy rằng các can thiệp phục hồi chức năng thông thường thành công trong việc bảo tồn và phục hồi tình trạng chức năng của bệnh nhân ung thư. Sự thiếu hụt rõ rệt của nghiên cứu dựa trên giả thuyết tiếp tục hạn chế lĩnh vực này, cũng như sự thiếu hụt các bác sĩ lâm sàng có kinh nghiệm và quan tâm. Hy vọng rằng những thiếu sót này sẽ được khắc phục, dựa trên các dự báo về sự gia tăng đều đặn của những người sống sót sau ung thư.
TÀI LIỆU THAM KHẢO
- Abramsen L, Midtgaard J, Rorth M, et al. Feasibility, physical capacity, and health benefits of a multidimensional exercise program for cancer patients undergoing chemotherapy. Supp Care Cancer. 2003;11:707-716.
- Adamsen L, Quist M, Andersen C, et al. Effect of a multimodal high intensity exercise intervention in cancer patients undergoing chemotherapy: randomised controlled trial. BMJ. 2009;339:b3410.
- Agency for Health Care Policy and Research. Acute Pain Management: Operative or Medical Procedures and Trauma. Washington, DC: US Department of Health and Human Services; 1992.
- Ahmed RL, Thomas W, Yee D, et al. Randomized controlled trial of weight training and lymphedema in breast cancer survivors. J Clin Oncol. 2006;24:2765-2772.
- Albornoz CR, Bach PB, Pusic AL, et al. The influence of sociodemographic factors and hospital characteristics on the method of breast reconstruction, including microsurgery: a US population-based study. Plast Reconstr Surg. 2012;129:1071-1079. … (và các tài liệu tham khảo khác)
BẢNG CHÚ GIẢI THUẬT NGỮ Y HỌC ANH – VIỆT – CHƯƠNG 29
| STT | Thuật ngữ tiếng Anh | Phiên âm (IPA) | Nghĩa tiếng Việt |
|---|---|---|---|
| 1 | Cancer Rehabilitation | /ˈkænsər ˌriəˌbɪlɪˈteɪʃən/ | Phục hồi chức năng Ung thư |
| 2 | Prognosis | /prɑɡˈnoʊsɪs/ | Tiên lượng |
| 3 | Multidisciplinary team | /ˌmʌltiˈdɪsəpləˌnɛri tim/ | Đội nhóm đa chuyên ngành |
| 4 | Physiatrist | /fɪˈzaɪətrɪst/ | Bác sĩ Phục hồi chức năng |
| 5 | Oncology | /ɑŋˈkɑlədʒi/ | Ung thư học |
| 6 | Neuropsychologist | /ˌnʊroʊsaɪˈkɑlədʒɪst/ | Nhà tâm lý học thần kinh |
| 7 | Fracture risk | /ˈfrækʃər rɪsk/ | Nguy cơ gãy xương |
| 8 | Venous thromboemboli | /ˈvinəs ˌθrɑmboʊˈɛmbəˌlaɪ/ | Huyết khối tĩnh mạch |
| 9 | Lymphedema | /ˌlɪmfɪˈdimə/ | Phù bạch huyết |
| 10 | Cytopenias | /ˌsaɪtoʊˈpiniəz/ | Giảm tế bào máu |
| 11 | Plexopathies | /plɛkˈsɑpəθiz/ | Bệnh lý đám rối thần kinh |
| 12 | Paraneoplastic syndromes | /ˌpærəˌnioʊˈplæstɪk ˈsɪnˌdroʊmz/ | Hội chứng cận ung thư |
| 13 | Health-related quality of life | /hɛlθ-rɪˈleɪtɪd ˈkwɑləti əv laɪf/ | Chất lượng cuộc sống liên quan đến sức khỏe |
| 14 | Disablement | /dɪsˈeɪbəlmənt/ | Tình trạng khuyết tật |
| 15 | Coexistent disease | /ˌkoʊɪɡˈzɪstənt dɪˈziz/ | Bệnh lý đồng thời |
| 16 | Symptom burden | /ˈsɪmptəm ˈbɜrdən/ | Gánh nặng triệu chứng |
| 17 | Treatment-related toxicities | /ˈtritmənt-rɪˈleɪtɪd tɑkˈsɪsətiz/ | Độc tính liên quan đến điều trị |
| 18 | Premorbid | /priˈmɔrbɪd/ | Tiền bệnh (trước khi mắc bệnh) |
| 19 | Surveillance | /sərˈveɪləns/ | Theo dõi |
| 20 | Recurrence | /rɪˈkɜrəns/ | Tái phát |
| 21 | Temporization | /ˌtɛmpərəˈzeɪʃən/ | Điều trị tạm thời |
| 22 | Palliation | /ˌpæliˈeɪʃən/ | Chăm sóc giảm nhẹ |
| 23 | Functional autonomy | /ˈfʌŋkʃənəl ɔˈtɑnəmi/ | Sự tự chủ chức năng |
| 24 | Combined modality therapy | /kəmˈbaɪnd moʊˈdæləti ˈθɛrəpi/ | Liệu pháp đa phương thức |
| 25 | Cumulative toxicities | /ˈkjumjələtɪv tɑkˈsɪsətiz/ | Độc tính tích lũy |
| 26 | Constitutional symptoms | /ˌkɑnstɪˈtuʃənəl ˈsɪmptəmz/ | Các triệu chứng toàn thân |
| 27 | Fatigue | /fəˈtiɡ/ | Mệt mỏi |
| 28 | Anemia | /əˈnimiə/ | Thiếu máu |
| 29 | Psychosocial interventions | /ˌsaɪkoʊˈsoʊʃəl ˌɪntərˈvɛnʃənz/ | Các can thiệp tâm lý xã hội |
| 30 | Endocrine | /ˈɛndoʊkrɪn/ | Nội tiết |
| 31 | Hypothyroidism | /ˌhaɪpoʊˈθaɪrɔɪˌdɪzəm/ | Suy giáp |
| 32 | Hypogonadism | /ˌhaɪpoʊˈɡoʊnæˌdɪzəm/ | Suy sinh dục |
| 33 | Adrenal insufficiency | /əˈdrinəl ˌɪnsəˈfɪʃənsi/ | Suy thượng thận |
| 34 | Glucose intolerance | /ˈɡlukoʊs ɪnˈtɑlərəns/ | Không dung nạp glucose |
| 35 | Exocrine | /ˈɛksoʊkrɪn/ | Ngoại tiết |
| 36 | Xerostomia | /ˌzɪroʊˈstoʊmiə/ | Khô miệng |
| 37 | Myelopathy | /ˌmaɪəˈlɑpəθi/ | Bệnh tủy sống |
| 38 | Cerebrovascular ischemia | /səˌribroʊˈvæskjələr ɪˈskimiə/ | Thiếu máu cục bộ mạch máu não |
| 39 | Dementia | /dɪˈmɛnʃə/ | Sa sút trí tuệ |
| 40 | Leukoencephalopathy | /ˌlukoʊɛnˌsɛfəˈlɑpəθi/ | Bệnh não chất trắng |
| 41 | Cranial neuropathy | /ˈkreɪniəl nʊˈrɑpəθi/ | Bệnh lý thần kinh sọ |
| 42 | Dysmotility | /dɪsˈmoʊtɪləti/ | Rối loạn vận động |
| 43 | Malabsorption | /ˌmæləbˈsɔrpʃən/ | Kém hấp thu |
| 44 | Dysgeusia | /dɪsˈɡjuziə/ | Rối loạn vị giác |
| 45 | Hyperpigmentation | /ˌhaɪpərˌpɪɡmɛnˈteɪʃən/ | Tăng sắc tố |
| 46 | Tinnitus | /ˈtɪnɪtəs/ | Ù tai |
| 47 | Atherosclerosis | /ˌæθəroʊskləˈroʊsɪs/ | Xơ vữa động mạch |
| 48 | Parenchymal fibrosis | /pəˈrɛŋkəməl faɪˈbroʊsɪs/ | Xơ hóa nhu mô |
| 49 | Dysphonia | /dɪsˈfoʊniə/ | Khàn giọng |
| 50 | Osteonecrosis | /ˌɑstioʊnəˈkroʊsɪs/ | Hoại tử xương |
| 51 | Osteoporosis | /ˌɑstioʊpəˈroʊsɪs/ | Loãng xương |
| 52 | Joint contracture | /dʒɔɪnt kənˈtrækʃər/ | Co rút khớp |
| 53 | Retinopathy | /ˌrɛtɪˈnɑpəθi/ | Bệnh võng mạc |
| 54 | Neurogenic bladder | /ˌnʊroʊˈdʒɛnɪk ˈblædər/ | Bàng quang thần kinh |
| 55 | Cachexia | /kəˈkɛksiə/ | Suy mòn |
| 56 | Analgesic | /ˌænəlˈdʒizɪk/ | Thuốc giảm đau |
| 57 | Interventional techniques | /ˌɪntərˈvɛnʃənəl tɛkˈniks/ | Các kỹ thuật can thiệp |
| 58 | Enteral route | /ˈɛntərəl rut/ | Đường tiêu hóa |
| 59 | Nociceptive pain | /ˌnoʊsɪˈsɛptɪv peɪn/ | Đau cảm thụ |
| 60 | Neuropathic pain | /ˌnʊrəˈpæθɪk peɪn/ | Đau thần kinh |
| 61 | Opioid | /ˈoʊpiɔɪd/ | Opioid |
| 62 | Morphine | /ˈmɔrfin/ | Morphin |
| 63 | Hydromorphone | /ˌhaɪdroʊˈmɔrfoʊn/ | Hydromorphon |
| 64 | Oxycodone | /ˌɑksɪˈkoʊdoʊn/ | Oxycodon |
| 65 | Fentanyl | /ˈfɛntənɪl/ | Fentanyl |
| 66 | Methadone | /ˈmɛθəˌdoʊn/ | Methadon |
| 67 | Incident pain | /ˈɪnsɪdənt peɪn/ | Đau đột xuất |
| 68 | Sustained-release | /səˈsteɪnd-rɪˈlis/ | Giải phóng kéo dài |
| 69 | Dose titration | /doʊs taɪˈtreɪʃən/ | Điều chỉnh liều |
| 70 | Rescue doses | /ˈrɛskju doʊsɪz/ | Liều cứu hộ |
| 71 | Equianalgesic dose | /ˌikwiˌænəlˈdʒizɪk doʊs/ | Liều tương đương giảm đau |
| 72 | Cross-tolerance | /krɔs-ˈtɑlərəns/ | Dung nạp chéo |
| 73 | Nonsteroidal anti-inflammatory drugs | /nɑnˈstɛrɔɪdəl ˌænti-ɪnˈflæməˌtɔri drʌɡz/ | Thuốc chống viêm không steroid |
| 74 | Acetaminophen | /əˌsitəˈmɪnəfən/ | Acetaminophen |
| 75 | Tricyclic antidepressants | /traɪˈsaɪklɪk ˌæntidɪˈprɛsənts/ | Thuốc chống trầm cảm ba vòng |
| 76 | Serotonin-norepinephrine reuptake inhibitors | /ˌsɛrəˈtoʊnɪn-ˌnɔrɛpɪˈnɛfrɪn riˈʌpteɪk ɪnˈhɪbɪtərz/ | Thuốc ức chế tái hấp thu serotonin-norepinephrine |
| 77 | Anticonvulsants | /ˌæntikənˈvʌlsənts/ | Thuốc chống co giật |
| 78 | Bisphosphonates | /bɪsˈfɑsfəˌneɪts/ | Bisphosphonat |
| 79 | Cannabinoids | /kəˈnæbɪˌnɔɪdz/ | Cannabinoid |
| 80 | Capsaicin | /kæpˈseɪɪsɪn/ | Capsaicin |
| 81 | Botulinum toxin | /ˌbɑtʃəˈlaɪnəm ˈtɑksɪn/ | Độc tố botulinum |
| 82 | Bone metastases | /boʊn mɪˈtæstəˌsiz/ | Di căn xương |
| 83 | Radiopharmaceuticals | /ˌreɪdioʊˌfɑrməˈsutɪkəlz/ | Dược phẩm phóng xạ |
| 84 | Orthotics | /ɔrˈθɑtɪks/ | Dụng cụ chỉnh hình |
| 85 | Osteolytic lesions | /ˌɑstioʊˈlɪtɪk ˈliʒənz/ | Tổn thương tiêu xương |
| 86 | Pathologic fractures | /ˌpæθəˈlɑdʒɪk ˈfrækʃərz/ | Gãy xương bệnh lý |
| 87 | Orthopedic oncology | /ˌɔrθəˈpidɪk ɑŋˈkɑlədʒi/ | Ung thư chỉnh hình |
| 88 | Orthoses | /ɔrˈθoʊsiz/ | Dụng cụ chỉnh hình (số nhiều) |
| 89 | Assistive devices | /əˈsɪstɪv dɪˈvaɪsɪz/ | Thiết bị hỗ trợ |
| 90 | Brain tumors | /breɪn ˈtumərz | U não |
