Sperling Nội tiết học Nhi khoa, Ấn bản thứ 5 – Biên dịch: Ths.Bs. Lê Đình Sáng
Sperling Pediatric Endocrinology, Fifth Edition
Tác giả: Sperling, Mark A., MD – Nhà xuất bản: Elsevier Inc.
PHẦN III. NỘI TIẾT HỌC TRẺ EM VÀ THANH THIẾU NIÊN
Chương 13. Rối Loạn Tuyến Giáp ở Trẻ em và Thanh Thiếu niên
Scott Rivkees; Andrew J. Bauer
Thyroid Disorders in Children and Adolescents
Sperling Pediatric Endocrinology, 13, 395-424
Mở đầu
Bệnh lý tuyến giáp có thể biểu hiện với các triệu chứng rõ rệt, diễn tiến âm thầm, hoặc chỉ với tình trạng phì đại tuyến giáp đơn thuần. Bệnh lý tuyến giáp ở trẻ em có thể bao gồm các bất thường sinh hóa đơn độc ít hoặc không gây ra hậu quả sinh lý, hoặc biểu hiện với các triệu chứng lâm sàng rõ ràng. Về mặt lâm sàng, suy giáp xảy ra phổ biến hơn cường giáp. Các nhân và khối u tuyến giáp ít gặp hơn nhiều so với các rối loạn chức năng nhưng có thể là dấu hiệu của ung thư tuyến giáp. Hộp 13.1 cung cấp phân loại các rối loạn tuyến giáp ở trẻ em. Chương này tập trung vào các tình trạng phổ biến nhất ảnh hưởng đến tuyến giáp của trẻ em và thanh thiếu niên.
| Hộp 13.1. Các Rối Loạn Tuyến Giáp ở Trẻ em và Thanh Thiếu niên
Bệnh tuyến giáp tự miễn
Viêm tuyến giáp nhiễm trùng
Bất thường protein gắn kết
Đột biến thụ thể TSH
Hội chứng đề kháng hormone tuyến giáp
Hội chứng thiếu iốt
Bướu giáp lan tỏa không độc
MEN, đa u tuyến nội tiết; TBG, globulin gắn thyroxine; TSH, hormone kích thích tuyến giáp. |
Hormone Tuyến Giáp và Tác Động
Rất ít hormone có vai trò sâu sắc và thiết yếu đối với sinh lý con người như hormone tuyến giáp. Các hormone chính do tuyến giáp tiết ra bao gồm tetraiodothyronine, hay thyroxine (T4), và triiodothyronine (T3). Quá trình sản xuất các hormone này bao gồm nhiều bước sinh hóa riêng biệt được trình bày trong Hình 13.1. Trong số các hormone này, T3 đóng vai trò then chốt trong việc ảnh hưởng đến sinh lý, là phân tử chủ yếu gắn vào thụ thể hormone tuyến giáp (TRs). Thụ thể hormone tuyến giáp trong nhân thuộc siêu họ thụ thể steroid hormone–axit retinoic và là một chất điều hòa phiên mã axit deoxyribonucleic (DNA).
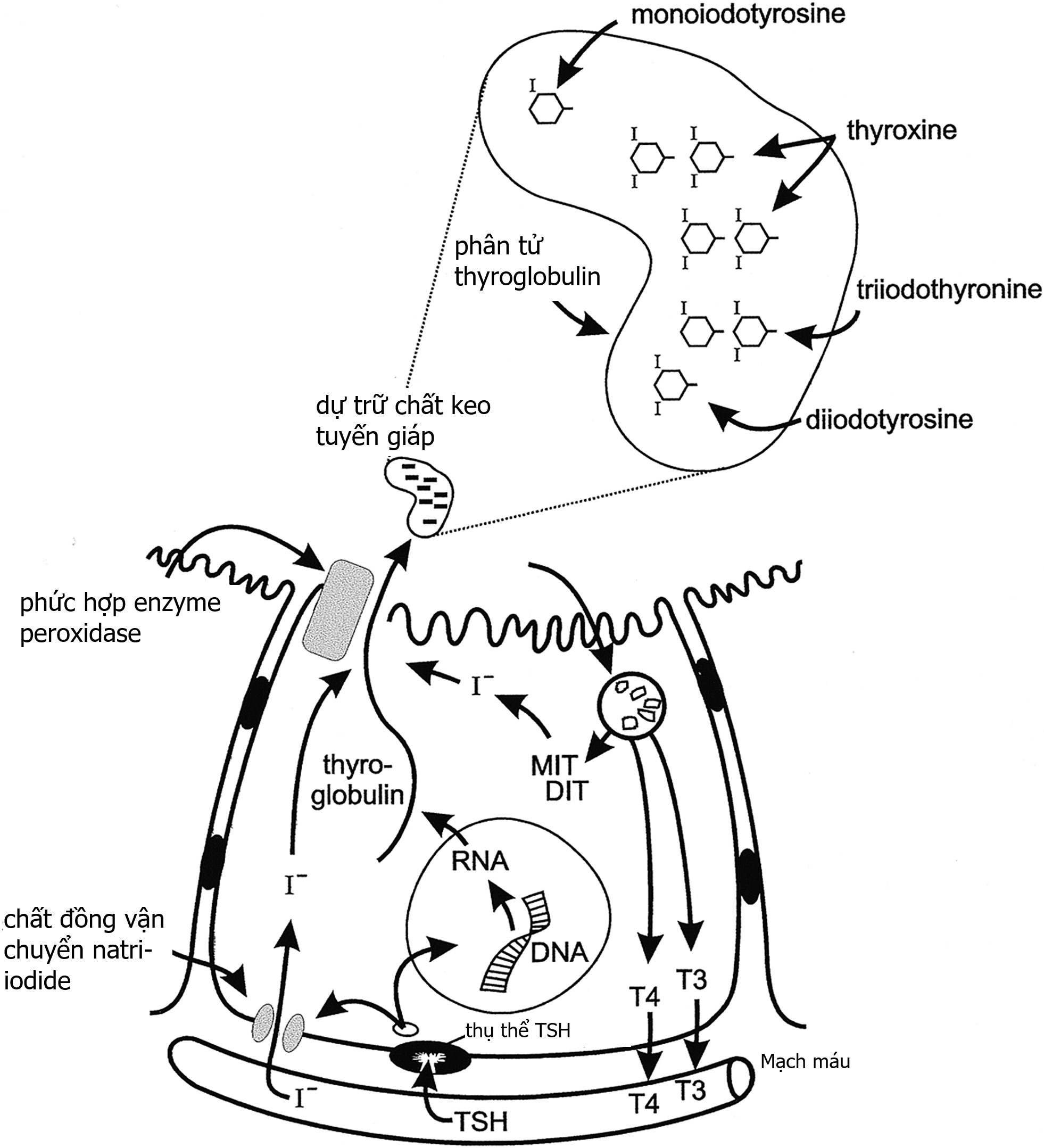
Hình 13.1 Minh họa quá trình tổng hợp và bài tiết hormone tuyến giáp. Hormone kích thích tuyến giáp (TSH) điều hòa quá trình này thông qua thụ thể TSH trên màng tế bào huyết tương liên kết với protein G. Việc TSH gắn vào sẽ kích thích tổng hợp thyroglobulin và symporter natri-iodide (chất vận chuyển iodide) hấp thu iodide từ tuần hoàn. Iodide khuếch tán trong bào tương đến màng đỉnh và được vận chuyển đến lòng nang bởi Pendrin, một chất trao đổi thuộc họ anion-bicarbonate, cung cấp iodide cho phức hợp enzyme hữu cơ hóa (Pendrin; thyroid peroxidase, TPO, THOX). Các gốc tyrosine của thyroglobulin được iod hóa tại màng tế bào đỉnh và được xúc tác bởi thyroid peroxidase, enzyme hữu cơ hóa. Các gốc monoiodotyrosine (MIT) và diiodotyrosine (DIT) tạo thành sẽ kết hợp để hình thành các iodothyronine là thyroxine (T4) và triiodothyronine (T3) bên trong phân tử thyroglobulin dự trữ. TSH kích thích quá trình vi ẩm bào các giọt chất keo và quá trình phân giải protein thyroglobulin tuần tự trong các phagolysosome được tạo thành. T4 và T3 được bài tiết vào tuần hoàn. Các MIT và DIT không kết hợp sẽ được khử iod bởi iodotyrosine deiodinase để giải phóng iodide, phần lớn được tái sử dụng trong tế bào nang. (Trích từ Fisher and Greuters [2008] Thyroid disorders in childhood and adolescence. Trong: Pediatric Endocrinology, M. Sperling, biên tập, tái bản lần 3, Saunders, Philadelphia, trang 227–253).
Hai gen mã hóa cho TR; một gen trên nhiễm sắc thể 17 được đặt tên là alpha (TRa) và một gen trên nhiễm sắc thể 3 được đặt tên là beta (TRb). Các TR có thể tồn tại dưới dạng monomer hoặc homodimer, và chúng có thể dimer hóa với các thành viên khác trong họ thụ thể nhân. Sau khi T3 gắn vào TR, quá trình phiên mã gen được điều hòa ở nhiều mô.
T4 là hormone chủ yếu được giải phóng từ các tế bào nang tuyến giáp. Sau khi giải phóng, nó lưu thông ở trạng thái gắn kết với protein và tự do với tỷ lệ khoảng 1000 trên 1. Các protein gắn hormone tuyến giáp trong máu bao gồm globulin gắn thyroxine (TBG), prealbumin hay transthyretin, và albumin. TBG là protein vận chuyển chủ yếu cho T4; TBG và albumin cũng vận chuyển T3. Trong một nghiên cứu về tình trạng bình giáp, nồng độ T4 tự do (FT4) và T3 tự do trong tuần hoàn lần lượt chiếm khoảng 0,03% và 0,30% tổng nồng độ hormone.
Điều quan trọng cần nhận biết là nồng độ hormone tuyến giáp và các protein vận chuyển trong tuần hoàn thay đổi theo tuổi (Bảng 13.1 và Bảng 13.2). Nồng độ T4 tự do và T3 tự do trung bình tuyệt đối lần lượt là khoảng 10 và 4 pg/mL, và khác nhau theo độ tuổi. Ở thanh thiếu niên và người lớn, nồng độ trong huyết tương của các protein gắn kết là 1 đến 3 mg/dL đối với TBG, 20 đến 30 mg/dL đối với prealbumin gắn thyroxine, và 2 đến 5 g/dL đối với albumin. Nồng độ TBG ở trẻ em cao hơn ở người lớn, và giảm xuống mức của người lớn trong giai đoạn thanh thiếu niên. Vì các protein gắn hormone tuyến giáp được sản xuất ở gan, chúng là các chất phản ứng giai đoạn cấp, với nồng độ tăng lên trong các bệnh cấp tính, và cũng tăng khi tiếp xúc với estrogen.
Bảng 13.1 Sự Thay Đổi Theo Tuổi của Nồng độ T4, TSH, TBG, và Thyroglobulin (Tg) trong Huyết Thanh
| Tuổi | TSH a (μU/mL) | T4 b (μg/dL) | TBG b (mg/dL) | Tg b (ng/mL) |
|---|---|---|---|---|
| Máu cuống rốn | 1–20 | 6.6–15 | 0.8–5.2 | 15–101 |
| 1–7 ngày | 1–39 | 11–22 | 0.8–5.2 | 1–110 |
| 1–4 tuần | 0.5–6.5 | 8.2–17 | 0.6–5 | 11–92 |
| 1–12 tháng | 0.5–6.5 | 5.9–16 | 1.6–3.6 | 12–113 |
| 1–5 tuổi | 0.6–8 | 7.3–15 | 1.4–2.8 | 5–72 |
| 6–10 tuổi | 0.6–8 | 6.4–13 | 1.4–2.8 | 3–40 |
| 11–15 tuổi | 0.6–8 | 5.5–12 | 1.4–2.8 | 3–40 |
| 16–20 tuổi | 0.5–6 | 4.2–12 | 1.4–2.8 | 2–36 |
| 21–50 tuổi | 0.5–6 | 4.3–12 | 1.2–2.6 | 2–35 |
T4, Thyroxine; TBG, globulin gắn thyroxine; TSH, hormone kích thích tuyến giáp.
(Trích từ Fisher, D.A., & Vanderschueren-Lodeweycky, M. (1985). Laboratory tests for thyroid diagnosis in infants and children. Trong: Delange,F., Fisher, D.A. (Chủ biên). Pediatric Thyroidology (trang 127–142). Basel: Karger; Walfish, P G., & Tseng, K.H. (1989). Thyroid physiology and pathology. Trong: Collu, R., Ducharme, J.R., Guyda H. (Chủ biên), Pediatric Endocrinology (trang 367–448). New York: Raven; Delange, F., Dahlem, A., Bourdoux, P., et al (1984). Increased risk of primary hypothyroidism in preterm infants. Pediatrics, 105, 462; Pazzino, V., Filetti, S., Belfiore, A., et al. (1981). Serum thyroglobulin levels in the newborn. J Clin Endocrinol Metab, 52, 3634; Delange, F. (1993). Thyroid hormones: biochemistry and physiology. Trong: J. Bertrang, J., R. Rappaport, R., P. C. Sizonenko P.C., (Chủ biên), Pediatric Endocrinology (trang 242–251). Baltimore: Williams and Wilkins; Lazar, L., Frumkin, R. B., Battat, E., et al. (2009). J Clin Endocrinol Metab, 94, 1678–1682.)
Bảng 13.2 Sự Thay Đổi Theo Tuổi của Nồng độ T3, rT3, T4 Tự do, và T3 Tự do trong Huyết Thanh
| T3 a (ng/dL) | rT3 a (ng/dL) | T4 tự do b (ng/dL) | T3 tự do b (pg/mL) | |
|---|---|---|---|---|
| Máu cuống rốn | 14–86 | 100–501 | 1.2–2.2 | — |
| 4–7 ngày | 36–316 | 34–258 | 2.2–5.3 | 1.3–6.1 |
| 1–4 tuần | 105–345 | 26–290 | 0.9–2.3 | 2.2–8 |
| 1–12 tháng | 105–245 | 11–129 | 0.8–2.1 | 2.5–7 |
| 1–5 tuổi | 105–269 | 15–71 | 0.8–2 | 2.8–5.2 |
| 6–10 tuổi | 94–241 | 17–79 | 0.8–2 | 2.8–5.2 |
| 11–15 tuổi | 83–213 | 19–88 | 0.8–2 | 2.9–5.6 |
| 16–20 tuổi | 80–210 | 25–80 | 0.8–2 | 2.4–5 |
| 21–50 tuổi | 70–204 | 30–80 | 0.9–2.5 | 2.4–4.4 |
T3, Triiodothyronine; rT3, T3 đảo ngược; T4, thyroxine.
(Trích từ Delange, F. (1993). Thyroid hormones: biochemistry and physiology. Trong: Bertrang, J., Rappaport, R., Sizonenko, P.C. (Chủ biên), Pediatric endocrinology (trang 242–251). Baltimore: Williams and Wilkins; Lucas, C., Carayan, P., Bellhilehi, J., & Giraud, F. (1980). Changes in levels of free thyroid hormones in children from 1 to 16 years: comparison with other thyroid indices. Pediatric, 35, 197; Nelson, J. C., Clark, S. J., Borut, D. L., et al. (1993). Age related changes in serum free thyroxine during childhood adolescence. J Pediatr, 123, 899.)
Sự chuyển đổi T4 thành T3 liên quan đến quá trình khử iod của T4 (Hình 13.2). Quá trình monodeiodination của vòng beta hoặc vòng ngoài bởi monodeiodinase (MD) loại II tạo ra T3. Quá trình monodeiodination của vòng alpha hoặc vòng trong tạo ra T3 đảo ngược (rT3), không có hoạt tính chuyển hóa. Trong điều kiện bình thường, T3 và rT3 được sản xuất với tốc độ tương đương. Khoảng 70% đến 90% T3 trong tuần hoàn có nguồn gốc từ chuyển đổi T4 ở ngoại vi, và 10% đến 30% T3 trong tuần hoàn đến từ tuyến giáp. Phản ánh những thay đổi liên quan đến tuổi tác của các hormone điều hòa sự ổn định T4, độ thanh thải T4 thường giảm từ giai đoạn sơ sinh đến tuổi trưởng thành (Bảng 13.3).
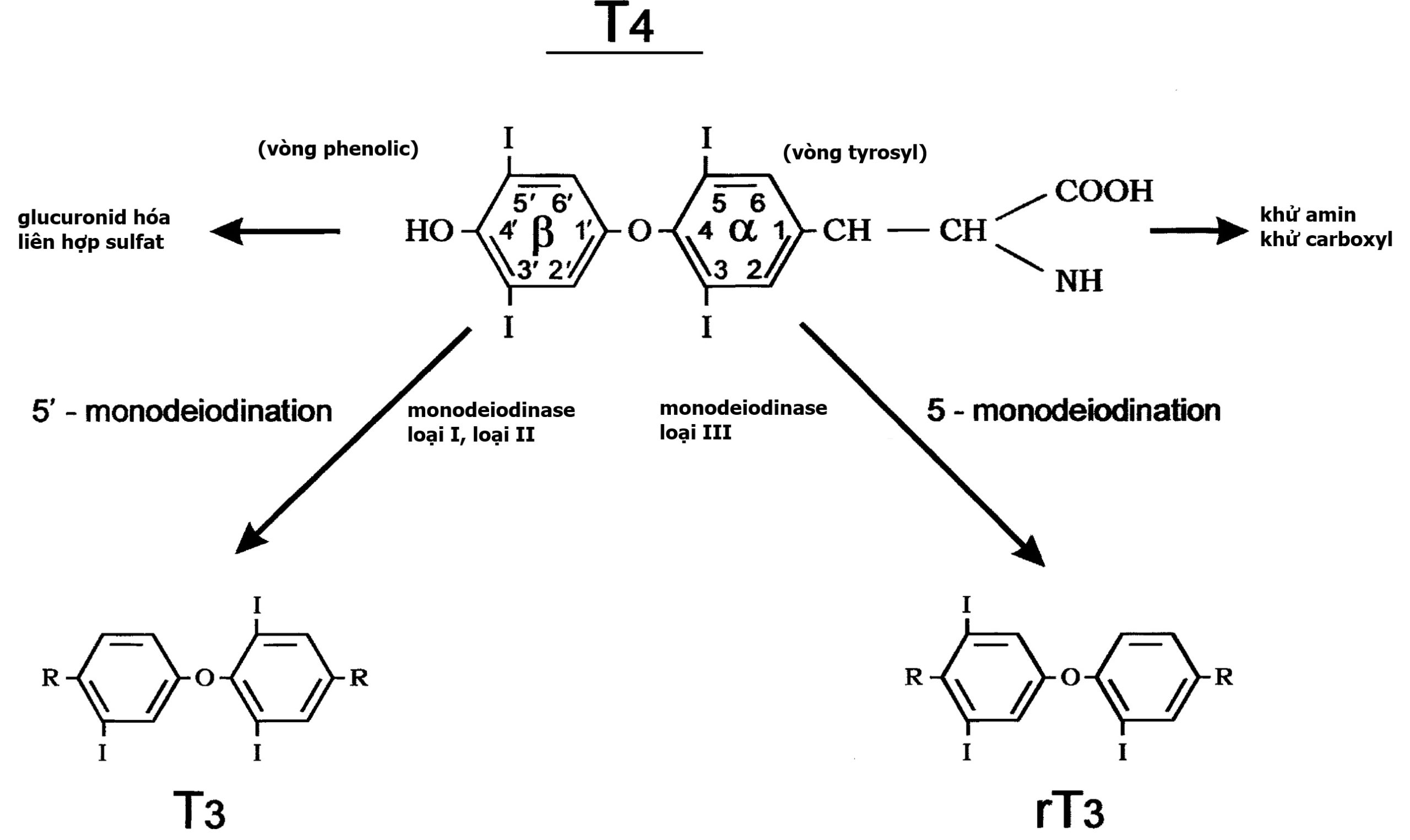
Hình 13.2 Chuyển hóa của thyroxine (tetraiodothyronine). Con đường chuyển hóa chính là quá trình monodeiodination tuần tự được trung gian bởi ba enzyme iodothyronine monodeiodinase loại I, loại II, và loại III. Quá trình monodeiodination 5’ ở vòng ngoài (phenolic) tạo ra 3,5,3’ triiodothyronine có hoạt tính. Quá trình monodeiodination 5’ ở vòng trong (tyrosyl) tạo ra 3,3,5’ triiodothyronine đảo ngược không có hoạt tính. Deiodinase loại I cũng có khả năng thực hiện monodeiodination ở vòng trong. Chuỗi bên alanine của vòng tyrosyl cũng chịu các phản ứng thoái giáng, bao gồm khử amin và khử carboxyl. Các phản ứng liên hợp sulfat và glucuronide tại vị trí vòng phenolic 4’ xảy ra chủ yếu ở mô gan. (Trích từ Fisher and Greuters [2008] Thyroid disorders in childhood and adolescence. Trong: Pediatric Endocrinology, M. Sperling, biên tập, tái bản lần 3, Saunders, Philadelphia, trang 227–253).
Bảng 13.3 Sự Thay Đổi trong Chuyển Hóa Thyroxine Ngoại Vi Theo Tuổi
| Thông số động học Thyroxine | Trẻ em (3–9 tuổi) | Thanh thiếu niên (10–16 tuổi) | Người lớn (23–26 tuổi) |
|---|---|---|---|
| Thời gian bán thải (ngày) | 5 (0.13) | 6 (0.35) | 6.7 (0.30) |
| Độ thanh thải theo phân suất b | 0.14 (0.005) | 0.12 (0.008) | 0.11 (0.004) |
| Thể tích phân bố (L/kg) | 0.16 (0.008) | 0.16 (0.014) | 0.12 (0.005) |
| Tốc độ chuyển hóa Thyroxine (μg/kg/ngày) | 1.9 (0.09) | 1.5 (0.07) | 1.1 (0.06) |
a (Trích từ Beckers, C., Malvaux, C., & De Visscher, M. (1966). Quantitative aspects of the secretion and degradation of thyroid hormones during adolescence. J Clin Endocrinol Metab, 26, 202–306; Sterling, K., & Chodos, R. (1956). Radiothyroxine turnover studies in myxedema, thyrotoxicosis and hypermetabolism without endocrine disease. J Clin Invest, 35, 806–813.)
Điều Hòa Chức Năng Tuyến Giáp
Việc sản xuất T4 và T3 trong tuyến giáp được điều hòa bởi hormone kích thích tuyến giáp ([TSH]; còn gọi là thyrotropin), được giải phóng từ thùy trước tuyến yên (Hình 13.3). Các thụ thể TSH có mặt trên các tế bào nang tuyến giáp và là các thụ thể liên kết với protein G với một đầu amino ngoại bào lớn. Đột biến của thụ thể TSH có thể dẫn đến kích hoạt thụ thể liên tục gây cường giáp nặng, trong khi các đột biến bất hoạt dẫn đến không đáp ứng với TSH và do đó gây suy giáp.
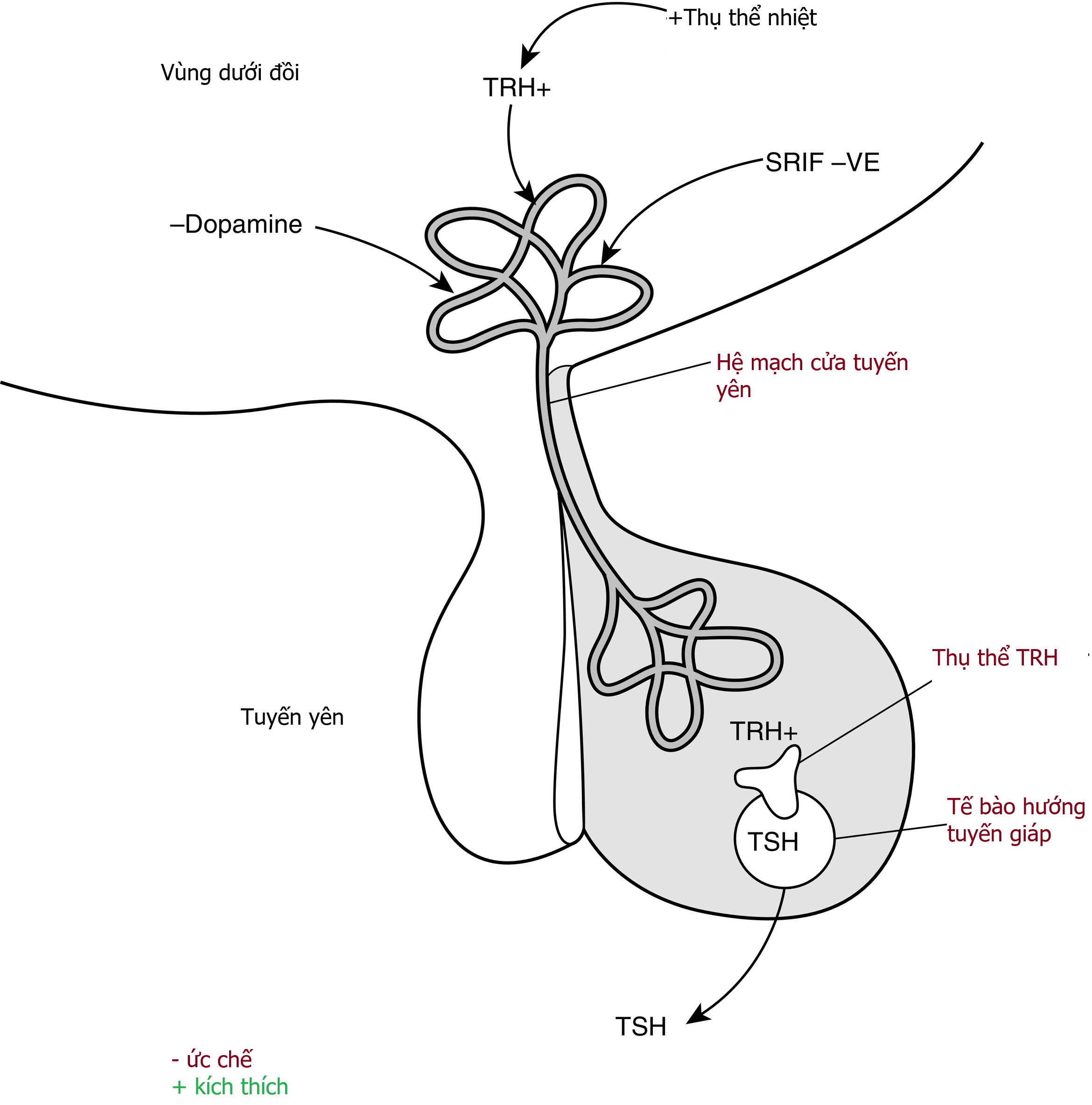
Hình 13.3 Trục hạ đồi-tuyến yên-kích thích tuyến giáp (TSH). Hormone giải phóng thyrotropin (TRH) được tiết vào hệ mạch cửa tuyến yên kích thích tổng hợp và bài tiết TSH từ tế bào thyrotroph của tuyến yên. Việc bài tiết TRH được điều hòa bởi các cảm biến nhiệt trung ương và ngoại vi. Dopamine hoặc somatostatin (SRIF) có thể ức chế giải phóng TSH. (Trích từ Fisher and Greuters [2008] Thyroid disorders in childhood and adolescence. Trong: Pediatric Endocrinology, M. Sperling, biên tập, tái bản lần 3, Saunders, Philadelphia, trang 227–253).
Sự kích hoạt thụ thể TSH kích thích tích lũy adenylate cyclase trong các tế bào nang, từ đó gây ra sự tích lũy cyclic adenosine monophosphate (cAMP). Nồng độ cAMP tăng trong tế bào thúc đẩy việc bẫy iodide, tổng hợp iodotyrosine, tổng hợp thyroglobulin (TG) và giải phóng hormone.
Việc giải phóng TSH được điều hòa bởi hormone của vùng dưới đồi là hormone giải phóng thyrotropin (TRH) (xem Hình 13.3). Hormone peptide này được sản xuất trong các neuron trung gian của nhân cạnh não thất của vùng dưới đồi và được giải phóng vào hệ tuần hoàn cửa của tuyến yên. Một số chất dẫn truyền thần kinh khác nhau đã được quan sát thấy có ảnh hưởng đến việc giải phóng TRH.
Ngoài sự điều hòa bình thường của hoạt động thụ thể TSH bởi TSH, chức năng tuyến giáp có thể bị ảnh hưởng bất lợi bởi các kháng thể có thể kích thích hoặc ức chế tác động của TSH. Các kháng thể immunoglobulin kích thích thụ thể TSH (TSIs), hoặc các kháng thể thụ thể tuyến giáp (TRAbs), có mặt trong tuần hoàn của những người mắc bệnh Basedow (GD) và kích hoạt các thụ thể TSH. Ngược lại, các immunoglobulin ức chế thụ thể TSH (TBIs) đối kháng tác động của TSH và có thể dẫn đến suy giáp.
Đánh Giá Tình Trạng Tuyến Giáp trên Lâm Sàng và Sinh Hóa
Đánh Giá Lâm Sàng Tuyến Giáp
Bệnh lý tuyến giáp có thể biểu hiện với các triệu chứng rõ rệt, diễn tiến âm thầm, hoặc chỉ với tình trạng phì đại tuyến giáp đơn thuần. Do đó, việc đánh giá tuyến giáp nên được bao gồm trong khám sức khỏe định kỳ của trẻ em. Tuyến giáp có thể được quan sát bằng cách yêu cầu bệnh nhân nhìn lên trần nhà và nuốt. Khi tuyến giáp di chuyển, bờ của tuyến được quan sát để ước tính kích thước và sự đối xứng. Tuyến giáp nên được sờ nắn để đánh giá kích thước, mật độ và sự đối xứng. Điều này có thể được thực hiện khi bác sĩ lâm sàng đứng sau bệnh nhân và sờ nắn cổ bằng các đầu ngón tay. Mật độ của tuyến giáp có thể được đánh giá để xác định xem nó trơn láng hay không đều và có nhân hay không, có thể cảm thấy chắc hoặc mềm. Nếu ghi nhận bất kỳ sự bất đối xứng hoặc đầy bất thường nào của tuyến giáp, nên thực hiện siêu âm vì các nhân tuyến giáp bệnh lý có thể có cảm giác giống như mô bình thường.
Để đánh giá kích thước tuyến, người ta có thể ước tính kích thước của mỗi thùy tuyến giáp so với một muỗng cà phê (5 g) hoặc một muỗng canh (15 g). Nói chung, cho đến cuối tuổi dậy thì, kích thước tuyến (tính bằng gram) xấp xỉ tuổi của bệnh nhân (tính bằng năm) nhân với 0,5 đến 0,7. Do đó, mỗi thùy tuyến giáp của một đứa trẻ 10 tuổi xấp xỉ bằng một nửa muỗng cà phê, với tổng kích thước tuyến là 5 đến 7 g. Đối với thanh thiếu niên và người lớn, mỗi thùy tuyến giáp có thể đạt kích thước một muỗng cà phê với tổng kích thước tuyến khoảng 10 g.
Ở trẻ sơ sinh và trẻ nhỏ, tuyến giáp có thể được khám bằng cách đặt trẻ nằm ngửa trên lòng cha mẹ, đầu hướng về phía đầu gối của cha mẹ. Sau đó, đầu có thể được nhẹ nhàng hạ xuống phía sau để lộ cổ, tạo điều kiện thuận lợi cho việc sờ nắn tuyến giáp. Nếu người khám có thể sờ nắn từng vòng của khí quản từ hõm ức đến trên thanh quản, điều đó cho thấy không có mô tuyến giáp trước khí quản. Sự thiếu vắng này xảy ra trong các trường hợp không hình thành hoặc di chuyển của tuyến giáp. Việc không phát hiện được mô tuyến giáp trước khí quản ở trẻ lớn hơn đòi hỏi phải kiểm tra trực quan đáy lưỡi để tìm mô tuyến giáp lạc chỗ.
Khi một tuyến giáp dưới lưỡi được phát hiện muộn ở trẻ em hoặc thanh thiếu niên, mô này nên được sờ nắn bằng ngón tay đeo găng trong các lần khám định kỳ, vì các nhân và khối u ác tính có thể phát triển trong các tuyến giáp lạc chỗ. Ngược lại, khi một tuyến giáp lạc chỗ được phát hiện ở trẻ sơ sinh và bắt đầu điều trị thay thế, mô tuyến giáp còn lại sẽ teo đi và không gây ra các vấn đề lâu dài.
Đánh Giá Sinh Hóa Chức Năng Tuyến Giáp
Khoảng 97% hormone tuyến giáp được giải phóng từ tuyến giáp là T4. Sau khi giải phóng, ít hơn 1% T4 tồn tại ở dạng tự do. Phần còn lại của hormone tuyến giáp lưu thông gắn với các protein thyroglobulin (TBG; 70%), prealbumin (transthyretin; 10%), và albumin (15% đến 20%). T3 cũng được giải phóng từ tuyến giáp và được tạo ra ở ngoại vi. Mặc dù T4 chiếm phần lớn hormone tuyến giáp trong tuần hoàn, T3 có ái lực lớn hơn nhiều đối với các thụ thể TR trong nhân và gây ra hầu hết các tác động tế bào mạnh mẽ của hormone tuyến giáp.
Chức năng tuyến giáp có thể được đánh giá bằng cách đo nồng độ T4 toàn phần và T3 toàn phần, cùng với các chỉ số phản ánh các protein gắn hormone tuyến giáp (độ hấp thu T3 hoặc T4 trên nhựa). Nồng độ T4 tự do (FT4) ước tính được đo để đánh giá tình trạng hormone tuyến giáp, không bị ảnh hưởng bởi các protein mang.
Một số tình trạng được thấy trong đó nồng độ hormone tuyến giáp bất thường, nhưng cá nhân đó lại bình giáp. Do tính chất khó hiểu, những tình trạng này có thể dẫn đến việc bệnh nhân bị chẩn đoán hoặc điều trị sai lầm về suy giáp hoặc cường giáp.
Khi giá trị FT4 bình thường, nhưng giá trị T4 toàn phần cao, cần xem xét đến tình trạng tăng thyroxine máu do rối loạn albumin gia đình. Rối loạn di truyền trội trên nhiễm sắc thể thường này thường thấy nhất ở người gốc Tây Ban Nha và có thể được chẩn đoán bằng điện di protein gắn hormone tuyến giáp. Nếu giá trị FT4 bình thường nhưng giá trị T4 toàn phần thấp, phải xét đến khả năng thiếu hụt TBG. Thiếu hụt TBG là một rối loạn liên kết với nhiễm sắc thể X có thể liên quan đến mù màu. Trong những tình trạng này và các tình trạng khác ảnh hưởng đến việc gắn kết hormone tuyến giáp, không cần điều trị và bệnh nhân nên được giáo dục về tình trạng này để tránh bị điều trị bởi các bác sĩ không nghi ngờ.
T4 có nhiều hơn trong tuần hoàn và T3 là hormone tuyến giáp hoạt động chuyển hóa mạnh hơn. T3 được sản xuất ở ngoại vi từ T4 và cũng được tuyến giáp tiết ra. Một dạng không hoạt động chuyển hóa của T3′, T3′ đảo ngược, cũng được sản xuất, và nồng độ của nó tăng trong các tình trạng, chẳng hạn như hội chứng bình giáp bệnh, hoặc hội chứng bệnh không do tuyến giáp (xem Hình 13.2).
Điều quan trọng cần xem xét là các giá trị FT4 ước tính có thể không chính xác ở trẻ sơ sinh do nồng độ TBG trong tuần hoàn tăng cao, gây khó khăn cho việc đánh giá sinh hóa ở nhóm tuổi này. Tuy nhiên, nồng độ FT4 được xác định bằng phương pháp thẩm tách cân bằng là chính xác.
Các xét nghiệm thyrotropin hoặc TSH siêu nhạy đã được phát triển, và việc đánh giá TSH đã cải thiện đáng kể việc đánh giá tình trạng tuyến giáp. Nồng độ TSH giúp phân biệt nhiều rối loạn tuyến giáp biểu hiện với nồng độ T4 thấp hoặc cao trong hầu hết các trường hợp. Giá trị TSH trong phạm vi bình thường của xét nghiệm cho thấy tình trạng bình giáp nếu trục hạ đồi-tuyến yên còn nguyên vẹn. Tăng TSH thường cho thấy rối loạn chức năng tuyến giáp nguyên phát; giá trị TSH bị ức chế cho thấy cường giáp. Khi cả nồng độ FT4 và TSH đều tăng, cần xem xét đến các u tuyến yên sản xuất TSH và đề kháng hormone tuyến giáp.
Cường giáp được phân biệt với cường giáp cận lâm sàng, một tình trạng trong đó nồng độ T4, FT4 và T3 bình thường, nhưng nồng độ TSH bị ức chế mà không có bệnh tuyến giáp rõ ràng. Nguyên nhân của cường giáp cận lâm sàng tương tự như cường giáp rõ ràng. Do đó, điều quan trọng là phải đánh giá lại những cá nhân có sự ức chế TSH đơn độc mỗi 3 đến 6 tháng, cho đến khi tình hình lâm sàng tự biểu hiện.
Điều quan trọng trong việc giải thích nồng độ TSH ở trẻ em là nhận ra rằng phạm vi tiêu chuẩn khác với người lớn (xem Hộp 13.1), được xác định bởi giới hạn trên khoảng 4 μU/mL hoặc thấp hơn. Trong các nghiên cứu toàn diện về vấn đề này, giới hạn trên của giá trị TSH ở trẻ em và thanh thiếu niên khỏe mạnh không mắc bệnh tuyến giáp là khoảng 7 μU/mL. Việc áp dụng khoảng tham chiếu của người lớn cho trẻ em do đó dẫn đến chẩn đoán sai suy giáp cận lâm sàng và dẫn đến việc chuyển tuyến không cần thiết của trẻ em đến chăm sóc chuyên khoa bởi các nhà cung cấp dịch vụ chăm sóc ban đầu.
Suy giáp
Các rối loạn của tuyến giáp dẫn đến suy giáp phổ biến hơn nhiều so với cường giáp. Suy giáp có thể xuất hiện khi sinh, mắc phải trong thời thơ ấu hoặc thanh thiếu niên, có hoặc không có triệu chứng, hoặc xuất hiện dần dần hoặc cấp tính.
Công chúng và nhiều bác sĩ thường tin rằng suy giáp có liên quan và là nguyên nhân gây béo phì, nhưng có rất ít bằng chứng ủng hộ quan điểm rằng tình trạng suy giáp góp phần gây béo phì. Điều quan trọng cần lưu ý là nồng độ TSH ở những người béo phì cao hơn một chút so với những người không béo phì. Khi giảm cân, nồng độ TSH trở lại bình thường ở những trẻ này. Do đó, sự tăng nhẹ TSH ở những người béo phì là sinh lý và không cần điều trị.
Suy giáp có thể khó phát hiện, với các triệu chứng chỉ được gợi ra khi hồi cứu. Ở mức độ cực đoan, suy giáp có thể liên quan đến không chịu được lạnh, nhịp tim chậm, nhiễm caroten máu, tóc thô và giòn, da khô, xanh xao và phù niêm. Những triệu chứng này có thể không gây khó chịu, cho phép suy giáp kéo dài không bị phát hiện.
Nguyên nhân phổ biến nhất của suy giáp ở trẻ em là các quá trình tự miễn dẫn đến viêm tuyến giáp Hashimoto. Viêm tuyến giáp tự miễn cũng dẫn đến suy giáp mắc phải ở trẻ vị thành niên, có thể biểu hiện bằng chậm tăng trưởng khi tồn tại mạn tính. Suy giáp ở trẻ em có thể do tiếp xúc với iốt hoặc rối loạn chức năng hạ đồi-tuyến yên. Các nguyên nhân khác của suy giáp bao gồm các chất gây Bướu giáp ngoại sinh, bệnh cystinosis, viêm tuyến giáp cấp tính và xạ trị tuyến giáp trong điều trị ung thư. Suy giáp ở trẻ sơ sinh là một mối quan tâm sức khỏe nghiêm trọng và được phát hiện bởi các chương trình sàng lọc sơ sinh.
Viêm Tuyến Giáp Hashimoto hay Viêm Tuyến Giáp Tự Miễn
Viêm tuyến giáp tự miễn với sự phì đại tuyến giáp là một trong những biểu hiện phổ biến nhất của bệnh lý tuyến giáp ở trẻ em. Nó liên quan đến các kháng thể chống lại thyroglobulin và thyroperoxidase và được đặc trưng bởi sự xâm nhập của tế bào lympho vào tuyến giáp, dẫn đến phì đại tuyến giáp. Tùy thuộc vào bản chất của các kháng thể kháng tuyến giáp, bệnh Hashimoto có thể liên quan đến tình trạng bình giáp, suy giáp hoặc cường giáp thoáng qua.
Viêm tuyến giáp Hashimoto hiếm khi có thể xảy ra ở trẻ sơ sinh rất nhỏ, và thường xuất hiện ở thanh thiếu niên, ảnh hưởng đến nữ nhiều hơn nam. Tuyến giáp thường phì đại lan tỏa và có thể có cảm giác không đều, giống như đá cuội. Sự phì đại tuyến giáp không đối xứng, giống như một nhân tuyến giáp, có thể được ghi nhận. Sự hiện diện của các kháng thể kháng tuyến giáp và không có nhân trên siêu âm có thể phân biệt viêm với các quá trình bệnh lý khác.
Quan trọng là, sự hiện diện của các kháng thể kháng tuyến giáp không báo trước sự phát triển của suy giáp hoàn toàn hoặc một phần cần điều trị. Trong dân số người lớn khỏe mạnh, có tới 5% cá nhân có kháng thể kháng tuyến giáp lưu hành. Ít hơn 10% trong số những cá nhân này sẽ phát triển suy giáp, với những người có kháng thể kháng thyroperoxidase (anti-TPO) cao có nguy cơ cao hơn nhiều so với những người có kháng thể kháng TG.
Ở trẻ em, tỷ lệ mắc kháng thể kháng tuyến giáp ở cấp độ dân số nói chung không được biết đến. Trong số những trẻ có kháng thể kháng tuyến giáp, khoảng 20% được báo cáo sẽ phát triển suy giáp cần điều trị. Những trẻ này thường có hiệu giá kháng thể kháng tuyến giáp rất cao. Do đó, nếu một đứa trẻ được phát hiện có nồng độ kháng thể kháng tuyến giáp thấp, việc đánh giá các chỉ số tuyến giáp mỗi 6 đến 12 tháng và bắt đầu điều trị khi TSH tăng trên giới hạn bình thường trên đối với trẻ em là hợp lý. Tuy nhiên, nếu hiệu giá cao có mặt khi trình bày, việc bắt đầu điều trị tại thời điểm đó là hợp lý.
Nếu không được điều trị ở một số trẻ em, viêm tuyến giáp Hashimoto có thể dẫn đến phì đại tuyến giáp tiến triển và suy giáp. Điều trị bằng levothyroxine ngăn ngừa suy giáp và sự tăng TSH kích thích phì đại tuyến. Khi nồng độ T4 giảm nhẹ (> 5 μ/dL) hoặc bình thường, điều trị có thể được bắt đầu với 1 đến 2 mcg/kg/ngày levothyroxine. Nếu có suy giáp nặng, u giả não có thể phát triển khi trẻ được điều trị bằng liều thông thường. Do đó, điều trị thường được bắt đầu với một phần ba đến một nửa liều levothyroxine thông thường. Sau 2 đến 4 tuần, bệnh nhân có thể được tăng lên liều thông thường. Tuy nhiên, trẻ em bị suy giáp nặng có thể phát triển u giả não, ngay cả khi điều trị được bắt đầu với liều levothyroxine thấp.
Thật thú vị, gần đây đã có báo cáo rằng suy giáp nặng ở trẻ em với TSH tăng > 500 μU/mL, trải qua sự hồi phục hoàn toàn của tình trạng suy giáp. Dựa trên kinh nghiệm của những người khác, trường hợp này rất hiếm gặp.
Mặc dù đã có báo cáo rằng có một số khác biệt về sinh khả dụng đường uống của các chế phẩm levothyroxine khác nhau, từ quan điểm thực tế, những khác biệt này là nhỏ. Do đó, việc sử dụng thường xuyên các hợp chất generic rẻ hơn so với các sản phẩm có thương hiệu đắt tiền hơn là hợp lý.
Thời điểm uống levothyroxine đã là chủ đề của nghiên cứu. Uống thuốc vào giờ đi ngủ có liên quan đến nồng độ T4 cao hơn và nồng độ TSH thấp hơn trong suốt cả ngày. Điều này được cho là liên quan đến sự hấp thu tốt hơn ở đường tiêu hóa vào buổi tối so với ban ngày.
Cũng có đề nghị rằng suy giáp ở thanh thiếu niên có thể được điều trị bằng một liều duy nhất mỗi tuần. Tuy nhiên, phương pháp này không được khuyến nghị, vì nồng độ hormone tuyến giáp cao, ngay sau khi dùng liều, và thấp vào cuối tuần. Điều trị suy giáp bẩm sinh bằng liều levothyroxine hàng tuần cũng có thể dẫn đến chậm phát triển trí tuệ. Cũng được công nhận rằng việc ăn quá nhiều đậu nành có thể cản trở sự hấp thu của levothyroxine.
Đáng chú ý, các liệu pháp tiềm năng khác có thể làm thay đổi quá trình tự miễn về mặt lý thuyết đã được thử nghiệm. Không có lợi ích đã được chứng minh nào được quan sát thấy ở những bệnh nhân đã dùng selenium.
Nhiễm độc giáp do Hashimoto (Hashitoxicosis)
Hiếm khi, bệnh nhân có thể biểu hiện Hashitoxicosis, trong đó sự phá hủy miễn dịch của mô tuyến giáp dẫn đến giải phóng hormone tuyến giáp đã được hình thành sẵn, dẫn đến nồng độ T4 tăng cao. Trái ngược với bệnh Basedow, cường giáp là thoáng qua, không có các dấu hiệu ở mắt, độ hấp thu radionuclide thấp, và không có nồng độ immunoglobulin kích thích tuyến giáp cao.
Viêm tuyến giáp Hashimoto có thể liên quan đến các bệnh tự miễn khác, bao gồm đái tháo đường, suy thượng thận, bạch biến và suy cận giáp. Viêm tuyến giáp tự miễn cũng được thấy ở những bệnh nhân bị bệnh viêm ruột và viêm khớp thiếu niên. Do đó, nên xem xét việc theo dõi hàng năm kích thước tuyến giáp và nồng độ TSH cho trẻ em có các vấn đề tự miễn khác, và các bác sĩ lâm sàng nên cảnh giác với các dấu hiệu cường giáp hoặc suy giáp. Ngược lại, trẻ em bị viêm tuyến giáp tự miễn nên được quan sát các dấu hiệu của đái tháo đường và bệnh Addison.
Tỷ lệ mắc bệnh celiac trong bối cảnh viêm tuyến giáp Hashimoto là khoảng 1%. Nếu bệnh nhân biểu hiện khó chịu ở bụng, sụt cân hoặc các triệu chứng tiêu hóa, nên thực hiện sàng lọc bệnh Celiac, nhưng không cần phải làm thường quy ở trẻ em mắc bệnh tuyến giáp. Chúng tôi đã tìm thấy tỷ lệ 1% bệnh gan tự miễn ở trẻ em mắc bệnh tuyến giáp tự miễn. Vì bệnh gan như vậy có thể tiềm ẩn, chúng tôi đánh giá hàng năm nồng độ transaminase trong tuần hoàn, và nếu nồng độ tăng, sẽ bắt đầu đánh giá bệnh gan có thể có.
Một số nhóm trẻ em có nguy cơ bị viêm tuyến giáp tự miễn. Vì các bé gái mắc hội chứng Turner có khuynh hướng bị viêm tuyến giáp tự miễn, nên nồng độ TSH nên được đánh giá hàng năm. Hội chứng Turner cũng nên được xem xét ở các bé gái bị suy giáp, đặc biệt nếu trẻ chưa dậy thì tại thời điểm biểu hiện. Trẻ em mắc hội chứng Down cũng cần được sàng lọc suy giáp hàng năm.
Suy giáp cận lâm sàng
Suy giáp cận lâm sàng là tình trạng nồng độ T4 và T3 trong tuần hoàn bình thường, nhưng nồng độ TSH tăng. Như đã lưu ý trước đó, nhiều trẻ em bị chẩn đoán sai với tình trạng này khi nồng độ TSH được phát hiện tăng so với giá trị tham chiếu của người lớn. Tuy nhiên, nếu áp dụng nồng độ TSH dựa trên tiêu chuẩn nhi khoa, đại đa số trẻ em được chẩn đoán như vậy sẽ không bị suy giáp. Do đó, một số chuyên gia đã đặt câu hỏi liệu suy giáp cận lâm sàng có phải là một thực thể thực sự ở trẻ em hay không.
Các nghiên cứu về trẻ em có TSH tăng nhẹ (5–10 μU/mL) cho thấy chỉ một phần nhỏ sẽ tiến triển đến TSH tăng trên 10 μU/mL. Dữ liệu cũng cho thấy rằng việc điều trị trẻ em có nồng độ TSH từ 5 đến 10 μU/mL không mang lại lợi ích về thể chất hoặc các lợi ích khác khi được điều trị bằng levothyroxine. Do đó, việc điều trị trẻ em có nồng độ TSH thấp hơn 10 μU/mL là không cần thiết. Đối với trẻ em có nồng độ TSH trên 10 μU/mL, điều trị bằng liều levothyroxine thấp được chỉ định.
Suy giáp Mắc phải ở Trẻ vị thành niên
Khi viêm tuyến giáp tự miễn xảy ra trong thời thơ ấu, nó được gọi là suy giáp mắc phải ở trẻ vị thành niên. Ở trẻ em, suy giáp nặng có thể được dung nạp tốt. Do đó, suy giáp kéo dài có thể không được phát hiện cho đến khi xảy ra chậm tăng trưởng.
Vì suy giáp ở trẻ sơ sinh không được điều trị có liên quan đến chậm phát triển trí tuệ, người ta thường cho rằng suy giáp ở trẻ vị thành niên có liên quan đến các vấn đề học tập và kết quả học tập kém. Quan niệm này không đúng, vì trẻ em bị suy giáp ở trẻ vị thành niên có thể thành công trong học tập và không biểu hiện các vấn đề học tập rõ ràng liên quan đến tình trạng suy giáp, cũng như không bị suy giảm nhận thức.
Trẻ em bị suy giáp nặng có thể biểu hiện không chịu được lạnh, giảm tần suất đi tiêu và giảm hoạt động thể chất. Nhịp tim chậm, mặt phù, phản xạ chậm và nhiễm caroten máu có thể có mặt. So với viêm tuyến giáp Hashimoto, tuyến giáp nhỏ hoặc chỉ phì đại khiêm tốn. Kháng thể kháng tuyến giáp thường có mặt. Những bệnh nhân này thường không béo phì, và chỉ số khối cơ thể tương tự trước và sau khi điều trị. Sự phát triển của trượt chỏm xương đùi có thể xảy ra trước khi phát hiện suy giáp.
Một số trẻ bị suy giáp ở trẻ vị thành niên có thể biểu hiện các dấu hiệu dậy thì mà không có lông mu. Các bé trai có thể biểu hiện tinh hoàn to và các bé gái có thể có kinh nguyệt, có hoặc không có phát triển vú. Khi điều trị tình trạng suy giáp, những đặc điểm này có thể thoái lui. Bằng chứng hiện có cho thấy rằng tình trạng suy giáp dẫn đến tăng tiết gonadotropin, kích hoạt hoạt động của tuyến sinh dục. Ở một số trẻ, dậy thì có thể phát triển trong vòng một hoặc hai năm sau khi bắt đầu điều trị, điều này có thể hạn chế sự tăng trưởng bắt kịp.
Suy giáp ở trẻ vị thành niên có thể không được nhận ra cho đến khi có sự thiếu hụt chiều cao đáng kể, và chiều cao bị mất thường không được phục hồi hoàn toàn. Trẻ em bị suy giáp ở trẻ vị thành niên có biểu hiện chậm tăng trưởng cho thấy giá trị T4 rất thấp, thường dưới 2 mcg/dL, và nồng độ TSH tăng cao rõ rệt, cao hơn 250 μU/mL. Tăng cholesterol máu và thiếu máu có thể có mặt.
Mức độ thiếu hụt chiều cao tỷ lệ thuận với thời gian suy giáp, có thể được ước tính bằng sự khác biệt giữa tuổi theo thời gian và tuổi xương. Khi cá nhân được điều trị bằng liều levothyroxine thông thường, sự trưởng thành xương nhanh chóng được quan sát thấy, với tuổi xương tiến triển nhanh hơn không tương xứng so với sự tăng chiều cao. Do đó, chiều cao dự đoán giảm, và tiềm năng tăng trưởng di truyền không đạt được.
Do kết quả kém của bệnh nhân suy giáp, chúng tôi đã điều trị những bệnh nhân này bằng liều levothyroxine thấp (0,25–0,5 mcg/kg/ngày; ví dụ, 50 mcg cho một đứa trẻ 10 tuổi). Thật thú vị, chúng tôi thấy rằng, với liệu pháp levothyroxine liều thấp, giá trị T4 trở lại bình thường (6–7 mcg/dL) trong vòng 2 tháng, và nồng độ TSH trở lại bình thường hoặc chỉ tăng nhẹ. Khi xác định tuổi xương hàng loạt đã được thực hiện, chúng tôi không quan sát thấy sự tiến triển không tương xứng của tuổi xương như thấy với liệu pháp thông thường. Tuy nhiên, chúng tôi không biết liệu phương pháp này có dẫn đến kết quả chiều cao thuận lợi hơn hay không. Một số người cũng đã đề nghị rằng việc điều trị những trẻ này bằng các chất tương tự hormone giải phóng gonadotropin sẽ dẫn đến sự tăng trưởng dài hạn được cải thiện. Tuy nhiên, chúng tôi đã thấy rằng sự tăng trưởng bắt kịp chậm lại rõ rệt ở một số trẻ suy giáp được điều trị bằng chất tương tự hormone giải phóng gonadotropin và chiều cao người lớn dự đoán giảm và những người khác không quan sát thấy lợi ích bổ sung. Vì sự mất mát chiều cao người lớn tỷ lệ thuận với thời gian suy giáp, việc phát hiện sớm rối loạn này là biện pháp can thiệp tốt nhất để ngăn ngừa thiếu hụt chiều cao.
Suy giáp do Iốt
Iốt là một nguyên tố vi lượng cần thiết cho sự hình thành hormone tuyến giáp (xem Hình 13.1). Lượng iốt ăn vào được khuyến nghị là khoảng 8 pg/kg, hoặc 100 đến 150 pg/ngày, cho thanh thiếu niên và người lớn. Mặc dù lượng iốt khiêm tốn là cần thiết cho chức năng tuyến giáp, việc tiếp xúc với iốt ở mức độ cao dẫn đến sự ức chế cấp tính trong việc giải phóng hormone tuyến giáp đã được hình thành sẵn và làm suy giảm quá trình tổng hợp hormone tuyến giáp, một hiện tượng được gọi là hiệu ứng Wolff-Chaikoff. Khi nghi ngờ suy giáp do iốt, nó có thể được chẩn đoán bằng cách phát hiện nồng độ iốt cao trong các mẫu nước tiểu.
Ở trẻ em, iốt có thể được hấp thụ qua da, và suy giáp do iốt đã được quan sát thấy sau khi sử dụng iốt hoặc betadine trên da. Chúng tôi cũng đã quan sát thấy sự ức chế sản xuất hormone tuyến giáp do iốt ở trẻ em có đường truyền tĩnh mạch trung tâm, khi việc làm sạch thường xuyên vị trí đặt đường truyền bằng iốt được bao gồm trong chăm sóc đường truyền trung tâm. Suy giáp sơ sinh cũng có liên quan đến việc mẹ tiếp xúc với povidone iodine vào thời điểm sinh.
Ở trẻ sinh non, suy giáp do iốt cần được chú ý đặc biệt, vì có ý kiến cho rằng việc tiếp xúc với iốt qua da là nguyên nhân chính gây suy giáp ở trẻ sinh non. May mắn thay, các nghiên cứu cho thấy suy giáp do iốt không phổ biến ở Hoa Kỳ.
Sự tiếp xúc với iốt đáng kể cũng xảy ra từ amiodarone, một loại thuốc chống loạn nhịp tim chứa 37% iốt. Suy giáp xảy ra ở 10% cá nhân được điều trị bằng hợp chất này. Amiodarone cũng có thể đến thai nhi qua đường nhau thai và gây suy giáp ở thai nhi.
Ngoài việc thừa iốt, thiếu iốt cũng dẫn đến suy giáp. Ước tính có hơn 1 tỷ người trên toàn thế giới có nguy cơ thiếu iốt. Về mặt lâm sàng, thiếu iốt có liên quan đến Bướu giáp, suy giáp và bệnh đần độn địa phương.
Ở Hoa Kỳ, có những khu vực địa lý thiếu iốt. Tuy nhiên, với việc sử dụng rộng rãi muối iốt, tỷ lệ thiếu iốt đã giảm đáng kể, và suy giáp và Bướu giáp do thiếu iốt rất hiếm. Đáng chú ý, lượng iốt tiêu thụ ở Hoa Kỳ đã giảm trong thập kỷ qua, một vấn đề có thể có ý nghĩa lâm sàng trong tương lai. Ở Úc, sự giảm lượng iốt tiêu thụ gần đây đã được quan sát thấy, với những tác động tiềm tàng đối với phụ nữ mang thai và cho con bú. Do đó, việc sử dụng độc quyền muối không iốt, bao gồm cả muối biển, không được khuyến khích.
Rối loạn chức năng Hạ đồi-Tuyến yên
Suy giáp trung ương nên được xem xét ở trẻ em có tiền sử chấn thương đầu, u não, viêm màng não, xạ trị hệ thần kinh trung ương, hoặc dị tật hệ thần kinh bẩm sinh. Suy giáp trung ương cũng có liên quan đến việc sử dụng các phối tử chọn lọc thụ thể retinoid X trong điều trị u lympho.
Trái ngược với suy giáp nguyên phát, việc chẩn đoán suy giáp, thứ phát sau rối loạn chức năng hạ đồi-tuyến yên, có thể khó xác định. Thông thường, nồng độ T4 trong tuần hoàn ở mức thấp-bình thường, và nồng độ TSH có thể thấp, bình thường hoặc tăng. Tuy nhiên, giá trị FT4 thường thấp.
Trong khi suy giáp trung ương bẩm sinh sẽ được chẩn đoán ở các tiểu bang thực hiện sàng lọc T4 cho trẻ sơ sinh, các chương trình sàng lọc sơ sinh dựa vào việc xác định TSH sẽ không phát hiện được tình trạng này. Do đó, suy giáp trung ương nên bị nghi ngờ ở trẻ sơ sinh bị ứ mật, chậm tăng trưởng, hạ đường huyết, các vấn đề cấu trúc hệ thần kinh hoặc suy tuyến yên. Khi giải thích giá trị T4 sơ sinh, cũng cần cẩn thận sử dụng giá trị hormone tuyến giáp của trẻ sơ sinh để so sánh, vì nồng độ T4 ở trẻ sơ sinh cao hơn ở người lớn (xem Bảng 13.1 và Bảng 13.2).
Quan trọng là, có tới 30% trẻ em sẽ phát triển suy giáp trung ương có thể có nồng độ T4 và TSH bình thường khi sinh. Do đó, tất cả trẻ em có bằng chứng suy tuyến yên nên được theo dõi thường xuyên về sự khởi phát của suy giáp trung ương.
Khi nghi ngờ suy giáp trung ương, xét nghiệm TRH giúp phân biệt suy giáp tuyến yên (thứ phát) và hạ đồi (tam phát). Hình ảnh hệ thần kinh trung ương cũng nên được thực hiện để tìm kiếm các dị tật bẩm sinh hoặc tổn thương hạ đồi-tuyến yên. Cần cẩn thận tìm kiếm các thiếu hụt hormone tuyến yên khác, đặc biệt là các bất thường của trục hạ đồi-tuyến yên-thượng thận và trục hormone tăng trưởng.
Điều trị bao gồm liệu pháp thay thế bằng levothyroxine. Thật thú vị, một số trẻ em bị suy giáp trung ương cần liều thấp hơn liều dùng để điều trị suy giáp nguyên phát. Vì giá trị TSH không hữu ích trong việc hướng dẫn điều trị, nên khuyến nghị đo nồng độ FT4. Một khuyến nghị là sử dụng liều 1,6 mcg/kg trọng lượng cơ thể. Liều này được phát hiện có liên quan đến việc cải thiện các dấu hiệu thường liên quan đến suy giáp trung ương và cho thấy rằng liều levothyroxine, dựa trên trọng lượng cơ thể, và nhằm mục tiêu nồng độ FT4 ở mức tham chiếu trên, vượt trội hơn so với việc điều chỉnh liều levothyroxine, nhằm mục tiêu nồng độ FT4 bình thường ở giữa ở những bệnh nhân này.
Điều quan trọng cần xem xét là trẻ em bị suy giáp trung ương cũng có thể có các thiếu hụt nội tiết khác. Những cá nhân này đã được chứng minh là có nguy cơ tử vong đột ngột cao hơn.
U máu khổng lồ
Suy giáp có liên quan đến các khối u máu khổng lồ. Ở một số u máu ở trẻ sơ sinh, lớp nội mô của các cấu trúc mạch máu này sản xuất iodothyronine deiodinase loại 3, làm thoái giáng T4 trong tuần hoàn (xem Hình 13.2). Điều trị suy giáp (tiêu thụ) trong bối cảnh này đòi hỏi liều levothyroxine cao.
Suy giáp ở những người sống sót sau ung thư
Được công nhận rộng rãi rằng trẻ em là những người sống sót sau ung thư, đã được xạ trị vùng đầu và cổ, có nguy cơ cao bị ung thư tuyến giáp biệt hóa. Tuy nhiên, phổ biến hơn là sự phát triển của suy giáp nhẹ. Có tới 30% trẻ em đã được xạ trị vùng đầu và cổ sẽ phát triển suy giáp nguyên phát. Do đó, nên sàng lọc TSH hàng năm. Ngoài ra, các nghiên cứu siêu âm được khuyến nghị, bắt đầu 5 năm sau khi tiếp xúc với bức xạ. Các bác sĩ cho rằng chỉ sờ nắn là đủ để theo dõi những cá nhân đã được xạ trị vùng đầu và cổ cần nhận ra rằng siêu âm sẽ phát hiện các nhân tuyến giáp tốt hơn nhiều so với sờ nắn.
Đề kháng Hormone Tuyến Giáp
Hormone tuyến giáp phát huy tác dụng bằng cách gắn vào các thụ thể nhân đặc hiệu để điều hòa biểu hiện gen của tế bào. Khi TR bị đột biến, khả năng đáp ứng của mô bị suy giảm, dẫn đến phì đại tuyến giáp, nồng độ T4 và T3 tăng, nhịp tim nhanh và các vấn đề về hành vi. Không giống như bệnh Basedow, nồng độ TSH bình thường hoặc tăng nhẹ.
Các dạng phổ biến nhất của đề kháng hormone tuyến giáp là do đột biến gen TR beta. Hơn 100 đột biến đã được xác định dẫn đến giảm ái lực với T3. Các TR đột biến cũng ngăn chặn chức năng của các TR bình thường. Do đó, đề kháng hormone tuyến giáp là một đột biến trội-âm, và di truyền là trội trên nhiễm sắc thể thường. Việc phát hiện đề kháng hormone tuyến giáp ở trường hợp chỉ điểm do đó có thể dẫn đến chẩn đoán tình trạng này ở các thành viên khác trong gia đình. Ở 50% trẻ em bị đề kháng hormone tuyến giáp, các đột biến là tự phát.
Hầu hết các cá nhân bị đề kháng hormone tuyến giáp có đề kháng hormone tuyến giáp toàn thể. Những cá nhân này có chuyển hóa bình thường và không có triệu chứng, với nồng độ TSH trong phạm vi bình thường.
Ngược lại, một số cá nhân có đề kháng hormone tuyến giáp tại tuyến yên đơn độc. Những cá nhân này có các triệu chứng cường giáp, vì họ nhạy cảm với tác động của nồng độ hormone tuyến giáp tăng. Đề kháng hormone tuyến giáp cũng có thể liên quan đến các vấn đề của hệ thần kinh trung ương. Khoảng 50% cá nhân bị đề kháng hormone tuyến giáp có rối loạn tăng động giảm chú ý, và một số ít bị chậm phát triển trí tuệ.
Vì các cá nhân bù đắp cho sự đề kháng hormone tuyến giáp bằng cách tiết ra nhiều hormone tuyến giáp hơn, nên việc điều trị thường không cần thiết. Tuy nhiên, bệnh nhân bị đề kháng hormone tuyến giáp có thể bị chẩn đoán không đúng là mắc bệnh Basedow và trải qua phẫu thuật cắt bỏ tuyến giáp. Trong tình huống này, cần điều trị thay thế bằng liều lớn hormone tuyến giáp ngoại sinh. Với việc nhận biết sớm hơn về đề kháng hormone tuyến giáp nhờ sàng lọc sơ sinh, vấn đề liệu trẻ em bị đề kháng hormone tuyến giáp có nên được điều trị trước khi sinh hoặc trong giai đoạn sơ sinh đã được đặt ra. Điều trị thường được dành cho trẻ sơ sinh có nồng độ TSH tăng, chậm tăng trưởng, co giật và chậm phát triển.
Trong một số trường hợp, sự bài tiết TSH có thể rất lớn, dẫn đến phì đại tuyến giáp khổng lồ, có thể ảnh hưởng xấu đến chức năng đường thở trên. Những trường hợp này thường liên quan đến các đột biến mất chức năng nghiêm trọng. Điều trị bằng liều T3 cao mỗi ngày cách nhật đã được chứng minh là có phần hiệu quả trong bối cảnh này. Trong các trường hợp khác, cần phải cắt bỏ tuyến giáp để ngăn ngừa chèn ép đường thở.
Cường giáp
Cường giáp có những ảnh hưởng sâu sắc đến thai nhi, trẻ sơ sinh, trẻ đang lớn và thanh thiếu niên, bao gồm cả các tác động về thể chất và hành vi. Ở trẻ em, nhiễm độc giáp thường tồn tại trong thời gian dài trước khi được nhận biết, góp phần gây ra các vấn đề sức khỏe đáng kể. Một số tình trạng dẫn đến cường giáp ở trẻ em (xem Bảng 13.1), tuy nhiên bệnh Basedow (GD) là nguyên nhân phổ biến nhất, và do đó sẽ là trọng tâm chính của chương này với các phương pháp điều trị được phân tầng (Hình 13.4).
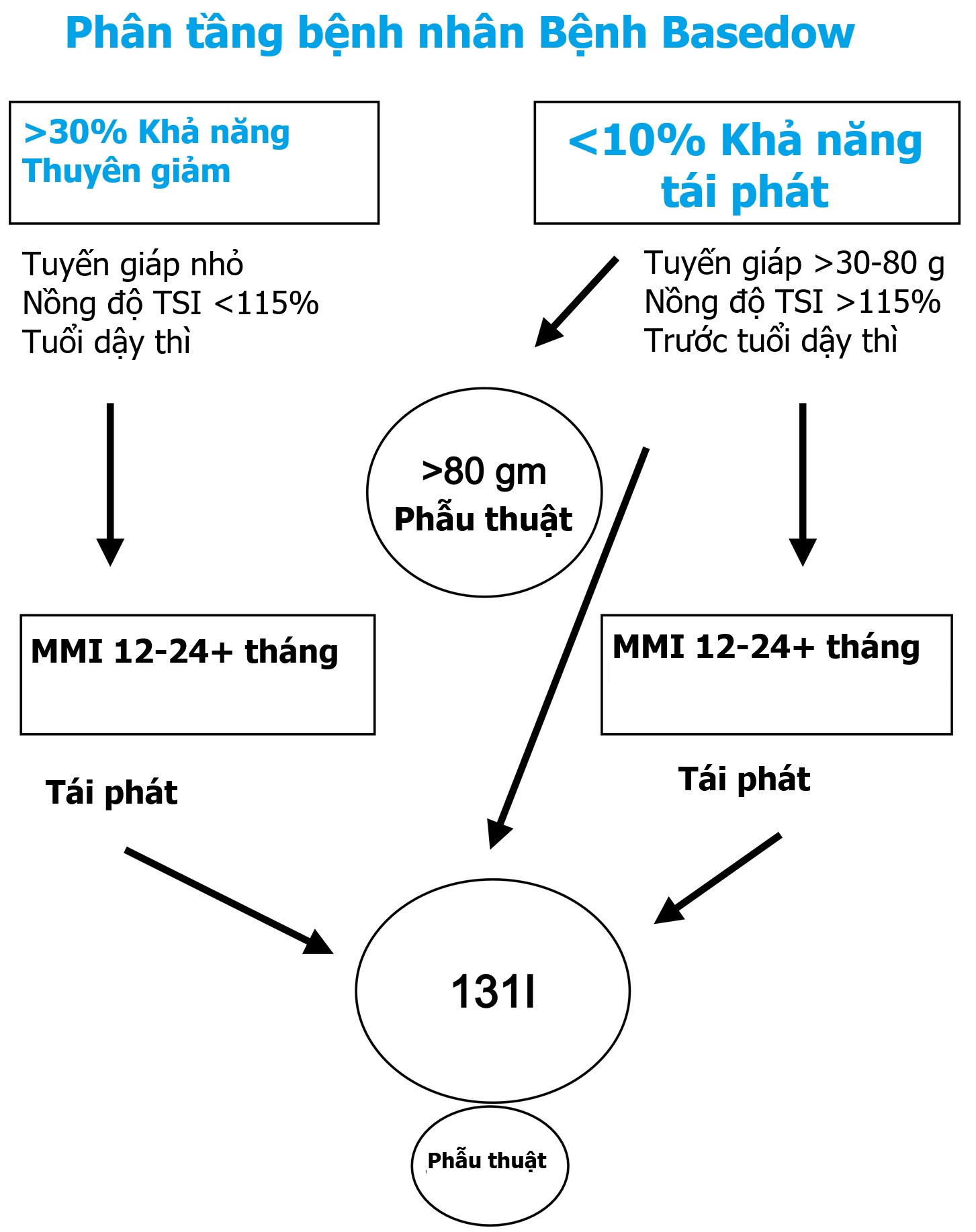
Hình 13.4 Điều trị bệnh Basedow ở trẻ em: phân tầng theo đặc điểm lâm sàng. Bệnh nhân có thể được phân nhóm thành những người có cơ hội thuyên giảm tốt hơn hoặc kém hơn dựa trên tuổi, nồng độ TSI và kích thước tuyến giáp. Đối với các tuyến giáp rất lớn (> 80 g), phẫu thuật là lựa chọn điều trị. Bệnh nhân có thể được điều trị bằng thuốc kháng giáp trong 12 đến 24 tháng và ngưng thuốc để xem có đạt được thuyên giảm hay không. Nếu không có sự thuyên giảm, có thể thực hiện phẫu thuật hoặc iốt phóng xạ. Ngoài ra, bệnh nhân có thể được bắt đầu lại với thuốc kháng giáp. Chỉ nên sử dụng methimazole hoặc carbimazole.
Các nguyên nhân khác gây cường giáp ở trẻ em bao gồm các nhân tuyến giáp hoạt động tự chủ, nhiễm độc giáp do Hashimoto, nhiễm độc giáp sơ sinh và nhiễm trùng tuyến giáp. Cường giáp cũng là kết quả của việc uống hormone tuyến giáp, hội chứng McCune–Albright, bướu giáp buồng trứng và các u tuyến yên sản xuất TSH. Cường giáp dịch tễ cũng đã được ghi nhận khi mô tuyến giáp vô tình được đưa vào các sản phẩm thịt. Một số tình trạng có thể giả dạng cường giáp, bao gồm đề kháng hormone tuyến giáp và các rối loạn protein gắn hormone tuyến giáp, tuy nhiên tốt nhất là không nên điều trị.
Đánh Giá Lâm Sàng Tình Trạng Cường giáp
Bệnh lý tuyến giáp ở trẻ em có thể biểu hiện với các triệu chứng rõ rệt, âm thầm, hoặc chỉ với tình trạng phì đại tuyến giáp đơn thuần. Khi nghi ngờ cường giáp trong thời thơ ấu, bác sĩ lâm sàng nên tìm kiếm các dấu hiệu thực thể (xem Bảng 13.2). Một trong những đặc điểm phổ biến của cường giáp là nhịp tim nhanh. Nếu không có dấu hiệu này, khả năng có cường giáp là không cao. Các đặc điểm lâm sàng khác có thể bao gồm ánh nhìn chằm chằm và lồi mắt, mặc dù các dấu hiệu ở mắt ít xảy ra ở trẻ em hơn người lớn. Quan niệm phổ biến cho rằng trẻ em bị cường giáp thường gầy và sụt cân, nhưng điều này thường không đúng.
Bệnh Basedow
Bệnh Basedow là nguyên nhân phổ biến nhất gây cường giáp ở trẻ em và ảnh hưởng đến 1 trong 10.000 trẻ. Điều thú vị là tỷ lệ mắc bệnh Basedow ở trẻ em có thể đang gia tăng. Là một rối loạn tự miễn, bệnh Basedow gây ra bởi sự kích thích tuyến giáp của các kháng thể TRAbs hoặc TSI, và có liên quan đến các yếu tố di truyền.
Cường giáp có thể gây ra những ảnh hưởng bất lợi sâu sắc ở trẻ em, bao gồm hoạt động thể chất quá mức, run, nhịp tim nhanh, đỏ bừng mặt, đánh trống ngực, sụt cân, tăng trưởng chiều cao nhanh, giảm khoáng hóa xương và kết quả học tập kém. So với người lớn, bệnh mắt xảy ra ở thiểu số bệnh nhân nhi mắc bệnh Basedow, và khi xảy ra, thường ở mức độ nhẹ.
Trong vài năm qua, dữ liệu kết quả bổ sung đã có sẵn để bổ sung cho các nghiên cứu cũ hơn về tỷ lệ thuyên giảm tự nhiên của trẻ em mắc bệnh Basedow. Nhìn chung, các nghiên cứu này cho thấy phần lớn bệnh nhân nhi mắc bệnh Basedow sẽ không thuyên giảm tự nhiên, ngay cả sau nhiều năm điều trị bằng thuốc kháng giáp (ATD) (xem Bảng 13.3). Do đó, hầu hết bệnh nhân nhi sẽ cần điều trị bằng iốt phóng xạ (RAI, 131I) hoặc phẫu thuật.
Điều trị bằng Thuốc kháng giáp
Thuốc kháng giáp (ATD) hoạt động bằng cách ức chế quá trình oxy hóa và gắn kết hữu cơ của iốt tuyến giáp để làm suy giảm sản xuất hormone tuyến giáp và bao gồm methimazole (MMI) và propylthiouracil (PTU). MMI mạnh hơn PTU từ 10 đến 20 lần và có thời gian bán thải dài hơn. Quan trọng là, những loại thuốc này không chữa khỏi tình trạng cường giáp, mà chỉ làm giảm nhẹ tình trạng này, cho đến khi xảy ra thuyên giảm tự nhiên hoặc thực hiện điều trị dứt điểm.
Mỗi loại thuốc này đều có các tác dụng phụ phải được xem xét khi kê đơn. Trước khi bắt đầu điều trị bằng thuốc, phải xây dựng một kế hoạch dự phòng có tính đến tuổi và nguy cơ điều trị của bệnh nhân ngay từ khi bắt đầu điều trị trong trường hợp xảy ra phản ứng độc hại. Việc không xem xét ban đầu các phương pháp điều trị thay thế có thể dẫn đến khủng hoảng khi xảy ra các tác dụng phụ.
Vì phải mất 1 hoặc 2 tháng cho đến khi cường giáp sinh hóa được giải quyết bằng liệu pháp thuốc, việc điều trị bằng thuốc chẹn beta (propranolol, atenolol hoặc metoprolol) có thể được sử dụng để kiểm soát các triệu chứng của bệnh Basedow. Tập trung vào kiểm soát triệu chứng bằng thuốc chẹn beta cũng làm giảm bớt nhu cầu nhận thấy sai lầm về liệu pháp ATD liều cao ban đầu. Vì atenolol không vượt qua hàng rào máu não nhiều như propranolol, bệnh nhân sẽ không cảm thấy mệt mỏi khi dùng thuốc này và do đó được ưa chuộng hơn. Đối với những người có bệnh đường thở phản ứng, có thể sử dụng thuốc chẹn beta chọn lọc tim metoprolol.
Năm 2008, Rivkees đã thu hút sự chú ý của công chúng về một số biến chứng nghiêm trọng liên quan đến liệu pháp PTU ở trẻ em. Tổn thương gan do PTU xảy ra ở 1 trong 2000 trẻ, xảy ra nhanh chóng và thường không thể hồi phục. Việc theo dõi nối tiếp nồng độ transaminase ở trẻ dùng PTU không được xem là hữu ích trong việc giảm nguy cơ độc tính gan. Do đó, cách duy nhất để giảm nguy cơ độc tính gan liên quan đến PTU là tránh sử dụng thuốc này.
Tuy nhiên, PTU có thể cần thiết trong những trường hợp đặc biệt. Những tình trạng này bao gồm các tình huống khi cả điều trị bằng 131I hoặc phẫu thuật kịp thời đều không phải là lựa chọn ở bệnh nhân đã có phản ứng độc hại với MMI và cần dùng thuốc ATD. Trong trường hợp này, việc sử dụng PTU nên là ngắn hạn.
Nếu PTU được kê đơn, bệnh nhân và người giám hộ phải được thông báo về nguy cơ suy gan và cảnh giác với các dấu hiệu và triệu chứng của bất thường gan, bao gồm ngứa, vàng da, chán ăn, phân màu nhạt, nước tiểu sẫm màu và đau bụng. Nếu những triệu chứng này phát triển, bệnh nhân nên ngừng thuốc ngay lập tức, liên hệ với bác sĩ và thực hiện các xét nghiệm để đánh giá chức năng gan và nồng độ transaminase.
MMI hiện là thuốc được lựa chọn cho bệnh cường giáp. Liều MMI được mô tả trong các báo cáo đã công bố dao động từ 0,1 đến 1,0 mg/kg/ngày. Tuy nhiên, không cần sử dụng liều cao khi bắt đầu điều trị, vì các tác dụng phụ của MMI một phần liên quan đến liều. Phản ứng với ATD ảnh hưởng đến nồng độ hormone tuyến giáp trong tuần hoàn không phải là tức thời, và cần vài tháng để nồng độ hormone tuyến giáp trở lại bình thường. Các xét nghiệm chức năng tuyến giáp nên được thực hiện hàng tháng sau khi bắt đầu điều trị. Sau khi nồng độ T4 trở lại bình thường, trong hầu hết các trường hợp, liều MMI có thể giảm một nửa để duy trì tình trạng bình giáp. Mặc dù MMI thường được kê đơn chia liều trong ngày, nhưng dùng một lần mỗi ngày là đủ, và có liên quan đến sự tuân thủ tốt hơn so với nhiều liều hàng ngày.
MMI có sẵn ở dạng viên nén 5, 10 và 20 mg. Khi sử dụng ở trẻ em, có thể sử dụng các liều sau đây là phân số của viên nén: trẻ sơ sinh, 1,25 mg/ngày; 1 đến 5 tuổi, 2,5 đến 5,0 mg/ngày; 5 đến 10 tuổi, 5 đến 10 mg/ngày; và 10 đến 18 tuổi, 10 đến 20 mg/ngày. Vì tình trạng cường giáp có thể liên quan đến số lượng bạch cầu thấp, và bệnh nhân sẽ được điều trị bằng một loại thuốc có thể làm giảm nồng độ bạch cầu trung tính, nên cần làm công thức máu toàn phần khi bắt đầu điều trị.
Liệu pháp MMI không phải là không có nguy cơ. Các tác dụng phụ nhỏ có thể ảnh hưởng đến 20% trẻ em, và các tác dụng phụ lớn có thể xảy ra ở 1% trẻ em. Các tác dụng phụ nhỏ phổ biến nhất liên quan đến MMI là nổi mề đay, đau khớp và giảm bạch cầu trung tính. Trẻ em cũng có thể phát triển các tác dụng phụ lớn, bao gồm mất bạch cầu hạt, hội chứng Stevens-Johnson và viêm mạch. Các biến cố bất lợi của MMI thường xảy ra trong vòng 6 tháng sau khi bắt đầu điều trị. Tuy nhiên, trẻ em có thể phát triển các biến cố bất lợi hơn 12 tháng sau khi bắt đầu điều trị.
Mất bạch cầu hạt là một biến cố bất lợi nghiêm trọng tiềm tàng của ATD và xảy ra ở 0,3% người lớn dùng PTU hoặc MMI. Nguy cơ mất bạch cầu hạt phụ thuộc vào liều và hiếm gặp. Nếu một người đang dùng MMI cảm thấy không khỏe, sốt hoặc viêm họng, nên ngừng MMI ngay lập tức, liên hệ với bác sĩ và làm công thức máu toàn phần.
Lưu ý rằng trong kỷ nguyên chỉ dùng MMI mà chúng ta đang ở, các báo cáo về mất bạch cầu hạt liên quan đến MMI gần đây đã được công bố. Tương tự như việc theo dõi các biến cố bất lợi liên quan đến PTU, điều quan trọng là các biến cố bất lợi liên quan đến MMI phải được theo dõi và báo cáo cho Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ bởi các bác sĩ lâm sàng thông qua chương trình MedWatch.
Thời gian điều trị bằng thuốc kháng giáp và dự đoán sự thuyên giảm
Dựa trên bằng chứng đáng kể, liệu pháp ATD kéo dài sẽ không làm tăng cơ hội thuyên giảm cho hầu hết trẻ em, trong khi ở một số ít trẻ em thì có thể. Do đó, với đánh giá ban đầu của một đứa trẻ mắc bệnh Basedow, các bác sĩ lâm sàng nên cố gắng phân tầng trẻ em thành hai nhóm: trẻ em có 30% đến 40% cơ hội thuyên giảm với liệu pháp ATD kéo dài, và trẻ em có cơ hội thuyên giảm tự nhiên rất nhỏ.
Dữ liệu cho thấy có thể phân biệt bệnh nhân có khả năng thuyên giảm cao hơn với những người có cơ hội thấp hơn nhiều, sau liệu pháp ATD kéo dài. Cơ hội thuyên giảm sau nhiều năm dùng ATD sẽ thấp nếu tuyến giáp lớn (> 2 lần kích thước bình thường theo tuổi), trẻ còn nhỏ (< 12 tuổi), không phải người da trắng, nồng độ TRAb/TSI trong huyết thanh tăng, hoặc bệnh nhân có biểu hiện cường giáp nặng khi trình bày (FT4 > 4 ng/dL).
Các nghiên cứu tiền cứu ở người lớn cho thấy rằng nếu sự thuyên giảm không xảy ra sau 12 đến 18 tháng điều trị bằng ATD, thì khả năng thuyên giảm sẽ không xảy ra với liệu pháp kéo dài. Trong dân số nhi khoa, dữ liệu đã công bố cho thấy khi ATD được sử dụng trong 1 đến 2 năm, tỷ lệ thuyên giảm là 15% đến 30%, và có thể lên đến 40% ở một số trẻ em. Xin lưu ý rằng sự thuyên giảm được định nghĩa là tình trạng bình giáp hoặc suy giáp trong 1 năm hoặc hơn sau khi ngừng điều trị.
Ở người lớn, việc đánh giá nồng độ TRAb hoặc TSI rất hữu ích trong việc xác định diễn biến bệnh và khả năng thuyên giảm. Vấn đề này đã được nghiên cứu ít hơn ở trẻ em. Phù hợp với quan điểm rằng bệnh Basedow sẽ thuyên giảm chỉ ở một tỷ lệ nhỏ trẻ em, nồng độ TRAb trở lại bình thường sau 24 tháng chỉ ở 18% bệnh nhân nhi dùng ATD. Do đó, nồng độ TRAb tồn tại lâu hơn ở trẻ em so với người lớn. Không có dữ liệu nào cho thấy sự bình thường hóa nồng độ TRAb ở bệnh nhân nhi dùng ATD trong thời gian dài hơn.
Đối với trẻ em có các yếu tố nguy cơ không thuận lợi cho sự thuyên giảm tự nhiên khi bắt đầu điều trị, việc điều trị trẻ trong tối đa 2 năm bằng MMI và xem liệu có xảy ra thuyên giảm tự nhiên hay không là hợp lý. Tại thời điểm đó, nếu không có sự thuyên giảm, việc chuyển sang điều trị dứt điểm nếu gia đình mong muốn là phù hợp. Ngoài ra, có thể xem xét điều trị trong thời gian dài hơn, miễn là không xảy ra tác dụng phụ của thuốc. Cách tiếp cận này có thể đặc biệt hữu ích nếu trẻ được coi là quá nhỏ để phẫu thuật hoặc RAI. Đối với trẻ có các yếu tố nguy cơ thuận lợi cho sự thuyên giảm, nếu sự thuyên giảm tự nhiên không xảy ra sau 2 năm dùng ATD, việc tiếp tục dùng thuốc kháng giáp trong thời gian dài cũng được chấp nhận, tuy nhiên cần chú ý đến các tác dụng phụ.
Chiến lược cho Trẻ có Biến cố Bất lợi với Methimazole
Với MMI là thuốc được lựa chọn để điều trị và nguy cơ độc tính gan khi sử dụng PTU, các bác sĩ lâm sàng có thể đối mặt với tình thế tiến thoái lưỡng nan về việc phải làm gì khi một bệnh nhân dùng MMI phát triển phản ứng bất lợi. Có rất ít báo cáo được công bố giải quyết vấn đề này ở trẻ em.
Đối với trẻ em phát triển các triệu chứng dị ứng, có thể thử dùng thuốc kháng histamine. Tuy nhiên, cách tiếp cận này thường không hiệu quả.
Nếu một người phát triển giảm bạch cầu trung tính, mất bạch cầu hạt hoặc độc tính gan, thuốc kháng giáp phải được ngưng ngay lập tức. Vì tình trạng cường giáp sẽ nhanh chóng tái phát, và tốt nhất là không điều trị bệnh nhân bằng RAI hoặc phẫu thuật, trong khi cường giáp nặng, liệu pháp để kiểm soát tình trạng cường giáp, cho đến khi liệu pháp dứt điểm phải được bắt đầu trong vòng vài ngày. Nếu một bệnh nhân sẽ được điều trị bằng RAI, nên bắt đầu phong bế beta và thực hiện điều trị trong vòng một tuần sau khi ngừng ATD để ngăn ngừa tái phát cường giáp nặng. Cách tiếp cận này đòi hỏi sự phối hợp nỗ lực với các chuyên gia y học hạt nhân, ngay khi quyết định ngừng ATD được đưa ra.
Nếu cá nhân được xem là quá cường giáp để điều trị bằng RAI, các bác sĩ lâm sàng có thể xem xét việc sử dụng PTU ngắn hạn để kiểm soát tình trạng cường giáp, cho đến khi bệnh nhân được xem là đủ ổn định để điều trị bằng RAI. Vì PTU cũng có thể liên quan đến mất bạch cầu hạt, nếu sử dụng PTU, số lượng bạch cầu cần được theo dõi rất chặt chẽ.
Nếu kế hoạch là can thiệp phẫu thuật, có thể bắt đầu dùng thuốc nhỏ iốt ngay sau khi ngừng MMI và tiếp tục trong ít nhất 2 tuần. Giai đoạn này sẽ cho phép tình trạng cường giáp được giải quyết và có đủ thời gian để lập kế hoạch phẫu thuật.
Liệu pháp Iốt Phóng xạ
Mục tiêu của liệu pháp 131I đối với bệnh Basedow là gây suy giáp. Có một số lưu ý quan trọng liên quan đến việc sử dụng RAI ở trẻ em. Không nên dùng RAI để gây ra tình trạng bình giáp ở trẻ em, vì điều này dẫn đến mô tuyến giáp còn lại bị chiếu xạ một phần có thể liên quan đến nguy cơ tân sinh tuyến giáp cao hơn so với dân số bình thường.
Người ta đã đề nghị rằng liều lượng cung cấp 30.000 đến 40.000 centiGray (cGy) (rad) cho tuyến giáp là cần thiết để triệt tiêu tuyến giáp. Nhưng, liều lượng cung cấp 10.000 đến 20.000 cGy cho tuyến giáp thường được sử dụng hơn và dẫn đến phá hủy một phần hoặc hoàn toàn tuyến giáp. Thông thường, liều tuyến giáp được dùng là 150 μCi/g (5,5 megaBecquerel [MBq]/g) tạo ra liều phóng xạ 12.000 cGy cho tuyến giáp.
Liều lượng được dựa trên phương trình Quimby-Marinelli: Liều (bức xạ β + γ; tính bằng Gy) = 90 × [liều 131I uống (microcurie [μCi]) × độ hấp thu 24 giờ qua đường uống (%)/g × 100%]. Ví dụ, nếu liều mong muốn là 300 μCi/g, và tuyến giáp là 30 g với độ hấp thu 75% (0,75), liều dùng mong muốn sẽ là 12 mCi. (Liều lượng tính bằng mCi = 300 μCi/g × 30 g/0,75 độ hấp thu = 12.000 μCi hoặc 12 mCi).
Một số trung tâm đưa ra một liều lượng cố định 10 hoặc 15 mCi 131I cho tất cả trẻ em, thay vì tính toán liều dùng riêng lẻ. Không có nghiên cứu nào so sánh kết quả của liều cố định so với liều được tính toán ở trẻ em. Ở người lớn, hai phương pháp khác nhau dẫn đến kết quả tương tự; tuy nhiên, ở trẻ em, một lợi thế tiềm tàng của việc tính liều so với liều cố định, là có thể sử dụng liều 131I thấp hơn nếu liều dùng được tính toán.
Khi trẻ em được điều trị bằng 131I, nên ngừng ATD 3 đến 5 ngày trước khi điều trị. Bệnh nhân được dùng thuốc chẹn beta cho đến khi nồng độ T4 và/hoặc FT4 trở lại bình thường sau điều trị. Trong khi một số bác sĩ lâm sàng bắt đầu lại ATD sau khi điều trị bằng 131I, điều này hiếm khi được yêu cầu ở trẻ em. Nồng độ hormone tuyến giáp bắt đầu giảm khoảng 7 ngày sau liệu pháp iốt phóng xạ ở trẻ em. Việc tiếp tục sử dụng ATD có thể gây khó khăn trong việc đánh giá liệu suy giáp sau điều trị là kết quả của 131I hay ATD.
Tác dụng phụ của liệu pháp 131I là không phổ biến. Ít hơn 10% trẻ em sẽ phàn nàn về cảm giác đau nhẹ ở tuyến giáp trong tuần đầu tiên sau liệu pháp 131I. Vấn đề này có thể được điều trị bằng acetaminophen hoặc các thuốc chống viêm không steroid trong 24 đến 48 giờ.
Có những báo cáo hiếm hoi về trẻ em bị cường giáp nặng phát triển cơn bão giáp sau 131I. Nói chung, những trẻ này đã bị cường giáp nặng khi được dùng 131I. Do đó, nếu nồng độ T4 trên 20 mcg/dL hoặc nồng độ FT4 lớn hơn 5 ng/dL, trẻ em nên được điều trị bằng MMI cho đến khi nồng độ T4 và/hoặc T4 tự do trở lại bình thường, trước khi tiến hành liệu pháp 131I. Quan trọng là, hầu hết trẻ em mắc bệnh Basedow đã bị cường giáp trong nhiều tháng trước khi được chẩn đoán; không cần phải vội vàng với liệu pháp 131I.
Thường mất từ 6 đến 12 tuần sau khi điều trị bằng 131I để bệnh nhân trở nên bình giáp hoặc suy giáp về mặt sinh hóa. Cho đến lúc đó, các triệu chứng của cường giáp có thể được kiểm soát bằng thuốc chẹn beta. Việc sử dụng kali iodide hoặc dung dịch Lugol, 1 tuần sau 131I, cũng sẽ nhanh chóng làm giảm cường giáp sinh hóa, mà không ảnh hưởng xấu đến kết quả của liệu pháp iốt phóng xạ.
Một số nghiên cứu đã báo cáo chi tiết về liệu pháp 131I cho bệnh Basedow ở trẻ em. Trẻ em nhỏ nhất là 1 tuổi đã được điều trị bằng 131I với kết quả xuất sắc. Nhưng, việc điều trị những trẻ nhỏ như vậy không phổ biến, cũng như không được khuyến nghị hiện nay. Liều lượng 131I ở trẻ em và thanh thiếu niên dao động từ 100 đến 400 μCi/g mô tuyến giáp. Tương tự như ở người lớn, đáp ứng với liệu pháp 131I có liên quan đến kích thước tuyến và liều lượng. Khoảng 25% đến 40% trẻ em được điều trị bằng 50 đến 100 μCi 131I mỗi gram mô tuyến giáp vẫn bị cường giáp vài năm sau điều trị. Ở trẻ em được điều trị bằng 150 đến 200 μCi 131I mỗi gram mô tuyến giáp, cường giáp vẫn còn ở 5% đến 20%, và 60% đến 90% trở nên suy giáp.
Sự phát triển hoặc tiến triển của bệnh mắt sau 131I ở người lớn đã được báo cáo. Tuy nhiên, trẻ em hiếm khi phát triển bệnh mắt nghiêm trọng và lồi mắt ở mức độ nhẹ. Các nghiên cứu cho thấy bệnh mắt trở nên tồi tệ hơn chỉ ở một tỷ lệ nhỏ trẻ em mắc bệnh Basedow, bất kể loại liệu pháp.
Ở người lớn, đã được chứng minh rằng sự tiến triển của bệnh mắt có thể được ngăn ngừa bằng cách điều trị bằng prednisone trong 3 tháng sau liệu pháp 131I. Liệu pháp prednisone bổ trợ không được khuyến nghị thường quy cho đa số trẻ em, vì hầu hết không có bệnh mắt đáng kể. Việc sử dụng prednisone kéo dài cũng liên quan đến chậm tăng trưởng, tăng cân và ức chế miễn dịch. Tuy nhiên, prednisone (0,5 mg/kg × 4–6 tuần) có thể hữu ích cho trẻ có bệnh mắt trung bình hoặc nặng và sẽ được điều trị bằng 131I.
nguy cơ của Iốt Phóng xạ ở Trẻ em được điều trị Bệnh Basedow
Không có bằng chứng nào cho thấy tác dụng phụ đối với con cái của trẻ em được điều trị bằng 131I. Dị tật bẩm sinh không cao hơn ở con cái sinh ra từ những người được điều trị bằng 131I vì cường giáp trong thời thơ ấu hoặc thanh thiếu niên. Ngoài ra, tỷ lệ dị tật bẩm sinh không cao hơn ở trẻ em được điều trị bằng 80 đến 700 mCi 131I cho ung thư tuyến giáp, là những liều lượng cao hơn nhiều so với liều dùng cho bệnh Basedow.
Tuyến giáp có độ nhạy cảm phát triển đặc biệt đối với bệnh ác tính sau khi tiếp xúc với bức xạ mức độ thấp. Có sự gia tăng nguy cơ ung thư tuyến giáp ở những người dưới 20 tuổi tại thời điểm chiếu xạ tuyến giáp mức độ thấp. Ngược lại, những người trên 20 tuổi không có nguy cơ ung thư tuyến giáp tăng lên khi tiếp xúc với chiếu xạ tuyến giáp mức độ thấp.
Nguy cơ tân sinh tuyến giáp ở trẻ em lớn nhất khi tiếp xúc với bức xạ ngoài mức độ thấp (0,1–25 Gy; ~ 0,09–30 μCi/g), và không phải với liều lượng cao hơn được sử dụng để điều trị bệnh Basedow. Hiện tại, chúng tôi không biết về bất kỳ trường hợp ung thư tuyến giáp nào phát triển ở bệnh nhân nhi được điều trị bằng hơn 150 μCi 131I mỗi gram mô tuyến giáp cho bệnh Basedow ở trẻ em mà có thể quy cho liệu pháp 131I.
Điều quan trọng khi xem xét việc sử dụng RAI ở trẻ em là những ảnh hưởng tiềm tàng của liệu pháp 131I đối với các bệnh ung thư khác, vì liệu pháp 131I dẫn đến phơi nhiễm bức xạ toàn thân ở mức độ thấp. Một số nghiên cứu ở người lớn đã kiểm tra các nguy cơ tiềm tàng của liệu pháp 131I đối với bệnh Basedow đối với các bệnh ung thư. Những nghiên cứu này không cho thấy sự gia tăng tỷ lệ tử vong hoặc tỷ lệ ung thư sau 131I đối với bệnh Basedow.
So với các nghiên cứu ở người lớn, ít nghiên cứu tập trung vào kết quả của liệu pháp 131I cho bệnh Basedow ở trẻ em. Nghiên cứu sâu rộng nhất về bệnh nhân nhi liên quan đến kết quả 36 năm của những bệnh nhân dưới 20 tuổi khi được điều trị bằng liệu pháp 131I cho bệnh Basedow. Không có bằng chứng về việc tăng nguy cơ ung thư trong dân số này. Tuy nhiên, cỡ mẫu này còn khiêm tốn.
Liều phóng xạ toàn thân sau 131I thay đổi theo tuổi, và cùng một liều 131I tuyệt đối sẽ dẫn đến phơi nhiễm phóng xạ nhiều hơn ở trẻ nhỏ so với thanh thiếu niên hoặc người lớn. Hiện tại, chúng tôi không có dữ liệu đo liều về việc sử dụng 131I ở bệnh nhân nhi mắc bệnh Basedow để đánh giá phơi nhiễm toàn thân ở bệnh nhân nhi. Dựa trên mô hình ma nơ canh, ước tính rằng ở 0, 1, 5, 10, 15 tuổi và tuổi trưởng thành, liều phóng xạ toàn thân tương ứng sẽ là 11,1, 4,6, 2,4, 1,45, 0,90 và 0,85 Roentgen tương đương ở người (rem) (0,01 Sievert [Sv]) trên mỗi millicurie 131I được dùng. Dựa trên phân tích của Ủy ban Tác động Sinh học của Bức xạ Ion hóa V (BEIR VII) về phơi nhiễm cấp tính, mức độ thấp với bức xạ, nguy cơ tử vong do ung thư và tất cả tỷ lệ mắc ung thư có thể quy cho trong suốt cuộc đời có thể được dự đoán. Dựa trên những tính toán lý thuyết này, chúng tôi cảm thấy thận trọng khi tránh liệu pháp RAI ở trẻ em dưới 5 tuổi và tránh dùng hơn 10 mCi ở bệnh nhân dưới 10 tuổi.
Phẫu thuật cắt tuyến giáp và các nguy cơ
Phẫu thuật là một hình thức điều trị hiệu quả cho bệnh Basedow nếu một bác sĩ phẫu thuật chuyên nghiệp có thể thực hiện, và trong một số tình huống, nó được ưu tiên hơn RAI. Khi phẫu thuật được thực hiện, phẫu thuật cắt bỏ tuyến giáp gần toàn bộ hoặc toàn bộ được chỉ định, vì phẫu thuật cắt bỏ tuyến giáp bán phần có liên quan đến tỷ lệ tái phát cao hơn. Suy giáp gần như là phổ biến ở trẻ em và người lớn trải qua phẫu thuật cắt bỏ tuyến giáp toàn bộ. So sánh, sau phẫu thuật cắt bỏ tuyến giáp bán phần, cường giáp tái phát ở 10% đến 15% bệnh nhân.
Phẫu thuật được ưu tiên ở trẻ em dưới 5 tuổi khi cần điều trị dứt điểm và có thể được thực hiện bởi một bác sĩ phẫu thuật tuyến giáp có tay nghề. Ở những người có tuyến giáp lớn (> 80 g), đáp ứng với 131I kém, và phẫu thuật được khuyến nghị cho những bệnh nhân này.
Để chuẩn bị cho phẫu thuật, bệnh nhân nên được đưa về trạng thái bình giáp. Thông thường, điều này được thực hiện bằng cách tiếp tục MMI cho đến khi nồng độ T4 trở lại bình thường. Một tuần trước khi phẫu thuật, bắt đầu dùng thuốc nhỏ iốt (1–3 giọt, ba lần mỗi ngày), giúp ức chế sản xuất hormone tuyến giáp và làm cho tuyến trở nên chắc và ít mạch máu hơn.
Sau phẫu thuật, bệnh nhân nhi nhỏ tuổi có nguy cơ suy cận giáp thoáng qua cao hơn so với thanh thiếu niên hoặc người lớn. Để giảm thiểu hạ canxi máu sau phẫu thuật, chúng tôi điều trị trẻ em bằng 0,5 mcg calcitriol, hai lần một ngày, trong 3 ngày trước phẫu thuật. Sau phẫu thuật, calcitriol được giảm dần trong 15 ngày (0,5 mcg hai lần một ngày × 5 ngày; 0,5 mcg mỗi ngày × 5 ngày; 0,5 mcg cách ngày × 5 ngày). Sử dụng phương pháp này, chỉ 5% bệnh nhân cần truyền canxi sau phẫu thuật so với 40% bệnh nhân không được điều trị trước phẫu thuật.
Các biến chứng cấp tính sau phẫu thuật cắt tuyến giáp bao gồm xuất huyết, hạ canxi máu và liệt dây thần kinh quặt ngược thanh quản. Ở trẻ em, tỷ lệ từ 0 đến 6 tuổi là 22%; từ 7 đến 12 tuổi là 11%; và từ 13 đến 17 tuổi là 11%. Những tỷ lệ này cao hơn so với người lớn.
Tỷ lệ biến chứng liên quan đến chuyên môn của bác sĩ phẫu thuật. Xem xét những dữ liệu này, nếu không có chuyên môn phẫu thuật tuyến giáp nhi khoa tại địa phương, nên xem xét việc chuyển một đứa trẻ mắc bệnh Basedow đến một trung tâm phẫu thuật tuyến giáp có số lượng lớn, có kinh nghiệm nhi khoa. Tỷ lệ biến chứng rất thấp đối với trẻ em trải qua phẫu thuật cắt tuyến giáp vì bệnh Basedow đã được báo cáo với mô hình đa ngành này.
Theo mô hình của chúng tôi, có xu hướng gần đây trong việc phát triển các trung tâm tuyến giáp nhi khoa trên khắp Hoa Kỳ. Các trung tâm này thường có các chuyên gia về phẫu thuật tuyến giáp nhi khoa.
Các biến chứng thực thể của bệnh Basedow
Ngoài việc tập trung vào các khía cạnh liên quan đến tuyến giáp của bệnh Basedow, các cân nhắc về thực thể cũng rất quan trọng. Những người mắc bệnh Basedow có tỷ lệ chuyển hóa cơ bản tăng và nhu cầu calo tăng. Điều này có thể dẫn đến thay đổi thói quen ăn uống, dẫn đến tăng lượng calo nạp vào. Sau khi điều chỉnh tình trạng cường giáp, người ta nhận ra rằng chỉ số khối cơ thể sẽ tăng lên, có thể là đáng kể ở một số người. Do đó, việc hướng dẫn dự phòng và theo dõi cân nặng sau khi thực hiện liệu pháp kháng giáp là rất quan trọng.
Bệnh Basedow cũng liên quan đến sự gia tăng chu chuyển xương, có thể dẫn đến loãng xương ở những người bị ảnh hưởng. Do đó, bệnh Basedow có liên quan đến nguy cơ gãy xương tăng.
Nhiễm độc giáp có thể gây ra liệt chu kỳ do nhiễm độc giáp, là một tình trạng đe dọa tính mạng liên quan đến hạ kali máu nặng. Tình trạng này thường được quan sát thấy ở nam giới châu Á và có liên quan đến hạ kali máu, ảnh hưởng đến chi dưới và là thứ phát sau nhiễm độc giáp. Tình trạng này là kết quả của sự dịch chuyển kali vào nội bào do sự nhạy cảm hóa của Na+/K+-adenosine triphosphatase bởi hormone tuyến giáp và có liên quan đến các đột biến của kênh kali chỉnh lưu vào trong Kir2.6.
Một mối lo ngại tiềm tàng khác liên quan đến việc giải quyết bệnh Basedow là sự phát triển của bệnh cơ cấp tính. Điều này đã được báo cáo lẻ tẻ ở trẻ em sau khi điều chỉnh tình trạng cường giáp, dẫn đến sự gia tăng lớn các enzyme cơ trong tuần hoàn khi tình trạng cường giáp chuyển sang suy giáp. Sau khi điều trị, những người có biểu hiện chuột rút cơ nên được đánh giá về khả năng này thông qua việc theo dõi nồng độ creatine phosphokinase.
Viêm tuyến giáp tự miễn có thể liên quan đến các bệnh tự miễn khác, bao gồm đái tháo đường, suy thượng thận, bạch biến và suy cận giáp. Viêm tuyến giáp tự miễn cũng được thấy ở những bệnh nhân bị bệnh viêm ruột và viêm khớp thiếu niên. Do đó, nên xem xét việc theo dõi hàng năm kích thước tuyến giáp và nồng độ TSH cho trẻ em có các vấn đề tự miễn khác, và các bác sĩ lâm sàng nên cảnh giác với các dấu hiệu cường giáp hoặc suy giáp. Ngược lại, trẻ em bị viêm tuyến giáp tự miễn nên được quan sát các dấu hiệu của đái tháo đường và bệnh Addison.
Tỷ lệ mắc bệnh celiac trong bối cảnh viêm tuyến giáp tự miễn là khoảng 1%. Nếu bệnh nhân biểu hiện khó chịu ở bụng, sụt cân hoặc các triệu chứng tiêu hóa, nên thực hiện sàng lọc bệnh Celiac, nhưng không cần phải làm thường quy ở trẻ em mắc bệnh tuyến giáp. Chúng tôi đã tìm thấy tỷ lệ 1% bệnh gan tự miễn ở trẻ em mắc bệnh tuyến giáp tự miễn. Vì bệnh gan như vậy có thể tiềm ẩn, chúng tôi đánh giá hàng năm nồng độ transaminase trong tuần hoàn, và nếu nồng độ tăng, sẽ bắt đầu đánh giá bệnh gan có thể có.
Một số nhóm trẻ em có nguy cơ bị viêm tuyến giáp tự miễn và bệnh Basedow. Vì các bé gái mắc hội chứng Turner có khuynh hướng bị viêm tuyến giáp tự miễn, nên nồng độ TSH nên được đánh giá hàng năm. Hội chứng Turner cũng nên được xem xét ở các bé gái bị suy giáp, đặc biệt nếu trẻ chưa dậy thì tại thời điểm biểu hiện. Trẻ em mắc hội chứng Down cũng cần được sàng lọc hàng năm về rối loạn chức năng tuyến giáp.
Nhiễm độc giáp sơ sinh
Nhiễm độc giáp ở trẻ sơ sinh là một tình trạng nghiêm trọng và đe dọa tính mạng có thể liên quan đến các vấn đề thần kinh lâu dài. Nhiễm độc giáp sơ sinh thường xảy ra nhất trong bối cảnh mẹ đang hoặc đã từng mắc bệnh Basedow. Nếu một người mẹ mắc bệnh Basedow, có 1 trong 80 khả năng TRAbs sẽ được truyền cho thai nhi, dẫn đến cường giáp trong tử cung hoặc sơ sinh. Hiếm khi nhiễm độc giáp sơ sinh sẽ tồn tại, giống như bệnh Basedow thấy ở trẻ lớn hơn. Trong các trường hợp hiếm gặp khác, nhiễm độc giáp sơ sinh kéo dài là do kích hoạt thụ thể TSH.
Tuyến giáp của thai nhi đáp ứng với TRAbs của mẹ, nếu có ở nồng độ cao, có thể dẫn đến cường giáp. Cường giáp ở thai nhi biểu hiện trong nửa sau của thai kỳ, vì sự chuyển giao TRAbs từ mẹ sang thai nhi tăng lên cùng với sự tiến triển của thai kỳ.
Nguy cơ cường giáp ở thai nhi và bệnh Basedow sơ sinh tỷ lệ thuận với mức độ tăng nồng độ TRAb. Cường giáp ở thai nhi thường liên quan đến nồng độ TRAbs cao hơn giới hạn bình thường trên của xét nghiệm từ 2 đến 4 lần. Vì thai nhi có nguy cơ bị cường giáp khi mẹ đang hoặc đã từng mắc bệnh Basedow, nên sự phát triển và nhịp tim của thai nhi cần được đánh giá thường xuyên từ giữa thai kỳ trở đi. Nhịp tim thai quá nhanh (> 160 nhịp mỗi phút sau 20 tuần) và sự hiện diện của Bướu giáp ở thai nhi cho thấy cường giáp ở thai nhi. Ngoài ra, sự trưởng thành nhanh chóng của trung tâm cốt hóa xương đùi được thấy với cường giáp ở thai nhi.
Nếu một người mẹ mắc bệnh Basedow đang dùng thuốc kháng giáp trong thai kỳ, quá trình tổng hợp hormone tuyến giáp của thai nhi sẽ bị ức chế, điều này sẽ ngăn chặn sự phát triển của cường giáp trong tử cung. Tuy nhiên, trẻ có thể sinh ra với Bướu giáp và suy giáp. Khi sinh, nồng độ T4 trong tuần hoàn có thể thấp và nồng độ TSH tăng. Trong hầu hết các trường hợp, tác dụng của ATD giảm dần, và chức năng tuyến giáp trở lại bình thường trong vòng một tuần. Tuy nhiên, nếu đã xảy ra sự truyền qua nhau thai đáng kể của TRAbs, nhiễm độc giáp sẽ phát triển.
Nếu một người mẹ có tiền sử bệnh Basedow không dùng ATD trong thai kỳ, thai nhi có thể phát triển cường giáp trong tử cung. Nếu tình trạng này không được nhận ra, nó có thể dẫn đến nhiễm độc giáp trong tử cung nặng và chậm phát triển. Những trẻ sơ sinh như vậy có các khớp sọ hợp nhất sớm, tuổi xương tiến triển, các vấn đề học tập lâu dài và chậm phát triển trí tuệ. Nếu cường giáp ở thai nhi được nhận biết trước khi sinh bằng sự hiện diện của nhịp tim nhanh ở thai nhi (nhịp tim > 160 nhịp mỗi phút sau 22 tuần), việc điều trị cho mẹ bằng ATD sẽ làm giảm nhiễm độc giáp trong tử cung.
Điều trị trẻ sơ sinh bị nhiễm độc giáp bao gồm dùng MMI (1,25 mg mỗi ngày) và thuốc chẹn beta (propranolol 1 mg mỗi kg mỗi ngày). Dung dịch Lugol hoặc kali iodide bão hòa có thể được dùng (1–2 giọt mỗi 8 giờ) trong 7 đến 10 ngày để kiểm soát nhanh hơn cường giáp sinh hóa. Sau khoảng 2 tuần điều trị bằng ATD, nồng độ hormone tuyến giáp sẽ giảm. Khi nồng độ hormone tuyến giáp giảm xuống dưới mức bình thường, levothyroxine bổ sung (37,5 mcg/ngày cho trẻ đủ tháng) được thêm vào để ngăn ngừa suy giáp. Khi TRAbs được thanh thải khỏi tuần hoàn của trẻ, sự hồi phục tự nhiên bắt đầu trong vòng 3 tháng và thường hoàn tất sau 6 tháng. Do đó, trẻ có thể được cai điều trị sau 3 tháng. Việc theo dõi nồng độ TRAb của trẻ cũng là một yếu tố dự báo hữu ích về thời điểm có thể giảm liều thuốc kháng giáp.
Các nguyên nhân khác gây cường giáp
Đột biến kích hoạt của thụ thể Hormone kích thích tuyến giáp
Một số đột biến của thụ thể TSH đã được báo cáo dẫn đến kích hoạt thụ thể không phụ thuộc vào phối tử và cường giáp. Những người bị ảnh hưởng có biểu hiện cường giáp trong giai đoạn sơ sinh với những tác dụng phụ nghiêm trọng tiềm tàng đối với trẻ bao gồm sự trưởng thành xương tiến triển và hẹp sọ, suy giảm tăng trưởng và suy giảm thần kinh. Chẩn đoán này nên được xem xét ở trẻ nhỏ có biểu hiện cường giáp và tuổi xương tiến triển, trong trường hợp không có sự gia tăng TSI. Tình trạng cường giáp có thể được kiểm soát bằng ATD, tuy nhiên, cần phải RAI nếu phẫu thuật là cần thiết. Vì cường giáp trong giai đoạn sơ sinh và đầu thời thơ ấu có thể liên quan đến sự tăng trưởng và trưởng thành bất thường và các bất thường thần kinh, điều cần thiết là tình trạng cường giáp phải được kiểm soát một cách tinh vi ở trẻ nhỏ.
Hội chứng McCune–Albright
Hội chứng McCune–Albright là một rối loạn di truyền được đặc trưng bởi sự kích hoạt tự phát của tiểu đơn vị alpha protein G. Vì thụ thể TSH được liên kết với protein G, các xoay vòng soma của tiểu đơn vị alpha protein G trong tuyến giáp có thể dẫn đến cường giáp. Trẻ em mắc hội chứng McCune–Albright có thể được nhận biết với một kiểu đốm café au lait đặc biệt với bờ rách, và/hoặc tiền sử loạn sản xơ đa xương hoặc đơn xương. Vì có sự kích hoạt dòng vô tính trong tuyến giáp, dẫn đến các vùng tăng sinh và hoạt động tuyến giáp, và các vùng khác sẽ không bị ảnh hưởng, tương tự như việc điều trị các nhân tuyến giáp tăng chức năng đơn độc, điều trị dứt điểm bằng phẫu thuật được khuyến nghị.
U tuyến sản xuất Hormone kích thích tuyến giáp
U tuyến yên sản xuất thyrotropin (Thyrotropinomas) hiếm gặp ở người lớn và cực kỳ hiếm ở trẻ em. Những khối u như vậy thường là các u tuyến lớn có biểu hiện các dấu hiệu cường giáp và đôi khi có các triệu chứng của hệ thần kinh trung ương có thể bao gồm mất thị trường và đau đầu. Những cá nhân như vậy sẽ có nồng độ hormone tuyến giáp trong tuần hoàn tăng cao, nhưng không có TSH bị ức chế.
Phẫu thuật qua xương bướm là phương pháp điều trị được ưu tiên và có thể cần xạ trị bổ trợ. Ở người lớn, điều trị thành công bằng octreotide đã được báo cáo. Điều quan trọng là phải phân biệt tình trạng này với đề kháng hormone tuyến giáp trung ương đơn độc, có thể có các đặc điểm sinh hóa tương tự. Các đặc điểm phân biệt bao gồm sự hiện diện của một khối u tuyến yên với các khối u sản xuất TSH, thiếu đáp ứng với kích thích TRH và nồng độ tiểu đơn vị a-glycoprotein tăng cao, trong các u tuyến yên.
Viêm tuyến giáp do vi khuẩn
Thỉnh thoảng, một đứa trẻ có biểu hiện cường giáp, đau ở tuyến giáp và sốt do nhiễm trùng vi khuẩn của tuyến giáp, một tình trạng được gọi là viêm tuyến giáp cấp tính. Viêm tuyến giáp cấp tính có thể liên quan đến sự hiện diện của một lỗ rò nối xoang lê bên trái của hầu họng với tuyến giáp. Sốt có thể cao, và tốc độ lắng hồng cầu và số lượng bạch cầu tăng. Siêu âm có thể cho thấy một áp xe cục bộ. Trái ngược với bệnh Basedow, sự hấp thu của technetium 99-pertechnetate hoặc iốt phóng xạ bị giảm khi thực hiện xạ hình tuyến giáp.
Các vi khuẩn gây bệnh bao gồm Haemophilus influenza và liên cầu khuẩn nhóm A. Do đó, điều trị bằng một loại kháng sinh kháng lại sự phá vỡ bởi β-lactamase được khuyến nghị. Trong những trường hợp nặng, cần nhập viện và dùng kháng sinh đường tĩnh mạch, vì hệ thống bạch huyết có thể dẫn lưu vào vùng trung thất. Cần dẫn lưu phẫu thuật nếu một áp xe cục bộ phát triển và đáp ứng với kháng sinh kém.
Vì quá trình nhiễm trùng dẫn đến phá hủy mô tuyến giáp, việc giải phóng hormone tuyến giáp đã được hình thành sẵn và cường giáp có thể xảy ra trong quá trình nhiễm trùng. Tình trạng cường giáp thường là thoáng qua, và không chỉ định điều trị bằng ATD. Nếu bệnh nhân có triệu chứng, có thể sử dụng thuốc chẹn beta.
Sau khi trẻ đã hồi phục, chỉ định chụp hầu họng để kiểm tra đường rò xoang lê còn thông hay không. Thỉnh thoảng, đường rò có thể đóng lại do nhiễm trùng. Tuy nhiên, nếu đường rò vẫn tồn tại và viêm tuyến giáp cấp tính tái phát, cần phải cắt bỏ.
Viêm tuyến giáp bán cấp
Nhiễm trùng virus ở tuyến giáp có thể xảy ra và dẫn đến viêm tuyến giáp bán cấp. So với viêm tuyến giáp cấp tính, viêm tuyến giáp bán cấp có thể ít nghiêm trọng hơn. Sốt, đau tuyến giáp và cường giáp có thể xuất hiện và có thể kéo dài vài tuần. Vì việc phân biệt lâm sàng giữa nhiễm trùng tuyến giáp do vi khuẩn và virus là khó khăn, nên chỉ định điều trị kháng sinh khi nghi ngờ viêm tuyến giáp nhiễm trùng.
Nhân tăng chức năng
Các nhân nóng hoặc ấm dẫn đến sản xuất quá mức hormone tuyến giáp và có thể liên quan đến cường giáp lâm sàng và sinh hóa. Thật thú vị, các đột biến kích hoạt của thụ thể TSH và Gs đã được phát hiện trong các nhân tăng chức năng. Mặc dù các nhân tăng chức năng có thể được triệt tiêu bằng iốt phóng xạ, phẫu thuật cắt bỏ các nhân tăng chức năng được khuyến nghị ở trẻ em và thanh thiếu niên, vì mô tuyến giáp bình thường bị phơi nhiễm bức xạ sẽ vẫn còn sau khi nhân tăng chức năng được triệt tiêu. Mặc dù nguy cơ ác tính trong các nhân tăng chức năng là thấp, các bệnh ung thư tuyến giáp đã được mô tả trong các nhân ấm.
Bướu giáp đa nhân độc
Bướu giáp đa nhân không phổ biến ở trẻ em, nhưng bệnh nhân mắc bệnh này có thể phát triển nhiễm độc giáp, thường liên quan đến thời gian Bướu giáp đã tồn tại và kích thước Bướu giáp. Trong bối cảnh này, cường giáp phát triển khi một nhân đơn lẻ trong tuyến giáp, trở nên hoạt động quá mức và hoạt động tự chủ. Khoảng 46% bệnh nhân có thể bị nhiễm độc giáp T3, và các nhân có đường kính từ 3 cm trở lên.
Ở người lớn, 131I thường được sử dụng trong điều trị các u tuyến độc đơn độc và Bướu giáp đa nhân độc. Việc sử dụng iốt phóng xạ để điều trị những tình trạng này ở trẻ em không phổ biến, và có rất ít dữ liệu theo dõi. Mặc dù có lý do chính đáng cho việc sử dụng iốt phóng xạ trong điều trị bệnh Basedow ở trẻ em, đặc biệt khi sử dụng liều thích hợp, chúng tôi khuyến nghị nên tránh dùng iốt phóng xạ ở trẻ em bị u tuyến độc hoặc Bướu giáp đa nhân. Khi có một nhân độc, dù là một nhân đơn độc hay trong bối cảnh Bướu giáp đa nhân, chức năng tuyến giáp bị ức chế ở các vùng không độc. Khi dùng iốt phóng xạ, sự hấp thu sẽ bị giới hạn ở mô hoạt động tự chủ, và nếu dùng liều lớn, mô tuyến giáp còn lại sẽ nhận bức xạ ngoài. Vì nguy cơ ung thư tuyến giáp sau bức xạ ngoài rất thấp sau 20 tuổi, việc sử dụng iốt phóng xạ để triệt tiêu nhân độc ở người lớn không liên quan đến nguy cơ ung thư tuyến giáp tăng. Tuy nhiên, ở trẻ em hoặc thanh thiếu niên được điều trị bằng 131I cho các nhân độc, chiếu xạ mức độ thấp đến mô tuyến giáp còn lại sẽ xảy ra với nguy cơ ung thư tuyến giáp tăng.
Amiodarone
Amiodarone là một loại thuốc chống loạn nhịp tim nhóm III có liên quan đến cả cường giáp và suy giáp do hàm lượng iốt cao của amiodarone và tác dụng độc trực tiếp lên tuyến giáp. Hai loại nhiễm độc giáp do amiodarone (AIT) đã được mô tả. Trong AIT loại I, iốt dư thừa dẫn đến tăng sản xuất hormone tuyến giáp. AIT loại II, phổ biến hơn loại I và là một bệnh viêm tuyến giáp phá hủy dẫn đến tác dụng độc trực tiếp của amiodarone lên các tế bào biểu mô nang tuyến giáp trong việc giải phóng dư thừa T4 và T3, mà không tăng tổng hợp hormone. Việc điều trị tình trạng này bao gồm glucocorticoid.
Nạp Iốt quá mức
Iốt là một vi chất dinh dưỡng và lượng tiêu thụ điển hình là 150 mg/ngày cho người lớn. Nói chung, việc nạp iốt quá mức không dẫn đến bệnh tuyến giáp. Tuy nhiên, ở một số người bị thiếu iốt có khuynh hướng mắc bệnh Basedow, iốt dư thừa có thể gây ra cường giáp, một tình trạng được gọi là hiệu ứng Jod–Basedow.
Nhân tuyến giáp và ung thư tuyến giáp
Bối cảnh
Nhân tuyến giáp ở trẻ em và thanh thiếu niên ít phổ biến hơn so với người lớn; tuy nhiên, nguy cơ ác tính đối với một nhân được chẩn đoán ở bệnh nhân nhi cao hơn khoảng hai lần. Trong 2 thập kỷ qua, số lượng bệnh nhân được chẩn đoán mắc nhân tuyến giáp và ung thư tuyến giáp biệt hóa (DTC) đã tăng từ 2% đến 4% mỗi năm, với mức tăng lớn nhất được ghi nhận ở nữ giới trong độ tuổi từ 15 đến 19, nơi ung thư tuyến giáp chiếm 8% tổng số các loại ung thư. Tương tự như người lớn, hơn 85% ung thư tuyến giáp ở trẻ em là ung thư tuyến giáp dạng nhú (PTC), phần còn lại được phân chia giữa ung thư biểu mô tuyến giáp dạng nang (FTC) và ung thư tuyến giáp thể tủy (MTC), loại sau thường liên quan nhất đến đa u tuyến nội tiết loại 2 (MEN2).
Nhân tuyến giáp có thể được phát hiện qua khám sức khỏe hoặc tình cờ phát hiện trong quá trình chụp ảnh phóng xạ vùng đầu và cổ không liên quan. Khi phát hiện một nhân tuyến giáp, cần thực hiện xét nghiệm TSH huyết thanh và siêu âm (US) tuyến giáp và cổ để xác định kế hoạch quản lý tốt nhất. Nếu TSH bị ức chế, có thể thực hiện xạ hình phóng xạ để xác định một nhân tăng chức năng, một tổn thương có nguy cơ ác tính thấp hơn. Nồng độ calcitonin huyết thanh không được đánh giá thường quy; tuy nhiên, nên xem xét hóa mô miễn dịch calcitonin hoặc rửa giải calcitonin từ kim chọc hút tế bào bằng kim nhỏ (FNA) dựa trên tiền sử gia đình mắc MEN2, các lo ngại về khám sức khỏe đối với MEN2B, hoặc các phát hiện tế bào học phù hợp với MTC.
Đánh giá một nhân tuyến giáp
Siêu âm là phương pháp hiệu quả và chính xác nhất để xác định xem một nhân tuyến giáp có thể được theo dõi hay cần được đánh giá thêm bằng FNA. Các đặc điểm siêu âm của nhân cần được đánh giá, bao gồm trong báo cáo X-quang, và được sử dụng để phân tầng các nhân cho FNA theo Hệ thống Dữ liệu và Báo cáo Hình ảnh Tuyến giáp (TI-RADS) bao gồm thành phần (nang, dạng bọt biển, hỗn hợp hoặc đặc), độ hồi âm, (không hồi âm, tăng hồi âm, đồng hồi âm, hoặc giảm hồi âm), hình dạng trên hình ảnh ngang (cao hơn rộng hoặc rộng hơn cao), bờ (trơn láng, không rõ, có thùy, hoặc có sự xâm lấn ra ngoài tuyến giáp), và các ổ tăng âm (không có, đuôi sao chổi, vôi hóa lớn, vôi hóa viền, hoặc vôi hóa dạng chấm) (Hình 13.5). Thành phần nang hoặc hỗn hợp, với thành phần nang lớn hơn 75%, là đặc điểm duy nhất, đáng tin cậy nhất liên quan đến nguy cơ ác tính thấp hơn. Các đặc điểm liên quan đến nguy cơ ác tính cao hơn bao gồm thành phần đặc, giảm hồi âm, hình dạng cao hơn rộng trên hình ảnh ngang, bờ có thùy hoặc không đều, và các ổ tăng âm dạng chấm. Đánh giá siêu âm vùng cổ bên phải được thực hiện trên tất cả các bệnh nhân được phát hiện có nhân tuyến giáp không xác định hoặc đáng ngờ để xác định xem có hạch bạch huyết liên quan đến di căn ung thư tuyến giáp hay không. Các đặc điểm siêu âm dự đoán chính xác nhất một hạch bạch huyết bất thường bao gồm hình dạng tròn, các ổ tăng âm dạng chấm, và sự hiện diện của mạch máu ngoại vi. Kích thước thường không phải là một đặc điểm dự đoán cho bệnh ác tính, và các hạch bạch huyết ở vùng cổ trên (mức II) thường lớn hơn các hạch bạch huyết ở vùng thấp hơn (mức III và IV) hoặc vùng sau (mức V) của cổ (xem Hình 13.6).
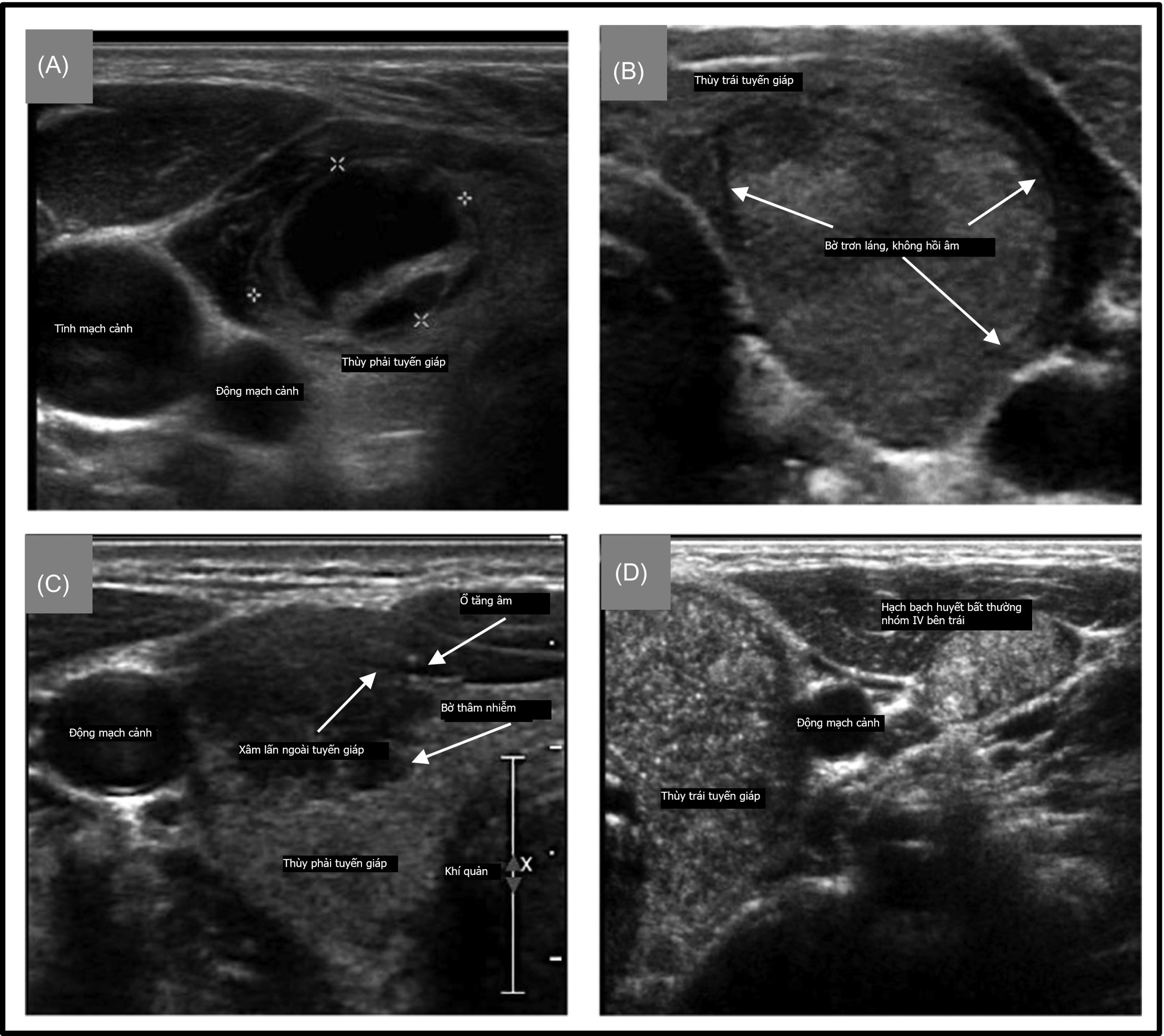
Hình 13.5 Hình ảnh đại diện của các nhân tuyến giáp mô tả các đặc điểm khác nhau được sử dụng trong Hệ thống Báo cáo và Dữ liệu Hình ảnh Tuyến giáp (TI-RADS). (A) Nhân phức hợp, hỗn hợp đặc-nang (>80% nang), phần đặc đồng hồi âm với bờ trơn láng, không có ổ tăng âm, với phần đặc nhỏ không cao hơn rộng, bờ trơn láng, và không có ổ tăng âm (TI-RADS 2). (B) Nhân đặc, đồng- (phần lớn hơn, phía sau) và hơi giảm hồi âm (khu vực nhỏ hơn, phía trước), không cao hơn rộng, với bờ trơn láng, và không có ổ tăng âm (TI-RADS 3). (C) Nhân đặc, rất giảm hồi âm, không cao hơn rộng, có thùy, bờ xâm lấn với bằng chứng xâm lấn ra ngoài tuyến giáp (mũi tên), và một số ổ tăng âm (TI-RADS 5). (D) Tổn thương đặc, giảm hồi âm, xâm lấn lan tỏa với quá nhiều ổ tăng âm không thể đếm được (TI-RADS 5). Một hạch bạch huyết bất thường được ghi nhận ở cổ bên với các đặc điểm siêu âm tương tự như khối u nguyên phát.
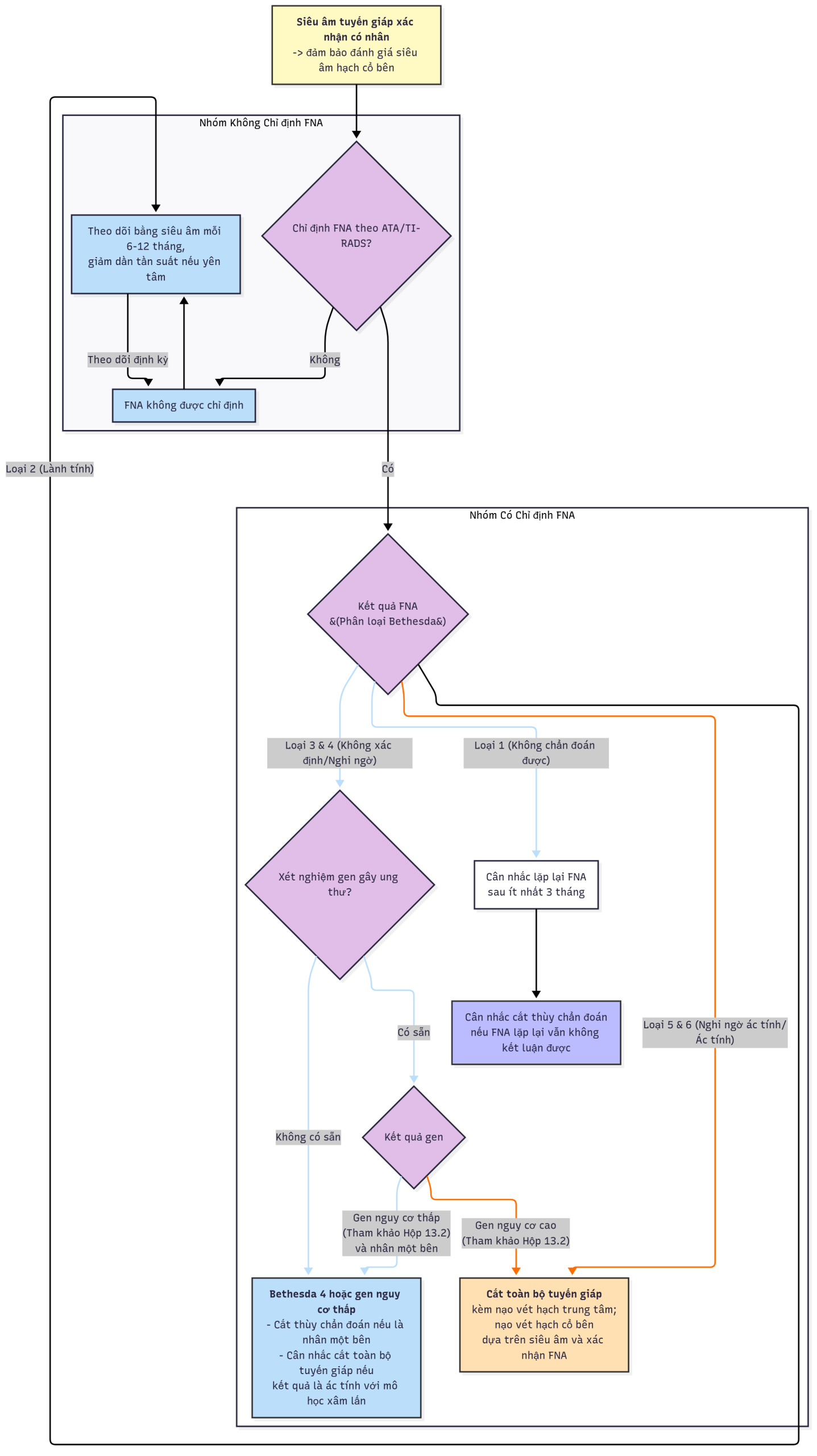
Hình 13.6 Sơ đồ đánh giá và quản lý ban đầu các nhân tuyến giáp tản phát ở trẻ em và thanh thiếu niên (Sơ đồ được người dịch vẽ lại để trực quan hơn). Đối với bệnh nhân có nhân tuyến giáp liên quan đến bệnh tuyến giáp tự miễn, sau phơi nhiễm bức xạ, hoặc có hội chứng khuynh hướng ung thư tuyến giáp, phẫu thuật cắt bỏ tuyến giáp có thể được ưu tiên hơn so với cắt bỏ thùy. ATA, Hiệp hội Tuyến giáp Hoa Kỳ; FNA, chọc hút tế bào bằng kim nhỏ; TI-RADS, Hệ thống Báo cáo và Dữ liệu Hình ảnh Tuyến giáp; US, siêu âm.
Đối với nhiều nhân, chỉ riêng hình ảnh siêu âm không thể phân biệt một cách đáng tin cậy giữa một tổn thương lành tính và ác tính. Do đó, FNA được chỉ định cho trẻ em có các nhân tuyến giáp không xác định hoặc đáng ngờ nhằm xác định xem có cần phẫu thuật hay không, cũng như để lên kế hoạch cho phạm vi phẫu thuật. FNA là phương tiện chính xác nhất để đánh giá xem một nhân tuyến giáp có ác tính hay không. Các báo cáo về FNA được thực hiện ở trẻ em mô tả độ đặc hiệu và độ nhạy tương tự như người lớn, với một phân tích tổng hợp báo cáo độ nhạy và độ đặc hiệu lần lượt là 94% và 81%, và độ chính xác, giá trị dự đoán dương tính và âm tính lần lượt là 84%, 55% và 98%, giả sử nguy cơ ác tính là 20%. Khó khăn nảy sinh khi tế bào học FNA là “không xác định”, vì bệnh ác tính có thể có mặt ở 40% các nhân được đặc trưng bởi Hệ thống Bethesda để Báo cáo Tế bào học Tuyến giáp (TBSRTC). Việc bổ sung xét nghiệm gen gây ung thư có thể có giá trị với sự hiện diện của một đột biến gen gây ung thư tuyến giáp đã biết liên quan đến nguy cơ ác tính tăng lên (xem “Bối cảnh phân tử” ở phần sau). Các lựa chọn thay thế cho các nhân có phân loại TBSRTC loại III không xác định (“tổn thương nang không xác định” hoặc “không điển hình không xác định”) là thực hiện phẫu thuật cắt bỏ thùy chẩn đoán hoặc xem xét lặp lại FNA trong vòng 3 đến 6 tháng. Đối với bệnh nhân có nhân có phân loại TBSRTC loại IV không xác định (“tân sinh nang” hoặc “nghi ngờ tân sinh nang”), nên thực hiện phẫu thuật cắt bỏ thùy chẩn đoán (xem Hình 13.6). Ở người lớn, các khuyến nghị gần đây cho thấy rằng FNA chỉ nên được thực hiện khi đường kính nhân bằng hoặc vượt quá 1,5 cm. Không có dữ liệu nào để phân tầng FNA dựa trên kích thước ở bệnh nhân nhi. Cần xem xét phán đoán lâm sàng dựa trên các nguy cơ ác tính có sẵn và hình ảnh siêu âm của nhân, và các hạch bạch huyết cổ trước khi thực hiện FNA trên một nhân nhỏ hơn 1 cm.
Ung thư tuyến giáp biệt hóa
Trong 2 thập kỷ qua, đã có sự gia tăng số lượng trẻ em và người lớn được chẩn đoán mắc ung thư tuyến giáp. Trong nhi khoa, sự gia tăng lớn nhất về tỷ lệ chẩn đoán là ở các bé gái vị thành niên và, tương tự như người lớn, phần lớn các khối u là PTC. Trong bản cập nhật gần đây nhất từ cơ sở dữ liệu Giám sát Dịch tễ học và Kết quả Cuối cùng của Viện Ung thư Quốc gia (SEER), PTC chiếm 58,8%, biến thể nang của PTC 23%, FTC 10,1 %, và MTC 8,1%, với sự chiếm ưu thế của MTC được chẩn đoán ở những bệnh nhân dưới 10 tuổi có liên quan đến MEN2.
So với người lớn, trẻ em mắc DTC có biểu hiện bệnh lan rộng hơn tại thời điểm chẩn đoán. Sự xâm lấn hạch bạch huyết cổ tại thời điểm chẩn đoán được thấy ở 50% đến 90% trẻ em, so với 20% đến 50% người lớn. Tỷ lệ di căn xa, phổ biến nhất là phổi, là 6% đến 8% ở trẻ em so với 2% đến 3% ở người lớn, với nguy cơ tăng 10% đến 20% đối với bệnh nhân nhi có di căn hạch bạch huyết cổ bên (mức II, III và IV). Bệnh đa ổ phổ biến hơn ở trẻ em so với người lớn và được thấy ở khoảng 40% các trường hợp PTC ở trẻ em. Có một số báo cáo cho rằng PTC ở trẻ em dưới 10 tuổi tại thời điểm chẩn đoán có tỷ lệ di căn khu vực và xa cao hơn, nguy cơ tái phát cao hơn và tỷ lệ tử vong đặc hiệu do bệnh tăng lên khi so sánh với thanh thiếu niên và người lớn. Tuy nhiên, các nhà điều tra khác báo cáo rằng DTC có hành vi lâm sàng tương tự khi so sánh trẻ nhỏ với thanh thiếu niên.
May mắn thay, ngay cả khi có bệnh di căn, dữ liệu theo dõi dài hạn cho thấy tỷ lệ sống sót sau 30 năm từ 90% đến 99% đối với trẻ em mắc DTC (xem Hình 13.2). Ngay cả với di căn xa, tỷ lệ tử vong ở trẻ em thuận lợi hơn so với người lớn, và di căn phổi có thể ổn định trong nhiều năm đến nhiều thập kỷ. Tiên lượng thuận lợi phản ánh thực tế rằng hầu hết các bệnh nhân trẻ có các khối u biệt hóa tốt duy trì sự biểu hiện của symporter natri-iốt và một mô hình tăng trưởng chậm.
Nguyên nhân của Ung thư tuyến giáp biệt hóa
Đối với phần lớn trẻ em, không thể xác định được một yếu tố nguy cơ cụ thể cho sự phát triển của DTC. Tuy nhiên, một số yếu tố làm tăng nguy cơ phát triển DTC. Phơi nhiễm với bức xạ đầu và cổ ở mức độ thấp đã được công nhận trong hơn 6 thập kỷ là yếu tố dẫn đến các nhân tuyến giáp và DTC. Liều bức xạ mức độ thấp đến tuyến giáp dưới 30 Gy (3000 cGy hoặc rad) làm tăng nguy cơ phát triển ung thư, với nguy cơ càng cao ở các độ tuổi càng trẻ. Trên 20 tuổi, nguy cơ ung thư tuyến giáp sau khi chiếu xạ mức độ thấp là rất thấp hoặc không thể phát hiện được. Thời gian tiềm tàng giữa thời điểm phơi nhiễm bức xạ và khởi phát DTC ở trẻ em thường là 10 đến 20 năm; tuy nhiên, ung thư tuyến giáp có thể phát triển trong vòng 5 đến 10 năm ở những bệnh nhân tiếp xúc với bức xạ khi còn nhỏ (< 5–10 tuổi). Nuốt phải bức xạ ion hóa cũng làm tăng nguy cơ phát triển bệnh tuyến giáp, bao gồm cả DTC. Điều này có thể xảy ra trong quá trình điều trị y tế các khối u nhạy cảm với bức xạ, chẳng hạn như u nguyên bào thần kinh, trong đó 131I-labeled metaiodobenzylguanidine (MIBG) thường là một trong một số tác nhân được sử dụng để điều trị, hoặc qua việc nuốt phải tình cờ, như đã xảy ra sau tai nạn hạt nhân Chernobyl năm 1981. Các hướng dẫn gần đây cho thấy rằng cả khám sức khỏe hoặc siêu âm đều có thể được sử dụng để theo dõi những bệnh nhân có nguy cơ phát triển ung thư tuyến giáp do bức xạ, trong đó siêu âm có độ nhạy cao hơn để phát hiện bệnh sớm hơn.
Ung thư tuyến giáp ở trẻ em cũng có thể được quan sát thấy trong các gia đình, liên quan đến nguy cơ phát triển DTC tăng lên dưới dạng một loại khối u duy nhất hoặc là một trong một số khối u liên quan đến hội chứng khuynh hướng khối u. Ung thư tuyến giáp biệt hóa không phải thể tủy gia đình (FNMTC) là một khuynh hướng di truyền để phát triển DTC mà không có nguy cơ phát triển các loại khối u khác tăng lên. Theo các tiêu chí nghiêm ngặt nhất, FNMTC được chẩn đoán khi có ba hoặc nhiều cá nhân trong gia đình mắc DTC; tuy nhiên, ngay cả trong các gia đình có hai hoặc nhiều người thân cấp một mắc DTC, nguy cơ phát triển PTC hoặc FTC tăng từ 8 đến 10 lần. Tương tự như DTC tản phát, 85% FNMTC bao gồm các bệnh nhân mắc PTC. Kiểu truyền bệnh phù hợp nhất với kiểu di truyền trội trên nhiễm sắc thể thường; tuy nhiên, cho đến nay, một locus dòng mầm duy nhất vẫn chưa được xác định. Khi có FNMTC, nên thực hiện siêu âm tuyến giáp mỗi năm hoặc 2 năm một lần, bắt đầu từ 8 tuổi như một phần của việc theo dõi khối u. DTC ở trẻ em mắc FNMTC đã được xác định sớm nhất là 8 tuổi và FNMTC thể hiện “sự dự đoán di truyền”, với tuổi xuất hiện ung thư thường trẻ hơn ở thế hệ thứ hai và các thế hệ tiếp theo.
Có một số hội chứng khuynh hướng khối u gia đình có DTC là một trong một số khối u khác nhau có thể phát triển ở một người bị ảnh hưởng trong suốt cuộc đời của họ. Các hội chứng này chủ yếu tuân theo kiểu di truyền trội trên nhiễm sắc thể thường, trong đó có 50% nguy cơ truyền đột biến dòng mầm cho con cái; tuy nhiên, các đột biến de novo cũng có thể xảy ra ở một đứa trẻ và là trường hợp chỉ điểm cho gia đình. Hội chứng khối u hamartoma phosphatase and tensin homolog (PTEN), trước đây được gọi là hội chứng Cowden, gây ra bởi đột biến gen PTEN và có liên quan đến đầu to, các khối u hamartoma ở bề mặt niêm mạc (miệng), polyp đường tiêu hóa, ung thư vú (chỉ ở phụ nữ), ung thư nội mạc tử cung, ung thư đại trực tràng, ung thư biểu mô tế bào thận và DTC. Có sự gia tăng tỷ lệ mắc FTC ở những bệnh nhân mắc hội chứng khối u hamartoma PTEN (PHTS); tuy nhiên, bệnh nhân có thể có các nhân với chẩn đoán mô học hỗn hợp và PTC vẫn phổ biến hơn FTC. Các nhân tuyến giáp cuối cùng được chẩn đoán ở hơn 75%, với khoảng 35% phát triển DTC sớm nhất là 8 tuổi. Bệnh đa polyp tuyến gia đình, hay hội chứng Gardner, gây ra bởi các đột biến gen adenomatous polyposis coli (APC) và có liên quan đến phì đại biểu mô sắc tố võng mạc (CHRPE), khuynh hướng phát triển hàng trăm đến hàng nghìn polyp ruột với sự biến đổi ác tính thành ung thư biểu mô ruột non và đại trực tràng, u nguyên bào gan, các bất thường về răng và da, và nguy cơ phát triển DTC từ 10% đến 15%. Hội chứng DICER1 gây ra bởi một đột biến gen DICER1 và có liên quan đến nguy cơ phát triển u nguyên bào màng phổi-phổi (từ sơ sinh đến 5 tuổi), các khối u tế bào Sertoli-Leydig, u nang thận, sarcoma cơ vân dạng chùm nho, một số khối u hiếm gặp khác của mắt và mũi, cũng như Bướu giáp đa nhân và DTC. Phức hợp Carney là một trong những hội chứng lentiginosis gây ra bởi các đột biến gen PRKAR1A. Phức hợp Carney có liên quan đến nguy cơ phát triển các khối u bao thần kinh (schwanommas), các khối u nhầy, bệnh vỏ thượng thận dạng nốt sắc tố nguyên phát (tăng cortisol), các khối u tuyến yên (tiết hormone tăng trưởng), và các khối u tế bào Sertoli vôi hóa tế bào lớn của tinh hoàn, với khoảng 50% phát triển các nhân tuyến giáp và ít hơn 5% phát triển DTC. Các bài đánh giá cập nhật về các hội chứng khuynh hướng khối u gia đình có thể được tìm thấy tại trang web GeneReviews® của Viện Y tế Quốc gia.
Bối cảnh phân tử
Sự thay đổi trong các gen gây ung thư (đột biến và dung hợp) thúc đẩy quá trình hình thành khối u trong DTC và MTC tương tự giữa bệnh nhân nhi và người lớn. Tuy nhiên, do những khác biệt quan sát được trong hành vi lâm sàng của các khối u này, quan trọng nhất là việc duy trì sự biệt hóa tế bào, có khả năng có sự khác biệt trong biểu hiện gen, cũng như các con đường tín hiệu xuôi dòng giữa DTC ở trẻ em và người lớn. Hậu quả của những khác biệt này được phản ánh bởi tỷ lệ tử vong đặc hiệu do bệnh thấp hơn đối với bệnh nhân nhi có di căn khu vực và xa khi so sánh với người lớn có gánh nặng bệnh tương tự.
Trong DTC, sự hình thành và tiến triển khối u tuyến giáp có liên quan đến các đột biến điểm soma trong các gen BRAF và RAS, cũng như các dung hợp liên quan đến các kinase tyrosine rearranged during transfection (RET), TRK, và ALK với kết quả là sự kích hoạt cấu thành của con đường tín hiệu mitogen-activated protein kinase (MAPK) và phosphoinositide 3-kinase (PI3K). Các đột biến gen gây ung thư này thường là các sự kiện loại trừ lẫn nhau và có một mối quan hệ có thể dự đoán được giữa kiểu gen gây ung thư và kiểu hình mô bệnh học, với các gen gây ung thư dung hợp (RET, TRK, và ALK) và các đột biến BRAF gần như chỉ được tìm thấy trong PTC. RAS thường liên quan đến FTC; tuy nhiên, nó có thể được tìm thấy trên phổ các khối u tuyến giáp, từ các u tuyến nang lành tính đến biến thể nang PTC, FTC và ung thư biểu mô tuyến giáp biệt hóa kém. Ngoài tiện ích tiềm năng của xét nghiệm gen gây ung thư trong chẩn đoán các nhân tuyến giáp có tế bào học không xác định (phân loại TBSRTC III và IV), sự hiện diện của các gen dung hợp RET/PTC và TRK có thể hữu ích trong việc dự đoán PTC với tiềm năng di căn tăng lên, mặc dù không có dữ liệu nào cho thấy rằng những thay đổi này có liên quan đến tỷ lệ tử vong đặc hiệu do bệnh tăng lên.
Quản lý phẫu thuật
Xác nhận đánh giá trước phẫu thuật chính xác và đầy đủ của bệnh nhân nhi mắc nhân tuyến giáp và ung thư tuyến giáp là bước đầu tiên trong việc quyết định các lựa chọn phẫu thuật và tối ưu hóa kế hoạch phẫu thuật. Siêu âm cổ sử dụng đầu dò tuyến tính tần số cao (12,0 MHz) nên được thực hiện để kiểm tra tuyến giáp, cũng như các mức trung tâm (mức VI và VII) và bên (mức II, III, IV và V) của cổ. Hơn 70% trẻ em mắc PTC sẽ có bệnh hạch bạch huyết cổ di căn theo một mô hình di căn nhất quán dựa trên sự dẫn lưu bạch huyết của tuyến giáp. Việc hạ thấp tần số đầu dò xuống 8 đến 10 mHz cho phép cải thiện hình ảnh của các trường nhìn sâu hơn, bao gồm vùng cạnh khí quản và rãnh khí quản-thực quản. Ngoài ra, tần số thấp hơn cũng có thể giúp cải thiện hình ảnh cho những bệnh nhân có mô mềm dư thừa. Nên thực hiện FNA ít nhất một hạch bạch huyết đáng ngờ ở mỗi mức cổ trước khi phẫu thuật để xác định mức độ bóc tách hạch bạch huyết. Đối với những bệnh nhân có sự xâm lấn hạch bạch huyết rộng rãi hoặc các dấu hiệu/triệu chứng liệt/liệt dây thanh âm (khàn giọng, ho), khó nuốt, hoặc các triệu chứng hô hấp (thở rít, khó thở, ho ra máu), hình ảnh cắt ngang của cổ và trung thất trên bằng chụp cắt lớp vi tính (CT) hoặc chụp cộng hưởng từ (MRI) có thể cung cấp thông tin bổ sung, bao gồm vị trí của các hạch bạch huyết đáng ngờ ở những khu vực mà siêu âm có độ nhạy thấp hơn để phát hiện (vùng cạnh hầu, sau hầu, dưới đòn, hoặc trung thất trên), cũng như đánh giá đường thở-tiêu hóa. Không có chống chỉ định sử dụng thuốc cản quang chứa iốt để chụp CT cổ hoặc trung thất trước phẫu thuật vì phần lớn bệnh nhân sẽ đạt được mức iốt trong nước tiểu thấp, đủ (được định nghĩa là iốt/creatinine trong nước tiểu tại chỗ < 66,2 μg/gCr) 1 tháng sau khi tiếp xúc với thuốc cản quang chứa iốt với chế độ ăn ít iốt trong 1 đến 2 tuần.
Mục tiêu của phẫu thuật là duy trì tỷ lệ tử vong đặc hiệu do bệnh thấp ở bệnh nhân nhi mắc DTC, đồng thời giảm các biến chứng tiềm tàng từ liệu pháp. Việc tiếp cận với một bác sĩ phẫu thuật tuyến giáp có khối lượng lớn, được định nghĩa là một bác sĩ phẫu thuật hoàn thành > 25 ca cắt bỏ tuyến giáp toàn phần hàng năm, có liên quan đến tỷ lệ biến chứng thấp hơn. Mặc dù số lượng phẫu thuật chính xác được thực hiện hàng năm có thể không phản ánh chất lượng của bác sĩ phẫu thuật, nhưng nó làm tăng khả năng bác sĩ phẫu thuật hiểu được quá trình bệnh ở trẻ em và thanh thiếu niên nhằm cân bằng việc cắt bỏ hoàn toàn, đồng thời giảm thiểu nguy cơ cắt bỏ phẫu thuật không hoàn toàn, suy cận giáp vĩnh viễn và tổn thương dây thần kinh thanh quản quặt ngược.
Đối với phần lớn bệnh nhân mắc PTC, phẫu thuật cắt bỏ tuyến giáp toàn phần, với bóc tách hạch bạch huyết khoang trung tâm dự phòng, được khuyến nghị do tỷ lệ mắc bệnh hai bên/đa ổ tăng ở PTC nhi, tỷ lệ di căn hạch bạch huyết khu vực cao, và nguy cơ tái phát và phẫu thuật lần thứ hai sau đó tăng lên khi thực hiện ít hơn phẫu thuật cắt bỏ tuyến giáp gần toàn bộ hoặc toàn bộ. Không khuyến nghị bóc tách cổ bên dự phòng thường quy. Việc bóc tách cổ bên nên dựa trên hình ảnh trước phẫu thuật với xác nhận di căn bằng FNA trước phẫu thuật. Bất kỳ bệnh nhân nào trải qua phẫu thuật bóc tách cổ bên cũng nên trải qua phẫu thuật bóc tách hạch bạch huyết cổ trung tâm cùng bên, dựa trên giải phẫu dẫn lưu bạch huyết. Việc bóc tách hạch bạch huyết nên là bóc tách hạch bạch huyết theo khoang thay vì bóc tách hạch bạch huyết riêng lẻ (‘nhặt quả mọng’), nhằm đạt được sự thuyên giảm phẫu thuật.
Tương tự như người lớn, một phần bệnh nhân nhi mắc DTC sẽ có bệnh không xâm lấn chỉ giới hạn ở tuyến giáp, nơi phẫu thuật cắt bỏ thùy có thể đủ để đạt được sự thuyên giảm phẫu thuật. Trên siêu âm trước phẫu thuật, các nhân đồng hồi âm đến tăng hồi âm với hình dạng tròn đến bầu dục, bờ trơn láng, và không có ổ tăng âm, có nhiều khả năng liên quan đến hành vi không xâm lấn. Do đó, ngay cả trong nhi khoa, phẫu thuật cắt bỏ thùy có thể được xem xét cho những bệnh nhân có một nhân tuyến giáp đơn độc, một bên, với các đặc điểm không xâm lấn trên siêu âm để tránh liệu pháp thay thế hormone tuyến giáp suốt đời. Khi xem xét bệnh học giải phẫu, phẫu thuật cắt bỏ thùy với theo dõi có thể được coi là đủ, ngay cả đối với một nhóm bệnh nhân chọn lọc mắc biến thể nang PTC và FTC, dựa trên sự vắng mặt của bằng chứng mô học về đa ổ, xâm lấn mạch máu-bạch huyết và xâm lấn ra ngoài tuyến giáp, những đặc điểm có liên quan đến nguy cơ di căn khu vực tăng lên. Các yếu tố nguy cơ chống chỉ định phẫu thuật cắt bỏ thùy bao gồm tiền sử tiếp xúc với bức xạ ion hóa, tiền sử cá nhân mắc hội chứng khuynh hướng khối u tuyến giáp, hoặc tiền sử viêm tuyến giáp tự miễn, nơi có nguy cơ phát triển thêm các nhân và DTC ở thùy còn lại nếu thực hiện phẫu thuật cắt bỏ thùy. Đối với bệnh nhân mắc ung thư vi nhú một ổ (< 1 cm), và không có bằng chứng di căn hạch bạch huyết trên hình ảnh trước phẫu thuật, phẫu thuật cắt bỏ thùy với theo dõi cũng có thể là đủ; tuy nhiên, không có dữ liệu để dự đoán nguy cơ bệnh tồn tại hoặc tái phát. Tất cả bệnh nhân trải qua phẫu thuật cắt bỏ thùy vì DTC cần tuân thủ việc theo dõi và được tư vấn về nhu cầu phẫu thuật bổ sung tiềm tàng nếu phát hiện bệnh tồn tại hoặc tái phát. Kiến thức về đột biến gen điều khiển soma có thể hữu ích trong việc hướng dẫn phương pháp phẫu thuật; tuy nhiên, cần có các nghiên cứu bổ sung để xác nhận tính hữu dụng của phương pháp này để phân tầng chăm sóc (Hộp 13.2).
Hộp 13.2. Đột biến gen điều khiển Soma trong Nhân tuyến giáp và Ung thư tuyến giáp Biệt hóa ở Trẻ em với Nguy cơ Hành vi Xâm lấn và Ứng dụng Tiềm năng trong Phân tầng Quản lý Phẫu thuật
FNA, Chọc hút tế bào bằng kim nhỏ; TSH, hormone kích thích tuyến giáp; US, siêu âm. |
Không giống như PTC, FTC thường là một ổ và không có khuynh hướng xâm lấn hạch bạch huyết, nhưng có thể biểu hiện di căn theo đường máu sớm. Vì chẩn đoán FTC dựa trên bằng chứng xâm lấn giải phẫu, không phải trên các thay đổi nhân hoặc tế bào chất, phần lớn bệnh nhân cuối cùng được chẩn đoán mắc FTC sẽ có tế bào học không xác định trên FNA và trải qua phẫu thuật cắt bỏ thùy cho phẫu thuật ban đầu của họ. Tương tự như PTC, phẫu thuật cắt bỏ tuyến giáp hoàn toàn nên được xem xét cho những bệnh nhân có bệnh tuyến giáp tiềm ẩn, các nhân hai bên, hoặc chẩn đoán đã biết về một hội chứng khuynh hướng khối u tuyến giáp. Trái ngược với PTC, không có lợi thế trong việc thực hiện bóc tách hạch bạch huyết cổ trung tâm dự phòng cho bệnh nhân mắc FTC, vì di căn hạch bạch huyết khu vực không phổ biến. FTC xâm lấn tối thiểu được định nghĩa là FTC có xâm lấn vi thể hoặc không có xâm lấn vỏ bọc và/hoặc xâm lấn mạch máu hạn chế, được định nghĩa là ít hơn 4 mạch máu trong hoặc liền kề với vỏ bọc khối u. FTC xâm lấn rộng được định nghĩa là FTC có xâm lấn vỏ bọc lan rộng, xâm lấn mạch máu lan rộng, hoặc lan rộng vào mô tuyến giáp xung quanh. Sự xâm lấn của 4 hoặc nhiều mạch máu có liên quan đến bệnh tích cực hơn, nguy cơ di căn xa tăng lên và tiên lượng xấu hơn. Phẫu thuật cắt bỏ tuyến giáp hoàn toàn nên được thực hiện cho những bệnh nhân được chẩn đoán mắc FTC xâm lấn rộng để bệnh nhân có thể được đánh giá bằng chứng di căn xa trên xạ hình toàn thân RAI sau phẫu thuật.
Tỷ lệ biến chứng phẫu thuật từ phẫu thuật cắt tuyến giáp ở trẻ em dao động từ 0% đến 32% đối với suy cận giáp vĩnh viễn và 0% đến 40% đối với tổn thương dây thần kinh thanh quản quặt ngược, với tỷ lệ biến chứng cao hơn ở trẻ em từ 0 đến 6 tuổi (22%) khi so sánh với trẻ lớn hơn (15% đối với 7–12 tuổi và 11% đối với 13–17 tuổi). Bệnh nhân được điều trị tại các bệnh viện có khối lượng thấp và bởi các bác sĩ phẫu thuật có khối lượng thấp (≤ 30 ca cắt bỏ tuyến giáp/năm) có nhiều khả năng được chăm sóc không phù hợp với các hướng dẫn thực hành quốc gia, có tỷ lệ biến chứng tăng (14,3% so với 35,9%, tỷ số chênh [OR], 0,16; khoảng tin cậy 95% [CI] 0,05–0,51; P =,02) và tỷ lệ tái nhập viện trong vòng 30 ngày sau phẫu thuật tăng so với các trung tâm có khối lượng lớn. Việc sử dụng nồng độ hormone cận giáp trong phẫu thuật giúp xác định những bệnh nhân có nguy cơ suy cận giáp sau phẫu thuật, tạo cơ hội cho việc dùng sớm canxi và calcitriol. Việc xác định sớm suy cận giáp, với việc bắt đầu sau đó của calcitriol và canxi làm giảm nguy cơ hạ canxi máu có triệu chứng, cũng như rút ngắn thời gian nằm viện sau phẫu thuật. Canxi và phốt pho chu phẫu phải được theo dõi để đảm bảo các giá trị ổn định trước khi xuất viện.
Nguy cơ liệt dây thanh âm do tổn thương dây thần kinh thanh quản quặt ngược (RLN) dao động từ 1% đến 8,6%, với tỷ lệ tổn thương thần kinh hai bên ở đầu dưới của phạm vi, một thách thức đặc biệt, do suy hô hấp và nhu cầu mở khí quản tiềm tàng. Soi thanh quản bằng ống soi sợi mềm hoặc siêu âm thanh quản qua da nên được thực hiện trước khi phẫu thuật cho những bệnh nhân có tiền sử bất thường về giọng nói trước phẫu thuật, di căn hạch bạch huyết cổ và/hoặc trung thất trên rộng rãi. Do tỷ lệ mắc bệnh đáng kể liên quan đến liệt RLN hai bên, chức năng RLN cùng bên nên được đánh giá giữa chừng trong quá trình phẫu thuật cắt bỏ tuyến giáp toàn phần, sau khi hoàn thành việc bóc tách thùy tuyến giáp đầu tiên. Chức năng RLN có thể được theo dõi chủ động bằng theo dõi thần kinh, hoặc thủ công. Nếu RLN còn nguyên vẹn nhưng không đáp ứng với kích thích, bác sĩ phẫu thuật nên xem xét thay đổi kế hoạch phẫu thuật để tránh nguy cơ tổn thương RLN hai bên. Do đó, mặc dù việc sử dụng theo dõi RLN chủ động có thể không làm giảm tỷ lệ tổn thương RLN một bên, nhưng nó rất hiệu quả trong việc giảm nhu cầu tiềm tàng về đường thở phẫu thuật thứ phát sau tổn thương RLN hai bên.
Liệu pháp Iốt Phóng xạ
RAI, 131I, còn được gọi là iốt phóng xạ, đã được quan sát thấy có khả năng tiêu diệt các tế bào khối u tuyến giáp hơn 70 năm trước. Cho đến nay, RAI vẫn là tác nhân điều trị đích hiệu quả và an toàn nhất để tiêu diệt DTC tồn tại không thể cắt bỏ bằng phẫu thuật. Có một số cân nhắc cần ghi nhớ khi xem xét sử dụng RAI ở trẻ em: (1) lợi ích của RAI được chứng minh rõ ràng ở những bệnh nhân có di căn, nhưng không phải với bệnh chỉ giới hạn ở tuyến giáp, và việc triệt tiêu mô còn sót lại không liên quan đến kết quả cải thiện; (2) các phương pháp khác nhau đã được sử dụng để chọn hoạt độ điều trị được cung cấp bao gồm liều lượng kinh nghiệm, đo liều giới hạn trên dựa trên máu, và đo liều khối u, mà không có một phương pháp nào cho thấy hiệu quả rõ ràng hơn các phương pháp khác; (3) hiệu quả của RAI phụ thuộc vào các yếu tố bao gồm sinh học khối u và liều bức xạ đến khối u; (4) hoạt độ tích lũy tương đối cao của RAI (> 300 mCi; 11 GBq) có thể liên quan đến nguy cơ tăng các khối u ác tính nguyên phát thứ hai (SPM); và (5) bệnh nhân có thể được coi là kháng RAI trong các tình huống sau: các ổ chưa bao giờ tập trung RAI, các ổ trước đây đã tập trung RAI mất ái lực, có sự tiến triển giải phẫu trong vòng 1 năm điều trị RAI, hoặc liều RAI tích lũy vượt quá 600 mCi.
Có những cân nhắc và lo ngại tương tự khi sử dụng RAI ở trẻ em và thanh thiếu niên được khuếch đại bởi việc sử dụng liệu pháp RAI tăng gấp 3 lần ở bệnh nhân nhi mắc DTC trong bốn thập kỷ qua, khoảng thời gian mà bệnh nhân nhi phải chịu gánh nặng của các biến chứng do RAI gây ra trong thời gian ngắn, và khoảng thời gian mà các biến chứng do RAI gây ra trong thời gian dài có thời gian để phát triển. Các biến chứng ngắn hạn của liệu pháp RAI trong điều trị DTC bao gồm viêm tuyến nước bọt cấp tính, khô miệng, ức chế tủy xương và viêm phổi. Các biến chứng dài hạn bao gồm khô miệng, sâu răng, xơ phổi, độc tính sinh dục và phát triển SPM. Việc bắt đầu sử dụng các chất kích thích tiết nước bọt, 2 giờ sau khi dùng một liều điều trị RAI, với việc sử dụng liên tục trong 1 đến 2 ngày tiếp theo (cứ sau 15–30 phút, ngay cả qua đêm) có thể giúp giảm phơi nhiễm tuyến nước bọt với RAI. Về nguy cơ SPM do RAI gây ra, đánh giá hồi cứu gần đây nhất của cơ quan đăng ký ung thư SEER của Viện Ung thư Quốc gia đã báo cáo rằng khoảng 1 trong 227 bệnh nhân được điều trị bằng RAI sẽ phát triển một SPM (nguy cơ tăng 0,125% so với những bệnh nhân không nhận RAI) với 1 trong 588 người phát triển ung thư tuyến nước bọt do RAI gây ra. Do đó, nguy cơ tổng thể của các biến chứng liên quan đến RAI là rất thấp và phải được xem xét trong bối cảnh lợi ích của RAI, trong đó nhiều nghiên cứu đã cho thấy nguy cơ tái phát giảm liên quan đến việc sử dụng RAI cho những bệnh nhân được phát hiện có di căn khu vực và xa tại thời điểm chẩn đoán.
Trái ngược với người lớn bị ung thư tuyến giáp, không có hệ thống phân giai đoạn cho trẻ em và thanh thiếu niên mắc PTC, do tỷ lệ tử vong đặc hiệu do bệnh cực kỳ thấp, ngay cả đối với bệnh nhân có di căn phổi. Tuy nhiên, hệ thống phân loại Khối u, Hạch, Di căn (TNM) của Ủy ban Liên hợp về Ung thư Hoa Kỳ được sử dụng để mô tả mức độ của bệnh và phân tầng một phương pháp để đánh giá và quản lý thêm, dựa trên nguy cơ bệnh tồn tại sau phẫu thuật. Ba nhóm từ hướng dẫn Nhi khoa của Hiệp hội Tuyến giáp Hoa Kỳ (ATA) năm 2015 là như sau, được điều chỉnh dựa trên dữ liệu gần đây hơn:
- Nguy cơ Thấp theo ATA Nhi khoa: Bệnh giới hạn đại thể trong tuyến giáp với bệnh N0 (không di căn hạch bạch huyết) hoặc NX (không đánh giá hạch bạch huyết) hoặc bệnh nhân có ≤ 5 hạch bạch huyết di căn tình cờ ở cổ trung tâm (N1a).
- Nguy cơ Trung bình theo ATA Nhi khoa: Sự hiện diện của sự xâm lấn ra ngoài tuyến giáp hoặc > 6 hạch bạch huyết di căn (N1a) hoặc di căn hạch bạch huyết cổ bên (N1b).
- Nguy cơ Cao theo ATA Nhi khoa: Sự hiện diện của hơn 10 hạch bạch huyết di căn hoặc di căn xa.
Bất kể mức độ nguy cơ, tất cả bệnh nhân đều trải qua theo dõi. Đối với bệnh nhân Nguy cơ Thấp theo ATA, bệnh nhân có thể được điều trị bằng liệu pháp levothyroxine ức chế TSH (TSH < 0,5 μU/L) và bắt đầu theo dõi xét nghiệm với khoảng thời gian 3 đến 6 tháng đối với nồng độ TG và anti-TG và siêu âm cổ với khoảng thời gian 6 đến 12 tháng thay vì theo đuổi nồng độ TG được kích thích, với xạ hình toàn thân chẩn đoán (DxWBS) trong khung thời gian ngay sau phẫu thuật. TG được kích thích TSH và DxWBS có thể được thực hiện vào một thời điểm sau đó, nếu có bất kỳ lo ngại nào về bệnh tồn tại hoặc tái phát không thể xác định vị trí trên hình ảnh không dùng đồng vị phóng xạ. Đối với bệnh nhân có nguy cơ trung bình và cao, nên thực hiện TG được kích thích TSH và DxWBS 123I để đánh giá bằng chứng bệnh còn sót lại. Khoảng 2 đến 3 tuần trước DxWBS, liothyronine hoặc levothyroxine được ngưng với mục tiêu đạt được TSH trên 30 μU/L. Khả năng đạt được sự tăng TSH đầy đủ bằng cách sử dụng TSH tái tổ hợp ở người (rhTSH) đã được nghiên cứu ở trẻ em bằng cách sử dụng liều người lớn điển hình (0,9 mg cách nhau 24 giờ); tuy nhiên, dữ liệu nhi khoa về hiệu quả của rhTSH đối với kết quả điều trị còn hạn chế. Trong khung thời gian này, bệnh nhân cũng được đặt trong chế độ ăn ít iốt để tối ưu hóa sự hấp thu của iốt phóng xạ. Đối với trẻ em đã nhận thuốc cản quang chứa iốt, nên đợi 1 đến 2 tháng và xác nhận tình trạng thiếu iốt bằng xét nghiệm iốt trong nước tiểu tại chỗ hoặc 24 giờ trước khi dùng RAI. Đối với DxWBS, có thể sử dụng 131I hoặc 123I, tuy nhiên, 123I được ưa chuộng hơn do chất lượng hình ảnh vượt trội, giảm phơi nhiễm bức xạ và ngăn ngừa hiện tượng choáng (giảm hấp thu 131I của liều điều trị). Nên xem xét việc bổ sung chụp cắt lớp phát xạ đơn photon (SPECT) để xác nhận bệnh được phát hiện ở những vị trí giải phẫu không mong muốn hoặc bất thường.
Đối với những bệnh nhân có sự hấp thu tối thiểu ở giường tuyến giáp trên DxWBS sau phẫu thuật ban đầu, liệu pháp 131I có thể được xem xét dựa trên nồng độ TG được kích thích TSH, trên cơ sở từng trường hợp. TG được kích thích TSH thấp hơn 2 ng/mL có giá trị dự đoán 94,9% là không còn bệnh. Nếu TG được kích thích TSH là 2 đến 10 ng/mL, liệu pháp 131I có thể được xem xét cho những bệnh nhân có sự hấp thu ở giường tuyến giáp và nên được xem xét cho DTC với mô học xâm lấn (biến thể xơ cứng lan tỏa PTC và biến thể nang xâm lấn rộng PTC), và cho các khối u được phát hiện có các đặc điểm xâm lấn trên bệnh học giải phẫu, bao gồm sự xâm lấn ra ngoài tuyến giáp, di căn khu vực rộng rãi (> 6 hạch bạch huyết), hoặc bằng chứng xâm lấn ra ngoài hạch. Nếu TG được kích thích TSH lớn hơn 10 ng/mL, chỉ định liệu pháp 131I. Phẫu thuật lặp lại trước khi dùng 131I nên được theo đuổi nếu có bằng chứng bệnh tồn tại “cồng kềnh”, đại thể, được ghi nhận trong quá trình đánh giá sau phẫu thuật ban đầu.
Các lựa chọn để chọn liều 131I điều trị là theo kinh nghiệm hoặc được xác định dựa trên đo liều giới hạn liều tủy xương. Liều lượng kinh nghiệm được đưa ra dưới dạng một phần (trọng lượng của trẻ tính bằng kilôgam chia cho 70 kg) của một liều người lớn điển hình được sử dụng để điều trị mức độ bệnh tương tự hoặc dựa trên trọng lượng (1,0–1,5 mCi/kg). Đo liều giới hạn liều tủy xương được nhắm mục tiêu để hạn chế sự lưu giữ ở phổi dưới 80 mCi ở 48 giờ và phơi nhiễm máu/tủy xương dưới 200 cGy. Nên xem xét đo liều ở trẻ nhỏ hơn (< 10 tuổi), những trẻ có di căn phổi lan tỏa, và những trẻ có thể có dự trữ tủy xương giảm, bao gồm tiền sử xạ trị cho các khối u ác tính khác. Nên thực hiện WBS sau điều trị (RxWBS) 5 đến 7 ngày sau tất cả các liệu pháp 131I vì có tới 15% bệnh nhân có thể có các ổ mới được xác định không thấy trên DxWBS có thể ảnh hưởng đến kế hoạch theo dõi và điều trị tiếp theo.
Liệu pháp Levothyroxine
Sau khi hoàn thành liệu pháp ban đầu cho DTC, bệnh nhân được dùng liều levothyroxine siêu sinh lý để ức chế TSH xuống dưới giới hạn phát hiện, vì người ta đã nhận ra rằng sự ức chế TSH có thể làm giảm tỷ lệ tái phát. Mức độ ức chế TSH tối ưu đang được tranh luận ở những bệnh nhân có nguy cơ thấp, vì không rõ liệu việc ức chế hoàn toàn sự tiết TSH có mang lại lợi ích hay không. Ở người lớn, tác động lâu dài của liều hormone tuyến giáp siêu sinh lý đối với mật độ khoáng của xương và các nguy cơ tim mạch đã được công nhận. Ở trẻ em, nồng độ hormone tuyến giáp cao có thể ảnh hưởng đến sự tăng trưởng và ảnh hưởng sâu sắc đến hành vi và khả năng học tập.
Các mục tiêu TSH được đề xuất trong hướng dẫn nhi khoa của ATA khuyến nghị duy trì nồng độ TSH trong phạm vi bình thường thấp (0,5–1,0 μU/mL) cho bệnh nhân có nguy cơ thấp, từ 0,1 đến 0,5 μU/L cho bệnh nhân có nguy cơ trung bình, và dưới 0,1 μU/L cho bệnh nhân có nguy cơ cao. Khi một bệnh nhân bước vào giai đoạn thuyên giảm TSH, sự ức chế có thể được nới lỏng vào phạm vi nguy cơ thấp, từ 0,5 đến 1,0 μU/L.
Theo dõi
Chăm sóc theo dõi trẻ bị DTC bao gồm việc đánh giá thường xuyên nồng độ hormone tuyến giáp trong tuần hoàn, đo TG và anti-TG, và chụp ảnh X-quang. Nồng độ TG phải được giải thích trong mối quan hệ với TSH đồng thời và phải cố gắng hết sức để sử dụng cùng một phòng thí nghiệm và phương pháp xét nghiệm để xác định chính xác xu hướng của nồng độ TG. Đánh giá xét nghiệm thường được thực hiện mỗi 3 đến 6 tháng, giảm xuống 6 đến 12 tháng đối với bệnh nhân trong giai đoạn thuyên giảm, và sau đó một lần mỗi năm khi sự tăng trưởng tuyến tính đã hoàn thành.
Một vấn đề rất thích hợp là các tiêu chí được sử dụng để đánh giá xem bệnh nhân có hết bệnh hay không. Với các xét nghiệm TG có độ nhạy cao, người ta có thể nhắm đến nồng độ TG không thể phát hiện được (< 0,2 mcg/L) là dấu hiệu của tình trạng không còn bệnh. Tuy nhiên, với các xét nghiệm TG có độ nhạy cao này, sẽ có những bệnh nhân có TG hoặc anti-TG có thể phát hiện được ở mức tối thiểu mà có thể không có bất kỳ bằng chứng nào về bệnh giải phẫu. Đối với nhiều bệnh nhân này, việc tiếp tục theo dõi có thể là kế hoạch tốt nhất nhằm cân bằng giữa nguy cơ và lợi ích của liệu pháp bổ sung.
Có tới 25% bệnh nhân mắc DTC có nồng độ anti-TG có thể phát hiện được có thể gây nhiễu cho các xét nghiệm TG. Đối với những bệnh nhân này, nên theo dõi xu hướng của TGAb như một dấu hiệu của tình trạng bệnh. Nhiều phòng thí nghiệm sẽ tự động thực hiện TG bằng xét nghiệm miễn dịch phóng xạ hoặc sắc ký lỏng/khối phổ song song, nếu phát hiện TGAb. Đối với những bệnh nhân không được điều trị bằng RAI sau phẫu thuật, TG bị ức chế TSH sẽ giảm xuống dưới 0,5 mcg/L từ 6 đến 12 tháng sau khi cắt bỏ tuyến giáp toàn phần. Nếu TG vẫn tăng nhẹ, từ 2 đến 10 mcg/L, có thể tiếp tục theo dõi tùy thuộc vào xu hướng của TG theo thời gian, cũng như bằng chứng về bệnh tồn tại hoặc tái phát dựa trên hình ảnh X-quang. Mức độ tăng hoặc tăng rõ rệt của TG bị ức chế TSH (> 10 mcg/L) cần được đánh giá thêm để xác định vị trí bệnh và quyết định liệu phẫu thuật bổ sung và/hoặc liệu pháp 131I có lợi hay không. TG được kích thích TSH có thể được thực hiện với DxWBS lặp lại cho những bệnh nhân đang được đánh giá để điều trị bổ sung, cũng như để xác nhận sự thuyên giảm cho những bệnh nhân có tiền sử bệnh xâm lấn.
Siêu âm cổ là công cụ X-quang hiệu quả và hiệu quả nhất để theo dõi bệnh giải phẫu tồn tại hoặc tái phát. Siêu âm đầu tiên nên được thực hiện khoảng 6 tháng sau phẫu thuật ban đầu và sau đó trong khoảng thời gian 6 đến 12 tháng đối với bệnh nhân nhi có nguy cơ trung bình và cao theo ATA. CT ngực hàng loạt trong khoảng thời gian 6 đến 12 tháng nên được sử dụng để theo dõi bệnh nhân có di căn phổi đã biết. TG được kích thích TSH và DxWBS có thể được thực hiện ở những bệnh nhân nhi có nguy cơ trung bình và cao theo ATA, đã được điều trị bằng 131I trước đó, với bệnh di căn ái lực iốt đã biết, nếu nồng độ TG đã ổn định hoặc đang tăng, và bệnh giải phẫu không được tìm thấy trên siêu âm cổ hoặc hình ảnh cắt ngang (CT ngực hoặc MRI). Điều này đặc biệt quan trọng đối với những bệnh nhân có di căn phổi vi nốt lan tỏa vì có tới 50% trường hợp WBS sẽ phát hiện các tổn thương nhỏ 1 đến 2 mm có thể bị bỏ sót ngay cả khi chụp CT độ phân giải cao. Việc sử dụng chụp cắt lớp phát xạ positron 18(F)-fluorodeoxyglucose (FDG-PET)/CT nên được giới hạn ở những bệnh nhân có nồng độ TG tăng nghi ngờ có bệnh giải phẫu tồn tại không ái lực RAI, dựa trên điều trị RAI trước đó và hình ảnh WBS.
Điều trị bệnh tồn tại hoặc tái phát
Các hạch bạch huyết cổ là vị trí phổ biến nhất cho PTC còn sót lại và tái phát. Quyết định điều trị hoặc quan sát bệnh ở cổ có thể xác định được nên được cá nhân hóa theo kích thước, vị trí giải phẫu, tiền sử điều trị trước đó, ái lực iốt của bệnh ở cổ, và sự hiện diện của di căn xa. Đối với bệnh ở cổ đại thể (kích thước ≥ 1 cm) được xác nhận bằng FNA, phẫu thuật được ưu tiên hơn liệu pháp 131I. Đối với trẻ em mắc bệnh ở cổ có thể tích nhỏ ái lực iốt, có thể xem xét liệu pháp 131I điều trị hoặc có thể quan sát bệnh nhân với sự ức chế TSH liên tục, tùy thuộc vào tỷ lệ nguy cơ và lợi ích của từng cá nhân, cũng như sự vắng mặt hoặc hiện diện của di căn xa.
Phần lớn trẻ em có di căn phổi có bệnh vi nốt thể hiện ái lực iốt tuyệt vời. Do đó, trái ngược với người lớn, trẻ em và thanh thiếu niên có di căn phổi có tỷ lệ tử vong đặc hiệu do bệnh thấp. Tuy nhiên, mặc dù nhiều bệnh nhân nhi đạt được sự thuyên giảm khỏi bệnh phổi, ít nhất một phần ba trẻ em sẽ có bệnh tồn tại, ổn định mà không đáp ứng với các liều 131I lặp lại. Việc điều trị lại các di căn phổi ái lực iốt 131I nên được xem xét ở những trẻ đã cho thấy sự cải thiện trước đó nhưng vẫn tiếp tục có bệnh tồn tại dựa trên sự ổn định hoặc xu hướng tăng của TG hoặc TGAb, cũng như dữ liệu từ hình ảnh cắt ngang. Thời điểm bổ sung 131I nên cách ít nhất 12 tháng trở lên so với lần điều trị trước đó, với một số nghiên cứu chứng minh sự sụt giảm liên tục nồng độ TG trong huyết thanh trong 18 đến 24 tháng, hoặc lâu hơn, sau liệu pháp RAI trước đó.
Liệu pháp toàn thân cho trẻ em có bệnh tiến triển
Bệnh kháng RAI (RAIR) phổ biến hơn ở những bệnh nhân trên 45 tuổi; tuy nhiên, một tỷ lệ nhỏ trẻ em và thanh thiếu niên cũng phát triển DTC tiến triển kháng lại điều trị 131I. Trong thập kỷ qua, đã có sự gia tăng số lượng các liệu pháp toàn thân đường uống được đưa vào thực hành lâm sàng. Các tác nhân này nhắm vào các protein kinase được kích hoạt cấu thành trong các con đường tín hiệu MAPK và PI3K. Kiến thức về đột biến gen điều khiển ung thư soma trong khối u kháng thuốc là rất quan trọng trong việc lựa chọn loại thuốc có khả năng có hiệu quả lâm sàng lớn nhất. Các chất ức chế kinase tyrosine đa mục tiêu (TKI), bao gồm sorafenib, lenvatinib, và các chất khác, nhắm vào các thụ thể yếu tố tăng trưởng nội mô mạch máu, cũng như sự kết hợp của các thụ thể yếu tố tăng trưởng biểu bì, thụ thể yếu tố tăng trưởng nguyên bào sợi, thụ thể yếu tố tăng trưởng có nguồn gốc tiểu cầu, và RET. Các tác nhân này đã được chứng minh là làm chậm sự tiến triển và giảm gánh nặng khối u cho nhiều bệnh nhân, bao gồm các khối u có BRAF v600E, cũng như trong các khối u không rõ tình trạng gen gây ung thư. Thật không may, hiệu quả thường là thoáng qua và nhiều bệnh nhân gặp phải các tác dụng phụ, bao gồm tăng huyết áp, tiêu chảy, chán ăn kèm sụt cân, và mệt mỏi. Các chất ức chế chọn lọc mới hơn có hiệu quả tăng và ít độc tính hơn. Sự tái nhạy cảm của các khối u với RAI đã đạt được đối với những bệnh nhân có các khối u chứa đột biến BRAF hoặc RAS sau khi dùng các chất ức chế BRAF chọn lọc, cũng như các chất ức chế MEK. Các chất ức chế chọn lọc hiệu quả tương đương cũng đang trong thử nghiệm và thực hành lâm sàng, với một số được phê duyệt cho đến 12 tuổi đối với những bệnh nhân có các khối u chứa các gen dung hợp BRAF, RET, NTRK, ALK, hoặc ROS1. Mặc dù các tác nhân này mang lại lợi ích lâm sàng, phần lớn là kìm tế bào, không phải là gây độc tế bào. Các khối u cuối cùng phát triển tình trạng kháng thuốc và có kiến thức hạn chế về lựa chọn tốt nhất cho một loại thuốc tiếp theo để điều trị cứu vãn nếu hoặc khi một khối u trở nên kháng với tác nhân ban đầu. Với khả năng có các tác dụng phụ đáng kể, bệnh nhân nhi có thể được hưởng lợi từ liệu pháp nên được chuyển đến các trung tâm có kinh nghiệm với các loại thuốc này trong điều trị ung thư tuyến giáp RAIR, để thời gian, lựa chọn, theo dõi và điều chỉnh liệu pháp có thể được tối ưu hóa, và nguy cơ phản ứng bất lợi được giảm thiểu.
Ung thư tuyến giáp thể tủy
MTC là một loại ung thư nội tiết thần kinh có nguồn gốc từ mào thần kinh và có nguồn gốc từ các tế bào C cạnh nang của tuyến giáp. Do đó, trái ngược với PTC và FTC, các khối u tuyến giáp có nguồn gốc từ tế bào nang, các tế bào MTC không đáp ứng với TSH, không biểu hiện symporter natri-iốt, và không sản xuất TG. Thay vào đó, MTC tiết ra calcitonin và kháng nguyên carcinoembryonic (CEA), cả hai đều đóng vai trò là dấu ấn khối u của MTC. Ở trẻ em, MTC thường là một rối loạn đơn gen gây ra bởi một đột biến tăng chức năng di truyền trội hoặc de novo trong tiền gen gây ung thư RET, liên quan đến một thành phần của MEN2, hoặc MEN2A hoặc 2B, tùy thuộc vào đột biến cụ thể. MTC tản phát không liên quan đến một đột biến dòng mầm; thay vào đó, nó phát triển thứ phát sau các đột biến soma trong tiền gen gây ung thư RET, RAS, hoặc một số gen khác, bao gồm cả các dung hợp ALK.
Có một mối tương quan kiểu gen và kiểu hình mạnh mẽ trong tiền gen gây ung thư RET cho phép dự đoán tốc độ mà một cá nhân có thể phát triển MTC, cũng như nguy cơ và thời điểm phát triển các đặc điểm và khối u liên quan đến MEN2 khác, bao gồm u tủy thượng thận và cường cận giáp. ATA chia các đột biến RET phổ biến nhất thành ba loại nguy cơ: (1) nguy cơ cao nhất, (2) nguy cơ cao, và (3) nguy cơ trung bình, và dựa vào độ tuổi khuyến nghị để sàng lọc ban đầu, và thời điểm phẫu thuật cắt bỏ tuyến giáp dự phòng để trùng với mục tiêu đạt được sự thuyên giảm bệnh do phẫu thuật. Có nhiều đột biến codon liên quan đến MEN2A với nguy cơ phát triển MTC cao nhất liên quan đến các đột biến ở C634 và A883F. Các đột biến còn lại mang nguy cơ phát triển MTC tăng lên, mặc dù đối với từng bệnh nhân, quá trình từ tăng sản tế bào C đến MTC có thể diễn ra chậm chạp với MTC không phát triển cho đến thập kỷ thứ ba, thứ tư, hoặc sau đó của cuộc đời. Ngoài MTC, trong MEN2A có nguy cơ từ 10% đến 50% phát triển cường cận giáp và/hoặc u tủy thượng thận, được xác định bởi đột biến codon riêng lẻ. Hai đặc điểm bổ sung liên quan đến MEN2A là lichen amyloidosis da, một phát ban dạng mảng ngứa thường ở lưng trên liên quan đến các đột biến ở C634 và V804M, và bệnh Hirschsprung, liên quan đến các đột biến ở C609, C611, C618 và C620.
MEN2B có liên quan đến một đột biến tại codon 918 trong tiền gen gây ung thư RET. Vì các đột biến ở codon 918 thường là de novo so với các đột biến codon tiền gen gây ung thư RET khác, việc nhận biết các dấu hiệu và triệu chứng lâm sàng sớm là cực kỳ quan trọng để chẩn đoán hội chứng trước khi di căn MTC, thường xảy ra trước 4 tuổi. Những dấu hiệu và triệu chứng này bao gồm không có nước mắt (không có khả năng hoặc giảm khả năng, tạo ra nước mắt), táo bón (liên quan đến bệnh hạch thần kinh), và giảm trương lực cơ (khó khăn khi cho ăn kèm theo suy dinh dưỡng, bàn chân khoèo, trật khớp háng). Các triệu chứng xác định cổ điển hơn, bao gồm các u thần kinh niêm mạc miệng và môi và khuôn mặt Marfanoid thon dài, không rõ ràng về mặt lâm sàng cho đến tuổi đi học, khoảng 5 tuổi. Khoảng 50% bệnh nhân sẽ phát triển u tủy thượng thận; tuy nhiên, không giống như bệnh nhân mắc MEN2A, dường như không có nguy cơ phát triển cường cận giáp tăng lên.
Dựa trên những quan sát này, ATA khuyến nghị thời điểm phẫu thuật cắt bỏ tuyến giáp toàn phần như sau; trong năm đầu đời đối với những người mang đột biến có nguy cơ cao nhất (codon 918), tại hoặc trước 5 tuổi đối với những người có đột biến nguy cơ cao (codon 634 và 883), và đối với tất cả các đột biến nguy cơ trung bình khác khi nồng độ calcitonin trong huyết thanh cho thấy xu hướng tăng lên, một nhân được tìm thấy trên siêu âm tuyến giáp theo dõi, hoặc nếu cha mẹ không muốn tiếp tục thực hiện một thời gian dài theo dõi xét nghiệm và X-quang. Đối với bệnh nhân mắc MEN2B, nếu phẫu thuật cắt bỏ tuyến giáp không được hoàn thành trước 4 tuổi, khả năng thuyên giảm do phẫu thuật sẽ giảm.
Đối với những bệnh nhân trải qua phẫu thuật cắt bỏ tuyến giáp, nên thực hiện bóc tách hạch bạch huyết trung tâm ở trẻ em có calcitonin cơ bản lớn hơn 40 pg/mL hoặc có bất kỳ bằng chứng nào về di căn hạch bạch huyết. Sau phẫu thuật ban đầu, thuốc levothyroxine được dùng để bình thường hóa, không phải để ức chế, TSH. Trái ngược với tế bào nang trong DTC không phải thể tủy, các tế bào C cạnh nang không tích lũy iốt vì chúng không biểu hiện symporter natri-iốt. Do đó, liệu pháp 131I sau phẫu thuật không được chỉ định sau khi cắt bỏ tuyến giáp vì MTC. Nồng độ calcitonin và CEA nên được theo dõi như các dấu ấn khối u mỗi 6 đến 12 tháng, với tần suất giảm dần khi sự thuyên giảm được xác nhận. Nên theo dõi siêu âm cổ cho những bệnh nhân có dấu ấn khối u có thể phát hiện được liên tục hoặc di căn hạch bạch huyết ban đầu. Nếu các dấu ấn khối u vẫn tăng đáng kể, hoặc cho thấy thời gian nhân đôi nhanh, nên thực hiện hình ảnh bổ sung, chẳng hạn như CT ngực, MRI hoặc CT gan có cản quang, xạ hình xương, MRI cột sống trục, 18F-FDG PET/CT hoặc gallium-68 dotatate PET/CT.
Bệnh nhân mắc MTC di truyền nên được theo dõi liên tục và suốt đời, bao gồm tư vấn di truyền, hỗ trợ tâm lý xã hội, và sàng lọc tiền cứu u tủy thượng thận và cường cận giáp nguyên phát. Sàng lọc hàng năm cho u tủy thượng thận bằng bảng metanephrine phân đoạn trong nước tiểu hoặc huyết thanh được bắt đầu ở tuổi 11 đối với bệnh nhân có nguy cơ cao nhất theo ATA 918 và ở tuổi 16 đối với bệnh nhân có nguy cơ cao và trung bình theo ATA, với việc bổ sung sàng lọc hàng năm cho cường cận giáp đối với bệnh nhân có nguy cơ cao và trung bình theo ATA cùng một lúc.
MTC di căn nói chung là không thể chữa khỏi, nhưng có thể cho thấy một diễn biến lâm sàng chậm chạp với bệnh ổn định trong nhiều thập kỷ. Thời gian nhân đôi calcitonin nhanh và calcitonin thấp không tương xứng, liên quan đến nồng độ CEA cao, có liên quan đến hành vi tích cực và tiên lượng xấu hơn. Đối với bệnh nhân MTC có bệnh di căn có triệu chứng hoặc tiến triển, nên xem xét điều trị bằng TKI đa mục tiêu, hoặc, các liệu pháp nhắm mục tiêu chọn lọc mới hơn và hiệu quả hơn ức chế RET. Tương tự như việc sử dụng các loại thuốc này ở bệnh nhân mắc DTC, bệnh nhân nhi có thể được hưởng lợi từ các tác nhân hóa trị liệu đường uống này nên được chuyển đến các trung tâm có kinh nghiệm với các loại thuốc này trong điều trị MTC tiến triển, để thời gian, lựa chọn, theo dõi và điều chỉnh liệu pháp có thể được tối ưu hóa và nguy cơ phản ứng bất lợi được giảm thiểu.
Bảng chú giải thuật ngữ Anh Việt – Chương 13
| STT | Thuật ngữ tiếng Anh | Phiên âm IPA | Nghĩa Tiếng Việt |
|---|---|---|---|
| 1 | Thyroid Disorders | /ˈθaɪ.rɔɪd dɪsˈɔːrdərz/ | Rối loạn tuyến giáp |
| 2 | Thyromegaly | /ˌθaɪroʊˈmɛɡəli/ | Phì đại tuyến giáp |
| 3 | Biochemical abnormalities | /ˌbaɪoʊˈkɛmɪkəl ˌæbnɔːrˈmælətiz/ | Bất thường sinh hóa |
| 4 | Hypothyroidism | /ˌhaɪpoʊˈθaɪrɔɪdɪzəm/ | Suy giáp |
| 5 | Hyperthyroidism | /ˌhaɪpərˈθaɪrɔɪdɪzəm/ | Cường giáp |
| 6 | Thyroid nodules | /ˈθaɪ.rɔɪd ˈnɑːdjuːlz/ | Nhân tuyến giáp |
| 7 | Thyroid cancer | /ˈθaɪ.rɔɪd ˈkænsər/ | Ung thư tuyến giáp |
| 8 | Multiple endocrine neoplasia (MEN) | /ˈmʌltɪpəl ˈɛndoʊkrɪn ˌniːoʊˈpleɪʒə/ | Đa u tuyến nội tiết |
| 9 | Thyroxine-binding globulin (TBG) | /θaɪˈrɑːksɪn-ˈbaɪndɪŋ ˈɡlɑːbjəlɪn/ | Globulin gắn thyroxine |
| 10 | Thyroid-stimulating hormone (TSH) | /ˈθaɪ.rɔɪd-ˈstɪmjəˌleɪtɪŋ ˈhɔːrˌmoʊn/ | Hormone kích thích tuyến giáp |
| 11 | Autoimmune thyroid disease | /ˌɔːtoʊɪˈmjuːn ˈθaɪ.rɔɪd dɪˈziːz/ | Bệnh tuyến giáp tự miễn |
| 12 | Hashimoto thyroiditis | /ˌhɑːʃiˈmoʊtoʊ ˌθaɪrɔɪˈdaɪtɪs/ | Viêm tuyến giáp Hashimoto |
| 13 | Juvenile acquired hypothyroidism | /ˈdʒuːvənaɪl əˈkwaɪərd ˌhaɪpoʊˈθaɪrɔɪdɪzəm/ | Suy giáp mắc phải ở trẻ vị thành niên |
| 14 | Stimulating antibody | /ˈstɪmjəˌleɪtɪŋ ˈæntɪˌbɑːdi/ | Kháng thể kích thích |
| 15 | Basedow disease | /ɡreɪvz dɪˈziːz/ | Bệnh Basedow |
| 16 | Blocking antibody | /ˈblɑːkɪŋ ˈæntɪˌbɑːdi/ | Kháng thể ức chế |
| 17 | Infectious thyroiditis | /ɪnˈfɛkʃəs ˌθaɪrɔɪˈdaɪtɪs/ | Viêm tuyến giáp nhiễm trùng |
| 18 | Suppurative thyroiditis | /ˈsʌpjəˌreɪtɪv ˌθaɪrɔɪˈdaɪtɪs/ | Viêm tuyến giáp mưng mủ |
| 19 | Subacute thyroiditis | /ˌsʌbəˈkjuːt ˌθaɪrɔɪˈdaɪtɪs/ | Viêm tuyến giáp bán cấp |
| 20 | Binding protein abnormalities | /ˈbaɪndɪŋ ˈproʊˌtiːn ˌæbnɔːrˈmælətiz/ | Bất thường protein gắn kết |
| 21 | TBG deficiency | /ˌtiːbiːˈdʒiː dɪˈfɪʃənsi/ | Thiếu hụt TBG |
| 22 | Transthyretin | /ˌtrænsθaɪˈrɛtɪn/ | Transthyretin |
| 23 | TSH Receptor mutations | /ˌtiːɛsˈeɪtʃ rɪˈsɛptər mjuːˈteɪʃənz/ | Đột biến thụ thể TSH |
| 24 | Loss-of-function | /lɔːs əv ˈfʌŋkʃən/ | Mất chức năng |
| 25 | Gain-of-function | /ɡeɪn əv ˈfʌŋkʃən/ | Tăng chức năng |
| 26 | Thyroid hormone resistance syndromes | /ˈθaɪ.rɔɪd ˈhɔːrˌmoʊn rɪˈzɪstəns ˈsɪnˌdroʊmz/ | Hội chứng đề kháng hormone tuyến giáp |
| 27 | Thyroid hormone beta receptor (TRβ) | /ˈθaɪ.rɔɪd ˈhɔːrˌmoʊn ˈbeɪtə rɪˈsɛptər/ | Thụ thể beta hormone tuyến giáp |
| 28 | Peripheral tissue resistance | /pəˈrɪfərəl ˈtɪʃuː rɪˈzɪstəns/ | Đề kháng mô ngoại biên |
| 29 | Pituitary resistance | /pɪˈtuːɪˌtɛri rɪˈzɪstəns/ | Đề kháng tuyến yên |
| 30 | Iodine deficiency syndromes | /ˈaɪəˌdaɪn dɪˈfɪʃənsi ˈsɪnˌdroʊmz/ | Hội chứng thiếu iốt |
| 31 | Goiter | /ˈɡɔɪtər/ | Bướu cổ |
| 32 | Mental impairment | /ˈmɛntəl ɪmˈpɛərmənt/ | Suy giảm trí tuệ |
| 33 | Cretinism | /ˈkriːtənɪzəm/ | Bệnh đần độn |
| 34 | Diffuse nontoxic goiter | /dɪˈfjuːs ˌnɑnˈtɑksɪk ˈɡɔɪtər/ | Bướu cổ lan tỏa không độc |
| 35 | Nonthyroidal illness | /ˌnɑnθaɪˈrɔɪdəl ˈɪlnəs/ | Bệnh không do tuyến giáp |
| 36 | Thyroid neoplasia | /ˈθaɪ.rɔɪd ˌniːoʊˈpleɪʒə/ | Tân sinh tuyến giáp |
| 37 | Adenoma | /ˌædɪˈnoʊmə/ | U tuyến |
| 38 | Papillary-follicular carcinoma | /ˈpæpəˌlɛri fəˈlɪkjələr ˌkɑːrsɪˈnoʊmə/ | Ung thư biểu mô nhú-nang |
| 39 | Medullary carcinoma | /ˈmɛdʒəˌlɛri ˌkɑːrsɪˈnoʊmə/ | Ung thư biểu mô thể tủy |
| 40 | Metastatic | /ˌmɛtəˈstætɪk/ | Di căn |
| 41 | Tetraiodothyronine (Thyroxine, T4) | /ˌtɛtrəˌaɪədoʊˈθaɪrəniːn/ | Tetraiodothyronine (Thyroxine, T4) |
| 42 | Triiodothyronine (T3) | /ˌtraɪaɪədoʊˈθaɪrəniːn/ | Triiodothyronine (T3) |
| 43 | Thyroid hormone receptor (TRs) | /ˈθaɪ.rɔɪd ˈhɔːrˌmoʊn rɪˈsɛptər/ | Thụ thể hormone tuyến giáp |
| 44 | Deoxyribonucleic acid (DNA) | /diˌɑksiˌraɪboʊnjuːˌkliːɪk ˈæsɪd/ | Axit deoxyribonucleic (DNA) |
| 45 | Monomers | /ˈmɑːnəmərz/ | Monomer |
| 46 | Homodimers | /ˌhoʊmoʊˈdaɪmərz/ | Homodimer |
| 47 | Gene transcription | /dʒiːn trænˈskrɪpʃən/ | Phiên mã gen |
| 48 | Follicular cells | /fəˈlɪkjələr sɛlz/ | Tế bào nang |
| 49 | Prealbumin | /ˌpriːælˈbjuːmɪn/ | Prealbumin |
| 50 | Albumin | /ælˈbjuːmɪn/ | Albumin |
| 51 | Euthyroid | /juːˈθaɪrɔɪd/ | Bình giáp |
| 52 | Acute phase reactants | /əˈkjuːt feɪz riˈæktənts/ | Chất phản ứng pha cấp |
| 53 | Estrogen | /ˈɛstrədʒən/ | Estrogen |
| 54 | Deiodination | /diːˌaɪədɪˈneɪʃən/ | Khử iốt |
| 55 | Monodeiodinase (MD) | /ˌmɑnoʊdiːˈaɪədɪneɪs/ | Monodeiodinase |
| 56 | Reverse T3 (rT3) | /rɪˈvɜːrs ˌtiːˈθriː/ | Reverse T3 (rT3) |
| 57 | Clearance | /ˈklɪərəns/ | Độ thanh thải |
| 58 | Thyrotropin | /ˌθaɪroʊˈtroʊpɪn/ | Thyrotropin |
| 59 | Anterior pituitary gland | /ænˈtɪriər pɪˈtuːɪˌtɛri ɡlænd/ | Thùy trước tuyến yên |
| 60 | G protein–coupled receptors | /dʒiː ˈproʊˌtiːn-ˈkʌpəld rɪˈsɛptərz/ | Thụ thể cặp đôi protein G |
| 61 | Adenylate cyclase | /əˈdɛnəleɪt ˈsaɪkleɪs/ | Adenylate cyclase |
| 62 | Cyclic adenosine monophosphate (cAMP) | /ˈsaɪklɪk əˈdɛnəsiːn ˌmɑnoʊˈfɑsfeɪt/ | Adenosine monophosphate vòng (cAMP) |
| 63 | Iodide trapping | /ˈaɪəˌdaɪd ˈtræpɪŋ/ | Bẫy iốt |
| 64 | Iodotyrosine synthesis | /ˌaɪədoʊˈtaɪrəsiːn ˈsɪnθəsɪs/ | Tổng hợp iodotyrosine |
| 65 | Thyroglobulin (TG) | /ˌθaɪroʊˈɡlɑːbjəlɪn/ | Thyroglobulin |
| 66 | Thyrotropin-releasing hormone (TRH) | /ˌθaɪroʊˈtroʊpɪn-rɪˈliːsɪŋ ˈhɔːrˌmoʊn/ | Hormone giải phóng thyrotropin |
| 67 | Paraventricular nucleus | /ˌpærəvɛnˈtrɪkjələr ˈnuːkliəs/ | Nhân cạnh não thất |
| 68 | Hypothalamus | /ˌhaɪpoʊˈθæləməs/ | Vùng dưới đồi |
| 69 | Portal circulation | /ˈpɔːrtəl ˌsɜːrkjəˈleɪʃən/ | Tuần hoàn cửa |
| 70 | Neurotransmitters | /ˌnʊroʊtrænzˈmɪtərz/ | Chất dẫn truyền thần kinh |
| 71 | TSH receptor–stimulating immunoglobulin antibodies (TSIs) | /… ˈstɪmjəˌleɪtɪŋ ˌɪmjənoʊˈɡlɑːbjəlɪn ˈæntɪˌbɑːdiz/ | Kháng thể immunoglobulin kích thích thụ thể TSH |
| 72 | Thyroid receptor antibodies (TRAbs) | /ˈθaɪ.rɔɪd rɪˈsɛptər ˈæntɪˌbɑːdiz/ | Kháng thể thụ thể tuyến giáp |
| 73 | TSH receptor–blocking immunoglobulins (TBIs) | /… ˈblɑːkɪŋ ˌɪmjənoʊˈɡlɑːbjəlɪnz/ | Globulin miễn dịch ức chế thụ thể TSH |
| 74 | Palpation | /pælˈpeɪʃən/ | Sờ nắn |
| 75 | Ultrasonographic evaluation | /ˌʌltrəˌsɑnəˈɡræfɪk ɪˌvæljuˈeɪʃən/ | Đánh giá siêu âm |
| 76 | Ectopic thyroid tissue | /ɛkˈtɑːpɪk ˈθaɪ.rɔɪd ˈtɪʃuː/ | Mô tuyến giáp lạc chỗ |
| 77 | Sublingual | /ˌsʌbˈlɪŋɡwəl/ | Dưới lưỡi |
| 78 | Malignancies | /məˈlɪɡnənsiz/ | Bệnh ác tính |
| 79 | Resin uptake | /ˈrɛzɪn ˈʌpˌteɪk/ | Độ hấp thu nhựa |
| 80 | Familial dysalbuminemic hyperthyroxinemia | /fəˈmɪliəl ˌdɪsælbjuːmɪˈniːmɪk ˌhaɪpərθaɪrɑkˈsɪniːmiə/ | Tăng thyroxine máu do rối loạn albumin gia đình |
| 81 | Color blindness | /ˈkʌlər ˈblaɪndnəs/ | Mù màu |
| 82 | Euthyroid sick syndrome | /juːˈθaɪrɔɪd sɪk ˈsɪnˌdroʊm/ | Hội chứng bệnh bình giáp |
| 83 | Equilibrium dialysis assay | /ˌiːkwəˈlɪbriəm daɪˈæləsɪs əˈseɪ/ | Xét nghiệm thẩm tách cân bằng |
| 84 | Subclinical hyperthyroidism | /ˌsʌbˈklɪnɪkəl ˌhaɪpərˈθaɪrɔɪdɪzəm/ | Cường giáp cận lâm sàng |
| 85 | Subclinical hypothyroidism | /ˌsʌbˈklɪnɪkəl ˌhaɪpoʊˈθaɪrɔɪdɪzəm/ | Suy giáp cận lâm sàng |
| 86 | Obesity | /oʊˈbiːsəti/ | Béo phì |
| 87 | Cold intolerance | /koʊld ɪnˈtɑːlərəns/ | Không chịu được lạnh |
| 88 | Bradycardia | /ˌbreɪdɪˈkɑːrdiə/ | Nhịp tim chậm |
| 89 | Carotenemia | /ˌkærətiˈniːmiə/ | Tăng caroten máu |
| 90 | Myxedema | /ˌmɪksɪˈdiːmə/ | Phù niêm |
| 91 | Growth failure | /ɡroʊθ ˈfeɪljər/ | Chậm tăng trưởng |
| 92 | Iodine exposure | /ˈaɪəˌdaɪn ɪkˈspoʊʒər/ | Phơi nhiễm iốt |
| 93 | Goitrogens | /ˈɡɔɪtrədʒənz/ | Chất gây bướu cổ |
| 94 | Cystinosis | /ˌsɪstɪˈnoʊsɪs/ | Bệnh cystinosis |
| 95 | Thyroid irradiation | /ˈθaɪ.rɔɪd ɪˌreɪdiˈeɪʃən/ | Chiếu xạ tuyến giáp |
| 96 | Newborn screening | /ˈnuːˌbɔːrn ˈskriːnɪŋ/ | Sàng lọc sơ sinh |
| 97 | Thyroperoxidase | /ˌθaɪroʊpəˈrɑːksɪdeɪs/ | Thyroperoxidase |
| 98 | Lymphocytic infiltration | /ˌlɪmfoʊˈsɪtɪk ˌɪnfɪlˈtreɪʃən/ | Thâm nhiễm lympho bào |
| 99 | Antithyroid antibodies | /ˌæntiˈθaɪ.rɔɪd ˈæntɪˌbɑːdiz/ | Kháng thể kháng tuyến giáp |
| 100 | Transient hyperthyroidism | /ˈtrænziənt ˌhaɪpərˈθaɪrɔɪdɪzəm/ | Cường giáp thoáng qua |
| 101 | Antithyroperoxidase (anti-TPO) antibodies | /ˌæntiˌθaɪroʊpəˈrɑːksɪdeɪs ˈæntɪˌbɑːdiz/ | Kháng thể kháng thyroperoxidase |
| 102 | Levothyroxine | /ˌliːvoʊθaɪˈrɑːksiːn/ | Levothyroxine |
| 103 | Pseudotumor cerebri | /ˌsuːdoʊˈtuːmər ˈsɛrəbraɪ/ | U giả não |
| 104 | Bioavailability | /ˌbaɪoʊəˌveɪləˈbɪləti/ | Sinh khả dụng |
| 105 | Hashitoxicosis | /ˌhɑːʃiˌtɑksɪˈkoʊsɪs/ | Nhiễm độc giáp Hashimoto |
| 106 | Radionuclide uptake | /ˌreɪdioʊˈnuːklaɪd ˈʌpˌteɪk/ | Hấp thu hạt nhân phóng xạ |
| 107 | Diabetes mellitus | /ˌdaɪəˈbiːtiːz ˈmɛlɪtəs/ | Đái tháo đường |
| 108 | Adrenal insufficiency | /əˈdriːnəl ˌɪnsəˈfɪʃənsi/ | Suy thượng thận |
| 109 | Vitiligo | /ˌvɪtɪˈlaɪɡoʊ/ | Bệnh bạch biến |
| 110 | Hypoparathyroidism | /ˌhaɪpoʊˌpærəˈθaɪrɔɪdɪzəm/ | Suy cận giáp |
| 111 | Inflammatory bowel disease | /ɪnˈflæmətɔːri ˈbaʊəl dɪˈziːz/ | Bệnh viêm ruột |
| 112 | Juvenile arthritis | /ˈdʒuːvənaɪl ɑːrˈθraɪtɪs/ | Viêm khớp thiếu niên |
| 113 | Addison disease | /ˈædɪsən dɪˈziːz/ | Bệnh Addison |
| 114 | Celiac disease | /ˈsiːliæk dɪˈziːz/ | Bệnh celiac |
| 115 | Transaminase | /trænsˈæmɪneɪs/ | Transaminase |
| 116 | Turner syndrome | /ˈtɜːrnər ˈsɪnˌdroʊm/ | Hội chứng Turner |
| 117 | Down syndrome | /daʊn ˈsɪnˌdroʊm/ | Hội chứng Down |
| 118 | Somatic | /soʊˈmætɪk/ | Thuộc về thân thể |
| 119 | Facial puffiness | /ˈfeɪʃəl ˈpʌfinəs/ | Phù mặt |
| 120 | Delayed reflexes | /dɪˈleɪd ˈriːflɛksɪz/ | Phản xạ chậm |
| 121 | Body mass index (BMI) | /ˈbɑːdi mæs ˈɪnˌdɛks/ | Chỉ số khối cơ thể |
| 122 | Slipped capital femoral epiphyses | /slɪpt ˈkæpɪtəl ˈfɛmərəl ɪˈpɪfəsiːz/ | Trượt chỏm xương đùi |
| 123 | Pubic hair | /ˈpjuːbɪk hɛər/ | Lông mu |
| 124 | Testicular enlargement | /tɛˈstɪkjələr ɪnˈlɑːrdʒmənt/ | Tinh hoàn to |
| 125 | Menarche | /məˈnɑːrki/ | Hành kinh lần đầu |
| 126 | Breast development | /brɛst dɪˈvɛləpmənt/ | Phát triển vú |
| 127 | Gonadotropin | /ˌɡoʊnədoʊˈtroʊpɪn/ | Gonadotropin |
| 128 | Statural deficit | /ˈstæʧərəl ˈdɛfəsɪt/ | Thiếu hụt chiều cao |
| 129 | Chronologic age | /ˌkrɑnəˈlɑdʒɪk eɪdʒ/ | Tuổi đời |
| 130 | Bone age | /boʊn eɪdʒ/ | Tuổi xương |
| 131 | Skeletal maturation | /ˈskɛlətəl ˌmæʧəˈreɪʃən/ | Trưởng thành xương |
| 132 | Gonadotropin-releasing hormone analogs | /… rɪˈliːsɪŋ ˈhɔːrˌmoʊn ˈænəˌlɔɡz/ | Chất tương tự hormone giải phóng gonadotropin |
| 133 | Wolff-Chaikoff effect | /vɔlf-ˈʧaɪkɔf ɪˈfɛkt/ | Hiệu ứng Wolff-Chaikoff |
| 134 | Betadine | /ˈbeɪtəˌdaɪn/ | Betadine |
| 135 | Povidone iodine | /ˈpoʊvɪdoʊn ˈaɪəˌdaɪn/ | Povidone iodine |
| 136 | Preterm infants | /ˈpriːˌtɜːrm ˈɪnfənts/ | Trẻ sinh non |
| 137 | Amiodarone | /əˈmiːoʊdəˌroʊn/ | Amiodarone |
| 138 | Antiarrhythmic drug | /ˌæntiəˈrɪðmɪk drʌɡ/ | Thuốc chống loạn nhịp |
| 139 | Transplacental passage | /ˌtrænspləˈsɛntəl ˈpæsɪdʒ/ | Đi qua nhau thai |
| 140 | Endemic cretinism | /ɛnˈdɛmɪk ˈkriːtənɪzəm/ | Bệnh đần độn đặc hữu |
| 141 | Iodized salt | /ˈaɪəˌdaɪzd sɔːlt/ | Muối iốt |
| 142 | Head trauma | /hɛd ˈtrɔːmə/ | Chấn thương đầu |
| 143 | Brain tumors | /breɪn ˈtuːmərz/ | U não |
| 144 | Meningitis | /ˌmɛnɪnˈdʒaɪtɪs/ | Viêm màng não |
| 145 | Central nervous system irradiation | /ˈsɛntrəl ˈnɜːrvəs ˈsɪstəm ɪˌreɪdiˈeɪʃən/ | Chiếu xạ hệ thần kinh trung ương |
| 146 | Retinoid X receptor | /ˈrɛtɪnɔɪd ɛks rɪˈsɛptər/ | Thụ thể retinoid X |
| 147 | Lymphomas | /lɪmˈfoʊməz/ | U lympho |
| 148 | Cholestasis | /ˌkoʊlɪˈsteɪsɪs/ | Ứ mật |
| 149 | Hypoglycemia | /ˌhaɪpoʊɡlaɪˈsiːmiə/ | Hạ đường huyết |
| 150 | Pituitary insufficiency | /pɪˈtuːɪˌtɛri ˌɪnsəˈfɪʃənsi/ | Suy tuyến yên |
| 151 | Hypopituitarism | /ˌhaɪpoʊpɪˈtuːɪtərɪzəm/ | Suy tuyến yên |
| 152 | Congenital malformations | /kənˈdʒɛnɪtəl ˌmælfɔːrˈmeɪʃənz/ | Dị tật bẩm sinh |
| 153 | Giant hemangiomas | /ˈdʒaɪənt hɪˌmændʒiˈoʊməz/ | U máu khổng lồ |
| 154 | Consumptive hypothyroidism | /kənˈsʌmptɪv ˌhaɪpoʊˈθaɪrɔɪdɪzəm/ | Suy giáp tiêu thụ |
| 155 | Cancer survivors | /ˈkænsər sərˈvaɪvərz/ | Người sống sót sau ung thư |
| 156 | Tachycardia | /ˌtækɪˈkɑːrdiə/ | Nhịp tim nhanh |
| 157 | Behavioral problems | /bɪˈheɪvjərəl ˈprɑːbləmz/ | Vấn đề hành vi |
| 158 | Ablation | /æˈbleɪʃən/ | Cắt bỏ, triệt tiêu |
| 159 | Attention deficit hyperactivity disorder (ADHD) | /əˈtɛnʃən ˈdɛfəsɪt ˌhaɪpərækˈtɪvəti dɪsˈɔːrdər/ | Rối loạn tăng động giảm chú ý |
| 160 | Thyroidectomy | /ˌθaɪrɔɪˈdɛktəmi/ | Phẫu thuật cắt bỏ tuyến giáp |
| 161 | Neonate | /ˈniːəʊneɪt/ | Trẻ sơ sinh |
| 162 | Thyrotoxicosis | /ˌθaɪroʊˌtɑksɪˈkoʊsɪs/ | Nhiễm độc giáp |
| 163 | Autonomously functioning thyroid nodules | /ɔːˈtɑːnəməsli ˈfʌŋkʃənɪŋ ˈθaɪ.rɔɪd ˈnɑːdjuːlz/ | Nhân tuyến giáp hoạt động tự chủ |
| 164 | Struma ovarii | /ˈstruːmə oʊˈværiaɪ/ | Bướu giáp buồng trứng |
| 165 | TSH-producing pituitary adenomas | /… prəˈduːsɪŋ pɪˈtuːɪˌtɛri ˌædɪˈnoʊməz/ | U tuyến yên sản xuất TSH |
| 166 | Proptosis | /prɑːpˈtoʊsɪs/ | Lồi mắt |
| 167 | Palpitations | /ˌpælpɪˈteɪʃənz/ | Hồi hộp, đánh trống ngực |
| 168 | Linear growth | /ˈlɪniər ɡroʊθ/ | Tăng trưởng theo chiều dài |
| 169 | Bone mineralization | /boʊn ˌmɪnərəlaɪˈzeɪʃən/ | Khoáng hóa xương |
| 170 | Spontaneous remission | /spɑnˈteɪniəs rɪˈmɪʃən/ | Thuyên giảm tự phát |
| 171 | Radioactive iodine (RAI, 131I) | /ˌreɪdioʊˈæktɪv ˈaɪəˌdaɪn/ | Iốt phóng xạ |
| 172 | Antithyroid drug (ATD) | /ˌæntiˈθaɪ.rɔɪd drʌɡ/ | Thuốc kháng giáp |
| 173 | Methimazole (MMI) | /məˈθɪməzoʊl/ | Methimazole |
| 174 | Propylthiouracil (PTU) | /ˌproʊpəlˌθaɪoʊˈjʊərəsɪl/ | Propylthiouracil |
| 175 | Beta-blockers | /ˈbeɪtə-ˈblɑːkərz/ | Thuốc chẹn beta |
| 176 | Propranolol | /proʊˈprænəˌlɔːl/ | Propranolol |
| 177 | Atenolol | /əˈtɛnəˌlɔːl/ | Atenolol |
| 178 | Metoprolol | /məˈtoʊprəˌlɔːl/ | Metoprolol |
| 179 | Reactive airway disease | /riˈæktɪv ˈɛərˌweɪ dɪˈziːz/ | Bệnh đường thở phản ứng |
| 180 | Hepatotoxicity | /ˌhɛpətoʊtɑkˈsɪsəti/ | Độc tính trên gan |
| 181 | Pruritus | /prʊəˈraɪtəs/ | Ngứa |
| 182 | Jaundice | /ˈdʒɔːndɪs/ | Vàng da |
| 183 | Anorexia | /ˌænəˈrɛksiə/ | Chán ăn |
| 184 | Neutrophil | /ˈnuːtrəfɪl/ | Bạch cầu trung tính |
| 185 | Complete blood count | /kəmˈpliːt blʌd kaʊnt/ | Công thức máu toàn phần |
| 186 | Hives | /haɪvz/ | Mề đay |
| 187 | Arthralgia | /ɑːrˈθrældʒə/ | Đau khớp |
| 188 | Neutropenia | /ˌnuːtrəˈpiːniə/ | Giảm bạch cầu trung tính |
| 189 | Agranulocytosis | /əˌɡrænjəloʊsaɪˈtoʊsɪs/ | Mất bạch cầu hạt |
| 190 | Stevens-Johnson syndrome | /ˈstiːvənz-ˈdʒɑːnsən ˈsɪnˌdroʊm/ | Hội chứng Stevens-Johnson |
| 191 | Vasculitis | /ˌvæskjəˈlaɪtɪs/ | Viêm mạch |
| 192 | Pharyngitis | /ˌfærɪnˈdʒaɪtɪs/ | Viêm họng |
| 193 | Antihistamine | /ˌæntiˈhɪstəmiːn/ | Thuốc kháng histamine |
| 194 | Iodine drops | /ˈaɪəˌdaɪn drɑːps/ | Thuốc nhỏ iốt |
| 195 | Quimby-Marinelli equation | /ˈkwɪmbi-ˌmærɪˈnɛli ɪˈkweɪʒən/ | Phương trình Quimby-Marinelli |
| 196 | Potassium iodide | /pəˈtæsiəm ˈaɪəˌdaɪd/ | Kali iodua |
| 197 | Lugol solution | /ˈluːɡɔːl səˈluːʃən/ | Dung dịch Lugol |
| 198 | Ophthalmopathy | /ˌɑfθælˈmɑpəθi/ | Bệnh mắt |
| 199 | Prednisone | /ˈprɛdnɪsoʊn/ | Prednisone |
| 200 | Thyroid storm | /ˈθaɪ.rɔɪd stɔːrm/ | Cơn bão giáp |
