Sperling Nội tiết học Nhi khoa, Ấn bản thứ 5 – Biên dịch: Ths.Bs. Lê Đình Sáng
Sperling Pediatric Endocrinology, Fifth Edition
Tác giả: Sperling, Mark A., MD – Nhà xuất bản: Elsevier Inc.
PHẦN III. NỘI TIẾT HỌC TRẺ EM VÀ THANH THIẾU NIÊN
Chương 21: Đái tháo đường
Diabetes Mellitus
Mark A. Sperling; Joseph I. Wolfsdorf; Ram K. Menon; William V. Tamborlane; David Maahs; Tadej Battelino; Moshe Phillip
Sperling Pediatric Endocrinology, 21, 814-883
Giới thiệu
Đái tháo đường (ĐTĐ) là một hội chứng rối loạn chuyển hóa năng lượng liên quan đến carbohydrate, protein và chất béo, gây ra bởi sự thiếu hụt tuyệt đối hoặc tương đối trong bài tiết insulin, trong bối cảnh nhạy cảm hoặc đề kháng với các hoạt động của insulin tại các mô khác nhau. Do đó, mức độ suy giảm bài tiết insulin và độ nhạy cảm của mô với hoạt động của insulin sẽ quyết định mức độ nghiêm trọng của các biểu hiện lâm sàng, thường được theo dõi phổ biến nhất qua mức độ tăng đường huyết lúc đói và sau ăn không phù hợp. Chính mức độ tăng đường huyết dẫn đến các triệu chứng và dấu hiệu kinh điển như tiểu nhiều, uống nhiều và sụt cân. Các rối loạn chuyển hóa protein và chất béo cũng tồn tại nhưng, không giống như glucose, chúng chỉ được theo dõi ngắt quãng chứ không phải hàng ngày. Theo thời gian, nếu không được kiểm soát, những rối loạn chuyển hóa này sẽ dẫn đến các biến chứng vi mạch và mạch máu lớn khác nhau, chẳng hạn như bệnh võng mạc, bệnh thận, bệnh thần kinh và tắc nghẽn các động mạch lớn ở ngoại biên và tim, làm giảm tuổi thọ và chất lượng cuộc sống. Mức độ nghiêm trọng và thời điểm xuất hiện của các biến chứng này tỷ lệ nghịch với mức độ kiểm soát chuyển hóa, được đánh giá qua các thông số khác nhau, chủ yếu là mức độ tăng đường huyết và sự dao động của glucose trong ngày. Kiểm soát chuyển hóa càng gần mức bình thường thì các biến chứng càng ít có khả năng xảy ra.
ĐTĐ xảy ra khi hằng số bình thường của tích số giữa bài tiết insulin và độ nhạy insulin, một hàm parabol được gọi là chỉ số bù trừ (Hình 21.1), không đủ để ngăn chặn tăng đường huyết và các hậu quả lâm sàng của nó như tiểu nhiều, uống nhiều và sụt cân. Ở mức độ nhạy cảm insulin cao, sự suy giảm nhỏ trong khả năng bài tiết insulin chỉ gây ra những khiếm khuyết nhẹ, không thể nhận thấy trên lâm sàng trong chuyển hóa glucose. Tuy nhiên, bất kể độ nhạy insulin như thế nào, một lượng insulin tối thiểu vẫn cần thiết cho chuyển hóa bình thường. Do đó, sự thiếu hụt gần như tuyệt đối insulin chắc chắn sẽ dẫn đến rối loạn chuyển hóa nghiêm trọng như trong đái tháo đường tuýp 1 (ĐTĐ tuýp 1). Ngược lại, khi độ nhạy cảm với hoạt động của insulin giảm, cần một lượng insulin tiết ra cao hơn để duy trì chỉ số bù trừ bình thường. Tại một điểm tới hạn trên đường cong chỉ số bù trừ (xem Hình 21.1), một sự suy giảm nhỏ hơn nữa về độ nhạy insulin đòi hỏi một sự gia tăng lớn trong bài tiết insulin; những người có thể đáp ứng với tốc độ bài tiết insulin cao hơn này sẽ duy trì chuyển hóa glucose bình thường, trong khi những người không thể tăng tiết insulin do các khiếm khuyết di truyền hoặc mắc phải sẽ biểu hiện đái tháo đường trên lâm sàng, như thường thấy ở đái tháo đường tuýp 2 (ĐTĐ tuýp 2).
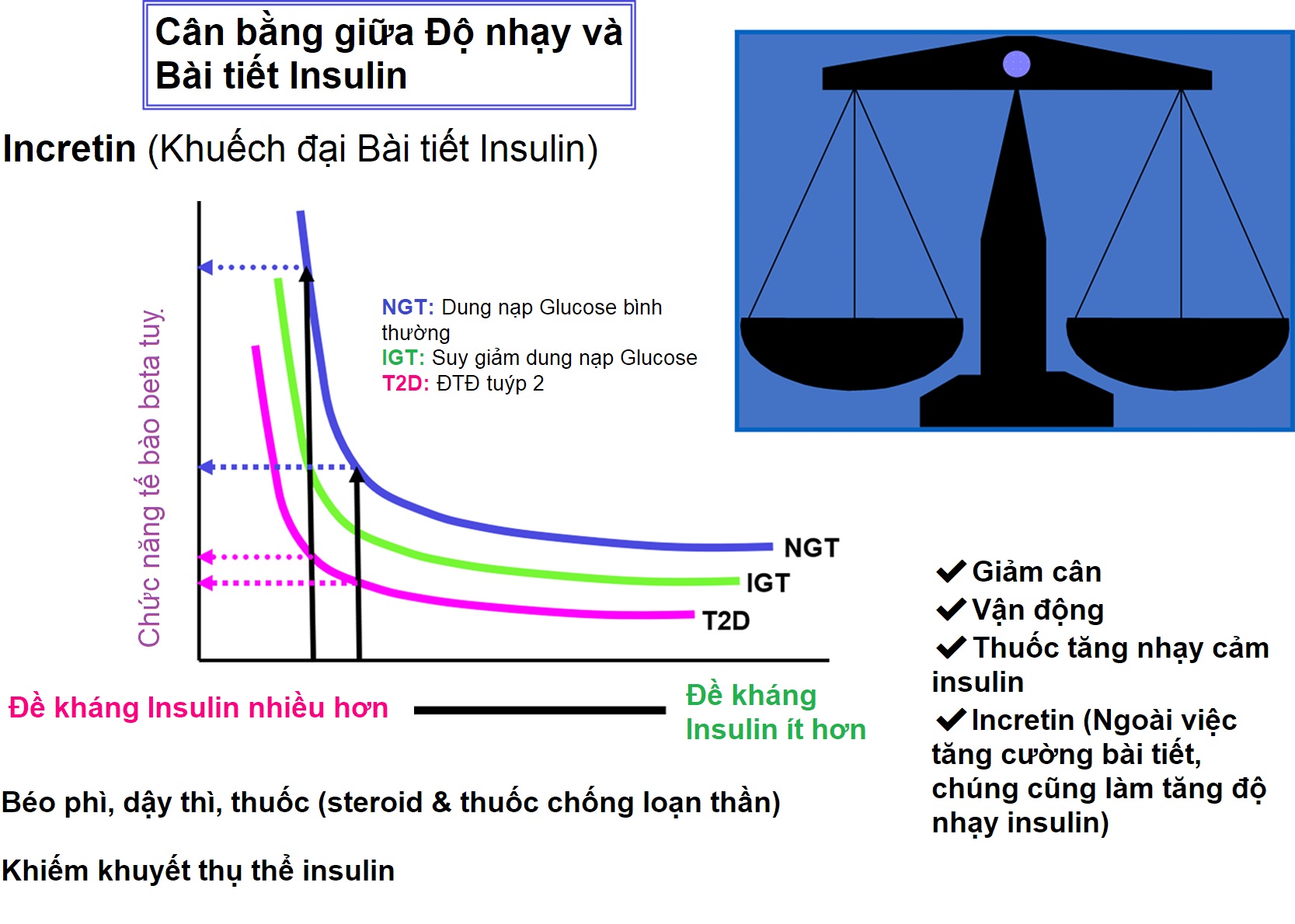
Hình 21.1 Mối quan hệ hyperbol giữa đề kháng insulin và chức năng tế bào beta. Trục y là chức năng tế bào beta được phản ánh qua đáp ứng insulin pha đầu trong quá trình truyền glucose tĩnh mạch (IV); trục x là độ nhạy insulin và hình ảnh phản chiếu của nó là đề kháng insulin. Ở một đối tượng có dung nạp glucose bình thường (NGT) và dự trữ tế bào beta, sự gia tăng đề kháng insulin dẫn đến tăng tiết insulin và dung nạp glucose bình thường. Ở một cá nhân mà khả năng tăng tiết insulin bị tổn hại, việc tăng đề kháng insulin với sự bù trừ một phần hoặc không có của tế bào beta dẫn đến tiến triển từ dung nạp glucose bình thường, đến rối loạn dung nạp glucose (IGT), và cuối cùng là đái tháo đường (T2D). Sự khác biệt giữa các loại này là nhỏ ở độ nhạy insulin cao, có thể được duy trì bằng cách giảm cân, tập thể dục và một số loại thuốc. Ở một mức độ đề kháng insulin tới hạn, do béo phì hoặc các yếu tố được liệt kê khác, chỉ cần một sự gia tăng nhỏ hơn nữa trong đề kháng cũng đòi hỏi một sự gia tăng lớn trong sản lượng insulin. Những người có thể tăng tiết insulin đến mức này vẫn duy trì dung nạp glucose bình thường; những người không thể đạt được mức độ tiết insulin này (ví dụ, do một khiếm khuyết nhẹ trong các gen điều hòa tổng hợp insulin, bài tiết insulin, hoạt động của insulin, hoặc một quá trình phá hủy tế bào beta do miễn dịch đang diễn ra) sẽ bộc lộ các mức độ không dung nạp carbohydrate khác nhau. Tích số của độ nhạy insulin (nghịch đảo của đề kháng insulin) và đáp ứng insulin cấp tính (một phép đo chức năng tế bào beta) đã được gọi là “chỉ số bù trừ”. Chỉ số này không đổi ở một cá nhân có sự bù trừ tế bào beta bình thường để đáp ứng với những thay đổi trong đề kháng insulin. Incretin là các hormone như GLP-1, giúp tăng cường bài tiết insulin và cũng làm tăng độ nhạy insulin. (Nguồn: Ize-Ludlow, D., & Sperling, M.A. (2005). The classification of diabetes mellitus: a conceptual framework. Pediatr Clin North Am, 52, 1533–1552.)
Bằng cách xem xét đồng thời bài tiết insulin và hoạt động của insulin ở bất kỳ cá nhân nào, có thể giải thích được diễn biến tự nhiên của bệnh đái tháo đường ở người đó (ví dụ, sự thuyên giảm ở bệnh nhân ĐTĐ tuýp 1 hoặc nhiễm toan ceton ở người bị ĐTĐ tuýp 2). Do đó, ĐTĐ có thể là kết quả của sự thiếu hụt insulin tuyệt đối, hoặc đề kháng insulin tuyệt đối, hoặc sự kết hợp của các khiếm khuyết nhẹ hơn ở cả bài tiết insulin và hoạt động của insulin. Nhìn chung, các hội chứng ĐTĐ là các rối loạn nội tiết/chuyển hóa phổ biến nhất ở trẻ em và thanh thiếu niên. Việc áp dụng các công cụ sinh học phân tử tiếp tục cung cấp những hiểu biết đáng kể về nguyên nhân, sinh lý bệnh và di truyền của các dạng ĐTĐ khác nhau do sự thiếu hụt bài tiết insulin hoặc hoạt động của nó ở cấp độ tế bào.
Tỷ lệ mắc bệnh và tử vong xuất phát từ các rối loạn chuyển hóa và từ các biến chứng lâu dài. Các biểu hiện lâm sàng cấp tính được hiểu đầy đủ trong bối cảnh kiến thức về sự bài tiết và hoạt động của insulin. Các yếu tố di truyền và nguyên nhân khác cho thấy vai trò của các cơ chế tự miễn trong sự tiến triển của dạng đái tháo đường phổ biến nhất ở trẻ em, được gọi là đái tháo đường tuýp 1a. Các khiếm khuyết di truyền trong bài tiết insulin ngày càng được công nhận và hiểu rõ là nguyên nhân xác định của các dạng đái tháo đường đơn gen, chẳng hạn như đái tháo đường khởi phát ở người trẻ (MODY) và ĐTĐ sơ sinh, và góp phần vào phổ bệnh của ĐTĐ tuýp 2.
Bằng chứng mạnh mẽ cho thấy các biến chứng lâu dài có liên quan đến mức độ và thời gian của các rối loạn chuyển hóa đã tạo cơ sở cho các phương pháp điều trị tiêu chuẩn và sáng tạo cho phổ các hội chứng ĐTĐ, bao gồm các công thức dược lý mới hơn của insulin, các phương pháp cung cấp insulin truyền thống và sinh lý hơn, và các phương pháp đang phát triển để theo dõi glucose máu liên tục nhằm duy trì nó trong giới hạn mong muốn bằng cách liên kết các tính năng này với các bơm insulin được điều khiển bằng thuật toán cho một “tụy nhân tạo”.
Phân loại
ĐTĐ không phải là một thực thể đơn lẻ, mà là một nhóm các rối loạn không đồng nhất trong đó có các kiểu di truyền riêng biệt, cũng như các cơ chế nguyên nhân và sinh lý bệnh khác dẫn đến suy giảm dung nạp glucose. Hộp 21.1 trình bày một phân loại nguyên nhân của ĐTĐ ở trẻ em, dựa trên “Báo cáo của Ủy ban Chuyên gia về Phân loại và Chẩn đoán Đái tháo đường,” được Hiệp hội Đái tháo đường Hoa Kỳ (ADA) công bố vào tháng 1 năm 2018.
| Hộp 21.1: Phân loại Đái tháo đường theo Nguyên nhân
ABCC8, ATP binding cassette subfamily C member 8; DNA, deoxyribonucleic acid; HNF, hepatocyte nuclear factor; IPF, insulin promoter factor; KCNJ11, potassium channel family J number 11; MODY, đái tháo đường khởi phát ở người trẻ. I. ĐÁI THÁO ĐƯỜNG TUÝP 1 (PHÁ HỦY TẾ BÀO BETA DẪN ĐẾN THIẾU HỤT INSULIN HOÀN TOÀN) A. Qua trung gian miễn dịch B. Vô căn II. ĐÁI THÁO ĐƯỜNG TUÝP 2 (KẾT HỢP BIẾN THIÊN GIỮA ĐỀ KHÁNG INSULIN VÀ THIẾU HỤT INSULIN) A. Điển hình B. Không điển hình III. KHIẾM KHUYẾT DI TRUYỀN CỦA CHỨC NĂNG TẾ BÀO BETA A. Các hội chứng MODY 1. MODY 1: nhiễm sắc thể 20, HNF4A 2. MODY 2: nhiễm sắc thể 7, glucokinase 3. MODY 3: nhiễm sắc thể 12, HNF1A 4. MODY 4: nhiễm sắc thể 13, IPF-1 5. MODY 5: nhiễm sắc thể 17, HNF-1β 6. MODY 6: nhiễm sắc thể 2q32, neuro-D1/beta-2 7. MODY 7-14, xem Bảng 21.14 B. Đột biến DNA ty thể (bao gồm một dạng hội chứng Wolfram, hội chứng Pearson, Kearns-Sayre, đái tháo đường, điếc) C. Hội chứng Wolfram—DIDMOAD (đái tháo nhạt, đái tháo đường, teo thần kinh thị giác, điếc): WFS1-Wolframin—nhiễm sắc thể 4p 1. Locus Wolfram 2—nhiễm sắc thể 4q22-24 2. Wolfram do ty thể D. Thiếu máu hồng cầu khổng lồ và đái tháo đường đáp ứng với thiamine IV. DO THUỐC HOẶC HÓA CHẤT A. Chống thải ghép—cyclosporine, sirolimus B. Glucocorticoid (với suy giảm bài tiết insulin; ví dụ: xơ nang) C. l-Asparaginase D. Thuốc chẹn β-adrenergic E. Vacor (thuốc diệt chuột) F. Phenytoin (dilantin) G. Alfa-interferon H. Diazoxide I. Acid nicotinic J. Các loại khác V. BỆNH LÝ TUỴ NGOẠI TIẾT A. Đái tháo đường liên quan đến xơ nang B. Chấn thương—cắt bỏ tụy C. Viêm tụy—bức xạ ion hóa D. Các bệnh lý khác VI. NHIỄM TRÙNG A. Rubella bẩm sinh B. Cytomegalovirus C. Hội chứng tan máu-urê huyết VII. CÁC BIẾN THỂ CỦA ĐÁI THÁO ĐƯỜNG TUÝP 2 A. Khiếm khuyết di truyền của hoạt động insulin 1. Hội chứng Rabson-Mendenhall 2. Hội chứng Leprechaunism 3. Các hội chứng đái tháo đường loạn dưỡng mỡ 4. Đề kháng insulin tuýp A—gai đen B. Khiếm khuyết mắc phải của hoạt động insulin 1. Các khối u nội tiết—hiếm gặp ở trẻ em C. U tủy thượng thận (Pheochromocytoma) D. Bệnh Cushing E. Các nguyên nhân khác 1. Kháng thể kháng thụ thể insulin VIII. CÁC HỘI CHỨNG DI TRUYỀN KÈM ĐÁI THÁO ĐƯỜNG VÀ ĐỀ KHÁNG INSULIN/THIẾU HỤT INSULIN A. Hội chứng Prader-Willi, nhiễm sắc thể 15 B. Hội chứng Down, nhiễm sắc thể 21 C. Hội chứng Turner D. Hội chứng Klinefelter E. Các hội chứng khác 1. Bardet-Biedl 2. Alstrom 3. Werner IX. ĐÁI THÁO ĐƯỜNG THAI KỲ X. ĐÁI THÁO ĐƯỜNG SƠ SINH A. Thoáng qua—nhiễm sắc thể 6q24, KCNJ11, ABCC8, INS, HNF1β, các gen khác B. Vĩnh viễn—bất sản tụy—thiếu hụt glucokinase, đồng hợp tử, KCNJ11, ABCC8, các gen khác (xem Chương 10) |
Phân loại của chúng tôi được điều chỉnh để phản ánh chính xác hơn các nhóm chính ở trẻ em, bao gồm sự nổi lên của ĐTĐ tuýp 2, đái tháo đường liên quan đến xơ nang, và đái tháo đường do thuốc—chủ yếu từ các thuốc chống thải ghép cyclosporine, sirolimus, và tacrolimus (trước đây là FK-506). Bảng 21.1 trình bày tóm tắt phân loại ban đầu được đề xuất vào năm 1979 nhưng có kết hợp các tiêu chí mới hơn về giá trị glucose máu được sử dụng để chẩn đoán đái tháo đường, rối loạn dung nạp glucose và đái tháo đường thai kỳ. Phân loại hiện tại của ĐTĐ tuýp 1 bao gồm các giai đoạn: giai đoạn 1 là sự hiện diện của hai hoặc nhiều kháng thể tế bào đảo tụy (ICA), nhưng không có bất kỳ rối loạn nào có thể nhận thấy trong chuyển hóa glucose; giai đoạn 2 bao gồm kháng thể dương tính cộng với rối loạn glucose lúc đói hoặc rối loạn dung nạp glucose; giai đoạn 3 là sự hiện diện của các tiêu chí đường huyết cho bệnh đái tháo đường cùng với các biểu hiện lâm sàng. Trong số các dạng phụ thuộc insulin, sự thiếu hụt nghiêm trọng bài tiết insulin thường là kết quả của sự phá hủy tự miễn các đảo tụy ở những cá thể có cơ địa di truyền. Như đã lưu ý trước đó, bằng chứng về tự miễn dịch có thể xuất hiện trước nhiều tháng đến nhiều năm so với sự suy giảm lâm sàng dẫn đến dung nạp glucose bất thường. Dạng này đồng nghĩa với đái tháo đường tuýp 1a, trước đây được gọi là đái tháo đường khởi phát ở tuổi vị thành niên. ĐTĐ phụ thuộc insulin nặng, không thể phân biệt trên lâm sàng với dạng tự miễn, có thể không có bất kỳ bằng chứng nào về tự miễn dịch và có thể là kết quả của các khiếm khuyết gen ty thể hoặc gen khác cản trở bài tiết insulin bình thường hoặc hiếm khi là do bất sản tụy.
Bảng 21.1: Tóm tắt Phân loại Đái tháo đường ở Trẻ em và Thanh thiếu niên
| Loại, Tiêu chí | |
|---|---|
| Đái tháo đường | |
| Tuýp 1 | “Các triệu chứng điển hình: glucose niệu, ceton niệu; glucose huyết tương ngẫu nhiên > 200 mg/dL; ≥ 2 kháng thể với dung nạp glucose bình thường hiện được coi là khởi đầu của ĐTĐ tuýp 1; với dung nạp glucose bất thường là Giai đoạn 2; với các triệu chứng lâm sàng là Giai đoạn 3” |
| Tuýp 2 | Glucose huyết tương lúc đói > 126 mg/dL với giá trị 2 giờ xen kẽ > 200 mg/dL trong nghiệm pháp dung nạp glucose đường uống (OGTT) nhiều hơn một lần và không có các yếu tố thúc đẩy |
| Các loại khác | “Tiêu chí tuýp 1 hoặc tuýp 2 với các hội chứng di truyền, bao gồm đái tháo đường khởi phát ở người trẻ (MODY), đái tháo đường sơ sinh (NDM), điều trị bằng thuốc; bệnh tụy hoặc các nguyên nhân hay mối liên quan đã biết khác” |
| Rối loạn glucose lúc đói | Glucose > 100 mg/dL nhưng < 126 mg/dL |
| Rối loạn dung nạp glucose | Glucose huyết tương lúc đói < 126 mg/dL với giá trị 2 giờ > 140 mg/dL nhưng < 200 mg/dL trong OGTT |
| Đái tháo đường thai kỳ | “Hai hoặc nhiều mức glucose huyết tương lúc đói bất thường > 105 mg/dL, 1 giờ > 180 mg/dL, 2 giờ > 155 mg/dL, 3 giờ > 140 mg/dL trong OGTT” |
| Các nhóm nguy cơ thống kê | |
| Bất thường dung nạp glucose trước đây | “OGTT bình thường với OGTT bất thường trước đây, tăng đường huyết tự phát, hoặc đái tháo đường thai kỳ” |
| Khả năng bất thường dung nạp glucose tiềm tàng | “Khuynh hướng di truyền (ví dụ, sinh đôi cùng trứng với người bị đái tháo đường); 2 kháng thể tế bào đảo tụy được coi là tiền đái tháo đường” |
ĐTĐ tuýp 1, Đái tháo đường tuýp 1; OGTT, nghiệm pháp dung nạp glucose đường uống.
Các dạng nghiêm trọng hơn của hội chứng MODY, sẽ được trình bày chi tiết sau, cũng có thể cần dùng insulin. Các dạng đái tháo đường tương tự về mặt lâm sàng có thể xảy ra thứ phát sau bệnh xơ nang, do các loại thuốc độc hại như các thuốc ức chế miễn dịch cyclosporine, sirolimus, và tacrolimus, thuốc diệt chuột Vacor, hoặc streptozotocin được sử dụng cho một số khối u tế bào đảo tụy; với hội chứng tan máu-urê huyết; hoặc sau phẫu thuật cắt bỏ tụy, chẳng hạn như do viêm tụy tái phát hoặc hạ đường huyết tăng insulin máu kéo dài ở trẻ sơ sinh. Đái tháo đường phụ thuộc insulin ở trẻ em nói chung là ĐTĐ tuýp 1a.
Đái tháo đường tuýp 1
Tình trạng này được đặc trưng bởi sự thiếu hụt insulin nghiêm trọng và sự phụ thuộc vào insulin ngoại sinh để ngăn ngừa nhiễm ceton và bảo tồn sự sống. Do đó, nó được gọi là ĐTĐ phụ thuộc insulin (IDDM). Diễn biến tự nhiên của bệnh này cho thấy có các giai đoạn không phụ thuộc insulin, không nhiễm ceton trước và sau chẩn đoán ban đầu. Mặc dù khởi phát chủ yếu ở trẻ em, bệnh có thể xảy ra ở mọi lứa tuổi. Do đó, các tên gọi như “đái tháo đường vị thành niên”, “đái tháo đường có xu hướng nhiễm ceton”, và “đái tháo đường dao động” đã bị loại bỏ để thay bằng thuật ngữ đái tháo đường tuýp 1 (ĐTĐ tuýp 1).
Đái tháo đường tuýp 1a thường khác biệt bởi sự liên quan với một số kháng nguyên phức hợp tương hợp mô chính (HLA) và các dấu ấn di truyền khác mà phần lớn trong số đó quyết định phản ứng với các kháng nguyên của chính cơ thể (hoặc ngoại sinh), ví dụ, kháng nguyên 4 của tế bào T gây độc (CTLA4), gen điều hòa tự miễn (AIRE), số lượng biến thiên của các đoạn lặp lại song song trong gen insulin (VNTR), thụ thể interleukin 2 (IL2R), protein tyrosine phosphatase, và protein tyrosine phosphatase nonreceptor type 22 (PTPN22); bởi sự hiện diện của các kháng thể lưu hành chống lại các thành phần tế bào chất và bề mặt tế bào của các tế bào đảo tụy; của các kháng thể kháng insulin khi chưa từng tiếp xúc với việc tiêm insulin ngoại sinh, của các kháng thể kháng glutamic acid decarboxylase (GAD, enzyme chuyển đổi acid glutamic thành acid γ-aminobutyric có nhiều trong hệ thần kinh của các đảo tụy), của các kháng thể kháng IA-2 (một phosphatase liên quan đến tế bào đảo tụy) và các kháng thể kháng phân tử vận chuyển kẽm (ZnT8); bởi sự thâm nhiễm lympho bào vào các đảo tụy ở giai đoạn đầu của bệnh; và bởi sự cùng tồn tại với các bệnh tự miễn khác. Đôi khi, các dấu ấn của tự miễn dịch không được tìm thấy nhưng vẫn có sự thiếu hụt insulin sâu sắc và phụ thuộc vào insulin mà không có bằng chứng về một khiếm khuyết ty thể hoặc di truyền khác. Trong những trường hợp này, ĐTĐ tuýp 1 được coi là vô căn (tuýp 1b). Với các ngoại lệ đã lưu ý, đái tháo đường ở trẻ em thường phụ thuộc insulin và thuộc loại tuýp 1a.
Đái tháo đường tuýp 2
Những người mắc phân nhóm đái tháo đường này (trước đây được gọi là đái tháo đường khởi phát ở người trưởng thành, đái tháo đường khởi phát ở tuổi trưởng thành [MOD], hoặc đái tháo đường ổn định) có thể không phụ thuộc insulin vĩnh viễn và chỉ thỉnh thoảng mới bị nhiễm ceton. Tuy nhiên, một số người có thể cần insulin để điều chỉnh tăng đường huyết có triệu chứng—và nhiễm ceton có thể phát triển ở một số người trong các đợt nhiễm trùng nặng hoặc stress khác. Do đó, trước đây nó được gọi là ĐTĐ không phụ thuộc insulin (NIDDM). Dạng đái tháo đường này đang ngày càng phổ biến ở thanh thiếu niên thừa cân, đặc biệt là những người thuộc các nhóm dễ bị tổn thương, như người gốc Phi, người Latin, người Mỹ bản địa và các nhóm dân tộc nhạy cảm khác.
ĐTĐ tuýp 2 không phải là một thực thể đơn lẻ. ĐTĐ tuýp 2 có thể là một rối loạn nguyên phát, với sự bài tiết insulin không đủ do đột biến ở một trong số các gen mã hóa enzyme hoặc các yếu tố phiên mã quan trọng đối với sự phát triển của tế bào đảo tụy và bài tiết insulin. Một số trong những khiếm khuyết này hiện là một phần của phổ các hội chứng thường liên quan đến MODY, có phương thức di truyền trội. Tuy nhiên, một số bệnh nhân có khiếm khuyết MODY có thể cần insulin ngay từ đầu hoặc khi họ lớn tuổi và trở nên đề kháng insulin, vượt quá khả năng bù trừ bằng cách tăng tiết insulin (xem Hình 21.1). Một khiếm khuyết trong gen điều hòa vận chuyển glucose vào tế bào beta của tụy, chất vận chuyển GLUT2, có thể là nguyên nhân của một dạng đái tháo đường tuýp 2 (ĐTĐ tuýp 2) khác.
Các khiếm khuyết trong glycogen synthase cũng đã được đề cập. Một khiếm khuyết nguyên phát trong các thụ thể insulin—thường liên quan đến chứng gai đen, các khiếm khuyết sau thụ thể (bao gồm Rad [Ras liên quan đến đái tháo đường]), và các khiếm khuyết gen ty thể nhẹ hơn—cũng có thể dẫn đến ĐTĐ tuýp 2. Các nguyên nhân thứ phát của ĐTĐ tuýp 2 bao gồm các hormone đối kháng điều hòa quá mức, đặc biệt là liều dược lý của glucocorticoid, kháng thể kháng thụ thể insulin, và béo phì với suy giảm bài tiết insulin.
Trong ĐTĐ tuýp 2, nồng độ insulin trong huyết thanh so với người gầy bình thường có thể tăng, bình thường hoặc giảm vừa phải tùy thuộc vào việc khiếm khuyết là ở hoạt động hay bài tiết insulin. Sự khởi phát của ĐTĐ tuýp 2 thường xảy ra ở trẻ em nói chung vào khoảng thời gian dậy thì hoặc ngay sau đó, nhưng nó được công nhận là có thể xảy ra ở mọi lứa tuổi và đang ngày càng trở nên thường xuyên hơn ở trẻ em và thanh thiếu niên. Trong một số trường hợp, những gì có vẻ là ĐTĐ tuýp 2 thực sự có thể là ĐTĐ tuýp 1 đang tiến triển chậm. Trong ĐTĐ tuýp 2, không có sự liên quan với các kháng nguyên HLA cụ thể, tự miễn dịch hoặc các ICA khác nhau. Tuy nhiên, một số bất thường di truyền điều hòa bài tiết hoặc hoạt động của insulin ngày càng được cho là có liên quan đến ĐTĐ tuýp 2, do đó cấu trúc di truyền của ĐTĐ tuýp 2 rất phức tạp và vẫn chưa được hiểu đầy đủ.
Đái tháo đường tuýp 1
Dịch tễ học
Tỷ lệ mắc ĐTĐ có tương quan cao với sự gia tăng của tuổi tác. Dữ liệu hiện có cho thấy một khoảng từ một trường hợp trên 1430 trẻ em ở 5 tuổi đến một trường hợp trên 360 trẻ em ở 16 tuổi.
Dữ liệu về tỷ lệ mắc mới liên quan đến nguồn gốc chủng tộc hoặc dân tộc cho thấy một khoảng từ hơn 50 trường hợp mới hàng năm trên 100.000 dân ở Phần Lan và Sardinia đến khoảng một trường hợp trên 100.000 ở Trung Quốc và các vùng của Nam Mỹ (Hình 21.2). Ở tất cả các khu vực được kiểm tra, dường như có sự gia tăng tỷ lệ mắc mới ĐTĐ tuýp 1 khoảng 2% đến 3% mỗi năm. Tuy nhiên, tỷ lệ mắc mới ĐTĐ tuýp 1 ở Phần Lan đã được báo cáo là đạt đỉnh và giảm nhẹ, với dữ liệu tương tự từ Na Uy cho thấy sự gia tăng tỷ lệ mắc mới có thể đang suy yếu.
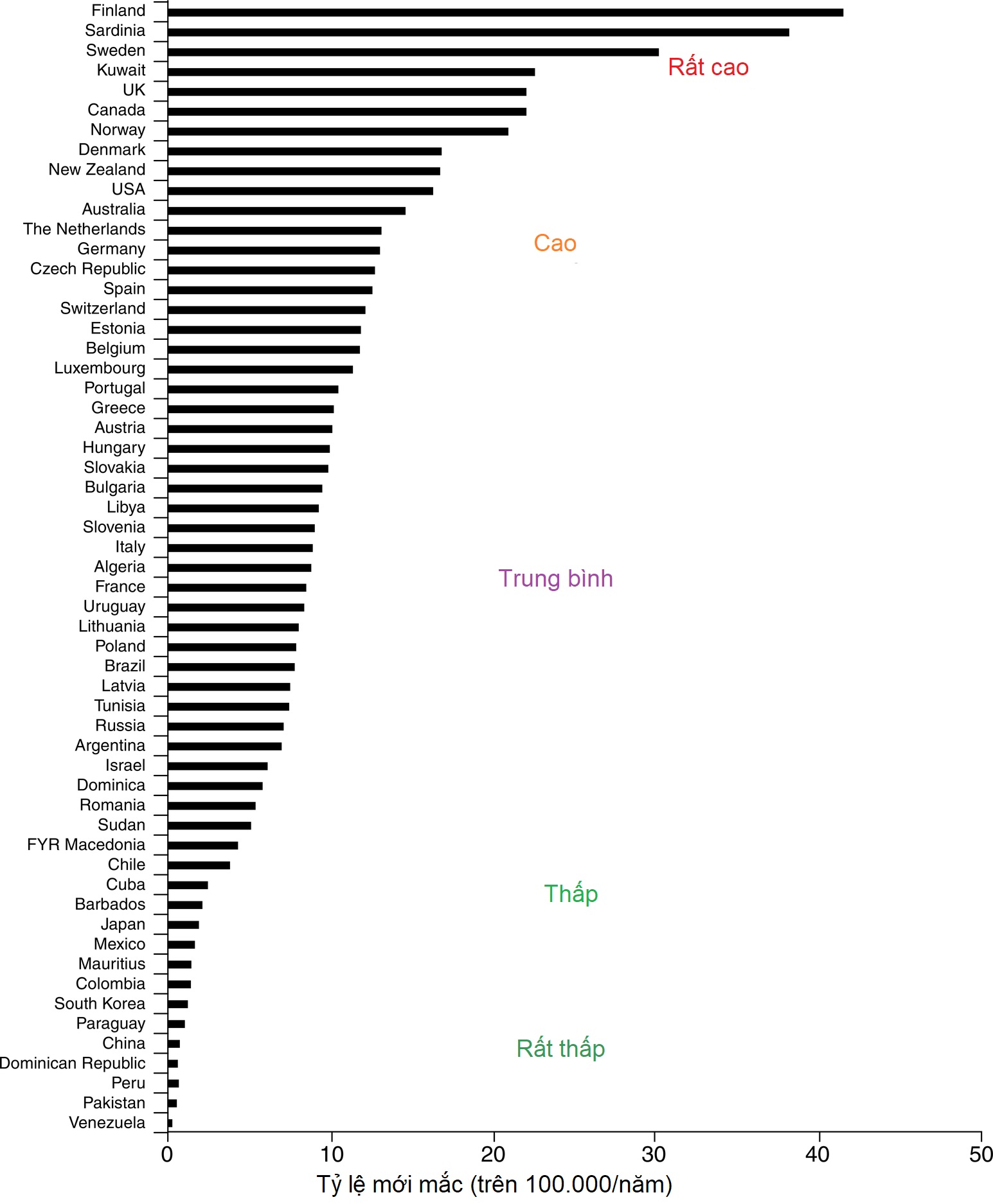
Hình 21.2 Tỷ lệ mắc mới chuẩn hóa theo tuổi (trên 100.000/năm) của đái tháo đường tuýp 1 ở trẻ em dưới 14 tuổi trong 100 quần thể. Dữ liệu của bé trai và bé gái đã được gộp lại. Các quốc gia được sắp xếp theo thứ tự giảm dần theo tỷ lệ mắc mới. (Puerto Rico và Quần đảo Virgin được trình bày riêng biệt với các quần thể khác ở Hoa Kỳ.) (Nguồn: Diamond Project Group (2006). Incidence of trends of childhood type 1 diabetes worldwide 1990-1999. Diabet Med, 23, 857–866.)
Tại Hoa Kỳ, sự xuất hiện của tuýp 1 ở người gốc Phi trước đây đã được báo cáo chỉ bằng khoảng một phần ba đến hai phần ba so với người da trắng. Dữ liệu gần đây hơn cho thấy tỷ lệ mắc ĐTĐ ở người Mỹ gốc Phi đang gia tăng. Tuy nhiên, liệu một phần của sự gia tăng tỷ lệ mắc mới được báo cáo này trong số người Mỹ gốc Phi có phải hoàn toàn là tuýp 1 hay bao gồm các trường hợp tuýp 2 biểu hiện nhiễm toan ceton và do đó bị phân loại sai vẫn chưa rõ ràng. Thông tin mới nhất hiện có cho thấy tỷ lệ mắc mới hàng năm tại Hoa Kỳ là 20 đến 25 trường hợp trên 100.000 dân số trẻ em với sự gia tăng đáng kể của ĐTĐ tuýp 1 ở tất cả các nhóm, bao gồm cả người Mỹ gốc Phi (xem IDF Diabetes Atlas Ấn bản thứ 9 năm 2019 www.diabetesatlas.org).
Nam và nữ dường như bị ảnh hưởng gần như bằng nhau. Không có mối tương quan rõ ràng với tình trạng kinh tế xã hội. Các đỉnh biểu hiện xảy ra ở hai nhóm tuổi: từ 5 đến 7 tuổi và vào thời điểm dậy thì. Đỉnh đầu tiên tương ứng với thời điểm tăng tiếp xúc với các tác nhân gây bệnh trùng với thời điểm bắt đầu đi học. Đỉnh sau tương ứng với giai đoạn tăng trưởng vượt bậc ở tuổi dậy thì do sự gia tăng của steroid sinh dục, cũng như sự bài tiết hormone tăng trưởng ở tuổi dậy thì gây đối kháng với hoạt động của insulin. Tỷ lệ mắc ĐTĐ tuýp 1 đang gia tăng trên toàn thế giới, rõ rệt nhất ở một số quần thể (ví dụ, Phần Lan) và ở một số nhóm tuổi nhất định (đặc biệt là những người < 5 tuổi). Như đã đề cập, dường như có một sự chững lại về tỷ lệ mắc mới được báo cáo từ Phần Lan và Na Uy. Ở những bệnh nhân trẻ tuổi hơn, sự khởi phát dường như đột ngột hơn và mức độ của các dấu ấn miễn dịch ít rõ ràng hơn so với trẻ lớn hơn. Đái tháo đường tuýp 1b với khởi phát đột ngột, ít bằng chứng về tự miễn dịch, và các chỉ số nhiễm virus (bao gồm bằng chứng viêm tụy) đã được mô tả ở Nhật Bản.
Sự biến đổi theo mùa và theo chu kỳ dài hạn đã được ghi nhận trong tỷ lệ mắc ĐTĐ tuýp 1. Các trường hợp mới được công nhận dường như xảy ra với tần suất cao hơn vào mùa thu và mùa đông ở bán cầu bắc và nam. Sự biến đổi theo mùa rõ rệt nhất ở lứa tuổi thanh thiếu niên. Không có một mô hình nhất quán nào liên kết chu kỳ dài hạn với tỷ lệ mắc các bệnh nhiễm virus; tuy nhiên, có một sự gia tăng rõ rệt về tỷ lệ mắc đái tháo đường ở trẻ em bị rubella bẩm sinh. Những mô hình thay đổi về tỷ lệ mắc mới và mối liên quan với các bệnh nhiễm virus này cho thấy vai trò tiềm tàng của virus hoặc các tác nhân vi sinh vật khác hoặc các sản phẩm của chúng như là các cơ chế kích hoạt trực tiếp hoặc gián tiếp để gây ra ĐTĐ tuýp 1 ở một cơ thể nhạy cảm. Việc phát hiện một nhiễm trùng enterovirus mức độ thấp trong các đảo Langerhans của bệnh nhân đái tháo đường mới khởi phát và sự biểu hiện quá mức của các kháng nguyên HLA lớp 1 trên các tế bào đảo tụy như một đặc điểm xác định của ĐTĐ tuýp 1 càng củng cố thêm khả năng nhiễm virus là một tác nhân tiềm tàng cho quá trình tự miễn dẫn đến ĐTĐ ở cơ thể có khuynh hướng di truyền.
Nguyên nhân, Sinh bệnh học và Di truyền
Nguyên nhân của các phát hiện lâm sàng ban đầu trong dạng đái tháo đường chủ yếu này ở trẻ em là sự suy giảm mạnh mẽ bài tiết insulin. Mặc dù nồng độ insulin nền trong huyết tương có thể bình thường ở những bệnh nhân mới được chẩn đoán, sự bài tiết insulin đáp ứng với nhiều chất kích thích tiết mạnh bị suy giảm và thường biến mất trong khoảng thời gian từ vài tháng đến vài năm. Ở một số cá nhân được coi là có nguy cơ cao phát triển ĐTĐ tuýp 1, chẳng hạn như người sinh đôi cùng trứng không bị ảnh hưởng của một người bị đái tháo đường, sự suy giảm tiến triển trong khả năng bài tiết insulin đã được ghi nhận trong nhiều tháng đến nhiều năm trước khi xuất hiện lâm sàng các triệu chứng đái tháo đường, thường biểu hiện khi dự trữ bài tiết insulin chỉ còn 20% hoặc ít hơn so với mức bình thường của cá nhân đó (Hình 21.3). Sơ đồ lý tưởng hóa về sự suy giảm đều đặn của bài tiết insulin được trình bày trong Hình 21.3 không nên được hiểu là thực tế; các giai đoạn hồi phục và suy giảm nhanh hơn có thể xảy ra nhưng cuối cùng dẫn đến giảm đáng kể khả năng bài tiết insulin.
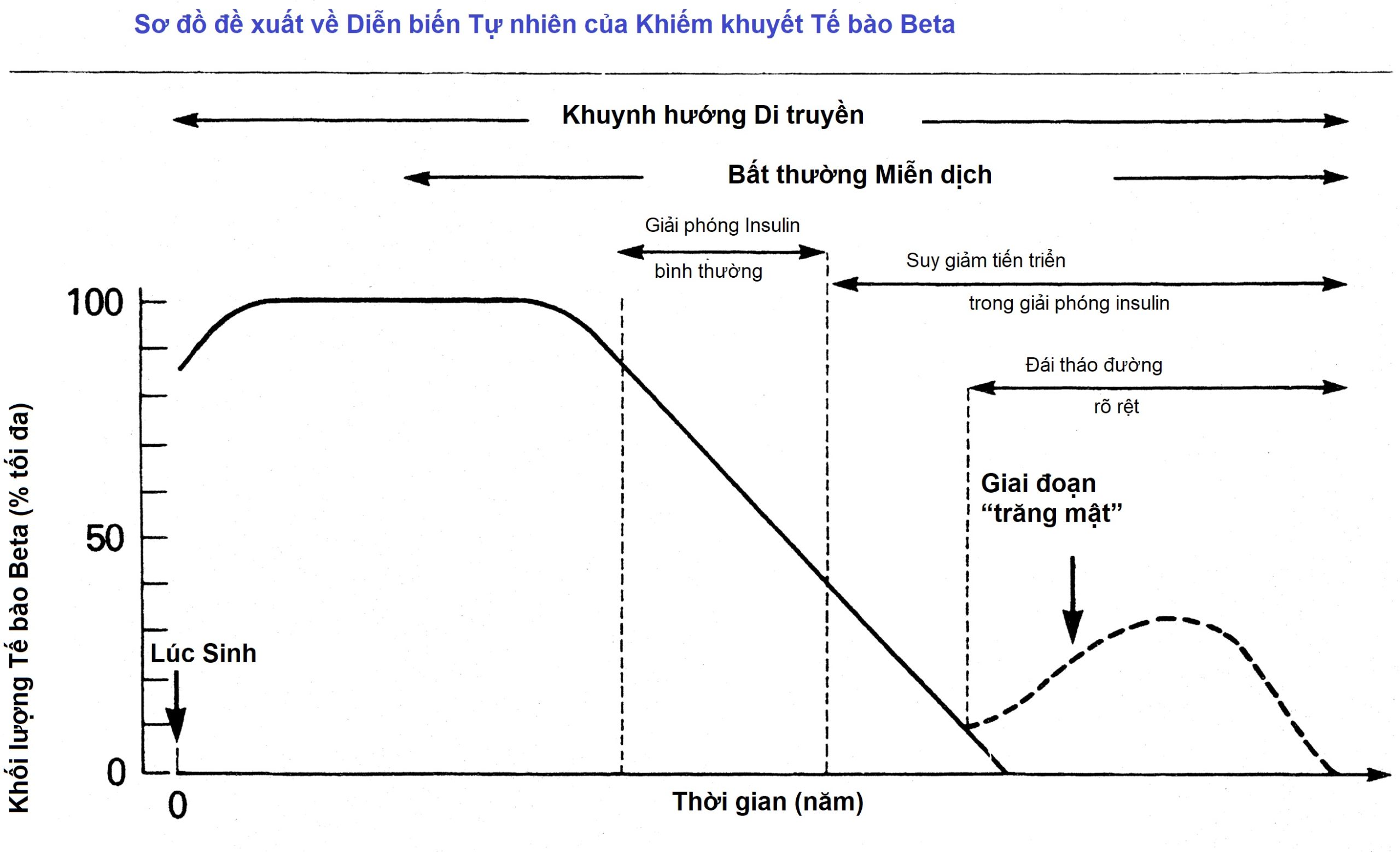
Hình 21.3 Sơ đồ đề xuất về diễn biến tự nhiên của sự tiến triển của đái tháo đường phụ thuộc insulin với sự suy giảm tiến triển của tế bào beta. (Nguồn: Sperling, M.A. (Ed.) (1988). Physician’s guide to insulin-dependent (type 1) diabetes mellitus: diagnosis and treatment. Alexandria, VA: American Diabetes Association.)
Các cơ chế dẫn đến suy giảm chức năng của tế bào beta tụy chỉ ra sự phá hủy tự miễn của các đảo tụy ở những cá nhân có khuynh hướng. ĐTĐ tuýp 1 từ lâu đã được biết là có tỷ lệ mắc tăng cao ở những người mắc các rối loạn như bệnh Addison và viêm tuyến giáp Hashimoto, trong đó các cơ chế tự miễn được biết là có vai trò gây bệnh. Những tình trạng này, cũng như ĐTĐ tuýp 1, được biết là có liên quan đến tần suất gia tăng của các gen tham gia vào việc điều hòa miễn dịch, bao gồm gen điều hòa tự miễn AIRE, PTPN22, CTLA4, và chính gen INS, cũng như một số HLA nhất định—đặc biệt là DR3 và DR4. Nằm trên nhiễm sắc thể 6, hệ thống HLA là phức hợp tương hợp mô chính—bao gồm một cụm gen mã hóa các kháng nguyên ghép và đóng một vai trò trung tâm trong các phản ứng miễn dịch.
Tính nhạy cảm tăng cao với một số bệnh đã được liên kết với một hoặc nhiều kháng nguyên HLA đã được xác định. Việc thừa hưởng HLA DR3 hoặc DR4 làm tăng nguy cơ phát triển ĐTĐ tuýp 1 lên hai đến ba lần. Khi cả DR3 và DR4 đều được thừa hưởng, nguy cơ tương đối phát triển đái tháo đường tăng lên 7 đến 10 lần. Việc áp dụng các kỹ thuật di truyền phân tử mới hơn đã tiết lộ thêm sự không đồng nhất trong vùng HLA D ở những cá nhân có và không có đái tháo đường mặc dù sở hữu các dấu ấn DR3 hoặc DR4, cho thấy sự tham gia của các locus nhạy cảm khác trong các dấu ấn này.
Các cuộc quét toàn bộ bộ gen về các dấu ấn liên quan đến ĐTĐ tuýp 1 đã phát hiện ra hơn 40 locus được coi là mang lại tính nhạy cảm (Bảng 21.2). Một số locus này được xác nhận và sao chép bởi ít nhất ba bộ dữ liệu khác nhau. Những locus khác có tính gợi ý nhưng vẫn chưa được liên kết một cách chắc chắn. Các dấu ấn mạnh nhất là những dấu ấn trên nhiễm sắc thể 6 và 11 (IDDM1 và IDDM2), tương ứng, liên quan đến chuỗi DQ β của HLA và chính gen insulin.
Bảng 21.2: Nghiên cứu liên kết toàn bộ bộ gen và phân tích gộp tìm thấy hơn 40 locus ảnh hưởng đến nguy cơ đái tháo đường tuýp 1
| Locus | Nguy cơ tương đối xấp xỉ | Tác động lên |
|---|---|---|
| HLA | 6.5 | Miễn dịch |
| INS | 2.3 | Sản xuất, chuyển hóa và miễn dịch insulin |
| PTPN22 | 2.0 | Miễn dịch |
| ILR2A | 1.5 | Miễn dịch |
| SH2BE | 1.3 | Miễn dịch |
| ERBB3 | 1.3 | Sản xuất và chuyển hóa insulin |
| PTPN2 | 1.25 | Miễn dịch |
| CLEC16A | 1.20 | Chức năng chưa rõ |
| CTLA4 | 1.20 | Miễn dịch |
| IL18RAP | 1.20 | Miễn dịch |
| PTPN2 | 1.20 | Miễn dịch |
| OCR5 | 1.20 | Miễn dịch |
| IFIHI | 1.20 | Miễn dịch |
| CTSH | 1.20 | Chưa rõ |
| CD226 | 1.10 | Miễn dịch |
| IL2RA | 1.10 | Miễn dịch |
| PRKCQ | 1.10 | Miễn dịch |
| IL2 | 1.10 | Miễn dịch |
| BACH2 | 1.10 | Miễn dịch |
| UBASH3A | 1.10 | Miễn dịch |
| RGS1 | 1.10 | Miễn dịch |
| IL7RA | 1.10 | Miễn dịch |
| CITNF6 | 1.10 | Chưa rõ |
| TNFAIP3 | 1.10 | Bảo vệ tế bào beta khỏi apoptosis |
| TAGAP | 1.10 | Miễn dịch |
(Nguồn: Barrett, J.C., Clayton, D.G., Concannon, P., et al. for the Type 1 Diabetes Genetics Consortium. (2009). Genome-wide association study and meta-analysis find that over 40 loci affect risk of type 1 diabetes. Nat Genet, 41, 703–707.)
Ở IDDM1, sự vắng mặt đồng hợp tử của acid aspartic ở vị trí 57 của chuỗi DQ β của HLA (non-Asp/non-Asp) mang lại nguy cơ tương đối phát triển ĐTĐ tuýp 1 cao hơn khoảng 100 lần. Những người dị hợp tử với một acid aspartic duy nhất ở vị trí 57 (non-Asp/Asp) không có nguy cơ cao hơn những cá nhân chứa acid aspartic trên cả hai chuỗi DQ β (tức là đồng hợp tử Asp/Asp; Bảng 21.3). Một số nghiên cứu cho thấy ĐTĐ tuýp 1 tỷ lệ với tần số gen của các alen non-Asp trong quần thể đó. Ngoài ra, arginine ở vị trí 52 của chuỗi DQ α mang lại tính nhạy cảm rõ rệt với tuýp 1. Vị trí 57 của chuỗi DQ β và vị trí 52 của chuỗi DQ α nằm ở các vị trí quan trọng của phân tử HLA cho phép hoặc ngăn cản sự trình diện kháng nguyên cho các thụ thể tế bào T và kích hoạt chuỗi phản ứng tự miễn (Hình 21.4). Tầm quan trọng của những thay thế acid amin này và các thay thế bổ sung trong HLA DQ và DR trong việc tạo điều kiện cho sự trình diện kháng nguyên và góp phần vào nguy cơ phát triển đái tháo đường đã được xác nhận.
Bảng 21.3: Tần suất kiểu hình HLA DR và DQ ở bệnh nhân đái tháo đường tuýp 1 và nhóm chứng khỏe mạnh
| Kiểu hình | Bệnh nhân ĐTĐ (%) | Người không ĐTĐ | Tỷ số chênh |
|---|---|---|---|
| DR (Huyết thanh học) | |||
| DR3/DR4 | 33 | 6 | 8.3 |
| DR3/DR3 | 7 | 1 | 9.8 |
| DR3/DRX | 7 | 14 | 0.05 |
| DR4/DR4 | 26 | 0 | — |
| DR4/DRX | 22 | 16 | 1.5 |
| DRX/DRX | 4 | 63 | 0.02 |
| DQ (Đầu dò phân tử) | |||
| Non-Asp/non-Asp | 96 | 19 | 107.2 |
| Non-Asp/Asp | 4 | 46 | 0.04 |
| Asp/Asp | 0 | 34 | 0 |
(Nguồn: Morel, P. A., Dorman, J. S., Todd, J. A., et al. (1988). Aspartic acid at position 57 of the HLA-DQ beta chain protects against type 1 diabetes: a family study. Proc Natl Acad Sci USA, 85, 8111.)
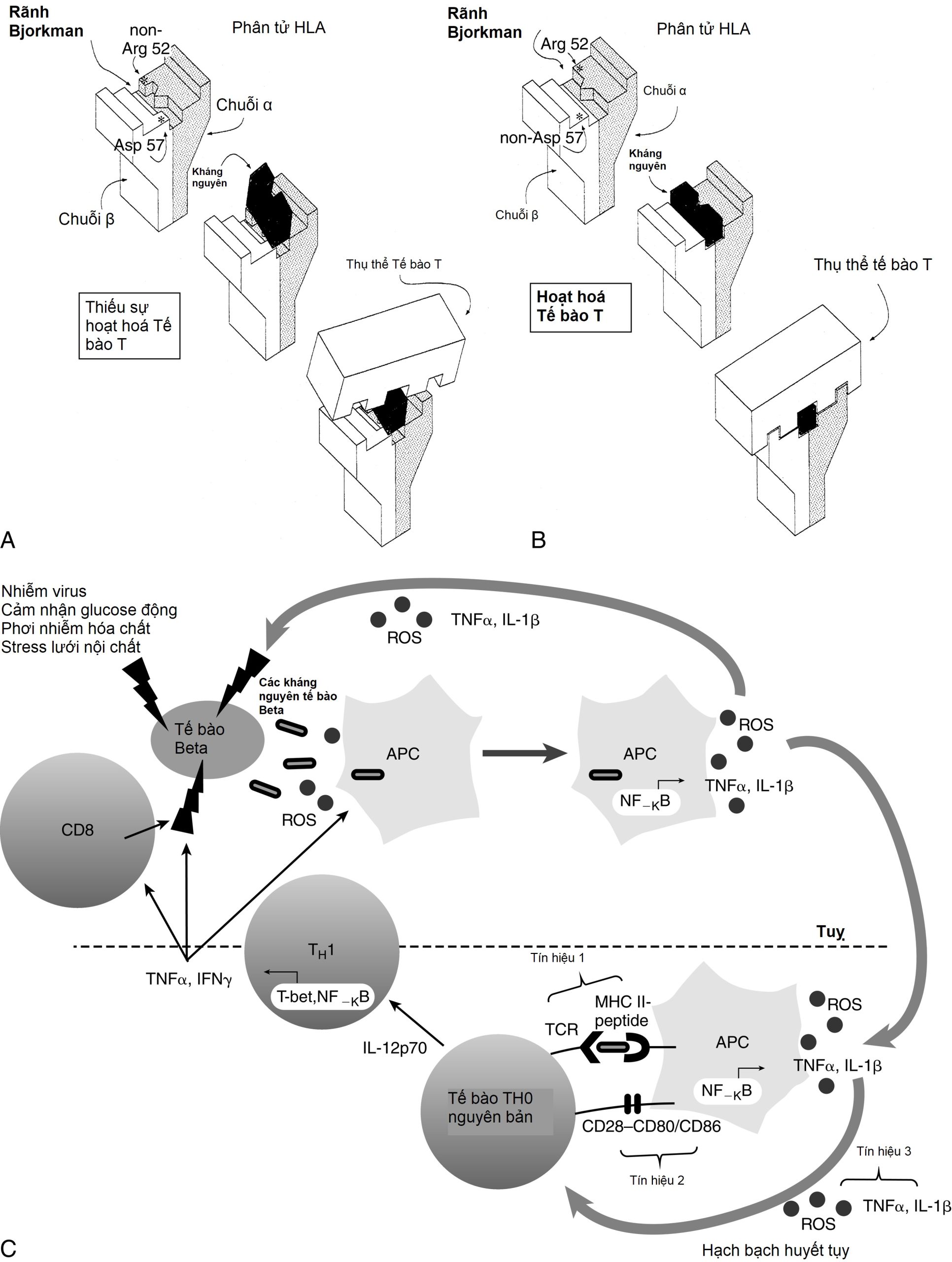
Hình 21.4 Biểu diễn sự tương tác giữa trình diện kháng nguyên trong bối cảnh các phân nhóm HLA-DQ cụ thể và thụ thể tế bào T. A, Sự hiện diện của acid aspartic ở vị trí 57 của chuỗi DQ β và một acid amin khác arginine ở vị trí 52 của chuỗi α ngăn cản kháng nguyên gắn vào rãnh Bjorkman. Do đó, sự trình diện kháng nguyên cho thụ thể tế bào T bị suy giảm—và trong trường hợp không có sự “khớp” này, sự kích hoạt tế bào T bị ngăn chặn. B, Thiếu acid aspartic ở vị trí 57 của chuỗi DQ β và arginine ở vị trí 52 của chuỗi DQ α cho phép kháng nguyên khớp và được nhận diện bởi thụ thể tế bào T, lúc này được kích hoạt. C, Vai trò của quá trình oxy hóa-khử trong sinh bệnh học miễn dịch của đái tháo đường tuýp 1. Một tổn thương di truyền hoặc môi trường ban đầu đối với tế bào beta kích hoạt sự giải phóng các kháng nguyên tế bào beta, cũng như sản xuất các loại oxy phản ứng (ROS). Các kháng nguyên tế bào beta bị thực bào, và ROS có thể kích thích các yếu tố phiên mã phụ thuộc oxy hóa-khử, chẳng hạn như yếu tố hạt nhân (NF)-κB, dẫn đến sự kích hoạt tế bào trình diện kháng nguyên (APC) và bài tiết cytokine. ROS và các cytokine tiền viêm được tiết ra bởi các APC hoạt động như tín hiệu thứ ba trong khớp thần kinh miễn dịch T-cell–APC, xảy ra trong hạch bạch huyết tụy. ROS đóng một vai trò quan trọng trong sự tiến triển của các tế bào TH0 ngây thơ thành các tế bào TH1 tiết cytokine. Sự giải phóng interferon (IFN)γ bởi các tế bào TH1 sau đó tác động trực tiếp lên các tế bào beta, cũng như kích hoạt thêm các APC và tế bào CD8, tất cả đều có thể gây ra các tác động có hại cho các đảo tụy. (A và B từ Trucco, M. (1995). To be or not to be Asp 57, that is the question. Diabetes Care, 15, 705; Faas, S., Trucco, M. (1995). The genes influencing the susceptibility to IDDM in humans. J Endocrinol Invest, 17,477; C từ Delmastro, M.M., & Piganelli, J.D. (2011). Oxidative stress and redox modulation potential in type 1 diabetes. Clin Dev Immunol, 2011.)
IDDM2 là một dấu ấn đa hình gần vị trí bắt đầu phiên mã của gen insulin, tạo ra VNTR ở đầu promoter của gen insulin trên nhiễm sắc thể 11. Mỗi yếu tố lặp lại song song bao gồm một đoạn DNA khoảng 14 bp với một chuỗi nucleotide đồng thuận. Số lần lặp lại dao động từ khoảng 25 đến khoảng 200, và ba loại alen được dựa trên kích thước tổng thể. Insulin VNTR loại I bao gồm 26 đến 63 lần lặp lại và mang lại tính nhạy cảm, trong khi loại III bao gồm 140 đến 200 lần lặp lại hoặc nhiều hơn và có tác dụng bảo vệ khỏi bệnh đái tháo đường. Cùng nhau, các dấu ấn gen trên nhiễm sắc thể 6 và 11 (tức là, IDDM1 và IDDM2) chiếm 50% đến 60% tính di truyền của ĐTĐ tuýp 1. Tuy nhiên, sự kết hợp của một số alen DQ nhất định cùng với một số alen DR nhất định có thể mang lại tính nhạy cảm hoặc bảo vệ cho sự phát triển của ĐTĐ tuýp 1 (xem Bảng 21.3).
Ngoài ra, các yếu tố di truyền khác chưa được xác định cũng đóng một vai trò bởi vì cùng một kiểu gen nguy cơ cao có khả năng phát triển đái tháo đường cao hơn khoảng sáu lần ở một cá nhân có tiền sử gia đình dương tính so với một người không có tiền sử gia đình bị ĐTĐ tuýp 1 (Bảng 21.4). Việc điều tra bốn cuộc quét liên kết toàn bộ bộ gen ở gần 1500 gia đình có nhiều hơn một thành viên bị ảnh hưởng bởi ĐTĐ tuýp 1 đã xác định được một số locus nhạy cảm. Trong số này, khoảng 40% vẫn có thể được quy cho sự biến đổi alen của các locus HLA, và ảnh hưởng của VNTR trong gen insulin đã được xác nhận.
Bảng 21.4: Ước tính Nguy cơ Di truyền cho HLA Lớp II trong Đái tháo đường tuýp 1
| Kiểu gen Nguy cơ Cao | Nguy cơ ở một Cá nhân với Kiểu gen này |
|---|---|
| DQB1*0302 (DQ3.2) | 1 trên 60 |
| DQ3.2/DQ2 (DR3) | 1 trên 25 |
| DQB1*0302 + tiền sử gia đình IDDM | 1 trên 10 |
| DQ3.2/DQ2 (DR3) + tiền sử gia đình IDDM | 1 trên 4 |
| Chia sẻ hoàn toàn cả hai haplotype HLA | 1 trên 2 |
(Nguồn: Nepom, G. T. (1995). Class II antigens and disease susceptibility. Ann Rev Med, 46, 17; Aly, T.A., Ide, A., Jahromi, M.M., et al. (2006). Extreme genetic risk for type 1A diabetes. Proc Natl Acad Sci U S A, 103, 14, 10474–10479.)
Ngoài ra, gen CTLA4 trên nhiễm sắc thể 2 và gen PTPN22 trên nhiễm sắc thể 1p13 đã được phát hiện góp phần đáng kể vào khuynh hướng mắc ĐTĐ tuýp 1. Tuy nhiên, cuộc quét bộ gen đã xác định các locus nhạy cảm tiềm năng khác trên các nhiễm sắc thể 2q31-q33, 10p14-q11, và 16q220q24 và một locus trên nhánh dài của nhiễm sắc thể 6 (6q21) khác với vùng HLA trên 6p21. Các gen chính xác trong những vùng này có thể có khuynh hướng gây ra ĐTĐ tuýp 1 vẫn chưa được xác định, mặc dù một số đã bị loại trừ và các gen ứng cử viên mới hơn—chẳng hạn như CBLB tương tác với CTLA4, gen yếu tố tăng tốc phân hủy (daf, một chất ức chế bổ thể), và thụ thể interleukin 2a IL2R—đang được xem xét kỹ lưỡng. Các bài đánh giá về di truyền học của ĐTĐ tuýp 1 đã nhận được sự quan tâm đáng kể và một điểm số nguy cơ di truyền có thể dự đoán sự tiến triển của tự miễn dịch tế bào đảo tụy và đái tháo đường lâm sàng ở những người có nguy cơ. Những cân nhắc này cung cấp một khuôn khổ hợp lý cho mối liên quan đã được công nhận từ lâu của đái tháo đường tuýp 1 với các yếu tố di truyền dựa trên tỷ lệ mắc tăng cao trong một số gia đình, tỷ lệ tương đồng ở các cặp song sinh cùng trứng, và sự khác biệt về tỷ lệ mắc bệnh giữa các dân tộc và chủng tộc. Từ nhiều phả hệ gia đình và dữ liệu định type HLA, người ta đã ước tính rằng nếu một anh chị em ruột chia sẻ cả hai haplotype HLA D với một trường hợp chỉ điểm, nguy cơ đối với cá nhân đó là 12% đến 20%; đối với một anh chị em ruột chỉ chia sẻ một haplotype, nguy cơ mắc IDDM là 5% đến 7%; và nếu không có haplotype nào chung, nguy cơ chỉ là 1% đến 2%. Việc định type HLA không được khuyến nghị cho thực hành lâm sàng thông thường, nhưng với mục đích tư vấn di truyền, có thể an toàn giả định rằng ở người da trắng, nguy cơ tái phát tổng thể cho anh chị em ruột là khoảng 6% nếu bệnh nhân chỉ điểm dưới 10 tuổi và 3% nếu lớn tuổi hơn vào thời điểm chẩn đoán. Nguy cơ đối với con cái là 2% đến 5%, với nguy cơ cao hơn ở con của một người cha bị đái tháo đường.
Các yếu tố khác ngoài di truyền thuần túy cũng phải có vai trò trong việc gây ra bệnh đái tháo đường lâm sàng. Ví dụ, DR3 hoặc DR4 được tìm thấy ở khoảng 50% dân số chung và non-Asp/non-Asp được tìm thấy ở khoảng 20% người da trắng không bị đái tháo đường ở Hoa Kỳ. Tuy nhiên, nguy cơ mắc ĐTĐ tuýp 1 ở những đối tượng này chỉ bằng 1/10 so với một anh chị em ruột có HLA giống hệt của một trường hợp chỉ điểm bị ĐTĐ tuýp 1 sở hữu những dấu ấn này. Ngay cả những anh chị em ruột chỉ chia sẻ một haplotype cũng có nguy cơ phát triển tuýp 1 cao hơn 6 đến 10 lần so với dân số bình thường (xem Bảng 21.4).
Điều quan trọng là, khoảng 10% đến 15% bệnh nhân tuýp 1 không có HLA DR3 hoặc DR4 (xem Bảng 21.3). Điều thuyết phục nhất là tỷ lệ tương đồng giữa các cặp song sinh cùng trứng mà một người bị đái tháo đường phụ thuộc insulin chỉ khoảng 50%, cho thấy sự tham gia của các yếu tố kích hoạt môi trường hoặc các yếu tố di truyền khác, chẳng hạn như sự chọn lọc sau sinh của một số dòng tế bào T tự phản ứng mang các thụ thể nhận diện “bản thân”. Quá trình sau sinh này xảy ra trong tuyến ức và ngụ ý rằng các cặp song sinh cùng trứng không giống hệt nhau về kho thụ thể tế bào T mà chúng sở hữu. Các cặp song sinh cùng trứng bất đồng về bệnh đái tháo đường cũng đã được chứng minh là có sự methyl hóa khác biệt trong các loại tế bào hiệu ứng miễn dịch, cho thấy vai trò của biểu sinh trong nguy cơ phát triển bệnh đái tháo đường. Các yếu tố kích hoạt có thể bao gồm nhiễm virus. Ở động vật, một số virus có thể gây ra hội chứng đái tháo đường, sự xuất hiện và mức độ nghiêm trọng của nó phụ thuộc vào dòng di truyền và khả năng miễn dịch của loài động vật được thử nghiệm. Ở người, các vụ dịch quai bị, rubella, và nhiễm virus coxsackie đã được liên kết với sự gia tăng tỷ lệ mắc ĐTĐ tuýp 1 sau đó. Sự khởi phát cấp tính của ĐTĐ, được cho là do coxsackievirus B4 gây ra, đã được mô tả. Các virus có thể hoạt động bằng cách phá hủy trực tiếp các tế bào beta, bằng cách tồn tại trong các tế bào beta tụy như các bệnh nhiễm virus chậm, hoặc bằng cách kích hoạt một phản ứng miễn dịch lan rộng đến một số mô nội tiết. Nhiễm enterovirus mức độ thấp trong tụy của bệnh nhân mới được chẩn đoán ĐTĐ tuýp 1 và sự biểu hiện quá mức của kháng nguyên HLA lớp 1 trong các tế bào đảo tụy như một đặc điểm xác định của ĐTĐ tuýp 1 càng củng cố thêm bằng chứng về vai trò tiềm tàng của virus trong việc kích hoạt các quá trình tự miễn. Một phản ứng siêu kháng nguyên có thể tham gia vào việc kích hoạt các tế bào T, bỏ qua sự trình diện cổ điển của kháng nguyên đã được xử lý bởi các tế bào trình diện kháng nguyên (APC) trong bối cảnh các phân tử HLA bị hạn chế cho các thụ thể tế bào T. Một số virus và một số nội độc tố hoặc ngoại độc tố có khả năng gây ra một phản ứng siêu kháng nguyên. Ngoài ra, virus có thể gây ra tổn thương tế bào beta ban đầu—dẫn đến sự trình diện của các yếu tố quyết định kháng nguyên đã bị che giấu hoặc thay đổi trước đó. Cũng có thể virus chia sẻ một số yếu tố quyết định kháng nguyên với những yếu tố có trên hoặc trong các tế bào beta, bao gồm cả GAD, sao cho các kháng thể được hình thành để đáp ứng với virus có thể tương tác với các yếu tố quyết định chung này của các tế bào beta, dẫn đến sự phá hủy của chúng, một ví dụ về sự bắt chước phân tử.
Nitrosamine và việc tiếp xúc sớm với sữa bò đã được đề xuất là những yếu tố có thể kích hoạt bệnh đái tháo đường ở những người có nguy cơ di truyền, do đó giải thích cho tỷ lệ mắc đái tháo đường thấp hơn được báo cáo ở những trẻ sơ sinh được bú mẹ hoàn toàn. Đây là cơ sở cho một nghiên cứu phòng ngừa ban đầu: thử nghiệm giảm đái tháo đường phụ thuộc insulin ở những người có nguy cơ di truyền (TRIGR). Tuy nhiên, ở những người có nguy cơ di truyền, nghiên cứu TRIGR đã không cho thấy sự giảm đáng kể trong việc phát triển bệnh đái tháo đường thông qua việc trì hoãn hoặc loại trừ sữa bò.
Căng thẳng trước đó và tiếp xúc với một số độc tố hóa học cũng đã được cho là có liên quan đến sự phát triển của ĐTĐ tuýp 1. Mặc dù thuốc diệt chuột Vacor đã là nguyên nhân gây ra bệnh đái tháo đường ở những cá nhân bị ngộ độc cố ý hoặc vô ý bởi tác nhân này, một số bệnh nhân này có ICA, cho thấy rằng các kháng thể như vậy là thứ phát sau tổn thương đảo tụy hoặc bệnh tuýp 1 đang tiến triển đã có trước khi dùng thuốc. Nitrosamine trong thịt đã qua xử lý cũng đã được cho là có liên quan đến ĐTĐ tuýp 1, cũng như các độc tố môi trường khác.
Bằng chứng ủng hộ một cơ sở tự miễn cho sự phát triển của ĐTĐ tuýp 1, nhưng tại sao tế bào beta lại là mục tiêu cụ thể vẫn là một bí ẩn. Tế bào beta tụy có phải là mục tiêu duy nhất của sự phá hủy miễn dịch (bị giết) hay là một người góp phần vào sự tự hủy của chính nó (tự sát)? Khám nghiệm mô học tụy từ những bệnh nhân tuýp 1 tử vong do các nguyên nhân ngẫu nhiên đã cho thấy sự thâm nhiễm lympho bào xung quanh các đảo Langerhans. Sau đó, các đảo tụy trở nên hyalin hóa và sẹo hóa dần dần, một quá trình cho thấy một phản ứng viêm đang diễn ra có thể là tự miễn. Tuy nhiên, những thay đổi này thường có sự phân bố loang lổ, do đó các khu vực dường như chứa các tế bào beta bình thường xen kẽ với các khu vực bị phá hủy tế bào beta, tương tự như sự phân bố loang lổ của sự mất sắc tố được tìm thấy trong bệnh bạch biến. Khoảng 80% đến 90% bệnh nhân mới được chẩn đoán ĐTĐ tuýp 1 có ICA nhắm vào các yếu tố quyết định trên bề mặt tế bào hoặc trong tế bào chất của các tế bào đảo tụy của họ. Tỷ lệ hiện mắc của các kháng thể này giảm dần theo thời gian mắc bệnh. Ngược lại, sau khi ghép tụy, ICA có thể xuất hiện trở lại ở những bệnh nhân mà huyết thanh của họ đã trở nên âm tính với ICA trước khi ghép. Cùng nhau, những phát hiện này cho thấy ICA biến mất khi các kháng nguyên nội tại của các đảo tụy bị phá hủy và xuất hiện trở lại khi kháng nguyên mới (các đảo tụy được ghép) được trình diện.
Các nghiên cứu ở các cặp song sinh cùng trứng và trong các phả hệ gia đình cho thấy sự tồn tại của ICA có thể có trước nhiều tháng đến nhiều năm so với sự xuất hiện của ĐTĐ tuýp 1 có triệu chứng. Trong ống nghiệm, ICA có thể làm suy giảm sự bài tiết insulin đáp ứng với các chất kích thích tiết và có thể được chứng minh là gây độc tế bào cho các tế bào đảo tụy—đặc biệt là khi có sự hiện diện của bổ thể hoặc các tế bào T từ bệnh nhân ĐTĐ tuýp 1. Khoảng 80% bệnh nhân có thể có kháng thể kháng GAD, và 30% đến 40% bệnh nhân mới được chẩn đoán có kháng thể kháng insulin tự phát tại thời điểm chẩn đoán ban đầu. Những kháng thể này có thể được phát hiện nhiều tháng đến nhiều năm trước khi bệnh đái tháo đường lâm sàng trở nên rõ ràng. Một kháng thể được mô tả gần đây hơn, chất vận chuyển kẽm, ZnT8, dường như là một dấu ấn chính cho sự suy giảm tiến triển của chức năng tế bào beta. Cũng có bằng chứng về chức năng tế bào T bất thường với sự thay đổi trong tỷ lệ tế bào T ức chế (điều hòa) so với tế bào T tiêu diệt khi bệnh khởi phát. Do đó, khả năng của Treg trong việc điều chỉnh hoạt động của các tế bào T hiệu ứng trong việc gây ra sự phá hủy tế bào beta là một lĩnh vực đang được nghiên cứu. Những phát hiện này cho thấy ĐTĐ tuýp 1 (tương tự như các bệnh tự miễn khác, chẳng hạn như viêm tuyến giáp Hashimoto) là một bệnh của “sự tự tấn công” trong đó các tự kháng thể hợp tác với bổ thể, tế bào T, cytokine, FAS, và phối tử FAS, và các yếu tố khác, gây ra apoptosis hoặc sự phá hủy của các tế bào đảo tụy sản xuất insulin.
Do đó, việc thừa hưởng một số gen nhất định (chẳng hạn như những gen liên quan đến hệ thống HLA trên nhiễm sắc thể 6 hoặc các gen điều hòa miễn dịch hoặc điều biến miễn dịch khác) dường như mang lại một khuynh hướng cho bệnh tự miễn—bao gồm cả đái tháo đường—khi được kích hoạt bởi một tác nhân thích hợp, chẳng hạn như một loại virus. Bằng chứng về sự kích hoạt thụ thể tế bào T do siêu kháng nguyên đã được thảo luận trước đó.
Mặc dù người ta hiểu rằng một số bệnh nhân đái tháo đường phụ thuộc insulin không có kháng nguyên HLA nào thường liên quan, bằng chứng về cơ sở miễn dịch của sự phá hủy tế bào đảo tụy đủ thuyết phục để thúc đẩy một số nghiên cứu về các tác nhân ức chế miễn dịch khác nhau trong điều trị bệnh nhân đái tháo đường mới được chẩn đoán. Không có thử nghiệm ức chế miễn dịch hoặc điều biến miễn dịch nào trong số này có kết quả tích cực lâu dài, và một số tác nhân (ví dụ, cyclosporine) đã được chứng minh là độc hại đối với các tế bào beta. Mặc dù các phương pháp tiếp cận mới hơn đang được thử nghiệm, tất cả đều phải được coi là thử nghiệm và không được xem là liệu pháp đã được thiết lập hoặc khuyến nghị. Thử nghiệm Phòng ngừa Đái tháo đường tuýp 1 [DPT1] là một nghiên cứu đa trung tâm ngẫu nhiên nhưng không mù sử dụng insulin tiêm dưới da hàng ngày và nhập viện hàng năm để truyền insulin tĩnh mạch [IV] ở những người thân cấp một có các yếu tố nguy cơ đã được chứng minh để phát triển ĐTĐ tuýp 1. Trong khi dự đoán rất chính xác trong việc xác định những người có khả năng cao nhất phát triển ĐTĐ tuýp 1 trong vòng 5 năm kể từ khi tham gia nghiên cứu, việc tiêm insulin không có tác dụng bảo vệ để ngăn chặn sự xuất hiện của ĐTĐ tuýp 1. Hình 21.3 và 21.4 tóm tắt các khái niệm hiện tại về nguyên nhân của ĐTĐ tuýp 1 như một bệnh tự miễn, xu hướng di truyền và trong đó sự phá hủy tự miễn của các tế bào beta được kích hoạt bởi một tác nhân chưa được xác định (có thể là một loại virus). Độ dốc của sự suy giảm insulin thay đổi, và có thể có những giai đoạn phục hồi một phần sao cho quá trình suy giảm bài tiết insulin không đều đặn chứ không trơn tru. Thời điểm xuất hiện các đặc điểm lâm sàng tương ứng với khoảng 80% sự phá hủy dự trữ bài tiết insulin. Quá trình này có thể mất nhiều tháng đến nhiều năm ở thanh thiếu niên và bệnh nhân lớn tuổi hơn, và vài tuần ở bệnh nhân rất trẻ, trong đó sự phá hủy cấp tính bởi các cơ chế không tự miễn có thể đóng một vai trò quan trọng. Hiệu giá cao hơn của các kháng thể kháng insulin tự phát và ICA là đặc trưng của sự phá hủy tế bào đảo tụy tích cực hơn, thường ở bệnh nhân trẻ tuổi hơn, và có thể hữu ích trong việc dự đoán bệnh đái tháo đường đang tiến triển.
Dự đoán và Phòng ngừa
Mặc dù hiện tại không có dấu ấn hoặc xét nghiệm đơn lẻ nào có thể dự đoán chính xác ĐTĐ tuýp 1, bằng chứng cho thấy sự kết hợp của các dấu ấn miễn dịch và di truyền cho ĐTĐ tuýp 1 có thể cung cấp khả năng dự đoán. Một số chuyên gia cho rằng ĐTĐ tuýp 1 là một bệnh có thể dự đoán được, nhưng các chuyên gia khác đã đưa ra phản đối vì khả năng dự đoán không mạnh mẽ như vậy trong các nghiên cứu của họ. Liệu pháp phòng ngừa dứt điểm không có sẵn, do đó làm dấy lên những tình huống khó xử về đạo đức, và cần nhấn mạnh rằng phần lớn các trường hợp mới xảy ra một cách lẻ tẻ, không có tiền sử gia đình dương tính ở người thân cấp một.
Hầu hết các nghiên cứu dự đoán đã được thực hiện ở những người thân cấp một của bệnh nhân ĐTĐ tuýp 1 mới khởi phát. Tuy nhiên, ngày càng có nhiều bằng chứng cho thấy sự hiện diện của hiệu giá cao của các tự kháng thể tế bào đảo tụy, GAD, IA2, ZnT8, và insulin kết hợp với sự suy giảm nhất quán của đáp ứng insulin pha đầu với một liều glucose IV (tương ứng với bách phân vị ≤ 5 theo tuổi trong đáp ứng insulin) có thể được sử dụng để dự đoán một cách đáng tin cậy sự khởi phát của bệnh tuýp 1.
Hình 21.5 chứng minh rằng trong một nhóm người thân cấp một, việc chuyển thành ĐTĐ tuýp 1 phụ thuộc rất nhiều vào số lượng kháng thể được phát hiện trong huyết thanh của họ. Trong số những người có ba kháng thể, khoảng một nửa đã phát triển bệnh đái tháo đường lâm sàng trong vòng 5 năm theo dõi. Đáp ứng insulin pha đầu và các dấu ấn di truyền (HLA) có thể được sử dụng để tăng cường khả năng dự đoán. Ví dụ, Bảng 21.5 chứng minh rằng nguy cơ tương đối phát triển bệnh đái tháo đường lâm sàng trong vòng 4 năm kể từ khi phát hiện ICA là gần 230 ở những người sở hữu tất cả bốn dị nhị hợp tử trong HLA DQ β có khuynh hướng gây ra bệnh đái tháo đường (tức là, Asp57 2/2 và Arg52 1/1).
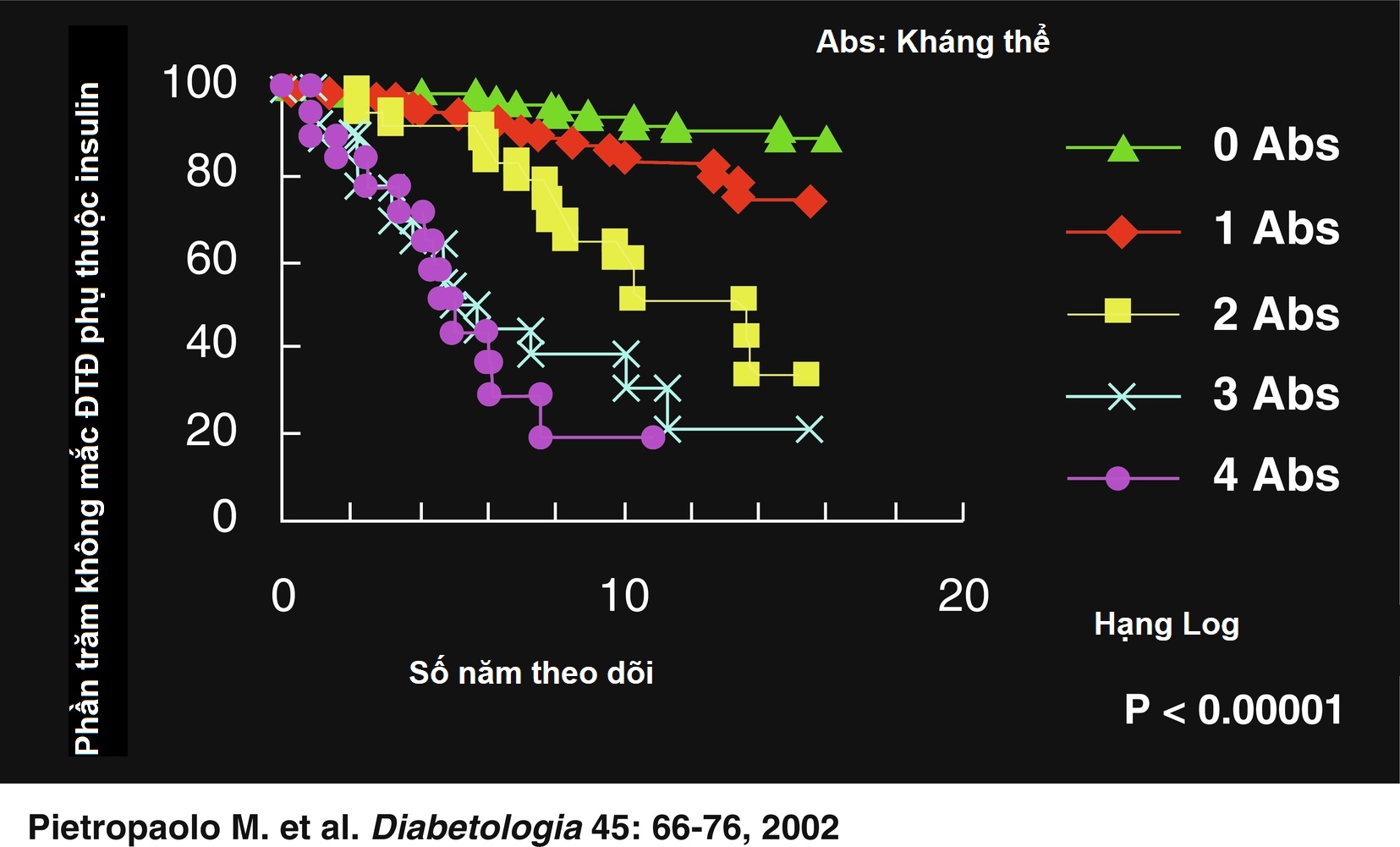
Hình 21.5 Nguy cơ tích lũy phát triển đái tháo đường tuýp 1 lâm sàng (ĐTĐ tuýp 1) ở những người thân của các bệnh nhân chỉ điểm bị ĐTĐ tuýp 1 đã được xác định chỉ sử dụng các dấu ấn kháng thể (IAA, GAD65, IA-2, ICA).
(Nguồn: Pietropaolo, M. et al. (2002). Progression to insulin-requiring diabetes in seronegative prediabetic subjects: the role of two HLA-DQ high-risk haplotypes. Diabetologia, 45, 66–76.)
Bảng 21.5: Ảnh hưởng của các Dị nhị hợp tử Đái tháo đường (ASP57 âm tính, Arg52 dương tính) và Tình trạng Kháng thể Tế bào Đảo tụy đến Nguy cơ Tương đối Phát triển Đái tháo đường sau 4 năm
| ICA Âm tính | ICA Dương tính | |
|---|---|---|
| Dị nhị hợp tử ĐTĐ (dH) | 0 | 1 |
| Phát triển IDDM sau 4 năm | 12 | 16 |
| Nguy cơ tương đối | 1.0 | 2.9 |
ICA, Kháng thể tế bào đảo tụy; IDDM, đái tháo đường phụ thuộc insulin.
(Nguồn: Friday, R.P., Trucco, M., & Pietropaolo, M. (1999). Genetics of type 1 diabetes mellitus. Diabetes Nutr Metab, 12, 3.)
Khi công nghệ tiếp tục cải tiến, có khả năng sàng lọc toàn dân cho các dấu ấn kháng thể (đơn lẻ hoặc kết hợp với các dấu ấn di truyền cụ thể) sẽ có sẵn để xác định những người có nguy cơ phát triển ĐTĐ tuýp 1. Việc sàng lọc toàn dân như vậy sẽ được biện minh về mặt đạo đức nếu việc phòng ngừa được chứng minh là hiệu quả. Hiện tại, dữ liệu đủ thuyết phục để thúc đẩy các thử nghiệm quốc gia ở Châu Âu và Hoa Kỳ để dự đoán và có thể ngăn chặn sự khởi phát lâm sàng của ĐTĐ tuýp 1 thông qua các chiến lược can thiệp miễn dịch. Thử nghiệm Can thiệp Nicotinamide cho Đái tháo đường Châu Âu (ENDIT) là một thử nghiệm đa trung tâm đã sàng lọc khoảng 22.000 người thân cấp một của bệnh nhân ĐTĐ tuýp 1 để xác định 500 người được coi là có nguy cơ cao phát triển bệnh này. Những cá nhân có nguy cơ này được điều trị bằng nicotinamide hoặc giả dược theo phương pháp mù đôi. Kết quả của ENDIT không cho thấy sự bảo vệ tích cực nào chống lại sự phát triển của bệnh đái tháo đường. DPT1 của Hoa Kỳ dựa trên dữ liệu thí điểm đầy hứa hẹn cho thấy sự bảo tồn bài tiết insulin và ngăn ngừa sự tiến triển thành ĐTĐ ở những cá nhân có nguy cơ được điều trị bằng insulin. Insulin tiêm dưới da hàng ngày, kết hợp với một liệu trình chuyên sâu insulin IV mỗi 9 tháng, đã ngăn ngừa bệnh đái tháo đường trong ít nhất 3 năm ở năm đối tượng được coi là có nguy cơ do các dấu ấn di truyền, tự kháng thể tế bào đảo tụy và insulin, và đáp ứng insulin pha đầu suy giảm. Trong số bảy đối tượng có nguy cơ tương tự đã chọn không được điều trị, sáu người đã phát triển đái tháo đường phụ thuộc insulin trong vòng 3 năm. DPT1 nhằm mục đích điều tra những kết quả thí điểm đầy hứa hẹn này trong một nhóm thuần tập lớn hơn được đối chứng cẩn thận và đã kết thúc vào năm 2001; không có sự khác biệt về tỷ lệ phát triển bệnh đái tháo đường giữa các nhóm giả dược và nhóm được điều trị bằng insulin. Tuy nhiên, các nghiên cứu ENDIT và DPT1 đã chứng minh rằng các nghiên cứu đa trung tâm quy mô lớn có thể được thực hiện thành công và dự đoán về sự tiến triển thành bệnh đái tháo đường lâm sàng là chính xác đáng kể. Do đó, ở những người có nguy cơ cao nhất (chẳng hạn như người thân cấp một của bệnh nhân ĐTĐ tuýp 1), việc dự đoán là khả thi và việc khám phá các phương pháp thành công để ngăn chặn hoặc đảo ngược sự tiến triển thành bệnh đái tháo đường lâm sàng là chủ đề của nghiên cứu chuyên sâu.
Một nghiên cứu khác (TRIGR) có sự tham gia của 3000 gia đình, trong đó một nửa tránh dùng sữa bò trong 9 tháng đầu đời để kiểm tra giả thuyết rằng việc uống sữa mẹ và tránh sữa công thức từ sữa bò (với albumin huyết thanh bò [BSA] của nó) có thể bảo vệ những người tham gia khỏi sự xuất hiện của bệnh đái tháo đường. Như đã lưu ý trước đó, không có lợi ích nào được ghi nhận ở những người tránh dùng sữa bò. Một số nghiên cứu khác đang xem xét tiện ích của các kháng thể kháng thụ thể IL2R, kháng thể CD3, các thuốc ức chế miễn dịch, chẳng hạn như mycophenolate mofetil, và các thuốc điều biến miễn dịch trong việc phòng ngừa bệnh đái tháo đường, bao gồm cả insulin đường uống. Những nghiên cứu này được thực hiện bởi các hiệp hội các tổ chức tham gia (xem www.trialnet.org).
Ở các mô hình động vật, insulin đường uống hoặc GAD đường uống đã được sử dụng thành công để phòng ngừa bệnh đái tháo đường. Người ta đã giả định rằng việc ăn các kháng nguyên phụ thuộc tế bào T lympho có thể thiết lập sự dung nạp miễn dịch. Các chiến lược đường uống như vậy đã được đề xuất và insulin đường uống đã được thử nghiệm ở người nhưng một lần nữa không có lợi ích rõ ràng. Các đối tượng của các thử nghiệm phòng ngừa ban đầu và các thử nghiệm can thiệp thứ cấp để bảo tồn sự bài tiết insulin còn lại khi chẩn đoán ban đầu là mối quan tâm lớn của các nhà điều tra cũng như các bác sĩ lâm sàng. Có khả năng sẽ có tiến bộ, nhưng hiện tại, tất cả các chiến lược này phải được xem là thử nghiệm và hiện không thuộc lĩnh vực thực hành lâm sàng hàng ngày.
Điều có liên quan ngay lập tức là các báo cáo về sự suy giảm tỷ lệ mắc mới ĐTĐ tuýp 1 ở trẻ em được tiêm vắc-xin phòng rotavirus. Nếu những phát hiện này được xác nhận, chúng sẽ củng cố thêm vai trò của virus trong việc khởi đầu tổn thương tế bào đảo tụy có thể dẫn đến chuỗi phản ứng tự miễn gây ra ĐTĐ tuýp 1 và những lợi ích tiềm tàng của việc tiêm chủng chống lại những tác nhân virus này và những tác nhân virus khác chưa được xác định.
Sinh tổng hợp Insulin
Insulin được tổng hợp trên ribosome của các tế bào beta đảo tụy và được giải phóng vào tuần hoàn dưới dạng một phân tử bao gồm hai chuỗi polypeptide thẳng riêng biệt được liên kết bởi các cầu disulfide giữa và trong các chuỗi này. Hai chuỗi này không được tổng hợp riêng biệt mà có nguồn gốc từ một tiền chất lớn hơn, proinsulin, một chuỗi đơn cuộn trong đó đầu tận NH2 của chuỗi A được liên kết với đầu tận COOH của chuỗi B bởi một peptide nối, được gọi là C-peptide (Hình 21.6). Một tiền chất thậm chí còn lớn hơn (preproinsulin, chứa một chuỗi peptide bổ sung ở đầu tận NH2 của chuỗi A) được tổng hợp đầu tiên, nhưng mảnh bổ sung này (quan trọng đối với việc khởi đầu tổng hợp) nhanh chóng bị cắt bỏ. Quá trình xử lý tiếp theo của proinsulin trong tế bào beta sẽ cắt C-peptide, bao gồm 31 acid amin, ra khỏi phân tử insulin tại các vị trí được chỉ ra trong Hình 21.6.
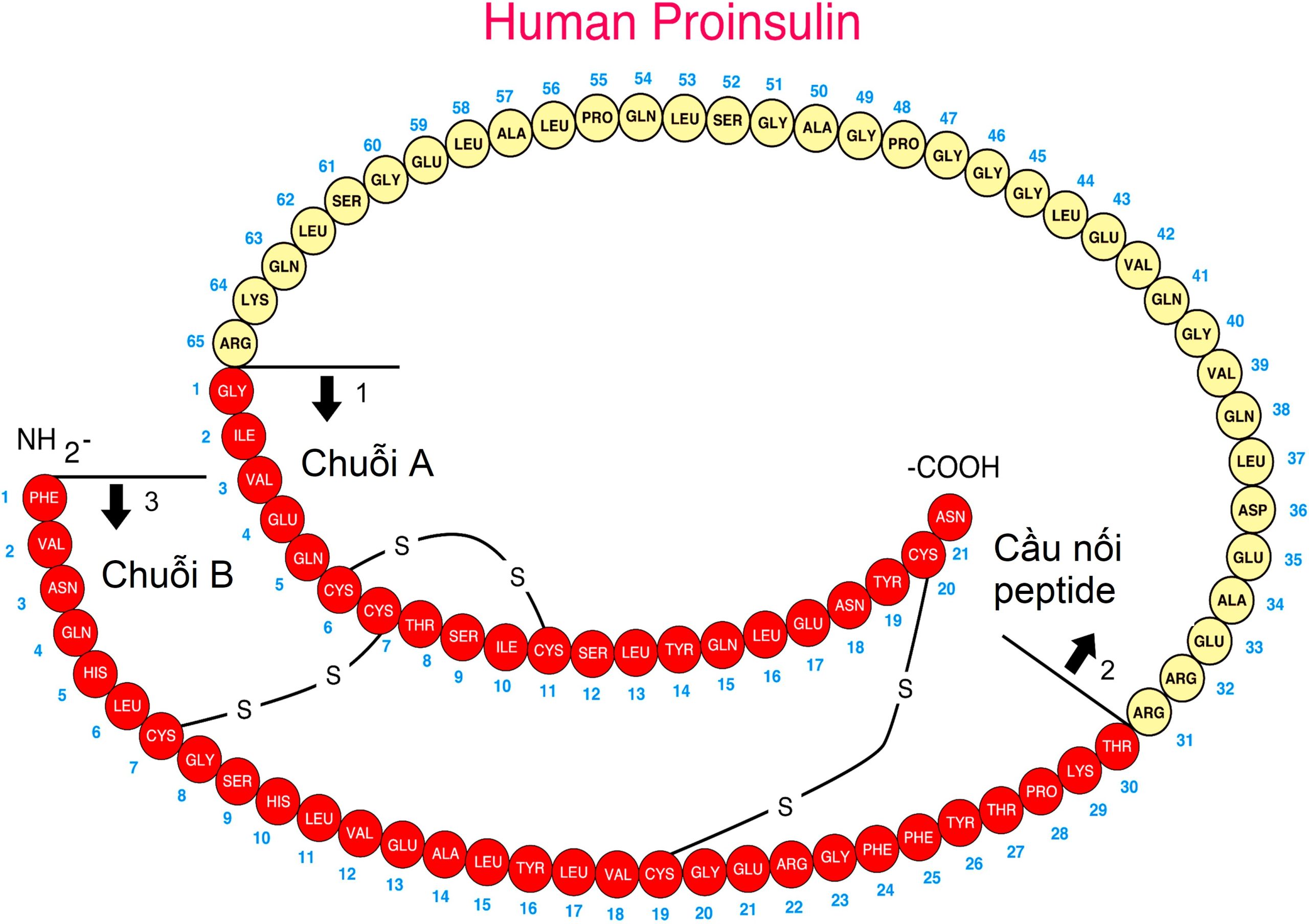
Hình 21.6 Cấu trúc của proinsulin. Các mũi tên 1 và 2 chỉ ra hai vị trí cắt bình thường tạo ra insulin và C-peptide khi các gốc acid amin được chỉ ra trong các vòng tròn mở bị loại bỏ. Những điểm cắt này là các vị trí đột biến đã biết, được di truyền theo kiểu trội trên nhiễm sắc thể thường, và có thể tạo ra hai loại tăng proinsulin máu gia đình. Trong quá trình bài tiết insulin, một lượng tương đương insulin và C-peptide được giải phóng. Mũi tên 3 chỉ vị trí bắt đầu của chuỗi B ở đầu tận Amino của tiền hormone.
Các khiếm khuyết ở những vị trí cắt này được di truyền theo kiểu trội trên nhiễm sắc thể thường và dẫn đến các phân tử insulin có hoạt tính sinh học thấp hơn bình thường, có thể gây ra hai loại tăng proinsulin máu gia đình. Một khiếm khuyết dẫn đến proinsulin B-C, được cắt ở vị trí 1 nhưng không ở vị trí 2 (xem Hình 21.6). Chất trung gian này có 50% hoạt tính sinh học của insulin, đủ để ngăn chặn bất kỳ bất thường nào trong chuyển hóa carbohydrate. Khiếm khuyết ở vị trí 1 tạo ra proinsulin A-C, được cắt ở vị trí 2 nhưng không ở vị trí 1, có hoạt tính sinh học không đủ để ngăn chặn tình trạng không dung nạp carbohydrate. Một đột biến cấu trúc trong phân tử proinsulin, giữa C-peptide và insulin, đã được xác nhận. Ngoài ra, một sự chuyển đổi enzyme khiếm khuyết của một phân tử proinsulin bình thường thành insulin dẫn đến tăng proinsulin máu và không dung nạp carbohydrate nhẹ.
Các proconvertase chịu trách nhiệm chuyển đổi chính xác proinsulin thành insulin cũng tham gia vào quá trình xử lý các hormone khác. Do đó, việc xử lý tiền hormone bị suy giảm có thể dẫn đến béo phì nặng và suy vỏ thượng thận thứ phát do xử lý proopiomelanocortin (POMC) khiếm khuyết, đến suy sinh dục do suy gonadotropin, và đến đái tháo nhạt. Proinsulin tự nhiên có ít hơn 5% hoạt tính sinh học của insulin, trong khi C-peptide không có. Trong quá trình tổng hợp, vai trò của C-peptide dường như là cung cấp sự sắp xếp không gian cần thiết trong việc hình thành các liên kết disulfide. Các khiếm khuyết khác đã được mô tả trong sinh tổng hợp insulin liên quan đến sự thay thế các acid amin trong chuỗi B dẫn đến suy giảm dung nạp glucose khi có tăng insulin máu.
Gen insulin đã được nhân bản và định vị trên nhiễm sắc thể 11, và các khiếm khuyết di truyền trong tổng hợp insulin có thể liên quan đến bệnh đái tháo đường—đặc biệt là các hội chứng MODY 1, 3, 4, 5, và 10, trong đó MODY 10 chính là gen insulin. Theo một số ước tính, các hội chứng MODY có thể chiếm từ 2% đến 5% tổng số người gầy phát triển bệnh đái tháo đường lâm sàng trong độ tuổi từ 10 đến 30. Các hội chứng MODY sẽ được thảo luận ngắn gọn sau đây và chi tiết trong Chương 10. Mối liên quan của VNTR trong gen insulin với khuynh hướng di truyền đối với ĐTĐ tuýp 1 tự miễn đã được mô tả trước đó.
Trong điều kiện bình thường, chỉ một lượng nhỏ proinsulin được giải phóng vào tuần hoàn—chiếm ít hơn 15% tổng lượng insulin được đo bằng xét nghiệm miễn dịch phóng xạ (RIA). Lượng chất trung gian proinsulin được giải phóng thậm chí còn nhỏ hơn. Tuy nhiên, trong quá trình bài tiết insulin do tất cả các kích thích gây ra, một phân tử C-peptide được giải phóng cùng với mỗi phân tử insulin. Do đó, huyết tương của những người bình thường chứa một lượng nhỏ proinsulin, chất trung gian proinsulin, và lượng insulin và C-peptide gần như tương đương. Tuy nhiên, thời gian bán thải trong huyết tương của C-peptide dài hơn insulin. Do đó, tỷ lệ mol của C-peptide so với insulin trong huyết tương ngoại biên luôn lớn hơn 1 và đỉnh bài tiết C-peptide hoặc điểm thấp nhất sau khi ức chế giải phóng dường như xảy ra muộn hơn so với insulin. Mặc dù RIA tiêu chuẩn của insulin cũng sẽ đo proinsulin, C-peptide sẽ không được đo vì nó khác biệt về mặt miễn dịch (xem Hình 21.6).
Việc tách proinsulin khỏi insulin có thể được thực hiện bằng sắc ký để tách proinsulin lớn hơn trước khi xét nghiệm. Điều này được thực hiện bằng cách sử dụng một enzyme phân hủy insulin nhưng không phân hủy proinsulin, hoặc bằng cách sử dụng một xét nghiệm C-peptide cũng sẽ đo proinsulin nhưng không đo insulin. Vì C-peptide khác biệt về mặt miễn dịch, RIA cho chất này có thể được sử dụng để đánh giá dự trữ bài tiết của tế bào beta ngay cả khi có sự hiện diện của các kháng thể insulin được hình thành để đáp ứng với việc tiêm insulin người hoặc insulin bò-lợn trước đây.
Sự bài tiết insulin nội sinh đi kèm với sự giải phóng C-peptide, trong khi việc sử dụng insulin ngoại sinh ức chế sự bài tiết insulin nội sinh (và do đó là C-peptide) trong mọi trường hợp ngoại trừ u đảo tụy. Kết quả của RIA tiêu chuẩn với kết tủa kháng thể kép cao trong cả hai trường hợp. Những thuộc tính này quan trọng trong việc phân biệt sự lạm dụng cá nhân bằng cách tiêm insulin ngoại sinh (insulin cao, C-peptide thấp) với u đảo tụy hoặc bài tiết insulin không điều hòa (insulin cao, C-peptide cao) trong các trường hợp hạ đường huyết. Việc đo động học C-peptide hoặc bài tiết C-peptide qua nước tiểu có thể được sử dụng như một chỉ số của sự bài tiết insulin nội sinh.
Bài tiết Insulin
Sự bài tiết insulin được điều chỉnh bởi sự tương tác của các chất dinh dưỡng, hormone và hệ thần kinh tự chủ. Glucose, cũng như một số loại đường khác được chuyển hóa bởi các đảo tụy, kích thích giải phóng insulin. Mức insulin nền và đỉnh có liên quan chặt chẽ với nồng độ glucose, và việc nhịn ăn kéo dài sẽ làm giảm thêm mức glucose và insulin—tuy nhiên, vẫn nằm trong phạm vi có thể đo được từ 2 đến 5 mU/mL. Có bằng chứng cho thấy một sản phẩm hoặc các sản phẩm của quá trình chuyển hóa glucose có thể tham gia vào việc duy trì bài tiết insulin và các loại đường không được chuyển hóa bởi các tế bào đảo tụy không thúc đẩy giải phóng insulin.
Các bước ban đầu của quá trình giải phóng insulin do glucose kích thích được mô tả trong Hình 21.7 và được thảo luận chi tiết trong Chương 7 và 10 liên quan đến các đột biến trong phức hợp thụ thể sulfonylurea (SUR)-Kir6 (kênh kali chỉnh lưu vào trong) của kênh kali điều hòa bằng adenosine triphosphate KATP, cùng với các bước tiếp theo có thể gây ra sự kích hoạt bài tiết insulin do glucose hoặc acid amin kích thích. Sơ đồ này liên quan đến việc vận chuyển glucose vào tế bào beta thông qua chất vận chuyển glucose GLUT2 và quá trình phosphoryl hóa glucose bằng glucokinase. Các khiếm khuyết ở chất vận chuyển trước đây có liên quan đến ĐTĐ tuýp 2, trong khi các đột biến bất hoạt dị hợp tử ở chất vận chuyển sau có liên quan đến MODY2. Các đột biến đồng hợp tử ở glucokinase dẫn đến ĐTĐ sơ sinh vĩnh viễn (như được mô tả chi tiết trong Chương 10). Các đột biến bất hoạt dị hợp tử ở glucokinase thường liên quan đến sự giải phóng insulin bình thường ở nồng độ glucose cao hơn, và do đó với một loại đái tháo đường nhẹ hơn hiếm khi cần điều trị và không liên quan đến các biến chứng vi mạch hoặc các biến chứng đái tháo đường khác. Sau khi truyền glucose IV ở người bình thường, sự bài tiết insulin có hai pha—với một đỉnh ban đầu sau đó là một cao nguyên duy trì. Người ta đề xuất rằng đỉnh ban đầu đại diện cho insulin được tạo sẵn, trong khi cao nguyên duy trì đại diện cho insulin mới được tổng hợp.
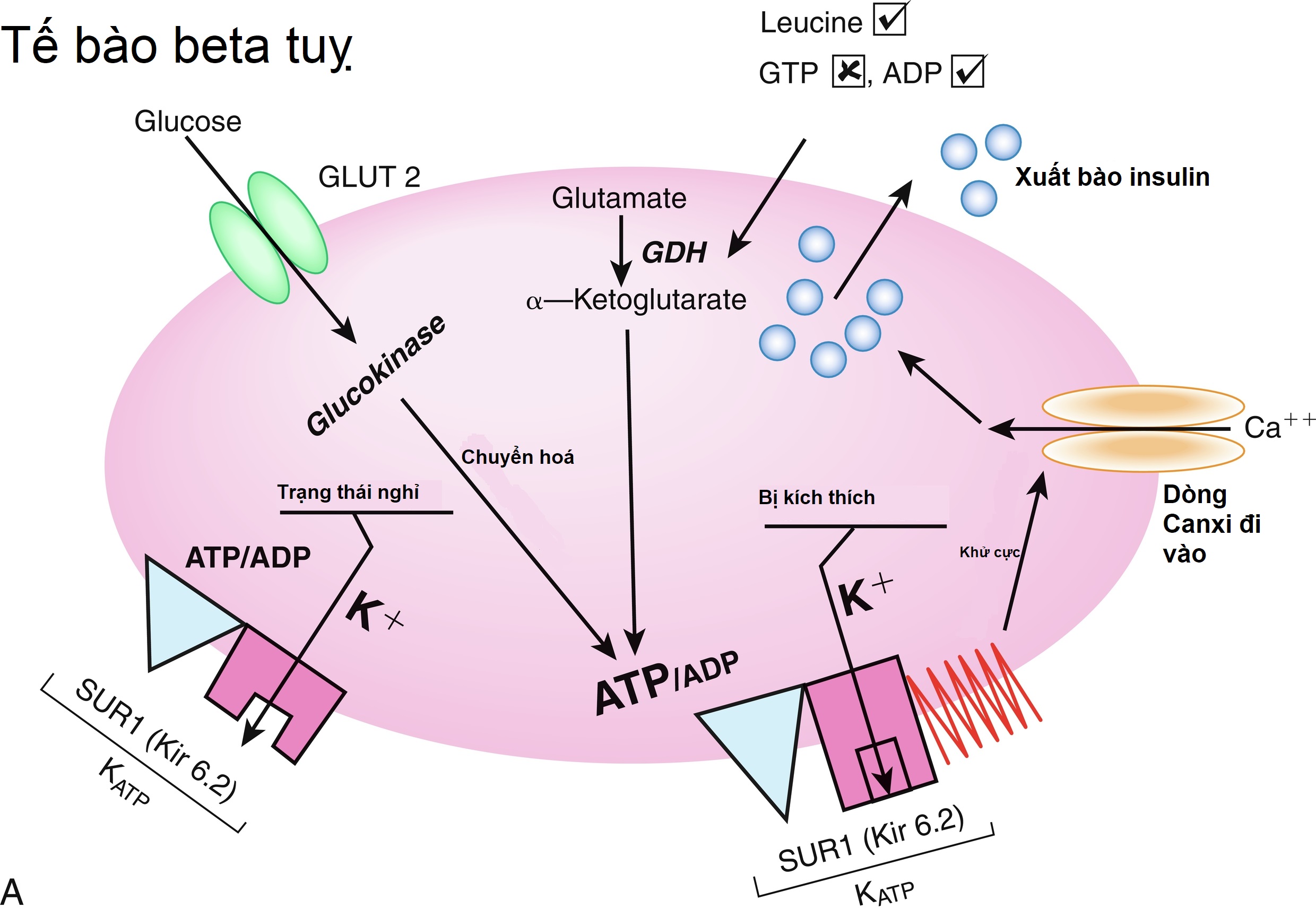
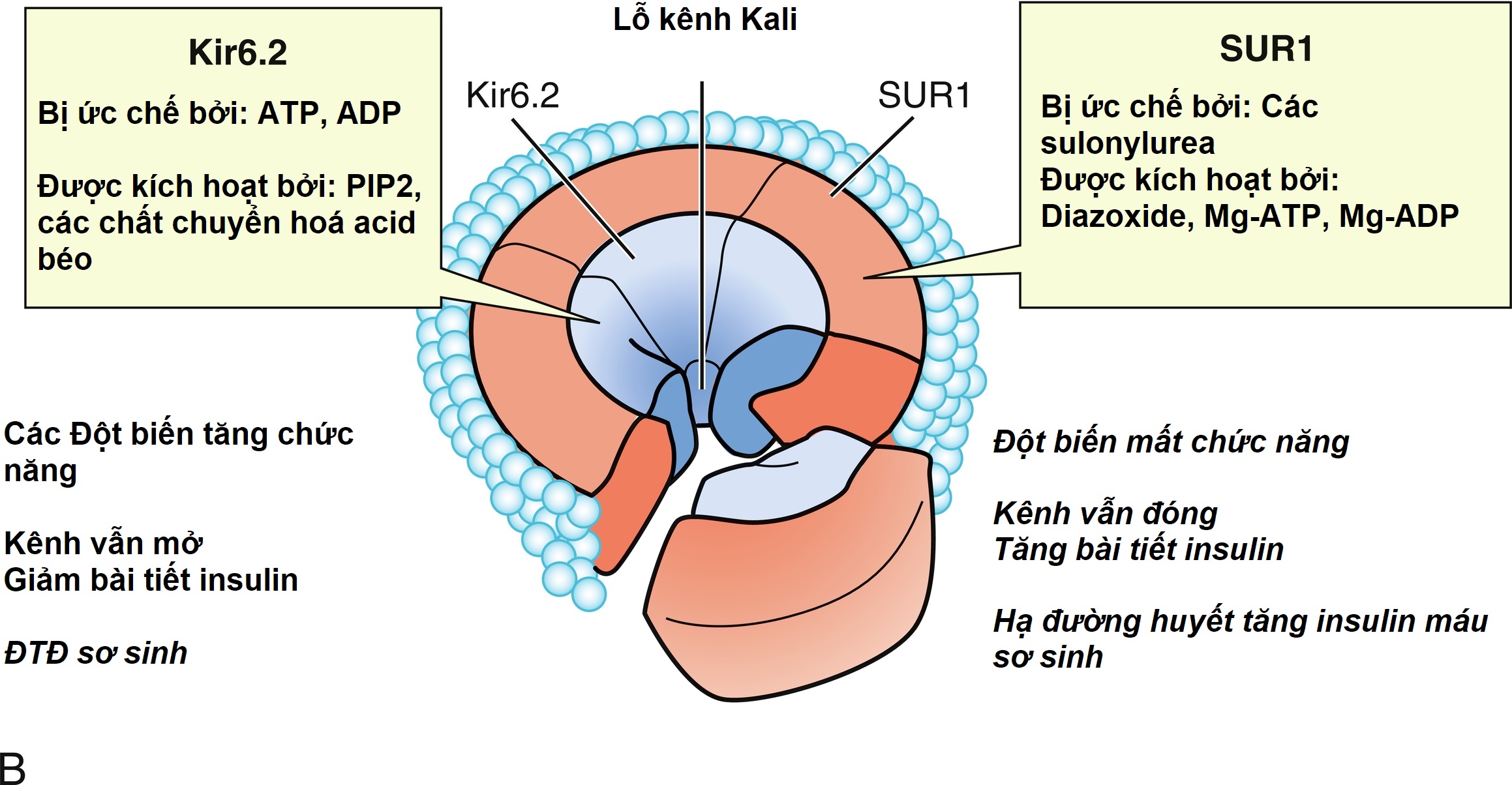
Hình 21.7 A, Mô hình bài tiết insulin của tế bào beta tụy. Glucose được vận chuyển vào tế bào beta bởi chất vận chuyển glucose không phụ thuộc insulin (GLUT 2) trải qua quá trình phosphoryl hóa bởi glucokinase và được chuyển hóa. Điều này dẫn đến sự gia tăng tỷ lệ adenosine triphosphate (ATP)/adenosine diphosphate (ADP) với sự đóng lại của kênh KATP sau đó và khởi đầu một chuỗi các sự kiện được đặc trưng bởi sự giảm thông lượng kali qua màng, khử cực màng, dòng canxi vào trong, và giải phóng insulin từ các hạt lưu trữ. Leucine kích thích bài tiết insulin bằng cách kích hoạt allosteric glutamate dehydrogenase (GDH) và bằng cách tăng quá trình oxy hóa glutamate; điều này làm tăng tỷ lệ ATP/ADP và đóng kênh KATP. Dấu tích (√) chỉ sự kích thích bài tiết insulin; dấu chéo (x) chỉ sự ức chế bài tiết insulin. Diazoxide ức chế bài tiết insulin bằng cách tương tác với thụ thể sulfonylurea; somatostatin và thuốc chẹn kênh canxi cản trở tín hiệu canxi. B, Điều hòa bài tiết insulin. Phức hợp Kir6.2–SUR1 và sự điều hòa cũng như tính biến thiên di truyền của nó. Bảng điều khiển cho thấy cấu trúc tiểu đơn vị chi tiết của kênh KATP, bao gồm bốn tiểu đơn vị nhỏ, Kir6.2, bao quanh một lỗ trung tâm và bốn tiểu đơn vị điều hòa lớn hơn tạo thành SUR1. Ở trạng thái nghỉ bình thường, kênh kali mở, được điều chỉnh bởi tỷ lệ ATP so với ADP. PIP2 biểu thị phosphatidylinositol-4,5-bisphosphate, Kir6.2 biểu thị kênh kali chỉnh lưu vào trong 6.2, SUR1 biểu thị thụ thể sulfonylurea 1, ADP là adenosine diphosphate, và ATP là adenosine triphosphate. Như đã lưu ý, trong các đột biến tăng chức năng, kênh vẫn mở dẫn đến giảm bài tiết insulin do đó có thể dẫn đến đái tháo đường sơ sinh. Với các đột biến mất chức năng, kênh vẫn đóng, dẫn đến bài tiết insulin liên tục và do đó là nguyên nhân gây hạ đường huyết tăng insulin máu sơ sinh. (Nguồn: Sperling, M.A. (2006). ATP-sensitive potassium channels—neonatal diabetes mellitus and beyond. N Engl J Med, 355, 507–510.)
Cyclic adenosine monophosphate (cAMP) tham gia vào việc kích thích giải phóng insulin. Do đó, các tác nhân ức chế phosphodiesterase và làm giảm sự phá hủy cAMP (chẳng hạn như theophylline) sẽ làm tăng giải phóng insulin. Sự di chuyển của các ion canxi vào tế bào chất từ bên ngoài, cũng như từ các bào quan nội bào (xem Hình 21.7), đóng một vai trò quan trọng trong các lực co bóp đẩy insulin đến bề mặt tế bào. Ở đó, màng của túi insulin hợp nhất với màng tế bào—cho phép các hạt insulin được đẩy ra ngoài vào không gian mạch máu xung quanh, một quá trình được gọi là emiocytosis. Các ion khác, bao gồm kali và magiê, cũng tham gia vào việc bài tiết insulin. Thụ thể sulfonylurea có liên quan chặt chẽ với các kênh kali trong tế bào beta. Các acid amin cũng kích thích giải phóng insulin, mặc dù hiệu lực của các acid amin riêng lẻ khác nhau. Một nhóm các acid amin có hiệu lực mạnh hơn bất kỳ acid amin đơn lẻ nào, và đáp ứng bài tiết insulin được tăng cường khi có sự hiện diện của glucose. Các acid béo tự do và thể ceton cũng có thể kích thích giải phóng insulin. Đáp ứng insulin với việc dùng glucose đường uống luôn lớn hơn đáp ứng với việc dùng glucose IV tạo ra cùng một biểu đồ glucose máu, một phát hiện dẫn đến khái niệm rằng các yếu tố đường ruột (incretin) điều chỉnh và làm tăng bài tiết insulin. Mặc dù nhiều loại hormone đường ruột tham gia vào việc thúc đẩy giải phóng insulin, polypeptide tiêu hóa (gip), glucagon tụy và các peptide giống glucagon (GLP) đóng một vai trò chính trong việc kích thích giải phóng insulin. Những đặc tính này đã được ứng dụng như các tác nhân, được gọi chung là incretin, trong việc tăng cường bài tiết insulin ở những người bị ĐTĐ tuýp 2 và ở một số người bị ĐTĐ tuýp 1.
Yếu tố ức chế giải phóng somatotropin (somatostatin), được sản xuất trong các tế bào delta của đảo tụy, ức chế giải phóng insulin và glucagon và làm giảm lưu lượng máu tạng. Những đặc tính này đã được ứng dụng để giảm bài tiết insulin ở trẻ sơ sinh bị hạ đường huyết tăng insulin máu sơ sinh (xem Chương 7). Cùng nhau, những yếu tố này có thể điều chỉnh tinh vi việc hấp thu chất dinh dưỡng và sự phân bố của nó và tạo thành một trục ruột-đảo tụy cho sự cân bằng nội môi chuyển hóa. Ngoài các hormone đường ruột này, một số hormone khác cũng điều chỉnh bài tiết insulin. Hormone tăng trưởng tham gia vào quá trình tổng hợp và lưu trữ insulin. Những người bị thiếu hụt hormone tăng trưởng bẩm sinh có đáp ứng insulin nền và kích thích thấp hơn bình thường, trong khi ở bệnh to đầu chi, mức insulin nền và kích thích tăng lên. Somatomammotropin màng đệm người (còn được gọi là lactogen nhau thai người), có cấu trúc liên quan đến hormone tăng trưởng, cũng ảnh hưởng đến việc giải phóng insulin. Tuy nhiên, tác dụng kích thích của mỗi hormone đối với bài tiết insulin bị đối kháng bởi tác dụng kháng insulin ở cấp độ ngoại biên. Tương tự, glucocorticoid và estrogen gây ra sự bài tiết insulin nhiều hơn trong khi gây ra đề kháng insulin ngoại biên—một phần bằng cách giảm các thụ thể insulin trên các tế bào đích.
Bài tiết insulin được điều chỉnh liên tục bởi hệ thần kinh tự chủ. Nhánh phó giao cảm, thông qua dây thần kinh phế vị, trực tiếp kích thích giải phóng insulin. Sự điều chỉnh bài tiết insulin của nhánh giao cảm phụ thuộc vào việc các thụ thể α- hoặc β-adrenergic được kích hoạt. Sự kích hoạt các thụ thể β2 bởi các tác nhân, chẳng hạn như isoproterenol, kích thích bài tiết insulin thông qua một quá trình liên quan đến việc tạo ra cAMP. Việc phong bế các thụ thể β-adrenergic bởi propranolol làm giảm sự giải phóng insulin nền và kích thích. Ngược lại, sự kích hoạt các thụ thể α-adrenergic làm giảm bài tiết insulin, và việc phong bế các thụ thể này bởi các tác nhân, chẳng hạn như phentolamine, làm tăng giải phóng insulin nền và do glucose kích thích. Epinephrine và norepinephrine chủ yếu kích thích các thụ thể α-adrenergic trong các đảo tụy, dẫn đến suy giảm bài tiết insulin—như được quan sát trong các tình huống căng thẳng hoặc ở bệnh nhân bị u tủy thượng thận.
Tóm lại, ở người bình thường, sự bài tiết insulin được điều chỉnh liên tục bởi số lượng, chất lượng và tần suất hấp thu chất dinh dưỡng; bởi môi trường hormone; và bởi các xung thần kinh tự chủ. Việc ăn các chất dinh dưỡng, chủ yếu là carbohydrate và protein, tạo ra các tín hiệu hormone đường ruột chuẩn bị và khởi đầu việc giải phóng insulin. Sự đi vào của glucose vào tế bào beta, quá trình phosphoryl hóa glucose, và việc tạo ra adenosine triphosphate (ATP) bởi chất dinh dưỡng này hoặc các chất dinh dưỡng khác dẫn đến việc giải phóng insulin. Trình tự này liên quan đến cAMP, các thụ thể β-adrenergic, và các ion—chủ yếu là canxi và kali. Quá trình chuyển hóa glucose trong tế bào beta cung cấp năng lượng cho việc tổng hợp và giải phóng insulin tiếp theo.
Hoạt động của Insulin
Hoạt động của insulin trên các tế bào đích ở các mô như gan, tế bào mỡ và cơ, bắt đầu bằng việc liên kết với các thụ thể insulin cụ thể nằm trên màng tế bào. Việc liên kết với các thụ thể này có thể bão hòa, xảy ra với năng lượng liên kết cao (ái lực), và phụ thuộc vào pH và nhiệt độ. Thụ thể insulin là một glycoprotein dị nhị hợp tử bao gồm hai tiểu đơn vị α và hai tiểu đơn vị β được liên kết bởi các liên kết disulfide (Hình 21.8). Tiểu đơn vị α, với khối lượng phân tử khoảng 125.000 kDa, hoạt động như vị trí liên kết—trong khi tiểu đơn vị β, với khối lượng phân tử khoảng 90.000 kDa, sở hữu hoạt tính tyrosine kinase đối với các cơ chất nội sinh và ngoại sinh (xem Hình 21.8 và 21.9).
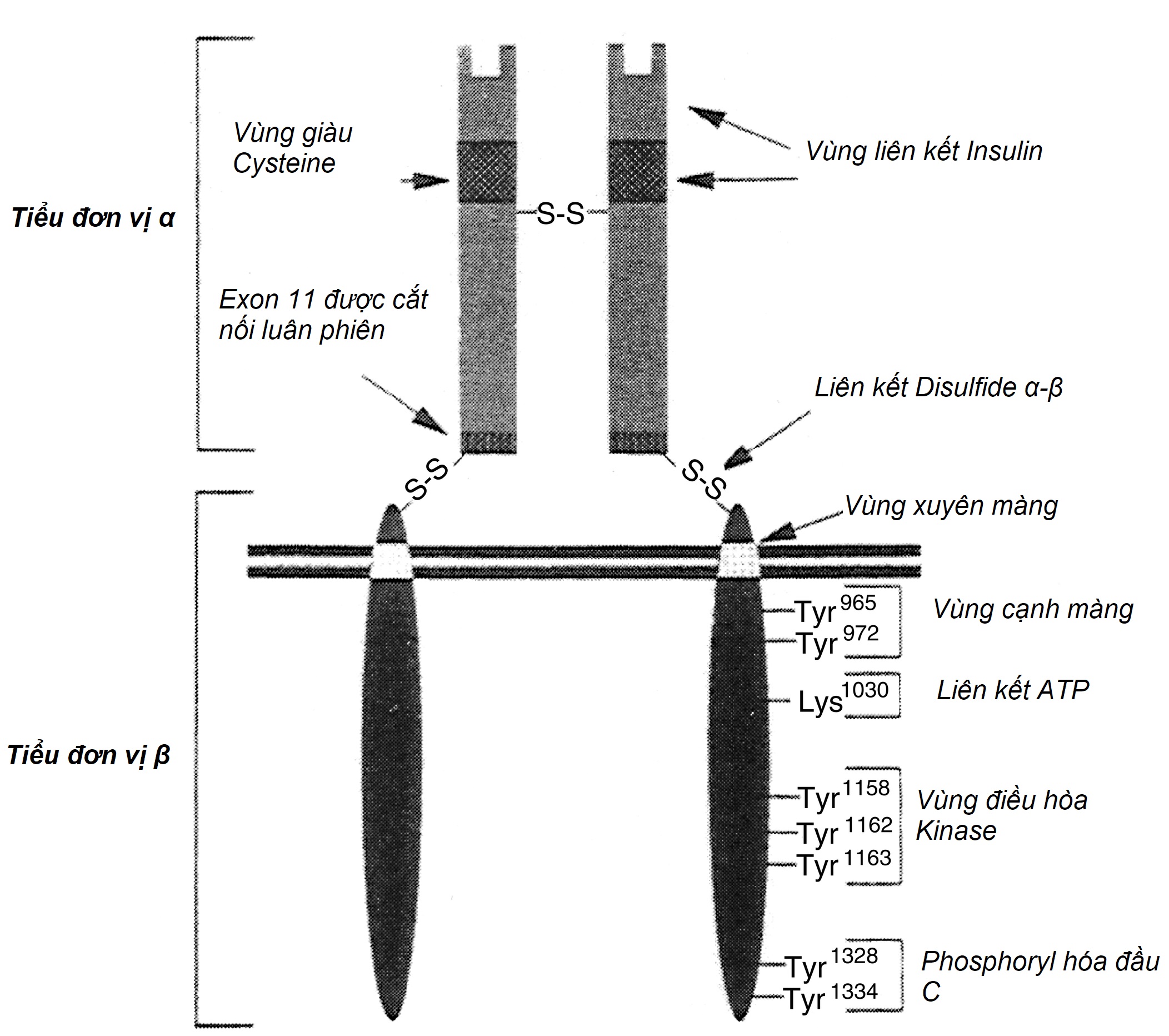
Hình 21.8 Cấu trúc của thụ thể insulin. ATP, adenosine triphosphate. (Nguồn: Cheatham, B., Kahn, C.R (1995). Insulin action and the insulin signaling network. Endocr Rev, 16, 117.)
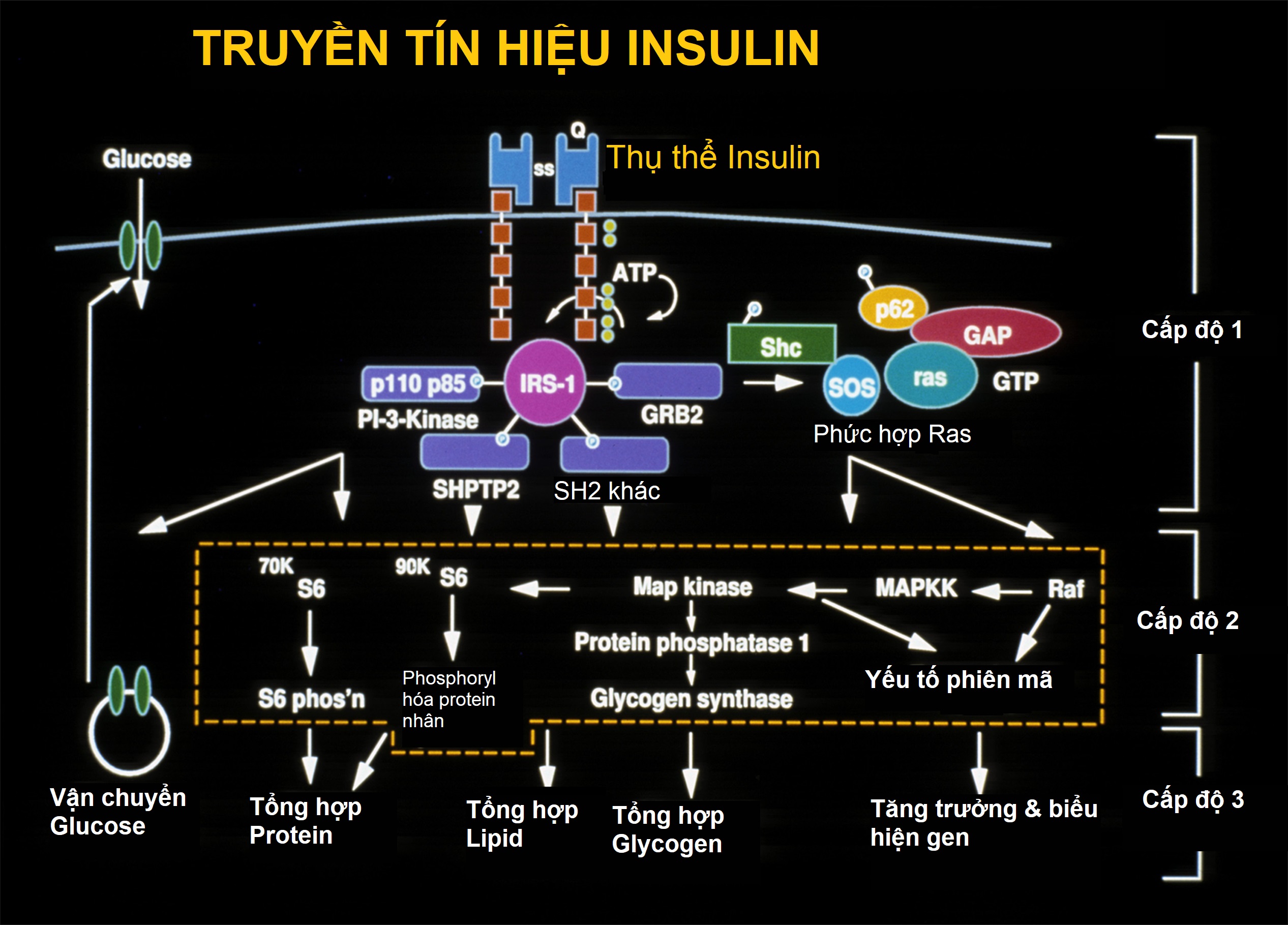
Hình 21.9 Việc liên kết của insulin với tiểu đơn vị alpha ngoại bào của thụ thể insulin (IR) khởi đầu một chuỗi phosphoryl hóa đầu tiên bởi tyrosine kinase trên tiểu đơn vị beta nội bào của IR, sau đó là một số chuỗi phosphoryl hóa khác được thể hiện ở cấp độ 1. Các quá trình phosphoryl hóa này có chức năng ngay lập tức trong việc di chuyển chất vận chuyển glucose (GLUT 4) từ tế bào chất đến màng tế bào, do đó tạo điều kiện cho việc vận chuyển glucose qua màng tế bào ở các tế bào như cơ, hoặc kích hoạt các kinase khác, chẳng hạn như kinase S6 và MAP (cấp độ 2) tham gia vào quá trình tổng hợp protein, tổng hợp lipid, và tổng hợp glycogen, cũng như kích hoạt các yếu tố phiên mã tham gia vào sự tăng trưởng và biểu hiện gen (Cấp độ 3). ATP, Adenosine triphosphate; GAP, chất hoạt hóa protein Ras p21; GRB2, yếu tố tăng trưởng liên kết thụ thể 2; GTP, guanosine triphosphate; IRS-1, cơ chất thụ thể insulin 1; MAP kinase, kinase protein hoạt hóa bởi mitogen; MAPKK, kinase của kinase protein hoạt hóa bởi mitogen; p110 và p85, các tiểu đơn vị của PI3 kinase (phosphoinositide 3 kinase); p62, nucleoporin 62; Raf, họ kinase protein đặc hiệu serine/threonine tham gia vào chuỗi MAPK; S6, protein ribosome S6; SH2, vùng tương đồng Src 2; Shc, chứa tương đồng src; SHPTP2, protein thích ứng liên kết Janus kinase 2 và các cơ chất thụ thể insulin; SOS, con trai của bảy.
Khả năng phosphoryl hóa protein này có thể là cơ sở cho một số trong vô số hoạt động của insulin. Trong số các loại protein được phosphoryl hóa có các cơ chất thụ thể insulin 1 đến 3 (được coi là một phân tử hiệu ứng tín hiệu insulin quan trọng) và pp 185, một cơ chất khác của thụ thể insulin (xem Hình 21.9). Các chất trung gian insulin khác có thể tham gia vào hoạt động của insulin. Hoạt động này cũng có thể được trung gian một phần bởi sự thủy phân của glycan phosphoinositide trong màng huyết tương của tế bào. Gen thụ thể insulin đã được nhân bản và định vị trên nhiễm sắc thể 19, trong khi thụ thể yếu tố tăng trưởng giống insulin-1 (IGF-1) có cấu trúc liên quan đã được định vị trên nhiễm sắc thể 15.
Trong điều kiện bình thường, chỉ một phần nhỏ trong tổng số thụ thể tế bào có sẵn cần được chiếm giữ để đạt được đáp ứng sinh học tối đa. Do đó, thông thường có các thụ thể dự phòng. Thụ thể insulin thể hiện hai hiện tượng: điều hòa giảm, trong đó nồng độ insulin xung quanh cao làm giảm số lượng thụ thể có sẵn, và hợp tác âm tính, trong đó việc chiếm giữ một thụ thể làm giảm ái lực của các vị trí thụ thể liền kề. Phân tích Scatchard của dữ liệu liên kết insulin trong các hệ thống in vitro cho thấy các biểu đồ cong tương thích với hợp tác âm tính hoặc với hai loại thụ thể: ái lực cao/dung lượng thấp và ái lực thấp/dung lượng cao. Tổng số thụ thể và ái lực của cả hai loại vị trí thụ thể có thể được tính toán bằng cách sử dụng các biểu đồ Scatchard này.
Sau khi liên kết với bề mặt tế bào, phức hợp thụ thể-insulin được nội hóa vào trong tế bào và được xử lý bởi các enzyme lysosome, với sự giải phóng insulin tự do và khả năng tái chế thụ thể trở lại màng tế bào. Việc liên kết của insulin với thụ thể trên bề mặt tế bào, có lẽ với sự tham gia của quá trình nội hóa cho phép insulin hoạt động ở cấp độ nhân, dẫn đến các quá trình sinh hóa phức tạp đặc trưng cho hoạt động của insulin trong một mô nhất định. Tuy nhiên, với giả định các sự kiện sau thụ thể là bình thường, đáp ứng sinh học với insulin trong một mô là một hàm số của số lượng phức hợp thụ thể/insulin được hình thành—đến lượt nó lại liên quan trực tiếp đến nồng độ insulin lưu hành và nồng độ thụ thể. Do đó, sự giảm số lượng thụ thể có thể được bù đắp bằng sự gia tăng nồng độ insulin miễn là số lượng thụ thể quan trọng cần thiết để tạo ra đáp ứng sinh học tối đa vẫn còn. Ngược lại, nồng độ insulin giảm có thể được bù đắp bằng sự gia tăng số lượng thụ thể, miễn là lượng insulin tối thiểu cần thiết để tạo ra đáp ứng sinh học tối đa có mặt.
Các thụ thể insulin và các protein tín hiệu của chúng (xem Hình 21.8 và 21.9) được phân bố rộng rãi ở các mô khác nhau. Sử dụng các phương pháp xóa có chủ đích các thành phần riêng lẻ hoặc các kết hợp khác nhau của các thành phần trong con đường thụ thể insulin đã cung cấp những hiểu biết đáng kể về sự đóng góp của gan, cơ, mỡ, tế bào beta và não vào sự cân bằng nội môi glucose tổng thể. Các khái niệm chính đã xuất hiện là chuỗi tín hiệu thụ thể insulin trên các tế bào beta có tầm quan trọng sống còn trong việc duy trì bài tiết insulin bình thường. Do đó, các đột biến gây đề kháng insulin tại tế bào beta cuối cùng sẽ dẫn đến tình trạng giảm insulin máu tương đối, có thể tương tác với đề kháng insulin ở các mô ngoại biên để tạo ra đặc điểm nổi bật của ĐTĐ tuýp 2 (tức là, đề kháng insulin ngoại biên cộng với giảm insulin máu tương đối).
Ngoài ra, các nghiên cứu với việc xóa có chủ đích thụ thể insulin trong não—cái gọi là chuột NIRKO (knockout thụ thể insulin đặc hiệu cho neuron)—chứng minh rằng những con vật này phát triển béo phì, tăng mỡ cơ thể, đề kháng insulin với tăng insulin máu khiêm tốn, và mức triglyceride tăng cao. Chức năng sinh sản ở cả con đực và con cái đều bị suy giảm do sự điều hòa bất thường của bài tiết hormone luteinizing, và nồng độ leptin trong huyết thanh tăng cao. Do đó, tín hiệu insulin trong não tham gia vào danh sách các yếu tố quan trọng mới nổi trong việc điều hòa cân bằng nội môi năng lượng và sinh sản.
Các khiếm khuyết nguyên phát về số lượng hoặc ái lực của thụ thể insulin có thể tạo ra những rối loạn sâu sắc tương tự trong chuyển hóa trung gian như sự thiếu hụt bài tiết insulin, và những rối loạn tương tự có thể xảy ra mặc dù nồng độ insulin bình thường và đặc điểm thụ thể bình thường nếu các bước sau thụ thể bị khiếm khuyết. Tín hiệu insulin để điều hòa chuyển hóa đã là chủ đề của nhiều nghiên cứu và được đánh giá rộng rãi. Các ví dụ về mỗi loại khiếm khuyết trong các thành phần riêng lẻ của hệ thống tích hợp này bao gồm sinh tổng hợp, bài tiết và hoạt động của insulin tồn tại và có thể giải thích cho các bất thường chuyển hóa đặc trưng của ĐTĐ. Một phương pháp tiếp cận dựa trên các nguyên tắc sinh tổng hợp, bài tiết và hoạt động của insulin cũng cho phép phân loại hợp lý ĐTĐ.
Sinh lý bệnh
Sự bài tiết insulin bình thường để đáp ứng với việc ăn uống được điều chỉnh một cách tinh vi bởi sự tương tác của các cơ chế thần kinh, hormone và liên quan đến cơ chất để cho phép sự phân bố có kiểm soát của thực phẩm ăn vào thành năng lượng để sử dụng ngay lập tức hoặc trong tương lai cho quá trình chuyển hóa và tăng trưởng. Việc huy động năng lượng trong trạng thái nhịn ăn phụ thuộc vào mức insulin trong huyết tương thấp. Do đó, trong chuyển hóa bình thường, có những dao động đều đặn giữa trạng thái đồng hóa insulin cao sau ăn và trạng thái dị hóa insulin thấp khi đói, ảnh hưởng đến ba mô chính: gan, cơ và mô mỡ (Bảng 21.6).
Bảng 21.6: Ảnh hưởng của việc Ăn (Insulin cao) hoặc Nhịn ăn (Insulin thấp) đối với một số quá trình chuyển hóa ở Gan, Cơ và Mô mỡ
| Insulin Huyết tương cao (Trạng thái sau ăn) | Insulin Huyết tương thấp (Trạng thái nhịn ăn) | |
|---|---|---|
| Gan | Thu nhận glucose | Sản xuất glucose |
| Tổng hợp glycogen | Phân giải glycogen | |
| Không có tân tạo glucose | Tân tạo glucose | |
| Tạo mỡ | Không có tạo mỡ | |
| Không có tạo ceton | Tạo ceton | |
| Cơ | Thu nhận glucose | Không có thu nhận glucose |
| Oxy hóa glucose | Oxy hóa acid béo và ceton | |
| Tổng hợp glycogen | Phân giải glycogen | |
| Tổng hợp protein | Phân giải protein và giải phóng acid amin | |
| Mô mỡ | Thu nhận glucose | Không có thu nhận glucose |
| Tổng hợp lipid | Phân giải mỡ và giải phóng acid béo | |
| Thu nhận triglyceride | Không có thu nhận triglyceride |
Insulin được coi là yếu tố chính chi phối các quá trình chuyển hóa này. Đái tháo đường có thể được xem như một trạng thái insulin thấp vĩnh viễn, nếu không được điều trị sẽ dẫn đến tình trạng nhịn ăn quá mức.
Insulin là hormone đồng hóa chính thúc đẩy quá trình tổng hợp và lưu trữ carbohydrate, lipid và protein, đồng thời kìm hãm sự phân hủy của chúng. Sự hấp thu glucose, acid béo và acid amin được kích thích—cũng như hoạt động hoặc biểu hiện của các enzyme thúc đẩy quá trình tổng hợp glycogen, chất béo và protein. Ngược lại, hoạt động hoặc biểu hiện của các enzyme phân hủy các chất chuyển hóa này bị kìm hãm. Tất cả các hoạt động đồng hóa này của insulin bị đảo ngược trong trạng thái insulin thấp của tình trạng đói. ĐTĐ tuýp 1, khi tiến triển, trở thành một trạng thái dị hóa (đói) insulin thấp vĩnh viễn, trong đó việc ăn uống không thể đảo ngược mà còn làm trầm trọng thêm các quá trình dị hóa này.
Điều quan trọng cần nhấn mạnh là gan nhạy cảm hơn cơ hoặc mỡ đối với một nồng độ insulin nhất định. Nghĩa là, sản xuất glucose nội sinh từ gan thông qua quá trình phân giải glycogen và tân tạo glucose có thể bị kìm hãm ở nồng độ insulin không hoàn toàn làm tăng việc sử dụng glucose của các mô ngoại biên. Do đó, với sự suy giảm tiến triển của bài tiết insulin, biểu hiện ban đầu là tăng đường huyết sau ăn. Tăng đường huyết lúc đói là một biểu hiện muộn, phản ánh sự thiếu hụt insulin nghiêm trọng và cho thấy sản xuất glucose nội sinh quá mức.
Mặc dù thiếu hụt insulin là khiếm khuyết chính, một số thay đổi thứ phát liên quan đến các hormone căng thẳng (tức là, epinephrine, cortisol, hormone tăng trưởng và glucagon) làm tăng tốc và làm trầm trọng thêm tốc độ và mức độ mất bù chuyển hóa.
Nồng độ các hormone đối kháng điều hòa này trong huyết tương tăng lên làm khuếch đại các rối loạn chuyển hóa bằng cách làm suy giảm thêm sự bài tiết insulin (ví dụ, epinephrine), bằng cách đối kháng hoạt động của nó (ví dụ, epinephrine, cortisol và hormone tăng trưởng), và bằng cách thúc đẩy quá trình phân giải glycogen, tân tạo glucose, phân giải mỡ và tạo ceton (ví dụ, glucagon, epinephrine, hormone tăng trưởng và cortisol) trong khi làm giảm việc sử dụng glucose và độ thanh thải glucose (ví dụ, epinephrine, hormone tăng trưởng và cortisol). Với sự thiếu hụt insulin tiến triển, đặc biệt là với các hormone căng thẳng tăng cao đồng thời, sản xuất glucose quá mức và suy giảm việc sử dụng nó dẫn đến tăng đường huyết với glucose niệu khi ngưỡng thận khoảng 180 mg/dL (10 mmol/L) bị vượt qua.
Sự lợi tiểu thẩm thấu gây ra đa niệu, mất điện giải qua nước tiểu, mất nước và uống nhiều để bù trừ. Những biểu hiện đang tiến triển này, đặc biệt là mất nước, đại diện cho căng thẳng sinh lý—dẫn đến tăng tiết epinephrine, glucagon, cortisol và hormone tăng trưởng, làm khuếch đại và duy trì các rối loạn chuyển hóa và đẩy nhanh quá trình mất bù chuyển hóa. Căng thẳng cấp tính do chấn thương hoặc nhiễm trùng cũng có thể đẩy nhanh quá trình mất bù chuyển hóa thành nhiễm toan ceton ở bệnh đái tháo đường đang tiến triển hoặc đã được xác định.
Tăng áp lực thẩm thấu, thường gặp do tăng đường huyết tiến triển, góp phần vào các triệu chứng—đặc biệt là sự suy giảm tri giác ở bệnh nhân nhiễm toan ceton do đái tháo đường (DKA). Áp lực thẩm thấu huyết thanh có thể được ước tính bằng công thức sau: Áp lực thẩm thấu huyết thanh (mOsm/kg) = (Nồng độ Na+ huyết thanh (mEq/L) + K+ (mEq/L)) × 2 + Glucose (mmol/L)
Lưu ý rằng 1 mmol/L glucose tương đương với 18 mg/dL.
Việc xem xét áp lực thẩm thấu huyết thanh có ý nghĩa quan trọng trong điều trị DKA. Sự kết hợp giữa thiếu hụt insulin và nồng độ các hormone đối kháng điều hòa trong huyết tương tăng cao cũng chịu trách nhiệm cho việc tăng tốc phân giải mỡ và suy giảm tổng hợp lipid, dẫn đến tăng nồng độ lipid toàn phần, cholesterol, triglyceride và acid béo tự do trong huyết tương. Sự tương tác hormone giữa thiếu hụt insulin và dư thừa glucagon sẽ chuyển các acid béo tự do vào con đường hình thành thể ceton. Tốc độ hình thành các thể ceton này, chủ yếu là β-hydroxybutyrate và acetoacetate, vượt quá khả năng sử dụng ở ngoại biên và bài tiết qua thận. Sự tích tụ của các ketoacid này dẫn đến nhiễm toan chuyển hóa và thở nhanh sâu bù trừ trong nỗ lực thải bớt carbon dioxide dư thừa (thở Kussmaul).
Acetone, được hình thành do sự chuyển đổi không qua enzyme của acetoacetate, là nguyên nhân gây ra mùi trái cây đặc trưng của hơi thở. Các thể ceton được bài tiết qua nước tiểu cùng với các cation và do đó làm tăng thêm sự mất nước và điện giải (Hình 21.10 và Bảng 21.7). Với tình trạng mất nước, nhiễm toan, tăng áp lực thẩm thấu tiến triển, và giảm sử dụng oxy ở não, ý thức trở nên suy giảm—cuối cùng bệnh nhân rơi vào hôn mê. Do đó, thiếu hụt insulin tạo ra một trạng thái dị hóa sâu sắc—một tình trạng đói quá mức trong đó tất cả các đặc điểm lâm sàng ban đầu có thể được giải thích dựa trên những thay đổi đã biết trong chuyển hóa trung gian do thiếu hụt insulin kết hợp với dư thừa hormone đối kháng điều hòa. Vì những thay đổi hormone đối kháng điều hòa thường là thứ phát, mức độ nghiêm trọng và thời gian của các triệu chứng phản ánh mức độ thiếu hụt insulin nguyên phát. Chi tiết hơn về những cân nhắc này được cung cấp trong phần thảo luận về nhiễm toan ceton do đái tháo đường, sẽ được trình bày sau.
Hình 21.10 Sinh lý bệnh của nhiễm toan ceton do đái tháo đường được minh họa như là một chức năng của sự thiếu hụt insulin tuyệt đối hoặc không đủ insulin khi có căng thẳng lớn, chẳng hạn như nhiễm trùng, dẫn đến sự gia tăng của bốn hormone đối kháng điều hòa chính. Cùng nhau, những thay đổi này làm tăng sản xuất glucose thông qua quá trình phân giải glycogen và tân tạo glucose, dẫn đến tăng đường huyết, lợi tiểu thẩm thấu và mất nước. Đồng thời, sự tăng phân giải mỡ dẫn đến sản xuất thể ceton và nhiễm toan kết hợp với tăng acid lactic do mất nước. Xem văn bản để biết thêm chi tiết.
Bảng 21.7: Nhu cầu Duy trì Dịch và Điện giải và Ước tính Mất mát trong Nhiễm toan Ceton do Đái tháo đường
| Nhu cầu Duy trì Hàng ngày Gần đúng | Mất mát Trung bình (khoảng) mỗi Kg |
|---|---|
| Nước | Phương pháp Holliday-Segar 10 kg đầu tiên: 100 mL/kg/ngày 10 kg tiếp theo: 50 mL/kg/ngày Mỗi kg tiếp theo: 20 mL/kg/ngày hoặc Phương pháp diện tích bề mặt cơ thể 1500 mL/m²/ngày |
| Natri | 2–4 mmol |
| Kali | 2–3 mmol |
| Clorua | 2–3 mmol |
| Phosphate | 1–2 mmol |
Sử dụng phương pháp Holliday-Segar, ví dụ, đối với một đứa trẻ 10 tuổi nặng 30 kg, nhu cầu dịch duy trì là: 1000 + 500 + 200 = 1700 mL/ngày
Biểu hiện lâm sàng của Đái tháo đường
Biểu hiện kinh điển của đái tháo đường ở trẻ em là tiền sử tiểu nhiều, uống nhiều, ăn nhiều và sụt cân. Tiểu nhiều có thể được báo hiệu bằng việc tái phát đái dầm ở một đứa trẻ đã được huấn luyện đi vệ sinh và uống nhiều bởi một đứa trẻ liên tục đòi uống nước. Sụt cân không giải thích được nên làm dấy lên nghi ngờ về sự tồn tại của bệnh đái tháo đường, cần được xác nhận hoặc loại trừ bằng cách đo nồng độ glucose trong máu, đầu tiên là sau ăn và sau đó là lúc đói. Nước tiểu cũng nên được kiểm tra sự hiện diện của glucose niệu. Thời gian của những triệu chứng này khác nhau; thường là ít hơn 1 tháng, nhưng một bệnh sử cẩn thận có thể tiết lộ nhiều tuần khát, đái dầm, mệt mỏi và sụt cân. Hầu hết trẻ em được chẩn đoán mắc ĐTĐ tuýp 1 đã được bác sĩ khám trong vòng một hoặc hai tuần trước khi chẩn đoán, nhưng bệnh đái tháo đường không được xem xét, và việc đo glucose trong máu hoặc nước tiểu đã không được thực hiện.
Một sự khởi phát âm thầm với lờ đờ, yếu và sụt cân cũng khá phổ biến. Việc sụt cân mặc dù tăng lượng thức ăn ăn vào có thể dễ dàng giải thích bằng ví dụ sau. Một đứa trẻ 10 tuổi khỏe mạnh trung bình có lượng calo hàng ngày là 2000 calo hoặc hơn, trong đó khoảng 50% có nguồn gốc từ carbohydrate. Khi phát triển bệnh đái tháo đường, lượng nước và glucose mất hàng ngày có thể lên tới 5 L và 250 g, tương ứng. Điều này tương đương với 1000 calo bị mất qua nước tiểu, hoặc 50% lượng calo trung bình hàng ngày. Do đó, mặc dù đứa trẻ tăng cường ăn và uống để bù trừ, lượng calo không thể được sử dụng, lượng calo mất quá mức vẫn tiếp tục, và tình trạng dị hóa và sụt cân ngày càng tăng.
Nhiễm trùng da mủ và viêm âm đạo do nấm ở bé gái hoặc viêm quy đầu do nấm ở bé trai chưa cắt bao quy đầu thỉnh thoảng xuất hiện tại thời điểm chẩn đoán đái tháo đường. Chúng hiếm khi là biểu hiện lâm sàng duy nhất của bệnh đái tháo đường ở trẻ em, và một bệnh sử cẩn thận sẽ luôn tiết lộ sự cùng tồn tại của việc đi tiểu quá nhiều hoặc tái phát đái dầm ở một đứa trẻ đã được huấn luyện đi vệ sinh, khát quá mức, và có thể là sụt cân. Nhiễm toan ceton là nguyên nhân cho biểu hiện ban đầu của nhiều trẻ em bị đái tháo đường (khoảng 25%–40%). Nhiễm toan ceton có khả năng xuất hiện thường xuyên hơn ở trẻ em dưới 5 tuổi vì chẩn đoán có thể không được nghi ngờ và tiền sử tiểu nhiều và uống nhiều có thể khó khai thác. Các biểu hiện sớm có thể tương đối nhẹ và bao gồm nôn, tiểu nhiều và mất nước.
Trong các trường hợp kéo dài và nghiêm trọng hơn, có thở Kussmaul—và có mùi acetone trong hơi thở. Thở Kussmaul có thể bị nhầm lẫn với viêm tiểu phế quản hoặc hen suyễn và nếu được điều trị sai lầm bằng steroid hoặc các thuốc adrenergic, sẽ làm bệnh đái tháo đường trở nên tồi tệ hơn. Đau bụng hoặc co cứng thành bụng có thể xuất hiện và có thể giống như viêm ruột thừa hoặc viêm tụy. Suy giảm tri giác và (cuối cùng) hôn mê xảy ra và có liên quan đến mức độ tăng áp lực thẩm thấu. Các kết quả xét nghiệm bao gồm glucose niệu, ceton niệu, tăng đường huyết, tăng ceton máu và nhiễm toan chuyển hóa. Tăng bạch cầu là phổ biến, và nồng độ amylase huyết thanh không đặc hiệu có thể tăng. Nồng độ lipase huyết thanh thường không tăng. Ở những người bị đau bụng, không nên cho rằng những phát hiện này là bằng chứng của một trường hợp cấp cứu ngoại khoa trước một giai đoạn điều trị bằng dịch, điện giải và insulin thích hợp để điều chỉnh tình trạng mất nước và nhiễm toan. Các biểu hiện ở bụng thường biến mất sau vài giờ điều trị như vậy.
Chẩn đoán
Chẩn đoán ĐTĐ phải được xem xét ở những trẻ có các biểu hiện sau: những trẻ có tiền sử gợi ý bệnh đái tháo đường, đặc biệt là các triệu chứng tiểu nhiều kèm uống nhiều, và không tăng cân hoặc sụt cân mặc dù ăn ngon miệng; những trẻ có glucose niệu được xác nhận; và những trẻ có biểu hiện lâm sàng của nhiễm toan chuyển hóa có hoặc không có sững sờ hoặc hôn mê. Trong mọi trường hợp, chẩn đoán ĐTĐ phụ thuộc vào việc chứng minh có tăng đường huyết kết hợp với glucose niệu có hoặc không có ceton niệu. Khi các triệu chứng kinh điển của tiểu nhiều và uống nhiều đi kèm với tăng đường huyết và glucose niệu đáp ứng các tiêu chí chẩn đoán ĐTĐ theo định nghĩa của ADA hoặc Tổ chức Y tế Thế giới (WHO), nghiệm pháp dung nạp glucose là chống chỉ định.
Glucose niệu do thận có thể là một rối loạn bẩm sinh đơn độc hoặc là một biểu hiện của hội chứng Fanconi và các rối loạn ống thận khác do ngộ độc kim loại nặng nghiêm trọng, sử dụng một số loại thuốc (ví dụ, tetracycline hết hạn), hoặc các lỗi chuyển hóa bẩm sinh (ví dụ, bệnh cystinosis). Khi nôn, tiêu chảy và ăn uống không đủ là các yếu tố phức tạp trong bất kỳ tình trạng nào trong số này, nhiễm ceton do đói có thể xảy ra và giống như DKA. Sự vắng mặt của tăng đường huyết loại trừ khả năng đái tháo đường. Cũng cần nhận ra rằng không phải tất cả đường trong nước tiểu đều là glucose, và không thường xuyên galactosemia, pentosuria, và fructosuria sẽ cần được xem xét như là các khả năng chẩn đoán.
Việc phát hiện glucose niệu, có hoặc không có mức độ tăng đường huyết nhẹ, trong quá trình nhập viện vì chấn thương hoặc nhiễm trùng (hoặc ngay cả trong sự biến động cảm xúc liên quan) có thể báo hiệu sự tồn tại của bệnh đái tháo đường. Trong hầu hết các trường hợp này, glucose niệu sẽ thuyên giảm trong quá trình hồi phục. Vì tình huống này có thể cho thấy khả năng bài tiết insulin hạn chế, bị bộc lộ bởi nồng độ các hormone căng thẳng trong huyết tương tăng cao, những bệnh nhân này nên được kiểm tra lại vào một thời điểm sau đó để tìm khả năng tăng đường huyết, các đặc điểm lâm sàng của ĐTĐ, và tiền sử gia đình bị đái tháo đường.
Tiền sử gia đình bị ĐTĐ trong hai thế hệ trước đó nên gợi ý khả năng có hội chứng MODY; sự vắng mặt của các kháng thể phổ biến chống lại tế bào beta, chẳng hạn như IA2, GAD65, ZnT8, hoặc ICA, củng cố khả năng chẩn đoán MODY. Trong những trường hợp này, nghiệm pháp dung nạp glucose có thể hữu ích để xác định chẩn đoán. Nghiệm pháp dung nạp glucose nên được thực hiện vài tuần sau khi hồi phục sau bệnh cấp tính, với liều glucose được điều chỉnh theo cân nặng. Bằng chứng cho thấy nghiệm pháp có khả năng bất thường cao nhất ở những người có HLA DR3 và DR4, ở những người có ICA hoặc tự kháng thể insulin được phát hiện, hoặc những người có MODY. Tăng đường huyết thoáng qua là phổ biến ở những bệnh nhân hen suyễn được điều trị bằng epinephrine và steroid. Việc xét nghiệm thêm ở những bệnh nhân như vậy không được chỉ định. Các quy trình sàng lọc, chẳng hạn như xác định glucose máu sau ăn hoặc nghiệm pháp dung nạp glucose đường uống, đã cho thấy tỷ lệ phát hiện thấp ở trẻ em—ngay cả ở những trẻ được coi là có nguy cơ, chẳng hạn như anh chị em của trẻ bị đái tháo đường. Theo đó, các quy trình sàng lọc như vậy không được khuyến nghị ở trẻ em.
Sinh lý bệnh và điều trị nhiễm toan ceton do đái tháo đường
Nhiễm toan ceton do đái tháo đường
Nhiễm toan ceton do đái tháo đường (DKA) là tình trạng mất bù chuyển hóa nghiêm trọng gây ra bởi tác động kết hợp của sự thiếu hụt insulin lưu hành, cùng với sự gia tăng nồng độ các hormone đối kháng điều hòa: catecholamine, glucagon, cortisol và hormone tăng trưởng, cũng như các cytokine tiền viêm (xem Hình 21.10). Các triệu chứng và dấu hiệu điển hình là tiểu nhiều, đái dầm, nôn, mất nước, khát nhiều, thở Kussmaul, hơi thở có mùi acetone, cùng với các đặc điểm sinh hóa đặc trưng, bao gồm tăng đường huyết, tăng ceton máu, nhiễm toan chuyển hóa và bất thường điện giải.
Thiếu hụt insulin nghiêm trọng xảy ra khi DKA tiến triển ở bệnh nhân ĐTĐ tuýp 1 chưa được chẩn đoán trước đó, hoặc khi bệnh nhân đang điều trị cố ý hoặc vô ý không tiêm insulin, đặc biệt là thành phần tác dụng kéo dài trong chế độ tiêm nhiều mũi hàng ngày (MDI), hoặc giảm đáng kể liều insulin, ví dụ, trong khi bị bệnh như viêm dạ dày ruột. Bệnh nhân sử dụng bơm insulin có thể nhanh chóng phát triển DKA khi việc cung cấp insulin bị gián đoạn vì bất kỳ lý do gì, bởi vì bơm chỉ cung cấp insulin tác dụng ngắn và không có thành phần tác dụng kéo dài như trong MDI. Thiếu hụt insulin tương đối xảy ra khi nồng độ các hormone đối kháng điều hòa tăng lên để đáp ứng với stress (ví dụ, nhiễm trùng huyết, chấn thương, hoặc bệnh có sốt) và dẫn đến mất bù chuyển hóa mặc dù đã dùng liều insulin thông thường. Mặc dù ít phổ biến hơn ở ĐTĐ tuýp 1, Nghiên cứu SEARCH về Đái tháo đường ở Thanh thiếu niên tại Hoa Kỳ đã báo cáo rằng gần 6% thanh thiếu niên mắc ĐTĐ tuýp 2 có biểu hiện DKA.
Sự kết hợp giữa thiếu hụt insulin tuyệt đối hoặc tương đối và nồng độ hormone đối kháng điều hòa cao gây ra một trạng thái dị hóa tăng tốc với sự gia tăng sản xuất glucose bởi gan và thận (thông qua quá trình phân giải glycogen và tân tạo glucose) cùng với sự suy giảm sử dụng glucose ở ngoại biên, dẫn đến tăng đường huyết và tăng áp lực thẩm thấu (xem Hình 21.10). Sự kết hợp giữa insulin thấp và hormone đối kháng điều hòa cao cũng làm tăng quá trình phân giải mỡ và tạo ceton, dẫn đến tăng ceton máu và nhiễm toan chuyển hóa do sự tích tụ của các ketoacid, chủ yếu là β-hydroxybutyrate. Tăng đường huyết vượt quá ngưỡng thận thông thường, khoảng 10 mmol/L (180 mg/dL), gây ra lợi tiểu thẩm thấu, mất nước và mất điện giải qua nước tiểu, thường trở nên trầm trọng hơn do nôn mửa liên quan đến nhiễm ceton nặng. Những thay đổi này kích thích sản xuất thêm hormone căng thẳng, gây ra đề kháng insulin nghiêm trọng hơn và làm trầm trọng thêm tình trạng tăng đường huyết và tăng ceton máu. Nhiễm toan lactic do giảm tưới máu hoặc nhiễm trùng huyết có thể góp phần vào tình trạng nhiễm toan. Trừ khi chu trình này bị gián đoạn bằng liệu pháp dịch và điện giải và việc sử dụng insulin ngoại sinh, tình trạng mất nước và nhiễm toan chuyển hóa gây tử vong sẽ xảy ra.
DKA là một cấp cứu y khoa đe dọa tính mạng, đòi hỏi phải được nhận biết và điều trị kịp thời. Cần phải phân biệt nó với tình trạng nhiễm toan và hôn mê do các nguyên nhân khác, chẳng hạn như hạ đường huyết, urê huyết, viêm dạ dày ruột với nhiễm toan chuyển hóa, nhiễm toan lactic, ngộ độc salicylate, viêm não và các tổn thương nội sọ khác.
Các tiêu chí sinh hóa để chẩn đoán DKA là: tăng đường huyết (glucose máu > 11 mmol/L [200 mg/dL]), pH máu tĩnh mạch dưới 7,3 hoặc bicarbonate huyết thanh dưới 15 mmol/L, có ceton trong máu hoặc nước tiểu (thường ≥ 2+, “vừa hoặc nhiều”), hoặc nồng độ beta-hydroxybutyrate (BOHB) trong máu từ 3 mmol/L trở lên là dấu hiệu của DKA. Trẻ em được điều trị một phần và trẻ em ăn ít hoặc không ăn carbohydrate (chán ăn hoặc ăn chay tôn giáo, chế độ ăn ít carbohydrate nhiều chất béo) có thể chỉ có nồng độ glucose máu tăng nhẹ, được gọi là nhiễm toan ceton với đường huyết bình thường. Gần đây, nhiễm toan ceton với đường huyết bình thường đã được mô tả ở những bệnh nhân sử dụng thuốc ức chế protein đồng vận chuyển natri-glucose 2 (SGLT2) (hiện chưa được phê duyệt để sử dụng ở trẻ em). Mức độ nghiêm trọng của DKA được xác định bởi mức độ nhiễm toan: nhẹ, pH tĩnh mạch 7,2 đến 7,3 hoặc bicarbonate huyết thanh 10 đến 15 mmol/L; trung bình, pH 7,1 đến 7,2 hoặc bicarbonate huyết thanh 5 đến dưới 10 mmol/L; nặng, pH dưới 7,1 hoặc bicarbonate huyết thanh dưới 5 mmol/L.
Tần suất DKA tại thời điểm chẩn đoán thay đổi rất nhiều trên toàn thế giới và tương quan nghịch với tỷ lệ mắc ĐTĐ tuýp 1 trong khu vực, dao động từ khoảng 15% đến 70% ở Châu Âu và Bắc Mỹ. Tại thời điểm chẩn đoán, khoảng 30% đến 50% tất cả trẻ em bị DKA ngay cả ở các nước phát triển. Các chương trình nâng cao nhận thức đã làm giảm tỷ lệ DKA. DKA là nguyên nhân hàng đầu gây ra các biến chứng, tử vong, và việc sử dụng dịch vụ y tế và chi phí quá mức ở bệnh nhân ĐTĐ tuýp 1.
DKA phổ biến hơn ở trẻ nhỏ (đặc biệt là < 2 tuổi, bao gồm cả trẻ sơ sinh bị đái tháo đường sơ sinh), thường là hậu quả của sai sót chẩn đoán và điều trị chậm trễ. DKA tại thời điểm chẩn đoán cũng phổ biến hơn ở các dân tộc thiểu số và ở trẻ em không được tiếp cận dễ dàng với chăm sóc y tế vì lý do xã hội hoặc kinh tế. Ở trẻ em đã được chẩn đoán ĐTĐ tuýp 1, nguy cơ DKA là 1% đến 10% mỗi bệnh nhân mỗi năm. Nguy cơ tăng lên ở trẻ bỏ tiêm insulin; trẻ có kiểm soát chuyển hóa kém hoặc có các đợt DKA trước đó; bệnh xen kẽ, đặc biệt là viêm dạ dày ruột với nôn ói kéo dài và không thể duy trì hydrat hóa; trẻ có rối loạn tâm thần, bao gồm cả những trẻ bị rối loạn ăn uống; trẻ sống trong hoàn cảnh gia đình căng thẳng hoặc rối loạn chức năng; và các bé gái ở tuổi tiền dậy thì và vị thành niên. DKA là một nguy cơ được công nhận rõ ràng liên quan đến việc sử dụng các loại thuốc giải trí và uống rượu say sưa ở thanh thiếu niên và người trẻ tuổi. Việc bỏ tiêm insulin hoặc không tuân theo các hướng dẫn quản lý khi bị bệnh hoặc khi bơm hỏng chiếm gần như tất cả các đợt DKA tái phát.
DKA phải được phân biệt với tình trạng tăng đường huyết tăng áp lực thẩm thấu (HHS), trước đây được gọi là hôn mê tăng áp lực thẩm thấu không do ceton, một hội chứng đặc trưng bởi nồng độ glucose huyết thanh tăng cực cao và tăng áp lực thẩm thấu mà không có nhiễm ceton đáng kể. Các tiêu chí cho HHS bao gồm nồng độ glucose huyết tương trên 33,3 mmol/L (600 mg/dL), pH tĩnh mạch lớn hơn 7,25 (pH động mạch > 7,30), bicarbonate huyết thanh trên 15 mmol/L, ceton niệu ít, ceton máu không có đến ít, áp lực thẩm thấu hiệu dụng của huyết thanh lớn hơn 320 mOsm/kg, suy giảm tri giác, hung hăng, hoặc co giật (xảy ra ở khoảng 50%).
Mặc dù ít phổ biến hơn nhiều ở trẻ em và thanh thiếu niên so với DKA, tỷ lệ mắc HHS đang gia tăng; một nghiên cứu gần đây đã phát hiện HHS khi nhập viện ở 2% thanh thiếu niên mắc ĐTĐ tuýp 2 (thường liên quan đến béo phì bệnh lý). Không giống như các triệu chứng thông thường của DKA (tăng thông khí, nôn mửa và đau bụng), thường đưa trẻ đến khám, tình trạng tiểu nhiều và uống nhiều tăng dần của HHS có thể không được nhận ra, cuối cùng dẫn đến mất nước sâu và mất điện giải nghiêm trọng tại thời điểm nhập viện; lượng dịch mất trong HHS được ước tính gấp đôi so với DKA. Hơn nữa, béo phì và tăng áp lực thẩm thấu làm cho việc đánh giá lâm sàng tình trạng mất nước trở nên đặc biệt khó khăn vì tăng trương lực bảo tồn thể tích nội mạch; do đó, mặc dù thiếu hụt thể tích và mất điện giải nghiêm trọng, các dấu hiệu mất nước có thể ít rõ ràng hơn. Các báo cáo đã mô tả một tỷ lệ cao các tổn thương thần kinh có từ trước. Tăng đường huyết sâu có thể phát triển trong vài ngày; ban đầu, tình trạng tiểu nhiều thẩm thấu bắt buộc và mất nước có thể được bù trừ một phần bằng cách tăng lượng dịch uống vào. Tuy nhiên, khi bệnh tiến triển, cảm giác khát bị suy giảm, có thể là kết quả của sự thay đổi chức năng của trung tâm khát ở vùng dưới đồi do tăng áp lực thẩm thấu. Trong một số trường hợp, đây là hậu quả của một khiếm khuyết có từ trước trong cơ chế điều hòa thẩm thấu của vùng dưới đồi.
Các đặc điểm của HHS và DKA có thể chồng chéo. Một số bệnh nhân HHS, đặc biệt là những người bị mất nước nghiêm trọng và tăng nitơ máu trước thận, có nhiễm toan nhẹ hoặc trung bình do giảm tưới máu và nhiễm toan lactic. Ngược lại, trẻ em bị ĐTĐ tuýp 1 có thể bị tăng đường huyết nghiêm trọng, đặc biệt nếu đã uống các loại đồ uống chứa nhiều carbohydrate để giải khát.
Sản xuất ceton thấp chủ yếu là do tăng áp lực thẩm thấu, trong ống nghiệm làm giảm tác dụng phân giải mỡ của epinephrine, và do tác dụng chống phân giải mỡ đồng thời của insulin còn lại. Việc làm giảm phân giải mỡ bằng cách sử dụng thuốc chẹn β-adrenergic cũng có thể góp phần vào hội chứng này. Một sự khác biệt chính giữa DKA và HHS là mức độ thiếu hụt insulin, gần như tuyệt đối trong DKA, trong khi ở HHS có đủ hoạt động insulin còn lại để hạn chế phân giải mỡ trong mô mỡ nhưng không đủ insulin để ức chế tân tạo glucose và cho phép sử dụng glucose ngoại biên bình thường tại thời điểm sản xuất glucose tăng lên do nồng độ các hormone căng thẳng hoặc đối kháng điều hòa tăng cao. Suy giảm ý thức tương quan với mức độ tăng áp lực thẩm thấu ở cả HHS và DKA, và tình trạng cô đặc máu dễ dẫn đến huyết khối động mạch và tĩnh mạch não (Hộp 21.2).
Hộp 21.2: Mục tiêu Điều trị trong Nhiễm toan Ceton do Đái tháo đường
|
Quản lý Nhiễm toan Ceton do Đái tháo đường
Điều trị DKA bao gồm ba yếu tố cơ bản: theo dõi tỉ mỉ các dấu hiệu sinh tồn và đáp ứng sinh hóa; bù dịch và điện giải, với thể tích và thành phần dựa trên ước tính mức độ mất nước và nhu cầu duy trì hàng ngày; và cung cấp insulin IV (xem Bảng 21.7). Việc điều trị nên được bắt đầu ngay khi chẩn đoán lâm sàng được xác nhận. Quản lý cấp tính nên tuân theo các hướng dẫn chung cho Hồi sức Cấp cứu Nhi khoa Nâng cao (PALS), với sự chú ý đặc biệt đến những điều sau: ngay lập tức đo glucose máu và nồng độ BOHB trong máu bằng máy đo tại giường hoặc đo ceton trong nước tiểu bằng que thử (chỉ đo acid acetoacetic) nếu không có máy đo ceton máu tại giường. Thực hiện đánh giá lâm sàng để xác định một nhiễm trùng có thể có. Cân bệnh nhân và, nếu diện tích bề mặt cơ thể được sử dụng để tính toán liệu pháp dịch, hãy đo chiều cao hoặc chiều dài để xác định diện tích bề mặt. Cân nặng hiện tại nên được sử dụng để tính toán dịch.
Ước tính lâm sàng mức độ mất nước là không chính xác; các dấu hiệu hữu ích bao gồm thời gian làm đầy mao mạch kéo dài (thời gian làm đầy mao mạch bình thường là ≤ 1,5–2 giây), độ đàn hồi da bất thường (“véo da” hoặc da không đàn hồi), niêm mạc khô, mắt trũng, không có nước mắt, mạch yếu và các chi lạnh. Nhiều dấu hiệu mất nước hơn có xu hướng liên quan đến mất nước nghiêm trọng hơn; mạch ngoại biên yếu hoặc không sờ thấy, hạ huyết áp và thiểu niệu cho thấy mất nước từ 10% trở lên.
Đánh giá mức độ ý thức bằng Thang điểm Hôn mê Glasgow (GCS)—Bảng 21.8. Ở bệnh nhân bất tỉnh hoặc suy giảm tri giác nặng không có phản xạ bảo vệ đường thở bình thường, hãy bảo vệ đường thở và làm rỗng dạ dày bằng cách hút liên tục qua ống thông mũi-dạ dày để ngăn ngừa hít sặc vào phổi. Nên tránh đặt nội khí quản nếu có thể; sự gia tăng pCO2 trong hoặc sau khi đặt nội khí quản trên mức mà bệnh nhân đã duy trì có thể làm giảm pH dịch não tủy và góp phần làm phù não nặng hơn.
Bảng 21.8: Thang điểm Hôn mê Glasgow
| Đáp ứng Mắt Tốt nhất | Đáp ứng Lời nói Tốt nhất | Đáp ứng Lời nói Tốt nhất (Trẻ không nói được) | Đáp ứng Vận động Tốt nhất |
|---|---|---|---|
| 1. Không mở mắt | 1. Không có đáp ứng lời nói | 1. Không có đáp ứng | 1. Không có đáp ứng vận động |
| 2. Mở mắt khi đau | 2. Chỉ có âm thanh không thể hiểu được; rên rỉ | 2. Không dỗ được, cáu kỉnh, bồn chồn, khóc | 2. Duỗi cứng khi đau (tư thế mất não) |
| 3. Mở mắt theo lệnh | 3. Nói từ nhưng không mạch lạc | 3. Dỗ được không nhất quán và rên rỉ; phát ra âm thanh | 3. Gấp cứng khi đau (tư thế mất vỏ) |
| 4. Mở mắt tự nhiên | 4. Lú lẫn, mất phương hướng | 4. Dỗ được khi khóc và tương tác không phù hợp | 4. Rút lui khỏi cơn đau |
| 5. Định hướng, nói chuyện bình thường | 5. Mỉm cười, định hướng theo âm thanh, theo dõi vật thể và tương tác | 5. Khu trú được cơn đau | |
| 6. Tuân theo mệnh lệnh |
Thang điểm Hôn mê Glasgow (GCS) bao gồm ba thông số và được chấm điểm từ 3 đến 15; 3 là tệ nhất và 15 là tốt nhất. Một trong những thành phần của GCS là đáp ứng lời nói tốt nhất, không thể đánh giá được ở trẻ nhỏ không nói được. Một bản sửa đổi của GCS đã được tạo ra cho trẻ em quá nhỏ để nói chuyện.
Cho bệnh nhân bị suy tuần hoàn hoặc sốc thở oxy. Nên sử dụng máy theo dõi tim để theo dõi điện tâm đồ liên tục nhằm đánh giá sóng T để tìm bằng chứng về tăng hoặc hạ kali máu.
Nên đặt một catheter tĩnh mạch ngoại biên thứ hai để lấy máu lặp lại. Trừ khi thực sự cần thiết, hãy tránh đặt catheter tĩnh mạch trung tâm vì nguy cơ huyết khối cao, đặc biệt ở trẻ rất nhỏ.
Cho kháng sinh cho bệnh nhân có sốt sau khi lấy các mẫu cấy thích hợp từ các dịch cơ thể.
Đặt thông tiểu thường không cần thiết, nhưng nếu trẻ bất tỉnh hoặc không thể tự đi tiểu theo yêu cầu (ví dụ, trẻ sơ sinh và trẻ nhỏ bị bệnh rất nặng), bàng quang nên được đặt thông.
Lấy mẫu máu để đo lường trong phòng thí nghiệm:
- Glucose huyết thanh hoặc huyết tương
- BOHB huyết thanh
- Điện giải đồ (bao gồm bicarbonate huyết thanh)
- Nitơ urê máu, creatinine
- Áp lực thẩm thấu huyết thanh
- pH tĩnh mạch, pCO2
- Hemoglobin, hematocrit. Số lượng bạch cầu tăng để đáp ứng với stress là đặc trưng của DKA và không phải là dấu hiệu của nhiễm trùng
- Nồng độ albumin, canxi, phosphate, magiê (nếu có thể)
- Ceton niệu (nếu BOHB huyết thanh chưa được đo)
- Lấy các mẫu thích hợp để cấy (máu, nước tiểu, họng) nếu có bằng chứng nhiễm trùng (ví dụ, sốt)
- Nếu việc đo kali huyết thanh trong phòng thí nghiệm bị trì hoãn, hãy thực hiện điện tâm đồ (ECG) để đánh giá ban đầu tình trạng kali
- Mặc dù không cần thiết cho việc quản lý DKA, hemoglobin (Hb)A1c có thể hữu ích ở những bệnh nhân cụ thể vì nó cung cấp thông tin về thời gian tăng đường huyết
Trẻ bị Nhiễm toan Ceton do Đái tháo đường nên được Quản lý ở đâu?
Quản lý thành công DKA và HHS đòi hỏi phải theo dõi và ghi chép tỉ mỉ đáp ứng lâm sàng và sinh hóa của bệnh nhân đối với điều trị để có thể điều chỉnh kịp thời khi có chỉ định từ dữ liệu lâm sàng hoặc xét nghiệm của bệnh nhân. Sau khi hồi sức ban đầu, trẻ nên được chăm sóc tại một đơn vị có các hướng dẫn bằng văn bản và đội ngũ y tá có kinh nghiệm được đào tạo về quản lý DKA ở trẻ em và thanh thiếu niên. Trẻ em bị DKA nặng và những trẻ có nguy cơ cao bị tổn thương não (ví dụ, < 5 tuổi, nhiễm toan nặng, pCO2 thấp, nitơ urê máu cao) nên được điều trị tại đơn vị chăm sóc tích cực (ICU).
Theo dõi Lâm sàng và Sinh hóa
- Hàng giờ (thường xuyên hơn khi có chỉ định) các dấu hiệu sinh tồn bao gồm nhịp tim, nhịp thở, huyết áp
- Hàng giờ (thường xuyên hơn khi có chỉ định) quan sát thần kinh (GCS; xem Bảng 21.8) để tìm các dấu hiệu và triệu chứng cảnh báo tổn thương não (xem phần sau về phù não)
- Lượng insulin đã dùng
- Hàng giờ (hoặc thường xuyên hơn khi có chỉ định) lượng dịch vào và ra
- Các xét nghiệm: glucose huyết thanh, điện giải đồ, nitơ urê máu, canxi, magiê, phosphate, hematocrit, và khí máu nên được lặp lại sau 2 đến 4 giờ, hoặc thường xuyên hơn, khi có chỉ định lâm sàng, trong các trường hợp nặng hơn
- Nồng độ BOHB trong máu, nếu có, mỗi 2 đến 4 giờ
- Các phép đo BOHB tại điểm chăm sóc tương quan tốt với phương pháp tham chiếu lên đến 3 mmol/L, nhưng không chính xác trên 5 mmol/L
- Các tính toán hữu ích:
- Khoảng trống anion = Na – (Cl + HCO3): bình thường là 12 ± 2 mmol/L. Trong DKA, khoảng trống anion thường là 20 đến 30 mmol/L; khoảng trống anion lớn hơn 35 mmol/L cho thấy có nhiễm toan lactic đi kèm
- “Natri hiệu chỉnh” = Na đo được + 2([glucose huyết tương – 5,6]/5,6) mmol/L hoặc Na đo được + 2([glucose huyết tương – 100]/100) mg/dL
- Áp lực thẩm thấu hiệu dụng (mOsm/kg) = 2 × (Na huyết tương) + glucose huyết tương (mmol/L)
Liệu pháp Dịch và Điện giải
Liệu pháp bù dịch và điện giải là nền tảng của việc quản lý DKA. Mục tiêu là phục hồi thể tích tuần hoàn, bù natri và sự thiếu hụt nước ngoại bào và nội bào, cải thiện độ lọc cầu thận, và tăng cường thanh thải glucose và ceton khỏi máu. Bệnh nhân DKA có sự thiếu hụt thể tích dịch ngoại bào (ECF) thường trong khoảng 5% đến 10% trọng lượng cơ thể. Sốc với suy giảm huyết động hiếm gặp trong DKA ở trẻ em. Trong DKA trung bình, giả định mất nước 5% đến 7% và trong DKA nặng là 7% đến 10%. Việc tính toán nồng độ natri hiệu chỉnh (công thức trước đó) rất hữu ích để giúp đánh giá mức độ thiếu hụt natri và nước. Natri hiệu chỉnh đại diện cho nồng độ natri huyết thanh dự kiến khi không có tăng đường huyết. Khi nồng độ glucose huyết tương giảm (để đáp ứng với dịch và insulin), nồng độ natri huyết thanh đo được sẽ tăng và nồng độ natri hiệu chỉnh sẽ giảm từ từ hoặc vẫn nằm trong phạm vi bình thường. Sự gia tăng nhanh chóng và liên tục của nồng độ natri huyết thanh có thể cho thấy sự mất nước tự do trong nước tiểu do đái tháo nhạt, một biến chứng hấp hối của phù não.
Đã có nhiều tranh cãi về tốc độ truyền dịch hoặc natri và vai trò có thể có của việc truyền nhanh dịch nhược trương trong sự phát triển của phù não. Một thử nghiệm lâm sàng ngẫu nhiên gần đây đã so sánh các kết quả thần kinh cấp tính và lâu dài trong 1389 đợt ở 1255 trẻ em bị DKA được điều trị bằng cách truyền dịch chậm hơn so với nhanh hơn bằng cách sử dụng dung dịch muối 0,45% hoặc 0,9%. Cả tốc độ lẫn hàm lượng natri clorua của dịch IV đều không ảnh hưởng đáng kể đến các kết quả thần kinh, cho thấy rằng một loạt các tốc độ truyền dịch và hàm lượng natri trong dịch có thể được sử dụng một cách an toàn để điều trị DKA ở trẻ em. Do đó, một sự thiếu hụt dịch giả định từ 5% đến 10% trọng lượng cơ thể nên được bù trong vòng 24 đến 48 giờ, cùng với dịch duy trì, sử dụng các loại dịch có hàm lượng natri từ 0,45% đến 0,9% muối. Quan trọng nhất, các bác sĩ lâm sàng không nên hạn chế truyền dịch nếu các dấu hiệu lâm sàng cho thấy cần phải mở rộng thể tích tuần hoàn.
Dịch Hồi sức
Ngay lập tức bắt đầu mở rộng thể tích bằng dung dịch muối 0,9% 10 mL/kg truyền trong 30 đến 60 phút để phục hồi tuần hoàn ngoại biên. Nếu tưới máu mô kém, liều dịch ban đầu được truyền nhanh hơn (ví dụ, trong 15–30 phút) và có thể cần một liều dịch thứ hai để đảm bảo tưới máu mô đầy đủ.
Dịch Bù Thiếu hụt
Việc quản lý dịch tiếp theo có thể bằng dung dịch muối 0,45% đến 0,9% hoặc một dung dịch muối cân bằng (Ringer’s lactate, dung dịch Hartmann hoặc Plasmalyte). Ngoài việc cung cấp nhu cầu dịch duy trì hàng ngày thông thường, hãy bù sự thiếu hụt dịch ước tính với tốc độ đều trong 24 đến 48 giờ (Bảng 21.9 cung cấp một ví dụ minh họa). Khi nồng độ glucose huyết tương giảm trong quá trình điều trị, thể tích mạch máu sẽ giảm; do đó, điều cần thiết là cung cấp đủ dịch và muối để duy trì tưới máu mô đầy đủ. Ngoại trừ những cá nhân bị bệnh nặng, việc ăn uống bằng đường miệng thường bắt đầu trong vòng 24 giờ. Mặc dù việc bù nước thường được lên kế hoạch diễn ra trong thời gian dài hơn, trong một nghiên cứu trên 635 đợt DKA, thời gian trung bình để điều chỉnh DKA và phục hồi hoàn toàn tuần hoàn là 11,6 ± 6,2 giờ. Bất kỳ sự thiếu hụt nào còn lại sẽ được bù bằng đường uống sau khi DKA đã được giải quyết và bệnh nhân được chuyển sang dùng insulin dưới da. Các kết quả khả quan cũng đã được báo cáo khi sử dụng một phương pháp đơn giản hóa thay thế: sau khi truyền dịch ban đầu 20 mL/kg nước muối sinh lý, dung dịch muối 0,675% (3/4 nước muối sinh lý, 115,5 mmoL natri) được truyền với tốc độ gấp 2 đến 2,5 lần tốc độ truyền dịch duy trì thông thường bất kể mức độ mất nước, và giảm xuống còn 1 đến 1,5 lần tốc độ duy trì sau 24 giờ, hoặc sớm hơn nếu tình trạng nhiễm toan đã được giải quyết.
Bảng 21.9: Liệu pháp Dịch và Điện giải cho Nhiễm toan Ceton do Đái tháo đường: Khuyến nghị Bù Dịch và Điện giải
| Mất mát Tích lũy Gần đúng với 10% Mất nước | Nhu cầu Gần đúng để Duy trì (36 Giờ) | Tổng Gần đúng để Bù và Duy trì (36 Giờ) | |
|---|---|---|---|
| Nước (mL) | 3000 | 2250 | 5250 |
| Natri (mmol) | 300 | 70 | 370 |
| Kali (mmol) | 180 | 65 | 245 |
| Clorua (mmol) | 180 | 65 | 245 |
| Phosphate (mmol) | 75 | 35 | 110 |
| Lịch trình Bù (Truyền tĩnh mạch liên tục) | |||
| Thời gian Gần đúng | Dịch (Thành phần) | Natri (mmol) | Kali (mmol) |
| Giờ 1 | 600 mL NaCl 0,9% (muối đẳng trương) | 92 | — |
| Giờ 2–6 (200 mL/giờ trong 5 giờ) | 1000 mL NaCl 0,9% cộng với 40 mmol KCl/L | 154 | 40 |
| Giờ 7–12 (200 mL/giờ trong 6 giờ) | 1200 mL NaCl 0,45% với 20 mmol/L kali clorua và 20 mmol/L kali phosphate | 92 | 48 |
| Tổng phụ 12 giờ đầu | 2800 mL | 338 | 88 |
| 24 giờ tiếp theo 100 mL/giờ | 2400 mL glucose 5% trong NaCl 0,45% với 20 mmol/L kali clorua và 20 mmol/L kali phosphate | 185 | 96 |
| Tổng trong 36 giờ | 5200 mL | 523 | 184 |
Đánh giá lâm sàng tình trạng hydrat hóa và áp lực thẩm thấu hiệu dụng được tính toán là những hướng dẫn hữu ích cho liệu pháp dịch và điện giải. Mục tiêu là giảm dần áp lực thẩm thấu hiệu dụng của huyết thanh về mức bình thường. Cần có sự gia tăng đồng thời nồng độ natri huyết thanh 0,5 mmol/L cho mỗi 1 mmol/L giảm nồng độ glucose. Hàm lượng natri trong dịch nên được tăng lên nếu nồng độ natri huyết thanh đo được thấp và không tăng một cách thích hợp khi nồng độ glucose huyết tương giảm.
Việc sử dụng một lượng lớn dịch giàu clorua (kết hợp với việc bài tiết ưu tiên ceton qua thận so với clorua) có thể liên quan đến sự phát triển nhanh chóng của tăng clo máu (được định nghĩa là tỷ lệ clorua:natri [Cl−:Na+] > 0,79) và nhiễm toan chuyển hóa do tăng clo máu. Nhiễm toan do tăng clo máu phổ biến hơn ở những bệnh nhân nhận một lượng lớn dung dịch natri clorua 0,9% so với những người nhận dịch chứa natri clorua 0,45%. Tác dụng gây toan của clorua có thể che giấu việc nhận ra sự giải quyết của nhiễm toan ceton khi tổng thâm hụt kiềm được sử dụng để theo dõi sự cải thiện sinh hóa. Khi tăng clo máu phát triển, sự thiếu hụt kiềm kéo dài hoặc nồng độ bicarbonate thấp có thể bị giải thích sai là do nhiễm ceton đang diễn ra. Việc đo nồng độ BOHB tại giường sẽ ngăn chặn mọi sự nhầm lẫn và chứng minh rằng nhiễm toan ceton đã được giải quyết. Nhiễm toan do tăng clo máu tự khỏi. Mặc dù khoảng trống anion hữu ích để theo dõi sự giải quyết của nhiễm ceton, nó có hai hạn chế trong bối cảnh này: nó không thể phân biệt một tình trạng nhiễm toan chuyển hóa hỗn hợp (tăng clo máu và do ceton), và mức độ nhiễm toan do tăng clo máu không thể định lượng được. Thông thường, sự khác biệt giữa nồng độ natri và clorua trong huyết thanh là 30 đến 35 mmol/L. Để phân chia thành phần clorua của thâm hụt kiềm, công thức sau đã được đề xuất để cho phép các bác sĩ lâm sàng theo dõi sự giải quyết của nhiễm toan ceton tại giường: thâm hụt kiềm do clorua = (natri huyết tương – clorua huyết tương – 32). Lượng clorua có thể được giảm bằng cách không cho kali dưới dạng kali clorua (thay vào đó sử dụng kali axetat) và bằng cách sử dụng các loại dịch, chẳng hạn như Ringer’s lactate hoặc Plasmalyte, trong đó một phần clorua được thay thế, tương ứng, bằng lactate hoặc axetat. Bảng 21.9 minh họa liệu pháp dịch và điện giải cho một đứa trẻ 30 kg bị DKA nặng được ước tính mất nước 10%.
Liệu pháp Insulin
Chỉ riêng việc bù nước đã làm giảm đáng kể nồng độ glucose trong máu; tuy nhiên, liệu pháp insulin là cần thiết để ức chế quá trình phân giải glycogen, tân tạo glucose, phân giải mỡ và tạo ceton; thúc đẩy việc sử dụng glucose tế bào bình thường; và để bình thường hóa nồng độ glucose trong máu. Bắt đầu truyền insulin liên tục, 0,05 đến 0,1 U/kg/giờ được thực hiện bằng cách truyền IV được kiểm soát bởi một bơm tiêm điện, ít nhất 1 giờ sau khi bắt đầu liệu pháp bù dịch; tức là, sau khi bệnh nhân đã nhận được sự mở rộng thể tích ban đầu. Không nên sử dụng liều bolus IV khi bắt đầu điều trị; điều này không cần thiết, có thể làm tăng nguy cơ phù não, có thể gây sốc bằng cách giảm nhanh áp lực thẩm thấu, và có thể làm trầm trọng thêm tình trạng hạ kali máu. Liều insulin thường nên giữ ở mức 0,05 đến 0,1 U/kg/giờ ít nhất cho đến khi DKA được giải quyết (pH > 7,30, bicarbonate huyết thanh > 15 mmol/L, BOHB < 1 mmol/L, hoặc đóng khoảng trống anion), điều này luôn mất nhiều thời gian hơn so với việc bình thường hóa nồng độ glucose trong máu. Nếu tác dụng của insulin đầy đủ, BOHB huyết thanh sẽ giảm khoảng 0,5 mmol/L mỗi giờ. Nếu bệnh nhân có biểu hiện nhạy cảm rõ rệt với insulin (ví dụ, một số trẻ nhỏ bị DKA, bệnh nhân HHS, và một số trẻ lớn hơn đã mắc đái tháo đường), liều insulin có thể được giảm miễn là tình trạng nhiễm toan chuyển hóa tiếp tục được giải quyết. Ví dụ, nếu một đứa trẻ nhỏ đang nhận 0,05 U/kg/giờ, có thể cần giảm liều insulin xuống 0,03 U/kg/giờ để ngăn ngừa hạ đường huyết mặc dù đã bổ sung glucose IV. Đối với DKA nhẹ và trung bình (pH > 7,1–7,2), 0,05 U/kg/giờ (0,03 U/kg/giờ cho trẻ < 5 tuổi bị DKA nhẹ) thường đủ để giải quyết tình trạng nhiễm toan.
Để ngăn ngừa hạ đường huyết, nên thêm 5% glucose vào dịch IV khi glucose huyết tương giảm xuống khoảng 14 đến 17 mmol/L (250–300 mg/dL) hoặc sớm hơn nếu tốc độ giảm quá nhanh. Có thể cần sử dụng dextrose 10% hoặc thậm chí 12,5% để ngăn ngừa hạ đường huyết trong khi vẫn tiếp tục truyền insulin để điều chỉnh nhiễm toan chuyển hóa.
Trong những trường hợp không thể truyền IV liên tục và ở những bệnh nhân DKA không biến chứng, tiêm insulin analog tác dụng nhanh dưới da (SC) hàng giờ hoặc 2 giờ là an toàn và hiệu quả như truyền insulin regular IV. Liều ban đầu SC: 0,3 U/kg, sau đó 1 giờ bằng insulin lispro hoặc aspart SC với liều 0,1 U/kg mỗi giờ, hoặc 0,15 đến 0,20 U/kg mỗi 2 đến 3 giờ. Nếu glucose máu giảm xuống dưới 14 mmol/L (250 mg/dL) trước khi DKA được giải quyết, hãy giảm insulin lispro hoặc aspart SC xuống 0,05 U/kg/giờ để giữ glucose máu khoảng 11 mmol/L (200 mg/dL) cho đến khi DKA được giải quyết. Việc tiêm insulin tác dụng ngắn (regular) dưới da mỗi 4 giờ cũng là một phương pháp thay thế an toàn và hiệu quả cho việc truyền insulin IV ở trẻ em có pH từ 7,0 trở lên. Liều khởi đầu được đề nghị là 0,8 đến 1 U/kg/24 giờ; liều tính cho 24 giờ được chia cho 6 để cung cấp một liều insulin tiêm mỗi 4 giờ. Liều được tăng hoặc giảm 10% đến 20% dựa trên mức glucose máu trước lần tiêm insulin tiếp theo (ví dụ, nếu một đứa trẻ nặng 45 kg: 45 × 0,8 = 36 đơn vị; liều khởi đầu là 6 đơn vị).
Bù Kali
Trẻ em bị DKA có tổng lượng kali thiếu hụt trong cơ thể vào khoảng 3 đến 6 mmol/kg. Kali nội bào bị suy giảm do sự dịch chuyển qua màng tế bào gây ra bởi tăng trương lực (tăng áp lực thẩm thấu huyết tương gây ra hiện tượng kéo dung môi trong đó nước và kali bị kéo ra khỏi tế bào), nhiễm toan, và quá trình phân giải glycogen và protein thứ phát sau thiếu hụt insulin cũng gây ra sự thoát kali ra khỏi tế bào. Nôn mửa và lợi tiểu thẩm thấu là những nguyên nhân chính gây mất kali khỏi cơ thể, và tăng aldosterone thứ phát để đáp ứng với tình trạng thiếu hụt thể tích thúc đẩy bài tiết kali qua nước tiểu. Mặc dù tổng lượng kali trong cơ thể bị suy giảm, nồng độ kali huyết thanh có thể bình thường, tăng hoặc giảm khi nhập viện. Rối loạn chức năng thận làm giảm bài tiết kali và góp phần gây tăng kali máu; trong khi đó, việc sử dụng insulin và điều chỉnh nhiễm toan sẽ đẩy kali trở lại vào tế bào và làm giảm nhanh chóng nồng độ kali huyết thanh. Sự giảm đột ngột nồng độ kali huyết thanh có thể dẫn đến rối loạn nhịp tim. Do đó, cần phải bù kali bất kể nồng độ kali huyết thanh như thế nào, trừ khi có suy thận. Nếu bệnh nhân bị hạ kali máu, hãy bắt đầu bù kali (nên sử dụng 20 mmol/L) tại thời điểm mở rộng thể tích ban đầu và trước khi bắt đầu liệu pháp insulin. Ngược lại, hãy bắt đầu bù kali sau khi mở rộng thể tích ban đầu và đồng thời với việc bắt đầu liệu pháp insulin. Nếu bệnh nhân bị tăng kali máu, hãy hoãn liệu pháp bù kali cho đến khi lượng nước tiểu được ghi nhận. Nếu không có kết quả đo kali huyết thanh ngay lập tức, ECG có thể giúp xác định xem trẻ có bị tăng hay hạ kali máu. Kéo dài khoảng PR, sóng T dẹt và đảo ngược, đoạn ST chênh xuống, sóng U nổi bật, và khoảng QT dường như kéo dài (do sự hợp nhất của sóng T và U) cho thấy hạ kali máu. Sóng T cao, nhọn, đối xứng và khoảng QT ngắn lại là những dấu hiệu của tăng kali máu. Nồng độ kali ban đầu trong dịch truyền nên là 40 mmol/L, và liệu pháp bù kali tiếp theo nên dựa trên các phép đo kali huyết thanh. Kali phosphate có thể được sử dụng cùng với kali clorua hoặc axetat; ví dụ, 20 mmol/L kali clorua và 20 mmol/L kali phosphate hoặc 20 mmol/L kali phosphate và 20 mmol/L kali axetat. Việc cung cấp kali hoàn toàn dưới dạng kali clorua góp phần vào nguy cơ nhiễm toan chuyển hóa do tăng clo máu, trong khi việc cung cấp hoàn toàn dưới dạng kali phosphate có thể dẫn đến hạ canxi máu. Tốc độ truyền kali IV tối đa được khuyến nghị thường là 0,5 mmol/kg/giờ. Nếu tình trạng hạ kali máu vẫn tồn tại mặc dù đã đạt tốc độ bù kali tối đa, thì có thể giảm tốc độ truyền insulin. Hạ kali máu sâu (< 2,5 mmol/L) trong DKA chưa được điều trị là hiếm gặp và cần phải bù kali mạnh mẽ, đồng thời trì hoãn việc bắt đầu liệu pháp insulin cho đến khi nồng độ kali huyết thanh trên 2,5 mmol/L để giảm nguy cơ suy giảm tim phổi và thần kinh cơ.
Phosphate
Lợi tiểu thẩm thấu gây ra mất phosphate qua nước tiểu và suy giảm phosphate nội bào. Nồng độ phosphate huyết tương giảm sau khi bắt đầu điều trị, trầm trọng hơn bởi insulin, chất thúc đẩy phosphate đi vào tế bào. Sự suy giảm phosphate đã được liên kết với nhiều rối loạn chuyển hóa. Phosphate cần thiết cho sự hình thành 2,3-diphosphoglycerate (2,3-DPG), chất chi phối đường cong phân ly oxy. Thiếu hụt 2,3-DPG làm dịch chuyển đường cong phân ly oxy sang trái (tức là, nhiều oxy hơn được giữ lại bởi hemoglobin và ít hơn có sẵn cho các mô, một tình huống dễ dẫn đến nhiễm toan lactic). Nhiễm toan tự nó làm dịch chuyển đường cong phân ly hemoglobin-oxy sang phải (hiệu ứng Bohr) và do đó “bù trừ” một phần cho sự thiếu hụt 2,3-DPG. Vì nhiễm toan được điều chỉnh bằng việc cung cấp insulin, các tác động của sự thiếu hụt 2,3-DPG có thể không còn được bù trừ và việc giải phóng oxy cho các mô có thể lại bị suy giảm. Phosphate ngoại sinh góp phần vào sự hình thành 2,3-DPG mới, cho phép đường cong phân ly oxy dịch chuyển sang phải, tạo điều kiện giải phóng oxy cho các mô. Mặc dù có những cân nhắc sinh lý bệnh trước đó, các nghiên cứu tiền cứu đã không cho thấy lợi ích lâm sàng từ việc bù phosphate thường quy.
Hạ phosphate máu có ý nghĩa lâm sàng có thể xảy ra nếu liệu pháp IV không kèm theo ăn uống kéo dài quá 24 giờ. Hạ phosphate máu nặng với suy giảm phosphate tế bào là không phổ biến nhưng có thể có những hậu quả nghiêm trọng tùy thuộc vào mức độ nghiêm trọng và tính mãn tính của sự suy giảm phosphate. Các triệu chứng thường không xuất hiện cho đến khi phosphate huyết tương dưới 1 mg/dL (0,32 mmol/L). Mặc dù hạ phosphate máu nặng có thể xảy ra trong quá trình điều trị DKA, các triệu chứng không phổ biến vì nó thường là cấp tính, thường không có sự thiếu hụt phosphate mãn tính trước đó. Nhiều hệ cơ quan có thể bị ảnh hưởng. Các biểu hiện bao gồm: bệnh não chuyển hóa, suy giảm co bóp cơ tim, suy hô hấp do yếu cơ hoành, rối loạn chức năng cơ với bệnh cơ gốc chi, khó nuốt và liệt ruột, và các tác động huyết học hiếm gặp bao gồm tan máu, giảm thực bào và hóa ứng động bạch cầu hạt, co cục máu đông khiếm khuyết, và giảm tiểu cầu. Hạ phosphate máu cấp tính ở bệnh nhân có suy giảm phosphate nặng từ trước có thể dẫn đến tiêu cơ vân. Hạ phosphate máu nặng liên quan đến bất kỳ triệu chứng nào trước đó nên được điều trị. Muối kali phosphate có thể được sử dụng một cách an toàn như một phương pháp thay thế hoặc kết hợp với kali clorua hoặc axetat, miễn là việc theo dõi canxi huyết thanh được thực hiện cẩn thận để tránh hạ canxi máu.
Nhiễm toan
Ngay cả nhiễm toan nặng cũng có thể hồi phục bằng liệu pháp dịch, điện giải và insulin; insulin ngăn chặn sản xuất ketoacid và cho phép các ketoacid được chuyển hóa, tạo ra bicarbonate. Điều trị giảm thể tích máu cải thiện tưới máu mô và chức năng thận, do đó làm tăng bài tiết các acid hữu cơ. Các thử nghiệm có đối chứng đã không cho thấy lợi ích lâm sàng từ việc sử dụng bicarbonate. Mối lo ngại về việc sử dụng bicarbonate trong điều trị tập trung vào bốn cân nhắc: dịch chuyển đường cong phân ly hemoglobin-oxy sang trái có thể làm giảm giải phóng oxy cho các mô và dễ dẫn đến nhiễm toan lactic; việc sử dụng bicarbonate làm tăng tốc độ kali đi vào tế bào và có thể gây hạ kali máu; việc cung cấp bicarbonate theo thâm hụt kiềm được tính toán sẽ gây thừa và có thể dẫn đến nhiễm kiềm; và bicarbonate có thể dẫn đến tình trạng nhiễm toan não nghịch lý (và gây suy giảm chức năng não) trong thời gian pH huyết tương đang được phục hồi về mức bình thường vì HCO3− kết hợp với H+; H2CO3 sau đó phân ly thành CO2 và H2O. Trong khi HCO3− chậm chạp đi qua hàng rào máu não, CO2 khuếch tán tự do, do đó có khả năng làm trầm trọng thêm tình trạng nhiễm toan não.
Nhiễm toan nặng làm giảm thể tích thông khí phút, có thể gây hạ huyết áp do giãn mạch ngoại biên, làm suy giảm chức năng cơ tim, và có thể gây đề kháng insulin. Vì những lý do này, việc sử dụng bicarbonate có thể có lợi ở những bệnh nhân hiếm gặp bị tăng kali máu đe dọa tính mạng hoặc nhiễm toan nặng bất thường (pH tĩnh mạch < 6,9) và suy giảm co bóp tim. Nếu bicarbonate được coi là cần thiết, hãy thận trọng cho 1 đến 2 mmol/kg trong 60 phút. Bicarbonate không được tiêm bolus vì nó có thể gây rối loạn nhịp tim.
Chuyển sang Tiêm Insulin Dưới da
Việc chuyển sang insulin SC và bắt đầu uống dịch nên xảy ra khi có sự cải thiện lâm sàng đáng kể và DKA đã được giải quyết. Việc không có ceton niệu không nên được sử dụng như một điểm kết thúc để xác định sự giải quyết của DKA và các bác sĩ lâm sàng phải nhận thức rằng ceton niệu kéo dài trong 1 ngày hoặc nhiều hơn có thể không phản ánh một cách đáng tin cậy sự cải thiện lâm sàng và không nên được giải thích là bằng chứng của một đáp ứng điều trị kém. Việc đo ceton trong nước tiểu bằng que thử (dựa trên phản ứng hóa học với nitroprusside), đo acetoacetate và acetone (được tạo ra bởi sự decarboxyl hóa không qua enzyme của acetoacetate) nhưng không đo BOHB. Tỷ lệ thông thường của BOHB so với acetoacetate là khoảng 3:1 hoặc 4:1 trong khi nhịn ăn, nhưng thường lớn hơn hoặc bằng 8:1 trong DKA. Với việc điều chỉnh nhiễm toan, BOHB được oxy hóa thành acetoacetate và ceton niệu kéo dài thường xảy ra trong vài giờ sau khi nồng độ BOHB huyết thanh đã trở về bình thường.
Khi nhiễm toan ceton đã được giải quyết, bệnh nhân dung nạp được đường uống, và việc chuyển sang insulin SC được lên kế hoạch, một liều insulin nền (tác dụng kéo dài hoặc trung gian) nên được tiêm ngoài insulin tác dụng nhanh hoặc ngắn. Có thể có lợi ích từ việc tiêm một liều insulin tác dụng kéo dài sớm hơn trong khi bệnh nhân vẫn đang nhận truyền insulin IV. Ví dụ, trong một nghiên cứu, 0,3 U/kg insulin glargine SC đã được tiêm trong 6 giờ đầu của quá trình quản lý và dẫn đến sự giải quyết DKA nhanh hơn. Một nghiên cứu hồi cứu không đối chứng khác cho thấy rằng việc dùng đồng thời insulin glargine (khoảng 0,4 U/kg) sớm trong quá trình điều trị DKA được dung nạp tốt, không làm tăng nguy cơ hạ đường huyết, nhưng có liên quan đến hạ kali máu thường xuyên hơn. Để ngăn ngừa tăng đường huyết tái phát, mũi tiêm SC đầu tiên nên được tiêm trước 15 đến 30 phút (với insulin tác dụng nhanh) hoặc 1 đến 2 giờ (với insulin regular) trước khi ngừng truyền insulin để cho phép có đủ thời gian để insulin được hấp thu. Mức glucose máu nên được theo dõi trước và 2 giờ sau mỗi bữa ăn, và liều insulin được điều chỉnh để duy trì nồng độ glucose máu trong khoảng 80 đến 180 mg/dL. Chế độ insulin cụ thể, liều lượng, và loại insulin SC nên tuân theo sở thích và hoàn cảnh của địa phương (xem phần Liệu pháp Insulin).
Các bước thiết yếu trong việc quản lý DKA được tóm tắt trong Hộp 21.3 và 21.4.
Hộp 21.3: Tóm tắt các Nguyên tắc Quản lý Nhiễm toan Ceton do Đái tháo đường
|
Hộp 21.4: Các Biến chứng của Điều trị
|
Phù não
Mặc dù hầu hết bệnh nhân dường như hồi phục không biến chứng sau một đợt DKA, phù não rõ ràng trên lâm sàng biểu hiện bằng sự suy giảm đột ngột tình trạng thần kinh xảy ra ở 0,5% đến 1% tất cả các đợt DKA và là nguyên nhân chính gây bệnh tật và tử vong, chiếm 60% đến 90% tất cả các trường hợp tử vong do DKA. Trong một phân tích hồi cứu bao gồm gần 7000 đợt DKA, các yếu tố nguy cơ sau đã được xác định: áp suất riêng phần carbon dioxide động mạch (pCO2) thấp và nồng độ nitơ urê huyết thanh cao khi nhập viện, và điều trị bằng bicarbonate. Ở 5% trẻ em, phù não rõ ràng trên phim chụp đã xuất hiện trước khi bắt đầu điều trị, và trong một nghiên cứu khác, một trong năm đợt phù não đã rõ ràng khi nhập viện ban đầu trước khi bất kỳ liệu pháp dịch hoặc insulin nào có thể góp phần vào sự tích tụ nước trong não. Những yếu tố nguy cơ sinh hóa này có thể chỉ đơn giản phản ánh mức độ nghiêm trọng ban đầu của các rối loạn sinh hóa. Do đó, việc tránh DKA (đặc biệt ở trẻ nhỏ) bằng cách nhận biết sớm các dấu hiệu và triệu chứng của ĐTĐ hiện là cách duy nhất để ngăn ngừa phù não, và những bệnh nhân có các đặc điểm lâm sàng và sinh hóa được mô tả trước đó cần được theo dõi cẩn thận hơn nữa.
Mặc dù được điều trị bằng các tác nhân tăng áp lực thẩm thấu (xem sau), khoảng 20% đến 25% bệnh nhân tử vong và 15% đến 35% người sống sót bị khuyết tật thần kinh vĩnh viễn. Mặc dù hầu hết bệnh nhân không có biểu hiện suy giảm thần kinh rõ ràng trong quá trình điều trị DKA, những thay đổi tinh vi về chức năng thần kinh thường có thể phát hiện được sau khi hồi phục, bao gồm các khiếm khuyết về trí nhớ, sự chú ý và chỉ số thông minh. Những thay đổi về hình thái não cũng đã được chứng minh bằng hình ảnh cộng hưởng từ (MRI).
Nguyên nhân của phù não vẫn còn gây tranh cãi. Một giả thuyết trước đó cho rằng việc truyền dịch nhanh, làm giảm đột ngột áp lực thẩm thấu huyết thanh, dẫn đến phù não do thẩm thấu (phù độc tế bào), và nhiều phác đồ điều trị khuyến cáo bù nước chậm bằng các dung dịch đẳng trương. Tuy nhiên, người ta đã quan sát thấy rằng mức độ phù não phát triển trong DKA tương quan với mức độ mất nước và tăng thông khí khi nhập viện, nhưng không tương quan với áp lực thẩm thấu ban đầu hoặc những thay đổi thẩm thấu trong quá trình điều trị. Các nghiên cứu gần đây hơn đã không cho thấy mối liên quan giữa tốc độ truyền dịch và tổn thương não và một thử nghiệm đối chứng ngẫu nhiên đa trung tâm tiền cứu lớn cho thấy cả hàm lượng muối của dịch bù (muối 0,45% so với 0,9%) lẫn tốc độ truyền của nó đều không ảnh hưởng đến sự phát triển của phù não hoặc ảnh hưởng đến các kết quả nhận thức thần kinh. Các nghiên cứu trên trẻ em và các mô hình gặm nhấm đã tìm thấy những điểm tương đồng giữa tổn thương não liên quan đến DKA và tổn thương do thiếu máu cục bộ-tái tưới máu: lưu lượng máu não thấp và sưng tế bào não, nồng độ phosphate năng lượng cao trong não thấp và nồng độ lactate tăng cao trong các đợt DKA không được điều trị, và sung huyết não và phù vận mạch trong quá trình điều trị DKA. Các nghiên cứu MRI đã cho thấy sự giảm hệ số khuếch tán biểu kiến sau khi hồi phục, cho thấy có nhiều nước quanh tế bào hơn là trong tế bào trong quá trình điều trị. Ngoài ra, tổn thương não có triệu chứng và thậm chí gây tử vong đã được báo cáo xảy ra trước khi bắt đầu điều trị DKA. Mức độ nghiêm trọng của giảm tưới máu não tự nó không đủ để gây tổn thương não; do đó, các yếu tố khác có thể góp phần. DKA cũng được biết là có liên quan đến sự gia tăng rõ rệt của các cytokine và chemokine viêm toàn thân có thể góp phần gây tổn thương não bằng cách kích hoạt nội mô mạch máu não và tăng sự bám dính của bạch cầu; và nồng độ metalloproteinase tăng cao có thể thúc đẩy rối loạn chức năng hàng rào máu não. Một giả thuyết thay thế hiện tại cho rằng giảm tưới máu não (do mất nước và tăng thông khí) và các tác động của tái tưới máu cùng với viêm thần kinh và rối loạn chức năng nội mô mạch máu não là những yếu tố chính gây ra tổn thương não liên quan đến DKA. Thời gian kéo dài và các rối loạn sinh hóa nghiêm trọng hơn trước khi điều trị có thể dẫn đến thiếu máu cục bộ não. Trẻ nhỏ sẽ dễ bị ảnh hưởng hơn do tốc độ chuyển hóa và nhu cầu oxy của não trẻ em cao hơn so với não người lớn. Ngoài ra, có thể có thời gian dài hơn để các chất thẩm thấu tự sinh tích tụ trong não. Một câu hỏi khó giải thích là nhiều trẻ em có bằng chứng tăng áp lực nội sọ trên các nghiên cứu hình ảnh (ví dụ, chụp cắt lớp vi tính hoặc MRI) phù hợp với phù não cận lâm sàng thường liên quan đến các bất thường nhẹ về trạng thái tinh thần, nhưng chỉ một số ít phát triển phù não rõ ràng trên lâm sàng.
Phù não có ý nghĩa lâm sàng thường trở nên rõ ràng trong vòng 12 giờ đầu tiên sau khi bắt đầu điều trị và khi đã có sự cải thiện về mức glucose máu, tình trạng toan kiềm, và tình trạng hydrat hóa, nhưng có thể có mặt khi nhập viện ban đầu hoặc, hiếm khi, 24 đến 48 giờ sau khi bắt đầu điều trị. Một bệnh nhân trước đó tỉnh táo có thể trở nên lơ mơ, phàn nàn về đau đầu dữ dội, phát triển các dấu hiệu thần kinh bất thường, tiến triển đến hôn mê, và bị ngừng thở với thoát vị thân não. Một tập hợp các quan sát lâm sàng tại giường có thể tạo điều kiện cho việc nhận biết phù não đang phát triển (Bảng 21.10). Mặc dù hữu ích, cần lưu ý rằng các tiêu chí do Muir và đồng nghiệp đề xuất chưa được chứng thực một cách độc lập.
Bảng 21.10: Một phương pháp chẩn đoán lâm sàng phù não dựa trên đánh giá tình trạng thần kinh tại giường
| Tiêu chí chẩn đoán | Tiêu chí chính | Tiêu chí phụ |
|---|---|---|
| • Đáp ứng vận động hoặc lời nói bất thường với cơn đau | • Tư thế mất vỏ hoặc mất não | • Liệt dây thần kinh sọ (đặc biệt là III, IV, VI) |
| • Kiểu thở thần kinh bất thường (rên, thở nhanh, thở Cheyne-Stokes, ngưng thở) | • Thay đổi tri giác/mức độ ý thức dao động | • Giảm nhịp tim kéo dài (hơn 20 nhịp/phút) không do cải thiện thể tích nội mạch hoặc giấc ngủ) |
| • Tiểu không tự chủ không phù hợp với lứa tuổi | • Nôn | • Đau đầu |
| • Lơ mơ hoặc khó đánh thức khỏi giấc ngủ | • Huyết áp tâm trương > 90 mmHg | |
| • Tuổi < 5 tuổi |
Các dấu hiệu xảy ra trước khi điều trị không nên được xem xét trong chẩn đoán phù não. Một tiêu chí chẩn đoán, hai tiêu chí chính, một tiêu chí chính và hai tiêu chí phụ có độ nhạy 92% và độ đặc hiệu 96% (tỷ lệ dương tính giả 4%).
Bảng 21.11: Các loại Chế phẩm Insulin và Hồ sơ Tác dụng Đề xuất cho Việc Tiêm dưới da
| Loại Insulin | Khởi phát Tác dụng (giờ) | Đỉnh Tác dụng (giờ) | Thời gian Tác dụng (giờ) |
|---|---|---|---|
| Analog tác dụng siêu nhanh (aspart nhanh hơn) a,c | 0.1–0.2 | 1–3 | 3–5 |
| Analog tác dụng nhanh (aspart, glulisine, và lispro) | 0.15–0.35 | 1–3 | 3–5 |
| Regular/tan (tác dụng ngắn) | 0.5–1 | 2–4 | 5–8 |
| NPH | 2–4 | 4–12 | 12–24 a |
| Analog nền tác dụng kéo dài | |||
| Glargine b | 2–4 | 8–12 | 22–24 a |
| Detemir | 12 | 4–7 | 20–24 a |
| Glargine U300 | 2–6 | Đỉnh tối thiểu | 30–36 |
| Degludec c | 0.5–1.5 | Đỉnh tối thiểu | > 42 |
NPH, Insulin Neutral protamine Hagedorn. Tất cả các loại insulin được sử dụng phải được sản xuất trong điều kiện “Thực hành Sản xuất Tốt/Thực hành Phòng thí nghiệm Tốt”.
(Nguồn: Danne, T., et al. (2018). ISPAD Clinical Consensus Guidelines 2018: Insulin treatment in children and adolescents with diabetes. Pediatr Diabetes, 19(Suppl. 27), 115–135.)
Tỷ lệ sống sót và kết quả thần kinh được cải thiện rõ rệt với việc nhận biết và can thiệp kịp thời bằng mannitol hoặc dung dịch muối ưu trương, hỗ trợ hô hấp bằng cách đặt nội khí quản, và tăng thông khí. Nhận thức cao hơn, nhận biết sớm và điều trị kịp thời giải thích cho sự suy giảm tỷ lệ tử vong được báo cáo (xem Bảng 21.10 và Hộp 21.5).
Hộp 21.5: Các Nguyên nhân Gây bệnh và Tử vong Không phổ biến hoặc Hiếm gặp khác liên quan đến Nhiễm toan Ceton do Đái tháo đường
|
Điều trị Tình trạng Tăng đường huyết Tăng áp lực thẩm thấu
Mục tiêu của liệu pháp dịch ban đầu là mở rộng thể tích trong và ngoài mạch và phục hồi tưới máu thận bình thường. Trong quá trình điều trị, việc giảm áp lực thẩm thấu huyết thanh (do tăng glucose niệu và sự hấp thu glucose qua trung gian insulin) gây ra sự di chuyển của nước ra khỏi không gian nội mạch dẫn đến giảm thể tích nội mạch; lợi tiểu thẩm thấu rõ rệt có thể tiếp tục trong nhiều giờ ở những bệnh nhân có nồng độ glucose huyết tương tăng cực cao. Sớm trong quá trình điều trị HHS, lượng dịch mất qua nước tiểu có thể đáng kể và, vì thể tích nội mạch có thể giảm nhanh chóng, tốc độ bù dịch nên nhanh hơn so với khuyến cáo cho DKA để ngăn ngừa trụy mạch. Liều bolus ban đầu nên là 20 mL/kg hoặc nhiều hơn dung dịch muối đẳng trương (0,9% NaCl) và nên giả định một sự thiếu hụt dịch khoảng 12% đến 15% trọng lượng cơ thể. Các liều dịch bolus bổ sung nên được truyền nhanh chóng, nếu cần, để phục hồi tưới máu mô đầy đủ. Sau đó, nên truyền NaCl 0,45% đến 0,75% để bù sự thiếu hụt trong 24 đến 48 giờ nhằm mục đích giảm dần nồng độ natri huyết thanh hiệu chỉnh và áp lực thẩm thấu huyết thanh. Vì các dung dịch đẳng trương hiệu quả hơn trong việc duy trì thể tích tuần hoàn, nên bắt đầu lại dung dịch muối đẳng trương nếu tình trạng tưới máu và huyết động có vẻ không đủ khi áp lực thẩm thấu huyết thanh giảm. Nồng độ natri huyết thanh nên được đo thường xuyên và nồng độ natri trong dịch IV được điều chỉnh để thúc đẩy sự giảm dần nồng độ natri huyết thanh hiệu chỉnh. Tỷ lệ tử vong có liên quan đến việc nồng độ natri huyết thanh hiệu chỉnh không giảm khi điều trị, điều này có thể là một chỉ định cho thẩm tách máu.
Mặc dù không có dữ liệu nào cho thấy tốc độ giảm tối ưu của nồng độ natri huyết thanh, 0,5 mmol/L mỗi giờ đã được khuyến nghị cho tình trạng mất nước do tăng natri máu. Chỉ với việc bù nước đầy đủ (tức là, trước khi bắt đầu liệu pháp insulin), nồng độ glucose huyết thanh sẽ giảm từ 4,1 đến 5,5 mmol/L (75–100 mg/dL) mỗi giờ. Tốc độ giảm nồng độ glucose huyết thanh nhanh hơn là điển hình trong vài giờ đầu điều trị khi thể tích mạch máu được mở rộng dẫn đến cải thiện tưới máu thận. Nếu có sự giảm nhanh liên tục của glucose huyết thanh (> 5 mmol/L, 90 mg/dL mỗi giờ) sau vài giờ đầu, hãy cân nhắc thêm 2,5% hoặc 5% glucose vào dịch bù. Việc không giảm nồng độ glucose huyết tương như mong đợi nên thúc đẩy việc đánh giá lại và đánh giá chức năng thận. Không giống như điều trị DKA, việc bù lượng dịch mất qua nước tiểu được khuyến nghị. Nồng độ natri trong nước tiểu điển hình trong quá trình lợi tiểu thẩm thấu xấp xỉ 0,45% muối; tuy nhiên, khi có lo ngại về sự đầy đủ của thể tích tuần hoàn, lượng dịch mất qua nước tiểu có thể được bù bằng một loại dịch chứa nồng độ natri cao hơn.
Liệu pháp Insulin
Trong khi giảm tưới máu mô trong HHS thường gây ra nhiễm toan lactic, nhiễm ceton thường là tối thiểu và việc sử dụng insulin sớm là không cần thiết. Chỉ riêng việc truyền dịch đã làm giảm đáng kể nồng độ glucose huyết thanh do pha loãng, cải thiện tưới máu thận dẫn đến tăng glucose niệu, và tăng hấp thu glucose ở mô với tuần hoàn được cải thiện. Tác dụng thẩm thấu của glucose trong không gian mạch máu góp phần duy trì thể tích máu; do đó, sự giảm nhanh nồng độ glucose huyết thanh và áp lực thẩm thấu sau khi sử dụng insulin có thể dẫn đến suy tuần hoàn và huyết khối tĩnh mạch trừ khi việc bù dịch đầy đủ. Bệnh nhân HHS cũng bị thiếu hụt kali cực độ; sự dịch chuyển nhanh chóng kali vào nội bào do insulin gây ra có thể gây rối loạn nhịp tim. Việc sử dụng insulin nên được bắt đầu khi hoặc nếu nồng độ glucose huyết thanh không còn giảm với tốc độ ít nhất 3 mmol/L (~ 50 mg/dL) mỗi giờ chỉ với việc truyền dịch. Tuy nhiên, ở những bệnh nhân bị nhiễm ceton và nhiễm toan nặng hơn, việc sử dụng insulin nên được bắt đầu sớm hơn. Việc truyền insulin liên tục với tốc độ 0,025 đến 0,05 U/kg/giờ có thể được sử dụng ban đầu, với liều lượng được điều chỉnh để đạt được sự giảm nồng độ glucose huyết thanh từ 3 đến 4 mmol/L (~ 50–75 mg/dL) mỗi giờ. Không khuyến nghị tiêm bolus insulin.
Điện giải
Sự thiếu hụt kali, phosphate, và magiê cũng lớn hơn trong HHS so với DKA. Việc bù kali (40 mmol/L) nên bắt đầu ngay khi nồng độ kali huyết thanh nằm trong phạm vi bình thường và chức năng thận đầy đủ đã được xác nhận. Có thể cần tốc độ bù kali cao hơn sau khi bắt đầu truyền insulin. Nồng độ kali huyết thanh nên được theo dõi mỗi 2 đến 3 giờ cùng với theo dõi điện tâm đồ. Có thể cần đo kali hàng giờ nếu bệnh nhân bị hạ kali máu. Liệu pháp bicarbonate là chống chỉ định; nó làm tăng nguy cơ hạ kali máu và có thể ảnh hưởng xấu đến việc cung cấp oxy cho mô. Hạ phosphate máu nặng có thể dẫn đến tiêu cơ vân, hội chứng tan máu urê huyết, yếu cơ, và liệt. Mặc dù việc sử dụng phosphate có liên quan đến nguy cơ hạ canxi máu, một dung dịch IV chứa hỗn hợp 50:50 kali phosphate và một muối kali khác (kali clorua hoặc kali axetat) thường cho phép bù phosphate đầy đủ trong khi tránh được hạ canxi máu có ý nghĩa lâm sàng. Nồng độ phosphate huyết thanh nên được đo mỗi 3 đến 4 giờ. Bệnh nhân HHS thường bị thiếu hụt magiê lớn, nhưng không có dữ liệu để xác định xem việc bù magiê có lợi hay không. Việc bù magiê nên được xem xét ở những bệnh nhân thỉnh thoảng bị hạ magiê máu và hạ canxi máu nặng trong quá trình điều trị. Liều khuyến nghị là 25 đến 50 mg/kg mỗi liều cho 3 đến 4 liều, tiêm mỗi 4 đến 6 giờ với tốc độ truyền tối đa là 150 mg/phút và 2 g/giờ.
Các biến chứng
Huyết khối tĩnh mạch liên quan đến việc sử dụng catheter tĩnh mạch trung tâm là một biến chứng phổ biến trong HHS. Việc sử dụng heparin liều thấp dự phòng đã được đề xuất ở người lớn, nhưng không có dữ liệu nào cho thấy lợi ích từ thực hành này. Điều trị bằng heparin nên được dành riêng cho trẻ em cần catheter tĩnh mạch trung tâm để theo dõi sinh lý hoặc tiếp cận tĩnh mạch và bất động trong hơn 24 đến 48 giờ. Tiêu cơ vân (đau cơ, yếu, và nước tiểu sẫm màu) có thể xảy ra ở trẻ em bị HHS dẫn đến suy thận cấp, tăng kali máu nặng, hạ canxi máu, và sưng cơ gây hội chứng khoang. Theo dõi nồng độ creatine kinase mỗi 2 đến 3 giờ được khuyến nghị để phát hiện sớm. Vì những lý do chưa rõ, một số trẻ em bị HHS đã có các biểu hiện lâm sàng phù hợp với tăng thân nhiệt ác tính, một tình trạng liên quan đến tỷ lệ tử vong cao. Bệnh nhân sốt liên quan đến sự gia tăng nồng độ creatine kinase có thể được điều trị bằng dantrolene, chất làm giảm giải phóng canxi từ mạng lưới cơ tương và ổn định chuyển hóa canxi trong tế bào cơ. Tuy nhiên, trong số ba bệnh nhân HHS được báo cáo điều trị bằng dantrolene, chỉ có một người sống sót. Thay đổi trạng thái tinh thần là phổ biến khi áp lực thẩm thấu huyết thanh vượt quá 330 mOsm/kg; tuy nhiên, phù não là hiếm gặp. Trong số 96 trường hợp HHS được báo cáo trong y văn năm 2010, bao gồm 32 trường hợp tử vong, chỉ có một trường hợp phù não. Sự suy giảm trạng thái tinh thần sau khi tăng áp lực thẩm thấu đã cải thiện với điều trị là bất thường và nên được điều tra ngay lập tức.
Tình trạng Tăng đường huyết Tăng áp lực thẩm thấu Hỗn hợp và Nhiễm toan Ceton do Đái tháo đường
Điều trị phải tính đến các biến chứng tiềm tàng của cả DKA và HHS. Trạng thái tinh thần phải được theo dõi chặt chẽ và việc đánh giá lại thường xuyên tình trạng tuần hoàn và cân bằng dịch là hoàn toàn cần thiết để hướng dẫn điều trị. Để duy trì thể tích tuần hoàn đầy đủ, tốc độ truyền dịch và điện giải thường vượt quá mức cần thiết cho trường hợp DKA điển hình. Insulin cần thiết để giải quyết nhiễm ceton và ngăn chặn tân tạo glucose ở gan; tuy nhiên, việc truyền insulin nên được trì hoãn cho đến sau khi bệnh nhân đã nhận được một liều bolus dịch ban đầu và tuần hoàn đã được ổn định. Nồng độ kali và phosphate huyết thanh nên được theo dõi cẩn thận như đã mô tả trước đó cho HHS (Hộp 21.6).
| Hộp 21.6: Các Nguyên tắc Quản lý Tình trạng Tăng đường huyết Tăng áp lực thẩm thấu
DKA, Nhiễm toan ceton do đái tháo đường; HHS, tình trạng tăng đường huyết tăng áp lực thẩm thấu.
|
Điều trị đái tháo đường tuýp 1
Nguyên tắc chung
Quản lý tối ưu trẻ em mắc ĐTĐ tuýp 1 (và tuýp 2) đòi hỏi một phương pháp tiếp cận tích hợp, có tính đến mức độ hoạt động chung của trẻ và gia đình, các kiểu dinh dưỡng và lối sống cụ thể của trẻ đó, và sự chú ý đến các giai đoạn phát triển chung của thời thơ ấu và thanh thiếu niên. Không có một chế độ insulin hay kế hoạch bữa ăn nào là phù hợp cho tất cả mọi người. Nguyên tắc hàng đầu nên là kế hoạch chăm sóc đái tháo đường phải phù hợp nhất có thể với môi trường gia đình và trường học xung quanh, và các nhiệm vụ chính của thời thơ ấu là giáo dục, giao tiếp xã hội, tăng trưởng và trưởng thành vẫn tiếp tục không bị cản trở bởi các trách nhiệm phụ thêm mà việc chăm sóc đái tháo đường đòi hỏi.
Nhiệm vụ khó khăn này trong việc hỗ trợ các gia đình quản lý bệnh đái tháo đường được thực hiện tốt nhất bởi một đội ngũ đa ngành, bao gồm các bác sĩ, nhà giáo dục và y tá chuyên khoa, chuyên gia dinh dưỡng, và các chuyên gia sức khỏe tâm thần, tất cả đều được đào tạo và có kinh nghiệm về các sắc thái của việc chăm sóc bệnh đái tháo đường ở trẻ em. Trẻ em bị đái tháo đường nên được đội ngũ này khám định kỳ (thường là mỗi 3 tháng ở những bệnh nhân đã ổn định) để đánh giá kiểm soát đường huyết, tăng trưởng và phát triển; đánh giá các rối loạn và biến chứng liên quan; giáo dục; khắc phục sự cố; giải quyết vấn đề; và sàng lọc các vấn đề về sự thích ứng có thể ảnh hưởng đến bệnh đái tháo đường hoặc sức khỏe tổng thể của trẻ.
Mục tiêu Điều trị
Thử nghiệm Kiểm soát và Biến chứng Đái tháo đường (DCCT) đã xác định rằng việc quản lý đường huyết tích cực dẫn đến mức glucose và A1c gần như bình thường đã làm giảm đáng kể nguy cơ phát triển các biến chứng lâu dài và lợi ích của việc giảm nguy cơ này lớn hơn nguy cơ hạ đường huyết nặng tăng gấp ba lần. Việc làm chậm sự phát triển của bệnh võng mạc sớm đã được quan sát thấy ở phân nhóm thanh thiếu niên được điều trị tích cực trong DCCT, cũng như ở người lớn trong nghiên cứu. Trong Nghiên cứu Dịch tễ học về Can thiệp và Biến chứng Đái tháo đường (EDIC), nghiên cứu theo dõi quan sát sau DCCT, sự gia tăng liên tục nguy cơ biến chứng đã được ghi nhận ở nhóm điều trị thông thường trước đây nhiều năm sau khi kết thúc thử nghiệm ngẫu nhiên có đối chứng mặc dù kiểm soát chuyển hóa đã được cải thiện ở nhóm điều trị thông thường trước đây, cho thấy rằng mức glucose và A1c gần như bình thường nên được đạt được và duy trì ở bệnh nhân ĐTĐ tuýp 1 càng sớm càng tốt trong quá trình của bệnh. Do bằng chứng này, các khuyến nghị hiện tại yêu cầu thanh thiếu niên mắc ĐTĐ tuýp 1 nên đặt mục tiêu đạt được mức glucose huyết tương và HbA1c càng gần mức bình thường càng tốt, càng sớm càng tốt trong quá trình của bệnh, và với càng ít biến cố hạ đường huyết nặng càng tốt.
Về các mục tiêu cụ thể, các hướng dẫn điều trị của ADA chỉ ra rằng mục tiêu HbA1c nên dưới 7,5% và Hiệp hội Quốc tế về Đái tháo đường Trẻ em và Vị thành niên (ISPAD) đã hạ mức này xuống dưới 7%, mặc dù cả hai bộ hướng dẫn đều nhấn mạnh việc cá nhân hóa các mục tiêu cho bệnh nhân và gia đình để cũng giảm thiểu hạ đường huyết và nâng cao chất lượng cuộc sống. Trước đây, mức HbA1c cao hơn đã được đề xuất cho trẻ rất nhỏ do nguy cơ tiềm tàng của hạ đường huyết tái phát đối với não đang phát triển. Có nhiều vấn đề với cách tiếp cận này, bao gồm cả bằng chứng ngày càng tăng cho thấy tăng đường huyết mãn tính cũng có hại cho não đang phát triển và rằng HbA1c thấp hơn có thể đạt được mà không làm tăng nguy cơ hạ đường huyết nặng ở trẻ em dưới 6 tuổi.
Các loại Insulin
Các loại insulin hiện có được phân loại dựa trên thời gian tác dụng là tác dụng nhanh, ngắn, trung bình và kéo dài, và mỗi loại đều có nồng độ 100 U/mL (U-100). Một nồng độ cao hơn (U-500) của insulin regular người có sẵn cho bệnh nhân bị đề kháng insulin nặng. Các dung dịch pha loãng phù hợp có thể được chuẩn bị cho những bệnh nhân trẻ tuổi cần liều thấp. Sự phát triển của công nghệ DNA tái tổ hợp để tổng hợp insulin người và các chất tương tự insulin người đã thay đổi bộ mặt của việc điều trị bằng insulin.
Mục tiêu của liệu pháp thay thế insulin là mô phỏng mô hình bài tiết insulin bình thường càng sát càng tốt (Hình 21.11). Mục tiêu này có thể đạt được tốt nhất thông qua việc sử dụng liệu pháp nền-bolus bằng MDI hoặc liệu pháp truyền insulin dưới da liên tục (CSII) bằng bơm. Cho đến gần đây, các lựa chọn về công thức insulin còn hạn chế. Ngày nay, có hơn 10 loại insulin người sinh tổng hợp và insulin analog, bao gồm insulin regular người, insulin neutral protamine Hagedorn (NPH) người, các chất tương tự insulin tác dụng kéo dài, các chất tương tự insulin tác dụng nhanh, và một số loại insulin trộn sẵn (xem Bảng 21.11).
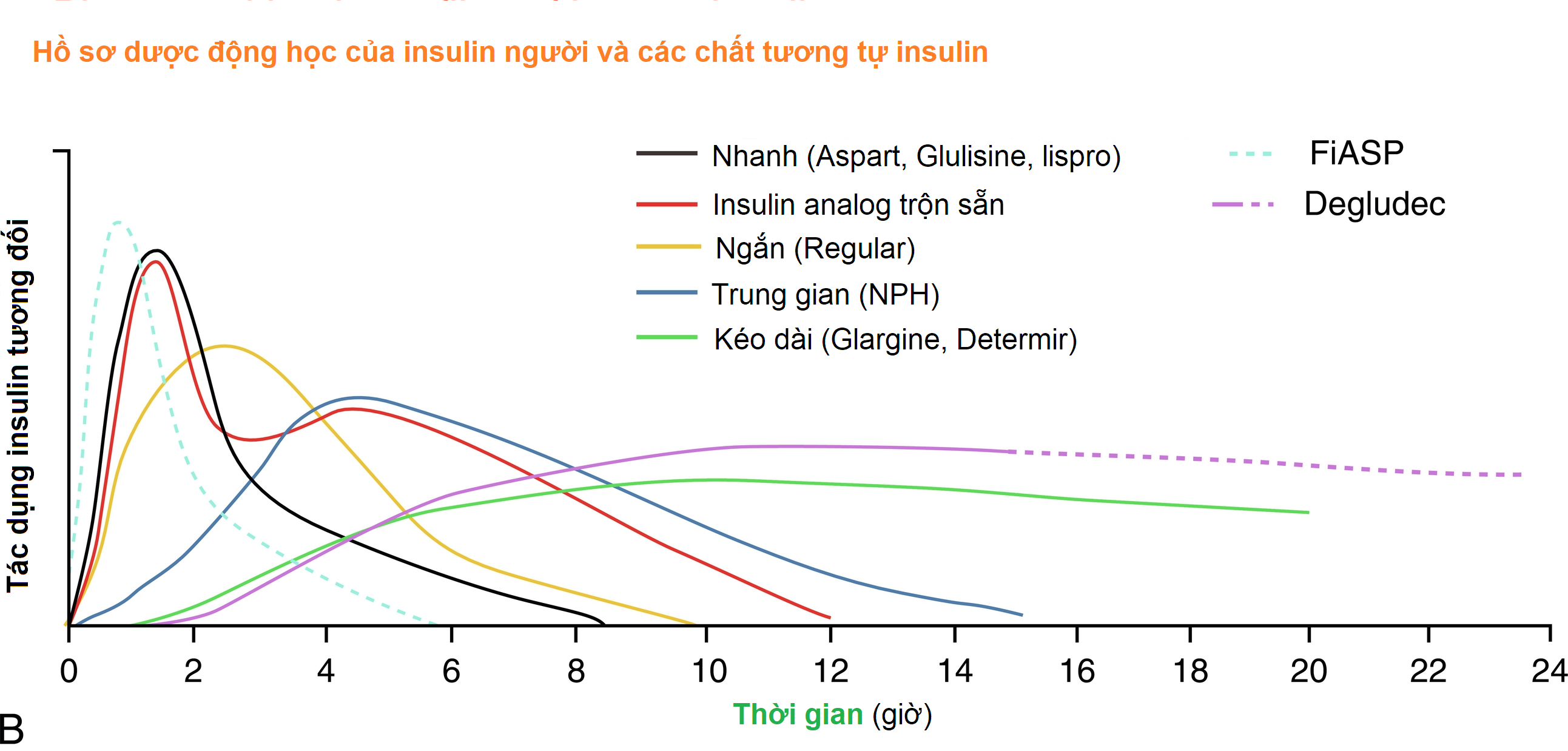
Hình 21.11 A, Biểu diễn mối quan hệ bình thường giữa việc ăn uống, glucose máu, và nồng độ insulin huyết thanh. Lưu ý rằng nồng độ glucose được duy trì trong khoảng 80 và 140 mg/dL. Cũng lưu ý sự giải phóng chính xác của insulin đã đi qua tuần hoàn cửa đồng bộ với và tỷ lệ thuận với sự dao động đường huyết do thức ăn gây ra. So sánh và đối chiếu các mô hình này với mô hình thời gian tác dụng của insulin sau khi tiêm dưới da insulin aspart/glulisine/lispro, regular, NPH, và glargine/detemir. B, Hồ sơ dược động học của insulin người và các chất tương tự của nó. Các hồ sơ dược động học của một số chế phẩm insulin hiện đang được sử dụng được trình bày một cách sch. Insulin aspart tác dụng nhanh (FiASP) và chất tương tự tác dụng kéo dài (Degludec) đã được chèn thủ công phù hợp với dữ liệu hiện có. Những hình này mang tính minh họa và tương ứng với các khung thời gian trong Bảng 21.11. (B, Chỉnh sửa từ Brunton, S.A. (2013). Integrating advances in insulin into clinical practice. J Fam Pract, 62(9 Suppl Insulin), S2–S18).
Insulin Regular Người
Insulin regular người là một trụ cột trong quản lý insulin của thanh thiếu niên mắc ĐTĐ tuýp 1 cho đến đầu những năm 2000 khi sự ra đời của các chất tương tự insulin tác dụng nhanh gần như đã loại bỏ việc sử dụng nó ở trẻ em và thanh thiếu niên, ngoại trừ việc tiêm tĩnh mạch. Sự hấp thu chậm và thời gian tác dụng kéo dài của các liều bolus insulin regular lớn trước bữa ăn mà thanh thiếu niên mắc ĐTĐ tuýp 1 cần để vượt qua sự đề kháng insulin của tuổi dậy thì đã góp phần vào các vấn đề về tăng và hạ đường huyết ở nhóm tuổi này. Insulin regular vẫn là insulin được lựa chọn để truyền tĩnh mạch trong điều trị DKA. Một công thức đặc biệt U-500 (500 đơn vị/mL) của insulin regular có sẵn để sử dụng ở những bệnh nhân bị đề kháng insulin nặng cần liều insulin hàng ngày rất lớn.
Các Analog Tác dụng Nhanh
Insulin lispro (Eli Lilly), aspart (Novo Nordisk), và glulisine (Sanofi) được sản xuất bằng cách thay thế các acid amin ở vùng C-cuối của chuỗi B làm giảm ái lực của các phân tử insulin tự kết tụ thành các hexamer. Những sửa đổi này cho phép hấp thu analog vào máu nhanh hơn sau khi tiêm dưới da. Một loại insulin tác dụng nhanh mới, Fiasp (Fast insulin aspart, Novo Nordisk) gần đây đã được phê duyệt để sử dụng ở trẻ em. So với insulin regular, sự hấp thu nhanh hơn của các analog tác dụng nhanh dẫn đến các đỉnh cao hơn và sắc nét hơn và thời gian tác dụng ngắn hơn, các tác động dược động học và dược lực học làm giảm nguy cơ hạ đường huyết sau ăn muộn và làm dịu đi tình trạng tăng đường huyết sau bữa ăn sớm. Tuổi dậy thì dường như không làm thay đổi dược động học của các liều bolus trước bữa ăn của các analog nhanh, nhưng sự đề kháng insulin của tuổi dậy thì làm giảm khả năng của các loại insulin này trong việc kích thích chuyển hóa glucose. Insulin tác dụng nhanh có thể được trộn một cách an toàn với các loại insulin tác dụng trung gian, nhưng không khuyến nghị trộn với insulin tác dụng kéo dài, vì việc trộn như vậy làm giảm đáng kể tác dụng đỉnh của analog tác dụng nhanh. Cả ba analog tác dụng nhanh đều có thể được sử dụng trong bơm insulin, và các nghiên cứu đã cho thấy chúng an toàn và hiệu quả. Insulin lispro và aspart có thể được pha loãng đến nồng độ thấp hơn U-100, chẳng hạn như U-50 hoặc U-25, bằng cách sử dụng các chất pha loãng do nhà sản xuất cung cấp. Insulin pha loãng được sử dụng ở trẻ rất nhỏ và những người khác nhạy cảm với insulin và có thể được hưởng lợi từ việc định liều chính xác hơn. Các analog insulin tác dụng nhanh có thể được tiêm tĩnh mạch, nhưng chúng chưa được chứng minh là vượt trội hơn insulin regular. Một analog insulin mới hơn là Fiasp, có khởi phát tác dụng và đỉnh hơi nhanh hơn và thời gian tác dụng ngắn hơn.
Insulin Tác dụng Trung gian
NPH hiện là insulin tác dụng trung gian duy nhất có sẵn. Mặc dù sự chậm trễ trong tác dụng đỉnh của NPH được tiêm trước bữa sáng cung cấp một phương tiện để bao phủ các dao động glucose vào giờ ăn trưa, NPH không hoàn toàn thỏa đáng cho việc thay thế insulin nền qua đêm. Cũng như insulin regular, sự ra đời của các analog insulin tác dụng kéo dài đã thay thế phần lớn NPH trong điều trị MDI nền-bolus trong nhi khoa. Tuy nhiên, NPH vẫn là một loại insulin có thời gian tác dụng trung gian hiệu quả, đặc biệt hữu ích trong các trường hợp đặc biệt, chẳng hạn như tuân thủ kém và ở những người có điều kiện kinh tế khó khăn hơn.
Các Analog Insulin Tác dụng Kéo dài
Glargine (Lantus do Sanofi sản xuất) và detemir (Levemir do Novo Nordisk sản xuất) là hai analog insulin tác dụng kéo dài đầu tiên có sẵn trên thị trường được phát triển để đáp ứng nhu cầu insulin nền của cơ thể để điều hòa sản xuất glucose ở gan. Insulin glargine là một analog của insulin người với sự kéo dài C-cuối của chuỗi beta bởi hai gốc arginine và sự thay thế asparagine ở vị trí A21 bằng glycine. Analog này tan trong dung dịch axit mà nó được đóng gói nhưng tương đối không tan trong pH sinh lý của dịch ngoại bào. Do đó, các vi kết tủa của insulin glargine được hình thành sau khi tiêm dưới da, làm chậm đáng kể sự hấp thu của nó vào tuần hoàn hệ thống. Tác dụng của insulin detemir được kéo dài bằng cách thêm một chuỗi bên acid béo thúc đẩy sự liên kết thuận nghịch với albumin trong dịch kẽ và trong tuần hoàn.
Các nghiên cứu dược động học và dược lực học đã chứng minh rằng các analog insulin tác dụng kéo dài này có hồ sơ thời gian-tác dụng phẳng và kéo dài. Tuy nhiên, so với glargine, detemir đã được chứng minh là có hồ sơ dược động học nhất quán hơn ở trẻ em và hồ sơ dược lực học nhất quán hơn ở người lớn mắc ĐTĐ tuýp 1. Việc thay thế insulin nền bằng insulin detemir thường có nhiều khả năng cần tiêm hai lần mỗi ngày hơn so với điều trị bằng insulin glargine.
Insulin degludec là một loại insulin tác dụng siêu dài mới, là sản phẩm của việc kết hợp insulin Des-B30 threonine với các chuỗi bên acid béo. Sau khi tiêm, degludec tự kết hợp, tạo thành các chuỗi insulin dài phân ly rất chậm. Nồng độ insulin trong huyết tương tăng lên đạt nồng độ đỉnh sau 10 đến 12 giờ sau khi tiêm và thời gian bán thải là từ 17 đến 21 giờ, gần gấp đôi thời gian tác dụng của insulin glargine. Degludec đã được chứng minh là an toàn và hiệu quả ở trẻ em và thanh thiếu niên mắc ĐTĐ tuýp 1.
Insulin Trộn sẵn
Nhiều công thức insulin trộn sẵn khác nhau, kết hợp cả analog insulin tác dụng nhanh hoặc insulin regular với NPH hoặc analog insulin tác dụng trung gian, hiện đang có sẵn. Tỷ lệ phần trăm tác dụng nhanh/regular so với tác dụng trung gian thay đổi theo công thức. Lợi thế thực tế của insulin trộn sẵn để đáp ứng cả nhu cầu insulin ngắn hạn và trung hạn trong một lần tiêm cũng là hạn chế lớn nhất của chúng. Có ít sự linh hoạt hơn khi sử dụng insulin trộn sẵn để điều chỉnh các thành phần insulin riêng lẻ, và điều này có thể đặc biệt có vấn đề ở trẻ nhỏ hoặc những người có lượng thức ăn thay đổi. Việc sử dụng insulin trộn sẵn thường được giới hạn ở những bệnh nhân và gia đình gặp khó khăn trong việc quản lý các chế độ điều trị phức tạp hơn hoặc trong các môi trường có nguồn lực hạn chế.
Xi lanh so với Bút tiêm
Xi lanh insulin có nhiều kích cỡ khác nhau, đặc biệt hữu ích ở trẻ nhỏ. Ngoài xi lanh 100 đơn vị (1 mL) truyền thống được đánh dấu theo từng 2 đơn vị, còn có các xi lanh 50 đơn vị (0,5 mL) và 30 đơn vị (0,3 mL) được đánh dấu theo từng đơn vị, và cũng có thể đặt hàng các xi lanh 30 đơn vị có vạch chia 1/2 đơn vị. Những xi lanh này có sẵn với chiều dài kim từ 8 đến 13 mm. Bút tiêm insulin cũng có sẵn, cả dạng bút dùng một lần và bút tái sử dụng với hộp mực dùng một lần. Việc định liều nửa đơn vị có sẵn và có thể hữu ích ở trẻ nhỏ hơn.
Khởi đầu Liệu pháp Insulin
Hầu hết các bệnh nhân mới được chẩn đoán có triệu chứng của bệnh đái tháo đường hoặc đang trong tình trạng DKA cần hơn 1 U/kg/ngày khi bắt đầu điều trị bằng insulin. Đối với những bệnh nhân không có triệu chứng được chẩn đoán “tình cờ” mắc bệnh đái tháo đường, ví dụ, trong một cuộc kiểm tra sức khỏe thể thao định kỳ hoặc một cuộc kiểm tra sức khỏe trẻ em, liều khởi đầu có thể chỉ cần khoảng 0,5 U/kg/ngày hoặc ít hơn. Mục tiêu của liệu pháp insulin ban đầu ở trẻ em mắc ĐTĐ tuýp 1 nên là đạt được tình trạng gần như bình thường đường huyết trong vài tuần đầu điều trị để cho trẻ có cơ hội bước vào giai đoạn “trăng mật”, hoặc giai đoạn thuyên giảm một phần. Giai đoạn trăng mật là kết quả của sự kết hợp giữa chức năng cải thiện của các tế bào beta còn lại và sự đảo ngược của tình trạng đề kháng insulin đi kèm với bệnh đái tháo đường không được kiểm soát. Việc đạt được kiểm soát tối ưu một cách nhanh chóng chứ không phải là các phương pháp được sử dụng để đạt được kiểm soát tốt dường như là yếu tố quan trọng nhất trong việc đạt được những kết quả này. Khả năng đạt được mức A1c mục tiêu với ít hoặc không có hạ đường huyết nặng được tăng cường đáng kể ở những bệnh nhân ĐTĐ tuýp 1 có chức năng tế bào beta còn lại.
Một số trung tâm cho tất cả các bệnh nhân mới được chẩn đoán nhập viện để được giáo dục ban đầu về bệnh đái tháo đường và điều chỉnh liều insulin, nhưng những trung tâm khác có các phác đồ điều trị ngoại trú hiệu quả. Trong 2 đến 3 tuần sau khi xuất viện, liều insulin được điều chỉnh theo các giá trị glucose mục tiêu trước bữa ăn từ 70 đến 130 mg/dL thông qua liên lạc qua điện thoại hàng ngày; bệnh nhân được khám theo dõi tại phòng khám, khoảng 2, 6, 13, 26, 39 và 52 tuần sau khi chẩn đoán.
Các Chế độ Insulin
Nồng độ insulin huyết tương ở những người không bị đái tháo đường được đặc trưng bởi nồng độ nền tương đối thấp, trên đó có các đỉnh nồng độ insulin tăng vọt do bữa ăn kích thích. Các chế độ điều trị tích cực hiện tại cố gắng mô phỏng mô hình biến động insulin huyết tương này bằng cách sử dụng phương pháp nền-bolus để thay thế insulin. Vì insulin ngoại sinh được tiêm hoặc truyền dưới da chứ không phải trực tiếp vào tĩnh mạch cửa, tốc độ hấp thu của chúng có thể thay đổi. Ngoài ra, liều được tiêm được xác định theo kinh nghiệm, do đó nó thiếu sự chính xác của insulin được tiết ra nội sinh. Do đó, không có chế độ thay thế insulin nào sẽ sao chép chính xác mô hình bài tiết insulin bình thường; sẽ có những giai đoạn nồng độ insulin huyết tương tăng cao có thể gây hạ đường huyết và những giai đoạn nồng độ insulin thấp dẫn đến tăng đường huyết. Do đó, mục tiêu của các chế độ insulin hiện tại là giảm thiểu tần suất và mức độ nghiêm trọng của các dao động vào phạm vi tăng và hạ đường huyết.
DCCT và nghiên cứu theo dõi của nó, các nghiên cứu EDIC, đã thiết lập liệu pháp nền-bolus sử dụng MDI hoặc CSII làm tiêu chuẩn vàng trong điều trị ĐTĐ tuýp 1. Tuy nhiên, insulin chỉ hoạt động nếu trẻ nhận được nó, và các yếu tố khác phải được giải quyết khi xác định chế độ insulin tốt nhất cho một bệnh nhân cụ thể. Những yếu tố này bao gồm sự sẵn có của một người lớn là cha mẹ/người giám hộ để giám sát việc tiêm insulin, khả năng đếm carbohydrate và theo dõi mức glucose bằng máy đo glucose hoặc máy theo dõi glucose liên tục (CGM), và sự sẵn lòng đeo bơm hoặc tiêm bốn lần hoặc nhiều hơn mỗi ngày.
Các Chế độ Tiêm Nhiều mũi Hàng ngày
Các chế độ MDI cố gắng sao chép sự bài tiết insulin bình thường thông qua việc sử dụng một analog insulin tác dụng kéo dài để thay thế nhu cầu insulin nền cùng với các liều tiêm bolus của analog insulin tác dụng nhanh để bao phủ lượng thức ăn ăn vào và để điều chỉnh sự tăng cao của mức glucose máu. Có thể sử dụng bao phủ insulin nền một hoặc hai lần mỗi ngày. Thông thường, insulin nền chiếm khoảng 40% đến 50% tổng liều insulin hàng ngày (TDD). Tuy nhiên, trẻ em dưới 5 tuổi thường cần liều insulin nền là 30% đến 40% TDD, và có sự thay đổi đáng kể giữa các bệnh nhân. Glargine hoặc detemir tiêm một lần mỗi ngày có thể được tiêm vào buổi sáng hoặc buổi tối. Bệnh nhân được điều trị bằng detemir có thể có nhiều khả năng cần tiêm hai lần mỗi ngày hơn so với những người được điều trị bằng glargine. Một số bác sĩ nhi khoa trộn insulin tác dụng kéo dài và nhanh để giảm số lần tiêm, nhưng các nghiên cứu chỉ ra rằng việc trộn như vậy làm giảm và trì hoãn đáng kể sự hấp thu và tác dụng của thành phần insulin tác dụng nhanh trong hỗn hợp.
Bất kỳ một trong các analog insulin tác dụng nhanh nào cũng có thể được sử dụng để đáp ứng nhu cầu insulin bolus. Lý tưởng nhất, bolus insulin tác dụng nhanh được tiêm 10 đến 15 phút trước khi ăn, nhưng đây là một mục tiêu khó đạt được ở nhiều thanh thiếu niên mắc ĐTĐ tuýp 1. Để định liều bolus insulin chính xác nhất, cần sử dụng tỷ lệ insulin-carbohydrate (ICR) và độ nhạy insulin hoặc hệ số điều chỉnh, cũng như tốc độ và hướng thay đổi của mức glucose cảm biến ở những bệnh nhân sử dụng các thiết bị theo dõi glucose liên tục. ICR được định nghĩa là số gam carbohydrate mà 1 đơn vị insulin sẽ bao phủ. Tỷ lệ này có thể được xác định bằng cách sử dụng quy tắc 500, cụ thể là, chia 500 cho TDD sẽ cho một điểm khởi đầu cho tỷ lệ carbohydrate. Ví dụ, ở một thiếu niên có TDD là 50 đơn vị, 1 đơn vị insulin sẽ bao phủ 10 gam carbohydrate (500/50 = 10). Cũng cần lưu ý rằng ICR thường khác nhau theo thời gian trong ngày vì thường cần nhiều insulin hơn cho mỗi gam carbohydrate trước bữa sáng và có thể tiêm ít hơn để bao phủ các bữa ăn nhẹ trước khi đi ngủ. Đây là những hướng dẫn nhằm cá nhân hóa liều insulin dựa trên kết quả glucose. Sự chính xác trong việc xác định hàm lượng carbohydrate của bữa ăn là vô cùng quan trọng nhưng thường là một vấn đề ở thanh thiếu niên. Thanh thiếu niên có xu hướng đánh giá thấp số lượng carbohydrate trong bữa ăn của họ, và các cuộc gặp gỡ bồi dưỡng với một chuyên gia dinh dưỡng có thể củng cố tầm quan trọng của việc duy trì sự thành thạo kỹ năng này. Ngoài ra, carbohydrate không phải là nguồn dinh dưỡng duy nhất cần insulin để chuyển hóa tối ưu; có các công thức để điều chỉnh nhu cầu insulin cho hàm lượng protein và chất béo. Ngoài việc bao phủ bữa ăn, một liều điều chỉnh insulin tác dụng nhanh nên được tiêm vào giờ ăn để “sửa chữa” mức glucose máu tăng cao. Các liều điều chỉnh cũng có thể được tiêm vào các thời điểm khác trong ngày vì cùng một lý do. Các liều insulin “thang trượt” truyền thống dựa trên mức glucose máu đã nhường chỗ cho các thuật toán định liều phức tạp hơn dựa trên một yếu tố nhạy cảm insulin (ISF); cụ thể là, glucose máu sẽ giảm bao nhiêu bởi 1 đơn vị insulin. ISF có thể được xác định bằng cách sử dụng quy tắc 1800: chia 1800 cho TDD. Liều điều chỉnh sau đó có thể được tính theo phương trình sau: (Glucose máu thực tế (BG) – BG mục tiêu) / ISF = Số đơn vị insulin Dù được tính toán ban đầu như thế nào, ICR và ISF sau đó được điều chỉnh dựa trên kết quả theo dõi glucose.
Những ưu điểm đặc biệt của các chế độ MDI nền-bolus là chúng cố gắng phản ánh mô hình sinh lý của sự bài tiết insulin, tăng tính linh hoạt trong thời gian và quy mô bữa ăn, và cung cấp nhiều cơ hội hơn để “điều chỉnh hướng đi” trong ngày để đáp ứng với các dao động glucose bất thường. Một nhược điểm đặc biệt của các chế độ này là chúng đòi hỏi một số lượng lớn các mũi tiêm hàng ngày. Thật vậy, do hồ sơ thời gian-tác dụng phẳng của các analog insulin nền tác dụng kéo dài, điều trị MDI nền-bolus đặt nặng vấn đề tuân thủ liều bolus trước bữa ăn. Nếu không có liều bolus insulin tác dụng nhanh, chỉ riêng insulin nền tác dụng kéo dài không thể ngăn chặn tình trạng tăng đường huyết sau ăn rõ rệt. Tuy nhiên, việc tuân thủ nghiêm ngặt liều bolus trước bữa ăn là khó khăn đối với thanh thiếu niên mắc ĐTĐ tuýp 1, ngay cả khi nó được thực hiện dễ dàng nhất có thể với một bơm insulin. Đây là một số lý do tại sao mức A1c trung bình ở bệnh nhân nhi, đặc biệt là thanh thiếu niên, mắc ĐTĐ tuýp 1, vẫn cao hơn nhiều so với các mức mục tiêu được khuyến nghị bởi ADA và ISPAD (Hộp 21.7).
Hộp 21.7: Khuyến nghị về Mục tiêu Đường huyết và Glucose máu
ADA, Hiệp hội Đái tháo đường Hoa Kỳ; BG, glucose máu; CGM, theo dõi glucose liên tục; HbA1c, hemoglobin A1c; ISPAD, Hiệp hội Quốc tế về Đái tháo đường Trẻ em và Vị thành niên; NICE, Viện Sức khỏe và Chăm sóc Xuất sắc Quốc gia.
| Mục tiêu HbA1c | HbA1c < 53 mmol/mol (< 7,0%) | |
| • “Mục tiêu này phải được cá nhân hóa với mục tiêu đạt được một giá trị càng gần bình thường càng tốt trong khi tránh hạ đường huyết nặng, hạ đường huyết nhẹ đến trung bình thường xuyên, và căng thẳng/gánh nặng quá mức cho trẻ bị đái tháo đường và gia đình của họ” | ||
| • “Các yếu tố phải được xem xét khi đặt mục tiêu cá nhân hóa bao gồm, nhưng không giới hạn ở:”, | ||
| • “Tiếp cận công nghệ, bao gồm bơm và CGM” | ||
| • Khả năng diễn đạt các triệu chứng của hạ đường huyết và tăng đường huyết | ||
| • Tiền sử hạ đường huyết nặng/không nhận biết hạ đường huyết | ||
| • Tiền sử tuân thủ điều trị | ||
| • Trẻ là người có mức glycate hóa cao hay thấp | ||
| • “Trẻ có tiếp tục sản xuất insulin nội sinh không (ví dụ, trong giai đoạn mới khởi phát hoặc “trăng mật” của bệnh đái tháo đường)” | ||
| Các yếu tố cần thiết để quản lý đường huyết thành công | • Đo HbA1c ít nhất hàng quý | |
| • Theo dõi glucose bằng CGM hoặc tự theo dõi BG lên đến 6 đến 10 lần mỗi ngày | ||
| • Xem xét thường xuyên các giá trị glucose với việc điều chỉnh liệu pháp khi cần thiết | ||
| Mục tiêu đường huyết | Mục tiêu A1c của NICE | |
| < 48 mmol/mol (< 6,5%) | ||
| Trước bữa ăn | 4,0–7,0 mmol/L (70–126 mg/dL) | |
| Sau bữa ăn | 5,0–9,0 mmol/L (90–162 mg/dL) | |
| Trước khi ngủ | 4,0–7,0 mmol/L (70–126 mg/dL) |
(Nguồn: DiMeglio, L.A., Acerini, C.L., Codner, E., Craig, M.E., Hofer, S.E., Pillay, K., Maahs, D.M. (2018). ISPAD Clinical Practice Consensus Guidelines 2018: glycemic control targets and glucose monitoring for children, adolescents, and young adults with diabetes. Pediatr Diabetes, 19 (Suppl 27), 105–114.)
Liệu pháp Bơm Insulin
CSII được cung cấp bởi các loại bơm có mức độ phức tạp khác nhau đã trở thành một phương tiện điều trị tiêu chuẩn cho trẻ em bị đái tháo đường. Một số lợi ích thực tế của CSII so với MDI được liệt kê trong Hộp 21.8. Một nguy cơ cụ thể của liệu pháp bơm là việc gián đoạn cung cấp insulin do tai nạn hoặc cố ý kéo dài trong vài giờ có thể dẫn đến sự phát triển của ceton và DKA vì bệnh nhân chỉ nhận được insulin tác dụng nhanh. Nguy cơ này có thể được giảm bớt hoặc loại bỏ bằng cách kiểm tra glucose máu thường xuyên và để tạo điều kiện cho việc kiểm tra glucose máu, nhiều loại thiết bị đã được phát triển. Việc liên kết các thiết bị này với các bơm và thuật toán đã dẫn đến sự ra đời của các hệ thống cung cấp insulin tự điều chỉnh, đang được cải tiến liên tục và được tích hợp vào thực hành hàng ngày như được trình bày chi tiết sau đây.
Hộp 21.8: Các Lợi ích Thực tế của Việc Truyền Insulin Dưới da Liên tục
- Tốc độ truyền nền có thể điều chỉnh lên đến mỗi 30 phút
- Tốc độ nền tạm thời có thể lập trình
- Các hồ sơ tốc độ nền thay thế có thể lập trình trước
- Một vị trí đặt mỗi 2 đến 3 ngày (so với nhiều mũi tiêm mỗi ngày)
- Máy tính liều
- Chức năng lịch sử bơm và khả năng tải dữ liệu lên các hệ thống quản lý dữ liệu
- Các liều bolus sóng vuông và sóng kép có thể tùy chỉnh
- Khả năng lập trình tốc độ nền tạm thời cho những ngày bị bệnh và trong và sau khi tập thể dục
- Khả năng cung cấp các liều insulin rất nhỏ (0,025–0,05 đơn vị)
Một chương hướng dẫn của ISPAD gần đây tập trung vào công nghệ đái tháo đường.
Các ứng cử viên lý tưởng cho liệu pháp bơm bao gồm các gia đình có động lực, cam kết theo dõi glucose máu ít nhất 4 lần mỗi ngày và có hiểu biết cơ bản về quản lý bệnh đái tháo đường, đặc biệt là đếm carbohydrate và sử dụng ICR và ISF để tính toán liều insulin.
Hầu hết các bơm insulin hiện có là các bơm “thông minh” trong đó cả ICR và ISF đều được lập trình để tạo ra một máy tính bolus. Một số bơm có khả năng nhận và tích hợp các giá trị glucose máu vào máy tính bolus của chúng thông qua một liên kết không dây với một máy đo glucose máu cụ thể. Các liều bolus có thể được tiêm trong vài phút hoặc dưới dạng các liều bolus sóng vuông và sóng kép trong một khoảng thời gian dài hơn. Lý tưởng nhất, các liều bolus nên được cung cấp 10 đến 15 phút trước bữa ăn để giảm thiểu các dao động sau bữa ăn. Ở trẻ nhỏ và những người kén ăn, một liều bolus insulin mồi nhỏ có thể được tiêm trước bữa ăn để bao phủ các mức glucose trên mục tiêu và lượng carbohydrate sẽ được ăn một cách đáng tin cậy, sau đó là các liều bolus bổ sung tùy thuộc vào số lượng carbohydrate thực sự được tiêu thụ.
Nhu cầu insulin nền được bao phủ bởi insulin tác dụng nhanh, được cung cấp thông qua một “mô hình nền” được lập trình sẵn. Mô hình này có thể được tạo thành từ nhiều tốc độ khác nhau, cho phép một mô hình cung cấp insulin nền tăng giảm. Ngoài ra, hầu hết các bơm cho phép nhiều mô hình nền 24 giờ được lập trình sẵn và lưu trong bộ nhớ. Ví dụ, một số thanh thiếu niên có một mô hình nền cho những ngày đi học và một mô hình cho cuối tuần để tính đến xu hướng thức dậy muộn hơn nhiều vào cuối tuần và ngày lễ. Cuối cùng, có thể thực hiện các thay đổi tạm thời đối với mô hình insulin nền, đây có thể là một công cụ hiệu quả để đối phó với việc tập thể dục hoặc quản lý những ngày bị bệnh.
Các Chế độ Điều trị Dựa trên CSII
Do vai trò ngày càng quan trọng của chúng trong việc quản lý ĐTĐ tuýp 1 ở thời thơ ấu, một mô tả và thảo luận chi tiết về liệu pháp bơm sẽ theo sau phần này; Hộp 21.8 tóm tắt một số yếu tố chính của liệu pháp bơm. Các đề xuất thực tế để bắt đầu liệu pháp cảm biến được trình bày trong Hộp 21.9. Việc liên kết liệu pháp CSII với các cảm biến cấy ghép tạo thành một bước quan trọng trong việc thiết lập một “hệ thống vòng kín” như được trình bày chi tiết dưới đây.
Hộp 21.9: Các Gợi ý Thực tế để Bắt đầu Liệu pháp Cảm biến
Đào tạo ban đầu về cách đặt và tuân thủ
- Dành đủ thời gian khi bắt đầu liệu pháp cảm biến
- Đảm bảo kỹ thuật đặt đúng
- Thảo luận về việc sử dụng các sản phẩm dính bổ sung:
- Khăn lau: skin tac IV prep, skin prep
- Băng và rào cản: tegaderm, IV-3000, hypafix (Một Chuyên gia Giáo dục Đái tháo đường (CDE) được đào tạo tại Hoa Kỳ nên xác minh tên thương hiệu hiện tại trong toàn bộ danh sách)
- Băng quấn bên ngoài: Coban, PreWrap
- Thảo luận về việc sử dụng các chất tẩy keo:
- unisolve hoặc detachol
- thuốc mỡ (dầu em bé)
Hiệu chuẩn (nếu cần)
- Thảo luận về tần suất và thời gian lý tưởng để hiệu chuẩn
- Xem xét lịch trình hiệu chuẩn phòng ngừa: khuyến khích hiệu chuẩn ba lần một ngày (ví dụ, trước bữa sáng, bữa tối và trước khi đi ngủ)
- Thảo luận về việc hiệu chuẩn khi glucose tương đối ổn định (không có mũi tên, không có thay đổi nhanh trên biểu đồ glucose cảm biến)
Cảnh báo và báo động
- Cân nhắc tắt cảnh báo khi bắt đầu liệu pháp cảm biến
- Cá nhân hóa cảnh báo và sử dụng ngưỡng rộng lúc đầu (tức là, 70–250 mg/dL )
- Điều chỉnh theo thời gian:
- với hạ đường huyết tái phát, đặt cảnh báo thấp trước
- với kiểm soát không tối ưu, đặt cảnh báo cao trước
- Sử dụng một cách thận trọng các cảnh báo về tốc độ thay đổi hoặc dự đoán
- đề xuất chỉ những cảnh báo sẽ kích hoạt sự can thiệp tích cực của người dùng
Dữ liệu thời gian thực
- Thảo luận về việc sử dụng dữ liệu cảm biến không bổ trợ
- Thảo luận về các khuyến nghị về liều insulin/điều chỉnh hành vi dựa trên các giá trị và xu hướng glucose của cảm biến
- Thảo luận về việc chuyển dữ liệu lên “đám mây”
Xem xét hồi cứu
- Khuyến khích tải xuống và xem xét dữ liệu thường xuyên
- Khuyến khích sửa đổi liều insulin/hành vi dựa trên các đánh giá dữ liệu hồi cứu
Việc sử dụng bơm insulin (CSII) đã tăng lên đáng kể ở trẻ em và thanh thiếu niên mắc ĐTĐ tuýp 1 kể từ những năm 1990. Nhóm nghiên cứu T1D Exchange đã báo cáo rằng 33% trẻ em dưới 6 tuổi, 47% trẻ em từ 6 đến 12 tuổi, 50% thanh thiếu niên từ 13 đến 17 tuổi, và 52% bệnh nhân từ 18 đến 25 tuổi đã sử dụng bơm insulin trong nhóm thuần tập gồm 20.555 người tham gia (11.641 người < 18 tuổi) từ Hoa Kỳ. Con số này tương đương với 44,4% trong số 16.570 trẻ em và thanh thiếu niên từ sổ đăng ký quốc tế SWEET, và với nhiều quốc gia khác trong Liên minh Châu Âu và Israel báo cáo việc sử dụng bơm insulin tương tự ở trẻ em và thanh thiếu niên. Một số trung tâm nhi khoa cấp ba báo cáo việc sử dụng bơm insulin là phương thức điều trị chủ yếu trong dân số nhi khoa của họ. CSII có một số lợi ích thực tế so với MDI, bao gồm tốc độ insulin nền có thể lập trình với nhiều hồ sơ tốc độ nền và khả năng có tốc độ nền tạm thời, các liều bolus “sóng kép” có thể điều chỉnh, cùng một vị trí tiêm trong 2 đến 3 ngày (so với MDI), máy tính liều, và khả năng tải lên dữ liệu, tất cả đều tạo điều kiện thuận lợi cho việc quản lý bệnh hàng ngày.
Việc sử dụng bơm insulin có liên quan đến việc cải thiện kiểm soát chuyển hóa, giảm hemoglobin glycated, hoặc ít hạ đường huyết hơn ở nhiều người, nhưng không phải tất cả, các thử nghiệm lâm sàng. Các nghiên cứu thuần tập lớn, bao gồm vài nghìn bệnh nhân nhi, đã mô tả một mối tương quan đáng kể giữa kiểm soát chuyển hóa tốt hơn và việc sử dụng bơm insulin. Ngoài ra, chất lượng cuộc sống được đánh giá bằng bảng câu hỏi PedsQL-T1DM có liên quan đáng kể đến việc sử dụng bơm insulin, và dữ liệu sơ bộ cho thấy nhận thức, tâm trạng và hành vi tốt hơn.
Các tiêu chí lựa chọn cho liệu pháp bơm insulin trong dân số bệnh nhân nhi đã được mở rộng khi kinh nghiệm và dữ liệu về việc sử dụng nó tích lũy. Thông thường, kiểm soát đường huyết kém, hạ đường huyết thường xuyên, tăng biến thiên glucose bất kể HbA1c, chất lượng cuộc sống bị tổn hại, và tăng nguy cơ biến chứng mãn tính được liệt kê. Tự theo dõi glucose máu (SBGM) vẫn là một điều kiện tiên quyết quan trọng, cũng như sự hỗ trợ của cha mẹ. Tuổi trẻ, SBGM thường xuyên, và HbA1c thấp hơn khi bắt đầu bơm có liên quan đến kiểm soát chuyển hóa lâu dài tốt hơn. Ở nhiều trường hợp, đặc biệt là ở các nước phát triển kinh tế, SBGM đã được thay thế bằng theo dõi glucose liên tục như được trình bày chi tiết dưới đây. Ngược lại, giới tính nữ, tuổi lớn hơn 10 ở bé gái, và kiểm soát chuyển hóa kém khi bắt đầu bơm có liên quan đến nguy cơ cao hơn bị bỏ điều trị bằng bơm insulin. Điều thú vị là, trẻ em có kiểm soát chuyển hóa không đủ trên MDI có thể trải qua sự giảm HbA1c cao nhất khi chuyển sang bơm insulin. Ở trẻ mẫu giáo, việc bắt đầu liệu pháp bơm insulin khi bệnh khởi phát có thể giúp bệnh nhân duy trì HbA1c thấp hơn trong tối đa 8 năm.
Việc khởi đầu liệu pháp bơm insulin là một quá trình có cấu trúc gồm nhiều bước liên quan đến toàn bộ gia đình (mở rộng) của bệnh nhân và một đội ngũ đái tháo đường lý tưởng bao gồm một bác sĩ nội tiết nhi, một nhà giáo dục đái tháo đường nhi, một chuyên gia dinh dưỡng chuyên biệt, một nhà tâm lý học trẻ em, và một nhân viên xã hội. Ngoài ra, việc đào tạo đầy đủ cho nhân viên nhà trẻ, bảo mẫu, hoặc nhân viên trường học là vô cùng quan trọng.
Tốc độ Insulin Nền
Một chuỗi liên tục các liều bolus nhỏ khoảng mỗi 10 phút của một analog insulin tác dụng ngắn cung cấp insulin nền cần thiết để ức chế tân tạo glucose và tạo ceton ở gan và duy trì đường huyết nền bình thường. Các mô hình tốc độ nền hàng ngày theo độ tuổi khác nhau đáng kể về liều lượng và phân phối. Vì đề kháng insulin tăng theo tuổi, liều insulin cũng vậy. Mặc dù trẻ mẫu giáo thường cần tốc độ nền cao nhất trong khoảng từ 10 giờ tối đến 2 giờ sáng, mô hình này thay đổi khi đến tuổi dậy thì khi nhu cầu insulin cao nhất thường bắt đầu sau 4 giờ sáng và kéo dài cho đến khi thức dậy.
Khi chuyển một bệnh nhân từ MDI sang CSII, tổng liều tốc độ nền thường được tính dựa trên liều trước đó của analog insulin tác dụng kéo dài và thường được giảm 10% đến 20% nếu HbA1c dưới 8%. Hoặc, tổng liều insulin hàng ngày được giảm 20% đến 30% và sau đó một nửa được tiêm dưới dạng tốc độ nền. Một số bác sĩ lâm sàng tính toán liều tốc độ nền một cách tùy ý là khoảng 0,4 đơn vị insulin mỗi kg trọng lượng cơ thể, đặc biệt là khi liều của analog insulin tác dụng kéo dài hoặc tổng liều insulin hàng ngày khi được điều trị bằng các mũi tiêm rõ ràng là không phù hợp và đạt được kiểm soát chuyển hóa kém.
Việc lập trình nhiều tốc độ nền trong dân số nhi khoa có vẻ thận trọng, vì điều này có liên quan đến kiểm soát chuyển hóa tốt hơn. Một số phương pháp tiếp cận ban đầu được sử dụng với thành công có thể tương tự, vì các tốc độ nền nên được xác minh và cá nhân hóa sau đó. Ở trẻ sơ sinh và trẻ mới biết đi, một tốc độ nền ban đầu không đổi có thể phù hợp và được điều chỉnh theo nhu cầu cá nhân trong tuần đầu tiên sử dụng bơm insulin. Vì các bơm insulin hiện đại có thể cung cấp ít nhất là 0,025 đơn vị insulin mỗi giờ, việc pha loãng insulin hiếm khi cần thiết. Việc lập trình ngắt quãng 0 đơn vị insulin mỗi giờ trong các khoảng thời gian ngắn hơn lên đến 2 giờ đôi khi được sử dụng cho trẻ sơ sinh. Một tốc độ insulin nền cao hơn sẽ cần thiết vào khoảng nửa đêm với một tốc độ thấp hơn được áp dụng vào buổi chiều. Đối với trẻ lớn hơn và thanh thiếu niên, ngày có thể được chia thành năm phần: từ nửa đêm đến 4 giờ sáng, bao phủ giai đoạn có nhu cầu insulin nền ít nhất, từ 4 đến 7 giờ sáng bao phủ giai đoạn hiện tượng bình minh, từ 7 giờ sáng đến 1 giờ chiều bao phủ buổi sáng, từ 1 đến 8 giờ tối bao phủ buổi chiều, và từ 8 giờ tối đến nửa đêm bao phủ buổi tối. Đôi khi, có thể cần một khung thời gian bổ sung cho hiện tượng hoàng hôn từ 5 đến 8 giờ tối. Có thể cần một số mô hình tốc độ nền cho các tình huống khác nhau: một mô hình tiêu chuẩn cho các ngày trong tuần thông thường, một mô hình cuối tuần hoặc giải trí với tốc độ insulin nền thấp hơn trong buổi sáng (ví dụ, ít căng thẳng hơn từ trường học hoặc công việc hoặc hoạt động nhiều hơn), và một mô hình tốc độ nền “những ngày bị bệnh” với lượng insulin nhiều hơn 30% trong suốt 24 giờ.
Xác minh Cài đặt Tốc độ Insulin Nền
Tốc độ nền lý tưởng sẽ giữ cho mức glucose máu trong phạm vi mong muốn trong khi nhịn ăn. Nhu cầu về insulin nền thay đổi theo thời gian và phụ thuộc vào độ nhạy insulin thay đổi theo tuổi, lối sống, sự tăng trưởng và một số ảnh hưởng dao động khác. Tốc độ insulin nền có thể được xác minh tốt nhất khi bỏ qua việc ăn uống. Tốc độ insulin nền ban đêm có thể được xác minh trước, vì hồ sơ nồng độ glucose qua đêm thường là mối quan tâm lớn nhất. Vào một ngày bình thường sau bữa tối sớm (lúc 5–6 giờ tối) đã được bao phủ tỉ mỉ bằng một liều bolus thích hợp, SBGM được thực hiện mỗi 2 đến 3 giờ từ 10 giờ tối cho đến khi thức dậy. Nếu glucose máu thay đổi hơn ± 40 mg/dL (2 mM), tốc độ nền khoảng 1 giờ trước khi glucose máu thay đổi được điều chỉnh ± 10% đến 20%. Tương tự, một hồ sơ SBGM nền buổi sáng được thực hiện sau một đêm bình thường, bỏ qua bữa sáng và bữa ăn nhẹ buổi sáng với SBGM mỗi 2 đến 3 giờ cho đến bữa trưa. Cuối cùng, một hồ sơ SBGM nền buổi chiều được thực hiện sau một buổi sáng bình thường, bỏ qua bữa trưa, với SBGM mỗi 2 đến 3 giờ cho đến bữa tối. Tốc độ insulin nền được điều chỉnh như được mô tả cho hồ sơ nền ban đêm. Nếu mức glucose máu giảm xuống dưới hoặc trên phạm vi thông thường từ 70 đến 180 mg/dL, tình trạng này được điều trị, việc kiểm tra hồ sơ nền bị ngừng, tốc độ nền được điều chỉnh tương ứng, và hồ sơ SBGM nền được kiểm tra lại sau vài ngày. Ở trẻ mẫu giáo, tốc độ nền có thể được xác minh trong các khoảng thời gian ngắn hơn, vì chỉ có thể bỏ qua một bữa ăn mỗi ngày. Một số người xác minh hồ sơ nền mà không bỏ qua bữa ăn mà sau khi ăn các bữa ăn nhỏ được tiêu chuẩn hóa được bao phủ bởi các liều bolus thích hợp. CGM có thể hỗ trợ rõ ràng và có thể làm giảm tần suất SBGM. Việc liên lạc qua điện thoại thường xuyên với đội ngũ đái tháo đường là thận trọng trong những tuần đầu tiên sau khi khởi đầu bơm insulin để tinh chỉnh các tốc độ insulin nền một cách cá nhân.
Tốc độ Nền Tạm thời và Tạm dừng Insulin Nền
Với ít insulin trong cơ thể giữa các liều bolus, việc giảm hoặc ngừng tốc độ insulin nền là một cách hiệu quả để ngăn ngừa hạ đường huyết trong khi hoạt động thể chất hoặc thể thao. Các bơm thông minh có thể hiển thị lượng insulin còn lại trong cơ thể sau một liều bolus (cái gọi là insulin hoạt động), điều này có thể giúp ích đáng kể trong việc ngăn ngừa hạ đường huyết liên quan đến tập thể dục, vì “insulin hoạt động” có thể được bao phủ bằng carbohydrate bổ sung.
Liều lượng Insulin Bolus
Việc định liều insulin cẩn thận và thường xuyên hơn để bao phủ thức ăn và điều chỉnh mức glucose máu cao có liên quan đến kiểm soát chuyển hóa tốt hơn khi sử dụng bơm insulin. Các bơm insulin hiện đại có thể hỗ trợ tính toán liều insulin bolus làm giảm sai sót và kết hợp sự biến thiên sinh lý của độ nhạy insulin trong suốt cả ngày.
Insulin Bolus để Bao phủ Thức ăn
Các nguyên tắc tính toán liều bolus cho thức ăn giống như đối với MDI, với khả năng bổ sung là định liều chính xác hơn xuống đến 0,025 đơn vị insulin ở một số bơm insulin. Kiến thức thực tế vững chắc về đếm carbohydrate là tối quan trọng. Công thức tùy ý 500 chia cho tổng liều insulin hàng ngày cho trẻ lớn hơn và thanh thiếu niên (300 hoặc 200 cho trẻ mẫu giáo hoặc trẻ mới biết đi, tương ứng) có thể giúp xác định ICR ban đầu. ICR có thể cao hơn (một đơn vị insulin bao phủ ít carbohydrate hơn) vào buổi sáng, đôi khi cao hơn từ 30% đến 100% so với giữa trưa, và cao hơn một chút nữa vào buổi tối. Các máy tính bolus được tích hợp vào các bơm hiện đại và thực hiện tất cả các tính toán cần thiết dựa trên các ICR được cài đặt trước, glucose máu hiện tại, lượng carbohydrate dự kiến ăn vào, và phạm vi mục tiêu glucose, thường từ 70 đến 120 mg/dL (3,9 và 6,5 mM).
Việc xác định liều bolus thức ăn nâng cao kết hợp việc đếm protein (15 g carbohydrate cho mỗi 100 g protein bổ sung sau 100 g đầu tiên) và việc sử dụng liều bolus kéo dài hoặc “sóng kép”, có liên quan đến kiểm soát glucose sau ăn tốt hơn sau khi ăn thực phẩm có chỉ số đường huyết thấp.
Tốt nhất, liều bolus nên được tiêm 15 đến 20 phút trước bữa ăn vì đỉnh glucose máu sau ăn xảy ra trước đỉnh tác dụng của analog insulin tác dụng nhanh. Vì thói quen ăn uống ở trẻ nhỏ có thể không thể đoán trước, có thể sử dụng phương pháp “chia liều bolus” để kiểm soát sau ăn tối ưu với chỉ 10% đến 20% liều bolus được tính toán được tiêm 15 đến 20 phút trước bữa ăn để bao phủ lượng thức ăn “chắc chắn” ăn vào, và phần còn lại được tiêm sau bữa ăn theo lượng thực tế tiêu thụ.
ICR nên được xác minh thường xuyên bằng SBGM hoặc CGM sau ăn hàng giờ, nhằm mục tiêu glucose máu dưới 180 mg/dL (10 mM).
Các liều bolus bữa ăn bị bỏ lỡ, đặc biệt là trong giờ học, là nguyên nhân phổ biến nhất của kiểm soát chuyển hóa không tối ưu. Sự giám sát và hỗ trợ của cha mẹ và nhân viên nhà trường là rất có giá trị.
Insulin Bolus để Điều chỉnh Tăng đường huyết
ISF có thể được ước tính bằng cách chia 1800 cho TTD ở trẻ lớn hơn và thanh thiếu niên (2000 hoặc 2200 ở trẻ mẫu giáo và trẻ mới biết đi, tương ứng). Một lần nữa, các máy tính bolus được tích hợp vào các bơm insulin thông minh tính toán các liều bolus điều chỉnh dựa trên ISF được cài đặt trước, mức glucose máu hiện tại, phạm vi mục tiêu glucose máu được cài đặt trước, và lượng insulin hoạt động từ các liều bolus điều chỉnh đã được tiêm trước đó. Lượng insulin hoạt động được tính toán bởi máy tính bolus của bơm insulin phụ thuộc vào cài đặt thời gian tác dụng của insulin, thường được đặt là 3 giờ cho các liều bolus được sử dụng trong dân số nhi khoa. Cài đặt thời gian tác dụng của insulin ngắn hơn cho phép tiêm bolus điều chỉnh tích cực hơn.
Ngoài ra, ISF được xác minh thường xuyên bằng SBGM 2 đến 4 giờ sau khi điều chỉnh hoặc bằng CGM. Nên tránh các liều bolus điều chỉnh cách nhau dưới 2 giờ vì sự tích tụ insulin (xếp chồng) có thể xảy ra và gây hạ đường huyết.
Các Cân nhắc Cụ thể và Biến chứng Cấp tính của Liệu pháp Bơm Insulin
Hoạt động thể chất thường xuyên được khuyến khích mạnh mẽ nhưng đầy thách thức ở thanh thiếu niên mắc ĐTĐ tuýp 1, đặc biệt là liên quan đến hạ đường huyết trong và sau đó. Lợi thế lớn nhất của CSII có thể liên quan đến khả năng giảm hạ đường huyết liên quan đến hoạt động thể chất. Tốc độ insulin nền có thể được ngừng hoặc giảm bằng cách đặt tốc độ nền tạm thời ngay trước và trong khi hoạt động thể chất, tùy thuộc vào cường độ và thời gian của nó. Sự hiện diện của insulin hoạt động từ các liều bolus trước đó có thể được xác minh và một bữa ăn nhẹ carbohydrate thích hợp được bổ sung trước khi hoạt động thể chất, ngoài việc sửa đổi tốc độ insulin nền, ngăn ngừa hiệu quả hạ đường huyết. Cuối cùng, tập thể dục gắng sức hoặc kéo dài thường dẫn đến hạ đường huyết muộn, có thể được ngăn ngừa bằng cách giảm tốc độ insulin nền tạm thời được lập trình trong vài giờ sau khi hoạt động thể chất. Do đó, hạ đường huyết có thể được ngăn ngừa mà không cần sử dụng quá nhiều carbohydrate bổ sung và do đó có thể duy trì cân bằng năng lượng âm, điều này đặc biệt quan trọng đối với việc quản lý cân nặng.
Việc giảm hạ đường huyết bằng cách sử dụng liệu pháp bơm insulin một cách hợp lý đã được chứng minh trong một số nghiên cứu và có nhiều ý nghĩa thực tế quan trọng phải được thảo luận trong quá trình đào tạo gia đình. Khả năng xếp chồng insulin sau các liều bolus điều chỉnh quá thường xuyên; đếm carbohydrate không phù hợp; và các sửa đổi insulin liên quan đến một bệnh cấp tính (ví dụ, nôn mửa), rối loạn ăn uống, hoặc hoạt động thể chất là những vấn đề quan trọng nhất cần được xem xét.
DKA theo truyền thống được coi là một nguy cơ liên quan đến CSII; tuy nhiên, các nghiên cứu báo cáo ít DKA hơn với việc sử dụng bơm insulin hiện đại. Vì chỉ có các analog insulin tác dụng nhanh được sử dụng trong bơm insulin, tình trạng tăng ceton máu đáng kể có thể phát triển sau 4 đến 6 giờ sau khi ngừng CSII. Việc ngắt kết nối một phần hoặc hoàn toàn bộ truyền dịch và tắc nghẽn hoặc gấp khúc catheter dưới da là những nguyên nhân phổ biến nhất. Một kế hoạch cứu hộ DKA phải được bao gồm trong chương trình giáo dục có cấu trúc được cung cấp cho bệnh nhân và người chăm sóc. Phải kiểm tra ceton trong máu hoặc nước tiểu nếu hai mức glucose máu liên tiếp hoặc mức glucose máu lúc đói trên 275 mg/dL (> 15 mM), và phải xem xét khả năng có vấn đề về bộ truyền dịch. Bộ truyền dịch phải được thay thế và tiêm một liều bolus điều chỉnh thích hợp, có thể bằng một bút tiêm insulin, nếu không chắc chắn về hoạt động của bộ truyền dịch. Nếu nồng độ ceton trong máu lớn hơn 1,5 mM, có thể cần một tốc độ nền tạm thời tăng lên 150% đến 200% cho đến khi ceton trong máu được bình thường hóa. Nên uống thêm chất lỏng. Nếu tình trạng tăng ceton máu liên quan đến một bệnh cấp tính hoặc vẫn không giải thích được, cần liên hệ với đội ngũ đái tháo đường trực.
Việc duy trì đường huyết bình thường trong các bệnh nặng cấp tính đã được chứng minh ở người lớn, cùng với việc giảm nguy cơ hạ đường huyết. Mặc dù thiếu bằng chứng được công bố cho trẻ em, các đội ngũ tại ICU nhi và ICU sơ sinh cần được đào tạo thích hợp để duy trì kiểm soát đường huyết ổn định bằng CSII trong các bệnh nặng cấp tính. Các bác sĩ gây mê thường đề nghị chuyển sang insulin IV trong các cuộc phẫu thuật kéo dài, điều này với việc xác định mức glucose máu thường xuyên cung cấp một phương thức điều trị đã được thiết lập và an toàn. CSII nên được khởi động lại ngay trước khi kết thúc việc truyền insulin IV. Việc ngừng CSII trong các đợt nhập viện ngắt quãng tại các khoa nhi hoặc phẫu thuật khác nhau thường liên quan đến kiểm soát chuyển hóa kém và nên được hạn chế. Một đội ngũ nội tiết nhi khoa nên tham gia vào việc chăm sóc thích hợp cho trẻ em bị đái tháo đường nhập viện.
Liệu pháp Bơm Insulin ở Mẫu giáo và Trường học
Hầu hết các trường học ở các xã hội phát triển chấp nhận trẻ em mắc bệnh mãn tính và cung cấp sự chăm sóc cần thiết hoặc được thực thi thông qua luật pháp và quy định hoặc tự nguyện. Một kế hoạch có cấu trúc cho nhân viên nhà trường và giáo dục liên quan đến bệnh đái tháo đường tương tự như kế hoạch cho người chăm sóc tạo điều kiện cho sự hợp tác giữa phụ huynh, đội ngũ đái tháo đường và nhà trường. Một tinh thần hợp tác nhằm mục đích tốt nhất cho trẻ mắc ĐTĐ tuýp 1 thường mang lại kết quả tối ưu lâu dài. Đội ngũ đái tháo đường đóng vai trò là người hỗ trợ và điều phối trong sự hợp tác giữa phụ huynh và nhân viên nhà trường. Lý tưởng nhất, đào tạo cơ bản cho nhân viên nhà trường bao gồm nhưng không giới hạn ở SBGM và ghi chép phù hợp; quản lý hạ đường huyết bao gồm ngừng cung cấp insulin; carbohydrate cứu hộ và tiêm glucagon; quản lý tăng đường huyết, bao gồm các liều bolus điều chỉnh và kiểm tra ceton, đếm carbohydrate và xác định liều bolus; và quản lý hoạt động thể chất.
Mặc dù có những cải thiện đáng kể trong kiểm soát chuyển hóa với việc sử dụng thường quy CSII trong dân số nhi khoa, hầu hết những người trẻ mắc bệnh đái tháo đường tuýp 1 vẫn không đạt được kiểm soát chuyển hóa mục tiêu, với hạ đường huyết và DKA vẫn là những vấn đề. Cần nhấn mạnh hơn vào hỗ trợ tâm lý xã hội và nuôi dạy con thành công trong bối cảnh môi trường hiện đại đầy thách thức mà trẻ em và thanh thiếu niên thường phải đối mặt.
Theo dõi Glucose máu
Sự an toàn và thành công của bất kỳ chế độ insulin nào đều phụ thuộc vào việc theo dõi thường xuyên mức glucose máu. Việc kiểm soát đái tháo đường tích cực sẽ không thể thực hiện được nếu không có sự phát triển của các máy đo glucose tại nhà chính xác và dễ sử dụng. Các mẫu máy hiện tại sử dụng các phương pháp điện hóa dựa trên glucose-oxidase. Các máy đo nhanh và chỉ cần một lượng máu rất nhỏ (0,1 mL). Yêu cầu lượng máu nhỏ hơn đã cho phép xét nghiệm tại các vị trí thay thế (ví dụ, cẳng tay), có thể giảm thiểu sự khó chịu và cải thiện sự tuân thủ các chế độ tự theo dõi.
Việc theo dõi glucose máu thường xuyên, với tối thiểu bốn lần xét nghiệm mỗi ngày, trước bữa ăn và trước khi đi ngủ, là một mục tiêu tối thiểu. Tuyên bố Lập trường của ADA gần đây nhất và Hướng dẫn của ISPAD khuyến nghị kiểm tra glucose bằng que thử 6 đến 10 lần mỗi ngày hoặc sử dụng CGM để đạt được kiểm soát glucose chặt chẽ một cách an toàn.
Theo dõi Glucose Liên tục
Đã được biết đến trong nhiều năm rằng SMBG thường xuyên hơn có tương quan với mức HbA1c được cải thiện và giảm tần suất các biến chứng cấp tính. Thật vậy, việc giới thiệu các hệ thống CGM thời gian thực đã cách mạng hóa việc quản lý insulin trong điều trị bệnh đái tháo đường. Các thiết bị CGM hiện có dựa trên các cảm biến được đưa vào qua da và đo nồng độ glucose trong dịch kẽ bằng các phương pháp điện hóa dựa trên glucose-oxidase. Nồng độ glucose của cảm biến có thể được báo cáo theo thời gian thực, khoảng mỗi 5 phút, với các chỉ báo tốc độ thay đổi và hồ sơ hồi cứu từ 1 đến 24 giờ. Lượng thông tin phong phú này cho phép điều chỉnh liều insulin dựa trên phân tích hồi cứu, cũng như các điều chỉnh tức thời, “tại thời điểm” và các điều chỉnh dự đoán về tốc độ cung cấp insulin hoặc tạm dừng tạm thời dựa trên tốc độ thay đổi. Các hệ thống quản lý dữ liệu dựa trên web có sẵn để hỗ trợ bệnh nhân và các nhà cung cấp dịch vụ chăm sóc sức khỏe (HCP) trong việc đánh giá dữ liệu cảm biến một mình, hoặc kết hợp với dữ liệu bơm insulin hoặc bút tiêm được kết nối.
Ở trẻ em khỏe mạnh từ 2 đến 8 tuổi, mức glucose của cảm biến CGM chủ yếu nằm trong khoảng 4 đến 7,8 mmol/L (72–140 mg/dL), với 9% dưới 4 mmol/L (< 72 mg/dL), 3% < dưới 3,5 mmol/L (< 63 mg/dL), và 1% trên 9,0 mmol/L (> 162 mg/dL). Điều quan trọng là 0% giá trị glucose của cảm biến lớn hơn 11,1 mmol/L (> 200 mg/dL) ở trẻ em khỏe mạnh. Mô hình đường huyết rất ổn định, với độ lệch chuẩn glucose trung bình là 1,0 ± 0,2 mmol/L và hệ số biến thiên (CV) là 18,87%. Mức glucose của cảm biến hơi cao hơn vào buổi tối và thấp hơn vào buổi sáng. Những dữ liệu sinh lý này giúp hướng dẫn các mục tiêu đường huyết ở trẻ em mắc ĐTĐ tuýp 1.
Các thiết bị CGM hiện nay bao gồm CGM mù/hồi cứu, CGM thời gian thực, và CGM quét ngắt quãng (isCGM). Việc sử dụng phổ biến nhất của CGM hồi cứu là bởi các HCP trong một khoảng thời gian ngắn để thu thập thông tin về các mô hình glucose để hỗ trợ chẩn đoán (ví dụ, đái tháo đường liên quan đến xơ nang), với các điều chỉnh liệu pháp, và với giáo dục về bệnh đái tháo đường.
Các CGM thời gian thực hiển thị nồng độ glucose kẽ (gần) hiện tại, cung cấp các báo động thời gian thực cho các ngưỡng được xác định trước và dự đoán về nồng độ glucose thấp và cao, cũng như các báo động về tốc độ thay đổi đối với các biến thiên đường huyết nhanh. Một số cảm biến CGM có thể truyền tín hiệu lên “đám mây”, và cho phép người chăm sóc và/hoặc HCP theo dõi từ xa các biểu đồ CGM với các cảnh báo trên các thiết bị của riêng họ, bao gồm điện thoại thông minh, máy tính bảng hoặc đồng hồ thông minh.
Các hệ thống isCGM hiện tại không liên tục hiển thị nồng độ glucose kẽ thời gian thực, các mũi tên xu hướng, biểu đồ hoặc báo động; các mức glucose chỉ xuất hiện khi người dùng giữ một đầu đọc, hoặc một điện thoại di động, gần cảm biến. Tất cả các kết quả đọc glucose liên tục được lưu trữ và cung cấp theo yêu cầu. Hầu hết các CGM để sử dụng mù và thời gian thực vẫn yêu cầu hiệu chuẩn bằng glucose máu từ que thử; tuy nhiên, các CGM và isCGM mới được hiệu chuẩn tại nhà máy và có thể loại bỏ hoàn toàn nhu cầu hiệu chuẩn thông qua SMBG. Các cảm biến được đưa vào qua da bởi những người bị đái tháo đường hoặc cha mẹ/người chăm sóc của họ, và có tuổi thọ từ 6 đến 14 ngày. Một loại cảm biến dưới da thời gian thực cấy ghép lâu dài mới được phê duyệt để sử dụng trong 3 hoặc 6 tháng như một phương án thay thế cho CGM qua da.
Việc sử dụng CGM đang tăng lên liên tục ở những người bị đái tháo đường, bao gồm cả dân số nhi khoa. CGM đã được sử dụng bởi 4,8% tất cả các bệnh nhân trẻ và 2,3% tất cả các bệnh nhân nhi trong sổ đăng ký Đức-Áo Tài liệu Bệnh nhân Đái tháo đường (DPV) vào năm 2012. Sổ đăng ký Type 1 Diabetes Exchange (T1DEx) tại Hoa Kỳ đã báo cáo việc sử dụng CGM ở 6% trẻ em dưới 13 tuổi, 4% thanh thiếu niên, và 6% người trẻ tuổi. Cả hai sổ đăng ký đều báo cáo sự tăng trưởng theo cấp số nhân của việc sử dụng CGM vào năm 2017, với 18,4% (DPV) và 21,7% (T1DEx) sử dụng trong dân số nhi khoa. Việc sử dụng cao hơn ở trẻ nhỏ hơn có thể phản ánh sự tham gia của cha mẹ, nỗi sợ hãi của cha mẹ về hạ đường huyết, giảm gánh nặng của SMBG, các chương trình hoàn trả tốt hơn cho nhóm tuổi này, và công nghệ cải tiến.
Bằng chứng Lâm sàng cho Máy theo dõi Glucose Liên tục
Bằng chứng về hiệu quả của CGM trong dân số nhi khoa đã phát triển dần dần. Thử nghiệm của Quỹ Nghiên cứu Đái tháo đường Vị thành niên (JDRF) từ năm 2008 đã cung cấp bằng chứng cho dân số người lớn; tuy nhiên, không có lợi ích tổng thể nào của việc sử dụng CGM được chứng minh trong các nhóm thanh thiếu niên và tuổi đi học, có thể do sự tuân thủ sử dụng cảm biến kém. Tuy nhiên, một phân tích post hoc của những dữ liệu này giới hạn ở những người có sử dụng cảm biến hơn 6 ngày/tuần cũng đã chứng minh lợi ích đáng kể trong các nhóm tuổi đi học và thanh thiếu niên. Các nghiên cứu được thực hiện sau năm 2010 đã chứng minh sự cải thiện nhất quán hơn về mức HbA1c và giảm biến thiên glucose ở người lớn và trong dân số nhi khoa, đặc biệt với việc sử dụng CGM gần như liên tục từ 6 đến 7 ngày/tuần. Bằng chứng về lợi ích ở trẻ nhỏ hơn và đặc biệt là trẻ mẫu giáo ban đầu không rõ ràng: tính khả thi đã được chứng minh ở trẻ em dưới 10 tuổi; tuy nhiên, một sự cải thiện trong kiểm soát đường huyết đã không được chứng minh trong một thử nghiệm ngẫu nhiên có đối chứng (RCT). Đặc biệt ở trẻ mới biết đi dưới 4 tuổi, sự giảm HbA1c sau 6 tháng sử dụng vẫn khó nắm bắt, mặc dù mức độ hài lòng của cha mẹ cao và việc sử dụng các thiết bị bền vững hơn. Các nghiên cứu gần đây hơn đã cung cấp thêm bằng chứng với lợi ích rõ ràng cũng trong dân số mẫu giáo khi phân tích tập trung nghiêm ngặt vào các giai đoạn sử dụng CGM. Hỗ trợ cho việc sử dụng các thiết bị CGM ở các trường mẫu giáo và trường học là vô cùng quan trọng, như được nhấn mạnh gần đây trong các hướng dẫn và tuyên bố lập trường quốc tế.
Ít nghiên cứu hơn đã tập trung vào tác động của CGM đối với hạ đường huyết. Bằng chứng khá mạnh mẽ trong dân số người lớn, cả từ các phân tích hồi cứu và các RCT. Ban đầu, sự giảm hạ đường huyết nhẹ, và thời gian ở trong tình trạng hạ đường huyết với MDI và liệu pháp bơm insulin đã được chứng minh, cùng với sự giảm biến thiên glucose. Một RCT ở trẻ em đã chứng minh sự giảm hạ đường huyết nặng; tuy nhiên, hầu hết các thử nghiệm trước đây hoặc không đủ mạnh để phát hiện sự khác biệt về hạ đường huyết nặng hoặc chỉ tập trung vào việc giảm HbA1c.
Ngay từ đầu việc sử dụng CGM thời gian thực, các cá nhân được điều trị bằng MDI đã được bao gồm thành công. Tuy nhiên, chỉ gần đây việc sử dụng độc lập CGM, và đặc biệt là isCGM, mới được sử dụng không bổ trợ cho SMBG, một phương pháp tiếp cận đang thu hút sự chú ý mạnh mẽ. Bằng chứng ngày càng tăng về lợi ích lâm sàng của isCGM trong dân số nhi khoa mắc ĐTĐ tuýp 1, cũng như trong khi tập thể dục và thể thao và được sử dụng không bổ trợ, đã mang lại sự tự tin bổ sung cho việc sử dụng thành công tất cả các phương thức CGM trong dân số trẻ em đầy thách thức này.
Số lượng cảm biến ngày càng tăng hiện có thể đạt được mốc đề xuất là chênh lệch tương đối tuyệt đối trung bình dưới 10% (MARD < 10%), đủ để cho phép tự điều chỉnh liều insulin mà không cần SMBG xác nhận. Dữ liệu thực tế từ sổ đăng ký T1DEx đã cung cấp bằng chứng về sự an toàn và hiệu quả của việc sử dụng cảm biến không bổ trợ vì chỉ có 26% người tham gia xác minh glucose của cảm biến bằng cách thực hiện SMBG. Việc sử dụng không bổ trợ CGM dường như đáng tin cậy nhất khi người đó không bị hạ đường huyết và glucose không thay đổi nhanh chóng. Những lo ngại nghiêm trọng đã được nêu ra về việc sử dụng CGM không bổ trợ; tuy nhiên, có bằng chứng rõ ràng rằng những lo ngại tương tự cũng áp dụng cho nhiều máy đo glucose máu mà Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt cho SMBG. Các hướng dẫn thực tế cho việc sử dụng CGM không bổ trợ giải quyết một số mối quan tâm hiện tại.
Một cảm biến cấy ghép lâu dài gần đây đã được phê duyệt để đeo trong tối đa 6 tháng tại Liên minh Châu Âu, và tối đa 3 tháng tại Hoa Kỳ. Một RCT ban đầu đã chứng minh hiệu quả và an toàn ở một dân số người lớn mắc ĐTĐ tuýp 1, với một RCT tiếp theo báo cáo MARD dưới 10% trong tất cả các phạm vi glucose, cho thấy tiềm năng sử dụng không bổ trợ của nó. Những lợi thế rõ ràng của một cảm biến cấy ghép lâu dài hiện tại vẫn có thể bị bù đắp bởi quy trình cấy ghép và loại bỏ, mặc dù được thực hiện trong một cơ sở đái tháo đường ngoại trú. Hiện không có dữ liệu nhi khoa nào có sẵn.
Cuối cùng, việc hoàn trả chi phí cho CGM ảnh hưởng lớn đến việc sử dụng nó. Gần đây, CGM và đặc biệt là isCGM đã nhận được sự chấp thuận rộng rãi cho việc hoàn trả từ các hệ thống bảo hiểm tư nhân và công cộng lớn. Chỉ với sự hỗ trợ rộng rãi như vậy cho việc sử dụng CGM, các hướng dẫn hiện tại về việc sử dụng CGM, đặc biệt là liên quan đến thời gian trong phạm vi (TIR), mới có thể được thực hiện. Các chỉ số CGM với các mục tiêu lâm sàng được chấp nhận cho TIR, thời gian dưới phạm vi (TBR), và thời gian trên phạm vi (TAR) có thể trở thành các thông số phổ biến nhất để quản lý glucose.
Các Cân nhắc Thực tế đối với Máy theo dõi Glucose Liên tục
Giáo dục ban đầu kỹ lưỡng cùng với việc đặt ra các kỳ vọng thực tế là bắt buộc để sử dụng CGM thành công. Giáo dục trực tiếp và các tài liệu giáo dục cũng nên được cung cấp cho giáo viên tại các trường mẫu giáo và trường học, với các kế hoạch chăm sóc sức khỏe cá nhân hóa bằng văn bản được thỏa thuận giữa phụ huynh, y tá trường học, người chăm sóc chuyên nghiệp, giáo viên và trẻ em, khi phù hợp. Theo dõi từ xa có thể góp phần vào thành công của việc quản lý bệnh đái tháo đường ở các trường mẫu giáo và trường học.
Các báo động và cảnh báo có thể gây ra sự mệt mỏi và gánh nặng tâm lý gia tăng, dẫn đến tỷ lệ bỏ CGM cao hơn. Việc cài đặt báo động cá nhân hóa hợp lý là tối quan trọng; những điều này, và các khía cạnh khác của CGM được thảo luận rộng rãi trong ấn phẩm có tựa đề: Vai trò của Việc theo dõi Glucose Liên tục trong Điều trị Đái tháo đường.
Độ dính của cảm biến không đủ và kích ứng da, đặc biệt ở trẻ nhỏ nơi diện tích bề mặt cơ thể hạn chế, có thể bị báo cáo thiếu, và đại diện cho những rào cản quan trọng đối với việc sử dụng CGM lâu dài. Các sản phẩm dính bổ sung (ví dụ, keo lỏng, khăn lau dính, băng trong suốt, băng đặc biệt) và băng quấn bên ngoài được khuyến nghị để giúp cố định cảm biến vào da. Các vấn đề về da có thể trở nên phổ biến hơn khi sử dụng cảm biến lâu dài. Nên xoay vòng vị trí thường xuyên để ngăn ngừa kích ứng da và chấn thương do việc dán và tháo keo cảm biến thường xuyên. Các chất tẩy keo cũng giúp ngăn ngừa chấn thương da.
Liệu pháp Bơm Tăng cường Cảm biến
Liệu pháp bơm tăng cường cảm biến (SAP) bao gồm một CGM được liên kết với một bơm insulin thông qua một thuật toán. Sau RCT ban đầu trong dân số người lớn, nơi SAP không cho thấy lợi thế so với liệu pháp bơm insulin đơn thuần, và thậm chí còn làm tăng hạ đường huyết, có thể do việc đeo và sử dụng cảm biến không đủ, SAP đã được chứng minh là vượt trội hơn MDI với SMBG trong một RCT kéo dài 1 năm, bao gồm một dân số nhi khoa từ 7 đến 18 tuổi, dẫn đến sự giảm đáng kể HbA1c và tác động trung tính đối với hạ đường huyết. Trẻ em đi học sử dụng cảm biến thường xuyên hơn so với thanh thiếu niên; việc sử dụng cảm biến nhiều hơn có liên quan đến HbA1c thấp hơn, giảm phơi nhiễm với tăng đường huyết, và giảm biến thiên đường huyết độc lập với HbA1c. Tương tự, trong giai đoạn tiếp tục 6 tháng, những người tham gia trong nhóm can thiệp SAP ban đầu vẫn duy trì được sự cải thiện HbA1c ở tháng thứ 18, với những người chuyển sang SAP từ nhóm MDI ban đầu cũng đạt được sự giảm đáng kể HbA1c.
Mức độ thứ hai của liệu pháp SAP đi kèm với một phương thức tạm dừng insulin tự động khi glucose cảm biến ở ngưỡng thấp (LGS), đã chứng minh ít thời gian ở trong tình trạng hạ đường huyết hơn so với SAP không có LGS. Một RCT được thực hiện tại nhà đã chứng minh rằng việc sử dụng phương thức LGS đã làm giảm diện tích dưới đường cong (AUC) cho glucose dưới 3,9 mmol/L (< 70 mg/dL) đối với hạ đường huyết về đêm hơn một phần ba, với tỷ lệ phần trăm các kết quả đọc của cảm biến trong phạm vi hạ đường huyết thấp hơn đáng kể, mà không có bất kỳ sự gia tăng nào của HbA1c. Trong một RCT khác tập trung vào những người trẻ tuổi có bằng chứng về nhận thức hạ đường huyết suy giảm, sự giảm kết hợp hạ đường huyết nặng (co giật/hôn mê) và trung bình có liên quan đến việc sử dụng LGS so với bơm với SMGB. Bằng chứng bổ sung từ các thử nghiệm quan sát nhi khoa chứng thực các kết quả từ các RCT, cùng với một phân tích dữ liệu được tải lên từ 935 người dùng SAP cung cấp 49.867 ngày-người dùng với LGS được sử dụng trong 82%. Một sự gia tăng glucose chậm vừa phải 2 giờ sau khi tiếp tục insulin đã được mô tả trong tất cả các nghiên cứu; tuy nhiên, không có sự khác biệt đáng kể nào về BOHB được quan sát thấy, ngay cả sau khi LGS được kích hoạt trong đêm ở hoặc trên mức đường huyết bình thường.
Mức độ thứ ba của liệu pháp SAP đi kèm với một phương thức tạm dừng insulin dự đoán khi glucose cảm biến thấp (PLGS), làm giảm thêm nguy cơ hạ đường huyết bằng cách tạm dừng cung cấp insulin trước khi dự đoán hạ đường huyết. Việc sử dụng tại nhà một PLGS đang được điều tra ở thanh thiếu niên và người lớn đã làm giảm phơi nhiễm với hạ đường huyết 81% và thời gian ở dưới 60 mg/dL (< 3,3mmo/L) 70%, với các kết quả tương đương trong một nhóm thuần tập nhi khoa và trong các nhóm thuần tập có các yếu tố nguy cơ khác nhau đối với hạ đường huyết, mà không có sự gia tăng đáng kể nào về nồng độ BOHB.
Hiện tại, phương thức PLGS có sẵn trên thị trường làm gián đoạn việc cung cấp insulin khi glucose của cảm biến được dự đoán sẽ đạt 20 mg/dL (1,1 mmol/L) trên giới hạn glucose thấp được cài đặt trước trong vòng 30 phút, và tự động tiếp tục cung cấp insulin nền khi đường huyết bình thường. Trong một đánh giá ban đầu tại phòng khám, hạ đường huyết đã được tránh trong 60% trong số 69 thí nghiệm. Một RCT với 100 trẻ em và thanh thiếu niên đã chứng minh sự giảm số lượng các biến cố hạ đường huyết 40% khi PLGS được sử dụng tại nhà, với một sự gia tăng khiêm tốn đồng thời về thời gian ở trong phạm vi tăng đường huyết nhẹ. Một RCT đa trung tâm kéo dài 6 tháng đã chứng minh giảm thời gian ở với glucose cảm biến dưới 63 mg/dL (< 3,5 mmol/L), mà không có sự khác biệt về mức HbA1c vào cuối nghiên cứu. Dữ liệu từ đánh giá thực tế hỗ trợ các kết quả từ các RCT, nhấn mạnh tầm quan trọng của việc giáo dục và đào tạo đúng cách.
Gần đây hơn, một RCT đã thử nghiệm hệ thống PLGS thứ hai có sẵn trên thị trường ở 102 người lớn, thanh thiếu niên và trẻ em, và đã chứng minh sự giảm tương đối tổng thể 31% về thời gian cảm biến dưới 70 mg/dL (< 3,9 mmol/L), mà không có sự khác biệt về nồng độ glucose trung bình, nhưng với sự gia tăng đáng kể về AUC lớn hơn 180 mg/dL và thời gian trên 250 mg/dL. Tuy nhiên, nồng độ BOHB đã được đánh giá vào 1954 buổi sáng, một nửa trong số đó xảy ra sau khi kích hoạt PLGS qua đêm, và tần suất BOHB trên 0,6 mmol/L không khác biệt. Các khuyến nghị đồng thuận về việc sử dụng SAP với PLGS không khuyến nghị thêm việc kiểm tra BOHB trong máu.
Các Cân nhắc Thực tế đối với Bơm Tăng cường Cảm biến
Thành công với SAP, cũng như với CGM, phụ thuộc vào sự hiểu biết về chức năng của hệ thống và các kỳ vọng thực tế. Các chủ đề được đề xuất khi khởi đầu SAP có thể bao gồm tần suất sử dụng cảm biến cần thiết, và khả năng mệt mỏi do báo động. Các báo động cho PLGS có thể được đặt thành tắt, đặc biệt là trong đêm, có thể với báo động ngưỡng thấp được bật. Nếu một biến cố hạ đường huyết xảy ra mặc dù đã tạm dừng insulin với PLGS, việc ăn carbohydrate cứu hộ nên được thực hiện một cách thận trọng để ngăn ngừa tăng đường huyết tái phát. Phân tích thường xuyên các dữ liệu tải xuống hỗ trợ các quyết định liên quan đến tất cả các cài đặt SAP, và đặc biệt là những cài đặt liên quan đến PLGS.
Cung cấp Insulin Tự động—Vòng kín (Tụy nhân tạo)
Các thiết bị bao gồm bơm, cảm biến và thuật toán gần đây đã được phát triển thành các sản phẩm thương mại cho bệnh nhân ĐTĐ tuýp 1. Các thiết bị này vẫn đang được cải tiến với mục tiêu tạo ra một hệ thống vòng kín hoàn chỉnh để cung cấp insulin, cái gọi là tụy nhân tạo. Các hệ thống cung cấp insulin tự động thường dựa trên CGM, một bơm insulin và một thuật toán máy tính kiểm soát lượng và tốc độ insulin được cung cấp cho bệnh nhân.
Bước đầu tiên hướng tới việc kiểm soát tự động cung cấp insulin là tính năng tạm dừng khi glucose thấp. Tính năng này là một thuật toán bổ sung cho những bệnh nhân đang sử dụng phương pháp bơm tăng cường cảm biến cho phép tốc độ nền của bơm của bệnh nhân bị tạm dừng trong tối đa 2 giờ nếu bệnh nhân không phản ứng với báo động glucose thấp của cảm biến (xem phần Theo dõi Glucose Liên tục trước đó). Các hệ thống này đã được thử nghiệm ở người lớn và trẻ em mắc ĐTĐ tuýp 1 và đã được phát hiện làm giảm đáng kể mức độ và thời gian hạ đường huyết về đêm ở bệnh nhân ĐTĐ tuýp 1.
Tính năng “tạm dừng khi glucose thấp” được theo sau bởi sự phát triển của PLGS thương mại, có khả năng tạm dừng mức nền của bơm ngay cả trước khi mức glucose của bệnh nhân đạt đến phạm vi hạ đường huyết được xác định trước. Trong hệ thống PLGS này, việc cung cấp insulin nền bị tạm dừng khi thuật toán dự đoán, dựa trên các xu hướng glucose của cảm biến cho thấy mức glucose máu của bệnh nhân sẽ sớm đạt đến vùng hạ đường huyết, mặc dù mức glucose máu tại thời điểm đó vẫn nằm trong phạm vi bình thường (xem phần Theo dõi Glucose Liên tục trước đó).
Một số nhóm các nhà điều tra, cũng như các nhà sản xuất bơm và cảm biến, hiện đang phát triển các hệ thống vòng kín còn được gọi là tụy nhân tạo. Các hệ thống này sử dụng các thuật toán điều khiển tự động điều chỉnh tốc độ truyền insulin do bơm cung cấp, dựa trên các kết quả đọc glucose của cảm biến mỗi vài phút (thường là mỗi 5 phút) cho ra 288 kết quả đọc mỗi 24 giờ. Ba phương pháp tiếp cận thuật toán cơ bản chính trong thực tế ngày nay là đạo hàm tích phân tỷ lệ (PID), điều khiển dự báo mô hình (MPC), và logic mờ. Ban đầu, các nghiên cứu chứng minh khái niệm với một số lượng nhỏ bệnh nhân tại các trung tâm nghiên cứu lâm sàng đã được tiến hành và đã chứng minh sự an toàn và hiệu quả của chúng. Vào năm 2011, nghiên cứu đa trung tâm, đa quốc gia, tiền cứu, ngẫu nhiên chéo có đối chứng đầu tiên, bao gồm 54 trẻ em và thanh thiếu niên, sử dụng cung cấp insulin tự động tại một khu nghỉ dưỡng bên ngoài môi trường được bảo vệ của bệnh viện, đã được tiến hành và báo cáo thành công. Nghiên cứu đó được theo sau bởi một loạt các nghiên cứu sử dụng các hệ thống vòng kín tại các trại hè đái tháo đường, cũng như các môi trường ngoại trú, và đã được chứng minh là an toàn và hiệu quả và nằm trong khả năng của các đối tượng. Những kết quả này cuối cùng đã dẫn đến sự chấp thuận quy định đầu tiên của Châu Âu—Dấu CE—cho thuật toán cung cấp insulin tự động vào năm 2015. “Hệ thống” cung cấp insulin tự động bao gồm bơm, cảm biến và máy đo (Minimed Medtronic 670G), đã được FDA chấp thuận cho những người từ 14 tuổi trở lên vào năm 2016. Đến năm 2018, hệ thống đã nhận được sự cho phép của FDA cho độ tuổi từ 7 trở lên, cũng như sự chấp thuận của Dấu CE Châu Âu. Hệ thống truyền insulin tự động này thân thiện với người dùng, và có khả năng thay đổi tốc độ truyền insulin theo mức glucose máu. Tuy nhiên, những nỗ lực phát triển một hệ thống vòng kín hoàn toàn đã không cho thấy kết quả mong muốn, chủ yếu là do các dao động đường huyết sau ăn đáng kể so với kết quả với các liều bolus trước bữa ăn. Do đó, các hệ thống cung cấp insulin tự động có sẵn ngày nay thực chất là một hệ thống “lai”, trong đó việc cung cấp insulin nền được kiểm soát bởi thuật toán, nhưng bệnh nhân cần phải thông báo bữa ăn một cách thủ công cùng với việc đánh giá hàm lượng carbohydrate và độ nhạy insulin cá nhân để cung cấp một liều bolus insulin trước bữa ăn. Các thuật toán vòng kín lai tiên tiến, hiện đang trong các nghiên cứu lâm sàng, có khả năng tiêm các liều bolus để điều chỉnh mức glucose cao giữa các bữa ăn hoặc tiêm một liều bolus sau bữa ăn nếu bệnh nhân quên tiêm một liều bolus trước bữa ăn. Vài nghìn bệnh nhân ĐTĐ tuýp 1 đã sử dụng thành công một hệ thống “lai” có sẵn trên thị trường (670G Medtronic) tại Hoa Kỳ, và dự kiến sẽ có mặt trên thị trường thương mại ở Châu Âu và các khu vực khác trên thế giới trong năm 2019. Các hệ thống cung cấp insulin tự động có sẵn trên thị trường ngày nay dựa trên việc chỉ cung cấp insulin, và do đó có khả năng tăng cung cấp insulin nền, cũng như tiêm các liều bolus, nếu cần, và giảm hoặc thậm chí tạm dừng cung cấp insulin, khi cần. Tuy nhiên, cũng có những nỗ lực liên tục của một số nhóm trên thế giới để phát triển một hệ thống hai hormone tự động tiêm insulin và glucagon với mục đích đạt được kiểm soát chuyển hóa gần như bình thường mà không bị hạ đường huyết, và tốt hơn so với một hệ thống chỉ dựa trên insulin. Tuy nhiên, vẫn còn một số mối lo ngại về hiệu quả và an toàn đã được nêu ra liên quan đến việc tiêm glucagon liên tục hoặc lặp lại, do đó các nghiên cứu lâm sàng để khắc phục những mối lo ngại này của các hệ thống vòng kín hai hormone đang được tiến hành.
Các nghiên cứu trên bệnh nhân ngoại trú trong điều kiện “sống tự do” đã chứng minh sự cải thiện TIR của mức glucose cảm biến trong khoảng 70 và 180 mg/dL (3,9–10 mmol/L) liên quan đến việc giảm thời gian ở trong phạm vi hạ đường huyết thông qua việc sử dụng cung cấp insulin tự động so với việc chỉ sử dụng bơm hoặc với liệu pháp SAP. Các hệ thống cung cấp insulin tự động cũng đã được chứng minh là làm giảm hạ đường huyết về đêm sau khi hoạt động thể chất vào buổi chiều, cũng như tăng sự hài lòng về điều trị.
Với số lượng bệnh nhân sử dụng các hệ thống vòng kín ngày càng tăng và khả năng tiếp cận ngày càng tăng của chúng, điều quan trọng là phải chuẩn bị cho cả bệnh nhân và HCP cho công nghệ mới và vẫn đang phát triển này và điều chỉnh các kỳ vọng với thực tế. Khả năng của các hệ thống hiện tại trong việc giảm thiểu hạ đường huyết không hoàn toàn hoàn hảo; bệnh nhân vẫn được yêu cầu phải cảnh giác và phản ứng với các báo động hạ đường huyết của hệ thống bằng cách ăn carbohydrate. Bệnh nhân nên được chuẩn bị để đối mặt và phản ứng một cách thích hợp với một số khó khăn kỹ thuật và báo động có thể xảy ra, được dạy khi nào nên ngừng cung cấp insulin tự động và quay trở lại cài đặt bơm trước đó của họ, cảnh giác với các tình huống khi hệ thống có thể tự động chuyển bệnh nhân từ chế độ tự động sang chế độ bơm thủ công, và phải làm gì khi và nếu mức glucose của cảm biến vẫn tăng cao theo thời gian.
Các hệ thống vòng kín trong tương lai có thể bao gồm việc kết hợp dữ liệu bổ sung có nguồn gốc từ các cảm biến khác, chẳng hang như theo dõi nhịp tim, mức độ hoạt động thể chất, nhiệt độ cơ thể, mô hình giấc ngủ, tâm trạng, vị trí địa lý, và đếm carbohydrate tự động để được tích hợp với trí tuệ nhân tạo (AI) và các thuật toán mới sẽ thay thế các hệ thống vòng kín lai bằng một hệ thống hoàn toàn tự động, một “tụy nội tiết nhân tạo”.
Thế giới kỹ thuật số mới nổi của bệnh đái tháo đường
Đái tháo đường là một bệnh mãn tính ảnh hưởng đến tất cả các khía cạnh của thói quen hàng ngày của bệnh nhân. Bệnh nhân đái tháo đường được yêu cầu phải đưa ra nhiều quyết định mỗi ngày liên quan đến hoạt động, chế độ ăn uống và chế độ insulin của họ. Sự tương tác của bệnh nhân với các HCP thường xảy ra vài tháng một lần ở hầu hết các trung tâm đái tháo đường trên thế giới. Giữa những lần khám lâm sàng này, bệnh nhân được yêu cầu tự quản lý bệnh đái tháo đường của mình, hoặc với sự giúp đỡ của cha mẹ, những người thân khác, hoặc những người chăm sóc khác trong môi trường xung quanh họ. Hơn nữa, sự gia tăng trên toàn thế giới về số lượng bệnh nhân mắc bệnh đái tháo đường, cả tuýp 2 và tuýp 1, số lượng không đủ các HCP chuyên về bệnh đái tháo đường, và thời gian hạn chế dành cho mỗi lần khám của bệnh nhân tạo ra nhu cầu về những cách mới để đối phó với việc chăm sóc bệnh đái tháo đường. Trong những năm gần đây, công nghệ kỹ thuật số đã có những bước tiến lớn, và số lượng người có quyền truy cập vào công nghệ kỹ thuật số thông qua Internet và điện thoại thông minh đã tăng lên đáng kể. Do đó, những nỗ lực đã xuất hiện để sử dụng các giải pháp kỹ thuật số để giúp bệnh nhân đối phó với bệnh đái tháo đường của họ giữa các lần khám lâm sàng, và để giúp các HCP với lượng dữ liệu ngày càng tăng trong quá trình khám lâm sàng. Với việc sử dụng ngày càng tăng các hồ sơ sức khỏe điện tử, CSII, CGM, isCGM, và gần đây là thông tin có được từ các bút tiêm được kết nối (bút tiêm insulin truyền thông tin về liều lượng và thời gian tiêm insulin lên đám mây), các HCP đang phải đối phó với “dữ liệu lớn” có nguồn gốc từ các nguồn khác nhau, đòi hỏi sự tích hợp, phân tích, và cuối cùng là một khuyến nghị được cá nhân hóa cho từng bệnh nhân của họ. Các công cụ dựa trên AI đã được phát triển để giúp các bác sĩ trong và giữa các lần khám của bệnh nhân. Chẩn đoán tự động bệnh võng mạc đái tháo đường (DR) dựa trên chụp ảnh đáy mắt sử dụng AI và các thuật toán học sâu đã được phát triển và thử nghiệm lâm sàng. Gần đây, một nghiên cứu đã được tiến hành nhằm đánh giá sự điều chỉnh của các bác sĩ đối với cài đặt bơm insulin dựa trên các dữ liệu tải xuống từ CSII, CGM, và glucose SMBG được thu thập trong 3 tuần của các bệnh nhân ĐTĐ tuýp 1. Trong nghiên cứu đó, 26 bác sĩ từ 16 trung tâm ở Châu Âu, Israel, và Nam Mỹ được yêu cầu điều chỉnh liều insulin của 15 bệnh nhân ĐTĐ tuýp 1. Nghiên cứu cho thấy tỷ lệ đồng ý hoàn toàn giữa các bác sĩ về: (1) xu hướng điều chỉnh insulin của tốc độ truyền insulin nền, (2) tỷ lệ insulin: carbohydrate (CR), và (3) hệ số điều chỉnh (CF) lần lượt là 41 ± 9%, 45 ± 11%, và 45,5% ± 13%; đối với sự không đồng ý hoàn toàn, chúng lần lượt là 12 ± 7%, 9,5 ± 7%, và 10 ± 8%. Kết quả tương tự đáng kể đã được tìm thấy giữa các bác sĩ và một thuật toán hỗ trợ quyết định tự động được phát triển cho các HCP. Các thuật toán AI khác đang được thử nghiệm với mục đích cung cấp các chương trình phòng ngừa và can thiệp được cá nhân hóa để giúp các HCP chọn phương pháp điều trị được cá nhân hóa tối ưu bằng cách sử dụng các thuật toán học sâu và học máy dựa trên các bộ dữ liệu lớn. Việc sử dụng AI cho phép xử lý thời gian thực dữ liệu lớn đến từ các nguồn khác nhau, chẳng hạn như bộ dữ liệu hồ sơ sức khỏe, thông tin di truyền cá nhân, khu vực địa lý, dữ liệu tải xuống từ các thiết bị và cảm biến, và biến thông tin này thành một kế hoạch được cá nhân hóa có thể hành động để sử dụng bởi các HCP hoặc bởi chính bệnh nhân. Có vẻ như bệnh nhân sẽ sớm có thể sử dụng các công cụ AI như vậy hàng ngày để điều chỉnh các chế độ điều trị của họ nhằm đạt được kiểm soát glucose tốt hơn mà không cần phải chờ đợi các cuộc hẹn đã lên lịch với các HCP của họ.
Phong trào Nguồn mở
Với quan niệm của nhiều bệnh nhân ĐTĐ tuýp 1 rằng công nghệ đang tiến bộ nhanh hơn so với các cơ quan quản lý trên thế giới có thể đánh giá và phê duyệt, một sáng kiến đã xuất hiện từ một số cá nhân và nhóm để thành lập một hiệp hội nguồn mở. Các công cụ sử dụng nguồn mở không cần phải được FDA chấp thuận và không phải để bán; những công cụ này miễn phí để bất kỳ ai sử dụng như một hệ thống nguồn mở cho phép những người bị đái tháo đường tự xây dựng tụy nhân tạo cho chính họ, vợ/chồng của họ, hoặc con cái của họ. Một số thuật toán nguồn mở sử dụng các sản phẩm độc quyền của ngành công nghiệp, chẳng hạn như bơm và CGM, với mục đích đẩy nhanh tốc độ mà những công cụ này trở nên có sẵn để bệnh nhân sử dụng nhằm cải thiện việc quản lý bệnh đái tháo đường của chính họ. Một sáng kiến thú vị khác là dự án Tidepool nguồn mở phi lợi nhuận. Tổ chức này đã phát triển một trung tâm dữ liệu đái tháo đường thu thập dữ liệu từ bơm, CGM, máy đo glucose máu và các thiết bị di động khác và tích hợp chúng và cho phép bệnh nhân đái tháo đường hình dung và sử dụng nó. Nền tảng Tidepool khuyến khích bệnh nhân đóng góp dữ liệu của họ với mục tiêu tạo ra một nguồn dữ liệu khổng lồ để bệnh nhân và các nhà nghiên cứu có thể sử dụng, từ đó phát triển các thuật toán tốt hơn cho bệnh nhân.
Thách thức Công nghệ
Hàng trăm ứng dụng và thuật toán điện thoại thông minh Internet để thu thập dữ liệu, cũng như quản lý đường huyết, hỗ trợ xã hội, tư vấn chế độ ăn uống, công cụ giảng dạy và các cố vấn khác, đã được phát triển và sẵn sàng sử dụng. Tuy nhiên, hầu hết các công cụ hiện nay đều chưa được FDA chấp thuận và tính an toàn cũng như hiệu quả của chúng chưa được kiểm nghiệm trong các thử nghiệm ngẫu nhiên có đối chứng (RCT) được thiết kế bài bản. Các nghiên cứu thực tế so sánh lợi ích của chúng với tiêu chuẩn chăm sóc còn rất hạn chế. Các vấn đề về quyền riêng tư liên quan đến việc ai sở hữu dữ liệu thu được từ các cảm biến và thiết bị khác nhau, cũng như khả năng bị tấn công, có thể xâm phạm quyền riêng tư của bệnh nhân và sự an toàn của người dùng thiết bị, vẫn đang được thảo luận liên tục. Lượng dữ liệu thu được từ các thiết bị và cảm biến khác nhau như CSII và CGM đã đặt ra nhu cầu xác định các dấu ấn sinh học kỹ thuật số mới ngoài các giá trị HbA1c truyền thống, chẳng hạn như thời gian nằm trong phạm vi, hạ đường huyết, tăng đường huyết và biến thiên đường huyết. Với ngày càng nhiều cảm biến và thiết bị kết nối, cùng việc sử dụng AI, công nghệ sẽ cung cấp các công cụ mới cho cả bệnh nhân và nhân viên y tế, sự tương tác và mối quan hệ giữa bệnh nhân và nhân viên y tế trong và giữa các lần khám cuối cùng sẽ thay đổi. Những thay đổi này cũng có thể thay đổi nền tảng kinh tế hiện đang được sử dụng để quản lý bệnh tiểu đường ở nhiều nơi trên thế giới.
Các công cụ kỹ thuật số có tiềm năng trao quyền cho bệnh nhân và cung cấp cho họ các công cụ có sẵn để sử dụng 24/7; điều này rất cần thiết để đối phó với một căn bệnh mãn tính như T1D, căn bệnh mà không có một ngày nào được nghỉ ngơi.
Tổng quan ngắn gọn này về cuộc cách mạng kỹ thuật số được vi tính hóa liên quan đến bệnh tiểu đường, đặc biệt là ở trẻ em, nhằm cảnh báo người đọc về lĩnh vực đang phát triển nhanh chóng này với những hứa hẹn và rủi ro của nó. Hứa hẹn, bởi vì việc ứng dụng các công nghệ này là cốt lõi của những tiến bộ trong việc quản lý bệnh tiểu đường. Điều này được chứng minh bằng sự phát triển của các hệ thống vòng kín cung cấp insulin kết hợp với cảm biến glucose, hay còn gọi là tuyến tụy nhân tạo, cũng như các hệ thống AI để khai thác, diễn giải và áp dụng lượng dữ liệu khổng lồ từ các công nghệ này. Nguy cơ là do phần lớn công nghệ vẫn đang trong quá trình phát triển, thiếu các tính năng an toàn nghiêm ngặt, vốn rất quan trọng cho việc tự điều trị của bệnh nhân và gia đình họ. Trên hết, những bình luận của chúng tôi được trình bày ở đây nhằm mục đích giáo dục người đọc, nhưng không nên được xem là sự chứng thực hay phê bình bất kỳ hệ thống hoặc sản phẩm cụ thể nào.
Sống chung với Bệnh đái tháo đường
Liệu pháp Dinh dưỡng Y khoa
Quản lý dinh dưỡng hợp lý là rất quan trọng đối với sức khỏe ngắn hạn và dài hạn của trẻ em mắc bệnh đái tháo đường. Nói chung, các thuật ngữ như chế độ ăn kiêng (diet) nên được tránh để thay bằng kế hoạch bữa ăn hoặc lựa chọn thực phẩm lành mạnh—cả vì ý nghĩa tiêu cực liên quan đến thuật ngữ cũ và vì một thực tế đơn giản là nhu cầu dinh dưỡng cho sự tăng trưởng và phát triển bình thường là như nhau ở trẻ em bị đái tháo đường và không bị đái tháo đường. Hơn nữa, việc ước tính tương đối chính xác hàm lượng carbohydrate trong bữa ăn là quan trọng để kiểm soát đường huyết tối ưu với các chế độ điều trị nền-bolus hiện tại. Thật vậy, sự phổ biến của các liệu pháp nền-bolus và việc sử dụng phương pháp đếm carbohydrate để điều chỉnh liều insulin tác dụng nhanh được tiêm trong mỗi bữa ăn đã thay đổi cơ bản mô hình điều trị.
Cách tiếp cận truyền thống là điều chỉnh lối sống của bệnh nhân theo liều insulin cố định và lượng carbohydrate cố định trong mỗi bữa ăn đã được thay thế bằng một cách tiếp cận linh hoạt hơn, cố gắng điều chỉnh chế độ insulin cho phù hợp với lối sống của bệnh nhân. Sự thay đổi về khẩu vị hàng ngày ở trẻ em và thanh thiếu niên làm cho cách tiếp cận sau có nhiều khả năng thành công hơn. Điều quan trọng cần lưu ý là ở một số bệnh nhân và một số gia đình, cách tiếp cận truyền thống cố gắng tiêu thụ các khẩu phần carbohydrate nhất quán cho mỗi bữa ăn/bữa phụ có thể thành công hơn vì nó phù hợp hơn với tính cách và lối sống của họ.
Mô hình liệu pháp dinh dưỡng được ưa chuộng hiện nay là đếm carbohydrate, dựa trên mô hình khái niệm về việc khớp “liều” carbohydrate với liều insulin. Vì tổng hàm lượng carbohydrate của thực phẩm (chứ không phải loại carbohydrate) có tác động lớn nhất đến glucose máu, lượng carbohydrate ăn vào mỗi bữa ăn hoặc bữa phụ cần được ước tính càng chính xác càng tốt. Mặc dù hàm lượng protein và chất béo trong bữa ăn có ảnh hưởng đến mô hình dao động glucose sau bữa ăn, chúng thường không được tính đến để đơn giản hóa quy trình. Việc tính toán chất béo và protein thường được đưa vào trong giáo dục nâng cao hơn và để sử dụng cho các điều chỉnh bolus của bơm insulin (bolus sóng kép hoặc sóng vuông). Các yêu cầu về nhãn mác thực phẩm đã đơn giản hóa quy trình vì hầu hết các loại thực phẩm đều được ghi nhãn rõ ràng với số gam carbohydrate mỗi khẩu phần và kích thước khẩu phần. Các loại thực phẩm khó định lượng hơn có thể được cân hoặc ước tính, và việc ăn ngoài có thể là một vấn đề đặc biệt. Mặc dù việc cấm “đồ ngọt” đã được bãi bỏ, chúng tôi vẫn khuyến nghị bệnh nhân tránh các loại đồ uống chứa đường.
Trong cách tiếp cận linh hoạt đối với tư vấn dinh dưỡng, không có lượng ăn vào cố định. Thay vào đó, trẻ và cha mẹ quyết định nội dung bữa ăn. Carbohydrate được đếm và một liều insulin được tính toán dựa trên tỷ lệ số đơn vị insulin trên gam carbohydrate được xác định bằng phương pháp thử và sai theo kinh nghiệm. Tỷ lệ insulin-carbohydrate thực tế thay đổi từ trẻ này sang trẻ khác và ở cùng một trẻ tùy theo thời gian trong ngày. Bữa sáng thường đòi hỏi tương đối nhiều insulin hơn bữa trưa hoặc bữa tối. Đếm carbohydrate cũng có thể được sử dụng trong cách tiếp cận truyền thống đối với điều trị dinh dưỡng để cung cấp các khẩu phần carbohydrate nhất quán cho mỗi bữa ăn/bữa phụ. Thật vậy, một cách tiếp cận đơn giản nhấn mạnh sự nhất quán về thời gian và quy mô bữa ăn có thể hiệu quả tại thời điểm chẩn đoán đái tháo đường—khi cha mẹ và bệnh nhân quá choáng ngợp để có thể học các khái niệm dinh dưỡng nâng cao hơn.
Các khuyến nghị của ADA về các nguyên tắc dinh dưỡng chung trong bệnh đái tháo đường cũng tính đến mục tiêu lâu dài là ngăn ngừa các biến chứng mạch máu lớn và vi mạch của bệnh đái tháo đường. Do đó, các chế độ ăn tốt cho tim mạch, ít cholesterol và chất béo bão hòa được khuyến khích. Các mục tiêu lâu dài của quản lý dinh dưỡng bệnh đái tháo đường bao gồm duy trì cân bằng lượng chất dinh dưỡng khoảng 50% carbohydrate, 20% protein và 30% chất béo (trong đó không quá 10% là chất béo bão hòa). Quan trọng nhất, sự tăng trưởng và tăng cân nên được theo dõi—và nên khuyến khích theo dõi thường xuyên với một chuyên gia dinh dưỡng được đào tạo về quản lý bệnh đái tháo đường để cá nhân hóa một kế hoạch bữa ăn cho mỗi trẻ dựa trên nhu cầu và sở thích thực phẩm của trẻ. Chúng ta đang đối mặt với một đại dịch béo phì ở trẻ em tại các nước phát triển, và một trong những hậu quả bất lợi của điều trị insulin tích cực là 30% đến 35% bệnh nhân nhi mắc ĐTĐ tuýp 1 tại Hoa Kỳ bị thừa cân hoặc béo phì. Do đó, bất kỳ xu hướng nào về điểm Z của chỉ số khối cơ thể (BMI) tăng quá mức cần phải được giải quyết kịp thời.
Vận động
Thiết lập và duy trì một lối sống năng động nên là một mục tiêu cho tất cả trẻ em, nhưng đặc biệt là trẻ em bị đái tháo đường, để tăng cường sức khỏe tim mạch. Vận động và thể chất tăng cường có liên quan đến việc cải thiện độ nhạy insulin và sử dụng glucose, các tương quan lâm sàng của nó là nhu cầu insulin thấp hơn, huyết áp thấp hơn và hồ sơ lipid tốt hơn. Những cải thiện về thể chất cũng thường liên quan đến lòng tự trọng cao hơn và tăng động lực tham gia vào việc chăm sóc bệnh đái tháo đường. Các hướng dẫn và tuyên bố đồng thuận gần đây đã xem xét chi tiết chủ đề này.
Mặc dù có những lợi ích của nó, các đợt vận động cấp tính ở trẻ em mắc ĐTĐ tuýp 1 thực sự làm cho việc điều hòa mức glucose máu trở nên khó khăn hơn. Hạ đường huyết là một biến chứng phổ biến trong khi vận động, và việc ăn vặt quá mức để ngăn ngừa hạ đường huyết có thể dẫn đến tăng đường huyết và làm mất đi một số lợi ích về chuyển hóa và tim mạch của việc vận động. Những khó khăn này càng trở nên phức tạp bởi mô hình hoạt động thể chất không đều đặn đặc trưng cho hầu hết thanh thiếu niên không tham gia vào các môn thể thao có tổ chức hoặc các chương trình tập luyện theo quy định và bởi các phương pháp quản lý bệnh đái tháo đường thông thường có liều thay thế insulin nền cố định. Mạng lưới Nghiên cứu Đái tháo đường ở Trẻ em đã chứng minh rằng nguy cơ hạ đường huyết về đêm gần như tăng gấp đôi ở thanh thiếu niên mắc ĐTĐ tuýp 1 sau khi vận động vào buổi chiều so với những ngày ít vận động.
Các tác động của việc vận động phải được xem xét cẩn thận trong bối cảnh của toàn bộ kế hoạch chăm sóc bệnh đái tháo đường. Trẻ em tham gia vào các môn thể thao ở trường hoặc các chương trình khác nên được tư vấn để theo dõi glucose máu trước, trong và sau khi vận động để tối ưu hóa việc quản lý đường huyết. Ngoài ra, bệnh nhân và cha mẹ nên nhận thức rằng các tác động hạ đường huyết muộn của việc vận động buổi chiều thường được quan sát thấy từ 7 đến 11 giờ sau đợt vận động vào buổi chiều, một hiện tượng dường như được gây ra bởi sự gia tăng trong việc thải bỏ glucose không qua oxy hóa trong khi ngủ, có thể phục vụ để hỗ trợ việc bổ sung lại các kho dự trữ glycogen trong cơ.
Ở những bệnh nhân đang điều trị bằng bơm, việc chỉ cần tạm dừng tốc độ truyền nền có thể làm giảm đáng kể nguy cơ hạ đường huyết trong khi vận động—và những lợi ích tương tự có thể có được từ việc giảm tốc độ nền qua đêm sau những ngày hoạt động rất tích cực. Hơn nữa, CGM thời gian thực có thể cực kỳ có giá trị để cung cấp các cảnh báo về hạ đường huyết sắp xảy ra. Các hệ thống tích hợp với CGM và bơm bao gồm tính năng tạm dừng dự đoán khi glucose thấp làm giảm hạ đường huyết trong các nghiên cứu ở trẻ em.
Các nghiên cứu đã xem xét các phương pháp quản lý đường huyết trong khi vận động minh họa rằng có một số lượng gần như vô hạn các kết hợp của các điều kiện cần được xem xét. Do sự phức tạp này, thử và sai vẫn là phương pháp chính để quản lý mức glucose trong và sau khi vận động ở trẻ em và thanh thiếu niên mắc ĐTĐ tuýp 1, mặc dù các nguyên tắc hướng dẫn tồn tại trong nhiều hướng dẫn và bài đánh giá.
Chức năng tế bào β còn lại (Giai đoạn Trăng mật)
Sau khi bắt đầu điều trị bằng insulin ở những bệnh nhân mới được chẩn đoán, chức năng bài tiết của các tế bào beta còn lại được cải thiện và sự đề kháng insulin cũng như độc tính của glucose trong bệnh đái tháo đường mất bù được đảo ngược—báo hiệu sự khởi đầu của giai đoạn thuyên giảm một phần (giai đoạn trăng mật) của ĐTĐ tuýp 1. Hầu hết bệnh nhân cần giảm dần liều hàng ngày của họ để tránh hạ đường huyết quá mức. Một số ít trẻ em (< 5% bệnh nhân) thậm chí có thể duy trì đường huyết bình thường trong một thời gian mà không cần tiêm insulin. Mặc dù có nhiều ý kiến khác nhau, chúng tôi không ngừng điều trị bằng insulin trừ khi liều hàng ngày 0,1 U/kg vẫn gây hạ đường huyết.
Thời gian của giai đoạn trăng mật ở trẻ em mắc ĐTĐ tuýp 1 là khác nhau, nhưng mức HbA1c và TDD thấp nhất thường được quan sát thấy trong khoảng từ 3 đến 6 tháng sau chẩn đoán và cả hai thường tăng lên trong khoảng từ 9 đến 15 tháng. Với các phương pháp điều trị MDI và CSII hiện tại, phần lớn thanh thiếu niên mắc ĐTĐ tuýp 1 vẫn giữ lại được sự bài tiết insulin còn lại đáng kể, được đo bằng đáp ứng C-peptide với các nghiệm pháp dung nạp bữa ăn hỗn hợp, trong năm đầu tiên của bệnh, và điều này có thể kéo dài thêm vài năm sau đó với việc duy trì kiểm soát đường huyết tối ưu. So với những bệnh nhân âm tính với C-peptide, những bệnh nhân có chức năng tế bào beta còn lại có mức HbA1c và tổng liều insulin hàng ngày thấp hơn—cũng như giảm nguy cơ hạ đường huyết. Những lợi ích lâm sàng và chuyển hóa này là cơ sở vững chắc cho nghiên cứu hiện tại liên quan đến các can thiệp miễn dịch nhằm bảo tồn chức năng tế bào beta ở những bệnh nhân mới được chẩn đoán. Mặt khác, việc áp dụng sớm hơn và tích cực hơn liệu pháp bơm tăng cường cảm biến vào khoảng thời gian chẩn đoán dường như không mang lại bất kỳ lợi thế nào so với MDI và CSII tiêu chuẩn về mức HbA1c hoặc khả năng đáp ứng C-peptide ở thanh thiếu niên mắc ĐTĐ tuýp 1.
Hạ đường huyết
Trong lịch sử, mặt tối của các chế độ điều trị tích cực có hiệu quả trong việc hạ thấp mức HbA1c là chúng cũng làm tăng nguy cơ hạ đường huyết. Trong DCCT, liệu pháp tích cực có liên quan đến nguy cơ hạ đường huyết nặng tăng khoảng ba lần so với điều trị thông thường và, bất kể nhóm điều trị nào, tỷ lệ hạ đường huyết nặng cao hơn khoảng 50% đối với thanh thiếu niên so với người lớn. Hạ đường huyết đã trở thành rào cản đáng kể nhất đối với việc theo đuổi và duy trì kiểm soát đường huyết chặt chẽ ở những người mắc ĐTĐ tuýp 1, và việc quản lý hiệu quả nguy cơ hạ đường huyết là đặc biệt quan trọng trong điều trị trẻ em và thanh thiếu niên mắc bệnh này. Tuy nhiên, dữ liệu gần đây hơn từ nhiều sổ đăng ký trên toàn thế giới cho thấy sự phẳng lại của báo cáo DCCT, vốn đã chứng minh mối quan hệ nghịch đảo cong của A1c với hạ đường huyết nặng. Dữ liệu đương đại cho thấy các mục tiêu A1c có thể được đáp ứng mà không làm tăng hạ đường huyết nặng.
ADA và ISPAD đã thống nhất các định nghĩa của họ với định nghĩa của Nhóm Nghiên cứu Hạ đường huyết Quốc tế như sau: (1) cảnh báo hạ đường huyết lâm sàng (giá trị glucose ≤ 70 mg/dL [3,9 mmol/L]) cần chú ý để ngăn ngừa hạ đường huyết; (2) hạ đường huyết quan trọng hoặc nghiêm trọng trên lâm sàng (giá trị glucose < 54 mg/dL [3,0 mmol/L]) chỉ ra hạ đường huyết nghiêm trọng, quan trọng trên lâm sàng; và (3) hạ đường huyết nặng được định nghĩa là một biến cố liên quan đến suy giảm nhận thức nặng (bao gồm hôn mê và co giật) cần sự hỗ trợ từ bên ngoài của người khác. Ở người lớn không bị đái tháo đường, dưới 70 mg/dL là mức glucose huyết tương mà tại đó các đáp ứng hormone đối kháng điều hòa bắt đầu hoạt động và tại đó nhận thức về các triệu chứng thường xảy ra. Tuy nhiên, cần lưu ý rằng các đáp ứng như vậy có thể được kích hoạt ở mức glucose cao hơn ở trẻ em từ 8 đến 16 tuổi khỏe mạnh và ở trẻ em và thanh thiếu niên mắc ĐTĐ tuýp 1 có kiểm soát đường huyết kém.
Hai cơ chế chính gây ra các triệu chứng và dấu hiệu của hạ đường huyết là sự tuôn ra của catecholamine (dẫn đến xanh xao, đổ mồ hôi, lo lắng, run rẩy và nhịp tim nhanh) và các tác động của tình trạng thiếu glucose ở não, bao gồm đói, buồn ngủ, lú lẫn, co giật và hôn mê. Những thay đổi về tâm trạng và tính cách có thể là những tác động thiếu glucose ở não tinh vi hơn, cung cấp một manh mối sớm cho thấy glucose huyết tương đã giảm xuống mức nguy hiểm. Các đợt có triệu chứng mà bệnh nhân có thể tự điều trị mà không cần sự hỗ trợ của người khác được coi là hạ đường huyết nhẹ hoặc trung bình, trong khi các đợt có suy giảm nhận thức đủ để việc điều trị cần sự hỗ trợ của người khác được coi là các biến cố hạ đường huyết nặng hoặc nghiêm trọng. Các biến cố hạ đường huyết gây co giật hoặc hôn mê thường được phân loại là một tập hợp con của hạ đường huyết nặng. Trong hạ đường huyết nặng, việc ăn carbohydrate có thể bị cản trở do mất ý thức, co giật hoặc hôn mê—và việc điều trị có thể cần tiêm glucagon hoặc truyền glucose tĩnh mạch.
Ở trẻ em không bị đái tháo đường, đáp ứng ban đầu đối với việc giảm mức glucose huyết tương là sự ức chế nhanh chóng bài tiết insulin. Nếu glucose huyết tương tiếp tục giảm và đạt đến các giá trị ngưỡng để giải phóng các hormone đối kháng điều hòa chống insulin, sẽ có sự gia tăng đột ngột nồng độ glucagon và epinephrine trong tuần hoàn. Nồng độ hormone tăng trưởng và cortisol trong huyết tương cũng tăng lên, nhưng những hormone này ít quan trọng hơn trong việc chống lại cấp tính các tác động của insulin. Sự đối kháng điều hòa khiếm khuyết xảy ra ở bệnh nhân ĐTĐ tuýp 1 vì nồng độ insulin được cung cấp từ bên ngoài không giảm để đáp ứng với mức glucose máu thấp và khả năng bài tiết glucagon để đáp ứng với hạ đường huyết bị mất sớm trong quá trình của bệnh. Do đó, bệnh nhân ĐTĐ tuýp 1 phụ thuộc vào các đáp ứng của hệ thần kinh giao cảm—đặc biệt là sự gia tăng nồng độ epinephrine trong huyết tương—để ngăn ngừa hạ đường huyết.
Các đợt hạ đường huyết nhẹ thường đi kèm với điều trị tích cực làm giảm các đáp ứng catecholamine và nhận thức triệu chứng đối với các thách thức hạ đường huyết tiếp theo. Hiện tượng này được gọi là suy giảm tự chủ liên quan đến hạ đường huyết (HAAF). Các nghiên cứu đã cho thấy rằng những khiếm khuyết như vậy trong các đáp ứng hormone đối kháng điều hòa là phổ biến ở cả trẻ nhỏ và thanh thiếu niên mắc ĐTĐ tuýp 1 được kiểm soát tốt. Các đáp ứng catecholamine đối với hạ đường huyết cũng bị suy giảm trong khi ngủ, đây là một lý do quan trọng tại sao hầu hết các biến cố hạ đường huyết nặng xảy ra vào ban đêm. Như đã lưu ý trước đó, các đợt vận động vào buổi chiều làm tăng mạnh nguy cơ hạ đường huyết vào đêm hôm sau.
Việc sử dụng liệu pháp nền-bolus với các analog insulin và bơm insulin đã làm giảm tần suất hạ đường huyết nặng nhưng không hề loại bỏ được vấn đề này. Mức HbA1c có thể được giảm ở những bệnh nhân sử dụng CGM có hoặc không có tích hợp trong một hệ thống bơm tăng cường cảm biến mà không làm tăng nguy cơ hạ đường huyết, nhưng việc giảm hạ đường huyết nặng vẫn là một ưu tiên lâm sàng. Trong Sổ đăng ký Phòng khám T1D Exchange bao gồm hơn 10.000 trẻ em mắc ĐTĐ tuýp 1, 1 trong 20 bệnh nhân báo cáo có ít nhất một cơn co giật hoặc biến cố hôn mê liên quan đến hạ đường huyết trong 12 tháng trước đó. Cũng đáng chú ý là nguy cơ hạ đường huyết nặng ở những bệnh nhân có mức HbA1c trên 9,5% trong nhóm thuần tập này tương tự như ở những bệnh nhân có mức HbA1c dưới 8%. Những dữ liệu này chỉ ra rằng kiểm soát kém, tự nó, không phải là một chiến lược hiệu quả để giảm nguy cơ hạ đường huyết.
Điều quan trọng là bệnh nhân và gia đình phải nhận biết sớm các triệu chứng và dấu hiệu của hạ đường huyết và các yếu tố thúc đẩy đã biết. Các đợt nhẹ nên được điều trị ngay lập tức bằng 10–15g (hoặc ~ 0,3 g/kg) carbohydrate (ví dụ, viên glucose, nước trái cây, hoặc gel glucose). Cha mẹ và y tá trường học cũng cần được hướng dẫn cách tiêm glucagon (0,5–1,0 mg) khi bệnh nhân mất ý thức và không thể nuốt carbohydrate ngoại sinh. Nếu vận động là yếu tố thúc đẩy, bệnh nhân nên được hướng dẫn về các biện pháp phòng ngừa. Việc phát triển các chế phẩm glucagon dùng đường uống đang được tiến hành và cho thấy hứa hẹn là một phương pháp hiệu quả, hữu hiệu và tự sử dụng để tránh hạ đường huyết mà không cần chuẩn bị phức tạp các dạng tiêm hiện tại.
Quản lý những ngày bị bệnh
Trẻ em bị các bệnh xen kẽ, chẳng hạn như nhiễm trùng hoặc nôn mửa, nên được theo dõi chặt chẽ về sự tăng cao của mức glucose máu và ceton niệu. Vào những ngày bị bệnh, mức glucose máu nên được kiểm tra mỗi 2 giờ—và nước tiểu nên được kiểm tra ceton mỗi lần đi tiểu. Các liều bổ sung insulin tác dụng nhanh (0,1–0,3 U/kg) nên được tiêm mỗi 2 đến 4 giờ đối với sự tăng cao của glucose hoặc ceton. Ngay cả khi không có tăng đường huyết rõ rệt, sự hiện diện của ceton cho thấy sự thiếu hụt insulin và do đó cần insulin bổ sung.
Uống đủ chất lỏng là cần thiết để ngăn ngừa mất nước và đẩy nhanh việc bài tiết ceton. Các chất lỏng như soda không ga, súp trong, kem que và nước gelatin được khuyến nghị để cung cấp một số chất điện giải và carbohydrate thay thế. Ở trẻ dung nạp được bù nước bằng đường uống, một “liều” chất lỏng 1 ounce (30 mL) mỗi năm tuổi mỗi giờ là một hướng dẫn sơ bộ, hàm lượng đường của nó phụ thuộc vào glucose huyết thanh. Đối với các giá trị glucose máu lớn hơn 200 mg/dL, nên cho uống các chất lỏng không đường. Đối với các mức từ 140 đến 200 mg/dL, nên cho uống một hỗn hợp các chất lỏng không đường và có đường. Đối với đường máu dưới 140 mg/dL, chỉ nên cho uống các chất lỏng có đường.
Nếu nôn mửa cản trở việc ăn uống bình thường bằng đường miệng, nên ngừng insulin tác dụng trung gian hoặc kéo dài và nên tiêm các liều nhỏ thường xuyên insulin tác dụng ngắn hoặc nhanh. Ở những bệnh nhân được điều trị bằng bơm, nếu nôn mửa cản trở việc ăn uống bình thường bằng đường miệng, nên tiếp tục insulin nền, nhưng cũng có thể sử dụng các tốc độ nền tạm thời cao hơn hoặc thấp hơn, để tránh hạ đường huyết hoặc nhiễm ceton tùy thuộc vào những thay đổi về mức glucose và ceton. Sau khi ceton đã được loại bỏ và trẻ dung nạp được chế độ ăn uống bằng đường miệng, gia đình có thể tiếp tục thói quen bình thường. Nếu nôn mửa kéo dài và ceton vẫn ở mức trung bình hoặc lớn sau vài liều insulin bổ sung, nên sắp xếp để có thể bù nước và đánh giá tại khoa cấp cứu của bệnh viện.
Cần đặc biệt chú ý đến tình trạng tăng đường huyết kéo dài ở những bệnh nhân sử dụng liệu pháp bơm, vì việc không có insulin nền tác dụng kéo dài có thể dẫn đến sự phát triển của ceton và DKA nếu insulin tác dụng nhanh không được cung cấp. Vì chỉ có insulin tác dụng nhanh được tiêm, sự gián đoạn cung cấp insulin sẽ dẫn đến sự gia tăng mức ceton trong máu và nước tiểu sau 4 đến 6 giờ. Những sự gián đoạn này thường do các vấn đề với bộ truyền dịch, chẳng hạn như gấp khúc hoặc tắc nghẽn catheter dưới da. Do đó, việc đánh giá tăng đường huyết và bất kỳ triệu chứng buồn nôn và nôn nào phải bao gồm việc đánh giá tính toàn vẹn của bộ truyền dịch và vị trí truyền.
Các Bệnh Tự miễn Liên quan
Bệnh nhân ĐTĐ tuýp 1 có nguy cơ cao mắc các bệnh tự miễn khác. Những bệnh này được trình bày chi tiết trong Chương 22, trong phần thảo luận về các hội chứng suy đa nội tiết. Viêm tuyến giáp lympho bào mạn tính thường liên quan đến ĐTĐ tuýp 1 ở trẻ em, và có tới một phần năm có thể có kháng thể tuyến giáp trong huyết thanh của họ. Tuy nhiên, chỉ một tỷ lệ nhỏ trong số những bệnh nhân này phát triển suy giáp lâm sàng. Khoảng thời gian giữa chẩn đoán đái tháo đường và chẩn đoán bệnh tuyến giáp trung bình khoảng 5 năm. Các bác sĩ nên dự đoán khả năng suy giáp ở bệnh nhân ĐTĐ tuýp 1 bằng cách kiểm tra định kỳ tuyến giáp và đo nồng độ hormone kích thích tuyến giáp (TSH) trong huyết thanh.
Khi bệnh đái tháo đường và bệnh tuyến giáp cùng tồn tại, nên xem xét khả năng suy thượng thận. Điều này có thể được báo hiệu bằng việc giảm nhu cầu insulin, tăng sắc tố da và niêm mạc miệng, thèm muối, yếu và hạ huyết áp tư thế. Hiếm khi, cơn Addisonian rõ ràng là bằng chứng đầu tiên của suy thượng thận. Hội chứng này thường xảy ra ở thập kỷ thứ hai của cuộc đời hoặc muộn hơn.
Bệnh Celiac ảnh hưởng từ 2% đến 8% trẻ em mắc ĐTĐ tuýp 1, và hầu hết trong số họ không nhận thức được bất kỳ triệu chứng tiêu hóa nào. Chẩn đoán sớm đòi hỏi phải sàng lọc các kháng thể transglutaminase mô, có độ tái lập, độ đặc hiệu và độ nhạy cao nếu tổng nồng độ IgA lưu hành không thấp bất thường. Trẻ em dương tính với kháng thể nên được chuyển đến một bác sĩ tiêu hóa nhi để xác nhận bằng sinh thiết ruột non, cũng như để được tư vấn và quản lý bệnh. Khi có các dấu hiệu và triệu chứng điển hình của kém hấp thu hoặc bệnh nhân bị hạ đường huyết thường xuyên hoặc thay đổi tâm trạng hành vi không giải thích được, can thiệp chế độ ăn uống được chỉ định. Khi các triệu chứng là tối thiểu hoặc không có, quyết định đưa ra chế độ ăn không chứa gluten với những gánh nặng hạn chế và bất tiện bổ sung cho bệnh nhân và gia đình là ít rõ ràng hơn. Để hướng dẫn quyết định của họ, cha mẹ và trẻ lớn hơn cần được nhận thức về nguy cơ ung thư ruột ở bệnh Celiac không được điều trị trong cuộc sống sau này và về các biến chứng lâu dài khác của bệnh này.
Các Vấn đề Tâm lý xã hội Liên quan
Bệnh đái tháo đường ở một đứa trẻ ảnh hưởng đến lối sống và các mối quan hệ giữa các cá nhân của cả gia đình. Các hướng dẫn về quản lý và hỗ trợ tâm lý xã hội cho các gia đình có trẻ bị đái tháo đường đã được công bố. Cảm giác lo lắng và tội lỗi là phổ biến ở cha mẹ. Những cảm giác tương tự, cùng với sự từ chối và phủ nhận, cũng phổ biến ở trẻ em—đặc biệt là trong những năm tháng nổi loạn của tuổi vị thành niên. Những vấn đề này không chỉ có ở ĐTĐ tuýp 1 mà còn được quan sát thấy ở các gia đình có trẻ em mắc các rối loạn mãn tính khác khó điều trị. Những căng thẳng này thường bị phóng đại ở các gia đình đơn thân có thu nhập thấp và làm suy giảm khả năng thực hiện hiệu quả các nhiệm vụ tự quản lý cần thiết, dẫn đến kiểm soát chuyển hóa kém. Các rào cản ngôn ngữ và văn hóa là những trở ngại bổ sung ở các gia đình nhập cư.
Những khó khăn tâm lý xã hội và xung đột giữa bệnh nhân và cha mẹ có thể dẫn đến việc không tuân thủ các hướng dẫn về lựa chọn thực phẩm lành mạnh, liệu pháp insulin và tần suất theo dõi glucose máu. Trong kỷ nguyên của liệu pháp insulin nền-bolus này, việc bỏ lỡ các liều bolus trước bữa ăn là nguyên nhân phổ biến nhất của mức HbA1c tăng cao, đặc biệt ở thanh thiếu niên. Do đó, một trong những ưu điểm chính của CSII so với MDI ở bệnh nhân nhi là chức năng lịch sử bolus của các bơm insulin hiện tại cung cấp một bản ghi về số lượng liều bolus hàng ngày đã được tiêm thực tế. Việc cố ý dùng quá liều insulin dẫn đến hạ đường huyết hoặc bỏ tiêm insulin để hạn chế tăng cân (còn được gọi là diabulimia) có thể là những lời kêu gọi giúp đỡ về tâm lý. Đôi khi, chúng có thể là biểu hiện của ý định tự tử. Việc nhập viện thường xuyên vì nhiễm toan ceton hoặc hạ đường huyết nên làm dấy lên nghi ngờ về xung đột tình cảm và gia đình tiềm ẩn. Cảm giác khác biệt hoặc cô đơn cũng phổ biến.
Bác sĩ lâm sàng quản lý một đứa trẻ hoặc thanh thiếu niên bị đái tháo đường nên nhận thức được vai trò then chốt của mình là một người tư vấn và cố vấn và nên dự đoán các vấn đề tình cảm phổ biến của bệnh nhân. Khi các vấn đề tình cảm rõ ràng là nguyên nhân gây ra sự tuân thủ kém với chế độ y tế, việc giới thiệu để được giúp đỡ về tâm lý là cần thiết. Tại các trung tâm nhi khoa, các nhà tâm lý học là một phần của đội ngũ quản lý cho trẻ em bị đái tháo đường. Mặc dù trầm cảm lâm sàng là một trong những bệnh đi kèm phổ biến nhất ở thanh thiếu niên mắc ĐTĐ tuýp 1, các vấn đề trong lĩnh vực này có thể không rõ ràng trong các lần khám tại phòng khám định kỳ, đặc biệt ở trẻ tiền vị thành niên có thể biểu hiện hơi thu mình hơn là nổi loạn. Do đó, các hướng dẫn điều trị đề nghị rằng các bảng câu hỏi sàng lọc các triệu chứng trầm cảm nên được thực hiện cho thanh thiếu niên mắc ĐTĐ tuýp 1 một cách thường xuyên. Tuy nhiên, việc thực hiện khuyến nghị này ở hầu hết các cơ sở lâm sàng là rất khó khăn.
Chăm sóc Ngoại trú
Tầm quan trọng của việc theo dõi thường xuyên bởi đội ngũ chăm sóc sức khỏe đái tháo đường không thể được nhấn mạnh quá mức. Trẻ em và thanh thiếu niên mắc ĐTĐ tuýp 1 nên được chăm sóc thường xuyên tại một trung tâm đái tháo đường sử dụng một đội ngũ đa ngành có kiến thức và kinh nghiệm trong việc quản lý bệnh nhân trẻ tuổi. Đội ngũ này lý tưởng nên bao gồm các bác sĩ đái tháo đường nhi, y tá chuyên khoa đái tháo đường, chuyên gia dinh dưỡng, và nhân viên xã hội hoặc nhà tâm lý học.
ADA và ISPAD đã công bố các hướng dẫn chăm sóc trẻ em và thanh thiếu niên bị đái tháo đường. Các lần khám theo dõi định kỳ với bác sĩ hoặc y tá chuyên khoa/thực hành đái tháo đường mỗi 2 đến 3 tháng được khuyến nghị cho hầu hết bệnh nhân. Mục đích chính của những lần khám này là để đảm bảo rằng bệnh nhân đang đạt được các mục tiêu điều trị chính. Các lần khám ngoại trú cung cấp một cơ hội để xem xét việc theo dõi glucose (và các hồ sơ CGM), để điều chỉnh chế độ điều trị, và để đánh giá sự thích ứng của trẻ và gia đình. Tại mỗi lần khám, các hồ sơ glucose nên được xem xét và các thay đổi về liều lượng hoặc lịch trình phù hợp nên được thực hiện. Chuyên gia dinh dưỡng và nhà tâm lý học hoặc nhân viên xã hội cũng đưa ra lời khuyên và hỗ trợ theo dõi.
Một bệnh sử tạm thời chi tiết nên bao gồm các câu hỏi liên quan đến sức khỏe chung, năng lượng, mệt mỏi, tiểu nhiều hoặc tiểu đêm, các bệnh xen kẽ, các đợt hạ đường huyết, và sự hiện diện của các triệu chứng như đau bụng, đầy hơi hoặc tiêu chảy. Điều quan trọng cần nhớ là các bệnh đi kèm của các rối loạn tự miễn khác xảy ra với tần suất gia tăng ở trẻ em mắc ĐTĐ tuýp 1: viêm tuyến giáp, suy thượng thận và bệnh Celiac. Trẻ nên được cân và đo tại mỗi lần khám, và huyết áp được ghi nhận. Khám thực thể trẻ nên tập trung vào các hệ cơ quan chung và vào việc kiểm tra da và các vị trí tiêm insulin/đặt bơm để tìm các dấu hiệu loạn dưỡng mỡ hoặc thay đổi sắc tố, sờ nắn tuyến giáp, và xác định giai đoạn phát triển sinh dục.
Teo mỡ thường được quan sát thấy trong quá khứ nhưng hiện nay là một biến chứng hiếm gặp của liệu pháp insulin. Sự chậm tăng trưởng, chậm phát triển sinh dục, hoặc phát hiện bướu cổ có thể báo hiệu suy giáp. Bác sĩ lâm sàng nhạy bén cũng nên xem xét rằng hạ đường huyết không giải thích được thường xuyên hoặc giảm nhu cầu insulin khi không có vận động hoặc hoạt động có thể là những chỉ số tinh vi của suy giáp hoặc suy thượng thận. Tương tự, mặc dù tiền sử đi ngoài phân có mùi hôi, nhờn thường xuyên là một chỉ số rõ ràng hơn của bệnh Celiac, phần lớn các trường hợp không có triệu chứng.
Việc đo hemoglobin glycosyl hóa (HbA1c) cung cấp tiêu chuẩn vàng để đánh giá sự đầy đủ của chế độ insulin và việc sử dụng các phương pháp tại điểm dịch vụ có thể được thực hiện tại văn phòng trong vài phút mang lại cơ hội để thực hiện các thay đổi ngay lập tức trong chế độ insulin trong khi bệnh nhân đang được khám. Kết quả của các phép đo tại điểm chăm sóc so sánh tốt với các phương pháp trong phòng thí nghiệm. Thậm chí quan trọng hơn, kết quả của xét nghiệm này được cung cấp trong các cuộc gặp mặt trực tiếp với bác sĩ lâm sàng đóng vai trò là “phiếu báo cáo” hàng quý cho trẻ và cha mẹ. Thanh thiếu niên có thể không thể đồng cảm với khái niệm làm việc chăm chỉ với bệnh đái tháo đường của họ để khỏe mạnh hơn nhiều năm trong tương lai, nhưng hầu hết đều có thể hiểu được điểm số tốt. Do đó, mức HbA1c cung cấp một kết quả hữu hình mà họ có thể đồng cảm. Mục tiêu của điều trị là đạt được mức HbA1c càng gần mức bình thường càng tốt. Dựa trên kết quả DCCT và các khuyến nghị của ADA, mục tiêu chung của chúng tôi trong điều trị là cố gắng giữ cho tất cả bệnh nhân dưới 7,5%, mặc dù ISPAD gần đây đã hạ mục tiêu xuống 7,0%. Mức HbA1c được xác định ít nhất mỗi 3 tháng.
Sàng lọc định kỳ các bệnh tự miễn liên quan bằng T4, TSH và IgA transglutaminase mô mỗi 1 đến 2 năm được khuyến nghị. Việc theo dõi trẻ bị đái tháo đường để tìm các biến chứng tiềm tàng và các yếu tố nguy cơ tim mạch là một chức năng quan trọng khác của lần khám tại phòng khám. Tỷ lệ albumin/creatinine trong nước tiểu bình thường là dưới 30 mg albumin trên gam creatinine, microalbumin niệu là 30 đến 300 mg/g, và macroalbumin niệu là lớn hơn 300 mg/g. Các mẫu xét nghiệm tại chỗ tăng cao nên được xác nhận bằng ít nhất một kết quả dương tính thứ hai. Tốt nhất đây nên là nước tiểu đầu tiên vào buổi sáng hoặc một mẫu thu thập qua đêm có hẹn giờ để loại trừ protein niệu tư thế lành tính. Nếu xét nghiệm xác nhận cũng cho thấy microalbumin niệu, việc điều trị bằng thuốc ức chế men chuyển angiotensin hoặc thuốc chẹn thụ thể angiotensin hoặc giới thiệu đến bác sĩ thận nhi khoa được chỉ định. Tất cả trẻ em bị đái tháo đường bị tăng huyết áp, bất kể tình trạng bài tiết albumin, cũng nên được xem xét là ứng cử viên cho các loại thuốc này. Các khuyến nghị hiện tại cho trẻ em không bị đái tháo đường là huyết áp trên bách phân vị thứ 90 theo tuổi cần can thiệp lối sống và những trẻ trên bách phân vị thứ 95 xứng đáng sử dụng các tác nhân dược lý với các chi tiết khác có sẵn trong các hướng dẫn của ADA và ISPAD.
Các nghiên cứu sàng lọc khác cho các biến chứng của bệnh đái tháo đường bao gồm việc đo nồng độ lipid trong huyết thanh. Các tiêu chuẩn chăm sóc hiện tại cho người lớn bị đái tháo đường chỉ ra rằng nồng độ lipoprotein mật độ thấp (LDL) nên được duy trì dưới 100 mg/dL, trong khi liệu pháp dược lý cho rối loạn lipid máu ở trẻ em bị đái tháo đường không được khuyến nghị trừ khi các can thiệp chế độ ăn uống không thành công trong việc hạ nồng độ LDL xuống dưới 130 mg/dL. ADA khuyến nghị rằng các cuộc kiểm tra võng mạc có nhỏ thuốc giãn đồng tử hàng năm nên được thực hiện ở những bệnh nhân trên 10 tuổi và đã mắc ĐTĐ tuýp 1 từ 3 năm trở lên. Mặt khác, kết quả từ các cuộc kiểm tra như vậy rất thấp ở trẻ em và thanh thiếu niên có huyết áp bình thường, mức HbA1c đáp ứng các mục tiêu hiện tại, và không có microalbumin niệu. Một cuộc thảo luận chi tiết về các biến chứng, chẩn đoán, tiên lượng và điều trị của chúng ở trẻ em bị đái tháo đường được tìm thấy dưới đây.
Quản lý trong Quá trình Phẫu thuật
Mục tiêu quản lý trong quá trình phẫu thuật là ngăn ngừa hạ đường huyết, mất dịch quá mức và nhiễm ceton trong quá trình gây mê. Các chế độ được mô tả ở đây thường có thể áp dụng, nhưng sự cảnh giác và điều chỉnh cá nhân cho mỗi bệnh nhân là cần thiết để đạt được những mục tiêu này. Các nghiên cứu có đối chứng, dựa trên bằng chứng về chăm sóc chu phẫu chưa được thực hiện ở trẻ em, nhưng các bài đánh giá chuyên môn chi tiết về quản lý đã được công bố trong các tài liệu gây mê và đái tháo đường nhi khoa và các Hướng dẫn của ISPAD gần đây.
Cách tiếp cận đáng tin cậy và đơn giản nhất để đạt được các mục tiêu quản lý trong các cuộc phẫu thuật lớn có chọn lọc hoặc khẩn cấp là sử dụng truyền glucose và insulin tĩnh mạch trong giai đoạn chu phẫu. Đối với các trường hợp cấp cứu ngoại khoa có thể trì hoãn trong thời gian ngắn, chẳng hạn như viêm ruột thừa cấp, nên phục hồi bù nước và cân bằng chuyển hóa trước khi phẫu thuật. Các cuộc phẫu thuật lớn có chọn lọc nên được thực hiện vào buổi sáng sớm, và việc truyền glucose và insulin nên được bắt đầu từ 2 giờ trở lên trước khi tiến hành vào phòng mổ. Đối với các cuộc phẫu thuật có chọn lọc, việc truyền 5% glucose trong dung dịch muối 0,45% hoặc 0,9% được bắt đầu vào buổi sáng phẫu thuật—và 1 đơn vị insulin regular được truyền tĩnh mạch cho mỗi 4 đến 6 g glucose được cung cấp. Có thể cần 1 đơn vị insulin regular cho mỗi 2 đến 4 g glucose ngoại sinh trong các trường hợp cấp cứu ngoại khoa do nồng độ các hormone căng thẳng trong tuần hoàn tăng cao hoặc ở những bệnh nhân đái tháo đường béo phì đề kháng insulin.
Tốc độ truyền dịch tĩnh mạch nên đủ để cung cấp nhu cầu dịch duy trì cộng với lượng mất ước tính trong quá trình phẫu thuật và các thiếu hụt dịch khác. Nồng độ glucose trong máu nên được theo dõi định kỳ trước, trong và sau phẫu thuật. Nồng độ từ 120 đến 150 mg/dL nên là mục tiêu. Điều này có thể đạt được bằng cách thay đổi tốc độ truyền hỗn hợp glucose và điện giải hoặc tốc độ truyền insulin. Việc truyền insulin và glucose tĩnh mạch có thể được tiếp tục cho đến khi bệnh nhân tỉnh và có khả năng ăn uống bình thường, lúc đó chế độ tiêm hoặc bơm insulin thông thường của họ có thể được bắt đầu lại. Việc sử dụng các thiết bị theo dõi glucose liên tục trong quá trình phẫu thuật ở trẻ em và thanh thiếu niên chưa được nghiên cứu đầy đủ.
Ở những bệnh nhân nhận insulin tác dụng kéo dài vào buổi sáng và đang trải qua cuộc phẫu thuật ngắn, một cách tiếp cận tiêu chuẩn và hiệu quả như sau: vào buổi sáng phẫu thuật, một nửa liều insulin tác dụng kéo dài buổi sáng thông thường được tiêm dưới da, liều insulin tác dụng nhanh thông thường được bỏ qua trừ khi cần để điều chỉnh tăng đường huyết, và một liều truyền tĩnh mạch duy trì dung dịch điện giải và glucose được bắt đầu nếu cần. Tương tự, ở những bệnh nhân đang điều trị bằng bơm insulin đang trải qua các thủ thuật ngắn, CSII có thể được tiếp tục với tốc độ nền qua đêm thông thường hoặc giảm nhẹ. Bệnh nhân được điều trị bằng bơm insulin cũng có thể được duy trì trên CSII cho các thủ thuật lớn, miễn là tính toàn vẹn của việc truyền và vị trí truyền được đảm bảo.
Liều insulin glargine hoặc detemir ban đêm có thể cung cấp đủ lượng insulin nền cho phẫu thuật ở những bệnh nhân nhận các loại insulin tác dụng kéo dài này trước bữa tối hoặc trước khi đi ngủ. Nên xem xét việc giảm liều glargine hoặc detemir 20% đến 30% vào đêm trước phẫu thuật ở những bệnh nhân có xu hướng có mức glucose huyết tương trước bữa sáng thấp. Với cả ba chế độ, một liều điều chỉnh insulin tác dụng nhanh có thể được tiêm dưới da ngay sau thủ thuật nếu cần đối với tăng đường huyết—và lặp lại khi cần để cân bằng lượng ăn uống ban đầu (ví dụ, chất lỏng trong chứa carbohydrate). Khi việc truyền tĩnh mạch được ngừng và bệnh nhân sẵn sàng tiếp tục các bữa ăn thông thường, chế độ điều trị thông thường được bắt đầu lại.
Đái tháo đường tuýp 1 không do Tự miễn
Không phải tất cả các dạng ĐTĐ tuýp 1 cổ điển rõ ràng đều có các dấu ấn tự miễn liên quan. Trong một báo cáo, trong số trẻ em nhập viện với chẩn đoán ĐTĐ mới, ít trẻ dưới 5 tuổi tại thời điểm chẩn đoán có hiệu giá dương tính của các kháng thể tế bào đảo và GAD—và ít trẻ có giai đoạn trăng mật trong vòng 6 tháng—so với một nhóm khởi phát ở độ tuổi trung bình là 10. Tương tự, các nhà điều tra Nhật Bản đã báo cáo rằng một số bệnh nhân ĐTĐ tuýp 1 vô căn có một rối loạn bùng phát không tự miễn với khởi phát đột ngột được đặc trưng bởi sự vắng mặt của các kháng thể lưu hành, bằng chứng viêm đảo tụy trong sinh thiết tụy, và nồng độ cao của các enzyme tụy—cho thấy một quá trình viêm cấp tính trong tụy.
Các hội chứng MODY ban đầu cũng có thể được coi là ĐTĐ tuýp 1. Tuy nhiên, một tiền sử gia đình mạnh mẽ về ĐTĐ được truyền theo chiều dọc trong hai đến ba thế hệ, sự vắng mặt của các dấu ấn tự miễn, và các đặc điểm tương đối nhẹ hơn của bệnh đái tháo đường nên cảnh báo bác sĩ về khả năng có một dạng đái tháo đường đơn gen, chẳng hạn như MODY.
Các biến chứng của bệnh đái tháo đường
Các biến chứng của ĐTĐ có thể là cấp tính hoặc mãn tính. Các biến chứng cấp tính chủ yếu liên quan đến tỷ lệ mắc bệnh liên quan đến DKA, chẳng hạn như phù não, đột quỵ, viêm tụy, huyết khối tĩnh mạch sâu, tiêu cơ vân, tràn khí trung thất, phù phổi và nhiễm nấm mucor. Những biến chứng này đã được mô tả trong phần về DKA. Các biến chứng mãn tính hoặc lâu dài là do chuyển hóa hoặc mạch máu.
Các Biến chứng Chuyển hóa Mãn tính
Hội chứng Mauriac
Hội chứng Mauriac là một biến chứng chuyển hóa của kiểm soát đường huyết kém chỉ có ở trẻ em. Hội chứng Mauriac được đặc trưng bởi suy giảm tăng trưởng, tầm vóc thấp, dậy thì muộn và gan to rõ rệt do lắng đọng glycogen lớn. Hội chứng này được thấy ở trẻ em có kiểm soát rất kém (HbA1c thường > 10%) trong vài năm. Nguyên nhân của sự chậm tăng trưởng không hoàn toàn rõ ràng, nhưng tác động của tình trạng tăng insulin máu mãn tính, là trung tâm của hội chứng này, đối với trục hormone tăng trưởng–IGF-1 (GH-IGF1) đã được cho là có vai trò trong sinh bệnh học của sự suy giảm tăng trưởng. Một báo cáo gần đây về một đột biến mất chức năng trong tiểu đơn vị xúc tác của glycogen phosphorylase kinase ở gan ở một bệnh nhân mắc hội chứng Mauriac cho thấy enzyme này có vai trò trong sinh bệnh học của gan to. Glycogen phosphorylase kinase kích hoạt glycogen phosphorylase, enzyme xúc tác bước đầu tiên trong quá trình phân hủy glycogen. Người ta cho rằng ở đối tượng này, tăng đường huyết do kiểm soát đường huyết kém kết hợp với đột biến mất chức năng, đã ức chế glycogen phosphorylase do đó ngăn chặn quá trình phân giải glycogen và dẫn đến gan to lớn đặc trưng của bệnh Mauriac. Mặc dù các dạng nghiêm trọng hơn của hội chứng này hiếm gặp ở các nước phát triển, sự hiện diện của gan to hoặc các mức độ suy giảm tăng trưởng tinh vi, đặc biệt là sự chững lại của giai đoạn tăng trưởng vượt bậc ở tuổi dậy thì, không phải là một quan sát không phổ biến trong thực hành lâm sàng tại Hoa Kỳ.
Hạn chế Vận động Khớp
Hạn chế vận động khớp (LJM) là một biến chứng có thể thấy rõ trên lâm sàng sớm của ĐTĐ tuýp 1 ở trẻ em và thanh thiếu niên. LJM là do sự dày lên và cứng lại của mô liên kết quanh khớp và có thể biểu hiện dưới dạng tổn thương một khớp, tổn thương nhiều khớp với biến dạng bàn tay, và thậm chí hạn chế vận động cột sống. Bệnh học là sự dày lên của lớp bì và biểu bì với sự tích tụ collagen và mất các phần phụ của da. LJM có liên quan đến kiểm soát đường huyết kém, suy giảm tăng trưởng đáng kể và tăng nguy cơ bệnh vi mạch. Sự giảm rõ rệt về tần suất LJM và thiếu hụt tầm vóc ở trẻ em và thanh thiếu niên bị đái tháo đường trong 20 năm từ cuối những năm 1970 đến những năm 1990 có thể là do sự cải thiện kiểm soát chuyển hóa của trẻ em và thanh thiếu niên. Tỷ lệ hiện mắc LJM trong một quần thể có thể là một thước đo chất lượng kiểm soát bệnh đái tháo đường.
Các Biến chứng Mạch máu Mãn tính
Các biến chứng mạch máu lâu dài của bệnh đái tháo đường bao gồm bệnh vi mạch và bệnh mạch máu lớn. Các bệnh vi mạch bao gồm bệnh thận, bệnh võng mạc và bệnh thần kinh. Các biểu hiện của bệnh mạch máu lớn bao gồm bệnh tim, bệnh mạch máu ngoại biên và đột quỵ.
Các Yếu tố Nguy cơ đối với Biến chứng
Cho đến đầu những năm 1990, giáo điều là các biến chứng mãn tính của các biến chứng ĐTĐ tuýp 1 không liên quan đến kiểm soát chuyển hóa và vốn có trong bệnh và do đó không thể trì hoãn hoặc ngăn ngừa được. Một sự thay đổi mô hình trong hiểu biết của chúng ta về các yếu tố nguy cơ đối với các biến chứng mãn tính đã xảy ra từ những phát hiện của DCCT. DCCT là một thử nghiệm lâm sàng có đối chứng ngẫu nhiên đa trung tâm bao gồm 1441 bệnh nhân ĐTĐ tuýp 1 được thực hiện ở Bắc Mỹ từ năm 1983 đến 1993. Những người tham gia nghiên cứu bao gồm 195 thanh thiếu niên đang trong tuổi dậy thì (tuổi 13–17). Bệnh nhân được phân ngẫu nhiên vào điều trị tích cực hoặc thông thường; tích cực thông qua bơm hoặc MDI insulin và thông thường thông qua hai mũi tiêm kết hợp insulin regular cộng với NPH hoặc một sản phẩm tác dụng kéo dài tương tự. DCCT đã cung cấp bằng chứng không thể chối cãi rằng điều trị đái tháo đường tích cực và kiểm soát đường huyết được cải thiện mang lại sự giảm nguy cơ đáng kể đối với các biến chứng vi mạch so với điều trị thông thường. Trong nhóm thuần tập thanh thiếu niên, điều trị tích cực (HbA1c trung bình 8,1%) so với điều trị thông thường (HbA1c trung bình 9,8%) trong thời gian trung bình là 7,4 năm, đã giảm nguy cơ và sự tiến triển của DR 53%, bệnh thần kinh lâm sàng 60% và microalbumin niệu 54%. Một nghiên cứu theo dõi, tiếp tục theo dõi những người tham gia DCCT, cụ thể là nghiên cứu EDIC, đã chứng minh rằng tác động tích cực này vẫn tiếp tục sau khi kết thúc can thiệp: tức là, có một hiệu ứng ghi nhớ của việc kiểm soát đường huyết được cải thiện. Những phát hiện của các nghiên cứu DCCT và EDIC đã cách mạng hóa hiểu biết của chúng ta về các yếu tố nguy cơ đối với các biến chứng vi mạch và làm cho việc đạt được kiểm soát đường huyết tốt hơn trở thành nền tảng của các chế độ đái tháo đường hiện tại. Các biến chứng mạch máu lâu dài là một hàm số của mức độ và thời gian kiểm soát chuyển hóa kém. Do đó, không có gì ngạc nhiên khi các biến chứng mạch máu mãn tính có thể thấy rõ trên lâm sàng ít phổ biến hơn ở thời thơ ấu và thanh thiếu niên so với người lớn. Tuy nhiên, các nghiên cứu đã cho thấy rằng các bất thường về chức năng và cấu trúc sớm có thể xuất hiện ngay cả trong vài năm đầu sau khi khởi phát bệnh. Do đó, tầm quan trọng của việc hiểu và nhận biết sinh lý bệnh và các yếu tố nguy cơ ở thời thơ ấu và thanh thiếu niên là để cho phép áp dụng các chiến lược và chế độ quản lý trong giai đoạn này có thể ngăn ngừa hoặc trì hoãn sự xuất hiện của các biến chứng rõ ràng sau này trong cuộc sống trưởng thành.
Các Yếu tố Nguy cơ Khác đối với sự Phát triển của Biến chứng
Thời gian mắc bệnh đái tháo đường dài hơn, tuổi cao hơn và tuổi dậy thì là những yếu tố nguy cơ đối với các biến chứng. Tỷ lệ hiện mắc các biến chứng vi mạch thấp hơn đã được báo cáo ở các bé trai vị thành niên so với các bé gái. Các nghiên cứu dọc cũng đã báo cáo rằng tuổi khởi phát ĐTĐ tuýp 1 trẻ hơn, đặc biệt là trước tuổi dậy thì, có liên quan đến thời gian không có biến chứng dài hơn, chẳng hạn như bệnh thận và bệnh võng mạc. Hút thuốc có liên quan đến nguy cơ gia tăng phát triển albumin niệu kéo dài, tỷ lệ mắc bệnh và tử vong do tim mạch quá mức. Huyết áp cao và những thay đổi trong nhịp huyết áp sinh học đã được liên kết với nguy cơ phát triển bệnh thận và bệnh võng mạc ở thanh thiếu niên mắc ĐTĐ tuýp 1. Rối loạn lipid máu có liên quan đến microalbumin niệu và sự phát triển bệnh võng mạc trong DCCT/EDIC và các nghiên cứu khác. BMI cao hơn là một yếu tố nguy cơ đối với microalbumin niệu, bệnh võng mạc, bệnh thần kinh và bệnh tim mạch (Bảng 21.12). Các nghiên cứu đã tiết lộ rằng có sự tập hợp của các biến chứng. Ví dụ, các biến chứng xảy ra đồng thời thường xuyên hơn dự kiến là bệnh võng mạc và bệnh thận đái tháo đường, bệnh võng mạc và xơ cứng động mạch, và xơ cứng động mạch và bệnh thần kinh tự chủ tim mạch.
Bảng 21.12: Khuyến nghị Sàng lọc và các Yếu tố Nguy cơ đối với Biến chứng Mạch máu ở Trẻ em và Thanh thiếu niên mắc Đái tháo đường tuýp 1
(Nguồn: Donaghue, K.C., et al. (2018). ISPAD Clinical Practice Consensus Guidelines 2018: microvascular and macrovascular complications in children and adolescents. Pediatr Diabetes, 19 (Suppl 27), 262–274.)
| Bắt đầu Sàng lọc | Phương pháp Sàng lọc | Các Yếu tố Nguy cơ | |
|---|---|---|---|
| Bệnh thận | 11 tuổi với 2–5 năm mắc đái tháo đường | Tỷ lệ albumin/creatinine trong nước tiểu | Tăng đường huyết, Huyết áp cao, Bất thường lipid, Hút thuốc |
| Bệnh võng mạc | 11 tuổi với 2–5 năm mắc đái tháo đường | Chụp ảnh đáy mắt hoặc soi đáy mắt có nhỏ thuốc giãn đồng tử | Tăng đường huyết, Huyết áp cao, Bất thường lipid, BMI cao hơn |
| Bệnh thần kinh | 11 tuổi với 2–5 năm mắc đái tháo đường | Bệnh sử, Khám thực thể, Các xét nghiệm lâm sàng | Tăng đường huyết, BMI cao hơn, Tuổi, Thời gian mắc bệnh đái tháo đường, Di truyền |
| Bệnh mạch máu lớn | 11 tuổi với 2–5 năm mắc đái tháo đường | Hồ sơ lipid mỗi 2 năm, Huyết áp hàng năm | Tăng đường huyết, Huyết áp cao, Bất thường lipid, BMI cao hơn, Hút thuốc |
BMI, Chỉ số khối cơ thể; BP, huyết áp.
Bệnh thận do Đái tháo đường
Bệnh thận do đái tháo đường (DN) là một trong những biến chứng mãn tính thường gặp và nghiêm trọng nhất của ĐTĐ. DN rõ ràng là nguyên nhân phổ biến nhất gây tử vong quá mức liên quan đến ĐTĐ. DN rõ ràng cực kỳ hiếm gặp trước tuổi dậy thì và không phổ biến ngay cả ở thanh thiếu niên mắc bệnh đái tháo đường lâu năm. Tuy nhiên, các quá trình dẫn đến DN rõ ràng được khởi đầu sớm trong quá trình của bệnh đái tháo đường. Các nghiên cứu đã mang lại bằng chứng mô học cho các giai đoạn sớm của DN trong vòng 2 đến 5 năm sau khi chẩn đoán ĐTĐ tuýp 1.
DN ban đầu được mô tả là một bệnh cầu thận liên quan đến xơ cứng cầu thận lan tỏa hoặc dạng nốt (tổn thương Kimmelsteil-Wilson). Tuy nhiên, chưa đến một phần ba bệnh nhân ĐTĐ tuýp 1 và microalbumin niệu có bệnh cầu thận điển hình được mô tả bởi Kimmelsteil và Wilson. Những thay đổi sinh lý bệnh trong DN bao gồm tăng sản hoặc phì đại của các loại tế bào khác nhau của cầu thận và ống thận, dày lên của màng đáy cầu thận và ống thận, và sự mở rộng của các khoang ống kẽ và gian mạch. Các nghiên cứu gần đây đã tập trung vào vai trò của các tế bào có chân (podocyte) trong sự phát triển của DN. Tế bào có chân là các tế bào biểu mô tạng độc đáo, chuyên biệt cao, biệt hóa cuối cùng trong cầu thận, bao quanh các mao mạch của cầu thận. Tế bào có chân đóng một vai trò quan trọng trong việc duy trì tính chọn lọc của tính thấm cầu thận. Sự phát triển của protein niệu có liên quan đến những thay đổi hình thái trong tế bào có chân gây ra rối loạn chức năng của chúng và sau đó là apoptosis, cuối cùng dẫn đến sự suy giảm của các tế bào này trong cầu thận, bao gồm cả sự xóa mờ các mấu chân. Sự xóa mờ các mấu chân và giảm số lượng và/hoặc mật độ tế bào có chân trên mỗi cầu thận đã được báo cáo ở cả ĐTĐ tuýp 1 và tuýp 2. Mặc dù hầu hết các nghiên cứu đã tập trung vào những thay đổi ở cầu thận trong thận đái tháo đường, gần đây hơn, những thay đổi quan trọng ở các vị trí khác của mô thận đã được báo cáo, bao gồm cả ống thận, kẽ, tủy và nhú thận.
Danh tính, sự tiến triển và trình tự thời gian của các sự kiện và quá trình đóng một vai trò trong sự khởi đầu và tiến triển của DN vẫn chưa được hiểu đầy đủ. Tăng đường huyết là cần thiết cho sự khởi đầu của tổn thương cấu trúc thận, vì các đối tượng không bị đái tháo đường không phát triển cùng loại bệnh thận. Sớm trong quá trình của ĐTĐ tuýp 1, tăng đường huyết làm rối loạn cân bằng nội môi của lưu lượng máu và tính thấm mạch máu trong cầu thận. Các nghiên cứu trong ống nghiệm đã chứng minh rằng tăng đường huyết gây ra sản xuất chất nền tế bào gian mạch và apoptosis tế bào gian mạch. Nồng độ tăng cao của các loại oxy phản ứng của ty thể có liên quan đến sinh bệnh học của DN. Sự sản xuất quá mức superoxide của ty thể do tăng đường huyết gây ra được cho là kích hoạt các con đường tổn thương mô mạch máu, dẫn đến mất cân bằng oxy hóa-khử tế bào và stress oxy hóa. Một quá trình khác được cho là đóng một vai trò quan trọng trong DN là sự tích tụ của các sản phẩm cuối cùng của quá trình glycation tiên tiến (AGEs). Nhiều protein có tuổi thọ dài, chẳng hạn như collagen, bị glycat hóa rộng rãi ở bệnh nhân đái tháo đường. Hơn nữa, các thụ thể AGE khác nhau, chẳng hạn như RAGE, đã được mô tả trong thận và có liên quan đến việc trung gian một số tác động có hại của AGEs bằng cách gây ra sự biểu hiện của yếu tố tăng trưởng biến đổi (TGF)-β và các cytokine khác được đề xuất để trung gian sự biến đổi của các tế bào biểu mô để tạo thành các nguyên bào sợi cơ, một bước quan trọng trong sự phát triển của xơ hóa ống kẽ. Sự kích hoạt của các phân tử tín hiệu nội bào, chẳng hạn như protein kinase C (PKC), cũng đã được chứng minh là dẫn đến tăng sản màng đáy cầu thận (GBM) và truyền tín hiệu cho các yếu tố tăng trưởng. Hoạt động tăng cao của trục GH-IGF1 và hoạt động prorenin tăng cao đã được đề xuất là góp phần vào sự phát triển của DN. Viêm mức độ thấp có thể đóng một vai trò quan trọng trong sinh bệnh học của DN thông qua việc kích hoạt các cytokine, chẳng hạn như TGF-β. Sự điều hòa giảm biểu hiện của nephrin ở thận (một protein xuyên màng được định vị ở màng khe giữa các tế bào có chân liền kề của cầu thận và được biểu hiện bởi các tế bào có chân) bị suy giảm ở ĐTĐ tuýp 1 và có liên quan đến sự hoạt động sai của hàng rào lọc thận trong DN và sự phát triển của albumin niệu.
Diễn biến tự nhiên của DN trong ĐTĐ tuýp 1 theo truyền thống được mô tả theo các giai đoạn sau.
Giai đoạn 1 (giai đoạn tăng lọc) là giai đoạn ban đầu liên quan đến sự gia tăng mức lọc cầu thận (GFR) và tăng áp lực mao mạch cầu thận. Sinh lý bệnh chính xác của giai đoạn này vẫn chưa rõ ràng. Các nghiên cứu đã chứng minh mối tương quan giữa GFR tăng cao và sự phát triển sau này của protein niệu. Giai đoạn 2 (giai đoạn im lặng) được đặc trưng bởi sự vắng mặt của bằng chứng rõ ràng về rối loạn chức năng thận với việc duy trì GFR và không có albumin niệu. Tuy nhiên, các nghiên cứu hình thái thận chứng minh những thay đổi cấu trúc đáng kể, bao gồm dày màng đáy và mở rộng gian mạch ở những đối tượng không có albumin niệu này. Trong Giai đoạn 3 (giai đoạn microalbumin niệu), tốc độ bài tiết albumin trong nước tiểu tăng lên đến phạm vi microalbumin niệu từ 20 đến 200 mcg/phút hoặc 30 đến 300 mg/24 giờ. Microalbumin niệu kéo dài được xác định khi microalbumin niệu được xác nhận ít nhất hai lần cách nhau từ 3 đến 6 tháng. Microalbumin niệu được coi là dấu hiệu sớm nhất của sự phát triển DN. Microalbumin niệu ở đầu trên của phạm vi bình thường ở độ tuổi từ 10 đến 16 có liên quan đến nguy cơ tiến triển thành microalbumin niệu và nguy cơ bệnh tim mạch trong tương lai, độc lập với HbA1c. Tuy nhiên, các nghiên cứu gần đây cho thấy microalbumin niệu có thể là tạm thời và không nhất thiết phản ánh sự suy giảm chức năng thận vĩnh viễn. Sự đảo ngược của microalbumin niệu có nhiều khả năng xảy ra hơn khi nó có thời gian ngắn; kiểm soát đường huyết phù hợp; và huyết áp tâm thu, cholesterol huyết thanh và nồng độ triglyceride nằm trong phạm vi bình thường. Ngược lại, các tổn thương sớm ở cả cấu trúc cầu thận và ống thận đôi khi có thể xuất hiện ở các đối tượng không có albumin niệu. Giai đoạn 4 (giai đoạn macroalbumin niệu) được xác định bằng sự phát triển của tốc độ bài tiết albumin trong nước tiểu lớn hơn 300 mg/24 giờ (200 mcg/phút). Giai đoạn này dự đoán mạnh mẽ sự tiến triển tiếp theo đến suy thận, nếu không được điều trị. Giai đoạn 5 (suy giảm chức năng thận) được đặc trưng bởi urê huyết và bệnh thận giai đoạn cuối có thể xảy ra ở tối đa 40% bệnh nhân ĐTĐ tuýp 1. Những bệnh nhân này cần lọc máu hoặc ghép thận.
Sàng lọc Microalbumin niệu
Dấu hiệu lâm sàng sớm nhất của DN là microalbumin niệu, và các hướng dẫn hiện tại khuyến nghị rằng việc sàng lọc hàng năm đối với microalbumin niệu nên bắt đầu từ 11 tuổi với thời gian mắc bệnh đái tháo đường từ 2 đến 5 năm. Microalbumin niệu được định nghĩa là:
- Tỷ lệ albumin/creatinine (ACR) 2,5 đến 25 mg/mmol hoặc 30 đến 300 mg/g (nước tiểu tại chỗ) ở nam giới và 3,5 đến 25 mg/mmol hoặc 42 đến 300 mg/g ở nữ giới (do bài tiết creatinine thấp hơn) hoặc
- Tốc độ bài tiết albumin (AER) từ 20 đến 200 mcg/phút hoặc từ 30 đến 300 mg/24 giờ trong 24 giờ hoặc các mẫu thu thập nước tiểu có hẹn giờ.
Microalbumin niệu được xác nhận bằng cách tìm thấy hai hoặc tất cả ba mẫu bất thường trong khoảng thời gian từ 3 đến 6 tháng. Việc đánh giá ACR trong một mẫu nước tiểu tại chỗ là phương pháp dễ thực hiện nhất trong môi trường văn phòng và nó thường cung cấp thông tin chính xác. Nước tiểu đầu tiên vào buổi sáng được ưu tiên do sự thay đổi trong ngày của bài tiết albumin và các tác động tư thế. Một mẫu ngẫu nhiên có thể được sử dụng nhưng có liên quan đến nguy cơ gia tăng các kết quả dương tính giả, và do đó các kết quả bất thường nên được xác nhận bằng các mẫu thu thập nước tiểu buổi sáng đầu tiên. Các yếu tố gây nhiễu có thể dẫn đến các xét nghiệm dương tính giả (ACR/AER tăng) bao gồm vận động gắng sức, nhiễm trùng, bệnh thận không do đái tháo đường (tức là, viêm thận IgA hoặc các loại viêm thận khác), tăng đường huyết rõ rệt, sốt và chảy máu kinh nguyệt. Các mẫu thu thập qua đêm hoặc 24 giờ có hẹn giờ phiền hà hơn và thường không nâng cao độ chính xác hoặc khả năng dự đoán DN.
Liệu pháp hạ huyết áp hiệu quả ở bệnh nhân bị bệnh thận kéo dài thời gian đến bệnh thận giai đoạn cuối. Tăng huyết áp ở trẻ em được định nghĩa là huyết áp bằng hoặc trên bách phân vị thứ 95 theo tuổi, giới tính và chiều cao, trong khi ở thanh thiếu niên (tuổi ≥ 13), nó được định nghĩa là huyết áp tâm thu ≥ 130 và/hoặc huyết áp tâm trương ≥ 80. Huyết áp cao (trước đây được gọi là tiền tăng huyết áp) được định nghĩa là huyết áp trên bách phân vị thứ 90 theo tuổi, giới tính và chiều cao, hoặc từ 13 tuổi, là huyết áp từ 120 đến 129/80 mmHg. Tương tự như tăng huyết áp rõ ràng, huyết áp cao có liên quan đến tăng huyết áp ở người lớn và có khả năng đáp ứng với điều trị. Trẻ em và thanh thiếu niên được phát hiện có huyết áp cao hoặc tăng huyết áp nên được xác nhận huyết áp cao vào 3 ngày riêng biệt. Việc xác nhận tăng huyết áp có thể được hỗ trợ bằng các phép đo huyết áp lưu động 24 giờ. Ở trẻ em và thanh thiếu niên có huyết áp cao, điều trị ban đầu bao gồm các can thiệp lối sống bao gồm sửa đổi chế độ ăn uống và hoạt động thể chất từ trung bình đến mạnh ít nhất 3 đến 5 ngày mỗi tuần (30–60 phút mỗi buổi). Nếu huyết áp mục tiêu không đạt được trong vòng 3 đến 6 tháng sau khi bắt đầu can thiệp lối sống, nên xem xét điều trị bằng thuốc (Bảng 21.13). Điều trị bằng thuốc tăng huyết áp ở trẻ em và thanh thiếu niên nên được bắt đầu bằng thuốc ức chế men chuyển angiotensin (ACE), thuốc chẹn thụ thể angiotensin II (ARB), thuốc chẹn kênh canxi tác dụng kéo dài, hoặc thuốc lợi tiểu thiazide. Thuốc ức chế ACE được khuyến nghị sử dụng ở trẻ em và thanh thiếu niên bị tăng huyết áp và albumin niệu, nhưng có thể sử dụng ARB nếu không dung nạp thuốc ức chế ACE do tác dụng phụ. Mục tiêu của điều trị là huyết áp luôn dưới bách phân vị thứ 90 theo tuổi, giới tính và chiều cao. Ở người lớn, thuốc ức chế ACE và ARB làm giảm sự tiến triển từ microalbumin niệu sang macroalbumin niệu và tăng tỷ lệ thoái lui về normoalbumin niệu. Tuy nhiên, một phân tích tổng hợp cho thấy rằng các tác động có lợi khiêm tốn hơn ở những người có mức microalbumin niệu thấp nhất. Ngoài ra, vẫn còn những lo ngại về việc sử dụng thuốc ức chế ACE trong việc bảo vệ chức năng thận lâu dài ở những người trẻ không bị tăng huyết áp. Những người trẻ bị albumin niệu có thể sẽ phải dùng thuốc ức chế ACE trong nhiều thập kỷ. Các tác dụng phụ bao gồm ho, tăng kali máu, đau đầu và liệt dương. Một vấn đề an toàn quan trọng liên quan đến việc sử dụng thuốc ức chế ACE, cũng như ARB, là nguy cơ tiềm tàng dị tật bẩm sinh khi sử dụng trong thai kỳ. Những rủi ro này nên được thảo luận với gia đình trước khi bắt đầu điều trị và các biện pháp tránh thai thích hợp được khuyến nghị.
Bảng 21.13: Các Giá trị Ngưỡng được Khuyến nghị cho Can thiệp và Phòng ngừa Ban đầu Bệnh Vi mạch và Tim mạch ở Trẻ em và Thanh thiếu niên mắc Đái tháo đường tuýp 1
(Nguồn: Donaghue, K.C., et al. (2018). ISPAD Clinical Practice Consensus Guidelines 2018: microvascular and macrovascular complications in children and adolescents. Pediatr. Diabetes, 19 (Suppl 27), 262–274.)
| Giá trị Ngưỡng | Can thiệp |
|---|---|
| Huyết áp > bách phân vị thứ 90 theo tuổi, giới tính và chiều cao | Can thiệp lối sống: vận động, ít thời gian xem màn hình và chế độ ăn uống |
| Huyết áp > bách phân vị thứ 90 mặc dù đã can thiệp lối sống | Thuốc ức chế ACE hoặc thuốc hạ huyết áp khác. Nếu có microalbumin niệu: Thuốc ức chế ACE hoặc ARB |
| Huyết áp > bách phân vị thứ 95 theo tuổi, giới tính và chiều cao | Can thiệp lối sống và thuốc ức chế ACE hoặc thuốc hạ huyết áp khác. Nếu có microalbumin niệu: Thuốc ức chế ACE hoặc ARB |
| Cholesterol LDL > 2,6 mmol/L (100 mg/dL) | Can thiệp chế độ ăn uống và lối sống |
| Cholesterol LDL > 3,4 mmol/L (130 mg/dL) và một hoặc nhiều yếu tố nguy cơ CVD | Statin |
ACE, Men chuyển angiotensin; ARB, thuốc chẹn thụ thể angiotensin II; BP, huyết áp; CVD, bệnh tim mạch; LDL, lipoprotein mật độ thấp.
Bệnh võng mạc do Đái tháo đường
Trên toàn thế giới và tại Hoa Kỳ, DR là nguyên nhân hàng đầu gây ra các trường hợp mù lòa mới. Tầm quan trọng của DR không thể được phóng đại quá mức ở nhóm tuổi nhi khoa. Nếu không được điều trị, biến chứng này có những hậu quả thảm khốc vì nó thường dẫn đến mù lòa. Trong nghiên cứu mang tính bước ngoặt về DR được thực hiện tại Wisconsin bắt đầu từ năm 1980 đến 1982, sau 15 năm mắc bệnh đái tháo đường, 98% có bệnh võng mạc nền và sau 35 năm, 62% có bệnh võng mạc tăng sinh. Nghiên cứu DCCT đã chứng minh giá trị của việc kiểm soát đường huyết chặt chẽ trong việc giảm nguy cơ mù lòa. Những thay đổi sau đó trong quản lý bệnh đái tháo đường có liên quan đến sự giảm bệnh võng mạc tăng sinh dẫn đến giảm tỷ lệ DR. Dữ liệu gần đây hơn từ một nhóm thuần tập ở tuổi vị thành niên trung bình (tuổi trung bình 16,4) với thời gian mắc bệnh đái tháo đường trung bình là 8,6 năm cho thấy DR đã giảm từ 53% (năm 1990–1994) xuống 23% (năm 2000–2004) và xuống 12% (năm 2005–2009). Ở một nhóm trẻ hơn từ 11 đến 17 tuổi (tuổi trung bình 14,5, thời gian mắc bệnh 2–5 năm), tỷ lệ hiện mắc bệnh võng mạc nền nhẹ đã giảm từ 16% năm 1990 đến 1994 xuống 7% năm 2003 đến 2006. Hơn nữa, những người có thời gian mắc bệnh ngắn hơn có bệnh võng mạc ít hơn đáng kể, và bệnh võng mạc chỉ xuất hiện ở 6% nhóm trẻ nhất (tuổi 11–13).
Võng mạc bao gồm các thành phần thần kinh, thần kinh đệm và mạch máu. Mặc dù cả ba thành phần đều bị ảnh hưởng xấu trong ĐTĐ, từ quan điểm lâm sàng, những thay đổi trong mạch máu võng mạc là những thay đổi bị ảnh hưởng rõ ràng nhất bởi bệnh đái tháo đường. Trong bệnh đái tháo đường, có lẽ do những thay đổi trong chuyển hóa võng mạc, có nhu cầu tăng lưu lượng máu võng mạc. Người ta cho rằng tăng lưu lượng máu võng mạc là phát hiện sớm nhất trong DR và tổn thương do giãn mạch mãn tính của các mạch máu võng mạc dẫn đến sự hình thành các tổn thương võng mạc đặc trưng thấy trong DR. Các cơ chế khác đã được giả định để giải thích tổn thương mạch máu võng mạc, bao gồm stress oxy hóa, tăng chuyển hóa glucose theo con đường polyol, các sản phẩm cuối cùng của quá trình glycosyl hóa tiên tiến có thể gây ra sự dày lên của màng đáy, và sự kích hoạt của protein kinase C.
DR được phân loại thành các loại sau: bệnh võng mạc không tăng sinh được đặc trưng bởi các vi phình mạch, xuất huyết võng mạc cả trước và trong võng mạc, các đốm dạng bông liên quan đến thiếu máu cục bộ và vi nhồi máu, các tiết cứng do rò rỉ protein và lipid, các bất thường vi mạch trong võng mạc (IRMA), và giãn và ngoằn ngoèo của các tiểu tĩnh mạch. Các giai đoạn nhẹ và trung bình của bệnh võng mạc không tăng sinh không đe dọa thị lực và không phải lúc nào cũng tiến triển thành các giai đoạn bệnh võng mạc nặng hơn. Bệnh võng mạc không tăng sinh nặng (trước đây được gọi là tiền tăng sinh) được đặc trưng bởi tắc nghẽn mạch máu, tăng số lượng xuất huyết võng mạc và vi phình mạch, IRMA, các bất thường tĩnh mạch rõ rệt, và thiếu máu cục bộ và nhồi máu của các sợi thần kinh võng mạc gây ra các đốm dạng bông. Bệnh võng mạc đái tháo đường tăng sinh (PDR) được đặc trưng bởi sự tân tạo mạch máu trong võng mạc và/hoặc bề mặt sau của dịch kính. Các mạch máu có thể vỡ hoặc chảy máu vào khoang dịch kính-võng mạc, đe dọa thị lực. Phù hoàng điểm/bệnh hoàng điểm do đái tháo đường được đặc trưng bởi sự suy giảm khả năng của mạch máu và sự hình thành vi phình mạch, tạo ra sự tiết dịch và sưng ở trung tâm võng mạc.
Đánh giá Bệnh võng mạc
Hiện tại, các phương pháp phát hiện nhạy cảm nhất để sàng lọc bệnh võng mạc là khám đáy mắt bằng kính sinh hiển vi khe qua đồng tử đã được nhỏ thuốc giãn bởi một bác sĩ nhãn khoa hoặc chuyên viên đo thị lực và chụp ảnh võng mạc lập thể bảy trường có nhỏ thuốc giãn đồng tử. Phương pháp sau là tối ưu cho nghiên cứu nhưng không phổ biến trong môi trường lâm sàng. Các phương pháp khác là chụp ảnh đáy mắt hai trường có và không có nhỏ thuốc giãn đồng tử, soi đáy mắt trực tiếp, soi đáy mắt gián tiếp, chụp mạch huỳnh quang đáy mắt, và chụp cắt lớp kết hợp quang học. Những tiến bộ nhanh chóng trong nhiếp ảnh và quang học kết hợp với AI và học máy đã mở ra những kỹ thuật mới, sáng tạo và hiệu quả hơn để sàng lọc DR có thể được áp dụng cho việc sử dụng thường quy trong lĩnh vực lâm sàng trong tương lai gần.
Các khuyến nghị hiện tại là việc sàng lọc DR nên bắt đầu từ 11 tuổi với thời gian mắc bệnh đái tháo đường từ 2 đến 5 năm. Một cuộc kiểm tra mắt toàn diện ban đầu cũng nên được xem xét để phát hiện đục thủy tinh thể, các tật khúc xạ lớn, hoặc các rối loạn mắt khác. Đối với những người có thời gian mắc bệnh đái tháo đường dưới 10 năm, bệnh võng mạc không tăng sinh nhẹ (chỉ có vi phình mạch) và kiểm soát đường huyết tốt, việc đánh giá sàng lọc hai năm một lần bằng khám kính sinh hiển vi hoặc chụp ảnh đáy mắt có thể là đủ. Tần suất sàng lọc bệnh võng mạc nên thường xuyên hơn nếu có các đặc điểm nguy cơ cao mất thị lực. Sự xấu đi ban đầu của DR có thể xảy ra khi bắt đầu cải thiện kiểm soát đường huyết đặc biệt ở những bệnh nhân bị đái tháo đường không kiểm soát lâu dài và thiếu insulin nghiêm trọng. Nên thực hiện kiểm tra võng mạc cẩn thận ở tất cả các bệnh nhân như vậy trước khi bắt đầu liệu pháp insulin tích cực. Cho đến nay, không có bằng chứng nào cho thấy việc kiểm soát tốc độ hoặc mức độ giảm HbA1C sẽ làm giảm nguy cơ DR ở bệnh nhân đái tháo đường. Mang thai là một nguy cơ được công nhận đối với sự tăng tốc và tiến triển của bệnh võng mạc; do đó việc sàng lọc bệnh võng mạc nên được thực hiện trước khi thụ thai, mỗi tam cá nguyệt và 1 năm sau sinh.
Điều trị Bệnh võng mạc
Các lựa chọn điều trị cho bệnh võng mạc đe dọa thị lực bao gồm quang đông laser và/hoặc liệu pháp kháng yếu tố tăng trưởng nội mô mạch máu (VEGF). Quang đông laser toàn võng mạc (PRP hoặc thường được gọi là liệu pháp laser) đã được chứng minh là làm giảm sự tiến triển của mất thị lực hơn 50% ở bệnh nhân PDR. Tuy nhiên, quang đông không được chỉ định cho mắt bị bệnh võng mạc không tăng sinh nhẹ hoặc trung bình. Các biến chứng của liệu pháp laser là xuất huyết dịch kính và hắc mạc hoặc di chứng thị giác do các vết bỏng đặt sai vị trí. Đối với PDR, tiêm kháng thể đơn dòng kháng VEGF vào nội nhãn (ví dụ, aflibercept) hiện đang được sử dụng ngày càng nhiều và cho thấy kết quả 12 tháng tốt hơn về thị lực so với PRP. Điều trị này không phá hủy nhưng đòi hỏi phải tái khám và tiêm lặp lại để có hiệu quả (ví dụ, tiêm hàng tháng trong 5 tháng đầu tiên với tối đa chín lần tiêm trong năm đầu tiên), và có nguy cơ nhiễm trùng mắt hiếm gặp. Đối với phù hoàng điểm do đái tháo đường liên quan đến mất thị lực, kháng thể đơn dòng kháng VEGF (ví dụ, bevacizumab) hiện được coi là tiêu chuẩn chăm sóc và đã cho thấy kết quả vượt trội hơn 5 năm so với điều trị bằng laser. Điều trị phẫu thuật, chẳng hạn như cắt dịch kính, có thể được chỉ định cho xuất huyết dịch kính kéo dài, bong võng mạc do co kéo, hoặc xơ hóa lan rộng.
Bệnh thần kinh do Đái tháo đường
Bệnh thần kinh do đái tháo đường là một biến chứng chính của bệnh đái tháo đường. Trái ngược với người lớn, trẻ em và thanh thiếu niên bị bệnh thần kinh do đái tháo đường, vì họ đang ở giai đoạn đầu của quá trình bệnh, không có triệu chứng. Tầm quan trọng của việc nhận biết và chẩn đoán bệnh thần kinh do đái tháo đường ở trẻ em và thanh thiếu niên là việc phát hiện sớm bệnh thần kinh cận lâm sàng trong thời thơ ấu sẽ cho phép can thiệp sớm hơn, với khả năng giảm hoặc trì hoãn tỷ lệ mắc bệnh thần kinh lâm sàng sau này trong cuộc sống.
Phân loại Bệnh thần kinh do Đái tháo đường (Chỉnh sửa từ Pop-Busui và cộng sự)
A. Bệnh thần kinh lan tỏa
* Bệnh đa dây thần kinh đối xứng ngọn chi (DSPN)
* Chủ yếu là bệnh thần kinh sợi nhỏ
* Chủ yếu là bệnh thần kinh sợi lớn
* Hỗn hợp bệnh thần kinh sợi nhỏ và lớn (phổ biến nhất)
* Tự chủ
* Tim mạch
* Tiêu hóa (bao gồm liệt dạ dày, bệnh ruột, giảm nhu động đại tràng)
* Tiết niệu-sinh dục (bao gồm bệnh bàng quang do đái tháo đường, rối loạn cương dương, rối loạn chức năng tình dục nữ)
* Rối loạn chức năng mồ hôi (bao gồm giảm/không tiết mồ hôi, đổ mồ hôi vị giác)
* Không nhận biết hạ đường huyết
* Chức năng đồng tử bất thường
B. Bệnh đơn dây thần kinh—Dây thần kinh sọ hoặc ngoại biên riêng lẻ (ví dụ, dây thần kinh sọ [CN] III, ulnar, median, femoral, peroneal)
C. Bệnh rễ thần kinh hoặc đa rễ thần kinh—bệnh đa rễ thần kinh thắt lưng-cùng, teo cơ vận động gốc chi
Loại bệnh thần kinh do đái tháo đường phổ biến nhất ở trẻ em là DSPN. Rối loạn chức năng sợi thần kinh lớn biểu hiện dưới dạng mất phản xạ gân ở ngọn chi và thay đổi nhận thức về rung, cảm thụ bản thể, và/hoặc cảm giác xúc giác. Rối loạn chức năng sợi nhỏ biểu hiện dưới dạng tăng cảm giác và giảm cảm giác đau và nhiệt độ. Hơn một nửa số trẻ em bị DSPN do đái tháo đường sớm có thể không có triệu chứng. Tỷ lệ hiện mắc được báo cáo đối với bệnh thần kinh do đái tháo đường ở trẻ em thay đổi từ dưới 10% đến 30%. Sự chênh lệch rộng này có thể phản ánh sự khác biệt trong việc lựa chọn bệnh nhân, tình trạng lâm sàng, loại xét nghiệm chẩn đoán được sử dụng, và các tiêu chí được sử dụng để định nghĩa bệnh thần kinh do đái tháo đường. Các nghiên cứu dẫn truyền thần kinh bất thường có thể được phát hiện sớm nhất là trong vòng 6 tháng sau khi chẩn đoán ĐTĐ tuýp 1, với sự cải thiện sau khi điều chỉnh tăng đường huyết. Sự hiện diện của bệnh thần kinh tự chủ do đái tháo đường có khả năng bị đánh giá thấp do sàng lọc không tối ưu. Bệnh thần kinh tự chủ do đái tháo đường cận lâm sàng đã được báo cáo là từ 8% đến 43% ở trẻ em mắc ĐTĐ tuýp 1. Bệnh thần kinh do đái tháo đường cũng là một biến chứng sớm của ĐTĐ tuýp 2. Các nghiên cứu gần đây đã báo cáo rằng tỷ lệ hiện mắc DSPN cao hơn đáng kể ở thanh thiếu niên mắc tuýp 2 so với những người mắc ĐTĐ tuýp 1 (25,7% so với 8,2%).
Tất cả bệnh nhân nên được đánh giá DSPN sau 5 năm chẩn đoán ĐTĐ tuýp 1 và tại thời điểm chẩn đoán ĐTĐ tuýp 2, và ít nhất hàng năm sau đó. Đánh giá nên bao gồm bệnh sử và khám thực thể, và cảm giác nhiệt độ hoặc châm kim (chức năng sợi nhỏ) và cảm giác rung bằng âm thoa 128 Hz (chức năng sợi lớn). Tất cả bệnh nhân nên được kiểm tra bằng sợi đơn 10 g hàng năm để đánh giá nguy cơ loét và cắt cụt bàn chân. Xét nghiệm điện sinh lý hoặc giới thiệu đến một nhà thần kinh học hiếm khi cần thiết để sàng lọc, ngoại trừ trong các tình huống mà các đặc điểm lâm sàng không điển hình hoặc chẩn đoán không rõ ràng. Các đặc điểm không điển hình bao gồm bệnh thần kinh vận động nhiều hơn cảm giác, khởi phát nhanh, hoặc biểu hiện không đối xứng. Kiểm soát glucose chặt chẽ là nền tảng của việc phòng ngừa bệnh thần kinh do đái tháo đường. Mặc dù có những tiến bộ trong việc làm sáng tỏ sinh bệnh học của bệnh thần kinh do đái tháo đường, có rất ít lựa chọn điều trị làm thay đổi diễn biến tự nhiên của DSPN hoặc đảo ngược DSPN một khi đã được thiết lập. Các tác nhân dược lý, chẳng hạn như pregabalin và duloxetine, đã được chứng minh là có lợi trong điều trị đau thần kinh.
Một điểm cuối cùng liên quan đến những thay đổi thần kinh ở trẻ em bị đái tháo đường là bằng chứng ngày càng tăng cho thấy tăng đường huyết cấp tính làm suy giảm chức năng não biểu hiện dưới dạng trí nhớ làm việc không gian thấp hơn cùng với những thay đổi trong các khu vực liên quan của MRI chức năng ở thanh thiếu niên mắc ĐTĐ tuýp 1. Ngoài ra, tăng đường huyết mãn tính ở trẻ nhỏ hơn có liên quan đến sự phát triển chất trắng bị thay đổi, điều này có thể góp phần vào các khiếm khuyết nhận thức nhẹ đã được ghi nhận của chúng.
Bệnh Mạch máu lớn
Bệnh tim mạch là nguyên nhân hàng đầu gây tử vong ở bệnh nhân ĐTĐ tuýp 1. Trong khi các biến chứng bệnh tim mạch liên quan đến đái tháo đường rõ ràng là hiếm gặp cho đến khi trưởng thành, các dấu hiệu sớm và nền tảng sinh lý bệnh của những biến chứng này biểu hiện ở thanh thiếu niên và người trẻ tuổi mắc ĐTĐ tuýp 1. Nói chung, tiến bộ trong việc giảm các biến chứng mạch máu lớn đã chậm hơn so với các nỗ lực tương tự nhắm vào việc quản lý các biến chứng vi mạch của ĐTĐ tuýp 1. Lý do cho sự chênh lệch này có thể liên quan đến sự khác biệt trong sinh bệnh học và thời gian cần thiết lâu hơn để phát triển các biến chứng mạch máu lớn. Vì các biến cố tim mạch (như đột quỵ, nhồi máu cơ tim) không có hoặc hiếm gặp ở thời thơ ấu và thanh thiếu niên, các nghiên cứu đã phải dựa vào các thông số và chỉ số thay thế (chẳng hạn như độ dày nội trung mạc động mạch cảnh). Các yếu tố nguy cơ truyền thống đối với bệnh tim mạch là tăng đường huyết, tăng huyết áp, rối loạn lipid máu và bệnh thận đái tháo đường. Tuy nhiên, mối quan hệ chính xác của những yếu tố nguy cơ này với bệnh mạch máu lớn ở nhóm tuổi nhi khoa hiện tại không rõ ràng. Do đó, trái ngược với các nghiên cứu ở người lớn, các nghiên cứu ở trẻ em đã không chứng minh được mối quan hệ rõ ràng giữa nồng độ HbA1c và các biện pháp về sức khỏe mạch máu. Béo phì là một yếu tố nguy cơ tử vong sớm do biến cố tim mạch và tỷ lệ béo phì đang tăng lên đáng kể ở trẻ em và thanh thiếu niên mắc ĐTĐ tuýp 1. Vai trò của các yếu tố lối sống và hành vi, chẳng hạn như vận động, chế độ ăn uống, hút thuốc, căng thẳng, giấc ngủ và trầm cảm cũng quan trọng trong sinh bệnh học của bệnh mạch máu lớn ở bệnh nhân ĐTĐ tuýp 1.
Tăng đường huyết, tăng huyết áp và rối loạn lipid máu là những yếu tố góp phần chính gây ra bệnh tim mạch. Tuy nhiên, việc đạt được sự giảm thiểu các yếu tố nguy cơ này ở trẻ em và thanh thiếu niên vẫn là một thách thức vì nhiều lý do. Bản chất âm thầm của tác động của những yếu tố nguy cơ này, cộng với thời gian dài cần thiết để phát triển bệnh tim mạch, đã che giấu tầm quan trọng của những yếu tố nguy cơ này. Việc thiếu các nghiên cứu nghiêm ngặt ở nhóm tuổi nhi khoa là một yếu tố khác làm giảm việc ưu tiên cao cho những yếu tố nguy cơ này ở trẻ em và thanh thiếu niên. Phần lớn bằng chứng có sẵn ở nhóm tuổi nhi khoa được suy ra từ các nghiên cứu ở người lớn.
Ở ĐTĐ tuýp 2, các bệnh đi kèm có thể đã có mặt tại thời điểm chẩn đoán ĐTĐ tuýp 2 ở thanh thiếu niên. Do đó, nên thực hiện đo huyết áp, bảng xét nghiệm lipid lúc đói, đánh giá tỷ lệ albumin/creatinine trong nước tiểu ngẫu nhiên, và khám mắt có nhỏ thuốc giãn đồng tử tại thời điểm chẩn đoán. Sau đó, các hướng dẫn sàng lọc và khuyến nghị điều trị cho tăng huyết áp, rối loạn lipid máu, bài tiết albumin trong nước tiểu và bệnh võng mạc tương tự như đối với thanh thiếu niên mắc ĐTĐ tuýp 1. Các vấn đề bổ sung có thể cần được giải quyết bao gồm bệnh buồng trứng đa nang và các bệnh đi kèm khác liên quan đến béo phì ở trẻ em, chẳng hạn như gan nhiễm mỡ, ngưng thở khi ngủ, các biến chứng chỉnh hình và các mối quan tâm về tâm lý xã hội.
Đái tháo đường tuýp 2
Thể điển hình
ĐTĐ tuýp 2, trước đây được gọi là NIDDM, là một rối loạn không đồng nhất đặc trưng bởi sự bài tiết insulin khiếm khuyết, dần dần không thể bù đắp cho tình trạng đề kháng insulin. Nguyên nhân của đề kháng insulin thường là do béo phì, mặc dù các tác nhân như hormone tăng trưởng và cortisol cũng đối kháng với tác dụng của insulin và có thể làm bộc lộ sự bài tiết insulin không được bù đắp đầy đủ. Nồng độ cao của các hormone tăng trưởng nhau thai trong giai đoạn giữa và cuối thai kỳ cũng có thể làm bộc lộ sự bài tiết insulin không đủ, dẫn đến đái tháo đường thai kỳ—một điềm báo của bệnh đái tháo đường vĩnh viễn sau này trong cuộc sống.
Cơ chế đề kháng insulin do béo phì có thể một phần liên quan đến những thay đổi trong chuyển hóa acid béo cản trở chuyển hóa glucose bình thường, và một phần do các yếu tố được tổng hợp trong các tế bào mỡ đối kháng với tác dụng của insulin. Đáng chú ý nhất là các hormone adiponectin, leptin và resistin, được sản xuất bởi các tế bào mỡ và có khả năng là một liên kết chính giữa béo phì và đái tháo đường. Sự điều hòa di truyền của khả năng bù đắp cho đề kháng insulin có thể là một cơ chế khác dẫn đến hoặc bảo vệ khỏi ĐTĐ tuýp 2. Do đó, ngoài các thành phần di truyền chịu trách nhiệm cho sự suy giảm bài tiết insulin (đang được nghiên cứu, xác định dần dần và hiện không thể thay đổi), yếu tố có thể thay đổi chính chịu trách nhiệm cho đại dịch ĐTĐ tuýp 2 ở trẻ em là đại dịch béo phì ngày càng được công nhận trên toàn thế giới.
ĐTĐ tuýp 2 đang được ghi nhận ngày càng nhiều ở trẻ em, đặc biệt là thanh thiếu niên béo phì và đặc biệt nhưng không chỉ giới hạn ở một số nhóm dân tộc nhất định, chẳng hạn như người Mỹ bản địa, người Mỹ da đen không phải gốc Tây Ban Nha, người Mỹ gốc Tây Ban Nha, người dân các đảo Thái Bình Dương và người Đông Nam Á ở các nước đang phát triển. Ở đây, một khuynh hướng di truyền về đề kháng insulin cùng với đại dịch béo phì cũng là nguyên nhân gây ra sự gia tăng nhanh chóng về tỷ lệ bệnh nhân mắc ĐTĐ tuýp 2—chiếm tới một nửa số ca mới nhập viện tại một trung tâm y tế lớn ở Hoa Kỳ. Trong các nhóm dân tộc dễ bị tổn thương này, tỷ lệ ĐTĐ tuýp 2 đã tăng gần gấp đôi từ năm 2002 đến năm 2012.
Ngoài béo phì, những bệnh nhân này thường có tiền sử gia đình mắc ĐTĐ tuýp 2, cho thấy khuynh hướng di truyền. Họ cũng có thể bị gai đen (acanthosis nigricans), thường là nữ giới, và thường có kiểm soát chuyển hóa kém, khiến họ dễ bị xuất hiện sớm các biến chứng vi mạch và mạch máu lớn. Có một nhịp độ gia tăng trong sự phát triển của các biến chứng liên quan đến ĐTĐ; suy giảm chức năng thận biểu hiện dưới dạng albumin niệu xảy ra ở ~ 6% trong vòng 5 năm sau khi chẩn đoán và khoảng 2,3% bị suy thận giai đoạn cuối sau 10 năm chẩn đoán. Các thay đổi vi mạch, ví dụ như bệnh võng mạc, cũng xuất hiện sớm hơn, và sự giảm thể tích não với những thay đổi vi cấu trúc trong chất trắng và suy giảm chức năng nhận thức đã được báo cáo. Trong nghiên cứu TODAY, những người có BMI từ 35 kg/m2 trở lên đã cho thấy sự tiến triển nhanh chóng của các yếu tố nguy cơ tim mạch mặc dù đã được điều trị; tăng huyết áp tăng gấp ba lần trong 4 năm từ 11% lên 34%; microalbumin niệu tăng từ 6% lên 17% trong vòng 3 năm; và LDL nguy cơ cao (LDL > 130 mg/dL hoặc đang dùng thuốc) tăng từ 4,5% lên 11% sau 3 năm. Như đã lưu ý trước đó, can thiệp lối sống và metformin đã thất bại và việc sử dụng insulin thúc đẩy tăng cân thêm. Đối với bệnh nhân được lựa chọn cẩn thận và tại cơ sở thích hợp, phẫu thuật giảm béo mang lại kết quả đầy hứa hẹn với sự cải thiện trong tất cả các biểu hiện của rối loạn chuyển hóa và các bất thường mạch máu liên quan, mặc dù tình trạng thiếu vitamin và sắt, cũng như các biến chứng phẫu thuật vẫn còn tồn tại.
Bệnh nhân ĐTĐ tuýp 2 ban đầu có thể có biểu hiện DKA gợi ý ĐTĐ tuýp 1, nhưng sau khi hồi phục, họ có thể biểu hiện một giai đoạn trăng mật kéo dài—cái gọi là ĐTĐ không điển hình, một dạng của ĐTĐ tuýp 2, được ghi nhận bằng nồng độ insulin hoặc C-peptide đáng kể không phù hợp với ĐTĐ tuýp 1. Họ cũng thiếu các dấu ấn tự miễn dịch của đảo tụy và các mối liên quan HLA kinh điển.
Ở những người có tiền sử gia đình mắc ĐTĐ tuýp 2, tình trạng đề kháng insulin (thể hiện qua sự suy giảm thải trừ glucose do insulin kích thích và nồng độ insulin cao hơn trong nghiệm pháp dung nạp glucose đường uống hoặc cái gọi là kẹp tăng đường huyết) có thể chứng minh được trong thập kỷ đầu tiên của cuộc đời trước khi có những thay đổi có thể chứng minh được trên lâm sàng về dung nạp glucose. Các vị trí của sự suy giảm nhạy cảm với insulin được cho là do di truyền này vẫn chưa được xác định nhưng rõ ràng có trước ĐTĐ lâm sàng gây ra bởi đề kháng insulin do béo phì. Có thể có các yếu tố khác gây ra đề kháng insulin.
Cũng có một số lượng ngày càng tăng các yếu tố di truyền mới được xác định liên quan đến suy giảm bài tiết và tác dụng của insulin. Các nghiên cứu quét toàn bộ bộ gen đã liên tục xác định được ba mối liên kết di truyền chính: kênh K-ATP, đặc biệt là tiểu đơn vị Kir 6.2 được mã hóa bởi gen KCNJ11; thụ thể kích hoạt bởi chất tăng sinh peroxisome γ (PPARG); và yếu tố phiên mã 7-like 2 (TCF7L2). Sự phát triển của các mảng tinh vi cho phép xác định kiểu gen của hàng trăm nghìn đa hình đã tiết lộ thêm các locus của các dấu ấn di truyền trong ĐTĐ tuýp 2, bao gồm một đa hình trong chất vận chuyển kẽm SLC30A8 (chỉ biểu hiện trên các tế bào β của tụy) và các gen có khả năng liên quan đến sự phát triển của tụy (IDE, KIF11, HHEX) hoặc chức năng (EXT2-ALX4). Các phương pháp sàng lọc di truyền tinh vi này có khả năng xác định thêm nhiều đặc điểm di truyền phức tạp làm nền tảng cho ĐTĐ tuýp 2. Tuy nhiên, sự phức tạp của các đóng góp di truyền vào ĐTĐ tuýp 2 vẫn còn nhiều thách thức.
Từ quan điểm thực tế, ĐTĐ tuýp 2 ở trẻ em và thanh thiếu niên nên được xem là một vấn đề sức khỏe cộng đồng lớn—và nếu không có các can thiệp lối sống hiệu quả (chẳng hạn như giảm cân kết hợp với tập thể dục thường xuyên), các lựa chọn điều trị còn hạn chế và chỉ thành công khiêm tốn. Phẫu thuật giảm béo thành công ở người lớn và trong các mẫu dân số nhỏ đã là một phương tiện bền vững và hiệu quả để đảo ngược các rối loạn chuyển hóa, bao gồm tăng lipid máu, đái tháo đường, tăng huyết áp albumin niệu. Insulin ngoại sinh có thể cần thiết để kiểm soát đường huyết ban đầu, nhưng tác dụng kích thích thèm ăn của nó thách thức những nỗ lực giảm cân. Sulfonylurea có thể hữu ích tạm thời, cũng như meglitinide—chất làm tăng tiết insulin cấp tính.
Metformin, chất làm tăng nhạy cảm của mô với tác dụng của insulin và làm giảm sản xuất glucose ở gan, là tác nhân được sử dụng thường xuyên nhất để điều trị ĐTĐ tuýp 2 ở trẻ em. FDA đã phê duyệt việc sử dụng nó cho những người trên 10 tuổi. FDA chưa phê duyệt sử dụng ở trẻ em các thiazolidinedione (glitazone) làm tăng nhạy cảm của mô với insulin, nhưng tuy nhiên chúng đã được báo cáo là đã được sử dụng. Các tác nhân này có khả năng gây độc cho gan, và sản phẩm ban đầu đã bị thu hồi vì lý do này. Các glitazone mới hơn (chẳng hạn như rosiglitazone) đang được nghiên cứu ở thanh thiếu niên mắc ĐTĐ tuýp 2. Các chất ức chế alpha-glucosidase làm chậm hấp thu carbohydrate và các chất ức chế lipase để giảm hấp thu chất béo đã có sẵn và được phê duyệt, nhưng các thử nghiệm lâm sàng ở trẻ em/thanh thiếu niên về hiệu quả và tuân thủ vẫn chưa được công bố. Ngoài ra, các tác nhân như chất chủ vận thụ thể GLP-1, chất ức chế dipeptidyl-peptidase (DPP)4, và chất đối kháng SGLT2 được sử dụng ở người lớn mắc ĐTĐ tuýp 2 đang được thử nghiệm ở thanh thiếu niên nhưng chưa được phê duyệt để sử dụng trong nhóm tuổi này. Điều này thể hiện một sự thiếu hụt trong khả năng điều trị ĐTĐ tuýp 2 ở thanh thiếu niên và người trẻ tuổi. So với giả dược, việc bổ sung liraglutide, một chất tương tự GLP-1, vào metformin và insulin ở thanh thiếu niên mắc ĐTĐ tuýp 2 đã thành công trong việc hạ HbA1c, và liraglutide hiện đã được phê duyệt để sử dụng ở thanh thiếu niên mắc ĐTĐ tuýp 2. Dự kiến rằng các nghiên cứu tương tự kiểm tra hiệu quả và an toàn của nhiều loại tác nhân hiện đã được phê duyệt để sử dụng ở người lớn mắc ĐTĐ tuýp 2 sẽ có sẵn để sử dụng ở thanh thiếu niên và người trẻ tuổi trong tương lai gần.
Các khiếm khuyết di truyền của chức năng tế bào beta
Các Hội chứng MODY
Thuật ngữ MODY ban đầu được khái niệm hóa là một dạng đái tháo đường khởi phát ở người trưởng thành (tức là tuýp 2). Tuy nhiên, các hội chứng MODY được xem xét tốt nhất là một nhóm các rối loạn do khiếm khuyết đơn gen trong chức năng tế bào beta. Bệnh nhân bị ảnh hưởng có thể chỉ tăng glucose ở mức độ khiêm tốn, có thể không có triệu chứng trong nhiều năm, và có thể trở nên rõ ràng trên lâm sàng trong các bệnh xen kẽ hoặc thai kỳ làm bộc lộ sự hạn chế trong bài tiết insulin. Các tiêu chí lâm sàng được sử dụng để xác định chẩn đoán bao gồm:
- Di truyền trội với ít nhất hai (và tốt nhất là ba) thế hệ liên tiếp bị ảnh hưởng
- Khởi phát trước 25 đến 30 tuổi
- Bằng chứng về sự bài tiết insulin còn lại đáng kể nhưng bị suy giảm, được phản ánh qua nồng độ C-peptide cho dù bệnh nhân có đang được điều trị bằng insulin hay không
Khoảng 14 khiếm khuyết di truyền cụ thể đã được xác định (xem thêm Chương 10) nhưng trong số này, phổ biến nhất là MODY2, MODY3, MODY1 và MODY5 (Bảng 21.14), cùng chiếm hơn 85% tất cả các dạng. Hơn nữa, các khiếm khuyết nhẹ hơn trong các gen kênh K-ATP KCNJ11 và ABCC8, cũng như các khiếm khuyết trong chính gen insulin (INS), đã được tìm thấy ở những bệnh nhân đáp ứng các tiêu chí chẩn đoán MODY. Trong số những khiếm khuyết di truyền này, cùng chiếm không quá 2% đến 5% các trường hợp đái tháo đường, khoảng hai phần ba (65%) là MODY 3 (HNF1A), cùng với MODY 2 (khiếm khuyết glucokinase), và phần còn lại là các khiếm khuyết khác. MODY2 có tỷ lệ hiện mắc khoảng 1:1000 ca sinh và có thể hoàn toàn không có triệu chứng cho đến khi được phát hiện trong các đánh giá xét nghiệm định kỳ, ví dụ như trong thai kỳ. Tăng đường huyết ổn định nhẹ có thể xuất hiện từ khi sinh và không cần điều trị ngoại trừ trong các trường hợp căng thẳng, chẳng hạn như nhiễm trùng ở trẻ sơ sinh hoặc trẻ nhỏ, hoặc thai kỳ ở người trẻ tuổi.
Bảng 21.14: Phân loại Đái tháo đường Khởi phát ở Người trưởng thành Trẻ tuổi
| Loại | Gen | Nhiễm sắc thể | Điều trị | Tần suất tương đối (%) |
|---|---|---|---|---|
| MODY 1 | HNF4A | 20q12–q13.1 | Insulin/SU | 5 |
| MODY 2 | Glucokinase | 7p15–p13 | Vận động/chế độ ăn | 22 |
| MODY 3 | HNF1A | 12q24.2 | Insulin/SU | 58 |
| MODY 4 | IPF1/PDX1 | 13q12.2 | Insulin | < 1 |
| MODY 5 | HNF1β | 17q12 | Insulin/SU | 2 |
| MODY 6 | NEUROD1/Beta-2 | 2q32 | Insulin | < 1 |
| MODY 7 | KLF11 | 2p25 | Insulin | < 1 |
| MODY 8 | CEL | 9q34.3 | Insulin | < 1 |
| MODY 9 | PAX4 | 7q32 | Insulin | < 1 |
| MODY 10 | Insulin | 11p15.5 | Insulin | < 1 |
| MODY 11 | BLK | 8p23.1 | Insulin | < 1 |
| MODY 12 | ABCC8 | 11p15.1 | SU | < 1 |
| MODY 13 | KCNJ11 | 11p15.1 | SU | < 1 |
| MODY 14 | APPL1 | 3p14.3 | Insulin | < 1 |
ABCC8, ATP binding cassette subfamily C member 8; APPL1, adaptor protein, phosphotyrosine interacting with PH domain and leucine zipper 1; BLK, BLK proto-oncogene, Src family tyrosine kinase; CEL, carboxyl-ester lipase; HNF, hepatic nuclear factor; IPF/PDX, insulin promoter factor/pancreas-duodenum homeobox; KCNJ11, potassium channel family J number 11; KLF, Kruppel-like factor; NEUROD1/Beta-2, neurogenic differentiation factor 1/beta-cell E-box transactivator 2; PAX, paired homeobox; SU, thuốc sulfonylurea.
- Đái tháo đường khởi phát ở người trưởng thành trẻ tuổi (MODY) 1, 2, & 3 cùng chiếm 85% tất cả các hội chứng MODY đã biết; nếu bao gồm MODY5, gần 90% tất cả các hội chứng MODY được xác định
- MODY2 ổn định, hiếm khi cần điều trị bằng insulin ngoại trừ trong thai kỳ để bảo vệ thai nhi khỏi tăng đường huyết, và có tiên lượng tuyệt vời về việc tránh các biến chứng mạch máu
- MODY1 & 3 thường đáp ứng với thuốc sulfonylurea ban đầu nhưng có thể tiến triển đến phụ thuộc insulin và có nguy cơ phát triển các biến chứng mạch máu phụ thuộc vào kiểm soát chuyển hóa
- MODY chiếm khoảng 1,5%–3,0% các trường hợp đái tháo đường mới khởi phát ở trẻ em và nên được nghi ngờ ở những người có tiền sử gia đình có nhiều thành viên bị ảnh hưởng trong hai đến ba thế hệ, với khởi phát trước 35 tuổi, không có các dấu ấn tự miễn, “đái tháo đường nhẹ” cần < 0,5 U/kg insulin ngay từ đầu hoặc giai đoạn “trăng mật” kéo dài bất thường
Với thiếu hụt glucokinase, các biến chứng vi mạch của đái tháo đường là hiếm gặp. Tuy nhiên, ở các dạng MODY phổ biến khác, chẳng hạn như MODY3 và MODY1, khởi phát thường ở độ tuổi thiếu niên đến 20, tình trạng không dung nạp glucose có thể ngày càng trở nên tồi tệ hơn và do đó cần điều trị, và các biến chứng vi mạch có thể phát triển sau này trong cuộc sống. U nang thận hoặc các bất thường khác ở bể thận có thể xảy ra ở MODY 5 (HNF1β). Đáng chú ý, nếu khiếm khuyết di truyền trong yếu tố khởi động insulin-1 (IPF1, MODY 4) là đồng hợp tử, sẽ dẫn đến bất sản tụy và đây là nguyên nhân gây ra đái tháo đường sơ sinh vĩnh viễn liên quan đến suy ngoại tiết cũng như nội tiết (xem Chương 10). Tương tự, các đột biến đồng hợp tử trong glucokinase đã được liên kết với đái tháo đường bẩm sinh. Ngược lại, các đột biến tăng chức năng trong glucokinase gây ra hạ đường huyết tăng insulin máu kéo dài ở trẻ sơ sinh (xem Chương 7). Do đó, các hội chứng MODY là các khiếm khuyết đơn gen của sự hình thành tế bào đảo (MODY 4) hoặc của các yếu tố phiên mã (MODY 1, 3, 5 và 6)—hoặc một khiếm khuyết trong cảm biến glucose chức năng glucokinase (MODY 2).
Bảng 21.15 so sánh và đối chiếu bốn loại đái tháo đường phổ biến nhất được tìm thấy ở thanh thiếu niên: tuýp 1, tuýp 2, ĐTĐ không điển hình và MODY. Các hội chứng MODY đơn gen đã được xem xét rộng rãi về các phân tích hóa học, sinh hóa và phân tử, và cũng được thảo luận trong Chương 10. Các khiếm khuyết đơn gen khác được báo cáo có liên quan đến một bức tranh lâm sàng tuýp 2 bao gồm đột biến trong các gen GLUT2 và glycogen synthase.
Bảng 21.15: So sánh các Dạng Đái tháo đường Khởi phát ở Người trẻ tuổi Phổ biến
| Đặc điểm | Đái tháo đường tuýp 1 | Đái tháo đường tuýp 2 | MODY Cổ điển | Đái tháo đường Không điển hình |
|---|---|---|---|---|
| Tuổi khởi phát | Đỉnh điểm ở 5 và 15 tuổi | Tuổi thiếu niên, người trẻ tuổi | < 25 tuổi | > 40 tuổi |
| Nhóm dân tộc bị ảnh hưởng chủ yếu | Da trắng | Gốc Tây Ban Nha, người Mỹ gốc Phi, người Mỹ bản địa | Xảy ra ở tất cả các nhóm dân tộc | Người Mỹ gốc Phi |
| Tỷ lệ nam/nữ | 1.1:1 | 1:1.5 | 1:1 | 1:3 |
| Mức độ nghiêm trọng khi khởi phát | Cấp tính, nặng, cần insulin | Tinh vi, không cần insulin | Tinh vi, không cần insulin | Cấp tính, nặng, cần insulin |
| Tự miễn dịch đảo tụy | Có mặt | Vắng mặt | Vắng mặt | Vắng mặt |
| HLA-DR3,-DR4 | Rất phổ biến | Không tăng tần suất | Không tăng tần suất | Không tăng tần suất |
| Nhiễm ceton, DKA | Phổ biến | Không phổ biến | Hiếm | Phổ biến khi khởi phát |
| Diễn biến lâu dài | Phụ thuộc insulin | Không phụ thuộc insulin | Không phụ thuộc insulin | Không phụ thuộc insulin |
| Tỷ lệ béo phì | Không phổ biến | ≥ 90% | Không phổ biến | 40% |
| Tỷ lệ các trường hợp đái tháo đường khởi phát ở người trẻ | Dạng phổ biến nhất | Tần suất ngày càng tăng; ± phổ biến như tuýp 1 ở các quần thể cụ thể | ≤ 5% ở người da trắng | ≤ 10% ở người Mỹ gốc Phi |
| Tỷ lệ bệnh nhân có người thân cấp một bị ảnh hưởng | ≤ 15% | Thay đổi nhưng phổ biến | 100% | > 75% |
| Kiểu di truyền | Không theo Mendel, thường là lẻ tẻ | Không theo Mendel nhưng có tính gia đình mạnh | Trội trên nhiễm sắc thể thường | Trội trên nhiễm sắc thể thường |
| Số lượng gen kiểm soát di truyền | Đa gen | Đa gen | Đơn gen | Đơn gen |
| Sinh bệnh học | Phá hủy tế bào beta tự miễn: thiếu insulin | Đề kháng insulin cộng với thiếu insulin tương đối | Thiếu insulin | Thiếu insulin |
DKA, Nhiễm toan ceton do đái tháo đường; MODY, đái tháo đường khởi phát ở người trưởng thành trẻ tuổi.
Các Dạng Đái tháo đường Đơn gen Khác
Đái tháo đường do Ty thể
Các khiếm khuyết di truyền của ty thể liên quan đến bệnh đái tháo đường thường nhưng không phải lúc nào cũng liên quan đến các rối loạn thần kinh cơ, bao gồm điếc, đau nửa đầu, co giật và chậm phát triển trí tuệ. Ví dụ, hội chứng MELAS (bệnh não ty thể, nhiễm toan lactic và các đợt giống đột quỵ) ban đầu có thể xuất hiện ở thời thơ ấu với tầm vóc thấp, tiến triển đến điếc ở tuổi thiếu niên, và phát triển bệnh đái tháo đường và bệnh não ở tuổi trung niên. ĐTĐ có thể là biểu hiện duy nhất của một rối loạn ty thể được mã hóa bởi một khiếm khuyết gen trong ty thể (tất cả đều được di truyền từ mẹ) hoặc một gen được mã hóa bởi DNA nhân cần thiết cho chuỗi phosphoryl hóa oxy hóa trong ty thể.
Con đường năng lượng khiếm khuyết này dẫn đến sự suy giảm dần dần của bài tiết insulin, và do đó một tình trạng tăng đường huyết nhẹ ban đầu có thể ngày càng trở nên tồi tệ hơn. Đây là trường hợp của dạng đái tháo đường phổ biến nhất gây ra bởi một đột biến gen ty thể tại cặp nucleotide (np) 3243 của bộ gen ty thể, thường liên quan đến điếc. Đáng chú ý, cùng một khiếm khuyết di truyền này có thể liên quan đến hội chứng MELAS. Ban đầu, bệnh nhân có đột biến np 3243 có thể được kiểm soát chỉ bằng chế độ ăn uống nhưng sau đó có thể cần insulin. ĐTĐ xuất hiện ở trẻ sơ sinh và nặng ngay từ đầu và cần insulin có thể liên quan đến sự xóa đoạn DNA ty thể, như thấy trong hội chứng Kearns-Sayre và hội chứng Pearson. Hình 21.7 đã xác định vai trò quan trọng của sản xuất năng lượng, bao gồm cả con đường phosphoryl hóa oxy hóa của ty thể đối với sự bài tiết insulin bình thường.
Các khiếm khuyết trong con đường này có thể là nguyên nhân gây ra ĐTĐ sơ sinh tạm thời hoặc vĩnh viễn, đặc biệt là những khiếm khuyết liên quan đến các đột biến kích hoạt trong các tiểu đơn vị kênh K-ATP Kir 6.2 (KCNJ11) và tiểu đơn vị điều hòa của nó là thụ thể sulfonylurea SUR1 (ABCC8) như đã thảo luận trong Chương 10. Các đột biến bất hoạt trong các tiểu đơn vị K-ATP gây ra hạ đường huyết tăng insulin máu sơ sinh với mức độ nghiêm trọng khác nhau, như được mô tả chi tiết trong Chương 7. Bệnh đái tháo đường trong các hội chứng ty thể thường được kiểm soát tốt bằng insulin ngoại sinh.
Hội chứng Wolfram
Hội chứng Wolfram được đặc trưng bởi đái tháo nhạt, ĐTĐ, teo thị giác và điếc (DIDMOAD). Có sự mất chọn lọc các tế bào beta, là nguyên nhân gây ra ĐTĐ. Các nghiên cứu liên kết di truyền trong các gia đình cận huyết có di truyền lặn trên nhiễm sắc thể thường đã dẫn đến việc nhân bản vị trí của một gen trên nhánh ngắn của nhiễm sắc thể 4 (được gọi là WFS1, và hiện được xác định là Wolframin).
Mặc dù chức năng của gen này chưa được hiểu đầy đủ, nó được biểu hiện ở nhiều mô (phong phú nhất ở các tế bào beta, so với tụy ngoại tiết). Các đột biến trong Wolframin đã được xác định ở nhiều gia đình mắc hội chứng Wolfram. Các cá nhân bị ảnh hưởng thường là dị hợp tử phức hợp. Gen Wolframin có thể có một vai trò trong sự sống còn của tế bào beta và mô thần kinh, và dường như không có mối tương quan giữa đột biến quan sát được và mức độ nghiêm trọng của bệnh. Các khiếm khuyết trong Wolframin đã được liên quan đến dạng ĐTĐ tuýp 1 phổ biến không miễn dịch vô căn. Một locus thứ hai của hội chứng Wolfram đã được lập bản đồ trên nhánh dài của nhiễm sắc thể 4 ở một số gia đình cận huyết người Jordan. Ở những bệnh nhân này, đái tháo nhạt không phải là một đặc điểm—nhưng xuất huyết và loét đường tiêu hóa trên là nổi bật.
Mặc dù một dạng ty thể của hội chứng Wolfram đã được đề xuất, một khiếm khuyết trong DNA ty thể không thể được xác nhận trong một nhóm thuần tập lớn. Người ta đã đề nghị rằng ĐTĐ (tuổi < 15) và teo thị giác tiến triển có khả năng dự đoán cao về hội chứng Wolfram. Trình tự xuất hiện của các dấu hiệu là ĐTĐ tuýp 1 không tự miễn trong thập kỷ đầu tiên của cuộc đời; đái tháo nhạt trung ương và điếc thần kinh giác quan ở hai phần ba đến ba phần tư bệnh nhân trong thập kỷ thứ hai; các bất thường đường tiết niệu ở khoảng một nửa trong thập kỷ thứ ba; và các biến chứng thần kinh, chẳng hạn như thất điều tiểu não và rung giật cơ, ở một nửa đến hai phần ba trong thập kỷ thứ tư. Các đặc điểm khác bao gồm teo tuyến sinh dục nguyên phát ở phần lớn nam giới và một quá trình thoái hóa thần kinh tiến triển với tử vong do suy hô hấp thần kinh ở độ tuổi trung bình là 30. Trầm cảm đã được báo cáo là một đặc điểm thường gặp của người thân của bệnh nhân mắc hội chứng Wolfram.
Đái tháo đường Đáp ứng với Thiamine (Hội chứng Roger)
Hội chứng này được đặc trưng bởi thiếu máu hồng cầu khổng lồ, ĐTĐ, và điếc thần kinh giác quan—tất cả đều có thể đáp ứng với vitamin B1 (thiamine). ĐTĐ từ nhẹ đến trung bình, sự bài tiết insulin có thể cải thiện với liệu pháp thiamine, và không có các dấu ấn tự miễn liên quan. Nó được gây ra bởi một khiếm khuyết trong chất vận chuyển thiamine, hiện đã được xác định là do các đột biến trong gen SLC19A2. Gen này mã hóa chất vận chuyển thiamine gắn màng THTR-1.
Sự hấp thu thiamine bằng các con đường kết hợp của một chất mang có ái lực cao hoạt động và một chất mang có ái lực thấp thụ động dẫn đến sự tích tụ thiamine nội bào, sau đó được chuyển đổi thành dạng hoạt động của nó, thiamine pyrophosphate. Yếu tố đồng vận này cho phép chức năng thích hợp của transketolase, rất quan trọng trong con đường pentose phosphate, chìa khóa cho sự tổng hợp ribose và do đó sản xuất acid nucleic và của pyruvate dehydrogenase, α ketoglutarate dehydrogenase, và dehydrogenase acid chuỗi nhánh—tất cả đều là chìa khóa cho quá trình decarboxyl hóa oxy hóa. Các đột biến trong chất vận chuyển ái lực cao THTR-1 dẫn đến cái chết tế bào ở những tế bào có tốc độ luân chuyển acid nucleic cao (chẳng hạn như các tế bào tủy xương) và hoạt động (chẳng hạn như các tế bào beta của tụy), do đó giải thích mối liên quan của thiếu máu đáp ứng với thiamine với bệnh đái tháo đường ở những người bị ảnh hưởng bởi đột biến này.
Do Thuốc hoặc Hóa chất
Một số loại thuốc và tác nhân hóa học có thể gây độc cho tế bào beta. Nổi tiếng nhất về tác dụng gây đái tháo đường là các loại thuốc ức chế miễn dịch cyclosporine, sirolimus và tacrolimus, có độc tính với tế bào beta—gây ra đái tháo đường phụ thuộc insulin ở một tỷ lệ đáng kể bệnh nhân được điều trị bằng các tác nhân này để ghép tạng. Độc tính của chúng đối với các tế bào beta của tụy càng trở nên trầm trọng hơn do việc sử dụng glucocorticoid ức chế miễn dịch sau khi ghép, đối kháng với tác dụng của insulin và cùng với số lượng hoặc chức năng tế bào β bị suy giảm dẫn đến bệnh đái tháo đường.
Streptozotocin và thuốc diệt chuột Vacor cũng gây độc cho tế bào beta, gây ra bệnh đái tháo đường. Hộp 21.1 đã liệt kê các tác nhân khác có thể gây ra bệnh đái tháo đường. Trong số này, l-asparaginase (được sử dụng trong hóa trị liệu cho bệnh bạch cầu) và diazoxide (được sử dụng để điều trị hạ đường huyết tăng insulin máu kéo dài ở trẻ sơ sinh) có thể gây ra bệnh đái tháo đường. Tất cả các tác nhân này, đặc biệt là glucocorticoid, có thể kết hợp để làm bộc lộ ĐTĐ lâm sàng.
Các Bệnh của Tụy Ngoại tiết
Bệnh xơ nang (CF)
Bệnh xơ nang (CF) là một trong những lỗi bẩm sinh phổ biến nhất của quá trình chuyển hóa, liên quan đến kênh clorua được mã hóa trên nhiễm sắc thể 7 và ảnh hưởng đến khoảng một trong 2500 trẻ sơ sinh da trắng còn sống. Tỷ lệ sống sót ngày càng tăng của bệnh nhân CF và việc sử dụng glucocorticoid ngày càng nhiều để ức chế viêm phế quản-phổi đã đưa ra một thực thể được gọi là đái tháo đường liên quan đến bệnh xơ nang (CFRD), đặc trưng bởi sự suy giảm khả năng dung nạp carbohydrate ở các mức độ khác nhau.
Một số người bị ĐTĐ nhẹ chỉ rõ ràng trên lâm sàng khi đang dùng steroid, trong khi những người khác cần insulin cho một dạng ĐTĐ thiếu insulin không do tự miễn. Có tới 75% người lớn bị CF mắc CFRD. Amyloid đảo tụy nổi bật, cả sự bài tiết insulin và độ nhạy insulin đều có thể bị suy giảm, và DKA có thể xảy ra—cũng như các biến chứng vi mạch. Khi tăng đường huyết lúc đói (7 mM = 126 mg/dL hoặc cao hơn) được ghi nhận, liệu pháp bằng insulin được chỉ định. Insulin cũng tạo điều kiện cho dinh dưỡng và tăng trưởng tối ưu và do đó thúc đẩy cảm giác khỏe mạnh. Các tiêu chí chẩn đoán và quản lý cho CFRD đã được xem xét rộng rãi.
Chiếu xạ ion hóa vào Bụng
Chiếu xạ ion hóa vào bụng trong thời thơ ấu đối với một tình trạng, chẳng hạn như u nguyên bào thận, có liên quan đến sự phát triển của ĐTĐ khoảng 20 năm sau đó ở 5% đến 10% trẻ em được điều trị như vậy.
Cắt tụy
Cắt tụy rộng rãi được thực hiện để quản lý hạ đường huyết tăng insulin máu nặng ở trẻ sơ sinh có liên quan đến bệnh đái tháo đường ở khoảng 50% hoặc nhiều hơn những người sống sót lâu dài.
Nhiễm virus
Một số loại virus đã được liên quan đến nguyên nhân gây ra ĐTĐ tuýp 1 ở trẻ em. Coxsackievirus B4 đã được chứng minh trong một báo cáo trường hợp có khả năng đáp ứng các định đề của Koch về tác dụng gây độc trực tiếp lên tế bào beta trong việc gây ra ĐTĐ bùng phát cấp tính. Trong các trường hợp nhiễm coxsackievirus khác (cũng như với mối liên quan đã được thiết lập giữa rubella, cytomegalovirus và enterovirus), sự bắt chước phân tử giữa các yếu tố quyết định kháng nguyên trong virus và một số kháng nguyên tế bào đảo đã được cho là cơ chế dẫn đến một dạng ĐTĐ tuýp 1 tự miễn. Cuối cùng, một phản ứng miễn dịch được kích hoạt bởi siêu kháng nguyên đã được đề xuất cho một số bệnh nhiễm virus và có thể là cơ chế liên quan đến sự khởi phát cấp tính của ĐTĐ với hội chứng tan máu-urê huyết. Bệnh nhân bị đái tháo đường mới khởi phát thường có bằng chứng nhiễm enterovirus trong các đảo tụy của họ. Các peptide có nguồn gốc từ một chi virus cụ thể có các đặc tính giống insulin, bao gồm liên kết và kích thích các thụ thể insulin và IGF-1, cung cấp một mối liên kết tiềm năng hơn nữa giữa nhiễm virus và sự khởi phát của ĐTĐ thông qua cơ chế bắt chước phân tử; các kháng thể đối với virus cũng có thể ảnh hưởng đến các tế bào nội sinh sản xuất insulin.
Các khiếm khuyết di truyền trong tác dụng của insulin
Đề kháng Insulin Tuýp A với Gai đen
Hội chứng này được đặc trưng bởi đề kháng insulin nặng, gai đen khi không có béo phì hoặc teo mỡ. Phụ nữ bị ảnh hưởng cũng bị tăng androgen, có thể là một biểu hiện thứ phát của tăng insulin máu với sự kích thích tổng hợp androgen bởi các tế bào vỏ buồng trứng. Tình trạng không dung nạp glucose là khác nhau và bao gồm cả đái tháo đường có triệu chứng. Tăng androgen biểu hiện dưới dạng các dấu hiệu lâm sàng và sinh hóa gợi ý hội chứng buồng trứng đa nang (PCOS).
Một số bệnh nhân (chủ yếu là phụ nữ da đen bị béo phì, gai đen và tăng trưởng nhanh gợi ý chứng khổng lồ) có thể biểu hiện đề kháng insulin do béo phì, với sự điều hòa giảm của thụ thể insulin. Chứng khổng lồ có thể đại diện cho một tác động “lan tỏa” của insulin tác động thông qua thụ thể IGF-1 thay vì thụ thể insulin.
Đề kháng Insulin Tuýp B
Đề kháng insulin tuýp B là một hội chứng hiếm gặp liên quan đến bằng chứng rối loạn chức năng miễn dịch (chẳng hạn như bệnh tự miễn đã xác định là viêm khớp dạng thấp) hoặc các đặc điểm không đặc hiệu của tự miễn dịch (chẳng hạn như tốc độ lắng máu tăng cao hoặc nồng độ kháng thể kháng nhân cao). Cũng như các rối loạn tự miễn khác, phụ nữ bị ảnh hưởng chủ yếu. Một bệnh đái tháo đường đề kháng insulin phát triển cùng với gai đen và các đặc điểm của PCOS (chẳng hạn như rậm lông).
Hội chứng này là do các tự kháng thể huyết thanh chống lại thụ thể insulin dẫn đến suy giảm chức năng. Tuy nhiên, thụ thể có thể được kích hoạt bởi những thay đổi về cấu hình được cho là do kháng thể gây ra và gây ra hạ đường huyết nặng thay vì đái tháo đường. Điều trị có thể cần liều insulin cao để cố gắng kiểm soát tăng đường huyết, cùng với các loại thuốc ức chế miễn dịch để ức chế sản xuất kháng thể.
Leprechaunism (Hội chứng Donohue)
Leprechaunism là một hội chứng được đặc trưng bởi chậm phát triển trong tử cung, hạ đường huyết lúc đói và tăng đường huyết sau ăn liên quan đến sự đề kháng sâu sắc với insulin ở một bệnh nhân có nồng độ insulin trong huyết thanh có thể gấp 100 lần so với trẻ sơ sinh cùng tuổi trong một nghiệm pháp dung nạp glucose đường uống. Nhiều khiếm khuyết khác nhau của thụ thể insulin đã được mô tả, do đó chứng thực vai trò quan trọng của insulin và thụ thể của nó trong sự phát triển của thai nhi và có thể cả trong sự hình thành hình thái. Ngay cả sự vắng mặt hoàn toàn có thể có của các thụ thể insulin chức năng do di truyền đồng hợp tử của đột biến sai nghĩa trong thụ thể insulin, tuy nhiên, đã dẫn đến sự hình thành cơ quan bình thường và một trẻ sơ sinh còn sống bị một dạng leprechaunism nặng. Hầu hết những bệnh nhân này chết trong những năm đầu đời.
Hội chứng Rabson-Mendenhall
Hội chứng Rabson-Mendenhall được xác định bởi các đặc điểm lâm sàng dường như là trung gian giữa gai đen với đề kháng insulin tuýp A và leprechaunism. Các đặc điểm bao gồm đề kháng insulin cực độ, gai đen, các bất thường của răng và móng tay, và tăng sản tuyến tùng. Không rõ liệu hội chứng này có hoàn toàn khác biệt với leprechaunism hay không. Tuy nhiên, bệnh nhân mắc hội chứng Rabson-Mendenhall có xu hướng sống sót qua năm đầu tiên của cuộc đời. Các khiếm khuyết trong gen thụ thể insulin đã được mô tả trong hội chứng này.
Đái tháo đường do Teo mỡ
Đái tháo đường do teo mỡ thể hiện một nghịch lý thú vị. Trong khi ĐTĐ tuýp 2 cổ điển thường liên quan đến tình trạng thừa mỡ và các hậu quả chuyển hóa của nó (như đã mô tả trước đó), tình trạng thiếu mỡ cũng gây ra đề kháng insulin nặng và các rối loạn chuyển hóa rõ rệt. Bảng 21.16 liệt kê các hội chứng di truyền liên quan đến đái tháo đường do teo mỡ. Một nguyên nhân chính đã được xác định ở dạng được gọi là teo mỡ một phần có tính gia đình (còn được gọi là hội chứng Dunnigan). Đây là một khiếm khuyết gen được định vị trên nhiễm sắc thể 1q21-22 và sản phẩm của nó là lamin A/C.
Bảng 21.16: Các Hội chứng Di truyền của Teo mỡ
| Hội chứng | Teo mỡ | Gen/Locus | Di truyền | OMIM |
|---|---|---|---|---|
| Các Hội chứng Teo mỡ Nguyên phát | ||||
| Teo mỡ toàn thân bẩm sinh (Seip-Berardinelli) | Toàn thân | 9q34 | Lặn (AR) | 269700 |
| Xem văn bản để biết chi tiết | Gmg3lg; 11q13p | |||
| Hội chứng Dunnigan | Một phần, có tính gia đình | 1q21–22 | Trội (AD) | 151660 |
| Xem văn bản để biết chi tiết | Lamin A/C | |||
| Các hội chứng khác | Phân bố đa dạng | Không rõ | Trội/Lặn (AD/AR) | Không có |
| Các Hội chứng Phức tạp Liên quan đến Teo mỡ | ||||
| Loạn sản hàm-mỏm cùng vai | Bẩm sinh, một phần | Không rõ | Lặn (AR) | 248370 |
| Liên quan đến các chi | ||||
| Hội chứng Werner | Bẩm sinh, một phần | 8p12 | Lặn (AR) | 277700 |
| Liên quan đến các chi | Werner helicase | |||
| Hội chứng Cockayne | Bẩm sinh, một phần | 5 | Lặn (AR) | 216400 |
| Liên quan đến các chi | CSA | |||
| Hội chứng glycoprotein thiếu carbohydrate | Thoáng qua, một phần | 16p13.3 | Lặn (AR) | 212065 |
| Mông | PMM1 và 2 | |||
| Hội chứng SHORT | Toàn thân, bẩm sinh | Không rõ | Lặn (AR) | 269880 |
| Hội chứng AREDYLD | Toàn thân, bẩm sinh | Không rõ | Không rõ | 207780 |
AD, Di truyền trội trên nhiễm sắc thể thường; AR, Di truyền lặn trên nhiễm sắc thể thường; OMIM, Di truyền Mendel ở Người Trực tuyến, cơ sở dữ liệu cung cấp thông tin về các hội chứng di truyền; PMM1, PMM2, phosphomannomutase 1 và 2.
Có bằng chứng về sự không đồng nhất di truyền vì các đặc điểm lâm sàng tương tự có thể do các đột biến di truyền khác nhau gây ra.
Bệnh di truyền trội trên nhiễm sắc thể thường này thường biểu hiện ở tuổi tiền dậy thì dưới dạng mất mỡ dưới da ở các chi và thân mình nhưng với lượng mỡ ngày càng nhiều ở mặt và cổ khi dậy thì tiến triển. Mỡ nội tạng và mỡ giữa các bó cơ cũng tăng lên. Phụ nữ dường như phát triển ĐTĐ và rối loạn lipid máu sớm hơn và nặng hơn nam giới. Không rõ tại sao và làm thế nào các đột biến lamin A/C gây ra hội chứng teo mỡ này, đặc biệt là khi các đột biến trong gen này cũng liên quan đến một dạng loạn dưỡng cơ tiến triển (hội chứng Emery-Dreifuss), bệnh cơ tim và các khiếm khuyết dẫn truyền tim. Gen bị thay đổi trong loạn dưỡng mỡ bẩm sinh Berardinelli-Seip đã được định vị trên nhiễm sắc thể 11q13. Ngoài ra, các khiếm khuyết trong các gen mã hóa enzyme AGPAT2, endoprotease ZMPSTE24, kinase AKT2, thụ thể hạt nhân PPARγ, và protein BSCL 2 đã được tìm thấy ở những bệnh nhân bị loạn dưỡng mỡ.
Các khiếm khuyết mắc phải trong tác dụng của insulin
Những khiếm khuyết này bao gồm từ các rối loạn nội tiết, chẳng hạn như u tủy thượng thận và hội chứng Cushing đối kháng với tác dụng của insulin đến các dạng loạn dưỡng mỡ mắc phải do thuốc. Các kháng thể kháng thụ thể insulin có thể được tìm thấy trong một số rối loạn mạch máu collagen và có thể gây ra một hội chứng ĐTĐ tuýp 2 đặc trưng bởi gai đen và đề kháng insulin nặng. Điều này thường được gọi là gai đen với đề kháng insulin tuýp B. Hội chứng tuýp A bao gồm nhiều đột biến thụ thể insulin khác nhau, một số trong đó đã được mô tả trước đó. Hội chứng tuýp B hiếm khi được mô tả ở thời thơ ấu.
Các hội chứng di truyền có đái tháo đường và đề kháng insulin hoặc thiếu hụt insulin
Một số hội chứng di truyền có liên quan đến ĐTĐ. Ở trẻ em, bốn hội chứng di truyền tương đối phổ biến có thể liên quan đến bệnh đái tháo đường. Trong tam nhiễm sắc thể 21 (hội chứng Down) và hội chứng Turner (một nhiễm sắc thể X bình thường duy nhất), có sự gia tăng tỷ lệ mắc các rối loạn tự miễn, đặc biệt là của tuyến giáp. ĐTĐ tuýp 1 cũng có tỷ lệ hiện mắc cao hơn ở bệnh nhân mắc hội chứng Down so với dân số chung.
Trong hội chứng Turner, dự trữ bài tiết insulin có thể bị hạn chế đến mức việc điều trị bằng hormone tăng trưởng (hiện nay phổ biến) có thể dẫn đến suy giảm dung nạp glucose hoặc ĐTĐ tuýp 2. Trong hội chứng Klinefelter (XXY), đề kháng insulin là một đặc điểm chính—nhưng các mối liên quan tự miễn đã được mô tả. Trong hội chứng Prader-Willi, tần suất cao được báo cáo của ĐTĐ có thể không chỉ đơn giản là do đề kháng insulin như một phần của bệnh béo phì của hội chứng này mà có thể do một khiếm khuyết chính trong bài tiết insulin.
Hội chứng Alström bao gồm loạn dưỡng võng mạc, điếc thần kinh giác quan, béo phì và đái tháo đường liên quan, bệnh cơ tim, tăng triglyceride máu, bệnh gan và các bất thường tiết niệu. Đề kháng insulin nặng có thể dẫn đến gai đen và đái tháo đường. Các đột biến trong gen ALMS1 đã được xác định ở những bệnh nhân này. Hội chứng Bardet-Biedl cũng có viêm võng mạc sắc tố không điển hình là một đặc điểm chính, cùng với béo phì trung tâm, đa ngón, chậm phát triển trí tuệ, suy sinh dục và rối loạn chức năng thận. Mười một locus đã được liên kết với hội chứng này, với các bất thường trong các cấu trúc giống như lông mao là một chủ đề trung tâm. Mối liên quan của những hội chứng này và các hội chứng khác với bệnh đái tháo đường (được liệt kê trong Hộp 21.1) có thể được xác định bằng cách tìm kiếm cơ sở dữ liệu Di truyền Mendel ở Người Trực tuyến (OMIM, có sẵn tại www.ncbi.nlm.nih.gov/omim).
Đái tháo đường thai kỳ
Đái tháo đường thai kỳ là một bệnh của tam cá nguyệt thứ hai và thứ ba của thai kỳ, gây ra bởi các khiếm khuyết bẩm sinh hoặc mắc phải trong bài tiết insulin dẫn đến không có khả năng bù đắp cho nhu cầu insulin tăng lên do tác động chống insulin của các hormone tăng trưởng nhau thai.
Đái tháo đường sơ sinh
Những khám phá về cơ sở phân tử của sự hình thành tụy và điều hòa bài tiết insulin đã đưa các hội chứng đái tháo đường sơ sinh từ vùng nước tù của sự hiếm gặp lên hàng đầu của nghiên cứu. Những hội chứng này có lẽ xảy ra thường xuyên hơn so với suy nghĩ trước đây, và chúng có thể có tỷ lệ mắc chung khoảng 1:100.000 ca sinh ở các quần thể châu Âu. Hơn nữa, một số người trong số những người có đột biến kích hoạt trong các tiểu đơn vị kênh K-ATP Kir 6.2 hoặc SUR1 có thể được điều trị bằng các loại thuốc hạ đường huyết sulfonylurea đường uống, chẳng hạn như glibenclamide—dẫn đến sự bài tiết insulin nội sinh với kiểm soát đường huyết gần như bình thường và ít nhất là đảo ngược một phần các biểu hiện thần kinh cơ. Những thực thể này được mô tả chi tiết trong Chương 10.
Suy giảm dung nạp Glucose
Thuật ngữ suy giảm dung nạp glucose được sử dụng để mô tả những cá nhân có nồng độ glucose huyết tương vượt quá 140 mg/dL nhưng dưới 200 mg/dL ở 2 giờ sau khi bắt đầu nghiệm pháp dung nạp glucose đường uống tiêu chuẩn, nhưng không có các triệu chứng của bệnh đái tháo đường hoặc tăng đường huyết lúc đói. Một tập hợp như vậy có thể đại diện cho giai đoạn sớm nhất của một khiếm khuyết gen trong bài tiết hoặc tác dụng của insulin hoặc là một bước trong quá trình tiến triển của ĐTĐ tuýp 1 hoặc 2. Tăng đường huyết có thể là một phát hiện tình cờ trong một bệnh xen kẽ, trong quá trình điều trị bằng corticosteroid, hoặc là một phần của việc sàng lọc những người thân gần gũi của bệnh nhân mắc các hội chứng di truyền xác định.
Ở những người bị suy giảm dung nạp glucose nhưng không bị tăng đường huyết lúc đói, không nên thực hiện lặp lại các nghiệm pháp dung nạp glucose đường uống (OGTT). Các cuộc điều tra ở những trẻ em như vậy cho thấy mức độ suy giảm dung nạp glucose có xu hướng ổn định ngoại trừ ở những người có đáp ứng insulin giảm rõ rệt. Đáp ứng được chỉ định một cách tùy tiện xác định suy giảm dung nạp glucose được định nghĩa là giá trị glucose huyết tương lúc đói dưới 100 mg/dL và giá trị ở 2 giờ hơn 140 mg/dL. Việc xác định các đáp ứng insulin huyết thanh trong nghiệm pháp dung nạp glucose không phải là điều kiện tiên quyết để đi đến chẩn đoán. Tuy nhiên, vì mức độ của đáp ứng insulin có thể có giá trị tiên lượng, một số nhà điều tra yêu cầu đo insulin trong các xét nghiệm OGTT.
Ghép tụy và đảo tụy
Trong một nỗ lực chữa khỏi bệnh đái tháo đường phụ thuộc insulin, việc ghép một đoạn tụy hoặc các đảo tụy biệt lập đã được thực hiện ngày càng nhiều ở người. Các thủ thuật này đòi hỏi kỹ thuật cao và liên quan đến các rủi ro và biến chứng của thải ghép và việc điều trị nó bằng ức chế miễn dịch. Do đó, ghép tụy đoạn thường được thực hiện kết hợp với ghép thận cho bệnh nhân bị bệnh thận giai đoạn cuối do DN mà chế độ ức chế miễn dịch được chỉ định cho việc ghép thận.
Vài nghìn ca ghép như vậy đã được thực hiện trên toàn thế giới kể từ cuối những năm 1980. Với kinh nghiệm và các tác nhân ức chế miễn dịch mới hơn, sự sống còn chức năng của mảnh ghép tụy có thể đạt được trong nhiều năm—trong thời gian đó bệnh nhân có thể kiểm soát chuyển hóa mà không cần hoặc cần rất ít insulin ngoại sinh và đảo ngược một số biến chứng vi mạch. Tuy nhiên, vì trẻ em và thanh thiếu niên mắc ĐTĐ không có khả năng bị bệnh thận giai đoạn cuối do đái tháo đường, việc ghép tụy như một phương pháp điều trị chính không thể được khuyến nghị (cũng như không thể biện minh cho những rủi ro của nó) ở trẻ em. Một ngoại lệ có thể là việc cấy lại các đảo tụy tự thân sau khi cắt tụy vì viêm tụy tái phát.
Các nỗ lực ghép các đảo tụy biệt lập cũng đầy thách thức tương tự vì các kỹ thuật thu hoạch đủ đảo tụy và vấn đề thải ghép. Một số loại thuốc chống thải ghép mới hơn, đáng chú ý là cyclosporine và tacrolimus, có độc tính với các đảo Langerhans—làm suy giảm bài tiết insulin và thậm chí gây ra bệnh đái tháo đường. Giao thức Edmonton cho việc ghép đảo tụy tránh sử dụng steroid và sử dụng một kháng thể kháng thụ thể IL-2 và tacrolimus thay vì các thuốc ức chế miễn dịch khác. Thành công ban đầu đầy hứa hẹn, nhưng sự sống còn lâu dài của mảnh ghép sau 3 đến 5 năm là không bình thường—và đã có những tác dụng phụ nghiêm trọng của thủ thuật, cũng như không phục hồi được tình trạng không nhận biết hạ đường huyết. Do đó, giao thức ghép đảo tụy này không thể được khuyến nghị ở trẻ em.
Nghiên cứu tiếp tục cải thiện các kỹ thuật về năng suất, khả năng sống và mất tính sinh miễn dịch của các đảo Langerhans để cấy ghép. Việc cấy ghép các đảo tụy được phủ hoặc bao vi nang bằng một lớp màng hóa chất bảo vệ cho phép khuếch tán insulin và chất dinh dưỡng nhưng ngăn chặn sự tiếp xúc của tế bào T và do đó tránh thải ghép đã được nghiên cứu. Những phương pháp tiếp cận mới này đã bị thất bại trong dài hạn do sự phát triển quá mức của các nguyên bào sợi làm suy giảm dần khả năng cảm nhận glucose của các đảo tụy và sự khuếch tán insulin từ chúng. Nếu những vấn đề kỹ thuật này được khắc phục, hoặc các phương pháp tránh thải ghép được thiết lập, việc cấy ghép tụy hoặc đảo tụy như một phương pháp điều trị chính cho bệnh đái tháo đường có thể được xem xét sau khi những rủi ro của chúng được so sánh cẩn thận và cân nhắc với những lợi ích tiềm năng—đặc biệt là ở trẻ em. Tái tạo đảo tụy bằng cách điều chỉnh đáp ứng miễn dịch cũng đang được xem xét kỹ lưỡng.
Lời kết
Tiến bộ tiếp tục ngoạn mục trong việc hiểu và điều trị ĐTĐ. Chúng ta đã chuyển từ một tia sáng hiểu biết rằng đái tháo đường là một hội chứng gồm các loại rộng (phụ thuộc insulin và không phụ thuộc insulin) đến sự hiểu biết về tính nhạy cảm với bệnh và nguyên nhân gây bệnh ở cấp độ phân tử. ĐTĐ tuýp 1 được thừa nhận là một bệnh tự miễn với các locus nhạy cảm chính trong các gen điều hòa miễn dịch khác nhau, đặc biệt là phức hợp HLA, mặc dù (các) tác nhân kích hoạt cho quá trình tự miễn này vẫn còn khó nắm bắt; các loại virus khác nhau đứng đầu danh sách nhưng các yếu tố môi trường chưa được xác định cũng có thể liên quan. Các nghiên cứu gần đây cho thấy tiêm chủng chống rotavirus có tác dụng bảo vệ; điều này vẫn cần được chứng minh. Bằng chứng về tự miễn dịch thông qua sự hiện diện của các kháng thể lưu hành đối với các thành phần tế bào đảo có trước biểu hiện lâm sàng hàng tháng đến hàng năm; điều trị bằng các kháng thể kháng CD3 dường như trì hoãn sự khởi phát lâm sàng của bệnh ở những người có hai kháng thể nhưng không bị suy giảm dung nạp glucose. Các kỹ thuật nhân bản vị trí và liên kết trên toàn bộ bộ gen đã xác định được các dấu ấn gen khác, và bây giờ chúng ta nhận ra tầm quan trọng của các khiếm khuyết gen ty thể trong một số loại đái tháo đường phụ thuộc insulin có thể không phải là tự miễn. Khuynh hướng của tế bào beta đối với sự phá hủy tự miễn (bị giết) so với khuynh hướng apoptosis (tự sát) là chủ đề của cuộc tranh luận gay gắt và các nhà điều tra đặt ra câu hỏi về các mô hình được chấp nhận của chúng ta về căn bệnh này. Ngoạn mục hơn cả là việc làm sáng tỏ cơ sở phân tử của các khiếm khuyết đơn gen, chẳng hạn như MODY và đái tháo đường sơ sinh và việc điều trị chúng, bao gồm cả việc sử dụng sulfonylurea. Không có gì ngạc nhiên khi kiến thức này đang được áp dụng nhanh chóng để dự đoán khả năng xuất hiện bệnh ở những cá nhân có thể định lượng được tính nhạy cảm của họ bằng sự hiện diện của một số kháng thể nhất định và bởi những hạn chế trong đáp ứng insulin pha đầu. Các cuộc khảo sát dân số ở những cá nhân không được biết là có nguy cơ mắc bệnh đái tháo đường vừa mới bắt đầu. Chúng ta đang ở giai đoạn đầu của những nỗ lực ngăn ngừa bệnh, gợi nhớ đến các thử nghiệm ban đầu kiểm tra mối quan hệ giữa kiểm soát và các biến chứng vi mạch.
Các nghiên cứu hoành tráng của DCCT và Châu Âu đã thiết lập một cách không thể chối cãi mối liên kết giữa kiểm soát và các biến chứng, đòi hỏi các tiêu chuẩn chăm sóc mới. Tiến bộ và hiểu biết về bài tiết insulin và tác dụng của insulin cũng ngoạn mục không kém đối với những hiểu biết được cung cấp trong việc xác định các dạng đái tháo đường không phụ thuộc insulin ở cấp độ sinh lý, sinh hóa và phân tử. Liệu pháp bằng insulin người hiện là tiêu chuẩn và vô số các chế phẩm tác dụng kéo dài cũng như tác dụng nhanh hiện đã có sẵn. Các thử nghiệm với các hệ thống cung cấp insulin cải tiến, bao gồm cả tụy nhân tạo được vi tính hóa, cũng như cấy ghép tụy và đảo tụy, đang được tiến hành và đã đi vào lĩnh vực thực hành lâm sàng. FDA tại Hoa Kỳ đã phê duyệt hai hệ thống tụy nhân tạo để sử dụng, và những cải tiến trong các thiết bị này chắc chắn sẽ thay đổi quá trình và điều trị ĐTĐ tuýp 1. Những người được hưởng lợi từ những tiến bộ này là bệnh nhân của chúng ta, những người có lợi ích sẽ tiếp tục được phục vụ tốt nhất bằng cách điều tra khoa học hai chiều từ phòng thí nghiệm đến giường bệnh.
| STT | Thuật ngữ tiếng Anh | Phiên âm IPA (US) | Nghĩa Tiếng Việt |
|---|---|---|---|
| 1 | Diabetes mellitus (DM) | /ˌdaɪ.əˈbiː.tiːz məˈlaɪ.təs/ | Đái tháo đường (ĐTĐ) |
| 2 | Metabolism | /məˈtæb.əl.ɪ.zəm/ | Chuyển hóa |
| 3 | Carbohydrate | /ˌkɑːr.boʊˈhaɪ.dreɪt/ | Carbohydrate, chất đường bột |
| 4 | Protein | /ˈproʊ.tiːn/ | Protein, chất đạm |
| 5 | Fat | /fæt/ | Chất béo |
| 6 | Insulin secretion | /ˈɪn.sə.lɪn sɪˈkriː.ʃən/ | Sự bài tiết insulin |
| 7 | Insulin resistance | /ˈɪn.sə.lɪn rɪˈzɪs.təns/ | Đề kháng insulin |
| 8 | Postprandial hyperglycemia | /ˌpoʊstˈpræn.di.əl ˌhaɪ.pɚ.ɡlaɪˈsiː.mi.ə/ | Tăng đường huyết sau ăn |
| 9 | Polyuria | /ˌpɑː.liˈjʊə.ri.ə/ | Đa niệu |
| 10 | Polydipsia | /ˌpɑː.liˈdɪp.si.ə/ | Uống nhiều, khát nhiều |
| 11 | Weight loss | /weɪt lɑːs/ | Sụt cân |
| 12 | Microvascular complications | /ˌmaɪ.kroʊˈvæs.kjə.lɚ ˌkɑːm.pləˈkeɪ.ʃənz/ | Biến chứng vi mạch |
| 13 | Macrovascular complications | /ˌmæk.roʊˈvæs.kjə.lɚ ˌkɑːm.pləˈkeɪ.ʃənz/ | Biến chứng mạch máu lớn |
| 14 | Retinopathy | /ˌret.əˈnɑː.pə.θi/ | Bệnh võng mạc |
| 15 | Nephropathy | /nəˈfrɑː.pə.θi/ | Bệnh thận |
| 16 | Neuropathy | /nʊˈrɑː.pə.θi/ | Bệnh thần kinh |
| 17 | Peripheral arteries | /pəˈrɪf.ɚ.əl ˈɑːr.tə.riz/ | Động mạch ngoại biên |
| 18 | Disposition index | /ˌdɪs.pəˈzɪʃ.ən ˈɪn.deks/ | Chỉ số bù trừ (của tế bào beta) |
| 19 | Beta-cell function | /ˈbeɪ.tə sel ˈfʌŋk.ʃən/ | Chức năng tế bào beta |
| 20 | Glucose tolerance | /ˈɡluː.koʊs ˈtɑː.lɚ.əns/ | Dung nạp glucose |
| 21 | Impaired glucose tolerance (IGT) | /ɪmˈperd ˈɡluː.koʊs ˈtɑː.lɚ.əns/ | Rối loạn dung nạp glucose |
| 22 | Ketoacidosis | /ˌkiː.toʊ.æs.əˈdoʊ.sɪs/ | Nhiễm toan ceton |
| 23 | Incretins | /ˈɪŋ.krə.tɪnz/ | Incretin |
| 24 | Pathophysiology | /ˌpæθ.oʊˌfɪz.iˈɑː.lə.dʒi/ | Sinh lý bệnh |
| 25 | Monogenic forms of diabetes | /ˌmɑː.noʊˈdʒen.ɪk fɔːrmz əv ˌdaɪ.əˈbiː.tiːz/ | Các thể đái tháo đường đơn gen |
| 26 | Maturity-onset diabetes of the young (MODY) | /məˈtʃʊr.ə.t̬i ˌɑːn.set ˌdaɪ.əˈbiː.tiːz əv ðə jʌŋ/ | Đái tháo đường khởi phát ở tuổi trưởng thành ở người trẻ |
| 27 | Neonatal diabetes mellitus | /ˌniː.oʊˈneɪ.təl ˌdaɪ.əˈbiː.tiːz məˈlaɪ.təs/ | Đái tháo đường sơ sinh |
| 28 | Pharmacological formulations | /ˌfɑːr.mə.kəˈlɑː.dʒɪ.kəl ˌfɔːr.mjəˈleɪ.ʃənz/ | Dạng bào chế thuốc |
| 29 | Algorithm-driven | /ˈæl.ɡə.rɪ.ðəm ˈdrɪv.ən/ | Điều khiển bằng thuật toán |
| 30 | Artificial pancreas | /ˌɑːr.t̬əˈfɪʃ.əl ˈpæŋ.kri.əs/ | Tụy nhân tạo |
| 31 | Etiological classification | /ˌiː.t̬i.əˈlɑː.dʒɪ.kəl ˌklæs.ə.fəˈkeɪ.ʃən/ | Phân loại theo nguyên nhân |
| 32 | Immune mediated | /ɪˈmjuːn ˈmiː.di.eɪ.t̬ɪd/ | Qua trung gian miễn dịch |
| 33 | Idiopathic | /ˌɪd.i.oʊˈpæθ.ɪk/ | Vô căn |
| 34 | Genetic defects | /dʒəˈnet̬.ɪk ˈdiː.fekts/ | Khiếm khuyết di truyền |
| 35 | Mitochondrial DNA | /ˌmaɪ.t̬əˈkɑːn.dri.əl diː.enˈeɪ/ | DNA ty thể |
| 36 | Wolfram syndrome | /ˈwʊl.frəm ˈsɪn.droʊm/ | Hội chứng Wolfram |
| 37 | Thiamine responsive megaloblastic anemia | /ˈθaɪ.ə.mɪn rɪˈspɑːn.sɪv ˌmeɡ.ə.loʊˈblæs.tɪk əˈniː.mi.ə/ | Thiếu máu hồng cầu khổng lồ đáp ứng với thiamine |
| 38 | Glucocorticoids | /ˌɡluː.koʊˈkɔːr.t̬ə.kɔɪdz/ | Glucocorticoid |
| 39 | Cystic fibrosis–related diabetes | /ˈsɪs.tɪk faɪˈbroʊ.sɪs rɪˈleɪ.t̬ɪd ˌdaɪ.əˈbiː.tiːz/ | Đái tháo đường liên quan đến xơ nang |
| 40 | Pancreatectomy | /ˌpæŋ.kri.əˈtek.tə.mi/ | Cắt tụy |
| 41 | Congenital rubella | /kənˈdʒen.ə.təl ruːˈbel.ə/ | Rubella bẩm sinh |
| 42 | Cytomegalovirus | /ˌsaɪ.t̬oʊˌmeɡ.ə.loʊˈvaɪ.rəs/ | Cytomegalovirus |
| 43 | Hemolytic-uremic syndrome | /ˌhiː.məˈlɪt̬.ɪk jʊˈriː.mɪk ˈsɪn.droʊm/ | Hội chứng tan máu-urê huyết |
| 44 | Rabson-Mendenhall syndrome | /ˈræb.sən ˈmen.dən.hɔːl ˈsɪn.droʊm/ | Hội chứng Rabson-Mendenhall |
| 45 | Leprechaunism | /ˈlep.rə.kɑː.nɪ.zəm/ | Hội chứng người lùn (Leprechaunism) |
| 46 | Lipoatrophic diabetes | /ˌlaɪ.poʊ.əˈtroʊ.fɪk ˌdaɪ.əˈbiː.tiːz/ | Đái tháo đường teo mỡ |
| 47 | Antiinsulin receptor antibodies | /ˌæn.tiˈɪn.sə.lɪn rɪˈsep.tɚ ˈæn.t̬iˌbɑː.diz/ | Kháng thể kháng thụ thể insulin |
| 48 | Prader-Willi syndrome | /ˈprɑː.dɚ ˈwɪl.i ˈsɪn.droʊm/ | Hội chứng Prader-Willi |
| 49 | Down syndrome | /daʊn ˈsɪn.droʊm/ | Hội chứng Down |
| 50 | Turner syndrome | /ˈtɝː.nɚ ˈsɪn.droʊm/ | Hội chứng Turner |
| 51 | Klinefelter syndrome | /ˈklaɪn.fel.tɚ ˈsɪn.droʊm/ | Hội chứng Klinefelter |
| 52 | Gestational diabetes | /dʒesˈteɪ.ʃən.əl ˌdaɪ.əˈbiː.tiːz/ | Đái tháo đường thai kỳ |
| 53 | Impaired fasting glucose | /ɪmˈperd ˈfæs.tɪŋ ˈɡluː.koʊs/ | Rối loạn glucose huyết lúc đói |
| 54 | Glucosuria | /ˌɡluː.kəˈsʊə.ri.ə/ | Glucose niệu |
| 55 | Ketonuria | /ˌkiː.təˈnʊə.ri.ə/ | Ceton niệu |
| 56 | Islet cell antibodies (ICAs) | /ˈaɪ.lət sel ˈæn.t̬iˌbɑː.diz/ | Kháng thể tế bào đảo tụy |
| 57 | Autoimmune destruction | /ˌɔː.t̬oʊ.ɪˈmjuːn dɪˈstrʌk.ʃən/ | Sự phá hủy tự miễn |
| 58 | Genetically predisposed | /dʒəˈnet̬.ɪ.kə.li ˌpriː.dɪˈspoʊzd/ | Có khuynh hướng di truyền |
| 59 | Pancreatic agenesis | /ˌpæŋ.kriˈæt̬.ɪk eɪˈdʒen.ə.sɪs/ | Bất sản tụy |
| 60 | Immunosuppressive agents | /ˌɪm.jə.noʊ.səˈpres.ɪv ˈeɪ.dʒənts/ | Thuốc ức chế miễn dịch |
| 61 | Insulinopenia | /ˌɪn.sə.lɪn.oʊˈpiː.ni.ə/ | Tình trạng thiếu insulin |
| 62 | Exogenous insulin | /ekˈsɑː.dʒə.nəs ˈɪn.sə.lɪn/ | Insulin ngoại sinh |
| 63 | Histocompatibility locus antigens (HLAs) | /ˌhɪs.toʊ.kəmˌpæt̬.əˈbɪl.ə.t̬i ˈloʊ.kəs ˈæn.t̬ə.dʒənz/ | Kháng nguyên locus tương hợp mô |
| 64 | Autoimmune regulator gene (AIRE) | /ˌɔː.t̬oʊ.ɪˈmjuːn ˈreɡ.jə.leɪ.t̬ɚ dʒiːn/ | Gen điều hòa tự miễn |
| 55 | Variable number of tandem repeats (VNTR) | /ˈver.i.ə.bəl ˈnʌm.bɚ əv ˈtæn.dəm rɪˈpiːts/ | Số lượng lặp lại song song thay đổi |
| 66 | Interleukin 2 receptor (IL2R) | /ˌɪn.t̬ɚˈluː.kɪn tuː rɪˈsep.tɚ/ | Thụ thể Interleukin 2 |
| 67 | Protein tyrosine phosphatase | /ˈproʊ.tiːn ˈtaɪ.rə.siːn ˈfɑːs.fə.teɪs/ | Protein tyrosine phosphatase |
| 68 | Glutamic acid decarboxylase (GAD) | /ɡluːˌtæm.ɪk ˈæs.ɪd diː.kɑːrˈbɑːk.sə.leɪs/ | Glutamic acid decarboxylase |
| 69 | Lymphocytic infiltration | /ˌlɪm.fəˈsɪt̬.ɪk ɪn.fɪlˈtreɪ.ʃən/ | Sự thâm nhiễm lympho bào |
| 70 | Zinc transporter (ZnT8) | /zɪŋk trænˈspɔːr.t̬ɚ/ | Chất vận chuyển kẽm (ZnT8) |
| 71 | Acanthosis nigricans | /ˌæ.kænˌθoʊ.sɪs ˈnaɪ.ɡrɪ.kænz/ | Gai đen |
| 72 | Postreceptor defects | /ˌpoʊst.rɪˈsep.tɚ ˈdiː.fekts/ | Khiếm khuyết sau thụ thể |
| 73 | Counterregulatory hormones | /ˌkaʊn.t̬ɚˈreɡ.jə.ləˌtɔːr.i ˈhɔːr.moʊnz/ | Các hormone đối kháng điều hòa |
| 74 | Epidemiology | /ˌep.əˌdiː.miˈɑː.lə.dʒi/ | Dịch tễ học |
| 75 | Prevalence | /ˈprev.əl.əns/ | Tỷ lệ hiện mắc |
| 76 | Incidence | /ˈɪn.sɪ.dəns/ | Tỷ lệ mới mắc |
| 77 | Socioeconomic status | /ˌsoʊ.si.oʊˌek.əˈnɑː.mɪk ˈstæt̬.əs/ | Tình trạng kinh tế xã hội |
| 78 | Pubertal growth spurt | /ˈpjuː.bɚ.təl ɡroʊθ spɝːt/ | Giai đoạn tăng trưởng vượt bậc tuổi dậy thì |
| 79 | Enteroviral infection | /ˌen.t̬ə.roʊˈvaɪ.rəl ɪnˈfek.ʃən/ | Nhiễm enterovirus |
| 80 | Islets of Langerhans | /ˈaɪ.ləts əv ˈlɑːŋ.ɚ.hɑːns/ | Đảo Langerhans |
| 81 | Pathogenesis | /ˌpæθ.əˈdʒen.ə.sɪs/ | Sinh bệnh học |
| 82 | Secretagogues | /sɪˈkriː.t̬ə.ɡɑːɡz/ | Chất kích thích bài tiết |
| 83 | Major histocompatibility complex (MHC) | /ˈmeɪ.dʒɚ ˌhɪs.toʊ.kəmˌpæt̬.əˈbɪl.ə.t̬i ˈkɑːm.pleks/ | Phức hợp tương hợp mô chính |
| 84 | Genome-wide scans | /dʒəˈnoʊm waɪd skænz/ | Quét toàn bộ bộ gen |
| 85 | Homozygous | /ˌhoʊ.moʊˈzaɪ.ɡəs/ | Đồng hợp tử |
| 86 | Heterozygous | /ˌhet̬.ɚ.oʊˈzaɪ.ɡəs/ | Dị hợp tử |
| 87 | Antigen presentation | /ˈæn.t̬ə.dʒən ˌprez.ənˈteɪ.ʃən/ | Trình diện kháng nguyên |
| 88 | Haplotypes | /ˈhæp.loʊˌtaɪps/ | Haplotype (Kiểu đơn bội) |
| 89 | Monozygotic twins | /ˌmɑː.noʊ.zaɪˈɡɑː.t̬ɪk twɪnz/ | Song sinh cùng trứng |
| 90 | Postnatal selection | /ˌpoʊstˈneɪ.təl sɪˈlek.ʃən/ | Chọn lọc sau sinh |
| 91 | Autoreactive T-cell clones | /ˌɔː.t̬oʊ.riˈæk.tɪv tiː sel kloʊnz/ | Các dòng tế bào T tự phản ứng |
| 92 | T-cell receptor repertoire | /tiː sel rɪˈsep.tɚ ˈrep.ɚ.twɑːr/ | Vốn thụ thể tế bào T |
| 93 | Epigenetics | /ˌep.ə.dʒəˈnet̬.ɪks/ | Di truyền học biểu sinh |
| 94 | Coxsackie virus | /kɑːkˈsæk.i ˈvaɪ.rəs/ | Virus Coxsackie |
| 95 | Superantigen | /ˌsuː.pɚˈæn.tə.dʒən/ | Siêu kháng nguyên |
| 96 | Antigen-presenting cells (APCs) | /ˈæn.tə.dʒən prɪˈzen.tɪŋ selz/ | Tế bào trình diện kháng nguyên |
| 97 | Molecular mimicry | /məˈlek.jə.lɚ ˈmɪm.ɪ.kri/ | Bắt chước phân tử |
| 98 | Nitrosamines | /naɪˌtroʊ.səˈmiːnz/ | Nitrosamine |
| 99 | Bovine serum albumin (BSA) | /ˈboʊ.vaɪn ˈsɪr.əm ælˈbjuː.mɪn/ | Albumin huyết thanh bò |
| 100 | Hyalinized | /ˈhaɪ.ə.lɪ.naɪzd/ | Hyalin hóa, thoái hóa kính |
| 101 | Vitiligo | /ˌvɪt̬.əlˈaɪ.ɡoʊ/ | Bệnh bạch biến |
| 102 | Cytotoxic | /ˌsaɪ.t̬əˈtɑːk.sɪk/ | Gây độc tế bào |
| 103 | Complement | /ˈkɑːm.plə.mənt/ | Bổ thể |
| 104 | Apoptosis | /ˌæp.əpˈtoʊ.sɪs/ | Chết tế bào theo chương trình |
| 105 | Immunomodulatory trials | /ˌɪm.jə.noʊˈmɑː.dʒə.ləˌtɔːr.i ˈtraɪ.əlz/ | Thử nghiệm điều hòa miễn dịch |
| 106 | Nicotinamide | /ˌnɪk.əˈtɪn.ə.maɪd/ | Nicotinamide |
| 107 | Rotavirus | /ˈroʊ.t̬əˌvaɪ.rəs/ | Rotavirus |
| 108 | Biosynthesis | /ˌbaɪ.oʊˈsɪn.θə.sɪs/ | Sinh tổng hợp |
| 109 | Polypeptide chains | /ˌpɑː.liˈpep.taɪd tʃeɪnz/ | Chuỗi polypeptide |
| 110 | Disulfide bridges | /daɪˈsʌl.faɪd ˈbrɪdʒ.ɪz/ | Cầu disulfide |
| 111 | Proinsulin | /ˌproʊˈɪn.sə.lɪn/ | Proinsulin |
| 112 | C-peptide | /siː ˈpep.taɪd/ | Peptide C |
| 113 | Preproinsulin | /ˌpriː.proʊˈɪn.sə.lɪn/ | Preproinsulin |
| 114 | Autosomal-dominant | /ˌɔː.t̬əˈsoʊ.məl ˈdɑː.mə.nənt/ | Trội trên nhiễm sắc thể thường |
| 115 | Hyperproinsulinemia | /ˌhaɪ.pɚ.proʊˌɪn.sə.lɪˈniː.mi.ə/ | Tăng proinsulin máu |
| 116 | Proconvertases | /ˌproʊ.kənˈvɝː.teɪ.sɪz/ | Proconvertase |
| 117 | Proopiomelanocortin (POMC) | /ˌproʊˌoʊ.pi.oʊ.məˌlæn.oʊˈkɔːr.tɪn/ | Proopiomelanocortin |
| 118 | Hypogonadotropic hypogonadism | /ˌhaɪ.poʊ.ɡoʊˌnæd.əˈtroʊ.pɪk ˌhaɪ.poʊˈɡoʊ.næd.ɪ.zəm/ | Suy sinh dục do giảm gonadotropin |
| 119 | Radioimmunoassay (RIA) | /ˌreɪ.di.oʊˌɪm.jə.noʊˈæs.eɪ/ | Xét nghiệm miễn dịch phóng xạ |
| 120 | Insulinoma | /ˌɪn.sə.lɪˈnoʊ.mə/ | U tế bào beta (Insulinoma) |
| 121 | Autonomic nervous system | /ˌɔː.t̬əˈnɑː.mɪk ˈnɝː.vəs ˈsɪs.təm/ | Hệ thần kinh tự chủ |
| 122 | Glucose transporter (GLUT2) | /ˈɡluː.koʊs trænˈspɔːr.t̬ɚ/ | Chất vận chuyển glucose (GLUT2) |
| 123 | Glucokinase | /ˌɡluː.koʊˈkaɪ.neɪs/ | Glucokinase |
| 124 | Biphasic | /baɪˈfeɪ.zɪk/ | Hai pha |
| 125 | Cyclic adenosine monophosphate (cAMP) | /ˈsaɪ.klɪk əˈden.ə.siːn ˌmɑː.noʊˈfɑːs.feɪt/ | Adenosine monophosphate vòng |
| 126 | Phosphodiesterase | /ˌfɑːs.foʊ.daɪˈes.tə.reɪs/ | Phosphodiesterase |
| 127 | Emiocytosis | /ˌem.i.oʊ.saɪˈtoʊ.sɪs/ | Xuất bào (Emiocytosis) |
| 128 | Glucagon-like peptides (GLP) | /ˈɡluː.kə.ɡɑːn laɪk ˈpep.taɪdz/ | Các peptide giống glucagon |
| 129 | Somatotropin release-inhibiting factor (somatostatin) | /soʊˌmæt̬.əˈtroʊ.pɪn rɪˈliːs ɪnˈhɪb.ɪ.tɪŋ ˈfæk.tɚ/ | Yếu tố ức chế giải phóng somatotropin (somatostatin) |
| 130 | Enteroinsular axis | /ˌen.tə.roʊˈɪn.sə.lɚ ˈæk.sɪs/ | Trục ruột-đảo tụy |
| 131 | Human chorionic somatomammotropin | /ˈhjuː.mən ˌkɔːr.iˈɑː.nɪk soʊˌmæt̬.oʊˈmæm.oʊˌtroʊ.pɪn/ | Somatomammotropin màng đệm người |
| 132 | Parasympathetic | /ˌper.ə.sɪm.pəˈθet̬.ɪk/ | Đối giao cảm |
| 133 | Sympathetic | /ˌsɪm.pəˈθet̬.ɪk/ | Giao cảm |
| 134 | Adrenergic receptors | /ˌæd.rəˈnɝː.dʒɪk rɪˈsep.tɚz/ | Thụ thể adrenergic |
| 135 | Pheochromocytoma | /ˌfiː.oʊˌkroʊ.moʊ.saɪˈtoʊ.mə/ | U tủy thượng thận |
| 136 | Insulin receptors | /ˈɪn.sə.lɪn rɪˈsep.tɚz/ | Thụ thể insulin |
| 137 | Heterodimeric glycoprotein | /ˌhet̬.ə.roʊ.daɪˈmer.ɪk ˌɡlaɪ.koʊˈproʊ.tiːn/ | Glycoprotein dị nhị phân |
| 138 | Tyrosine kinase | /ˈtaɪ.rə.siːn ˈkaɪ.neɪs/ | Tyrosine kinase |
| 139 | Insulin receptor substrates (IRS) | /ˈɪn.sə.lɪn rɪˈsep.tɚ ˈsʌb.streɪts/ | Cơ chất thụ thể insulin |
| 140 | Glycan phosphoinositides | /ˈɡlaɪ.kæn ˌfɑːs.foʊ.ɪˈnoʊ.sɪ.taɪdz/ | Glycan phosphoinositide |
| 141 | Insulin-like growth factor-1 (IGF-1) | /ˈɪn.sə.lɪn laɪk ɡroʊθ ˈfæk.tɚ wʌn/ | Yếu tố tăng trưởng giống insulin-1 |
| 142 | Downregulation | /ˌdaʊn.reɡ.jəˈleɪ.ʃən/ | Điều hòa giảm |
| 143 | Negative cooperativity | /ˈneɡ.ə.t̬ɪv koʊˌɑː.pɚ.əˈtɪv.ə.t̬i/ | Hợp tác tính âm |
| 144 | Scatchard analysis | /ˈskætʃ.ɑːrd əˈnæl.ə.sɪs/ | Phân tích Scatchard |
| 145 | Lysosomal enzymes | /ˌlaɪ.səˈsoʊ.məl ˈen.zaɪmz/ | Enzyme lysosome |
| 146 | Neuron-specific insulin receptor knockout (NIRKO) | /ˈnʊə.rɑːn spəˈsɪf.ɪk ˈɪn.sə.lɪn rɪˈsep.tɚ ˈnɑːk.aʊt/ | Chuột knockout thụ thể insulin đặc hiệu cho neuron |
| 147 | Luteinizing hormone | /ˈluː.t̬i.əˌnaɪ.zɪŋ ˈhɔːr.moʊn/ | Hormone tạo hoàng thể |
| 148 | Anabolic state | /ˌæn.əˈbɑː.lɪk steɪt/ | Trạng thái đồng hóa |
| 149 | Catabolic state | /ˌkæt̬.əˈbɑː.lɪk steɪt/ | Trạng thái dị hóa |
| 150 | Glycogenolysis | /ˌɡlaɪ.kə.dʒəˈnɑː.lə.sɪs/ | Sự ly giải glycogen |
| 151 | Gluconeogenesis | /ˌɡluː.koʊˌniː.oʊˈdʒen.ə.sɪs/ | Sự tân tạo glucose |
| 152 | Osmotic diuresis | /ɑːzˈmɑː.t̬ɪk ˌdaɪ.jəˈriː.sɪs/ | Lợi tiểu thẩm thấu |
| 153 | Polydipsia | /ˌpɑː.liˈdɪp.si.ə/ | Uống nhiều, khát nhiều |
| 154 | Cerebral obtundation | /səˈriː.brəl ˌɑːb.tʌnˈdeɪ.ʃən/ | Tình trạng lú lẫn não |
| 155 | Serum osmolality | /ˈsɪr.əm ˌɑːz.moʊˈlæl.ə.t̬i/ | Áp lực thẩm thấu huyết thanh |
| 156 | Lipolysis | /laɪˈpɑː.lə.sɪs/ | Sự ly giải mỡ |
| 157 | Triglycerides | /traɪˈɡlɪs.ə.raɪdz/ | Triglyceride |
| 158 | Free fatty acids | /friː ˌfæt̬.i ˈæs.ɪdz/ | Acid béo tự do |
| 159 | Kussmaul respiration | /ˈkuːs.maʊl ˌres.pəˈreɪ.ʃən/ | Nhịp thở Kussmaul |
| 160 | Cations | /ˈkæt̬.aɪ.ənz/ | Cation (ion dương) |
| 161 | Polyphagia | /ˌpɑː.liˈfeɪ.dʒə/ | Ăn nhiều |
| 162 | Enuresis | /ˌen.jəˈriː.sɪs/ | Đái dầm |
| 163 | Lethargy | /ˈleθ.ɚ.dʒi/ | Hôn mê, lơ mơ |
| 164 | Pyogenic skin infections | /ˌpaɪ.oʊˈdʒen.ɪk skɪn ɪnˈfek.ʃənz/ | Nhiễm trùng da sinh mủ |
| 165 | Candidal vaginitis | /kænˈdɪd.əl ˌvædʒ.əˈnaɪ.təs/ | Viêm âm đạo do nấm Candida |
| 166 | Candidal balanitis | /kænˈdɪd.əl ˌbæl.əˈnaɪ.təs/ | Viêm quy đầu do nấm Candida |
| 167 | Bronchiolitis | /ˌbrɑːŋ.ki.oʊˈlaɪ.təs/ | Viêm tiểu phế quản |
| 168 | Appendicitis | /əˌpen.dəˈsaɪ.t̬əs/ | Viêm ruột thừa |
| 169 | Pancreatitis | /ˌpæŋ.kri.əˈtaɪ.t̬əs/ | Viêm tụy |
| 170 | Leukocytosis | /ˌluː.koʊ.saɪˈtoʊ.sɪs/ | Tăng bạch cầu |
| 171 | Renal glucosuria | /ˈriː.nəl ˌɡluː.kəˈsʊə.ri.ə/ | Glucose niệu do thận |
| 172 | Fanconi syndrome | /fænˈkoʊ.ni ˈsɪn.droʊm/ | Hội chứng Fanconi |
| 173 | Cystinosis | /ˌsɪs.təˈnoʊ.sɪs/ | Bệnh Cystinosis |
| 174 | Galactosemia | /ɡəˌlæk.toʊˈsiː.mi.ə/ | Bệnh Galactosemia |
| 175 | Pentosuria | /ˌpen.təˈsʊə.ri.ə/ | Pentose niệu |
| 176 | Fructosuria | /ˌfrʌk.toʊˈsʊə.ri.ə/ | Fructose niệu |
| 177 | Diabetic Ketoacidosis (DKA) | /ˌdaɪ.əˌbet̬.ɪk ˌkiː.toʊ.æs.əˈdoʊ.sɪs/ | Nhiễm toan ceton do đái tháo đường |
| 178 | Metabolic decompensation | /ˌmet̬.əˈbɑː.lɪk diːˌkɑːm.penˈseɪ.ʃən/ | Mất bù chuyển hóa |
| 179 | Hyperketonemia | /ˌhaɪ.pɚˌkiː.toʊˈniː.mi.ə/ | Tăng ceton máu |
| 180 | Beta-hydroxybutyrate (BOHB) | /ˈbeɪ.tə haɪˌdrɑːk.siˈbjuː.tə.reɪt/ | Beta-hydroxybutyrate |
| 181 | Euglycemic ketoacidosis | /ˌjuː.ɡlaɪˈsiː.mɪk ˌkiː.toʊ.æs.əˈdoʊ.sɪs/ | Nhiễm toan ceton với đường huyết bình thường |
| 182 | Sodium glucose transport protein 2 (SGLT2)-inhibitors | /ˈsoʊ.di.əm ˈɡluː.koʊs trænsˈpɔːrt ˈproʊ.tiːn tuː ɪnˈhɪb.ə.t̬ɚz/ | Thuốc ức chế kênh đồng vận chuyển Natri-Glucose 2 |
| 183 | Hyperglycemic hyperosmolar state (HHS) | /ˌhaɪ.pɚ.ɡlaɪˈsiː.mɪk ˌhaɪ.pɚˈɑːz.moʊ.lɚ steɪt/ | Tình trạng tăng đường huyết tăng áp lực thẩm thấu |
| 184 | Prerenal azotemia | /ˌpriːˈriː.nəl ˌeɪ.zoʊˈtiː.mi.ə/ | Nitơ huyết cao trước thận |
| 185 | Hemoconcentration | /ˌhiː.moʊˌkɑːn.sənˈtreɪ.ʃən/ | Cô đặc máu |
| 186 | Thromboses | /θrɑːmˈboʊ.siːz/ | Huyết khối |
| 187 | Pediatric Advanced Life Support (PALS) | /ˌpiː.diˈæt.rɪk ədˈvænst laɪf səˈpɔːrt/ | Hồi sức cấp cứu nhi khoa nâng cao |
| 188 | Glasgow Coma Scale (GCS) | /ˈɡlæs.ɡoʊ ˈkoʊ.mə skeɪl/ | Thang điểm hôn mê Glasgow |
| 189 | Cerebrospinal fluid (CSF) | /səˌriː.broʊˈspaɪ.nəl ˈfluː.ɪd/ | Dịch não tủy |
| 190 | Cerebral edema | /səˈriː.brəl əˈdiː.mə/ | Phù não |
| 191 | Electrocardiogram (ECG) | /ɪˌlek.troʊˈkɑːr.di.oʊ.ɡræm/ | Điện tâm đồ |
| 192 | Hyperkalemia | /ˌhaɪ.pɚ.kəˈliː.mi.ə/ | Tăng kali máu |
| 193 | Hypokalemia | /ˌhaɪ.poʊ.kəˈliː.mi.ə/ | Hạ kali máu |
| 194 | Anion gap | /ˈæn.aɪ.ən ɡæp/ | Khoảng trống anion |
| 195 | Hemodynamic | /ˌhiː.moʊ.daɪˈnæm.ɪk/ | Huyết động |
| 196 | Hyperchloremia | /ˌhaɪ.pɚ.klɔːrˈiː.mi.ə/ | Tăng clo máu |
| 197 | Hypocalcemia | /ˌhaɪ.poʊ.kælˈsiː.mi.ə/ | Hạ canxi máu |
| 198 | Phosphaturia | /ˌfɑːs.fəˈtʊə.ri.ə/ | Phosphat niệu |
| 199 | Hypophosphatemia | /ˌhaɪ.poʊˌfɑːs.fəˈtiː.mi.ə/ | Hạ phosphat máu |
| 200 | 2,3-diphosphoglycerate (2,3-DPG) | /tuː θriː daɪˌfɑːs.foʊˈɡlɪs.ə.reɪt/ | 2,3-diphosphoglycerate |
| 201 | Oxygen dissociation curve | /ˈɑːk.sɪ.dʒən dɪˌsoʊ.siˈeɪ.ʃən kɝːv/ | Đường cong phân ly oxy |
| 202 | Rhabdomyolysis | /ˌræb.doʊ.maɪˈɑː.lə.sɪs/ | Tiêu cơ vân |
| 203 | Hemolysis | /hiːˈmɑː.lə.sɪs/ | Tan máu |
| 204 | Granulocyte chemotaxis | /ˈɡræn.jə.loʊˌsaɪt ˌkiː.moʊˈtæk.sɪs/ | Hóa ứng động bạch cầu hạt |
| 205 | Thrombocytopenia | /ˌθrɑːm.boʊˌsaɪ.t̬əˈpiː.ni.ə/ | Giảm tiểu cầu |
| 206 | Alkalosis | /ˌæl.kəˈloʊ.sɪs/ | Nhiễm kiềm |
| 207 | Vasodilation | /ˌveɪ.zoʊ.daɪˈleɪ.ʃən/ | Giãn mạch |
| 208 | Cardiac arrhythmias | /ˈkɑːr.di.æk əˈrɪð.mi.əz/ | Loạn nhịp tim |
| 209 | Hypomagnesemia | /ˌhaɪ.poʊˌmæɡ.nəˈsiː.mi.ə/ | Hạ magiê máu |
| 210 | Pneumothorax | /ˌnuː.moʊˈθɔːr.æks/ | Tràn khí màng phổi |
| 211 | Pneumomediastinum | /ˌnuː.moʊˌmiː.di.əsˈtaɪ.nəm/ | Tràn khí trung thất |
| 212 | Rhabdomyolysis | /ˌræb.doʊ.maɪˈɑː.lə.sɪs/ | Tiêu cơ vân |
| 213 | Ischemic bowel necrosis | /ɪˈskiː.mɪk ˈbaʊ.əl nəˈkroʊ.sɪs/ | Hoại tử ruột do thiếu máu cục bộ |
| 214 | Acute kidney injury | /əˈkjuːt ˈkɪd.ni ˈɪn.dʒə.ri/ | Tổn thương thận cấp |
| 215 | Acute pancreatitis | /əˈkjuːt ˌpæŋ.kri.əˈtaɪ.t̬əs/ | Viêm tụy cấp |
| 216 | Malignant hyperthermia | /məˈlɪɡ.nənt ˌhaɪ.pɚˈθɝː.mi.ə/ | Sốt cao ác tính |
| 217 | Sarcoplasmic reticulum | /ˌsɑːr.koʊˌplæz.mɪk rəˈtɪk.jə.ləm/ | Lưới cơ tương |
| 218 | Multidisciplinary team | /ˌmʌl.tiˈdɪs.ə.pləˌner.i tiːm/ | Đội ngũ đa chuyên khoa |
| 219 | Nurse educators | /nɝːs ˈedʒ.ə.keɪ.t̬ɚz/ | Điều dưỡng giáo dục |
| 220 | Dietitians | /ˌdaɪ.əˈtɪʃ.ənz/ | Chuyên gia dinh dưỡng |
| 221 | Diabetes Control and Complications Trial (DCCT) | /ˌdaɪ.əˈbiː.tiːz kənˈtroʊl ənd ˌkɑːm.pləˈkeɪ.ʃənz ˈtraɪ.əl/ | Thử nghiệm Kiểm soát và Biến chứng Đái tháo đường |
| 222 | Epidemiology of Diabetes Interventions and Complications (EDIC) | /ˌep.əˌdiː.miˈɑː.lə.dʒi əv ˌdaɪ.əˈbiː.tiːz ˌɪn.t̬ɚˈven.ʃənz ənd ˌkɑːm.pləˈkeɪ.ʃənz/ | Dịch tễ học các Can thiệp và Biến chứng của Đái tháo đường |
| 223 | Recombinant DNA technology | /riˈkɑːm.bə.nənt diː.enˈeɪ tekˈnɑː.lə.dʒi/ | Công nghệ DNA tái tổ hợp |
| 224 | Biosynthetic human insulin | /ˌbaɪ.oʊ.sɪnˈθet̬.ɪk ˈhjuː.mən ˈɪn.sə.lɪn/ | Insulin người sinh tổng hợp |
| 225 | Analog insulins | /ˈæn.ə.lɔːɡ ˈɪn.sə.lɪnz/ | Các insulin analog (tương tự) |
| 226 | Neutral protamine Hagedorn (NPH) insulin | /ˈnuː.trəl ˈproʊ.tə.miːn ˈhæɡ.ə.dɔːrn ˈɪn.sə.lɪn/ | Insulin Neutral protamine Hagedorn (NPH) |
| 227 | Pharmacokinetics | /ˌfɑːr.mə.koʊ.kɪˈnet̬.ɪks/ | Dược động học |
| 228 | Pharmacodynamics | /ˌfɑːr.mə.koʊ.daɪˈnæm.ɪks/ | Dược lực học |
| 229 | Insulin-to-carbohydrate ratio (ICR) | /ˈɪn.sə.lɪn tu ˌkɑːr.boʊˈhaɪ.dreɪt ˈreɪ.ʃi.oʊ/ | Tỷ lệ insulin-carbohydrate |
| 230 | Insulin sensitivity factor (ISF) | /ˈɪn.sə.lɪn ˌsen.səˈtɪv.ə.t̬i ˈfæk.tɚ/ | Hệ số nhạy cảm insulin |
| 231 | Continuous glucose monitor (CGM) | /kənˈtɪn.ju.əs ˈɡluː.koʊs ˈmɑː.nə.t̬ɚ/ | Máy theo dõi glucose liên tục |
| 232 | Continuous subcutaneous insulin infusion (CSII) | /kənˈtɪn.ju.əs ˌsʌb.kjuːˈteɪ.ni.əs ˈɪn.sə.lɪn ɪnˈfjuː.ʒən/ | Truyền insulin dưới da liên tục (bơm insulin) |
| 233 | Smart pumps | /smɑːrt pʌmps/ | Bơm thông minh |
| 234 | Glycated hemoglobin | /ˈɡlaɪ.keɪ.t̬ɪd ˌhiː.məˈɡloʊ.bɪn/ | Hemoglobin glycated (HbA1c) |
| 235 | Self-blood glucose monitoring (SBGM) | /self blʌd ˈɡluː.koʊs ˈmɑː.nə.t̬ɚ.ɪŋ/ | Tự theo dõi glucose máu |
| 236 | Dawn phenomenon | /dɔːn fəˈnɑː.mə.nɑːn/ | Hiện tượng bình minh |
| 237 | Dusk phenomenon | /dʌsk fəˈnɑː.mə.nɑːn/ | Hiện tượng hoàng hôn |
| 238 | Insulin stacking | /ˈɪn.sə.lɪn ˈstæk.ɪŋ/ | Chồng liều insulin |
| 239 | Intermittently scanned CGM (isCGM) | /ˌɪn.t̬ɚˈmɪt̬.ənt.li skænd siː.dʒiː.em/ | CGM quét ngắt quãng |
| 240 | Mean absolute relative difference (MARD) | /miːn ˌæb.sə.luːt ˈrel.ə.t̬ɪv ˈdɪf.ɚ.əns/ | Chênh lệch tương đối tuyệt đối trung bình |
| 241 | Sensor-augmented pump (SAP) | /ˈsen.sɚ ɔːɡˈmen.t̬ɪd pʌmp/ | Bơm tăng cường cảm biến |
| 242 | Low sensor glucose threshold insulin suspend (LGS) | /loʊ ˈsen.sɚ ˈɡluː.koʊs ˈθreʃ.hoʊld ˈɪn.sə.lɪn səˈspend/ | Tạm dừng insulin theo ngưỡng glucose cảm biến thấp |
| 243 | Predictive low sensor glucose insulin suspend (PLGS) | /prɪˈdɪk.tɪv loʊ ˈsen.sɚ ˈɡluː.koʊs ˈɪn.sə.lɪn səˈspend/ | Tạm dừng insulin dự đoán glucose cảm biến thấp |
| 244 | Closed-loop system | /kloʊzd luːp ˈsɪs.təm/ | Hệ thống vòng kín |
| 245 | Proportional integrative derivative (PID) | /prəˈpɔːr.ʃən.əl ˌɪn.t̬əˈɡreɪ.t̬ɪv dɪˈrɪv.ə.t̬ɪv/ | Tỷ lệ-Tích phân-Vi phân |
| 246 | Model predictive control (MPC) | /ˈmɑː.dəl prɪˈdɪk.tɪv kənˈtroʊl/ | Điều khiển dự báo theo mô hình |
| 247 | Fuzzy logic | /ˈfʌz.i ˈlɑː.dʒɪk/ | Logic mờ |
| 248 | Artificial intelligence (AI) | /ˌɑːr.t̬əˈfɪʃ.əl ɪnˈtel.ə.dʒəns/ | Trí tuệ nhân tạo |
| 249 | Diabetic retinopathy (DR) | /ˌdaɪ.əˈbet̬.ɪk ˌret.əˈnɑː.pə.θi/ | Bệnh võng mạc đái tháo đường |
| 250 | Fundus photography | /ˈfʌn.dəs fəˈtɑː.ɡrə.fi/ | Chụp ảnh đáy mắt |
| 251 | Decision support algorithm | /dɪˈsɪʒ.ən səˈpɔːrt ˈæl.ɡə.rɪ.ðəm/ | Thuật toán hỗ trợ quyết định |
| 252 | Machine learning | /məˈʃiːn ˈlɝː.nɪŋ/ | Học máy |
| 253 | Open-source | /ˈoʊ.pən sɔːrs/ | Nguồn mở |
| 254 | Digital biomarkers | /ˈdɪdʒ.ə.t̬əl ˈbaɪ.oʊˌmɑːr.kɚz/ | Dấu ấn sinh học kỹ thuật số |
| 255 | Medical Nutrition Therapy | /ˈmed.ɪ.kəl nuːˈtrɪʃ.ən ˈθer.ə.pi/ | Liệu pháp Dinh dưỡng Y khoa |
| 256 | Carbohydrate counting | /ˌkɑːr.boʊˈhaɪ.dreɪt ˈkaʊn.tɪŋ/ | Đếm carbohydrate |
| 257 | Body mass index (BMI) | /ˈbɑː.di mæs ˈɪn.deks/ | Chỉ số khối cơ thể |
| 258 | Honeymoon period | /ˈhʌn.i.muːn ˈpɪə.ri.əd/ | Giai đoạn trăng mật |
| 259 | Glucotoxicity | /ˌɡluː.koʊ.tɑːkˈsɪs.ə.t̬i/ | Độc tính của glucose |
| 260 | Hypoglycemia-associated autonomic failure (HAAF) | /ˌhaɪ.poʊ.ɡlaɪˌsiː.mi.ə əˌsoʊ.siˈeɪ.t̬ɪd ˌɔː.t̬əˈnɑː.mɪk ˈfeɪl.jɚ/ | Suy giảm tự chủ liên quan đến hạ đường huyết |
| 261 | Sick day management | /sɪk deɪ ˈmæn.ədʒ.mənt/ | Quản lý những ngày bị bệnh |
| 262 | Emesis | /ˈem.ə.sɪs/ | Nôn mửa |
| 263 | Chronic lymphocytic thyroiditis | /ˈkrɑː.nɪk ˌlɪm.fəˈsɪt̬.ɪk ˌθaɪ.rɔɪˈdaɪ.t̬əs/ | Viêm tuyến giáp lympho bào mạn tính |
| 264 | Adrenal insufficiency | /əˈdriː.nəl ˌɪn.səˈfɪʃ.ən.si/ | Suy thượng thận |
| 265 | Celiac disease | /ˈsiː.li.æk dɪˈziːz/ | Bệnh Celiac |
| 266 | Tissue transglutaminase antibodies | /ˈtɪʃ.uː træns.ɡluːˈtæm.ə.neɪs ˈæn.t̬iˌbɑː.diz/ | Kháng thể transglutaminase mô |
| 267 | Diabulimia | /ˌdaɪ.ə.bjuːˈliː.mi.ə/ | Chứng cuồng ăn-đái tháo đường |
| 268 | Lipoatrophy | /ˌlaɪ.poʊˈæ.trə.fi/ | Teo mỡ |
| 269 | Lipohypertrophy | /ˌlaɪ.poʊ.haɪˈpɝː.trə.fi/ | Phì đại mỡ |
| 270 | Glycosylated hemoglobin | /ɡlaɪˈkɑː.sə.leɪ.t̬ɪd ˌhiː.məˈɡloʊ.bɪn/ | Hemoglobin glycosyl hóa |
| 271 | Microalbuminuria | /ˌmaɪ.kroʊ.ælˌbjuː.məˈnʊə.ri.ə/ | Microalbumin niệu |
