Sperling Nội tiết học Nhi khoa, Ấn bản thứ 5 – Biên dịch: Ths.Bs. Lê Đình Sáng
Sperling Pediatric Endocrinology, Fifth Edition
Tác giả: Sperling, Mark A., MD – Nhà xuất bản: Elsevier Inc.
PHẦN III. NỘI TIẾT HỌC TRẺ EM VÀ THANH THIẾU NIÊN
Chương 18: Dậy thì và các rối loạn dậy thì ở nam giới
Mark R. Palmert; Yee-Ming Chan; Leo Dunkel
Puberty and Its Disorders in the Male
Sperling Pediatric Endocrinology, 18, 661-694
Dậy thì là quá trình mà qua đó trẻ em đạt được các đặc điểm sinh dục phụ của người trưởng thành và khả năng sinh sản. Ở người, có hai quá trình trưởng thành sinh dục riêng biệt được công nhận: hoạt hóa tuyến sinh dục (gonadarche) và hoạt hóa tuyến thượng thận (adrenarche). Hoạt hóa tuyến sinh dục được định nghĩa là sự tăng trưởng và trưởng thành của tuyến sinh dục, dẫn đến tăng tiết steroid sinh dục (đáng chú ý nhất là testosterone ở bé trai) và quá trình sinh tinh. Hoạt hóa tuyến sinh dục đòi hỏi một trục hạ đồi-tuyến yên-tuyến sinh dục (HPG) nguyên vẹn, và bất kỳ sự gián đoạn nào của trục này đều có thể dẫn đến các rối loạn tạm thời hoặc vĩnh viễn chức năng nội tiết sinh sản. Hoạt hóa tuyến thượng thận được định nghĩa là sự trưởng thành của vỏ thượng thận, dẫn đến tăng tiết androgen tuyến thượng thận và sự phát triển của lông mu và lông nách, mùi cơ thể từ tuyến apocrine và mụn trứng cá. Nền tảng sinh lý của dậy thì bắt đầu trong tử cung với sự phát triển của các cấu trúc thần kinh sinh học tạo nên thành phần hạ đồi-tuyến yên của trục HPG và với sự biệt hóa và phát triển của tuyến sinh dục. Toàn bộ quá trình, kéo dài từ đời sống bào thai cho đến khi đạt được năng lực sinh sản, là kết quả của sự tương tác năng động và phối hợp của một danh sách ngày càng nhiều các gen, protein, phân tử tín hiệu, các yếu tố nội tiết và cận tiết, và các sự kiện biểu sinh.
Sự phát triển của hệ thống nội tiết sinh sản
Sự phát triển của mạng lưới nơron giải phóng Gonadotropin
Trong đời sống sau sinh, các nơron giải phóng gonadotropin (GnRH) nằm ở vùng dưới đồi. Các nơron này tạo ra các đợt phóng thích GnRH không liên tục vào tuần hoàn cửa tuyến yên để kích thích các tế bào hướng sinh dục của tuyến yên tổng hợp và tiết ra các gonadotropin là hormone kích thích nang trứng (FSH) và hormone hoàng thể hóa (LH).
Sự phát triển của trục HPG là một ngoại lệ ở chỗ các nơron GnRH phát triển ở phôi động vật đa bào bên ngoài hệ thần kinh trung ương (CNS). Các tiền chất nơron GnRH chưa trưởng thành có thể được phát hiện trong tấm khứu giác và trong mầm mũi (cơ quan lá mía mũi) từ một giai đoạn phôi thai sớm (khoảng tuần thứ sáu của thai kỳ ở người và ngày phôi E10.5–E11 ở chuột) và sau đó bắt đầu hành trình phức tạp của chúng về phía vùng dưới đồi. Sự di chuyển trong phôi của các nơron GnRH đến vùng dưới đồi là chìa khóa cho sự phát triển của mạng lưới nội tiết thần kinh cho phép sự phát triển dậy thì bình thường.
Con đường mà các nơron GnRH di chuyển bao gồm các giàn giáo được hình thành bởi các dây thần kinh khứu giác, lá mía mũi và tận cùng. Các nơron GnRH di chuyển được biết là có các thụ thể cho ít nhất 20 phân tử tín hiệu. Chúng nhận được vô số thông điệp hướng dẫn và gây di chuyển trong suốt hành trình của mình, dường như khác biệt tùy thuộc vào giai đoạn di chuyển của chúng. Các tín hiệu này có thể tác động trực tiếp lên các nơron GnRH hoặc gián tiếp lên các sợi trục khứu giác, vì sự phá vỡ chính các “giàn giáo” của đường khứu giác có thể làm gián đoạn sự di chuyển của GnRH. Các tín hiệu phân tử liên quan bao gồm các phân tử kết dính (ví dụ, phân tử kết dính tế bào thần kinh [N-CAM]), các phân tử chất nền ngoại bào (ví dụ, heparin sulphotransferase), cytokine (ví dụ, yếu tố ức chế bệnh bạch cầu, yếu tố tăng trưởng tế bào gan), những yếu tố kiểm soát tương tác giữa các tế bào (thụ thể màng [ví dụ, neuropilin-2]), và các yếu tố phiên mã (ví dụ, Ebf2), cũng như cả chất hóa hướng động và chất hóa xua đuổi (ví dụ, Reelin). Gradient của các chemokine (ví dụ, CXCL12) có thể đặc biệt quan trọng để thúc đẩy và hướng dẫn sự di chuyển của các nơron GnRH. Sự kết hợp của các yếu tố này có mức độ dư thừa cao, do đó việc mất đi bất kỳ một yếu tố nào cũng có thể không làm gián đoạn hoàn toàn sự di chuyển của nơron GnRH.
Các nơron bắt đầu di chuyển trong khoang mũi tại hoặc xung quanh cơ quan lá mía mũi, đi qua phiến sàng và xâm nhập vào hệ thần kinh trung ương ở gần các hành khứu, và cuối cùng di chuyển áp sát vào một tập hợp con của các dây thần kinh lá mía mũi phân nhánh về phía đuôi vào các vùng đáy của não trước. Vào cuối hành trình, các nơron GnRH tách khỏi các sợi trục dẫn đường để phân tán vào các vị trí cuối cùng của chúng trong vùng vách-hạ đồi, bao gồm dải chéo Broca, vách giữa và các vùng trước thị của vùng dưới đồi. Cuối cùng, các nơron này đến vùng dưới đồi nơi chúng mở rộng các nhánh đến lồi giữa để tạo thành một mạng lưới, hoàn thành khía cạnh này của sự phát triển nơron GnRH.
Toàn bộ quá trình di chuyển chỉ liên quan đến không quá vài trăm nơron ở mỗi bán cầu ở chuột và vài nghìn ở linh trưởng hoặc người. Số lượng tuyệt đối các nơron GnRH cần thiết cho sự phát triển dậy thì không được biết, nhưng dường như có một mức độ dư thừa trong hệ thống. Các nghiên cứu trên loài gặm nhấm cho thấy rằng khoảng 12% quần thể nơron GnRH là đủ cho việc tiết gonadotropin theo nhịp và khởi phát dậy thì, trong khi cần từ 12% đến 34% cho chu kỳ động dục và rụng trứng ở chuột cái trưởng thành. Ngoài ra, những con chuột Reeler trưởng thành (ban đầu được xác định dựa trên kiểu hình mất điều hòa) có số lượng nơron GnRH ở vùng dưới đồi ít hơn đáng kể và biểu hiện kiểu hình trưởng thành dậy thì muộn và khả năng sinh sản thấp.
Các nơron GnRH mở rộng các sợi thần kinh của chúng đến lồi giữa dưới sự kiểm soát của các yếu tố hầu hết vẫn chưa được biết. Tín hiệu của thụ thể yếu tố tăng trưởng nguyên bào sợi 1 (FGFR1) được biết là quan trọng cho quá trình mở rộng sợi trục này, bằng chứng là các nhánh đến lồi giữa bị giảm ở những con chuột chuyển gen biểu hiện một FGFR1 trội âm (dnFGFR1) trong các nơron GnRH.
Giai đoạn cuối cùng của sự phát triển nơron GnRH bao gồm hoạt động chức năng. Đến tuần thứ 15 của thai kỳ ở người, bộ tạo nhịp GnRH đang điều chỉnh chức năng của các tế bào hướng sinh dục của thai nhi. Toàn bộ trục HPG hoạt động chức năng lần đầu tiên trong quá trình phát triển của thai nhi, và sau một thời gian tạm dừng ngắn quanh sinh, nó tiếp tục hoạt động ở giai đoạn sơ sinh (trong giai đoạn được gọi là dậy thì mini), cho đến khi nó bước vào trạng thái tương đối yên lặng, thường được gọi là giai đoạn tạm dừng vị thành niên hoặc tiền dậy thì.
Như sẽ được thảo luận sau, các bất thường bệnh lý của sự phát triển dậy thì đã được xác định với từng khía cạnh của sự phát triển nơron GnRH: (1) khiếm khuyết trong quá trình tổng hợp GnRH, chủ yếu là do sự di chuyển bất thường của các nơron GnRH từ tấm khứu giác về phía vùng dưới đồi trong ba tháng đầu của đời sống thai nhi; (2) khiếm khuyết trong sự trưởng thành và chức năng của mạng lưới nơron GnRH; (3) mất chức năng của chính GnRH hoặc thụ thể của nó, còn được gọi là khiếm khuyết hoạt tính sinh học của GnRH (Hình 18.1).
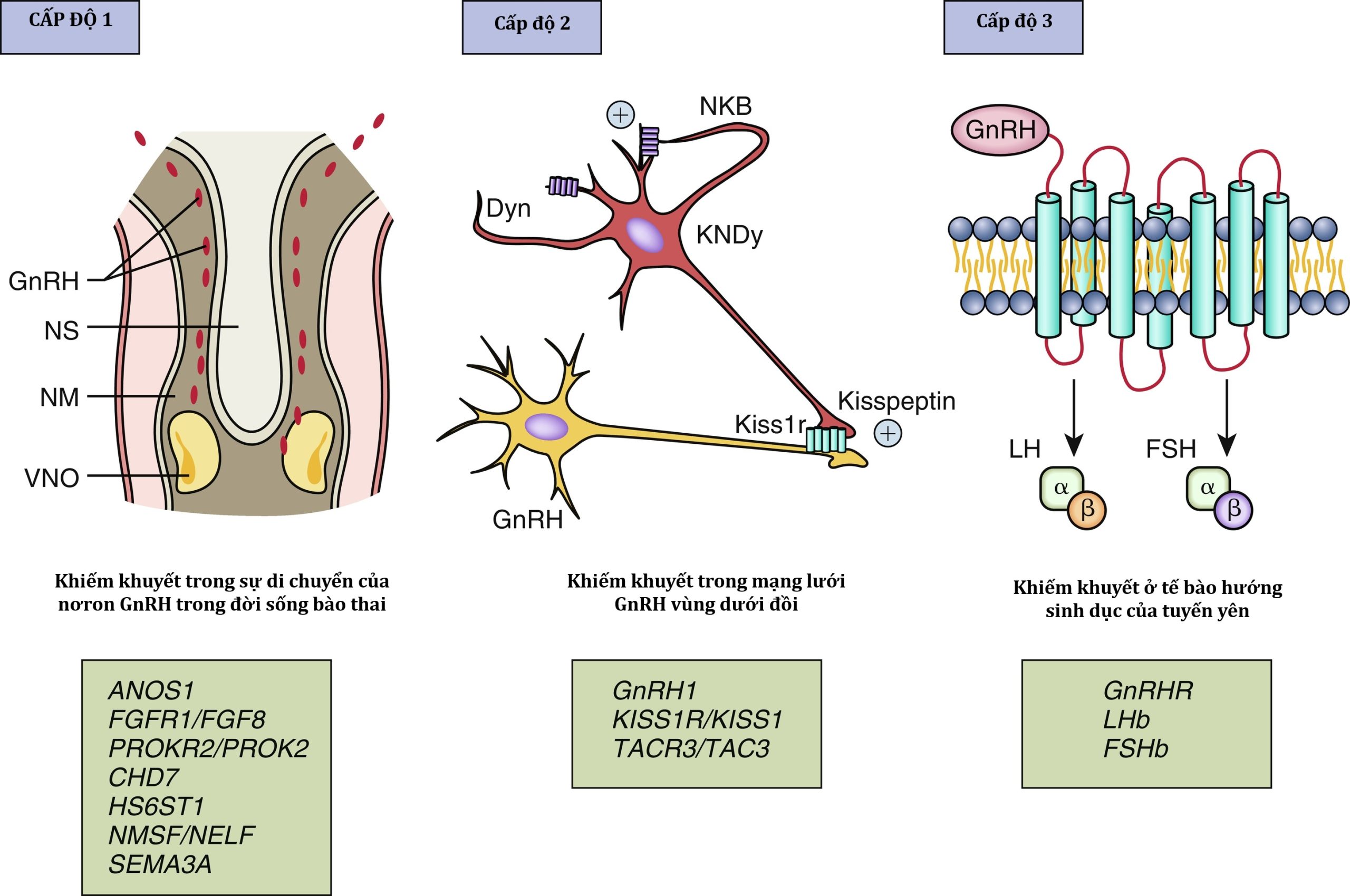
Hình 18.1 Các đột biến ở các gen đơn lẻ tại ba cấp độ khác nhau của trục hạ đồi-tuyến yên-tuyến sinh dục (HPG) có thể gây ra suy sinh dục do giảm gonadotropin. Sơ đồ ba cấp độ cùng với các gen ảnh hưởng đến chức năng HPG ở mỗi cấp độ được hiển thị. Xem văn bản để biết chi tiết về từng gen. ARC, nhân cung; Dyn, Dynorphin; ME, lồi giữa; NKB, neurokinin B; NM, trung mô mũi; NS, vách ngăn mũi; POA, vùng trước thị; VNO, cơ quan lá mía mũi.
Một ví dụ điển hình là ANOS1, trước đây được gọi là KAL1, mã hóa anosmin-1, một protein chất nền ngoại bào điều chỉnh việc tìm đường của sợi trục và sự kết dính của tế bào. Anosmin-1 thúc đẩy sự phân nhánh của các nơron hành khứu. Các đối tượng có đột biến mất chức năng ANOS1 bị ngừng phát triển cả nơron hành khứu và nơron GnRH ở mức phiến sàng, dẫn đến khứu giác bất thường và suy sinh dục do giảm gonadotropin (HH). Các yếu tố di truyền bổ sung liên quan đến sự phát triển và chức năng của nơron GnRH được mô tả chi tiết trong phần “Dậy thì muộn, Suy sinh dục do giảm gonadotropin” ở phần sau của chương này.
Sự phát triển của tuyến yên
Tuyến yên bao gồm thùy trước (hoặc tuyến yên tuyến) và thùy sau (hoặc tuyến yên thần kinh), cũng như phần trung gian và phần cuống (hoặc cuống tuyến yên). Thùy trước có nguồn gốc từ các tiền chất biểu mô/ngoại bì miệng và thùy sau có nguồn gốc từ ngoại bì thần kinh, cả hai đều dưới sự kiểm soát của một chuỗi các yếu tố phiên mã. Sự biểu hiện không gian và thời gian của các yếu tố này là rất quan trọng, và các đột biến trong các gen mã hóa các yếu tố này có thể dẫn đến suy sinh dục do giảm gonadotropin, cũng như thiếu hụt hormone tuyến yên kết hợp/đa hormone (xem phần “Dậy thì muộn” sau; được đánh giá trong).
Quá trình hình thành cơ quan của tuyến yên bắt đầu trong tuần thứ tư của thai kỳ với một phần mở rộng hướng lên của ngoại bì miệng (để tạo thành túi Rathke) về phía ngoại bì thần kinh. Đồng thời, ngoại bì thần kinh của não trung gian bụng mở rộng xuống dưới, cho phép kết nối hai yếu tố này và dẫn đến sự hình thành cuối cùng của cấu trúc hai thùy phức hợp của tuyến yên trưởng thành.
Sự khởi đầu của quá trình hình thành cơ quan và sự hình thành túi Rathke liên quan đến các phân tử tín hiệu, chẳng hạn như Hesx1, Otx2, Pitx1/2/3, Sox2, FGF8 và Lhx3. Sự xác định dòng tế bào sau đó phụ thuộc vào các phân tử, chẳng hạn như Prop1, POU1F1 (Pit1) và Nr5a1 (SF1) cùng những phân tử khác. Do mô hình kiểm soát yếu tố phiên mã phức tạp, các phân tử khác nhau là chìa khóa cho sự phát triển của các dòng tế bào khác nhau tại các thời điểm khác nhau. Ví dụ, Lhx3 và Hesx1 ảnh hưởng đến sự phát triển của tất cả các dòng cũng như Pitx1/2/3; Prop1 ảnh hưởng đến sự biệt hóa của các tế bào hướng sinh dục, tế bào hướng tuyến giáp, tế bào hướng thân, tế bào hướng sữa nhưng có lẽ đóng một vai trò ít độc lập hơn trong sự phát triển của các tế bào hướng vỏ thượng thận; POU1F1 điều chỉnh sự biệt hóa của các tế bào hướng tuyến giáp, tế bào hướng thân và tế bào hướng sữa; Nr5a1 ảnh hưởng phần lớn đến các tế bào hướng sinh dục. Như đã lưu ý, trong trường hợp không có sự dư thừa chức năng, các đột biến trong các gen của các yếu tố điều hòa này có thể dẫn đến thiếu hụt hormone tuyến yên, với các hormone bị ảnh hưởng phần lớn được dự đoán bởi các loại tế bào mà sự phát triển của chúng phụ thuộc vào yếu tố phiên mã cụ thể. Tuy nhiên, một số đột biến, chẳng hạn như trong HESX1 hoặc OTX2, có thể dẫn đến thiếu hụt hormone tuyến yên kết hợp, như mong đợi, nhưng cũng dẫn đến thiếu hụt hormone tăng trưởng (GH) đơn độc và loạn sản vách-thị.
Tuyến yên phát triển sớm trong thai kỳ và, tương tự như mạng lưới nơron GnRH, trở nên hoạt động chức năng trong tử cung. Các tế bào hướng sinh dục là loại tế bào tuyến yên trước phát triển cuối cùng, nhưng sự giải phóng gonadotropin có thể được phát hiện vào tuần 14 để đáp ứng với sự bài tiết GnRH. Sự bài tiết gonadotropin đạt đỉnh vào khoảng 20 đến 22 tuần trong tử cung và sau đó tăng và giảm theo sự bài tiết GnRH năng động của vùng dưới đồi, được mô tả trước đó, và với các vòng phản hồi dương và âm, được mô tả sau.
Sự phát triển của tinh hoàn
Sau đây là tóm tắt ngắn gọn về sự biệt hóa và phát triển của tinh hoàn trước khi sinh; mô tả chi tiết hơn về sự biệt hóa tinh hoàn và sự phát triển giới tính có thể được tìm thấy trong Chương 6. Bắt đầu vào khoảng 4 đến 6 tuần của thai kỳ, tuyến sinh dục lưỡng tiềm nguyên thủy phát sinh từ sự cô đặc của trung bì của mào niệu-dục. Trong thời gian này, các tế bào mầm nguyên thủy tăng sinh và di chuyển từ ruột sau để định cư trong tuyến sinh dục đang phát triển. Ở thai nhi nam của người, các khoang tinh hoàn, các thành phần ống và kẽ, và các loại tế bào cụ thể, tế bào Leydig, Sertoli và tế bào mầm có thể được hình dung vào tuần thứ 11 của thai kỳ. Trong thời kỳ đầu của thai kỳ, gonadotropin màng đệm người (hCG) của nhau thai chi phối sự tăng sinh tế bào Leydig và sự bài tiết testosterone và yếu tố giống insulin 3 (INSL3); LH nội sinh bắt đầu điều chỉnh các hoạt động này vào giữa thai kỳ. Do vai trò của hCG nhau thai trong giai đoạn đầu thai kỳ, sự thiếu hụt gonadotropin không ảnh hưởng đến sự biệt hóa giới tính nam. Tuy nhiên, sự bài tiết LH ảnh hưởng đến số lượng tế bào Leydig của thai nhi, được chứng minh bằng số lượng giảm ở thai nhi vô não và số lượng tăng ở thai nhi 46,XY có nồng độ gonadotropin tăng cao thứ phát do không nhạy cảm hoàn toàn với androgen. Sản xuất testosterone thứ phát sau bài tiết LH của thai nhi cũng rất quan trọng cho sự phát triển của dương vật trong tam cá nguyệt thứ hai và thứ ba; nam giới bị thiếu hụt LH thường có dương vật được hình thành bình thường nhưng nhỏ khi sinh. Sự bài tiết FSH ảnh hưởng đến sự biệt hóa tế bào Sertoli và sự bài tiết hormone kháng Müller (AMH) và inhibin B.
Sự di chuyển của tinh hoàn xuống bìu xảy ra theo hai giai đoạn. Giai đoạn qua ổ bụng bắt đầu vào khoảng tuần thứ 12 của thai kỳ và bị ảnh hưởng bởi sản phẩm của tế bào Leydig, INSL3, và thụ thể tương ứng của nó, thụ thể 8 ghép cặp với protein G chứa đoạn lặp giàu leucine (LGR8). Giai đoạn thứ hai phụ thuộc androgen, sự di chuyển của tinh hoàn qua ống bẹn, thường được hoàn thành vào cuối tuần thứ 35.
Sau một thời gian tạm dừng hoạt động ngắn sau khi sinh, trục hạ đồi-tuyến yên-tinh hoàn hoạt động trong vài tháng đầu đời với nồng độ testosterone đạt đỉnh lúc 1 đến 2 tháng tuổi. Đến khoảng 6 tháng tuổi, nồng độ testosterone giảm xuống mức tiền dậy thì. Trong giai đoạn ngắn của hoạt động HPG sơ sinh tăng lên, lông sinh dục không phát triển và quá trình sinh giao tử không xảy ra do tín hiệu thụ thể androgen (AR) bị hạn chế ở một số mô nhất định (ví dụ, tế bào Sertoli). Trong giai đoạn sơ sinh và thời thơ ấu, các dây sinh tinh đặc và thường chứa đầy các tế bào Sertoli chưa trưởng thành. Các tế bào mầm chỉ giới hạn ở tinh nguyên bào và tế bào Leydig hiếm khi được nhìn thấy. Inhibin B và AMH tiếp tục được tiết ra trong thời thơ ấu và đóng vai trò là những dấu hiệu có giá trị về chức năng của tế bào Sertoli.
Sinh lý của dậy thì
Nơron KNDy vùng hạ đồi và nơron giải phóng Gonadotropin
Sự giải phóng GnRH được điều phối bởi các tín hiệu đầu vào từ nơron và tế bào thần kinh đệm mang tính ức chế và kích thích (Hình 18.2). Các nghiên cứu truy vết ngược ở chuột đã chứng minh rằng các nơron GnRH được kiểm soát bởi một mạng lưới nơron phức tạp từ nhiều vùng của não, bao gồm thân não, hệ limbic, các nhân vùng dưới đồi, các mạch vận động và cảm giác, và hạch nền.
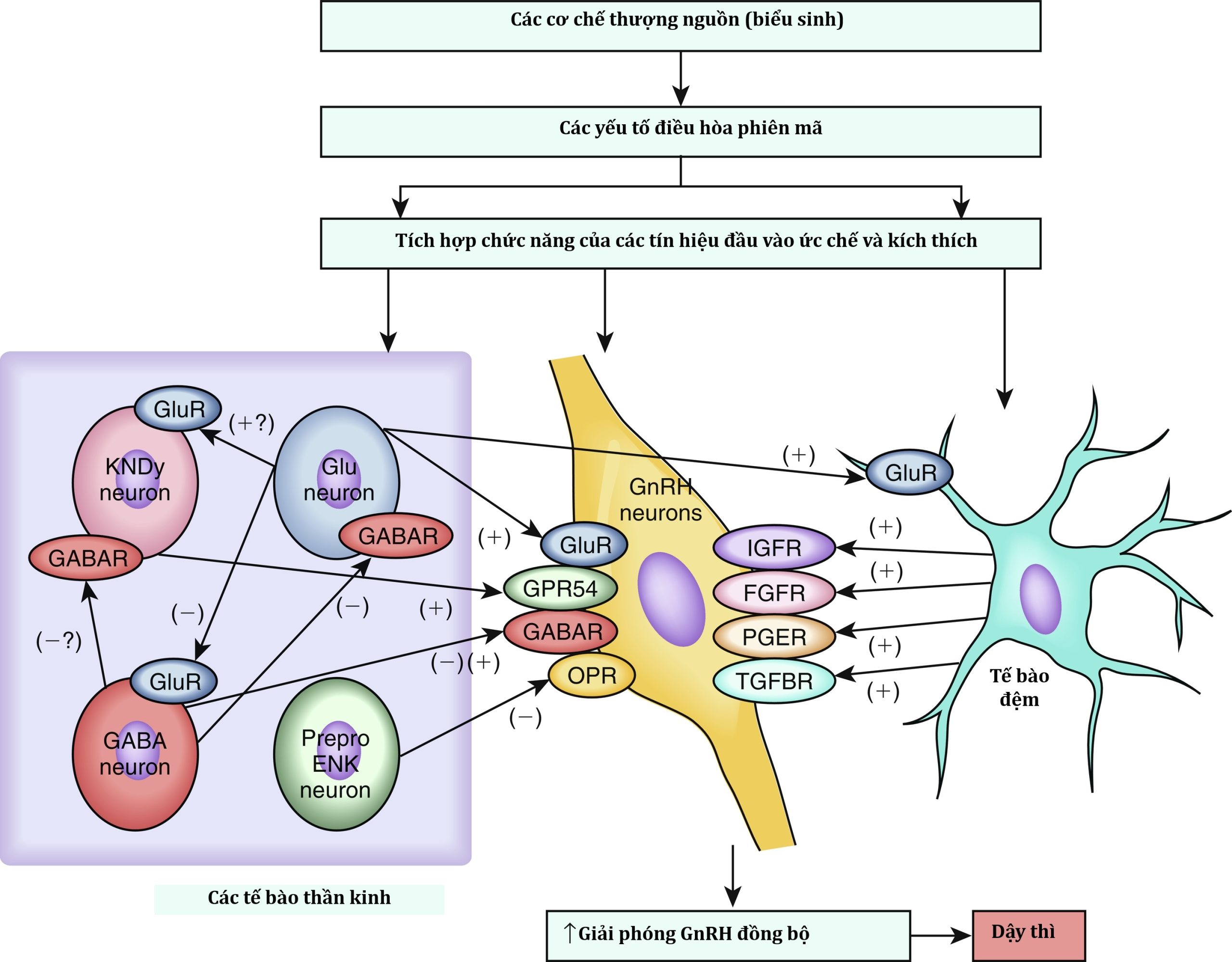
Hình 18.2 Các yếu tố điều hòa chức năng nơron giải phóng gonadotropin (GnRH). Các nơron GnRH được điều hòa bởi một mạng lưới bao gồm các yếu tố biểu sinh và phiên mã, cũng như các yếu tố điều chỉnh xuyên synap và thần kinh đệm trong quá trình dậy thì. (Sửa đổi từ Ojeda, S.R., và cộng sự (2006). Minireview: the neuroendocrine regulation of puberty: is the time ripe for a systems biology approach? Endocrinology, 147:1166–1174.)
Trong số các yếu tố điều hòa khác nhau của nơron GnRH, kisspeptin và neurokinin B là cần thiết nhất. Sự phân bố của các nơron kisspeptin ở vùng dưới đồi thay đổi theo loài. Các nơron kisspeptin đã được lập bản đồ giải phẫu ở chuột nằm trong vùng dưới đồi về phía đuôi, ở vùng dưới đồi nền giữa, bao gồm vùng nhân cung (ARC)/vùng phễu. Ở chuột, một quần thể thứ hai nằm ở phần trước của vùng dưới đồi được gọi là vùng quanh não thất trước-bụng (AVPV). Ở chuột cống, khỉ và người, sự phân bố theo vùng này của các nơron kisspeptin ít rõ ràng hơn. Hai quần thể nơron kisspeptin ở chuột biểu hiện sự khác biệt chức năng rõ rệt, ví dụ, các nơron kisspeptin AVPV có vai trò trung gian cho các hiệu ứng phản hồi dương của estrogen, dẫn đến sự tăng vọt GnRH/LH gây ra rụng trứng, và các nơron kisspeptin ARC có vai trò trung gian cho các hiệu ứng phản hồi âm của steroid sinh dục lên hoạt động trương lực của trục HPG. Các nơron kisspeptin AVPV biểu hiện sự lưỡng hình giới tính rõ ràng, với chuột cái ở tuổi dậy thì có số lượng nơron kisspeptin lớn hơn nhiều trong khu vực này.
Kisspeptin, một neuropeptide kích thích, được xác định là một yếu tố cho phép quan trọng trong sự khởi đầu dậy thì bằng việc phát hiện ra các bệnh nhân bị thiếu hụt GnRH có đột biến mất chức năng trong thụ thể kisspeptin, KISS1R, trước đây được gọi là GPR54. Sau đó, một đột biến hoạt hóa trong KISS1R đã được xác định ở một bé gái bị dậy thì sớm trung ương, và một đột biến hoạt hóa trong KISS1, mã hóa chính kisspeptin, đã được báo cáo ở một trẻ bị dậy thì sớm trung ương. Hơn nữa, những con chuột bị loại bỏ gen Kiss1r bị vô sinh, mặc dù sự phân bố nơron GnRH và mức GnRH ở vùng dưới đồi bình thường, và những con chuột bị loại bỏ gen Kiss1 cũng có kiểu hình phù hợp với thiếu hụt GnRH có khứu giác bình thường.
Kisspeptin được tổng hợp bởi các nơron vùng dưới đồi tiếp xúc với các nơron GnRH và các nhánh của chúng. Các nơron kisspeptin nằm bên ngoài hàng rào máu não và do đó tiếp xúc trực tiếp với các hormone sinh dục ngoại vi. Hầu hết các nơron GnRH biểu hiện thụ thể kisspeptin và các nơron kisspeptin biểu hiện các thụ thể steroid (thụ thể estrogen alpha, thụ thể androgen và thụ thể progesterone) và là rơle chính cho phản hồi âm và dương của các hormone steroid lên trục hướng sinh dục.
Kisspeptin truyền tín hiệu trực tiếp đến các nơron GnRH để kiểm soát sự giải phóng GnRH theo nhịp. Kisspeptin được điều hòa tăng ở cả linh trưởng và chuột trong giai đoạn quanh dậy thì, và việc sử dụng nó cho các loài gặm nhấm ở tuổi dậy thì sẽ thúc đẩy sự khởi đầu của quá trình trưởng thành sinh dục. Điều thú vị là, kisspeptin dường như cũng bị điều hòa giảm trong tình trạng vô kinh chức năng, cho thấy vai trò của nó như một chất trung gian của các yếu tố môi trường, chẳng hạn như sức khỏe tinh thần và tình trạng dinh dưỡng. Ngoài ra, như đã lưu ý, kisspeptin đã được chứng minh là một chất điều hòa nội tiết thần kinh quan trọng của sự rụng trứng. Ở chuột, các nơron kisspeptin nằm ở AVPV làm trung gian cho phản hồi dương của estradiol lên mạng lưới nơron GnRH và do đó tạo ra đỉnh LH trước rụng trứng. Ngược lại, estrogen có tác dụng ức chế các nơron Kiss1 trong ARC. Do đó, tín hiệu kisspeptin dường như có cả vòng phản hồi dương và âm trong trục HPG. Trong khi kisspeptin đã được xác định là một chất điều hòa ngược dòng quan trọng của các nơron GnRH, liệu kisspeptin có phải là yếu tố then chốt trong việc khởi động quá trình dậy thì hay không vẫn chưa rõ ràng.
Một neuropeptide kích thích khác, neurokinin B, đã được liên hệ đến việc kiểm soát ngược dòng sự bài tiết GnRH. Việc xác định con đường này dựa trên việc phát hiện các đột biến mất chức năng trong TAC3, mã hóa neurokinin B, và thụ thể của nó TACR3, ở những bệnh nhân bị thất bại dậy thì do suy sinh dục do giảm gonadotropin có khứu giác bình thường. Các nơron kisspeptin nằm trong ARC tổng hợp neurokinin B và dynorphin A và đã được gọi là nơron KNDy (Kisspeptin, Neurokinin B, Dynorphin). Cả sự biểu hiện của TAC3 và KISS1 trong ARC đều bị điều hòa giảm bởi estrogen. Do đó, các nơron này được coi là rơle của phản hồi âm của các hormone steroid lên trục hướng sinh dục. Các nơron KNDy cũng biểu hiện thụ thể neurokinin B, NK3R, cho thấy rằng các vòng lặp cận tiết và tự tiết kiểm soát sự giải phóng GnRH. Dynorphin ức chế sự giải phóng GnRH, và cùng nhau các peptide này hiện được cho là đóng một vai trò cơ bản trong việc điều chỉnh sự giải phóng GnRH theo nhịp.
Gần đây hơn, một peptide liên quan đến RF-amide khác (RFRP1, RFRP3), tương đồng ở động vật có vú với peptide hormone ức chế gonadotropin (GnIH) ở chim, đã được phát hiện là một chất điều hòa ức chế khác của trục hướng sinh dục bằng cách kiểm soát trực tiếp các nơron GnRH. GnIH đóng một vai trò thiết yếu trong việc ức chế trục HPG ở một số loài. Ngoài các neuropeptide, một số chất dẫn truyền thần kinh tham gia vào việc kiểm soát mạng lưới GnRH. Axit gamma aminobutyric (GABA) và glutamate kiểm soát khả năng kích thích của nơron GnRH trong ARC. Ở chuột cống cái, glutamine synthase bị điều hòa giảm và glutamate dehydrogenase trở nên phong phú hơn ở vùng dưới đồi khi dậy thì, cả hai đều dẫn đến tăng lượng glutamate có sẵn, chất này hoạt động thông qua các thụ thể n-methyl-D-aspartate (NMDA) và kainate của nó. Việc sử dụng các chất chủ vận glutamate cho các loài linh trưởng tiền dậy thì có thể kích thích sự khởi đầu của dậy thì.
Mạng lưới thần kinh của GABA khá phức tạp vì một số nơron này sẽ có tác động trực tiếp lên các nơron GnRH, và những nơron khác sẽ tác động lên các nơron trung gian. Vai trò ức chế của sự dẫn truyền thần kinh GABAergic trong việc kìm hãm sự khởi đầu của dậy thì đã được thể hiện rõ ràng ở các loài linh trưởng nhưng mơ hồ hơn ở các loài gặm nhấm. Các con đường tín hiệu GABAergic có thể quan trọng trong việc ức chế LH do căng thẳng.
Một số bằng chứng gần đây nhấn mạnh tầm quan trọng ở chuột của các micro ribonucleic acid (microRNA) (đặc biệt là họ miR-200/429 và miR-155) trong việc điều hòa tăng biểu sinh của phiên mã GnRH trong giai đoạn tương đương với dậy thì mini ở chuột. Hơn nữa, miR-7a2, đã được chứng minh là cần thiết cho sự phát triển bình thường của tuyến yên và chức năng HPG, với việc xóa bỏ gen này ở chuột dẫn đến suy sinh dục do giảm gonadotropin và vô sinh.
Tín hiệu hormone giải phóng corticotropin (CRH) từ lâu đã được biết là đóng một vai trò quan trọng trong việc ức chế bộ tạo nhịp GnRH do căng thẳng ở các loài gặm nhấm. Việc tiêm CRH vào não thất (ICV) làm giảm tần số nhịp LH ở chuột cống, trong khi việc ức chế nhịp LH do căng thẳng gây ra bởi hạ đường huyết do insulin bị chặn bởi việc tiêm ICV một chất đối kháng CRH. Sự kề cận của các sợi miễn dịch phản ứng với CRH với các nơron GnRH đã được quan sát thấy ở vùng phễu của vùng dưới đồi ở người.
Cuối cùng, sự bài tiết theo nhịp đồng bộ của GnRH cũng được kiểm soát thông qua các con đường tín hiệu nơron-thần kinh đệm. Các tín hiệu đầu vào từ tế bào thần kinh đệm dường như chủ yếu mang tính hỗ trợ và chúng bao gồm các yếu tố tăng trưởng và các phân tử khuếch tán nhỏ, bao gồm yếu tố tăng trưởng biến đổi (TGF)β1, yếu tố tăng trưởng giống insulin 1 (IGF-1), và các neuregulin, mà trực tiếp hoặc gián tiếp kích thích sự bài tiết GnRH. Các tế bào thần kinh đệm ở lồi giữa điều chỉnh sự bài tiết GnRH bằng cách sản xuất các yếu tố tăng trưởng, hoạt động thông qua các thụ thể có hoạt tính tyrosine kinase. Tín hiệu FGF là cần thiết để các nơron GnRH đến được vị trí cuối cùng của chúng ở vùng dưới đồi, cũng như cho sự biệt hóa và tồn tại của nơron GnRH. Ngoài ra, hoạt động bài tiết của nơron GnRH được hỗ trợ bởi IGF-1 và bởi các thành viên của họ yếu tố tăng trưởng biểu bì, chẳng hạn như neuregulin 1β. Sự sắp xếp lại dẻo dai của độ bám dính tế bào thần kinh đệm-nơron GnRH, được trung gian bởi các phân tử hòa tan, chẳng hạn như N-CAM và phân tử kết dính tế bào synap (SynCAM), phối hợp việc vận chuyển GnRH có kiểm soát đến các mạch máu cửa, một quá trình cũng chịu sự điều chỉnh của steroid sinh dục.
Gonadotropin tuyến yên
GnRH kích thích sản xuất và bài tiết LH và FSH từ các tế bào hướng sinh dục bằng cách liên kết với một thụ thể trên bề mặt tế bào, kích hoạt sự gia tăng nồng độ canxi nội bào và sự phosphoryl hóa của protein kinase C. LH được giải phóng từ các bể dễ giải phóng, dẫn đến sự gia tăng LH trong huyết thanh trong vòng vài phút sau một liều bolus GnRH, nhưng cũng từ các bể cần thời gian lâu hơn để huy động. Trong khi sự kích thích từng đợt bởi GnRH làm tăng tiết gonadotropin, việc truyền GnRH liên tục làm giảm tiết LH và FSH và điều hòa giảm các thụ thể tuyến yên cho GnRH—một hiện tượng được sử dụng trong điều trị y tế của dậy thì sớm trung ương. Những thay đổi trong thụ thể GnRH có vai trò quan trọng khác trong việc điều chỉnh chức năng hướng sinh dục vì estrogen làm tăng và androgen làm giảm các thụ thể GnRH.
FSH và LH là các glycoprotein bao gồm hai tiểu đơn vị, một tiểu đơn vị α chung cho tất cả các hormone glycoprotein và các tiểu đơn vị β riêng biệt mang lại tính đặc hiệu của thụ thể. Các tiểu đơn vị β dài 115 axit amin với hai chuỗi carbohydrate bên. hCG do nhau thai sản xuất có cấu trúc gần như giống hệt LH ngoại trừ thêm 32 axit amin và các nhóm carbohydrate bổ sung. Các trường hợp hiếm gặp về đột biến ở tiểu đơn vị β của các phân tử gonadotropin gây ra các tác động bệnh lý đã được báo cáo: một trường hợp đột biến bất hoạt của LHB gây ra sự vắng mặt của các tế bào Leydig và không dậy thì ở nam giới và hai trường hợp đột biến bất hoạt của FSHB dẫn đến không có sự trưởng thành của nang trứng và vô kinh, và ở hai nam giới, là vô tinh trùng. Ngoài ra, một phụ nữ có đột biến đồng hợp tử ở vị trí cho nối 5′ trong vùng không mã hóa của LHB cho thấy sự bài tiết LH bị suy giảm, sự phát triển dậy thì bình thường, vô kinh thứ phát và vô sinh. Điều quan trọng về mặt khái niệm từ những quan sát này là sự trưởng thành dậy thì bình thường ở phụ nữ, bao gồm sự phát triển của vú và có kinh nguyệt, có thể xảy ra trong tình trạng thiếu hụt LH, trong khi sự bài tiết LH bình thường dường như là bắt buộc để rụng trứng. Điều này ngụ ý rằng mặc dù LH là cần thiết cho sự trưởng thành bình thường của các tế bào Leydig và quá trình sinh steroid ở nam giới, vai trò chính của nó ở phụ nữ là gây rụng trứng.
Cùng một tế bào hướng sinh dục sản xuất cả LH và FSH trong tuyến yên. Các tế bào hướng sinh dục không được kích thích, ví dụ, do bệnh ảnh hưởng đến sự bài tiết GnRH, có đường kính nhỏ, trong khi các tế bào hướng sinh dục trong suy sinh dục nguyên phát, được kích thích bởi một lượng lớn GnRH, có đường kính lớn và thể hiện lưới nội chất hạt nổi bật.
Sản xuất Hormone tuyến sinh dục
Steroid sinh dục
Sự kích thích của LH lên các tế bào Leydig dẫn đến tăng tiết testosterone ở tinh hoàn, và các tế bào Leydig điển hình trở nên rõ ràng trên mô học. Testosterone hoạt động như một yếu tố cận tiết để gây ra sự trưởng thành của tế bào Sertoli. Sự trưởng thành dậy thì của các ống sinh tinh được đặc trưng bởi sự sắp xếp lại của khung tế bào, bao gồm sự phát triển của các liên kết chặt, sự phân cực của tế bào Sertoli, sự tăng sinh của tế bào Sertoli, sự di chuyển của các tinh nguyên bào về phía màng đáy và giảm tiết AMH.
Các tế bào Leydig của tinh hoàn tổng hợp testosterone thông qua một loạt các chuyển đổi enzym mà cholesterol là tiền chất. Khi LH liên kết với các thụ thể màng tế bào Leydig, phức hợp phối tử-thụ thể kích thích adenyl cyclase liên kết màng để tăng adenosine monophosphate vòng (cAMP), sau đó kích thích protein kinase A, đến lượt nó gây ra sự kích thích chuyển đổi cholesterol thành pregnenolone bởi P450scc (enzym cắt chuỗi bên), bước đầu tiên trong quá trình sản xuất testosterone. Với sự tiếp xúc đáng kể với LH, số lượng thụ thể LH và con đường sau thụ thể giảm khả năng đáp ứng với LH trong ít nhất 24 giờ. Điều này giải thích phát hiện lâm sàng về sự không nhạy cảm với LH sau khi tiêm LH hoặc hCG hàng ngày so với tiêm cách ngày. Khi đánh giá phản ứng của tinh hoàn với LH, hCG hoặc LH phải được dùng cách nhau 2 đến 3 ngày để tránh sự điều hòa giảm như vậy.
Khi testosterone được tiết vào tuần hoàn, phần lớn được liên kết với globulin liên kết hormone sinh dục. Phần testosterone tự do còn lại (95% trong số đó được liên kết với albumin với ái lực thấp) thường được coi là phần hoạt động. Tại tế bào đích, testosterone tách ra khỏi protein liên kết, khuếch tán vào tế bào, và có thể được chuyển đổi bởi 5α-reductase type 2 (một enzym bề mặt nằm trên da sinh dục và các nơi khác và được mã hóa bởi một gen trên nhiễm sắc thể 2) thành dihydrotestosterone hoặc bởi aromatase (CYP19) thành estrogen. Testosterone hoặc dihydrotestosterone liên kết với thụ thể androgen được mã hóa bởi một gen trên nhiễm sắc thể X (Xq11-q12). Phức hợp testosterone/dihydrotestosterone-thụ thể sau đó gắn vào vùng đáp ứng steroid của deoxyribonucleic acid (DNA) bộ gen để bắt đầu phiên mã và dịch mã phụ thuộc androgen, cuối cùng dẫn đến nam hóa. Tuy nhiên, androgen phải được chuyển đổi thành estrogen để kích thích sự trưởng thành của xương ở đĩa sụn tiếp hợp.
FSH liên kết với các thụ thể đặc hiệu trên bề mặt tế bào của các tế bào Sertoli và gây ra một chuỗi các sự kiện mà đỉnh điểm là tăng hoạt động của protein kinase A theo cách tương tự như tác dụng kích thích của LH trên các tế bào Leydig. Tuy nhiên, FSH gây ra sự gia tăng khối lượng của các ống sinh tinh, và theo một cách không xác định, hỗ trợ sự phát triển của tinh trùng. Sự gia tăng số lượng tế bào Sertoli góp phần vào sự gia tăng thể tích tinh hoàn, cung cấp một dấu hiệu vật lý về sự khởi đầu của hoạt hóa tuyến sinh dục ở bé trai. Khi dậy thì tiến triển, các ống sinh tinh to ra và phát triển một lòng ống. Mặc dù có nhiều biến thể về tuổi đời và thể tích tinh hoàn đã được mô tả, sự xuất tinh lần đầu (spermarche) (sản xuất tinh trùng ban đầu) xảy ra trước tốc độ tăng trưởng tuyến tính đỉnh của tuổi dậy thì và xảy ra ở thể tích tinh hoàn trung bình từ 10 đến 12 mL, mặc dù đôi khi thấp tới 4 mL.
Activin và Inhibin B
FSH kích thích các tế bào Sertoli tiết ra inhibin B, từ giữa tuổi dậy thì trở đi đóng vai trò là chất điều hòa âm chính của sự bài tiết FSH của tuyến yên. Trước tuổi dậy thì, inhibin B độc lập với tế bào mầm. Sau tuổi dậy thì, sự bài tiết inhibin B trở nên phụ thuộc vào tế bào mầm và cung cấp một dấu hiệu về sự toàn vẹn của tế bào mầm ở người lớn.
Inhibin B là một thành viên glycoprotein dị nhị phân của họ TGF-β được sản xuất ở nam giới độc quyền bởi tinh hoàn, chủ yếu ở tinh hoàn tiền dậy thì bởi các tế bào Sertoli, và bởi các tế bào hạt của buồng trứng và nhau thai ở nữ giới. Một số nghiên cứu cho thấy nồng độ inhibin-B trong huyết thanh ở trẻ em thay đổi đồng bộ với sự bài tiết của gonadotropin. Trong giai đoạn “dậy thì mini”, nồng độ inhibin-B trong huyết thanh tăng đến mức tương tự hoặc cao hơn so với mức quan sát thấy ở các bé trai vị thành niên và nam giới trưởng thành. Sự bài tiết inhibin-B sớm này được duy trì cho đến 18 đến 24 tháng tuổi; sau đó, nồng độ trong huyết thanh giảm xuống mức thấp hơn nhưng có thể đo được. Đầu tuổi dậy thì, giữa các giai đoạn Tanner G1 và G2, nồng độ inhibin-B trong huyết thanh lại tăng lên và đạt mức cao nhất ở giai đoạn Tanner G2, nhưng sau đó mức này ổn định. Inhibin ức chế sự bài tiết FSH từ tuyến yên và cung cấp một lời giải thích khác cho nồng độ LH và FSH trong huyết thanh khác nhau chỉ với một peptide vùng dưới đồi (GnRH) kích thích chúng. Activin là các đồng nhị phân của tiểu đơn vị β của inhibin và có tác dụng ngược lại, kích thích sự bài tiết FSH từ tuyến yên. Sự vắng mặt của inhibin B do suy tuyến sinh dục gây ra sự gia tăng FSH trong huyết thanh lớn hơn LH ở các đối tượng dậy thì và người lớn.
Hormone kháng Müller
AMH thuộc cùng họ TGF-β với inhibin và được sản xuất từ các tế bào Sertoli của tinh hoàn từ thời điểm biệt hóa tinh hoàn đến tuổi dậy thì, và ở nữ giới bởi các tế bào hạt từ khi sinh ra cho đến khi mãn kinh. Ở nam giới bình thường, AMH cao ở thai nhi và trẻ sơ sinh với mức cao nhất vào khoảng 2 tháng tuổi và sau đó giảm dần vào lúc 1 tuổi. Bệnh nhân có tinh hoàn loạn sản có AMH huyết thanh giảm, trong khi các giá trị tăng cao trong các khối u tế bào Sertoli và ở nữ giới có khối u tế bào hạt. AMH và inhibin B không thể phát hiện được là đặc điểm của tình trạng không có tinh hoàn bẩm sinh nhưng cũng có thể được thấy trong suy sinh dục do giảm gonadotropin nặng ở nam giới. Ở các bé gái sơ sinh, một mô hình tương tự về nồng độ AMH trong những tháng đầu đời đã được báo cáo, nhưng nồng độ ở các bé gái thấp hơn đáng kể. AMH giảm trong quá trình dậy thì như một dấu hiệu của tác động androgen. Bắt đầu từ đầu tuổi dậy thì, testosterone ức chế sự bài tiết AMH của các tế bào Sertoli, và testosterone và AMH bắt đầu có mối quan hệ nghịch đảo. Testosterone trong tinh hoàn và tín hiệu thông qua các thụ thể androgen trong tế bào Sertoli là cần thiết cho sự suy giảm nồng độ AMH, quá trình giảm phân và sinh tinh. Do đó, nồng độ AMH cung cấp một dấu hiệu về chức năng của tế bào Sertoli và tác động của androgen trong tinh hoàn.
Tổng hợp lại: Sự tái hoạt hóa trục hướng sinh dục ở tuổi dậy thì
Thay đổi nội tiết tố
Trục hướng sinh dục trải qua các chu kỳ hoạt hóa và ức chế phức tạp từ đời sống bào thai đến tuổi dậy thì (Hình 18.3).
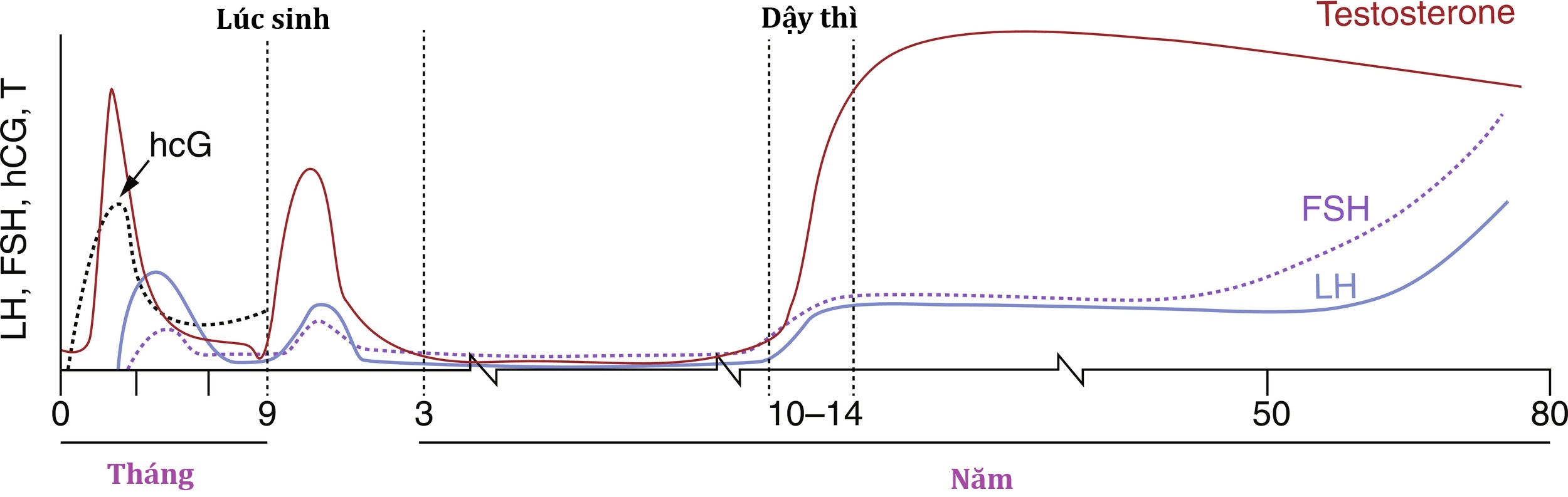
Hình 18.3 Nồng độ gonadotropin (hCG, FSH, LH) và testosterone lưu hành trong suốt vòng đời của một nam giới. Chức năng của trục nội tiết sinh sản là năng động trong suốt cuộc đời. Ở đây, các mức độ được hiển thị cho các giai đoạn trong tử cung, sơ sinh, tiền dậy thì, dậy thì và trưởng thành. “Dậy thì mini” được hiển thị trong hình giữa giai đoạn sơ sinh và 3 tuổi xảy ra vào khoảng 6 đến 10 tuần tuổi. hCG, Gonadotropin màng đệm người; FSH, hormone kích thích nang trứng; LH, hormone hoàng thể hóa. (Sửa đổi từ Huhtaniemi, I., và cộng sự (2017). The gonadal axis: a life perspective. In: Pfaff, D.W., Joels, M., editors. Hormones, Brain, and Behavior. 3rd ed: Oxford, Academic Press.)
Sự bài tiết testosterone của thai nhi vào đầu thai kỳ là do sự kích thích của hCG từ nhau thai. Vùng dưới đồi của thai nhi chứa các nơron chứa GnRH vào tuần thứ 14 của thai kỳ, và tuyến yên của thai nhi chứa LH và FSH vào tuần thứ 20. Hệ thống cửa hạ đồi-tuyến yên phát triển vào tuần thứ 20 của thai kỳ, cho phép GnRH của vùng dưới đồi đến được các tế bào hướng sinh dục của tuyến yên. Vào giữa thai kỳ, có sự gia tăng đáng kể nồng độ gonadotropin lưu hành ở cả thai nhi nam và nữ, đạt đỉnh vào 34 đến 38 tuần ở thai nhi nam, và sau đó giảm xuống mức thấp khi sinh. Sự thay đổi này trong bài tiết gonadotropin là kết quả của sự phát triển của một hệ thống phản hồi âm thông qua các steroid sinh dục, cũng như từ sự phát triển của các ảnh hưởng ức chế từ hệ thần kinh trung ương lên các nơron GnRH.
Sự bài tiết LH và FSH tăng lên trong tháng đầu tiên sau khi sinh, có lẽ vì tác động phản hồi âm của estrogen từ nhau thai đã bị loại bỏ. LH được tiết ra theo nhịp trong giai đoạn sau sinh này, thường được gọi là dậy thì mini. Sau hoạt động sau sinh này, trục HPG trở nên tương đối không hoạt động ở trẻ em trong độ tuổi từ 2 đến 8-9 tuổi.
Quá trình chuyển đổi từ trạng thái tương đối yên lặng tiền dậy thì sang mô hình bài tiết GnRH của tuổi vị thành niên là một quá trình dần dần chứ không phải đột ngột. Sự tiết LH và FSH theo nhịp đã được phát hiện ở trẻ em bình thường ngay từ 4 tuổi. Trong suốt thời thơ ấu, sự bài tiết GnRH dường như trải qua những lần tăng nhỏ nhưng tiến triển cho đến khi bắt đầu dậy thì, khi đó sự bài tiết GnRH tăng lên, đầu tiên vào ban đêm và cuối cùng là trong suốt cả ngày. Do bản chất từng đợt của sự bài tiết gonadotropin, một lần xác định gonadotropin đơn lẻ không cung cấp thông tin về động lực bài tiết của các hormone này. Tuy nhiên, các xét nghiệm thế hệ thứ ba hiện đại đủ nhạy để chỉ ra sự khởi đầu của dậy thì trong các mẫu cơ bản không kích thích đơn lẻ.
Sự thay đổi sinh học đầu tiên cho thấy trục HPG đang được tái hoạt hóa ở tuổi dậy thì là sự gia tăng các nhịp LH về đêm ở trẻ em; sự tái hoạt hóa này là cận lâm sàng và bắt đầu trước khi phát triển lâm sàng của giai đoạn sinh dục Tanner 2. Do đó, giai đoạn này có thể được xem là sự khởi đầu về mặt nội tiết của dậy thì. Sự khác biệt giữa mức LH ban ngày và ban đêm vẫn tồn tại cho đến các giai đoạn muộn của dậy thì nhưng biến mất vào đầu tuổi trưởng thành. Trong quá trình tái hoạt hóa trục này, có sự phát triển dần dần của một sự tương tác năng động giữa việc sản xuất GnRH và gonadotropin ở trung ương và việc sản xuất steroid sinh dục của tuyến sinh dục. Có sự trưởng thành tiến triển của các vòng phản hồi âm nhưng đồng thời động lực ức chế tiền dậy thì từ hệ thần kinh trung ương cũng giảm dần, và phản hồi dương tăng cường tạm thời là kết quả của việc tăng sản xuất steroid sinh dục của tuyến sinh dục.
Trong giai đoạn tương đối yên lặng, testosterone và estrogen cũng có thể đo được trong tuần hoàn bằng các xét nghiệm nhạy, cho thấy hoạt động thấp nhưng xác định của tuyến sinh dục tiền dậy thì. Tuy nhiên, sự đóng góp của tuyến sinh dục vào việc ức chế hệ thống hạ đồi-tuyến yên xảy ra muộn hơn, chỉ có hiệu lực vào giữa tuổi dậy thì, và cuối cùng trở nên chiếm ưu thế so với động lực phản hồi ức chế trung ương (Hình 18.4). Cả mức LH và FSH trung bình đều tăng trong suốt quá trình phát triển dậy thì, mặc dù LH tăng ở mức độ lớn hơn, có lẽ do sự khác biệt trong cơ chế phản hồi cho hai hormone này. Sự gia tăng này là kết quả của cả sự gia tăng mức LH và FSH cơ bản, và số lượng và biên độ lớn hơn của các đỉnh LH.
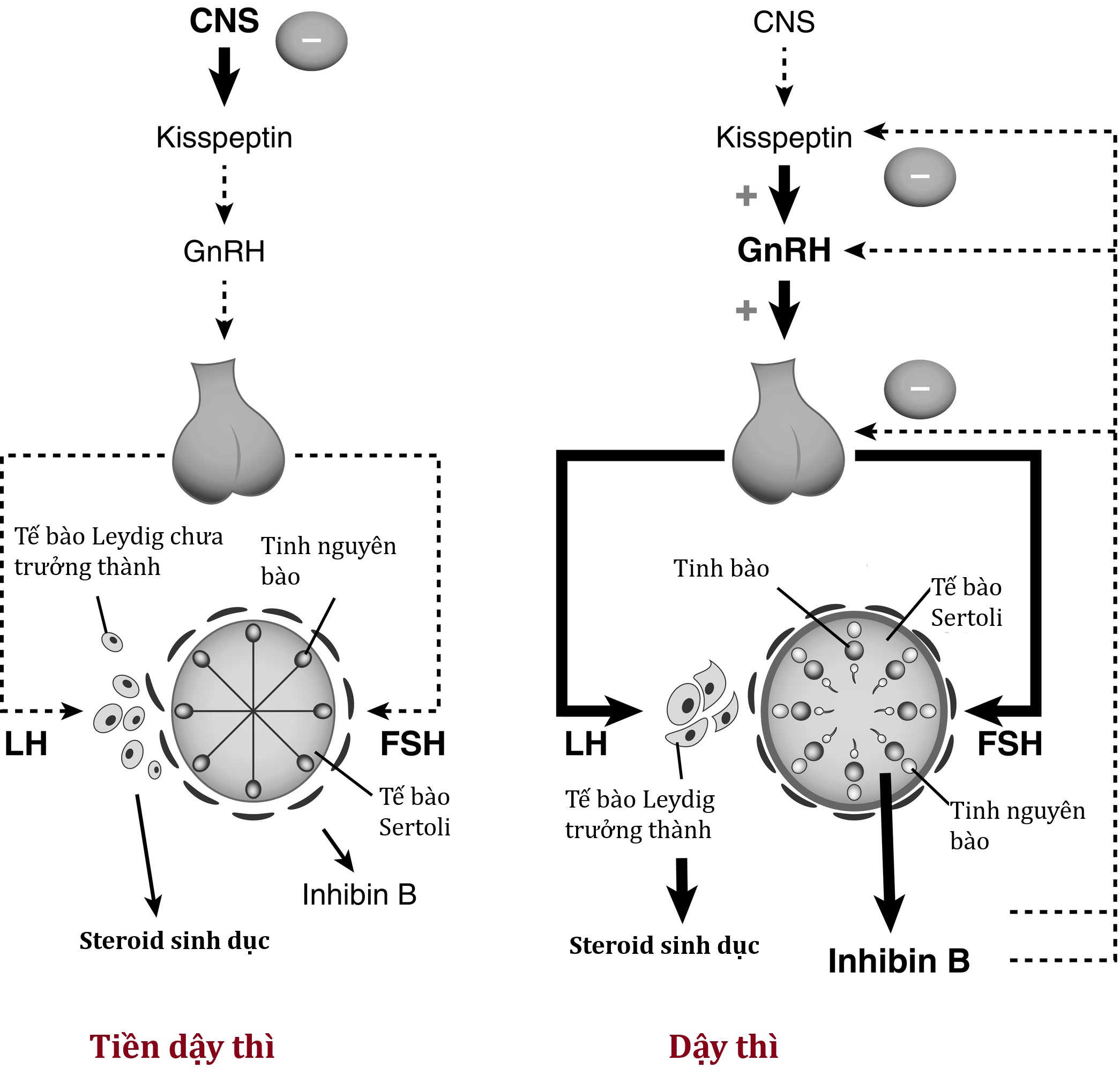
Hình 18.4 Tổng quan về trục hạ đồi-tuyến yên-tuyến sinh dục (HPG) trước và sau dậy thì. Mặc dù các sản phẩm của tinh hoàn, chẳng hạn như inhibin, đóng một vai trò nhỏ trong việc điều hòa trục HPG trước dậy thì, phần lớn sự suy giảm của trục HPG sau giai đoạn sơ sinh và cho đến khi bắt đầu dậy thì (bảng trái) xuất phát từ sự ức chế trung ương. Cơ sở cho sự ức chế đó chưa được hiểu đầy đủ cũng như cơ sở cho sự suy giảm của nó, dẫn đến sự xuất hiện của hoạt hóa trung ương (bảng phải), tăng tiết hormone giải phóng gonadotropin (GnRH), và sự khởi đầu của dậy thì. Khi quá trình phát triển dậy thì tiến triển, inhibin B được tiết ra từ các tế bào Sertoli của tinh hoàn trưởng thành (bảng phải) có vai trò đáng kể hơn trong việc điều hòa/ức chế hoạt động hạ đồi-tuyến yên. Độ đậm của các đường (từ chấm chấm đến liền mảnh đến liền đậm) cho biết cường độ tăng dần của tín hiệu cụ thể. LH, hormone hoàng thể hóa; FSH, hormone kích thích nang trứng.
Ở các bé trai trong tuổi dậy thì, nồng độ testosterone trong huyết tương tăng lên đáng kể. Sự gia tăng kích thước tinh hoàn ở tuổi dậy thì chủ yếu là do số lượng tế bào mầm tăng sinh và biệt hóa tăng lên, và ở mức độ thấp hơn là sự gia tăng các tế bào Sertoli. Trong giai đoạn đầu và giữa tuổi dậy thì, có một nhịp sinh học rõ rệt với đỉnh testosterone có thể đo được vào buổi sáng, nhưng điều này ít rõ rệt hơn ở giai đoạn sau của dậy thì và giảm dần theo tuổi, có lẽ do tỷ lệ ngày-đêm của gonadotropin giảm.
Sự tái hoạt hóa sinh học của trục hướng sinh dục xảy ra sớm hơn ở nữ so với nam, và động lực của sự tái hoạt hóa trục hướng sinh dục không giống hệt nhau ở hai giới. Sự bài tiết testosterone tăng lên ngay sau khi nồng độ LH và FSH trong huyết tương tăng. Ở nữ giới, estradiol tăng cùng với sự gia tăng LH và FSH. Sau đó, một cuộc đối thoại nội tiết giữa tuyến sinh dục, vùng dưới đồi và tuyến yên góp phần vào sự hoạt hóa tiến triển của trục hướng sinh dục, cho đến khi xảy ra đỉnh LH gây rụng trứng ở nữ. Cơ sở cho sự lưỡng hình giới tính này chưa rõ ràng và có thể liên quan đến sự khác biệt trong sản xuất hormone tuyến sinh dục và cũng có thể là một đặc điểm của sự lưỡng hình giới tính của não. Cũng có một số dữ liệu cho thấy rằng mặc dù hầu hết các gen điều chỉnh thời điểm dậy thì tương tự ở nam và nữ, có một tập hợp nhỏ có thể có tác động đặc hiệu theo giới tính.
Cơ chế sinh lý
Sự hiểu biết của chúng ta về sự hoạt hóa của trục hướng sinh dục vào cuối giai đoạn tiền dậy thì vẫn chưa hoàn chỉnh nhưng đã có những tiến bộ ở một số lĩnh vực (xem phần thảo luận sau). Hoạt động của nơron GnRH chịu sự kiểm soát của một số chất dẫn truyền thần kinh và neuropeptide, như đã mô tả trước đó, và sự khởi đầu của dậy thì được kích hoạt bởi sự suy giảm các tín hiệu ức chế này và sự khuếch đại các tín hiệu đầu vào kích thích, dẫn đến tăng tần số và biên độ của các nhịp GnRH. Các cơ chế nội tiết thần kinh kiểm soát sự hoạt hóa của trục hướng sinh dục ở thai nhi, cũng như trong giai đoạn “dậy thì mini” ít được hiểu rõ hơn. Tương tự, bản chất chính xác của cơ chế hãm hoạt động trong giai đoạn tiền dậy thì vẫn chưa được biết.
Một thay đổi ở tuổi dậy thì là sự thay đổi trong sự cân bằng của tín hiệu GABA-glutamate trong não. Một thay đổi khác là sự gia tăng mật độ gai đuôi gai và sự đơn giản hóa cấu trúc đuôi gai của các nơron GnRH. Thay đổi thứ ba là sự gia tăng tín hiệu kisspeptin ở vùng dưới đồi, được gây ra bởi sự gia tăng tổng hợp kisspeptin, cũng như sự tăng đáp ứng của các nơron GnRH với sự kích thích của kisspeptin. Mặc dù chủ yếu được mô tả ở chuột, mô hình này, được bảo tồn tốt trong quá trình tiến hóa, có lẽ cũng đúng ở khỉ cũng như ở người.
Các cơ chế chịu trách nhiệm cho sự gia tăng sinh tổng hợp kisspeptin ở vùng dưới đồi vào cuối giai đoạn vị thành niên vẫn chưa được biết. Dữ liệu chỉ ra sự điều hòa của vùng dưới đồi thông qua một mạng lưới gen phân cấp (xem Hình 18.2) chủ yếu đến từ một phương pháp tiếp cận sinh học hệ thống và các mô hình động vật, với ít dữ liệu từ các đối tượng người cho đến nay; tuy nhiên, việc tích hợp các phát hiện từ các nghiên cứu liên kết toàn bộ bộ gen của con người có khả năng sẽ làm phong phú thêm các mô hình này. Các chất điều hòa phiên mã ứng cử viên đã được xác định thông qua các phương pháp tiếp cận này bao gồm yếu tố phiên mã octamer 2 (Oct-2), yếu tố phiên mã tuyến giáp-1 (TTF-1), và yếu tố tăng cường ở tuổi dậy thì 1 (EAP1). TTF-1 là một gen homeobox giúp tăng cường biểu hiện GnRH. Biểu hiện của TTF-1 tăng lên ở khỉ rhesus dậy thì. Oct-2 là một chất điều hòa phiên mã của họ gen chứa miền POU của các gen chứa homeobox. RNA thông tin (mRNA) của Oct-2 được điều hòa tăng ở vùng dưới đồi của các loài gặm nhấm vị thành niên; việc ngăn chặn sự tổng hợp Oct-2 làm trì hoãn tuổi rụng trứng lần đầu; và các tổn thương vùng dưới đồi gây ra dậy thì sớm (ví dụ, hamartoma vùng dưới đồi), kích hoạt biểu hiện Oct-2. Mức mRNA của EAP1 cũng tăng lên ở vùng dưới đồi của các loài linh trưởng và gặm nhấm trong tuổi dậy thì, EAP1 kích hoạt chuyển mã promoter GnRH, và việc loại bỏ EAP1 bằng RNA can thiệp nhỏ (siRNA) gây ra dậy thì muộn (DP) và phá vỡ chu kỳ động dục ở các loài gặm nhấm.
Dữ liệu gần đây đã nhấn mạnh tầm quan trọng của một chương trình di truyền kiểm soát sự biểu hiện của Kiss1. Sự can thiệp của các protein phức hợp polycomb, EED và Cbx7, trong việc ức chế phiên mã của Kiss1 gần đây đã được tiết lộ. Sự biểu hiện của các gen này trong giai đoạn tiền dậy thì giảm dần cùng với sự tăng methyl hóa các promoter của chúng. Do đó, sự liên kết của EED trên promoter Kiss1 giảm ở tuổi dậy thì. Sự ức chế của việc ức chế Kiss1 cũng tương quan với sự giảm biểu hiện của các yếu tố phiên mã có mô-típ ngón tay kẽm. Ngoài ra, một sự chuyển đổi microRNA đã được đề xuất để điều chỉnh sự gia tăng tổng hợp GnRH1, xảy ra trong giai đoạn vị thành niên ở các nơron GnRH. Do đó, sự khởi đầu của dậy thì từ vùng dưới đồi là kết quả của một mạng lưới phức tạp các yếu tố phiên mã chủ yếu hoạt động như những chất ức chế phiên mã Kiss1 và GnRH1.
Khái niệm rằng dậy thì là kết quả của sự biến mất của sự ức chế trục hướng sinh dục cũng được hỗ trợ bởi việc mô tả các đột biến mất chức năng của MKRN3 và DLK1 trong dậy thì sớm trung ương có tính gia đình (CPP, được thảo luận chi tiết trong phần “Dậy thì sớm” sau). Vị trí hoạt động của các yếu tố này trong mạng lưới phân cấp của các gen kiểm soát kisspeptin vẫn chưa được xác định.
Thay đổi cơ thể
Ở bé trai, phát hiện thể chất đầu tiên đánh dấu sự khởi đầu của dậy thì là sự thay đổi từ giai đoạn sinh dục Tanner G1 sang G2, bao gồm sự to ra của tinh hoàn (tức là, đạt được thể tích ≥ 4 mL hoặc chiều dài tinh hoàn ≥ 25 mm). Ban đầu Marshall và Tanner đã báo cáo tuổi khởi phát dậy thì trung bình (độ lệch chuẩn [SD]) ở bé trai là 11,64 (1,07) tuổi. Các giai đoạn dậy thì này (Hình 18.5) dựa trên các quan sát chụp ảnh theo chiều dọc về sự phát triển sinh dục của một mẫu tương đối nhỏ gồm 228 bé trai sống trong một nhà trẻ. Mặc dù tính đại diện có thể kém của mẫu này, các nghiên cứu ở Thụy Sĩ, Hoa Kỳ, và Đan Mạch đã báo cáo tuổi khởi phát dậy thì trung bình gần như tương tự.
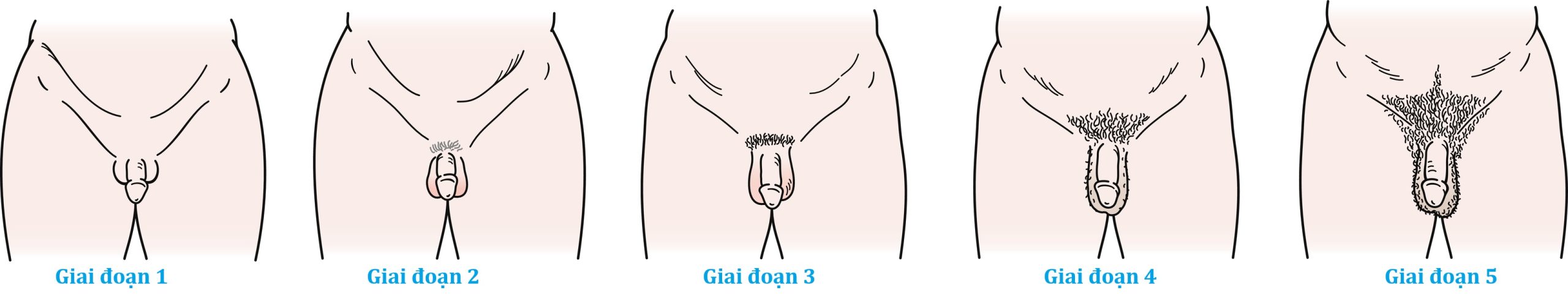
Hình 18.5 Các giai đoạn Tanner ở nam giới. Ở bé trai, sự phát triển sinh dục được đánh giá từ 1 (tiền dậy thì) đến 5 (trưởng thành); giai đoạn 2 đánh dấu sự khởi đầu của sự phát triển dậy thì và được đặc trưng bởi sự to ra của bìu và tinh hoàn và bởi sự thay đổi kết cấu và đỏ lên của da bìu. Các giai đoạn lông mu được đánh giá từ 1 (tiền dậy thì, không có lông mu) đến 5 (trưởng thành), và giai đoạn 2 đánh dấu sự khởi đầu của sự phát triển lông mu. Mặc dù lông mu và sự phát triển sinh dục được thể hiện đồng bộ trong hình minh họa, chúng không nhất thiết phải đi cùng nhau và nên được chấm điểm riêng. (Sửa đổi từ Halpern, B., và cộng sự (1996). Preparticipation sports physicals. In: Zachazewski, J.E., Magee, D.J., Quillen, W.S., editors: Athletic Injuries and Rehabilitation, Philadelphia, WB Saunders, p. 855.)
Mặc dù tuổi khởi phát trung bình có thể khá đồng đều giữa các quần thể, phạm vi tuổi khởi phát dậy thì ở thanh thiếu niên bình thường, khỏe mạnh rất đa dạng. Một số tình trạng bệnh lý có thể ảnh hưởng thêm đến thời điểm dậy thì một cách trực tiếp hoặc gián tiếp và có thể góp phần vào sự chênh lệch này, nhưng phần lớn sự thay đổi trong thời điểm dậy thì không thể quy cho các rối loạn lâm sàng. Khoảng 95% bé trai trải qua sự khởi đầu của phát triển sinh dục trong khoảng từ 9,5 đến 13,5 tuổi, và những dữ liệu này đã dẫn đến định nghĩa truyền thống về dậy thì sớm ở bé trai là sự phát triển các đặc điểm sinh dục phụ trước 9 tuổi và dậy thì muộn là không có sự to ra của tinh hoàn ở tuổi 14.
Sự phát triển các đặc điểm sinh dục phụ là kết quả của cả hoạt hóa tuyến sinh dục và hoạt hóa tuyến thượng thận. Hoạt hóa tuyến thượng thận đề cập đến sự trưởng thành của lớp lưới của tuyến thượng thận, dẫn đến tăng sản xuất các androgen tuyến thượng thận dehydroepiandrosterone (DHEA) và androstenedione, cũng như chất chuyển hóa tương đối không hoạt động DHEA sulfate (DHEA-S). Các androgen tuyến thượng thận này, cùng với androgen tinh hoàn, góp phần vào các đặc điểm sinh dục phụ, chẳng hạn như lông mu (pubarche), lông nách, mùi cơ thể từ tuyến apocrine và mụn trứng cá. Giống như hoạt hóa tuyến sinh dục, sự khởi đầu của hoạt hóa tuyến thượng thận dường như là một quá trình trưởng thành dần dần, tiến triển bắt đầu từ thời thơ ấu và được đánh dấu bằng sự gia tăng hơn nữa của việc sản xuất androgen tuyến thượng thận vào khoảng thời gian dậy thì. Mặc dù hoạt hóa tuyến thượng thận và hoạt hóa tuyến sinh dục thường chồng chéo, chúng là các quá trình riêng biệt được điều chỉnh độc lập. Các yếu tố kích hoạt hoạt hóa tuyến thượng thận vẫn chưa được biết; tuy nhiên, những thay đổi về trọng lượng cơ thể và chỉ số khối cơ thể (BMI), cũng như sinh lý trong tử cung và sơ sinh, có khả năng điều chỉnh quá trình phát triển này, có lẽ cùng với việc sản xuất cortisol trong tuyến thượng thận.
Điều hòa thời điểm dậy thì
Xu hướng thế kỷ trong thời điểm dậy thì
Tuổi có kinh trung bình ở châu Âu giữa thế kỷ 19 được báo cáo là từ 17 đến 18 tuổi. Bắt đầu từ cuối thế kỷ 19 đến giữa thế kỷ 20, đã có báo cáo về sự giảm dần tuổi dậy thì, sau đó xu hướng này dường như đã chậm lại. Phần lớn sự thay đổi này trong thời điểm dậy thì có khả năng là kết quả của vệ sinh và dinh dưỡng tốt hơn liên quan đến sự ổn định kinh tế xã hội ngày càng tăng.
Sự sụt giảm gần đây hơn về tuổi dậy thì được chứng minh một cách thuyết phục hơn ở nữ giới so với nam giới. Vào giữa những năm 1990, dữ liệu từ Khảo sát Kiểm tra Sức khỏe và Dinh dưỡng Quốc gia lần thứ ba (NHANES III), nơi xếp hạng bộ phận sinh dục được thực hiện bằng cách kiểm tra trực quan, đã báo cáo tuổi dậy thì sớm hơn ở cả nam và nữ so với những gì đã được báo cáo trước đây từ Hoa Kỳ. Sử dụng ngưỡng cắt truyền thống là 9 tuổi, những dữ liệu này cho thấy rằng số lượng bé trai được phân loại là dậy thì sớm đã tăng lên. Tuy nhiên, do thiếu dữ liệu về khởi phát dậy thì trong nghiên cứu dựa trên dân số trước đó (Khảo sát Kiểm tra Sức khỏe Quốc gia lần thứ ba [NHES III]), một số tranh cãi vẫn còn về cách giải thích các phát hiện của NHANES III.
Hơn nữa, các câu hỏi đã được đặt ra về các tiêu chí được sử dụng để phân loại giai đoạn sinh dục trong NHANES III. Một phân tích xu hướng thế kỷ sau đó giữa NHES III (thiếu dữ liệu từ các giai đoạn dậy thì sớm) và NHANES III không tìm thấy bằng chứng rõ ràng hỗ trợ tuổi dậy thì sớm hơn, mặc dù có một số dấu hiệu ở các bé trai da trắng không phải gốc Tây Ban Nha. Dữ liệu này cũng đã được một hội đồng chuyên gia xem xét, kết luận rằng dữ liệu hiện có không đủ về chất lượng và số lượng để xác nhận sự thay đổi trong thời điểm dậy thì ở các bé trai Hoa Kỳ. Cùng lúc đó ở châu Âu, so với các nghiên cứu NHANES III, một số dữ liệu thậm chí còn báo cáo cho thấy tuổi khởi phát dậy thì muộn hơn ở các bé trai.
Xu hướng thế kỷ về thời điểm đã được đánh giá trong một vài nghiên cứu châu Âu trong các quần thể cụ thể. Các nghiên cứu trước đó không ủng hộ một sự thay đổi đủ lớn trong tuổi khởi phát dậy thì ở các bé trai từ giữa những năm 1960 đến cuối những năm 1990 để đảm bảo thay đổi các định nghĩa về tuổi cho dậy thì sớm và dậy thì muộn. Tuy nhiên, dữ liệu gần đây nhất từ Copenhagen, so sánh thời điểm dậy thì ở các bé trai được đánh giá trong khoảng thời gian từ năm 2006 đến 2008 so với một nhóm được đánh giá trong khoảng thời gian từ năm 1991 đến 1993, đã báo cáo tuổi khởi phát dậy thì trung bình sớm hơn (11,62 so với 11,92 tuổi).
Tóm lại, dữ liệu còn mâu thuẫn nhưng có khả năng có một gợi ý chung rằng dậy thì có thể xảy ra sớm hơn ở các bé trai so với trước đây. Tuy nhiên, sự thay đổi không rõ rệt như ở các bé gái, và các ngưỡng tuổi được sử dụng để xác định các rối loạn dậy thì vẫn chưa được thay đổi một cách thống nhất.
Đóng góp của di truyền vào sự biến thiên trong dậy thì bình thường
Mặc dù các cơ chế chính xác kích hoạt dậy thì vẫn chưa được biết, nhưng đã được xác lập rõ ràng rằng thời điểm dậy thì bị ảnh hưởng bởi cả yếu tố di truyền và môi trường. Bằng chứng về sự đóng góp của di truyền được cung cấp bởi các mối tương quan về thời điểm trong các gia đình và giữa các cặp song sinh cùng trứng. Điều quan trọng cần lưu ý là thành phần di truyền này không loại trừ vai trò quan trọng của các ảnh hưởng môi trường; thực tế, di truyền đơn thuần không thể giải thích các xu hướng thế kỷ trong thời điểm dậy thì. Tuy nhiên, thành phần di truyền mạnh mẽ cung cấp một cơ hội để xác định các yếu tố điều chỉnh thời điểm dậy thì bình thường trong dân số chung. Các phương pháp được sử dụng để xác định các yếu tố di truyền cụ thể bao gồm các nghiên cứu gen ứng cử viên và các nghiên cứu liên kết toàn bộ bộ gen (GWA).
Các nghiên cứu dựa trên gen ứng cử viên
Một cách tiếp cận để xác định các biến thể ảnh hưởng đến các đặc điểm phức tạp, chẳng hạn như thời điểm dậy thì trong dân số chung, là các nghiên cứu liên kết dựa trên gen ứng cử viên, nhằm chứng minh tỷ lệ hiện mắc cao hơn của các biến thể di truyền trong một hoặc nhiều gen được xác định trước ở các trường hợp bệnh so với nhóm chứng.
Trong một nghiên cứu liên kết kiểm tra mối liên quan giữa các biến thể phổ biến trong 10 gen liên quan đến suy sinh dục do giảm gonadotropin (HH) (GNRH1, GNRHR, KISS1R/GPR54, KISS1, LEP, LEPR, FGFR1, KAL1, PROK2, và PROKR2) và tuổi có kinh, chỉ có các mối liên quan có ý nghĩa danh nghĩa giữa các đa hình đơn nucleotide (SNP) trong một số gen và tuổi có kinh được xác định.
Các công trình khác tương tự cũng không xác định được mối liên quan giữa các SNP trong GNRH1 và GNRHR hoặc LEP và LEPR và những thay đổi trong thời điểm dậy thì. Tuy nhiên, các nghiên cứu GWA quy mô lớn (xem phần sau) đã chứng minh rằng các biến thể trong một số gen này thực sự ảnh hưởng đến thời điểm dậy thì và đã tiết lộ kích thước ảnh hưởng tương đối nhỏ của các biến thể này, do đó các nghiên cứu gen ứng cử viên trước đó có khả năng không đủ năng lực để phát hiện các kích thước ảnh hưởng nhỏ này.
Các nghiên cứu liên kết toàn bộ bộ gen
Trong các nghiên cứu GWA quy mô lớn, tuổi có kinh đã là dấu hiệu được sử dụng phổ biến nhất về thời điểm dậy thì. Các nghiên cứu GWA đầu tiên về tuổi có kinh liên quan đến từ 17.000 đến 25.000 phụ nữ, tất cả đều thuộc gốc châu Âu. Các biến thể phổ biến trong LIN28B có liên quan đến tuổi có kinh trong bốn nghiên cứu GWA độc lập và một phân tích gộp. LIN28B là một tương đồng ở người của lin-28, mà ở Caenorhabditis elegans kiểm soát tốc độ tiến triển từ các giai đoạn ấu trùng đến sự hình thành lớp biểu bì trưởng thành, cho thấy sự bảo tồn của các cơ chế điều hòa micro-RNA cụ thể liên quan đến thời điểm phát triển. Trong mỗi trường hợp, tuổi có kinh (AAM) đã được phân tích, nhưng trong một nghiên cứu, các kiểu hình bổ sung (phát triển vú ở nữ, vỡ giọng và phát triển lông mu ở nam, và nhịp độ tăng trưởng chiều cao ở cả nam và nữ) được phát hiện có liên quan đến các biến thể trong LIN28B, cho thấy rằng LIN28B ảnh hưởng đến thời điểm dậy thì nói chung, không chỉ thời điểm có kinh, và việc kiểm soát thời điểm dậy thì ở nam và nữ có chung một số yếu tố, mặc dù các nghiên cứu sau đó trên chuột cho thấy con đường này cũng có thể có tác động đặc hiệu theo giới tính. Kích thước ảnh hưởng trong các nghiên cứu GWA được ước tính là khoảng 1,2 tháng có kinh sớm hơn cho mỗi alen ảnh hưởng đối với LIN28B. Một locus có kinh thứ hai đã được xác định trong hai trong số bốn nghiên cứu tại 9q31.2. Sinh học đằng sau locus tại 9q31.2 vẫn chưa được biết, nhưng kích thước ảnh hưởng của nó tương tự như locus trong/gần LIN28B. Các SNP liên quan nằm trong một vùng liên gen không có gen ứng cử viên rõ ràng nào gần đó. Gen gần nhất là TMEM38B, một gen protein xuyên màng, nằm cách tín hiệu tại 9q31.2 khoảng 400 kb. Mặc dù các nghiên cứu này mang tính đột phá, các locus LIN28B và 9q31.2 cùng nhau chỉ giải thích được 0,6% sự biến thiên về tuổi có kinh.
Các nghiên cứu GWA sau đó đã sử dụng các cỡ mẫu ngày càng lớn hơn, dẫn đến sự gia tăng năng lực thống kê và xác định được nhiều locus di truyền hơn ảnh hưởng đến thời điểm dậy thì.
Nghiên cứu GWA gần đây nhất về tuổi có kinh đã nghiên cứu hơn 350.000 phụ nữ gốc châu Âu và xác định được 389 locus độc lập, có ý nghĩa trên toàn bộ bộ gen ảnh hưởng đến thời điểm dậy thì. Nhìn chung, các locus này được ước tính chiếm 7,4% tổng số biến thiên về thời điểm có kinh. Có sự làm giàu đáng kể về biểu hiện của các gen liên quan đến các locus này trong não, phù hợp với giả thuyết rằng thời điểm dậy thì chủ yếu được điều hòa bởi các yếu tố vùng dưới đồi.
Một nghiên cứu GWA cũng đã được thực hiện trên tuổi vỡ giọng ở hơn 55.000 nam giới và xác định được 11 locus có ý nghĩa trên toàn bộ bộ gen. Mười trong số 11 locus này cũng đã được chứng minh là có liên quan đáng kể đến tuổi có kinh, và locus thứ mười một (ANOS1 trên nhiễm sắc thể X, cũng liên quan đến hội chứng Kallmann liên kết X, sẽ được thảo luận thêm sau) gần đạt được ý nghĩa trên toàn bộ bộ gen. Hơn nữa, khi phân tích tất cả các biến thể phổ biến trên toàn bộ bộ gen, gần như tất cả các locus đều có tác động tương tự đối với cả tuổi vỡ giọng và tuổi có kinh. Do đó, các cơ chế điều chỉnh thời điểm dậy thì ở nữ và nam dường như phần lớn, mặc dù không hoàn toàn, chồng chéo lên nhau.
Các nghiên cứu GWA được thiết kế để đánh giá sự đóng góp của các biến thể di truyền phổ biến vào một kiểu hình cụ thể. Tuy nhiên, có khả năng các hình thức di truyền khác cũng là cơ sở của tình trạng chậm tăng trưởng và dậy thì thể tạng (CDGP), bao gồm các biến thể hiếm hơn (tần suất < 5% trong dân số chung) với các ảnh hưởng kiểu hình lớn hoặc thậm chí nhỏ; tương tác (epistasis) giữa các biến thể trong một gen đơn lẻ hoặc trong nhiều gen (oligogenicity); biến đổi cấu trúc, chẳng hạn như các biến thể số lượng bản sao; và biểu sinh. Thực tế, một số cơ chế này đã được xác định là nguyên nhân gây vô kinh do vùng dưới đồi.
Các yếu tố khác điều chỉnh thời điểm dậy thì
Mặc dù những tiến bộ di truyền này rất thú vị, các yếu tố di truyền đơn thuần không thể giải thích những thay đổi thế kỷ được báo cáo trong thời điểm dậy thì đã xảy ra từ cuối thế kỷ 20. Rõ ràng, những thay đổi trong các yếu tố môi trường cũng phải có liên quan, dù là các yếu tố điều hòa độc lập hay thông qua các tương tác gen-môi trường (G X E). Các biến số, chẳng hạn như tăng béo phì, kháng insulin, ít vận động thể chất, các yếu tố tâm lý, thay đổi thói quen ăn uống và các hóa chất gây rối loạn nội tiết đều đã được liên hệ là các yếu tố môi trường ảnh hưởng đến thời điểm dậy thì.
Ảnh hưởng của chỉ số khối cơ thể đến thời điểm dậy thì
Trong số trẻ em Mỹ da trắng từ 6 đến 11 tuổi, tỷ lệ béo phì đã tăng từ khoảng 5% trong giai đoạn 1963-1965 lên 12% trong giai đoạn 1999-2000. Khả năng tỷ lệ béo phì ngày càng tăng góp phần vào xu hướng thế kỷ hướng tới khởi phát dậy thì sớm ban đầu được nhấn mạnh vào năm 1997. Tuy nhiên, mặc dù có bằng chứng mạnh mẽ ở nữ giới ủng hộ mối liên hệ giữa tăng béo phì và khởi phát sớm các dấu hiệu dậy thì, dữ liệu ở nam giới vẫn còn hơi mơ hồ, với BMI tăng có liên quan đến dậy thì sớm hơn trong hầu hết các nghiên cứu, nhưng một số nghiên cứu lại cho thấy béo phì không liên quan đến sự thay đổi thời điểm dậy thì hoặc thậm chí là dậy thì muộn.
Ví dụ, trong một nghiên cứu trên 463 bé trai trong dàn hợp xướng ở Đan Mạch, một xu hướng giảm đáng kể về tuổi vỡ giọng đã được tìm thấy trong khoảng thời gian 10 năm (từ 14 tuổi xuống 13,7 tuổi). Tuổi vỡ giọng khác biệt đáng kể giữa các bé trai ở các nhóm tứ phân vị BMI tiền dậy thì khác nhau, và một xu hướng hướng tới vỡ giọng sớm hơn có liên quan đến việc tăng SDS BMI. Các bé trai trong nhóm tứ phân vị nặng nhất lúc 8 tuổi có khả năng vỡ giọng sớm hơn so với những bé trong nhóm gầy nhất, cho thấy mối quan hệ giữa BMI tiền dậy thì và thời điểm dậy thì ở các bé trai.
Trong nghiên cứu Copenhagen được thảo luận trước đó, các xu hướng thế kỷ trong khởi phát dậy thì trong khoảng thời gian 15 năm đã được đánh giá cũng như mối quan hệ của chúng với BMI ở các bé trai. Trong tổng số 1528 bé trai, khởi phát dậy thì, được định nghĩa là tuổi đạt được thể tích tinh hoàn lớn hơn 3 mL, xảy ra sớm hơn 3 tháng trong giai đoạn 2006-2008 so với giai đoạn 1991-1993. Điểm độ lệch chuẩn BMI cũng tăng đáng kể từ năm 1991-1993 đến 2006-2008. Điều thú vị là, tuổi khởi phát dậy thì không còn khác biệt đáng kể giữa các giai đoạn nghiên cứu sau khi điều chỉnh theo BMI, cho thấy rằng sự sụt giảm quan sát được về tuổi khởi phát dậy thì có liên quan ít nhất một phần đến sự gia tăng BMI.
Trong một nghiên cứu từ Jamaica, ảnh hưởng của thành phần cơ thể đến thời điểm khởi phát dậy thì đã được đánh giá ở cả nam và nữ. Khối lượng mỡ tăng cao ở tuổi 8 có liên quan đến dậy thì sớm ở cả hai giới. Những dữ liệu này ủng hộ giả thuyết rằng sự tăng trưởng nhanh trong suốt thời thơ ấu, đặc biệt là sự tích tụ khối lượng mỡ, có liên quan đến sự phát triển dậy thì sớm.
Nhưng không phải tất cả các nghiên cứu đều đồng ý. Ví dụ, trong một nghiên cứu từ Đức, trọng lượng cơ thể, chiều cao, tốc độ tăng trưởng chiều cao đỉnh và các giai đoạn dậy thì đã được đánh giá ở 1421 trẻ em quanh tuổi dậy thì. Trái ngược với những phát hiện từ các nghiên cứu trước đó, các nhà nghiên cứu không tìm thấy sự khác biệt đáng kể về giai đoạn lông mu trung bình ở nữ và nam bị béo phì khi so sánh với trẻ gầy hoặc có cân nặng bình thường. Khi phân tích chỉ giới hạn ở trẻ em ở giai đoạn lông mu 2, tuổi ở giai đoạn này được phát hiện không khác biệt đáng kể giữa các cá nhân có cân nặng bình thường và béo phì. Ở các bé trai, thể tích tinh hoàn ở một độ tuổi nhất định cũng tương tự ở tất cả các nhóm cân nặng. Tại Hoa Kỳ, một đoàn hệ các bé trai béo phì bị dậy thì muộn cũng đã được mô tả.
Tóm lại, nghiên cứu cho đến nay cho thấy sự không nhất quán trong cách béo phì ảnh hưởng đến thời điểm dậy thì ở các bé trai. Dữ liệu gần đây từ một nghiên cứu tại Hoa Kỳ có thể làm sáng tỏ lý do cho một số sự không nhất quán giữa các nghiên cứu. Khoảng 3872 bé trai được chia dựa trên BMI thành ba loại (cân nặng bình thường, thừa cân và béo phì). Dựa trên sự phát triển sinh dục, dậy thì ở các bé trai da trắng và người Mỹ gốc Phi xảy ra sớm hơn ở nhóm thừa cân so với nhóm cân nặng bình thường nhưng muộn hơn ở nhóm béo phì so với nhóm thừa cân. Mối quan hệ này không được quan sát thấy ở thanh niên gốc Tây Ban Nha. Những dữ liệu này cho thấy rằng mối quan hệ giữa dậy thì sớm hơn và trọng lượng cơ thể có thể không tuyến tính ở các bé trai và có thể khác nhau theo nhóm dân tộc/chủng tộc.
Ảnh hưởng của các hóa chất gây rối loạn nội tiết
Một số bằng chứng ủng hộ mối liên quan giữa thời điểm dậy thì của con người và việc tiếp xúc với các yếu tố điều chỉnh môi trường, mặc dù phần lớn dữ liệu liên quan đến nữ giới. Ví dụ, có kinh và mọc lông mu sớm hơn có liên quan đến việc tiếp xúc với biphenyl đa brom hóa (PBB) và dichlorodiphenyl dichloroethene (DDT), trong khi sự phát triển vú và lông mu chậm lại, cũng như có kinh muộn hơn có liên quan đến việc tiếp xúc với chì. Ngoài ra, nồng độ một loại độc tố nấm (zearalenone) trong huyết thanh tăng cao đã được báo cáo ở các bé gái bị dậy thì sớm.
Một số nghiên cứu ở các bé trai cũng đã được báo cáo. Trong số các nghiên cứu mạnh nhất là một đánh giá theo chiều dọc về sự tăng trưởng và thời điểm dậy thì trong một đoàn hệ khoảng 500 bé trai ở Nga. Kết quả từ nghiên cứu này gần đây đã được tóm tắt, với dữ liệu cho thấy rằng việc tiếp xúc tiền dậy thì với các biphenyl đa clo hóa không giống dioxin làm tăng tốc độ dậy thì, trong khi nồng độ thuốc trừ sâu, các hợp chất giống dioxin, thuốc trừ sâu organochlorine và chì làm chậm quá trình dậy thì. Các nghiên cứu khác cho thấy rằng việc tiếp xúc nhiều hơn với thuốc trừ sâu có liên quan đến tinh hoàn ẩn hoặc lỗ tiểu lệch thấp.
Mức độ mà đây là các mối liên quan so với các mối quan hệ nhân quả vẫn chưa được biết đầy đủ, cũng như các cơ chế cơ bản. Những ảnh hưởng của việc tiếp xúc này trong dân số chung so với các ví dụ riêng lẻ về các bất thường liên quan cũng không rõ ràng. Chắc chắn cần có thêm nghiên cứu trong lĩnh vực này.
Dậy thì sớm
Theo truyền thống, sự khởi đầu của các đặc điểm sinh dục phụ ở một bé trai trước 9 tuổi được định nghĩa là sớm, trong khi việc không có sự to ra của tinh hoàn ở tuổi 14 được phân loại là dậy thì muộn. Trong các cơ sở lâm sàng, các bé trai ít khi đến khám vì dậy thì sớm hơn là vì dậy thì muộn, vấn đề này sẽ được thảo luận sâu hơn ở phần sau của chương. Để đánh giá lâm sàng, ngoài các ngưỡng tuổi lưỡng phân này, một công cụ trực tuyến gần đây cho phép đánh giá giai đoạn phát triển (lông mu, thể tích tinh hoàn, phân loại giai đoạn sinh dục) so với các tiêu chuẩn dân số. Sự tiến triển của dậy thì có thể được theo dõi bằng cách sử dụng các biểu đồ dậy thì được trình bày dưới dạng sơ đồ đường giai đoạn (Hình 18.6). Các biểu đồ này cung cấp các đường cong xác suất cho một cá nhân ở một giai đoạn phát triển nhất định ở một độ tuổi nhất định. Giá trị phân vị trên trục y là một đánh giá định lượng về thời điểm dậy thì cho cá nhân đang được đánh giá trên các biểu đồ. Các sơ đồ như vậy hỗ trợ trong việc xác định sự phát triển sớm và muộn, cũng như tìm ra sự khác biệt trong sự tiến triển của dậy thì.
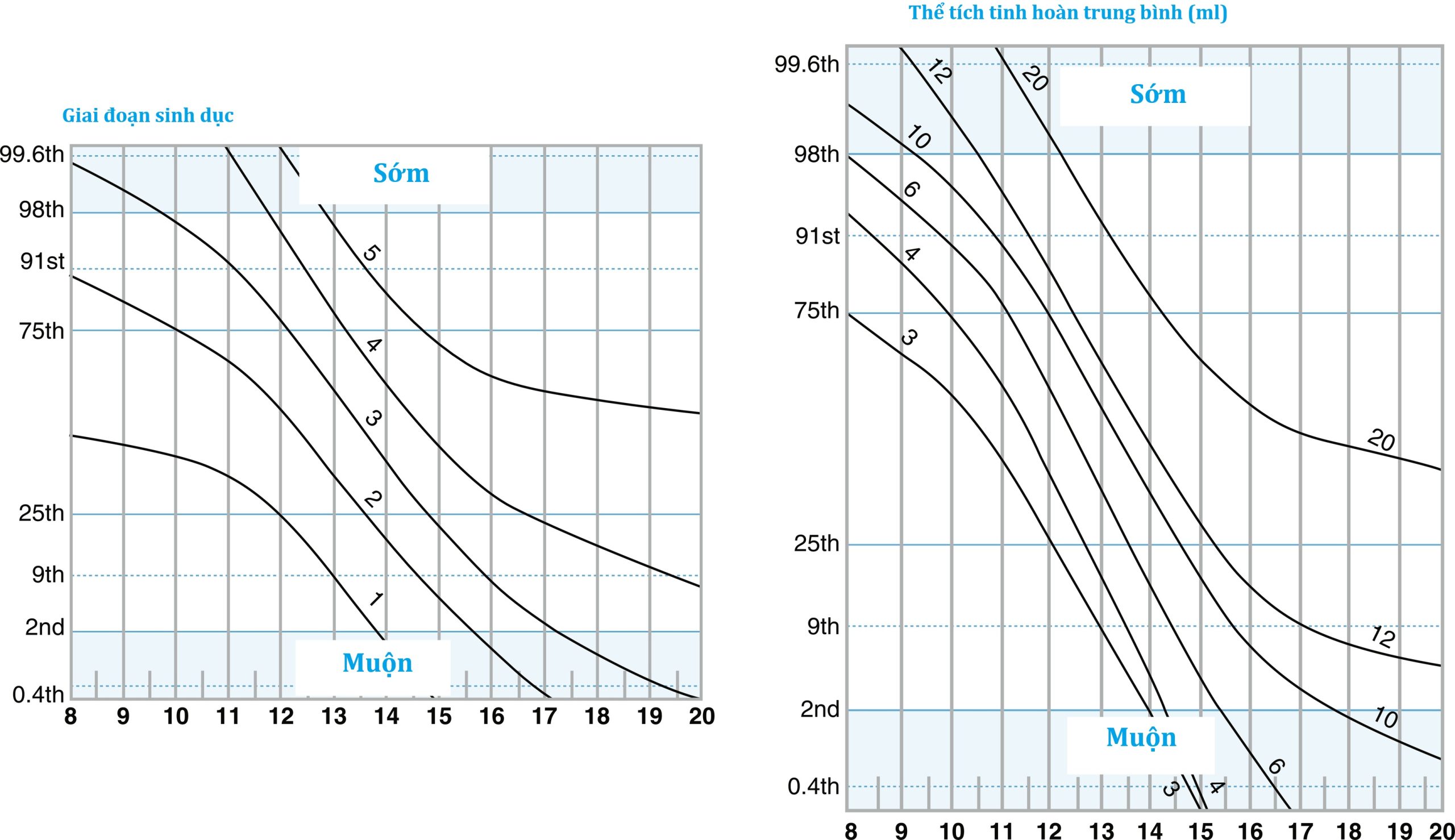
Hình 18.6 Sự phân bố các giai đoạn sinh dục (G) Tanner và thể tích tinh hoàn ở các bé trai khỏe mạnh. Trong các sơ đồ đường giai đoạn này, các đường 1–5 tương ứng với các giai đoạn Tanner 1–5 (bảng trái) hoặc thể tích tinh hoàn tính bằng mL (bảng phải). Các giá trị trục X là tuổi tính theo năm và trục Y hiển thị các phân vị phù hợp với giới tính cho sự phát triển. Các cá nhân có thể được vẽ biểu đồ giai đoạn Tanner và thể tích tinh hoàn để xác định sự sớm phát, chậm phát triển, hoặc sự tiến triển phù hợp để xác định xem sự phát triển đã ổn định hay bị ngừng lại. (Từ van Buuren, S. (2014). Growth charts of human development. Stat Methods Med Res, 23, 346–368.)
Các dạng dậy thì sớm phụ thuộc Hormone giải phóng Gonadotropin
Dạng dậy thì sớm phổ biến nhất là do sự hoạt hóa sớm của việc bài tiết GnRH theo nhịp, được gọi là dậy thì sớm trung ương (CPP) hoặc dậy thì sớm phụ thuộc gonadotropin. CPP có thể là kết quả của các khối u vùng dưới đồi hoặc các tổn thương hệ thần kinh trung ương (CPP do thần kinh) nhưng trong hầu hết các trường hợp vẫn không giải thích được (CPP vô căn) (Bảng 18.1).
Bảng 18.1 Các nguyên nhân thường gặp của dậy thì sớm ở bé trai
| Trung ương (Phụ thuộc GnRH) | Ngoại vi (Không phụ thuộc GnRH) |
|---|---|
| Vô căn | Tăng sản tuyến thượng thận bẩm sinh |
| Các khối u hệ thần kinh trung ương (CNS) | Hội chứng McCune-Albright |
| – Hamartoma | Các khối u sản xuất Testosterone |
| – U sao bào | – Ung thư biểu mô hoặc u tuyến thượng thận |
| – U tuyến | – U tế bào Leydig |
| – U tế bào thần kinh đệm | Các khối u sản xuất hCG |
| – U tế bào mầm | – Ung thư màng đệm |
| Nhiễm trùng CNS | – U tế bào mầm ác tính |
| Chấn thương đầu | – U gan phôi |
| Do thầy thuốc | – Ung thư biểu mô màng đệm |
| – Xạ trị CNS liều thấp | – U quái |
| – Hóa trị | – U nguyên bào sinh dục |
| – Phẫu thuật | Tiếp xúc ngoại sinh với androgen |
| Dị tật của CNS | Dậy thì sớm giới hạn ở nam giới có tính gia đình |
| – Nang màng nhện hoặc trên yên | Suy giáp (Hội chứng Van Wyk–Grumbach) |
| – Não úng thủy |
hCG, Gonadotropin màng đệm người.
(Sửa đổi từ Nathan BM, Palmert MR (2005). Regulation and disorders of pubertal timing. Endocrinol Metab Clin North Am, 34:617–641, ix.)
Hamartoma vùng dưới đồi là một ví dụ về nguyên nhân gây CPP do thần kinh. Hamartoma là các dị tật bẩm sinh được đặc trưng bởi chất xám lạc chỗ, các nơron và tế bào thần kinh đệm, và chúng thường nằm trên sàn não thất ba hoặc gắn vào củ xám. Trên hình ảnh cộng hưởng từ (MRI), hamartoma biểu hiện một khối căng đồng tỷ trọng. Kiểm tra mô học đã cho thấy phản ứng miễn dịch với GnRH và với các yếu tố tế bào hình sao, chẳng hạn như TGF-α. Các cơ chế được giả định bao gồm sự bài tiết GnRH trực tiếp từ các nơron này, sự bài tiết TGF-α đến lượt nó kích thích sự bài tiết GnRH từ các nơron GnRH, và sự kích hoạt điện của các trung tâm thần kinh lân cận. Hầu hết các hamartoma vùng dưới đồi là lẻ tẻ, nhưng chúng có thể xảy ra kết hợp với hội chứng Pallister-Hall, gây ra bởi các đột biến trong gen GLI3. U tế bào thần kinh đệm thị giác, có thể liên quan đến bệnh u xơ thần kinh loại 1, cũng có thể gây ra dậy thì sớm phụ thuộc GnRH do thần kinh. Các nguyên nhân khác của CPP do thần kinh bao gồm các khối u tuyến tùng, nang trên yên, chấn thương đầu, xạ trị CNS và bệnh não tĩnh.
Các đột biến mất chức năng của gen MKRN3, nằm ở nhiễm sắc thể 15q11-q13, đã được liên kết với dậy thì sớm phụ thuộc GnRH. MKRN3 mã hóa protein ngón tay RING makorin 3, có thể hoạt động như một protein liên kết RNA và/hoặc một ubiquitin ligase. Tất cả các cá nhân bị ảnh hưởng lâm sàng đều thừa hưởng alen đột biến từ cha của họ, điều này có thể được giải thích vì gen này được in dấu của mẹ và chỉ được biểu hiện từ alen của cha. Cả nam và nữ đều bị ảnh hưởng, mặc dù mức độ sớm phát dường như lớn hơn ở nữ so với nam. Khoảng 30% các trường hợp có tính gia đình và 3% các trường hợp lẻ tẻ của CPP có liên quan đến các đột biến trong MKRN3 (OMIM ID 603856). Các đột biến trong MKRN3 liên quan đến CPP bao gồm các đột biến dịch khung có khả năng gây mất chức năng; điều này cho thấy rằng MKRN3 thường hoạt động để trì hoãn sự khởi đầu của dậy thì và thu hút sự chú ý đến tầm quan trọng của các yếu tố ức chế trong việc điều hòa thời điểm dậy thì.
Có bằng chứng thuyết phục rằng các đột biến phá vỡ gen DLK1 cũng có thể gây ra CPP. Việc xóa và các khiếm khuyết in dấu trong vùng trên nhiễm sắc thể 14 xung quanh DLK1 gây ra hội chứng Temple, có liên quan đến dậy thì sớm. Một lần xóa nhỏ hơn dường như chỉ ảnh hưởng đến DLK1 đã được xác định ở bốn cá nhân bị CPP từ cùng một gia đình, cho thấy rằng sự phá vỡ DLK1 là nguyên nhân gây ra dậy thì sớm được thấy trong hội chứng Temple. Mối liên quan của DLK1 với dậy thì sớm đã được xác nhận bởi một báo cáo sau đó về các đột biến dịch khung trong DLK1 ở các cá nhân bị dậy thì sớm từ ba gia đình không liên quan khác. Giống như MKRN3, DLK1 được in dấu, và CPP chỉ được quan sát thấy nếu alen của cha bị phá vỡ. DLK1 mã hóa một phối tử không kinh điển cho họ thụ thể Notch, và chức năng chính xác của nó vẫn chưa được biết.
Các dạng dậy thì sớm không phụ thuộc Hormone giải phóng Gonadotropin
Sự phát triển sớm của các đặc điểm sinh dục phụ cũng có thể do các cơ chế không liên quan đến sự hoạt hóa của việc bài tiết GnRH theo nhịp. Các dạng sớm phát này được gọi là sớm phát không phụ thuộc gonadotropin hoặc sớm phát ngoại vi và bao gồm các khối u tuyến sinh dục và tuyến thượng thận, sự hoạt hóa không phù hợp của thụ thể LH do đột biến gen hoặc tín hiệu bởi các khối u sản xuất hCG, và tiếp xúc với các steroid sinh dục ngoại sinh (xem Bảng 18.1). Dậy thì sớm giới hạn ở nam giới có tính gia đình (FMPP, OMIM ID: 176410), trước đây được gọi là nhiễm độc tinh hoàn, là một dạng sớm phát không phụ thuộc gonadotropin trội hiếm gặp gây ra bởi các đột biến hoạt hóa cấu thành của thụ thể LH/hCG (LHCGR). Rối loạn này thường biểu hiện ở độ tuổi từ 1 đến 4 tuổi với sự nam hóa nhanh chóng, tăng tốc độ tăng trưởng, sự tiến triển của xương (tuổi xương), và nồng độ testosterone tăng cao mặc dù nồng độ LH ở mức tiền dậy thì. Hội chứng McCune-Albright (MAS, OMIM ID: 174800) là một nguyên nhân di truyền hiếm gặp khác của dậy thì sớm ở nam giới. Nó được gây ra bởi các đột biến hoạt hóa soma sau hợp tử trong GNAS1, gen mã hóa tiểu đơn vị α của protein G dị tam thể Gs. Gs truyền tín hiệu từ nhiều thụ thể ghép cặp với protein G, bao gồm thụ thể LH, và sự hoạt hóa cấu thành của tín hiệu GS dẫn đến sự tăng sinh tế bào tự trị và tăng chức năng rải rác trong các cơ quan nội tiết, với một phổ kiểu hình rộng phụ thuộc vào cơ quan nào mang đột biến. Các đặc điểm kinh điển của MAS bao gồm bộ ba lâm sàng của loạn sản xơ xương (BFD), các đốm da café-au-lait, và sự phát triển sớm của các đặc điểm sinh dục phụ. Ngoài ra, cường giáp do hoạt hóa thụ thể hormone kích thích tuyến giáp (TSH), tăng cortisol do hoạt hóa cấu thành của thụ thể CRH và/hoặc hormone vỏ thượng thận (ACTH), mất phốt phát ở thận, ứ mật và bệnh tim phì đại có thể có mặt. Vì những lý do không rõ ràng, MAS dẫn đến dậy thì sớm thường xuyên hơn ở nữ so với nam. Nhiều bé trai có thể có bệnh lý tinh hoàn không được nhận biết, nhưng phát hiện chủ yếu là tăng sản tế bào Leydig, có thể không cần can thiệp tích cực.
Năm 1960, Van Wyk và Grumbach lần đầu tiên mô tả một hội chứng được đặc trưng ở các bé gái bởi sự phát triển vú, chảy máu tử cung và buồng trứng đa nang khi có suy giáp nguyên phát kéo dài. Một đặc điểm chẩn đoán độc đáo của hội chứng Van Wyk–Grumbach là sự kết hợp giữa tuổi xương chậm với dậy thì sớm rõ ràng. Các bé trai mắc hội chứng này có tinh hoàn to nhưng không có sự nam hóa đáng kể. Mô học tinh hoàn cho thấy sự to ra của các ống sinh tinh mà không có sự gia tăng số lượng tế bào Leydig. Nếu được thực hiện, kích thích GnRH cho thấy một phản ứng tiền dậy thì với LH bị ức chế, xác nhận sớm phát không phụ thuộc GnRH. Hầu hết các trường hợp dường như bắt nguồn từ bệnh tuyến giáp tự miễn, nhưng có một số báo cáo trường hợp hội chứng này là thứ phát sau suy giáp bẩm sinh không được nhận biết. Sinh lý bệnh của hội chứng Van Wyk–Grumbach liên quan đến một cơ chế phức tạp, được trung gian ít nhất một phần bởi tác động trực tiếp của TSH lên các thụ thể FSH. TSH người tái tổ hợp (Rec-hTSH) gây ra một phản ứng cAMP phụ thuộc liều trong các tế bào biểu hiện thụ thể FSH của người trong ống nghiệm; tuy nhiên, nồng độ rec-hTSH cần thiết để kích thích tối đa một nửa lớn hơn vài log so với nồng độ của hFSH. Việc nhận biết sớm và bắt đầu thay thế hormone tuyến giáp có thể không chỉ dẫn đến sự giải quyết các triệu chứng và cải thiện chiều cao trưởng thành mà còn tránh được các thủ tục chẩn đoán thêm.
Sớm phát không phụ thuộc GnRH cũng có thể do các dạng nam hóa của tăng sản tuyến thượng thận bẩm sinh (CAH). Đây là các rối loạn lặn trên nhiễm sắc thể thường của quá trình tổng hợp cortisol, biểu hiện bằng sự phát triển lông mu sớm, phát triển lông nách, tăng trưởng tuyến tính nhanh và dương vật to ra mà không có sự to ra của tinh hoàn. Dạng phổ biến nhất là thiếu hụt 21-hydroxylase do các đột biến mất chức năng trong CYP21A2. Các đột biến trong 11β-hydroxylase (CYP11B1) và 3β-hydroxysteroid dehydrogenase type 2 (HSD3B2) chiếm 5% đến 10% các trường hợp. Các khối u tiết androgen là một nguyên nhân hiếm gặp khác của sớm phát không phụ thuộc GnRH ở các bé trai. Các khối u tế bào Leydig tiết ra testosterone. Vì các khối u này thường ở một bên, thể tích tinh hoàn có thể không đối xứng. Phần lớn các khối u tế bào Leydig là lành tính. Siêu âm có thể hữu ích vì khối u có thể quá nhỏ để sờ thấy. Các đột biến trong gen LHCGR đã được xác định trong một số u tuyến tinh hoàn. Các khối u tiết hCG cũng kích thích sự bài tiết testosterone ở các bé trai và có thể giống với dậy thì sớm giới hạn ở nam giới có tính gia đình (nhiễm độc tinh hoàn). Các khối u này thường có nguồn gốc từ gan (lưu ý, các đột biến hoạt hóa của thụ thể LH và các khối u tiết hCG không gây ra dậy thì sớm ở các bé gái, vì việc sản xuất estradiol đòi hỏi sự hoạt hóa của cả thụ thể FSH và LH). Các khối u tuyến thượng thận ở trẻ em có thể tiết ra androgen, và nam hóa là một biểu hiện phổ biến.
Liệu dậy thì sớm có phụ thuộc gonadotropin hay không phụ thuộc gonadotropin không phải lúc nào cũng rõ ràng. Cả hai dạng đôi khi có thể cùng tồn tại vì các dạng dậy thì sớm ngoại vi, chẳng hang như CAH hoặc các khối u tinh hoàn hoặc tuyến thượng thận, cuối cùng có thể dẫn đến dậy thì sớm trung ương chồng chéo thông qua các cơ chế chưa được biết. Ngược lại, trong một số trường hợp phát triển dậy thì sớm ở các bé gái, các biểu hiện dậy thì sẽ ngừng tiến triển hoặc thoái lui, làm cho việc điều trị không cần thiết; những trường hợp như vậy không thường thấy ở các bé trai. Các cơ chế chịu trách nhiệm cho các dạng dậy thì sớm không tiến triển này không được biết, nhưng có bằng chứng cho thấy trong một số trường hợp, trục HPG được hoạt hóa không liên tục nhưng không hoàn toàn.
Hoạt hóa tuyến thượng thận sớm
Một dạng phát triển sớm khác của các đặc điểm sinh dục phụ xảy ra khi lớp lưới của vỏ thượng thận trưởng thành sớm, gây ra hoạt hóa tuyến thượng thận sớm. Hoạt hóa tuyến thượng thận sớm, phổ biến hơn ở các bé gái, không liên quan đến sự phát triển dậy thì tiến triển và được biểu hiện bằng lông mu và lông nách với sự gia tăng khiêm tốn của DHEA-S. Thông thường, không có sự tiến triển đáng kể về tuổi xương; tuy nhiên, ngay cả trong tập hợp con có tuổi xương tiến triển hơn, dường như có rất ít hoặc không có ảnh hưởng đến chiều cao trưởng thành, mặc dù phải thừa nhận rằng, hầu hết các dữ liệu này bắt nguồn từ các nghiên cứu ở các bé gái. Do đó, hoạt hóa tuyến thượng thận sớm không cần điều trị.
Hậu quả của dậy thì sớm
Trong các trường hợp dậy thì sớm trung ương tiến triển hoặc sớm phát ngoại vi, các mối quan tâm bao gồm các kết quả tâm lý xã hội bất lợi và tầm vóc trưởng thành thấp do sự cốt hóa sớm của các đầu xương. Một số nghiên cứu đã đánh giá chiều cao trưởng thành ở các đối tượng có tiền sử dậy thì sớm, chứng minh rằng sự mất mát chiều cao trưởng thành có thể là đáng kể. Sự mất mát chiều cao có tương quan nghịch với tuổi khởi phát dậy thì. Điều đặc biệt quan trọng là phải đánh giá cẩn thận tốc độ tăng trưởng và sự trưởng thành của xương của các cá nhân bị dậy thì sớm trung ương do các tổn thương CNS (ví dụ, khối u, dị tật não hoặc chấn thương do chấn thương hoặc bức xạ) vì các tổn thương này có thể liên quan đến thiếu hụt GH đồng thời, có thể bị che dấu bởi sự tăng trưởng do steroid sinh dục mà có thể trông có vẻ đầy đủ một cách lừa dối. Trong những trường hợp như vậy, sự kết hợp của thiếu hụt GH không được chẩn đoán và điều trị và sự trưởng thành nhanh chóng của xương do steroid sinh dục có thể dẫn đến chiều cao trưởng thành bị ảnh hưởng nghiêm trọng.
Mặc dù dữ liệu có sẵn chủ yếu bắt nguồn từ nghiên cứu trên các bé gái có khởi phát dậy thì ở đầu sớm của phạm vi bình thường, nhưng người ta cho rằng một tỷ lệ cao hơn thanh thiếu niên trưởng thành sớm trong dân số chung tham gia vào các hành vi nguy cơ khám phá (quan hệ tình dục và sử dụng chất gây nghiện) ở độ tuổi sớm hơn so với thanh thiếu niên có thời điểm trưởng thành trung bình hoặc muộn. Tuy nhiên, dữ liệu có sẵn về các kết quả tâm lý xã hội bất lợi tiềm ẩn đặc trưng cho bệnh nhân dậy thì sớm còn hạn chế, và không rõ liệu dữ liệu thu được từ các cá nhân có sự trưởng thành ở đầu sớm của phổ bình thường có hoàn toàn áp dụng được cho dậy thì sớm hay không.
Các nghiên cứu dịch tễ học đã liên kết thời điểm dậy thì sớm hơn với nguy cơ gia tăng một số kết quả sức khỏe tiêu cực ở người trưởng thành, bao gồm béo phì; các bệnh ung thư sinh sản, chẳng hạn như ung thư vú ở phụ nữ và ung thư tuyến tiền liệt ở nam giới; đái tháo đường týp 2; và bệnh tim mạch. Hầu hết các nghiên cứu này được thực hiện ở phụ nữ vì tuổi có kinh được nhớ lại là một chỉ số khá đáng tin cậy về thời điểm dậy thì, và một dấu hiệu tương đương thiếu ở nam giới, mặc dù tuổi vỡ giọng được nhớ lại đã được sử dụng trong một số nghiên cứu. Hầu hết các nghiên cứu này cũng đã kiểm tra thời điểm dậy thì nói chung hơn là dậy thì sớm cụ thể, nhưng nhiều mối liên quan quan sát được đã mở rộng sang phạm vi sớm phát.
Các nghiên cứu liên kết ban đầu không thể xác định được mối quan hệ nhân quả, tức là, liệu dậy thì muộn có gây ra nguy cơ gia tăng trực tiếp hay liệu một số yếu tố ngược dòng chung ảnh hưởng đến thời điểm dậy thì và nguy cơ bệnh tật ở người trưởng thành một cách độc lập. Gần đây hơn, các phương pháp tiếp cận di truyền của con người đã được sử dụng để giải quyết vấn đề này. Một cách tiếp cận là so sánh tác động của các biến thể di truyền phổ biến trên hai đặc điểm để xác định xem các đặc điểm có chung một cơ sở di truyền hay không; cách tiếp cận này đã được sử dụng để chứng minh rằng thời điểm dậy thì và BMI có chung các yếu tố quyết định di truyền. Một kỹ thuật khác được gọi là ngẫu nhiên hóa Mendel đánh giá xem (sau khi điều chỉnh cho tính đa hiệu) các yếu tố quyết định di truyền của một đặc điểm cũng ảnh hưởng đến một đặc điểm thứ hai hay không, với suy luận hợp lý rằng bất kỳ ảnh hưởng nào như vậy đều được trung gian bởi đặc điểm thứ nhất ảnh hưởng đến đặc điểm thứ hai. Kỹ thuật này đã được sử dụng để gợi ý rằng chính thời điểm dậy thì ảnh hưởng đến nguy cơ ung thư sinh sản, bao gồm ung thư vú, buồng trứng và nội mạc tử cung ở phụ nữ và ung thư tuyến tiền liệt ở nam giới. Ngẫu nhiên hóa Mendel cũng chỉ ra rằng thời điểm dậy thì sớm hơn dẫn đến huyết áp cao hơn ở tuổi trưởng thành. Về BMI, thời điểm dậy thì đã được chứng minh là ảnh hưởng đến BMI của người trưởng thành, và béo phì ở trẻ em đã được chứng minh là ảnh hưởng đến thời điểm dậy thì; do đó, có nhiều hơn một cơ chế làm cơ sở cho mối quan hệ giữa thời điểm dậy thì và BMI.
Các thực thể bệnh lý dẫn đến dậy thì sớm cần được điều trị, nhưng liệu và ở độ tuổi nào nên bắt đầu điều trị cho dậy thì sớm trung ương vô căn thì ít rõ ràng hơn, đặc biệt nếu chiều cao trưởng thành dường như không bị ảnh hưởng. Hiện tại, thiếu dữ liệu chắc chắn về các di chứng tâm lý xã hội ngắn hạn và dài hạn của CPP và dữ liệu về việc liệu điều trị CPP bằng các chất tương tự GnRH (GnRHa) có làm thay đổi các kết quả này hay không. Do đó, cần phải thận trọng khi sử dụng các kết quả tâm lý xã hội làm cơ sở cho can thiệp dược lý để ngăn chặn sự tiến triển của dậy thì, đặc biệt là ở các bé trai có khởi phát dậy thì gần với phạm vi bình thường.
Đánh giá một bé trai có sự phát triển sớm của các đặc điểm sinh dục phụ
Các bé trai bị dậy thì sớm cần được đánh giá cẩn thận vì nhiều em có các rối loạn tiềm ẩn. Những em bị mọc lông mu sớm (phát triển sớm lông mu hoặc mùi cơ thể) cần được đánh giá các nguyên nhân ngoại vi của sớm phát trước khi xác định rằng mọc lông mu sớm chỉ đơn thuần là do hoạt hóa tuyến thượng thận sớm. Hoạt hóa tuyến thượng thận sớm có thể được phân biệt với dậy thì thật sự theo thời gian bằng việc không có sự tiến triển nhanh chóng. Ngược lại, sớm phát tiến triển được đánh dấu bằng sự tiến triển đáng kể của tuổi xương (> 2 SD so với tuổi), tăng tốc độ tăng trưởng và sự tiến triển nhanh chóng của các đặc điểm sinh dục phụ khi khám thực thể.
Việc đánh giá một bé trai bị dậy thì sớm được nêu trong Hộp 18.1. Các cân nhắc bao gồm trước tiên xác minh rằng sự phát triển dậy thì đang xảy ra ngoài phạm vi phát triển bình thường trước khi bắt đầu đánh giá. Điều quan trọng cũng cần lưu ý là không phải tất cả các xét nghiệm đều phù hợp trong mọi trường hợp và hiệu suất chẩn đoán của các xét nghiệm khác nhau không được biết. Do đó, điều quan trọng là để bệnh sử và khám thực thể hướng dẫn việc đánh giá. Ví dụ, đứa trẻ có cả hai tinh hoàn to đến 8 mL hoặc hơn có khả năng cao nhất là bị dậy thì sớm trung ương, với FSH đã dẫn đến sự mở rộng thể tích ống sinh tinh (trong khi các trường hợp nhiễm độc tinh hoàn và các khối u tiết hCG cũng có thể biểu hiện với sự to ra khiêm tốn của cả hai tinh hoàn, thể tích trong các tình trạng này thường không quá 6 mL). Ngược lại, đứa trẻ có tinh hoàn kích thước tiền dậy thì ở cả hai bên có nhiều khả năng bị sớm phát ngoại vi; đứa trẻ có tinh hoàn to một bên có thể bị u tinh hoàn. Việc xét nghiệm nên được hướng dẫn tương ứng.
| Hộp 18.1. Đề cương đánh giá dậy thì sớm ở bé trai
Các xét nghiệm sàng lọc ban đầu phổ biến
Các xét nghiệm thứ cấp cần xem xét
ACTH, Hormone vỏ thượng thận; DHEA-S, dehydroepiandrosterone sulfate; FSH, hormone kích thích nang trứng; GnRH, hormone giải phóng gonadotropin; LH, hormone hoàng thể hóa; MRI, hình ảnh cộng hưởng từ; T4, thyroxine; TSH, hormone kích thích tuyến giáp. |
(Sửa đổi từ Nathan, B. M., Palmert, M. R. (2005). Regulation and disorders of pubertal timing. Endocrinol Metab Clin North Am, 34, 617–641, ix.)
Các nguyên nhân ngoại vi của dậy thì sớm được đặc trưng bởi các giá trị LH và FSH bị ức chế trong bối cảnh nồng độ steroid sinh dục tăng cao. Nồng độ testosterone sẽ tăng cao trong các trường hợp sớm phát cùng giới (các đặc điểm sinh dục phụ phù hợp với giới tính nam), trong khi nồng độ estradiol có thể tăng cao trong các trường hợp hiếm gặp của sớm phát khác giới (các đặc điểm sinh dục phụ không phù hợp với giới tính, chẳng hạn như vú phát triển rõ rệt là dấu hiệu khởi phát ở một bé trai). Việc xác định cơ chế cơ bản cho sớm phát ngoại vi tiến triển là quan trọng vì tất cả các trường hợp sẽ là kết quả của các tình trạng bệnh lý hoặc tiếp xúc ngoại sinh. DHEA-S thường được sử dụng để sàng lọc các khối u tuyến thượng thận hoặc bệnh lý tuyến thượng thận. Việc xác định nồng độ 17-hydroxyprogesterone được sử dụng để sàng lọc tăng sản tuyến thượng thận bẩm sinh do thiếu hụt 21-hydroxylase. Tăng sản tuyến thượng thận bẩm sinh và các khối u tiết hormone của tuyến thượng thận được thảo luận chi tiết trong Chương 14. Đánh giá sự trưởng thành của xương bằng tuổi xương là một phương tiện bổ trợ quan trọng, vì nó cho phép dự đoán chiều cao trưởng thành.
Trong lịch sử, tiêu chuẩn vàng để chẩn đoán dậy thì sớm trung ương là nghiệm pháp kích thích GnRH và việc chứng minh các đáp ứng gonadotropin dậy thì bắt nguồn từ việc các tế bào hướng sinh dục đã được mồi bởi sự bài tiết GnRH nội sinh. Tuy nhiên, với sự ra đời của các xét nghiệm gonadotropin siêu nhạy, việc công nhận rằng các xét nghiệm này có thể xác định các cá nhân bị CPP bằng cách sử dụng các mẫu ngẫu nhiên không kích thích, và việc không có GnRH để xét nghiệm đã khiến nhiều người bỏ qua nghiệm pháp kích thích. Các chất chủ vận GnRH có thể được sử dụng thay thế cho GnRH để làm nghiệm pháp kích thích, nhưng một lần nữa chẩn đoán thường có thể được thực hiện thông qua sự kết hợp của các đặc điểm lâm sàng và một giá trị LH cơ bản trong phạm vi dậy thì. Mặc dù việc xác định ngưỡng chẩn đoán cho nồng độ LH cơ bản là khó khăn do thiếu dữ liệu tiêu chuẩn và sự thay đổi giữa các xét nghiệm, một giá trị từ 0,3 IU/L trở lên, sử dụng một xét nghiệm siêu nhạy với giới hạn phát hiện gần 0,1 IU/L, thường được trích dẫn. Nếu nghiệm pháp kích thích được thực hiện, một ngưỡng chẩn đoán 5 IU/L cho giá trị đỉnh đã được đề xuất. Các giá trị LH hữu ích hơn các giá trị FSH trong việc đánh giá chẩn đoán dậy thì sớm, nhưng các giá trị LH/FSH được kích thích có thể giúp xác định bệnh nhân bị dậy thì sớm tiến triển chậm vì những trẻ này có xu hướng có các đáp ứng chủ yếu là FSH. Dậy thì sớm trung ương vô căn là một nguyên nhân phổ biến hơn của dậy thì sớm ở các bé gái so với các bé trai trong các phòng khám nội tiết. Do đó, tất cả các bé trai bị CPP nên được chụp MRI não để loại trừ bệnh lý tiềm ẩn.
Tóm lại, điều quan trọng đối với các bác sĩ đánh giá bệnh nhân nghi ngờ dậy thì sớm là phải giải quyết các câu hỏi sau: Sự phát triển dậy thì có xảy ra ngoài phạm vi phát triển bình thường không? Cơ chế cơ bản là gì, và cơ chế đó có liên quan đến nguy cơ của một tình trạng nghiêm trọng, chẳng hạn như tổn thương nội sọ không? Sự phát triển dậy thì có khả năng tiến triển không, và điều này có thể làm suy yếu sự phát triển thể chất và tâm lý xã hội bình thường của trẻ không?
Điều trị trẻ bị dậy thì sớm
Trừ khi có bệnh lý tiềm ẩn cần can thiệp, việc liệu sự phát triển dậy thì sớm có khả năng làm suy yếu sự phát triển thể chất hoặc tâm lý xã hội bình thường của bé trai hay không thường là đặc điểm quyết định xem có cần điều trị hay không.
Dậy thì sớm trung ương
Vì các dạng dậy thì sớm không tiến triển không cần can thiệp, một điều kiện tiên quyết để xem xét điều trị cho CPP là sự hiện diện của sự phát triển dậy thì tiến triển được ghi nhận trong khoảng thời gian từ 3 đến 6 tháng, mặc dù giai đoạn quan sát này có thể không cần thiết nếu trẻ đang ở hoặc vượt qua giai đoạn phát triển sinh dục Tanner 3. Sự cốt hóa của sụn tiếp hợp là một quá trình phụ thuộc estrogen, và việc sản xuất sớm và tiến triển của các steroid sinh dục có thể gây ra sự tiến triển nhanh chóng của sự trưởng thành xương và dẫn đến chiều cao trưởng thành bị ảnh hưởng. Do đó, việc bảo tồn tầm vóc trưởng thành là một trong những lý do chính để xem xét điều trị CPP bằng các chất chủ vận GnRH, làm giảm điều hòa trục tuyến yên-tuyến sinh dục và hạn chế sự tiến triển của dậy thì. Mặc dù dữ liệu chủ yếu bắt nguồn từ các nghiên cứu ở các bé gái, nhưng dường như nguy cơ tầm vóc thấp rõ rệt nhất ở những trẻ có khởi phát triệu chứng sớm hơn. Tuổi xương tiến triển cũng góp phần vào kết quả chiều cao kém hơn. Dữ liệu có sẵn cho thấy rằng mức tăng chiều cao lớn nhất (bảo tồn) xảy ra với việc điều trị các bé gái có khởi phát dậy thì trước 6 tuổi, với lợi ích khiêm tốn hơn được thấy với khởi phát từ 6 đến 8 tuổi. Tuy nhiên, không đủ dữ liệu để đưa ra kết luận tương tự về tuổi khởi phát và kết quả chiều cao ở các bé trai; do đó, một hội nghị đồng thuận đã khuyến nghị xem xét bắt đầu điều trị bằng GnRHa cho tất cả các bé trai có khởi phát CPP trước 9 tuổi có tiềm năng chiều cao bị ảnh hưởng.
Lý do chính thứ hai để xem xét điều trị trong CPP là để giảm thiểu các tác động tâm lý xã hội tiềm ẩn của dậy thì sớm. Tuy nhiên, như đã lưu ý trước đó, cần có các nghiên cứu bổ sung để xác định tác động của dậy thì sớm đối với chất lượng cuộc sống và chức năng tâm lý xã hội và để đánh giá xem việc điều trị bằng các liệu pháp GnRHa có ảnh hưởng đến các kết quả này hay không. Do đó, hội nghị đồng thuận đã kết luận rằng việc sử dụng các liệu pháp GnRHa chỉ để ảnh hưởng đến các hậu quả tâm lý xã hội của dậy thì sớm cần được xem xét cẩn thận, do thiếu dữ liệu thuyết phục. Những cảnh báo này càng phù hợp hơn đối với các bé trai vì dữ liệu về nam giới thậm chí còn khan hiếm hơn.
Cuối cùng, mặc dù các mối liên quan với thời điểm dậy thì và các kết quả sức khỏe sau này được đề cập trước đó rất hấp dẫn, nhưng không có dữ liệu nào về việc liệu việc điều trị dậy thì sớm (hoặc muộn) có ảnh hưởng đến nguy cơ của các kết quả đó hay không. Câu hỏi này đại diện cho một lĩnh vực nghiên cứu sâu hơn quan trọng vì khả năng giảm thiểu rủi ro ung thư hoặc bệnh tim mạch sẽ là một cân nhắc quan trọng khi quyết định có hoặc không điều trị dậy thì sớm.
Các công thức khác nhau (tiêm bắp, tiêm dưới da và xịt mũi) của các chất chủ vận GnRH tác dụng ngắn (hàng ngày) và tác dụng dài có sẵn để điều trị CPP. Các công thức depot được ưu tiên hơn, vì chúng dễ dàng hơn cho bệnh nhân và gia đình sử dụng thường xuyên trong một thời gian điều trị dài. Các loại thuốc depot ban đầu là các công thức 1 tháng, đã được chứng minh là được dung nạp tốt và hiệu quả. Sau đó, các công thức depot 3 tháng và 6 tháng đã được phát triển, và một que cấy 1 năm (histrelin-acetate) cũng đã có sẵn. Việc sử dụng GnRHa nào phụ thuộc vào sở thích của bệnh nhân và nhà cung cấp, sự chấp thuận của cơ quan quản lý địa phương và hệ thống hoàn trả.
Các chất chủ vận GnRH thường được dung nạp tốt. Thỉnh thoảng, một đợt bùng phát tạm thời ban đầu của hoạt động GnRH có thể xảy ra và dẫn đến sự tiến triển thoáng qua của các đặc điểm sinh dục phụ. Các phản ứng tại chỗ (áp xe vô trùng) có thể xảy ra ở 10% đến 15% bệnh nhân sử dụng các công thức depot tiêm của các chất tương tự GnRH. Các cân nhắc khác bao gồm các tác động lâu dài của các chất chủ vận GnRH đối với mật độ khoáng của xương (BMD) và chức năng sinh sản. Các kết quả này phần lớn đã được nghiên cứu ở các bé gái, và dữ liệu có sẵn là đáng yên tâm. Liệu việc sử dụng GnRHa có liên quan đến tăng béo phì hay không thì ít rõ ràng hơn, và dữ liệu ở các bé trai bị CPP còn ít. Tuy nhiên, hầu hết các nghiên cứu ở các bé gái đều đáng yên tâm và chỉ ra rằng mối quan tâm này không đủ lớn để chống lại việc sử dụng GnRHa trong các trường hợp CPP, đặc biệt là vì các yếu tố nguy cơ béo phì có thể liên quan đến chính CPP chứ không nhất thiết là việc sử dụng GnRHa.
Việc theo dõi điều trị bằng chất chủ vận GnRH nên bao gồm đánh giá giai đoạn Tanner và tốc độ tăng trưởng mỗi 3 đến 6 tháng, với việc đánh giá sự trưởng thành của xương mỗi 6 đến 12 tháng. Sự tiến triển của sự phát triển dậy thì hoặc của sự trưởng thành nhanh chóng của xương cho thấy sự thiếu hiệu quả, sự tuân thủ kém hoặc chẩn đoán sai. Những bệnh nhân như vậy cần được đánh giá lại, bao gồm cả việc đo lường tiềm năng nồng độ LH cơ bản hoặc được kích thích. Liệu việc đo lường thường xuyên gonadotropin để theo dõi sự ức chế trong quá trình điều trị bằng GnRHa có hữu ích hay không vẫn còn gây tranh cãi. Khi nào nên ngừng điều trị bằng chất chủ vận GnRH phải được đánh giá cho từng bệnh nhân. Dữ liệu ở các bé trai còn hạn chế, nhưng việc kiểm tra các đặc điểm lâm sàng khi ngừng điều trị—chẳng hạn như thời gian điều trị, chiều cao, tốc độ tăng trưởng, tuổi xương và tuổi đời—đã không xác định được các yếu tố dự báo rõ ràng về chiều cao trưởng thành có thể hướng dẫn các quyết định về thời điểm ngừng điều trị bằng chất chủ vận GnRH. Trong trường hợp không có dữ liệu này, có vẻ hợp lý khi xác định thời điểm ngừng điều trị dựa trên sở thích của bệnh nhân và gia đình, thường với ý định để sự phát triển dậy thì tiếp tục ở một độ tuổi cho phép sự phát triển xảy ra song song với các bạn cùng lứa của bệnh nhân.
Sớm phát ngoại vi
Trước đây, việc điều trị các nguyên nhân dậy thì sớm không phụ thuộc GnRH, chẳng hạn như MAS hoặc dậy thì sớm giới hạn ở nam giới có tính gia đình, bao gồm việc sử dụng các chất ức chế sinh tổng hợp steroid (ketoconazole), các chất kháng androgen yếu (spironolactone) và các chất ức chế aromatase thế hệ đầu tiên (AI) (testolactone). Mặc dù các liệu pháp này có hiệu quả một phần trong việc làm chậm tốc độ tăng trưởng và giảm sự nam hóa, nguy cơ nhiễm độc gan và suy thượng thận với ketoconazole, cũng như yêu cầu dùng thuốc nhiều lần trong ngày, là những trở ngại để đạt được kết quả điều trị thuận lợi. Gần đây hơn, liệu pháp kết hợp ngắn hạn với một chất kháng androgen mạnh, bicalutamide, và các AI thế hệ thứ ba, anastrozole và letrozole, dường như có hiệu quả trong việc giảm tốc độ tăng trưởng và sự nam hóa và cải thiện chiều cao trưởng thành dự đoán. Liệu pháp kết hợp này cung cấp một chế độ dùng thuốc một lần mỗi ngày thuận tiện hơn, mặc dù liệu pháp này đắt hơn các phương pháp điều trị trước đó và có thể liên quan đến nữ hóa tuyến vú. Việc xác nhận đầy đủ các chế độ này đang chờ các thử nghiệm lâm sàng có kiểm soát sâu hơn, bao gồm cả việc đánh giá các tác động lâu dài của liệu pháp đó đối với chiều cao trưởng thành, khả năng sinh sản, các thông số chuyển hóa, chức năng nhận thức và sức khỏe của xương. Nếu CPP chồng chéo phát triển ở một bệnh nhân bị sớm phát ngoại vi, việc điều trị bằng một chất chủ vận GnRH có thể được cân nhắc.
Dậy thì muộn
Nguyên nhân, đánh giá và điều trị dậy thì muộn (DP) đã được các tác giả xem xét trước đây. DP được định nghĩa là không có sự to ra của tinh hoàn muộn hơn 2 đến 2,5 độ lệch chuẩn so với trung bình của dân số (theo truyền thống là 14 tuổi ở bé trai). Như đã lưu ý trước đây, do xu hướng giảm thời điểm dậy thì trong một số báo cáo nhưng không phải tất cả từ Hoa Kỳ và các quốc gia khác, một số người ủng hộ các ngưỡng tuổi trẻ hơn cho dân số chung hoặc có lẽ cho các quốc gia hoặc nhóm dân tộc cụ thể. Tuy nhiên, sự thay đổi theo thời gian trong khởi phát dậy thì không đáng chú ý ở các bé trai phát triển muộn và do đó, việc điều chỉnh lại các định nghĩa về tuổi cho DP ở nam giới có thể không cần thiết. Đáng chú ý, vì mọc lông mu có thể là kết quả của sự trưởng thành của tuyến thượng thận (hoạt hóa tuyến thượng thận) độc lập với sự hoạt hóa trục HPG, sự hiện diện của các dấu hiệu hoạt hóa tuyến thượng thận (chẳng hạn như lông mu) không loại trừ chẩn đoán DP.
DP thường gây lo ngại đáng kể cho bệnh nhân và gia đình. Nó có thể ảnh hưởng đến sức khỏe tâm lý xã hội, mối quan hệ bạn bè và việc tham gia thể thao, và những vấn đề này là những lý do phổ biến để bắt đầu điều trị. Tuy nhiên, cũng như với dậy thì sớm, cần có các nghiên cứu sâu hơn để đánh giá đầy đủ sự căng thẳng tâm lý xã hội mà các cá nhân bị DP trải qua, liệu sự căng thẳng này có di chứng lâu dài hay không, và tác động của việc bổ sung steroid sinh dục đối với các kết quả này. Bệnh nhân, gia đình và các bác sĩ cũng thường lo lắng rằng DP có thể ảnh hưởng đến tầm vóc người trưởng thành, và nhiều bệnh nhân có biểu hiện tầm vóc thấp tương đối so với gia đình, cùng với DP và thiếu đợt tăng trưởng vượt bậc của tuổi dậy thì, điều này càng làm tăng thêm mối lo ngại về tầm vóc hiện tại và trưởng thành. Chiều cao người trưởng thành thực sự có thể bị ảnh hưởng bởi DP, nhưng trung bình nó chỉ thấp hơn một chút so với mục tiêu di truyền. Vẫn chưa rõ liệu khối lượng xương người trưởng thành có bị ảnh hưởng xấu bởi dậy thì muộn hay không và liệu những lo ngại liên quan đến sức khỏe xương có phải là lý do y tế để bắt đầu điều trị hay không. Cuối cùng, cũng như với dậy thì sớm, tuổi khởi phát dậy thì muộn hơn có liên quan đến các kết quả cuộc sống sau này, nhưng không rõ liệu việc điều trị DP có ảnh hưởng đến các mối liên quan này hay không.
Nguyên nhân của dậy thì muộn
Nguyên nhân phổ biến nhất của DP ở bé trai là dậy thì muộn tự giới hạn hoặc chậm tăng trưởng và dậy thì thể tạng (CDGP), đề cập đến một thái cực của phổ thời điểm dậy thì bình thường. Trong hai loạt nghiên cứu lớn, khoảng 65% đến 80% bé trai và 30% đến 50% bé gái bị DP có DP tự giới hạn (Hình 18.7). Tuy nhiên, vì dữ liệu bắt nguồn từ các trung tâm giới thiệu, những tỷ lệ phần trăm này có thể đánh giá thấp tần suất DP tự giới hạn mà các nhà cung cấp dịch vụ chăm sóc ban đầu gặp phải.
Hình 18.7 Sự phân bố các loại chẩn đoán ở nam và nữ bị dậy thì muộn. CD, Chậm tăng trưởng và dậy thì thể tạng; FHH, suy sinh dục do giảm gonadotropin chức năng; HypoH, suy sinh dục do giảm gonadotropin kéo dài; HyperH, suy sinh dục do tăng gonadotropin vĩnh viễn. (Từ Sedlmeyer, I. L., & Palmert, M. R. [2002]. Delayed puberty: analysis of a large case series from an academic center. J Clin Endocrinol Metab, 87, 1613–1620. Với sự cho phép.)
Mặc dù DP/CDGP tự giới hạn là nguyên nhân phổ biến nhất của DP ở bé trai, đây là một chẩn đoán loại trừ, và các nguyên nhân bệnh lý tiềm ẩn gây chậm trễ cần được xem xét. Các nguyên nhân khác của DP có thể được chia thành ba loại chính (xem Hình 18.7 và Bảng 18.2): suy sinh dục do giảm gonadotropin (HH) kéo dài, chiếm khoảng 10% các trường hợp ở bé trai và được đặc trưng bởi nồng độ LH và FSH thấp do các rối loạn vùng dưới đồi hoặc tuyến yên; HH chức năng, chiếm khoảng 10% đến 20% các trường hợp và trong đó sự chậm trễ dậy thì là tạm thời và thứ phát sau các tình trạng tiềm ẩn; và suy sinh dục do tăng gonadotropin gây ra bởi suy tuyến sinh dục nguyên phát, chiếm khoảng 5% đến 10% các trường hợp và được đặc trưng bởi nồng độ LH và FSH tăng cao do thiếu phản hồi âm từ tuyến sinh dục.
Bảng 18.2 Các nguyên nhân của dậy thì muộn ngoài Chậm tăng trưởng và dậy thì thể tạng
| Suy sinh dục do tăng Gonadotropin | Suy sinh dục do giảm Gonadotropin kéo dài | Suy sinh dục do giảm Gonadotropin chức năng |
|---|---|---|
| Các hội chứng di truyền | Các khối u/bệnh xâm lấn CNS | Bệnh/tình trạng hệ thống |
| – Hội chứng Noonan và các rối loạn liên quan | – U sao bào | – Xơ nang |
| – Loạn sản tuyến sinh dục | – U tế bào mầm | – Hen suyễn |
| – Hội chứng thoái triển tinh hoàn | – U tế bào thần kinh đệm | – Bệnh viêm ruột |
| – Chấn thương/xoắn tinh hoàn | – U sọ hầu | – Bệnh celiac |
| – Hóa trị/xạ trị | – U tiết prolactin | – Viêm khớp dạng thấp thiếu niên |
| – Nhiễm trùng tuyến sinh dục | – Bệnh mô bào Langerhans | – Chán ăn tâm thần/chứng ăn ói |
| –– Quai bị, Coxsackie | – Nang túi Rathke | – Bệnh hồng cầu hình liềm |
| – Viêm tinh hoàn tự miễn | Các khiếm khuyết di truyền | – Bệnh nhiễm hemosiderin |
| Các khiếm khuyết trong sinh tổng hợp steroid | – Hội chứng Kallmann (ANOS1/KAL1, FGFR1, PROK2, PROKR2, FGF8, HS6ST1, và CHD7) | – Thalassemia |
| – Thiếu hụt 5-alpha reductase (SR5A2) | – Suy sinh dục do giảm gonadotropin đơn độc (GNRHR, GNRH1, GPR54, FGFR1, FGF8, PROK2, PROKR2, TAC3, TACR3. HS6ST1, NSMF/NELF) | – Bệnh thận mạn tính |
| – Thiếu hụt 17, 20 lyase (CYP17A1) | – Phát triển trục HPG (NR0B1/DAX1, NR5A1/SF-1, HESX-1, LHX3, và PROP-1) | – AIDS |
| – Tăng sản tuyến thượng thận dạng mỡ bẩm sinh (StAR) | – Các hội chứng béo phì và suy sinh dục do giảm gonadotropin (LEP, LEPR, và PCSK1) | Các bệnh nội tiết |
| – Thiếu hụt 17-hydroxysteroid dehydrogenase (HSD17B3) | – Prader-Willi | – Đái tháo đường |
| Không nhạy cảm với Androgen | – Bardet-Biedl | – Suy giáp |
| Hội chứng chỉ có tế bào Sertoli (hội chứng Del Castillo) | – CHARGE | – Tăng prolactin máu |
| – Bệnh Gaucher | – Thiếu hụt hormone tăng trưởng | |
| Nhiễm trùng CNS trước đó | – Hội chứng Cushing | |
| Các khiếm khuyết đường giữa | Tập thể dục quá mức | |
| – Loạn sản vách-thị | Suy dinh dưỡng | |
| – Suy tuyến yên bẩm sinh | ||
| Hóa trị/xạ trị | ||
| Chấn thương |
CHARGE, Coloboma, khuyết tật tim, hẹp lỗ mũi sau, chậm phát triển, bất thường sinh dục và bất thường tai; CNS, hệ thần kinh trung ương; HPG, hạ đồi-tuyến yên-tuyến sinh dục.
(Sửa đổi từ Palmert, M. R., Dunkel, L. (2012). Clinical practice. Delayed puberty. N Engl J Med, 366, 443–453.)
Suy sinh dục do giảm Gonadotropin kéo dài
Các khiếm khuyết di truyền là một nguyên nhân chính của HH, và việc nghiên cứu các rối loạn di truyền gây ra thiếu hụt GnRH đã làm tăng đáng kể sự hiểu biết của chúng ta về sự phát triển và chức năng của trục HPG. Thiếu hụt GnRH phổ biến hơn ở nam giới so với nữ giới, ảnh hưởng đến một trong 7500 nam giới nhưng chỉ một trong 70.000 nữ giới; lý do cho sự khác biệt giới tính này chưa rõ ràng. Các kiểu di truyền bao gồm liên kết X, trội trên nhiễm sắc thể thường và lặn trên nhiễm sắc thể thường. Tuy nhiên, các trường hợp lẻ tẻ phổ biến hơn các dạng gia đình. HH đã được phân loại thành ba loại chính: (1) HH liên quan đến mất khứu giác, được gọi là hội chứng Kallmann (KS); (2) HH đơn độc (IHH) không có mất khứu giác; và (3) HH mắc phải. Tuy nhiên, có khả năng có sự chồng chéo giữa các loại này, vì cùng một đột biến có thể gây ra các kiểu hình không đồng nhất ngay cả trong các gia đình.
Các gen liên quan đến sự phát triển nơron giải phóng Gonadotropin
Sự liên quan của HH với khứu giác bất thường được thấy trong KS phát sinh từ nguồn gốc phát triển của các nơron GnRH trong tấm khứu giác và sự di chuyển của các nơron GnRH dọc theo các đường khứu giác. Một số gen quan trọng đối với chức năng trục HPG và sự phát triển khứu giác đã được xác định thông qua việc điều tra KS. Dạng cổ điển của KS được đặc trưng bởi thiếu hụt gonadotropin đơn độc, mất khứu giác và di truyền liên kết X. Rối loạn này là do các đột biến trong anosmin 1 được mã hóa bởi gen ANOS1 / KAL1, dẫn đến sự thất bại của các nơron GnRH trong việc di chuyển đến vùng dưới đồi. MRI có thể xác nhận kích thước giảm hoặc sự vắng mặt hoàn toàn của các hành khứu. Các đặc điểm không liên quan đến sinh sản có thể bao gồm bất sản thận một bên và đồng vận động (“vận động soi gương,” với các vận động ở một bên cơ thể gây ra các vận động không tự chủ ở bên đối diện). Các đột biến ANOS1 cũng liên quan đến tỷ lệ mắc tinh hoàn ẩn, dương vật nhỏ và nồng độ inhibin B giảm tương đối cao.
Danh sách các gen liên quan đến HH đang mở rộng, và các kiểu hình không liên quan đến sinh sản liên quan đến gen gây bệnh trong một số trường hợp. Cho đến nay, nhiều đột biến đã được xác định trong gen FGFR1, nguyên nhân trội trên nhiễm sắc thể thường phổ biến nhất của KS; các đặc điểm liên quan có thể bao gồm các bất thường về xương, mất thính giác và đồng vận động. Các đột biến trong FGF8, phối tử cho FGFR1, đã được liên kết với tật não trước không phân chia, loạn sản vách-thị và hội chứng Moebius. Các đặc điểm lâm sàng không liên quan đến sinh sản của bệnh nhân có đột biến PROK2 và PROK2R, mã hóa prokineticin 2 và thụ thể ghép cặp với protein G của nó, tương ứng, bao gồm loạn sản xơ, béo phì, đồng vận động và động kinh. Một nghiên cứu đã báo cáo một bệnh nhân dị hợp tử cho cả đột biến PROKR2 và đột biến ANOS1, cho thấy một phương thức di truyền hai gen có thể xảy ra trong một số trường hợp. Các đột biến trong CHD7 có thể liên quan đến các đặc điểm khác của hội chứng CHARGE (coloboma, khuyết tật tim, hẹp lỗ mũi sau, chậm phát triển, bất thường sinh dục và bất thường tai). Cả khứu giác bình thường và mất khứu giác đã được báo cáo cho tất cả các gen này.
Yếu tố tín hiệu synap-hạt nhân và di chuyển nơron của thụ thể NMDA (NSMF, còn được gọi là yếu tố LHRH phôi mũi, NELF) cũng có liên quan đến KS. NSMF dường như có một vai trò quan trọng như một phân tử hướng dẫn chung cho các sợi trục khứu giác và sau đó, trực tiếp hoặc gián tiếp trong sự di chuyển của các nơron GnRH. Một lần xóa dị hợp tử trong NSMF ban đầu được báo cáo là một thành phần của KS hai gen, cùng với FGFR1, nhưng kể từ đó đã có báo cáo rằng NSMF có thể dẫn đến HH hoặc KS thông qua di truyền đơn gen rõ ràng.
Các đột biến trong HS6ST1, SEMA3A, và WDR11, cũng đã được xác định ở những bệnh nhân bị HH. Trong các gia đình mang đột biến trong các gen này, sự không đồng nhất về kiểu hình đối với chứng mất khứu giác xảy ra, và HH thường phân ly như một đặc điểm phức tạp được tìm thấy kết hợp với các đột biến ở các gen khác. Do đó, vẫn cần xác định liệu các đột biến chỉ trong các gen này có đủ để dẫn đến thiếu hụt GnRH hay không. Các đột biến trong các gen mã hóa protein, chẳng hạn như FGF17 và IL17RD điều chỉnh hiệu quả tín hiệu của FGF8 thông qua FGFR1, đã được xác định, cho thấy sự tồn tại của một nhóm đồng biểu hiện FGF8 có thể tạo thành một cơ sở đa gen cho HH.
Các gen liên quan đến chức năng nơron giải phóng Gonadotropin
Các tình trạng ảnh hưởng đến chức năng nơron GnRH nhưng không ảnh hưởng đến sự phát triển nơron GnRH được cho là sẽ gây ra loại IHH có khứu giác bình thường, cũng như các tình trạng gây kháng GnRH. Thật vậy, các đột biến trong GNRHR, mã hóa thụ thể GnRH, chiếm 3,5% đến 10,4% các trường hợp HH có khứu giác bình thường. Điều thú vị là, một trường hợp CDGP cũng có liên quan đến một đột biến mất chức năng một phần đồng hợp tử trong GNRHR, và các phả hệ của các bệnh nhân chỉ điểm bị HH có thể bao gồm các cá nhân bị dậy thì muộn nhưng phát triển bình thường. Các đột biến trong GNRH1 cũng đã được xác định ở những bệnh nhân bị HH có khứu giác bình thường nhưng chỉ trong các báo cáo ca hiếm gặp.
Các đột biến trong KISS1 và KISS1R, mã hóa kisspeptin và thụ thể của nó, tương ứng, là những nguyên nhân hiếm gặp của IHH. Các đột biến trong các gen mã hóa neurokinin B và thụ thể của nó, TAC3 và TACR3, tương ứng, đã được xác định ở bệnh nhân IHH. Như đã lưu ý trước đây, các gen này được biểu hiện cao trong cùng các nơron biểu hiện kisspeptin, nhấn mạnh vai trò của kisspeptin trong việc điều hòa thời điểm dậy thì. Gen của prohormone convertase-1 (PCSK1) đã được liên kết với béo phì, HH, đái tháo đường thiếu insulin và thiếu hụt ACTH, với HH được cho là do quá trình xử lý khiếm khuyết của các neuropeptide và prohormone là thành phần của sự bài tiết GnRH. Điều kỳ lạ là, các bệnh nhân đã được báo cáo là có HH có thể hồi phục, với việc đạt được hoạt động nội tiết sinh sản bình thường ở tuổi trưởng thành, mặc dù mang các đột biến mất chức năng trong các gen FGFR1, CHD7, TAC3, hoặc TACR3. Cơ chế sinh học cho sự thiếu hụt gonadotropin có thể hồi phục này vẫn chưa rõ ràng, và vẫn có khả năng một số trường hợp HH có thể đại diện cho các phiên bản nghiêm trọng của CDGP, làm mờ nhạt thêm sự phân biệt giữa HH và CDGP.
Các gen điều chỉnh chức năng nơron giải phóng Gonadotropin
Hormone leptin của tế bào mỡ dường như hoạt động như một yếu tố cho phép trong quá trình trưởng thành dậy thì, nhấn mạnh tầm quan trọng của dinh dưỡng đầy đủ trong việc điều chỉnh sự trưởng thành và chức năng của trục HPG. HH kèm theo béo phì có thể là kết quả của các khiếm khuyết trong tín hiệu leptin do các đột biến trong gen leptin (LEP) hoặc thụ thể leptin (LEPR). Hơn nữa, các nghiên cứu GWA đã chứng minh rằng các biến thể di truyền phổ biến gần LEPR ảnh hưởng đến thời điểm dậy thì, nhấn mạnh vai trò của leptin trong việc điều hòa hoạt động của nơron GnRH. Các mục tiêu nơron cho hoạt động của leptin chưa được giải thích đầy đủ vì các thụ thể leptin không được biểu hiện bởi các nơron GnRH, cho thấy rằng vị trí hoạt động của leptin có thể ở thượng nguồn của các nơron GnRH.
Các gen liên quan đến sự phát triển của tuyến yên
Các đột biến trong gen thụ thể GnRH (GNRHR) là một trong những nguyên nhân phổ biến hơn của IHH có khứu giác bình thường. Kiểu hình dao động từ biểu hiện sơ sinh với dương vật nhỏ và tinh hoàn ẩn đến biểu hiện ở tuổi vị thành niên là DP. Các đột biến trong các gen mã hóa FSH-beta và LH-beta cũng đã được mô tả. Các bất thường phát triển của tuyến yên, chẳng hạn như các khiếm khuyết đường giữa hoặc loạn sản vách-thị, có thể liên quan đến thiếu hụt gonadotropin và các hormone tuyến yên khác. Các gen liên quan đến các bất thường phát triển của tuyến yên bao gồm HESX1, SOX2, PITX2, LHX3, và PROP1, cũng như một số gen được biết là gây ra HH, chẳng hạn như FGFR1, FGF8, và PROKR2.
Các tình trạng ảnh hưởng đến cả vùng dưới đồi và tuyến yên
Thiểu sản tuyến thượng thận bẩm sinh là một rối loạn liên kết X gây ra bởi các đột biến trong NR0B1 / DAX1 và được đặc trưng bởi suy thượng thận nguyên phát và một kiểu suy sinh dục phức tạp. Trong rối loạn này, vỏ thượng thận của thai nhi phát triển bình thường, nhưng vùng trưởng thành của vỏ thượng thận không phát triển. Nam giới bị ảnh hưởng có thể biểu hiện suy thượng thận ở 6 đến 8 tuần tuổi. Nếu được đánh giá, dậy thì mini của giai đoạn sơ sinh có thể có mặt, nhưng bệnh nhân sau đó biểu hiện HH ở tuổi vị thành niên, và một số có thể lần đầu tiên đến khám vì DP. Sự bài tiết GnRH của vùng dưới đồi giảm hoặc khả năng đáp ứng của tuyến yên giảm có thể xảy ra dẫn đến giảm nồng độ LH, FSH và testosterone. Điều thú vị là, bệnh nhân cũng có thể bị suy tuyến sinh dục nguyên phát bị che giấu bởi HH. Các đột biến trong gen này có thể là một phần của hội chứng xóa gen liền kề cũng gây ra loạn dưỡng cơ Duchenne và thiếu hụt glycerol kinase. Các đột biến trong NR5A1/SF-1 cũng có thể ảnh hưởng đến sự phát triển của cả vùng dưới đồi và tuyến yên.
Các nguyên nhân không do di truyền cũng có thể gây ra HH. Các yếu tố không do di truyền, chẳng hạn như lạm dụng cocaine của mẹ, độc tính valproate và các sự kiện phá vỡ mạch máu trong tử cung có thể gây ra các bất thường phát triển CNS và dẫn đến HH. Các khối u nội sọ cũng có thể dẫn đến HH. Khối u phổ biến nhất là u sọ hầu, được cho là phát sinh từ tàn dư của túi Rathke. Các triệu chứng khác có thể bao gồm giảm tốc độ tăng trưởng, đau đầu, đa niệu/khát nhiều và rối loạn thị giác. Vôi hóa trên yên hoặc trong tế bào có thể được phát hiện trên các phim chụp cắt lớp vi tính (CT). Các khối u khác bao gồm các khối u tế bào mầm, u nang biểu bì và bì, u tiết prolactin và u tế bào thần kinh đệm thị giác. Bệnh mô bào X được đặc trưng bởi sự xâm nhập của các mô bào chứa đầy lipid vào da, xương hoặc các cơ quan nội tạng. Mặc dù đái tháo nhạt là biểu hiện nội tiết phổ biến nhất của bệnh mô bào X, các thiếu hụt hormone tuyến yên trước khác có thể xảy ra.
Tăng prolactin máu cũng có thể dẫn đến HH, vì prolactin ức chế sự bài tiết GnRH theo nhịp. Tăng prolactin máu có thể do một khối u tiết prolactin, bao gồm các u tuyến yên nhỏ (u tuyến < 10 mm) và u tuyến lớn (> 10 mm) và cũng có thể do sự gián đoạn của cuống tuyến yên, vì việc giải phóng dopamine từ vùng dưới đồi ức chế sự bài tiết prolactin. MRI cung cấp chi tiết giải phẫu tốt hơn so với CT scan. Tăng prolactin máu cũng có thể do suy giáp nguyên phát (vì hormone giải phóng thyrotropin cũng gây ra sự bài tiết prolactin) hoặc các loại thuốc hướng thần có đặc tính kháng dopaminergic.
Cuối cùng, một số hội chứng có liên quan đến HH. Các hội chứng này bao gồm Prader-Willi, Bardet-Biedl, Alström, và Bloom. Bệnh nhiễm sắc tố sắt di truyền dẫn đến quá tải sắt và lắng đọng sắt trong các cơ quan nội tiết dẫn đến HH, giảm dung nạp glucose và đái tháo đường.
Dậy thì muộn tự giới hạn hoặc Chậm tăng trưởng và dậy thì thể tạng
Dậy thì muộn tự giới hạn hoặc CDGP là một tình trạng trong đó dậy thì bắt đầu muộn nhưng, một khi đã bắt đầu, sẽ tiến triển đến sự trưởng thành sinh dục hoàn toàn. Sự chậm trễ cũng có thể được thấy trong các khía cạnh khác của sự tăng trưởng và phát triển thể chất. Việc xem xét các hồ sơ tăng trưởng thường cho thấy rằng sự tăng trưởng tuyến tính trong vài năm đầu đời chậm lại, sau đó tốc độ tăng trưởng đi theo các phân vị thấp hơn so với dự kiến dựa trên chiều cao của cha mẹ trong thời thơ ấu. Sự trưởng thành của xương thường cũng bị trì hoãn. Nguyên nhân của DP tự giới hạn chưa được biết. Các nguyên nhân được đề xuất bao gồm tăng tổng chi tiêu năng lượng và tăng độ nhạy insulin, nhưng không có nguyên nhân xác định nào được xác định.
DP tự giới hạn có một cơ sở di truyền mạnh mẽ. Năm mươi phần trăm đến 80% sự biến thiên của thời điểm dậy thì ở người là do các yếu tố di truyền, và 50% đến 75% các cá nhân bị DP tự giới hạn có tiền sử gia đình bị DP. Các kiểu di truyền được quan sát thấy trong các phả hệ bị DP tự giới hạn là khác nhau nhưng thường phù hợp nhất với kiểu di truyền trội trên nhiễm sắc thể thường, có hoặc không có độ xâm nhập hoàn toàn. Di truyền của DP tự giới hạn không đặc hiệu theo giới tính và được đặc trưng bởi các thành viên trong gia đình có sự phát triển tương đối chậm (ví dụ, tuổi có kinh trung bình của các bà mẹ của các cá nhân bị DP tự giới hạn là 14,3 tuổi so với trung bình 12,7 tuổi ở nhóm chứng) hoặc bằng chứng về thời điểm dậy thì đáp ứng các tiêu chí lâm sàng cho DP.
Như đã thảo luận trước đó, việc điều tra các nguyên nhân của HH kéo dài—KS và IHH—đã dẫn đến việc xác định các gen đóng vai trò quan trọng trong sự phát triển và điều hòa của trục HPG. Một số nghiên cứu, nhưng không phải tất cả, cho thấy rằng các đột biến trong các gen được xác định cho đến nay cũng có thể gây ra DP tự giới hạn, nhưng hầu hết các trường hợp DP tự giới hạn không liên quan đến các đột biến trong các gen IHH/KS. Các locus có liên quan đến tuổi có kinh trong dân số chung cũng có liên quan đến sự thay đổi trong thời điểm dậy thì ở các bé trai, với một số khác biệt nhỏ về giới tính đã được ghi nhận; tuy nhiên, sinh lý bệnh nội tiết thần kinh và cơ sở di truyền của nó vẫn chưa rõ ràng ở phần lớn bệnh nhân bị DP tự giới hạn. Kiểu hình của DP tự giới hạn đại diện cho phần đuôi của một đặc điểm phân bố chuẩn trong dân số. Do đó, các phân tích di truyền của các gia đình bị DP tự giới hạn bị phức tạp bởi thực tế là các biến thể gen chi phối sự di truyền của tình trạng này cũng có thể được tìm thấy trong dân số chung ở mức độ thấp, làm nhiễu loạn việc giải thích dữ liệu từ các nghiên cứu giải trình tự.
Một vài nghiên cứu đã kiểm tra cụ thể sự đóng góp của các đột biến trong các gen là cơ sở của KS/IHH vào kiểu hình của DP tự giới hạn. Trong một nghiên cứu giải trình tự trực tiếp đánh giá sự biến đổi trong FGFR1, GNRHR, TAC3, và TACR3 ở 146 đối tượng người Phần Lan, các biến thể trong các vùng mã hóa của các gen này không được xác định là nguyên nhân có khả năng gây ra CDGP trong dân số chung. Tương tự, sự biến đổi di truyền trong cả GNRH1 và GNRHR cũng như các gen liên quan đến HH khác không phải là nguyên nhân phổ biến của dậy thì muộn trong dân số chung. Sự biến đổi trong FGFR1 cũng không phải là một nguyên nhân chính của CDGP, mặc dù các đột biến mất chức năng trong FGFR1 có thể gây ra DP ở các thành viên của các phả hệ HH.
Ngược lại, một nghiên cứu khác đã xác định các đột biến trong FGFR1, cũng như HS6ST1 và Klotho Beta (KLB), trong một số dòng họ của bệnh nhân KS/IHH và người thân của họ có kiểu hình DP không liên quan đến thiếu hụt GnRH kéo dài. Ngoài ra, một số lượng hạn chế các biến thể trong các gen KS/IHH bao gồm GNRHR, TAC3, TACR3, IL17RD, SEMA3 đã được phát hiện bằng cách giải trình tự toàn bộ exome trong một số trường hợp DP tự giới hạn. Tuy nhiên, nhiều biến thể trong số này chưa được kiểm tra trong ống nghiệm hoặc trong cơ thể sống về khả năng gây bệnh, hoặc được điều tra về sự phân ly với đặc điểm trong các phả hệ, và do đó, phát hiện này có thể là một sự đánh giá quá cao về tần suất các gen KS/IHH được tìm thấy trong DP tự giới hạn. Gần đây nhất, một nghiên cứu so sánh tần suất các đột biến trong 24 gen KS/IHH giữa các bệnh nhân chỉ điểm bị DP tự giới hạn và những người bị KS/IHH đã tìm thấy một tỷ lệ đột biến cao hơn đáng kể trong nhóm KS/IHH (51% bệnh nhân chỉ điểm KS/IHH so với 7% bệnh nhân chỉ điểm DP, P = 7,6 × 10<sup>-11</sup>). Cùng một nghiên cứu cũng báo cáo một tỷ lệ đa gen cao hơn trong nhóm KS/IHH, cho thấy rằng cấu trúc di truyền của nhóm KS/IHH khác biệt so với DP tự giới hạn. Ngoài ra, các đột biến trong các gen KS, chẳng hạn như ANOS1 và NELF, chưa được xác định trong các phả hệ bị DP cho đến nay.
Do đó, mặc dù dữ liệu đôi khi mâu thuẫn, nhưng nhìn chung, tổng hợp các dữ liệu có sẵn cho thấy rằng mặc dù có thể có một số sự chồng chéo, nhưng nền tảng di truyền của IHH/KS và DP phần lớn là khác nhau hoặc được chia sẻ bởi các gen chưa được khám phá.
Sự biến đổi di truyền trong gen thụ thể GnRH (GNRHR) là một ví dụ khác về sự chồng chéo một phần nhưng phần lớn là bệnh sinh riêng biệt. Các đột biến mất chức năng trong gen thụ thể GnRH là nguyên nhân thường xuyên nhất của IHH lặn trên nhiễm sắc thể thường có khứu giác bình thường, chiếm 16% đến 40% bệnh nhân. Mặt khác, sự biến đổi trong DP tự giới hạn là cực kỳ hạn chế. Cho đến nay, một đột biến mất chức năng một phần đồng hợp tử trong GNRHR đã được tìm thấy chỉ ở hai anh em, một người bị DP tự giới hạn và một người bị IHH có khứu giác bình thường, và một đột biến dị hợp tử khác được tìm thấy ở một nam giới bị DP tự giới hạn.
Các gen là cơ sở của DP tự giới hạn gần đây đã được xem xét (https://www.ncbi.nlm.nih.gov/pubmed/?term=31220230). Các phương pháp giải trình tự toàn bộ exome và tái giải trình tự mục tiêu từ một đoàn hệ lớn của Phần Lan đã liên quan đến hai đột biến gây bệnh trong thành viên siêu họ immunoglobulin 10 (IGSF10) là yếu tố gây ra DP tự giới hạn ở sáu gia đình không có quan hệ họ hàng. Các nghiên cứu chức năng chỉ ra rằng các đột biến trong IGSF10 dường như gây ra sự rối loạn điều hòa di chuyển nơron GnRH trong quá trình phát triển phôi thai, biểu hiện ở tuổi vị thành niên là DP đơn thuần, mà không ảnh hưởng đến tốc độ tăng trưởng tuyến tính tiền dậy thì. Các đột biến IGSF10 gây bệnh dẫn đến tín hiệu IGSF10 bị gián đoạn có thể dẫn đến số lượng giảm hoặc sự đến không đúng lúc của các nơron GnRH tại vùng dưới đồi, cho thấy rằng một mạng lưới thần kinh tiết GnRH nguyên vẹn là cần thiết cho nhịp độ thời gian chính xác của dậy thì. Một hệ thống khiếm khuyết di chuyển nơron GnRH có thể gây ra một “ngưỡng” tăng lên cho sự khởi đầu của dậy thì, với sự chậm trễ sau đó trong thời điểm dậy thì. Các đột biến mất chức năng IGSF10 cũng được phát hiện ở những bệnh nhân bị vô kinh do vùng dưới đồi. Mặc dù các đột biến mất chức năng trong IGSF10 cũng được làm giàu ở những bệnh nhân bị KS/IHH, nhưng những đột biến này dường như không đủ để gây ra kiểu hình thiếu hụt GnRH hoàn toàn. Những phát hiện này đại diện cho một khái niệm mới về nguồn gốc bào thai của DP tự giới hạn.
Phân tích sâu hơn các cá nhân từ đoàn hệ mà trong đó IGSF10 được xác định cũng cung cấp thêm dữ liệu ủng hộ sự chồng chéo một phần giữa các gen KS/IHH và DP. Một đột biến có hại trong gen KS/IHH HS6ST1 được tìm thấy là yếu tố gây ra DP tự giới hạn trong một phả hệ từ cùng một đoàn hệ lớn của bệnh nhân bị DP gia đình. Biến thể này được mang bởi sáu thành viên gia đình từ ba thế hệ, tất cả đều có các đặc điểm điển hình của DP tự giới hạn. Trong cùng một báo cáo, các nghiên cứu song song trong một mô hình chuột đã chứng thực sự thiếu hụt Hs6st1 dị hợp tử là nguyên nhân gây ra thời điểm dậy thì muộn mà không ảnh hưởng đến khả năng sinh sản. Chuột Hs6st1 +/- được sinh ra với tỷ lệ Mendel bình thường mà không có khiếm khuyết rõ ràng trong sự phát triển nơron GnRH hoặc tinh hoàn, nhưng sau đó chúng biểu hiện khởi phát dậy thì muộn. Thiếu hụt GnRH đã được loại trừ bằng năng lực sinh sản và bằng quá trình sinh tinh bình thường ở con đực. Những phát hiện này cho thấy rằng những xáo trộn trong một alen duy nhất của một gen điều chỉnh trục HPG là đủ để gây ra DP tự giới hạn. Hơn nữa, dữ liệu từ ví dụ này cho thấy rằng những thay đổi có hại hơn trong cùng một gen, hoặc kết hợp với các gen bổ sung, có thể gây ra các kiểu hình KS/IHH nghiêm trọng hơn.
Các đột biến trong các gen liên quan đến khối lượng cơ thể và thời điểm dậy thì trong dân số chung cũng có thể là cơ sở của DP tự giới hạn. Trong một nghiên cứu gần đây, các biến thể hiếm, gây bệnh được chú thích chức năng trong FTO được phát hiện gây ra DP tự giới hạn gia đình ở ba gia đình. Các đột biến này cũng liên quan đến sự gầy gò ở những đối tượng này.
Sự kiểm soát nội tiết thần kinh của dậy thì được điều hòa bởi một mạng lưới các yếu tố phiên mã được tổ chức theo cấp bậc hoạt động ở thượng nguồn của GnRH (Hình 18.2). Chúng bao gồm yếu tố tăng cường ở tuổi dậy thì 1 (EAP1), góp phần vào sự khởi đầu của dậy thì thông qua việc kích hoạt chuyển mã của promoter GnRH. Gần đây, các đột biến EAP1 đầu tiên dẫn đến giảm hoạt động phiên mã GnRH dẫn đến một kiểu hình DP tự giới hạn đã được báo cáo.
Suy sinh dục do giảm Gonadotropin chức năng
Các nguyên nhân tạm thời của HH hoặc HH chức năng, trong đó sự chậm trễ dậy thì là thứ phát sau tác động của các tình trạng tiềm ẩn, là nguyên nhân ở 10% đến 20% bệnh nhân bị DP, có khả năng ảnh hưởng đến nữ giới nhiều hơn nam giới (xem Bảng 18.2). Ví dụ về các tình trạng này bao gồm chán ăn tâm thần, là một rối loạn mãn tính được đặc trưng bởi giảm lượng calo nạp vào, giảm cân và hoạt động thể chất quá mức. Mặc dù chán ăn tâm thần chủ yếu ảnh hưởng đến nữ giới, khoảng 10% bệnh nhân là nam giới. Loãng xương và loãng xương nặng là những hậu quả tiềm tàng. Ngoài nồng độ gonadotropin thấp, nồng độ cortisol, GH và T3 ngược có thể tăng cao. Các rối loạn mãn tính, chẳng hạn như thiếu máu hồng cầu hình liềm, thalassemia, xơ nang, bệnh viêm ruột, bệnh celiac và bệnh thận mãn tính cũng có thể liên quan đến DP. Hoạt động thể chất cường độ cao và nhu cầu “ép cân” ở các đô vật có thể làm gián đoạn sự phát triển dậy thì. Đối với các đô vật, những thay đổi này thường đảo ngược trong vòng vài tháng sau khi kết thúc mùa đấu vật.
Suy sinh dục do tăng Gonadotropin
Suy tuyến sinh dục nguyên phát dẫn đến mất ức chế phản hồi âm và suy sinh dục do tăng gonadotropin. Mặc dù chúng chỉ chiếm 5% đến 10% các nguyên nhân gây DP, nhưng các nguyên nhân trong loại này rất rộng và bao gồm tổn thương và/hoặc mất tuyến sinh dục, biệt hóa tuyến sinh dục bất thường, và các rối loạn ảnh hưởng đến quá trình tổng hợp và hoạt động của hormone steroid. Một số rối loạn, chẳng hạn như hội chứng Klinefelter, hội chứng Noonan và hội chứng Prader-Willi ảnh hưởng đến chức năng của cả tế bào Leydig và Sertoli.
Hóa trị, Xạ trị và Tỷ lệ sống sót sau ung thư
Điều trị ung thư ở trẻ em có thể dẫn đến suy tuyến sinh dục, DP và vô sinh. Khi các phương pháp điều trị đã được cải thiện, những lo ngại về chất lượng cuộc sống ngày càng trở nên phù hợp vì nhiều bệnh nhân ung thư trẻ tuổi trở thành những người sống sót sau ung thư lâu dài. Nhiều thành phần của trục HPG có thể bị ảnh hưởng bởi hóa trị và xạ trị với những hậu quả cụ thể, tùy thuộc vào các loại thuốc và trường chiếu xạ. Các tế bào mầm của tuyến sinh dục đặc biệt dễ bị tổn thương bởi bức xạ. Các cuộc thảo luận về bảo tồn khả năng sinh sản là rất quan trọng đối với bệnh nhân ung thư nhi và cha mẹ của họ; tuy nhiên, thảo luận chi tiết về chủ đề quan trọng này nằm ngoài phạm vi của chương này.
Hội chứng không nhạy cảm với Androgen và Loạn sản tuyến sinh dục
Hội chứng không nhạy cảm với androgen ở các cá thể 46,XY; loạn sản tuyến sinh dục ở các cá thể 46,XY hoặc ở các cá thể có thể khảm/thể đa bội ảnh hưởng đến nhiễm sắc thể Y; và các rối loạn phát triển giới tính tinh hoàn và buồng trứng-tinh hoàn ở các cá thể 46,XX đều có thể dẫn đến một loạt các kiểu hình. Mặc dù nhiều trường hợp biểu hiện sớm do bộ phận sinh dục không rõ ràng và/hoặc không tương xứng giữa hình dạng bộ phận sinh dục và một bộ nhiễm sắc thể đã được xác định trước đó, một số trường hợp có thể không có kiểu hình bên ngoài rõ ràng hoặc một kiểu hình nhẹ (ví dụ, lỗ tiểu lệch thấp đơn độc). Trong những trường hợp này, tình trạng này có thể không được nhận ra là một sự khác biệt trong phát triển giới tính (DSD), và bệnh nhân có thể lần đầu tiên đến khám để đánh giá sự phát triển dậy thì bị đình trệ. Các tình trạng này, cũng như các DSD khác, chẳng hạn như những tình trạng gây ra bởi các khiếm khuyết sinh steroid có thể gây ra thiếu sự phát triển dậy thì nội sinh hoàn toàn, được thảo luận sâu rộng trong Chương 6.
Các hội chứng liên quan đến dậy thì muộn hoặc bị đình trệ
Hội chứng Klinefelter, có liên quan đến bộ nhiễm sắc thể 47,XXY, không phải là nguyên nhân của DP tự thân nhưng có thể là nguyên nhân của một quá trình dậy thì kéo dài hoặc bị đình trệ. Tỷ lệ mắc được báo cáo là một trong 667 khi được xác định bằng phân tích tế bào học trước sinh, nhưng thấp hơn nhiều khi chỉ được xác định bằng các đặc điểm lâm sàng. Do đó, có khả năng xảy ra việc xác định không đầy đủ các cá nhân bị ảnh hưởng.
Các đặc điểm lâm sàng điển hình của hội chứng Klinefelter là tinh hoàn nhỏ, chắc; tầm vóc cao; dương vật nhỏ; và nữ hóa tuyến vú. Các bé trai có bộ nhiễm sắc thể khảm với một dòng tế bào 46,XY bình thường có xu hướng có kiểu hình nhẹ hơn. Tầm vóc cao có thể do một bản sao thừa của gen chứa hộp homeobox tầm vóc thấp (SHOX) trong vùng giả nhiễm sắc thể thường của nhiễm sắc thể X. Cả sự bài tiết androgen và quá trình sinh tinh đều bị suy giảm. Nồng độ inhibin B tương đối bình thường trong thời thơ ấu nhưng giảm trong quá trình dậy thì, phù hợp với sự suy tinh hoàn tiến triển. Nồng độ AMH tương tự cũng theo mô hình nam giới bình thường nhưng giảm dần từ giữa tuổi vị thành niên do rối loạn chức năng tế bào Sertoli.
Thể tích tinh hoàn giảm là thứ phát sau sự thoái hóa của các ống sinh tinh. Mức độ thiếu hụt testosterone và suy tinh hoàn khác nhau giữa những người đàn ông bị ảnh hưởng, nhưng hầu hết nam giới đều cần điều trị bằng testosterone vào một thời điểm nào đó. Mục tiêu điều trị bao gồm phát triển các đặc điểm sinh dục phụ, tăng khối lượng cơ, mật độ xương tối ưu và chức năng tình dục.
Ngoài việc giảm số lượng tế bào mầm, cấu trúc tinh hoàn tương đối bình thường ở tinh hoàn của thai nhi và tiền dậy thì. Mất tế bào mầm bắt đầu trong tử cung, đỉnh điểm là xơ hóa và hyalin hóa các ống sinh tinh, là nguyên nhân trực tiếp gây vô sinh liên quan đến hội chứng Klinefelter. Bảo tồn khả năng sinh sản là một chủ đề phù hợp cho các bé trai vị thành niên lớn tuổi. Một số nam giới bị Klinefelter có ít tinh trùng và có thể có con mà không cần can thiệp y tế. Đối với những người khác, việc làm cha đã được thực hiện bằng vi phẫu và chiết xuất tinh trùng từ tinh hoàn kết hợp với tiêm tinh trùng vào bào tương trứng (microTESE-ICSI), và con cái dường như không có nguy cơ gia tăng về bất thường số lượng nhiễm sắc thể giới tính.
Các đặc điểm không liên quan đến sinh sản có thể bao gồm tỷ lệ mắc bệnh đái tháo đường týp 2, ung thư vú, các khối u trung thất và bệnh mạch máu tăng lên. Khó khăn về học tập và cảm xúc là phổ biến, và một số bé trai được phát hiện thông qua các khuyết tật học tập của họ. Kiểu hình nhận thức được đặc trưng bởi các khiếm khuyết về ngôn ngữ và chức năng điều hành. Rối loạn chức năng điều hành được đặc trưng bởi khả năng ra quyết định, giải quyết vấn đề, suy luận và lập kế hoạch kém. Khó khăn trong việc tự kiểm soát, tăng tính mất tập trung và giảm các kỹ năng vận động tinh và thô là phổ biến.
Mặc dù đã biết nhiều, nhưng cũng có một số câu hỏi chưa được trả lời về việc quản lý các bé trai mắc hội chứng Klinefelter. Những câu hỏi này bao gồm: việc lưu trữ/chiết xuất tinh trùng ở đầu tuổi vị thành niên so với tuổi trưởng thành trẻ có mang lại tỷ lệ thành công cao hơn không? Các khiếm khuyết về hành vi và nhận thức có được cải thiện bằng cách sử dụng testosterone ở đầu thời thơ ấu hoặc thậm chí giai đoạn sơ sinh không? Testosterone có nên được sử dụng ở tuổi vị thành niên ngay cả khi các giá trị LH vẫn trong phạm vi bình thường không? Các chủ đề này là lĩnh vực điều tra tích cực, và kết quả sẽ ảnh hưởng đến việc chăm sóc những cá nhân này trong tương lai.
Hội chứng Noonan là một rối loạn trội trên nhiễm sắc thể thường được đặc trưng bởi tầm vóc thấp, sụp mí, hai mắt xa nhau, thiểu năng trí tuệ nhẹ và bệnh tim bẩm sinh. Tinh hoàn ẩn là phổ biến ở nam giới. Khoảng 50% các trường hợp là do các đột biến trong gen protein-tyrosine phosphatase, nonreceptor type 11 protein (PTPN11) (còn được gọi là SHP2). Các gen khác liên quan đến hội chứng Noonan bao gồm KRAS, SOS1, NRAS, và RAF1. Các protein được mã hóa bởi các gen này là thành viên của con đường tín hiệu RAS-MAPK. Trong một nghiên cứu theo chiều dọc, nồng độ LH, FSH, testosterone, AMH và inhibin B tương đương với các bé trai khỏe mạnh trước khi bắt đầu dậy thì. Tuy nhiên, một số cá nhân mắc hội chứng Noonan bị DP, và nam giới trưởng thành mắc hội chứng Noonan có nồng độ LH, FSH và testosterone cao hơn và nồng độ AMH và inhibin B thấp hơn so với nhóm chứng khỏe mạnh.
Hội chứng Prader-Willi cũng có thể liên quan đến DP. Tinh hoàn ẩn là phổ biến ở các bé trai mắc hội chứng Prader-Willi. Nồng độ inhibin B thường bình thường ở trẻ sơ sinh và các bé trai tiền dậy thì. Khi dậy thì tiến triển, nồng độ inhibin B giảm và nồng độ FSH tăng. Mô học tinh hoàn thay đổi và được báo cáo là dao động từ bình thường đến vắng mặt hoàn toàn tinh nguyên bào (hội chứng chỉ có tế bào Sertoli). Dữ liệu theo chiều dọc cho thấy rằng suy sinh dục ở các bé trai mắc hội chứng Prader-Willi có khả năng do rối loạn chức năng tinh hoàn nguyên phát liên quan đến cả khoang tế bào Sertoli và Leydig. Chức năng trục HPG không đầy đủ cũng có thể góp phần vào suy sinh dục.
Hậu quả của dậy thì muộn
Các steroid sinh dục là cần thiết cho việc thu nhận và duy trì mật độ khoáng của xương (BMD). Nam giới bị IHH có BMD thấp hơn, nam giới mắc hội chứng Klinefelter có nguy cơ loãng xương cao hơn, và một số nghiên cứu đã gợi ý rằng điều này cũng đúng với nam giới có tiền sử chậm phát triển thể tạng. Các nghiên cứu ngẫu nhiên hóa Mendel đã chứng minh rằng mối liên quan giữa dậy thì muộn và BMD có khả năng là nhân quả, tức là, chính thời điểm dậy thì muộn dẫn đến giảm BMD ở tuổi trưởng thành.
Các nghiên cứu dịch tễ học ban đầu đã chứng minh rằng thời điểm dậy thì sớm hơn có liên quan đến nguy cơ gia tăng bệnh tim mạch ở tuổi trưởng thành. Một nghiên cứu lớn hơn hiện đã cho thấy rằng mối quan hệ này không tuyến tính ở phụ nữ, do đó cả thời điểm dậy thì sớm và muộn đều cho thấy nguy cơ gia tăng này. Tuy nhiên, dữ liệu ở nam giới cho thấy rằng thời điểm dậy thì muộn hơn có tác dụng bảo vệ chống lại các kết quả tim mạch.
Vỡ giọng muộn cũng có liên quan đến nguy cơ gia tăng các vấn đề tâm thần, chẳng hạn như lo âu và trầm cảm, cũng như các tình trạng dị ứng, bao gồm chàm và hen suyễn. Đối với tất cả các mối liên quan này, người ta tự hỏi liệu việc can thiệp kịp thời bằng điều trị steroid sinh dục có thể làm giảm các nguy cơ này hay không. Một nghiên cứu đã chứng minh rằng tuổi bắt đầu điều trị testosterone sớm hơn có liên quan đến BMD cao hơn ở nam giới bị IHH; tuy nhiên, đối với hầu hết các mối liên quan này, bằng chứng trực tiếp về lợi ích của việc điều trị steroid sinh dục đối với nguy cơ bệnh tật ở người trưởng thành còn thiếu.
Đánh giá một thanh niên bị dậy thì muộn
Đánh giá ban đầu
Mục tiêu của việc đánh giá ban đầu là loại trừ các nguyên nhân gây DP khác ngoài CDGP (Bảng 18.3 và Hình 18.8). Sự tiến triển bình thường cuối cùng của dậy thì xác minh chẩn đoán CDGP, trong khi sự phát triển vắng mặt hoặc chậm, hoặc ngừng phát triển sau khi khởi phát, phù hợp với suy sinh dục kéo dài. Dù là do sự thiên vị trong việc giới thiệu bệnh nhân hay do sự khác biệt trong sinh học cơ bản, nhiều bé trai hơn bé gái được khám tại các phòng khám nội tiết vì DP nói chung và CDGP nói riêng.
Bảng 18.3 Các xét nghiệm cho dậy thì muộn
| Xét nghiệm hàng đầu | Yêu cầu và Hạn chế | Diễn giải |
|---|---|---|
| Tốc độ tăng trưởng | Hai hoặc nhiều lần đo chiều cao, tốt nhất là cách nhau 6-12 tháng. | Ở đầu tuổi vị thành niên ở cả hai giới, tốc độ tăng trưởng dưới 3 cm/năm gợi ý một bệnh đặc biệt ức chế tăng trưởng (ví dụ, thiếu hụt GH, tăng cortisol, suy giáp), nhưng tốc độ như vậy cũng có thể thấy ở CDGP. Các bé trai bị dậy thì muộn thừa cân có xu hướng có chiều cao và chiều cao dự đoán của người trưởng thành phù hợp với tiềm năng chiều cao di truyền. |
| Các giai đoạn Tanner | Các giai đoạn lông mu và giai đoạn sinh dục nên được chấm điểm riêng vì chúng không nhất thiết đi cùng nhau. | Thể tích tinh hoàn ≥ 4 mL là một chỉ số đáng tin cậy hơn về sự khởi đầu của dậy thì so với sự phát triển sinh dục giai đoạn 2 của Tanner. |
| Thể tích tinh hoàn | Thước đo tinh hoàn Prader hoặc thước kẻ. | Thể tích tinh hoàn ≥ 4 mL (≥ 2,5 cm chiều dài) cho thấy dậy thì trung ương. Hầu hết các bé trai khỏe mạnh có thể tích tinh hoàn từ 4 mL trở lên sẽ có sự gia tăng thêm về thể tích tinh hoàn, giai đoạn lông mu, hoặc cả hai, khi kiểm tra lại sau 6 tháng. |
| Tuổi xương | X-quang bàn tay và cổ tay trái. Bảng Atlas của Greulich và Pyle. Tuổi xương cũng được sử dụng để dự đoán chiều cao người trưởng thành. | Sự chậm trễ tuổi xương hơn 2 năm đã được sử dụng một cách tùy tiện như một tiêu chí cho CDGP nhưng không phải lúc nào cũng có mặt và cũng không đặc hiệu cho tình trạng đó. Sự chậm trễ tuổi xương 4 năm có liên quan đến việc dự đoán quá cao trung bình 8 cm chiều cao người trưởng thành, trong khi ở tầm vóc thấp không có sự chậm trễ tuổi xương, chiều cao người trưởng thành thường bị đánh giá thấp bởi các bảng Bayley-Pinneau. |
| Hóa sinh | Đánh giá thay đổi nhưng các xét nghiệm phổ biến bao gồm công thức máu toàn phần, tốc độ lắng hồng cầu, creatinine, điện giải, thyrotropin, và thyroxine tự do. | Để loại trừ các rối loạn mãn tính, việc đánh giá nên được định hướng dựa trên bệnh sử và khám thực thể vì hiệu suất của việc sàng lọc không có mục tiêu là thấp. Các xét nghiệm bổ sung có thể cần thiết dựa trên tiền sử gia đình, các triệu chứng và dấu hiệu, bao gồm sàng lọc bệnh celiac và bệnh viêm ruột. |
| Hormone hoàng thể hóa (LH) trong huyết thanh | Mẫu buổi sáng. Sử dụng các xét nghiệm miễn dịch hóa phát quang (ICMA) hoặc miễn dịch huỳnh quang (IFMA) với giới hạn phát hiện dưới ở mức hoặc dưới 0,1 IU/L. | Ở mức thấp, các giá trị thu được trên ICMA thấp hơn ít nhất 50% so với IFMA. Các giá trị < 0,1 IU/L không đặc hiệu cho suy sinh dục do giảm gonadotropin. Giá trị > 0,6 (IFMA) hoặc 0,2 (ICMA) IU/L là đặc hiệu nhưng không nhạy cho sự khởi đầu của dậy thì trung ương, vì ở đầu tuổi dậy thì, một số thanh thiếu niên có các giá trị thấp hơn. Trong dậy thì muộn, các giá trị tăng cao cho thấy suy sinh dục nguyên phát. |
| Hormone kích thích nang trứng (FSH) trong huyết thanh | Mẫu buổi sáng. Sử dụng các xét nghiệm ICMA hoặc IFMA với giới hạn phát hiện dưới ở mức hoặc dưới 0,1 IU/L nếu có thể. | Ở mức thấp, các giá trị thu được trên ICMA thấp hơn ~ 50% so với IFMA. Các giá trị < 0,2 (ICMA) hoặc < 1 (IFMA) IU/L cho thấy suy sinh dục do giảm gonadotropin nhưng không phải là chẩn đoán. Trong dậy thì muộn, một giá trị trên giới hạn trên của mức bình thường cho xét nghiệm là một dấu hiệu của thiếu hụt inhibin B và suy tuyến sinh dục nguyên phát với độ nhạy và độ đặc hiệu cao. |
| Yếu tố tăng trưởng giống insulin 1 (IGF-1) trong huyết thanh | Các mẫu máu nên được xử lý trong vòng 2 giờ để tránh sự gia tăng giả tạo trong kết quả. Chỉ các xét nghiệm nhận ra IGF-1 mà không có bất kỳ sự can thiệp nào từ các protein liên kết IGF mới cung cấp kết quả đáng tin cậy. | Nồng độ IGF-1 được sử dụng để sàng lọc thiếu hụt GH. Sự gia tăng nồng độ trong quá trình theo dõi hoặc trong hoặc sau khi điều trị bằng steroid sinh dục làm cho chẩn đoán thiếu hụt GH ít có khả năng xảy ra hơn. Nồng độ IGF-1 cho thấy sự thay đổi lớn nhất trong thời thơ ấu và dậy thì và sau đó thay đổi chậm hơn theo tuổi tác. Do đó, các giá trị bình thường cho trẻ em và thanh thiếu niên nên bao gồm các phạm vi tuổi hẹp và các giai đoạn Tanner. Các nghiệm pháp kích thích GH là cần thiết để chẩn đoán thiếu hụt GH. |
| Testosterone trong huyết thanh | Mẫu buổi sáng là lý tưởng. Sử dụng một xét nghiệm với giới hạn phát hiện dưới ở mức hoặc dưới 10 ng/dL (0,35 nmol/L) nếu có thể. Nồng độ cho thấy sự thay đổi theo ngày đêm. | Một giá trị testosterone huyết thanh lúc 8 giờ sáng ≥ 20 ng/dL (0,7 nmol/L) thường dự đoán sự xuất hiện của các dấu hiệu dậy thì trong vòng 12 đến 15 tháng. |
| Xét nghiệm hàng hai | ||
| Nghiệm pháp hormone giải phóng Gonadotropin (GnRH) | Yêu cầu xét nghiệm giống như đối với LH và FSH cơ bản. Nghiệm pháp có thể được thực hiện bất kỳ lúc nào trong ngày. Các giá trị LH và FSH thay đổi tùy theo xét nghiệm được sử dụng và với chất kích thích (GnRH hoặc chất chủ vận GnRH). | Một đáp ứng LH chiếm ưu thế hơn FSH sau khi kích thích GnRH hoặc nồng độ LH đỉnh từ 5 đến 8 IU/L (tùy thuộc vào xét nghiệm) cho thấy sự khởi đầu của dậy thì trung ương. Có sự chồng chéo giữa các giá trị sau GnRH tiền dậy thì và đầu dậy thì. Một đáp ứng tiền dậy thì được thấy ở một số bệnh nhân bị CDGP cũng như ở suy sinh dục do giảm gonadotropin, nhưng một giá trị LH sau GnRH < 0,8 IU (IFMA) và giá trị FSH < 1,1 IU/L (IFMA) có thể phù hợp hơn với suy sinh dục do giảm gonadotropin ở các bé trai. |
| Nghiệm pháp Gonadotropin màng đệm người (hCG) | Tiêm IM hoặc SC trong vài ngày. Có một số phác đồ khác nhau có sẵn. Kết quả thay đổi theo phác đồ. | Nồng độ testosterone đỉnh đối với cả nghiệm pháp hCG 3 ngày và 19 ngày đã được báo cáo là thấp hơn đáng kể ở những bệnh nhân bị suy sinh dục do giảm gonadotropin so với CDGP. Sự kết hợp giữa nghiệm pháp GnRH và nghiệm pháp hCG (ngưỡng LH đỉnh, 2,8 U/L; ngưỡng testosterone 19 ngày đỉnh, 275 ng/dL [9,5 nmol/L]) cho độ nhạy và độ đặc hiệu là 100% trong một nghiên cứu nhỏ về CDGP và suy sinh dục do giảm gonadotropin. |
| Inhibin B trong huyết thanh | Có thể đo bất kỳ lúc nào trong ngày. Chỉ có giá trị chẩn đoán ở bé trai. | Phép đo được sử dụng để phân biệt suy sinh dục do giảm gonadotropin với CDGP. Các bé trai có nồng độ inhibin B cơ bản cao hơn có khả năng bị CDGP cao hơn trong một nghiên cứu. Ở các bé trai tiền dậy thì, độ nhạy và độ đặc hiệu là 100% đã thu được ở nồng độ > 35 pg/mL. Với bộ phận sinh dục giai đoạn Tanner 2, độ nhạy là 86% và 80%, và độ đặc hiệu là 92% và 88%, tương ứng, đối với CDGP với một giá trị inhibin B > 65 pg/mL. Ở các bé trai, inhibin B không thể đo được cho thấy suy tinh hoàn. |
| Prolactin trong huyết thanh | Phép đo chỉ được chỉ định trong một số trường hợp. Các trạng thái sinh lý bao gồm căng thẳng, tập thể dục và giấc ngủ có thể làm tăng nồng độ prolactin, cũng như suy giáp và một số loại thuốc. | Nồng độ tăng cao có thể chỉ ra một khối u tiết prolactin hoặc sự gián đoạn của cuống tuyến yên, trong trường hợp đó có thể có thêm các thiếu hụt hormone tuyến yên. Phép đo macroprolactin (dạng prolactin không hoạt động sinh lý) được khuyến nghị như một xét nghiệm bổ sung ở những bệnh nhân bị tăng prolactin máu. |
| Chụp cộng hưởng từ (MRI) não | Được chỉ định khi có bất kỳ nghi ngờ nào về bệnh lý CNS (ví dụ, đau đầu, thay đổi thị lực, thay đổi hành vi). | Chẩn đoán hình ảnh chủ yếu được thực hiện để loại trừ các tổn thương của vùng hạ đồi-tuyến yên. Các phát hiện khác có thể bao gồm bất sản hoặc thiểu sản của hành khứu và rãnh khứu ở những bệnh nhân bị hội chứng Kallmann, điều này có thể giúp phân biệt hội chứng Kallmann với suy sinh dục do giảm gonadotropin đơn độc ở những bệnh nhân có khứu giác bình thường rõ ràng hoặc khó đánh giá. Trong suy sinh dục do giảm gonadotropin, có sự đồng thuận vừa phải giữa MRI của các hành khứu và kiểm tra khứu giác chính thức (Kappa tổng thể 0,5), nhưng khi có mặt các hành khứu bất sản và chứng mất khứu giác, có sự đồng thuận tốt (Kappa 0,9). |
| Kiểm tra chức năng khứu giác | Một bài kiểm tra, UPSIT, sử dụng các chất tạo mùi vi nang, được giải phóng bằng cách cào các tập sách kiểm tra được tẩm mùi tiêu chuẩn. | Được sử dụng để đánh giá giảm khứu giác và mất khứu giác như một phần của đánh giá hội chứng Kallmann. |
| Xét nghiệm di truyền | Ở hơn 60% bệnh nhân bị hội chứng Kallmann hoặc suy sinh dục do giảm gonadotropin đơn độc không tìm thấy khiếm khuyết gen cụ thể nào. | Việc xác định kiểu gen cho các nguyên nhân đơn gen đã biết hiện là một thủ tục nghiên cứu và không được đảm bảo trong thực hành lâm sàng thông thường. Nó có thể được đảm bảo khi có tiền sử gia đình dương tính hoặc bệnh nhân có các dấu hiệu kiểu hình gợi ý một đột biến cụ thể. Nếu được thực hiện, xét nghiệm di truyền nên đi kèm với tư vấn di truyền. |
| Xét nghiệm GH | Có nhiều phác đồ khác nhau cho cả xét nghiệm và mồi. Việc lựa chọn các kích thích GH sẽ được sử dụng là khác nhau. | Đáp ứng trong nghiệm pháp kích thích GH lớn hơn sau khi dùng các androgen (có thể thơm hóa) hoặc estrogen ngoại sinh (mồi). Hiệu suất xét nghiệm đáng tin cậy và dữ liệu tiêu chuẩn phù hợp là rất quan trọng để sử dụng phù hợp các phép đo GH và IGF-1. |
| Karyotype | Chẩn đoán hội chứng Klinefelter |
CDGP, Chậm tăng trưởng và dậy thì thể tạng; CNS, hệ thần kinh trung ương; GH, hormone tăng trưởng; IM, tiêm bắp; SC, tiêm dưới da; UPSIT, bài kiểm tra nhận dạng mùi của Đại học Pennsylvania.
(Sửa đổi từ Palmert, M. R., Dunkel, L. (2012). Clinical practice. Delayed puberty. N Engl J Med, 366, 443–453.)
Hình 18.8 Lưu đồ đánh giá bệnh nhân bị dậy thì muộn. BMI, chỉ số khối cơ thể; CDGP, chậm tăng trưởng và dậy thì thể tạng; DP, dậy thì muộn; FSH, hormone kích thích nang trứng; GH, hormone tăng trưởng; GHD, thiếu hụt hormone tăng trưởng; GI, tiêu hóa; GnRH, hormone giải phóng gonadotropin; IGF-1, yếu tố tăng trưởng giống insulin 1; LH, hormone hoàng thể hóa; MRI, hình ảnh cộng hưởng từ; PRL, prolactin; TFT, xét nghiệm chức năng tuyến giáp.
(Sửa đổi từ Palmert, M. R., & Dunkel, L. [2012]. Clinical practice: delayed puberty. N Engl J Med, 366, 443–453.)
Bệnh sử
Bệnh sử nên hỏi về các bệnh mãn tính, chẳng hạn như bệnh viêm ruột, bệnh hồng cầu hình liềm, bệnh celiac, hen suyễn, suy thận mãn tính, bệnh tim; các rối loạn nội tiết, chẳng hạn như suy giáp và đái tháo đường được kiểm soát kém; và điều trị mãn tính bằng glucocorticoid, tất cả đều có thể làm chậm cả sự tăng trưởng tuyến tính và dậy thì. Việc hấp thụ dinh dưỡng không đầy đủ, khi liên quan đến các tình trạng như xơ nang, chán ăn tâm thần, hoặc sử dụng năng lượng quá mức do tập thể dục mạnh ở các vận động viên hoặc vũ công ba lê, có thể dẫn đến chậm dậy thì. Sự can thiệp thành công trong những tình huống như vậy có thể được theo sau bởi sự tăng trưởng bắt kịp và tiến triển dậy thì.
Sự phát triển nhận thức chậm trễ liên quan đến béo phì hoặc các đặc điểm dị dạng có thể gợi ý một hội chứng di truyền tiềm ẩn. Tinh hoàn ẩn hoặc dương vật nhỏ khi sinh, giảm khứu giác hoặc mất khứu giác có thể gợi ý HH. Tiền sử hóa trị hoặc xạ trị có thể chỉ ra suy tuyến sinh dục nguyên phát. Tuy nhiên, một số bệnh nhân được điều trị ung thư có thể có nồng độ gonadotropin tăng cao trong và ngay sau khi điều trị, nhưng sau đó, nồng độ gonadotropin có thể giảm khi những bệnh nhân này có thể trải qua các mức độ phục hồi tuyến sinh dục khác nhau. Như đã lưu ý trước đây, mặc dù hội chứng Klinefelter là một loại suy sinh dục do tăng gonadotropin, nam giới mắc tình trạng này thường có biểu hiện tinh hoàn nhỏ bất thường, thiếu sự tiến triển dậy thì, hoặc vô sinh hơn là chậm dậy thì.
Tiền sử gia đình—bao gồm các mô hình tăng trưởng thời thơ ấu, tuổi khởi phát dậy thì của cha mẹ và tình trạng vô sinh—nên được khai thác. DP ở cha mẹ hoặc anh chị em, bất kể giới tính, sau đó là khởi phát dậy thì tự phát cho thấy CDGP. Tuy nhiên, nếu sự phát triển dậy thì được gây ra bởi steroid sinh dục ở các thành viên trong gia đình, IHH cũng có thể xảy ra, vì sự đảo ngược của suy sinh dục được ghi nhận sau khi ngừng sử dụng steroid sinh dục ở 10% hoặc nhiều hơn các trường hợp IHH.
Khám thực thể
Các số đo chiều cao và cân nặng trước đây nên được thu thập và vẽ biểu đồ để có thể đánh giá cẩn thận sự tăng trưởng theo chiều dọc. Chiều cao, cân nặng và tỷ lệ cơ thể nên được xác định. So với dữ liệu trước đây, chiều cao và cân nặng có thể được sử dụng để tính toán tốc độ tăng trưởng hàng năm, tốt nhất là dựa trên khoảng thời gian 12 tháng, vì các khoảng thời gian dưới 4 đến 6 tháng có thể không đầy đủ. DP thường liên quan đến tầm vóc thấp và tăng trưởng chậm so với tuổi và so với chiều cao mục tiêu của cha mẹ, mặc dù chiều cao và tốc độ tăng trưởng thường nằm trong phạm vi tiền dậy thì bình thường. Các cá nhân thiếu cân so với chiều cao có khả năng cao hơn về một tình trạng tiềm ẩn làm chậm sự hoạt hóa trục HPG. Ngược lại, ở các bé trai, không giống như các bé gái, béo phì có thể liên quan đến sự phát triển dậy thì muộn hơn như đã thảo luận trước đây. Tỷ lệ đoạn trên/đoạn dưới có thể được xác định bằng cách đo chiều cao ngồi hoặc đoạn dưới (từ đỉnh của khớp mu đến sàn) và so sánh với mức bình thường theo tuổi: tỷ lệ giảm theo tuổi xuống 1 hoặc thấp hơn tùy thuộc vào nhóm chủng tộc. Sải tay (từ đầu ngón tay này đến đầu ngón tay kia) nên nằm trong khoảng 5 cm so với chiều cao đứng. Chân tay dài hơn cho thấy suy sinh dục.
Khám thực thể cũng nên tập trung vào việc xác định các dấu hiệu của bệnh mãn tính, suy dinh dưỡng, các bất thường thần kinh, các bệnh nội tiết tuyến giáp và các bệnh nội tiết khác, và các đặc điểm hội chứng. Ở các bé trai, ngoài việc xác định chiều cao, cân nặng và tỷ lệ xương, tài liệu nên bao gồm đánh giá kích thước dương vật, sử dụng chiều dài kéo dài nếu cần thiết, vị trí của lỗ niệu đạo, kích thước tinh hoàn, và liệu cả hai tinh hoàn có mặt trong một bìu phát triển bình thường hay không. Tinh hoàn ẩn, bìu chẻ đôi, dương vật nhỏ, hoặc lỗ tiểu lệch thấp tầng sinh môn có thể chỉ ra một rối loạn phát triển giới tính do các khiếm khuyết trong sự phát triển tuyến sinh dục hoặc sinh steroid tuyến sinh dục. Tinh hoàn nhỏ, thể trạng hoạn quan và nữ hóa tuyến vú gợi ý hội chứng Klinefelter. Sự hiện diện của một cuộc kiểm tra thần kinh bất thường và/hoặc các khiếm khuyết trường thị giác làm dấy lên lo ngại về một tổn thương chiếm chỗ của vùng hạ đồi-tuyến yên. Béo phì và DP có thể gợi ý các khiếm khuyết trong các gen prohormone convertase 1 (PCSK1), leptin, hoặc thụ thể leptin. Khi béo phì liên quan đến DP và các đặc điểm dị dạng, nó gợi ý Prader-Willi, Bardet-Biedl, hoặc các hội chứng di truyền khác.
Ở các bé trai, bộ phận sinh dục giai đoạn Tanner 2 đánh dấu sự khởi đầu của sự phát triển dậy thì và được đặc trưng bởi sự to ra của bìu và tinh hoàn và bởi sự thay đổi kết cấu và màu sắc của da bìu (xem Hình 18.5). Giai đoạn lông mu và thể tích tinh hoàn cũng nên được đo; thể tích tinh hoàn từ 4 mL trở lên cho thấy sự khởi đầu của dậy thì trung ương. Cũng như đánh giá dậy thì sớm, một số người thấy việc sử dụng “biểu đồ dậy thì” đánh giá các giai đoạn phát triển so với dữ liệu dân số là hữu ích (xem Hình 18.6). Ở những bệnh nhân bị CDGP, cả hoạt hóa tuyến thượng thận và hoạt hóa nội tiết tố của tuyến sinh dục thường xảy ra muộn hơn mức trung bình, nhưng trong IHH đơn độc, hoạt hóa tuyến thượng thận thường xảy ra ở độ tuổi bình thường.
Xét nghiệm
Bệnh sử và khám thực thể nên định hướng các nghiên cứu cận lâm sàng và X-quang để thực hiện một đánh giá tiết kiệm và hiệu quả về chi phí. Chắc chắn, không phải tất cả các xét nghiệm đều cần được thực hiện ở tất cả các cá nhân.
Một cá nhân có kinh nghiệm trong việc giải thích tuổi xương nên xem xét các phim X-quang này. Sự chậm trễ về tuổi xương là đặc trưng của CDGP nhưng không phải là chẩn đoán, vì tuổi xương chậm cũng có thể xảy ra ở những cá nhân bị bệnh mãn tính, HH, hoặc suy tuyến sinh dục. Dự đoán chiều cao người trưởng thành là một phần quan trọng của việc tư vấn nếu tầm vóc thấp là một thành phần của biểu hiện, và các bác sĩ cần phải nhận thức được rằng các bảng Bayley-Pinneau đánh giá quá cao chiều cao người trưởng thành ở những bệnh nhân bị CDGP nếu tuổi xương bị trì hoãn hơn 2 năm (xem Bảng 18.3).
Khởi phát dậy thì được đặc trưng bởi sự gia tăng sự bài tiết gonadotropin và testosterone theo nhịp ngày đêm trước những thay đổi kiểu hình rõ ràng. Nồng độ LH và FSH cơ bản thấp ở CDGP và ở HH, trong khi chúng thường tăng cao trong suy tuyến sinh dục. Nói chung, LH là một dấu hiệu tốt hơn về sự khởi đầu dậy thì so với FSH, và FSH là một dấu hiệu tốt hơn về suy tuyến sinh dục so với LH. Nồng độ IGF-1 trong huyết thanh có thể giúp đánh giá thiếu hụt GH nhưng phải được giải thích cẩn thận vì nồng độ thường thấp so với tuổi đời nhưng nằm trong phạm vi bình thường so với tuổi xương ở những bệnh nhân bị DP. Các xét nghiệm chức năng tuyến giáp thường được thực hiện nhưng có thể không cần thiết nếu không có bất kỳ dấu hiệu hoặc triệu chứng nào của bệnh tuyến giáp ngoài DP.
MRI não và tuyến yên có thể được chỉ định khi có các dấu hiệu hoặc triệu chứng gợi ý một tổn thương CNS. Nếu không, mặc dù một số bác sĩ lâm sàng thực hiện chụp ảnh não thường quy, một chiến lược hợp lý là hoãn xét nghiệm này cho đến 15 tuổi, tại thời điểm đó nhiều bệnh nhân bị CDGP sẽ tự bắt đầu dậy thì và sẽ không cần đánh giá thêm. Xét nghiệm nội tiết thần kinh đầy đủ được đảm bảo ở những bệnh nhân có khối u vùng hạ đồi-tuyến yên gây ra HH, vì các cá nhân bị ảnh hưởng có thể có thêm các thiếu hụt hormone tuyến yên. Đánh giá các hành khứu trên MRI có thể hữu ích ở những bệnh nhân bị HH và mất khứu giác, mặc dù đã có báo cáo về những bệnh nhân có chức năng nội tiết sinh sản bình thường mặc dù bị mất khứu giác và không có hành khứu.
Đánh giá bổ sung
Hầu hết các bé trai sẽ không có một nguyên nhân thay thế rõ ràng nào cho DP khi đánh giá ban đầu, cho thấy CDGP là chẩn đoán có khả năng nhất. Tuy nhiên, không có xét nghiệm hiện tại nào có thể phân biệt đáng tin cậy giữa CDGP và IHH, vì vậy chẩn đoán CDGP không thể được thực hiện một cách chắc chắn. Việc quan sát thường giải quyết được tình thế khó xử này; IHH được chẩn đoán nếu dậy thì nội sinh chưa bắt đầu ở tuổi 18. Một số xét nghiệm đã được đề xuất để phân biệt CDGP với IHH (xem Bảng 18.3). Nếu nồng độ gonadotropin cơ bản không kết luận, một số người đã đề nghị rằng việc kích thích bằng GnRH hoặc một chất chủ vận GnRH có thể hữu ích. Nồng độ LH được kích thích trong phạm vi dậy thì cho thấy sự tái hoạt động của trục HPG và gợi ý rằng sự phát triển sinh dục phụ có khả năng xảy ra trong vòng 1 năm. Tuy nhiên, chỉ riêng nghiệm pháp GnRH thường không thể phân biệt CDGP với HH vì các giá trị tiền dậy thì có thể được quan sát thấy cả ở HH và ở những cá nhân bị CDGP chưa kích hoạt trục HPG. Hơn nữa, những cá nhân bị HH trải qua sự phát triển dậy thì bị đình trệ sẽ biểu hiện các đáp ứng dậy thì với GnRH. Dữ liệu cho thấy rằng nồng độ inhibin B cơ bản có thể tạo điều kiện phân biệt giữa các tình trạng này. Nồng độ inhibin B thấp có thể dự đoán IHH, nhưng một số người lớn bị HH có nồng độ inhibin B bình thường. Điều thú vị là, dữ liệu gần đây chỉ ra rằng thể tích tinh hoàn có thể tốt như nồng độ LH và inhibin B được kích thích trong việc phân biệt CDGP với HH. Do đó, cần có thêm kinh nghiệm trước khi các xét nghiệm sinh hóa bổ sung này có thể được áp dụng thường quy.
Sự bài tiết GH ở trạng thái cơ bản, cũng như sau khi xét nghiệm kích thích, có thể giảm ở những cá nhân bị CDGP so với các bạn cùng lứa dậy thì. Nếu những lo ngại về tăng trưởng đủ để đảm bảo xét nghiệm kích thích GH, việc mồi bằng steroid sinh dục với estrogen hoặc testosterone là cần thiết để có kết quả đáng tin cậy ở những bệnh nhân bị DP; estrogen kích thích sự bài tiết GH nội sinh, và việc mồi bằng steroid sinh dục tạo điều kiện phân tách thiếu hụt GH thực sự khỏi sự bài tiết GH sinh lý thấp bắt nguồn từ nồng độ steroid sinh dục lưu hành thấp. Một chiến lược khác để đánh giá thiếu hụt GH thực sự là đo lại nồng độ IGF-1 sau khi bắt đầu điều trị bằng testosterone. Nếu IGF-1 tăng lên một cách thích hợp khi dùng testosterone, thì thiếu hụt GH thực sự ít có khả năng xảy ra hơn. Nếu một bệnh nhân có tốc độ tăng trưởng bình thường, các nghiệm pháp kích thích GH không cần thiết, trong khi nồng độ IGF-1 thấp cùng với tốc độ tăng trưởng giảm đảm bảo việc xét nghiệm.
Điều trị dậy thì muộn
Các lựa chọn chính để quản lý CDGP bao gồm quan sát chờ đợi hoặc điều trị bằng testosterone liều thấp (Bảng 18.4 và các bài đánh giá gần đây). Nếu dậy thì đã bắt đầu, về mặt lâm sàng hoặc sinh hóa, và tầm vóc không phải là một mối quan tâm lớn, việc trấn an bằng dự đoán chiều cao người trưởng thành thực tế thường là tất cả những gì cần thiết. Nếu bắt đầu điều trị, thường là để xoa dịu những khó khăn tâm lý xã hội có thể bắt nguồn từ những tương tác tiêu cực với bạn bè, lòng tự trọng giảm sút và lo lắng về tốc độ tăng trưởng hoặc hình dáng cơ thể. Điều trị thường không được bắt đầu chỉ vì lý do y tế, chẳng hạn như tích lũy khối lượng xương. Tuy nhiên, dữ liệu mâu thuẫn về ảnh hưởng của thời điểm dậy thì đối với khối lượng xương cho thấy rằng cần có thêm dữ liệu để xác định một cách dứt khoát liệu các lý do y tế để bắt đầu điều trị có nên được xem xét nhiều hơn hay không.
Bảng 18.4 Các loại thuốc được sử dụng để điều trị Chậm tăng trưởng và dậy thì thể tạng và Suy sinh dục kéo dài
| Thuốc và Dạng bào chế | Điều trị cho bé trai – Liều khuyến cáo | Tác dụng phụ và Thận trọng |
|---|---|---|
| CDGP | SUY SINH DỤC | |
| Testosterone | ||
| Testosterone enanthate, cypionate, và propionate. Testosterone enanthate có thời gian tác dụng dài hơn testosterone propionate. Tiêm bắp. | Không bắt đầu cho đến khi chẩn đoán dậy thì muộn được thực hiện (~ 13,5–14 tuổi). Liều ban đầu 50–100 mg mỗi 4 tuần trong 3 đến 6 tháng. Nếu không có dấu hiệu dậy thì nội sinh sau một đợt điều trị, hãy xem xét điều trị lặp lại với liều tăng thêm 25–50 mg (không vượt quá 100 mg). | Có thể bắt đầu ở độ tuổi để cho phép dậy thì xảy ra đồng bộ với bạn bè ở liều 50 mg mỗi 4 tuần. Tăng liều thêm 50 mg mỗi 6 đến 12 tháng. Sau khi đạt 100–150 mg hàng tháng, giảm khoảng cách xuống còn mỗi 2 tuần. Liều người lớn ~ 100–200 mg mỗi 2 tuần tiêm bắp hoặc 80 mg tiêm dưới da hàng tuần. |
| Testosterone undecanoate. Tiêm bắp. | Không có dữ liệu. | Liều người lớn là 1000 mg mỗi 10–14 tuần. |
| Gel testosterone. Các chế phẩm qua da, bôi tại chỗ trước khi đi ngủ. | Không có dữ liệu. | Có thể bắt đầu khi đạt được ~ 50% liều người lớn với testosterone tiêm bắp. Liều người lớn 50–80 mg hàng ngày. |
| Các chất ức chế Aromatase | ||
| Letrozole đường uống | 2,5 mg hàng ngày | Không khuyến cáo |
| Anastrozole đường uống | 1 mg hàng ngày | Không khuyến cáo |
| GnRH theo nhịp. Bơm tiêm dưới da. | Không khuyến cáo thường quy. | Ban đầu: 5–25 ng/kg/nhịp mỗi 90–120 phút; tăng lên 25–600 ng/kg/nhịp. |
| hCG cộng với FSH tái tổ hợp. Tiêm hCG dưới da hoặc tiêm bắp. Tiêm rhFSH dưới da. | Không khuyến cáo thường quy. | hCG: liều 500 đến 3000 IU hai lần mỗi tuần, tăng lên mỗi 2 ngày. Liều được điều chỉnh dựa trên nồng độ T huyết thanh. rhFSH: liều 75 đến 225 IU 2–3 lần mỗi tuần. |
CDGP, Chậm tăng trưởng và dậy thì thể tạng; FSH, hormone kích thích nang trứng; GnRH, hormone giải phóng gonadotropin; hCG, gonadotropin màng đệm người; IM, tiêm bắp; PO, đường uống; rhFSH, hormone kích thích nang trứng tái tổ hợp của người; SC, tiêm dưới da.
(Sửa đổi từ Palmert, M. R., Dunkel, L. (2012). Clinical practice. Delayed puberty. N Engl J Med, 366, 443–453.)
Kể từ những năm 1980, đã có nhiều nghiên cứu về điều trị CDGP ở các bé trai, chủ yếu liên quan đến việc điều trị bằng các đợt ngắn androgen liều thấp. Có rất ít các thử nghiệm ngẫu nhiên có đối chứng, hầu hết với số lượng đối tượng nhỏ, nhưng dữ liệu từ những nghiên cứu này và các nghiên cứu khác cho thấy mạnh mẽ rằng việc điều trị dẫn đến tăng tốc độ tăng trưởng và sự trưởng thành sinh dục và ảnh hưởng tích cực đến sức khỏe tâm lý xã hội mà không có tác dụng phụ đáng kể, sự tiến triển nhanh chóng của tuổi xương, hoặc giảm chiều cao người trưởng thành. Đối với các bé trai chọn điều trị, chúng tôi bắt đầu bổ sung 50 mg testosterone enanthate hoặc cypionate tiêm bắp (IM) mỗi tháng trong 3 đến 6 tháng, có thể lặp lại trong 3 đến 6 tháng nữa với việc tăng liều (xem Bảng 18.4). Mặc dù việc sử dụng các este testosterone IM là phương pháp điều trị chính, các mũi tiêm IM gây đau và có thể yêu cầu các cuộc hẹn khám sức khỏe thường xuyên để tiêm; hơn nữa, nồng độ testosterone trong huyết thanh thiếu nhịp sinh học ngày đêm và được đặc trưng bởi các đỉnh và đáy không sinh lý. Do đó, có cơ sở cho các phương pháp tiếp cận thay thế, bao gồm tiêm testosterone dưới da; androgen đường uống, chẳng hạn như testosterone undecanoate; và các loại gel testosterone qua da. Việc sử dụng gel testosterone trong quá trình khởi đầu các đặc điểm sinh dục phụ có phần hạn chế do yêu cầu về liều lượng thấp có thể được cung cấp một cách lặp lại. Các liệu pháp mới, chẳng hạn như kisspeptin tổng hợp, cũng đang được khám phá. Mặc dù hứa hẹn, cần có thêm dữ liệu và kinh nghiệm trước khi các lựa chọn thay thế này có thể được khuyến nghị để quản lý thường quy thay cho các este testosterone.
Nếu dậy thì tự phát chưa xảy ra sau 1 năm, các chẩn đoán khác, chẳng hạn như HH kéo dài, nên được xem xét lại, và có thể chỉ định chụp MRI não. Khi không có dậy thì nội sinh, liều lượng testosterone có thể được tăng dần đến mức của người trưởng thành, trong khi vẫn đánh giá (khám kích thước tinh hoàn, đo lường LH, FSH và testosterone) mỗi 6 tháng để tìm bằng chứng về dậy thì tự phát.
Đối với một tập hợp con bệnh nhân bị CDGP, tầm vóc thấp có thể đáng lo ngại hơn DP, và thực tế trong tầm vóc thấp vô căn (ISS) có một thành phần của dậy thì muộn ở nhiều đối tượng. Mặc dù Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt việc sử dụng GH để điều trị ISS và SDS chiều cao từ 2,25 (hoặc thấp hơn) so với tuổi, liệu pháp này có hiệu quả khiêm tốn nhất đối với chiều cao người trưởng thành ở thanh thiếu niên bị CDGP, và việc sử dụng thường quy ở CDGP không được khuyến nghị. Chúng tôi cũng không sử dụng các steroid đồng hóa, chẳng hạn như oxandrolone, để điều trị DP. Việc sử dụng nó để điều trị ISS không được Tuyên bố Đồng thuận tán thành, và hiếm khi các bé trai sau 14 tuổi không lo lắng về việc thiếu các thay đổi dậy thì, điều này không thể được gây ra bởi oxandrolone do tác dụng androgen yếu của nó.
Ở các bé trai bị CDGP và tầm vóc thấp, một phương pháp điều trị tiềm năng khác là ức chế aromatase. Các chất ức chế aromatase (AI) ức chế sự chuyển đổi androgen thành estrogen. Vì estrogen là hormone chủ yếu cần thiết cho sự đóng sụn tiếp hợp, AI có thể kéo dài sự tăng trưởng tuyến tính và có khả năng làm tăng chiều cao người trưởng thành. Trong các thử nghiệm có đối chứng ở các bé trai bị tầm vóc thấp hoặc DP, hoặc thiếu hụt GH, AI đã được chứng minh là làm chậm sự trưởng thành của xương và tăng chiều cao người trưởng thành dự đoán. Tuy nhiên, chiều cao người trưởng thành chưa được báo cáo từ tất cả các nghiên cứu, và các đặc điểm của bệnh nhân đáp ứng và những người không đáp ứng cũng như thời điểm, liều lượng và thời gian điều trị AI tối ưu vẫn chưa được giải quyết.
Một hồ sơ đầy đủ về các tác dụng phụ tiềm ẩn liên quan đến việc sử dụng AI chưa được thiết lập. Nồng độ testosterone tăng cao trong quá trình điều trị bằng AI, và chứng tăng hồng cầu đã được quan sát thấy ở các bé trai dậy thì được điều trị bằng AI và ở nam giới bị thiếu hụt aromatase. Các nguy cơ lý thuyết bao gồm sự suy giảm adiponectin và sự phát triển sau đó của bệnh gan nhiễm mỡ không do rượu. Letrozole không có tác dụng phụ rõ ràng đối với BMD ở thanh thiếu niên. Tuy nhiên, thiếu hụt estrogen và điều trị bằng letrozole có liên quan đến sự phát triển xương bè bị suy giảm ở các bé trai bị ISS, và điều trị bằng letrozole trong giai đoạn tiền dậy thì hoặc đầu dậy thì cũng có liên quan đến nguy cơ gia tăng các dị dạng thân đốt sống. Do đó, việc sử dụng AI, ngay cả ở thanh thiếu niên có chiều cao người trưởng thành dự đoán bị ảnh hưởng, đòi hỏi phải nghiên cứu cẩn thận hơn nữa.
Ở các bé trai bị suy sinh dục kéo dài, liệu pháp steroid sinh dục ban đầu giống như đối với CDGP ngoại trừ trong các trường hợp có khiếm khuyết đã biết, liệu pháp có thể được bắt đầu ở độ tuổi trẻ hơn. Liều lượng testosterone được tăng dần đến mức thay thế hoàn toàn của người trưởng thành trong khoảng 3 năm (xem Bảng 18.4). Trong năm cuối cùng của việc tăng liều, khoảng cách giữa các lần dùng este testosterone được giảm từ mỗi tháng một lần xuống còn hai tuần một lần, với một chế độ điển hình để thay thế ở người trưởng thành là 100 đến 200 mg IM mỗi 2 tuần hoặc 80 mg tiêm dưới da hàng tuần. Các chế phẩm qua da có thể được bắt đầu trong giai đoạn cuối của việc tăng liều, nếu được ưu tiên. Trong HH, testosterone ngoại sinh không gây ra sự tăng trưởng tinh hoàn hoặc sinh tinh. Do đó, nếu bệnh nhân nam bị HH kéo dài muốn có con hoặc đạt được thể tích tinh hoàn tăng lên, việc gây ra sự tăng trưởng tinh hoàn và khả năng sinh sản có thể được thực hiện thông qua việc điều trị bằng gonadotropin ngoại sinh; trong các rối loạn vùng dưới đồi, GnRH theo nhịp cũng có thể được sử dụng nếu có sẵn (xem Bảng 18.4). Vẫn còn là một lĩnh vực không chắc chắn liệu kết quả sinh sản có được cải thiện hay không nếu GnRH và/hoặc gonadotropin được sử dụng để gây ra dậy thì thay vì chờ đợi để sử dụng các tác nhân này ở tuổi trưởng thành.
Trong một số trường hợp suy sinh dục do tăng gonadotropin, các cá nhân vẫn có thể có con bằng cách sử dụng các công nghệ hỗ trợ sinh sản, chẳng hạn như tiêm tinh trùng vào bào tương trứng (ICSI), mặc dù công nghệ này có thể liên quan đến nguy cơ dị tật bẩm sinh tăng nhẹ. Trong các trường hợp ICSI không được mong muốn hoặc không khả thi, việc nhận con nuôi và thụ tinh trong ống nghiệm bằng tinh trùng của người hiến tặng cung cấp các lựa chọn bổ sung cho những người muốn có con. Như đã lưu ý trước đó, bảo tồn khả năng sinh sản là một chủ đề quan trọng đối với các bé trai mắc hội chứng Klinefelter và những người bị bệnh ác tính.
Nữ hóa tuyến vú
Nữ hóa tuyến vú đáng được thảo luận, mặc dù nó không nhất thiết liên quan đến những thay đổi trong thời điểm dậy thì. Khám thực thể là cực kỳ quan trọng trong việc đánh giá nữ hóa tuyến vú để phân biệt giữa nữ hóa tuyến vú thật, nữ hóa tuyến vú giả và nữ hóa tuyến vú bệnh lý. Khi bệnh nhân nằm ngửa với hai tay đan sau gáy, người khám có thể từ từ ấn vào vùng vú giữa ngón trỏ và ngón cái bắt đầu từ hai bên vú. Trong nữ hóa tuyến vú thật, mô vú nằm đồng tâm dưới phức hợp quầng vú-núm vú, có cảm giác dai hoặc chắc, và thường ở cả hai bên. Trong giai đoạn đầu, sự tăng sinh ống tuyến và biểu mô xảy ra. Sự tăng sinh sớm này có liên quan đến viêm và phù nề quanh ống tuyến, tương ứng với cảm giác đau mà bệnh nhân ghi nhận.
Chẩn đoán phân biệt bao gồm nữ hóa tuyến vú do mỡ hoặc nữ hóa tuyến vú giả được đặc trưng bởi vú căng đầy và không có gò phức hợp quầng vú-núm vú, do đó có thể sờ thấy lồng ngực dưới quầng vú. U mỡ và u xơ thần kinh có thể xuất hiện ở vú. Mặc dù cực kỳ hiếm ở thanh thiếu niên, ung thư vú có cảm giác chắc hoặc cứng và thường nằm bên ngoài phức hợp quầng vú-núm vú. Tiết dịch núm vú, da lõm và co rút núm vú không xảy ra trong nữ hóa tuyến vú sinh lý.
Nữ hóa tuyến vú ở tuổi dậy thì hoặc sinh lý là một phát hiện phổ biến ở giữa tuổi dậy thì được ghi nhận ở giai đoạn Tanner 3 đến giai đoạn 4 của lông mu. Nữ hóa tuyến vú ở tuổi dậy thì được cho là do sự mất cân bằng tương đối và tạm thời trong tỷ lệ testosterone trên estradiol. Với sự tiến triển của dậy thì và nồng độ testosterone tăng lên, nữ hóa tuyến vú thường tự khỏi hoặc ít nhất là ổn định.
Các loại thuốc, phơi nhiễm và các rối loạn nội tiết hiếm gặp có liên quan đến nữ hóa tuyến vú bệnh lý. Các loại thuốc liên quan đến nữ hóa tuyến vú bao gồm spironolactone, cimetidine, ketoconazole, estrogen, thuốc kháng androgen, GH, các chất tương tự GnRH và các chất ức chế 5α-reductase. Việc tiếp xúc với các chất chứa estrogen, chẳng hạn như dầu oải hương và dầu cây trà, và phytoestrogen đã được coi là nguyên nhân. Các loại thuốc khác liên quan đến nữ hóa tuyến vú bao gồm thuốc chống trầm cảm ba vòng, thuốc hóa trị và thuốc tim mạch (ví dụ, digitalis). Các loại thuốc lạm dụng liên quan đến nữ hóa tuyến vú bao gồm cần sa, rượu, heroin và amphetamine.
Thừa estrogen có thể gây ra nữ hóa tuyến vú bệnh lý. Các đột biến trội trên nhiễm sắc thể thường trong gen aromatase (CYP19A1) dẫn đến tăng phiên mã gen một cách cấu thành và biểu hiện quá mức của enzyme aromatase. Các khối u nữ hóa có thể tiết ra estrogen trực tiếp. Hội chứng Peutz-Jeghers (PJS) được đặc trưng bởi sắc tố da-niêm mạc, nhiều polyp đường tiêu hóa và một loạt các khối u. Nữ hóa tuyến vú đã được mô tả ở các bé trai tiền dậy thì thứ phát sau các khối u tế bào Sertoli vôi hóa tế bào lớn liên quan đến PJS hoặc phức hợp Carney. Nữ hóa tuyến vú có thể xảy ra trong các tình trạng khác bao gồm cường giáp, suy sinh dục, hội chứng Klinefelter, không nhạy cảm với androgen và rối loạn buồng trứng-tinh hoàn. Các mối liên quan bổ sung bao gồm béo phì và bệnh gan.
Nữ hóa tuyến vú ở một bé trai tiền dậy thì là bệnh lý và cần được điều tra. Ngược lại, nữ hóa tuyến vú xảy ra ở một bé trai giữa tuổi dậy thì khỏe mạnh rất có thể là nữ hóa tuyến vú sinh lý mà không cần đánh giá xét nghiệm sâu rộng. Nữ hóa tuyến vú sinh lý thường tự giới hạn. Nếu có, việc điều trị rối loạn tiềm ẩn hoặc loại bỏ các nguyên nhân môi trường là phù hợp và có thể dẫn đến sự thoái triển của mô vú. Các chất ức chế aromatase và thuốc chẹn thụ thể estrogen đã được sử dụng. Một nghiên cứu nhãn mở đã kết luận rằng anastrozole làm giảm kích thước vú. Tuy nhiên, thử nghiệm nhi khoa ngẫu nhiên mù đôi, có đối chứng với giả dược duy nhất đã ghi nhận rằng anastrozole không hiệu quả hơn giả dược trong việc làm giảm nữ hóa tuyến vú, cho thấy rằng việc sử dụng thường quy của nó không thể được khuyến nghị. Nếu nữ hóa tuyến vú kéo dài và đặc biệt gây phiền toái cho thanh niên, có thể tiến hành phẫu thuật thu nhỏ.
Kết luận
Nền tảng cho quá trình dậy thì được đặt ra trong quá trình mang thai với sự biệt hóa và phát triển của các thành phần của trục HPG. Các công cụ của sinh học phân tử và di truyền học phân tử đã đưa nghiên cứu về các yếu tố chi phối thời điểm và nhịp độ của dậy thì lên hàng đầu của nội tiết học sinh sản. Việc xác định các gen mới liên quan đến các rối loạn dậy thì đã tạo ra nhiều câu hỏi hơn về các thành phần quan trọng khó nắm bắt chi phối sự bài tiết GnRH và gonadotropin. Những khám phá mới bổ sung về sự điều hòa trục HPG sẽ nâng cao hơn nữa sự hiểu biết của chúng ta về sự biến đổi bình thường trong thời điểm dậy thì và cung cấp thêm cái nhìn sâu sắc về nguyên nhân và điều trị các rối loạn dậy thì.
BẢNG CHÚ GIẢI THUẬT NGỮ ANH – VIỆT, CHƯƠNG 18
| STT | Thuật ngữ tiếng Anh | Phiên âm IPA | Nghĩa Tiếng Việt |
|---|---|---|---|
| 1 | Puberty | /ˈpjuːbərti/ | Dậy thì |
| 2 | Disorders | /dɪˈsɔːrdərz/ | Rối loạn |
| 3 | Male | /meɪl/ | Nam giới |
| 4 | Pediatric Endocrinology | /ˌpiːdiˈætrɪk ˌɛndoʊkrɪˈnɒlədʒi/ | Nội tiết học Nhi khoa |
| 5 | Secondary sexual characteristics | /ˈsɛkənˌdɛri ˈsɛkʃuəl ˌkærəktəˈrɪstɪks/ | Đặc điểm sinh dục phụ |
| 6 | Reproductive capability | /ˌriːprəˈdʌktɪv ˌkeɪpəˈbɪləti/ | Khả năng sinh sản |
| 7 | Sexual maturation | /ˈsɛkʃuəl ˌmætʃəˈreɪʃən/ | Trưởng thành sinh dục |
| 8 | Gonadarche | /ɡoʊnəˈdɑːrki/ | Hoạt hóa tuyến sinh dục |
| 9 | Adrenarche | /ˌædrəˈnɑːrki/ | Hoạt hóa tuyến thượng thận |
| 10 | Gonads | /ˈɡoʊnædz/ | Tuyến sinh dục |
| 11 | Maturation | /ˌmætʃəˈreɪʃən/ | Sự trưởng thành |
| 12 | Sex steroid | /sɛks ˈstɪərɔɪd/ | Steroid sinh dục |
| 13 | Secretion | /sɪˈkriːʃən/ | Sự bài tiết |
| 14 | Testosterone | /tɛˈstɒstəˌroʊn/ | Testosterone |
| 15 | Spermatogenesis | /ˌspɜːrmətəˈdʒɛnəsɪs/ | Quá trình sinh tinh |
| 16 | Hypothalamic-pituitary-gonadal (HPG) axis | /ˌhaɪpoʊθəˈlæmɪk pɪˈtjuːɪtəri ɡoʊˈnædəl ˈæksɪs/ | Trục hạ đồi-tuyến yên-tuyến sinh dục |
| 17 | Reproductive endocrine function | /ˌriːprəˈdʌktɪv ˈɛndoʊkrɪn ˈfʌŋkʃən/ | Chức năng nội tiết sinh sản |
| 18 | Adrenal cortex | /əˈdriːnəl ˈkɔːrtɛks/ | Vỏ thượng thận |
| 19 | Adrenal androgens | /əˈdriːnəl ˈændrədʒənz/ | Androgen tuyến thượng thận |
| 20 | Pubic hair | /ˈpjuːbɪk hɛər/ | Lông mu |
| 21 | Axillary hair | /ˈæksəˌlɛri hɛər/ | Lông nách |
| 22 | Apocrine body odor | /ˈæpəˌkraɪn ˈbɒdi ˈoʊdər/ | Mùi cơ thể do tuyến mồ hôi dầu |
| 23 | Acne | /ˈækni/ | Mụn trứng cá |
| 24 | Physiologic foundations | /ˌfɪziəˈlɒdʒɪk faʊnˈdeɪʃənz/ | Nền tảng sinh lý |
| 25 | In utero | /ɪn ˈjuːtəroʊ/ | Trong tử cung |
| 26 | Neurobiologic structures | /ˌnʊəroʊˌbaɪəˈlɒdʒɪk ˈstrʌktʃərz/ | Cấu trúc thần kinh sinh học |
| 27 | Hypothalamic-pituitary component | /ˌhaɪpoʊθəˈlæmɪk pɪˈtjuːɪtəri kəmˈpoʊnənt/ | Thành phần hạ đồi-tuyến yên |
| 28 | Differentiation | /ˌdɪfəˌrɛnʃiˈeɪʃən/ | Sự biệt hóa |
| 29 | Fetal life | /ˈfiːtəl laɪf/ | Đời sống bào thai |
| 30 | Reproductive competence | /ˌriːprəˈdʌktɪv ˈkɒmpɪtəns/ | Năng lực sinh sản |
| 31 | Genes | /dʒiːnz/ | Gen |
| 32 | Proteins | /ˈproʊtiːnz/ | Protein |
| 33 | Signaling molecules | /ˈsɪɡnəlɪŋ ˈmɒlɪkjuːlz/ | Phân tử tín hiệu |
| 34 | Endocrine factors | /ˈɛndoʊkrɪn ˈfæktərz/ | Yếu tố nội tiết |
| 35 | Paracrine factors | /ˈpærəkrɪn ˈfæktərz/ | Yếu tố cận tiết |
| 36 | Epigenetic events | /ˌɛpɪdʒəˈnɛtɪk ɪˈvɛnts/ | Sự kiện biểu sinh |
| 37 | Gonadotropin-Releasing Hormone (GnRH) | /ɡoʊˌnædəˈtroʊpɪn rɪˈliːsɪŋ ˈhɔːrmoʊn/ | Hormone giải phóng Gonadotropin |
| 38 | Hypothalamus | /ˌhaɪpoʊˈθæləməs/ | Vùng dưới đồi |
| 39 | Hypophysial-portal circulation | /haɪˌpɒfɪˈziːəl ˈpɔːrtəl ˌsɜːrkjəˈleɪʃən/ | Tuần hoàn cửa tuyến yên |
| 40 | Pituitary gonadotropes | /pɪˈtjuːɪtəri ɡoʊˈnædəˌtroʊps/ | Tế bào hướng sinh dục của tuyến yên |
| 41 | Follicle-stimulating hormone (FSH) | /ˈfɒlɪkəl ˈstɪmjəˌleɪtɪŋ ˈhɔːrmoʊn/ | Hormone kích thích nang trứng |
| 42 | Luteinizing hormone (LH) | /ˈluːtiəˌnaɪzɪŋ ˈhɔːrmoʊn/ | Hormone hoàng thể hóa |
| 43 | Central nervous system (CNS) | /ˈsɛntrəl ˈnɜːrvəs ˈsɪstəm/ | Hệ thần kinh trung ương |
| 44 | Olfactory placode | /ɒlˈfæktəri ˈplækoʊd/ | Tấm khứu giác |
| 45 | Vomeronasal organ | /ˌvoʊməroʊˈneɪzəl ˈɔːrɡən/ | Cơ quan lá mía mũi |
| 46 | Gestation | /dʒɛˈsteɪʃən/ | Thai kỳ |
| 47 | Embryonic migration | /ˌɛmbriˈɒnɪk maɪˈɡreɪʃən/ | Sự di chuyển phôi thai |
| 48 | Neuroendocrine network | /ˌnʊəroʊˈɛndoʊkrɪn ˈnɛtˌwɜːrk/ | Mạng lưới thần kinh nội tiết |
| 49 | Olfactory nerves | /ɒlˈfæktəri nɜːrvz/ | Dây thần kinh khứu giác |
| 50 | Vomeronasal nerves | /ˌvoʊməroʊˈneɪzəl nɜːrvz/ | Dây thần kinh lá mía mũi |
| 51 | Terminal nerves | /ˈtɜːrmɪnəl nɜːrvz/ | Dây thần kinh tận |
| 52 | Receptors | /rɪˈsɛptərz/ | Thụ thể |
| 53 | Adhesion molecules | /ədˈhiːʒən ˈmɒlɪkjuːlz/ | Phân tử bám dính |
| 54 | Neuronal cell adhesion molecule (N-CAM) | /nʊəˈroʊnəl sɛl ədˈhiːʒən ˈmɒlɪkjuːl/ | Phân tử bám dính tế bào thần kinh |
| 55 | Extracellular matrix | /ˌɛkstrəˈsɛljələr ˈmeɪtrɪks/ | Chất nền ngoại bào |
| 56 | Cytokines | /ˈsaɪtəˌkaɪnz/ | Cytokine |
| 57 | Transcription factors | /trænˈskrɪpʃən ˈfæktərz/ | Yếu tố phiên mã |
| 58 | Chemoattractants | /ˌkiːmoʊəˈtræktənts/ | Chất hóa hướng động |
| 59 | Chemorepellents | /ˌkiːmoʊrɪˈpɛlənts/ | Chất hóa xua đuổi |
| 60 | Gradients | /ˈɡreɪdiənts/ | Chênh lệch nồng độ (Gradient) |
| 61 | Chemokines | /ˈkiːməˌkaɪnz/ | Chemokine |
| 62 | Redundancy | /rɪˈdʌndənsi/ | Sự dư thừa |
| 63 | Cribriform plate | /ˈkrɪbrɪˌfɔːrm pleɪt/ | Mảnh sàng |
| 64 | Olfactory bulbs | /ɒlˈfæktəri bʌlbz/ | Hành khứu |
| 65 | Forebrain | /ˈfɔːrˌbreɪn/ | Não trước |
| 66 | Median eminence | /ˈmiːdiən ˈɛmɪnəns/ | Lồi giữa |
| 67 | Pulsatile gonadotropin secretion | /ˈpʌlsəˌtaɪl ɡoʊˌnædəˈtroʊpɪn sɪˈkriːʃən/ | Sự bài tiết gonadotropin theo nhịp |
| 68 | Estrous cycling | /ˈɛstrəs ˈsaɪklɪŋ/ | Chu kỳ động dục |
| 69 | Ovulation | /ˌɒvjəˈleɪʃən/ | Sự rụng trứng |
| 70 | Ataxia | /əˈtæksiə/ | Mất điều hòa |
| 71 | Phenotype | /ˈfiːnoʊˌtaɪp/ | Kiểu hình |
| 72 | Fertility | /fərˈtɪləti/ | Khả năng sinh sản |
| 73 | Neurites | /ˈnʊəraɪts/ | Sợi thần kinh |
| 74 | Fibroblast growth factor receptor 1 (FGFR1) | /ˈfaɪbroʊˌblæst ɡroʊθ ˈfæktər rɪˈsɛptər wʌn/ | Thụ thể yếu tố tăng trưởng nguyên bào sợi 1 |
| 75 | Transgenic mice | /trænsˈdʒɛnɪk maɪs/ | Chuột biến đổi gen |
| 76 | GnRH pulse generator | /dʒiː ɛn ɑːr eɪtʃ pʌls ˈdʒɛnəˌreɪtər/ | Bộ tạo nhịp GnRH |
| 77 | Fetal gonadotropes | /ˈfiːtəl ɡoʊˈnædəˌtroʊps/ | Tế bào hướng sinh dục của thai nhi |
| 78 | Minipuberty | /ˌmɪniˈpjuːbərti/ | Dậy thì mini |
| 79 | Juvenile pause | /ˈdʒuːvəˌnaɪl pɔːz/ | Giai đoạn tạm dừng thiếu niên |
| 80 | Prepuberty | /ˌpriːˈpjuːbərti/ | Tiền dậy thì |
| 81 | Pathological abnormalities | /ˌpæθəˈlɒdʒɪkəl ˌæbnɔːrˈmælɪtiz/ | Bất thường bệnh lý |
| 82 | Hypogonadotropic hypogonadism (HH) | /ˌhaɪpoʊɡoʊˌnædəˈtroʊpɪk ˌhaɪpoʊˈɡoʊnæˌdɪzəm/ | Suy sinh dục do giảm gonadotropin |
| 83 | Anosmin-1 | /əˈnɒzmɪn wʌn/ | Anosmin-1 |
| 84 | Axonal pathfinding | /ˈækˌsɒnəl ˈpæθˌfaɪndɪŋ/ | Sự tìm đường của sợi trục |
| 85 | Cellular adhesion | /ˈsɛljələr ədˈhiːʒən/ | Sự bám dính tế bào |
| 86 | Sense of smell | /sɛns əv smɛl/ | Khứu giác |
| 87 | Pituitary | /pɪˈtjuːɪtəri/ | Tuyến yên |
| 88 | Adenohypophysis | /ˌædɪnoʊhaɪˈpɒfəsɪs/ | Thùy trước tuyến yên |
| 89 | Neurohypophysis | /ˌnʊəroʊhaɪˈpɒfəsɪs/ | Thùy sau tuyến yên |
| 90 | Pituitary stalk | /pɪˈtjuːɪtəri stɔːk/ | Cuống tuyến yên |
| 91 | Oral ectoderm | /ˈɔːrəl ˈɛktəˌdɜːrm/ | Ngoại bì miệng |
| 92 | Neural ectoderm | /ˈnʊərəl ˈɛktəˌdɜːrm/ | Ngoại bì thần kinh |
| 93 | Organogenesis | /ˌɔːrɡənəˈdʒɛnəsɪs/ | Sự tạo cơ quan |
| 94 | Rathke’s pouch | /ˈræθkiz paʊtʃ/ | Túi Rathke |
| 95 | Diencephalon | /ˌdaɪənˈsɛfəˌlɒn/ | Não trung gian |
| 96 | Cell lineage | /sɛl ˈlɪniɪdʒ/ | Dòng tế bào |
| 97 | Gonadotrophs | /ɡoʊˈnædəˌtroʊfs/ | Tế bào hướng sinh dục |
| 98 | Thyrotrophs | /ˈθaɪroʊˌtroʊfs/ | Tế bào hướng giáp |
| 99 | Somatotrophs | /soʊˈmætəˌtroʊfs/ | Tế bào hướng thân |
| 100 | Lactotrophs | /ˈlæktoʊˌtroʊfs/ | Tế bào hướng sữa |
| 101 | Corticotrophs | /ˌkɔːrtɪkoʊˈtroʊfs/ | Tế bào hướng vỏ |
| 102 | Pituitary hormone deficiencies | /pɪˈtjuːɪtəri ˈhɔːrmoʊn dɪˈfɪʃənsiz/ | Thiếu hụt hormone tuyến yên |
| 103 | Growth hormone (GH) | /ɡroʊθ ˈhɔːrmoʊn/ | Hormone tăng trưởng |
| 104 | Septooptic dysplasia | /ˌsɛptoʊˈɒptɪk dɪsˈpleɪʒə/ | Loạn sản vách-thị |
| 105 | Testicular differentiation | /tɛˈstɪkjələr ˌdɪfəˌrɛnʃiˈeɪʃən/ | Biệt hóa tinh hoàn |
| 106 | Bipotential gonad | /baɪpoʊˈtɛnʃəl ˈɡoʊnæd/ | Tuyến sinh dục lưỡng năng |
| 107 | Urogenital ridge | /ˌjʊəroʊˈdʒɛnɪtəl rɪdʒ/ | Gờ niệu-sinh dục |
| 108 | Primordial germ cells | /praɪˈmɔːrdiəl dʒɜːrm sɛlz/ | Tế bào mầm nguyên thủy |
| 109 | Hindgut | /ˈhaɪndɡʌt/ | Ruột sau |
| 110 | Testicular compartments | /tɛˈstɪkjələr kəmˈpɑːrtmənts/ | Các khoang tinh hoàn |
| 111 | Leydig cells | /ˈlaɪdɪɡ sɛlz/ | Tế bào Leydig |
| 112 | Sertoli cells | /sərˈtoʊli sɛlz/ | Tế bào Sertoli |
| 113 | Human chorionic gonadotropin (hCG) | /ˈhjuːmən ˌkɔːriˈɒnɪk ɡoʊˌnædəˈtroʊpɪn/ | Gonadotropin màng đệm người |
| 114 | Leydig cell proliferation | /ˈlaɪdɪɡ sɛl prəˌlɪfəˈreɪʃən/ | Tăng sinh tế bào Leydig |
| 115 | Insulin-like factor 3 (INSL3) | /ˈɪnsjəlɪn laɪk ˈfæktər θriː/ | Yếu tố giống insulin 3 |
| 116 | Androgen insensitivity | /ˈændrədʒən ɪnˌsɛnsɪˈtɪvəti/ | Không nhạy cảm với androgen |
| 117 | Phallic growth | /ˈfælɪk ɡroʊθ/ | Sự phát triển dương vật |
| 118 | Anti-Mullerian hormone (AMH) | /ˌænti mʌˈlɪəriən ˈhɔːrmoʊn/ | Hormone kháng Mullerian |
| 119 | Inhibin B | /ɪnˈhɪbɪn biː/ | Inhibin B |
| 120 | Testicular descent | /tɛˈstɪkjələr dɪˈsɛnt/ | Sự di chuyển của tinh hoàn |
| 121 | Transabdominal phase | /ˌtrænzæbˈdɒmɪnəl feɪz/ | Giai đoạn qua ổ bụng |
| 122 | Inguinal canal | /ˈɪŋɡwɪnəl kəˈnæl/ | Ống bẹn |
| 123 | Hypothalamic-pituitary-testicular axis | /ˌhaɪpoʊθəˈlæmɪk pɪˈtjuːɪtəri tɛˈstɪkjələr ˈæksɪs/ | Trục hạ đồi-tuyến yên-tinh hoàn |
| 124 | Androgen receptor (AR) | /ˈændrədʒən rɪˈsɛptər/ | Thụ thể androgen |
| 125 | Gametogenesis | /ˌɡæmɪtəˈdʒɛnəsɪs/ | Quá trình tạo giao tử |
| 126 | Seminiferous cords | /ˌsɛmɪˈnɪfərəs kɔːrdz/ | Dây sinh tinh |
| 127 | Spermatogonia | /ˌspɜːrmətəˈɡoʊniə/ | Tinh nguyên bào |
| 128 | Glial inputs | /ˈɡlaɪəl ˈɪnpʊts/ | Tín hiệu đầu vào từ tế bào đệm |
| 129 | Brain stem | /breɪn stɛm/ | Thân não |
| 130 | Limbic system | /ˈlɪmbɪk ˈsɪstəm/ | Hệ viền |
| 131 | Hypothalamic nuclei | /ˌhaɪpoʊθəˈlæmɪk ˈnjuːkliaɪ/ | Các nhân vùng dưới đồi |
| 132 | Basal ganglia | /ˈbeɪzəl ˈɡæŋɡliə/ | Hạch nền |
| 133 | Kisspeptins | /kɪsˈpɛptɪnz/ | Kisspeptin |
| 134 | Neurokinin B | /ˌnʊəroʊˈkaɪnɪn biː/ | Neurokinin B |
| 135 | Arcuate nucleus (ARC) | /ˈɑːrkjuɪt ˈnjuːkliəs/ | Nhân cung |
| 136 | Estrogen | /ˈɛstrədʒən/ | Estrogen |
| 137 | Positive feedback | /ˈpɒzətɪv ˈfiːdbæk/ | Phản hồi dương |
| 138 | Negative feedback | /ˈnɛɡətɪv ˈfiːdbæk/ | Phản hồi âm |
| 139 | Sexual dimorphism | /ˈsɛkʃuəl daɪˈmɔːrfɪzəm/ | Lưỡng hình giới tính |
| 140 | Activating mutation | /ˈæktɪˌveɪtɪŋ mjuːˈteɪʃən/ | Đột biến hoạt hóa |
| 141 | Normosmic | /nɔːrˈmɒzmɪk/ | Có khứu giác bình thường |
| 142 | Functional amenorrhea | /ˈfʌŋkʃənəl əˌmɛnəˈriːə/ | Vô kinh chức năng |
| 143 | Estradiol | /ˌɛstrəˈdaɪɒl/ | Estradiol |
| 144 | Dynorphin | /daɪˈnɔːrfɪn/ | Dynorphin |
| 145 | Paracrine loops | /ˈpærəkrɪn luːps/ | Vòng lặp cận tiết |
| 146 | Autocrine loops | /ˈɔːtoʊkrɪn luːps/ | Vòng lặp tự tiết |
| 147 | RF-amide–related peptide (RFRP) | /ɑːr ɛf əˈmaɪd rɪˈleɪtɪd ˈpɛptaɪd/ | Peptide liên quan đến RF-amide |
| 148 | Gonadotrophin-inhibiting hormone (GnIH) | /ɡoʊˌnædəˈtroʊfɪn ɪnˈhɪbɪtɪŋ ˈhɔːrmoʊn/ | Hormone ức chế gonadotropin |
| 149 | Gamma aminobutyric acid (GABA) | /ˈɡæmə əˌmiːnoʊbjuːˈtɪrɪk ˈæsɪd/ | Axit gamma aminobutyric |
| 150 | Glutamate | /ˈɡluːtəˌmeɪt/ | Glutamate |
| 151 | Glutamine synthase | /ˈɡluːtəˌmiːn ˈsɪnˌθeɪs/ | Glutamine synthase |
| 152 | Glutamate dehydrogenase | /ˈɡluːtəˌmeɪt ˌdiːhaɪˈdrɒdʒəˌneɪs/ | Glutamate dehydrogenase |
| 153 | N-methyl-D-aspartate (NMDA) | /ɛn ˈmɛθəl diː əˈspɑːrteɪt/ | N-methyl-D-aspartate |
| 154 | Kainate receptors | /ˈkaɪəˌneɪt rɪˈsɛptərz/ | Thụ thể kainate |
| 155 | Micro ribonucleic acid (microRNAs) | /ˈmaɪkroʊ ˌraɪboʊnjuːˌkliːɪk ˈæsɪd/ | Micro a-xít ribonucleic |
| 156 | Epigenetic upregulation | /ˌɛpɪdʒəˈnɛtɪk ʌpˌrɛɡjəˈleɪʃən/ | Điều hòa tăng biểu sinh |
| 157 | Infertility | /ˌɪnfɜːrˈtɪləti/ | Vô sinh |
| 158 | Corticotropin-releasing hormone (CRH) | /ˌkɔːrtɪkoʊˈtroʊpɪn rɪˈliːsɪŋ ˈhɔːrmoʊn/ | Hormone giải phóng corticotropin |
| 159 | Intracerebroventricular (ICV) | /ˌɪntrəsəˌriːbroʊvɛnˈtrɪkjələr/ | Trong não thất |
| 160 | Hypoglycemia | /ˌhaɪpoʊɡlaɪˈsiːmiə/ | Hạ đường huyết |
| 161 | Neuron-glia signaling pathways | /ˈnʊərɒn ˈɡlaɪə ˈsɪɡnəlɪŋ ˈpæθˌweɪz/ | Con đường tín hiệu nơron-tế bào đệm |
| 162 | Transforming growth factor (TGF)β1 | /trænsˈfɔːrmɪŋ ɡroʊθ ˈfæktər ˈbeɪtə wʌn/ | Yếu tố tăng trưởng biến đổi β1 |
| 163 | Insulin-like growth factor 1 (IGF-1) | /ˈɪnsjəlɪn laɪk ɡroʊθ ˈfæktər wʌn/ | Yếu tố tăng trưởng giống insulin 1 |
| 164 | Neuregulins | /nʊəˈrɛɡjəlɪnz/ | Neuregulin |
| 165 | Tyrosine kinase | /ˈtaɪrəˌsiːn ˈkaɪˌneɪs/ | Tyrosine kinase |
| 166 | Fibroblast growth factor (FGF) | /ˈfaɪbroʊˌblæst ɡroʊθ ˈfæktər/ | Yếu tố tăng trưởng nguyên bào sợi |
| 167 | Epidermal growth factor family | /ˌɛpɪˈdɜːrməl ɡroʊθ ˈfæktər ˈfæməli/ | Họ yếu tố tăng trưởng biểu bì |
| 168 | Synaptic cell adhesion molecule (SynCAM) | /sɪˈnæptɪk sɛl ədˈhiːʒən ˈmɒlɪkjuːl/ | Phân tử bám dính tế bào synap |
| 169 | Portal vasculature | /ˈpɔːrtəl ˈvæskjələtʃər/ | Mạch máu cửa |
| 170 | Pituitary gonadotropins | /pɪˈtjuːɪtəri ɡoʊˈnædəˌtroʊpɪnz/ | Gonadotropin tuyến yên |
| 171 | Intracellular calcium concentration | /ˌɪntrəˈsɛljələr ˈkælsiəm ˌkɒnsənˈtreɪʃən/ | Nồng độ canxi nội bào |
| 172 | Protein kinase C | /ˈproʊtiːn ˈkaɪˌneɪs siː/ | Protein kinase C |
| 173 | Episodic stimulation | /ˌɛpɪˈsɒdɪk ˌstɪmjəˈleɪʃən/ | Kích thích theo đợt |
| 174 | Continuous infusion | /kənˈtɪnjuəs ɪnˈfjuːʒən/ | Truyền liên tục |
| 175 | Glycoproteins | /ˌɡlaɪkoʊˈproʊtiːnz/ | Glycoprotein |
| 176 | Subunits | /ˈsʌbˌjuːnɪts/ | Tiểu đơn vị |
| 177 | Azoospermia | /ˌeɪzoʊˈspɜːrmiə/ | Không có tinh trùng |
| 178 | Amenorrhea | /əˌmɛnəˈriːə/ | Vô kinh |
| 179 | Menarche | /məˈnɑːrki/ | Có kinh lần đầu |
| 180 | Endoplasmic reticulum | /ˌɛndoʊˈplæzmɪk rɪˈtɪkjələm/ | Lưới nội chất |
| 181 | Gonadal hormone production | /ɡoʊˈnædəl ˈhɔːrmoʊn prəˈdʌkʃən/ | Sản xuất hormone tuyến sinh dục |
| 182 | Paracrine factor | /ˈpærəkrɪn ˈfæktər/ | Yếu tố cận tiết |
| 183 | Cytoskeletal rearrangements | /ˌsaɪtoʊˈskɛlətəl ˌriːəˈreɪndʒmənts/ | Sắp xếp lại khung xương tế bào |
| 184 | Tight junctions | /taɪt ˈdʒʌŋkʃənz/ | Liên kết chặt |
| 185 | Sertoli cell polarization | /sərˈtoʊli sɛl ˌpoʊlərəˈzeɪʃən/ | Sự phân cực của tế bào Sertoli |
| 186 | Basement membrane | /ˈbeɪsmənt ˈmɛmbreɪn/ | Màng đáy |
| 187 | Cholesterol | /kəˈlɛstəˌrɒl/ | Cholesterol |
| 188 | Adenyl cyclase | /ˈædənɪl ˈsaɪˌkleɪs/ | Adenyl cyclase |
| 189 | Cyclic adenosine monophosphate (cAMP) | /ˈsaɪklɪk əˈdɛnəˌsiːn ˌmɒnoʊˈfɒsfeɪt/ | Cyclic adenosine monophosphate |
| 190 | Protein kinase A | /ˈproʊtiːn ˈkaɪˌneɪs eɪ/ | Protein kinase A |
| 191 | Pregnenolone | /prɛɡˈnɛnəˌloʊn/ | Pregnenolone |
| 192 | Sex-hormone–binding globulin | /sɛks ˈhɔːrmoʊn ˈbaɪndɪŋ ˈɡlɒbjəlɪn/ | Globulin gắn hormone sinh dục |
| 193 | 5α-reductase type 2 | /faɪv ˈælfə rɪˈdʌkteɪs taɪp tuː/ | 5α-reductase loại 2 |
| 194 | Dihydrotestosterone | /daɪˌhaɪdroʊtɛˈstɒstəˌroʊn/ | Dihydrotestosterone |
| 195 | Aromatase | /əˈroʊməˌteɪs/ | Aromatase |
| 196 | Virilization | /ˌvɪrəlaɪˈzeɪʃən/ | Nam hóa |
| 197 | Epiphyseal plate | /ˌɛpɪˈfɪziəl pleɪt/ | Sụn tiếp hợp |
| 198 | Spermarche | /spɜːrˈmɑːrki/ | Xuất tinh lần đầu |
| 199 | Activin | /ˈæktɪvɪn/ | Activin |
| 200 | Granulosa cells | /ˌɡrænjəˈloʊsə sɛlz/ | Tế bào hạt |
| 201 | Meiosis | /maɪˈoʊsɪs/ | Giảm phân |
| 202 | Nocturnal LH pulses | /nɒkˈtɜːrnəl ɛl eɪtʃ ˈpʌlsɪz/ | Các xung LH về đêm |
| 203 | Diurnal rhythm | /ˈdaɪɜːrnəl ˈrɪðəm/ | Nhịp ngày đêm |
| 204 | Dendritic spine density | /dɛnˈdrɪtɪk spaɪn ˈdɛnsəti/ | Mật độ gai đuôi gai |
| 205 | Messenger RNA (mRNA) | /ˈmɛsəndʒər ɑːr ɛn eɪ/ | RNA thông tin |
| 206 | Small interfering RNA (siRNA) | /smɔːl ˌɪntərˈfɪərɪŋ ɑːr ɛn eɪ/ | RNA can thiệp nhỏ |
| 207 | Zinc-finger motifs | /zɪŋk ˈfɪŋɡər moʊˈtiːfs/ | Motif ngón tay kẽm |
| 208 | Tanner stages | /ˈtænər ˈsteɪdʒɪz/ | Các giai đoạn Tanner |
| 209 | Standard deviation (SD) | /ˈstændərd ˌdiːviˈeɪʃən/ | Độ lệch chuẩn |
| 210 | Genital development | /dʒəˈnɪtəl dɪˈvɛləpmənt/ | Sự phát triển sinh dục |
| 211 | Sexual precocity | /ˈsɛkʃuəl prɪˈkɒsəti/ | Dậy thì sớm |
| 212 | Dehydroepiandrosterone (DHEA) | /diːˌhaɪdroʊˌɛpiænˈdrɒstəˌroʊn/ | Dehydroepiandrosterone |
| 213 | Androstenedione | /ˌændroʊstiːnˈdaɪoʊn/ | Androstenedione |
| 214 | DHEA sulfate (DHEA-S) | /diː eɪtʃ iː eɪ ˈsʌlfeɪt/ | DHEA sulfate |
| 215 | Pubarche | /pjuːˈbɑːrki/ | Mọc lông mu |
| 216 | Body mass index (BMI) | /ˈbɒdi mæs ˈɪndɛks/ | Chỉ số khối cơ thể |
| 217 | Regulation | /ˌrɛɡjəˈleɪʃən/ | Điều hòa |
| 218 | Secular trends | /ˈsɛkjələr trɛndz/ | Xu hướng thế kỷ |
| 219 | Socioeconomic stability | /ˌsoʊsioʊˌiːkəˈnɒmɪk stəˈbɪləti/ | Ổn định kinh tế xã hội |
| 220 | Visual inspection | /ˈvɪʒuəl ɪnˈspɛkʃən/ | Kiểm tra bằng mắt |
| 221 | Candidate gene-based association studies | /ˈkændɪdət dʒiːn beɪst əˌsoʊsiˈeɪʃən ˈstʌdiz/ | Các nghiên cứu liên kết dựa trên gen ứng cử viên |
| 222 | Single nucleotide polymorphisms (SNPs) | /ˈsɪŋɡəl ˈnjuːkliəˌtaɪd ˌpɒliˈmɔːrfɪzəmz/ | Đa hình đơn nucleotide |
| 223 | Genome-wide association (GWA) studies | /ˈdʒiːnoʊm waɪd əˌsoʊsiˈeɪʃən ˈstʌdiz/ | Các nghiên cứu liên kết toàn bộ bộ gen |
| 224 | Allele | /əˈliːl/ | Alen |
| 225 | Intergenic region | /ˌɪntərˈdʒɛnɪk ˈriːdʒən/ | Vùng liên gen |
| 226 | Transmembrane protein | /trænzˈmɛmbreɪn ˈproʊtiːn/ | Protein xuyên màng |
| 227 | Epistasis | /ˌɛpɪˈsteɪsɪs/ | Tương tác gen |
| 228 | Oligogenicity | /ˌɒlɪɡoʊdʒəˈnɪsəti/ | Tính đa gen |
| 229 | Copy number variants | /ˈkɒpi ˈnʌmbər ˈvɛəriənts/ | Biến thể số lượng bản sao |
| 230 | Epigenetics | /ˌɛpɪdʒəˈnɛtɪks/ | Biểu sinh |
| 231 | Hypothalamic amenorrhea | /ˌhaɪpoʊθəˈlæmɪk əˌmɛnəˈriːə/ | Vô kinh do vùng dưới đồi |
| 232 | Adiposity | /ˌædɪˈpɒsəti/ | Tình trạng béo phì |
| 233 | Insulin resistance | /ˈɪnsjəlɪn rɪˈzɪstəns/ | Kháng insulin |
| 234 | Endocrine-disrupting chemicals | /ˈɛndoʊkrɪn dɪsˈrʌptɪŋ ˈkɛmɪkəlz/ | Hóa chất gây rối loạn nội tiết |
| 235 | Obesity | /oʊˈbiːsəti/ | Béo phì |
| 236 | Fat mass | /fæt mæs/ | Khối lượng mỡ |
| 237 | Peak height velocity | /piːk haɪt vɪˈlɒsəti/ | Tốc độ tăng trưởng chiều cao đỉnh |
| 238 | Polychlorinated biphenyls (PBBs) | /ˌpɒliˈklɔːrəˌneɪtɪd baɪˈfɛnəlz/ | Biphenyl đa brom hóa |
| 239 | Dichlorodiphenyl dichloroethene (DDT) | /daɪˌklɔːroʊdaɪˌfɛnəl daɪˌklɔːroʊˈɛθiːn/ | Dichlorodiphenyl dichloroethene |
| 240 | Mycotoxin | /ˌmaɪkoʊˈtɒksɪn/ | Độc tố nấm |
| 241 | Cryptorchidism | /krɪpˈtɔːrkɪˌdɪzəm/ | Tinh hoàn ẩn |
| 242 | Hypospadias | /ˌhaɪpoʊˈspeɪdiəs/ | Lỗ tiểu lệch thấp |
| 243 | Central precocious puberty (CPP) | /ˈsɛntrəl prɪˈkoʊʃəs ˈpjuːbərti/ | Dậy thì sớm trung ương |
| 244 | Gonadotropin-dependent precocious puberty | /ɡoʊˌnædəˈtroʊpɪn dɪˈpɛndənt prɪˈkoʊʃəs ˈpjuːbərti/ | Dậy thì sớm phụ thuộc gonadotropin |
| 245 | Hypothalamic hamartomas | /ˌhaɪpoʊθəˈlæmɪk ˌhæmɑːrˈtoʊməz/ | U mô thừa vùng dưới đồi |
| 246 | Optic gliomas | /ˈɒptɪk ɡlaɪˈoʊməz/ | U tế bào thần kinh đệm thị giác |
| 247 | Neurofibromatosis | /ˌnʊəroʊˌfaɪbroʊməˈtoʊsɪs/ | Bệnh u xơ thần kinh |
| 248 | Pineal tumors | /paɪˈniːəl ˈtjuːmərz/ | U tuyến tùng |
| 249 | Suprasellar cysts | /ˌsuːprəˈsɛlər sɪsts/ | Nang trên yên |
| 250 | Static encephalopathy | /ˈstætɪk ɛnˌsɛfəˈlɒpəθi/ | Bệnh não tĩnh |
| 251 | Frameshift mutations | /ˈfreɪmˌʃɪft mjuːˈteɪʃənz/ | Đột biến dịch khung |
| 252 | Imprinting | /ɪmˈprɪntɪŋ/ | In dấu di truyền |
| 253 | Peripheral precocity | /pəˈrɪfərəl prɪˈkɒsəti/ | Dậy thì sớm ngoại vi |
| 254 | Testotoxicosis | /ˌtɛstoʊˌtɒksɪˈkoʊsɪs/ | Nhiễm độc tinh hoàn |
| 255 | McCune-Albright syndrome (MAS) | /məˈkuːn ˈɔːlbraɪt ˈsɪndroʊm/ | Hội chứng McCune-Albright |
| 256 | Fibrous dysplasia | /ˈfaɪbrəs dɪsˈpleɪʒə/ | Loạn sản xơ |
| 257 | Café-au-lait spots | /kæˈfeɪ oʊ ˈleɪ spɒts/ | Đốm café-au-lait |
| 258 | Hyperthyroidism | /ˌhaɪpərˈθaɪrɔɪˌdɪzəm/ | Cường giáp |
| 259 | Hypercortisolism | /ˌhaɪpərˈkɔːrtɪˌsɒlɪzəm/ | Tăng cortisol máu |
| 260 | Cholestasis | /ˌkoʊlɪˈsteɪsɪs/ | ứ mật |
| 261 | Hypertrophic heart disease | /ˌhaɪpərˈtroʊfɪk hɑːrt dɪˈziːz/ | Bệnh tim phì đại |
| 262 | Leydig cell hyperplasia | /ˈlaɪdɪɡ sɛl ˌhaɪpərˈpleɪʒə/ | Tăng sản tế bào Leydig |
| 263 | Van Wyk–Grumbach syndrome | /væn waɪk ˈɡrʌmbɑːk ˈsɪndroʊm/ | Hội chứng Van Wyk–Grumbach |
| 264 | Macroorchidism | /ˌmækroʊˈɔːrkɪˌdɪzəm/ | Tinh hoàn to |
| 265 | Congenital adrenal hyperplasia (CAH) | /kənˈdʒɛnɪtəl əˈdriːnəl ˌhaɪpərˈpleɪʒə/ | Tăng sản tuyến thượng thận bẩm sinh |
| 266 | Phallic enlargement | /ˈfælɪk ɪnˈlɑːrdʒmənt/ | Dương vật to |
| 267 | Choriocarcinoma | /ˌkɔːrioʊˌkɑːrsɪˈnoʊmə/ | Ung thư màng đệm |
| 268 | Dysgerminoma | /dɪsˌdʒɜːrmɪˈnoʊmə/ | U tế bào mầm ác tính |
| 269 | Hepatoblastoma | /ˌhɛpətəblæˈstoʊmə/ | U gan phôi |
| 270 | Teratoma | /ˌtɛrəˈtoʊmə/ | U quái |
| 271 | Gonadoblastoma | /ɡoʊˌnædəblæˈstoʊmə/ | U nguyên bào sinh dục |
| 272 | Epiphyseal fusion | /ˌɛpɪˈfɪziəl ˈfjuːʒən/ | Cốt hóa sụn tiếp hợp |
| 273 | Psychosocial outcomes | /ˌsaɪkoʊˈsoʊʃəl ˈaʊtˌkʌmz/ | Kết quả tâm lý xã hội |
| 274 | GnRH analogues (GnRHa) | /dʒiː ɛn ɑːr eɪtʃ ˈænəˌlɒɡz/ | Chất tương tự GnRH |
| 275 | Aromatase inhibitors (AIs) | /əˈroʊməˌteɪs ɪnˈhɪbɪtərz/ | Chất ức chế aromatase |
| 276 | Ketoconazole | /ˌkiːtoʊˈkoʊnəˌzoʊl/ | Ketoconazole |
| 277 | Bicalutamide | /ˌbaɪkəˈluːtəˌmaɪd/ | Bicalutamide |
| 278 | Anastrozole | /əˈnæstrəˌzoʊl/ | Anastrozole |
| 279 | Letrozole | /ˈlɛtrəˌzoʊl/ | Letrozole |
| 280 | Constitutional delay of growth and puberty (CDGP) | /ˌkɒnstɪˈtjuːʃənəl dɪˈleɪ əv ɡroʊθ ænd ˈpjuːbərti/ | Chậm tăng trưởng và dậy thì thể tạng |
| 281 | Hypergonadotropic hypogonadism | /ˌhaɪpərɡoʊˌnædəˈtroʊpɪk ˌhaɪpoʊˈɡoʊnæˌdɪzəm/ | Suy sinh dục do tăng gonadotropin |
| 282 | Functional hypogonadotropic hypogonadism | /ˈfʌŋkʃənəl ˌhaɪpoʊɡoʊˌnædəˈtroʊpɪk ˌhaɪpoʊˈɡoʊnæˌdɪzəm/ | Suy sinh dục do giảm gonadotropin chức năng |
| 283 | Anosmia | /əˈnɒzmiə/ | Mất khứu giác |
| 284 | Kallmann syndrome (KS) | /ˈkælmən ˈsɪndroʊm/ | Hội chứng Kallmann |
| 285 | Isolated hypogonadotropic hypogonadism (IHH) | /ˈaɪsəˌleɪtɪd ˌhaɪpoʊɡoʊˌnædəˈtroʊpɪk ˌhaɪpoʊˈɡoʊnæˌdɪzəm/ | Suy sinh dục do giảm gonadotropin đơn độc |
| 286 | Renal agenesis | /ˈriːnəl eɪˈdʒɛnəsɪs/ | Bất sản thận |
| 287 | Synkinesia | /ˌsɪnkɪˈniːʒə/ | Đồng vận động |
| 288 | Holoprosencephaly | /ˌhoʊloʊˌprɒsənˈsɛfəli/ | Tật não trước không phân chia |
| 289 | Moebius syndrome | /ˈmoʊbiəs ˈsɪndroʊm/ | Hội chứng Moebius |
| 290 | Epilepsy | /ˈɛpəˌlɛpsi/ | Động kinh |
| 291 | CHARGE syndrome | /tʃɑːrdʒ ˈsɪndroʊm/ | Hội chứng CHARGE |
| 292 | Coloboma | /ˌkɒləˈboʊmə/ | Khuyết mống mắt |
| 293 | Atresia choanae | /əˈtriːʒə ˈkoʊəˌniː/ | Hẹp lỗ mũi sau |
| 294 | Leptin | /ˈlɛptɪn/ | Leptin |
| 295 | Adrenal hypoplasia congenita | /əˈdriːnəl ˌhaɪpoʊˈpleɪʒə kənˈdʒɛnɪtə/ | Thiểu sản tuyến thượng thận bẩm sinh |
| 296 | Duchenne muscular dystrophy | /duːˈʃɛn ˈmʌskjələr ˈdɪstrəfi/ | Loạn dưỡng cơ Duchenne |
| 297 | Craniopharyngioma | /ˌkreɪnioʊfəˌrɪndʒiˈoʊmə/ | U sọ hầu |
| 298 | Histiocytosis X | /ˌhɪstioʊsaɪˈtoʊsɪs ɛks/ | Bệnh mô bào X |
| 299 | Hyperprolactinemia | /ˌhaɪpərproʊˌlæktɪˈniːmiə/ | Tăng prolactin máu |
| 300 | Gynecomastia | /ˌɡaɪnɪkoʊˈmæstiə/ | Nữ hóa tuyến vú |
