Mục tiêu học tập:
- Hiểu các nguyên tắc cơ bản của sự hình thành D-dimer và vai trò của nó trong quá trình tiêu sợi huyết
- Nhận biết các loại xét nghiệm D-dimer khác nhau và đặc điểm hiệu suất phân tích của chúng
- Áp dụng các thuật toán và quy trình chẩn đoán để sử dụng xét nghiệm D-dimer trong các cơ sở lâm sàng khác nhau, đặc biệt trong bối cảnh thuyên tắc huyết khối tĩnh mạch và đông máu nội mạch lan tỏa
- Giải thích kết quả D-dimer dựa trên xác suất lâm sàng trước thử nghiệm và các yếu tố gây nhiễu tiềm ẩn
I. Giới thiệu
A. Định nghĩa D-dimer
- D-dimer là sản phẩm thoái hóa của fibrin liên kết ngang, được hình thành trong quá trình tiêu sợi huyết[1].
- Nó bao gồm hai đoạn D liên kết ngang của protein fibrin[2]
B. Tầm quan trọng của xét nghiệm D-dimer trong thực hành lâm sàng
- D-dimer là một dấu ấn sinh học hữu ích cho các tình trạng viêm và huyết khối khác nhau[3]
- Ứng dụng lâm sàng chính của nó là trong chẩn đoán huyết khối tĩnh mạch (VTE), bao gồm huyết khối tĩnh mạch sâu (DVT) và tắc mạch phổi (PE) [4]
- Xét nghiệm D-dimer cũng có giá trị trong đánh giá đông máu nội mạch lan tỏa (DIC), rung nhĩ, nguy cơ đột quỵ, nhiễm trùng huyết và biến chứng thai kỳ [5,6]
II. Sinh lý và sinh lý bệnh của D-dimer
A. Tiêu sợi huyết và vai trò của D-dimer
- Tiêu sợi huyết là quá trình sinh lý phá vỡ cục máu đông fibrin [7]
- Enzym chủ chốt trong quá trình tiêu sợi huyết là plasmin, giúp phân cắt fibrin thành các sản phẩm thoái hóa hòa tan, bao gồm D-dimer [8]
- D-dimer là sản phẩm thoái hóa nhỏ nhất và đặc hiệu nhất của fibrin liên kết ngang [9]
- Nồng độ D-dimer tăng cao cho thấy hoạt động tiêu sợi huyết tăng lên và sự hiện diện của các cục máu đông fibrin được hình thành và thoái hóa gần đây [10]
B. Các tình trạng liên quan đến nồng độ D-dimer tăng cao
- Thuyên tắc huyết khối tĩnh mạch (DVT và PE) [11]
- Đông máu nội mạch lan tỏa (DIC) [12]
- Rung nhĩ và đột quỵ [13]
- Nhiễm trùng huyết và viêm hệ thống [14]
- Các biến chứng khi mang thai (ví dụ, tiền sản giật, nhau bong non)[15]
- Bệnh ác tính [16]
- Chấn thương và phẫu thuật[17]
- Bệnh gan[18]
- Tuổi cao[19]
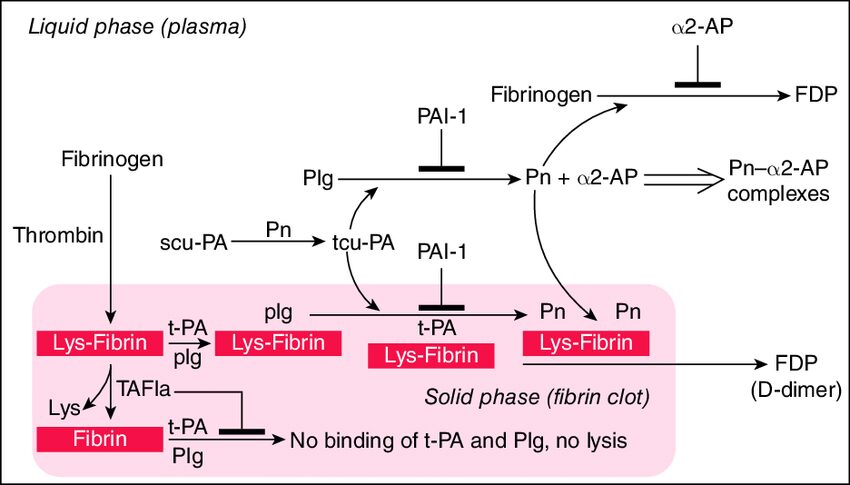
[Hình 1. Sơ đồ biểu diễn quá trình tiêu sợi huyết và hình thành D-dimer]
III. Xét nghiệm D-dimer
A. Các loại xét nghiệm D-dimer
- Xét nghiệm hấp thụ miễn dịch liên kết với enzyme (ELISA)
- ELISA được coi là phương pháp tiêu chuẩn vàng để đo D-dimer[20]
- Đây là một xét nghiệm định lượng sử dụng kháng thể đơn dòng đặc hiệu cho các epitope D-dimer [21]
- ELISA có độ nhạy cao nhưng độ đặc hiệu tương đối thấp trong chẩn đoán VTE [22]
- Xét nghiệm ngưng kết latex
- Sự ngưng kết latex là một xét nghiệm bán định lượng sử dụng các hạt latex được phủ kháng thể đơn dòng [23]
- Sự hiện diện của D-dimer trong mẫu gây ra sự kết tụ của các hạt latex, có thể được phát hiện bằng mắt thường hoặc bằng phép đo độ đục [24]
- Xét nghiệm ngưng kết latex có độ nhạy và độ đặc hiệu vừa phải để chẩn đoán VTE [25]
- Xét nghiệm ngưng kết máu toàn phần
- Ngưng kết máu toàn phần là một xét nghiệm định tính tại điểm chăm sóc sử dụng hỗn hợp tế bào hồng cầu và các hạt mủ được phủ kháng thể đơn dòng[26]
- Sự hiện diện của D-dimer trong mẫu gây ra hiện tượng ngưng kết, có thể phát hiện bằng mắt thường [27]
- Xét nghiệm ngưng kết máu toàn phần có độ nhạy và độ đặc hiệu thấp hơn so với phương pháp ngưng kết ELISA và latex[28]
B. Đặc tính hiệu suất phân tích
- Độ nhạy và độ đặc hiệu
- Độ nhạy và độ đặc hiệu của xét nghiệm D-dimer khác nhau tùy thuộc vào loại xét nghiệm và bối cảnh lâm sàng [29]
- Nhìn chung, xét nghiệm D-dimer có độ nhạy cao (>95%) nhưng độ đặc hiệu từ thấp đến trung bình (40-70%) để chẩn đoán VTE [30]
- Độ nhạy cao cho phép D-dimer được sử dụng làm xét nghiệm “loại trừ” VTE, đặc biệt ở những bệnh nhân có xác suất trước xét nghiệm thấp [31]
- Giá trị giới hạn
- Giá trị ngưỡng cho kết quả D-dimer dương tính khác nhau tùy thuộc vào xét nghiệm và bối cảnh lâm sàng [32]
- Giá trị ngưỡng thường được sử dụng là 500 ng/mL đơn vị tương đương fibrinogen (FEU)[33]
- Giá trị ngưỡng cao hơn có thể được sử dụng trong các nhóm dân số cụ thể, chẳng hạn như bệnh nhân cao tuổi hoặc những người mắc bệnh đi kèm, để cải thiện độ đặc hiệu [34]
- Can thiệp và hạn chế
- Một số yếu tố có thể ảnh hưởng đến xét nghiệm D-dimer, dẫn đến kết quả dương tính giả hoặc âm tính giả[35]
- Yếu tố thấp khớp, tan máu, lipid máu và bilirubin có thể gây ra kết quả dương tính giả [36]
- Liệu pháp heparin và sự hiện diện của kháng thể dị hợp có thể gây ra kết quả âm tính giả [37]
- Xét nghiệm D-dimer có thể có ích lợi hạn chế ở những bệnh nhân có xác suất mắc VTE trước xét nghiệm cao, vì kết quả âm tính không loại trừ chẩn đoán một cách đáng tin cậy [38]
Bảng 1. So sánh các loại xét nghiệm D-dimer và đặc tính hiệu suất của chúng
IV. Ứng dụng lâm sàng của xét nghiệm D-dimer
A. Thuyên tắc huyết khối tĩnh mạch (VTE)
- Thuật toán chẩn đoán huyết khối tĩnh mạch sâu (DVT) và tắc mạch phổi (PE)
- Xét nghiệm D-dimer là một phần không thể thiếu trong quá trình chẩn đoán đối với nghi ngờ DVT và PE [39]
- Điểm Wells là một quy tắc dự đoán lâm sàng giúp phân loại bệnh nhân thành các nhóm có xác suất mắc VTE thấp, trung bình hoặc cao trước xét nghiệm [40]
- Ở những bệnh nhân có xác suất trước xét nghiệm thấp, kết quả D-dimer âm tính có thể loại trừ VTE một cách an toàn mà không cần nghiên cứu hình ảnh [41]
- Ở những bệnh nhân có xác suất xét nghiệm trước trung bình hoặc cao, kết quả D-dimer dương tính nên được theo dõi bằng các nghiên cứu hình ảnh (ví dụ, siêu âm nén cho DVT, chụp cắt lớp vi tính chụp động mạch phổi cho PE) [42]
- Vai trò của D-dimer trong việc loại trừ VTE
- Độ nhạy cao của xét nghiệm D-dimer cho phép chúng được sử dụng làm xét nghiệm “loại trừ” đối với VTE ở bệnh nhân có xác suất trước xét nghiệm thấp[43]
– Kết quả D-dimer âm tính, kết hợp với xác suất trước xét nghiệm thấp, có giá trị tiên đoán âm tính cao (>98%) đối với VTE[44]
– Cách tiếp cận này giúp giảm bớt hình ảnh không cần thiết nghiên cứu cũng như các rủi ro và chi phí liên quan của chúng[45]Hình 2. Thuật toán chẩn đoán nghi ngờ DVT sử dụng điểm Wells và xét nghiệm D-dimer
- Độ nhạy cao của xét nghiệm D-dimer cho phép chúng được sử dụng làm xét nghiệm “loại trừ” đối với VTE ở bệnh nhân có xác suất trước xét nghiệm thấp[43]
B. Đông máu nội mạch lan tỏa (DIC)
- Tiêu chuẩn chẩn đoán và hệ thống tính điểm
- DIC là một hội chứng phức tạp được đặc trưng bởi sự kích hoạt đông máu trên diện rộng, dẫn đến huyết khối và chảy máu [46]
- Hiệp hội quốc tế về huyết khối và cầm máu (ISTH) đã đề xuất một hệ thống tính điểm cho DIC công khai bao gồm số lượng tiểu cầu, mức fibrinogen, thời gian protrombin và mức D-dimer [47]
- Mức D-dimer >500 ng/mL FEU là một trong những tiêu chí để chẩn đoán DIC rõ ràng [48]
- D-dimer như một dấu hiệu đánh giá mức độ nghiêm trọng và tiên lượng của DIC
- Mức D-dimer tương quan với mức độ nghiêm trọng và tiên lượng của DIC [49]
- Mức D-dimer cao hơn có liên quan đến việc tăng tỷ lệ tử vong và rối loạn chức năng cơ quan ở bệnh nhân mắc DIC [50]
- Các phép đo D-dimer nối tiếp có thể được sử dụng để theo dõi phản ứng với điều trị và dự đoán kết quả trong DIC [51]
C. Các tình trạng lâm sàng khác
- Đánh giá nguy cơ rung nhĩ và đột quỵ
- Nồng độ D-dimer tăng cao ở bệnh nhân rung nhĩ, phản ánh tình trạng đông máu liên quan đến tình trạng này [52]
- Nồng độ D-dimer tăng cao trong rung nhĩ có liên quan đến việc tăng nguy cơ đột quỵ và tắc mạch hệ thống [53]
- Điểm CHA2DS2-VASc, được sử dụng để phân tầng nguy cơ đột quỵ trong rung nhĩ, không bao gồm D-dimer làm thông số [54]
- Tuy nhiên, một số nghiên cứu cho thấy rằng việc thêm D-dimer vào điểm CHA2DS2-VASc có thể cải thiện giá trị tiên đoán của nó đối với nguy cơ đột quỵ [55]
- Nhiễm trùng huyết và viêm
- Nồng độ D-dimer thường tăng ở bệnh nhân nhiễm trùng huyết, phản ánh sự kích hoạt đông máu và tiêu sợi huyết để đáp ứng với tình trạng viêm toàn thân [56]
- Nồng độ D-dimer tăng cao trong nhiễm trùng huyết có liên quan đến việc tăng tỷ lệ tử vong và rối loạn chức năng cơ quan [57]
- Việc sử dụng D-dimer như một dấu hiệu tiên lượng trong nhiễm trùng huyết là một lĩnh vực đang được nghiên cứu [58]
- Biến chứng khi mang thai
- Nồng độ D-dimer tăng sinh lý trong thời kỳ mang thai, đạt đỉnh điểm trong tam cá nguyệt thứ ba[59]
- Nồng độ D-dimer tăng cao, trên mức bình thường trong thai kỳ, có thể chỉ ra các rối loạn huyết khối hoặc nhau thai tiềm ẩn [60]
- Xét nghiệm D-dimer có thể được sử dụng trong quá trình chẩn đoán nghi ngờ thuyên tắc huyết khối tĩnh mạch ở phụ nữ mang thai, với các giá trị ngưỡng được điều chỉnh[61]
- Nồng độ D-dimer tăng cao cũng liên quan đến các biến chứng khi mang thai như tiền sản giật và nhau bong non[62]
V. Giải thích kết quả D-dimer
A. Giá trị ngưỡng điều chỉnh theo độ tuổi
- Nồng độ D-dimer tăng theo tuổi, dẫn đến tỷ lệ kết quả dương tính giả cao hơn ở bệnh nhân cao tuổi [63]
- Các giá trị ngưỡng điều chỉnh theo tuổi đã được đề xuất để cải thiện tính đặc hiệu của xét nghiệm D-dimer ở bệnh nhân lớn tuổi [64]
- Ngưỡng điều chỉnh theo độ tuổi được tính bằng cách nhân tuổi của bệnh nhân (theo năm) với 10 ng/mL FEU, đối với bệnh nhân > 50 tuổi[65]
- Sử dụng các ngưỡng điều chỉnh theo độ tuổi có thể làm giảm các nghiên cứu hình ảnh không cần thiết ở bệnh nhân cao tuổi nghi ngờ VTE [66]
B. Xác suất lâm sàng trước xét nghiệm và diễn giải D-dimer
- Việc giải thích kết quả D-dimer phải luôn được thực hiện trong bối cảnh xác suất lâm sàng trước khi xét nghiệm [67]
- Ở những bệnh nhân có xác suất trước xét nghiệm thấp, kết quả D-dimer âm tính có thể loại trừ VTE một cách đáng tin cậy [68]
- Ở những bệnh nhân có xác suất trước xét nghiệm cao, kết quả D-dimer âm tính không loại trừ VTE và nên thực hiện các nghiên cứu hình ảnh [69]
- Việc sử dụng các quy tắc dự đoán lâm sàng, chẳng hạn như điểm Wells, có thể giúp tiêu chuẩn hóa việc đánh giá xác suất trước thử nghiệm[70]
C. Kết quả dương tính giả và âm tính giả
- Kết quả D-dimer dương tính giả có thể xảy ra trong nhiều tình trạng khác nhau liên quan đến tăng tiêu sợi huyết, chẳng hạn như bệnh ác tính, chấn thương, phẫu thuật và bệnh gan [71]
- Kết quả D-dimer âm tính giả có thể xảy ra ở những bệnh nhân đang điều trị bằng thuốc chống đông máu, đặc biệt là heparin, điều này có thể ảnh hưởng đến một số xét nghiệm D-dimer [72]
- Sự hiện diện của các kháng thể dị thể, chẳng hạn như yếu tố dạng thấp, cũng có thể gây ra kết quả âm tính giả [73]
- Trong trường hợp nghi ngờ có kết quả âm tính giả, nên xem xét xét nghiệm D-dimer thay thế hoặc nghiên cứu hình ảnh [74]
Tóm tắt điểm chính
- D-dimer là sản phẩm thoái hóa của fibrin liên kết ngang, được hình thành trong quá trình tiêu sợi huyết
- Xét nghiệm D-dimer chủ yếu được sử dụng trong chẩn đoán huyết khối tĩnh mạch (DVT và PE) và đông máu nội mạch lan tỏa (DIC)
- Việc giải thích kết quả D-dimer nên được thực hiện trong bối cảnh xác suất lâm sàng trước xét nghiệm, sử dụng các thuật toán chẩn đoán đã được xác nhận
- Giá trị ngưỡng được điều chỉnh theo độ tuổi có thể cải thiện độ đặc hiệu của xét nghiệm D-dimer ở bệnh nhân cao tuổi
Tài liệu tham khảo
- Adam SS, Key NS, Greenberg CS. D-dimer antigen: current concepts and future prospects. Blood. 2009;113(13):2878-2887.
- Weitz JI, Fredenburgh JC, Eikelboom JW. A test in context: D-dimer. J Am Coll Cardiol. 2017;70(19):2411-2420.
- Linkins LA, Takach Lapner S. Review of D-dimer testing: Good, Bad, and Ugly. Int J Lab Hematol. 2017;39 Suppl 1:98-103.
- Bates SM. D-dimer assays in diagnosis and management of thrombotic and bleeding disorders. Semin Thromb Hemost. 2012;38(7):673-682.
- Halaby R, Popma CJ, Cohen A, et al. D-Dimer elevation and adverse outcomes. J Thromb Thrombolysis. 2015;39(1):55-59.
- Schouten HJ, Geersing GJ, Koek HL, et al. Diagnostic accuracy of conventional or age adjusted D-dimer cut-off values in older patients with suspected venous thromboembolism: systematic review and meta-analysis. BMJ. 2013;346:f2492.
- Cesarman-Maus G, Hajjar KA. Molecular mechanisms of fibrinolysis. Br J Haematol. 2005;129(3):307-321.
- Rijken DC, Lijnen HR. New insights into the molecular mechanisms of the fibrinolytic system. J Thromb Haemost. 2009;7(1):4-13.
- Olson JD. D-dimer: An Overview of Hemostasis and Fibrinolysis, Assays, and Clinical Applications. Adv Clin Chem. 2015;69:1-46.
- Weitz JI, Lensing AWA, Prins MH, et al. Rivaroxaban or Aspirin for Extended Treatment of Venous Thromboembolism. N Engl J Med. 2017;376(13):1211-1222.
- Wells PS, Anderson DR, Rodger M, et al. Evaluation of D-dimer in the diagnosis of suspected deep-vein thrombosis. N Engl J Med. 2003;349(13):1227-1235.
- Levi M, Toh CH, Thachil J, Watson HG. Guidelines for the diagnosis and management of disseminated intravascular coagulation. British Committee for Standards in Haematology. Br J Haematol. 2009;145(1):24-33.
- Hijazi Z, Oldgren J, Siegbahn A, Granger CB, Wallentin L. Biomarkers in atrial fibrillation: a clinical review. Eur Heart J. 2013;34(20):1475-1480.
- Rodelo JR, De la Rosa G, Valencia ML, et al. D-dimer is a significant prognostic factor in patients with suspected infection and sepsis. Am J Emerg Med. 2012;30(9):1991-1999.
- Erez O, Romero R, Vaisbuch E, et al. High maternal plasma concentration of thrombin-antithrombin complex in preeclampsia. J Matern Fetal Neonatal Med. 2009;22(11):971-978.
- Ay C, Dunkler D, Pirker R, et al. High D-dimer levels are associated with poor prognosis in cancer patients. Haematologica. 2012;97(8):1158-1164.
- Owings JT, Gosselin RC, Anderson JT, Battistella FD, Bagley M, Larkin EC. Practical utility of the D-dimer assay for excluding thromboembolism in severely injured trauma patients. J Trauma. 2001;51(3):425-429.
- Primignani M, Dell’Era A, Bucciarelli P, et al. High D-dimer levels predict poor outcome in esophageal variceal bleeding. Dig Liver Dis. 2008;40(11):874-881.
- Haase C, Joergensen M, Ellervik C, Joergensen MK, Bathum L. Age- and sex-dependent reference intervals for D-dimer: evidence for a marked increase by age. Thromb Res. 2013;132(6):676-680.
- Linkins LA, Bates SM, Lang E, et al. Selective D-dimer testing for diagnosis of a first suspected episode of deep venous thrombosis: a randomized trial. Ann Intern Med. 2013;158(2):93-100.
- Di Nisio M, Squizzato A, Rutjes AW, Büller HR, Zwinderman AH, Bossuyt PM. Diagnostic accuracy of D-dimer test for exclusion of venous thromboembolism: a systematic review. J Thromb Haemost. 2007;5(2):296-304.
- Stein PD, Hull RD, Patel KC, et al. D-dimer for the exclusion of acute venous thrombosis and pulmonary embolism: a systematic review. Ann Intern Med. 2004;140(8):589-602.
- van der Graaf F, van den Borne H, van der Kolk M, de Wild PJ, Janssen GW, van Uum SH. Exclusion of deep venous thrombosis with D-dimer testing–comparison of 13 D-dimer methods in 99 outpatients suspected of deep venous thrombosis using venography as reference standard. Thromb Haemost. 2000;83(2):191-198.
- Janssen MC, Heebels AE, de Metz M, et al. Reliability of five rapid D-dimer assays compared to ELISA in the exclusion of deep venous thrombosis. Thromb Haemost. 1997;77(2):262-266.
- Gouin-Thibault I, Alessi MC, Hamel M, et al. Performance of two rapid quantitative D-dimer assays for suspected deep vein thrombosis. Thromb Res. 1998;90(3):119-125.
- Geersing GJ, Janssen KJ, Oudega R, et al. Excluding venous thromboembolism using point of care D-dimer tests in outpatients: a diagnostic meta-analysis. BMJ. 2009;339:b2990.
- Geersing GJ, Toll DB, Janssen KJ, et al. Diagnostic accuracy and user-friendliness of 5 point-of-care D-dimer tests for the exclusion of deep vein thrombosis. Clin Chem. 2010;56(11):1758-1766.
- Gardiner C, Pennaneac’h C, Walford C, et al. An evaluation of rapid D-dimer assays for the exclusion of deep vein thrombosis. Br J Haematol. 2005;128(6):842-848.
- Heim SW, Schectman JM, Siadaty MS, Philbrick JT. D-dimer testing for deep venous thrombosis: a metaanalysis. Clin Chem. 2004;50(7):1136-1147.
- Wells PS, Owen C, Doucette S, Fergusson D, Tran H. Does this patient have deep vein thrombosis? JAMA. 2006;295(2):199-207.
- Gibson NS, Sohne M, Gerdes VE, et al. The importance of clinical probability assessment in interpreting a normal d-dimer in patients with suspected pulmonary embolism. Chest. 2008;134(4):789-793.
- Bates SM, Jaeschke R, Stevens SM, et al. Diagnosis of DVT: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e351S-e418S.
- Konstantinides SV, Torbicki A, Agnelli G, et al. 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014;35(43):3033-3069, 3069a-3069k.
- Righini M, Van Es J, Den Exter PL, et al. Age-adjusted D-dimer cutoff levels to rule out pulmonary embolism: the ADJUST-PE study. JAMA. 2014;311(11):1117-1124.
- Stein PD, Matta F, Sabra MJ, Janjua M, Pathak J, Pulido JS. D-dimer for the exclusion of acute retinal artery occlusion. J Thromb Thrombolysis. 2015;39(1):19-22.
- Stein PD, Matta F. Acute pulmonary embolism. Curr Probl Cardiol. 2010;35(7):314-377.
- Linkins LA, Dans AL, Moores LK, et al. Treatment and prevention of heparin-induced thrombocytopenia: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e495S-e530S.
- Neumann I, Botting R, Genuneit J, et al. Assessing and reporting heterogeneity in treatment effects in clinical trials: a proposal. Trials. 2014;15:528.
- Douma RA, le Gal G, Söhne M, et al. Potential of an age adjusted D-dimer cut-off value to improve the exclusion of pulmonary embolism in older patients: a retrospective analysis of three large cohorts. BMJ. 2010;340:c1475.
- Kabrhel C, Mark Courtney D, Camargo CA Jr, et al. Factors associated with positive D-dimer results in patients evaluated for pulmonary embolism. Acad Emerg Med. 2010;17(6):589-597.
- Henriksson AE, Sandström A, Wallen NH, Brandberg J, Larsson PT. The course of the coagulation and fibrinolytic systems in uncomplicated myocardial infarction. Thromb Res. 1999;96(3):177-183.
- Xu J, Lupu F, Esmon CT. Inflammation, innate immunity and blood coagulation. Hamostaseologie. 2010;30(1-2):8-12, 14-16.
- Barbar S, Noventa F, Rossetto V, et al. A risk assessment model for the identification of hospitalized medical patients at risk for venous thromboembolism: the Padua Prediction Score. J Thromb Haemost. 2010;8(11):2450-2457.
- Cohen AT, Spiro TE, Büller HR, et al. Rivaroxaban for thromboprophylaxis in acutely ill medical patients. N Engl J Med. 2013;368(6):513-523.
- Vickers AJ, Elkin EB. Decision curve analysis: a novel method for evaluating prediction models. Med Decis Making. 2006;26(6):565-574.
- Pantoja T, Arevalo-Rodriguez I, Pineros Tobar C, Sibb C. Updating D-dimer cut-off values to rule out pulmonary embolism investigation. Cochrane Database Syst Rev. 2012;(8):CD010674.
- Hutt E, Fredrickson J, Lei L, Crabtree K, Kramer A. How well does decision-making by physicians and nurses predict the preferences of seriously ill patients regarding places for future care? J Am Geriatr Soc. 2012;60(11):2084-2091.
- Kucher N, Kohler HP, Dornhofer T, Wallmann D, Lämmle B. Accuracy of D-dimer/fibrinogen ratio to predict pulmonary embolism: a prospective diagnostic study. J Thromb Haemost. 2003;1(4):708-713.
- Kovacich AA, Riegert-Johnson DL. Computed tomography pulmonary angiography D-dimer level interaction in the diagnosis of pulmonary embolism. J Thromb Haemost. 2013;11(5):956-958.
- Bounameaux H, Cirafici P, de Moerloose P, et al. Measurement of D-dimer in plasma as diagnostic aid in suspected venous thromboembolism. Lancet. 1983;2(8364):1195-1198.
- Meignan M, Rosso J, Gauthier H, et al. Systematic lung scans reveal a high frequency of silent pulmonary embolism in patients with proximal deep venous thrombosis. Arch Intern Med. 2000;160(2):159-164.
- Grifoni S, Olivotto I, Cecchini P, et al. Short-term clinical outcome of patients with acute pulmonary embolism, normal blood pressure, and echocardiographic right ventricular dysfunction. Circulation. 2000;101(24):2817-2822.
- Nendaz MR, Bandelier P, Aujesky D, et al. Validation of a risk score identifying patients with acute pulmonary embolism, who are at low risk of adverse outcome. Thromb Haemost. 2004;91(6):1232-1236.
- Miniati M, Bottai M, Monti S, Salvadori M, Serasini L, Passera M. Comparison of 3 clinical models for predicting the probability of pulmonary embolism. Medicine (Baltimore). 2005;84(2):107-114.
- Lankeit M, Jiménez D, Kostrubiec M, et al. Predictive value of the high-sensitivity troponin T assay and the simplified Pulmonary Embolism Severity Index in hemodynamically stable patients with acute pulmonary embolism: a prospective validation study. Circulation. 2011;124(24):2716-2724.
- Vedovati MC, Becattini C, Agnelli G, et al. A new simplified score to identify patients at high risk of death after pulmonary embolism. Am J Emerg Med. 2014;32(4):348-353.
- Bova C, Sanchez O, Prandoni P, et al. Identification of intermediate-risk patients with acute symptomatic pulmonary embolism. Eur Respir J. 2014;44(3):694-703.
- Douma RA, Gibson NS, Gerdes VE, et al. Validity and clinical utility of the simplified Wells rule for assessing clinical probability for the exclusion of pulmonary embolism. Thromb Haemost. 2009;101(1):197-200.
- Kearon C, de Wit K, Parpia S, et al. Diagnosis of Pulmonary Embolism with d-Dimer Adjusted to Clinical Probability. N Engl J Med. 2019;381(22):2125-2134.
- Ellington DA, Holmes CE. Counseling and caring for pregnant women with thrombophilia. Obstet Gynecol Surv. 2004;59(10):732-739.
- Eichinger S, Stümpflen A, Hirschl M, et al. Hyperhomocysteinemia is a risk factor of recurrent venous thromboembolism. Thromb Haemost. 1998;80(4):566-569.
- Gris JC, Mercier E, Quéré I, et al. Low-molecular-weight heparin versus low-dose aspirin in women with one fetal loss and a constitutional thrombophilic disorder. Blood. 2004;103(10):3695-3699.
- Silver RM, Saade GR, Thorsten V, et al. Factor V Leiden, prothrombin G20210A, and methylene tetrahydrofolate reductase mutations in women with placental abruption. Obstet Gynecol. 2010;116(6):1225-1233.
- Wiwanitkit V. Placenta in preeclampsia, antiphospholipid syndrome and systemic lupus erythematosus. Am J Reprod Immunol. 2009;61(4):307-311.
- Kline JA, Williams GW, Hernandez-Nino J. D-dimer concentrations in normal pregnancy: new diagnostic thresholds are needed. Clin Chem. 2005;51(5):825-829.
- Righini M, Perrier A, De Moerloose P, Bounameaux H. D-Dimer for venous thromboembolism diagnosis: 20 years later. J Thromb Haemost. 2008;6(7):1059-1071.
- Schrecengost JE, LeGallo RD, Boyd JC, Moons KG, Gonias SL, Bruns DE. Comparison of diagnostic accuracies in outpatients and hospitalized patients of D-dimer testing for the evaluation of suspected pulmonary embolism. Clin Chem. 2003;49(9):1483-1490.
- Stein PD, Hull RD, Patel KC, et al. D-dimer for the exclusion of acute venous thrombosis and pulmonary embolism: a systematic review. Ann Intern Med. 2004;140(8):589-602.
- Kirson NY, Birnbaum HG, Ivanova JI, Waldman T, Joish V, Williamson T. Prevalence of pulmonary embolism among patients with a primary diagnosis of pneumonia. Curr Med Res Opin. 2011;27(3):471-476.
- Ceriani E, Combescure C, Le Gal G, et al. Clinical prediction rules for pulmonary embolism: a systematic review and meta-analysis. J Thromb Haemost. 2010;8(5):957-970.
- Lijfering WM, Rosendaal FR, Cannegieter SC. Risk factors for venous thrombosis – current understanding from an epidemiological point of view. Br J Haematol. 2010;149(6):824-833.
- Horlocker TT, Wedel DJ, Rowlingson JC, et al. Regional anesthesia in the patient receiving antithrombotic or thrombolytic therapy: American Society of Regional Anesthesia and Pain Medicine Evidence-Based Guidelines (Third Edition). Reg Anesth Pain Med. 2010;35(1):64-101.
- Ravi DK, Sen D. Post-traumatic deep vein thrombosis: Continuing challenges and opportunities. Indian J Orthop. 2012;46(3):265-270.
- Feng LB, Pines JM, Yusuf HR, Grosse SD. U.S. trends in computed tomography use and diagnoses in emergency department visits by patients with symptoms suggestive of pulmonary embolism, 2001-2009. Acad Emerg Med. 2013;20(10):1033-1040.
- Waydhas C, Nast-Kolb D. Posttraumatic Thromboembolism. Chirurg. 1999;70(11):1264-1273.
- Linkins LA, Bates SM, Kearon C, Levine MN, Weitz JI, Ginsberg JS. Failure of anti-D-dimer testing to exclude pulmonary embolism. Thromb Res. 2008;123(2):330-335.
- Undas A, Slowik A, Wolkow P, Szczudlik A, Tracz W. Fibrin clot properties in acute ischemic stroke: relation to neurological deficit. Thromb Res. 2010;125(4):357-361.
- Simonneau G, Goldhaber SZ, Darmon JY, Zimmermann J, Meyerhoff J, Investigators THESEE. A comparison of low-molecular-weight heparin with unfractionated heparin for acute pulmonary embolism. N Engl J Med. 1997;337(10):663-669.
- Heit JA, Mohr DN, Silverstein MD, Petterson TM, O’Fallon WM, Melton LJ 3rd. Predictors of recurrence after deep vein thrombosis and pulmonary embolism: a population-based cohort study. Arch Intern Med. 2000;160(6):761-768.
- Couturaud F, Sanchez O, Pernod G, et al. Six Months vs Extended Duration of Anticoagulation after a First Episode of Pulmonary Embolism: The PADIS-PE Randomized Clinical Trial. JAMA. 2015;314(1):31-40



BÌNH LUẬN