Sách dịch: CÁC NGUYÊN LÝ Y HỌC HÔ HẤP, ẤN BẢN THỨ 8
Dịch và chú giải: Ts.Bs. Lê Nhật Huy, Ths.Bs. Lê Đình Sáng
Chương 29. Hội chứng suy hô hấp cấp tính tiến triển (ARDS)
Acute respiratory distress syndrome
Steven E. Weinberger MD, MACP, FRCP, Barbara A. Cockrill MD and Jess Mandel MD, MACP, FRCP
Principles of Pulmonary Medicine, 29, 336-348
MỤC LỤC CHƯƠNG
|
Sinh lý của sự di chuyển dịch trong khoảng kẽ phế nang Hai cơ chế tích tụ dịch Nguyên nhân bệnh Các tác nhân gây hại qua đường hít Tổn thương qua tuần hoàn phổi Cơ chế bệnh sinh Bệnh học Sinh lý bệnh Ảnh hưởng lên trao đổi khí Những thay đổi trong mạch máu phổi Ảnh hưởng lên các đặc tính cơ học của phổi Đặc điểm lâm sàng Hướng tiếp cận chẩn đoán Điều trị |
Chương này tiếp tục thảo luận về suy hô hấp với việc xem xét chi tiết hơn về một loại suy hô hấp cấp quan trọng: hội chứng suy hô hấp cấp tính tiến triển (ARDS). Thực thể này ban đầu được gọi là hội chứng suy hô hấp ở người lớn, nhưng nó không chỉ giới hạn ở người lớn, vì vậy thuật ngữ cấp tính (acute) hiện nay được ưa chuộng hơn là người lớn (adult). ARDS là một dạng suy hô hấp cấp tính do giảm oxy máu phổ biến và quan trọng. Các đặc điểm lâm sàng và sinh lý bệnh của nó khác biệt đáng kể so với những đặc điểm được ghi nhận trong suy hô hấp cấp trên nền mạn tính. ARDS được đặc trưng bởi sự hiện diện của tình trạng giảm oxy máu động mạch nặng và thâm nhiễm phổi lan tỏa hai bên, không hoàn toàn do các nguyên nhân từ tim hoặc thủy tĩnh. Toàn bộ tiêu chí để xác định chẩn đoán ARDS được trình bày trong Bảng 29.1. Chương này mô tả chi tiết từng tiêu chí này cùng với các đặc điểm bệnh học và sinh lý bệnh liên quan.
ARDS được đặc trưng bởi sự hiện diện của tình trạng giảm oxy máu động mạch cấp tính, nặng và thâm nhiễm phổi hai bên không hoàn toàn do các nguyên nhân từ tim hoặc thủy tĩnh. Thay vì là một bệnh lý cụ thể, ARDS thực sự là một hội chứng xuất phát từ bất kỳ một trong số nhiều yếu tố nguyên nhân. Có lẽ cách đơn giản nhất để xem xét hội chứng này là kết quả không đặc hiệu của tổn thương cấp tính ở phổi, đặc trưng bởi sự phá vỡ hàng rào bình thường ngăn chặn sự rò rỉ dịch từ các mao mạch phổi ra khoảng kẽ và khoang phế nang. Một thuật ngữ khác, tổn thương phổi cấp (acute lung injury), trước đây được sử dụng để mô tả một quá trình tổn thương phổi tương tự trong đó rối loạn oxy hóa ít nghiêm trọng hơn, trong khi ARDS đại diện cho phần cuối của phổ bệnh với mức độ nghiêm trọng hơn. Tuy nhiên, phân loại hiện tại đã loại bỏ “tổn thương phổi cấp” như một thuật ngữ cụ thể và thay vào đó phân loại ARDS thành mức độ nhẹ, trung bình hoặc nặng dựa trên mức độ giảm oxy máu hiện có.
Một số tên gọi khác đã được sử dụng để mô tả ARDS, bao gồm phù phổi không do tim, phổi sốc, và suy phổi sau chấn thương. Chương này đầu tiên xem xét động lực học của sự vận chuyển dịch giữa các mạch máu phổi và khoảng kẽ phế nang vì sự thay đổi trong quá trình này rất quan trọng trong cơ chế bệnh sinh của ARDS. Tiếp theo là tổng quan về nhiều loại tổn thương có thể dẫn đến ARDS và một số giả thuyết được đề xuất để giải thích làm thế nào một nhóm các rối loạn đa dạng như vậy có thể tạo ra hội chứng này. Sau đó, chúng ta sẽ tiếp tục thảo luận về các hậu quả bệnh học, sinh lý bệnh và lâm sàng của ARDS. Chương kết thúc với một hướng tiếp cận điều trị tổng quát. Các chi tiết cụ thể hơn về hỗ trợ trao đổi khí bị suy giảm được cung cấp trong Chương 30.
SINH LÝ CỦA SỰ DI CHUYỂN DỊCH TRONG KHOẢNG KẼ PHẾ NANG
Mặc dù có một nhóm các rối loạn đa dạng có thể gây ra ARDS, kết quả cuối cùng của hội chứng này là như nhau: một sự rối loạn trong hàng rào bình thường giới hạn sự di chuyển của dịch thường được chứa trong các mao mạch phổi vào các phế nang. Trước khi thảo luận về một số giả thuyết giải thích cách hàng rào này bị tổn thương, việc xem xét ngắn gọn các yếu tố quyết định sự vận chuyển dịch giữa các mạch máu phổi, khoảng kẽ và khoang phế nang có thể hữu ích. Nhu mô phổi (Hình 29.1) bao gồm (1) các mạch máu nhỏ chạy qua thành phế nang, được gọi là mao mạch phổi; (2) nội mô mao mạch phổi, các tế bào lót thường giới hạn nhưng không hoàn toàn ngăn chặn sự di chuyển dịch ra khỏi mao mạch; (3) khoảng kẽ phổi, được xem xét ở đây là thành phế nang không bao gồm các mạch máu và các tế bào biểu mô lót lòng phế nang; (4) các kênh bạch huyết, chủ yếu được tìm thấy trong mô liên kết quanh mạch máu trong phổi; (5) các tế bào biểu mô phế nang, lót bề mặt của lòng phế nang; và (6) lòng phế nang hoặc khoang phế nang.
Sự di chuyển của dịch ra khỏi mao mạch phổi và vào khoảng kẽ được quyết định bởi áp lực thủy tĩnh trong các mạch máu và khoảng kẽ phổi, áp lực keo trong hai khoang này, và tính thấm của lớp nội mô. Ảnh hưởng của các yếu tố này trong việc quyết định sự vận chuyển dịch được tóm tắt trong phương trình Starling, đã được xem xét trong Chương 15 liên quan đến sự vận chuyển dịch qua khoang màng phổi. Phương trình Starling được lặp lại ở đây là phương trình 29.1:
| F=K[(PC−Pis)−σ(COPC−COPis)] |
trong đó F là sự di chuyển dịch; và lần lượt là áp lực thủy tĩnh của mao mạch phổi và khoảng kẽ; và lần lượt là áp lực keo (oncotic) của mao mạch phổi và khoảng kẽ; K là hệ số lọc; và là hệ số phản ánh (thước đo tính thấm của lớp nội mô đối với protein).
Dịch thường di chuyển từ mao mạch phổi vào khoảng kẽ. Sự tái hấp thu của hệ bạch huyết ngăn chặn sự tích tụ. Nếu các ước tính về các con số thực tế được thay thế cho các áp lực thủy tĩnh và áp lực keo bình thường trong phương trình 29.1, F là một số dương, cho thấy rằng dịch thường di chuyển ra khỏi mao mạch phổi và vào khoảng kẽ. Mặc dù tốc độ di chuyển dịch ra khỏi mao mạch phổi được ước tính tổng cộng khoảng 20 mL/giờ, dịch này không tích tụ. Trong điều kiện bình thường, các mạch bạch huyết có hiệu quả trong việc hấp thụ cả protein và dịch đã rời khỏi mạch máu và đi vào khoảng kẽ. Tuy nhiên, nếu sự di chuyển dịch vào khoảng kẽ tăng lên đáng kể hoặc nếu sự dẫn lưu bạch huyết bị cản trở, dịch sẽ tích tụ trong khoảng kẽ, dẫn đến phù kẽ. Khi có đủ dịch tích tụ hoặc biểu mô phế nang bị tổn thương, dịch cũng di chuyển qua hàng rào tế bào biểu mô và vào các khoang phế nang, dẫn đến phù phế nang.
Bảng 29.1 Định nghĩa Berlin 2012 về Hội chứng suy hô hấp cấp tính tiến triển (Tất cả các thành phần phải có mặt)
Chú thích: ARDS, hội chứng suy hô hấp cấp tính tiến triển.
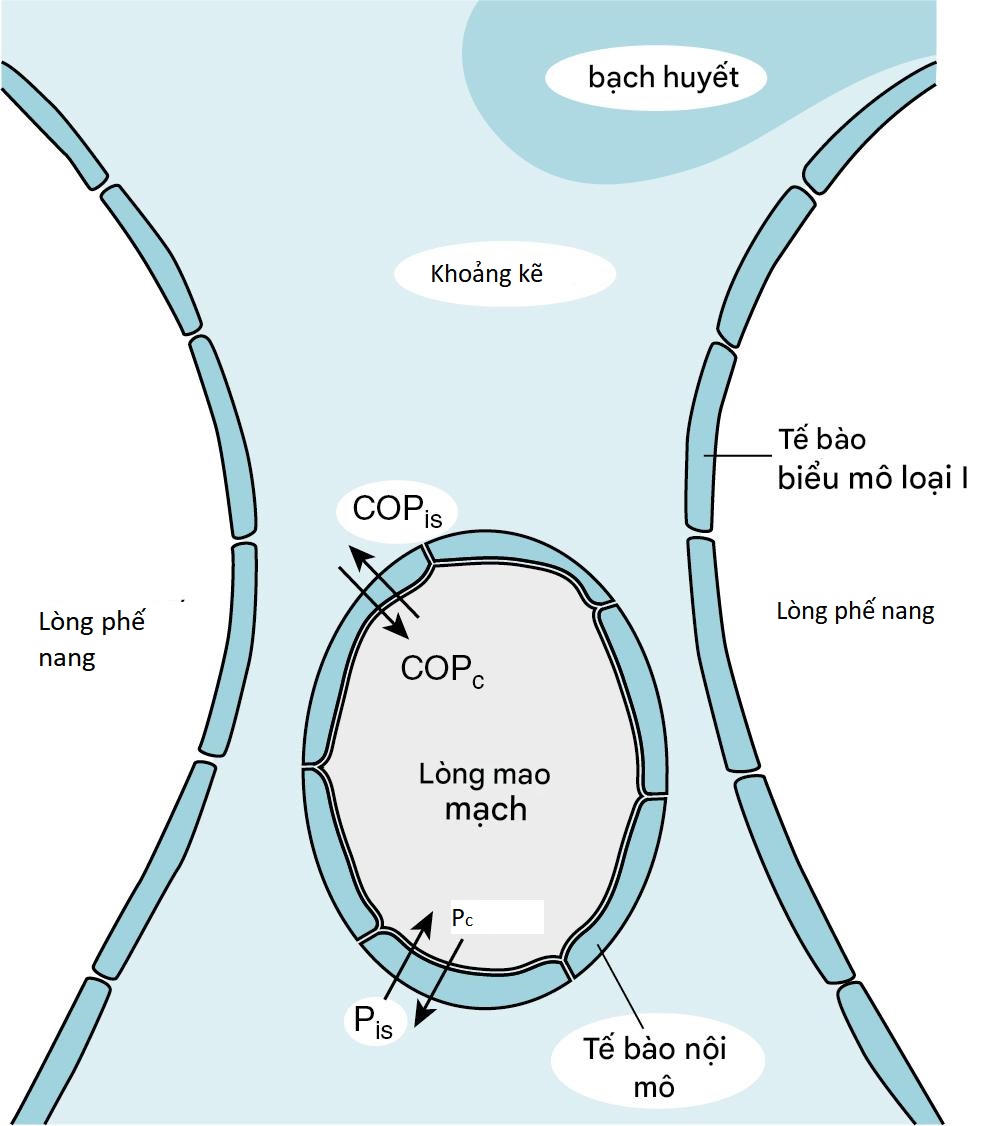
Hình 29.1 Sơ đồ vùng trao đổi khí của phổi. Các lực chi phối sự di chuyển của dịch giữa lòng mao mạch phổi và khoảng kẽ phế nang được thể hiện. Các mũi tên chỉ hướng di chuyển của dịch được tạo ra bởi mỗi lực quan trọng. Các mạch bạch huyết nằm trong mô liên kết quanh mạch chứ không nằm trong thành phế nang. , áp lực keo mao mạch phổi; , áp lực keo khoảng kẽ; , áp lực thủy tĩnh mao mạch phổi; , áp lực thủy tĩnh khoảng kẽ.
Hai cơ chế tích tụ dịch
Trong thực tế, các lực được mô tả trong phương trình Starling bị thay đổi theo hai cách chính, tạo ra phù kẽ và thường là phù phế nang (Bảng 29.2). Cách thứ nhất xảy ra khi áp lực thủy tĩnh trong mao mạch phổi () tăng lên, thường là do áp lực nhĩ trái tăng (ví dụ, trong suy thất trái hoặc hẹp van hai lá). Phù phổi kết quả được gọi là phù phổi do tim hoặc phù phổi do nguyên nhân thủy tĩnh, và nguyên nhân chủ yếu là sự mất cân bằng giữa các lực thủy tĩnh và lực keo chi phối sự di chuyển dịch. Trong dạng phù này, hàng rào tính thấm giới hạn sự di chuyển của protein ra khỏi mao mạch vẫn còn nguyên vẹn, và dịch rò rỉ ra ngoài có hàm lượng protein rất thấp.
Trong cơ chế thứ hai mà dịch tích tụ, áp lực thủy tĩnh bình thường, nhưng tính thấm của các hàng rào nội mô mao mạch và biểu mô phế nang tăng lên do tổn thương một hoặc cả hai quần thể tế bào này. Sự di chuyển của protein ra khỏi không gian nội mạch xảy ra như là một hệ quả của sự gia tăng tính thấm. Do sự gia tăng tính thấm đối với các phân tử lớn, dịch rò rỉ ra ngoài có hàm lượng protein tương đối cao, thường gần bằng hàm lượng trong huyết tương. Cơ chế thứ hai này là cơ chế hoạt động trong ARDS. Vì sự gia tăng áp lực mao mạch phổi do bệnh tim không liên quan, dạng phù này được gọi là phù phổi không do tim.
Mặc dù phù phổi do tim và do nguyên nhân thủy tĩnh được đề cập ở đây, các phần tiếp theo của chương này tập trung vào phù không do tim (tức là ARDS). Tuy nhiên, điều quan trọng cần nhớ là áp lực thủy tĩnh vẫn có tác động quan trọng đến sự di chuyển dịch, ngay cả khi vấn đề chính là hàng rào tính thấm bị lỗi. Cụ thể, áp lực thủy tĩnh mao mạch phổi cao hơn sẽ dẫn đến nhiều dịch rò rỉ qua lớp nội mô mao mạch phổi có tính thấm bất thường hơn so với khi áp lực thấp hơn. Ở mức độ cực đoan, một số bệnh nhân có khiếm khuyết về tính thấm của giường mao mạch phổi đồng thời có áp lực mao mạch phổi tăng cao rõ rệt do suy thất trái đồng thời. Trong những trường hợp này, khiếm khuyết về tính thấm và áp lực thủy tĩnh tăng cao hoạt động hiệp đồng, góp phần làm rò rỉ dịch ra khỏi mạch máu phổi. Không chỉ làm rò rỉ dịch trầm trọng hơn, mà khi cả hai yếu tố đều có mặt, việc xác định tầm quan trọng tương đối của mỗi yếu tố và do đó xác định các ưu tiên điều trị tối ưu ở một bệnh nhân cụ thể có thể trở nên khó khăn.
Bảng 29.2. Phân loại phù phổi
NGUYÊN NHÂN BỆNH
Nhiều rối loạn đa dạng có liên quan đến khả năng gây ra ARDS (Bảng 29.3). Điểm chung của các yếu tố nguyên nhân đa dạng này trong ARDS là khả năng gây ra tổn thương lan tỏa cho nhu mô phổi. Ngoài ra, việc xác định các đặc điểm khác liên kết các nguyên nhân cơ bản là rất khó dựa trên kiến thức hiện tại của chúng ta. Ngay cả con đường gây tổn thương cũng khác nhau. Một số yếu tố nguyên nhân liên quan đến các tác nhân gây hại được hít vào; những yếu tố khác dường như gây ra tác động của chúng lên phổi thông qua tuần hoàn thay vì đường thở.
Các tác nhân gây hại qua đường hít
Nhiều tác nhân gây hại đến nhu mô phổi qua đường thở đã được xác định. Trong một số trường hợp, chất lỏng là nguyên nhân; ví dụ bao gồm dịch dạ dày, nước muối hoặc nước ngọt, và hydrocarbon. Với dịch dạ dày có tính axit, đặc biệt khi pH thấp hơn 2.5, bệnh nhân phải chịu một “vết bỏng hóa học” đối với nhu mô phổi, dẫn đến tổn thương biểu mô phế nang. Trong trường hợp đuối nước ở cả nước ngọt hoặc nước mặn, không chỉ nước hít vào làm đầy các khoang phế nang, mà tổn thương thứ cấp đối với hàng rào phế nang-mao mạch còn gây ra rò rỉ dịch từ mạch máu phổi. Vì nước mặn ưu trương hơn so với huyết tương, nó hút dịch từ tuần hoàn do chênh lệch áp suất thẩm thấu. Mặt khác, nước ngọt lại nhược trương so với huyết tương và các thành phần tế bào, do đó có thể đi vào các tế bào nhu mô phổi, dẫn đến phù tế bào. Ngoài ra, nước ngọt dường như làm bất hoạt surfactant, một yếu tố phức tạp được thảo luận chi tiết hơn trong phần Sinh lý bệnh. Cuối cùng, hydrocarbon hít phải có thể gây độc cho nhu mô xa, có lẽ một phần vì chúng cũng làm bất hoạt surfactant và gây ra những thay đổi đáng kể về sức căng bề mặt.
Một số loại khí hít vào đã được xác định là chất độc cấp tính tiềm tàng và là tác nhân gây ra ARDS. Nitơ dioxide là một ví dụ, cũng như một số sản phẩm hóa học của quá trình đốt cháy khi hít phải khói. Một nguyên nhân được mô tả gần đây hơn là tổn thương phổi liên quan đến sử dụng thuốc lá điện tử hoặc vaping (EVALI), trong đó các hóa chất bay hơi được hít vào khởi phát sự phát triển của ARDS ở những người nhạy cảm, đặc biệt nếu vitamin E acetate là một trong những tác nhân được hít vào. Nồng độ oxy hít vào cao, đặc biệt khi được cung cấp trong thời gian dài, có thể góp phần gây tổn thương phế nang. Cơ chế gây độc của được cho là do sự tạo ra các gốc tự do và các anion superoxide, là các sản phẩm phụ của quá trình chuyển hóa oxy hóa gây độc cho các tế bào biểu mô và nội mô phổi. Thật trớ trêu khi có thể góp phần gây tổn thương phổi, trong khi nó lại rất quan trọng trong điều trị hỗ trợ của ARDS. Chương 30 thảo luận về một cách khác mà việc điều trị ARDS có thể làm trầm trọng thêm tổn thương phế nang thông qua việc căng phồng quá mức và/hoặc đóng mở chu kỳ của các phế nang do thông khí cơ học gây ra.
Các tác nhân nhiễm trùng có thể gây tổn thương thông qua đường thở đến nhu mô phổi. Viêm phổi do vi khuẩn là một vấn đề lâm sàng cơ bản phổ biến liên quan đến sự phát triển của ARDS. Một nguyên nhân quan trọng khác của ARDS là viêm phổi do virus như COVID-19 hoặc viêm phổi cúm, gây tổn thương các tế bào nhu mô và các tế bào nội mô lân cận, do đó làm thay đổi tính thấm của phế nang-mao mạch. Trong thập kỷ đầu tiên của đại dịch AIDS, viêm phổi do Pneumocystis jiroveci đã trở thành một nguyên nhân phổ biến của ARDS. Tuy nhiên, với sự ra đời của liệu pháp kháng retrovirus hoạt tính cao vào giữa những năm 1990 và sự sẵn có của các phác đồ dự phòng hiệu quả chống lại Pneumocystis, giờ đây nó là một nguyên nhân không phổ biến của ARDS.
Tổn thương qua tuần hoàn phổi
Đối với các nguyên nhân của ARDS không liên quan đến các tác nhân hoặc độc tố hít phải, tuần hoàn phổi được cho là con đường gây tổn thương. Tuy nhiên, trong hầu hết các trường hợp, một yếu tố lưu hành cụ thể chưa được xác định chắc chắn, mặc dù một số khả năng đã được đề xuất.
Một trong những tác nhân khởi phát phổ biến nhất cho ARDS là nhiễm khuẩn huyết, trong đó các vi sinh vật hoặc sản phẩm của chúng (đặc biệt là nội độc tố) lưu hành trong dòng máu khởi phát một chuỗi các sự kiện dẫn đến độc tính đối với các tế bào nhu mô.
Bảng 29.3 Nguyên nhân gây tổn thương phế nang lan tỏa và Hội chứng suy hô hấp cấp tính tiến triển
Mặc dù thuật ngữ phổi sốc đã được sử dụng nhiều năm trước để mô tả tình trạng hiện nay được gọi là ARDS, sự hiện diện của sốc giảm huyết áp đơn thuần có lẽ không đủ để phát triển ARDS. Những bệnh nhân mà ARDS phát triển dường như là kết quả của hạ huyết áp thường có các yếu tố nguyên nhân tiềm ẩn phức tạp (ví dụ: chấn thương, nhiễm khuẩn huyết) hoặc đã nhận được điều trị (ví dụ: truyền máu) liên quan đến tổn thương tế bào.
Những bệnh nhân mắc rối loạn đông máu được gọi là đông máu nội mạch lan tỏa (DIC) dường như có khả năng phát triển ARDS. Trong DIC, bệnh nhân có sự hoạt hóa liên tục của cả cơ chế đông máu và hệ thống tiêu sợi huyết bảo vệ ngăn chặn sự hình thành và lan rộng của cục máu đông. Giống như ARDS, DIC là một hội chứng và có thể xảy ra do nhiều nguyên nhân chính hoặc cơ bản khác nhau; mặc dù hai vấn đề này thường liên quan với nhau, nhưng liệu một vấn đề có gây ra vấn đề kia và chính xác như thế nào vẫn chưa chắc chắn.
Khi mỡ hoặc dịch ối đi vào tuần hoàn, vật liệu này được vận chuyển đến phổi, dẫn đến các vấn đề lâm sàng tương ứng là tắc mạch mỡ và tắc mạch ối. Có lẽ những vật liệu này gây độc cho các tế bào nội mô của mao mạch phổi, và sự phát triển của ARDS được mô tả rõ trong các bối cảnh lâm sàng này.
Một loạt các loại thuốc, nhiều trong số đó thuộc nhóm ma túy, là những nguyên nhân tiềm tàng của ARDS. Trong hầu hết các trường hợp, bệnh nhân đã dùng quá liều thuốc, mặc dù điều này không phải lúc nào cũng xảy ra. Một trong những tác nhân được công nhận thường xuyên nhất là heroin, và đôi khi tên gọi “phù phổi do heroin” được sử dụng. Ngoài heroin và các loại ma túy khác, một số loại thuốc khác đôi khi gây ra ARDS, bao gồm aspirin và thuốc lợi tiểu thiazide. Mặc dù hội chứng phù phổi do thuốc đã được mô tả rõ, cơ chế mà nó xảy ra vẫn chưa chắc chắn.
Một số bệnh nhân bị viêm tụy cấp phát triển một bức tranh lâm sàng phù hợp với phù phổi không do tim. Trong tình huống này, các enzyme được giải phóng vào tuần hoàn từ tụy bị tổn thương đã được đề xuất là gây tổn thương trực tiếp các tế bào nhu mô phổi hoặc khởi phát các con đường gián tiếp khác, dẫn đến tổn thương.
Một số rối loạn của hệ thần kinh trung ương, đặc biệt là chấn thương và xuất huyết nội sọ liên quan đến tăng áp lực nội sọ, được biết là có liên quan đến sự phát triển của ARDS. Tương tự, ARDS đôi khi xảy ra sau các cơn co giật toàn thể. Một giả thuyết thú vị và được chấp nhận rộng rãi để giải thích cái gọi là phù phổi do nguyên nhân thần kinh này là sự phóng điện mạnh của hệ thần kinh giao cảm để đáp ứng với tăng áp nội sọ gây ra co thắt mạch và áp lực mao mạch phổi cực cao, dẫn đến tổn thương cơ học cho lớp nội mô và sau đó là sự thoát dịch ra khỏi không gian nội mạch.
CƠ CHẾ BỆNH SINH
Làm thế nào mà tất cả các vấn đề lâm sàng đa dạng này đều dẫn đến hội chứng tăng tính thấm mao mạch phổi trong ARDS? Một yếu tố quan trọng dường như là tổn thương các tế bào nội mô mao mạch phổi và các tế bào biểu mô phế nang (chủ yếu là các tế bào biểu mô type I, có các bào tương cung cấp phần lớn diện tích bề mặt lót thành phế nang). Với sự đa dạng của các tác nhân có thể gây tổn thương cho các loại tế bào này, dường như không có khả năng có một cơ chế chung duy nhất hoạt động cho tất cả các loại tổn thương.
Tổn thương ban đầu trong ARDS ảnh hưởng đến các tế bào biểu mô phế nang (type I), các tế bào nội mô mao mạch, hoặc cả hai. Trong phần thảo luận về một số nguyên nhân cụ thể của ARDS, một vài giả thuyết về cơ chế bệnh sinh cho các rối loạn riêng lẻ đã được đề cập ngắn gọn. Ở đây, các cơ chế tế bào và sinh hóa tổng quát hơn hoạt động trong quá trình tổn thương các tế bào biểu mô phổi và nội mô mao mạch được xem xét.
Một thành phần đặc biệt quan trọng của cơ chế bệnh sinh của tổn thương phổi cấp và ARDS dường như là sự chiêu mộ các tế bào viêm đến phổi, đặc biệt là bạch cầu trung tính. Một giả thuyết ban đầu giải thích sự chiêu mộ bạch cầu trung tính đến phổi tập trung vào con đường bổ thể. Khi bổ thể được hoạt hóa bởi nhiễm khuẩn huyết, C5a được giải phóng và chịu trách nhiệm cho sự kết tập của bạch cầu trung tính trong mạch máu phổi. Các bạch cầu trung tính này có thể giải phóng một loạt các chất có khả năng phá hủy các thành phần tế bào và phi tế bào của thành phế nang. Các gốc superoxide, các sản phẩm phụ khác của quá trình chuyển hóa oxy hóa, một loạt các cytokine, và các enzyme phân giải protein khác nhau đều có thể được giải phóng bởi bạch cầu trung tính và có thể quan trọng về mặt bệnh sinh trong việc tạo ra tổn thương cấu trúc và chức năng cho thành phế nang. Ví dụ về các chất trung gian cụ thể bao gồm nội độc tố, các sản phẩm của quá trình chuyển hóa axit arachidonic, và các cytokine như yếu tố hoại tử khối u (TNF)-α, interleukin (IL)-8, endothelin, và yếu tố tăng trưởng biến đổi (TGF)-β. Một phản ứng viêm cũng có thể được tăng cường bởi sự giảm các chất trung gian chống viêm, bao gồm các cytokine như IL-10 và IL-11.
|
Các thành phần quan trọng được đề xuất trong cơ chế bệnh sinh của ARDS bao gồm:
|
Hoạt hóa bổ thể chỉ là một trong nhiều cơ chế tiềm năng để chiêu mộ và giữ lại bạch cầu trung tính trong phổi. Các yếu tố quan trọng khác bao gồm các cytokine khác nhau và các chất trung gian khác ảnh hưởng đến sự di chuyển của bạch cầu trung tính trong phổi. Các tế bào nội mô mạch máu, đặc biệt là trong hệ thống mạch máu phổi, cũng bị hoạt hóa, biểu hiện các phân tử kết dính bạch cầu, và dẫn đến sự tích tụ của bạch cầu trung tính trong mạch máu phổi.
Một quá trình quan trọng khác dường như là sự hoạt hóa của hệ thống đông máu. Một số yếu tố chịu trách nhiệm cho cái được gọi là “trạng thái tiền đông máu,” bao gồm việc giải phóng các yếu tố mô tiền đông máu, nồng độ giảm của các yếu tố có hoạt tính chống đông (ví dụ, protein C và protein S), và tăng hoạt tính của các protein ức chế tiêu sợi huyết (ví dụ, chất ức chế hoạt hóa plasminogen-1). Kết quả là tăng sản xuất thrombin và fibrin, cũng như bằng chứng về huyết khối trong các mao mạch phổi.
Mặc dù có những nỗ lực nghiên cứu sâu rộng trong nhiều thập kỷ qua để giải thích các cơ chế của tổn thương phổi cấp, sự hiểu biết đầy đủ về ARDS vẫn còn khó nắm bắt. Gần đây, vai trò tiềm năng của hệ thống miễn dịch bẩm sinh (bao gồm đại thực bào phế nang và tế bào tua), các thụ thể giống Toll, và các mẫu phân tử liên quan đến tổn thương ty thể (DAMPs) đang được tích cực điều tra. Việc làm rõ thêm về cơ chế bệnh sinh và tầm quan trọng của các con đường và chất trung gian khác nhau sẽ rất quan trọng để phát triển các hình thức phòng ngừa và điều trị hiệu quả.
BỆNH HỌC
Mặc dù có nhiều yếu tố nguyên nhân trong ARDS, các phát hiện bệnh học tương đối giống nhau bất kể nguyên nhân cơ bản. Theo quan sát của các nhà bệnh học, mô hình tổn thương đi kèm với ARDS được gọi là tổn thương phế nang lan tỏa.
|
Các đặc điểm bệnh học của ARDS:
|
Tổn thương các tế bào biểu mô phế nang type I và các tế bào nội mô mao mạch phổi dường như là yếu tố chính trong cơ chế bệnh sinh. Các tế bào biểu mô type I thường xuất hiện hoại tử và có thể bong ra khỏi bề mặt của thành phế nang. Tổn thương các tế bào nội mô mao mạch thường khó, nếu không muốn nói là không thể nhận ra bằng kính hiển vi quang học; kính hiển vi điện tử có thể cần thiết để đánh giá những thay đổi siêu cấu trúc tinh vi của chúng.
Trong giai đoạn đầu của ARDS, thường được gọi là giai đoạn tiết dịch, có thể thấy dịch trong khoảng kẽ của vách phế nang cũng như trong lòng phế nang. Có thể thấy xuất huyết rải rác và các vùng xẹp phế nang, ít nhất một phần liên quan đến sự bất hoạt của surfactant (bởi các dịch tiết phế nang giàu protein) và giảm sản xuất surfactant do tổn thương các tế bào biểu mô phế nang type II. Nhu mô phổi cho thấy sự xâm nhập của các tế bào viêm, cả trong khoảng kẽ và thường là trong lòng phế nang. Phản ứng tế bào tương đối không đặc hiệu, bao gồm bạch cầu trung tính và đại thực bào. Fibrin và các mảnh vụn tế bào có thể được nhìn thấy trong hoặc xung quanh các phế nang.
Một phát hiện đặc trưng trong bệnh học của ARDS là sự hiện diện của màng hyaline. Chúng không phải là “màng” thực sự theo nghĩa sinh học; thay vào đó, những phát hiện này đại diện cho dịch phù giàu protein đã lấp đầy các phế nang. Màng hyaline bao gồm sự kết hợp của fibrin, các mảnh vụn tế bào, và các protein huyết tương được lắng đọng trên bề mặt phế nang. Mặc dù chúng không đặc hiệu, sự hiện diện của chúng cho thấy rằng tổn thương phế nang và tăng tính thấm mao mạch, chứ không phải áp lực thủy tĩnh tăng cao, là nguyên nhân của phù phổi.
Sau khoảng 1 đến 2 tuần, giai đoạn tiết dịch tiến triển thành giai đoạn tăng sinh. Như một phần quan trọng của quá trình sửa chữa xảy ra trong giai đoạn tăng sinh, các tế bào biểu mô phế nang type II nhân lên trong nỗ lực thay thế các tế bào biểu mô type I bị tổn thương. Sự dư thừa kết quả của các tế bào biểu mô type II thường chiếm một vị trí khá nổi bật trong bức tranh bệnh học của ARDS. Một thành phần khác của giai đoạn tăng sinh là sự tích tụ của các nguyên bào sợi trong nhu mô phổi. Trong một số trường hợp ARDS nặng và kéo dài, phản ứng nguyên bào sợi này trở nên tiến triển và một giai đoạn xơ hóa xảy ra. Trong những trường hợp này, nhu mô phổi bị tổn thương không được sửa chữa mà tiến tới phát triển mô sẹo (xơ hóa) đáng kể. Thường đi kèm với xơ hóa là những thay đổi trong mạch máu phổi, bao gồm sự tái cấu trúc rộng rãi và sự thu hẹp lòng của các mạch máu nhỏ do sự tăng sinh của lớp áo trong và áo giữa và do sự hình thành các huyết khối tại chỗ.
SINH LÝ BỆNH
Ảnh hưởng lên trao đổi khí
Hầu hết các hậu quả lâm sàng của ARDS đều diễn ra một cách hợp lý từ sự hiện diện của phù kẽ và phù phế nang. Vấn đề nổi bật nhất ở giai đoạn đầu là tình trạng ngập dịch phế nang, ngăn chặn hiệu quả sự thông khí của các phế nang bị ảnh hưởng, mặc dù tưới máu có thể được bảo tồn tương đối. Những phế nang này, được tưới máu nhưng không được thông khí, hoạt động như những vùng mà máu được shunt từ tuần hoàn động mạch phổi sang tuần hoàn tĩnh mạch phổi mà không được oxy hóa. Loại shunt này là một trong những cơ chế gây giảm oxy máu (xem Chương 1), và có lẽ không có ví dụ nào tốt hơn về shunt trong phổi hơn là ARDS.
|
Các đặc điểm sinh lý bệnh của ARDS:
|
Trong ARDS, không chỉ có các vùng shunt thực sự mà còn có cả sự bất tương xứng thông khí-tưới máu. Ở một mức độ nào đó, hiện tượng này là kết quả của sự phân bố không đồng đều của quá trình bệnh lý trong phổi. Ở những vùng mà khoảng kẽ bị phù nhiều hơn hoặc có nhiều dịch hơn trong phế nang, thông khí bị suy giảm nhiều hơn (mặc dù vẫn còn một số thông khí) so với những vùng tương đối không bị ảnh hưởng. Những thay đổi trong lưu lượng máu không nhất thiết tuân theo cùng một sự phân bố như những thay đổi trong thông khí, và do đó dẫn đến sự bất tương xứng thông khí-tưới máu.
Ngoài các tác động trực tiếp của dịch kẽ và dịch phế nang lên quá trình oxy hóa, các thay đổi khác dường như là thứ phát sau những thay đổi trong việc sản xuất và hiệu quả của surfactant. Chương 8 đề cập đến surfactant như một hỗn hợp của lipid, các protein đặc hiệu và carbohydrate chịu trách nhiệm làm giảm sức căng bề mặt và duy trì sự thông khí của phế nang. Khi surfactant không có, như thấy trong hội chứng suy hô hấp ở trẻ sơ sinh, có sự xẹp phế nang trên diện rộng. Trong ARDS, việc sản xuất surfactant bị ảnh hưởng xấu bởi tổn thương các tế bào biểu mô phế nang type II. Ngoài ra, dịch giàu protein trong phế nang làm cho surfactant mất chức năng và do đó kém hiệu quả hơn trong việc ngăn chặn sự xẹp phế nang.
Về mặt oxy hóa, cả sự bất tương xứng thông khí-tưới máu (với các vùng có tỷ lệ thông khí-tưới máu thấp) và shunt thực sự (tỷ lệ thông khí-tưới máu = 0) đều góp phần gây giảm oxy máu. Trong chừng mực shunt chịu trách nhiệm phần lớn cho sự sụt giảm , việc bổ sung đơn thuần có thể không phục hồi được quá trình oxy hóa về bình thường. Trong thực tế, có tăng lên một chút khi dùng 100% , nhưng không đạt đến mức mong đợi sau khi dùng nồng độ cao như vậy. Xem xét bản chất của vấn đề ARDS, phản ứng này với bổ sung không có gì đáng ngạc nhiên. Oxy cải thiện thành phần giảm oxy máu do bất tương xứng thông khí-tưới máu, nhưng nó không hiệu quả đối với shunt thực sự.
Mặt khác, mức độ thông khí tuyệt đối ở bệnh nhân ARDS ban đầu vẫn còn nguyên vẹn hoặc thậm chí tăng lên. Kết quả là, bệnh nhân thường không gặp khó khăn với việc ứ đọng , ngoại trừ trong bệnh rất nặng hoặc khi có một quá trình bệnh lý phổi cơ bản khác. Mặc dù có thể có một lượng đáng kể khoảng chết (như một phần của sự bất tương xứng thông khí-tưới máu tổng thể), bệnh nhân ARDS giai đoạn đầu có thể tăng tổng thông khí để bù đắp cho các vùng phân bố không đều. Nếu bệnh nhân tiến triển đến các giai đoạn sau của ARDS, khoảng chết tăng lên, xơ hóa phổi xảy ra, và việc thải trừ có thể bị suy giảm.
Những thay đổi trong mạch máu phổi
Mạch máu phổi chịu những thay đổi do quá trình bệnh lý tổng thể gây ra. Kháng lực mạch máu phổi tăng lên, có lẽ vì nhiều lý do. Giảm oxy máu gây co mạch trong hệ thống động mạch phổi, và dịch trong khoảng kẽ có thể làm tăng áp lực kẽ, dẫn đến giảm kích thước và tăng kháng lực của các mạch máu nhỏ trong phổi. Lòng của các mạch máu nhỏ có thể bị tổn thương bởi các vi huyết khối và những thay đổi tăng sinh trong thành mạch (đã được thảo luận trước đó trong phần Cơ chế bệnh sinh và Bệnh học). Một hậu quả của những thay đổi mạch máu phổi là sự thay đổi trong sự phân bố bình thường của lưu lượng máu phổi. Máu chảy ưu tiên đến các khu vực có kháng lực thấp hơn, thường không tương ứng với các vùng nhận được nhiều thông khí nhất. Do đó, lại dẫn đến sự bất tương xứng thông khí-tưới máu, với một số khu vực có tỷ lệ thông khí-tưới máu cao và các khu vực khác có tỷ lệ thấp.
Ảnh hưởng lên các đặc tính cơ học của phổi
Khi xem xét các đặc tính cơ học của phổi trong ARDS, chúng ta phải nhận ra rằng chụp cắt lớp vi tính đã chứng minh sự phân bố của bệnh không đồng nhất hơn so với dự kiến dựa trên những thay đổi lan tỏa thấy trên phim chụp X-quang lồng ngực. Mặc dù một số vùng đã bị tổn thương và khá bất thường, những vùng khác dường như không bị ảnh hưởng. Kết quả là, các phế nang không bị ảnh hưởng một cách lan tỏa và đồng nhất. Thay vào đó, một số vùng của phổi có các phế nang bị bệnh đáng kể, không giãn nở và thông khí kém hoặc hoàn toàn không thông khí, trong khi những vùng khác có các phế nang tương đối được bảo tồn và thông khí tốt. Kết quả cuối cùng của việc có ít phế nang “chức năng” hiệu quả hơn là thể tích đi vào phổi ít hơn cho bất kỳ áp lực bơm phồng nào; theo định nghĩa, điều này có nghĩa là độ giãn nở của phổi giảm.
| Độ giãn nở giảm và FRC thấp trong ARDS không liên quan đến các phế nang bị ảnh hưởng đồng nhất mà là do sự tham gia không đồng nhất của bệnh. |
Thể tích khí chứa trong phổi ở dung tích cặn chức năng (FRC; tức là, vị trí cuối kỳ thở ra khi nghỉ của phổi) cũng giảm đáng kể. Một lần nữa, quá trình bệnh lý không đồng nhất, vì vậy FRC giảm không phải do sự giảm thể tích đồng đều trên tất cả các phế nang mà là do một nhóm phế nang chứa ít hoặc không có khí và một nhóm khác chứa một thể tích khí tương đối bình thường. Kết quả cuối cùng là bệnh nhân thở ở một thể tích phổi tổng thể thấp hơn nhiều so với bình thường, ưu tiên thông khí cho những phế nang tương đối được bảo tồn. Kiểu thở điển hình do những thay đổi cơ học này được đặc trưng bởi nhịp thở nhanh nhưng nông. Kiểu thở này không hiệu quả và đòi hỏi bệnh nhân phải tiêu tốn nhiều năng lượng hơn, điều này có lẽ góp phần gây ra chứng khó thở rất đặc trưng của bệnh nhân ARDS.
ĐẶC ĐIỂM LÂM SÀNG
Vì ARDS là một hội chứng lâm sàng với nhiều nguyên nhân khác nhau, bức tranh lâm sàng phản ánh sự hiện diện của không chỉ phù phổi không do tim mà còn cả bệnh lý nền. Trong phần này, chúng ta xem xét các hậu quả hô hấp của ARDS, bất kể nguyên nhân, và tập trung vào các ảnh hưởng lâm sàng của chính hội chứng này thay vì của rối loạn nền.
|
Đặc điểm lâm sàng của ARDS:
|
Sau tổn thương ban đầu, bất kể là gì, thường có một khoảng thời gian trễ từ vài giờ đến một ngày hoặc hơn trước khi các hậu quả hô hấp phát triển đầy đủ. Trong hầu hết các trường hợp, triệu chứng đầu tiên mà bệnh nhân trải qua là khó thở. Khi điều này biểu hiện, khám lâm sàng thường cho thấy bệnh nhân thở nhanh, mặc dù X-quang lồng ngực có thể không cho thấy những phát hiện đáng kể. Tuy nhiên, khí máu động mạch phản ánh một sự rối loạn oxy hóa, thường với sự gia tăng chênh lệch áp suất riêng phần oxy giữa phế nang và động mạch (). Ban đầu, thông khí phế nang bình thường hoặc (thường xuyên hơn) tăng lên, vì vậy thường dưới mức cơ bản. Khi dịch và protein tiếp tục rò rỉ từ mạch máu vào khoảng kẽ và khoang phế nang, các phát hiện lâm sàng trở nên rầm rộ. Bệnh nhân có thể trở nên cực kỳ khó thở và thở nhanh, và có thể nghe thấy ran khi nghe phổi. Các phát hiện trên X-quang lồng ngực trở nên rất bất thường, cho thấy phù kẽ và phù phế nang trên diện rộng. Các khía cạnh X-quang của ARDS được thảo luận trong phần Hướng tiếp cận chẩn đoán.
Vì shunt máu thực sự qua các phế nang không được thông khí là quan trọng trong cơ chế bệnh sinh của giảm oxy máu, động mạch có thể tương đối không đáp ứng với việc cung cấp bổ sung. Như một phương pháp tiêu chuẩn hóa để giải thích ở những bệnh nhân nhận các lượng oxy bổ sung khác nhau, tỷ lệ so với nồng độ oxy hít vào () được sử dụng để xác định mức độ nghiêm trọng của ARDS. Tỷ lệ nhưng lớn hơn 200 được coi là ARDS nhẹ (và được phân loại là tổn thương phổi cấp theo các tiêu chí trước đây), tỷ lệ từ 100 đến 200 xác định ARDS trung bình, và tỷ lệ dưới 100 được phân loại là ARDS nặng (xem Bảng 29.1).
Khả năng cải thiện của chúng ta trong 50 năm qua trong việc cung cấp hỗ trợ hô hấp cho những bệnh nhân này đã làm cho tử vong trực tiếp do suy hô hấp tương đối hiếm gặp. Thay vào đó, tỷ lệ tử vong cao với ARDS, hiện được ước tính từ 25% đến 40%, liên quan đến nguyên nhân cơ bản (đặc biệt là nhiễm khuẩn huyết) hoặc do suy đa cơ quan ở những bệnh nhân nặng này.
Những bệnh nhân may mắn hồi phục có thể có rất ít di chứng hô hấp vừa nghiêm trọng vừa vĩnh viễn. Chức năng phổi về cơ bản có thể trở lại bình thường, mặc dù đánh giá tinh vi thường cho thấy những bất thường tiềm ẩn dai dẳng. Tuy nhiên, ngày càng có nhiều nhận thức rằng một phần đáng kể những người sống sót có thể bị suy giảm chức năng nhận thức thần kinh, trầm cảm, lo âu, yếu cơ và rối loạn căng thẳng sau sang chấn liên quan đến chăm sóc tích cực.
HƯỚNG TIẾP CẬN CHẨN ĐOÁN
Chẩn đoán ARDS thường dựa trên sự kết hợp của thông tin lâm sàng và X-quang (đánh giá ở cấp độ vĩ mô) và các giá trị khí máu động mạch (đánh giá ở cấp độ chức năng). Mặc dù trước đây, một số bác sĩ lâm sàng và nhà nghiên cứu đã ủng hộ việc sinh thiết phổi ở những bệnh nhân được cho là mắc ARDS, những thủ thuật này được thực hiện chủ yếu cho mục đích nghiên cứu. Sinh thiết phổi hiện nay hiếm khi được thực hiện trừ khi nghi ngờ một quá trình bệnh lý khác ngoài ARDS.
X-quang lồng ngực ở những bệnh nhân ARDS giai đoạn đầu có thể không cho thấy những phát hiện bất thường khi bắt đầu biểu hiện lâm sàng. Tuy nhiên, trong một thời gian ngắn, bằng chứng về phù kẽ và phù phế nang thường phát triển, với phù phế nang là phát hiện nổi bật nhất trên X-quang lồng ngực. Phù xuất hiện lan tỏa, ảnh hưởng đến cả hai phổi tương đối đối xứng. Như một dấu hiệu cho thấy dịch đang lấp đầy các khoang phế nang, hình ảnh phế quản chứa khí (air bronchograms) thường xuất hiện trong các vùng thâm nhiễm lan tỏa. Trừ khi bệnh nhân có bệnh tim từ trước và tim to không liên quan đến vấn đề hiện tại, kích thước tim vẫn bình thường. Một ví dụ đặc trưng của X-quang lồng ngực ở một bệnh nhân ARDS nặng được hiển thị trong Hình 3.7.
Các giá trị khí máu động mạch trong giai đoạn đầu của ARDS cho thấy giảm oxy máu và giảm CO2 máu (nhiễm kiềm hô hấp). Việc tính toán cho thấy trao đổi khí thực sự tồi tệ hơn so với vẻ ngoài ban đầu, với phế nang tăng do tăng thông khí. Khi lượng phù kẽ và phù phế nang tăng lên, quá trình oxy hóa trở nên bất thường hơn, và dẫn đến giảm oxy máu nghiêm trọng.
Hầu hết bệnh nhân sẽ được đặt một catheter tĩnh mạch trung tâm (một catheter được đưa vào một tĩnh mạch hệ thống và sau đó tiến đến tĩnh mạch chủ trên), cho phép cung cấp thuốc và đo áp lực tĩnh mạch trung tâm (như một thước đo tình trạng thể tích tổng thể). Nếu có lo ngại về sự hiện diện của một thành phần phù phổi do thủy tĩnh từ rối loạn chức năng tim trái, việc đo áp lực bằng một catheter động mạch phổi (thường được gọi là catheter Swan-Ganz), được đưa sâu hơn và đi qua nhĩ phải và thất phải vào động mạch phổi, có thể được sử dụng (xem Chương 12). Áp lực được đo bằng catheter động mạch phổi khi bóng được bơm căng (và dòng chảy về phía trước bị chặn) phản ánh áp lực từ nhĩ trái và thường được gọi là áp lực bít động mạch phổi (PAOP) hoặc áp lực mao mạch phổi bít.
| Các phép đo từ một catheter tĩnh mạch trung tâm đánh giá tình trạng thể tích, và một catheter động mạch phổi (Swan-Ganz) có thể ước tính tiền tải của thất trái. |
Việc đo áp lực bít động mạch phổi, ước tính tiền tải của thất trái, có thể giúp phân biệt liệu phù phổi quan sát được là do tim hay không do tim. Trong phù phổi do tim, áp lực thủy tĩnh trong các mao mạch phổi cao do áp lực tăng trong các tĩnh mạch phổi và nhĩ trái. Trong phù phổi không do tim thuần túy hoặc ARDS, áp lực trong nhĩ trái (được đo bằng PAOP) là bình thường, cho thấy rằng dịch kẽ và dịch phế nang là kết quả của việc tăng tính thấm của các mao mạch phổi chứ không phải do áp lực nội mạch cao.
Mặc dù việc sử dụng catheter động mạch phổi để đo áp lực nội mạch không phải là thiết yếu để chẩn đoán ARDS, thông tin thu được có thể hữu ích để xác định liệu áp lực thủy tĩnh tăng cao trong giường mao mạch phổi có góp phần vào phù phổi quan sát được hay không. Tuy nhiên, mặc dù có tiềm năng cung cấp thông tin hữu ích cho việc quản lý những ca bệnh phức tạp này, việc sử dụng catheter động mạch phổi chưa được chứng minh một cách rõ ràng là cải thiện tỷ lệ tử vong. Do thiếu tác động đến kết quả của bệnh nhân, việc đặt catheter động mạch phổi để đánh giá và quản lý bệnh nhân được cho là mắc ARDS đã giảm đáng kể trong những năm gần đây.
ĐIỀU TRỊ
Việc quản lý ARDS tập trung vào ba vấn đề chính: (1) điều trị rối loạn khởi phát, (2) làm gián đoạn hoặc can thiệp vào chuỗi các sự kiện bệnh sinh liên quan đến sự phát triển của rò rỉ mao mạch, và (3) hỗ trợ trao đổi khí bằng các chiến lược thở máy nhằm giảm thiểu tổn thương phổi thêm cho đến khi quá trình bệnh lý ở phổi cải thiện.
Mặc dù việc điều trị rối loạn khởi phát không phải lúc nào cũng có thể hoặc thành công, nguyên tắc tương đối đơn giản: miễn là vấn đề cơ bản còn tồn tại, sự rò rỉ mao mạch phổi có thể vẫn còn. Trong trường hợp một rối loạn như nhiễm khuẩn huyết, việc quản lý nhiễm trùng bằng kháng sinh thích hợp (và dẫn lưu các ổ nhiễm trùng kín nếu cần) là rất quan trọng để cho phép mạch máu phổi tái thiết lập hàng rào tính thấm bình thường cho protein và dịch.
Quản lý hỗ trợ tỉ mỉ, đặc biệt là hỗ trợ trao đổi khí, là rất quan trọng để bệnh nhân ARDS sống sót qua cơn bệnh cấp tính. Do tính chất đe dọa tính mạng của ARDS, bệnh nhân thường được đặt nội khí quản, thông khí cơ học và quản lý tại một đơn vị chăm sóc tích cực. Suy các hệ cơ quan khác ngoài hệ hô hấp là phổ biến, và bệnh nhân thường là một trong những vấn đề quản lý phức tạp và thách thức nhất được xử lý trong các đơn vị chăm sóc tích cực. Do tầm quan trọng của thông khí cơ học và hỗ trợ thở máy trong việc quản lý suy hô hấp liên quan đến ARDS và các rối loạn khác, Chương 30 được dành để xem xét chi tiết hơn về thông khí cơ học trong quản lý suy hô hấp.
Ở những bệnh nhân được thông khí cơ học (như hầu hết các bệnh nhân ARDS), chiến lược hiệu quả nhất bao gồm việc áp dụng thể tích khí lưu thông thấp hơn so với thực hành truyền thống trước đầu thiên niên kỷ. Cái gọi là thông khí bảo vệ phổi này có lợi ích đáng kể về tỷ lệ tử vong đã được ghi nhận trong một thử nghiệm ngẫu nhiên quy mô lớn, được thiết kế tốt. Tuy nhiên, lý do chính xác tại sao phương pháp này có lợi vẫn còn mang tính suy đoán. Giả thuyết cho rằng việc thông khí phổi ở các thể tích phổi thấp hơn sẽ tránh được sự căng phồng quá mức của các phế nang và hậu quả là giải phóng các chất trung gian gây viêm có hại. Đối với những bệnh nhân ARDS nặng không có trao đổi khí đầy đủ mặc dù đã sớm áp dụng các chiến lược thông khí bảo vệ phổi, việc xoay người bệnh và thông khí ở tư thế nằm sấp có thể cải thiện quá trình oxy hóa và dường như làm giảm tỷ lệ tử vong. Các cơ chế mà trao đổi khí cải thiện với thông khí nằm sấp rất phức tạp, nhưng bao gồm sự phân bố thông khí và tưới máu đều hơn.
Các phương pháp nhằm thay đổi chuỗi các sự kiện bệnh sinh trong ARDS đã tập trung vào việc phát triển các tác nhân ngăn chặn tác dụng của các cytokine khác nhau hoặc các kích thích khởi phát khác, chẳng hạn như nội độc tố, ở những bệnh nhân bị sốc nhiễm khuẩn. Tuy nhiên, cho đến nay phương pháp này đã không thành công, và không có tác nhân nào ngăn chặn tác dụng của một chất trung gian cụ thể nào tỏ ra hữu ích. Một phương pháp không đặc hiệu hơn là sử dụng corticosteroid trong nỗ lực ngăn chặn một loạt các chất trung gian và kiểm soát hoặc đảo ngược khiếm khuyết về tính thấm của mao mạch cho phép dịch và protein rò rỉ vào khoảng kẽ và khoang phế nang. Phương pháp này một phần dựa trên bằng chứng thực nghiệm cho thấy rằng corticosteroid ức chế sự kết tập của bạch cầu trung tính do bổ thể hoạt hóa gây ra. Nhiều nghiên cứu đã được tiến hành về việc sử dụng corticosteroid trong ARDS với kết quả trái ngược nhau. Quan điểm hiện tại là corticosteroid chỉ nên được dùng cho những bệnh nhân có ARDS do viêm phổi COVID-19 hoặc một bệnh đã biết đáp ứng với steroid; chúng không được khuyến nghị trong các trường hợp khác.
Nitric oxide hít và epoprostenol hít là các thuốc giãn mạch phổi chọn lọc và đã được sử dụng trong điều trị ARDS. Bằng cách tạo ra sự giãn mạch ưu tiên ở các vùng phổi được thông khí tốt (vì đây là những vùng mà các loại thuốc hít có thể xâm nhập đến phế nang), nitric oxide hít hoặc epoprostenol có thể tạo điều kiện cho việc tưới máu tốt hơn ở các vùng được thông khí tốt, dẫn đến sự phù hợp thông khí-tưới máu tốt hơn và cải thiện quá trình oxy hóa. Tuy nhiên, không may là những tác động sinh lý có lợi này đối với trao đổi khí không đi kèm với bằng chứng cải thiện tỷ lệ sống sót trong các thử nghiệm lâm sàng được tiến hành cho đến nay.
Trong một số trường hợp ARDS nặng mà các bất thường trao đổi khí đe dọa tính mạng không thể được giải quyết bằng các phương tiện khác, kỹ thuật oxy hóa qua màng ngoài cơ thể (ECMO) được sử dụng. Với kỹ thuật này, máu tĩnh mạch được lấy ra thông qua một cannula, được bơm qua một mạch ngoài cơ thể để thêm oxy và loại bỏ carbon dioxide thông qua một màng thấm khí, và sau đó được trả lại vào tuần hoàn của bệnh nhân. ECMO không được liên kết một cách rõ ràng với việc cải thiện tỷ lệ sống sót, và do chuyên môn và nguồn lực cần thiết cho kỹ thuật này, nó chỉ có sẵn tại các trung tâm chuyên biệt.
TÀI LIỆU THAM KHẢO ĐỀ XUẤT
Tổng quan chung
- ARDS Definition Task Force. (2012). Acute respiratory distress syndrome: The Berlin Definition. JAMA, 307, 2526-2533.
- Bellani, G., Laffey, J. G., Pham, T., Fan, E., Brochard, L., Esteban, A., et al. (2016). Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA, 315, 788-800.
- Butt, Y., Kurdowska, A., & Allen, T. C. (2016). Acute lung injury: A clinical and molecular review. Archives of Pathology and Laboratory Medicine, 140, 345-350.
- Fan, E., Brodie, D., & Slutsky, A. S. (2018). Acute respiratory distress syndrome: Advances in diagnosis and treatment. JAMA, 319, 698-710.
- Seymour, C. W., & Rosengart, M. R. (2015). Septic shock: Advances in diagnosis and treatment. JAMA, 314, 708-717.
- Sweeney, R. M., & McAuley, D. F. (2016). Acute respiratory distress syndrome. Lancet, 388, 2416-2430.
- Thompson, B. T., Chambers, R. C., & Liu, K. D. (2017). Acute respiratory distress syndrome. New England Journal of Medicine, 377, 562-572.
Cơ chế bệnh sinh
- Beitler, J. R., Malhotra, A., & Thompson, B. T. (2016). Ventilator-induced lung injury. Clinics in Chest Medicine, 37, 633-646.
- Berlin, D. A., Gulick, R. M., & Martinez, F. J. (2020). Severe Covid-19. New England Journal of Medicine, 383, 2451-2460.
- Blondonnet, R., Constantin, J. M., Sapin, V., & Jabaudon, M. (2016). A pathophysiologic approach to biomarkers in acute respiratory distress syndrome. Disease Markers, 2016, 3501373.
- Blount, B. C., Karwowski, M. P., Shields, P. G., Morel-Espinosa, M., Valentin-Blasini, L., Gardner, M., et al. (2020). Vitamin E acetate in bronchoalveolar-lavage fluid associated with EVALI. New England Journal of Medicine, 382, 697-705.
- Burnham, E. L., Janssen, W. J., Riches, D. W., Moss, M., & Downey, G. P. (2014). The fibroproliferative response in acute respiratory distress syndrome: Mechanisms and clinical significance. European Respiratory Journal, 43, 276-285.
- Cardinal-Fernández, P., Lorente, J. A., Ballén-Barragán, A., & Matute-Bello, G. (2017). Acute respiratory distress syndrome and diffuse alveolar damage. New insights on a complex relationship. Annals of the American Thoracic Society, 14, 844-850.
- Han, S., & Mallampalli, R. K. (2015). The acute respiratory distress syndrome: From mechanism to translation. Journal of Immunology, 194, 855-860.
- Henderson, W. R., Chen, L., Amato, M. B. P., & Brochard, L. J. (2017). Fifty years of research in ARDS. Respiratory mechanics in acute respiratory distress syndrome. American Journal of Respiratory and Critical Care Medicine, 196, 822-833.
- Hotchkiss, R. S., Moldawer, L. L., Opal, S. M., Reinhart, K., Turnbull, I. R., & Vincent, J. L. (2016). Sepsis and septic shock. Nature Reviews Disease Primers, 2, 16045.
- Hu, X., Lee, J. S., Pianosi, P. T., & Ryu, J. H. (2015). Aspiration-related pulmonary syndromes. Chest, 147, 815-823.
- Laffey, J. G., Bellani, G., Pham, T., Fan, E., Madotto, F., Bajwa, E. K., et al. (2016). Potentially modifiable factors contributing to outcome from acute respiratory distress syndrome: The LUNG SAFE study. Intensive Care Medicine, 42, 1865-1876.
- Layden, J. E., Ghinai, I., Pray, I., Kimball, A., Layer, M., Tenforde, M. W., et al. (2020). Pulmonary illness related to e-cigarette use in Illinois and Wisconsin – final report. New England Journal of Medicine, 382, 903-916.
- Millar, F. R., Summers, C., Griffiths, M. J., Toshner, M. R., & Proudfoot, A. G. (2016). The pulmonary endothelium in acute respiratory distress syndrome: Insights and therapeutic opportunities. Thorax, 71, 462-473.
- Radermacher, P., Maggiore, S. M., & Mercat, A. (2017). Fifty years of research in ARDS. Gas exchange in acute respiratory distress syndrome. American Journal of Respiratory and Critical Care Medicine, 196, 964-984.
- Schwingshackl, A. (2016). The role of stretch-activated ion channels in acute respiratory distress syndrome: Finally a new target? American Journal of Physiology Lung Cellular and Molecular Physiology, 311, L639-L652.
- Shah, R. D., & Wunderink, R. G. (2017). Viral pneumonia and acute respiratory distress syndrome. Clinics in Chest Medicine, 38, 113-125.
- Toy, P., Looney, M. R., Popovsky, M., Palfi, M., Berlin, G., Chapman, C. E., et al. (2022). Transfusion-related acute lung injury: 36 years of progress (1985-2021). Annals of the American Thoracic Society, 19, 705-712.
Điều trị
- Barrot, L., Asfar, P., Mauny, F., Winiszewski, H., Montini, F., Badie, J., et al. (2020). Liberal or conservative oxygen therapy for acute respiratory distress syndrome. New England Journal of Medicine, 382, 999-1008.
- Beitler, J. R., Thompson, B. T., Baron, R. M., Bastarache, J. A., Denlinger, L. C., Esserman, L., et al. (2022). Advancing precision medicine for acute respiratory distress syndrome. Lancet Respiratory Medicine, 10, 107-120.
- Bhatt, N., & Osborn, E. (2016). Extracorporeal gas exchange: The expanding role of extracorporeal support in respiratory failure. Clinics in Chest Medicine, 37, 765-780.
- Combes, A., Hajage, D., Capellier, G., Demoule, A., Lavoué, S., Guervilly, C., et al. (2018). Extracorporeal membrane oxygenation for severe acute respiratory distress syndrome. New England Journal of Medicine, 378, 1965-1975.
- Esan, A., Hess, D. R., Raoof, S., George, L., & Sessler, C. N. (2010). Severe hypoxemic respiratory failure: Part 1- ventilatory strategies. Chest, 137, 1203-1216.
- Hochberg, C. H., Semler, M. W., & Brower, R. G. (2021). Oxygen toxicity in critically ill adults. American Journal of Respiratory and Critical Care Medicine, 204, 632-641.
- Howell, M. D., & Davis, A. M. (2018). Management of ARDS in adults. JAMA, 319, 711-712.
- Karam, O., Gebistorf, F., Wetterslev, J., & Afshari, A. (2017). The effect of inhaled nitric oxide in acute respiratory distress syndrome in children and adults: A Cochrane systematic review with trial sequential analysis. Anaesthesia, 72, 106-117.
- Malhotra, A. (2007). Low-tidal-volume ventilation in the acute respiratory distress syndrome. New England Journal of Medicine, 357, 1113-1120.
- Nieman, G. F., Satalin, J., Kollisch-Singule, M., Andrews, P., Aiash, H., Habashi, N. M., et al. (2017). Physiology in medicine: Understanding dynamic alveolar physiology to minimize ventilator-induced lung injury. Journal of Applied Physiology, 122, 1516-1522.
- Patel, B. K., Wolfe, K. S., Pohlman, A. S., Hall, J. B., & Kress, J. P. (2016). Effect of noninvasive ventilation delivered by helmet vs face mask on the rate of endotracheal intubation in patients with acute respiratory distress syndrome: A randomized clinical trial. JAMA, 315, 2435-2441.
- Raoof, S., Goulet, K., Esan, A., Hess, D. R., & Sessler, C. N. (2010). Severe hypoxemic respiratory failure: Part 2- nonventilatory strategies. Chest, 137, 1437-1448.
- Scholten, E. L., Beitler, J. R., Prisk, G. K., & Malhotra, A. (2017). Treatment of ARDS with prone positioning. Chest, 151, 215-224.
- Vieillard-Baron, A., Matthay, M., Teboul, J. L., Bein, T., Schultz, M., Magder, S., et al. (2016). Experts’ opinion on management of hemodynamics in ARDS patients: Focus on the effects of mechanical ventilation. Intensive Care Medicine, 42, 739-749.
- Wang, T., Gross, C., Desai, A. A., Zemskov, E., Wu, X., Garcia, A. N., et al. (2017). Endothelial cell signaling and ventilator-induced lung injury: Molecular mechanisms, genomic analyses, and therapeutic targets. American Journal of Physiology Lung Cellular and Molecular Physiology, 312, L452-L476.
Bảng chú giải thuật ngữ Y học Anh-Việt
Chương 29. Hội chứng suy hô hấp cấp tính tiến triển
