Sperling Nội tiết học Nhi khoa, Ấn bản thứ 5 – Biên dịch: Ths.Bs. Lê Đình Sáng
Sperling Pediatric Endocrinology, Fifth Edition
Tác giả: Sperling, Mark A., MD – Nhà xuất bản: Elsevier Inc.
PHẦN II: CÁC RỐI LOẠN NỘI TIẾT Ở TRẺ SƠ SINH
CHƯƠNG 5: NỘI TIẾT HỌC THAI NHI-MẸ VÀ CHUYỂN DẠ
Sam Mesiano; Helen N. Jones; Heide Aungst; Tani Malhotra; Louis J. Muglia
Fetal-Maternal Endocrinology and Parturition
Sperling Pediatric Endocrinology, 5, 106-122
TỔNG QUAN
Mang thai là một trạng thái sinh lý phức tạp bao gồm mối quan hệ cộng sinh giữa hai cá thể khác biệt về mặt di truyền nhưng có liên quan: người mẹ và thai nhi. Sự thành công của thai kỳ đòi hỏi những thay đổi đáng kể trong sinh lý của người mẹ để chấp nhận, bảo vệ, chứa đựng và nuôi dưỡng mảnh ghép thai nhi. Một thai kỳ thành công bao gồm việc phôi đang phát triển làm tổ trong nội mạc tử cung; tránh bị hệ miễn dịch của mẹ đào thải; sự thích nghi của tử cung mẹ để duy trì thai kỳ; và những thay đổi cụ thể trong sinh lý của mẹ để đáp ứng nhu cầu dinh dưỡng, trao đổi chất và thể chất của thai nhi đang phát triển—cùng với thời điểm chuyển dạ phù hợp, để việc sinh nở xảy ra khi thai nhi đủ trưởng thành để sống sót bên ngoài tử cung và người mẹ có thể nuôi dưỡng đứa con mới sinh của mình. Các tương tác hormone giữa khoang thai nhi và mẹ kiểm soát các quá trình này. Một cơ quan nội tiết độc đáo và cực kỳ quan trọng của thai kỳ là nhau thai (placenta). Cấu trúc giải phẫu hemochorial (máu mẹ tiếp xúc trực tiếp với màng đệm) của nhau thai người cho phép hợp bào nuôi (syncytiotrophoblast) của thai nhi tiếp cận trực tiếp với tuần hoàn của mẹ để tiết hormone. Các hormone của nhau thai tràn ngập các hệ thống của mẹ và tác động lên các tế bào đích của mẹ để điều chỉnh sinh lý của mẹ theo hướng duy trì thai kỳ và đáp ứng nhu cầu trao đổi chất của thai nhi. Thông qua mối quan hệ nội tiết này, thai nhi và người mẹ duy trì trạng thái cân bằng nội môi và cho phép thai nhi có thời gian cần thiết để tăng trưởng và phát triển chức năng. Các khiếm khuyết trong quá trình hình thành nhau thai, chức năng nhau thai, và những bất thường trong sản xuất hormone của nhau thai gây ra bệnh lý ở mẹ và trẻ sơ sinh, chẳng hạn như tiền sản giật đe dọa tính mạng và thai nhi chậm phát triển. Giai đoạn cuối của thai kỳ thường xảy ra thông qua quá trình chuyển dạ (parturition) và, trong hầu hết các trường hợp, tại một thời điểm, được gọi là đủ tháng (term), khi thai nhi đủ trưởng thành để sống sót như một trẻ sơ sinh. Thai kỳ đủ tháng ở người là từ tuần thứ 37 đến tuần thứ 42 hoàn thành của thai kỳ (tính từ ngày kinh cuối cùng). Sinh non (Preterm birth), được định nghĩa là dưới 37 tuần tuổi thai hoàn thành, là một vấn đề kinh tế xã hội lớn trên toàn thế giới, chiếm phần lớn tỷ lệ mắc bệnh và tử vong ở trẻ sơ sinh. Do đó, sự kiểm soát hormone của quá trình chuyển dạ—sao cho nó xảy ra đủ tháng—là một yếu tố quyết định chính đến sức khỏe của trẻ sơ sinh và sự thành công của thai kỳ. Chương này đề cập đến sự hiểu biết hiện tại về nội tiết học của thai kỳ và chuyển dạ từ quan điểm sức khỏe của thai nhi/nhau thai và quá trình cũng như thời điểm chuyển dạ, bao gồm cả những tiến bộ gần đây trong việc làm sáng tỏ di truyền học về độ dài thai kỳ và thời điểm sinh ở người. Cuộc thảo luận sẽ được mở đầu bằng một cái nhìn tổng quan theo bối cảnh về sinh học tiến hóa của thai kỳ và thời điểm sinh ở người.
SỰ TIẾN HÓA CỦA THAI KỲ VÀ SINH NỞ Ở NGƯỜI
Mang thai vừa là một sự kiện cá nhân giữa mẹ và bé, vừa là một mối quan tâm xã hội và sức khỏe cộng đồng, như được chứng minh bằng tỷ lệ tử vong ở trẻ sơ sinh và bà mẹ cao, ngay cả ở các nước phát triển như Hoa Kỳ. Mặc dù những tiến bộ khoa học đã cho phép chúng ta tìm hiểu về các nguyên nhân tiềm ẩn của sinh non và các biến chứng thai kỳ, điều quan trọng là phải nhìn lại, qua lăng kính tiến hóa, để hiểu đầy đủ hơn về quá trình mang thai và sinh nở.
Tiến hóa tối ưu hóa sự thích nghi sinh sản qua các thế hệ—tối đa hóa việc truyền gen cho thế hệ tiếp theo. Mang thai và chuyển dạ là những sự kiện quan trọng trong quá trình sinh sản của các loài đẻ con, và do đó, chúng đã phải chịu áp lực chọn lọc mạnh mẽ trong quá trình tiến hóa. Những tiến bộ trong công nghệ di truyền cho phép kiểm tra sâu hơn về ảnh hưởng của động lực tiến hóa đối với thai kỳ—bao gồm tác động của di truyền và hormone đối với thụ thai, duy trì thai kỳ, và các yếu tố kích hoạt chuyển dạ. Cuối cùng, cấu trúc di truyền phản ánh sự chọn lọc tự nhiên và, do đó, các sự thích nghi tiến hóa có thể góp phần vào các biến chứng thai kỳ hiện tại, bởi vì cấu trúc di truyền hiện tại của người mẹ, hoặc thậm chí của em bé, có thể không lý tưởng cho các điều kiện môi trường hiện tại. Sự không phù hợp này có thể là lý do cho các bệnh của thai kỳ, chẳng hạn như tiền sản giật (preeclampsia) và đái tháo đường thai kỳ (gestational diabetes)—và, trên thực tế, có khả năng ảnh hưởng đến sức khỏe trong suốt cuộc đời.
“Không có gì trong sinh học có ý nghĩa ngoại trừ dưới ánh sáng của sự tiến hóa,” nhà di truyền học và sinh học tiến hóa Theodosius Dobzhansky đã nói. Khái niệm này chắc chắn được phản ánh trong sinh học so sánh về thai kỳ và chuyển dạ giữa các loài đẻ con. Điểm chung giữa các loài đẻ con là sự phát triển của thai nhi đòi hỏi một thời gian mang thai tối thiểu và một nguồn cung cấp chất dinh dưỡng để thai nhi đạt được sự trưởng thành chức năng cần thiết để sống sót như một trẻ sơ sinh. Các hệ cơ quan của thai nhi (đặc biệt là hệ hô hấp, thận và tiêu hóa) và các trục thần kinh-nội tiết (đặc biệt là hệ thống trục dưới đồi-tuyến yên-thượng thận (hypothalamic-pituitary-adrenal, và tuyến giáp phải đủ phát triển khi sinh để trẻ sơ sinh có thể đạt được và duy trì cân bằng nội môi. Tương tự, sinh lý của người mẹ, đã được điều chỉnh để cung cấp cho thai kỳ, phải được chuẩn bị để nuôi dưỡng và bảo vệ trẻ sơ sinh. Một số quá trình là phổ biến (ví dụ, yêu cầu progesterone để thiết lập và duy trì thai kỳ; sự thúc đẩy trưởng thành cơ quan của thai nhi bởi glucocorticoid) đối với tất cả các loài, nhưng tồn tại những khác biệt tinh vi liên quan đến các áp lực chọn lọc cụ thể đối với các đặc điểm liên quan đến thai kỳ đã cải thiện hiệu quả sinh sản trong bối cảnh thói quen chung, môi trường sống và chiến lược sinh sản tổng thể.
Nhìn nhận việc thụ thai qua lăng kính tiến hóa đặt ra câu hỏi: Tại sao hệ miễn dịch của người mẹ không tấn công thai nhi? Giả thuyết “nghịch lý viêm” cho rằng viêm có thể là một quá trình cần thiết đã tiến hóa để hỗ trợ việc làm tổ, thay vì tấn công thai nhi. Đây chỉ là một phần của trạng thái cân bằng phải được thiết lập trong một thai kỳ khỏe mạnh giữa nhu cầu của người mẹ và nhu cầu của thai nhi. Khái niệm này đã được mô tả là “đối thoại chéo”, “cuộc chiến giằng co”, hoặc “sự điều biến” quy định gen hoặc mạng lưới tế bào giữa mẹ và thai nhi. Nhịp điệu thường mâu thuẫn này giữa mẹ và thai nhi tiếp tục trong suốt thai kỳ, làm nổi bật nhu cầu dinh dưỡng và những biến động hormone phải được giữ cân bằng để một thai kỳ thành công có thể kéo dài đến đủ tháng. Các nghiên cứu gần đây về các tế bào riêng lẻ tại giao diện mẹ-thai đã xác định các tương tác điều hòa ở cấp độ tế bào giữa mẹ và thai nhi ngăn chặn các tế bào miễn dịch tấn công thai nhi. Qua lăng kính tiến hóa, tiền sản giật, ví dụ, có thể là kết quả của sự xâm lấn nông của nguyên bào nuôi và sự tái cấu trúc không đủ của động mạch xoắn—buộc thai nhi phải tăng lưu lượng máu của mẹ đến nhau thai bằng cách tăng sức cản mạch máu ngoại biên của mẹ và cung cấp lưu lượng máu lớn hơn đến giao diện thai nhi.
Một “thế lưỡng nan sản khoa” khác được tạo ra bởi sự kết hợp của các đặc điểm encephalization: sự gia tăng khối lượng não so với khối lượng cơ thể là duy nhất ở các dòng họ hominid, và di chuyển bằng hai chân bắt buộc (obligate bipedalism). Di chuyển bằng hai chân đã tiến hóa từ 3 đến 5 triệu năm trước, dẫn đến sự gia tăng kích thước não của hominid, ước tính vào khoảng 1 triệu năm trước. Kích thước não người đã duy trì tương đối ổn định trong ít nhất 100.000 năm qua. Di chuyển bằng hai chân bắt buộc đòi hỏi những thay đổi trong giải phẫu xương chậu làm giảm kích thước của eo chậu. Điều này sẽ hạn chế mức độ encephalization trong tử cung và đòi hỏi quá trình chuyển dạ phải xảy ra trước khi đầu thai nhi trở nên lớn hơn eo chậu. Đặc điểm này dường như là duy nhất trong các dòng họ người. Không có loài linh trưởng nào khác phải đối mặt với mức độ bất tương xứng đầu-chậu (cephalopelvic disproportion) này, vì chúng có cácช่อง chậu lớn hơn đường kính đầu của thai nhi. Tuy nhiên, phụ nữ phải sinh ra một thai nhi có đầu to qua mộtช่อง chậu tương đối nhỏ. Điều này có nghĩa là thai nhi không thể phát triển quá lớn, nếu không sẽ có nguy cơ tử vong cho cả em bé và người mẹ. Chọn lọc tiến hóa của các dòng họ tổ tiên phải đã hoạt động để phát triển một độ dài thai kỳ tối ưu cho sự phát triển của thai nhi, đặc biệt là sự trưởng thành của phổi, trước khi chuyển dạ. Ngoài ra, nghiên cứu gần đây đã phát hiện ra sự thay đổi về hình dạng của ống sinh theo vùng và tổ tiên. Lý thuyết tiến hóa nghiêm ngặt có thể suy đoán rằng ống sinh nên có hình dạng tương tự. Thay vào đó, công trình mới này cho thấy các lực lượng tiến hóa khác, chẳng hạn như sự trôi dạt di truyền, các mô hình di cư, hoặc thậm chí là sự thích nghi với khí hậu cũng có thể đã hoạt động. Các tác giả nghiên cứu Lia Betti và Andrea Manica cho rằng việc hiểu thấu đáo điều này có ý nghĩa đối với thực hành sản khoa trong các xã hội đa sắc tộc.
Sự phát triển nhanh chóng của não thai nhi đòi hỏi năng lượng đáng kể, và do đó các đặc điểm làm tăng sự chuyển giao năng lượng từ mẹ sang thai nhi sẽ được ưa chuộng. Điều này có thể giải thích việc sản xuất placental lactogen và hormone tăng trưởng (GH) của nhau thai (placenta growth hormone) thúc đẩy sự đề kháng insulin của mẹ, cung cấp nhiều glucose hơn cho thai nhi tiêu thụ. Tuy nhiên, các đặc điểm có lợi cho sự phát triển não của thai nhi sẽ mâu thuẫn với vấn đề sinh ra một thai nhi có đầu to qua mộtช่อง chậu tương đối nhỏ. Vấn đề này có thể đã được giải quyết bằng cách thay đổi cơ chế định thời điểm chuyển dạ để rút ngắn thai kỳ, do đó tránh được “thế lưỡng nan sản khoa”. Các phân tích allometric (phân tích sự thay đổi tương đối của các bộ phận cơ thể) về tỷ lệ kích thước não sơ sinh so với cơ thể trên các loài linh trưởng, và thực tế là trẻ sơ sinh của người là altricial (non nớt, cần chăm sóc) (được gọi là “secondary altriciality”), trong khi các loài linh trưởng hiện hữu khác là precocial (phát triển sớm), hỗ trợ giả thuyết rằng thai kỳ đã được rút ngắn ở các hominid hiện đại. Đây là một giả thuyết hợp lý giải thích phần lớn các đặc điểm độc đáo của thai kỳ và chuyển dạ ở người. Vì chọn lọc tự nhiên thường hoạt động ở cấp độ quần thể và qua nhiều thế hệ, các đặc điểm làm tăng hiệu quả sinh sản của quần thể (chẳng hạn như encephalization; sự linh hoạt của hệ thần kinh-nội tiết của thai nhi) và có lợi về lâu dài, có thể gây ra những tổn thất cho một cá nhân, chẳng hạn như tăng nguy cơ sinh non hoặc bệnh tim mạch trong ngắn hạn.
Việc xem xét các đặc điểm này qua lăng kính tiến hóa mở rộng quan điểm của chúng ta về các biến chứng thai kỳ, chẳng hạn như tiền sản giật, thai chậm phát triển, đái tháo đường thai kỳ, và sinh non, cũng như các quá trình bình thường, chẳng hạn như sự linh hoạt của sự phát triển thần kinh-nội tiết của thai nhi để đáp ứng với các tín hiệu môi trường.
THIẾT LẬP THAI KỲ
Trong điều kiện bình thường, việc một phôi có khả năng sống làm tổ trong một nội mạc tử cung có khả năng tiếp nhận sẽ thiết lập thai kỳ. Trong chu kỳ kinh nguyệt, các hormone steroid buồng trứng, estradiol và progesterone, gây ra những thay đổi cấu trúc và chức năng trong nội mạc tử cung cần thiết cho việc thiết lập thai kỳ. Trong giai đoạn hoàng thể (luteal phase), nội mạc tử cung chuyển sang kiểu hình chế tiết để đáp ứng chủ yếu với progesterone do thể vàng (CL) (corpus luteum) sản xuất. Nội mạc tử cung chế tiết có cấu trúc xốp và có nhiều mạch máu, và có một biểu mô tuyến tiết ra các yếu tố vào tử cung có lợi cho sự sống sót của phôi. Đồng thời, các tế bào biểu mô trong nội mạc tử cung sản xuất các chemokine, các yếu tố tăng trưởng, và các phân tử kết dính tế bào thu hút phôi đến các vị trí gắn kết cụ thể để làm tổ và, ngoài ra, sự gia tăng mạch máu của mô đệm nội mạc tử cung cung cấp một chất nền tối ưu cho sự hình thành nhau thai.
Sau khi thụ tinh, hợp tử (zygote) trải qua một chương trình phân chia và biệt hóa tế bào nội tại không phụ thuộc vào môi trường hormone của vòi trứng hoặc tử cung. Khoảng ngày thứ tư sau khi thụ tinh, phôi là một cụm tế bào rắn được bao bọc bởi phần còn lại của màng trong suốt (zona pellucida) của noãn. Trong 24 đến 48 giờ tiếp theo, khi phôi di chuyển qua vòi trứng về phía tử cung, nó phát triển một khoang chứa đầy dịch, khoang phôi nang (blastocele), và được gọi là một phôi nang (blastocyst). Lớp tế bào ngoài của phôi nang, được gọi là lá nuôi (trophectoderm), sẽ hình thành nhau thai và màng đệm. Một khối tế bào bên trong của phôi nang sẽ tạo ra thai nhi, màng ối, và các thành phần trung mô và mạch máu của nhau thai. Phôi nang người đi vào tử cung vào khoảng ngày thứ năm sau khi thụ tinh và trôi nổi tự do trong khoang tử cung trong 2 đến 3 ngày. Đến giai đoạn này, màng trong suốt thoái hóa, để lại phôi nang mới hình thành trong điều kiện tối ưu để làm tổ trong nội mạc tử cung.
Việc phôi làm tổ trong nội mạc tử cung có giới hạn về thời gian và không gian trong tử cung có khả năng tiếp nhận. Tương tác vật lý của phôi nang với biểu mô nội mạc tử cung xảy ra tại các cấu trúc hình vòm được gọi là pinopodes biểu hiện các chemokine và các phân tử kết dính tế bào thu hút phôi và dường như là vị trí ưa thích để phôi bám vào và làm tổ sau đó. Việc phôi bám và làm tổ thành công nhất trong khoảng từ ngày 21 đến ngày 24 của chu kỳ kinh nguyệt (~ 85% tỷ lệ thành công), trong khi việc làm tổ trước hoặc sau cửa sổ tối ưu này có tỷ lệ thành công thấp (~ 11%). Sau ngày 24 đến 25, mô đệm nội mạc tử cung trải qua những thay đổi về hình thái và chức năng được gọi chung là phản ứng màng rụng (decidualization), phụ thuộc vào progesterone và xảy ra độc lập với việc thụ thai và làm tổ. Nội mạc tử cung đã rụng hóa, bao gồm các tế bào đa diện lớn, chứa hàm lượng glycogen và lipid cao, tiết ra một lớp vỏ bao quanh tế bào cứng rắn, không thuận lợi cho việc làm tổ. Do đó, việc làm tổ thành công phải xảy ra trước khi thiết lập hàng rào màng rụng. Trong một chu kỳ không thụ thai, kinh nguyệt xảy ra để loại bỏ nội mạc tử cung đã rụng hóa không có khả năng tiếp nhận. Trong chu kỳ tiếp theo, nội mạc tử cung sau đó tự làm mới để trở lại trạng thái có khả năng tiếp nhận.
Để làm tổ, các tế bào nguyên bào nuôi tăng sinh và tiết ra các protease phân hủy chất nền ngoại bào giữa các tế bào nội mạc tử cung, tạo thành một con đường để phôi nang đi vào mô đệm tử cung. Các tế bào nguyên bào nuôi xâm lấn được gọi là tế bào nuôi (cytotrophoblasts – CTBs) và tạo thành các cột thâm nhập vào màng đáy bên dưới các tế bào màng rụng và vào cơ tử cung. Cuối cùng, toàn bộ phôi được nhúng vào mô đệm tử cung, được neo bởi các cột CTB. Một số CTB ngoài nhung mao xâm lấn vào các tiểu động mạch xoắn của mẹ, thay thế các tế bào nội mô và mô cơ trơn, và làm giãn các mạch máu để tạo ra một hệ thống tiểu động mạch có sức cản thấp. Hệ thống này hướng máu của mẹ vào các không gian, được gọi là hồ máu (lacunae), giữa các cột xâm lấn của các tế bào CTB. Trong thời gian này, một số CTB hợp nhất màng sinh chất của chúng để trở thành một hợp bào nuôi. Đây trở thành lớp ngoài của nhau thai chức năng. Cuối cùng, hợp bào nuôi tạo thành các nhung mao màng đệm (chorionic villi) được tắm trong máu của mẹ trong các hồ máu.
Phôi là bán dị ghép (semiallogeneic) đối với mẹ, và do đó sự xâm lấn của nó vào nội mạc tử cung đại diện cho một sự vi phạm lớn đối với hệ thống miễn dịch của mẹ. Để thai kỳ thành công, hợp bào nuôi của nhau thai và các CTB tại giao diện mẹ-thai phải tránh bị tấn công và phá hủy bởi các tế bào miễn dịch của mẹ đã được hoạt hóa. Để làm được điều này, các tế bào nguyên bào nuôi tạo ra một lớp ngụy trang miễn dịch dưới dạng kháng nguyên bạch cầu người (HLA)-G (human leukocyte antigen (HLA)-G) có tính đa hình giảm; do đó các tế bào miễn dịch của mẹ không nhận ra nó là ngoại lai. Các CTB cũng biểu hiện nhiều yếu tố: phối tử Fas (Fas ligand) gây ra apoptosis (chết tế bào theo chương trình) ở các tế bào miễn dịch mang thụ thể Fas, yếu tố thai kỳ sớm (early pregnancy factor), và yếu tố ngăn chặn do progesterone gây ra (progesterone-induced blocking factor) ngăn chặn hoạt động ly giải của tế bào diệt tự nhiên (NK) (natural killer (NK) cell) và một số cytokine chống viêm (chẳng hạn như yếu tố tăng trưởng biến đổi -ß (transforming growth factor, -ß), interleukin (-10, IL-4).
Để thiết lập thai kỳ, kinh nguyệt thường xảy ra trong một chu kỳ không thụ thai phải được ngăn chặn. Điều này xảy ra khi các tế bào nguyên bào nuôi của phôi sớm tiết ra gonadotropin màng đệm (CG) (chorionic gonadotropin) ngăn chặn sự thoái triển của thể vàng và duy trì sự tiết progesterone của nó. Trong các chu kỳ không thụ thai, thể vàng thường thoái triển vào khoảng tuần thứ hai sau khi rụng trứng, và sự suy giảm progesterone sau đó dẫn đến kinh nguyệt. Do đó, một trong những tương tác nội tiết đầu tiên giữa thai nhi và người mẹ liên quan đến việc phôi sớm phát tín hiệu để thúc đẩy các điều kiện trong tử cung cho phép làm tổ và thiết lập thai kỳ thông qua việc duy trì sự tiết progesterone của thể vàng.
NHAU THAI NỘI TIẾT: CẤU TRÚC VÀ CHỨC NĂNG
Nhau thai thực hiện nhiều chức năng thiết yếu trong cuộc sống trước khi sinh. Vai trò toàn cầu của nó là duy trì một môi trường được bảo vệ tạo điều kiện cho sự tăng trưởng và phát triển tối ưu của phôi và thai nhi. Nhau thai hemochorial của người bao gồm một đĩa đệm và các nhung mao màng đệm. Các nhung mao màng đệm bao gồm các nhung mao gốc (loại 1 đến 3) được neo vào màng rụng đáy hoặc trôi nổi tự do. Các nhung mao loại 3 phân nhánh thành các nhung mao trung gian và cuối cùng là các nhung mao tận cùng. Bề mặt của các nhung mao tận cùng được bao phủ bởi các tế bào tiền thân CTB, có nguồn gốc từ lá nuôi của phôi nang sớm, và được neo vào một lá đáy. Môi trường oxy thấp của nhau thai sớm bảo vệ quá trình hình thành cơ quan và tạo điều kiện cho sự tăng sinh của CTB. Tuy nhiên, khi sự phát triển tiến triển, sự biệt hóa của các tế bào tiền thân nguyên bào nuôi này tạo ra các kiểu hình tế bào khác nhau.
Các CTB biệt hóa thành một kiểu hình xâm lấn, và các nguyên bào nuôi ngoài nhung mao (EVTs) (extravillous trophoblasts) xâm lấn thành tử cung, neo một số nhung mao màng đệm vào màng rụng đáy, đi vào các mạch máu của mẹ. Các CTB xâm lấn này bịt các tiểu động mạch của mẹ, duy trì trạng thái thiếu oxy sinh lý. Các EVT tiếp tục di chuyển sâu hơn vào các tiểu động mạch xoắn của mẹ, thay thế các tế bào nội mô của mẹ, tái cấu trúc và tăng đường kính của các tiểu động mạch để đáp ứng sự gia tăng lớn về nguồn cung cấp máu cần thiết cho sự phát triển của thai nhi. Hơn nữa, một số loại tế bào của mẹ duy trì sự cân bằng giữa viêm và dung nạp trong màng rụng. Đặc biệt, các tế bào lympho bẩm sinh (innate lymphoid cells), chẳng hạn như tế bào NK, tương tác với các nguyên bào nuôi, tế bào mô đệm và bạch cầu trung tính để đóng một vai trò quan trọng trong việc khởi phát và duy trì thai kỳ. Các tế bào NK màng rụng chiếm 50% đến 70% các tế bào lympho xâm nhập trong ba tháng đầu, nhưng số lượng giảm dần trong suốt thai kỳ. Các tế bào NK màng rụng tham gia vào quá trình tái cấu trúc sớm của các động mạch xoắn của mẹ trước khi nguyên bào nuôi xâm lấn, cũng như tiết ra các yếu tố hóa hướng động quan trọng cho sự di chuyển và xâm lấn của EVT (chẳng hạn như IL-8, CXCL10 và IL-6). Có một mối liên quan giữa sự suy giảm hóa hướng động của nguyên bào nuôi và sự tái cấu trúc không đúng của động mạch xoắn và sự hình thành nhau thai bất thường. Chức năng bất thường của tế bào NK màng rụng (dNK) (decidual NK (dNK)) cũng có thể dẫn đến mất kiểm soát sự xâm lấn của nguyên bào nuôi.
Trong thời gian này, một số CTB hợp nhất màng sinh chất của chúng để trở thành một tế bào đa nhân duy nhất được gọi là hợp bào nuôi, trở thành lớp ngoài của nhau thai chức năng. Đến tuần thứ 10 đến 12 của thai kỳ, các nút CTB bị phá vỡ và máu của mẹ đến các không gian gian nhung mao (hồ máu), dẫn đến sự thay đổi về áp lực oxy trong nhau thai và hợp bào nuôi tiếp xúc trực tiếp với máu của mẹ trong các hồ máu. Việc tái cấu trúc các nhung mao của nhau thai và hệ thống mạch máu bên dưới của chúng, kết nối với dây rốn, xảy ra trong suốt thai kỳ và có thể đáp ứng với các tín hiệu/phơi nhiễm môi trường của mẹ, ảnh hưởng đến chức năng nhau thai, sự phát triển và tăng trưởng của thai nhi, và có khả năng, sự phát triển bệnh sau này trong thời thơ ấu và trưởng thành (một quá trình được gọi là lập trình của thai nhi – fetal programming).
Hợp bào nuôi của nhau thai tạo điều kiện cho việc chuyển oxy và chất dinh dưỡng từ tuần hoàn của mẹ sang thai nhi và xử lý các chất thải của thai nhi. Nó tổng hợp và tiết ra các hormone, các yếu tố tăng trưởng, cytokine, và các phân tử có hoạt tính sinh học khác chủ yếu vào khoang của mẹ. Nó cũng chuyển hóa các hormone của mẹ (chẳng hạn như glucocorticoid và insulin) để ngăn chặn sự phơi nhiễm của thai nhi, và do đó, tách biệt các thành phần của hệ thống nội tiết của mẹ và thai nhi. Quan trọng là, sự sắp xếp hemochorial cho phép các hormone do hợp bào nuôi sản xuất tiếp cận trực tiếp với tuần hoàn của mẹ. Ngược lại, hợp bào nuôi ngăn chặn hầu hết các hormone của mẹ đi vào khoang của thai nhi. Hầu hết các hormone mà nhau thai sản xuất đều giống hệt, hoặc là các chất tương đồng về cấu trúc và chức năng gần gũi, với các hormone hiện có của mẹ. Do đó, chúng tương tác với các thụ thể tương ứng trên các tế bào của mẹ. Do đó, các hormone của nhau thai được tiết ra với số lượng tương đối lớn để đạt được nồng độ cao (so với nồng độ ở phụ nữ không mang thai) trong tuần hoàn của mẹ sẽ lấn át các đối tác của mẹ và có tác động sâu sắc đến sinh lý của mẹ. Các hormone của nhau thai bao gồm các thành viên của họ prolactin và GH, các hormone steroid, và các hormone hoạt động thần kinh.
Họ Prolactin-Hormone Tăng trưởng
Họ prolactin-hormone tăng trưởng (PRL-GH) (prolactin-growth hormone (PRL-GH)) là một trong những nhóm hormone chính mà nhau thai tiết ra trong thai kỳ. Các thành viên của họ này bao gồm prolactin, placental lactogens, và GH. Vai trò của chúng bao gồm trung gian cho sự thích nghi trao đổi chất của mẹ đối với thai kỳ. Việc sản xuất họ hormone PRL-GH của nhau thai dường như quan trọng trong việc điều chỉnh cả sản xuất insulin và độ nhạy của người mẹ để đáp ứng với thai kỳ. Họ PRL-GH cũng có liên quan đến việc điều chỉnh sự thèm ăn và trọng lượng cơ thể.
Các Hormone Steroid
Nhau thai là nguồn chính của các hormone steroid trong thai kỳ. Các hormone steroid của nhau thai bao gồm estrogen và progesterone. Cả estrogen và progesterone đều đóng vai trò trong việc điều chỉnh cân bằng nội môi insulin và glucose, xử lý lipid, và điều chỉnh sự thèm ăn, điều này có thể quan trọng trong việc thúc đẩy những thay đổi trao đổi chất và huy động các kho dự trữ dinh dưỡng ở người mẹ trong thai kỳ. Các hormone steroid có liên quan đến các biến chứng thai kỳ, chẳng hạn như đái tháo đường thai kỳ và tiền sản giật. Nồng độ progesterone và estrogen cao đã được báo cáo ở những phụ nữ bị đái tháo đường thai kỳ, trong khi nồng độ này giảm trong các trường hợp mang thai bị tiền sản giật so với các trường hợp mang thai khỏe mạnh.
Các Hormone Hoạt động Thần kinh
Các mục tiêu chính của các hormone nhau thai bao gồm não, vùng dưới đồi và tuyến yên của mẹ. Những tác động thần kinh-nội tiết này cho phép người mẹ phản ứng với môi trường và thích nghi để tránh các tác động bất lợi của căng thẳng và duy trì cân bằng nội môi. Các hormone hoạt động thần kinh cũng chuẩn bị và cho phép người mẹ tương lai chăm sóc đầy đủ cho con cái của mình. Melatonin và tiền chất của nó, serotonin, là các hormone có nguồn gốc từ tryptophan với các tác động thần kinh-nội tiết nổi tiếng. Trong thai kỳ, nồng độ melatonin và serotonin lưu thông tăng lên. Nhau thai cũng tiết ra các hormone hoạt động thần kinh, chẳng hạn như hormone giải phóng thyrotropin (TRH) (thyrotropin-releasing hormone) và kisspeptin, có thể có chức năng thích nghi sinh lý của mẹ để hỗ trợ thai kỳ. Nhau thai tiết ra oxytocin và biểu hiện thụ thể của nó. Cả hai đều tăng dần ở giai đoạn cuối của thai kỳ trong nhau thai bình thường.
Hormone Giải phóng Corticotropin
Nhau thai người biểu hiện gen mã hóa hormone giải phóng corticotropin (CRH) (corticotropin-releasing hormone) bắt đầu từ khoảng tuần thứ sáu đến thứ tám của thai kỳ. CRH của nhau thai có thể được phát hiện trong máu của mẹ vào tuần thứ 15 của thai kỳ với nồng độ tăng theo cấp số nhân cho đến thời điểm sinh. Trong phần lớn thời gian của thai kỳ, CRH lưu thông cùng với một protein liên kết, protein này cô lập CRH và ngăn chặn hoạt động sinh học của nó. Vào cuối thai kỳ (4–5 tuần trước khi chuyển dạ), nồng độ protein liên kết CRH trong máu của mẹ giảm xuống. Điều này đi kèm với sự gia tăng theo cấp số nhân trong sản xuất CRH của nhau thai, dẫn đến tăng hoạt động sinh học của CRH. Sản xuất CRH của nhau thai (dựa trên các nghiên cứu in vitro về các mảnh ghép nhau thai) được tăng lên bởi prostaglandin (PGs) E2 và F2α, norepinephrine, acetylcholine, vasopressin, angiotensin-II, oxytocin, IL-I, glucocorticoid, và neuropeptide-Y, và bị giảm bởi progesterone và các chất cho nitric oxide.
Các Yếu tố Tăng trưởng
Nhau thai người tiết ra nhiều yếu tố tăng trưởng và cytokine. Sự phát triển của nhau thai liên quan đến sự tăng sinh, di chuyển, biệt hóa và hợp nhất của nguyên bào nuôi, và do đó, các yếu tố tăng trưởng có khả năng tham gia vào các quá trình này. Sự phát triển của nhau thai cũng liên quan đến sự hình thành mạch máu và mạch máu hóa rộng rãi tại vị trí làm tổ, và sự điều biến hệ thống miễn dịch của mẹ để ngăn chặn sự đào thải của mô thai nhi dị ghép. Các quá trình này có khả năng liên quan đến một sự giao tiếp tự tiết/cận tiết phức tạp bao gồm vô số các yếu tố tăng trưởng, các yếu tố tạo mạch và cytokine.
Các Yếu tố Tăng trưởng Giống Insulin
Nhau thai người sản xuất yếu tố tăng trưởng giống insulin (IGF)-1 (insulin-like growth factor (IGF)-1) và IGF-2 từ rất sớm, vào tuần thứ tám của thai kỳ. IGF-1 có mặt trong hợp bào nuôi và các CTB ở tất cả các giai đoạn của thai kỳ. IGF-2, đóng một vai trò trong việc điều chỉnh độ nhạy của mẹ đối với glucose, insulin, và nồng độ glucose. Biểu hiện, nồng độ và tín hiệu IGF-1 bất thường có liên quan chặt chẽ đến tình trạng chậm phát triển trong tử cung ở người.
Họ Yếu tố Tăng trưởng Nội mô Mạch máu
Các CTB, hợp bào nuôi và các tế bào mô đệm nhung mao trong nhau thai biểu hiện các thành viên của họ peptide yếu tố tăng trưởng nội mô mạch máu (VEGF) (vascular endothelial growth factor (VEGF) family). Yếu tố tăng trưởng nhau thai (PGF) (Placental growth factor) là một thành viên của họ này, có khoảng 50% tương đồng với VEGF-A. Nó được biểu hiện bởi các tế bào nguyên bào nuôi nhung mao và ngoài nhung mao, và trái ngược với mức độ biểu hiện VEGF, có tương quan thuận với tuổi thai tiến triển. Sự mất cân bằng nồng độ lưu thông của các peptide này và thụ thể hòa tan của chúng, tyrosine kinase giống FMS hòa tan (sFLT) (soluble FMS-like tyrosine kinase), trong máu mẹ có liên quan chặt chẽ, nhưng không phải là duy nhất, với nguyên nhân của tiền sản giật. Tuy nhiên, sự đóng góp vào các nồng độ này từ nội mô của mẹ là không rõ ràng. Hơn nữa, sự biểu hiện của các peptide này ở CTB và mô đệm nhung mao điều chỉnh sự hình thành và tái cấu trúc mạch máu nhung mao trong suốt thai kỳ, và nếu bị gián đoạn, sẽ ảnh hưởng đến việc vận chuyển chất dinh dưỡng và oxy vào tuần hoàn của thai nhi.
Họ Yếu tố Tăng trưởng Nguyên bào sợi
Các nguyên bào nuôi nhung mao và trung mô nhung mao trong nhau thai người biểu hiện các thành viên của họ yếu tố tăng trưởng nguyên bào sợi (FGF) (fibroblast growth factor (FGF) family), và các đại thực bào đơn nhân của nhau thai (placental mononuclear phagocytes) (còn được gọi là tế bào Hofbauer – Hofbauer cells) biểu hiện các thụ thể FGF. FGF cảm ứng các tế bào Hofbauer sản xuất nhiều yếu tố tăng trưởng và cytokine tham gia vào quá trình sửa chữa mô.
Adipokine
Nhau thai người biểu hiện các adipokine, leptin, adiponectin, resistin, ghrelin, và visfatin, và tiết chúng vào tuần hoàn của mẹ. Chúng được cho là điều chỉnh sự thích nghi trao đổi chất của mẹ đối với thai kỳ, đặc biệt là tăng đề kháng insulin. Trong các tế bào nhau thai, leptin và adiponectin điều chỉnh khả năng xâm lấn của nguyên bào nuôi và nguồn cung cấp chất dinh dưỡng. Leptin có tương quan nghịch với cân nặng khi sinh ở trẻ sơ sinh nhẹ cân so với tuổi thai. Tương quan thuận của biểu hiện adiponectin với leptin và ghrelin cho thấy có sự tương tác giữa các hormone này trong nhau thai.
Họ Yếu tố Tăng trưởng Biến đổi-ß
TGF-ß ảnh hưởng đến cả sự tăng sinh và biệt hóa của các tế bào nguyên bào nuôi, hoạt động thông qua các thụ thể bao gồm endoglin (ENG), một đồng thụ thể cho TGF-ß1 và TGF-ß3, mà hợp bào nuôi và các tế bào nội mô biểu hiện. Các tế bào nguyên bào nuôi sản xuất một ENG hòa tan bị cắt ngắn (sENG) bao gồm miền ngoại bào. Biểu hiện sENG được điều hòa tăng trong tiền sản giật và có thể hoạt động như một mồi nhử để cô lập và ngăn chặn sự liên kết của TGF-ß1 với thụ thể tế bào nội mô của nó, ngăn chặn sự giãn mạch. sENG dường như làm tăng thêm rối loạn chức năng nội mô do sFLT1 tăng cao.
Activin và inhibin là các thành viên đồng và dị nhị lượng được liên kết bằng liên kết disulfide của họ TGF-ß, có tên bắt nguồn từ khả năng kích hoạt hoặc ức chế, tương ứng, sự tiết hormone kích thích nang trứng (FSH) (follicle-stimulating hormone) của tuyến yên. Hợp bào nuôi biểu hiện từng tiểu đơn vị activin/inhibin và follistatin, và mức độ biểu hiện không thay đổi khi tuổi thai tiến triển. Các yếu tố này được tiết vào tuần hoàn của mẹ và thai nhi và dịch ối, và sự sản xuất của chúng thay đổi theo giai đoạn của thai kỳ. Activin và inhibin có thể ảnh hưởng đến sản xuất CG của nhau thai. Trong các tế bào nguyên bào nuôi được nuôi cấy, inhibin ức chế biểu hiện CG do hormone giải phóng gonadotropin (GnRH) (gonadotropin- releasing hormone) gây ra, trong khi activin làm tăng sự giải phóng CG do GnRH gây ra. Do đó, ít nhất là in vitro, activin và inhibin thông qua các tác động cận tiết đối với sản xuất GnRH của nhau thai có thể góp phần điều chỉnh sự tiết CG theo cách tương tự như tác động của chúng đối với sự tiết gonadotropin của trục dưới đồi-tuyến yên. Điều thú vị là, nồng độ inhibin-A và activin-A trong tuần hoàn của mẹ đã được báo cáo là có giá trị tiên đoán cho các bệnh lý, chẳng hạn như u nhau thai, các rối loạn tăng huyết áp của thai kỳ, thai chậm phát triển trong tử cung, thiếu oxy của thai nhi, hội chứng Down, thai chết lưu, sinh non, và thai chậm phát triển trong tử cung.
Họ Yếu tố Tăng trưởng Biểu bì
Các CTB và hợp bào nuôi trong nhau thai người biểu hiện các yếu tố tăng trưởng biểu bì (EGFs) (epidermal growth factors) sớm trong thai kỳ, và mức độ biểu hiện giảm khi tuổi thai tiến triển. EGF được cho là thúc đẩy sự xâm lấn của nguyên bào nuôi trong quá trình làm tổ và sự thiếu hụt trong biểu hiện và/hoặc tín hiệu của EGF có liên quan đến tiền sản giật và thai chậm phát triển.
Các Túi ngoại bào
Nhau thai sản xuất các túi ngoại bào (EVs) (extracellular vesicles) với số lượng lớn trong cả thai kỳ khỏe mạnh và bệnh lý. EVs hiện đang được công nhận là những vật mang quan trọng cho protein, lipid và acid nucleic, có thể đóng một vai trò quan trọng trong giao tiếp mẹ-thai và sự thích nghi của mẹ đối với thai kỳ. Các túi vi và nano từ cả nhau thai người ở ba tháng đầu và đủ tháng đều mang Flt-1, và nồng độ tăng đáng kể trong EVs từ tiền sản giật nặng, nhưng không phải nhẹ, so với nhau thai có huyết áp bình thường. Các exosome của nhau thai có thể được phát hiện trong tuần hoàn của mẹ từ tuần thứ sáu của thai kỳ, và nồng độ của chúng tăng dần khi tuổi thai tiến triển tương ứng với sự gia tăng kích thước của nhau thai. Các microribonucleic acid (microRNA) trong các exosome của nhau thai ảnh hưởng đến chức năng của các tế bào miễn dịch tại chỗ để tăng cường sức đề kháng với nhiễm virus. Nồng độ của các exosome (của nhau thai và không phải của nhau thai) trong tuần hoàn của mẹ, và thành phần hàng hóa của chúng, đã được liên kết với các biến chứng thai kỳ, chẳng hạn như tiền sản giật, sinh non, thai chậm phát triển trong tử cung, và đái tháo đường thai kỳ.
Các Acid Nucleic tự do của Thai nhi
Deoxyribonucleic acid tự do (cfDNA) (Cell-free deoxyribonucleic acid) có nguồn gốc từ các tế bào nguyên bào nuôi và có thể được xét nghiệm trong máu của mẹ như là các dấu ấn sinh học về sức khỏe và chức năng của nhau thai. Từ khoảng tuần thứ bảy của thai kỳ, cfDNA có thể được phát hiện trong tuần hoàn của mẹ, và lượng này tăng lên khi tuổi thai tiến triển, đến mức vào cuối thai kỳ, nó chiếm khoảng 4% cfDNA trong máu của mẹ. Sau khi sinh nhau thai, lượng cfDNA trong máu của mẹ giảm nhanh chóng. Vai trò sinh lý của cfDNA—và tại sao nó được bong ra từ các tế bào nguyên bào nuôi vào khoang của mẹ—vẫn chưa được biết. Lượng cfDNA trong máu của mẹ đã được sử dụng như một dấu ấn sinh học về sức khỏe của nhau thai, với sự gia tăng cfDNA được ghi nhận trong các trường hợp thai không sống được, tiền sản giật, và thai chậm phát triển trong tử cung liên quan đến suy nhau thai.
Bởi vì nó có thể được phân lập và giải trình tự, cfDNA được sử dụng để chẩn đoán và xét nghiệm tiền sản không xâm lấn cho các tình trạng, chẳng hạn như các rối loạn di truyền liên kết X và các lệch bội, cũng như xác định giới tính của thai nhi.
RNA thông tin tự do (mRNA) (Cell-free messenger RNA) có nguồn gốc từ nhau thai đã được phát hiện trong máu của mẹ vào tuần thứ tám của thai kỳ. mRNA tự do đã được đánh giá định lượng cho các bản sao cụ thể, đặc biệt là những bản sao mã hóa các protein được biểu hiện duy nhất bởi nhau thai (chẳng hạn như tiểu đơn vị β CG, placental lactogen, placenta enriched-1 14). Người ta đã phát hiện ra rằng một số nồng độ bản sao này trong máu của mẹ tăng cao trong tiền sản giật và thai chậm phát triển trong tử cung.
Các microRNA, các phân tử RNA đơn sợi không mã hóa ngắn, được biết là các yếu tố ngoại di truyền điều chỉnh biểu hiện gen bằng cách nhắm vào các trình tự cụ thể trong mRNA và làm mất ổn định các bản sao và/hoặc ức chế hoặc giảm dịch mã. Các microRNA được giải phóng từ nhau thai được cho là ảnh hưởng đến biểu hiện gen của mẹ, đặc biệt là ở các tế bào nội mô mạch máu. Các microRNA đặc hiệu cho nhau thai bao gồm những microRNA được mã hóa trong các cụm trên nhiễm sắc thể 14 và 19, với các microRNA được nghiên cứu kỹ nhất là từ cụm nhiễm sắc thể 19 (C19MC). Sự thay đổi nồng độ của các microRNA cụ thể trong máu của mẹ đã được báo cáo trong các trường hợp thai không sống được và tiền sản giật.
SỰ PHÁT TRIỂN THẦN KINH-NỘI TIẾT CỦA THAI NHI
Hệ thống thần kinh-nội tiết, bao gồm vùng dưới đồi, tuyến yên trước, và các tuyến nội tiết chính, là cần thiết cho cân bằng nội môi sinh lý, tăng trưởng, đáp ứng với căng thẳng, và sinh sản. Do đó, sự phát triển phù hợp của các hệ thống thần kinh-nội tiết trong cuộc sống của thai nhi là rất quan trọng đối với sức khỏe và sự khỏe mạnh sau khi sinh.
Hệ thống thần kinh-nội tiết phát triển chức năng vào giữa thai kỳ. Vùng dưới đồi bắt nguồn từ mặt trong của ống thần kinh gian não vào khoảng tuần thứ sáu của thai kỳ. Đến tuần thứ mười, lồi giữa (median eminence) có thể được phân biệt và các tế bào cụ thể trong vùng dưới đồi bắt đầu sản xuất GnRH, TRH, CRH, hormone giải phóng hormone tăng trưởng (GHRH) (GH-releasing hormone), và somatostatin (SS). Mầm của tuyến yên trước xuất hiện vào khoảng tuần thứ tư của thai kỳ dưới dạng một sự lồi ra của túi Rathke (Rathke’s pouch), ở phía trước màng họng-miệng tại nóc của khoang miệng đang phát triển. Đến tuần thứ bảy, sàn của hố yên (sella turcica) đã vào vị trí và tách tuyến yên trước ra khỏi nguồn gốc biểu mô của nó. Bắt đầu từ tuần thứ 8, các mao mạch xen kẽ giữa mô trung mô của túi Rathke và lồi giữa của vùng dưới đồi, và đến tuần thứ 12 đến 15 của thai kỳ, các mạch máu này tạo thành hệ thống mạch máu dưới đồi-tuyến yên. Tuyến yên trước trưởng thành bao gồm các tế bào tiết prolactin (lactotropes) sản xuất prolactin (PRL), các tế bào tiết GH (somatotropes) sản xuất GH, các tế bào tiết corticotropin (corticotropes) sản xuất proopiomelanocortin (POMC) và tạo ra hormone vỏ thượng thận (ACTH), ß-lipotropin và ß-endorphin, các tế bào tiết TSH (thyrotropes) sản xuất hormone kích thích tuyến giáp (TSH), và các tế bào tiết gonadotropin (gonadotropes) sản xuất hormone hoàng thể hóa (LH) (luteinizing hormone) và FSH. Do đó, trục dưới đồi-tuyến yên của thai nhi được phát triển về mặt giải phẫu và chức năng vào giữa thai kỳ và, trong phần còn lại của thai kỳ, tuyến yên trước của thai nhi, dưới sự kiểm soát của vùng dưới đồi, sản xuất các hormone hướng và ảnh hưởng đến tuyến giáp, tuyến thượng thận, và tuyến sinh dục của thai nhi. Mặc dù, mỗi trục nội tiết thể hiện các mức độ hoạt động khác nhau, trục HPA của thai nhi hoạt động đáng kể để chuẩn bị cho vai trò thiết yếu của nó sau khi sinh.
SỰ TÍCH HỢP SẢN XUẤT STEROID TRONG THAI KỲ: ĐỐI THOẠI CHÉO GIỮA THƯỢNG THẬN THAI NHI VÀ NHAU THAI
Nhau thai người sản xuất một lượng lớn progesterone và estrogen, đặc biệt là sau ba tháng đầu. Vào tuần thứ 6 đến 10 của thai kỳ, các tế bào nguyên bào nuôi và hợp bào nuôi của nhau thai có khả năng chuyển đổi cholesterol của mẹ thành progesterone. Các tế bào nhau thai cũng có hoạt động aromatase và 17ß hydroxysteroid dehydrogenase (17ßHSD) cao và chuyển đổi các androgen C19 thành estrogen C18 (Hình 5.1). Tuy nhiên, nhau thai không thể sản xuất estrogen de novo từ cholesterol, hoặc từ pregnenolone hoặc progesterone vì các tế bào thiếu enzyme 17α-hydroxylase/17,20-lyase. Thay vào đó, vỏ thượng thận của thai nhi cung cấp các androgen C19. Do đó, nhau thai người sản xuất progesterone từ cholesterol của mẹ (được gọi là đơn vị nội tiết mẹ-nhau thai) và estrogen từ các tiền chất C19 của thượng thận thai nhi (được gọi là đơn vị nội tiết thai nhi-nhau thai) (Hình 5.2). Thiếu hụt aromatase của nhau thai có thể không ảnh hưởng đến việc làm tổ, nhưng phụ nữ báo cáo bị nam hóa trong ba tháng cuối, dẫn đến lông mặt và mụn trứng cá. Trẻ sơ sinh nữ có các mức độ khác nhau của lưỡng tính giả (pseudohermaphroditism) với phì đại âm vật và lỗ tiểu lệch thấp—do nhau thai không thể chuyển đổi dehydroepiandrosterone (DHEA) thành estrogen. Con trai phát triển tầm vóc cao do không có sự cốt hóa sụn tiếp hợp, cùng với tuổi xương chậm, gây ra giảm mật độ xương và thiếu khoáng hóa, cùng với một số vấn đề khác.
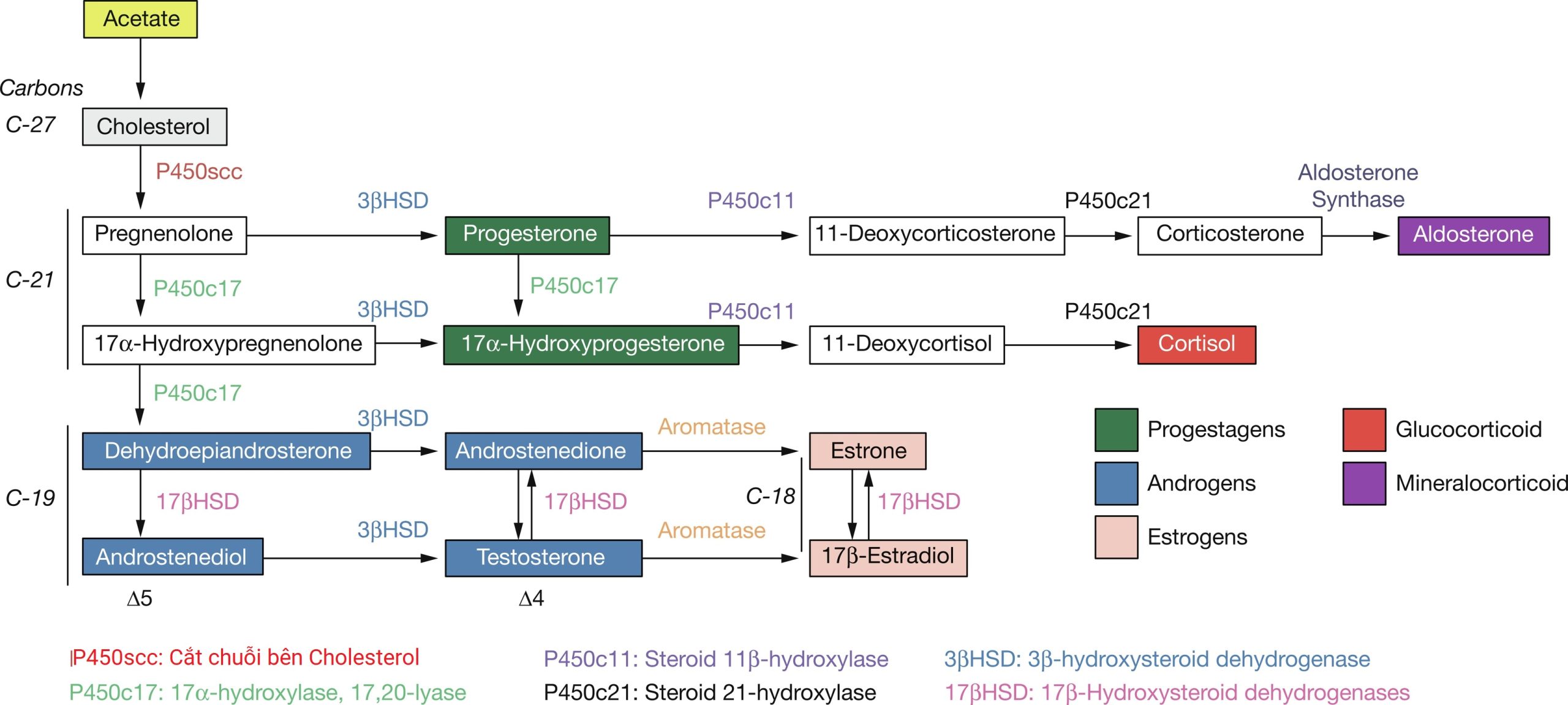
Hình 5.1 Sơ đồ sinh tổng hợp steroid. Các bước enzyme và các chất trung gian steroid progestogen, mineralocorticoid, glucocorticoid, androgen, và estrogen được trình bày.
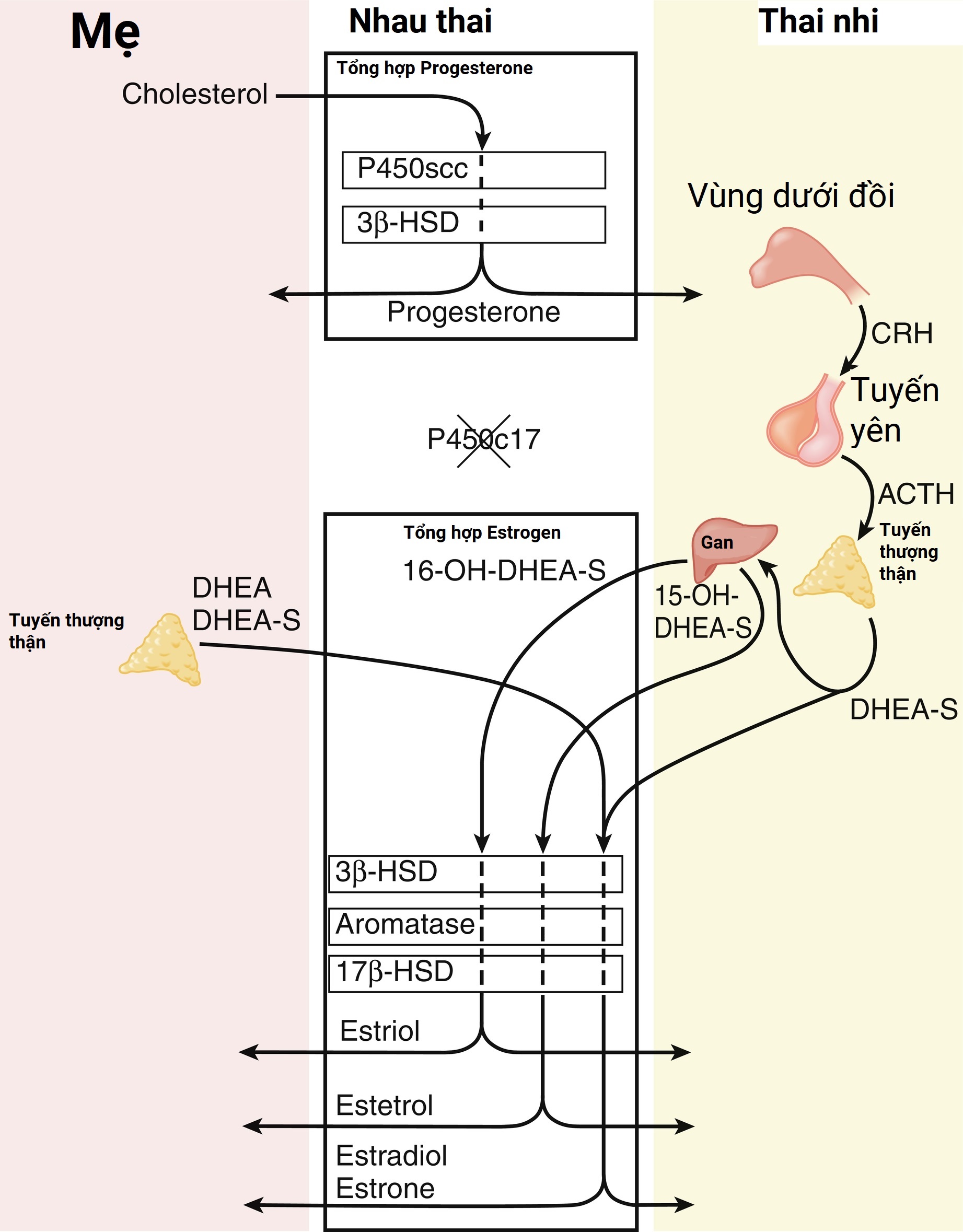
Hình 5.2 Sự phân chia và tích hợp của quá trình sinh tổng hợp steroid của nhau thai và thượng thận thai nhi. Nhau thai tạo ra progesterone de novo từ cholesterol của mẹ. Ngược lại, việc tạo ra estrogen của nhau thai đòi hỏi dehydroepiandrosterone (DHEA), thường được sulfat hóa (DHEA-S) từ thượng thận của thai nhi hoặc mẹ vì nhau thai thiếu hoạt động P450c17.
Tuyến thượng thận của người có nguồn gốc từ một sự dày lên của biểu mô khoang cơ thể giữa các gờ niệu sinh dục xảy ra vào khoảng tuần thứ tư của thai kỳ. Khoảng 1 tuần sau, các tế bào vỏ thượng thận nguyên thủy di chuyển về phía trung thận, nơi chúng tập hợp và tăng sinh để tạo thành mầm của vỏ thượng thận. Trong phần lớn thời gian của thai kỳ, vỏ thượng thận của thai nhi hiển thị hai vùng có hình thái riêng biệt: vùng thai nhi (fetal zone) lớn bên trong và vùng xác định (definitive zone) hẹp bên ngoài. Một vùng thứ ba, vùng chuyển tiếp (transitional zone), được phân biệt bởi các đặc điểm siêu cấu trúc và chức năng, tồn tại giữa vùng thai nhi và vùng xác định và rõ ràng vào đầu ba tháng cuối (Hình 5.3). Do đó, vào cuối thai kỳ, vỏ thượng thận của thai nhi giống như một dạng thô sơ của vỏ thượng thận người lớn. Ngay sau khi sinh, vùng thai nhi thoái triển để trở thành lớp lưới (zona reticularis), vùng chuyển tiếp trở thành lớp bó (zona fasciculata), và vùng xác định trở thành lớp cầu (zona glomerulosa). Giữa các tế bào vùng thai nhi trong cùng—cuối cùng sẽ tập hợp để tạo thành tủy thượng thận vào cuối ba tháng cuối—là các cụm nguyên bào thần kinh chưa trưởng thành.
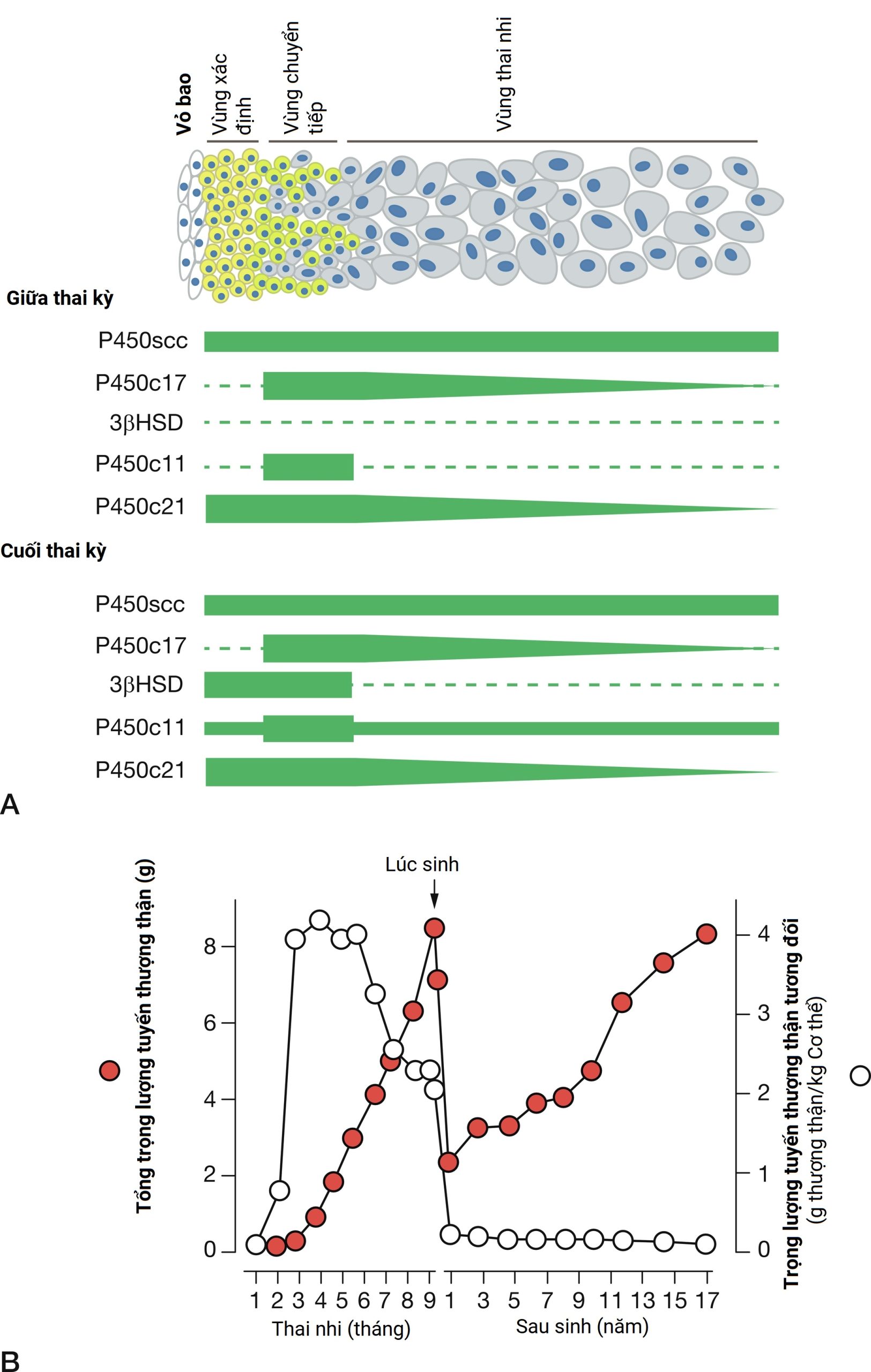
Hình 5.3 Sự phân vùng hình thái và sinh tổng hợp steroid trong tuyến thượng thận của thai nhi và sự phát triển của tuyến thượng thận trong quá trình phát triển. A, Hoạt động enzyme sinh steroid theo các vùng trong giai đoạn giữa hoặc cuối thai kỳ. B, Trọng lượng tuyệt đối của tuyến thượng thận và trọng lượng tương đối của tuyến thượng thận so với kích thước cơ thể trong cuộc sống của thai nhi và sau khi sinh.
Vào khoảng tuần thứ 12 của thai kỳ, quá trình sinh tổng hợp steroid để đáp ứng với ACTH bắt đầu ở các tế bào vùng thai nhi. Sự gia tăng này trùng với sự bắt đầu của việc mở rộng vùng thai nhi và tuyến yên của thai nhi tiết ra ACTH. Vào giữa thai kỳ, vùng thai nhi chiếm 80% đến 90% vỏ não và là vị trí chính của sự tăng trưởng và sản xuất steroid. Đáng chú ý, các tuyến thượng thận bị phì đại không tương xứng do sự phì đại của vùng thai nhi, và ở tuần thứ 20, chúng lớn hơn quả thận liền kề. Các tế bào vùng thai nhi có khả năng sinh steroid cao và để đáp ứng với ACTH, chúng sản xuất 100 đến 200 mg/ngày dehydroepiandrosterone sulfate (DHEA-S), một steroid C19 có hoạt tính androgen yếu, trong ba tháng cuối. Tuyến thượng thận của thai nhi sản xuất DHEA-S được sử dụng làm cơ chất cho quá trình tổng hợp estrogen của nhau thai. Trong nhau thai, enzyme steryl-sulfatase loại bỏ sulfat và các enzyme 3ßHSD, 17ßHSD, và aromatase chuyển đổi DHEA thành estradiol và estrone. Gan của thai nhi biểu hiện enzyme 16-hydroxylase và chuyển đổi một số DHEA-S thành 16-hydroxy-DHEA-S (16OH-DHEA-S), sau đó được chuyển đổi thành estriol. Bởi vì 16-hydroxylase không được biểu hiện sau khi sinh, lượng estriol trong tuần hoàn của mẹ gián tiếp phản ánh hoạt động của trục HPA của thai nhi. Vì lý do này, estriol của mẹ trước đây đã được sử dụng như một dấu ấn nội tiết để đánh giá sức khỏe của thai nhi. Vỏ thượng thận của thai nhi tiếp tục sản xuất DHEA-S để đáp ứng với ACTH trong phần còn lại của thai kỳ, tăng đáng kể trong ba tháng giữa và cuối. Khi đủ tháng, tuyến thượng thận của thai nhi người sản xuất khoảng 200 mg DHEA-S mỗi ngày. Do đó, đơn vị nội tiết thai nhi-nhau thai tạo thành một sự tương tác hợp tác giữa các con đường sinh steroid không hoàn chỉnh trong trục HPA của thai nhi và nhau thai để tạo ra một đơn vị tổng hợp estrogen hoàn chỉnh. Các báo cáo ban đầu về thiếu hụt steroid sulfatase cho thấy chuyển dạ bắt đầu muộn và không có sự giãn nở cổ tử cung. Tuy nhiên, nghiên cứu sau đó đã cho thấy độ dài thai kỳ bình thường với khả năng sinh ngả âm đạo tự nhiên.
Việc sản xuất CRH của nhau thai cũng ảnh hưởng đến trục HPA của thai nhi. Một đặc điểm độc đáo của thai kỳ ở loài linh trưởng là nhau thai sản xuất CRH với lượng ngày càng tăng khi tuổi thai tiến triển. CRH của nhau thai ảnh hưởng đến hoạt động của trục HPA của thai nhi thông qua một vòng phản hồi nội tiết dương, theo đó tuyến thượng thận của thai nhi sản xuất cortisol để tăng sự tiết CRH của nhau thai. Đổi lại, điều đó kích thích tuyến yên trước của thai nhi tiết thêm ACTH để thúc đẩy quá trình tổng hợp cortisol nhiều hơn. CRH cũng dường như làm tăng khả năng đáp ứng của ACTH của các tế bào trong vùng chuyển tiếp, ảnh hưởng trực tiếp đến các tế bào vỏ thượng thận. Do đó, sự tổng hợp cortisol của thượng thận thai nhi và estrogen của nhau thai có thể tăng lên thông qua một vòng phản hồi dương liên quan đến CRH của nhau thai.
Tuyến thượng thận của thai nhi phải trưởng thành về mặt chức năng để sản xuất glucocorticoid (cortisol) và mineralocorticoid (aldosterone) ngay sau khi sinh để trẻ sơ sinh có thể duy trì cân bằng nội môi. Sự suy giảm tiết cortisol và aldosterone sau khi sinh có thể gây tử vong. Một ví dụ về một tình trạng như vậy là tăng sản tuyến thượng thận bẩm sinh (CAH) (congenital adrenal hyperplasia), một tập hợp các khiếm khuyết di truyền trong đó các tuyến thượng thận không thể sản xuất cortisol và aldosterone. Trong tình trạng này, sự thiếu hụt phản hồi âm của cortisol đối với vùng dưới đồi-tuyến yên dẫn đến tăng sản xuất ACTH, gây ra sự phát triển quá mức của các tuyến thượng thận. Tình trạng này phát sinh từ các đột biến ở bất kỳ gen nào mã hóa các enzyme sinh steroid chính liên quan đến quá trình tổng hợp cortisol và aldosterone. Chúng bao gồm các đột biến ở CYP21A2 (mã hóa 21-hydroxylase), HSD3B2 (mã hóa 3ßHSD của tuyến thượng thận), CYP11B1 (mã hóa 11ß-hydroxylase), POR (mã hóa P450 oxidoreductase), CYP17A1 (mã hóa 17α-hydroxylase), và STAR (mã hóa protein điều hòa cấp tính sinh steroid, trung gian vận chuyển cholesterol từ màng ngoài ty thể đến màng trong ty thể, nơi nó có thể được sử dụng để tổng hợp pregnenolone). CAH do thiếu 21-hydroxylase (được gọi là CAH cổ điển) là nguyên nhân phổ biến nhất của suy hormone steroid thượng thận ở bệnh nhân nhi. Khiếm khuyết này làm suy giảm quá trình tổng hợp cortisol và aldosterone, trong khi quá trình tổng hợp androgen C19 không bị ảnh hưởng và tăng đáng kể do tiếp xúc với lượng ACTH tăng lên. Các triệu chứng có thể xuất hiện ngay sau khi sinh ở trẻ sơ sinh bị CAH cổ điển bao gồm mất nước, hạ huyết áp, natri thấp (được gọi là mất muối – salt wasting), rối loạn nhịp tim, và sốc (còn được gọi là: khủng hoảng thượng thận). Mức độ mất muối có thể thay đổi tùy thuộc vào mức độ nghiêm trọng của sự thiếu hụt aldosterone. Trong một số trường hợp, chỉ có quá trình tổng hợp cortisol bị suy giảm và điều này được gọi là CAH nam hóa đơn thuần không mất muối. Trẻ sơ sinh nữ bị CAH có thể biểu hiện với sự nam hóa và bộ phận sinh dục không rõ ràng với các cơ quan sinh sản bên trong bình thường. Biểu hiện này là do sản xuất androgen quá mức bởi tuyến thượng thận của thai nhi do sự thúc đẩy của ACTH tăng lên.
Giai đoạn của thai kỳ khi tuyến thượng thận của thai nhi bắt đầu sản xuất một lượng cortisol có liên quan về mặt sinh lý vẫn chưa được biết chắc chắn. Các nghiên cứu về biểu hiện enzyme sinh steroid trong các tế bào vỏ thượng thận cho thấy rằng vùng xác định có khả năng sản xuất aldosterone, và vùng chuyển tiếp sản xuất cortisol vào giữa ba tháng cuối. Điều thú vị là, bộ phận sinh dục không rõ ràng và bị nam hóa của trẻ sơ sinh nữ bị CAH cho thấy sự tiếp xúc với androgen quá mức dưới dạng DHEA, vào cuối ba tháng đầu khi xoang niệu-sinh dục trải qua sự biệt hóa phụ thuộc androgen. Điều này ngụ ý rằng tuyến thượng thận của thai nhi sản xuất cortisol và thực hiện phản hồi âm đối với sự tiết ACTH của tuyến yên trong ba tháng đầu. Do đó, dữ liệu gián tiếp cho thấy rằng tuyến thượng thận của thai nhi sản xuất cortisol trước 12 đến 15 tuần, sau đó giảm cho đến 25 đến 30 tuần tuổi thai, sau đó các tế bào vùng chuyển tiếp biểu hiện các enzyme sinh steroid cần thiết cho quá trình tổng hợp cortisol de novo từ cholesterol. Sản xuất mineralocorticoid bởi vỏ thượng thận của thai nhi người thấp vào đầu thai kỳ nhưng tăng trong ba tháng cuối. Khi đủ tháng, 80% aldosterone trong máu của thai nhi người và khỉ rhesus dường như có nguồn gốc từ thượng thận của thai nhi. Ở tuyến thượng thận của thai nhi người 18 đến 21 tuần, con đường chuyển hóa mineralocorticoid khu trú ở vùng xác định, nhưng hoạt động của nó thấp và không đáp ứng với các chất kích thích tiết. Tuy nhiên, trong điều kiện bình thường, khả năng sinh steroid của tuyến thượng thận của thai nhi để sản xuất cortisol và aldosterone đã sẵn sàng vào giữa ba tháng cuối để chuẩn bị cho trục HPA thực hiện chức năng sống còn của nó sau khi sinh.
SỰ TRƯỞNG THÀNH CỦA THAI NHI VÀ CHUYỂN DẠ
Khi sinh ra, thai nhi, với tư cách là một trẻ sơ sinh, phải đột ngột thích nghi với môi trường bên ngoài tử cung và độc lập thiết lập cũng như duy trì cân bằng nội môi sinh lý. Sự thành công của quá trình chuyển đổi này đòi hỏi các hệ cơ quan cần thiết cho cuộc sống ngoài tử cung (như phổi, ruột, tuyến thượng thận, tuyến giáp, thận, gan, tụy, hệ miễn dịch) phải trưởng thành về mặt chức năng trước, hoặc ít nhất là ngay sau khi chuyển dạ. Sự trưởng thành của phổi thai nhi với khả năng trao đổi khí là đặc biệt quan trọng. Cortisol là một chất điều hòa hormone quan trọng của quá trình này và thúc đẩy sự trưởng thành chức năng của nhiều hệ cơ quan của thai nhi trước khi chuyển dạ. Điều thú vị là, ở một số loài, cortisol chịu trách nhiệm cho sự trưởng thành của thai nhi cũng kích hoạt quá trình chuyển dạ. Ví dụ, ở cừu, hoạt động của trục HPA của thai nhi tăng lên trong tuần trước khi chuyển dạ để tuyến thượng thận của thai nhi tiết ra một lượng lớn cortisol không chỉ kích thích sự trưởng thành của các cơ quan thai nhi (đặc biệt là sản xuất surfactant bởi phổi) mà còn kích hoạt quá trình chuyển dạ bằng cách gây ra sự chuyển hóa progesterone của nhau thai thành androstenedione, dẫn đến sự giảm nồng độ progesterone toàn thân của mẹ gây ra chuyển dạ. Do đó, trong vai trò trung tâm, trục HPA của thai nhi sản xuất cortisol để đảm bảo rằng sự trưởng thành của thai nhi diễn ra trước khi chuyển dạ và hai quá trình này được phối hợp. Khám phá rằng cortisol thúc đẩy sự trưởng thành của phổi thai nhi đã dẫn đến việc sử dụng rộng rãi trên lâm sàng các glucocorticoid tổng hợp đi qua nhau thai để thúc đẩy sự trưởng thành của phổi thai nhi ở những phụ nữ có nguy cơ sinh non. Liệu pháp này làm tăng tỷ lệ sống sót của trẻ sinh non chủ yếu bằng cách giảm mức độ nghiêm trọng của hội chứng suy hô hấp do suy phổi ở trẻ sinh non. Do đó, cũng như hầu hết các loài, glucocorticoid kích thích sự trưởng thành của thai nhi người, chuẩn bị cho cuộc sống bên ngoài tử cung. Tuy nhiên, không giống như cừu, cả glucocorticoid hay hoạt động của trục HPA của thai nhi đều không gây ra chuyển dạ ở người.
Ở cừu, cortisol cần thiết để gây ra sự trưởng thành của thai nhi và kích hoạt chuyển dạ có nguồn gốc từ thai nhi, trong khi cortisol của mẹ hoặc liệu pháp cortisol chỉ dành cho mẹ không có tác dụng. Lý do cho phát hiện này là nhau thai cừu làm bất hoạt cortisol của mẹ bằng cách biểu hiện enzyme 11ß-HSD-2, enzyme này chuyển đổi cortisol thành cortisone không hoạt động. Đây có thể là một biện pháp bảo vệ để bảo vệ não bộ đang phát triển của thai nhi khỏi các tác động bất lợi của glucocorticoid đối với sự phát triển của tế bào thần kinh. Tương tự, nhau thai người ngăn chặn cortisol của mẹ đi vào khoang thai nhi trong hầu hết thời gian của thai kỳ ở người. Đây là lý do tại sao các glucocorticoid tổng hợp mà nhau thai không chuyển hóa được sử dụng để điều trị cho phụ nữ trong chuyển dạ sinh non. Tuy nhiên, hàng rào này dường như sụp đổ vào cuối ba tháng cuối. Bằng chứng cho điều này là nồng độ estriol trong tuần hoàn của mẹ trong giai đoạn cuối của thai kỳ có tương quan nghịch với những thay đổi hàng ngày trong nồng độ cortisol lưu thông của mẹ, cho thấy cortisol của mẹ đi qua nhau thai và thực hiện phản hồi âm đối với trục HPA của thai nhi, dẫn đến giảm sự kích thích của ACTH đối với sản xuất DHEA-S, từ đó gây ra sự giảm sản xuất estriol của nhau thai. Sự gia tăng vận chuyển cortisol của mẹ sang thai nhi có thể đại diện cho một cơ chế dự phòng để đảm bảo sự trưởng thành của phổi thai nhi trước khi chuyển dạ đủ tháng.
SỰ KIỂM SOÁT HORMONE CỦA QUÁ TRÌNH CHUYỂN DẠ Ở NGƯỜI
Tử cung mang thai chứa đựng thai nhi đang phát triển về mặt vật lý và miễn dịch. Trong phần lớn thời gian của thai kỳ, chất nền ngoại bào của cổ tử cung cứng và không co giãn, giúp đóng kín lối ra của tử cung một cách hiệu quả. Ngược lại, cơ tử cung của thành tử cung giãn ra, trở nên co giãn, phát triển chủ yếu bằng cách phì đại tế bào, và căng ra để đáp ứng với thai nhi và dịch ối đang phát triển. Hệ thống miễn dịch của mẹ cũng bị ức chế, đặc biệt là tại giao diện mẹ-thai trong màng rụng, để ngăn chặn sự đào thải của mô thai nhi bán dị ghép. Khi chuyển dạ, tử cung mang thai trải qua một loạt các biến đổi được phối hợp theo thời gian, sao cho cơ tử cung trở nên co bóp và dễ bị kích thích cao độ, co bóp nhịp nhàng và mạnh mẽ để trở thành động cơ cho việc sinh nở, và chất nền ngoại bào của cổ tử cung mềm ra để cho phép giãn nở và mở ra cánh cổng cho việc sinh nở. Ngoài ra, các màng thai yếu đi và vỡ ra để giải phóng thai nhi. Quá trình này cũng đi kèm với sự kích hoạt miễn dịch trong màng rụng tạo ra tình trạng viêm ở cấp độ mô rộng rãi và sản xuất tại chỗ các yếu tố co bóp tử cung gây chuyển dạ, chẳng hạn như prostaglandin. Những sự kiện này tạo nên cái mà chúng ta gọi là chuyển dạ (labor), được định nghĩa lâm sàng là các cơn co bóp nhịp nhàng và mạnh mẽ với sự mềm và giãn nở của cổ tử cung và vỡ màng ối. Quá trình này lên đến đỉnh điểm bằng việc tống xuất mạnh mẽ thai nhi, nhau thai, và các màng thai, bao gồm cả màng rụng, và thông qua cầm máu, co hồi, và tái tạo nội mạc tử cung, tử cung trở lại trạng thái không mang thai để tiếp tục chu kỳ kinh nguyệt.
Các hormone kiểm soát quá trình và thời điểm chuyển dạ. Progesterone và estrogen ảnh hưởng đến sự phát triển và co bóp của cơ tử cung, tình trạng miễn dịch/viêm của màng rụng, và tính toàn vẹn cơ học của cổ tử cung. Về mặt này, sự cân bằng giữa các tác động duy trì thai kỳ của progesterone chiếm ưu thế trong phần lớn thời gian của thai kỳ, và các tác động gây chuyển dạ của estrogen xảy ra như một phần của quá trình chuyển dạ, là rất quan trọng. Trong phần lớn thời gian của thai kỳ, progesterone và estrogen có tác dụng nuôi dưỡng tử cung để thúc đẩy sự phì đại của tế bào cơ tử cung và tăng lưu lượng máu đến tử cung và cổ tử cung. Progesterone có tác dụng làm giãn và chống viêm đối với các mô tử cung để ngăn chặn chuyển dạ bằng cách duy trì sự đóng kín của cổ tử cung và sự yên tĩnh của cơ tử cung. Khi chuyển dạ, tác dụng của progesterone bị mất và estrogen chiếm ưu thế để thúc đẩy sự biểu hiện của các gen trong các tế bào cơ tử cung và cổ tử cung mà các sản phẩm của chúng làm tăng sự co bóp của tử cung và làm mềm cổ tử cung. Do đó, một đặc điểm chung của các loài đẻ con là sự rút lui của khối progesterone kích hoạt quá trình chuyển dạ, cho phép các tác động kích thích của estrogen làm tăng sự co bóp và dễ bị kích thích của cơ tử cung và thúc đẩy sự mềm cổ tử cung và yếu màng. Cortisol từ tuyến thượng thận của thai nhi hoặc mẹ, dường như không đóng góp vào sự kiểm soát hormone của quá trình chuyển dạ ở người. Bằng chứng cho điều này là chuyển dạ xảy ra bình thường đủ tháng trong các trường hợp mang thai mà thai nhi bị CAH do không có khả năng sản xuất cortisol, và liệu pháp glucocorticoid không làm nhanh quá trình chuyển dạ.
CRH của nhau thai có thể liên quan đến việc điều chỉnh quá trình chuyển dạ ở người. Nồng độ CRH trong huyết tương của mẹ—phản ánh CRH chủ yếu có nguồn gốc từ nhau thai—tăng theo cấp số nhân khi tuổi thai tiến triển, và tốc độ thay đổi khi thai kỳ tiến triển có thể dự đoán được độ dài của thai kỳ. Sự gia tăng CRH của mẹ từ giữa thai kỳ càng nhanh, chuyển dạ xảy ra càng sớm. Tốc độ tăng chậm hơn có liên quan đến sinh già tháng. Sinh lý và sinh học phân tử đằng sau mối liên quan này vẫn chưa được hiểu rõ. Các thí nghiệm in vitro gợi ý một số khả năng. Các thụ thể CRH đã được xác định trong các tế bào cơ tử cung và màng thai. CRH kích thích sự tiết PG từ màng rụng và màng ối, và làm tăng sự co bóp của cơ tử cung bằng cách tăng cường khả năng đáp ứng với oxytocin và PGF2α. Một cách nghịch lý, CRH của nhau thai làm tăng hoạt động của adenylate cyclase trong các tế bào cơ tử cung, thúc đẩy sự giãn cơ, nhưng tác dụng này bị mất vào cuối thai kỳ, có thể là do những thay đổi trong các isoform của thụ thể CRH trong các tế bào cơ tử cung.
Cách thức rút lui progesterone xảy ra để đạt được chuyển dạ khác nhau giữa các loài, tùy thuộc vào nguồn progesterone duy trì thai kỳ. Ví dụ, ở loài gặm nhấm, thể vàng của mẹ sản xuất progesterone trong thai kỳ và sự thoái triển của thể vàng kích hoạt quá trình chuyển dạ, dẫn đến sự rút lui progesterone toàn thân. Ở cừu, nhau thai sản xuất progesterone độc quyền và sự rút lui của nó được gây ra bởi một sự tăng vọt cortisol trước khi sinh, gây ra sự biểu hiện của enzyme 17α-hydroxylase trong các tế bào nhau thai, chuyển hướng progesterone từ việc tiết ra sang chuyển đổi thành androstenedione, chất này được chuyển đổi thành estradiol. Sự cảm ứng enzyme này dẫn đến sự giảm nồng độ progesterone toàn thân của mẹ và sự gia tăng đồng thời nồng độ estrogen kích hoạt quá trình chuyển dạ. Trái ngược với loài gặm nhấm và cừu, chuyển dạ ở phụ nữ xảy ra mà không có sự rút lui progesterone toàn thân (Hình 5.4). Thay vào đó, tử cung mang thai nhận được nồng độ progesterone và estrogen cao—do hoạt động của đơn vị thai nhi-nhau thai—trong phần lớn thời gian của thai kỳ và trong quá trình chuyển dạ và sinh nở. Mặc dù điều này cho thấy rằng sự rút lui progesterone không kích hoạt quá trình chuyển dạ ở người, các nghiên cứu lâm sàng cho thấy rằng việc phá vỡ tín hiệu progesterone bằng các tác nhân, chẳng hạn như mifepristone, một chất điều biến/đối kháng thụ thể progesterone chọn lọc, làm tăng sự co bóp của cơ tử cung, và gây chuyển dạ ở tất cả các giai đoạn của thai kỳ. Quan sát đó cho thấy rằng một sự rút lui progesterone chức năng, thay vì toàn thân, kích hoạt quá trình chuyển dạ ở người, theo đó các tế bào tử cung trở nên trơ với progesterone.
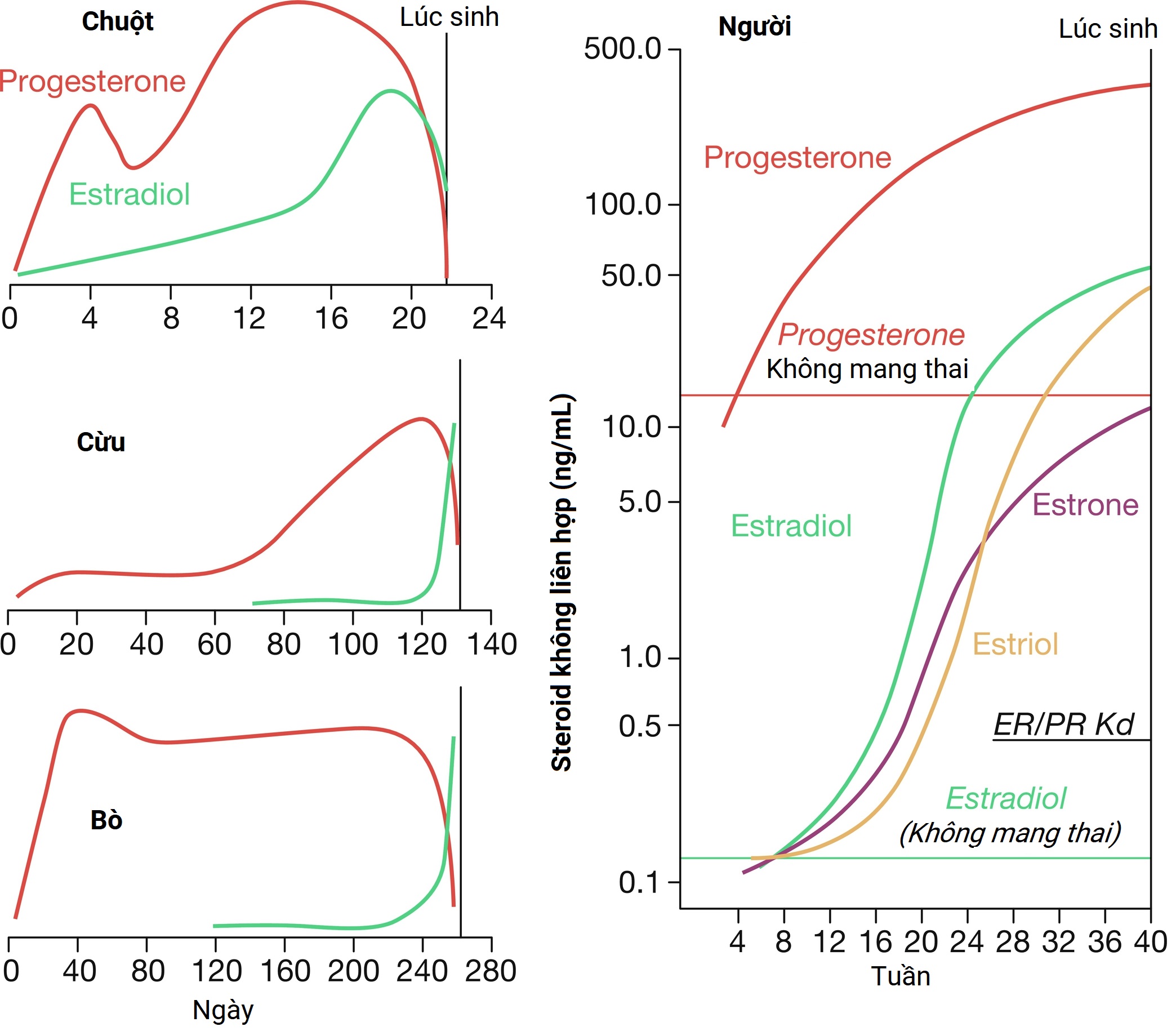
Hình 5.4 Các mô hình nồng độ progesterone và estrogen trong huyết thanh của mẹ trong suốt thai kỳ ở các loài động vật có vú. Chuột, cừu và bò đều cho thấy sự rút lui progesterone toàn thân trước khi chuyển dạ, trong khi phụ nữ thì không. Estrogen tăng ở các loài động vật có vú khi chuyển dạ đến gần. Ở phụ nữ, sự gia tăng nhanh chóng trong sản xuất estrogen của nhau thai là trong ba tháng đầu.
Progesterone duy trì thai kỳ thông qua sự tương tác của nó với các isoform của thụ thể progesterone (PR) (progesterone receptor) hạt nhân, PR-A và PR-B, được biểu hiện bởi các tế bào cơ tử cung, cổ tử cung và màng rụng (Hình 5.5). Các PR hoạt động chủ yếu như các chất điều biến phiên mã được kích hoạt bởi phối tử bằng cách tương tác trực tiếp với các yếu tố cis trong các promoter gen hoặc bằng cách điều biến hoạt động của các yếu tố phiên mã khác. Những thay đổi trong hoạt động phiên mã của PR có khả năng trung gian cho sự rút lui progesterone chức năng. Các cơ chế khả thi bao gồm: (1) tăng sự phong phú và hoạt động ức chế phiên mã của PR-A trong các tế bào tử cung làm giảm hoạt động phiên mã PR do progesterone gây ra; (2) giảm nồng độ và/hoặc hoạt động của các đồng kích hoạt phiên mã quan trọng điều biến hoạt động phiên mã của PR; và (3) các biến đổi sau dịch mã, đặc biệt là sự phosphoryl hóa serine đặc hiệu tại vị trí, ức chế hoạt động phiên mã của PR. Bất kỳ, hoặc tất cả, các cơ chế rút lui progesterone chức năng qua trung gian PR này có thể đáp ứng với các yếu tố kích hoạt chuyển dạ gây chuyển dạ. Cũng có thể các tế bào tử cung chuyển hóa progesterone thành một dạng không liên kết với PR, dẫn đến việc tạo ra các PR không có phối tử có thể có các tác động gây chuyển dạ.
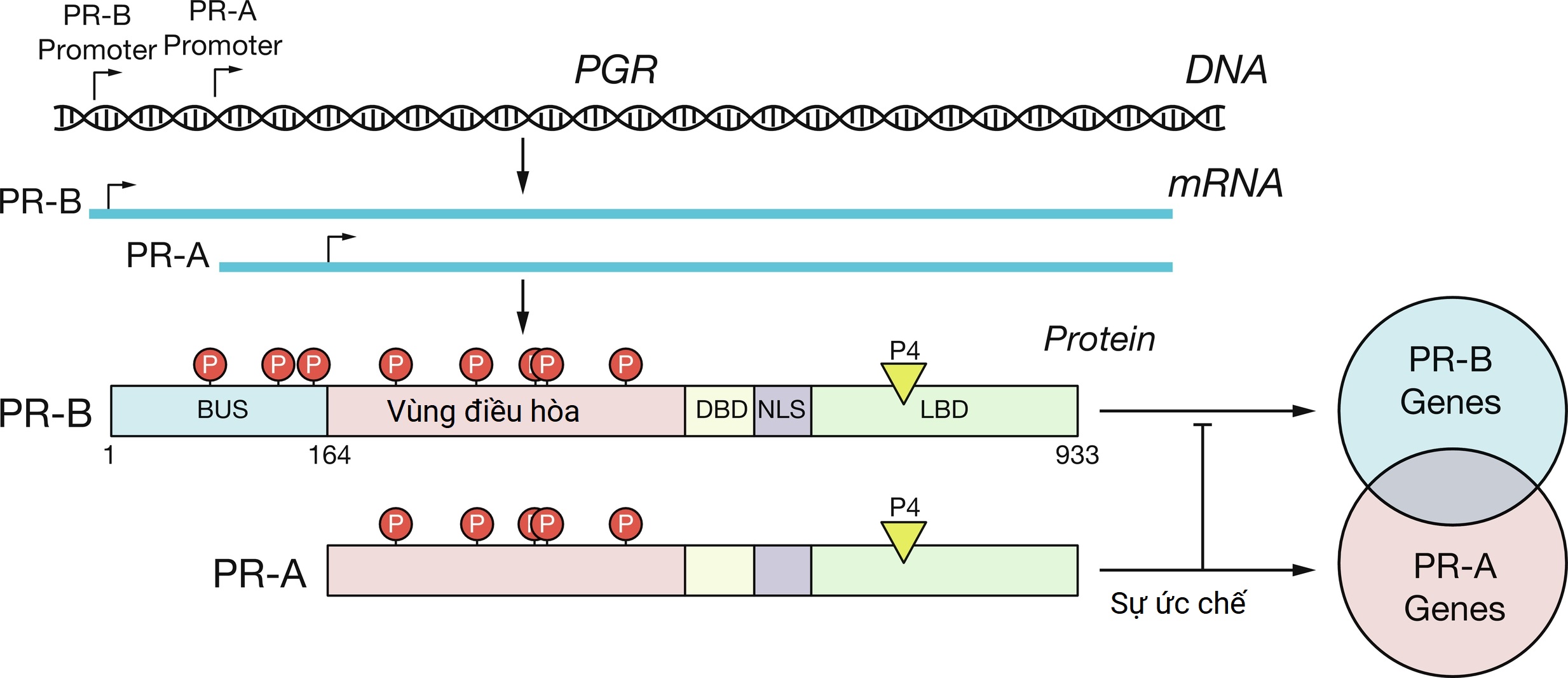
Hình 5.5 Sản xuất isoform của thụ thể Progesterone. Gen thụ thể progesterone (PGR) tạo ra hai sản phẩm dịch mã chính, PR-A và PR-B. PR-A thiếu các trình tự đầu N mã hóa một miền kích hoạt phiên mã. Cả hai isoform đều trải qua các biến đổi sau dịch mã rộng rãi với sự phosphoryl hóa. Các PR hoạt động như các yếu tố phiên mã được kích hoạt bởi phối tử để ảnh hưởng đến sự biểu hiện của các gen mục tiêu cụ thể và chung. Tại một số promoter gen, PR-A ức chế hoạt động phiên mã của PR-B. BUS, đoạn thượng nguồn B; DBD, miền liên kết DNA; LBD, miền liên kết phối tử; NLS, trình tự định vị hạt nhân.
Các nghiên cứu lâm sàng và động vật cho thấy rằng tình trạng viêm ở cấp độ mô trong các khoang mô tử cung (cơ tử cung, cổ tử cung và màng rụng) là một kích thích gây chuyển dạ chính đóng vai trò nhân quả trong quá trình và thời điểm chuyển dạ. Chuyển dạ cũng đi kèm với sự gia tăng sản xuất các PG co bóp tử cung bởi màng rụng và các màng thai; có khả năng là một hệ quả của tình trạng viêm ở cấp độ mô. Nồng độ PG tăng (đặc biệt là PGF2α và PGE2) trong mô tử cung có khả năng biến đổi cơ tử cung sang trạng thái chuyển dạ và thúc đẩy sự mềm và giãn nở của cổ tử cung. Do đó, một giả thuyết hàng đầu là chuyển dạ xảy ra từ một quá trình tự tiết/cận tiết tại chỗ liên quan đến tình trạng viêm ở cấp độ mô. Theo ngụ ý, giả thuyết này dự đoán rằng các tác động chống viêm đối với các mô tử cung và thai kỳ duy trì thai kỳ và ngăn chặn chuyển dạ. Progesterone có thể trung gian cho điều này thông qua các PR trong các tế bào cơ tử cung, cổ tử cung và màng rụng, vì các nghiên cứu in vitro cho thấy rằng tín hiệu progesterone/PR ức chế phản ứng của các tế bào tử cung đối với các kích thích gây chuyển dạ/gây viêm. Mất hoạt động chống viêm của progesterone/PR sẽ cho phép các kích thích gây viêm chiếm ưu thế và gây ra tình trạng viêm ở cấp độ mô với sự sản xuất đồng thời của các PG kích hoạt cơ tử cung và làm giãn cổ tử cung. Theo mô hình này, các điều kiện sinh lý và/hoặc bệnh lý ảnh hưởng đến khả năng của các PR trong việc trung gian cho các hành động chống viêm của progesterone trong các tế bào tử cung có thể kích hoạt quá trình chuyển dạ. Các nghiên cứu cho thấy rằng trong các tế bào cơ tử cung, các kích thích gây chuyển dạ/gây viêm ngăn chặn hoạt động chống viêm của progesterone/PR bằng cách gây ra sự phosphoryl hóa serine đặc hiệu tại vị trí của PR-A.
Trong suốt thai kỳ, các kích thích gây viêm/gây chuyển dạ có liên quan về mặt sinh lý khác nhau ảnh hưởng đến tử cung mang thai. Một số có thể là nội tại (chẳng hạn như căng thẳng của thai nhi hoặc mẹ, sự lão hóa của nhau thai, sự căng giãn của tử cung) và một số có thể là ngoại lai (chẳng hạn như nhiễm trùng trong tử cung, căng thẳng tâm lý xã hội về dinh dưỡng và môi trường của mẹ). Tác động thực tế là tử cung mang thai tiếp xúc với một gánh nặng viêm tăng lên khi thai kỳ tiến triển. Người ta đề xuất rằng trong phần lớn thời gian của thai kỳ, progesterone/PR ức chế phản ứng của các tế bào cơ tử cung, màng rụng và cổ tử cung đối với các kích thích gánh nặng viêm và tồn tại một ngưỡng gánh nặng viêm, trên đó hoạt động của protein kinase cụ thể xúc tác cho sự phosphoryl hóa PR và/hoặc các cơ chế khác gây ra sự rút lui progesterone chức năng qua trung gian PR. Mất hoạt động chống viêm của progesterone/PR sẽ tạo điều kiện cho sự phát triển của một trạng thái gây viêm phản hồi dương trong các mô tử cung, dẫn đến việc sản xuất các PG kích hoạt cơ tử cung và làm giãn cổ tử cung. Mô hình này cho thấy rằng thời điểm sinh là kết quả của quỹ đạo gánh nặng viêm, điểm đặt cho ngưỡng gánh nặng viêm, và khả năng gây ra sự rút lui progesterone chức năng qua trung gian PR. Bất kỳ tham số nào trong số này đều có thể phù hợp với các chiến lược điều trị để kiểm soát thời điểm sinh trên lâm sàng và ngăn ngừa sinh non. Dự phòng bằng progestin dưới dạng 17-hydroxyprogesterone-caproate (tiêm bắp hàng tuần) hoặc progesterone (đặt âm đạo hàng ngày) có thể làm giảm nguy cơ sinh non ở một nhóm nhỏ phụ nữ có nguy cơ bằng cách ảnh hưởng đến quỹ đạo gánh nặng viêm và/hoặc tăng cường hoạt động chống viêm qua trung gian PR.
CÁC TIẾP CẬN DI TRUYỀN VÀ GENOM HỌC ĐỂ KHÁM PHÁ CÁC CON ĐƯỜNG NỘI TIẾT MỚI LIÊN QUAN ĐẾN THỜI ĐIỂM SINH
Như đã nhấn mạnh trong suốt chương này, estrogen và progesterone là cần thiết cho việc thiết lập, duy trì và kết thúc thai kỳ. Các hormone steroid sinh sản quan trọng này đã nhận được sự chú ý đáng kể và chắc chắn tạo thành một phần của các phân tử tín hiệu được bảo tồn trong thai kỳ, cùng với prostaglandin, ở các loài. Trong nỗ lực tìm hiểu sự điều hòa tổng hợp progesterone và estrogen, và hoạt động vào cuối thai kỳ cho phép chuyển dạ đủ tháng diễn ra, việc xác định các cơ chế phân tử đã gặp nhiều thách thức. Các mô hình động vật điển hình khác biệt đáng kể so với phụ nữ về sự điều hòa progesterone và estrogen liên quan đến việc khởi phát chuyển dạ, như đã được xem xét rộng rãi ở những nơi khác. Ở phụ nữ, progesterone huyết thanh lưu thông tăng trong suốt thai kỳ và không giảm khi bắt đầu chuyển dạ. Vào cuối thai kỳ, nồng độ estrogen cũng tăng, một mô hình được quan sát thấy ở hầu hết các loài. Nhiều giả thuyết khác nhau về các cơ chế “rút lui” progesterone chức năng ở phụ nữ đã được đưa ra, bao gồm sự thay đổi trong các isoform của thụ thể progesterone, các đồng yếu tố của thụ thể progesterone, sự biến đổi sau dịch mã của thụ thể progesterone, và tỷ lệ estrogen trên progesterone tăng, nhưng không có cơ chế nào được chứng minh một cách dứt khoát.
Trong hai thập kỷ qua, khả năng thu được những hiểu biết sâu sắc về cơ chế sinh lý của con người thông qua các kỹ thuật phân tích toàn bộ bộ gen không thiên vị đã tạo cơ hội làm sáng tỏ sự kiểm soát thời điểm sinh ở người. Việc thao túng thực nghiệm thai kỳ ở người là không thể chấp nhận được về mặt đạo đức, vì nó có thể gây hại cho mẹ hoặc thai nhi. Các nghiên cứu dựa trên kiểu gen ở mẹ và trẻ sơ sinh, cho dù tìm kiếm các biến thể phổ biến hay hiếm gặp, đều có khả năng tạo ra những khám phá mới về sự kiểm soát thời điểm sinh, bao gồm cả sự điều biến của các con đường tín hiệu nội tiết đã biết và việc xác định các con đường mới. Khả năng sử dụng thông tin kiểu gen từ mẹ, cha và con cái của họ để xác định các locus liên quan đến độ dài của thai kỳ, như một biến liên tục, hoặc nguy cơ sinh non, như một đặc điểm lưỡng phân (đủ tháng so với non tháng), là một chiến lược đặc biệt quan trọng, vì thai kỳ ở người đã phải thích ứng với một số hạn chế đặc trưng của loài để tối ưu hóa kết quả cho cả trẻ sơ sinh và bà mẹ.
Nghiên cứu di truyền và gen học của thai kỳ có một số thách thức cố hữu. Thách thức độc đáo nhất trong số này là khả năng thông tin điều hòa cư trú trong hai bộ gen riêng biệt nhưng có liên quan, của mẹ và của thai nhi. Hơn nữa, mặc dù các yếu tố di truyền ảnh hưởng đến thời điểm sinh và sinh non, thì một loạt các phơi nhiễm môi trường, chẳng hạn như nhiễm trùng, căng thẳng tâm lý xã hội, dinh dưỡng và các hành vi sức khỏe, cũng có tác động, có thể hoạt động thông qua các cơ chế và con đường tương tự hoặc khác nhau.
Bằng chứng phong phú đã tích lũy cho thấy các yếu tố di truyền, đặc biệt là ở người mẹ, góp phần xác định độ dài thai kỳ của thai kỳ ở người. Các nghiên cứu song sinh cổ điển, điều tra sự tương đồng về thời điểm sinh của con cái của các cặp song sinh giống hệt nhau so với các cặp song sinh khác trứng hoặc các anh chị em khác, đã cho thấy rằng các yếu tố di truyền của mẹ đóng góp 30% đến 40% sự thay đổi về thời điểm sinh, với ít ảnh hưởng từ bộ gen của cha. Các phát hiện phân tích phân ly dựa trên gia đình cũng đi đến một kết luận tương tự. Các nghiên cứu dịch tễ học rất lớn cũng kết luận rằng tính di truyền của nguy cơ sinh non nằm trong bộ gen của mẹ, hoạt động ở người mẹ hoặc thông tin được mẹ truyền cho thai nhi. Cần lưu ý rằng 60% đến 70% nguy cơ sinh non nằm ở các yếu tố môi trường, và các locus góp phần vào hội chứng phức tạp phổ biến này có khả năng đóng góp nguy cơ có kích thước hiệu ứng nhỏ (tỷ số chênh 1.10–1.25). Mặc dù những dữ liệu này ủng hộ tiện ích của một cách tiếp cận toàn bộ bộ gen, chúng báo hiệu rằng sẽ cần có các kích thước mẫu lớn để phát hiện các locus có ý nghĩa thống kê và liên quan đến thời điểm sinh ở mức độ toàn bộ bộ gen là P < 5 × 10–8.
Các nghiên cứu liên kết toàn bộ bộ gen
Các nghiên cứu đã khắc phục được hạn chế về kích thước mẫu không đủ để phát hiện kiểu hình không đồng nhất này với nhiều locus có kích thước hiệu ứng khiêm tốn. Những phát hiện mới quan trọng đã xuất hiện từ nghiên cứu, sử dụng một đoàn hệ khám phá lớn được tập hợp thông qua một công ty xác định kiểu gen trực tiếp cho người tiêu dùng bao gồm thông tin về thời gian mang thai trong một trong các cuộc khảo sát của họ, kết hợp với các đoàn hệ Bắc Âu được xác định kiểu hình cẩn thận về thời điểm sinh và sinh non tự phát.
Năm 2017, Zhang và các đồng nghiệp đã công bố nghiên cứu đầu tiên có đủ sức mạnh, được xác nhận và sao chép về bộ gen của mẹ, xác định được sáu locus đạt ý nghĩa thống kê trên toàn bộ bộ gen. Nghiên cứu này bao gồm khoảng 44.000 phụ nữ trong đoàn hệ khám phá và thêm 8.000 người trong đoàn hệ sao chép. Sức mạnh của các nghiên cứu liên kết toàn bộ bộ gen (GWAS) (genome-wide association studies) để khám phá di truyền học sinh non cuối cùng đã đạt đến tầm cỡ của các kiểu hình phức tạp phổ biến khác, chẳng hạn như đái tháo đường type 2, béo phì, tăng huyết áp, và các rối loạn chuyển hóa và tim mạch khác ở người lớn. Như có thể dự đoán, nhìn lại, các mối liên quan logic của các vùng gen này với thời gian mang thai là rõ ràng, nhưng trước đây chúng không phải là trọng tâm để phân tích có mục tiêu. Trong số sáu vùng được xác định—những vùng gần các gen EBF1, EEFSEC, AGTR2, WNT4, ADCY5, và RAP2C—bốn trong số này có những tác động tín hiệu nội tiết ngay lập tức.
AGTR2 mã hóa thụ thể angiotensin II type 2. Đáp ứng với hormone angiotensin 2, thụ thể này có liên quan đến sự phát triển và điều hòa tim mạch và do đó, là một ứng cử viên hợp lý để chứa các biến thể quyết định thời điểm sinh. Ngoài các tác động tim mạch đã biết, nội mạc tử cung điều hòa tăng biểu hiện AGTR2 vào cuối quá trình rụng màng. Các hành động cụ thể của nó tại thời điểm này chưa được biết, nhưng phát hiện—được xem xét trong bối cảnh các tác động của WNT4 sẽ được thảo luận—làm tăng tầm nhìn và tác động của nội mạc tử cung và quá trình rụng màng như là các yếu tố chính không chỉ trong việc khởi đầu thai kỳ, mà còn trong việc kết thúc thai kỳ.
WNT4 và con đường tín hiệu WNT là một phần của bộ công cụ thiết yếu của sự phát triển động vật có vú nói chung. Con đường tín hiệu cận tiết này tham gia nổi bật vào sự phát triển của đường sinh sản nữ, và cũng đóng một vai trò thiết yếu cho quá trình rụng màng thích hợp. Đa hình đơn nucleotide (SNP) được xác định trong nghiên cứu GWAS về thời điểm sinh nằm trong cùng một khối mất cân bằng liên kết với các SNP liên quan đến nguy cơ lạc nội mạc tử cung, một lần nữa cho thấy tầm quan trọng của tế bào mô đệm nội mạc tử cung. Các nghiên cứu chức năng của locus này đã tiết lộ một biến thể gây bệnh giả định trong alen không tham chiếu đã tạo ra một vị trí liên kết thụ thể estrogen mới. Ở đây, không phải là sự tạo ra estrogen dẫn đến sự thay đổi của con người về thời điểm sinh, mà là hành động của nó trên các mô đích có liên quan đến thai kỳ.
ADCY5 mã hóa một thành viên của họ adenylyl cyclase trước đây đã được liên kết với sự thay đổi về cân nặng khi sinh trong bộ gen của thai nhi. Tuy nhiên, vùng gen trong bộ gen của thai nhi không liên quan chặt chẽ với vùng được tiết lộ trong thời điểm sinh trong bộ gen của mẹ. Các adenylyl cyclase tạo ra cyclic adenosine monophosphate, đóng một vai trò quan trọng trong việc thúc đẩy sự giãn cơ tử cung. Các tín hiệu nội tiết kích hoạt ADCY5 trong thai kỳ, nếu có, chưa được xác định và cung cấp một con đường quan trọng cho nghiên cứu trong tương lai.
Có lẽ locus hấp dẫn nhất xuất hiện từ phân tích GWAS của mẹ là EEFSEC, mã hóa yếu tố kéo dài eukaryotic cho selenocysteine. Selenocysteine, “acid amin thứ 21”, được kết hợp vào một nhóm 25 selenoprotein của người bằng một bộ máy phân tử phức tạp xác định một codon dừng dịch mã thay vào đó là một vị trí chèn selenocysteine bởi các trình tự chèn selenocysteine liền kề. Các selenoprotein này có chức năng chống oxy hóa và chống viêm, và một lần nữa có thể góp phần thúc đẩy hoặc hạn chế các tín hiệu tăng cường sự co bóp của tử cung và chức năng của màng rụng. Ngoài ra, iodothyronine deiodinase là một selenoprotein, và hoạt động tuyến giáp bị thay đổi có thể ảnh hưởng đến sự co bóp của tử cung và thời điểm sinh. Có lẽ phù hợp nhất trong việc xác định locus này trong nguy cơ sinh non là vai trò tiềm tàng của chính selen, một vi chất dinh dưỡng thiết yếu, trong việc hình thành nguy cơ sinh non. Dữ liệu cho thấy rằng thiếu hụt selen có thể khiến phụ nữ có nguy cơ sinh non, với gợi ý rằng bổ sung selen ở những người thiếu selen có thể cải thiện kết quả thai kỳ của họ.
EBF1 cho thấy mối liên quan mạnh nhất với nguy cơ sinh non. Locus này cũng có liên quan đến cân nặng khi sinh trong bộ gen của mẹ, có khả năng là do ảnh hưởng của nó đối với thời gian mang thai. EBF1 mã hóa yếu tố tế bào B sớm 1 tham gia vào chức năng của tế bào B, gần đây đã được liên kết với nguy cơ sinh non, và cũng có liên quan đến một loạt các đặc điểm tim mạch và chuyển hóa có khả năng ảnh hưởng đến thời điểm sinh.
Cuối cùng, RAP2C, mã hóa protein liên quan đến RAS-2c và là một thành viên của họ oncogene RAS, được biểu hiện cao nhất trong tử cung trong số các mô được lập hồ sơ khác. Vai trò của nó vẫn cần được xác định.
Phân tích biến thể hiếm
GWAS được mô tả trước đó phân tích mối quan hệ của các biến thể gen phổ biến ở người với các kết quả thai kỳ bất lợi. Câu hỏi sau đó nảy sinh là liệu có tồn tại các đột biến hiếm, có độ xâm nhập cao hơn cũng có thể góp phần vào nguy cơ sinh non hay không. Các biến thể hiếm thường có thể được chia sẻ với các thành viên gia đình gần gũi và cung cấp một con đường bổ sung để giải trình tự bộ gen tiết lộ các locus mới liên quan đến thời điểm sinh. Cho đến nay, đã có rất ít các nghiên cứu về biến thể hiếm và thời điểm sinh dựa trên gia đình. Hallman và các đồng nghiệp đã sử dụng phân tích liên kết để xác định các biến thể xung quanh thụ thể IGF-1 với nguy cơ sinh non trong bộ gen của trẻ sơ sinh. Sau đó, McElroy và các đồng nghiệp đã tiết lộ một sự hiện diện quá mức của các biến thể liên quan đến các con đường đông máu và bổ thể với nguy cơ sinh non. Nghiên cứu biến thể hiếm lớn nhất cho đến nay, của Huusko và các đồng nghiệp, đã chứng minh một lần nữa tầm quan trọng của các biến thể tín hiệu steroid và đặc biệt tìm thấy nguy cơ chung xung quanh các biến thể trong HSPA1L, điều biến tín hiệu steroid. Cách tiếp cận giải trình tự thế hệ tiếp theo này cũng sẽ hữu ích để tiết lộ nhiều biến thể gây bệnh liên quan đến các kết quả thai kỳ bất lợi ngoài sinh non.
Ngẫu nhiên hóa Mendel và các con đường gây bệnh
Một con đường mới để điều tra các biến thể di truyền liên quan đến thời điểm sinh là áp dụng các phương pháp ngẫu nhiên hóa Mendel (Mendelian randomization) cho các kết quả thai kỳ. Cách tiếp cận này tìm cách xác định mối quan hệ nhân quả của các đặc điểm liên quan đến một kiểu hình cụ thể, trong trường hợp này là sinh non. Zhang và các đồng nghiệp đã báo cáo vào năm 2015 rằng chiều cao của mẹ có liên quan đến nguy cơ sinh non. Họ tiếp tục cho thấy rằng việc xây dựng một điểm số nguy cơ di truyền dựa trên các SNP liên quan đến chiều cao đã biết có thể dự đoán chiều cao của mẹ và thời gian mang thai. Điều hấp dẫn là, mặc dù việc truyền các alen thúc đẩy tăng trưởng đã xác định các thông số tăng trưởng của thai nhi từ mẹ sang thai nhi, thời gian mang thai bị ảnh hưởng mạnh nhất bởi các biến thể chiều cao không được truyền của mẹ, cho thấy rằng chiều cao của mẹ là một yếu tố nhân quả đối với nguy cơ sinh non và rằng lập trình di truyền của môi trường của mẹ định hình kết quả thai kỳ.
Bộ gen của thai nhi
Hầu hết các bằng chứng di truyền cho thấy rằng phần lớn nguy cơ di truyền đối với sinh non nằm trong bộ gen của mẹ. Nghiên cứu được đề cập trước đó của Hallman và các đồng nghiệp đã tiết lộ rằng locus IGF1R có ảnh hưởng chủ yếu của thai nhi đối với nguy cơ sinh non. Gần đây, một bản in trước của một GWAS về bộ gen của thai nhi đã được ký gửi, cho thấy locus gây viêm xung quanh gen IL-1 có liên quan đến nguy cơ sinh non ở thai nhi.
Mục tiêu rất hợp lý này được hỗ trợ bởi dữ liệu sinh hóa. Mặc dù bằng chứng cho vùng IL-1 là mạnh mẽ, cần lưu ý rằng trong đoàn hệ khoảng 80.000 trường hợp mang thai, chỉ có locus duy nhất này được chứng thực. Phát hiện này một lần nữa phù hợp với việc phần lớn nguy cơ sinh non nằm trong bộ gen của mẹ.
KẾT LUẬN
Mặc dù đã nhiều năm nghiên cứu mối quan hệ cộng sinh giữa mẹ và thai nhi, vẫn còn nhiều điều chúng ta chưa hiểu hết về thai kỳ và sinh nở. Về mặt nội tiết, estrogen và progesterone thiết lập, duy trì và kết thúc thai kỳ. Bằng cách nghiên cứu quá trình sinh nở ở các loài động vật khác, những thay đổi được tinh chỉnh bởi quá trình tiến hóa qua nhiều thế kỷ, và kiến thức di truyền mới, chúng ta có thể bắt đầu giải mã bí ẩn về nguyên nhân gây ra các biến chứng thai kỳ và điều gì kích hoạt việc sinh nở vào khoảng 40 tuần ở hầu hết phụ nữ và sớm hơn ở những người khác. Ví dụ, chúng ta biết vai trò của trục HPA của thai nhi và sự sụt giảm đột ngột của progesterone huyết thanh của mẹ mà cừu trải qua không được lặp lại ở phụ nữ. Trên thực tế, những thay đổi của progesterone trong quá trình sinh nở dường như đặc trưng cho từng loài. Tuy nhiên, chúng ta biết rằng, mặc dù có những vai trò khác nhau ở động vật và người, hormone và chức năng của chúng trong đối thoại chéo, cuộc chiến giằng co, hoặc sự điều biến tín hiệu giữa mẹ và thai nhi trong suốt thai kỳ ở người vẫn là một trọng tâm chính. Sự cân bằng phải được thiết lập trong thai kỳ giữa nhu cầu của người mẹ và nhu cầu của thai nhi, cân bằng các yêu cầu dinh dưỡng và những biến động hormone phải chịu đựng để có một thai kỳ khỏe mạnh và sinh nở đủ tháng.
Chúng ta cũng nhận ra tầm quan trọng của việc xem xét thai kỳ qua lăng kính tiến hóa: các tương tác hormone đã tiến hóa thông qua chọn lọc tự nhiên để tăng cơ hội mang thai thành công của người phụ nữ. Về mặt sinh lý, sự phát triển não bộ và việc đi bằng hai chân là những lý do rõ ràng một thai kỳ không nên kéo dài quá 40 tuần nếu không có nguy cơ em bé quá lớn để lọt qua ống sinh. Tuy nhiên, một số biến chứng, chẳng hạn như đái tháo đường thai kỳ, có thể là kết quả của sự không phù hợp giữa chế độ ăn uống và môi trường của tổ tiên và hiện đại của chúng ta. Và, trên thực tế, một số nhà nghiên cứu tin rằng sự chênh lệch này cũng có thể góp phần vào đại dịch béo phì ngày càng gia tăng.
Cuối cùng, khi chúng ta chuyển trọng tâm sang việc tìm hiểu sự đóng góp của bộ gen của mẹ và thai nhi (và sự đóng góp của người cha, mặc dù cho đến nay, điều đó dường như không có tác động), GWAS đã phát hiện ra bốn gen trong bộ gen của mẹ có những tác động tín hiệu nội tiết: AGTR2, WNT4, ADCY5, và EEFSEC. Phân tích biến thể hiếm và ngẫu nhiên hóa Mendel là hai công cụ khác mà các nhà nghiên cứu đang sử dụng để khám phá các con đường gây bệnh dẫn đến sinh non.
Sinh non là nguyên nhân hàng đầu gây tử vong ở trẻ sơ sinh trên toàn thế giới, thường ảnh hưởng đến những trẻ sơ sinh sống sót với cả đời các vấn đề sức khỏe tốn kém. Một số khu vực đô thị ở Hoa Kỳ có tỷ lệ sinh non cao hơn một số nước đang phát triển. Tỷ lệ tử vong mẹ—được Tổ chức Y tế Thế giới định nghĩa là cái chết của người mẹ trong vòng 42 ngày sau khi sinh—cũng là một mối quan tâm ngày càng tăng vì nhiều ca tử vong xảy ra do các nguyên nhân có thể phòng ngừa được, chẳng hạn như xuất huyết hoặc tiền sản giật. Việc chúng ta tiếp tục nỗ lực tìm hiểu các nguyên nhân gây ra các biến chứng thai kỳ và thời điểm chuyển dạ vẫn rất quan trọng. Với các công nghệ mới nổi và các nền tảng omics đa chiều, chưa bao giờ có cơ hội lớn hơn để nghiên cứu thai kỳ ở người một cách trực tiếp và làm sáng tỏ thêm các cơ chế.
Không có yếu tố nào trong số này có tác động lớn đến thời điểm sinh. Bằng chứng cho thấy thai kỳ kéo dài ở thai vô sọ và thiếu hụt sulfatase là sơ sài, và hầu hết các khiếm khuyết enzyme sinh steroid (aromatase của nhau thai và các enzyme thượng thận của thai nhi) không ảnh hưởng đến thời điểm sinh. Tiền sản giật có thể làm tăng nguy cơ sinh non thông qua các cơ chế gián tiếp liên quan đến căng thẳng của thai nhi/mẹ. Tuy nhiên, tất cả những điều này chỉ là suy đoán. Về tình trạng thiếu hụt aromatase của nhau thai, tác động chính là nam hóa thai nhi nữ và người mẹ.
BẢNG CHÚ GIẢI THUẬT NGỮ Y HỌC ANH VIỆT – CHƯƠNG 5
| STT | Thuật ngữ tiếng Anh | Phiên âm IPA | Nghĩa Tiếng Việt |
|---|---|---|---|
| 1 | Fetal-Maternal Endocrinology | /ˈfiːtəl məˈtɜːrnl ˌɛndoʊkrɪˈnɑːlədʒi/ | Nội tiết học Thai nhi-Mẹ |
| 2 | Parturition | /ˌpɑːrtjʊˈrɪʃən/ | Chuyển dạ |
| 3 | Symbiotic relationship | /ˌsɪmbaɪˈɒtɪk rɪˈleɪʃənʃɪp/ | Mối quan hệ cộng sinh |
| 4 | Fetal allograft | /ˈfiːtəl ˈæloʊɡræft/ | Mảnh ghép thai nhi |
| 5 | Implantation | /ˌɪmplænˈteɪʃən/ | Sự làm tổ |
| 6 | Endometrium | /ˌɛndoʊˈmiːtriəm/ | Nội mạc tử cung |
| 7 | Immunological rejection | /ˌɪmjʊnoʊˈlɒdʒɪkəl rɪˈdʒɛkʃən/ | Sự đào thải miễn dịch |
| 8 | Conceptus | /kənˈsɛptəs/ | Thai thể (phôi và các phần phụ) |
| 9 | Placenta | /pləˈsɛntə/ | Nhau thai |
| 10 | Hemochorial | /ˌhiːmoʊˈkɔːriəl/ | (Nhau thai) Máu mẹ tiếp xúc trực tiếp với màng đệm |
| 11 | Syncytiotrophoblast | /sɪnˌsɪʃioʊˈtroʊfəˌblæst/ | Hợp bào nuôi |
| 12 | Homeostasis | /ˌhoʊmiəˈsteɪsɪs/ | Cân bằng nội môi |
| 13 | Preeclampsia | /ˌpriːɪˈklæmpsiə/ | Tiền sản giật |
| 14 | Fetal growth restriction | /ˈfiːtəl ɡroʊθ rɪˈstrɪkʃən/ | Thai nhi chậm phát triển |
| 15 | Term (gestation) | /tɜːrm/ | Đủ tháng |
| 16 | Neonate | /ˈniːəˌneɪt/ | Trẻ sơ sinh |
| 17 | Preterm birth | /ˈpriːtɜːrm bɜːrθ/ | Sinh non |
| 18 | Reproductive fitness | /ˌriːprəˈdʌktɪv ˈfɪtnəs/ | Sự thích nghi sinh sản |
| 19 | Viviparous | /vɪˈvɪpərəs/ | Đẻ con |
| 20 | Gestational diabetes | /dʒɛˈsteɪʃənəl ˌdaɪəˈbiːtiːz/ | Đái tháo đường thai kỳ |
| 21 | Hypothalamic-pituitary-adrenal (HPA) axis | /ˌhaɪpoʊθəˈlæmɪk pɪˈtjuːɪtəri əˈdriːnəl ˈæksɪs/ | Trục dưới đồi-tuyến yên-thượng thận |
| 22 | Inflammation paradox | /ˌɪnfləˈmeɪʃən ˈpærədɒks/ | Nghịch lý viêm |
| 23 | Trophoblast | /ˈtroʊfəˌblæst/ | Nguyên bào nuôi |
| 24 | Spiral artery | /ˈspaɪrəl ˈɑːrtəri/ | Động mạch xoắn |
| 25 | Encephalization | /ɛnˌsɛfəlaɪˈzeɪʃən/ | Sự phát triển não bộ |
| 26 | Obligate bipedalism | /ˈɒblɪɡət ˌbaɪˈpiːdəlɪzəm/ | Di chuyển bằng hai chân bắt buộc |
| 27 | Cephalopelvic disproportion | /ˌsɛfəloʊˈpɛlvɪk ˌdɪsprəˈpɔːrʃən/ | Bất tương xứng đầu-chậu |
| 28 | Allometric analyses | /ˌæloʊˈmɛtrɪk əˈnæləsiːz/ | Phân tích allometric |
| 29 | Altricial | /ælˈtrɪʃəl/ | Non nớt, cần chăm sóc |
| 30 | Precocial | /prɪˈkoʊʃəl/ | Phát triển sớm |
| 31 | Luteal phase | /ˈluːtiəl feɪz/ | Giai đoạn hoàng thể |
| 32 | Progesterone | /proʊˈdʒɛstəroʊn/ | Progesterone |
| 33 | Corpus luteum (CL) | /ˈkɔːrpəs ˈluːtiəm/ | Thể vàng |
| 34 | Zygote | /ˈzaɪɡoʊt/ | Hợp tử |
| 35 | Zona pellucida | /ˈzoʊnə pəˈluːsɪdə/ | Màng trong suốt |
| 36 | Blastocele | /ˈblæstoʊˌsiːl/ | Khoang phôi nang |
| 37 | Blastocyst | /ˈblæstoʊˌsɪst/ | Phôi nang |
| 38 | Trophectoderm | /troʊˈfɛktəˌdɜːrm/ | Lá nuôi |
| 39 | Pinopodes | /ˈpɪnoʊˌpoʊdz/ | Pinopode |
| 40 | Decidualization | /dɪˌsɪdʒuəlaɪˈzeɪʃən/ | Phản ứng màng rụng |
| 41 | Cytotrophoblasts (CTBs) | /ˌsaɪtoʊˈtroʊfəˌblæsts/ | Tế bào nuôi |
| 42 | Lacunae | /ləˈkjuːniː/ | Hồ máu |
| 43 | Chorionic villi | /ˌkɔːriˈɒnɪk ˈvɪlaɪ/ | Nhung mao màng đệm |
| 44 | Semiallogeneic | /ˌsɛmiˌæloʊdʒəˈniːɪk/ | Bán dị ghép |
| 45 | Human leukocyte antigen (HLA)-G | /ˈhjuːmən ˈluːkəˌsaɪt ˈæntɪdʒən/ | Kháng nguyên bạch cầu người-G |
| 46 | Fas ligand | /fæs ˈlaɪɡənd/ | Phối tử Fas |
| 47 | Apoptosis | /ˌæpəpˈtoʊsɪs/ | Chết tế bào theo chương trình |
| 48 | Early pregnancy factor | /ˈɜːrli ˈprɛɡnənsi ˈfæktər/ | Yếu tố thai kỳ sớm |
| 49 | Progesterone-induced blocking factor | /proʊˈdʒɛstəroʊn ɪnˈdjuːst ˈblɒkɪŋ ˈfæktər/ | Yếu tố ngăn chặn do progesterone gây ra |
| 50 | Natural killer (NK) cell | /ˈnætʃərəl ˈkɪlər sɛl/ | Tế bào diệt tự nhiên |
| 51 | Transforming growth factor (TGF)-ß | /trænsˈfɔːrmɪŋ ɡroʊθ ˈfæktər ˈbeɪtə/ | Yếu tố tăng trưởng biến đổi-ß |
| 52 | Interleukin (IL) | /ˌɪntərˈluːkɪn/ | Interleukin |
| 53 | Chorionic gonadotropin (CG) | /ˌkɔːriˈɒnɪk ˌɡoʊnədoʊˈtroʊpɪn/ | Gonadotropin màng đệm |
| 54 | Extravillous trophoblasts (EVTs) | /ˌɛkstrəˈvɪləs ˈtroʊfəˌblæsts/ | Nguyên bào nuôi ngoài nhung mao |
| 55 | Innate lymphoid cells | /ɪˈneɪt ˈlɪmfɔɪd sɛlz/ | Tế bào lympho bẩm sinh |
| 56 | Decidual NK (dNK) cells | /dɪˈsɪdʒuəl ɛnˈkeɪ sɛlz/ | Tế bào NK màng rụng |
| 57 | Fetal programming | /ˈfiːtəl ˈproʊɡræmɪŋ/ | Lập trình của thai nhi |
| 58 | Prolactin-growth hormone (PRL-GH) family | /proʊˈlæktɪn ɡroʊθ ˈhɔːrmoʊn ˈfæməli/ | Họ Prolactin-Hormone tăng trưởng |
| 59 | Prolactin | /proʊˈlæktɪn/ | Prolactin |
| 60 | Placental lactogens | /pləˈsɛntəl ˈlæktoʊdʒənz/ | Lactogen nhau thai |
| 61 | Placenta growth hormone | /pləˈsɛntə ɡroʊθ ˈhɔːrmoʊn/ | Hormone tăng trưởng của nhau thai |
| 62 | Melatonin | /ˌmɛləˈtoʊnɪn/ | Melatonin |
| 63 | Serotonin | /ˌsɛrəˈtoʊnɪn/ | Serotonin |
| 64 | Thyrotropin-releasing hormone (TRH) | /ˌθaɪroʊˈtroʊpɪn rɪˈliːsɪŋ ˈhɔːrmoʊn/ | Hormone giải phóng thyrotropin |
| 65 | Kisspeptin | /kɪsˈpɛptɪn/ | Kisspeptin |
| 66 | Oxytocin | /ˌɒksɪˈtoʊsɪn/ | Oxytocin |
| 67 | Corticotropin-releasing hormone (CRH) | /ˌkɔːrtɪkoʊˈtroʊpɪn rɪˈliːsɪŋ ˈhɔːrmoʊn/ | Hormone giải phóng corticotropin |
| 68 | Prostaglandins (PGs) | /ˌprɒstəˈɡlændɪnz/ | Prostaglandin |
| 69 | Insulin-like growth factor (IGF)-1 | /ˈɪnsəlɪn-laɪk ɡroʊθ ˈfæktər wʌn/ | Yếu tố tăng trưởng giống insulin-1 |
| 70 | Insulin-like growth factor (IGF)-2 | /ˈɪnsəlɪn-laɪk ɡroʊθ ˈfæktər tuː/ | Yếu tố tăng trưởng giống insulin-2 |
| 71 | Vascular endothelial growth factor (VEGF) | /ˈvæskjələr ˌɛndoʊˈθiːliəl ɡroʊθ ˈfæktər/ | Yếu tố tăng trưởng nội mô mạch máu |
| 72 | Placental growth factor (PGF) | /pləˈsɛntəl ɡroʊθ ˈfæktər/ | Yếu tố tăng trưởng nhau thai |
| 73 | Soluble FMS-like tyrosine kinase (sFLT) | /ˈsɒljəbəl ɛf ɛm ɛs laɪk ˌtaɪroʊsiːn ˈkaɪneɪs/ | Tyrosine kinase giống FMS hòa tan |
| 74 | Fibroblast growth factor (FGF) | /ˈfaɪbroʊˌblæst ɡroʊθ ˈfæktər/ | Yếu tố tăng trưởng nguyên bào sợi |
| 75 | Placental mononuclear phagocytes | /pləˈsɛntəl ˌmɒnoʊˈnjuːkliər ˈfæɡəˌsaɪts/ | Đại thực bào đơn nhân của nhau thai |
| 76 | Hofbauer cells | /ˈhɔːfˌbaʊər sɛlz/ | Tế bào Hofbauer |
| 77 | Adipokines | /ˌædɪpoʊˈkaɪnz/ | Adipokine |
| 78 | Leptin | /ˈlɛptɪn/ | Leptin |
| 79 | Adiponectin | /ˌædɪpoʊˈnɛktɪn/ | Adiponectin |
| 80 | Resistin | /rɪˈzɪstɪn/ | Resistin |
| 81 | Ghrelin | /ˈɡrɛlɪn/ | Ghrelin |
| 82 | Visfatin | /ˈvɪsfətɪn/ | Visfatin |
| 83 | Endoglin (ENG) | /ˈɛndoʊɡlɪn/ | Endoglin |
| 84 | Activin | /ˈæktɪvɪn/ | Activin |
| 85 | Inhibin | /ɪnˈhɪbɪn/ | Inhibin |
| 86 | Follicle-stimulating hormone (FSH) | /ˈfɒlɪkəl ˈstɪmjəˌleɪtɪŋ ˈhɔːrmoʊn/ | Hormone kích thích nang trứng |
| 87 | Follistatin | /ˌfɒlɪˈstætɪn/ | Follistatin |
| 88 | Gonadotropin-releasing hormone (GnRH) | /ˌɡoʊnədoʊˈtroʊpɪn rɪˈliːsɪŋ ˈhɔːrmoʊn/ | Hormone giải phóng gonadotropin |
| 89 | Epidermal growth factors (EGFs) | /ˌɛpɪˈdɜːrməl ɡroʊθ ˈfæktərz/ | Yếu tố tăng trưởng biểu bì |
| 90 | Extracellular vesicles (EVs) | /ˌɛkstrəˈsɛljələr ˈvɛsɪkəlz/ | Túi ngoại bào |
| 91 | Exosomes | /ˈɛksoʊˌsoʊmz/ | Exosome |
| 92 | Microribonucleic acid (microRNAs) | /ˌmaɪkroʊˌraɪboʊnjuːˌkliːɪk ˈæsɪd/ | Acid microribonucleic |
| 93 | Cell-free deoxyribonucleic acid (cfDNA) | /sɛl-friː diːˌɒksɪˌraɪboʊnjuːˌkliːɪk ˈæsɪd/ | Acid deoxyribonucleic tự do |
| 94 | Cell-free messenger RNA (mRNA) | /sɛl-friː ˈmɛsɪndʒər ɑːr ɛn eɪ/ | RNA thông tin tự do |
| 95 | Median eminence | /ˈmiːdiən ˈɛmɪnəns/ | Lồi giữa |
| 96 | Rathke’s pouch | /ˈræθkiz paʊtʃ/ | Túi Rathke |
| 97 | Sella turcica | /ˈsɛlə ˈtɜːrsɪkə/ | Hố yên |
| 98 | Lactotropes | /ˈlæktoʊˌtroʊps/ | Tế bào tiết prolactin |
| 99 | Somatotropes | /soʊˈmætoʊˌtroʊps/ | Tế bào tiết GH |
| 100 | Corticotropes | /ˌkɔːrtɪkoʊˈtroʊps/ | Tế bào tiết corticotropin |
| 101 | Proopiomelanocortin (POMC) | /proʊˌoʊpi.oʊˌmɛlənoʊˈkɔːrtɪn/ | Proopiomelanocortin |
| 102 | Adrenocorticotropic hormone (ACTH) | /əˌdriːnoʊˌkɔːrtɪkoʊˈtroʊpɪk ˈhɔːrmoʊn/ | Hormone vỏ thượng thận |
| 103 | ß-lipotropin | /ˈbeɪtə ˌlaɪpoʊˈtroʊpɪn/ | ß-lipotropin |
| 104 | ß-endorphin | /ˈbeɪtə ɛnˈdɔːrfɪn/ | ß-endorphin |
| 105 | Thyrotropes | /ˈθaɪroʊˌtroʊps/ | Tế bào tiết TSH |
| 106 | Thyroid-stimulating hormone (TSH) | /ˈθaɪrɔɪd ˈstɪmjəˌleɪtɪŋ ˈhɔːrmoʊn/ | Hormone kích thích tuyến giáp |
| 107 | Gonadotropes | /ˌɡoʊnədoʊˈtroʊps/ | Tế bào tiết gonadotropin |
| 108 | Luteinizing hormone (LH) | /ˈluːtiəˌnaɪzɪŋ ˈhɔːrmoʊn/ | Hormone hoàng thể hóa |
| 109 | Aromatase | /əˈroʊməˌteɪs/ | Aromatase |
| 110 | 17ß hydroxysteroid dehydrogenase (17ßHSD) | /sɛvənˈtiːn ˈbeɪtə haɪˌdrɒksiˈstɪərɔɪd ˌdiːhaɪˈdrɒdʒəˌneɪs/ | 17ß hydroxysteroid dehydrogenase |
| 111 | 17α-hydroxylase/17,20-lyase | /sɛvənˈtiːn ˈælfə haɪˈdrɒksɪˌleɪs sɛvənˈtiːn ˈtwɛnti ˈlaɪeɪs/ | 17α-hydroxylase/17,20-lyase |
| 112 | Maternal-placental endocrine unit | /məˈtɜːrnl pləˈsɛntəl ˈɛndoʊkrɪn ˈjuːnɪt/ | Đơn vị nội tiết mẹ-nhau thai |
| 113 | Fetoplacental endocrine unit | /ˌfiːtoʊpləˈsɛntəl ˈɛndoʊkrɪn ˈjuːnɪt/ | Đơn vị nội tiết thai nhi-nhau thai |
| 114 | Pseudohermaphroditism | /ˌsuːdoʊhɜːrˈmæfrəˌdaɪtɪzəm/ | Lưỡng tính giả |
| 115 | Dehydroepiandrosterone (DHEA) | /diːˌhaɪdroʊˌɛpiænˈdrɒstəˌroʊn/ | Dehydroepiandrosterone |
| 116 | Fetal zone | /ˈfiːtəl zoʊn/ | Vùng thai nhi |
| 117 | Definitive zone | /dɪˈfɪnɪtɪv zoʊn/ | Vùng xác định |
| 118 | Transitional zone | /trænˈzɪʃənəl zoʊn/ | Vùng chuyển tiếp |
| 119 | Zona reticularis | /ˈzoʊnə rɪˌtɪkjəˈlɛərɪs/ | Lớp lưới |
| 120 | Zona fasciculata | /ˈzoʊnə fəˌsɪkjəˈlɑːtə/ | Lớp bó |
| 121 | Zona glomerulosa | /ˈzoʊnə ɡloʊˌmɛrjəˈloʊsə/ | Lớp cầu |
| 122 | Dehydroepiandrosterone sulfate (DHEA-S) | /diːˌhaɪdroʊˌɛpiænˈdrɒstəˌroʊn ˈsʌlfeɪt/ | Dehydroepiandrosterone sulfate |
| 123 | Steryl-sulfatase | /ˈstɛrɪl ˈsʌlfəˌteɪs/ | Steryl-sulfatase |
| 124 | 16-hydroxylase | /sɪksˈtiːn haɪˈdrɒksɪˌleɪs/ | 16-hydroxylase |
| 125 | 16-hydroxy-DHEA-S (16OH-DHEA-S) | /sɪksˈtiːn haɪˈdrɒksi diːˌhaɪdroʊˌɛpiænˈdrɒstəˌroʊn ˈsʌlfeɪt/ | 16-hydroxy-DHEA-S |
| 126 | Estriol | /ˈɛstriˌɒl/ | Estriol |
| 127 | Congenital adrenal hyperplasia (CAH) | /kənˈdʒɛnɪtəl əˈdriːnəl ˌhaɪpərˈpleɪʒə/ | Tăng sản tuyến thượng thận bẩm sinh |
| 128 | Salt wasting | /sɔːlt ˈweɪstɪŋ/ | Mất muối |
| 129 | Classic CAH | /ˈklæsɪk siː eɪ eɪtʃ/ | CAH cổ điển |
| 130 | Simple virilizing non-salt wasting CAH | /ˈsɪmpəl ˈvɪrəˌlaɪzɪŋ nɒn-sɔːlt ˈweɪstɪŋ siː eɪ eɪtʃ/ | CAH nam hóa đơn thuần không mất muối |
| 131 | Surfactant | /sərˈfæktənt/ | Surfactant |
| 132 | Androstenedione | /ˌændroʊˌstiːnˈdaɪoʊn/ | Androstenedione |
| 133 | 11ß-HSD-2 | /ɪˈlɛvən ˈbeɪtə eɪtʃ ɛs diː tuː/ | 11ß-HSD-2 |
| 134 | Cortisone | /ˈkɔːrtɪˌsoʊn/ | Cortisone |
| 135 | Labor | /ˈleɪbər/ | Chuyển dạ (quá trình) |
| 136 | Myometrium | /ˌmaɪoʊˈmiːtriəm/ | Cơ tử cung |
| 137 | Uterine cervix | /ˈjuːtəraɪn ˈsɜːrvɪks/ | Cổ tử cung |
| 138 | Uterotonic factors | /ˌjuːtəroʊˈtɒnɪk ˈfæktərz/ | Các yếu tố co bóp tử cung |
| 139 | Hemostasis | /ˌhiːmoʊˈsteɪsɪs/ | Cầm máu |
| 140 | Involution | /ˌɪnvəˈluːʃən/ | Sự co hồi |
| 141 | Endometrial regeneration | /ˌɛndoʊˈmiːtriəl riːˌdʒɛnəˈreɪʃən/ | Tái tạo nội mạc tử cung |
| 142 | Uterotropic effects | /ˌjuːtəroʊˈtroʊpɪk ɪˈfɛkts/ | Tác dụng nuôi dưỡng tử cung |
| 143 | Uterine quiescence | /ˈjuːtəraɪn kwaɪˈɛsəns/ | Sự yên tĩnh của tử cung |
| 144 | Functional progesterone withdrawal | /ˈfʌŋkʃənəl proʊˈdʒɛstəroʊn wɪðˈdrɔːəl/ | Sự rút lui progesterone chức năng |
| 145 | Mifepristone | /ˌmɪfɪˈprɪstoʊn/ | Mifepristone |
| 146 | Selective progesterone receptor modulator | /sɪˈlɛktɪv proʊˈdʒɛstəroʊn rɪˈsɛptər ˈmɒdʒəˌleɪtər/ | Chất điều biến thụ thể progesterone chọn lọc |
| 147 | Progesterone receptor (PR) | /proʊˈdʒɛstəroʊn rɪˈsɛptər/ | Thụ thể progesterone |
| 148 | Cis-elements | /sɪs ˈɛlɪmənts/ | Các yếu tố cis |
| 149 | Transcriptional coactivators | /trænˈskrɪpʃənəl ˌkoʊˈæktɪˌveɪtərz/ | Các đồng kích hoạt phiên mã |
| 150 | Posttranslational modifications | /poʊst-trænzˈleɪʃənəl ˌmɒdɪfɪˈkeɪʃənz/ | Các biến đổi sau dịch mã |
| 151 | Serine phosphorylation | /ˈsɛriːn ˌfɒsfɔːrɪˈleɪʃən/ | Phosphoryl hóa serine |
| 152 | Inflammatory load | /ɪnˈflæmətəri loʊd/ | Gánh nặng viêm |
| 153 | Protein kinase | /ˈproʊtiːn ˈkaɪneɪs/ | Protein kinase |
| 154 | 17-hydroxyprogesterone-caproate | /sɛvənˈtiːn haɪˈdrɒksiproʊˈdʒɛstəroʊn ˈkæproʊeɪt/ | 17-hydroxyprogesterone-caproate |
| 155 | Progestin prophylaxis | /proʊˈdʒɛstɪn ˌproʊfɪˈlæksɪs/ | Dự phòng bằng progestin |
| 156 | Genome-wide association studies (GWAS) | /ˈdʒiːnoʊm-waɪd əˌsoʊsiˈeɪʃən ˈstʌdiz/ | Các nghiên cứu liên kết toàn bộ bộ gen |
| 157 | Odds ratio (OR) | /ɒdz ˈreɪʃioʊ/ | Tỷ số chênh |
| 158 | Dizygotic twins | /ˌdaɪzaɪˈɡɒtɪk twɪnz/ | Song sinh khác trứng |
| 159 | Heritability | /ˌhɛrɪtəˈbɪləti/ | Tính di truyền |
| 160 | Angiotensin II type 2 receptor (AGTR2) | /ˌændʒioʊˈtɛnsɪn tuː taɪp tuː rɪˈsɛptər/ | Thụ thể angiotensin II type 2 |
| 161 | WNT signaling pathway | /dʌbəljuː ɛn tiː ˈsɪɡnəlɪŋ ˈpæθweɪ/ | Con đường tín hiệu WNT |
| 162 | Endometriosis | /ˌɛndoʊˌmiːtriˈoʊsɪs/ | Lạc nội mạc tử cung |
| 163 | Linkage disequilibrium | /ˈlɪŋkɪdʒ ˌdɪsˌiːkwɪˈlɪbriəm/ | Mất cân bằng liên kết |
| 164 | Estrogen receptor binding site | /ˈɛstrədʒən rɪˈsɛptər ˈbaɪndɪŋ saɪt/ | Vị trí liên kết thụ thể estrogen |
| 165 | Adenylyl cyclase (ADCY5) | /əˌdɛnɪˈlaɪleɪt ˈsaɪkleɪs/ | Adenylyl cyclase |
| 166 | Cyclic adenosine monophosphate | /ˈsaɪklɪk əˈdɛnəsiːn ˌmɒnoʊˈfɒsfeɪt/ | Cyclic adenosine monophosphate |
| 167 | Eukaryotic elongation factor for selenocysteine (EEFSEC) | /juːˌkæriˈɒtɪk iːˌlɒŋˈɡeɪʃən ˈfæktər fər ˌsɛlɪnoʊˈsɪstiːn/ | Yếu tố kéo dài eukaryotic cho selenocysteine |
| 168 | Selenocysteine | /ˌsɛlɪnoʊˈsɪstiːn/ | Selenocysteine |
| 169 | Selenoproteins | /ˌsɛlɪnoʊˈproʊtiːnz/ | Selenoprotein |
| 170 | Selenocysteine insertion sequences | /ˌsɛlɪnoʊˈsɪstiːn ɪnˈsɜːrʃən ˈsiːkwənsɪz/ | Trình tự chèn selenocysteine |
| 171 | Iodothyronine deiodinase | /aɪˌoʊdoʊˈθaɪroʊniːn diːˈaɪəˌdɪneɪs/ | Iodothyronine deiodinase |
| 172 | Selenium | /sɪˈliːniəm/ | Selen |
| 173 | Early B-cell factor 1 (EBF1) | /ˈɜːrli biː sɛl ˈfæktər wʌn/ | Yếu tố tế bào B sớm 1 |
| 174 | RAS-related protein-2c (RAP2C) | /ɑːr eɪ ɛs rɪˈleɪtɪd ˈproʊtiːn tuː siː/ | Protein liên quan đến RAS-2c |
| 175 | Linkage analysis | /ˈlɪŋkɪdʒ əˈnæləsɪs/ | Phân tích liên kết |
| 176 | Coagulation pathways | /koʊˌæɡjəˈleɪʃən ˈpæθweɪz/ | Các con đường đông máu |
| 177 | Complement pathways | /ˈkɒmplɪmənt ˈpæθweɪz/ | Các con đường bổ thể |
| 178 | Mendelian randomization | /mɛnˈdiːliən ˌrændəmaɪˈzeɪʃən/ | Ngẫu nhiên hóa Mendel |
| 179 | Genetic risk score | /dʒəˈnɛtɪk rɪsk skɔːr/ | Điểm số nguy cơ di truyền |
| 180 | Fetal genome | /ˈfiːtəl ˈdʒiːnoʊm/ | Bộ gen của thai nhi |
| 181 | Proinflammatory locus | /proʊ-ɪnˈflæmətəri ˈloʊkəs/ | Locus gây viêm |
| 182 | Interleukin-1 (IL-1) gene | /ˌɪntərˈluːkɪn wʌn dʒiːn/ | Gen Interleukin-1 |
| 183 | Maternal mortality | /məˈtɜːrnl mɔːrˈtæləti/ | Tỷ lệ tử vong mẹ |
| 184 | Hemorrhage | /ˈhɛmərɪdʒ/ | Xuất huyết |
| 185 | Omics platforms | /ˈoʊmɪks ˈplætfɔːrmz/ | Các nền tảng omics |
| 186 | Anencephaly | /ˌænɛnˈsɛfəli/ | Thai vô sọ |
| 187 | Sulfatase deficiency | /ˈsʌlfəˌteɪs dɪˈfɪʃənsi/ | Thiếu hụt sulfatase |
| 188 | Steroidogenic enzyme deficiencies | /ˌstɪərɔɪdoʊˈdʒɛnɪk ˈɛnzaɪm dɪˈfɪʃənsiz/ | Thiếu hụt enzyme sinh steroid |
| 189 | Virilize | /ˈvɪrəˌlaɪz/ | Nam hóa |
| 190 | Hominid | /ˈhɒmɪnɪd/ | Hominid (tông Người) |
| 191 | Uterine stroma | /ˈjuːtəraɪn ˈstroʊmə/ | Mô đệm tử cung |
| 192 | Myometrium | /ˌmaɪoʊˈmiːtriəm/ | Cơ tử cung |
| 193 | Chemokines | /ˈkiːmoʊˌkaɪnz/ | Chemokine |
| 194 | Growth factors | /ɡroʊθ ˈfæktərz/ | Các yếu tố tăng trưởng |
| 195 | Cell adhesion molecules | /sɛl ədˈhiːʒən ˈmɒlɪˌkjuːlz/ | Các phân tử kết dính tế bào |
| 196 | Decidua basalis | /dɪˈsɪdʒuə bəˈseɪlɪs/ | Màng rụng đáy |
| 197 | Umbilical cord | /ʌmˈbɪlɪkəl kɔːrd/ | Dây rốn |
| 198 | Glucocorticoids | /ˌɡluːkoʊˈkɔːrtɪˌkɔɪdz/ | Glucocorticoid |
| 199 | Mineralocorticoids | /ˌmɪnərəloʊˈkɔːrtɪˌkɔɪdz/ | Mineralocorticoid |
| 200 | Androgens | /ˈændroʊdʒənz/ | Androgen |
