Sperling Nội tiết học Nhi khoa, Ấn bản thứ 5 – Biên dịch: Ths.Bs. Lê Đình Sáng
Sperling Pediatric Endocrinology, Fifth Edition
Tác giả: Sperling, Mark A., MD – Nhà xuất bản: Elsevier Inc.
PHẦN I: CÁC NGUYÊN LÝ VÀ PHƯƠNG PHÁP CỦA NỘI TIẾT HỌC NHI KHOA
Chương 4. Xét nghiệm Nội tiết
Endocrinology Laboratory Testing
Jon Nakamoto – Sperling Pediatric Endocrinology, 4, 86-105
Giới thiệu
Điều gì tạo nên một người sử dụng phòng xét nghiệm lâm sàng hiệu quả?
Một người như vậy:
- Xác định được ít nhất một đồng minh thân thiện trong phòng xét nghiệm lâm sàng để có thể nhờ tư vấn về các xét nghiệm. Không ai trong chúng ta có thể là chuyên gia trong mọi lĩnh vực cần biết để chăm sóc bệnh nhân tốt nhất có thể, vì vậy, việc có một chuyên gia xét nghiệm như một thành viên đặc biệt trong đội ngũ chăm sóc sức khỏe nên là một thực hành tốt nhất cho tất cả các bác sĩ lâm sàng.
- Ít nhất cũng phần nào thông thạo ngôn ngữ của phòng xét nghiệm lâm sàng để giao tiếp dễ dàng hơn với các chuyên gia xét nghiệm, cũng như để hiểu các bài báo quan trọng được công bố trong y văn về xét nghiệm lâm sàng.
- Hiểu rằng xét nghiệm chẩn đoán, giống như phần lớn y học, là “đặt cược vào xác suất”, và có đủ nhận thức về lý thuyết xác suất và thống kê cơ bản để biết: (1) khi nào nên và không nên chỉ định xét nghiệm và (2) mức độ tin cậy vào một kết quả dương tính hoặc âm tính.
- Có cái nhìn sâu sắc về cách các xét nghiệm được thẩm định (vì mục đích chất lượng).
- Biết đủ về phương pháp xét nghiệm để quyết định xét nghiệm nào là phù hợp nhất cho bệnh nhân.
- Nhận thức được những hạn chế của xét nghiệm và các nguồn sai sót có thể xảy ra (nhiều trong số đó có thể xảy ra ngay cả trước khi mẫu được xét nghiệm).
- Chấp nhận thực tế rằng các phiên bản/bộ kit/nhãn hiệu khác nhau của cùng một xét nghiệm có thể cho kết quả khác nhau rõ rệt, và điều chỉnh chiến lược chẩn đoán cho phù hợp.
- Nhận ra những hạn chế và sự thiếu chính xác về mặt thống kê của tất cả các khoảng tham chiếu, đặc biệt là trong nhi khoa, và diễn giải kết quả một cách cẩn trọng với sự thiếu chính xác này trong tâm trí.
Sự hợp tác giữa bác sĩ lâm sàng và chuyên gia xét nghiệm
Ngay cả với một xét nghiệm có vẻ đơn giản như hormone kích thích tuyến giáp (TSH), mối quan hệ hợp tác giữa một bác sĩ nội tiết và một chuyên gia xét nghiệm lâm sàng có thể mang lại lợi ích cho cả hai bên. Một bác sĩ lâm sàng có kinh nghiệm có thể nhận thức rõ về nhịp sinh học đáng kể của hormone này nhưng có thể không biết về sự khác biệt đáng kể giữa các cá nhân về mức độ biến thiên hàng ngày, cũng như kết quả TSH có thể thay đổi như thế nào giữa các phương pháp xét nghiệm khác nhau. Ngược lại, chuyên gia xét nghiệm có thể rất quen thuộc với tần suất các kháng thể gây nhiễu có thể dẫn đến kết quả dương tính giả, nhưng có thể không nhận ra rằng việc thấy bệnh nhân suy giáp bẩm sinh ở tuổi vị thành niên có TSH cao và thyroxine tự do (T4) cao là phổ biến như thế nào do dùng liều gấp đôi vào phút cuối sau nhiều tháng không tuân thủ điều trị mạn tính. Một chuyên gia xét nghiệm lâm sàng có thể giải thích sự khác biệt giữa nhiễu kháng thể dị loài và nhiễu tự kháng thể TSH (chúng ta sẽ đề cập vấn đề này sau), và những phương pháp chẩn đoán nào là hợp lý nhất dựa trên kịch bản lâm sàng do bác sĩ lâm sàng đưa ra. Cần có sự cam kết về thời gian để sắp xếp các cuộc trao đổi thường xuyên giữa bác sĩ lâm sàng và chuyên gia xét nghiệm, nhưng không nghi ngờ gì nữa, bệnh nhân sẽ được hưởng lợi rất nhiều từ những gì các chuyên gia có thể dạy cho nhau.
Học cách nói (một phần) ngôn ngữ của phòng xét nghiệm
Ngôn ngữ được sử dụng trong phòng xét nghiệm lâm sàng có thể là một rào cản cho việc học hỏi. “Ngôn ngữ xét nghiệm” không hẳn là một ngoại ngữ nhưng đại diện cho một phương ngữ với nhiều thuật ngữ không quen thuộc với các bác sĩ lâm sàng. Hãy tưởng tượng cuộc trò chuyện sau:
Bác sĩ lâm sàng: “Kết quả xét nghiệm X trên bệnh nhân này có vẻ rất khác nhau giữa phòng xét nghiệm Y và phòng xét nghiệm của anh.” Chuyên gia xét nghiệm: “Tôi đồng ý với anh rằng hai kết quả này cho thấy sự khác biệt nhiều hơn so với những gì tôi mong đợi từ biến thiên phân tích và sinh học thông thường vì tổng sai số cho phép chỉ là 15% mặc dù chúng ta đang ở gần LOQ. QC của xét nghiệm có vẻ ổn, vì vậy chúng ta nên kiểm tra các vấn đề tiền phân tích tiềm ẩn và xem xét cả khả năng nhiễu kháng thể dị loài. Và hãy kiểm tra các nền tảng được sử dụng, vì các xét nghiệm cho chất phân tích này chắc chắn chưa được chuẩn hóa hoặc thậm chí chưa được hài hòa hóa cho đến nay.”
Mặc dù những người làm việc trong phòng xét nghiệm lâm sàng nên đủ tinh ý để tránh nói chuyện như thế này với một bác sĩ lâm sàng (đặc biệt là sử dụng các từ viết tắt như LOQ), đoạn văn trên hoàn toàn có thể xảy ra trong một cuộc trò chuyện giữa hai chuyên gia xét nghiệm, và trên thực tế có thể là cách ngắn gọn nhất để truyền đạt những điểm chính trong cuộc điều tra tiếp theo. Biết chỉ một vài thuật ngữ xét nghiệm thường được sử dụng trong Bảng 4.1 có thể giúp thu hẹp khoảng cách giao tiếp và chắc chắn sẽ giúp một bác sĩ lâm sàng hiểu rõ hơn các bài báo quan trọng trên một tạp chí hữu ích, chẳng hạn như Clinical Chemistry.
Bảng 4.1 Thuật ngữ Xét nghiệm Chọn lọc
| Thuật ngữ và/hoặc Khái niệm | Từ viết tắt liên quan | Phần liên quan |
|---|---|---|
| Mẫu con (Aliquot) | 2 | |
| Chất phân tích (Analyte) | 2 | |
| Chất chuẩn/Hiệu chuẩn (Calibrator/calibration) | 7 | |
| Nhiễm chéo (Carryover) | 4 | |
| Sắc ký (Chromatography) | LC, HPLC, UPLC | 5 |
| Xét nghiệm miễn dịch cạnh tranh (Competitive immunoassay) | RIA, EIA, CIA | 5 |
| Chiết tách (Extraction) | 5 | |
| Hài hòa hóa (Harmonization) | 7 | |
| Kháng thể dị loài (Heterophilic antibody) | HAMA, HAAA | 6 |
| Xét nghiệm miễn dịch đo lường (Immunometric assay) | IRMA, ICMA, IFMA, ELISA | 5 |
| Nhiễu (Interferences) | 6 | |
| Giới hạn định lượng (so với giới hạn phát hiện) (Limit of quantitation [vs. limit of detection]) | LOQ (so với LOD) | 4 |
| Tuyến tính (Linearity) | 4 | |
| Khối phổ (Mass spectrometry) | MS, GC-MS, LC-MS/MS | 5 |
| Nền mẫu (Matrix) | 4 | |
| So sánh phương pháp (Method comparison) | 4 | |
| Nền tảng (Platform) | 2 | |
| Giá trị dự báo dương tính (so với âm tính) (Positive [vs. negative] predictive value) | PPV (so với NPV) | 3 |
| Tiền phân tích (Preanalytical) | 6 | |
| Độ chính xác (Precision) | 4 | |
| Đường cong đặc tính hoạt động của máy thu (Receiver-operator characteristic curve) | Đường cong ROC | 3 |
| Độ thu hồi (Recovery) | 4 | |
| Khoảng báo cáo được (Reportable range) | 4 | |
| Độ nhạy & độ đặc hiệu (phân tích) (Sensitivity & specificity [analytical]) | 4 | |
| Độ nhạy & độ đặc hiệu (lâm sàng) (Sensitivity & specificity [clinical]) | 4 | |
| Độ ổn định (Stability) | 3 | |
| Chuẩn hóa (Standardization) | 4 | |
| Thẩm định (Phân tích) (Validation [Analytical]) | 7 |
CIA, Xét nghiệm miễn dịch cạnh tranh; ELISA, Xét nghiệm miễn dịch liên kết enzyme; EIA, Xét nghiệm miễn dịch enzyme; GC-MS, Sắc ký khí-khối phổ; ICMA, Xét nghiệm miễn dịch hóa phát quang; IFMA, Xét nghiệm miễn dịch huỳnh quang; IRMA, Xét nghiệm miễn dịch phóng xạ; LC, Sắc ký lỏng; HAAA, Kháng thể kháng động vật ở người; HAMA, Kháng thể kháng chuột ở người; HPLC, Sắc ký lỏng hiệu năng cao; MS, Khối phổ; RIA, Xét nghiệm miễn dịch phóng xạ; UPLC, Sắc ký lỏng hiệu năng siêu cao.
Nhiều thuật ngữ trong số này sẽ được định nghĩa trong các hộp thông tin bên lề ở phần thích hợp, nhưng có một vài thuật ngữ chung đáng được đề cập ngay lập tức:
- “Chất phân tích” (Analyte) là một từ rất phổ biến trong y học xét nghiệm, khái niệm đơn giản, nhưng lại không quen thuộc với hầu hết các bác sĩ lâm sàng. Đó là một thuật ngữ chung cho “thứ đang được đo lường/phân tích”. Cảm thấy thoải mái với từ này sẽ giúp bạn dễ dàng nói chuyện với phòng xét nghiệm và tìm hiểu các tài liệu xét nghiệm liên quan hơn nhiều.
- “Mẫu con” (Aliquot) là các phần nhỏ hơn của một mẫu, được chuẩn bị từ ống ban đầu, hay “ống mẹ”. Bạn có thể sử dụng một mẫu con để gửi đến một phòng xét nghiệm khác để đối chứng, hoặc sử dụng một “mẫu con mới” để lặp lại xét nghiệm, nếu bạn nghĩ rằng mẫu ban đầu có thể đã trải qua quá nhiều chu kỳ đông-rã đông, hoặc có khả năng bị nhiễm bẩn.
- “Nền tảng” (Platform) là một thuật ngữ chung, mặc dù hơi mơ hồ, thường được sử dụng nhất để mô tả nhà sản xuất và kiểu máy của các thiết bị xét nghiệm tự động, ví dụ, Beckman Access so với Roche Elecsys. Tại sao điều này lại quan trọng đối với bác sĩ lâm sàng? Bởi vì các nền tảng khác nhau về đặc tính hoạt động và khả năng bị nhiễu. Chúng ta sẽ thấy sau này rằng việc so sánh kết quả của cùng một mẫu trên hai nền tảng khác nhau đôi khi là cách nhanh nhất để điều tra một số loại nhiễu. Một bác sĩ lâm sàng đối mặt với một kết quả bất ngờ phải đủ nhận thức để hỏi phòng xét nghiệm xem họ có thể đối chứng kết quả đó “trên một nền tảng khác” khi thích hợp hay không.
Thống kê xét nghiệm: những kiến thức cơ bản về chẩn đoán dựa trên bằng chứng
Thống kê sinh học và dịch tễ học thường được giảng dạy trong những năm đầu tiền lâm sàng của quá trình đào tạo, khi sinh viên đang khao khát tích lũy kinh nghiệm lâm sàng, và đôi khi coi thường những gì có vẻ như là những môn học lý thuyết suông. Tuy nhiên, cả các bác sĩ lâm sàng có kinh nghiệm và những người tham gia nghiên cứu lâm sàng đều nhanh chóng nhận ra tầm quan trọng của việc có ít nhất một nhận thức cơ bản về thống kê y học để tránh mắc phải những sai lầm đáng kể trong các quyết định chẩn đoán hoặc điều trị.
Nếu bạn gọi cho phòng xét nghiệm của mình để hỏi về độ nhạy và độ đặc hiệu của một xét nghiệm, bạn sẽ được hỏi liệu bạn muốn “độ nhạy và độ đặc hiệu lâm sàng” (được đề cập ở đây) hay “độ nhạy và độ đặc hiệu phân tích” hoàn toàn khác (được thảo luận trong phần phương pháp luận/thẩm định sau). Phòng xét nghiệm lâm sàng chắc chắn sẽ có dữ liệu về loại sau, nhưng có lẽ chỉ có các nghiên cứu hạn chế cho loại trước, vì việc thiết lập độ nhạy và độ đặc hiệu lâm sàng thường đòi hỏi các nghiên cứu lâm sàng quan trọng vượt quá khả năng của phòng xét nghiệm lâm sàng.
- “Độ nhạy lâm sàng” (Clinical sensitivity) là tần suất xét nghiệm sẽ dương tính ở một bệnh nhân mắc bệnh đang được xét nghiệm. Một mẹo ghi nhớ tuyệt vời (hữu ích cho các kỳ thi) là nghĩ đến từ viết tắt của “positive in disease” (dương tính khi có bệnh) là “PID” và xem xét tầm quan trọng của việc “nhạy cảm” (sensitive) khi bạn có một bệnh nhân bị PID lâm sàng (bệnh viêm vùng chậu).
- “Độ đặc hiệu lâm sàng” (Clinical specificity) là tần suất xét nghiệm sẽ âm tính ở một bệnh nhân “khỏe mạnh” (ít nhất, người không mắc bệnh đang được xét nghiệm). Mẹo ghi nhớ trong trường hợp này là “negative in health” (âm tính khi khỏe mạnh), hay “NIH”—hãy xem xét tầm quan trọng của việc phải rất “cụ thể” (specific) khi viết một đề xuất tài trợ cho NIH (Viện Y tế Quốc gia).
Có lẽ phù hợp hơn với thực hành lâm sàng là hiểu các khái niệm về “giá trị dự báo dương tính” (PPV) và “giá trị dự báo âm tính” (NPV)
- PPV là xác suất mắc bệnh ở một bệnh nhân có kết quả xét nghiệm dương tính.
- NPV là xác suất “khỏe mạnh” (không mắc bệnh) ở một bệnh nhân có kết quả xét nghiệm âm tính.
Cả NPV và PPV đều bị ảnh hưởng bởi tỷ lệ hiện mắc của bệnh, hay chính xác hơn, bởi xác suất mà bệnh nhân đang được đề cập mắc bệnh (“xác suất tiền xét nghiệm”). Hình 4.1 tóm tắt định nghĩa của các thuật ngữ này, trong khi Hình 4.2 minh họa ảnh hưởng đáng kể của việc tăng xác suất tiền xét nghiệm đối với PPV của một xét nghiệm chẩn đoán, điều này minh chứng cho tầm quan trọng của việc hỏi bệnh sử và khám thực thể kỹ lưỡng trước khi quyết định chỉ định xét nghiệm. Cách tốt nhất để cải thiện hiệu quả của xét nghiệm chẩn đoán là chắc chắn nhất có thể về chẩn đoán ngay cả trước khi chỉ định xét nghiệm!

Hình 4.1 Định nghĩa các thống kê cơ bản của xét nghiệm chẩn đoán.
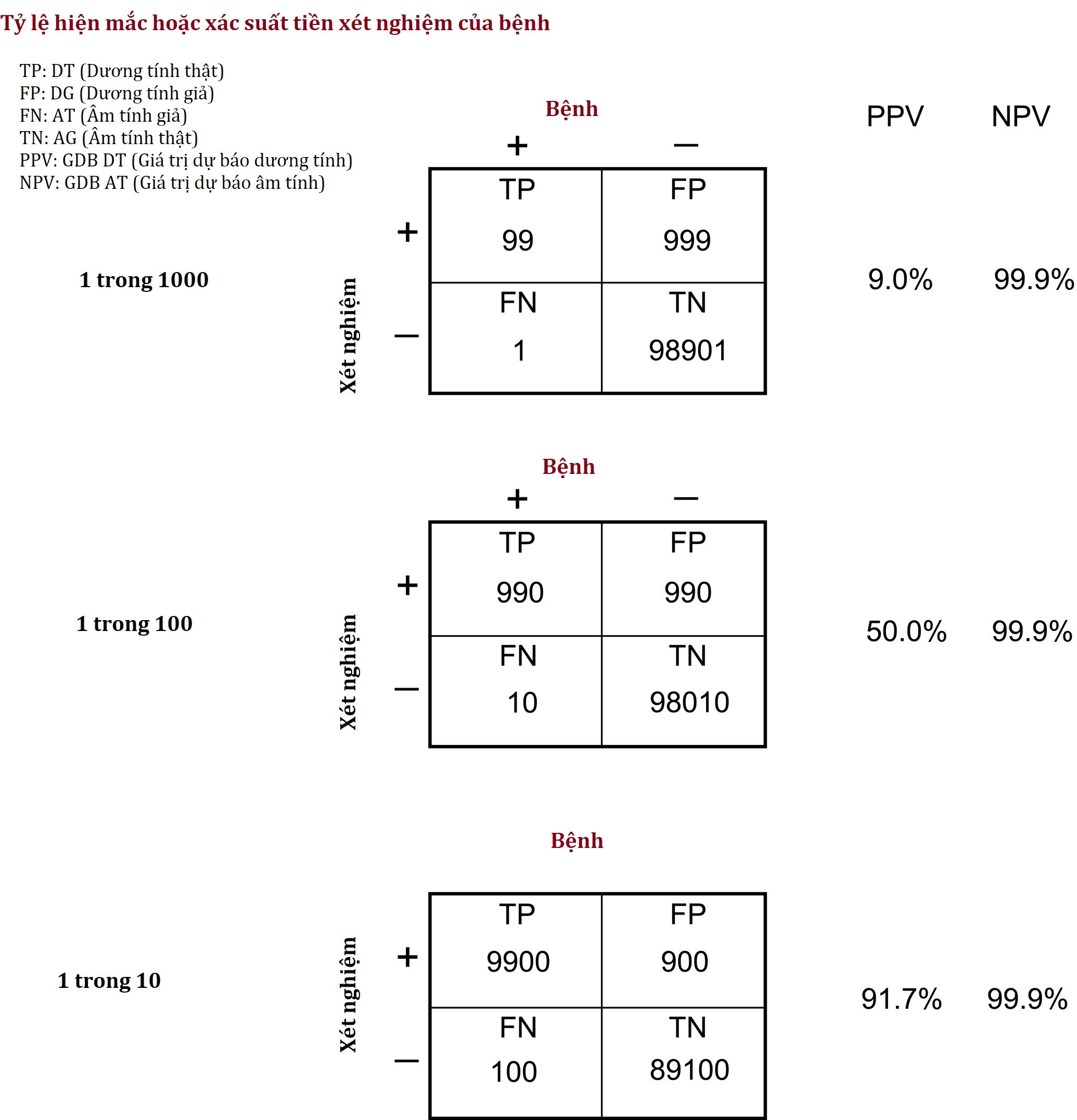
Hình 4.2 Ảnh hưởng của tỷ lệ hiện mắc bệnh/xác suất tiền xét nghiệm lên giá trị dự báo dương tính (PPV) và âm tính (NPV), sử dụng một xét nghiệm có độ nhạy lâm sàng 99% và độ đặc hiệu lâm sàng 99%. Các con số trong ô đại diện cho sự phân bố của 100.000 bệnh nhân giữa dương tính thật (TP), dương tính giả (FP), âm tính giả (FN) và âm tính thật (TN).
Trong thực hành lâm sàng, hầu hết các xét nghiệm nội tiết cho kết quả liên tục thay vì “có/không” và do đó hiếm khi được sử dụng như các xét nghiệm dương tính/âm tính nghiêm ngặt. TSH là 6,0 mU/L hay 60 mU/L đều là “dương tính”, nhưng không có giá trị nào sẽ được sử dụng làm ngưỡng chẩn đoán cho chẩn đoán suy giáp nguyên phát. Sử dụng TSH 6,0 mU/L sẽ đảm bảo rằng gần như tất cả bệnh nhân suy giáp nguyên phát đều được phát hiện (độ nhạy tối đa) nhưng phải trả giá bằng nhiều trường hợp âm tính giả (độ đặc hiệu rất kém) và các lượt giới thiệu không cần thiết đến phòng khám nội tiết. Mặt khác, sử dụng ngưỡng 60 mU/L sẽ giảm thiểu số lượng âm tính giả (độ đặc hiệu tuyệt vời) nhưng phải trả giá bằng việc bỏ sót nhiều trường hợp suy giáp nguyên phát thực sự (độ nhạy thấp không thể chấp nhận được về mặt lâm sàng). Việc lựa chọn một ngưỡng cắt đâu đó giữa hai thái cực này nên được xác định bởi kịch bản lâm sàng (ví dụ, có thể thấp hơn ở một trẻ 14 tháng tuổi so với một trẻ vị thành niên 13 tuổi béo phì nhưng khỏe mạnh) thay vì một ngưỡng phổ quát tùy tiện.
Đối với các xét nghiệm tạo ra kết quả liên tục, hiệu quả chẩn đoán tổng thể của một xét nghiệm cũng có thể được đánh giá bằng cách vẽ biểu đồ tỷ lệ dương tính thật so với tỷ lệ dương tính giả, tạo ra một đường cong đặc tính hoạt động của máy thu (đường cong ROC).
- Một đường cong ROC vẽ biểu đồ, cho các kết quả xét nghiệm khác nhau, tỷ lệ dương tính thật (độ nhạy lâm sàng) của một xét nghiệm trên trục y so với tỷ lệ dương tính giả (1 – độ đặc hiệu lâm sàng) trên trục x (Hình 4.3). Diện tích dưới đường cong (AUC) có thể được sử dụng để ước tính khả năng của xét nghiệm trong việc phân biệt bệnh và không bệnh, với AUC là 0,50 cho thấy một xét nghiệm không có giá trị chẩn đoán, một xét nghiệm có AUC từ 0,90 trở lên thường được coi là xuất sắc, và một xét nghiệm có AUC là 0,70 được coi là một xét nghiệm chẩn đoán khá.
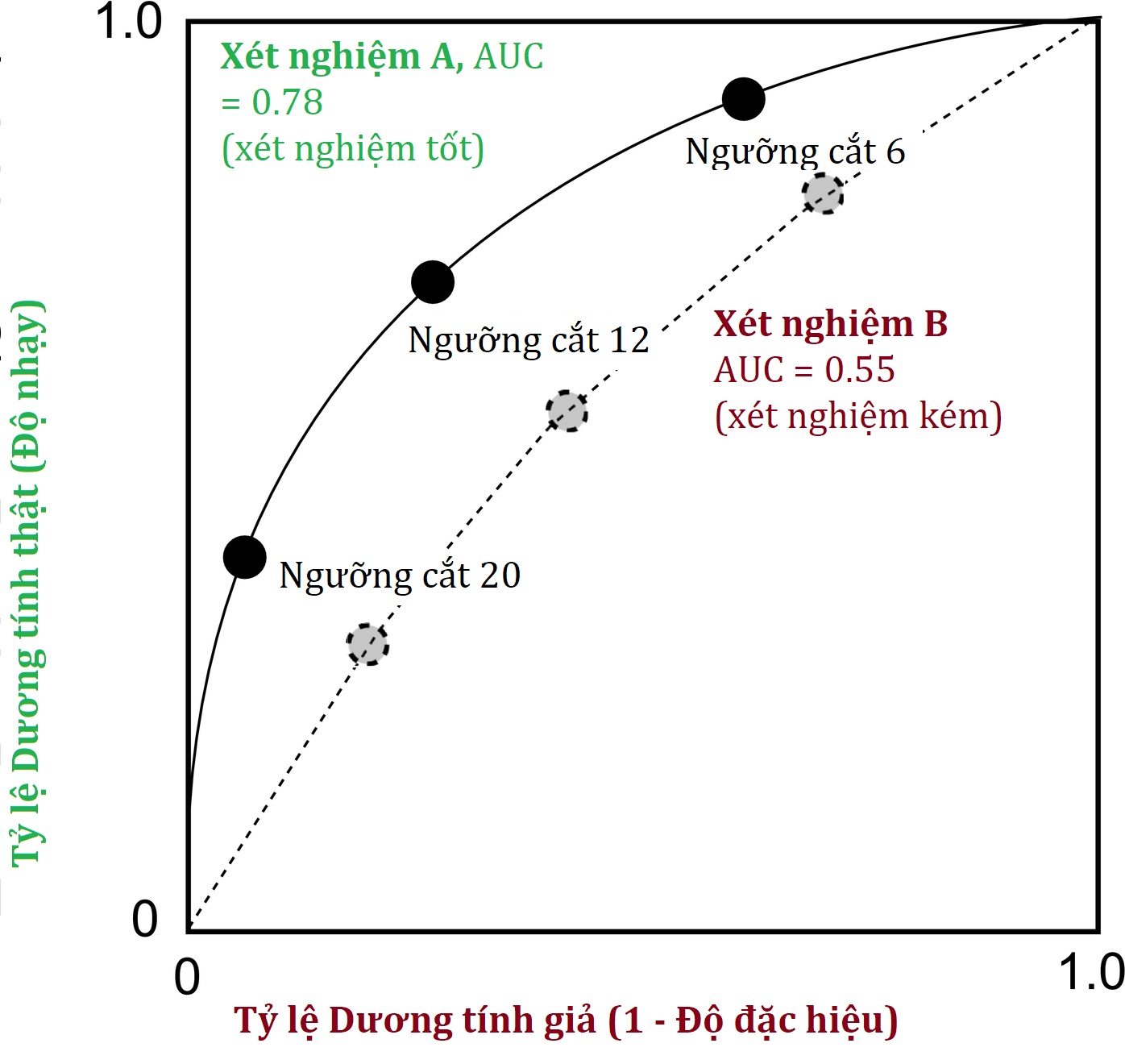
Hình 4.3 Đường cong đặc tính hoạt động của máy thu cho hai xét nghiệm chẩn đoán lý thuyết.
Hai lưu ý quan trọng đối với chẩn đoán dựa trên bằng chứng: (1) Việc tính toán độ nhạy và độ đặc hiệu lâm sàng cho một xét nghiệm chẩn đoán phụ thuộc vào định nghĩa rõ ràng về ai mắc bệnh đang xét và ai không. Nếu không có xét nghiệm chẩn đoán tiêu chuẩn vàng để so sánh, hoặc nếu định nghĩa về bệnh tiến triển và trở nên kém rõ ràng hơn theo thời gian (ví dụ, các định nghĩa ban đầu về thiếu hụt hormone tăng trưởng [GHD] nặng/đã được chứng minh về mặt giải phẫu so với các trường hợp GHD sau này, được xác định kém rõ ràng hơn), các định nghĩa về độ nhạy và độ đặc hiệu có thể chỉ là ước chừng ở mức tốt nhất. (2) Việc tính toán độ nhạy, độ đặc hiệu, và tỷ lệ dương tính hoặc âm tính thật và giả sẽ thay đổi tùy thuộc vào bản chất của quần thể được nghiên cứu. Ví dụ, một xét nghiệm chẩn đoán rất tốt được áp dụng trên toàn bộ dân số Hoa Kỳ sẽ có tỷ lệ dương tính giả cao hơn nhiều (như thấy với các xét nghiệm sàng lọc) so với cùng một xét nghiệm được áp dụng cho một nhóm bệnh nhân được lựa chọn cẩn thận, những người được cho là có khả năng mắc bệnh dựa trên bệnh sử và khám thực thể. Điều này một lần nữa nhấn mạnh sự cần thiết phải tăng xác suất tiền xét nghiệm của bệnh càng nhiều càng tốt trước khi chỉ định bất kỳ xét nghiệm chẩn đoán nào.
Thẩm định phương pháp phân tích
Tình huống lâm sàng 1
Một nhà nghiên cứu vô tình chạy hai ống không chứa gì ngoài nước trên một xét nghiệm miễn dịch phóng xạ (RIA) peptide cổ điển và bối rối khi kết quả cho thấy một nồng độ peptide đáng kể trong các ống này.
Tình huống lâm sàng 2
Một phòng xét nghiệm từ chối chạy một xét nghiệm miễn dịch dấu ấn ung thư được chỉ định trên dịch nang nhớt vì thiếu dữ liệu thẩm định phân tích nhưng đã nhượng bộ khi bác sĩ yêu cầu phòng xét nghiệm chạy mẫu với một tuyên bố miễn trừ trách nhiệm “loại mẫu không được thẩm định; diễn giải một cách thận trọng.” Mặc dù có tuyên bố miễn trừ trách nhiệm, cả phòng xét nghiệm và bác sĩ lâm sàng sau đó đều bị kiện thành công vì chẩn đoán không phù hợp và điều trị không cần thiết dựa trên một kết quả dương tính giả.
Cả hai tình huống lâm sàng ngắn gọn này đều minh họa tại sao các cơ quan quản lý và bất kỳ ai quan tâm đến chất lượng xét nghiệm đều nhấn mạnh tầm quan trọng của việc thẩm định phương pháp phân tích. Một xét nghiệm RIA peptide có thể cho kết quả chính xác trong huyết thanh, nhưng hoàn toàn không chính xác trong một chất lỏng không có protein; có lẽ chất đánh dấu (Xem Phương pháp luận: Xét nghiệm miễn dịch ở trang 91) trong tình huống 1 đã dính vào thành ống nhựa, dẫn đến giảm liên kết chất đánh dấu và một nồng độ peptide có vẻ phát hiện được trong khi thực tế không có. Tình huống 2 đại diện cho một trường hợp chẩn đoán sai; độ nhớt của dung dịch có thể đã ảnh hưởng đến sự tương tác của các thành phần xét nghiệm, với tác động đáng kể đến bệnh nhân và hậu quả pháp lý cho tất cả các bên liên quan.
Thẩm định phương pháp phân tích nhằm đảm bảo rằng một phương pháp xét nghiệm là chính xác cho mục đích sử dụng dự kiến của nó. Các thành phần của một cuộc thẩm định phân tích bao gồm: (1) tuyến tính/khoảng báo cáo được; (2) độ chính xác; (3) độ nhạy phân tích; (4) độ đặc hiệu phân tích, nhiễu, và độ thu hồi; (5) độ đúng/so sánh phương pháp; (6) các loại mẫu và hiệu ứng nền mẫu; (7) độ ổn định; và (8) nhiễm chéo. Việc xác định các khoảng tham chiếu là một phần quan trọng của nhiều cuộc thẩm định phân tích và giao thoa với thẩm định lâm sàng. Lưu ý rằng mặc dù không phải tất cả các thành phần này luôn được yêu cầu từ quan điểm pháp lý, tất cả đều đại diện cho thực hành xét nghiệm chất lượng tốt.
Tuyến tính/Khoảng báo cáo được
Còn được gọi là khoảng đo lường phân tích (AMR), đây là khoảng nồng độ mà xét nghiệm được biết là đáng tin cậy. Các mẫu chuẩn có nồng độ đã biết (chất chuẩn) được xét nghiệm và vẽ biểu đồ so với tín hiệu được tạo ra trong xét nghiệm. Đối với nghiên cứu giả định được trình bày trong Hình 4.4, giới hạn trên của AMR có khả năng là ở nồng độ được đại diện bởi chất chuẩn D, vì nồng độ cao hơn được đại diện bởi chất chuẩn E không dẫn đến mức độ tăng tín hiệu tương tự. Tuy nhiên, có thể pha loãng mẫu để có thể thực hiện phép đo trong phạm vi AMR, do đó cho phép xét nghiệm các nồng độ trên giới hạn trên của AMR. Việc lựa chọn chất chuẩn có thể làm thay đổi giá trị tuyệt đối được báo cáo, đặc biệt với peptide và protein nơi mà chất chuẩn chỉ có thể đại diện cho một trong một hỗn hợp các dạng được biến đổi khác nhau (ví dụ, glycosyl hóa hoặc bị cắt) có trong tuần hoàn.
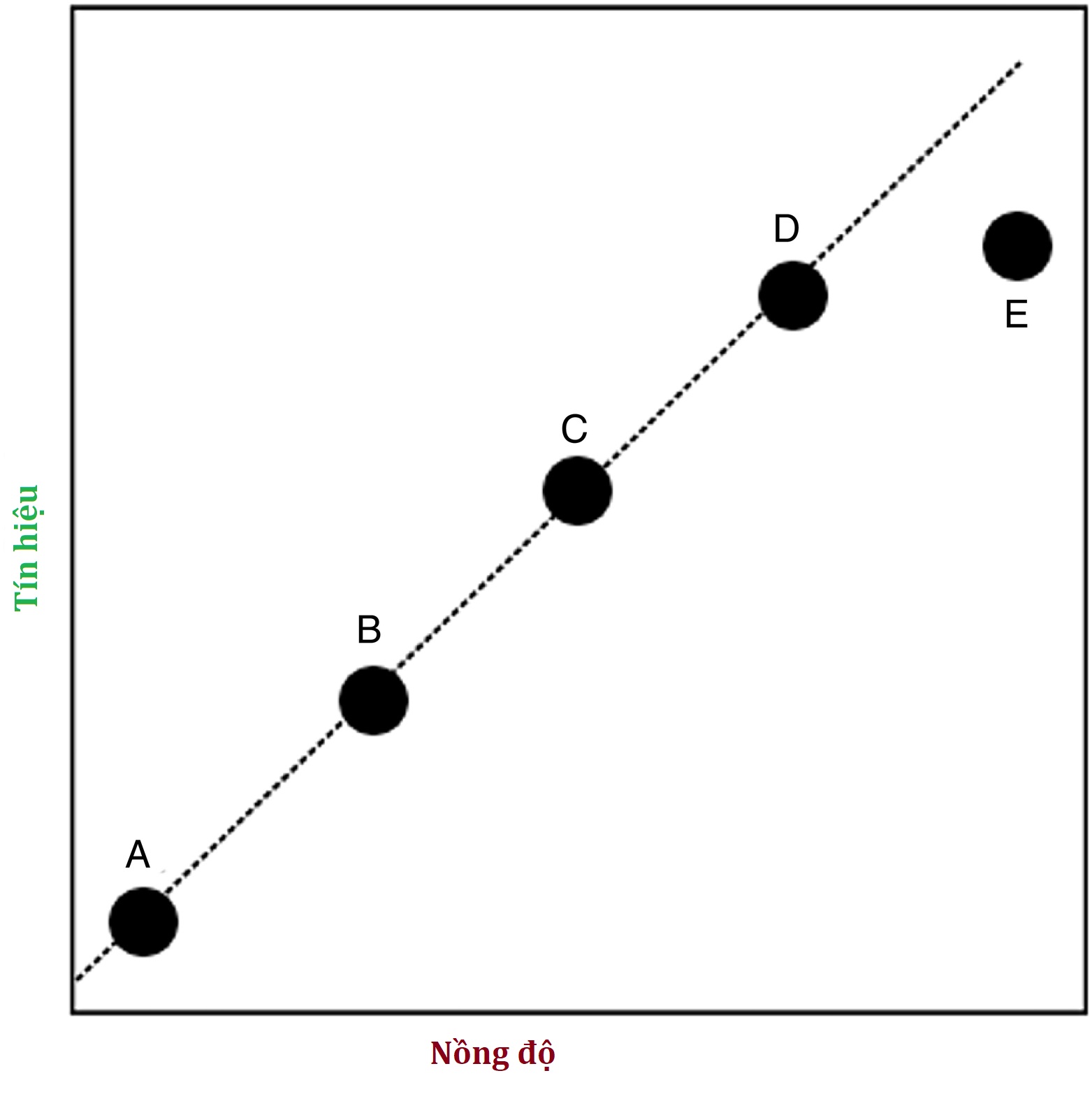
Hình 4.4 Nghiên cứu tuyến tính được sử dụng để xác định khoảng đo lường phân tích (AMR). Các nồng độ được biểu thị bằng các điểm A và D đại diện cho các nồng độ tối thiểu và tối đa có thể có của AMR. Các nồng độ cao hơn, chẳng hạn như nồng độ được biểu thị bằng điểm E, vẫn có thể được đo nếu mẫu có thể được pha loãng để đưa nồng độ vào trong AMR, với điều kiện các nghiên cứu trước đó đã chứng minh rằng phản ứng vẫn tuyến tính khi thực hiện pha loãng.
Độ chính xác
Còn được gọi là khả năng tái lập hoặc khả năng lặp lại, điều này xác định liệu sai số ngẫu nhiên của xét nghiệm có đủ nhỏ để làm cho xét nghiệm hữu ích về mặt lâm sàng hay không. Một phép loại suy thường được sử dụng là của người bắn súng mục tiêu: các lỗ đạn gần nhau đến mức nào? Lưu ý rằng độ chính xác khác với độ đúng (một phần khác của nghiên cứu thẩm định); độ chính xác chỉ đề cập đến việc các phát bắn có gần nhau hay không, chứ không phải liệu chúng có thực sự trúng tâm hay không. Cả độ chính xác nội xét nghiệm (ví dụ, 20 phép đo được thực hiện trong cùng một lần chạy xét nghiệm) và độ chính xác liên xét nghiệm (1 phép đo được thực hiện hàng ngày trong 20 ngày) đều được nghiên cứu và độ lệch chuẩn (SD) của các phép đo lặp lại được tính toán. Nói chung, độ chính xác được trình bày dưới dạng hệ số biến thiên (CV), là SD chia cho giá trị trung bình, được biểu thị bằng phần trăm. Ví dụ, tại giá trị trung bình là 100 ng/mL, một xét nghiệm có SD là 5 ng/mL sẽ có CV là 5%. Lưu ý rằng nồng độ của chất phân tích ảnh hưởng đến độ chính xác của xét nghiệm vì giá trị CV có xu hướng cao hơn ở cả hai giới hạn của AMR (Hình 4.5).
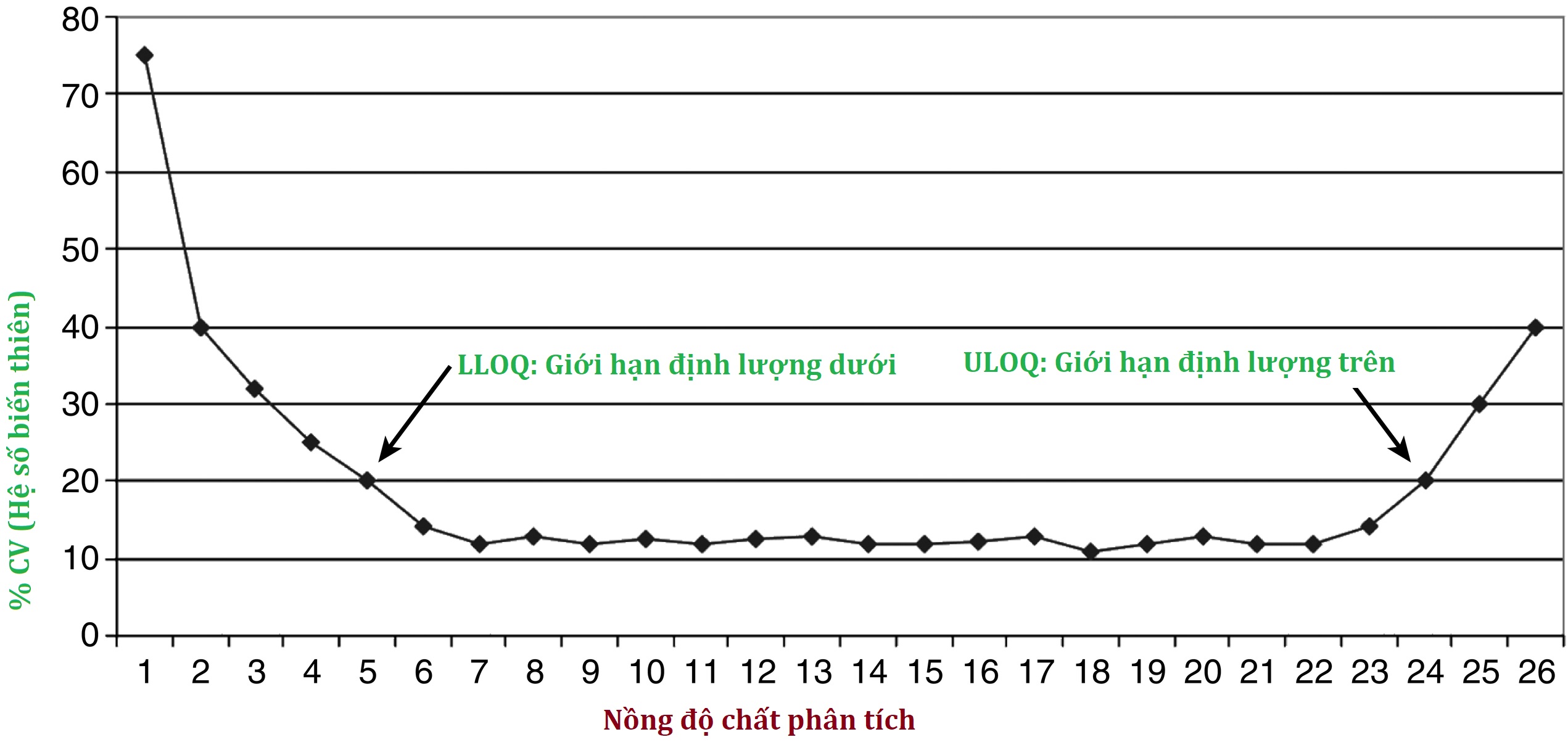
Hình 4.5 Sử dụng biểu đồ độ chính xác để xác định giới hạn định lượng dưới (LLOQ) và trên (ULOQ), dựa trên độ chính xác liên xét nghiệm có thể chấp nhận được (thường được đặt ở hệ số biến thiên [CV] từ 20% trở xuống).
Độ nhạy phân tích
Phần này của một nghiên cứu thẩm định xác định nồng độ chất phân tích thấp nhất có thể được đo với độ chính xác chấp nhận được. Nó khác với độ nhạy lâm sàng (tần suất một kết quả dương tính ở bệnh nhân có bệnh), là một phần chung của một nghiên cứu thẩm định lâm sàng được thực hiện sau khi thẩm định phân tích đã hoàn thành. Một vấn đề thường gặp là việc sử dụng nhiều thuật ngữ khác nhau cho độ nhạy phân tích, ví dụ, nồng độ phát hiện tối thiểu, giới hạn phát hiện (LOD), giới hạn của mẫu trắng, hoặc giới hạn không có, tất cả đều mô tả nồng độ thấp nhất có thể có thể được phân biệt một cách tự tin với zero. Mặc dù một nhà phát triển xét nghiệm có thể trích dẫn LOD để làm cho xét nghiệm trông nhạy nhất có thể, bác sĩ lâm sàng nên nhận ra rằng các giá trị gần LOD rất biến thiên và không thực sự định lượng được. Một giới hạn độ nhạy phân tích thận trọng và hữu ích hơn về mặt lâm sàng là giới hạn định lượng (LOQ), còn được gọi là độ nhạy chức năng và thường được định nghĩa là nồng độ thấp nhất có thể được đo với CV dưới 20%. Ngay cả mức độ biến thiên này cũng không phải là nhỏ; nếu một xét nghiệm testosterone có CV là 20% tại LOQ là 30 ng/dL, người ta có thể nhận được kết quả hoặc dưới 30 ng/dL hoặc 36 ng/dL trên cùng một mẫu, được chạy vào hai dịp khác nhau.
Độ đặc hiệu phân tích, Nhiễu, và Độ thu hồi
Độ đặc hiệu trong bối cảnh này đề cập đến khả năng của xét nghiệm đo lường một chất phân tích cụ thể mà không có phản ứng chéo với các chất khác trong mẫu. Các nghiên cứu về độ đặc hiệu phân tích có thể bao gồm việc thêm một lượng đã biết của các chất phân tích tương tự vào một mẫu; ví dụ, một xét nghiệm cortisol có thể được kiểm tra về phản ứng chéo với cortisone, prednisone, prednisolone, dexamethasone, 17-hydroxyprogesterone, và các steroid khác. Liên quan chặt chẽ là các nghiên cứu về nhiễu để xem liệu các tình huống thường gặp, chẳng hạn như tán huyết, tăng bilirubin máu, và lipid máu có ảnh hưởng đến kết quả xét nghiệm hay không. Các nghiên cứu về độ thu hồi ít được thực hiện hơn; ở đây, một mẫu chuẩn có nồng độ đã biết được thêm vào một mẫu, và mẫu được xét nghiệm để xem có bao nhiêu phần trăm của mẫu chuẩn được thêm vào được phát hiện (lý tưởng là 100%, nhưng thường ít hơn).
Độ đúng/So sánh phương pháp
Việc xác định độ đúng của một xét nghiệm là một quá trình gồm nhiều bước, không phải tất cả đều có thể được giải quyết trong một nghiên cứu thẩm định phân tích thông thường. Độ đúng có thể là một phần của quá trình ra quyết định phát triển xét nghiệm ban đầu—ví dụ, bao gồm một bước chiết tách và sắc ký để tránh các phản ứng chéo có vấn đề. Việc xác định đầy đủ độ đúng lâm sàng của một xét nghiệm có thể không thể thực hiện được cho đến khi thẩm định phân tích hoàn tất và xét nghiệm được phát hành cho các nhà điều tra để thực hiện các nghiên cứu thẩm định lâm sàng. Do đó, cái gọi là nghiên cứu độ đúng trong một cuộc thẩm định phân tích nhất thiết phải giới hạn chỉ trong một phần nhỏ của toàn bộ quá trình xác định độ đúng. Các nghiên cứu về nhiễu và độ thu hồi đã đề cập ở trên có liên quan đến độ đúng của xét nghiệm, nhưng cách tiếp cận phổ biến nhất là so sánh phương pháp xét nghiệm mới với một phương pháp so sánh khác. Lý tưởng nhất, phương pháp được sử dụng để so sánh sẽ là một loại phương pháp tham chiếu tiêu chuẩn vàng nào đó, nhưng thường thì một phương pháp như vậy không có sẵn. Thay vào đó, phương pháp đang được thẩm định được so sánh với một phương pháp được chấp nhận rộng rãi, và kết quả được hiển thị (kết quả phương pháp mới trên trục y, kết quả phương pháp so sánh trên trục x) trên một biểu đồ tương quan (Hình 4.6, bảng trên). Cũng thường được sử dụng là biểu đồ độ lệch hoặc biểu đồ chênh lệch (Hình 4.6, bảng dưới), cho thấy rõ hơn sự khác biệt giữa các phương pháp mà có thể bị bỏ qua trên một biểu đồ tương quan đơn giản.
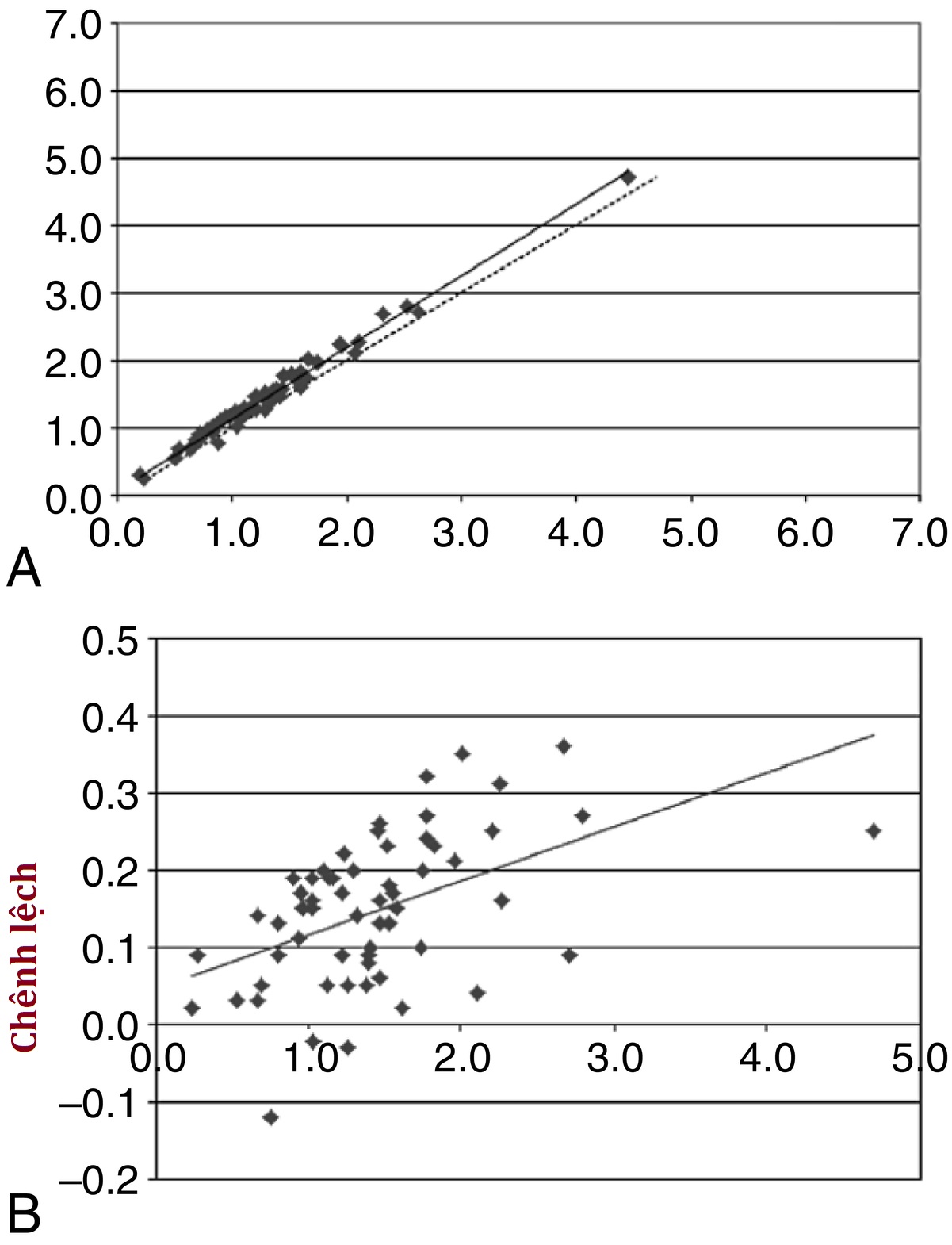
Hình 4.6 So sánh phương pháp. Một biểu đồ tương quan (bảng trên) so với biểu đồ chênh lệch/độ lệch (bảng dưới). Với một biểu đồ tương quan (A), các giá trị của một xét nghiệm mới (trục y) được so sánh với các giá trị từ một xét nghiệm đã được thiết lập (trục x), cho thấy một đường phù hợp nhất (đường liền nét) lệch nhẹ so với đường đồng nhất (đường chấm). Đối với biểu đồ chênh lệch/độ lệch (B), sự khác biệt giữa các giá trị từ xét nghiệm mới so với xét nghiệm cũ được vẽ trên trục y, trong khi giá trị trung bình của kết quả từ cả hai xét nghiệm được vẽ trên trục x. Độ lệch hệ thống tăng lên của xét nghiệm mới được nhìn thấy rõ ràng hơn trên biểu đồ chênh lệch/độ lệch.
Các loại mẫu và Hiệu ứng nền mẫu
Các loại mẫu không tự động hoán đổi cho nhau được. Huyết tương Ethylenediaminetetraacetic acid (EDTA) từ ống nắp tím có thể hoạt động tốt trong một xét nghiệm, trong khi huyết tương heparin từ ống nắp xanh có thể không. Một xét nghiệm hormone tuyến cận giáp có thể cho kết quả tương đương từ cả huyết tương EDTA và huyết thanh ống nắp đỏ, trong khi một xét nghiệm hormone tuyến cận giáp khác có thể không. Đây là những ví dụ về “hiệu ứng nền mẫu”.
- Nền mẫu (Matrix) đề cập đến các thành phần của một mẫu khác với chất phân tích đang được đo.
Như đã lưu ý trong các tình huống lâm sàng của chúng ta, nền mẫu (ví dụ, không có protein, nhớt, có nồng độ muối cao, chứa nồng độ paraprotein cao) có thể có ảnh hưởng sâu sắc đến độ chính xác của một xét nghiệm.
Nền mẫu của huyết thanh khác với huyết tương, do không có fibrinogen và chất chống đông, cộng với sự hiện diện của các chất được giải phóng bởi tiểu cầu. Sự khác biệt về giá trị của nhiều chất phân tích có thể nhiều hơn so với sự khác biệt nhỏ này; một nghiên cứu về hồ sơ chất chuyển hóa cho thấy 104 trong số 122 chất chuyển hóa có nồng độ cao hơn đáng kể trong huyết thanh so với huyết tương. Điều quan trọng là phải nhận ra rằng một xét nghiệm được thẩm định cho một nền mẫu không thể tự động được sử dụng cho một nền mẫu khác.
Độ ổn định
Thông thường, độ ổn định của mẫu được nghiên cứu ở nhiệt độ phòng (khoảng 22°–26° C), nhiệt độ lạnh (khoảng 2°–6° C), và nhiệt độ đông lạnh thông thường (khoảng − 18° đến − 20° C). Đối với các xét nghiệm được sử dụng trong các nghiên cứu lâm sàng nơi các mẫu có thể được lưu trữ trong thời gian dài, các nghiên cứu về độ ổn định cũng nên được thực hiện ở nhiệt độ đông lạnh sâu hơn (ví dụ, − 70° C). Các mẫu con được lưu trữ ở các nhiệt độ này trong các khoảng thời gian khác nhau được lấy ra và xét nghiệm để xem liệu kết quả có ổn định so với ban đầu hay không. Giới hạn ổn định là một thuộc tính cố hữu của xét nghiệm chứ không phải của chất phân tích: một xét nghiệm osteocalcin được thiết kế để chỉ nhận diện các phân tử nguyên vẹn có thể có giới hạn ổn định ngắn đối với các mẫu ở nhiệt độ phòng, trong khi một xét nghiệm khác phát hiện các mảnh phân tử osteocalcin, cũng như protein nguyên vẹn, có thể có giới hạn ổn định dài hơn nhiều.
Nhiễm chéo
Một quy trình chất lượng quan trọng khác là đảm bảo không có sự nhiễm bẩn chéo giữa các mẫu, và một mẫu có giá trị rất cao sẽ không bị mang sang và làm tăng giả tạo kết quả trong mẫu tiếp theo được xét nghiệm. Các xét nghiệm nên được thiết kế để giảm thiểu vấn đề này, nhưng cũng cần có sự nhận thức của nhân viên phòng xét nghiệm để kiểm tra nhiễm chéo bất cứ khi nào gặp một mẫu có giá trị tăng cao bất thường.
Phương pháp luận
Xét nghiệm miễn dịch
Xét nghiệm miễn dịch là một phương pháp luận quan trọng trong phòng xét nghiệm nội tiết. Việc hiểu các nguyên tắc cơ bản liên quan cho phép các chuyên gia: (1) xác định khi nào một xét nghiệm miễn dịch cụ thể là phù hợp hoặc không phù hợp cho một kịch bản lâm sàng cụ thể, (2) dự đoán các vấn đề sinh lý và kỹ thuật tiềm ẩn ảnh hưởng đến việc giải thích kết quả xét nghiệm, và (3) hiểu cách làm việc với phòng xét nghiệm lâm sàng để điều tra các kết quả xét nghiệm không mong muốn hoặc không phù hợp về mặt lâm sàng.
Xét nghiệm miễn dịch cạnh tranh so với Xét nghiệm miễn dịch đo lường (Sandwich)
Có hai định dạng xét nghiệm miễn dịch chính liên quan đến xét nghiệm nội tiết, và việc hiểu một số khác biệt cơ bản giữa các định dạng này giúp cả việc giải thích kết quả và khắc phục các tình huống bất ngờ. Loại xét nghiệm đầu tiên được gọi là cạnh tranh, với RIA là ví dụ điển hình. Một kháng thể sơ cấp chống lại chất phân tích quan tâm được thêm vào mẫu của bệnh nhân, cùng với một phiên bản được đánh dấu phóng xạ của chất phân tích (chất đánh dấu) cạnh tranh với chất phân tích nội sinh để liên kết với kháng thể sơ cấp (Hình 4.7, bảng trên). Sau một thời gian ủ đủ dài, kháng thể sơ cấp được kết tủa bằng cách sử dụng kháng thể IgG kháng immunoglobulin (Ig) thứ hai, polyethylene glycol, hoặc (phổ biến nhất hiện nay) bằng cách sử dụng kháng thể sơ cấp được gắn vào một giá thể rắn, chẳng hạn như một hạt, cho phép một bước ly tâm đơn giản để thu thập kháng thể sơ cấp. Bất kỳ chất đánh dấu hoặc chất phân tích không liên kết nào cũng được rửa sạch, và lượng chất đánh dấu trong kết tủa sau đó được định lượng.
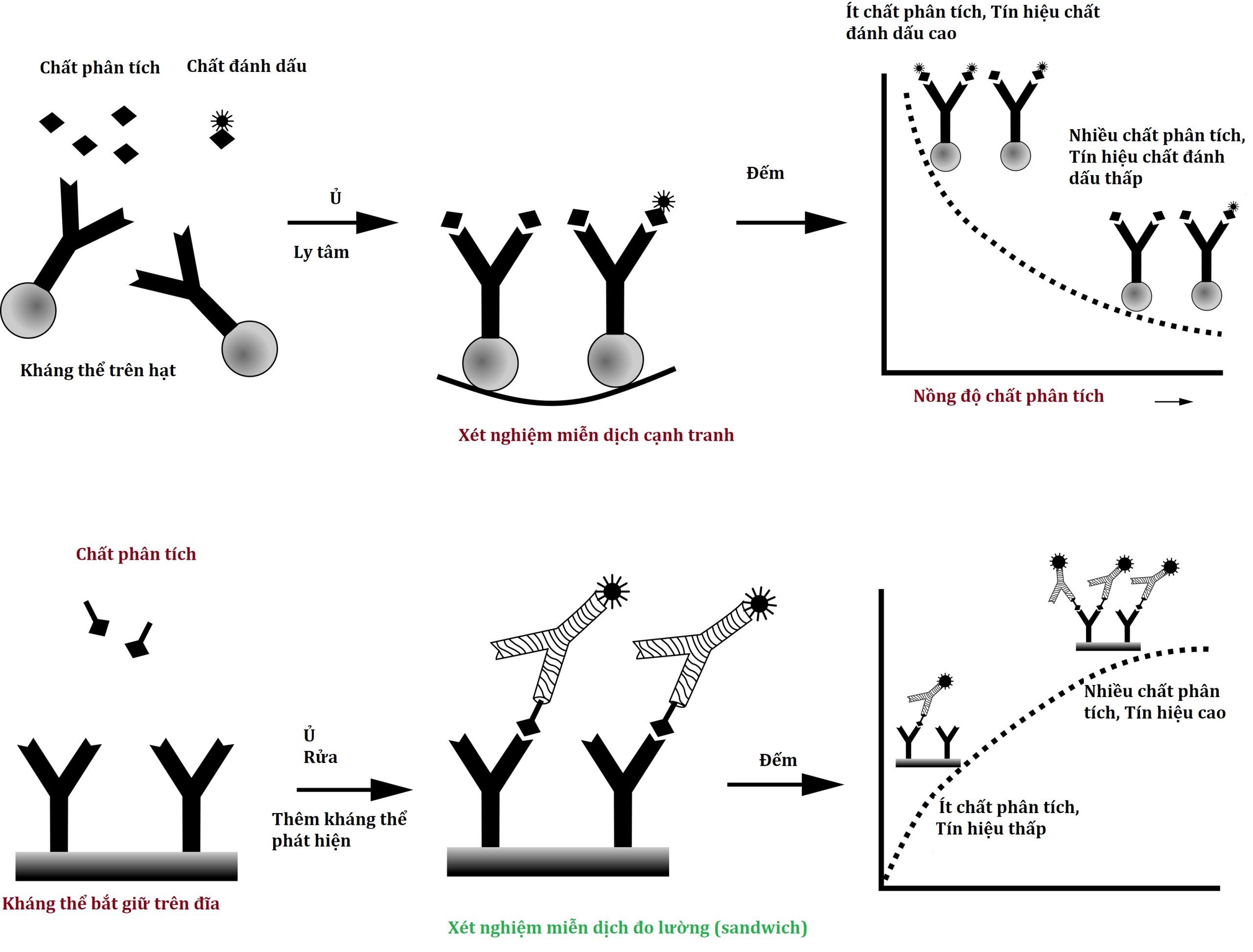
Hình 4.7 So sánh xét nghiệm miễn dịch cạnh tranh và xét nghiệm miễn dịch đo lường (sandwich). Trong xét nghiệm miễn dịch cạnh tranh (trên), chất đánh dấu (chất phân tích được đánh dấu) và chất phân tích không đánh dấu cạnh tranh để liên kết với các kháng thể xét nghiệm. Trong phương pháp đo lường miễn dịch hai vị trí (dưới), chất phân tích quan tâm được kẹp giữa kháng thể bắt giữ và kháng thể tín hiệu.
Để chuyển đổi tín hiệu chất đánh dấu này thành nồng độ, một đường cong chuẩn được chuẩn bị từ các mẫu nơi các nồng độ khác nhau của một lượng chất phân tích đã biết đã được thêm vào. Đối với một xét nghiệm miễn dịch cạnh tranh, lượng tín hiệu được phát hiện (lượng chất đánh dấu liên kết với kháng thể) giảm khi chất phân tích trong mẫu của bệnh nhân tăng lên. Quan trọng là, bất cứ điều gì ngăn cản chất đánh dấu liên kết với kháng thể sơ cấp cũng sẽ làm giảm tín hiệu và tăng nồng độ chất phân tích biểu kiến. Ví dụ, lấy một xét nghiệm miễn dịch được tối ưu hóa cho huyết thanh và sử dụng nó cho một mẫu nước tiểu cực kỳ cô đặc hoặc trong một dịch cơ thể nơi nồng độ protein cực kỳ cao có thể làm thay đổi đáng kể kết quả. Bởi vì nồng độ muối cao hoặc protein cao có thể ức chế sự liên kết của chất đánh dấu với kháng thể, tín hiệu chất đánh dấu sẽ thấp và nồng độ chất phân tích biểu kiến rất cao, ngay cả khi hoàn toàn không có chất phân tích nào.
Loại xét nghiệm miễn dịch thứ hai được gọi là miễn dịch đo lường, với ví dụ quan trọng nhất là xét nghiệm sandwich không cạnh tranh. Thông thường, như được trình bày trong Hình 4.7 (bảng dưới), một kháng thể được gắn vào một giá thể rắn (đĩa, thành ống, hoặc một hạt) được sử dụng để bắt giữ chất phân tích quan tâm, sau đó là việc thêm một kháng thể thứ hai, được đánh dấu, liên kết với một vị trí khác trên chất phân tích, tạo ra một phức hợp sandwich kháng thể-chất phân tích-kháng thể. Sau khi kháng thể phát hiện không liên kết được rửa sạch, phần còn lại sẽ tạo ra tín hiệu phóng xạ (miễn dịch phóng xạ [IRMA]), hóa phát quang (miễn dịch hóa phát quang [ICMA]), đo màu (xét nghiệm miễn dịch liên kết enzyme [ELISA]), hoặc huỳnh quang (xét nghiệm miễn dịch huỳnh quang [IFMA]), tùy thuộc vào nhãn được chọn.
Các xét nghiệm miễn dịch đo lường cung cấp những lợi thế cố hữu nhất định so với các xét nghiệm miễn dịch cạnh tranh. Trước hết, việc có hai kháng thể tham gia, mỗi kháng thể liên kết với một epitope riêng biệt trên chất phân tích, làm tăng đáng kể độ đặc hiệu phân tích, bao gồm cả khả năng lựa chọn các đồng dạng rất đặc hiệu của một chất phân tích. Ví dụ, một kháng thể có thể được hướng vào đầu N của một peptide, trong khi kháng thể kia có thể được hướng vào đầu C, đảm bảo rằng chỉ có peptide có chiều dài đầy đủ được phát hiện. Một lợi thế thứ hai là các xét nghiệm miễn dịch đo lường có xu hướng nhạy hơn về mặt phân tích so với các đối tác xét nghiệm cạnh tranh của chúng. Điều này phát sinh từ thực tế là độ nhạy của một xét nghiệm miễn dịch cạnh tranh phần lớn phụ thuộc vào ái lực của kháng thể được sử dụng trong xét nghiệm—và việc phát triển các kháng thể có ái lực rất cao không phải là một nhiệm vụ dễ dàng hay có thể dự đoán được. Ngược lại, độ nhạy của một xét nghiệm miễn dịch đo lường có thể được cải thiện bằng cách sử dụng tín hiệu có hoạt độ cao hơn, dễ dàng phát hiện hơn ngay cả khi nồng độ chất phân tích rất thấp. Khi công nghệ phát hiện tín hiệu tiếp tục được cải thiện, các xét nghiệm miễn dịch đo lường ngày càng nhạy hơn có thể được phát triển. Một lợi thế thứ ba của các xét nghiệm miễn dịch đo lường phát sinh từ khả năng sử dụng các kháng thể đơn dòng, có thể được sản xuất với số lượng dễ dàng hơn và có các đặc tính dễ dự đoán hơn so với các kháng thể đa dòng.
Hạn chế của Xét nghiệm miễn dịch
Khả năng của một kháng thể liên kết với một mục tiêu cụ thể với ái lực cao là đáng chú ý, nhưng vẫn có những hạn chế. Kích thước nhỏ và khả năng sinh miễn dịch tương đối kém của các phân tử steroid gây khó khăn cho việc thu được một kháng thể có thể phân biệt rõ ràng một steroid cụ thể với các steroid tương tự khác. Ví dụ, một kháng thể được tạo ra chống lại testosterone có thể cho thấy phản ứng chéo đáng kể với một dạng liên hợp, chẳng hạn như testosterone glucuronide, hoặc với phân tử dihydrotestosterone có cấu trúc tương tự. Một bước chiết tách bằng dung môi để loại bỏ các chất liên hợp tan trong nước, chẳng hang như glucuronide, kết hợp với một bước sắc ký để tách các phân tử có cấu trúc tương tự, sẽ cải thiện đáng kể độ đặc hiệu phân tích của xét nghiệm (Hình 4.8A). Bước chiết tách cũng tách testosterone khỏi các protein liên kết có thể gây nhiễu cho việc đo lường chính xác.
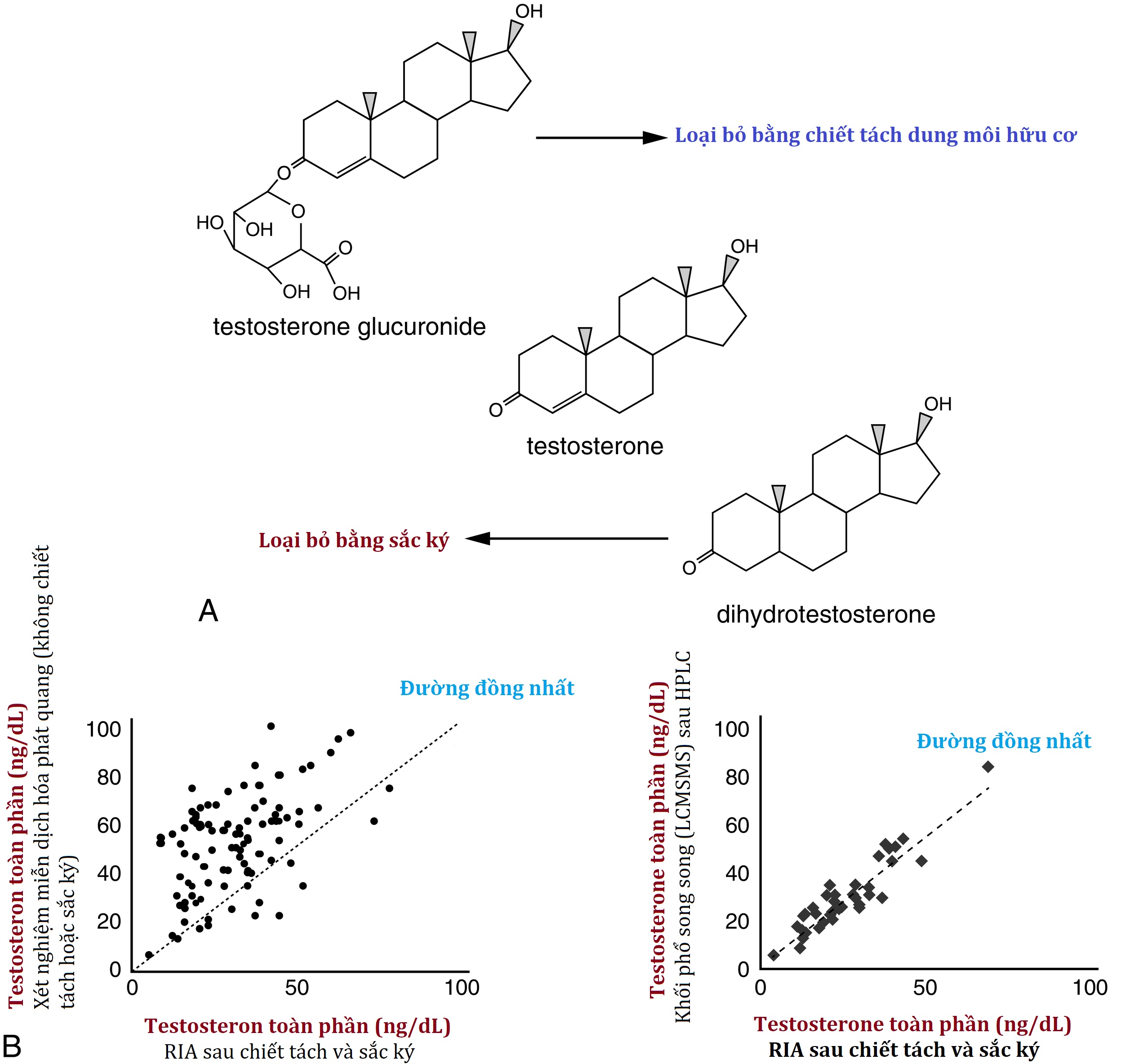
Hình 4.8 A, Tăng độ đặc hiệu phân tích thông qua chiết tách và sắc ký. Sau khi chiết tách bằng dung môi hữu cơ, các chất liên hợp tan trong nước vẫn còn trong pha nước trong khi các phân tử steroid thường vẫn còn trong pha hữu cơ. Các phân tử steroid tương tự có thể được tách ra bằng một bước sắc ký bổ sung. B, Tương quan của các xét nghiệm testosterone (chiết tách/sắc ký/xét nghiệm miễn dịch phóng xạ [RIA] so với xét nghiệm miễn dịch không chiết tách hoặc khối phổ song song). Bảng bên trái: Các xét nghiệm miễn dịch steroid không có các bước chuẩn bị bổ sung trước khi xét nghiệm có xu hướng cho giá trị cao hơn so với các xét nghiệm miễn dịch sau khi chiết tách và sắc ký, có khả năng là do các chất liên hợp steroid và các hợp chất có cấu trúc tương tự (các giá trị thấp hơn không thường xuyên có thể phản ánh các vấn đề với các protein liên kết steroid không được loại bỏ hoàn toàn). Bảng bên phải: Đo lường steroid bằng sắc ký lỏng hiệu năng cao [HPLC]-khối phổ song song (MS) (cũng bao gồm chiết tách và sắc ký) tạo ra kết quả testosterone rất giống với kết quả thu được bằng xét nghiệm miễn dịch sau khi chiết tách và sắc ký.
Các xét nghiệm miễn dịch testosterone không bao gồm các bước chiết tách và sắc ký như vậy, bao gồm phần lớn các xét nghiệm được tìm thấy trên hầu hết các nền tảng xét nghiệm tự động, có thể hoạt động tốt ở các mức độ cao hơn được tìm thấy ở nam giới trưởng thành (> 300 ng/dL) nhưng thường sẽ đo được các giá trị cao không phù hợp trong khoảng phù hợp nhất với phụ nữ và trẻ em trước tuổi dậy thì (Hình 4.8B). Việc đánh giá quá cao này (và độ nhạy phân tích ở mức thấp kém) cũng được thấy đối với các steroid khác, chẳng hạn như estradiol hoặc 17-hydroxyprogesterone. Bởi vì trong thực tế, các giá trị thấp hơn phù hợp hơn với bức tranh lâm sàng, các bác sĩ nội tiết chăm sóc cho phụ nữ và trẻ em theo truyền thống đã dựa vào các xét nghiệm miễn dịch bao gồm các bước chiết tách và sắc ký, hiện nay phần lớn được thay thế bằng các xét nghiệm bao gồm sắc ký và khối phổ song song.
Xét nghiệm Hormone tự do
Quan niệm rằng nồng độ hormone “tự do” (không gắn với bất kỳ protein liên kết nào) phản ánh tốt nhất tình trạng nội tiết của bệnh nhân vẫn được gọi là một giả thuyết, bởi vì tiện ích lâm sàng của các xét nghiệm hormone tự do thay đổi từ chắc chắn đến suy đoán. Một xét nghiệm T4 tự do bằng phương pháp thẩm tách cân bằng rõ ràng là có giá trị để đánh giá một bệnh nhân bị thiếu hụt globulin gắn thyroxine (TBG); một xét nghiệm testosterone tự do có thể hữu ích (mặc dù không phải lúc nào cũng cần thiết) ở một số bệnh nhân có những phát hiện không được giải thích đầy đủ bởi nồng độ testosterone toàn phần; và về mặt lý thuyết, nồng độ 25-hydroxyvitamin D (25-OHD) tự do có thể giúp giải thích tại sao người Mỹ da đen có nồng độ 25-OHD trung bình thấp hơn người Mỹ da trắng, mặc dù có tỷ lệ loãng xương thấp hơn.
T4 tự do bằng phương pháp đo trực tiếp sau thẩm tách cân bằng là xét nghiệm hormone tự do điển hình. Như được trình bày trong Hình 4.9, nó bao gồm việc ủ một mẫu của bệnh nhân ở một bên của một buồng chứa đầy dung dịch đệm thẩm tách được ngăn cách bởi một màng bán thấm mà T4 tự do (nhưng không phải T4 gắn kết) có thể đi qua. Sau một khoảng thời gian đủ để đạt được trạng thái cân bằng, lượng T4 tự do có thể được đo trực tiếp bằng một phương pháp phát hiện có độ nhạy cao (xét nghiệm miễn dịch sử dụng một kháng thể có ái lực rất cao, hoặc khối phổ song song). Xét nghiệm này hoạt động tốt ở các mức TBG cực đoan (thiếu hụt hoặc dư thừa), có lẽ tốt hơn một số xét nghiệm dựa trên chất tương tự thay thế được mô tả sau. Nhược điểm bao gồm thời gian chờ đợi kết quả lâu hơn (thời gian quay vòng), chi phí cao do yêu cầu thêm lao động, và nhạy cảm với các chất như axit béo không este hóa (tự do) (NEFA) có thể đẩy T4 ra khỏi các protein liên kết của nó. Vấn đề cuối cùng có thể được thấy khi các mẫu T4 tự do được lấy qua các đường truyền có heparin; heparin trong ống mẫu có thể đẩy nhanh việc giải phóng NEFA từ triglyceride trong mẫu, làm tăng giả tạo nồng độ T4 tự do đo được. Ngay cả khi không có tác dụng của heparin, có thể có những ảnh hưởng tinh vi đến đáng kể của NEFA lên xét nghiệm T4 tự do bằng thẩm tách ở những bệnh nhân có tăng triglyceride máu, đặc biệt nếu họ có khả năng liên kết hormone tuyến giáp thấp (TBG thấp hoặc albumin rất thấp).
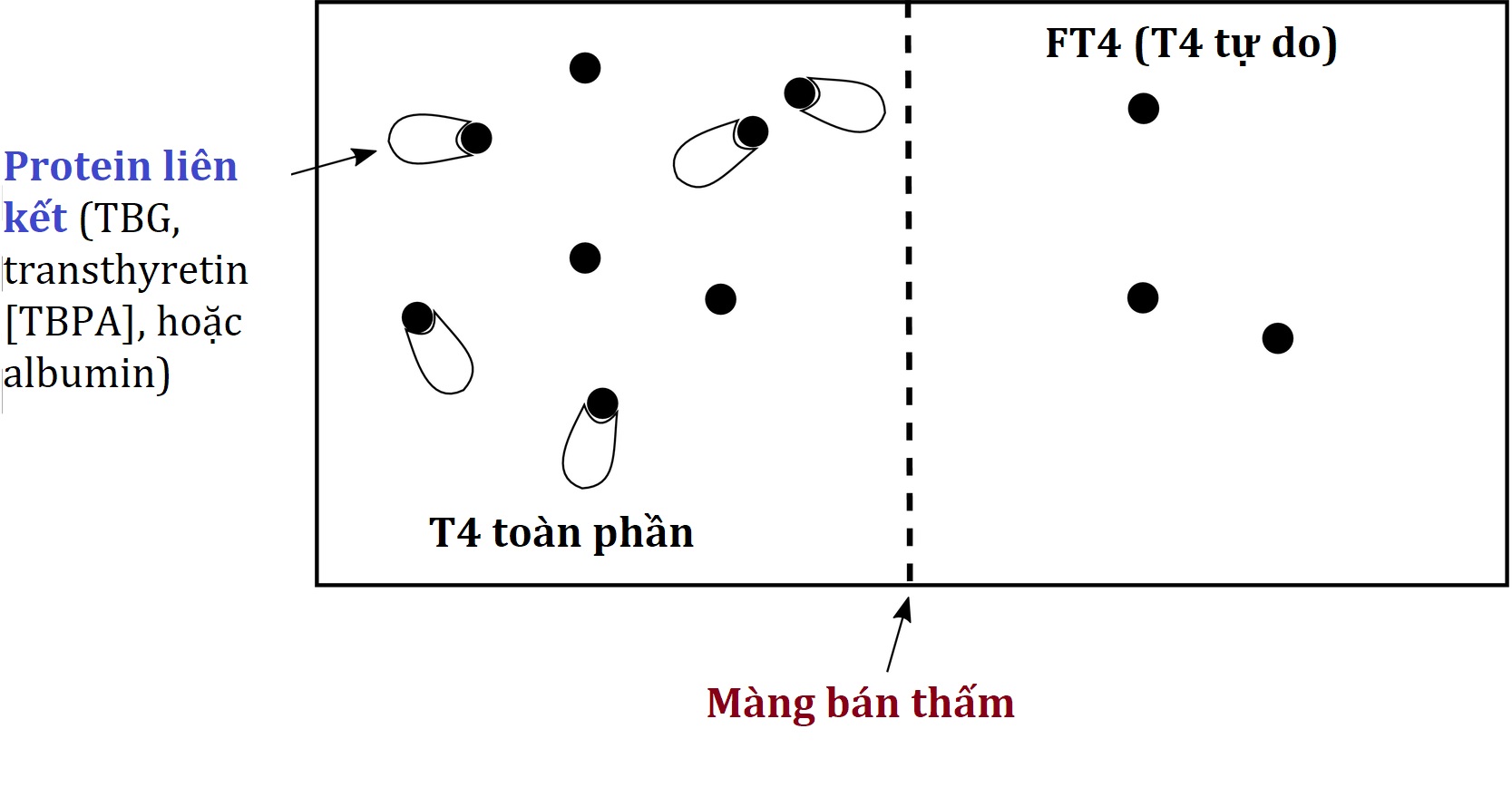
Hình 4.9 T4 tự do bằng phương pháp đo trực tiếp sau thẩm tách cân bằng. Xem văn bản để biết chi tiết.
T4 tự do và cortisol huyết thanh tự do có thể được đo trực tiếp sau khi thẩm tách, vì T4 toàn phần và cortisol toàn phần lưu hành trong khoảng microgam trên decilit. Ngược lại, testosterone toàn phần và triiodothyronine (T3) toàn phần được đo trong khoảng nanogam trên decilit, với nồng độ hormone tự do kết quả dưới mức có thể được đo một cách đáng tin cậy bằng các xét nghiệm miễn dịch hoặc khối phổ hiện tại. Do đó, một cách tiếp cận khác (đo gián tiếp bằng thẩm tách cân bằng chất đánh dấu) là cần thiết. Như được trình bày trong Hình 4.10, mẫu của bệnh nhân được đặt trong buồng thẩm tách cùng với một lượng đã biết của hormone được đánh dấu phóng xạ (chất đánh dấu). Một số chất đánh dấu được liên kết và một số vẫn tự do. Sau khi cân bằng, lượng phóng xạ đã đi qua màng thẩm tách (đại diện cho phần chất đánh dấu vẫn tự do) có thể được đo để xác định “phần trăm hormone tự do”. Nồng độ hormone toàn phần (T3 toàn phần hoặc testosterone toàn phần) có thể được nhân với phần trăm hormone tự do này để có được nồng độ hormone tự do được tính toán.
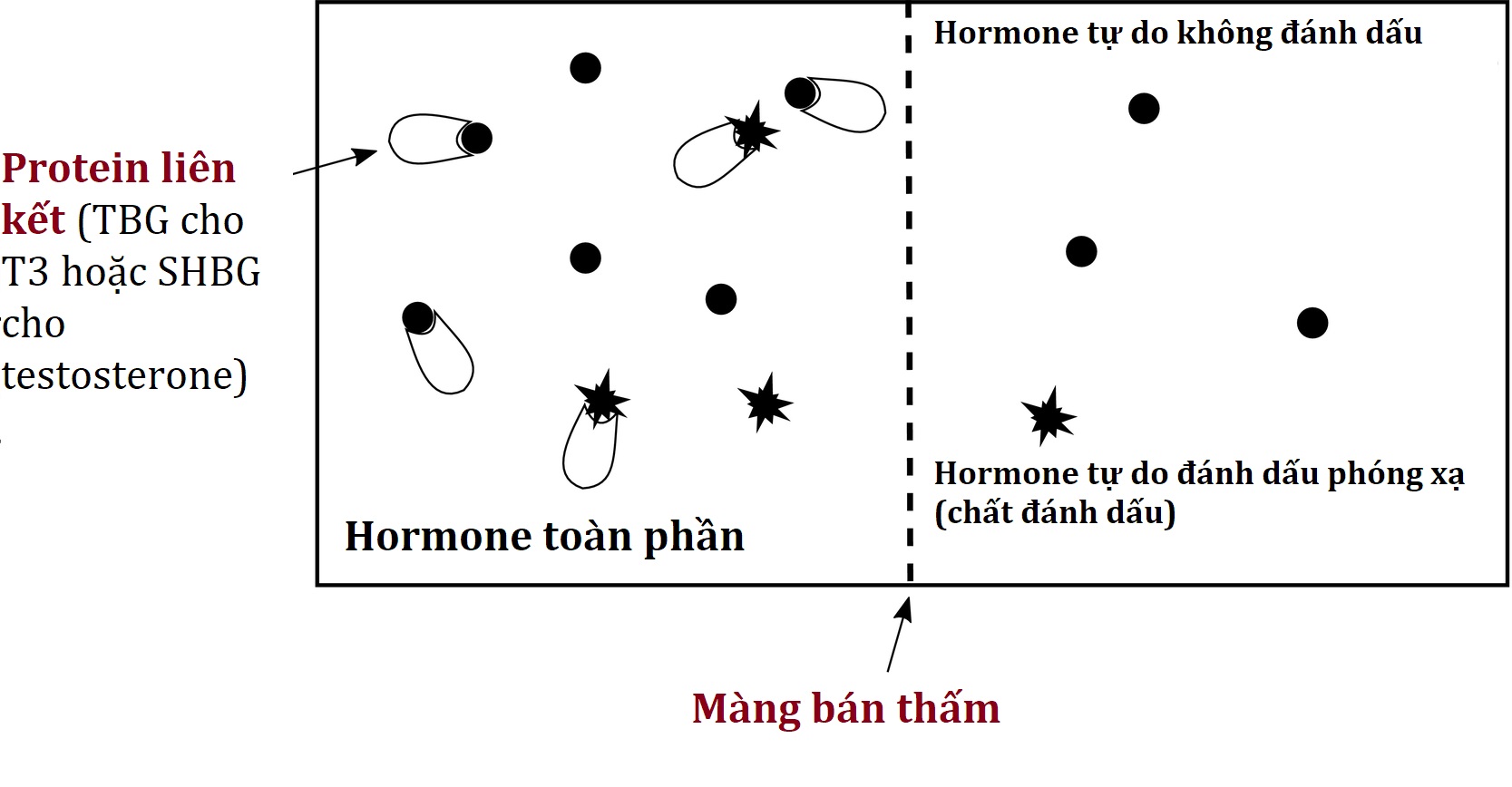
Hình 4.10 Hormone tự do (ví dụ, T3 tự do hoặc testosterone tự do) bằng thẩm tách cân bằng chất đánh dấu. Xem văn bản để biết chi tiết.
Bởi vì các xét nghiệm hormone tự do dựa trên thẩm tách đòi hỏi nhiều lao động và không phù hợp với tự động hóa, các phương pháp tiếp cận “trực tiếp” thay thế đã được phát triển. Phổ biến nhất là T4 tự do bằng phương pháp chất tương tự được đánh dấu (Hình 4.11). Một chất tương tự T4 được đánh dấu không liên kết với bất kỳ TBG nào (TBG, TBPA, albumin) được thêm vào mẫu của bệnh nhân; chất tương tự này cạnh tranh với T4 tự do của bệnh nhân để giành lấy các kháng thể T4 (được chọn để chỉ liên kết với các phân tử T4 tự do), với T4 tự do kết quả được xác định như với bất kỳ xét nghiệm miễn dịch cạnh tranh nào (tín hiệu nhiều hơn từ chất tương tự liên kết tương ứng với ít T4 tự do hơn trong mẫu của bệnh nhân).
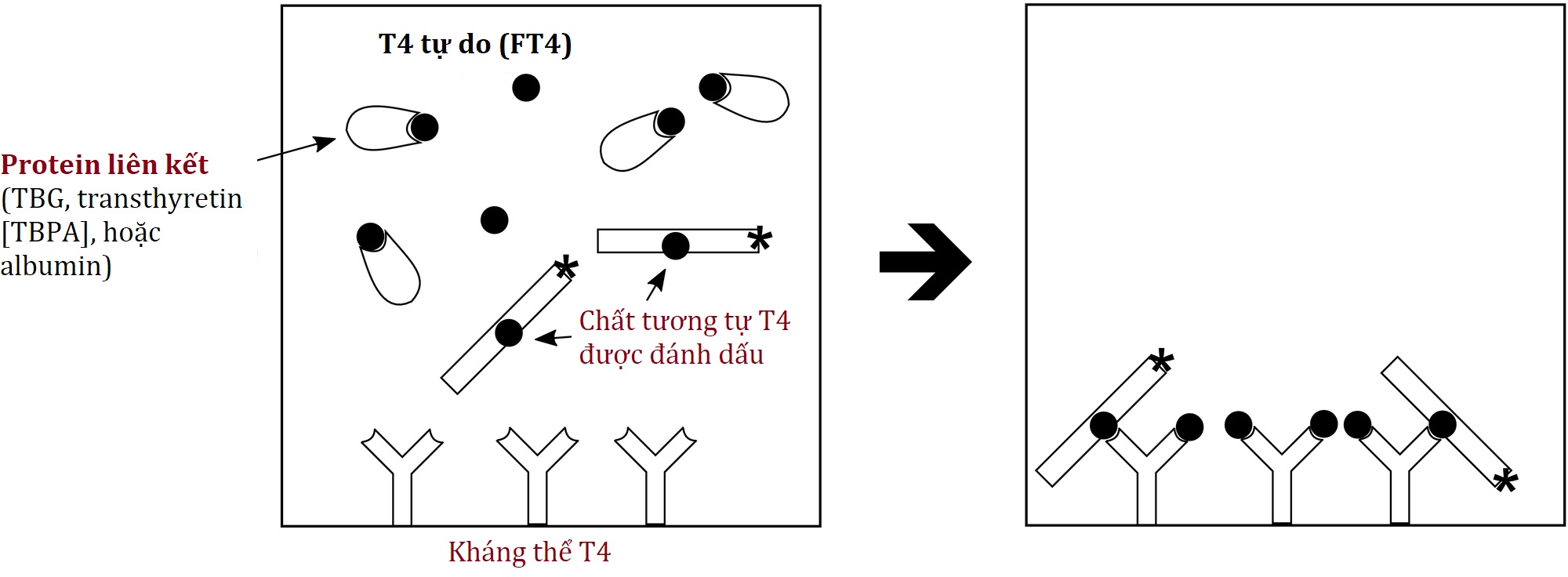
Hình 4.11 T4 tự do (không thẩm tách) bằng phương pháp chất tương tự được đánh dấu. Phương pháp này phụ thuộc vào một chất tương tự T4 liên kết với kháng thể T4 của xét nghiệm, nhưng không liên kết với globulin gắn thyroxine (TBG). Xem văn bản để biết thêm chi tiết.
Một biến thể thông minh liên quan đến việc đánh dấu kháng thể thay vì một chất tương tự của T4 tự do (Hình 4.12). T4 được cố định trên thành ống hoặc giếng đĩa cạnh tranh với T4 tự do của bệnh nhân để giành lấy kháng thể được đánh dấu. Sau khi ủ và một bước rửa, chỉ còn lại kháng thể liên kết với T4 cố định và tín hiệu được đo (như với bất kỳ xét nghiệm miễn dịch cạnh tranh nào, tín hiệu nhiều hơn tương ứng với ít T4 tự do hơn trong mẫu của bệnh nhân).
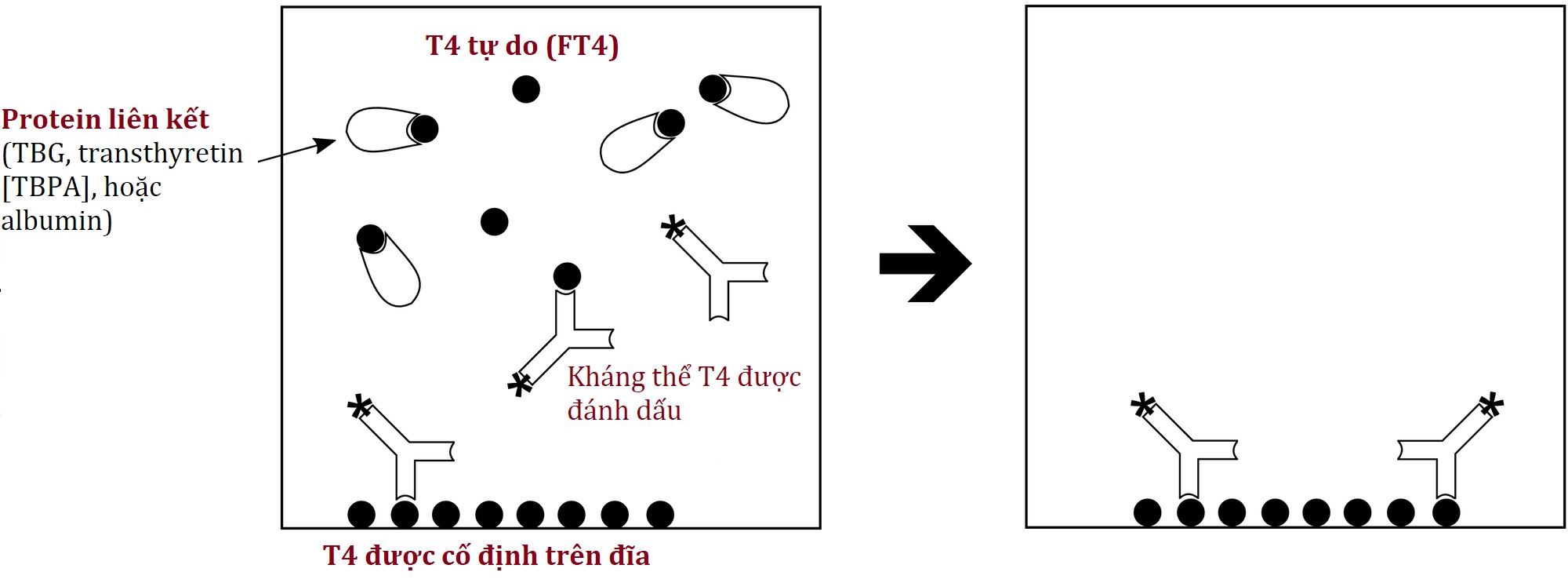
Hình 4.12 T4 tự do (không thẩm tách) bằng phương pháp kháng thể được đánh dấu. Xem văn bản để biết chi tiết.
Các xét nghiệm trực tiếp này nhanh, tương đối rẻ và dễ dàng tự động hóa. Do đó, chúng đã trở thành các xét nghiệm T4 tự do chiếm ưu thế, thay thế các phương pháp cũ hơn, chẳng hạn như tính toán chỉ số T4 tự do. Một mối lo ngại là hiệu suất của xét nghiệm chất tương tự phụ thuộc vào giả định rằng chất tương tự không tương tác chút nào với TBG hoặc các protein liên kết khác, một giả định có thể không hoàn toàn đúng, đặc biệt khi nồng độ TBG cao, hoặc ái lực của protein liên kết tăng lên. Do đó, các xét nghiệm này có thể hoạt động kém ở các mức độ cực đoan của khả năng liên kết hormone tuyến giáp (ví dụ, nồng độ TBG rất thấp hoặc rất cao, nồng độ albumin cực thấp như trong hội chứng thận hư, hoặc ở những bệnh nhân có ái lực protein liên kết hormone tuyến giáp bị thay đổi). Nói chung, các xét nghiệm trực tiếp có xu hướng đánh giá thấp T4 tự do khi nồng độ TBG hoặc albumin thấp và đánh giá quá cao khi nồng độ protein liên kết cao. Tuy nhiên, các xét nghiệm T4 tự do trực tiếp dựa trên chất tương tự được chấp nhận rộng rãi để sử dụng chung, trái ngược với các xét nghiệm testosterone tự do tương tự, mà Hiệp hội Nội tiết đặc biệt không khuyến nghị.
Khối phổ
Khối phổ (MS) đại diện cho một mô hình phát hiện hoàn toàn khác với các phương pháp dựa trên kháng thể. Đây là một phương pháp đã được thiết lập tốt để đạt được độ nhạy và độ đặc hiệu phân tích rất cao và định lượng chính xác cho các phân tử nhỏ như thuốc, steroid, catecholamine, và các hợp chất vô cơ khác nhau. Sử dụng MS, protein có thể được định lượng bằng cách đo lượng của một đoạn peptide “đặc trưng” sau khi phân giải protein, hoặc (với những tiến bộ công nghệ gần đây hơn) bằng cách đo trực tiếp các protein nguyên vẹn có kích thước lên đến khoảng 20 kDa.

Hình 4.13 Một thiết lập cũ nhưng vẫn đại diện cho một xét nghiệm khối phổ song song-sắc ký lỏng hiệu năng cao định lượng. Lưu ý các thiết bị đầu cuối rộng rãi cho các bước chiết tách và sắc ký, với máy khối phổ chỉ chiếm một không gian nhỏ ở phía ngoài cùng bên phải.
Một xét nghiệm khối phổ điển hình (Hình 4.13) có thể bao gồm các bước sau:
- Tinh chế ban đầu: phổ biến nhất là một bước chiết tách để loại bỏ các protein liên kết hoặc các chất gây nhiễu khác khỏi chất phân tích mục tiêu. Nhiều kỹ thuật thông minh đã được sử dụng để giảm độ phức tạp của mẫu tổng thể và làm giàu nồng độ của chất phân tích mục tiêu.
- Dẫn xuất hóa là một sửa đổi hóa học của chất phân tích mục tiêu có thể giúp phân tích chính xác hơn trong bước phát hiện sau này.
- Tách sắc ký, ví dụ, sắc ký khí (GC) hoặc sắc ký lỏng (LC). GC thường sử dụng các cột rất dài và có khả năng phân giải nhiều chất phân tích khác nhau với độ chính xác cao, mặc dù nó vừa chậm và thường không thân thiện với tự động hóa. LC vừa nhanh hơn và có thể tự động hóa, với sắc ký lỏng hiệu năng cao (HPLC) hoặc sắc ký lỏng hiệu năng siêu cao (UPLC) được sử dụng phổ biến nhất. Chất phân tích mục tiêu có thời gian lưu đặc trưng, là thời gian giữa việc tiêm mẫu vào hệ thống sắc ký và việc phát hiện đỉnh của chất phân tích.
- Ion hóa các phân tử trong hỗn hợp được tinh chế một phần, thường sử dụng một hoặc một sự kết hợp của những cách sau: nhiệt, bắn phá ion, điện áp cao, bắn phá laser, hoặc chuyển ion hóa học. Chất phân tích mục tiêu sẽ có một tỷ lệ khối lượng trên điện tích (m/z) đặc trưng sau khi ion hóa. Các kỹ thuật ion hóa được sử dụng phổ biến nhất trong phòng xét nghiệm lâm sàng (do tương thích với các hệ thống sắc ký lỏng) là ion hóa phun điện tử (ESI) cho các phân tử lớn hơn hoặc phân cực như peptide và protein, và ion hóa hóa học ở áp suất khí quyển (APCI) cho các phân tử nhỏ hơn, không phân cực như steroid. Ion hóa khử hấp phụ bằng laser có sự hỗ trợ của chất nền (MALDI) ít thấy hơn trong phòng xét nghiệm hóa học lâm sàng/nội tiết do khó khăn trong việc tự động hóa và đạt được định lượng chính xác, nhưng nó đã vô giá trong phòng xét nghiệm vi sinh để tạo ra các dấu vân tay peptide đặc trưng của các vi sinh vật khác nhau.
- Phân tích khối tách các ion được tạo ra trước đó theo tỷ lệ m/z của chúng. Điều này có thể được thực hiện bằng cách đầu tiên gia tốc các ion trong một điện trường và sau đó tách các ion chất phân tích mong muốn bằng bất kỳ một trong một số kỹ thuật. Đối với xét nghiệm nội tiết, các kỹ thuật thường gặp nhất là:
- Lọc khối tứ cực: các ion đi theo một đường phức tạp trong một điện trường dao động giữa bốn thanh hình trụ (Hình 4.14). Tần số của dao động có thể được điều chỉnh để chỉ các ion có tỷ lệ m/z mong muốn mới đi đến cuối (nơi chúng sẽ tiếp tục đến bước phát hiện) mà không va chạm với một trong các thanh, kết thúc hành trình của nó.
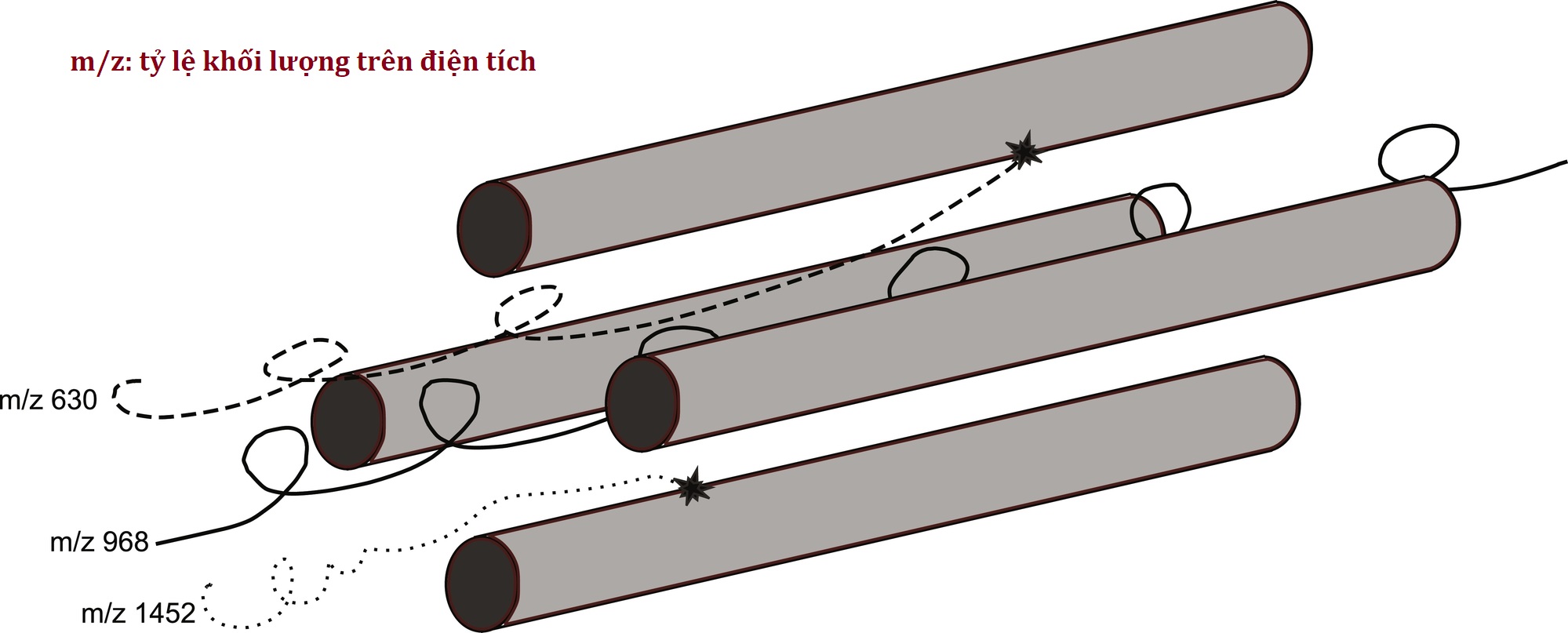
Hình 4.14 Lọc khối tứ cực. Một dòng điện dao động được chọn để chỉ cho phép các ion có tỷ lệ khối lượng trên điện tích (m/z) nhất định đi qua tứ cực. Các ion khác đi theo một đường không ổn định và va chạm với các tứ cực, kết thúc hành trình của chúng.
- Bẫy ion: các ion được dồn vào một điện trường dao động có thể được điều chỉnh để đẩy ra các ion có tỷ lệ m/z cụ thể để chúng đến được máy dò. Chúng có thể cho phép phân giải cao hơn các trọng lượng phân tử khác nhau so với những gì có thể đạt được bằng hệ thống tứ cực thông thường.
- Thời gian bay (TOF): tất cả các ion đều chịu một điện trường như nhau, với các ion có trọng lượng phân tử thấp hơn đến máy dò sớm hơn so với các đối tác nặng hơn của chúng. Các hệ thống này có thể cho phép phân tích các ion có khối lượng lớn hơn so với những gì có thể dễ dàng xử lý bằng các phương pháp khác.
- Phát hiện các ion (cường độ ion) tương ứng với các chất phân tích quan tâm trong phạm vi m/z mong muốn (Hình 4.15). Các hợp chất có thể được phân biệt thêm dựa trên thời điểm chúng rửa giải khỏi cột sắc ký (thời gian lưu).
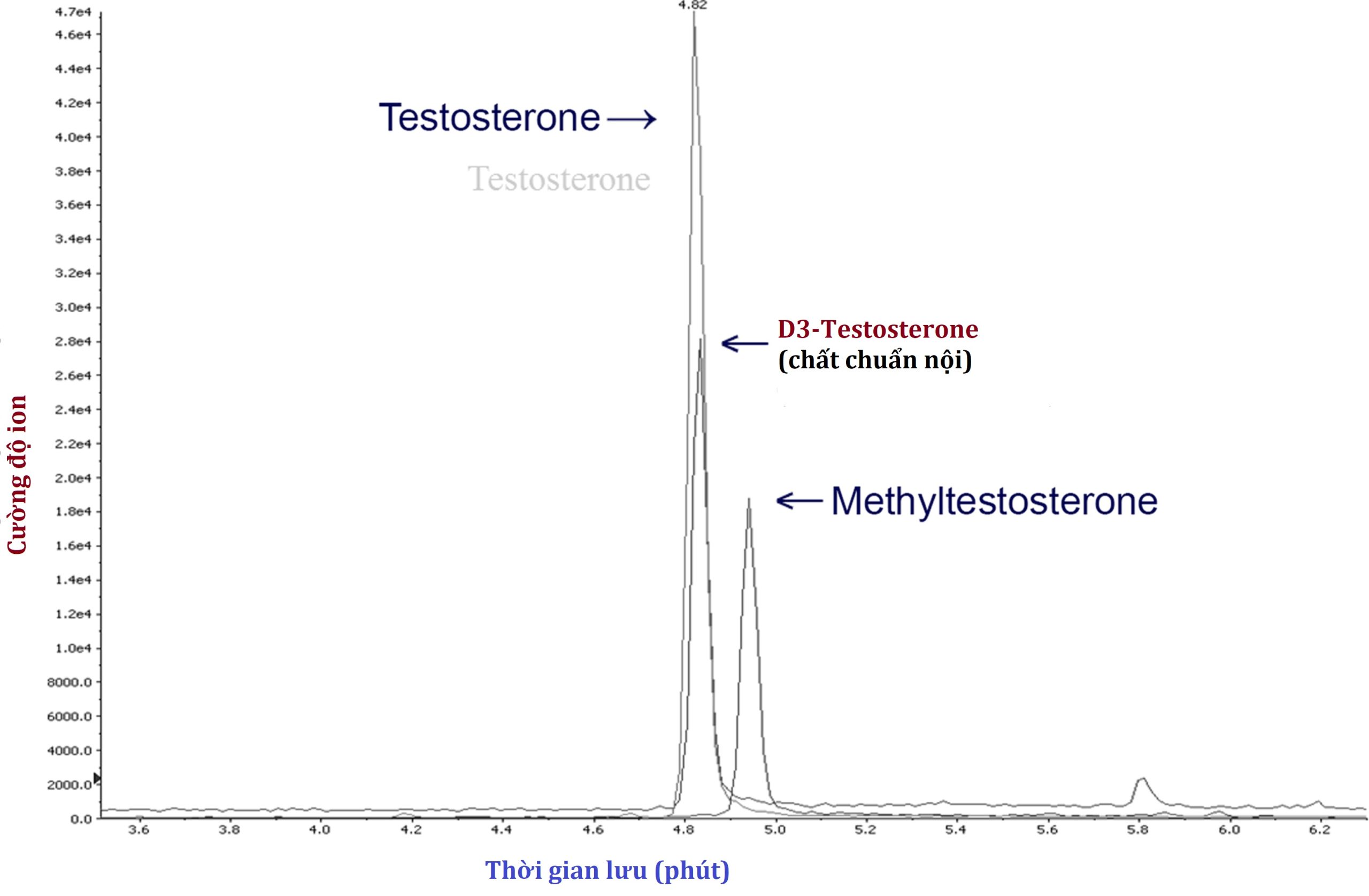
Hình 4.15 Định lượng testosterone bằng khối phổ. Testosterone có thể được đo định lượng bằng cách so sánh với một lượng đã biết của một chất chuẩn nội (testosterone được đánh dấu deuterium có khối lượng và thời gian lưu cao hơn một chút so với testosterone tự nhiên) được pha loãng vào mẫu. Methyltestosterone cũng có thể được đo riêng, do khối lượng cao hơn rõ rệt và thời gian lưu dài hơn trên cột sắc ký trước khi nó đến máy khối phổ.
- Xử lý dữ liệu để chuyển đổi dữ liệu cường độ ion thành kết quả xét nghiệm định lượng.
Những cải tiến hơn nữa về độ đặc hiệu phân tích sẽ có được khi hai máy phân tích khối được đặt nối tiếp (Hình 4.16). Trong một máy khối phổ song song ba tứ cực (MS/MS), máy phân tích/bộ lọc khối tứ cực đầu tiên tách các ion phân tử ban đầu, trong đó chỉ các ion có tỷ lệ m/z mong muốn được phép đi tiếp. Trong buồng thứ hai, nơi một tứ cực gia tốc các ion nhưng không lọc chúng, các ion được chọn va chạm với các phân tử của một khí trơ, chẳng hạn như argon, phá vỡ các “ion tiền chất” này một cách có thể dự đoán thành các mảnh đặc trưng (“ion con”), hoạt động như một dấu vân tay phân tử cho chất phân tích quan tâm. Các ion con này đi đến buồng thứ ba, nơi một máy phân tích/bộ lọc khối thứ hai chỉ cho phép các mảnh ion có tỷ lệ m/z cụ thể đi qua để đến máy dò.
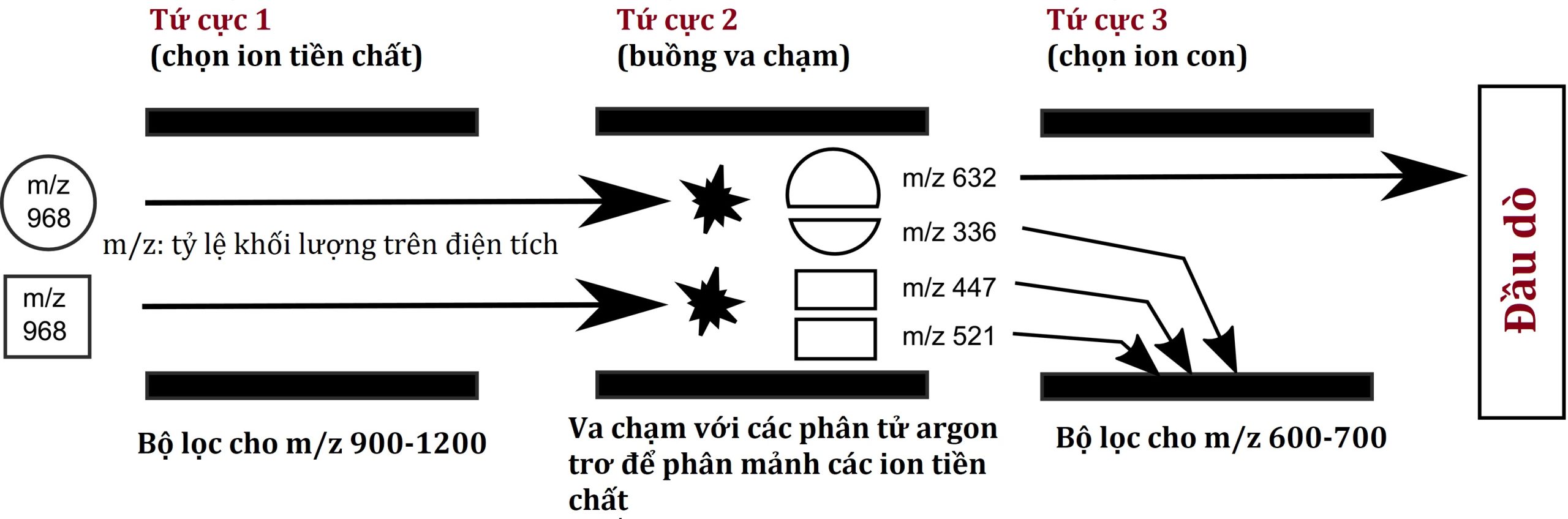
Hình 4.16 Cấu hình ba tứ cực để đạt được độ đặc hiệu phân tích cao. Ngay cả khi hai hợp chất có tỷ lệ khối lượng trên điện tích (m/z) giống hệt nhau và thời gian lưu sắc ký tương tự, chúng có thể được phân biệt bằng cách đo các “ion con” độc nhất của chúng sau một bước phân mảnh.
Mặc dù tính năng quan trọng nhất của MS đối với các nhà nội tiết học là độ đặc hiệu phân tích cao, nhưng vẫn có những khả năng đáng quan tâm khác. Một trong số đó là khả năng đo đồng thời nhiều chất phân tích, được gọi là phân tích đa thành phần. Các xét nghiệm miễn dịch cũng có thể được phân tích đa thành phần; tuy nhiên, các xét nghiệm như vậy có xu hướng khó thiết kế hơn nhiều và thường cho thấy các tương tác không mong muốn giữa nhiều phản ứng kháng thể-kháng nguyên khác nhau diễn ra trong cùng một ống mẫu. Ngược lại, với điều kiện các chất phân tích chịu được các điều kiện sắc ký và ion hóa tương đối giống nhau, nhiều phép đo MS có thể được thực hiện từ cùng một mẫu mà không có nhiễu chéo, làm giảm đáng kể thể tích mẫu cần thiết, ví dụ, cho một bảng các steroid tuyến thượng thận.
Trong vài năm qua, các máy khối phổ ngày càng có khả năng xử lý các phân tử ngày càng lớn hơn với độ phân giải ngày càng cao. Việc định lượng chính xác nhiều hormone peptide và protein hiện đã có sẵn. Phương pháp tiếp cận sớm nhất, vẫn được yêu cầu đối với các protein rất lớn, chẳng hạn như thyroglobulin (Tg, 660 kDa), bao gồm việc phân giải protein kỹ lưỡng và định lượng một đoạn peptide “dấu vân tay” bất biến. Phương pháp này, được gọi một cách không chính thức là proteomics “từ dưới lên”, được bổ sung bởi việc sử dụng gần đây hơn của proteomics “từ trên xuống”, nơi các protein nhỏ hơn (lên đến 20 kDa, với giới hạn trên liên tục tăng) có thể được phân tích và định lượng trực tiếp ở trạng thái nguyên vẹn của chúng (không cần phân giải protein). Cách tiếp cận proteomics từ trên xuống này đặc biệt thú vị, vì nó cho phép kiểm tra các protein ở trạng thái tự nhiên của chúng, bao gồm cả các sửa đổi sau dịch mã của chúng (ví dụ, glycosyl hóa, sialyl hóa, v.v.). Do đó, có khả năng xác định các đồng dạng protein cụ thể (có lẽ là những dạng có hoạt tính sinh học cao nhất?) để định lượng, nếu các nhà nghiên cứu nội tiết có thể xác định dạng nào nên được đo.
Proteomics từ trên xuống đòi hỏi sử dụng các máy khối phổ có độ phân giải cao, vì phương pháp xác định một protein dựa trên một “dấu vân tay đồng vị”. Với một thiết bị có độ phân giải thấp hơn, một protein nhỏ như insulin (5,8 kDa) có thể xuất hiện dưới dạng một đỉnh tròn nhẹ duy nhất mà danh tính của nó là insulin không chắc chắn 100%. Khi độ phân giải của máy khối phổ tăng lên, đỉnh này được tiết lộ là bao gồm nhiều đỉnh sắc nét hơn, tất cả đều có tỷ lệ m/z hơi khác nhau (Hình 4.17). Lý do insulin không có một đỉnh duy nhất ở một tỷ lệ m/z là vì một số phân tử insulin chứa các đồng vị bền tự nhiên như ¹³C thay vì ¹²C và do đó có khối lượng cao hơn một chút. Dựa trên kiến thức rằng khoảng 1,1% tổng số nguyên tử carbon là ¹³C, và insulin có 257 nguyên tử carbon, người ta có thể sử dụng xác suất để tính toán có bao nhiêu phân tử insulin có khả năng có 0, 1, 2, 3, hoặc nhiều ¹³C hơn. Người ta có thể làm tương tự đối với các đồng vị tự nhiên ít phong phú hơn, chẳng hạn như ¹⁵N, ¹⁸O, và ³⁴S, và do đó dự đoán về mặt toán học sự phân bố và cường độ ion của các đỉnh insulin ở các tỷ lệ m/z khác nhau, với các hồ sơ thực nghiệm khớp khá chặt chẽ (Hình 4.18). Các hồ sơ này hoạt động như những dấu vân tay xác định phân tử một cách chắc chắn là insulin.
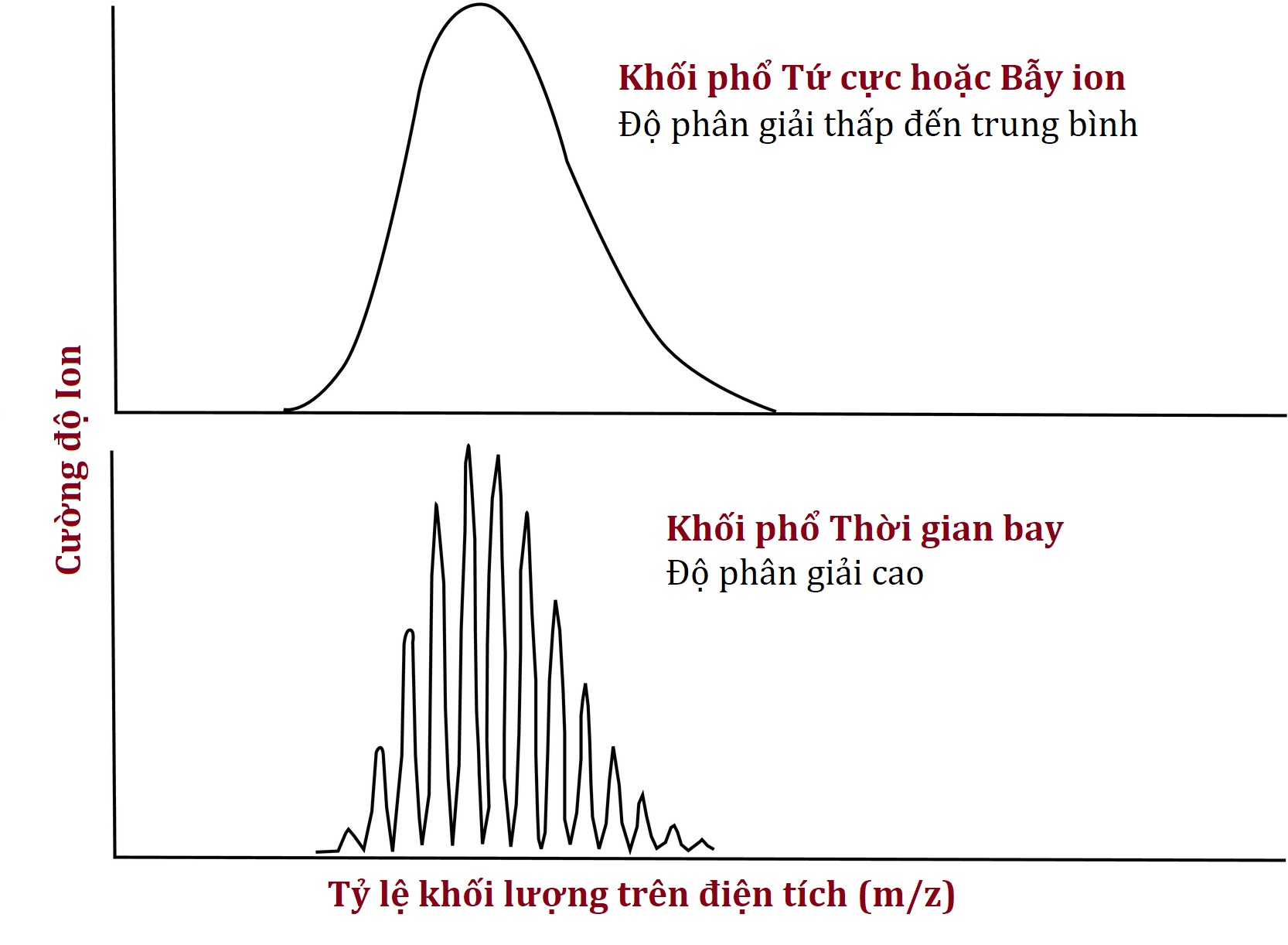
Hình 4.17 Khối phổ độ phân giải cao cho thấy nhiều đỉnh tương ứng với các protein có lượng đồng vị bền tự nhiên khác nhau.
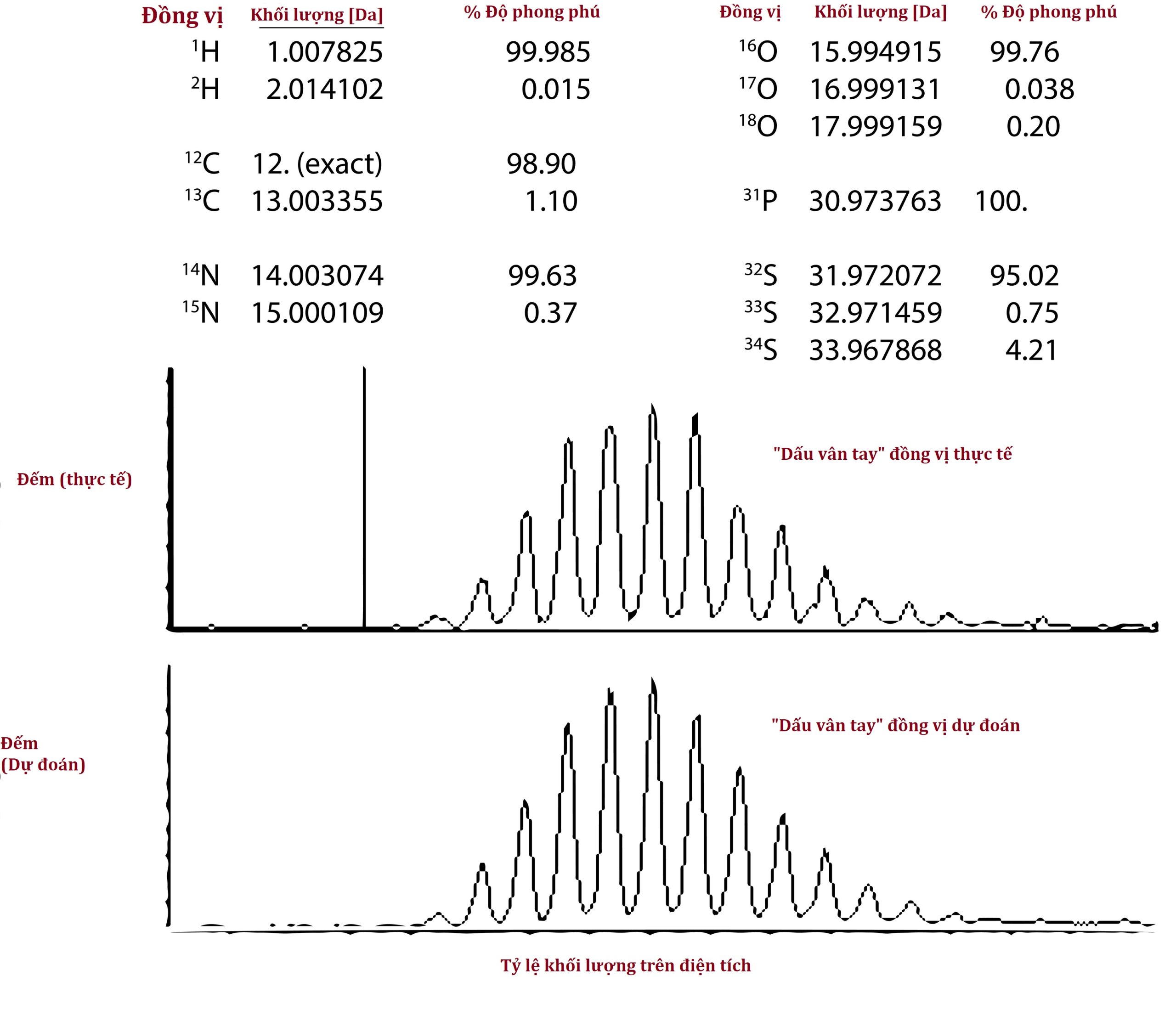
Hình 4.18 “Dấu vân tay đồng vị” khối phổ độ phân giải cao được dự đoán so với thực tế của insulin người.
Điều gì có thể sai? Sai sót, nhiễu, và những vấn đề tương tự
Sai sót có thể xảy ra ở bất kỳ thời điểm nào trong chu trình xét nghiệm chẩn đoán, ngay cả trước khi mẫu được thu thập.
- “Tiền phân tích” đề cập đến bất cứ điều gì xảy ra trước khi xét nghiệm thực tế một mẫu (bổ sung bởi “phân tích” và “hậu phân tích”). Bởi vì ước tính một nửa đến hai phần ba các sai sót ảnh hưởng đến kết quả xét nghiệm xảy ra trong giai đoạn tiền phân tích, điều quan trọng đối với bác sĩ lâm sàng là phải hiểu nhiều điều có thể sai ngay cả trước khi bắt đầu xét nghiệm.
Một trong những câu hỏi đầu tiên cần đặt ra là liệu xét nghiệm đúng có được chỉ định cho đúng bệnh nhân vào đúng thời điểm hay không. Ví dụ, một xét nghiệm cortisol tự do trong huyết thanh được lấy vào lúc 4 giờ chiều trên một bệnh nhân nghi ngờ suy thượng thận có xác suất cao là không thể giải thích được, cả vì khả năng có giá trị thấp không cung cấp thông tin (có thể dễ dàng là một phát hiện bình thường) và vì dữ liệu định mức sử dụng cortisol tự do hạn chế hơn nhiều so với cortisol toàn phần (đặc biệt là trong nhi khoa). Điều này có thể hữu ích hơn một chút đối với một bệnh nhân nghi ngờ hội chứng/bệnh Cushing, nhưng ngay cả khi đó vẫn có những phương pháp xét nghiệm tốt hơn. Đối với một số xét nghiệm, không có lý do kỹ thuật/sinh lý nào mà một mẫu buổi chiều không thể được sử dụng—ngoại trừ việc, nếu tất cả dữ liệu định mức có sẵn đều dựa trên các mẫu buổi sáng nhịn ăn hoặc mẫu nước tiểu đầu tiên vào buổi sáng, thì việc giải thích sẽ khó khăn hơn nhiều.
Vấn đề xét nghiệm đúng đặc biệt quan trọng đối với các bác sĩ nội tiết nhi khoa, những người may mắn thường được đào tạo tốt để tìm kiếm các xét nghiệm (ít nhất là đối với các xét nghiệm cốt lõi được sử dụng phổ biến nhất) trả lời chính xác nhất các câu hỏi lâm sàng của họ. Các vấn đề xung quanh độ chính xác của các xét nghiệm testosterone hoặc estradiol ở các khoảng thấp điển hình cho trẻ em đã được các chuyên gia biết đến trong nhiều thập kỷ, nhưng cho đến nay, có rất ít hoặc không có gì trong hướng dẫn của Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ hoặc danh sách kiểm tra của Trường Cao đẳng Bệnh học Hoa Kỳ (được sử dụng để đánh giá chất lượng phòng xét nghiệm) để không khuyến khích việc sử dụng các xét nghiệm miễn dịch testosterone không bao gồm các bước chiết tách và sắc ký (xem phần Phương pháp luận) để đảm bảo độ chính xác của kết quả ở các khoảng thấp hơn thường thấy ở trẻ em (lưu ý: điều này cũng áp dụng cho việc đo testosterone ở phụ nữ trưởng thành, hoặc estradiol ở nam giới, vì vậy nó không phải là một mối quan tâm riêng của nhi khoa). Một bác sĩ lâm sàng phải biết đủ về các xét nghiệm được chỉ định để biết khi nào nên yêu cầu một cái gì đó khác với dịch vụ tiêu chuẩn trên một phiếu xét nghiệm, và việc biết xét nghiệm đúng để chỉ định không phải lúc nào cũng liên quan đến việc yêu cầu phiên bản tiêu chuẩn vàng của một xét nghiệm; ví dụ, khi sàng lọc một bệnh nhân béo phì về cơ bản khỏe mạnh về rối loạn chức năng tuyến giáp, việc đo T4 tự do bằng thẩm tách cân bằng có thể là quá mức cần thiết, khi T4 tự do không thẩm tách nhanh hơn, sẵn có hơn và có lẽ rẻ hơn nhiều có thể là đủ (giả sử rằng bác sĩ nội tiết biết những hạn chế của xét nghiệm này).
Loại mẫu/loại ống thu thập chính xác đã được sử dụng chưa? Đối với nhiều chất phân tích, có sự khác biệt đáng kể về giá trị huyết thanh so với huyết tương, hoặc giữa giá trị huyết tương EDTA so với natri hoặc lithium heparin. Một mẫu huyết thanh vô tình được gửi để đo hoạt độ renin huyết tương (một sự cố phổ biến đáng ngạc nhiên) sẽ cho thấy các giá trị bị ức chế rõ ràng (người ta có thể dễ dàng kiểm tra khả năng này bằng cách yêu cầu phòng xét nghiệm kiểm tra nồng độ canxi trong mẫu, nồng độ này phải thấp trong mẫu huyết tương EDTA phù hợp). Một vấn đề rất phổ biến khác là việc sử dụng các ống tách huyết thanh (SST), có thể gây nhiễu hoặc ảnh hưởng đến nồng độ đo được của một số steroid (ví dụ, estradiol và testosterone), các vitamin tan trong chất béo (vitamin A và các chất chuyển hóa của vitamin D), và các loại thuốc kỵ nước. Bởi vì các ống SST tiện lợi hơn nhiều cho mục đích thu thập (ít thời gian chờ đợi để mẫu đông lại, và ít tốn công hơn nhiều trong việc tách huyết thanh khỏi khối tế bào), chúng có xu hướng là loại ống “mặc định” để thu thập huyết thanh; do đó, những người thu thập mẫu phải chú ý đến các yêu cầu về mẫu vật khi ống có khả năng ảnh hưởng đến độ chính xác của xét nghiệm.
Có yếu tố nào trong quá trình thu thập mẫu có thể ảnh hưởng đến kết quả không? Ví dụ bao gồm tán huyết do lấy máu khó khăn (giải phóng enzyme phân hủy insulin từ các tế bào hồng cầu) hoặc nhiễm bẩn vị trí chọc tĩnh mạch khuỷu tay bằng testosterone bôi ngoài da (có khả năng làm tăng nồng độ testosterone lên đến hàng trăm hoặc thậm chí hàng nghìn ng/dL). Một ví dụ khác là sự gia tăng kết quả T4 tự do bằng thẩm tách cân bằng khi các mẫu được lấy qua một đường truyền có heparin; heparin kích thích lipoprotein lipase phân hủy triglyceride thành NEFA + glycerol, với NEFA đẩy T4 ra khỏi TBG trong ống mẫu.
Có vấn đề nào trong quá trình xử lý, bảo quản và vận chuyển mẫu sau khi thu thập không? Ví dụ, nồng độ phosphoethanolamine (PEA) trong huyết thanh có thể tăng 2,7 lần trong các mẫu mà huyết thanh vẫn tiếp xúc với các tế bào máu trong 6 giờ, thay vì được tách trong vòng một giờ; nồng độ PEA có thể giảm 80% nếu huyết thanh được tách đúng cách được để ở nhiệt độ phòng trong 24 giờ. Kali huyết thanh tăng đáng kể khi các mẫu máu toàn phần được làm lạnh trong thời gian ngắn chỉ 6 giờ trước khi được ly tâm và xử lý (Hình 4.19), so với các mẫu được để ở nhiệt độ phòng trong cùng một khoảng thời gian.
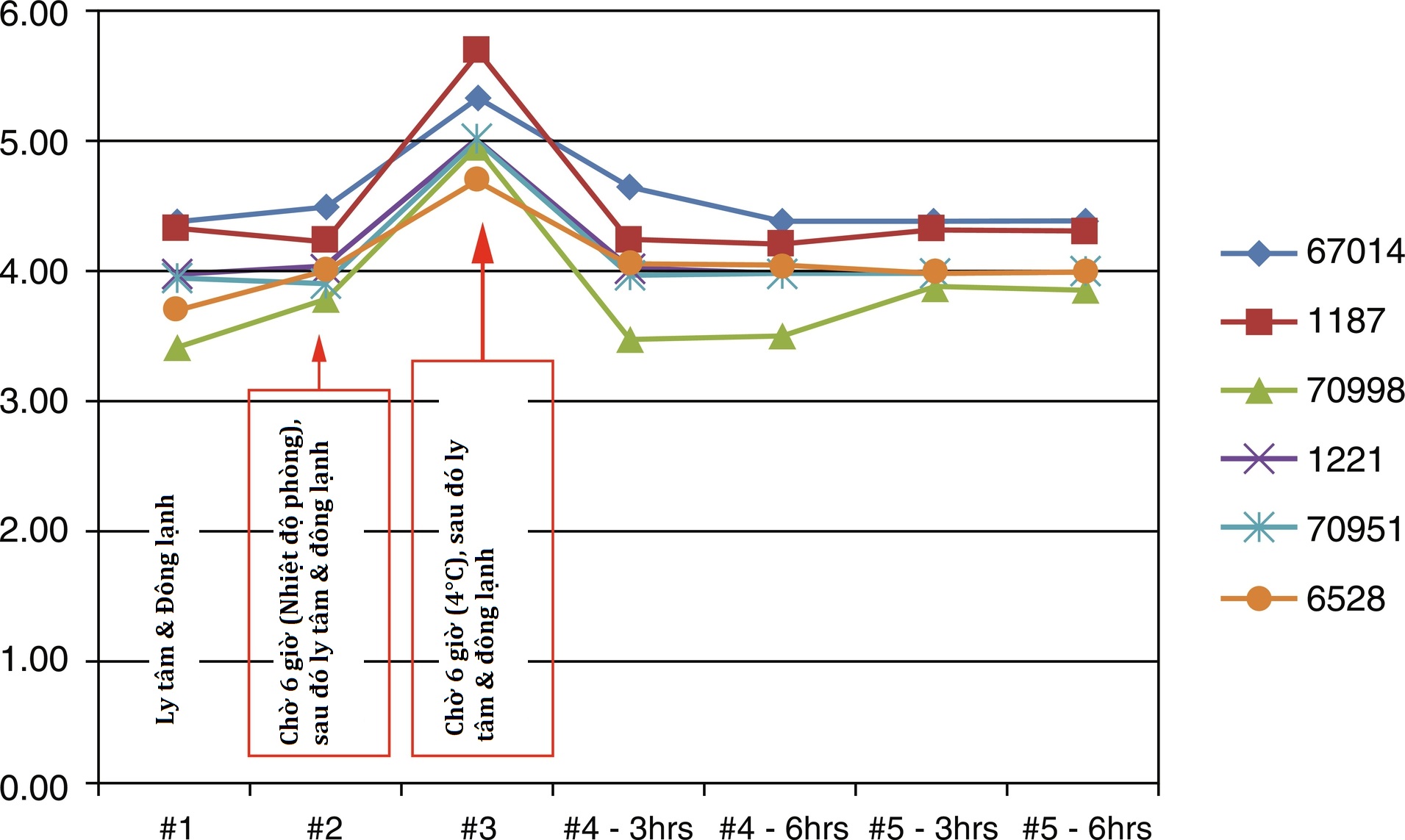
Hình 4.19 Ảnh hưởng của việc làm lạnh đến sự giải phóng kali từ các tế bào hồng cầu nguyên vẹn vào huyết thanh. Sáu tình nguyện viên khỏe mạnh được lấy máu vào các ống nắp đỏ trơn (không có chất phụ gia), với một mẫu con (#1) được ly tâm ngay lập tức và huyết thanh được đông lạnh ngay lập tức. Mẫu con #2 được để đứng trong 6 giờ ở nhiệt độ phòng (20° C) trước khi ly tâm và bảo quản huyết thanh đông lạnh. Mẫu con #3 được đặt trong tủ lạnh (4° C) trong 6 giờ trước khi ly tâm/bảo quản huyết thanh. Tất cả các đối tượng đều cho thấy kali huyết thanh cao hơn đáng kể trong mẫu con #3. (Dữ liệu từ Quest Diagnostics Nichols Institute, San Juan Capistrano.)
Có khả năng nào xảy ra nhầm lẫn/trộn lẫn mẫu ở bất kỳ đâu trong quá trình từ thu thập đến báo cáo kết quả không? Hậu quả của một sự kiện như vậy đối với độ chính xác của xét nghiệm là rõ ràng.
Các yếu tố gây nhiễu tiềm ẩn trong Xét nghiệm miễn dịch
Các xét nghiệm miễn dịch đo lường sandwich có khả năng dễ bị ảnh hưởng bởi cái được gọi là hiệu ứng “hook” hoặc “prozone”, có thể dẫn đến các giá trị bình thường hoặc thấp giả khi có một lượng lớn chất phân tích (Hình 4.20). Nói chung, khi nồng độ chất phân tích tăng lên, nhiều phức hợp sandwich kháng thể-chất phân tích-kháng thể được hình thành hơn, dẫn đến tín hiệu được phát hiện nhiều hơn. Tuy nhiên, ở nồng độ chất phân tích cực cao, có thể cả kháng thể bắt giữ và phát hiện đều bị bão hòa bởi chất phân tích trước khi hình thành một phức hợp sandwich, dẫn đến việc kháng thể phát hiện bị rửa trôi và tín hiệu thấp bị hiểu sai là nồng độ chất phân tích thấp. Hiện tượng này không thấy ở các xét nghiệm miễn dịch cạnh tranh. Để giảm thiểu khả năng xảy ra hiệu ứng hook, hầu hết các xét nghiệm miễn dịch đo lường hiện đã sửa đổi phương pháp của họ như sau: chất phân tích được phép liên kết với kháng thể bắt giữ, một bước rửa kỹ lưỡng loại bỏ chất phân tích không liên kết dư thừa, và chỉ sau đó kháng thể phát hiện mới được thêm vào. Trong tình huống cực kỳ hiếm gặp hiện nay khi hiệu ứng hook vẫn bị nghi ngờ, có thể thực hiện pha loãng nối tiếp mẫu để xem liệu nồng độ biểu kiến của chất phân tích có thực sự tăng lên khi pha loãng mẫu tăng lên hay không.
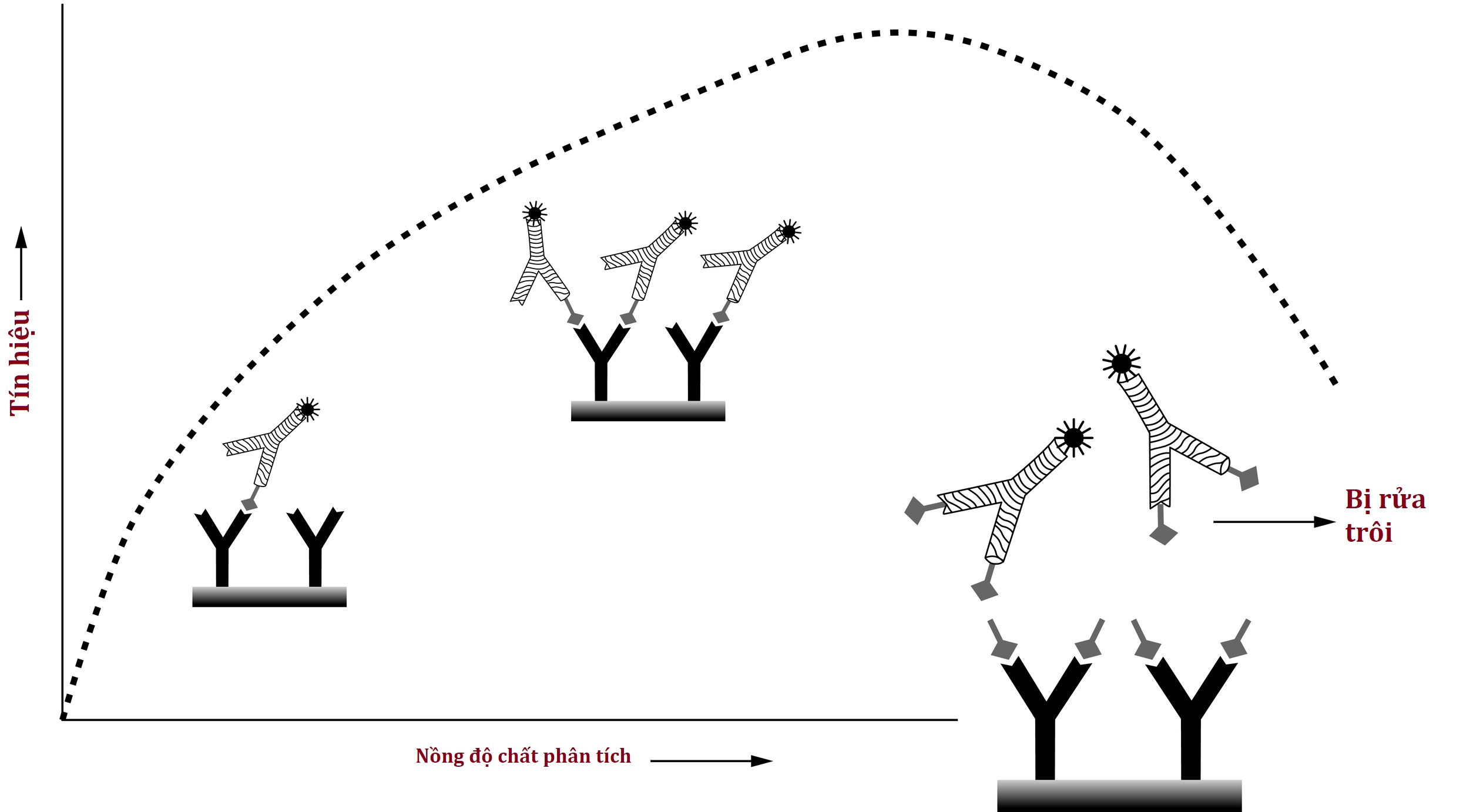
Hình 4.20 Hiệu ứng hook (còn gọi hiệu ứng móc) (prozone) dẫn đến kết quả thấp giả. Nồng độ chất phân tích cực cao dẫn đến việc chiếm giữ tất cả các vị trí liên kết mà không tạo ra cấu hình “sandwich” của xét nghiệm. Kháng thể tín hiệu bị rửa trôi và tín hiệu thấp được hiểu là nồng độ chất phân tích thấp (đường chấm). Pha loãng mẫu có thể dẫn đến tăng tín hiệu và tăng biểu kiến nồng độ chất phân tích đo được.
Có một số sự không nhất quán trong y văn xung quanh các thuật ngữ kháng thể dị loài và kháng thể kháng động vật ở người (HAAA) hoặc kháng thể kháng chuột ở người (HAMA). Một số tác giả sử dụng các thuật ngữ này thay thế cho nhau; những người khác dành thuật ngữ dị loài cho các kháng thể có ái lực thấp tự phát sinh chống lại nhiều kháng nguyên được xác định kém và chỉ sử dụng HAMA hoặc HAAA cho những bệnh nhân phát triển các kháng thể có ái lực cao cụ thể do điều trị bằng kháng thể đơn dòng của chuột hoặc do tiếp xúc tái phát với một loài động vật cụ thể (ví dụ, các vết trầy xước phải chịu bởi một người xử lý thỏ). Bất kể thuật ngữ nào được sử dụng, bất kỳ bệnh nhân nào cũng có thể có các kháng thể có mặt liên kết với và gây nhiễu cho các kháng thể động vật (đơn dòng của chuột; đa dòng của thỏ, dê, hoặc lừa) được sử dụng trong một xét nghiệm miễn dịch cụ thể, ngay cả khi không có tiếp xúc trước đó với loài động vật cụ thể đó. Các kháng thể này có thể bắc cầu cho các kháng thể bắt giữ và phát hiện trong một xét nghiệm miễn dịch đo lường, như được trình bày trong Hình 4.21 (bảng bên trái), tạo ra một sandwich và một tín hiệu cao (tăng giả) ngay cả khi không có chất phân tích. Ngoài ra, chúng có thể gắn vào vị trí liên kết của kháng thể bắt giữ và ngăn chặn sự liên kết của chất phân tích (Hình 4.21, bảng bên phải), loại bỏ sự hình thành của sandwich, và gây ra một giá trị thấp giả. Các xét nghiệm miễn dịch cạnh tranh ít bị ảnh hưởng hơn, mặc dù chúng có thể cho thấy các giá trị cao giả nếu kháng thể gây nhiễu cạnh tranh mạnh hơn kháng thể xét nghiệm để giành lấy chất đánh dấu, hoặc các giá trị thấp giả nếu chúng liên kết ưu tiên với chất phân tích hơn là chất đánh dấu.
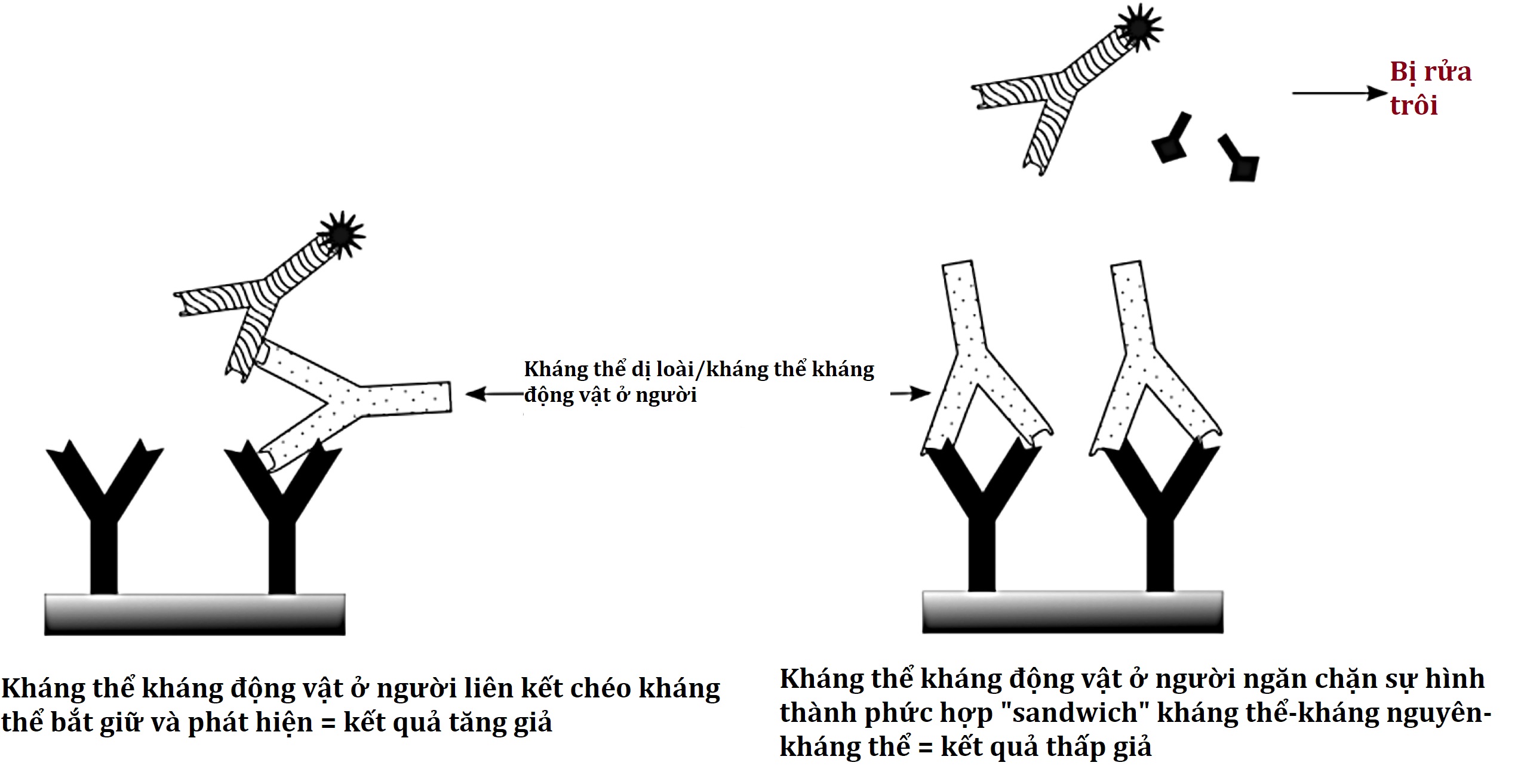
Hình 4.21 Cơ chế nhiễu xét nghiệm miễn dịch đo lường bởi các kháng thể dị loài hoặc kháng thể kháng động vật ở người. Xem văn bản để biết chi tiết.
Khi nghi ngờ có hiệu ứng dị loài/HAAA/HAMA, mẫu nên được xét nghiệm trên một nền tảng xét nghiệm miễn dịch khác vì sự nhiễu thường đặc hiệu cho xét nghiệm của một nhà sản xuất nhưng không phải của nhà sản xuất khác. Chỉ hiếm khi nhiễu kháng thể dị loài ảnh hưởng đến nhiều xét nghiệm hoặc các nền tảng khác nhau. Một thủ thuật như vậy thường là nhanh nhất để thực hiện, nhưng phòng xét nghiệm gửi đi phải đảm bảo rằng phòng xét nghiệm thứ hai thực sự đang sử dụng một nền tảng khác. Một lựa chọn khác là sử dụng các chất chặn kháng thể dị loài, là một hỗn hợp các mảnh immunoglobulin động vật hoặc các chất độc quyền khác hấp thụ các kháng thể gây nhiễu. Một nhược điểm của phương pháp này đối với nhi khoa là cần một thể tích mẫu lớn hơn đáng kể để xét nghiệm cả có và không có sử dụng chất chặn. Một lựa chọn thứ ba, tốn nhiều công sức hơn là xét nghiệm mẫu ở các độ pha loãng nối tiếp, vì những mẫu cho thấy các hiệu ứng nhiễu kháng thể có xu hướng không cho thấy các phản ứng tuyến tính khi pha loãng. Cần lưu ý, lựa chọn cuối cùng cũng yêu cầu bằng chứng trước đó (thẩm định) rằng xét nghiệm tiếp tục cho thấy một phản ứng tuyến tính trên các mẫu pha loãng, bằng chứng không phải lúc nào cũng có sẵn.
Nhiễu tự kháng thể đặc hiệu dường như hiếm gặp so với nhiễu dị loài/HAAA/HAMA được mô tả trong phần trước, với ngoại lệ đáng chú ý là kháng thể Tg (TgAb) ở bệnh nhân ung thư tuyến giáp. TgAb có mặt ở khoảng 20% đến 25% bệnh nhân ung thư tuyến giáp và dẫn đến giảm giả nồng độ Tg bằng xét nghiệm miễn dịch đo lường (ví dụ, Tg-ICMA). Ngoài ra, các xét nghiệm kháng thể Tg khác nhau có thể báo cáo các kết quả không nhất quán (âm tính so với dương tính) trong một số trường hợp. Mặc dù một xét nghiệm cạnh tranh, chẳng hạn như Tg-RIA, ít bị ảnh hưởng bởi nhiễu TgAb hơn là Tg-ICMA, nếu tự kháng thể có ái lực đủ cao để cạnh tranh mạnh hơn kháng thể xét nghiệm, một xét nghiệm Tg-RIA có thể cho thấy sự tăng giả khi có mặt của TgAb như vậy. Nhìn chung, bất kỳ kết quả xét nghiệm miễn dịch Tg nào, cho dù được thực hiện bằng Tg-ICMA hay Tg-RIA, phải được xem là có khả năng bị ảnh hưởng ở một bệnh nhân có TgAb (và thậm chí có thể ở những bệnh nhân có TgAb được báo cáo là âm tính). Các chỉ số thay thế hữu ích cho Tg bao gồm theo dõi hiệu giá TgAb, hiệu giá này sẽ giảm theo thời gian ở những bệnh nhân không tái phát ung thư. Đo nồng độ Tg bằng LCMS là phương pháp được lựa chọn để lập hồ sơ nồng độ Tg để theo dõi ung thư tuyến giáp khi có kháng thể kháng Tg. Các nghiên cứu hình ảnh cũng có thể giúp đánh giá xác suất tái phát. Mặc dù hiếm gặp, các tự kháng thể có thể có ái lực đủ cao để ảnh hưởng đến cả các xét nghiệm cạnh tranh và miễn dịch đo lường. Do đó, chúng ít có khả năng cho thấy sự khác biệt khi được xét nghiệm trên các nền tảng khác nhau và không bị ảnh hưởng bởi các chất chặn kháng thể dị loài. Trong những kịch bản này, chẩn đoán có thể yêu cầu đo lường tự kháng thể đặc hiệu (ví dụ, một xét nghiệm kháng thể hormone tuyến cận giáp [PTH] ở một người có nồng độ PTH cao hoặc thấp không tương xứng).
Chuẩn hóa/Hài hòa hóa: có liên quan lâm sàng và cực kỳ quan trọng
Một thực tế đáng thất vọng là các phiên bản khác nhau của một xét nghiệm có cùng tên thường cho các kết quả khác nhau, đôi khi một cách đáng ngạc nhiên. Đôi khi vấn đề là về phương pháp luận, liên quan đến sự khác biệt về độ tinh khiết của mẫu và độ đặc hiệu phân tích, như chúng ta đã thấy với các xét nghiệm miễn dịch testosterone được chạy trực tiếp trên huyết thanh, so với đo lường khối phổ của testosterone sau khi chiết tách và sắc ký. Trong các trường hợp khác, nó có thể liên quan đến sinh học phức tạp của một chất phân tích, chẳng hạn như hormone gonadotropin màng đệm người (hCG), với ít nhất bảy đồng dạng phân tử khác nhau (nguyên vẹn, bị cắt, glycosyl hóa cao, các tiểu đơn vị tự do, các mảnh lõi beta, và nhiều hơn nữa); kết quả của một xét nghiệm miễn dịch hCG do đó sẽ phụ thuộc vào các epitope mà các kháng thể xét nghiệm nhận ra và các điều kiện phản ứng được sử dụng. Trong một số trường hợp, sự khác biệt xuất hiện do thiết kế xét nghiệm: ví dụ, một xét nghiệm được thiết kế đặc biệt để chỉ phát hiện osteocalcin có chiều dài đầy đủ sẽ dễ bị ảnh hưởng bởi sự khác biệt trong xử lý, thao tác và bảo quản hơn nhiều, so với một xét nghiệm nhắm vào vùng giữa phân tử ổn định hơn.
Một ví dụ hàng đầu về sự khác biệt xét nghiệm liên quan đến nội tiết nhi khoa là của GH. Nhiều nghiên cứu ban đầu được thực hiện để thiết lập các ngưỡng chẩn đoán cho GHD đã sử dụng một xét nghiệm miễn dịch cạnh tranh với các kháng thể đa dòng. Khi một xét nghiệm GH miễn dịch đo lường (IRMA) dựa trên kháng thể đơn dòng mới được Hybritech giới thiệu, kết quả GH thường bằng 60% so với kết quả trong xét nghiệm ban đầu, dẫn đến nhiều bệnh nhân được chẩn đoán mắc GHD hơn nếu sử dụng cùng các ngưỡng chẩn đoán. Mặc dù người ta cho rằng các giá trị thấp hơn là do độ đặc hiệu phân tích cao hơn của một định dạng miễn dịch đo lường và các kháng thể đơn dòng, đây không phải là toàn bộ câu trả lời, vì một xét nghiệm GH miễn dịch đo lường/kháng thể đơn dòng khác (Wellcome IRMA) thực sự cho kết quả cao hơn khoảng 30% so với xét nghiệm GH cạnh tranh/đa dòng ban đầu, cho thấy các yếu tố khác (ví dụ, việc sử dụng huyết thanh động vật so với người trong các dung dịch pha loãng xét nghiệm, cường độ ion của các dung dịch xét nghiệm, nhiệt độ và thời gian ủ) cũng tạo ra sự khác biệt đáng kể.
Một yếu tố khác góp phần (ngay cả ngày nay) vào sự khác biệt của xét nghiệm GH là sự phát hiện khác nhau của các đồng dạng hormone tăng trưởng thay thế. Mặc dù GH 22-kDa là đồng dạng chiếm ưu thế (90% tổng số GH), 10% còn lại bao gồm GH 20-kDa và một lượng nhỏ các dạng khác. Để hình dung điều này một cách sơ đồ, hãy tưởng tượng rằng bạn được yêu cầu đếm số ngôi sao trong hộp được trình bày trong Hình 4.22. Trừ khi mọi người đồng ý về định nghĩa của một ngôi sao (chỉ có 5 cánh?) trước khi đếm, những người quan sát khác nhau có thể có tổng số khác nhau. Bài học rút ra là các nhà nội tiết học với tư cách là một nhóm cần phải xác định chính xác những gì họ muốn đo, nếu có bất kỳ hy vọng nào để các xét nghiệm đồng ý chặt chẽ hơn trong tương lai.

Hình 4.22 Có bao nhiêu ngôi sao trong hộp? Điều này cho thấy sự vô ích của việc định lượng nếu các định nghĩa không được thống nhất trước.
Để chuyển đổi một phép đo xét nghiệm (ví dụ, số đếm mỗi phút, đơn vị ánh sáng tương đối, hoặc chiều cao đỉnh) thành một lượng hormone có thể định lượng được, cần phải sử dụng các chất chuẩn—các nồng độ đã biết của hormone đang được đo có thể được đo cùng với các mẫu của bệnh nhân. Nhưng làm thế nào chúng ta có thể chắc chắn rằng các chất chuẩn là tương tự nhau giữa các xét nghiệm khác nhau?
Giải pháp tốt nhất hiện có là cung cấp cho các phòng xét nghiệm và các nhà sản xuất bộ kit/thiết bị chẩn đoán các vật liệu tham chiếu được đặc tính hóa tốt. Các vật liệu tham chiếu này phải có thể truy xuất nguồn gốc từ một vật liệu tham chiếu chuẩn (SRM) hoặc chế phẩm tham chiếu quốc tế (IRP), lý tưởng là càng tinh khiết càng tốt và có nồng độ càng chính xác càng tốt. Các SRM thường được cung cấp bởi các tổ chức, chẳng hạn như Viện Tiêu chuẩn và Công nghệ Quốc gia hoặc Tổ chức Y tế Thế giới (WHO); các SRM từ WHO thường được gọi là chuẩn quốc tế (IS).
Vài năm trước, gần như tất cả các xét nghiệm GH đã chuyển sang các chất chuẩn bao gồm GH 22-kDa tái tổ hợp tinh khiết (Chế phẩm Tham chiếu Nội bộ của WHO 98/574). Người ta hy vọng rằng điều này sẽ làm cho các xét nghiệm đồng thuận hơn. Điều này đã giúp phần nào, nhưng nó không phải là một giải pháp dứt điểm. Ví dụ, nhìn vào ba xét nghiệm GH phổ biến đều sử dụng IRP 98/574 làm chuẩn tham chiếu cho các chất chuẩn xét nghiệm, vẫn có sự khác biệt đáng kể. Xét nghiệm GH do Siemens sản xuất trên nền tảng Immulite có các mức độ (40%–77%) phản ứng chéo khác nhau với GH 20-kDa. Xét nghiệm GH của Beckman Coulter trên nền tảng Access về cơ bản không có phản ứng chéo với 20-kDa và cho kết quả bằng khoảng 76% so với kết quả trên Immulite. Xét nghiệm Roche Elecsys, với phản ứng chéo đáng kể với GH 20-kDa, chạy cao hơn khoảng 11% so với Immulite.
Nếu các xét nghiệm GH không đồng thuận, làm thế nào chúng ta có thể thiết lập các ngưỡng chẩn đoán phổ quát? Một nhóm châu Âu đã đề xuất các ngưỡng cắt xét nghiệm GH đặc hiệu cho từng nền tảng khác nhau (ví dụ, GH đỉnh 7,77 ng/mL cho Immulite và 5,15 ng/mL cho nền tảng Beckman Coulter Access/DxI) cho xét nghiệm kích thích GH, một cách tiếp cận chưa được chấp nhận rộng rãi.
Một giải pháp thay thế cho các ngưỡng cắt đặc hiệu cho từng xét nghiệm là chuẩn hóa hoặc hài hòa hóa các xét nghiệm khác nhau:
- Chuẩn hóa có nghĩa là làm cho các xét nghiệm đồng thuận bằng cách xác định rõ ràng chất phân tích cần đo (ví dụ, GH 22 kDa thay vì tất cả các đồng dạng GH), có một chế phẩm tham chiếu tinh khiết được xác định rõ (ví dụ, IRP 98/574), và một phương pháp tiêu chuẩn vàng mà tất cả các phương pháp khác có thể được so sánh. Chỉ một số ít các xét nghiệm có thể đáp ứng các tiêu chí này.
- Hài hòa hóa là một cách tiếp cận ít nghiêm ngặt hơn để cải thiện sự đồng thuận của xét nghiệm bằng cách chọn các vật liệu tham chiếu tùy ý (ngay cả khi không tinh khiết và được xác định rõ) và chỉ định một xét nghiệm cụ thể làm chuẩn tham chiếu, ngay cả khi không thực sự là một phương pháp tiêu chuẩn vàng. Hormone luteinizing sẽ là một ứng cử viên tốt cho việc hài hòa hóa, nhưng không phải chuẩn hóa, vì nó có hàng chục đồng dạng khác nhau (khác nhau về mức độ sialyl hóa, glycosyl hóa, hoặc sulfat hóa), không có chế phẩm tham chiếu tinh khiết nào có sẵn, và không có xét nghiệm tiêu chuẩn vàng. Thông thường, đối với một nỗ lực hài hòa hóa, một phòng xét nghiệm trung tâm chuẩn bị các pool mẫu có giá trị xác định và phân phối các mẫu con của pool này cho các phòng xét nghiệm khác, những phòng này sau đó có thể điều chỉnh hiệu chuẩn của họ để khớp với các giá trị này.
Có các nhóm làm việc tích cực trong cộng đồng hóa học lâm sàng quốc tế đang tìm cách chuẩn hóa các xét nghiệm cho insulin (làm việc với Hiệp hội Đái tháo đường Hoa Kỳ), các chất chuyển hóa vitamin D, T4 tự do/TSH, và một số dấu ấn xương (C-telopeptide và procollagen type 1 N-terminal propeptide). Sự khó khăn trong việc hoàn thành các nhiệm vụ này được minh họa bởi hơn 15 năm làm việc của Nhóm Công tác Chuẩn hóa Insulin trong dự án này (rất cần thiết vì các xét nghiệm insulin có thể dễ dàng thay đổi đến hai lần ở mức cao và có lẽ nhiều hơn nữa ở mức thấp). Các nỗ lực chuẩn hóa và hài hòa hóa hiện tại cũng có thể được theo dõi tại trang web của Hiệp hội Quốc tế về Hài hòa hóa Kết quả Xét nghiệm Lâm sàng (www.harmonization.net). Hiện đang được liệt kê là:
- Phosphatase kiềm, alpha fetoprotein, C-peptide, canxi ion hóa, cortisol, fructosamine, glucose, GH, hemoglobin A1c, hCG, insulin, lipoprotein/triglyceride, magiê, PTH, phốt phát, T4, T4 tự do, và T3 tự do.
Cũng có những sáng kiến ít chính thức hơn để hài hòa hóa các xét nghiệm steroid phổ biến (testosterone và estradiol). Các bác sĩ nội tiết nhi khoa có quan tâm lâm sàng hoặc nghiên cứu về bất kỳ chất phân tích cụ thể nào có thể muốn theo dõi tiến trình và việc ra quyết định của các nhóm làm việc này.
Khoảng tham chiếu
Khoảng tham chiếu (RI) là thuật ngữ được các chuyên gia xét nghiệm ưa thích hơn cho cái thường được gọi là dải tham chiếu, được ưa thích vì thực tế là dải được định nghĩa chính thức trong thống kê là một con số duy nhất (natri huyết thanh có thể có RI là 135–145 mmol/L, nhưng dải là 10 mmol/L). Dù chọn thuật ngữ nào (miễn là không sử dụng thuật ngữ dải bình thường!), tầm quan trọng của khái niệm này là rõ ràng đối với thực hành nội tiết nhi khoa. Điều có thể không rõ ràng bằng là nhiều RI hiện có cho các xét nghiệm thường được sử dụng lại mong manh một cách đáng ngạc nhiên, nhiều trong số đó dựa trên số lượng đối tượng nhỏ, các phương pháp luận cũ/khác, hoặc các tài liệu tham khảo có thể hoặc không thể áp dụng cho xét nghiệm đang được đề cập. Cũng không rõ ràng đối với hầu hết mọi người, là số lượng các quyết định chủ quan phải được đưa ra khi lập kế hoạch các nghiên cứu RI, phân tích dữ liệu, và quyết định các trích dẫn RI cuối cùng. Mặc dù óc phán đoán lâm sàng tốt có thể bù đắp cho những hạn chế hiện tại của RI, nhưng điều quan trọng là cộng đồng nội tiết nhi khoa phải tham gia cùng với các nhà xét nghiệm, nhà thống kê, và thậm chí cả các nhà quản lý để đảm bảo rằng tình hình RI không ngừng được cải thiện, thay vì xấu đi.
Để xem xét nhanh, điểm đầu tiên (và có lẽ rõ ràng nhất) về RI là chúng áp dụng cho một nhóm mẫu tham chiếu (được chọn từ một quần thể tham chiếu được xác định chính xác một cách hy vọng) và không nhất thiết áp dụng cho bệnh nhân đang được đề cập. Một ví dụ rõ ràng là một cá nhân bị hạ đường huyết nặng có giá trị insulin là 9 uIU/mL về mặt kỹ thuật nằm trong RI dưới 23 uIU/mL nhưng là bất thường trong bối cảnh lâm sàng đó. RI chỉ áp dụng cho các đối tượng khỏe mạnh nhịn ăn (và có lẽ là có đường huyết bình thường), không phải bệnh nhân hạ đường huyết. Một ví dụ khó hơn là áp dụng một RI TSH được tạo ra từ các đối tượng có cân nặng “bình thường” cho trẻ em béo phì được giới thiệu đến phòng khám nội tiết, những trẻ này rõ ràng có tỷ lệ giá trị TSH trên giới hạn RI trên cao hơn (so với nhóm mẫu tham chiếu). Hầu hết những người có giá trị TSH hơi cao sẽ có kết quả T4 tự do bình thường và kháng thể tuyến giáp âm tính.
Điều này dẫn đến tầm quan trọng của việc thiết lập các giới hạn quyết định lâm sàng ngoài các RI tiêu chuẩn được cung cấp trên các báo cáo xét nghiệm. Sử dụng ví dụ trước đó về TSH ở trẻ em béo phì, một số bác sĩ nội tiết nhi khoa qua kinh nghiệm có thể quyết định rằng trẻ em béo phì có giá trị TSH chỉ hơi cao hơn ngưỡng cắt RI trên không nên được giới thiệu hoặc làm thêm các xét nghiệm, đặc biệt nếu sự tăng trưởng và phát triển sẽ được theo dõi thường xuyên. Tuy nhiên, các chuyên gia có lẽ sẽ đồng ý rằng một đứa trẻ có TSH trên 10 mU/L xứng đáng được đánh giá chính thức và làm thêm các xét nghiệm.
Việc tạo ra các RI về lý thuyết là đơn giản:
- Thu được kết quả từ một mẫu ngẫu nhiên của các cá nhân khỏe mạnh được lấy từ một quần thể đại diện.
- Loại trừ các giá trị ngoại lai thống kê.
- Phân tầng và phân nhóm theo các khía cạnh phù hợp (ví dụ, tuổi, giới tính) theo chỉ định.
- Phân tích dữ liệu và tạo ra một trích dẫn khoảng tham chiếu; trên các báo cáo xét nghiệm, đánh dấu bất cứ điều gì nằm ngoài khoảng tham chiếu.
Trong thực tế, việc lựa chọn một quần thể tham chiếu đại diện là khó khăn/chủ quan một cách đáng ngạc nhiên. Khi quyết định các tiêu chí loại trừ cho một RI testosterone, chúng ta có nên loại trừ các bé gái gốc Tây Ban Nha hơi thừa cân, những người sẽ có nồng độ testosterone cao hơn một chút so với, chẳng hạn, các bé gái châu Á có chỉ số khối cơ thể trung bình không? Chúng ta có nên nhấn mạnh rằng các đối tượng tham gia vào một nghiên cứu RI cho các phản ứng C-peptide và insulin với một nghiệm pháp dung nạp glucose đường uống (OGTT) đều phải được nạp carbohydrate trong những ngày trước khi nghiên cứu—khi mà trong thực hành lâm sàng gần như không ai có sự chuẩn bị này trước một OGTT? Cuối cùng, các nhà điều tra sẽ phải đưa ra những quyết định tùy ý sẽ ảnh hưởng đến trích dẫn RI.
Một vấn đề tương tự phát sinh khi quyết định điều gì đại diện cho một giá trị ngoại lai thống kê (và có nên loại trừ chúng hay không). Hình 4.23 cho thấy kết quả của một nghiên cứu RI về osteocalcin và phosphatase kiềm đặc hiệu cho xương, trong đó điểm được khoanh tròn màu đỏ đại diện cho cùng một cá nhân. Điểm này rõ ràng là một giá trị ngoại lai thống kê nhưng đại diện cho một cá nhân khỏe mạnh tình cờ đang ở đỉnh tốc độ tăng trưởng của mình khi nghiên cứu được tiến hành. Nếu chúng ta loại trừ giá trị ngoại lai này, liệu chúng ta có kết thúc bằng việc đánh dấu là cao nhiều thanh thiếu niên khỏe mạnh ở đỉnh tăng trưởng của họ không? Nếu chúng ta bao gồm điểm này, liệu RI có quá rộng không?
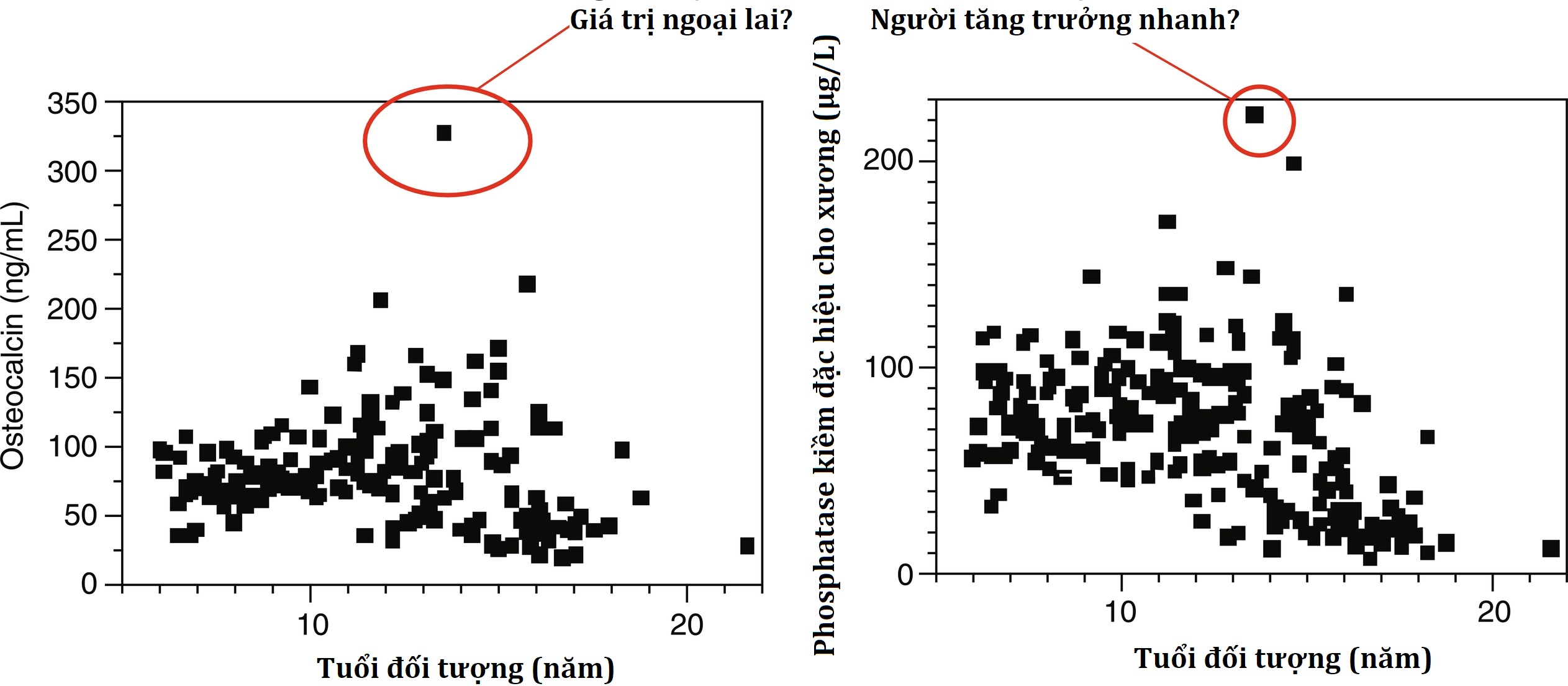
Hình 4.23 Nghiên cứu khoảng tham chiếu của hai dấu ấn tạo xương (osteocalcin và phosphatase kiềm đặc hiệu cho xương). Cùng một đối tượng có kết quả trên cả hai xét nghiệm là các giá trị ngoại lai thống kê (khoanh tròn màu đỏ), nhưng bệnh sử lâm sàng cho thấy cá nhân này đang ở đỉnh tốc độ tăng trưởng của mình khi mẫu được lấy.
Một câu trả lời hợp lệ có thể là nghiên cứu RI được phân tầng tốt hơn theo giai đoạn dậy thì Tanner, thay vì tuổi, do sự biến thiên rộng của tuổi khởi phát dậy thì. Tất nhiên, có những lưu ý. Trước hết, việc có được các đối tượng được phân giai đoạn Tanner chính xác là khó khăn trong thực tế, do sự miễn cưỡng thường xuyên của các đối tượng, phụ huynh, và các Ban Đánh giá Thể chế trong việc cho phép sờ nắn vú hoặc khám bộ phận sinh dục ngoài của những đứa trẻ khỏe mạnh. Tự đánh giá giai đoạn dậy thì có thể được thực hiện, nhưng nó đã được ghi nhận là dẫn đến một số sự không chính xác đáng kể. Thứ hai, ngay cả khi việc phân giai đoạn Tanner có thể được tiến hành bởi các nhà điều tra được đào tạo tốt, có một số giai đoạn có thể khó phân biệt một cách đáng ngạc nhiên (ví dụ, giai đoạn sinh dục nam II so với giai đoạn III), dẫn đến một số nhà điều tra thích sử dụng thể tích hoặc chiều dài tinh hoàn để đánh giá sự trưởng thành sinh dục ở nam giới, mặc dù kích thước tinh hoàn không phải là một phần của hệ thống phân giai đoạn Tanner ban đầu. Ngay cả việc phân giai đoạn Tanner của sự phát triển vú đôi khi cũng có thể khó khăn; mặc dù phân giai đoạn Tanner ban đầu chỉ dựa vào việc quan sát, rõ ràng là ở các bé gái thừa cân, người khám phải thực sự sờ nắn vú để tìm kiếm mô tuyến để phân biệt sự phát triển dậy thì thực sự với việc tăng kích thước vú do tích tụ mỡ. Giai đoạn vú Tanner II có thể khó xác định, và thậm chí có thể có sự nhầm lẫn giữa sự phát triển Tanner III ở một cá nhân có bộ ngực lớn so với sự phát triển Tanner V ở một phụ nữ trẻ có bộ ngực nhỏ hơn (mặc dù đường kính núm vú/quầng vú > 1 cm có thể giúp xác định rõ hơn sự phát triển Tanner V). Một số phụ nữ có thể luôn giữ lại gò thứ cấp của núm vú và quầng vú xác định Tanner IV, và do đó không bao giờ chính thức đạt đến giai đoạn vú Tanner V.
Các vấn đề bổ sung với phân giai đoạn Tanner bao gồm sự không tương hợp của sự phát triển vú/sinh dục (được điều khiển bởi sự hoạt hóa tuyến yên-tuyến sinh dục) với sự phát triển lông mu (được điều khiển bởi cả sự hoạt hóa tuyến sinh dục và tuyến thượng thận). Không hiếm khi một bé gái có lông mu Tanner III nhưng chỉ có sự phát triển vú Tanner II. Lý tưởng nhất, chúng ta nên có thể xác định đối tượng là “Vú II, Lông mu III”, nhưng cho đến nay, một hệ thống như vậy chưa được sử dụng cho các RI dựa trên Tanner. Cộng đồng nội tiết nhi khoa và hóa học lâm sàng có thể muốn đi đến một thỏa thuận rằng một số hormone (ví dụ, estradiol) nên được dựa trên giai đoạn vú Tanner, trong khi những hormone khác (ví dụ, dehydroepiandrosterone [DHEAS]) nên được dựa chủ yếu vào giai đoạn lông mu Tanner.
Một điểm cuối cùng về phân tầng giai đoạn Tanner là một số giai đoạn thực sự không hề đồng nhất. Một trẻ sơ sinh, trẻ mới biết đi, trẻ mẫu giáo, và một đứa trẻ 7 tuổi đều có thể là Tanner I về sự phát triển vú/sinh dục/lông mu, nhưng lại có các hồ sơ hormone rất khác nhau. Rõ ràng, ví dụ, sự hoạt hóa tuyến thượng thận (adrenarche) và DHEAS tăng lên bắt đầu ngay cả trước 6 tuổi, ít nhất 3 đến 4 năm trước khi xuất hiện lông mu. Do đó, một nghiên cứu bao gồm trẻ em Tanner I từ 1 đến 7 tuổi sẽ có DHEAS trung bình thấp hơn nhiều so với một nghiên cứu chỉ sử dụng trẻ em Tanner I từ 5 đến 7 tuổi. Hiện tại, không có định nghĩa chuẩn hóa về đối tượng nào nên được bao gồm trong một phân nhóm Tanner I.
Ngay cả việc phân tầng đơn giản hơn nhiều theo tuổi cũng đòi hỏi việc ra quyết định có thể ảnh hưởng đến trích dẫn RI cuối cùng. Một cách tiếp cận điển hình để tạo ra các RI liên quan đến tuổi là lấy các kết quả quan sát được, chẳng hạn như những kết quả được trình bày trong Hình 4.24, chia chúng thành các phân nhóm tuổi (ví dụ, các khoảng rộng 1 hoặc 2 năm) chứa các giá trị tương đối giống nhau và tính toán các RI riêng cho từng phân nhóm. Tuy nhiên, đối với các chất phân tích thay đổi nhanh chóng theo tuổi, điều này có xu hướng dẫn đến các phân nhóm nhỏ cho thấy sự biến thiên đáng kể chỉ do sai số lấy mẫu do số lượng nhỏ.
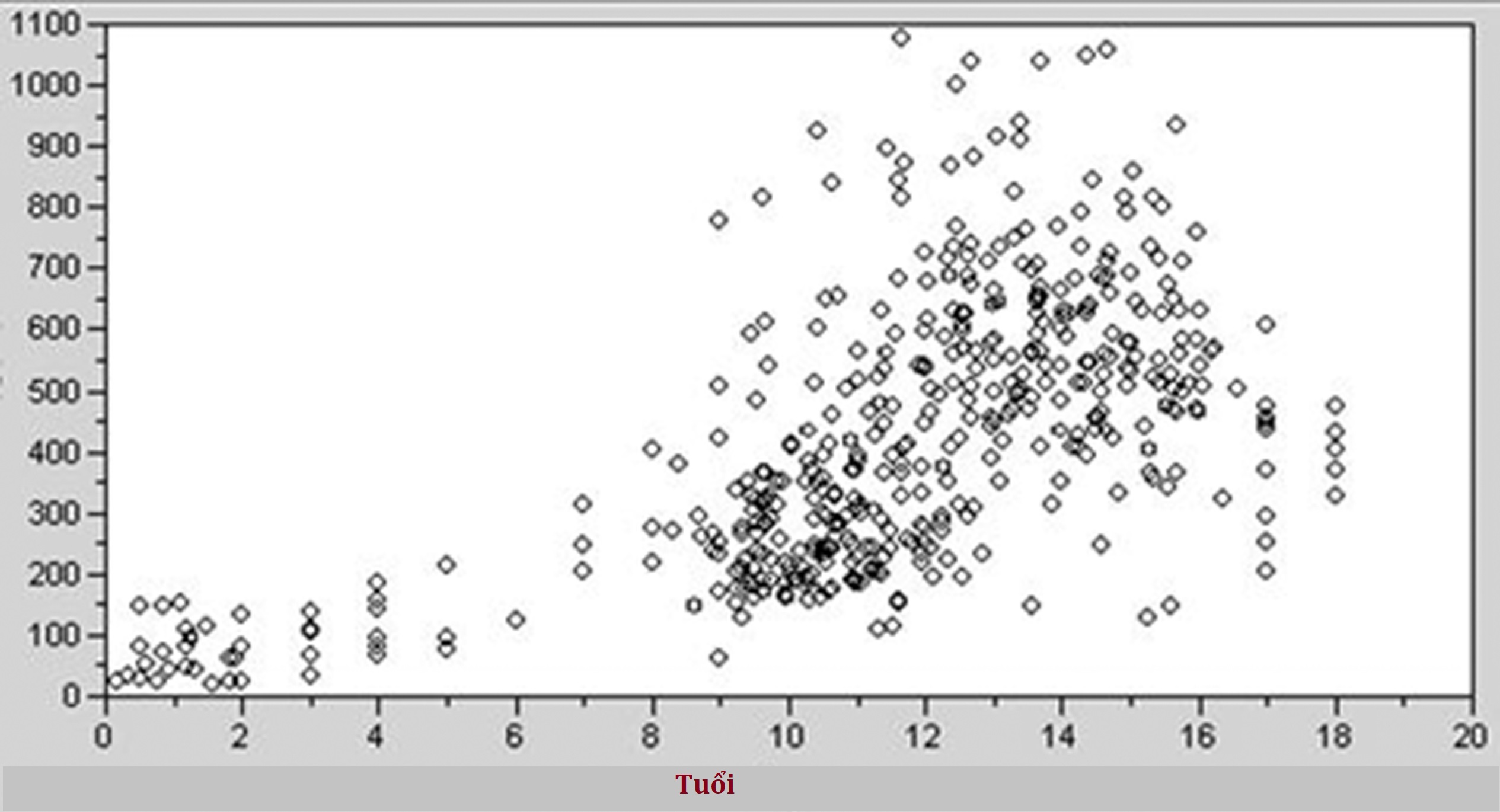
Hình 4.24 Nghiên cứu khoảng tham chiếu cho một hormone (yếu tố tăng trưởng giống insulin 1 [IGF-I]), thay đổi nhanh chóng trong vòng đời nhi khoa.
Một ví dụ giả định cực đoan được trình bày trong Hình 4.25. Ở đây, các giá trị thay đổi liên tục theo tuổi, và việc phân nhóm các dữ liệu này sẽ dẫn đến số n thấp không thể chấp nhận được nếu các phân nhóm nhỏ; việc phân nhóm theo một khoảng tuổi rộng hơn sẽ dẫn đến các RI sẽ đánh giá quá cao các giá trị cho đầu trẻ của phân nhóm và đánh giá thấp các giá trị cho những người ở đầu lớn tuổi hơn. Trong trường hợp này, rõ ràng là một cách tiếp cận tốt hơn nhiều là khớp một đường cong (trong trường hợp này là một đường thẳng) với dữ liệu và sử dụng điều này để tạo ra RI dựa trên tuổi.
Hình 4.25 Ví dụ giả định về một chất phân tích thay đổi nhanh chóng theo tuổi, chứng minh sự cần thiết phải thực hiện khớp đường cong thay vì chia tất cả dữ liệu thành các phân nhóm tuổi nhỏ (ví dụ, 1 năm).
Một ví dụ thực tế hơn về cách tiếp cận khớp đường cong này được trình bày trong Hình 4.26. Điều này không chỉ dẫn đến các biểu diễn mượt mà hơn, sinh lý hơn về những thay đổi về giá trị liên quan đến tuổi, mà còn cho phép tính toán SD, hoặc điểm z. Lưu ý rằng các đường cong điểm z không đối xứng quanh giá trị trung bình (khoảng cách giữa giá trị trung bình và + 2 SD lớn hơn khoảng cách giữa giá trị trung bình và −2 SD), điều này phản ánh thực tế là hầu hết các giá trị hormone nội tiết không tuân theo một phân phối bình thường/Gaussian (đường cong hình chuông). Do đó, các bảng RI cung cấp một giá trị trung bình và một giá trị duy nhất cho SD có thể gây hiểu lầm.
Hình 4.26 Ví dụ về điểm z của yếu tố tăng trưởng giống insulin 1 (IGF-I) được suy ra sau khi biến đổi dữ liệu Box-Cox và khớp đường cong.
Một trợ giúp khác ít được sử dụng để cải thiện sự hiểu biết về kết quả xét nghiệm là chuyển từ các RI đơn biến sang một trình bày hai biến. Ví dụ, người ta có thể xem xét các biểu đồ của TSH so với T4 tự do cho các cá nhân khỏe mạnh và cho các tình trạng bệnh khác nhau (Hình 4.27). Đối với bất kỳ bệnh nào ảnh hưởng đến tuyến giáp nhưng để lại trục hạ đồi-tuyến yên nguyên vẹn, các điểm thường sẽ nằm trong kênh được xác định bởi các đường liền nét.
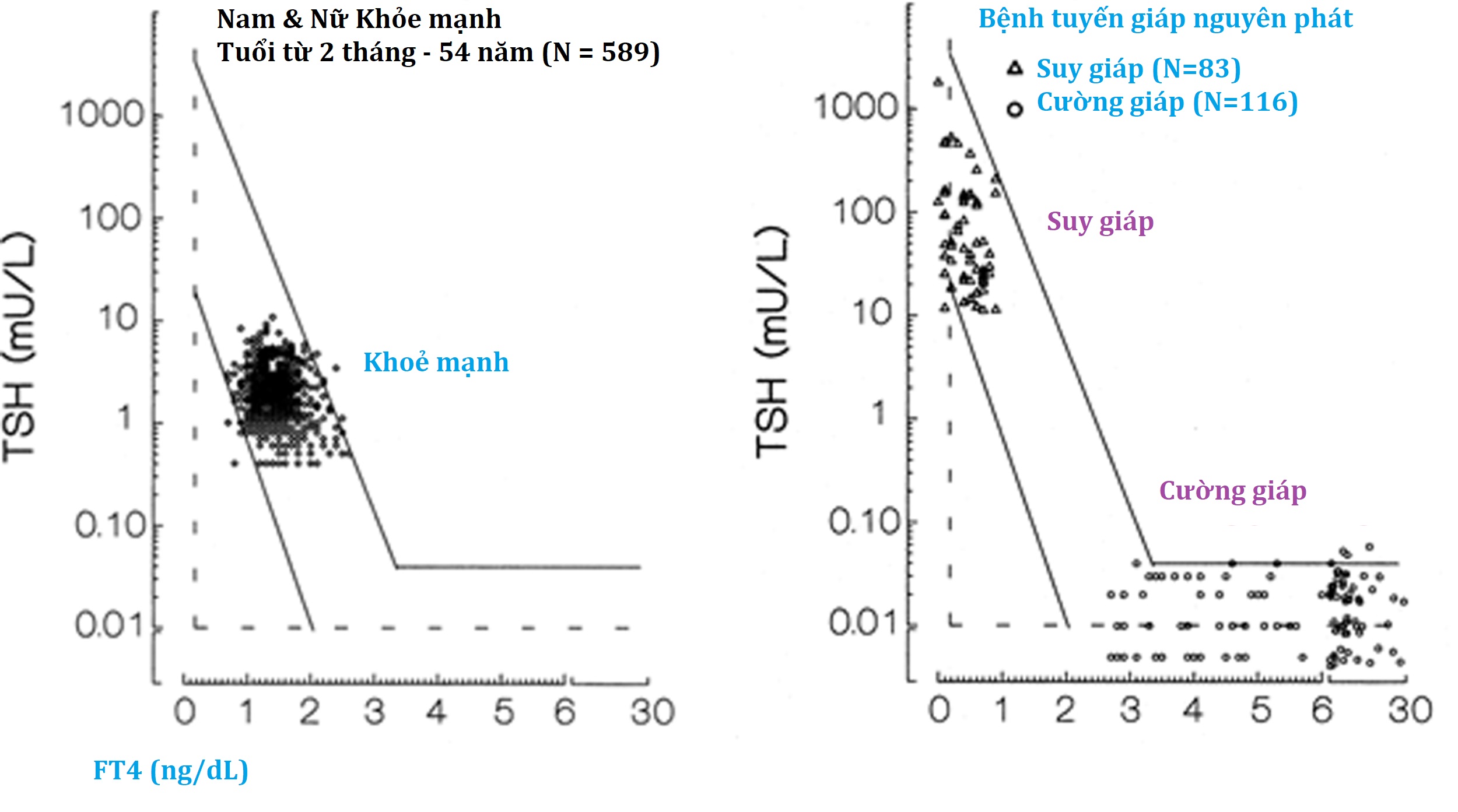
Hình 4.27 Trình bày khoảng tham chiếu hai biến: hormone kích thích tuyến giáp (TSH) so với T4 tự do bằng thẩm tách cân bằng, ở những bệnh nhân có trục hạ đồi-tuyến yên nguyên vẹn.
Các bệnh ảnh hưởng đến trục hạ đồi-tuyến yên sẽ dẫn đến các điểm nằm ngoài kênh này (Hình 4.28). Lưu ý rằng tất cả các điểm được khoanh tròn màu đỏ đều có giá trị TSH trong RI, nhưng khi được phân tích tương đối với nồng độ T4 tự do, các giá trị TSH này là bình thường một cách không phù hợp.
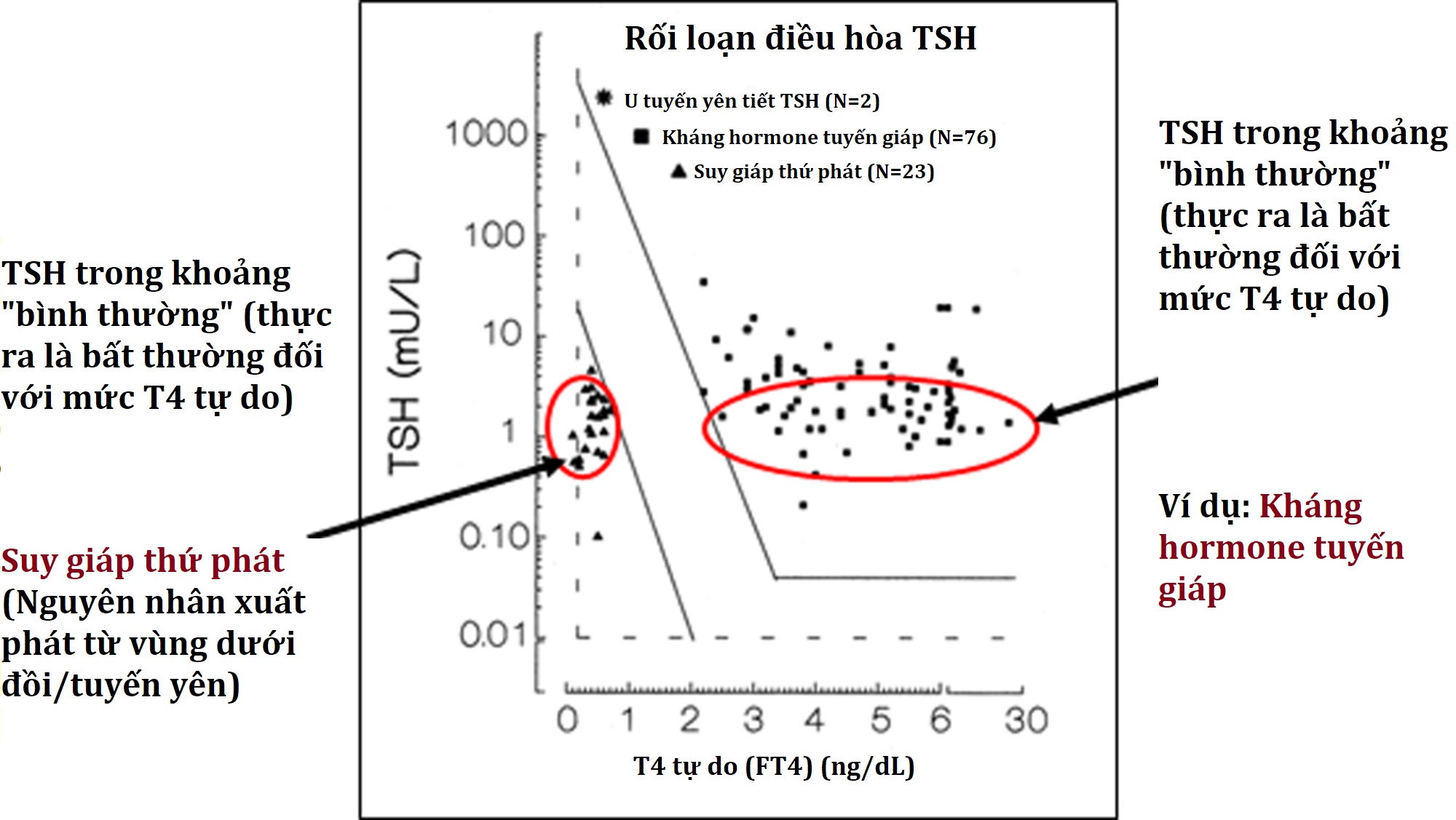
Hình 4.28 Hormone kích thích tuyến giáp (TSH) so với T4 tự do bằng thẩm tách cân bằng, ở những bệnh nhân bị suy giáp thứ phát/tam phát hoặc kháng hormone tuyến giáp.
Tóm tắt
Mặc dù một bác sĩ nội tiết nhi khoa không cần phải nắm vững tất cả các khía cạnh của y học xét nghiệm được đề cập trong chương này, nhưng có ít nhất kiến thức cơ bản về các chủ đề được đề cập sẽ giúp người đó đưa ra quyết định chỉ định xét nghiệm tốt hơn và tránh các sai sót trong giải thích. Biết một số “ngôn ngữ của phòng xét nghiệm” cho phép thảo luận tốt hơn với các chuyên gia xét nghiệm và giúp hiểu rõ hơn các ấn phẩm liên quan từ cộng đồng hóa học lâm sàng. Tìm hiểu thêm về thống kê đằng sau việc ra quyết định chẩn đoán, hiểu cách các xét nghiệm được thẩm định vì mục đích chất lượng, và hiểu các phương pháp khác nhau có sẵn (bao gồm cả những hạn chế và các nguồn sai sót có thể xảy ra) là rất có giá trị cho các chuyên gia ở mọi cấp độ kinh nghiệm. Một mục tiêu bổ sung của chương này là tiết lộ một số sự không chắc chắn liên quan đến xét nghiệm, để xoa dịu một số sự thất vọng khi thấy các kết quả khác nhau rất nhiều cho cùng một xét nghiệm được thực hiện tại các phòng xét nghiệm khác nhau, hoặc để nhận ra những khoảng trống hiện tại trong thông tin RI. Hy vọng rằng, cộng đồng nội tiết nhi khoa sẽ tham gia cùng cộng đồng xét nghiệm để giúp hài hòa hóa việc xét nghiệm và lấp đầy những khoảng trống quan trọng về khoảng tham chiếu. Quan trọng nhất, việc kết nối với các chuyên gia xét nghiệm để được tư vấn liên quan đến xét nghiệm chẩn đoán sẽ giúp các chuyên gia lâm sàng đưa ra quyết định tốt nhất cho các bệnh nhân nội tiết nhi của họ.
