Sách dịch: CÁC NGUYÊN LÝ Y HỌC HÔ HẤP, ẤN BẢN THỨ 8
Dịch và chú giải: Ts.Bs. Lê Nhật Huy, Ths.Bs. Lê Đình Sáng
Chương 25. Lao phổi và Các Mycobacteria không phải lao
Tuberculosis and nontuberculous mycobacteria
Steven E. Weinberger MD, MACP, FRCP, Barbara A. Cockrill MD and Jess Mandel MD, MACP, FRCP
Principles of Pulmonary Medicine, 25, 298-307
MỤC LỤC CHƯƠNG
|
Nguyên nhân và Cơ chế bệnh sinh Các định nghĩa Giải phẫu bệnh Sinh lý bệnh Biểu hiện lâm sàng Tiếp cận chẩn đoán Nguyên tắc điều trị Các Mycobacteria không phải lao |
Trải qua nhiều thế kỷ, hiếm có căn bệnh nào cướp đi nhiều sinh mạng, gây ra nhiều bệnh tật và đáng sợ như bệnh lao. Vào đầu thế kỷ 20, lao là nguyên nhân gây tử vong đơn lẻ phổ biến nhất ở Hoa Kỳ, và hơn 80% dân số bị nhiễm bệnh trước 20 tuổi.
Vào đầu thế kỷ 21, bệnh lao là một ví dụ rõ rệt về sự chênh lệch nguồn lực y tế giữa các quốc gia công nghiệp hóa và các nước đang phát triển. Ở các quốc gia có dịch vụ chăm sóc sức khỏe rộng rãi như ở Bắc Mỹ và Châu Âu, hiếm có bệnh nào lại suy giảm đáng kể về tần suất và tỷ lệ tử vong như bệnh lao. Hai yếu tố chính chịu trách nhiệm cho điều này là: sự cải thiện chung về điều kiện sống và sự phát triển của hóa trị liệu kháng lao hiệu quả, đã biến bệnh lao thành một bệnh có thể chữa khỏi thường quy. Tuy nhiên, ở các quốc gia có ít nguồn lực hơn, căn bệnh này, đặc biệt là lao kháng thuốc, vẫn tiếp tục là một cuộc khủng hoảng y tế, thường tấn công vào những thành viên trẻ tuổi, năng suất nhất của xã hội.
Hiện nay, hơn 140 năm kể từ khi Robert Koch xác định được trực khuẩn lao vào năm 1882, chúng ta không được chủ quan về căn bệnh này. Ước tính có khoảng 25% dân số thế giới hiện nay, tức hơn 2 tỷ người, đã bị nhiễm (nghĩa là nhiễm lao tiềm ẩn hoặc lao hoạt động) trực khuẩn lao.
Theo Tổ chức Y tế Thế giới (WHO), tỷ lệ mắc lao trên toàn cầu đạt đỉnh vào năm 2003 và giảm chậm cho đến năm 2019. Năm 2020, đại dịch COVID-19 đã làm giảm khả năng tiếp cận dịch vụ chăm sóc sức khỏe ở các quốc gia có nguồn lực hạn chế, dẫn đến sự sụt giảm số ca mắc lao mới được báo cáo. Tuy nhiên, việc giảm khả năng tiếp cận này lại đi kèm với sự gia tăng số ca tử vong do lao (1,5 triệu ca tử vong trên toàn thế giới). Đây là lần đầu tiên số ca tử vong hàng năm trên toàn thế giới do lao tăng lên kể từ năm 2003.
Bệnh lao xảy ra ở mọi nơi trên thế giới; tuy nhiên, tỷ lệ mắc bệnh khác nhau trên toàn cầu, với phần lớn các trường hợp lao hoạt động xảy ra ở các quốc gia có nguồn lực hạn chế. Nghèo đói, nhiễm HIV và sự hiện diện của các chủng vi khuẩn kháng thuốc là những yếu tố chính gây ra sự khác biệt này.
Vào năm 2020, số ca mắc lao mới lớn nhất xảy ra ở Khu vực Đông Nam Á của WHO, với 43% số ca mắc mới, tiếp theo là Khu vực Châu Phi của WHO với 25% số ca mắc mới, và Khu vực Tây Thái Bình Dương của WHO với 18%. Tại Hoa Kỳ, bệnh lao vẫn là một vấn đề y tế công cộng quan trọng, mặc dù vào năm 2020, Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh (CDC) đã báo cáo số ca mắc thấp kỷ lục. Giống như những năm trước, các ca mắc mới phổ biến hơn ở những người sinh ra bên ngoài Hoa Kỳ từ các khu vực có tỷ lệ mắc lao cao hơn (72%). Đại dịch COVID-19 có thể đã ảnh hưởng đến những con số này, và không chắc xu hướng này có tiếp tục hay không.
NGUYÊN NHÂN VÀ CƠ CHẾ BỆNH SINH
Tác nhân gây bệnh lao, Mycobacterium tuberculosis, là một loại trực khuẩn hình que, hiếu khí. Một đặc tính riêng biệt của trực khuẩn lao là khả năng giữ lại một số loại thuốc nhuộm ngay cả sau khi tiếp xúc với axit (được thảo luận trong phần Tiếp cận Chẩn đoán); do đó, các mycobacteria được gọi là trực khuẩn kháng axit.
Bệnh lây truyền qua các giọt bắn dạng khí dung nhỏ, thường có kích thước từ 1 đến 5 µm, chứa vi sinh vật. Nguồn của các giọt bắn này là một người mắc bệnh lao có chứa vi khuẩn, thường bài tiết trực khuẩn lao qua đờm hoặc các giọt nhỏ được tạo ra trong các hoạt động thông thường như nói, ho, hát và cười. Thông thường nhất, sự lây truyền xảy ra khi tiếp xúc tương đối gần, thường là giữa những người có quan hệ họ hàng hoặc những người khác sống trong cùng một hộ gia đình. Bệnh không lây truyền qua các vật trung gian (fomites) (ví dụ: quần áo, dụng cụ ăn uống); hít phải trực tiếp các giọt khí dung là phương thức lây lan duy nhất.
| Sự lây truyền của bệnh lao là do hít phải các giọt khí dung nhỏ chứa vi sinh vật. |
Khi các giọt chứa mycobacteria được hít vào, đến phế nang và không bị loại bỏ ngay lập tức bởi các cơ chế bảo vệ bẩm sinh của vật chủ, một ổ nhiễm trùng sơ phát nhỏ sẽ phát triển, bao gồm các vi sinh vật và một quá trình viêm do vật chủ khởi phát. Đại thực bào phế nang là hàng rào bảo vệ ban đầu chính chống lại vi sinh vật, và chúng là một thành phần đặc biệt quan trọng của phản ứng viêm sau đó. Trực khuẩn lao sinh sôi bên trong các đại thực bào phế nang, các đại thực bào này giải phóng các cytokine và chemokine dẫn đến việc huy động thêm nhiều đại thực bào và các tế bào viêm khác. Nếu nhiễm trùng không được kiểm soát, vi sinh vật sẽ lan truyền qua các mạch bạch huyết đến các hạch bạch huyết rốn phổi dẫn lưu cũng như qua đường máu đến các cơ quan ở xa và các vùng khác của phổi, đặc biệt là các đỉnh phổi. Mặc dù sự lan truyền qua đường bạch huyết và đường máu có thể xảy ra, các cơ chế bảo vệ miễn dịch của vật chủ (trong phổi và những nơi khác) kiểm soát và giới hạn nhiễm trùng sơ phát ở hơn 90% các trường hợp.
Một thành phần quan trọng của hệ thống phòng thủ mắc phải của cơ thể chống lại M. tuberculosis là sự phát triển của miễn dịch qua trung gian tế bào (quá mẫn muộn) chống lại các vi sinh vật mycobacteria. Sự mẫn cảm và phát triển phản ứng miễn dịch qua trung gian tế bào này thường xảy ra trong vòng vài tuần sau khi nhiễm trùng ban đầu. Bệnh nhân thường không nhận biết được tình trạng nhiễm trùng sơ phát, mặc dù có thể có báo cáo về một đợt sốt nhẹ, tự giới hạn. Di chứng duy nhất mà vi sinh vật để lại là những di chứng liên quan đến phản ứng của vật chủ với trực khuẩn: hoặc là phản ứng mô tại chỗ hoặc là bằng chứng cho thấy vật chủ đã trở nên mẫn cảm với trực khuẩn lao, được thể hiện bằng phản ứng test da quá mẫn muộn dương tính hoặc xét nghiệm giải phóng interferon- (IFN-). Ở một số ít bệnh nhân, có lẽ là 5% hoặc ít hơn, các cơ chế phòng vệ không thể kiểm soát được nhiễm trùng sơ phát, và kết quả là bệnh lao sơ nhiễm có biểu hiện lâm sàng. Điều này phổ biến nhất trong bối cảnh suy giảm miễn dịch, điều trị bằng thuốc ức chế miễn dịch, nghiện rượu, HIV/AIDS, suy dinh dưỡng hoặc bệnh ác tính.
Mặc dù nhiễm trùng sơ phát dường như đã được kiểm soát, trực khuẩn lao vẫn có thể tồn tại trong cơ thể vật chủ. Một số lượng nhỏ vi khuẩn thường ở trạng thái không hoạt động hoặc tiềm ẩn, không sinh sôi hoặc gây ra bất kỳ bệnh hoạt động rõ ràng nào, nhưng vẫn có khả năng sống sót. Những bệnh nhân này được coi là bị nhiễm lao tiềm ẩn. Hầu hết bệnh nhân nhiễm lao tiềm ẩn sẽ không bao giờ phát triển thành bệnh lao hoạt động trên lâm sàng. Tuy nhiên, ở một số bệnh nhân, sự cân bằng mong manh giữa vi sinh vật và các cơ chế phòng vệ của vật chủ cuối cùng bị phá vỡ, đôi khi sau nhiều năm, và một ổ nhiễm trùng không hoạt động trở nên hoạt động. Những bệnh nhân mắc bệnh lao hoạt động xảy ra tại một thời điểm khác với thời điểm nhiễm trùng sơ phát được cho là mắc bệnh lao tái hoạt. Trong suốt cuộc đời, ước tính có khoảng 10% những người có hệ miễn dịch bình thường đã bị nhiễm M. tuberculosis (và chưa được điều trị nhiễm lao tiềm ẩn để loại bỏ các vi khuẩn không hoạt động) sẽ phát triển thành bệnh lao hoạt động. Nguy cơ phát triển bệnh lao hoạt động cao nhất trong vòng 2 năm đầu sau khi nhiễm trùng ban đầu; khoảng một nửa số bệnh nhân phát triển bệnh lao hoạt động nằm trong khung thời gian này. Nửa còn lại phát triển bệnh lao hoạt động vào một thời điểm nào đó sau này trong đời. Những ước tính về nguy cơ này áp dụng cho những bệnh nhân có cơ chế phòng vệ vật chủ bình thường. Nguy cơ phát triển bệnh lao hoạt động cao hơn đáng kể ở những bệnh nhân có khiếm khuyết về miễn dịch vật chủ như nhiễm HIV giai đoạn tiến triển, sử dụng corticosteroid mạn tính, và điều trị bằng thuốc chẹn thụ thể yếu tố hoại tử khối u (TNF)-.
Đối với cả bệnh lao sơ nhiễm và lao tái hoạt, phổi là cơ quan bị ảnh hưởng phổ biến nhất. Tuy nhiên, với cả hai loại bệnh, các cơ quan khác có thể bị liên quan do sự lan tràn theo đường máu trong giai đoạn sơ nhiễm. Khi phản ứng miễn dịch của vật chủ bị quá tải, dù là do bệnh sơ nhiễm hay tái hoạt, sự lan tràn rộng rãi của vi sinh vật theo đường máu sẽ dẫn đến bệnh lan tỏa được gọi là lao kê (Hình 25.1).
| Phần lớn các trường hợp lao hoạt động liên quan đến sự tái hoạt của một ổ bệnh không hoạt động trước đó trong phổi. |
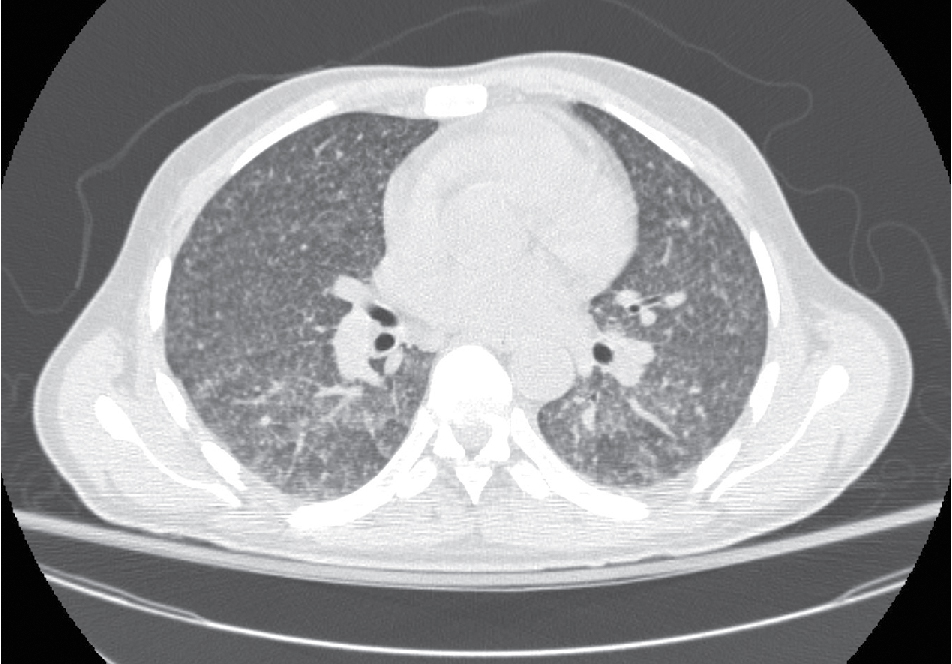
Hình 25.1 Hình ảnh CT ngực của một bệnh nhân bị lao kê. Có vô số nốt nhỏ là kết quả của sự lan tràn của M. tuberculosis theo đường máu. (Tư liệu của Bác sĩ Seth Kligerman.)
CÁC ĐỊNH NGHĨA
Dựa trên sự hiểu biết của chúng ta về cơ chế bệnh sinh, có một vài thuật ngữ đáng được làm rõ. Đầu tiên là sự phân biệt giữa nhiễm lao và bệnh lao. Nhiễm lao (hay nhiễm lao tiềm ẩn) được định nghĩa bởi một test da tuberculin dương tính hoặc một xét nghiệm giải phóng IFN- trong máu (IGRA; được mô tả trong phần Tiếp cận Chẩn đoán) nhưng không có bằng chứng lâm sàng về bệnh hoạt động. Những bệnh nhân nhiễm lao tiềm ẩn đã bị nhiễm vi sinh vật, nhưng nhiễm trùng ban đầu đã được kiểm soát bởi các cơ chế phòng vệ của cơ thể và sau đó chỉ có thể được truy dấu bằng một test da quá mẫn muộn dương tính hoặc phản ứng IGRA dương tính. Một số lượng nhỏ vi khuẩn còn lại đang ở trạng thái không hoạt động hoặc tiềm ẩn, nhưng có nguy cơ tái hoạt vào một thời điểm sau này, đặc biệt là khi có bất kỳ sự suy giảm nào trong miễn dịch tế bào của vật chủ. Mặt khác, bệnh lao (hoặc lao hoạt động) được định nghĩa bởi sự hiện diện của bệnh hoạt động trên lâm sàng ở một hoặc nhiều hệ cơ quan, lý tưởng nhất là với việc xác nhận chẩn đoán bằng cách phân lập được M. tuberculosis.
Các thuật ngữ khác đáng được định nghĩa là những thuật ngữ mô tả các phân nhóm khác nhau của bệnh lao. Phổ biến nhất là các thuật ngữ lao sơ nhiễm và lao tái hoạt, tương ứng chỉ bệnh xảy ra sau lần tiếp xúc ban đầu và bệnh tái hoạt sau một thời gian tiềm ẩn. Thuật ngữ lao sơ nhiễm tiến triển phản ánh bệnh sơ nhiễm không được kiểm soát bởi các cơ chế phòng vệ của vật chủ và tiếp tục hoạt động vượt quá thời điểm mà quá mẫn muộn đã phát triển. Thông thường, miễn dịch tế bào phát triển từ 2 đến 10 tuần sau khi nhiễm trùng ban đầu, và bệnh hoạt động tiếp diễn sau thời gian này có nhiều đặc điểm của lao tái hoạt. Thuật ngữ lao sau sơ nhiễm (postprimary tuberculosis) đề cập đến bệnh xảy ra sau giai đoạn nhiễm trùng sơ phát ban đầu. Mặc dù thuật ngữ này thường dùng để chỉ bệnh tái hoạt, đôi khi nó cũng bao gồm các trường hợp lao sơ nhiễm tiến triển.
Thuật ngữ lao tái nhiễm (reinfection tuberculosis) đề cập đến bệnh ở một người đã bị nhiễm trước đó, là kết quả của một nhiễm trùng do tiếp xúc với các vi sinh vật mới chứ không phải từ sự tái hoạt của trực khuẩn lao không hoạt động. Loại nhiễm trùng này theo truyền thống được coi là không phổ biến. Người ta tin rằng những người đã từng bị nhiễm lao và biểu hiện quá mẫn muộn với vi sinh vật này có khả năng kháng lại sự tái nhiễm từ một nguồn khác bên ngoài. Tuy nhiên, các nghiên cứu sử dụng kỹ thuật phân tích dấu vân tay DNA cho thấy rằng việc tái nhiễm với một loại vi sinh vật khác phổ biến hơn so với suy nghĩ trước đây, đặc biệt là ở những vùng lưu hành cao và ở những bệnh nhân nhiễm HIV.
GIẢI PHẪU BỆNH
Các đặc điểm giải phẫu bệnh của lao phổi thay đổi tùy theo giai đoạn của nhiễm trùng. Nhiễm trùng sơ phát ở phổi bao gồm các vi sinh vật và một phản ứng viêm có sự tham gia của các đại thực bào phế nang, bạch cầu trung tính và các đại thực bào có nguồn gốc từ monocyte trong vùng nhu mô bị ảnh hưởng. Nếu phản ứng viêm không kiểm soát được nhiễm trùng, các vi sinh vật sẽ lan đến các hạch bạch huyết khu vực, dẫn đến bệnh hạch bạch huyết rốn phổi và trung thất cùng bên. Sự kết hợp của khu vực sơ nhiễm trong phổi (tổn thương Ghon) và các hạch bạch huyết liên quan được gọi là phức hợp Ghon.
Khi quá mẫn muộn xuất hiện, hoặc là vài tuần sau khi nhiễm trùng sơ phát hoặc trong một giai đoạn bệnh tái hoạt, một hình thái bệnh lý khác sẽ xuất hiện. Dấu hiệu đặc trưng là sự hiện diện của (1) u hạt (tập hợp các đại thực bào có nguồn gốc từ máu và mô được hoạt hóa, gọi là tế bào biểu mô dạng mô bào, được bao quanh bởi một vành tế bào lympho), và (2) hoại tử bã đậu (các ổ hoại tử và mềm hóa ở trung tâm của một u hạt). Trong vùng hoại tử bã đậu, các chất bên trong có thể hóa lỏng và bong ra, để lại một cái hang, một dấu hiệu đặc trưng khác của bệnh lao. Các đặc điểm vi thể khác của u hạt bao gồm các tế bào khổng lồ đa nhân và sự hiện diện thường xuyên của trực khuẩn lao có thể nhìn thấy khi sử dụng các phương pháp nhuộm thích hợp. Sau sự phát triển của quá mẫn muộn, các dấu hiệu bệnh lý đặc trưng của bệnh lao là u hạt và hoại tử bã đậu, thường có sự hình thành hang.
Một quá trình lành sẹo có xu hướng xảy ra tại các vị trí của bệnh. Xơ hóa hoặc sẹo hóa xảy ra sau đó, thường đi kèm với sự co kéo của vùng bị ảnh hưởng và sự lắng đọng canxi. Khi phức hợp Ghon trải qua quá trình xơ hóa và vôi hóa tiến triển, nó được gọi là phức hợp Ranke. Với bệnh nặng, sự phá hủy rộng rãi của mô phổi là kết quả của các vùng viêm lớn, sự hình thành u hạt, hoại tử bã đậu và tạo hang, cùng với xơ hóa, co kéo và các ổ vôi hóa. Điều quan trọng là phần lớn sự phá hủy xảy ra trong bệnh lao đòi hỏi một hệ thống miễn dịch tế bào nguyên vẹn và dường như là do phản ứng viêm của vật chủ cố gắng ngăn chặn nhiễm trùng. Do đó, những bệnh nhân mắc bệnh HIV giai đoạn tiến triển và các khiếm khuyết miễn dịch rõ rệt khác thường có biểu hiện không điển hình, trong đó vi sinh vật lan rộng nhưng có ít bằng chứng về tạo hang và xơ hóa.
Bệnh lao có thể lan truyền theo đường máu, và sự lan tỏa của vi sinh vật qua dòng máu tại thời điểm nhiễm trùng sơ phát có lẽ là quy luật chứ không phải là ngoại lệ. Khi các cơ chế phòng vệ bị phá vỡ, bệnh có thể trở nên rõ ràng ở các vị trí khác (ví dụ: gan, thận, tuyến thượng thận, xương, hệ thần kinh trung ương). Sự lây lan cũng xảy ra đến các vùng khác của phổi, hoặc do gieo rắc theo đường máu trong quá trình nhiễm trùng sơ phát hoặc do sự tràn của các chất tiết bị nhiễm trùng hoặc vật liệu bã đậu vào phế quản và các vùng khác của phổi.
Trong phổi, các vị trí đặc trưng cho bệnh lao tái hoạt là các phân thùy đỉnh của thùy trên và ở mức độ thấp hơn là phân thùy trên của thùy dưới. Người ta tin rằng đây không phải là vị trí của nhiễm trùng sơ phát mà là vị trí ưa thích để vi sinh vật cấy vào sau khi lan truyền theo đường máu. Những vùng này có tỷ lệ thông khí-tưới máu tương đối cao, dẫn đến cao và làm cho chúng đặc biệt thích hợp cho sự tồn tại của trực khuẩn lao hiếu khí.
SINH LÝ BỆNH
Hầu hết các đặc điểm lâm sàng của lao phổi có thể được quy cho một trong hai khía cạnh của bệnh: sự hiện diện của một nhiễm trùng mạn tính được kiểm soát kém, hoặc một quá trình phá hủy mạn tính trong nhu mô phổi. Một loạt các biểu hiện khác là kết quả của sự lây lan của bệnh lao ra ngoài phổi, nhưng những hậu quả này không được xem xét ở đây.
Nhiễm trùng lao mạn tính trong phổi có liên quan đến các biểu hiện toàn thân của tình trạng viêm lan rộng. Như ngụ ý bởi thuật ngữ “bệnh hao mòn” (consumption), thường được sử dụng trong quá khứ, lao là một căn bệnh trong đó các biểu hiện toàn thân, như mệt mỏi, sụt cân, suy mòn và chán ăn, là những đặc điểm nổi bật. Những tác động toàn thân này và các tác động khác của bệnh lao được thảo luận trong phần về biểu hiện lâm sàng.
Quá trình phá hủy mạn tính liên quan đến nhu mô phổi kéo theo sự hình thành sẹo và mất mô phổi tiến triển. Tuy nhiên, chức năng hô hấp thường được bảo tồn tốt hơn so với dự kiến, có lẽ vì bệnh thường giới hạn ở các vùng đỉnh và sau của thùy trên cũng như phân thùy trên của thùy dưới. Khả năng oxy hóa máu cũng có xu hướng được bảo tồn một cách đáng ngạc nhiên, có lẽ vì thông khí và tưới máu bị phá hủy đồng thời trong vùng phổi bị ảnh hưởng. Do đó, sự bất tương hợp thông khí-tưới máu không lớn bằng nhiều bệnh lý nhu mô và đường thở khác.
BIỂU HIỆN LÂM SÀNG
Có một sự khác biệt quan trọng và những khác biệt lâm sàng quan trọng giữa nhiễm lao tiềm ẩn và bệnh lao (lao hoạt động). Nhiễm lao tiềm ẩn là hậu quả của sự tiếp xúc ban đầu, qua đó trực khuẩn đã được thiết lập trong cơ thể bệnh nhân; tuy nhiên, các cơ chế phòng vệ của vật chủ đã ngăn chặn bất kỳ bệnh nào có biểu hiện lâm sàng. Miễn dịch đặc hiệu với trực khuẩn lao có thể được chứng minh bằng phản ứng dương tính với test da quá mẫn muộn hoặc xét nghiệm IGRA dương tính; ngoài ra, không có bằng chứng về sự sinh sôi của vi khuẩn hoặc sự tổn thương mô do bệnh. Bệnh nhân bị nhiễm nhưng không mắc bệnh thì không có khả năng lây nhiễm. Ngược lại, bệnh lao đi kèm với sự sinh sôi của vi sinh vật, kèm theo phản ứng mô và thường (mặc dù không phải luôn luôn) có các vấn đề lâm sàng mà bệnh nhân nhận thức được.
| Bệnh nhân lao phổi có thể biểu hiện (1) các triệu chứng toàn thân, (2) các triệu chứng liên quan đến đường hô hấp, hoặc (3) một phát hiện bất thường trên X-quang ngực nhưng không có triệu chứng lâm sàng. Khi các triệu chứng xảy ra, chúng thường khởi phát âm thầm hoặc bán cấp chứ không phải cấp tính. |
Các triệu chứng toàn thân thường tương đối không đặc hiệu: sụt cân, chán ăn, mệt mỏi, sốt nhẹ và đổ mồ hôi đêm. Các triệu chứng phổ biến nhất do tổn thương phổi gây ra là ho, khạc đờm và ho ra máu; đôi khi có đau ngực. Nhiều bệnh nhân không có triệu chứng toàn thân hay phổi, và được chú ý y tế do một phát hiện bất thường trên X-quang ngực, thường được thực hiện vì một lý do không liên quan.
Bệnh nhân có tổn thương ngoài phổi thường cũng bị lao phổi, nhưng thỉnh thoảng có những trường hợp chỉ giới hạn ở một vị trí ngoài phổi. Màng ngoài tim, màng phổi, thận, phúc mạc, tuyến thượng thận, xương và hệ thần kinh trung ương đều có thể bị ảnh hưởng, với các triệu chứng xuất phát từ cơ quan hoặc vùng bị tổn thương. Với lao kê, bệnh lan tỏa, và bệnh nhân thường rất yếu về mặt toàn thân.
Khám thực thể bệnh nhân lao phổi có thể cho thấy sự tàn phá của một bệnh nhiễm trùng mạn tính với bằng chứng về sự gầy mòn và sụt cân. Biểu hiện này không phổ biến ở những bệnh nhân có khả năng tiếp cận điều trị, nhưng thường thấy ở những nơi có nguồn lực hạn chế. Các phát hiện khi khám ngực có xu hướng tương đối không đáng kể, mặc dù đôi khi có thể nghe thấy tiếng ran ở các vùng bị ảnh hưởng. Nếu có tràn dịch màng phổi do lao, có thể tìm thấy các dấu hiệu thực thể đặc trưng của tràn dịch.
|
Các vấn đề thường gặp khi bệnh nhân lao đến khám:
|
TIẾP CẬN CHẨN ĐOÁN
Test da tuberculin, một công cụ chẩn đoán thường được sử dụng, ghi nhận tình trạng nhiễm lao chứ không phải bệnh lao hoạt động. Một lượng nhỏ protein có nguồn gốc từ trực khuẩn lao (dẫn xuất protein tinh khiết [PPD]) được tiêm trong da ở mặt trong của cẳng tay. Những người đã bị nhiễm M. tuberculosis và đã có được miễn dịch tế bào đối với vi sinh vật này sẽ cho thấy một phản ứng test dương tính, được xem là sự cứng lại hoặc sưng lên tại vị trí tiêm sau 48 đến 72 giờ. Các tiêu chí để xác định một phản ứng test da dương tính thay đổi tùy theo bối cảnh lâm sàng, cụ thể là sự có hay không có tình trạng suy giảm miễn dịch và/hoặc các yếu tố nguy cơ dịch tễ học ảnh hưởng đến khả năng tiếp xúc với bệnh lao trước đó. Điều quan trọng là, test này không phân biệt được giữa những người bị lao hoạt động và những người chỉ đơn thuần có được quá mẫn muộn từ một lần nhiễm trùng trước đó. Tuy nhiên, vì lao tái hoạt xảy ra ở những bệnh nhân đã từng nhiễm lao, một phản ứng test da dương tính giúp xác định những cá nhân có nguy cơ cao hơn phát triển bệnh lao hoạt động sau này.
Giống như hầu hết các xét nghiệm chẩn đoán, kết quả âm tính giả có thể xảy ra với test da tuberculin. Việc thực hiện sai kỹ thuật, một lô vật liệu thử nghiệm da có hoạt tính sinh học kém hơn, và các bệnh lý tiềm ẩn làm suy giảm miễn dịch tế bào, chẳng hạn như HIV hoặc thậm chí chính bệnh lao giai đoạn tiến triển, là một vài nguyên nhân gây ra phản ứng test da âm tính giả. Mặt khác, không phải tất cả bệnh nhân có phản ứng với tuberculoprotein đều đã tiếp xúc với M. tuberculosis. Nhiễm các mycobacteria không phải lao, thường được gọi là mycobacteria không điển hình, đôi khi liên quan đến một phản ứng test da dương tính hoặc dương tính giới hạn với PPD.
Xét nghiệm IGRA, một xét nghiệm máu, là một phương pháp thay thế cho test da. Máu được lấy, và các tế bào T của bệnh nhân được ủ với các kháng nguyên của M. tuberculosis. Các tế bào từ những người đã được mẫn cảm trước đó sẽ giải phóng IFN- để đáp ứng với các kháng nguyên, và IFN- được phát hiện bằng một xét nghiệm miễn dịch liên kết enzyme. Test da tuberculin không yêu cầu cơ sở vật chất phòng thí nghiệm và trên toàn cầu vẫn được thực hiện phổ biến hơn các xét nghiệm IFN-. Tuy nhiên, vì các xét nghiệm máu không yêu cầu bệnh nhân quay lại để đọc kết quả, IGRA có lợi thế là ít bệnh nhân bị mất dấu theo dõi hơn. Các xét nghiệm này không bị ảnh hưởng bởi việc tiêm phòng vắc-xin Bacille Calmette-Guérin (BCG) trước đó (xem phần Nguyên tắc điều trị) hoặc tiếp xúc với hầu hết các mycobacteria không điển hình, nhưng kết quả dương tính giả vẫn có thể xảy ra ở những người tiếp xúc hoặc bị nhiễm Mycobacterium marinum và Mycobacterium kansasii.
Để chẩn đoán bệnh lao (tức là, bệnh lao thực sự), một công cụ chẩn đoán ban đầu quan trọng là X-quang ngực. Trong bệnh sơ nhiễm, X-quang ngực có thể cho thấy một hình ảnh thâm nhiễm không đặc hiệu, thường—nhưng chắc chắn không phải là duy nhất—ở các thùy dưới (trái ngược với sự chiếm ưu thế của thùy trên trong bệnh tái hoạt). Có thể có sự phì đại hạch bạch huyết rốn phổi (và đôi khi là cạnh khí quản), phản ánh sự liên quan của hạch dẫn lưu bởi vi sinh vật và bởi nhiễm trùng sơ phát. Tổn thương màng phổi có thể được nhìn thấy, với sự phát triển của tràn dịch màng phổi.
|
Các đặc điểm phổ biến trên X-quang ngực trong lao sơ nhiễm:
|
Khi bệnh sơ nhiễm lành lại, X-quang ngực thường cho thấy một số di chứng của quá trình lành bệnh. Phổ biến nhất là các tổn thương nhỏ, vôi hóa trong nhu mô phổi, phản ánh một tập hợp các u hạt đã vôi hóa. Có thể thấy sự vôi hóa trong các hạch bạch huyết rốn phổi hoặc cạnh khí quản. Thuật ngữ X-quang có thể gây nhầm lẫn khi được sử dụng phổ biến. Thuật ngữ u hạt là một thuật ngữ giải phẫu bệnh mô tả một tập hợp vi thể của các tế bào lympho và mô bào. Một nốt vôi hóa trên X-quang ngực thường được gọi là một u hạt vôi hóa, nhưng nó thực sự đại diện cho một khối nhỏ gồm nhiều u hạt vi thể.
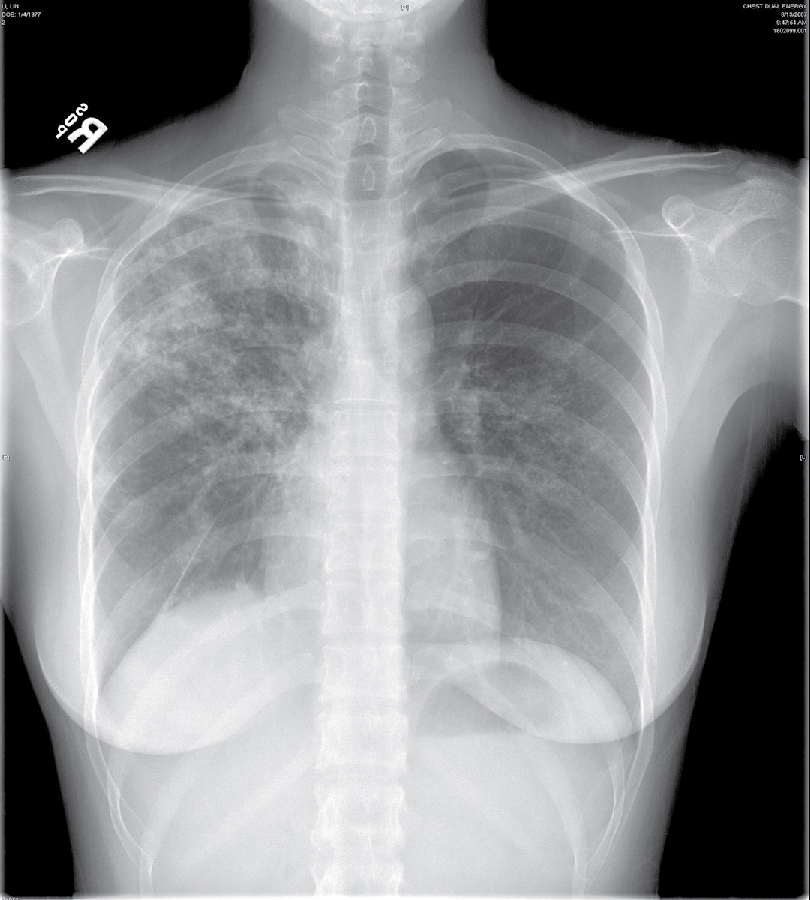
Hình 25.2. X-quang ngực của bệnh nhân bị lao tái hoạt. Lưu ý các đám thâm nhiễm ở phổi phải, chủ yếu ở thùy trên phải.
Với bệnh lao tái hoạt, các vị trí phổ biến nhất của bệnh là các phân thùy đỉnh và sau của các thùy trên và, ở mức độ thấp hơn, phân thùy trên của các thùy dưới. Có thể thấy nhiều hình thái khác nhau: thâm nhiễm, hang, nốt, và sẹo và co kéo (Hình 25.2). Sự hiện diện của các phát hiện bất thường trên X-quang ngực không nhất thiết cho thấy bệnh đang hoạt động. Bệnh có thể đã cũ, ổn định và hiện không hoạt động, và rất khó, nếu không muốn nói là không thể, để đánh giá mức độ hoạt động chỉ dựa vào hình ảnh X-quang.
| Vị trí trên X-quang của lao tái hoạt: phổ biến nhất là phân thùy đỉnh và sau của thùy trên, phân thùy trên của thùy dưới. |
Chẩn đoán xác định bệnh lao dựa vào việc nuôi cấy vi sinh vật từ các chất tiết (ví dụ: đờm) hoặc mô, nhưng vi sinh vật phát triển chậm, cần tới 6 tuần để phát triển và định danh cuối cùng. Nuôi cấy vi sinh vật là quan trọng để xác nhận chẩn đoán và để làm kháng sinh đồ, đặc biệt là khi tình trạng kháng một số loại thuốc kháng lao thông thường ngày càng tăng. Xét nghiệm di truyền phân tử hiện cho phép xác định sớm hơn một số loại kháng thuốc so với các phương pháp nuôi cấy và làm kháng sinh đồ truyền thống.
Một thủ thuật cực kỳ hữu ích khác có thể cung cấp kết quả gần như ngay lập tức là nhuộm mẫu bệnh phẩm lấy từ cây khí phế quản. Các mẫu bệnh phẩm thu được có thể là đờm, được khạc ra một cách tự nhiên hoặc sau khi hít một dung dịch khí dung gây kích thích (gây khạc đờm), hoặc dịch rửa hoặc mẫu sinh thiết thu được bằng nội soi phế quản ống mềm. Mặc dù chúng bắt màu dương tính với nhuộm Gram, một dấu hiệu đặc trưng của các vi sinh vật mycobacteria là khả năng giữ lại một số loại thuốc nhuộm ngay cả sau khi tiếp xúc với axit. Đặc tính kháng axit của chúng thường được chứng minh bằng nhuộm Ziehl-Neelsen hoặc Kinyoun, hoặc bằng một loại thuốc nhuộm huỳnh quang sử dụng auramine-rhodamine. Việc tìm thấy một trực khuẩn kháng axit duy nhất từ đờm hoặc dịch rửa khí phế quản có ý nghĩa lâm sàng trong phần lớn các trường hợp. Một lưu ý là các mycobacteria không phải lao, gây ra bệnh ít nghiêm trọng hơn hoặc hiện diện như các vi sinh vật thường trú hoặc tạp nhiễm, có cùng đặc tính nhuộm. Do đó, điều quan trọng là phải xác định xem trực khuẩn kháng axit nhìn thấy trên tiêu bản nhuộm có phải là M. tuberculosis hay là các mycobacteria không phải lao. Sự phân biệt này có thể được thực hiện bằng một số đặc điểm phát triển nhất định trên môi trường nuôi cấy hoặc các kỹ thuật sinh học phân tử.
Để một trực khuẩn lao duy nhất có thể được nhìn thấy trên tiêu bản nhuộm, phải có một số lượng lớn vi sinh vật trong phổi. Do đó, ngay cả trong bối cảnh bệnh đang hoạt động, nếu có tương đối ít vi sinh vật trong phổi, kết quả nhuộm soi có thể âm tính, mặc dù kết quả nuôi cấy thường sẽ dương tính. Nói chung, khả năng lây nhiễm của một bệnh nhân lao tương quan với số lượng vi sinh vật mà bệnh nhân đang mang và sự hiện diện của vi sinh vật trên tiêu bản nhuộm. Những bệnh nhân có đờm dương tính qua nhuộm soi có xu hướng lây nhiễm cao hơn nhiều so với những bệnh nhân có đờm dương tính qua nuôi cấy nhưng âm tính qua nhuộm soi.
Do độ nhạy thấp của phương pháp nhuộm soi đờm và thời gian cần thiết để M. tuberculosis phát triển trong môi trường nuôi cấy, các phương pháp nhanh hơn và nhạy hơn để xác định chẩn đoán lao đã được phát triển. Các xét nghiệm khuếch đại axit nucleic đã được phát triển có thể phát hiện M. tuberculosis trong các mẫu bệnh phẩm hô hấp trong vòng chưa đầy 12 giờ và với độ nhạy và độ đặc hiệu cao hơn so với các kỹ thuật nhuộm thông thường. Một kỹ thuật khác liên quan đến việc phát hiện được đánh dấu phóng xạ sau khi ủ mẫu bệnh phẩm với axit palmitic được đánh dấu phóng xạ, một cơ chất chuyển hóa cho mycobacteria. Kết quả có thể thu được nhanh hơn nhiều với kỹ thuật này so với nuôi cấy thông thường.
Đánh giá chức năng của bệnh nhân lao thường cho thấy sự suy giảm chức năng phổi ít đáng ngạc nhiên. Việc đo chức năng hô hấp chủ yếu hữu ích cho những bệnh nhân đã bị suy giảm chức năng phổi từ trước, khi có lo ngại về việc bệnh nhân đã mất bao nhiêu phần dự trữ chức năng. Tuy nhiên, một bệnh nhân có khả năng lây nhiễm không nên được đánh giá bằng đo chức năng hô hấp vì khả năng lây nhiễm cho người khác trong quá trình thực hiện. Khí máu động mạch thường tương đối được bảo tồn, với bình thường hoặc giảm, tùy thuộc vào mức độ bất tương hợp thông khí-tưới máu đã xảy ra.
NGUYÊN TẮC ĐIỀU TRỊ
Hóa trị liệu hiệu quả có sẵn cho hầu hết các trường hợp lao. Trước những năm 1950, việc điều trị bệnh lao chỉ có hiệu quả hạn chế, bao gồm việc nhập viện kéo dài (thường là trong một trại điều dưỡng) hoặc một loạt các thủ thuật phẫu thuật, trong khi hiện nay hầu hết các trường hợp đều có thể chữa khỏi bằng liệu pháp thuốc thích hợp. Tuy nhiên, sự gia tăng tỷ lệ mắc lao đa kháng thuốc lại một lần nữa đe dọa khả năng điều trị hiệu quả căn bệnh này. Bệnh nhân được điều trị trong một thời gian dài, thường với tối thiểu hai loại thuốc kháng lao hiệu quả mà vi sinh vật nhạy cảm. Có nhiều phác đồ thuốc được khuyến nghị khác nhau tùy thuộc vào khả năng có vi khuẩn kháng thuốc và khả năng dung nạp của bệnh nhân. Ở những khu vực có mối lo ngại về kháng thuốc thấp, phác đồ truyền thống bao gồm một giai đoạn tấn công với bốn loại thuốc (isoniazid, rifampin, pyrazinamide, và ethambutol) trong 2 tháng đầu, sau đó là 4 tháng nữa với hai loại thuốc. Nếu có kết quả kháng sinh đồ, việc lựa chọn thuốc ban đầu sẽ được điều chỉnh cho phù hợp.
| Một phác đồ điều trị lao phổi phổ biến là isoniazid và rifampin trong 6 tháng, bổ sung pyrazinamide trong 2 tháng đầu và ethambutol cho đến khi có kết quả kháng sinh đồ của vi khuẩn. |
Việc điều trị có thể được thực hiện tại ngoại trú trừ khi bệnh nhân đủ yếu để cần nhập viện. Bệnh nhân có kết quả nhuộm soi đờm ban đầu dương tính thường được coi là không còn khả năng lây nhiễm sau khi họ đã thể hiện đáp ứng lâm sàng với liệu pháp kháng lao và đờm của họ trở nên âm tính trên ba mẫu liên tiếp. Một vấn đề quan trọng quyết định sự thành công của liệu pháp kháng lao là sự tuân thủ của bệnh nhân đối với chế độ điều trị. Việc điều trị không đều đặn hoặc không đầy đủ có liên quan đến nguy cơ thất bại điều trị và sự xuất hiện của các chủng vi khuẩn kháng thuốc, với những hậu quả có thể rất thảm khốc. Do đó, việc sử dụng liệu pháp điều trị có giám sát trực tiếp, trong đó sự tuân thủ được theo dõi tại ngoại trú bằng video hoặc quan sát trực tiếp bệnh nhân uống thuốc, đã trở thành một thành phần quan trọng trong điều trị hầu hết các trường hợp lao. Độc tính trên gan có thể xảy ra với các loại thuốc kháng lao, đòi hỏi phải theo dõi bệnh nhân một cách thích hợp trong quá trình điều trị.
Điều trị lao hoạt động ở bệnh nhân đồng nhiễm HIV/AIDS đặt ra những thách thức riêng. Những bệnh nhân này có nguy cơ cao bị tương tác thuốc và các phản ứng bất lợi với thuốc kháng lao. Ngoài ra, hội chứng viêm phục hồi miễn dịch có thể phát triển nếu liệu pháp kháng retrovirus kết hợp được bắt đầu đồng thời với điều trị lao. Với liệu pháp kháng retrovirus, khi hệ miễn dịch bị suy yếu phục hồi và đối mặt với nhiễm trùng lao, tình trạng viêm dữ dội có thể phát triển gây ra sốt cao hơn thoáng qua, khó chịu, sụt cân và các triệu chứng hô hấp xấu đi. Hội chứng này có thể khó phân biệt trên lâm sàng với thất bại điều trị lao.
Do đó, việc điều trị lao hiệu quả đòi hỏi hóa trị liệu dài hạn cho tất cả bệnh nhân và điều trị có giám sát trực tiếp cho càng nhiều người càng tốt. Việc điều trị tốn nhiều công sức, và nó thành công nhất với một hệ thống y tế công cộng được tài trợ tốt và hiệu quả. Ngay cả ở các quốc gia công nghiệp hóa, điều này cũng đặt ra những khó khăn. Nhiều nơi trên thế giới có nguồn lực hạn chế và loại hình hệ thống y tế công cộng này không tồn tại.
Ngoài liệu pháp đa thuốc được áp dụng cho lao hoạt động, liệu pháp cũng được chỉ định cho một số bệnh nhân chọn lọc bị nhiễm lao tiềm ẩn được phát hiện qua test da tuberculin hoặc IGRA. Hiện tại, Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh (CDC) khuyến nghị một phác đồ dựa trên rifampin trong 3-4 tháng, vì phác đồ này an toàn và hiệu quả với tỷ lệ hoàn thành cao hơn so với phác đồ cũ là isoniazid trong 6 đến 9 tháng. Liệu pháp như vậy làm giảm đáng kể khả năng phát triển bệnh lao hoạt động, đặc biệt là ở những cá nhân có nguy cơ đặc biệt cao.
| Liệu pháp đơn thuốc với rifampin hoặc isoniazid được chỉ định cho một số bệnh nhân chọn lọc bị nhiễm lao tiềm ẩn (có test da tuberculin hoặc xét nghiệm giải phóng interferon- dương tính nhưng không có bằng chứng về bệnh hoạt động). |
Ngoài những người tiếp xúc gần với bệnh nhân lao hoạt động, một số bệnh nhân khác bị nhiễm lao tiềm ẩn được ghi nhận bằng phản ứng test da tuberculin hoặc IGRA dương tính nhưng không có bằng chứng về bệnh hoạt động được coi là ứng cử viên cho việc điều trị bằng phác đồ đơn thuốc. Cụ thể, nhóm này bao gồm những bệnh nhân thỏa mãn các tiêu chí bổ sung khiến họ có nguy cơ cao tái hoạt một ổ nhiễm trùng không hoạt động. Ví dụ bao gồm sự hiện diện của các phát hiện X-quang ổn định của bệnh lao hoạt động cũ nhưng chưa từng được điều trị trước đó, hoặc sự hiện diện của các bệnh lý nền hoặc điều trị làm suy giảm cơ chế phòng vệ của vật chủ. Mặc dù hình thức điều trị đơn thuốc này thường được gọi là “dự phòng”, nó thực sự là một phương pháp điều trị nhằm mục đích diệt trừ một số lượng nhỏ các vi sinh vật không hoạt động nhưng vẫn có khả năng sống, và chỉ cần một loại thuốc duy nhất vì ít lo ngại về tình trạng kháng thuốc khi số lượng vi sinh vật thấp. Điều trị lao tiềm ẩn rất hiệu quả trong việc giảm tỷ lệ lao tái hoạt.
Như đã lưu ý, một vấn đề y tế công cộng lớn gần đây là sự phát triển của các chủng vi khuẩn kháng một hoặc nhiều loại thuốc kháng lao thông thường. Khi một chủng kháng cả isoniazid và rifampin, nó được gọi là đa kháng thuốc (MDR). Nếu một chủng kháng isoniazid và rifampin cộng với bất kỳ fluoroquinolone nào và ít nhất một trong các loại thuốc tiêm, nó được gọi là siêu kháng thuốc (XDR). Vấn đề này nhấn mạnh tầm quan trọng của các biện pháp y tế công cộng để hạn chế lây truyền lao từ người sang người, cũng như các nỗ lực cải thiện sự tuân thủ của bệnh nhân đối với thuốc kháng lao. Khi điều trị một bệnh nhân lao do các chủng MDR hoặc XDR gây ra, sự phối hợp chặt chẽ giữa các bác sĩ điều trị và các cơ quan y tế công cộng là điều cần thiết. Các kỹ thuật chẩn đoán phân tử đã được phát triển để xác định ngay lập tức một số tình trạng kháng thuốc tại thời điểm chẩn đoán lao, và chúng có thể cải thiện đáng kể việc quản lý những bệnh nhân này.
Mục tiêu phát triển một loại vắc-xin hiệu quả chống lại M. tuberculosis vẫn là một bước quan trọng hướng tới việc thanh toán bệnh lao trên toàn thế giới. Việc tiêm phòng bằng BCG, một chủng sống, giảm độc lực của Mycobacterium bovis, đã được sử dụng trong nhiều năm ở nhiều quốc gia trên thế giới, nhưng nó không được khuyến nghị sử dụng ở Hoa Kỳ ngoại trừ một số trường hợp hiếm hoi được chọn lọc. Mặc dù việc tiêm phòng BCG dường như làm giảm nguy cơ mắc các dạng lao nghiêm trọng và có khả năng đe dọa tính mạng ở trẻ em, nhưng hiệu quả của nó trong việc ngăn ngừa lao phổi ở người lớn vẫn còn nhiều nghi vấn. Đáng chú ý, những bệnh nhân được tiêm vắc-xin BCG ít nhất ban đầu sẽ có phản ứng dương tính với test PPD, mặc dù độ chính xác của xét nghiệm IGRA đối với bệnh lao không bị ảnh hưởng trong trường hợp này.
CÁC MYCOBACTERIA KHÔNG PHẢI LAO
Một loạt các mycobacteria không phải lao, đôi khi được gọi là mycobacteria không điển hình, là những tác nhân gây bệnh tiềm tàng ở phổi. Chúng thường được tìm thấy trong nước và đất, dường như là nguồn lây nhiễm chứ không phải lây từ người sang người. Các sinh vật phổ biến nhất trong nhóm này được phân loại thuộc phức hợp Mycobacterium avium (MAC), bao gồm Mycobacterium avium, Mycobacterium intracellulare và các sinh vật khác tương tự về mặt di truyền. Các sinh vật không phải lao cũng có thể gây bệnh phổi bao gồm M. kansasii, M. abscessus, M. xenopi, và M. fortuitum.
Các mycobacteria không phải lao chủ yếu gây bệnh trong hai bối cảnh: (1) bệnh nhân có bệnh phổi cấu trúc tiềm ẩn, phổ biến nhất là giãn phế quản, xơ nang, hoặc COPD nặng, trong đó các cơ chế phòng vệ tại chỗ bị suy yếu, và (2) bệnh nhân có khiếm khuyết mắc phải hoặc di truyền trong phản ứng miễn dịch của vật chủ, bao gồm HIV/AIDS và các khiếm khuyết di truyền trong con đường interferon-. Điều quan trọng là, việc điều trị bằng các tác nhân ức chế miễn dịch, đặc biệt là glucocorticoid và liệu pháp sinh học chống lại TNF-, cũng liên quan đến việc tăng nguy cơ. Tuy nhiên, các mycobacteria không phải lao cũng có thể gây bệnh ở một số ít bệnh nhân không có các yếu tố nguy cơ này.
| Các mycobacteria không phải lao thường là tác nhân gây bệnh ở những bệnh nhân có bệnh phổi tiềm ẩn hoặc khiếm khuyết trong phản ứng miễn dịch của vật chủ. |
Bệnh do các mycobacteria không phải lao gây ra có thể khu trú ở phổi, nơi nó có thể bắt chước bệnh lao, hoặc nó có thể được tìm thấy sau khi lan tràn theo đường máu khắp cơ thể, đặc biệt là ở những bệnh nhân bị AIDS hoặc các tình trạng suy giảm miễn dịch khác. Việc xác nhận bệnh do các sinh vật này gây ra là khó khăn. Ở những bệnh nhân có bệnh phổi tiềm ẩn, những sinh vật này có thể cư trú trong hệ hô hấp mà không gây bệnh xâm lấn và có thể được tìm thấy như là các tạp nhiễm trong phòng xét nghiệm. Không giống như bệnh lao, nơi việc phân lập được vi sinh vật là bằng chứng của bệnh hoạt động cần điều trị, việc phân lập các mycobacteria không phải lao không tự động có nghĩa là cần phải điều trị. Bởi vì việc điều trị có thể đi kèm với các tác dụng phụ, độc tính của việc điều trị có thể lớn hơn lợi ích tiềm năng của nó. Do đó, quyết định có điều trị hay không dựa trên sự hiện diện và mức độ nghiêm trọng của bệnh, nguy cơ tiến triển và ưu tiên của bệnh nhân. Khi điều trị được thực hiện, nó thường bao gồm nhiều loại thuốc trong một thời gian dài, thường hơn 1 năm. Các sinh vật này thường kháng với một số loại thuốc kháng mycobacteria tiêu chuẩn, vì vậy các phác đồ điều trị phức tạp, khó dung nạp và thường không thành công. Tất cả các phương pháp điều trị nên dựa trên dữ liệu kháng sinh đồ. Đối với bệnh nhân mắc MAC, các kháng sinh macrolide (ví dụ: clarithromycin, azithromycin) được khuyến nghị như một phần của phác đồ ba thuốc, tùy thuộc vào độ nhạy cảm. Một cuộc thảo luận đầy đủ hơn về chủ đề này nằm ngoài phạm vi của văn bản này, vì vậy người đọc được giới thiệu đến các bài báo tổng quan trong phần tài liệu tham khảo.
TÀI LIỆU THAM KHẢO ĐỀ XUẤT
- Berger C.A., Alipanah N., Kheir F., Ruminjo J.K., Nahid P., Thomson C.: Summary for clinicians: 2019 Clinical practice guideline summary for the treatment of drug-resistant tuberculosis. Annals of the American Thoracic Society 2020; 17: pp. 911-917.
- Shah M., Dorman S.E.: Latent tuberculosis infection. New England Journal of Medicine 2021; 385: pp. 2271-2280.
- Shariq M., Sheikh J.A., Quadir N., Sharma N., Hasnain S.E., Ehtesham N.Z.: COVID-19 and tuberculosis: The double whammy of respiratory pathogens. European Respiratory Review 2022; 31: pp. 210264.
- Siow W.T., Lee P.: Tracheobronchial tuberculosis: A clinical review. Journal of Thoracic Disease 2017; 9: pp. E71-E77.
- Zaheen A., Bloom B.R.: Tuberculosis in 2020 – New approaches to a continuing global health crisis. New England Journal of Medicine 2020; 382: pp. e26.
- Awuh J.A., Flo T.H.: Molecular basis of mycobacterial survival in macrophages. Cellular and Molecular Life Sciences 2017; 74: pp. 1625-1648.
- Kinsella R.L., Zhu D.X., Harrison G.A., Mayer Bridwell A.E., Prusa J., Chavez S.M., et. al.: Perspectives and advances in the understanding of tuberculosis. Annual Review of Pathology 2021; 16: pp. 377-408.
- Ravimohan S., Kornfeld H., Weissman D., Bisson G.P.: Tuberculosis and lung damage: From epidemiology to pathophysiology. European Respiratory Review 2018; 27: pp. 170077.
- Torrelles J.B., Schlesinger L.S.: Integrating lung physiology, immunology, and tuberculosis. Trends in Microbiology 2017; 25: pp. 688-697.
- Clinical manifestations and diagnostic approach
- Blumberg H.M., Kempker R.R.: Interferon release assays for the evaluation of tuberculosis infection. JAMA 2014; 312: pp. 1460-1461.
- Cattamanchi A., Reza T.F., Nalugwa T., Adams K., Nantale M., Oyuku D., et. al.: Multicomponent strategy with decentralized molecular testing for tuberculosis. New England Journal of Medicine 2021; 385: pp. 2441-2450.
- CRyPTIC Consortium and the 100,000 Genomes Project, Allix-Béguec C., Arandjelovic I., Bi L., Beckert P., Bonnet M., et. al.: Prediction of susceptibility to first-line tuberculosis drugs by DNA sequencing. New England Journal of Medicine 2018; 379: pp. 1403-1415.
- Kahwati L.C., Feltner C., Halpern M., Woodell C.L., Boland E., Amick H.R., et. al.: Primary care screening and treatment for latent tuberculosis infection in adults: Evidence report and systematic review for the US Preventive Services Task Force. JAMA 2016; 316: pp. 970-983.
- Lewinsohn D.M., Leonard M.K., LoBue P.A., Cohn D.L., Daley C.L., Desmond E., et. al.: Official American Thoracic Society/Infectious Diseases Society of America/Centers for Disease Control and Prevention clinical practice guidelines: Diagnosis of tuberculosis in adults and children. Clinical Infectious Diseases 2017; 64: pp. 111-115.
- Restrepo C.S., Katre R., Mumbower A.: Imaging manifestations of thoracic tuberculosis. Radiologic Clinics of North America 2016; 54: pp. 453-473.
- Belknap R., Holland D., Feng P.J., Millet J.P., Caylà J.A., Martinson N.A., et. al.: Self-administered versus directly observed once-weekly isoniazid and rifapentine treatment of latent tuberculosis infection: A randomized trial. Annals of Internal Medicine 2017; 167: pp. 689-697.
- Conradie F., Diacon A.H., Ngubane N., Howell P., Everitt D., Crook A.M., et. al.: Treatment of highly drug-resistant pulmonary tuberculosis. New England Journal of Medicine 2020; 382: pp. 893-902.
- Mirzayev F., Viney K., Linh N.N., Gonzalez-Angulo L., Gegia M., Jaramillo E., et. al.: World Health Organization recommendations on the treatment of drug-resistant tuberculosis, 2020 update. European Respiratory Journal 2021; 57: pp. 2003300.
- Nahid P., Mase S.R., Migliori G.B., Sotgiu G., Bothamley G.H., Brozek J.L., et. al.: Treatment of drug-resistant tuberculosis. An official ATS/CDC/ERS/IDSA clinical practice guideline. American Journal of Respiratory and Critical Care Medicine 2019; 200: pp. e93-e142.
- Nunn A.J., Phillips P.P.J., Meredith S.K., Chiang C.Y., Conradie F., Dalai D., et. al.: A trial of a shorter regimen for rifampin-resistant tuberculosis. New England Journal of Medicine 2019; 380: pp. 1201-1213.
- Swindells S., Ramchandani R., Gupta A., Benson C.A., Leon-Cruz J., Mwelase N., et. al.: One month of rifapentine plus isoniazid to prevent HIV-related tuberculosis. New England Journal of Medicine 2019; 380: pp. 1001-1011.
- Turkova A., Wills G.H., Wobudeya E., Chabala C., Palmer M., Kinikar A., et. al.: Shorter treatment for nonsevere tuberculosis in African and Indian children. New England Journal of Medicine 2022; 386: pp. 911-922.
- Uthman O.A., Okwundu C., Gbenga K., Volmink J., Dowdy D., Zumla A., et. al.: Optimal timing of antiretroviral therapy initiation for HIV-infected adults with newly diagnosed pulmonary tuberculosis: A systematic review and meta-analysis. Annals of Internal Medicine 2015; 163: pp. 32-39.
- WHO Consolidated Guidelines on Tuberculosis, module 4: Treatment – drug resistant tuberculosis treatment. 2020. Retrieved from https://www.who.int/publications/i/item/9789240007048 . Accessed on May 6, 2022.
- Cowman S., van Ingen J., Griffith D.E., Loebinger M.R.: Non-tuberculous mycobacterial pulmonary disease. European Respiratory Journal 2019; 54: pp. 1900250.
- Daley C.L., Iaccarino J.M., Lange C., Cambau E., Wallace R.J.,Jr., Andrejak C., et. al.: Treatment of nontuberculous mycobacterial pulmonary disease: An official ATS/ERS/ESCMID/IDSA clinical practice guideline. European Respiratory Journal 2020; 56: pp. 2000535.
- Diel R., Ringshausen F., Richter E., Welker L., Schmitz J., Nienhaus A.: Microbiological and clinical outcomes of treating non- Mycobacterium avium complex nontuberculous mycobacterial pulmonary disease: A systematic review and meta-analysis. Chest 2017; 152: pp. 120-142.
- Flume P.A., Griffith D.E., Chalmers J.D., Daley C.L., Olivier K., O’Donnell A., et. al.: Development of drugs for nontuberculous mycobacterial disease: Clinicians’ interpretation of a US Food and Drug Administration workshop. Chest 2021; 159: pp. 537-543.
- Griffith D.E., Daley C.L.: Treatment of Mycobacterium abscessus pulmonary disease. Chest 2022; 161: pp. 64-75.
- Henkle E., Winthrop K.L.: Nontuberculous mycobacteria infections in immunosuppressed hosts. Clinics in Chest Medicine 2015; 36: pp. 91-99.
- Kumar K., Daley C.L., Griffith D.E., Loebinger M.R.: Management of Mycobacterium avium complex and Mycobacterium abscessus pulmonary disease: Therapeutic advances and emerging treatments. European Respiratory Review 2022; 31: pp. 210212.
- Kumar K., Loebinger M.R.: Nontuberculous mycobacterial pulmonary disease: Clinical epidemiologic features, risk factors, and diagnosis: The nontuberculous mycobacterial series. Chest 2022; 161: pp. 637-646.
- Varley C.D., Winthrop K.L.: Nontuberculous mycobacteria: Diagnosis and therapy. Clinics in Chest Medicine 2022; 43: pp. 89-98.
Bảng chú giải thuật ngữ Y học Anh-Việt
Chương 25. Lao phổi và Vi khuẩn Mycobacteria không lao
