SÁCH DỊCH “Y HỌC CHU PHẪU: QUẢN LÝ HƯỚNG ĐẾN KẾT QUẢ, ẤN BẢN THỨ 2”
Được dịch và chuyển thể sang tiếng Việt từ sách gốc “Perioperative Medicine: Managing for Outcome, 2nd Edition”
Dịch và chú giải: Ths.Bs. Lê Đình Sáng – Hiệu đính: Ts.Bs.Lê Nhật Huy
Chương 8. Đánh Giá Nguy Cơ và Rối Loạn Chức Năng Thận Chu Phẫu
Risk Assessment and Perioperative Renal Dysfunction – Robert A. Sickeler and Miklos D. Kertai
Perioperative Medicine, 8, 67-82
Tất cả người bệnh trải qua phẫu thuật – từ phẫu thuật đơn giản đến các thủ thuật phẫu thuật cực kỳ phức tạp – đều chịu một số rối loạn trong việc cung cấp oxy đến thận. Tổn thương thận cấp (AKI) sau phẫu thuật dự báo sự gia tăng bệnh suất và tử suất tổng thể và sử dụng nguồn lực bệnh viện. Do đó, việc xác định người bệnh có nguy cơ tăng cao đối với AKI sau phẫu thuật là rất quan trọng. Tiên lượng của AKI sau phẫu thuật cho một người bệnh cụ thể được lên lịch cho một can thiệp phẫu thuật cụ thể có thể (1) hỗ trợ người bệnh và gia đình trong quyết định trải qua một loại thủ thuật phẫu thuật cụ thể và (2) cho phép tối ưu hóa cân bằng nội môi thận trước, trong và sau phẫu thuật. Một số nghiên cứu cho thấy việc dự đoán AKI sau phẫu thuật và chẩn đoán kịp thời là rất quan trọng đối với việc điều trị hiệu quả AKI sau phẫu thuật, và điều này có tiềm năng để giảm thiểu nguy cơ cần liệu pháp thay thế thận tạm thời hoặc mãn tính. Đặc điểm người bệnh (ví dụ: tuổi cao, đái tháo đường [ĐTĐ], bệnh mạch máu), loại thủ thuật phẫu thuật (ví dụ: cắt túi mật nội soi so với thay đoạn cung động mạch chủ), và đặc điểm trong phẫu thuật (ví dụ: thời gian hạ huyết áp hoặc đặt kẹp trên thận, ngừng tuần hoàn), cũng như thuốc và/hoặc can thiệp được biết là yếu tố nguy cơ đối với AKI (aminoglycoside hoặc thuốc cản quang), tất cả đều ảnh hưởng đến nguy cơ phát triển AKI sau phẫu thuật (Hộp 8.1).
Một số chương trong cuốn sách này đề cập đến mối liên hệ giữa phẫu thuật và AKI sau phẫu thuật; tuy nhiên, mục tiêu cụ thể của chương này là cung cấp cho các bác sĩ lâm sàng các phương pháp để xác định người bệnh có nguy cơ tăng cao đối với AKI sau phẫu thuật. Đầu tiên, chúng tôi phác thảo các tác động nội tại của phẫu thuật và gây mê lên sinh lý thận, minh họa tại sao tất cả người bệnh đều có nguy cơ tiềm ẩn đối với AKI sau phẫu thuật. Thứ hai, chúng tôi thảo luận về các đặc điểm của người bệnh có liên quan đến việc tăng nguy cơ đối với AKI sau phẫu thuật. Thứ ba, chúng tôi chi tiết ba loại can thiệp phẫu thuật – tuần hoàn ngoài cơ thể, ngừng tuần hoàn hạ thân nhiệt sâu (HCA), và tắc nghẽn động mạch chủ trên thận – các điều này làm giảm tưới máu thận bình thường một cách cơ học và sâu sắc trong quá trình phẫu thuật và do đó gây ra nguy cơ đáng kể đối với AKI sau phẫu thuật. (Mặc dù đây không phải là danh sách đầy đủ các rối loạn cơ học có thể ảnh hưởng đến dòng máu thận [RBF] trong quá trình phẫu thuật, các can thiệp này được chọn vì chúng được sử dụng trong một số thủ thuật phẫu thuật.) Thứ tư, vì suy giảm chức năng thận trước đó có liên quan đến nguy cơ tăng cao đối với AKI sau phẫu thuật, chúng tôi trình bày các chiến lược để xác định người bệnh có bệnh thận từ trước hoặc để định lượng mức độ nghiêm trọng của bệnh thận mãn tính đã có từ trước. Thứ năm, chúng tôi kết thúc chương với đánh giá các hệ thống chấm điểm hiện có để định lượng nguy cơ đối với AKI sau phẫu thuật và tiện ích tương ứng của chúng.
Ảnh Hưởng của Phẫu Thuật và Gây Mê trên Tưới Máu Thận
Thận là một hệ thống phức tạp của các quá trình tích hợp duy trì cân bằng nội môi dịch và loại bỏ các sản phẩm chất thải. Mặc dù thận chỉ cần 10% tổng lượng tiêu thụ oxy toàn thân, vỏ thận nhận 90% tổng lượng RBF và chỉ chiết xuất 18% lượng oxy được cung cấp. Ngược lại, tủy thận chỉ nhận 10% RBF đến thận, và đó là nơi diễn ra các quá trình tiêu thụ oxy và năng lượng tốn kém chịu trách nhiệm tái hấp thu natri và nước ở ống thận. Ở tủy, 79% lượng oxy được cung cấp được chiết xuất, dẫn đến gradient oxy động tĩnh mạch cao ở tủy thận. Do đó, tủy cực kỳ nhạy cảm với việc giảm RBF. Giảm 40% RBF có thể dẫn đến hoại tử ống thận cấp tính, đặc biệt là khi có tổn thương thận khác. Các can thiệp cải thiện RBF (tăng cung lượng tim [CO], thay thế dịch) hoặc giảm tiêu thụ oxy tủy có thể cải thiện khả năng chịu đựng trong thời gian thiếu máu gián đoạn. Các tình trạng khác, bao gồm tiếp xúc với thuốc cản quang và tăng nồng độ bilirubin hoặc myoglobinuria, có thể làm trầm trọng thêm đáp ứng bất lợi đối với thiếu oxy thận bằng cách tăng tải thẩm thấu đến nephron và tăng thêm nhu cầu oxy.
Một số loại thuốc đã được chứng minh là độc thận thông qua nhiều cơ chế khác nhau. Việc sử dụng aminoglycoside hoặc thuốc chống viêm không steroid trong chu phẫu có thể gây ra AKI ở thận thiếu oxy. Việc sử dụng mãn tính chất ức chế enzyme chuyển angiotensin (ACE) có thể dẫn đến suy giảm đáp ứng bù đắp bình thường đối với sự giảm tưới máu thận. Aprotinin, một chất ức chế protease serine kháng viêm được sử dụng trong phẫu thuật để giảm mất máu, được tập trung trong thận, và theo các nghiên cứu trước đây, việc sử dụng nó có liên quan đến AKI sau phẫu thuật và suy thận cần liệu pháp thay thế thận. Hơn nữa, việc kết hợp chất ức chế ACE và aprotinin có thể có tác dụng phụ bất lợi đồng vận trên chức năng thận ở người bệnh trải qua phẫu thuật tim với tuần hoàn ngoài cơ thể (CPB).
AKI được định nghĩa là sự mất chức năng thận đột ngột, dẫn đến tích tụ chất thải chuyển hóa và các sản phẩm phụ cũng như mất cân bằng điều hòa dịch và điện giải. Đã có sự chuyển đổi từ các thuật ngữ như “rối loạn chức năng thận” và “suy thận” sang thuật ngữ được chấp nhận nhiều hơn là “tổn thương thận” để phản ánh tốt hơn kiến thức rằng mức độ rối loạn chức năng thận nhỏ có thể không nhất thiết dẫn đến sự thất bại hoàn toàn của cơ quan nhưng vẫn có hậu quả sinh lý sâu sắc và có thể dẫn đến bệnh tật đáng kể và tăng tỷ lệ tử vong. Có rất nhiều – hơn 30 – định nghĩa về AKI sử dụng các tiêu chí lâm sàng khác nhau. Thực tế, việc thiếu sự đồng thuận về một định nghĩa duy nhất rõ ràng và được chấp nhận rộng rãi về AKI đã là nguồn gốc của tranh cãi và nhầm lẫn trong lĩnh vực này, cũng như một rào cản đối với nghiên cứu về bệnh và tiến bộ trong kiến thức về AKI.
Ba trong số các định nghĩa nổi tiếng nhất là tiêu chí RIFLE của Sáng Kiến Chất Lượng Lọc Máu Cấp Tính, tiêu chí của Mạng Lưới Tổn Thương Thận Cấp Tính (AKIN), và tiêu chí của Cải Thiện Kết Quả Toàn Cầu Bệnh Thận (KDIGO), đã được phát triển trong nhiều năm khi kiến thức về AKI được cải thiện. Tiêu chí RIFLE sử dụng ý tưởng về các giai đoạn của tổn thương thận, được biết đến như “nguy cơ”, “tổn thương”, “suy thận”, “mất chức năng thận” và “bệnh thận giai đoạn cuối”, từ đó mà viết tắt được tạo ra, và sử dụng tăng creatinine (Cr) và giảm lượng nước tiểu (UO) làm các thước đo. Tiêu chí AKIN được phát triển sau đó và sửa đổi tiêu chí RIFLE, loại bỏ các giai đoạn “mất chức năng thận” và “bệnh thận giai đoạn cuối” và đơn giản hóa tên của ba giai đoạn đầu tiên thành giai đoạn 1, 2 và 3. Họ cũng sửa đổi thang thời gian mà trong đó những rối loạn này xảy ra, giảm thời gian xuống 48 giờ từ khung thời gian 7 ngày ban đầu của tiêu chí RIFLE. Tiêu chí KDIGO là mới nhất và cho phép điều chỉnh tình trạng thể tích và các nguyên nhân tắc nghẽn của AKI trước khi phân loại. Định nghĩa KDIGO về AKI liên quan đến việc tăng creatinine huyết thanh (sCr) thêm 0,3mg/dL hoặc nhiều hơn trong vòng 48 giờ, hoặc tăng sCr lên 1,5 lần cơ bản hoặc nhiều hơn trong vòng 7 ngày trước đó, hoặc UO ít hơn 0,5mL/kg/giờ trong 6 giờ. Các tiêu chí bổ sung sau đó được sử dụng để phân giai đoạn AKI.
Gây mê (cả toàn thân và vùng) và phẫu thuật, độc lập và đồng vận, có thể làm suy giảm nội môi thận trong các thủ thuật phẫu thuật. Cả hai loại gây mê đều liên quan đến giãn mạch ngoại vi, do đó dẫn đến giảm thể tích máu lưu thông và tưới máu thận. Giãn mạch và kết quả là giảm RBF đặc biệt đáng lo ngại ở người bệnh đã nil per os (NPO) trong 8 giờ trở lên, được kê thuốc lợi tiểu mãn tính hoặc chất ức chế ACE, đã bị nôn hoặc tiêu chảy gần đây, đã trải qua chuẩn bị ruột gần đây, hoặc đang chảy máu tích cực. Không có nghiên cứu nào chứng minh rằng gây mê toàn thân tốt hơn gây mê vùng trong việc hạn chế khả năng xảy ra AKI sau phẫu thuật.
Đối với gây mê toàn thân đặc biệt, đã có các nghiên cứu về tác dụng phụ có thể gây hại cho thận của các thuốc gây mê hít và các sản phẩm chuyển hóa ion florua của chúng. Trong số các thuốc gây mê hít được sử dụng lâm sàng, sevoflurane và enflurane giải phóng số lượng florua lớn nhất. Tuy nhiên, dược động học của các thuốc bay hơi này giới hạn rất nhiều khả năng rối loạn chức năng thận thứ phát do tiếp xúc với florua. Việc lựa chọn thuốc gây mê hít được phát hiện là ít liên quan đến việc gây ra AKI sau phẫu thuật, như được phản ánh bởi sự thiếu tăng các chỉ điểm sinh học AKI ở người bệnh đã trải qua phẫu thuật tim tự chọn. Sự tương tác giữa sevoflurane và vôi soda hoặc carbon dioxide hydroxit bari cũng có thể gây ra nguy cơ tiềm ẩn sản xuất một haloalkene có khả năng độc thận được gọi là “hợp chất A”. Tuy nhiên, các con đường chuyển hóa cho hợp chất này ở người hạn chế khả năng độc thận do hợp chất A. Thực tế, không có báo cáo được công bố về AKI do tiếp xúc với sevoflurane ở người bệnh phẫu thuật.
Đặc Điểm Bệnh Nhân và Nguy Cơ Tổn Thương Thận Cấp Sau Phẫu Thuật
Các yếu tố đặc hiệu của người bệnh (có thể xác định trong giai đoạn trước phẫu thuật) có liên quan đến AKI sau phẫu thuật nói chung rơi vào một trong ba loại: (1) đặc điểm người bệnh cho thấy dự trữ chức năng thận bị suy giảm, (2) phát hiện sinh lý liên quan đến tưới máu thận bị suy giảm, hoặc (3) các quá trình bệnh lý gây tổn thương thận.
|
Hộp 8.1 Các yếu tố liên quan đến nguy cơ tăng cao của tổn thương thận cấp sau phẫu thuật. Đặc điểm người bệnh ▪ Tuổi cao ▪ Đái tháo đường ▪ Rối loạn chức năng thất trái ▪ Bệnh mạch máu ngoại vi ▪ Bệnh mạch máu thận ▪ Nhiễm trùng huyết ▪ Suy gan Thủ thuật phẫu thuật ▪ Phẫu thuật động mạch chủ ▪ Tuần hoàn ngoài cơ thể ▪ Phẫu thuật chấn thương ▪ Ghép gan ▪ Ghép thận ▪ Ghép phổi Tổn thương thận chu phẫu ▪ Mất nước kéo dài ▪ Tắc nghẽn bàng quang kéo dài ▪ Thiếu oxy ▪ Hạ huyết áp ▪ Tiếp xúc với aminoglycoside ▪ Myoglobin hoặc hemoglobinuria ▪ Thuốc cản quang tĩnh mạch |
Các yếu tố nguy cơ tiềm ẩn bao gồm tuổi cao; giá trị sCr bất thường; ĐTĐ; và bất kỳ dấu hiệu, triệu chứng hoặc yếu tố nào cho thấy giảm CO và do đó ảnh hưởng đến tưới máu thận (Hình 8.1). Tuy nhiên, tỷ lệ thấp của AKI sau phẫu thuật cần liệu pháp thay thế thận (<2,0% ngay cả trong các quần thể có nguy cơ cao) và sự thiếu các nghiên cứu xét nghiệm thường quy nhạy cảm để xác định AKI ngay cả khi nó không dẫn đến sự tăng Cr hoặc nitơ urê máu (BUN) đã thách thức các nhà nghiên cứu xác định các yếu tố có liên quan đến AKI sau phẫu thuật.

Hình 8.1 Thuật toán nguy cơ thận trước phẫu thuật. Cây phân loại dựa trên phân tích phân vùng đệ quy. Bên cạnh các hộp đặc là các loại nguy cơ. CR CL, Độ thanh thải creatinine; IABP, bơm bóng đối xung trong động mạch chủ; NYHA, Hiệp hội Tim New York; PVD, bệnh mạch máu ngoại vi. (Được điều chỉnh với sự cho phép từ Chertow GM, Lazarus JM, Christiansen CL, et al 1997.)
ĐẶC ĐIỂM BỆNH NHÂN LIÊN QUAN ĐẾN GIẢM DỰ TRỮ THẬN
Khối lượng thận và chức năng thận tổng thể giảm theo tuổi tác. Đến 70 tuổi, số lượng nephron hoạt động giảm một nửa. Novis và cộng sự đã xem xét 28 nghiên cứu đánh giá các yếu tố nguy cơ đối với AKI sau phẫu thuật. Bốn trong số năm nghiên cứu lớn nhất xác định tuổi cao là một nguy cơ đối với AKI sau phẫu thuật. Trong một nghiên cứu về 2400 người bệnh trải qua phẫu thuật bắc cầu động mạch vành (CABG) tự chọn, Mangano và cộng sự phát hiện rằng người bệnh từ 70 đến 80 tuổi và những người trên 80 tuổi chịu nguy cơ tăng gấp đôi và gấp bốn lần đối với AKI sau phẫu thuật, tương ứng. Tương tự, Chertow và cộng sự, trong nghiên cứu của họ về 42.723 người bệnh phẫu thuật tim của Bộ Cựu Chiến Binh Hoa Kỳ (VA), phát hiện rằng 1,5% và 1,8% người bệnh phẫu thuật CABG từ 70 đến 80 tuổi và lớn hơn 80 tuổi, tương ứng, cần lọc máu sau phẫu thuật. Để so sánh, chỉ có 0,5% và 0,9% người bệnh từ 50 đến 59 và 60 đến 69 tuổi, tương ứng, cần liệu pháp thay thế thận. Tuy nhiên, sau khi điều chỉnh cho bệnh mạch máu ngoại vi, phẫu thuật tim trước đó và các biến số liên quan khác, tuổi cao không còn là một yếu tố dự đoán đáng kể của liệu pháp thay thế thận.
Người bệnh bị ĐTĐ, đặc biệt là những người mắc bệnh lâu dài được quản lý bằng insulin, thường có dự trữ thận giảm. ĐTĐ loại 1 và giá trị glucose trước phẫu thuật lớn hơn 300 mg/dL có liên quan đáng kể và độc lập với AKI sau phẫu thuật trong nghiên cứu của Mangano và cộng sự. Những người bệnh bị ĐTĐ loại 1 và những người bị tăng đường huyết lần lượt có khả năng cao hơn 1,8 và 3,7 lần so với người bệnh không bị ĐTĐ loại 1 để phát triển AKI sau phẫu thuật. Mặc dù một số nhà nghiên cứu đã không thể chứng minh mối liên hệ độc lập giữa ĐTĐ và AKI sau phẫu thuật, nhiều nhà nghiên cứu khác đã có thể phát triển chỉ số nguy cơ bao gồm ĐTĐ như một yếu tố dự đoán đáng kể của AKI sau phẫu thuật.
Nghiên cứu gần đây đã tập trung vào vai trò của béo phì và mối liên hệ của nó với nguy cơ tăng cao của AKI sau phẫu thuật. Một số nghiên cứu đã cho thấy tỷ lệ AKI sau phẫu thuật tăng gấp hai đến ba lần ở người bệnh béo phì, và sự gia tăng nguy cơ tiềm ẩn lớn hơn khi các thành phần khác của hội chứng chuyển hóa cũng hiện diện. Mối quan hệ này đã được nhìn thấy ở cả người bệnh phẫu thuật tim và không phải tim. Thú vị là, một số nghiên cứu đã tìm thấy hiệu ứng ngược đời giữa béo phì và cải thiện kết quả, điều này đã được gán cho một số cơ chế chuyển hóa và bệnh lý tiềm ẩn, tất cả đều không may bị nghiên cứu kém và do đó hiểu biết kém.
Giảm dự trữ chức năng thận được xác định tốt nhất bằng cách đo tốc độ lọc cầu thận (GFR). Tuy nhiên, hầu hết các nghiên cứu dựa vào giá trị sCr như một thước đo tiềm năng của dự trữ thận. Bởi vì giá trị Cr bị ảnh hưởng đáng kể bởi các yếu tố không phải thận (ví dụ: tuổi, giới tính, khối lượng cơ), chúng không thể được coi là thước đo đầy đủ của GFR. Một số nghiên cứu đã sử dụng phương trình Cockcroft-Gault để ước tính GFR. Các nghiên cứu sử dụng giá trị sCr, giá trị phái sinh cho GFR, hoặc đánh giá độ thanh thải creatinine thực sự (CrCl) hầu như đồng nhất xác định dự trữ thận trước phẫu thuật giảm, biểu hiện là tăng Cr hoặc giảm GFR, là một trong những đặc điểm người bệnh phổ biến nhất và quan trọng nhất liên quan đến AKI sau phẫu thuật (Bảng 8.1).
Bảng 8.1 Nguy cơ rối loạn chức năng thận theo dự trữ thận.
| Dự trữ thận | Nephron còn lại (%) | Tốc độ lọc cầu thận (mL/phút) | Dấu hiệu/triệu chứng | Bất thường xét nghiệm | Nguy cơ rối loạn chức năng hoặc suy thận |
|---|---|---|---|---|---|
| Bình thường | >50 | 125 | Không | Không | Tối thiểu |
| Giảm dự trữ thận | 40 | 50–80 | Không | Không | Nhẹ |
| Suy thận | 20–40 | 20–50 | Tiểu đêm | Tăng vừa phải BUN/creatinine, trừ khi bị căng thẳng | Vừa phải |
| Urê máu | 5–10 | <20 | Hội chứng urê máu | Nhiều | Nghiêm trọng |
BUN, Nitơ urê máu.
Một số nghiên cứu đã nhấn mạnh nguy cơ cộng thêm liên quan đến bệnh thận trước phẫu thuật thậm chí nhẹ trên AKI sau phẫu thuật. Weerasinghe và cộng sự đã nghiên cứu 1427 người bệnh không có bệnh thận đã biết, những người được lên lịch cho phẫu thuật CABG chính thức tự chọn. Họ báo cáo rằng người bệnh có mức tăng tối thiểu trong giá trị Cr (Cr >130 μmol/L) có nguy cơ đáng kể đối với suy thận sau phẫu thuật cần liệu pháp thay thế thận.
ĐẶC ĐIỂM BỆNH NHÂN CHO THẤY GIẢM DÒNG MÁU THẬN
Nhiều người bệnh đến phẫu thuật – đặc biệt là phẫu thuật tim hoặc phẫu thuật mạch máu lớn – có dấu hiệu và triệu chứng cho thấy giảm CO và do đó giảm RBF. Những dấu hiệu và triệu chứng như vậy bao gồm ran ẩm, ran ngáy, phù, căng tĩnh mạch cổ, âm thanh tim bất thường, nhu cầu hỗ trợ thất bằng thuốc hoặc cơ học, và bằng chứng siêu âm tim của phân suất tống máu giảm đáng kể (<35%). Ngay cả khi không có rối loạn chức năng thận trước đó rõ ràng (tức là với giá trị Cr bình thường), những người bệnh này có thể có khả năng rất giảm để duy trì GFR bình thường và cân bằng nội môi dịch, đặc biệt là với các tổn thương bổ sung của phẫu thuật và các can thiệp khác.
Nghiên cứu của Chertow và cộng sự về 43.642 người bệnh phẫu thuật tim và báo cáo của Thakar và cộng sự về 33.217 người bệnh phẫu thuật tim đều nhấn mạnh giá trị tiên lượng của các dấu hiệu, triệu chứng, can thiệp và đánh giá xét nghiệm chỉ ra chức năng thất trái giảm và do đó ảnh hưởng đến tưới máu thận. Sự hiện diện trước phẫu thuật của bất kỳ yếu tố nào trong số này thường chỉ ra rằng có nguy cơ tăng cao đối với AKI sau phẫu thuật.
Các nghiên cứu gần đây đã khám phá thêm mối liên hệ giữa suy giảm huyết động học trước phẫu thuật và AKI sau phẫu thuật. Một phân tích tổng hợp của Brienza và cộng sự bao gồm 20 nghiên cứu với tổng số 4220 người bệnh cho thấy tối ưu hóa huyết động học chu phẫu có thể giảm nguy cơ AKI sau phẫu thuật. Hồi sức dịch đầy đủ kết hợp với hỗ trợ tăng co bóp cơ tim trong giai đoạn trước phẫu thuật có thể là một cách hiệu quả để giảm thiểu nguy cơ AKI sau phẫu thuật, đặc biệt ở những người bệnh nguy cơ cao.
Liên Hệ Giữa Tổn Thương Thận và Các Yếu Tố Khác
Một số nghiên cứu đã đánh giá mối liên hệ của AKI sau phẫu thuật với các yếu tố có thể được dự đoán là liên quan đến giảm RBF, chẳng hạn như hẹp động mạch thận. Trong một trong những nghiên cứu, Conlon và cộng sự đã đánh giá mối liên hệ của hẹp động mạch thận có sẵn (>50% hẹp) với AKI sau phẫu thuật, nhưng họ không tìm thấy mối liên hệ đáng kể giữa hẹp động mạch thận có sẵn và AKI sau phẫu thuật.
CÁC BIẾN SỐ BỆNH NHÂN TRƯỚC PHẪU THUẬT KHÁC LIÊN QUAN ĐẾN TỔN THƯƠNG THẬN
Người bệnh có thể bị các quá trình bệnh lý khác nhau trong giai đoạn trước phẫu thuật làm cho thận tiếp xúc với các tổn thương độc hại, chẳng hạn như tăng mức độ sản phẩm phụ chuyển hóa hoặc các phân tử sinh học tự nhiên, do đó gây áp lực bổ sung lên chức năng thận. Những hiện tượng này gây tăng nhu cầu oxy thận. Ví dụ, suy gan hoặc tắc nghẽn dẫn đến tăng bilirubin và các phần tử chuyển hóa không hoàn toàn khác. Khi các chất chuyển hóa này tích tụ, nhu mô thận bù đắp cho sự thiếu hụt gan và phải giải độc, bài tiết, cô đặc hoặc tiết ra các chất độc này. Điều này thường đòi hỏi tăng nhu cầu oxy, và do đó, có thể hạn chế khả năng chịu đựng của thận đối với bất kỳ tổn thương thận nào khác được gây ra trong thời kỳ chu phẫu. Tương tự, người bệnh bị chấn thương lớn, chảy máu hoặc bỏng nhiều có nhu cầu oxy thận tăng, vì thận phải lọc mức myoglobin và hemoglobin trong huyết tương tăng. Cả nhiễm trùng huyết và thiếu máu ruột đều liên quan đến việc giải phóng nội độc tố và có thể dẫn đến giảm tưới máu thận, và có lẽ quan trọng hơn, phản ứng viêm tăng tốc. Trong giai đoạn viêm cấp tính, thận được huy động để giúp quản lý nhiều kinin viêm, và nó tiếp xúc với bạch cầu hoạt hóa. Các chất trung gian viêm được lọc có thể độc cho ống thận. Hạ huyết áp làm giảm GFR, và tiểu động mạch đi ra co lại để bù đắp. Cuối cùng, hạ huyết áp, thiếu máu tủy và ứ đọng bạch cầu trung tính hoạt hóa dẫn đến tăng khả năng bạch cầu trung tính bám dính. Bạch cầu trung tính bám dính giải phóng các chất trung gian co mạch và độc cho ống thận, làm tăng thêm nhu cầu oxy thận và giảm cung cấp oxy.
CÁC YẾU TỐ BỆNH NHÂN TRƯỚC PHẪU THUẬT KHÁC LIÊN QUAN ĐẾN RỐI LOẠN CHỨC NĂNG THẬN SAU PHẪU THUẬT
Các yếu tố người bệnh khác, bao gồm phẫu thuật tim trước đó, bệnh mạch máu ngoại vi, tăng huyết áp và bệnh phổi tắc nghẽn mãn tính, đã được xác định là các yếu tố nguy cơ tiềm ẩn đối với AKI sau phẫu thuật. Những yếu tố này, không được chấp nhận đồng nhất là yếu tố nguy cơ, được thảo luận trong phần sau.
Can Thiệp Phẫu Thuật Liên Quan Đến Thiếu Máu Thận Đáng Kể Trong Phẫu Thuật
TUẦN HOÀN NGOÀI CƠ THỂ
Tỷ lệ AKI sau phẫu thuật tim dao động từ 2% đến 50%, với khoảng 0,4%-4,7% người bệnh phát triển AKI sau phẫu thuật cần lọc máu (Bảng 8.2). Trong một nghiên cứu đột phá của Chertow và cộng sự về 42.773 người bệnh, AKI phụ thuộc lọc máu sau phẫu thuật xảy ra ở 1,1% người bệnh với tỷ lệ tử vong liên quan là 63,7% – đáng chú ý khi so sánh với tỷ lệ tử vong 4,3% ở những người không cần lọc máu sau phẫu thuật tim. AKI sau phẫu thuật báo hiệu tiên lượng xấu với tăng biến chứng và tử vong, đặc biệt là đối với người bệnh bị suy hô hấp sau phẫu thuật, các giai đoạn hạ huyết áp, chảy máu, rung nhĩ hoặc rối loạn chức năng cơ quan cuối khác.
Bảng 8.2 Các nghiên cứu về rối loạn chức năng thận sau phẫu thuật tuần hoàn ngoài cơ thể.
| Tác giả | Số lượng người bệnh | Thiết kế nghiên cứu | Định nghĩa của rối loạn chức năng thận | Kết quả không lọc máu | Kết quả lọc máu |
|---|---|---|---|---|---|
| Tỷ lệ (%) | Tử vong (%) | ||||
| Yeboah et al. | 428 | — | — | 26 | 38 |
| Abel et al. | 500 | Tiến cứu | Cr >1.5mmol/L | 21.6 | 13.8 |
| Bhat et al. | 490 | Hồi cứu | Cr 1.6mmol/L^a | 28.1 | 10.9 |
| McLeish et al. | 1542 | Hồi cứu | — | Không báo cáo | Không báo cáo |
| Hilberman et al. | 204 | Đối chứng ca bệnh | BUN 30mmol/L^b | 2.5 | 60 |
| Gailiunas et al. | 752 | Hồi cứu | Cr >1.5mmol/L | 17 | Không báo cáo |
| Lange et al. | 2959 | — | — | Không báo cáo | Không báo cáo |
| Corwin et al. | 572 | Đối chứng ca bệnh | Cr_sau PT 1.5 Cr_trước PT | 6.3 | Không báo cáo |
| Slogoff et al. | 504 | — | Cr 1.5mmol/L^d | 2.4 | 0.2 |
| Zanardo et al. | 775 | Tiến cứu | Cr 1.5mmol/L | 15.1 | 9.5 |
| Mangano et al. | 2417 | Tiến cứu | Cr 2.0mmol/L | 7.7 | 19 |
| Abrahamov et al. | 2214 | Hồi cứu | CrCl <40mL/min/1.73m^2^e | 2.1 | Không báo cáo |
| Grayson et al. | 5132 | Hồi cứu | Cr >2.0mmol/L | 2 | Không báo cáo |
| Antunes et al. | 2455 | Tiến cứu | Cr 2.1mmol/L^g | 5.6 | 5.8 |
| Oprea et al. | 6130 | Hồi cứu | Cr 0.3mmol/dL | 58 | 30.7 |
BUN, Nitơ urê máu; Cr, creatinine; CrCl, độ thanh thải creatinine; Cr_sau PT, creatinine sau phẫu thuật; Cr_trước PT, creatinine trước phẫu thuật; V, van.
^a Cũng như, Cr_sau PT – Cr_trước PT ≥ 0.4mmol/L (mg/dL). ^b Hoặc độ thanh thải inulin hoặc creatinine ≤50mL/min/1.73m^2. ^c Tỷ lệ tử vong được kết hợp cho người bệnh lọc máu và không lọc máu. ^d Và phân suất bài tiết natri >1% hoặc tổng natri niệu >20μg/L hoặc nước tiểu có khuôn đúc, tế bào biểu mô, hoặc mảnh vụn tế bào. ^e Độ thanh thải creatinine giảm ít nhất 15-mL/phút từ mức trước phẫu thuật. ^f Tùy thuộc vào loại phẫu thuật (32.9% sau bắc cầu động mạch vành [CABG]; 46.2% sau phẫu thuật van có hoặc không có CABG). ^g Cộng với mức creatinine tăng 0.9mmol/L từ giá trị trước phẫu thuật đến giá trị sau phẫu thuật tối đa.
Những người bệnh này ở lại đơn vị chăm sóc tích cực và bệnh viện trong thời gian dài hơn và có nhiều khả năng cần chăm sóc dài hạn chuyên biệt. Tỷ lệ tử vong tổng thể cho người bệnh phát triển AKI sau phẫu thuật cần liệu pháp thay thế thận dao động từ 27% đến 100%. Tác động kinh tế của AKI sau phẫu thuật ở người bệnh phẫu thuật tim là đáng kể. Trên thực tế, ước tính rằng chi phí bệnh viện trực tiếp trên toàn quốc để chăm sóc người bệnh bị suy thận sau CPB đang tiếp cận 645 triệu đô la.
AKI sau phẫu thuật tim với CPB ở người bệnh có tuổi cao đôi khi có thể là kết quả của thiếu máu thận cấp tính chồng lên dự trữ thận hạn chế có sẵn. Các yếu tố nguy cơ dự đoán cho thấy tưới máu thận bị ảnh hưởng, chẳng hạn như tuổi cao (>70 tuổi), rối loạn chức năng thất trái trước phẫu thuật, bệnh mạch máu xơ vữa động mạch, giảm dự trữ thận, ĐTĐ, tái tưới máu cơ tim trước đó, thời gian CPB kéo dài (>3 giờ), loại phẫu thuật (ví dụ: phẫu thuật van), sử dụng các chất độc thận trong chu phẫu (ví dụ: thuốc cản quang), và CO thấp sau phẫu thuật, tất cả đều có liên quan đến nguy cơ tăng cao đối với AKI sau phẫu thuật.
Theo truyền thống, tuần hoàn ngoài cơ thể được cho là liên quan đến nhiều rối loạn trong sinh lý và chức năng thận. Trong quá trình CPB, có sự giảm đáng kể (25%-75%) trong RBF và GFR và tăng kháng lực mạch máu thận. Những rối loạn sinh lý này có thể là hậu quả của việc mất dòng máu đập, tăng catecholamine lưu thông và chất trung gian viêm, tổn thương vĩ mô và vi mô đến thận (mảnh vụn hữu cơ và vô cơ), giải phóng hemoglobin tự do từ hồng cầu bị tổn thương, và giảm tốc độ dòng chảy và áp lực động mạch trung bình trong quá trình CPB. Ngoài ra, pha loãng máu cực độ và HCA sâu có liên quan đến khả năng xảy ra AKI sau phẫu thuật cao hơn đáng kể. Tuy nhiên, một số nghiên cứu không tìm thấy tác động của hạ thân nhiệt mà không có ngừng tuần hoàn, tưới máu đập, quản lý pH-stat hoặc loại bộ trao đổi oxy màng đối với chức năng thận sau CPB. Lema và cộng sự đã nghiên cứu GFR và dòng huyết tương thận hiệu quả của người bệnh có mức Cr ít hơn 1,5mg/dL trải qua CPB hạ thân nhiệt và phát hiện rằng chức năng thận không bị ảnh hưởng bất lợi bởi CPB.
Cách tiếp cận bắc cầu động mạch vành không dùng máy tim phổi đối với tái tạo mạch vành được kỳ vọng sẽ giảm đáng kể tỷ lệ rối loạn chức năng cơ quan cuối (ví dụ: thận, não) quan sát thấy ở người bệnh trải qua phẫu thuật CABG với CPB. Tuy nhiên, một số lượng đáng kể các nghiên cứu hồi cứu và tiến cứu so sánh tỷ lệ các kết quả bất lợi liên quan đến phẫu thuật CABG có và không dùng máy tim phổi đã không cho thấy rằng phẫu thuật CABG không dùng máy tim phổi có liên quan đến nguy cơ thấp hơn đối với các biến chứng sau phẫu thuật. Mặc dù các nghiên cứu về người bệnh trải qua phẫu thuật CABG không dùng máy tim phổi tiết lộ ít thay đổi hơn đáng kể trong microalbuminuria, chiết xuất phân đoạn natri, độ thanh thải nước tự do, hemoglobin tự do và N-acetyl-β-D-glucosaminidase, điều này không liên quan đến sự giảm đáng kể trong AKI sau phẫu thuật. Tuy nhiên, ở người bệnh có AKI không phụ thuộc lọc máu trước phẫu thuật, phẫu thuật CABG không dùng máy tim phổi dường như làm giảm tỷ lệ suy thận sau phẫu thuật, nhu cầu liệu pháp thay thế thận và tử vong. Một phân tích tổng hợp gần đây đã chỉ ra một số lợi ích tiềm năng của phẫu thuật CABG không dùng máy tim phổi đối với việc giảm tỷ lệ AKI sau phẫu thuật; tuy nhiên, không có sự khác biệt nào được tìm thấy trong nhu cầu lọc máu hoặc tử vong.
Ngược lại, Lamy và cộng sự không thể hiện sự khác biệt giữa suy thận mới xuất hiện cần lọc máu ở thời điểm 30 ngày, 1 năm hoặc 5 năm sau phẫu thuật CABG có hoặc không dùng máy tim phổi. Các nghiên cứu bổ sung đã tìm thấy kết quả tương tự đối với AKI sau phẫu thuật. Cuối cùng, McCreath và cộng sự cho rằng cách tiếp cận phẫu thuật tim ít xâm lấn như cách tiếp cận mở ngực nhỏ qua cổng để phẫu thuật van hai lá có thể mang lại sự giảm tỷ lệ AKI sau phẫu thuật khi so sánh với cách tiếp cận mở xương ức giữa tiêu chuẩn.
QUẢN LÝ DƯỢC LÝ CỦA AKI SAU TUẦN HOÀN NGOÀI CƠ THỂ
Các cách tiếp cận dược lý để giảm AKI sau phẫu thuật đã được nghiên cứu rộng rãi trong những năm gần đây. Mặc dù hầu hết các thuốc này dường như thúc đẩy UO trong thời kỳ chu phẫu, UO trong phẫu thuật không có mối tương quan với chức năng thận sau phẫu thuật, đặc biệt là khi thuốc lợi tiểu được sử dụng trong phẫu thuật. Dopamine (DA) ở liều thấp kích hoạt thụ thể DA-1 và có lợi ích lý thuyết là giãn động mạch thận, natri niệu và lợi tiểu. Mặc dù DA từng được chứng minh là tăng dòng huyết tương thận, GFR và bài tiết natri trong nước tiểu, những tác dụng dopamine này không được quan sát thấy ở người bệnh có chức năng thận bị suy giảm (GFR <50mL/min/1,73m²), có lẽ do thiếu khả năng dự trữ thận đáp ứng với tác dụng của DA. Các thử nghiệm đối chứng ngẫu nhiên với người bệnh phẫu thuật tim đã không chứng minh rằng DA dự phòng liều thấp có thể bảo tồn chức năng thận, giảm sự phát triển của AKI và giảm tỷ lệ tử vong. Ngoài ra, các tác dụng tăng co bóp và nhịp tim của DA có thể dẫn đến sự phát triển của rối loạn nhịp tim chu phẫu và tăng tiêu thụ oxy cơ tim có thể có hại cho người bệnh phẫu thuật tim. Hơn nữa, việc sử dụng DA để thúc đẩy lợi tiểu ở người bệnh bị giảm thể tích máu có khả năng làm trầm trọng thêm suy thận. Xét đến sự thiếu lợi ích đã được chứng minh và tác hại tiềm ẩn, việc sử dụng DA thường xuyên để thúc đẩy lợi tiểu trong bối cảnh chu phẫu không được khuyến nghị.
Mannitol là một chất tăng áp lực thẩm thấu làm tăng GFR trong thời kỳ giảm tưới máu thận, tăng cường dòng máu vỏ thận và tủy thận, và thúc đẩy thu gom gốc hydroxyl phản ứng tự do. Nó giảm tiêu thụ oxy thận trong thời kỳ thiếu máu và tăng cường lợi tiểu của mảnh vụn trong lòng ống. Tuy nhiên, việc sử dụng mannitol dự phòng ở người bệnh trải qua CPB không mang lại cải thiện thuyết phục trong chức năng thận và kết quả tử vong.
Thuốc lợi tiểu quai như furosemide mang lại lợi ích tương tự như mannitol trong việc giảm tiêu thụ oxy và cải thiện lợi tiểu bằng cách ngăn chặn sự tích tụ của các khuôn đúc tắc nghẽn. Trong hai nghiên cứu tiến cứu ngẫu nhiên riêng biệt, việc sử dụng furosemide trong và sau CPB được phát hiện là không có lợi ích lâm sàng và có thể có hại cho chức năng thận. Mặc dù DA, mannitol và furosemide có thể chuyển đổi suy thận ít nước tiểu thành không ít nước tiểu và tạo điều kiện quản lý cân bằng dịch và điện giải, trong trường hợp không có bằng chứng rằng lợi tiểu cưỡng bức mang lại lợi ích sống sót, việc sử dụng thường xuyên các thuốc này không được khuyến khích.
Một chất chủ vận thụ thể DA-1 chọn lọc, fenoldopam, có những lợi thế lý thuyết là giảm kháng lực mạch máu thận và tăng RBF và GFR. Caimmi và cộng sự đã nghiên cứu người bệnh có mức Cr trước phẫu thuật lớn hơn 1,5mg/dL và phát hiện rằng truyền fenoldopam (0,1-0,3μg/kg/phút) trong quá trình CPB và trong giai đoạn đầu sau phẫu thuật có liên quan đến cải thiện mức Cr sau phẫu thuật và CrCl. Trong một nghiên cứu thuần tập đa trung tâm tiến cứu của người bệnh phẫu thuật tim có nguy cơ cao bị suy thận, việc truyền fenoldopam dự phòng có liên quan đến giảm 50% AKI và giảm tỷ lệ tử vong từ 15,7% xuống 6,5%. Những lợi ích lâm sàng này dựa trên kinh nghiệm sơ bộ với fenoldopam và sẽ phải được xác nhận bởi các thử nghiệm lâm sàng ngẫu nhiên tiến cứu quy mô lớn hơn trước khi nó được sử dụng thường xuyên.
Các thuốc giãn mạch như thuốc chẹn kênh canxi (ví dụ: nifedipine, diltiazem) đã được chứng minh là cải thiện GFR ở người bệnh trải qua phẫu thuật tim với CPB. Tuy nhiên, thiếu những giảm đáng kể về mặt lâm sàng trong bệnh tật và tử vong để ủng hộ việc sử dụng thường xuyên của chúng để ngăn ngừa và điều trị AKI sau phẫu thuật.
Clonidine là một chất chủ vận α-adrenergic không chọn lọc có thể ngăn ngừa giảm tưới máu thận bằng cách ức chế việc co mạch được trung gian bởi catecholamine do căng thẳng. Kulka và cộng sự phát hiện rằng ở người bệnh không có nguy cơ cao đối với AKI sau phẫu thuật, clonidine ở mức 4 μg/kg ngăn ngừa sự xấu đi của CrCl sau phẫu thuật tim so với giả dược. Tuy nhiên, lợi ích lâu dài của việc truyền clonidine đối với việc giảm tỷ lệ tử vong ở người bệnh có nguy cơ cao chưa được đánh giá đầy đủ.
Peptide lợi niệu tâm nhĩ (ANP) quan trọng trong điều hòa dịch trong mạch máu và tuần hoàn. Nó thúc đẩy lợi tiểu và natri niệu, tăng GFR, đảo ngược co mạch thận đến và giãn mạch thận đi, và ức chế tái hấp thu natri. Tải lượng thể tích trong phẫu thuật đã được chứng minh là điều chỉnh việc giải phóng ANP, và nồng độ của nó có thể dự đoán kết quả lâu dài sau phẫu thuật CABG. Truyền ANP trong phẫu thuật đã được chứng minh là giảm áp lực tĩnh mạch trung tâm, áp lực mao mạch phổi, kháng lực mạch máu phổi, kháng lực mạch máu ngoại vi và hệ thống renin-angiotensin-aldosterone, và việc sử dụng nó có liên quan đến việc tăng RBF, GFR và lợi tiểu. Các tác động chính xác của ANP trên chức năng thận sau CPB và vai trò tiềm năng của chúng trong việc hạn chế suy thận và tỷ lệ tử vong liên quan sẽ phải được xác định bởi các thử nghiệm lâm sàng trong tương lai.
Hai nghiên cứu đã xem xét việc thiết lập liệu pháp thay thế thận sớm dưới hình thức lọc máu hemodiafiltration tĩnh mạch liên tục ở người bệnh bị AKI sau phẫu thuật đã thiết lập đã tìm thấy sự giảm có ý nghĩa thống kê trong tỷ lệ tử vong tổng thể. Ngay cả ngoài bối cảnh thời kỳ chu phẫu, vẫn tồn tại một cuộc tranh luận về thời điểm tối ưu của liệu pháp thay thế thận đối với AKI ở người bệnh bệnh nặng.
Tóm lại, tác động của CPB trên thận có ảnh hưởng đáng kể đến việc quản lý người bệnh và kết quả. Tuy nhiên, mặc dù có nghiên cứu tích cực về bệnh sinh và phòng ngừa AKI sau phẫu thuật, đã có tiến bộ hạn chế trong việc phát triển các chiến lược bảo vệ hiệu quả. Vì sự cạn kiệt thể tích nội mạch và giảm tưới máu có thể dẫn đến trầm trọng hóa thiếu máu thận và làm tăng nguy cơ AKI sau phẫu thuật, việc tránh các chất độc thận và chú ý sát sao đến việc duy trì thể tích nội mạch, huyết áp và CO là chìa khóa trong nỗ lực giảm sự xuất hiện của AKI sau phẫu thuật tim. Việc xác định người bệnh có biến thể di truyền của các chỉ điểm viêm cụ thể (đa hình promoter gen interleukin-6 [IL-6], apolipoprotein E) để xác định khuynh hướng đối với AKI sau phẫu thuật có thể là một phương tiện bổ sung để xác định người bệnh có nguy cơ AKI sau phẫu thuật. Trong những năm gần đây, các chỉ điểm sinh học đặc hiệu thận được đo trong chu phẫu đã được tương quan với thời gian CPB kéo dài và có thể giúp dự đoán AKI sau CPB.
Phẫu thuật Động mạch Chủ Lớn
Người bệnh trải qua phẫu thuật động mạch chủ lớn có hoặc không có HCA đặc biệt dễ bị AKI sau phẫu thuật. Những người bệnh này thường có tuổi cao và có bệnh xơ vữa động mạch của các mạch máu lớn và giường mạch máu cơ quan cuối (ví dụ: tim, não và thận). Do đó, người bệnh phẫu thuật mạch máu có nhiều đặc điểm có giá trị tiên lượng đối với AKI sau phẫu thuật ở người bệnh phẫu thuật tim. Xem xét tài liệu cho thấy sự hiện diện của AKI trước phẫu thuật là yếu tố dự đoán nhất quán nhất cho AKI sau phẫu thuật sau phẫu thuật mạch máu lớn. Tuy nhiên, bởi vì mỗi loại thủ thuật phẫu thuật mạch máu lớn có liên quan đến một rối loạn cơ học đáng kể cản trở RBF – kẹp động mạch chủ, bắc cầu tim trái, cấy ghép lại hoặc phẫu thuật động mạch thận, hoặc CPB có hoặc không có HCA – loại và thời gian của can thiệp cơ học cụ thể làm cho các biến số tiềm năng khác ít quan trọng hơn trong việc dự đoán AKI sau phẫu thuật.
Tỷ lệ được báo cáo của AKI và lọc máu sau phẫu thuật động mạch chủ lớn thay đổi đáng kể (Bảng 8.3). Tỷ lệ được báo cáo của AKI sau phẫu thuật dao động từ 5% đến 29% và từ 1,6% đến 22,2%, tương ứng. Điều này phản ánh các định nghĩa không đồng nhất về AKI trước và sau phẫu thuật nhưng cũng, và có lẽ quan trọng hơn, tiềm năng cơ bản cho sự khác biệt đáng kể, có khả năng đe dọa tính mạng trong đặc điểm người bệnh và chiến lược quản lý trong nhóm người bệnh này.
Bảng 8.3 Các nghiên cứu về rối loạn chức năng thận sau phẫu thuật mạch máua.
| Phẫu thuật | Tác giả nghiên cứu (tài liệu số) | Rối loạn chức năng thận sau phẫu thuật (%) | Lọc máu sau phẫu thuật cần thiết (%) | Yếu tố nguy cơ cho suy thận |
|---|---|---|---|---|
| Dưới thận | Powell et al. | – | 8–9^a | RD trước phẫu thuật |
| Dưới thận vs. trên thận | Breckwoldt et al. | Dưới thận 13.9 Trên thận 38.5 | 1.80 2.60 | Không có yếu tố đơn lẻ nào |
| AAA dưới thận + trên thận | Johnston | 5.0–33.0 | 0.4–6.0 | RD trước phẫu thuật, vị trí AX, thắt RV, bắc cầu RA |
| Shepard et al. | 14 | 1.18 | ||
| Liên quan đến thận | Hallett et al. | 22 | 9.0–35.0 | — |
| Chaikof et al. | 4.0 | 18.3 | RD trước phẫu thuật | |
| Nypaver et al. | 16.98 | 5.66 | Bắc cầu/nội mạc RA, bất kỳ biến chứng sau phẫu thuật nào | |
| Allen et al. | 12.3 | 3.08 | RD trước phẫu thuật | |
| Cambria et al. | 9.0 | 15.0 | RD trước phẫu thuật | |
| Acher et al. | 19.0^a | 2.0–71.0 | RD trước phẫu thuật | |
| Vỡ động mạch chủ | Panneton et al. | 27.7 | 6.3 | RD trước phẫu thuật |
| Bauer et al. | 29.0 | — | Thời gian/vị trí AX, RD trước phẫu thuật, tuổi, hạ huyết áp | |
| Hajarizadeh et al. | 11.43 | 18.1 | – | |
| Berisa et al. | 16.0 | 84.0 | RD trước phẫu thuật | |
| Ngực-bụng | Crawford et al. | – | 5.0–17.0 | Rối loạn chức năng thận trước phẫu thuật |
| Schepens et al. | – | 11.9–14.1 | Tuổi, creatinine trước phẫu thuật, CAD, DM | |
| Svensson et al. | 15.87 | 13 | Sửa chữa động mạch nội tạng, RD trước phẫu thuật và biến chứng sau phẫu thuật | |
| Godet | 17.26 | 8 | Tuổi >50 tuổi, RD trước phẫu thuật, LRA, thời gian thiếu máu, truyền máu | |
| Safi et al. | 2.5 | 15 | Tái gắn LRA, RD trước phẫu thuật, tưới máu nội tạng, kỹ thuật kẹp chéo đơn giản | |
| Nội mạch | White et al. | 14.29 | 21.43 | — |
| Sharma et al. | 3.7^a | 11.1^a | Nguồn tắc mạch chủ-chậu |
AAA, Phình động mạch chủ bụng; AX, kẹp động mạch chủ; CAD, bệnh động mạch vành; DM, đái tháo đường; LRA, động mạch thận trái; RA, động mạch thận; RD, suy thận không phụ thuộc lọc máu; RV, tĩnh mạch thận. a Nếu CR trước phẫu thuật >1.5mg%.
Hầu hết các bác sĩ lâm sàng chăm sóc người bệnh có phình động mạch chủ bụng (AAA) nhận ra bản chất quan trọng của quyết định liên quan đến vị trí đặt kẹp động mạch chủ trong phẫu thuật. Các bác sĩ gây mê tim mạch khuyến khích đồng nghiệp phẫu thuật của họ xem xét việc đặt kẹp dưới thận (nếu có thể) ở người bệnh trải qua phẫu thuật AAA. Các nghiên cứu của Breckwoldt và cộng sự và Johnston và cộng sự nhấn mạnh tầm quan trọng của việc đặt kẹp dưới thận so với trên thận liên quan đến sự phát triển của AKI sau phẫu thuật (Bảng 8.4). Trong một nghiên cứu về 205 người bệnh có AAA, Breckwoldt và cộng sự phát hiện rằng ở người bệnh có kẹp động mạch chủ được áp dụng dưới thận (n = 39), có ít người có nguy cơ phát triển AKI sau phẫu thuật hơn so với những người bệnh cần tắc nghẽn động mạch chủ trên thận (n = 166).
Nghiên cứu đa trung tâm của Johnston và cộng sự bao gồm 666 người bệnh được quản lý với kẹp động mạch chủ dưới thận so với trên thận, và họ cũng phát hiện rằng kẹp động mạch chủ dưới thận có liên quan đến nguy cơ thấp hơn đối với AKI sau phẫu thuật (xem Hình 8.1).
Người bệnh phẫu thuật có bệnh phình động mạch chủ-ngực-bụng có thể chịu những rối loạn lớn nhất trong nội môi thận chu phẫu. Nhiều cách tiếp cận khác nhau được sử dụng để hạn chế thời gian thiếu máu và tổn thương tổng thể cho thận; HCA, bắc cầu tim trái và “plegia” thận là những biện pháp để giảm chuyển hóa thận hoặc hạn chế sự gián đoạn thực tế của RBF. Tuy nhiên, hầu hết người bệnh tiếp tục có nguy cơ AKI sâu sắc vì một số sự kiện thường gặp trong phẫu thuật càng làm ảnh hưởng tiêu cực đến chuyển hóa thận. Mất máu đáng kể, thiếu máu nội tạng và nhiễm độc nội, yêu cầu truyền sản phẩm máu lớn và thiếu máu thận đều báo hiệu AKI sau phẫu thuật.
Có sự tranh luận trong cộng đồng phẫu thuật về bộ cách tiếp cận tối ưu cho quản lý phẫu thuật bệnh động mạch chủ-ngực-bụng. Một số bác sĩ lâm sàng cho rằng HCA tốt hơn bắc cầu tim trái trong việc bảo tồn chức năng thận. Soukiasian và cộng sự đã xem xét tất cả các trường hợp người bệnh của họ trải qua sửa chữa phình động mạch chủ-ngực-bụng trong giai đoạn 12 năm. Thực hành của họ đã trải qua một sự thay đổi để sử dụng ngừng tuần hoàn thay vì bắc cầu tim trái. Trong nhóm đầu tiên gồm 20 người bệnh, tỷ lệ suy thận là 15%, và nó là 0% ở 39 người bệnh được quản lý với HCA. Các nhận xét được công bố cùng với bài viết về cơ bản loại bỏ những phát hiện này và trích dẫn công trình của Crawford, Cosseli, và những người khác phản bác những phát hiện này. Quan trọng là, nhóm người bệnh có nguy cơ cao này được quản lý khác nhau bởi các bác sĩ phẫu thuật khác nhau và trong các tổ chức khác nhau. Do đó, khó có thể xác định nhiều yếu tố nguy cơ tiềm ẩn đối với AKI sau phẫu thuật. Thực tế, thiếu các nghiên cứu ngẫu nhiên tiến cứu để xác định các yếu tố nguy cơ liên quan đến AKI. Tuy nhiên, hầu hết các nghiên cứu cho thấy rằng AKI có sẵn từ trước, vỡ động mạch chủ và yêu cầu tái tạo động mạch thận có liên quan đến sự gia tăng nguy cơ AKI sau phẫu thuật và tử vong sau đó.
Một trong những phát triển hứa hẹn nhất trong quản lý bệnh động mạch chủ là việc giới thiệu các mảnh ghép stent, và các kỹ thuật đang phát triển nhanh chóng. Một số loại mảnh ghép được phê duyệt để sử dụng trong động mạch chủ ngực xuống và bụng. Một số trung tâm sử dụng nhiều mảnh ghép stent để tái tạo động mạch chủ-ngực-bụng. Một kỹ thuật như vậy sử dụng cách tiếp cận kết hợp “mở và đóng” trong đó quyền truy cập mở được đạt được (hạn chế nguồn gốc của một trong những biến cố bất lợi thường gặp nhất liên quan đến mảnh ghép stent) và một stent được sử dụng ở nơi có thể xác định được “vùng hạ cánh” đầy đủ.
Black và cộng sự đã báo cáo những phát hiện của họ ở 29 người bệnh liên tiếp được điều trị bằng tắc nghẽn nội mạch và tái tạo mạch máu nội tạng mở cho quản lý phình động mạch chủ-ngực-bụng. Năm trong số các người bệnh đã biết suy thận. Sau phẫu thuật, bốn người bệnh bị AKI, với hai người cần lọc máu tạm thời. Nhóm kết luận rằng họ sẽ quản lý tất cả các phình động mạch chủ-ngực-bụng loại Crawford I, II và III với cách tiếp cận này. Như trong các công trình khác trong quản lý phẫu thuật bệnh động mạch chủ-ngực-bụng, không có nghiên cứu tiến cứu ngẫu nhiên nào xác định sự khác biệt về nguy cơ giữa sửa chữa mở và mảnh ghép stent liên quan đến một số kết quả bất lợi, bao gồm cả AKI.
Tóm lại, người bệnh phẫu thuật mạch máu đại diện cho một nhóm người bệnh với nhiều yếu tố nguy cơ tiềm ẩn nội tại và ngoại lai đối với AKI. Tuy nhiên, mức độ của các sự kiện bệnh tật trong phẫu thuật (vị trí đặt kẹp, HCA, bắc cầu tim trái) liên quan đến các thủ thuật mạch máu này có khả năng là yếu tố quyết định lớn nhất của nguy cơ chu phẫu đối với các biến cố bất lợi thận.
Xét Nghiệm Chức Năng Thận Chu Phẫu
Mặc dù khả năng xác định người bệnh có nguy cơ AKI sau phẫu thuật đã được cải thiện, các phương pháp để phát hiện và định lượng cả sự xấu đi và cải thiện sau đó trong chức năng thận cần được hoàn thiện thêm.
Mặc dù có sẵn nhiều xét nghiệm chức năng thận và mỗi xét nghiệm kiểm tra một khía cạnh khác nhau của chức năng sinh lý của thận (Hộp 8.2), GFR vẫn là chỉ số đáng tin cậy nhất của chức năng thận. GFR thường được ước tính bằng CrCl, một giá trị thu được từ việc thu thập nước tiểu 24 giờ (xem Bảng 8.4). Mặc dù một số tác giả đã điều tra ước tính CrCl dựa trên tiêu chuẩn 2 giờ, ước tính CrCl 24 giờ của GFR hiện là chỉ số dự đoán tốt nhất về những thay đổi trong chức năng thận và sự phát triển tiềm năng của AKI sau phẫu thuật.
Bảng 8.4 So sánh các phương pháp xác định tốc độ lọc cầu thậna.
| Phương pháp thanh thải | Độ phức tạp của xét nghiệm | Độ chính xác | Hữu ích lâm sàng |
|---|---|---|---|
| Thanh thải insulin cổ điển | + + + + | + + + + | + + + |
| Thanh thải đồng vị phóng xạ | + + + | + + +1/2 | + + |
| Biến mất đồng vị phóng xạ trong huyết tương | +++ | +++ | ++ |
| Thanh thải creatinine | + + + | + + + | + + + |
| Thanh thải creatinine theo biểu đồ | +1/2 | +1/2 | +++ |
| Creatinine huyết thanh | + + | + + | + + |
a. Được đánh giá từ cao (+ + + +) đến thấp (+).
Theo truyền thống, sCr và UO đã là những phương tiện tiếp cận lâm sàng dễ dàng nhất để đánh giá và theo dõi chức năng thận. Mặc dù tính thực tế của chúng, chúng là những yếu tố dự đoán rất thay đổi. Giá trị sCr bình thường thay đổi theo tuổi, giới tính, chủng tộc, thể trạng cơ thể và chế độ ăn uống. Những thay đổi trong sCr không cụ thể và không tiết lộ nguyên nhân, vị trí và mức độ tổn thương. Ngoài ra, những thay đổi sCr không nhạy cảm với những thay đổi trong GFR và có thể bị trì hoãn trong vài ngày. UO và sCr có thể bị thay đổi bởi thuốc lợi tiểu và lọc máu cũng như các phương thức phòng ngừa và điều trị khác. Hơn nữa, nhiều nghiên cứu đã cho thấy sự tương quan thay đổi giữa sCr và UO và nguy cơ phát triển AKI chu phẫu. Cũng không có mối liên hệ rõ ràng giữa những thay đổi trong sCr và bệnh tật hoặc tiên lượng cho sự phục hồi lâu dài. Ngoài ra, các định nghĩa về AKI dựa trên những thay đổi ban đầu và tiếp theo trong sCr đã khác nhau rộng rãi.
Phần lớn tài liệu gần đây đã tập trung vào việc áp dụng phương trình Cockcroft-Gault sửa đổi để ước tính CrCl, là một thước đo thay thế của chức năng thận với độ chính xác được cải thiện và ước tính dự trữ thận. Các phương trình ở nam và nữ như sau:
CrCl (ở nam) = ([140 – tuổi] × cân nặng × 1,2) ÷ sCr CrCl (ở nữ) = ([140 – tuổi] × cân nặng) ÷ sCr
Wijeysundera và cộng sự phát hiện rằng sự kết hợp của sCr và CrCl cho phép xác định người bệnh mà họ chỉ định là có suy thận ẩn, được định nghĩa là sCr bình thường với CrCl là 60mL/phút hoặc ít hơn. Họ phát hiện rằng khoảng 13% người bệnh có sCr bình thường có suy thận ẩn, điều này độc lập liên quan đến nhu cầu liệu pháp thay thế thận sau phẫu thuật ở người bệnh phẫu thuật tim.
Một phương pháp gần đây hơn để ước tính GFR liên quan đến việc đo cystatin C huyết thanh, một protein kiềm không glycosyl hóa. Cystatin C được sản xuất bởi hầu như tất cả các tế bào có nhân và được lọc tự do qua màng cầu thận và gần như hoàn toàn được tái hấp thu và phân hủy bởi các tế bào ống thận gần. Các giá trị phạm vi tham chiếu cho cystatin C là giống nhau đối với nam, nữ và trẻ em, và chúng không phụ thuộc vào khối lượng cơ hoặc chế độ ăn uống. Một phân tích tổng hợp gần đây của Dharnidharka và cộng sự, so sánh mức cystatin C huyết thanh với giá trị CrCl, cho thấy cystatin C là một chỉ số thay thế tốt hơn của GFR và một chỉ số phản ánh những thay đổi trong GFR nhanh hơn.
Những hiểu biết gần đây về bệnh sinh của AKI đã tiết lộ nhu cầu phát hiện sớm hơn cả sự xấu đi và cải thiện trong chức năng thận. Các kỹ thuật mới hơn hiện đang được nghiên cứu có thể cung cấp đánh giá chi tiết hơn về cả bản chất và thời gian của tổn thương. Những điều này có thể cho phép chẩn đoán sớm hơn, xác định các thời điểm cụ thể để can thiệp và các phép đo có thể định lượng được cho hiệu quả điều trị.
Một lĩnh vực mới nổi là proteomics nước tiểu. Proteomics lâm sàng, hoặc lập hồ sơ protein nước tiểu, đã mang lại sự phát hiện các chỉ điểm sinh học protein mới cho các bệnh thận. Một ứng dụng của proteomics nước tiểu liên quan đến việc sử dụng phổ khối ion hóa/giải hấp bề mặt tăng cường laser thời gian bay (SELDI-TOF-MS), đã nổi lên như một trong những phương pháp ưa thích cho việc lập hồ sơ protein nước tiểu. SELDI-TOF-MS cho phép lập hồ sơ nhanh chóng của nhiều mẫu nước tiểu và phát hiện các chỉ điểm sinh học có trọng lượng phân tử thấp thường bị bỏ qua bởi các phương pháp khác.
Một số kỹ thuật mới khác cũng đang được nghiên cứu và sẵn sàng được điều chỉnh cho các nghiên cứu ở người. KIM-1 (chỉ điểm tổn thương thận 1) có thể là một dấu hiệu sớm của tổn thương ống thận, và một protein giàu cysteine (CYP 61) đã được tìm thấy trong nước tiểu sau tổn thương thiếu máu-tái tưới máu. Các chất tương phản mới hơn được sử dụng với chụp cộng hưởng từ đang được kiểm tra trong các mô hình AKI thực nghiệm và có thể cung cấp cái nhìn sâu sắc về huyết động học trong thận, mức độ và phạm vi tổn thương ống thận gần và sự hiện diện của viêm. Các chỉ điểm sinh học bổ sung tiếp tục được nghiên cứu với mục tiêu xác định các phương pháp để chẩn đoán AKI sau phẫu thuật sớm hơn và chính xác hơn so với việc sử dụng mức UO hoặc sCr. Có một danh sách mở rộng các chỉ điểm sinh học như vậy tiếp tục được phát hiện và phát triển, bao gồm NGAL (neutrophil gelatinase-associated lipocalin), IL-18, protein liên kết axit béo loại gan, TIMP2 (chất ức chế metalloproteinase mô 2), IGFBP7 (protein liên kết yếu tố tăng trưởng giống insulin 7), và nhiều chỉ điểm khác. Thật không may, việc sử dụng thường xuyên nhiều chỉ điểm này vẫn còn tốn kém; những chỉ điểm này chỉ nhắm vào một số cơ chế cụ thể của AKI; hoặc những chỉ điểm này có nhiều hạn chế khác nhau (ví dụ: cơ chế hiểu biết kém và dữ liệu hạn chế về động học) ngăn cản nghiên cứu sâu rộng hơn về chúng và việc áp dụng rộng rãi cuối cùng của chúng vào thực hành lâm sàng thường quy.
Thuật Toán Chấm Điểm Nguy Cơ Thận Chu Phẫu
Sự phát triển của nhiều hệ thống chấm điểm dựa trên các yếu tố nguy cơ được xác định rõ ràng đã cung cấp cái nhìn sâu sắc hơn về những người bệnh có nguy cơ cao nhất đối với AKI chu phẫu. Hầu hết các chỉ số bao gồm nhiều yếu tố nguy cơ được thảo luận trong chương này.
Thuật toán được đề xuất bởi Chertow và cộng sự để dự đoán suy thận sau phẫu thuật và lọc máu sau phẫu thuật tim đã được phát triển trong một cơ sở dữ liệu mạnh mẽ của 43.642 người bệnh VA. Chertow và cộng sự đã xác định 10 biến số lâm sàng liên quan đến bệnh tim mạch cơ bản và chức năng thận (Hộp 8.3). Dựa trên các biến số này, họ đã chia nguy cơ thận thành ba loại – nguy cơ thấp (<0,4%), nguy cơ trung bình (0,9%-2,8%) và nguy cơ cao (>5,0%). Họ đã sử dụng phân vùng đệ quy để xác định 11 nhóm người bệnh riêng biệt dựa trên tương tác giữa các biến số phân biệt chính. Ví dụ, người bệnh phẫu thuật CABG chính với chức năng thận trước phẫu thuật về cơ bản bình thường có nguy cơ cần lọc máu sau phẫu thuật ít hơn 0,4%. Ngược lại, người bệnh phẫu thuật tim van với rối loạn chức năng thận trước phẫu thuật, suy tim độ IV và hỗ trợ bơm bóng đối xung trong động mạch chủ có nguy cơ suy thận sau phẫu thuật và lọc máu lớn hơn 5,0% (xem Hình 8.1).
Thakar và cộng sự đã tạo ra một điểm số AKI cho lọc máu sau phẫu thuật dựa trên 33.217 người bệnh đã trải qua phẫu thuật tim tại Quỹ Lâm sàng Cleveland (Bảng 8.5). Điểm số này bao gồm 13 biến số trước phẫu thuật được gán giá trị điểm là 1 hoặc 2. Người bệnh có thể có điểm số là 0 đến tối đa là 17. Bốn loại nguy cơ được gán giá trị điểm lần lượt là 0-2, 3-5, 6-8 và 9-13 (Hình 8.2). Tần suất lọc máu dao động từ 0,5% đến 21,1%. Mô hình này nhất quán cho cả bộ dữ liệu kiểm tra và xác thực, với diện tích dưới đường cong là 0,82 trong cả hai trường hợp.
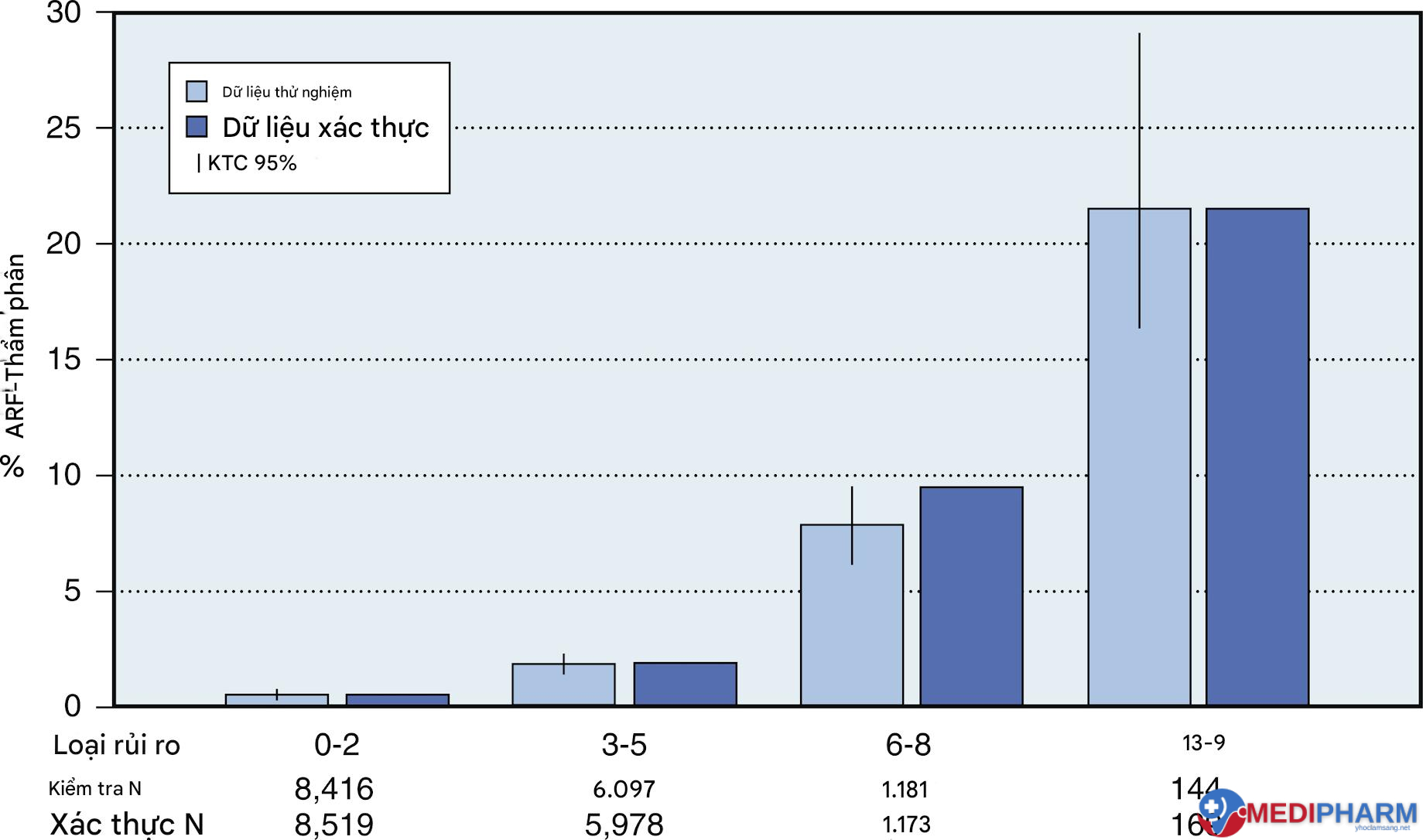
Hình 8.2 Các loại nguy cơ tổn thương thận cấp. ARF, Suy thận cấp; CI, khoảng tin cậy. (Được điều chỉnh với sự cho phép từ Thakar CV, Arrigain S, Worley S, et al. A clinical score to predict acute renal failure after cardiac surgery. J Am Soc Nephrol 2005;16(1):162-168.)
Bảng 8.5 Điểm số suy thận cấp.
| Yếu tố nguy cơ | Điểm |
|---|---|
| Giới tính nữ | 1 |
| Suy tim sung huyết | 1 |
| Phân suất tống máu thất trái <35% | 1 |
| Sử dụng IABP trước phẫu thuật | 2 |
| COPD | 1 |
| Đái tháo đường phụ thuộc insulin | 1 |
| Phẫu thuật tim trước đó | 1 |
| Phẫu thuật cấp cứu | 2 |
| Chỉ phẫu thuật van (so với CABG) | 1 |
| CABG + phẫu thuật van (so với CABG) | 2 |
| Các phẫu thuật tim khác | 2 |
| Creatinine trước phẫu thuật 1.2 đến <2.1mg/dL (so với ≤1.2) | 2 |
| Creatinine trước phẫu thuật ≥2.1mg/dL (so với ≤1.2) | 5 |
CABG, Bắc cầu động mạch vành; COPD, bệnh phổi tắc nghẽn mãn tính; IABP, bơm bóng đối xung trong động mạch chủ. ^a Tổng điểm tối thiểu, 0; tổng điểm tối đa, 17.
Mangano và nhóm nghiên cứu McSPI (Nghiên cứu Đa trung tâm về Thiếu máu Chu phẫu) đã báo cáo xác suất phát triển AKI sau phẫu thuật dựa trên mô hình hồi quy logistic đa biến của họ về các yếu tố nguy cơ trước phẫu thuật (Bảng 8.6). Ví dụ, người bệnh 70-79 tuổi bị suy tim trước phẫu thuật, rối loạn chức năng thận có sẵn và CABG trước đó có 33,3% cơ hội phát triển AKI sau phẫu thuật. Bộ dữ liệu của họ không đủ mạnh để phát triển một điểm số nguy cơ cho 1,7% người bệnh trong nghiên cứu của họ cần liệu pháp thay thế thận sau phẫu thuật. Thú vị là, tỷ lệ lọc máu sau phẫu thuật tim trong các nghiên cứu của Chertow, Thakar, Mangano và Aronson đều bằng nhau (tất cả khoảng 1,7%).
Bảng 8.6 Các yếu tố nguy cơ trước phẫu thuật và xác suất dự đoán rối loạn chức năng thận.
| Số lượng yếu tố nguy cơ | YẾU TỐ NGUY CƠ | TUỔI <70 NĂM | TUỔI 70-79 NĂM |
|---|---|---|---|
| Suy tim sung huyết | CABG tái phẫu | Đái tháo đường loại 1 | |
| 0 | Không | Không | Không |
| 1 | Không | Không | Không |
| Không | Không | Có | |
| Không | Có | Không | |
| Có | Không | Không | |
| 2 | Không | Không | Có |
| Không | Có | Không | |
| Không | Có | Có | |
| Có | Không | Không | |
| Có | Không | Có | |
| Có | Có | Không | |
| 3 | Không | Có | Có |
| Có | Không | Có | |
| Có | Có | Không | |
| Có | Có | Có | |
| 4 | Có | Có | Có |
Đối với cột “Quan sát”, n = số lượng người bệnh quan sát được với sự kết hợp yếu tố nguy cơ và % = tỷ lệ quan sát được của người bệnh bị rối loạn chức năng thận trong số những người có sự kết hợp này. Đối với cột “Dự đoán”, % = xác suất dự đoán rối loạn chức năng thận xuất phát từ mô hình hồi quy logistic đa biến của các yếu tố trước phẫu thuật. CABG, Bắc cầu động mạch vành; CI, khoảng tin cậy.
| Hộp 8.2. Các xét nghiệm chức năng thận có sẵn cho sử dụng lâm sàng.
▪ Thể tích nước tiểu ▪ Tỷ trọng nước tiểu ▪ Áp lực thẩm thấu nước tiểu ▪ Creatinine huyết thanh và nitơ urê máu ▪ Tỷ lệ creatinine nước tiểu-huyết tương ▪ Tỷ lệ urê nước tiểu-huyết tương ▪ Bài tiết natri nước tiểu ▪ Phân suất bài tiết natri ▪ Độ thanh thải nước tự do ▪ Độ thanh thải creatinine ▪ Dòng máu thận |
| Hộp 8.3. Các biến số không phải thận ảnh hưởng đến mức creatinine huyết thanh và nitơ urê máu.
▪ Tăng hấp thu nitơ ▪ Phân hủy mô ▪ Khối lượng cơ thể ▪ Chế độ ăn uống ▪ Hoạt động ▪ Bệnh gan ▪ Nhiễm toan ceton đái tháo đường ▪ Máu tụ lớn ▪ Chảy máu đường tiêu hóa ▪ Sử dụng thuốc hoặc steroid |
Các hệ thống chấm điểm mới hơn tiếp tục được phát triển, xác thực và tối ưu hóa. Điểm số Mehta và Điểm số Chỉ số Thận Đơn giản hóa của Wijeysundera cho thấy triển vọng trong việc xác định người bệnh có nguy cơ AKI sau phẫu thuật sẽ cần lọc máu. Birnie và cộng sự đã phát triển một hệ thống chấm điểm tính đến tất cả các giai đoạn (Giai đoạn I, nguy cơ; Giai đoạn II, tổn thương; Giai đoạn III, suy thận) của AKI, không chỉ AKI nặng. Các hệ thống chấm điểm bổ sung đã kết hợp các chỉ điểm sinh học mới như IL-18 nước tiểu và NGAL nước tiểu vào thuật toán của họ, với kết quả đầy hứa hẹn. Mặc dù vẫn chưa có sự đồng thuận dứt khoát về hệ thống chấm điểm nguy cơ thận tối ưu, những phát triển mới này chứa đựng nhiều hứa hẹn cho một hệ thống cho phép tăng cường ra quyết định lâm sàng dẫn đến cải thiện kết quả cho người bệnh.
Một hệ thống chấm điểm không thể cung cấp câu trả lời cụ thể về việc liệu một người bệnh cụ thể có nên trải qua một thủ thuật tim hay không, với nguy cơ dự đoán đối với AKI sau phẫu thuật. Tuy nhiên, nó cung cấp một đánh giá khách quan về nguy cơ phát triển một sự kiện morbid sẽ liên quan đến một thời gian nằm viện kéo dài và sẽ đặt người bệnh vào nguy cơ tăng cao đối với tử vong trong chu phẫu. Mặc dù một số yếu tố nguy cơ trước phẫu thuật (ví dụ: tuổi cao, phẫu thuật tim trước đó) không thể được thay đổi, những yếu tố khác có thể được kiểm soát hoặc cải thiện. Các chiến lược phòng ngừa hoặc điều trị có thể được tập trung vào những người bệnh có nhiều khả năng cần đến chúng nhất. Chức năng tim nên được tối ưu hóa và tưới máu thận tăng cường. Tăng đường huyết nên được điều trị tích cực. Liệu pháp với các thuốc độc thận nên được tránh hoặc giảm thiểu. Việc xác định một nhóm người bệnh có nguy cơ cao cho phép các cá nhân và gia đình của họ một sự đồng ý thông tin toàn diện hơn về quyết định của họ để theo đuổi các lựa chọn chăm sóc sức khỏe. Ngoài ra, các hệ thống chấm điểm hiệu quả và được xác thực tạo điều kiện cho nghiên cứu về AKI sau phẫu thuật bằng cách xác định và phân tầng các quần thể người bệnh với các mức độ nguy cơ AKI khác nhau.
Kết Luận
Tỷ lệ AKI sau phẫu thuật, cũng như tác động tiềm ẩn của nó đối với việc sử dụng nguồn lực chăm sóc sức khỏe sau phẫu thuật tim và mạch máu lớn, có khả năng tăng lên trong thập kỷ tới. Người bệnh đến phẫu thuật ngày càng lớn tuổi hơn, có nhiều bệnh đồng mắc và có nhiều khả năng có sự giảm đã có từ trước trong chức năng thận, làm tăng thêm nguy cơ và tính dễ bị tổn thương của họ đối với các biến cố thận bất lợi nghiêm trọng sau thủ thuật phẫu thuật. Hơn nữa, các bác sĩ sẵn sàng hơn để theo đuổi điều trị các bệnh đe dọa tính mạng (bệnh lý động mạch chủ lớn, hiệu suất cơ tim kém), trong khi người bệnh mong đợi các cách tiếp cận phẫu thuật và lựa chọn điều trị tiên tiến và/hoặc mới. Mặc dù đa số các yếu tố dự đoán AKI sau phẫu thuật không thể sửa đổi được, một số yếu tố nguy cơ, chẳng hạn như thiếu máu trước và sau phẫu thuật, quản lý dịch đầy đủ, và sự bao gồm và loại trừ một số thuốc chu phẫu, có thể được sửa đổi có thể giảm nhẹ sự xuất hiện của AKI sau phẫu thuật tim và không phải tim.
HẾT CHƯƠNG 8.
Bảng Chú Giải Thuật Ngữ Y Học Anh-Việt – Chương 8 (Người dịch)
| STT | Thuật ngữ tiếng Anh | Cách phát âm | Nghĩa Tiếng Việt |
|---|---|---|---|
| 1 | Acute kidney injury (AKI) | /əˈkjuːt ˈkɪdni ˈɪndʒəri/ | Tổn thương thận cấp (tình trạng mất chức năng thận đột ngột) |
| 2 | Postoperative | /ˌpoʊstˈɒpərətɪv/ | Sau phẫu thuật |
| 3 | Perioperative | /ˌpɛriˈɒpərətɪv/ | Chu phẫu (thời kỳ trước, trong và sau phẫu thuật) |
| 4 | Renal dysfunction | /ˈriːnəl dɪsˈfʌŋkʃən/ | Rối loạn chức năng thận |
| 5 | Comorbidity | /ˌkəʊmɔːˈbɪdɪti/ | Bệnh đồng mắc (bệnh xuất hiện cùng với bệnh chính) |
| 6 | Mortality | /mɔːˈtælɪti/ | Tử suất, tỷ lệ tử vong |
| 7 | Diabetes mellitus (DM) | /ˌdaɪəˈbiːtiːz məˈlaɪtəs/ | Đái tháo đường |
| 8 | Vascular disease | /ˈvæskjʊlər dɪˈziːz/ | Bệnh mạch máu |
| 9 | Operative procedure | /ˈɒpərətɪv prəˈsiːdʒər/ | Thủ thuật phẫu thuật |
| 10 | Endoscopic cholecystectomy | /ˌɛndəˈskɒpɪk ˌkɒlɪsɪsˈtɛktəmi/ | Cắt túi mật nội soi |
| 11 | Aortic arch replacement | /eɪˈɔːrtɪk ɑːrtʃ rɪˈpleɪsmənt/ | Thay đoạn cung động mạch chủ |
| 12 | Hypotension | /ˌhaɪpəʊˈtɛnʃən/ | Hạ huyết áp |
| 13 | Suprarenal cross-clamp | /ˌsuːprəˈriːnəl krɒs klæmp/ | Kẹp chéo trên thận |
| 14 | Circulatory arrest | /ˈsɜːrkjʊlətəri əˈrɛst/ | Ngừng tuần hoàn |
| 15 | Aminoglycoside | /əˌmiːnəʊˈɡlaɪkəsaɪd/ | Aminoglycoside (nhóm kháng sinh) |
| 16 | Radiocontrast dye | /ˌreɪdiəʊˈkɒntrɑːst daɪ/ | Thuốc cản quang |
| 17 | Renal physiology | /ˈriːnəl ˌfɪziˈɒlədʒi/ | Sinh lý thận |
| 18 | Renal blood flow (RBF) | /ˈriːnəl blʌd fləʊ/ | Dòng máu thận |
| 19 | Profound hypothermic circulatory arrest (HCA) | /prəˈfaʊnd ˌhaɪpəʊˈθɜːmɪk ˈsɜːrkjʊlətəri əˈrɛst/ | Ngừng tuần hoàn hạ thân nhiệt sâu |
| 20 | Chronic kidney disease | /ˈkrɒnɪk ˈkɪdni dɪˈziːz/ | Bệnh thận mãn tính |
| 21 | Glomerular filtration rate (GFR) | /ɡləˈmɛrjʊlər fɪlˈtreɪʃən reɪt/ | Tốc độ lọc cầu thận |
| 22 | Oxygen consumption | /ˈɒksɪdʒən kənˈsʌmpʃən/ | Tiêu thụ oxy |
| 23 | Renal cortex | /ˈriːnəl ˈkɔːtɛks/ | Vỏ thận |
| 24 | Renal medulla | /ˈriːnəl məˈdʌlə/ | Tủy thận |
| 25 | Tubular sodium | /ˈtjuːbjʊlər ˈsəʊdiəm/ | Natri ống thận |
| 26 | Arteriovenous oxygen gradient | /ɑːˌtɪəriəʊˈviːnəs ˈɒksɪdʒən ˈɡreɪdiənt/ | Gradient oxy động tĩnh mạch |
| 27 | Acute tubular necrosis | /əˈkjuːt ˈtjuːbjʊlər nəˈkrəʊsɪs/ | Hoại tử ống thận cấp tính |
| 28 | Cardiac output (CO) | /ˈkɑːdiæk ˈaʊtpʊt/ | Cung lượng tim |
| 29 | Osmotic load | /ɒzˈmɒtɪk ləʊd/ | Tải thẩm thấu |
| 30 | Nephron | /ˈnɛfrɒn/ | Nephron (đơn vị cấu trúc và chức năng của thận) |
| 31 | Nephrotoxic | /ˌnɛfrəʊˈtɒksɪk/ | Độc thận |
| 32 | Non-steroidal anti-inflammatory drugs | /nɒn stəˈrɔɪdəl ˌæntiɪnˈflæmətəri drʌɡz/ | Thuốc chống viêm không steroid |
| 33 | Angiotensin-converting enzyme (ACE) inhibitors | /ænˌdʒiəʊˈtɛnsɪn kənˈvɜːtɪŋ ˈɛnzaɪm ɪnˈhɪbɪtərz/ | Thuốc ức chế enzyme chuyển angiotensin |
| 34 | Aprotinin | /əˈprəʊtɪnɪn/ | Aprotinin (thuốc ức chế protease serine) |
| 35 | Serine protease inhibitor | /ˈsɛriːn ˈprəʊtieɪz ɪnˈhɪbɪtər/ | Chất ức chế protease serine |
| 36 | Cardiopulmonary bypass (CPB) | /ˌkɑːdiəʊˈpʌlmənəri ˈbaɪpɑːs/ | Tuần hoàn ngoài cơ thể |
| 37 | Metabolic waste | /ˌmɛtəˈbɒlɪk weɪst/ | Chất thải chuyển hóa |
| 38 | Electrolyte regulation | /ɪˈlɛktrəlaɪt ˌrɛɡjʊˈleɪʃən/ | Điều hòa điện giải |
| 39 | RIFLE criteria | /ˈraɪfəl kraɪˈtɪəriə/ | Tiêu chí RIFLE (Risk, Injury, Failure, Loss, End-stage) |
| 40 | Acute Kidney Injury Network (AKIN) | /əˈkjuːt ˈkɪdni ˈɪndʒəri ˈnɛtwɜːk/ | Mạng lưới Tổn thương Thận Cấp tính |
| 41 | Kidney Disease: Improving Global Outcomes (KDIGO) | /ˈkɪdni dɪˈziːz ɪmˈpruːvɪŋ ˈɡləʊbəl ˈaʊtkʌmz/ | Bệnh Thận: Cải Thiện Kết Quả Toàn Cầu |
| 42 | Serum creatinine (sCr) | /ˈsɪərəm kriˈætɪniːn/ | Creatinine huyết thanh |
| 43 | Urine output (UO) | /ˈjʊərɪn ˈaʊtpʊt/ | Lượng nước tiểu |
| 44 | General anesthesia | /ˈdʒɛnərəl ˌænɪsˈθiːziə/ | Gây mê toàn thân |
| 45 | Regional anesthesia | /ˈriːdʒənəl ˌænɪsˈθiːziə/ | Gây mê vùng |
| 46 | Peripheral vasodilation | /pəˈrɪfərəl ˌveɪzəʊdaɪˈleɪʃən/ | Giãn mạch ngoại vi |
| 47 | Nil per os (NPO) | /nɪl pɜːr ˈəʊs/ | Nhịn ăn qua đường miệng |
| 48 | Inhalational anesthetics | /ˌɪnhəˈleɪʃənəl ˌænɪsˈθɛtɪks/ | Thuốc gây mê hít |
| 49 | Fluoride ion | /ˈflʊəraɪd ˈaɪən/ | Ion florua |
| 50 | Sevoflurane | /ˌsɛvəʊˈflʊəreɪn/ | Sevoflurane (thuốc gây mê hít) |
| 51 | Enflurane | /ˈɛnflʊreɪn/ | Enflurane (thuốc gây mê hít) |
| 52 | Pharmacokinetics | /ˌfɑːməkəʊkɪˈnɛtɪks/ | Dược động học |
| 53 | Compound A | /ˈkɒmpaʊnd eɪ/ | Hợp chất A (chất haloalkene) |
| 54 | Renovascular | /ˌrɛnəʊˈvæskjʊlər/ | Mạch máu thận |
| 55 | Left ventricular dysfunction | /lɛft vɛnˈtrɪkjʊlər dɪsˈfʌŋkʃən/ | Rối loạn chức năng thất trái |
| 56 | Peripheral vascular disease | /pəˈrɪfərəl ˈvæskjʊlər dɪˈziːz/ | Bệnh mạch máu ngoại vi |
| 57 | Renovascular disease | /ˌrɛnəʊˈvæskjʊlər dɪˈziːz/ | Bệnh mạch máu thận |
| 58 | Sepsis | /ˈsɛpsɪs/ | Nhiễm trùng huyết |
| 59 | Hepatic failure | /hɪˈpætɪk ˈfeɪljər/ | Suy gan |
| 60 | Blood urea nitrogen (BUN) | /blʌd jʊˈriːə ˈnaɪtrədʒən/ | Nitơ urê máu |
| 61 | Nephron | /ˈnɛfrɒn/ | Đơn vị thận (đơn vị cấu trúc và chức năng cơ bản của thận) |
| 62 | Creatinine clearance (CrCl) | /kriˈætɪniːn ˈklɪərəns/ | Độ thanh thải creatinine |
| 63 | Cockcroft-Gault equation | /ˈkɒkkrɒft-ɡɔːlt ɪˈkweɪʒən/ | Phương trình Cockcroft-Gault |
| 64 | Obesity | /əʊˈbiːsɪti/ | Béo phì |
| 65 | Metabolic syndrome | /ˌmɛtəˈbɒlɪk ˈsɪndrəʊm/ | Hội chứng chuyển hóa |
| 66 | Rales | /rɑːlz/ | Ran ẩm (âm thanh bất thường khi nghe phổi) |
| 67 | Rhonchi | /ˈrɒŋkaɪ/ | Ran ngáy (âm thanh bất thường khi nghe phổi) |
| 68 | Edema | /ɪˈdiːmə/ | Phù |
| 69 | Jugular venous distention | /ˈdʒuːɡjʊlər ˈviːnəs dɪsˈtɛnʃən/ | Căng tĩnh mạch cổ |
| 70 | Ejection fraction | /ɪˈdʒɛkʃən ˈfrækʃən/ | Phân suất tống máu |
| 71 | Renal artery stenosis | /ˈriːnəl ˈɑːtəri stəˈnəʊsɪs/ | Hẹp động mạch thận |
| 72 | Hemodynamic | /ˌhiːməʊdaɪˈnæmɪk/ | Huyết động học |
| 73 | Pathophysiologic processes | /ˌpæθəʊˌfɪziəˈlɒdʒɪk ˈprəʊsɛsɪz/ | Các quá trình bệnh lý |
| 74 | Bilirubin | /ˌbɪlɪˈruːbɪn/ | Bilirubin |
| 75 | Renal parenchyma | /ˈriːnəl ˌpærənˈkaɪmə/ | Nhu mô thận |
| 76 | Myoglobin | /ˌmaɪəˈɡləʊbɪn/ | Myoglobin (protein cơ) |
| 77 | Hemoglobin | /ˈhiːməɡləʊbɪn/ | Hemoglobin (sắc tố hồng cầu) |
| 78 | Endotoxin | /ˌɛndəʊˈtɒksɪn/ | Nội độc tố |
| 79 | Inflammatory mediators | /ɪnˈflæmətəri ˈmiːdieɪtərz/ | Chất trung gian viêm |
| 80 | Neutrophil adhesion | /ˈnjuːtrəfɪl ədˈhiːʒən/ | Bám dính bạch cầu trung tính |
| 81 | Vasoconstriction | /ˌveɪzəʊkənˈstrɪkʃən/ | Co mạch |
| 82 | Chronic obstructive pulmonary disease | /ˈkrɒnɪk əbˈstrʌktɪv ˈpʌlmənəri dɪˈziːz/ | Bệnh phổi tắc nghẽn mãn tính |
| 83 | Coronary artery bypass grafting (CABG) | /ˈkɒrənəri ˈɑːtəri ˈbaɪpɑːs ˈɡrɑːftɪŋ/ | Phẫu thuật bắc cầu động mạch vành |
| 84 | Dialysis-dependent | /daɪˈælɪsɪs dɪˈpɛndənt/ | Phụ thuộc lọc máu |
| 85 | Renal replacement therapy | /ˈriːnəl rɪˈpleɪsmənt ˈθɛrəpi/ | Liệu pháp thay thế thận |
| 86 | Atrial fibrillation | /ˈeɪtriəl ˌfɪbrɪˈleɪʃən/ | Rung nhĩ |
| 87 | End-organ dysfunction | /ɛnd ˈɔːɡən dɪsˈfʌŋkʃən/ | Rối loạn chức năng cơ quan cuối |
| 88 | Pulsatile blood flow | /ˈpʌlsətaɪl blʌd fləʊ/ | Dòng máu đập |
| 89 | Catecholamines | /ˌkætɪˈkəʊləmiːnz/ | Catecholamine (hormone gây căng thẳng) |
| 90 | Macroembolic | /ˌmækrəʊɛmˈbɒlɪk/ | Tắc mạch vĩ mô |
| 91 | Microembolic | /ˌmaɪkrəʊɛmˈbɒlɪk/ | Tắc mạch vi mô |
| 92 | Hemodilution | /ˌhiːməʊdaɪˈluːʃən/ | Pha loãng máu |
| 93 | Off-pump coronary artery bypass | /ɒf-pʌmp ˈkɒrənəri ˈɑːtəri ˈbaɪpɑːs/ | Bắc cầu động mạch vành không dùng máy tim phổi |
| 94 | Microalbuminuria | /ˌmaɪkrəʊˌælbjʊmɪˈnjʊəriə/ | Vi albumin niệu |
| 95 | Urinary sodium excretion | /ˈjʊərɪnəri ˈsəʊdiəm ɪkˈskriːʃən/ | Bài tiết natri niệu |
| 96 | Free water clearance | /friː ˈwɔːtər ˈklɪərəns/ | Độ thanh thải nước tự do |
| 97 | N-acetyl-β-D-glucosaminidase | /ɛn-əˈsiːtaɪl-ˈbeɪtə-diː-ˌɡluːkəʊsəˈmɪnɪdeɪs/ | N-acetyl-β-D-glucosaminidase (enzyme) |
| 98 | Port access minithoracotomy | /pɔːrt ˈæksɛs ˌmɪnɪθəˈrækətəmi/ | Mở ngực nhỏ qua cổng |
| 99 | Median sternotomy | /ˈmiːdiən stɜːˈnɒtəmi/ | Mở xương ức giữa |
| 100 | Dopamine | /ˈdəʊpəmiːn/ | Dopamine (chất dẫn truyền thần kinh) |
| 101 | Dopamine-1 receptor | /ˈdəʊpəmiːn wʌn rɪˈsɛptər/ | Thụ thể dopamine-1 |
| 102 | Natriuresis | /ˌneɪtriˈjʊərɪsɪs/ | Natri niệu (tăng bài tiết natri trong nước tiểu) |
| 103 | Diuresis | /ˌdaɪəˈriːsɪs/ | Lợi tiểu (tăng bài tiết nước tiểu) |
| 104 | Inotropic | /ˌaɪnəˈtrɒpɪk/ | Tăng co bóp cơ tim |
| 105 | Chronotropic | /ˌkrɒnəˈtrɒpɪk/ | Tăng nhịp tim |
| 106 | Mannitol | /ˈmænɪtɒl/ | Mannitol (thuốc lợi tiểu thẩm thấu) |
| 107 | Hyperosmotic agent | /ˌhaɪpərɒzˈmɒtɪk ˈeɪdʒənt/ | Chất tăng áp lực thẩm thấu |
| 108 | Hydroxyl free radicals | /haɪˈdrɒksɪl friː ˈrædɪkəlz/ | Gốc hydroxyl tự do |
| 109 | Loop diuretics | /luːp ˌdaɪəˈrɛtɪks/ | Thuốc lợi tiểu quai |
| 110 | Furosemide | /fjʊəˈrəʊsəmaɪd/ | Furosemide (thuốc lợi tiểu) |
| 111 | Fenoldopam | /fəˈnɒldəpæm/ | Fenoldopam (thuốc giãn mạch) |
| 112 | Calcium channel blockers | /ˈkælsiəm ˈtʃænəl ˈblɒkərz/ | Thuốc chẹn kênh canxi |
| 113 | Nifedipine | /naɪˈfɛdɪpiːn/ | Nifedipine (thuốc chẹn kênh canxi) |
| 114 | Diltiazem | /dɪlˈtaɪəzɛm/ | Diltiazem (thuốc chẹn kênh canxi) |
| 115 | Clonidine | /ˈklɒnɪdiːn/ | Clonidine (thuốc chủ vận α-adrenergic) |
| 116 | Atrial natriuretic peptide (ANP) | /ˈeɪtriəl ˌneɪtriˈjʊərɪtɪk ˈpɛptaɪd/ | Peptide lợi niệu tâm nhĩ |
| 117 | Renin-angiotensin-aldosterone system | /ˈrɛnɪn ændʒiəʊˈtɛnsɪn ældəˈstɛrəʊn ˈsɪstəm/ | Hệ thống renin-angiotensin-aldosterone |
| 118 | Continuous venovenous hemodiafiltration | /kənˈtɪnjʊəs ˌviːnəʊˈviːnəs ˌhiːməʊˌdaɪəfɪlˈtreɪʃən/ | Lọc máu hemodiafiltration tĩnh mạch liên tục |
| 119 | Inflammatory markers | /ɪnˈflæmətəri ˈmɑːkərz/ | Chỉ điểm viêm |
| 120 | Interleukin-6 (IL-6) | /ˌɪntərˈluːkɪn sɪks/ | Interleukin-6 (cytokine tiền viêm) |
| 121 | Apolipoprotein E | /ˌæpəʊˌlɪpəʊˈprəʊtiːn iː/ | Apolipoprotein E (protein vận chuyển lipid) |
| 122 | Abdominal aortic aneurysm (AAA) | /æbˈdɒmɪnəl eɪˈɔːrtɪk ˈænjʊrɪzəm/ | Phình động mạch chủ bụng |
| 123 | Infrarenal | /ˌɪnfrəˈriːnəl/ | Dưới thận |
| 124 | Suprarenal | /ˌsuːprəˈriːnəl/ | Trên thận |
| 125 | Thoracoabdominal aneurysm | /ˌθɔːrəkəʊæbˈdɒmɪnəl ˈænjʊrɪzəm/ | Phình động mạch chủ-ngực-bụng |
| 126 | Left heart bypass | /lɛft hɑːt ˈbaɪpɑːs/ | Bắc cầu tim trái |
| 127 | Endotoxemia | /ˌɛndəʊtɒkˈsiːmiə/ | Nhiễm độc nội (sự hiện diện của nội độc tố trong máu) |
| 128 | Stent grafts | /stɛnt ɡrɑːfts/ | Mảnh ghép stent |
| 129 | Specific gravity | /spəˈsɪfɪk ˈɡrævɪti/ | Tỷ trọng |
| 130 | Osmolality | /ˌɒzməʊˈlælɪti/ | Áp lực thẩm thấu |
| 131 | Urine-to-plasma creatinine ratio | /ˈjʊərɪn tuː ˈplæzmə kriˈætɪniːn ˈreɪʃiəʊ/ | Tỷ lệ creatinine nước tiểu-huyết tương |
| 132 | Urine-to-plasma urea ratio | /ˈjʊərɪn tuː ˈplæzmə jʊˈriːə ˈreɪʃiəʊ/ | Tỷ lệ urê nước tiểu-huyết tương |
| 133 | Fractional excretion of sodium | /ˈfrækʃənəl ɪkˈskriːʃən əv ˈsəʊdiəm/ | Phân suất bài tiết natri |
| 134 | Cystatin C | /ˈsɪstətɪn siː/ | Cystatin C (protein kiềm không glycosyl hóa) |
| 135 | Urinary proteomics | /ˈjʊərɪnəri ˌprəʊtiːˈɒmɪks/ | Proteomics nước tiểu (phân tích protein trong nước tiểu) |
| 136 | Surface-enhanced laser desorption/ionization time-of-flight mass spectrometry (SELDI-TOF-MS) | Phổ khối ion hóa/giải hấp bề mặt tăng cường laser thời gian bay | |
| 137 | KIM-1 (kidney injury marker 1) | /kɪm wʌn/ | KIM-1 (chỉ điểm tổn thương thận 1) |
| 138 | Neutrophil gelatinase-associated lipocalin (NGAL) | NGAL (lipocalin liên kết với gelatinase bạch cầu trung tính) | |
| 139 | Liver-type fatty acid–binding protein | Protein liên kết axit béo loại gan | |
| 140 | TIMP2 (tissue inhibitor of metalloproteinase 2) | TIMP2 (chất ức chế metalloproteinase mô 2) | |
| 141 | IGFBP7 (insulin-like growth factor–binding protein 7) | IGFBP7 (protein liên kết yếu tố tăng trưởng giống insulin 7) | |
| 142 | Recursive partitioning | /rɪˈkɜːsɪv pɑːˈtɪʃənɪŋ/ | Phân vùng đệ quy (phương pháp thống kê) |
| 143 | New York Heart Association (NYHA) | /njuː jɔːk hɑːt əˌsəʊsiˈeɪʃən/ | Hiệp hội Tim New York |
| 144 | Intra-aortic balloon pump (IABP) | /ˌɪntrə eɪˈɔːrtɪk bəˈluːn pʌmp/ | Bơm bóng đối xung trong động mạch chủ |
| 145 | Cardiomegaly | /ˌkɑːdiəʊˈmɛɡəli/ | Tim to (phì đại tim) |
| 146 | Valvular surgery | /ˈvælvjʊlər ˈsɜːdʒəri/ | Phẫu thuật van tim |
| 147 | Mehta score | /ˈmeɪtə skɔː/ | Điểm số Mehta |
TÀI LIỆU THAM KHẢO
- Mangano D.T., Tudor I.C., Dietzel C.: The risk associated with aprotinin in cardiac surgery. N Engl J Med 2006; 354: pp. 353-365.
- Shaw A.D., Stafford-Smith M., White W.D., et. al.: The effect of aprotinin on outcome after coronary-artery bypass grafting. N Engl J Med 2008; 358: pp. 784-793.
- Fergusson D.A., Hébert P.C., Mazer C.D., et. al.: A comparison of aprotinin and lysine analogues in high-risk cardiac surgery. N Engl J Med 2008; 358: pp. 2319-2331.
- Kincaid E.H., Ashburn D.A., Hoyle J.R., et. al.: Does the combination of aprotinin and angiotensin-converting enzyme inhibitor cause renal failure after cardiac surgery?. Ann Thorac Surg 2005; 80: pp. 1388-1393. discussion 1393
- Bellomo R., et. al.: Acute renal failure – definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care 2004; 8: pp. R204.
- Mehta R.L., Kellum J.A., Shah S.V., et. al.: Acute kidney injury network: report of an initiative to improve outcomes in acute kidney injury. Crit Care 2007; 11: pp. R31.
- Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group : KDIGO clinical practice guideline for acute kidney injury. Kidney Int Suppl 2012; 2: pp. 1-138.
- Sear J.W.: Kidney dysfunction in the postoperative period. Br J Anaesth 2005; 95: pp. 20-32.
- Story D.A., Poustie S., Liu G., et. al.: Changes in plasma creatinine concentration after cardiac anesthesia with isoflurane, propofol, or sevoflurane: a randomized clinical trial. Anesthesiology 2001; 95: pp. 842-848.
- Novis B.K., Roizen M.F., Aronson S., et. al.: Association of preoperative risk factors with postoperative acute renal failure. Anesth Analg 1994; 78: pp. 143-149.
- Mangano C.M., Diamondstone L.S., Ramsay J.G., et. al.: Renal dysfunction after myocardial revascularization: risk factors, adverse outcomes, and hospital resource utilization. Ann Intern Med 1998; 128: pp. 194-203.
- Chertow G.M., Michael Lazarus J., Christiansen C.L., et. al.: Preoperative renal risk stratification. Circulation 1997; 95: pp. 878-884.
- Kheterpal S., Tremper K.K., Heung M., et. al.: Development and validation of an acute kidney injury risk index for patients undergoing general surgery: results from a national data set. Anesthesiology 2009; 110: pp. 505-515.
- Glance L.G., Wissler R., Mukamel D.B., et. al.: Perioperative outcomes among patients with the modified metabolic syndrome who are undergoing noncardiac surgery. Anesthesiology 2010; 113: pp. 859-872.
- Kumar A.B., Bridget Zimmerman M., Suneja M.: Obesity and post-cardiopulmonary bypass-associated acute kidney injury: a single-center retrospective analysis. J Cardiothorac Vasc Anesth 2014; 28: pp. 551-556.
- Mullen J.T., Moorman D.W., Davenport D.L.: The obesity paradox: body mass index and outcomes in patients undergoing nonbariatric general surgery. Ann Surg 2009; 250: pp. 166-172.
- Suneja M., Kumar A.B.: Obesity and perioperative acute kidney injury: a focused review. J Crit Care 2014; 29: pp. 694.e1-694.e6.
- Cockcroft D.W., Gault M.H.: Prediction of creatinine clearance from serum creatinine. Nephron 1976; 16: pp. 31-41.
- Weerasinghe A., Hornick P., Smith P., et. al.: Coronary artery bypass grafting in non-dialysis-dependent mild-to-moderate renal dysfunction. J Thorac Cardiovasc Surg 2001; 121: pp. 1083-1089.
- Thakar C.V., Arrigain S., Worley S., et. al.: A clinical score to predict acute renal failure after cardiac surgery. J Am Soc Nephrol 2005; 16: pp. 162-168.
- Brienza N., Giglio M.T., Marucci M., et. al.: Does perioperative hemodynamic optimization protect renal function in surgical patients? A meta-analytic study. Crit Care Med 2009; 37: pp. 2079-2090.
- Conlon P.J., Crowley J., Stack R., et. al.: Renal artery stenosis is not associated with the development of acute renal failure following coronary artery bypass grafting. Ren Fail 2005; 27: pp. 81-86.
- Erentug V., Bozbuga N., Polat A., et. al.: Coronary bypass procedures in patients with renal artery stenosis. J Card Surg 2005; 20: pp. 345-349.
- Heinzelmann M., Mercer-Jones M.A., Passmore J.C.: Neutrophils and renal failure. Am J Kidney Dis 1999; 34: pp. 384-399.
- Anderson R.J., O’Brien M., MaWhinney S., et. al.: VA Cooperative Study #5. Renal failure predisposes patients to adverse outcome after coronary artery bypass surgery. Kidney Int 1999; 55: pp. 1057-1062.
- Anderson R.J., O’Brien M., MaWhinney S., et. al.: Mild renal failure is associated with adverse outcome after cardiac valve surgery. Am J Kidney Dis 2000; 35: pp. 1127-1134.
- Albahrani M.J., Swaminathan M., Phillips-Bute B., et. al.: Postcardiac surgery complications: association of acute renal dysfunction and atrial fibrillation. Anesth Analg 2003; 96: pp. 637-643.
- Yeboah E.D., Petrie A., Pead J.L.: Acute renal failure and open heart surgery. Br Med J 1972; 1: pp. 415-418.
- Abel R.M., Buckley M.J., Austen W.G., et. al.: Etiology, incidence, and prognosis of renal failure following cardiac operations: results of a prospective analysis of 500 consecutive patients. J Thorac Cardiovasc Surg 1976; 71: pp. 323-333.
- Bhat J.G., Gluck M.C., Lowenstein J., et. al.: Renal failure after open heart surgery. Ann Intern Med 1976; 84: pp. 677-682.
- McLeish K.R., Luft F.C., Kleit S.A.: Factors affecting prognosis in acute renal failure following cardiac operations. Surg Gynecol Obstet 1977; 145: pp. 28-32.
- Hilberman M., Derby G.C., Spencer R.J., et. al.: Sequential pathophysiological changes characterizing the progression from renal dysfunction to acute renal failure following cardiac operation. J Thorac Cardiovasc Surg 1980; 79: pp. 838-844.
- Gailiunas P., Chawla R., Lazarus J.M., et. al.: Acute renal failure following cardiac operations. J Thorac Cardiovasc Surg 1980; 79: pp. 241-243.
- Lange H.W., Aeppli D.M., Brown D.C.: Survival of patients with acute renal failure requiring dialysis after open heart surgery: early prognostic indicators. Am Heart J 1987; 113: pp. 1138-1143.
- Corwin H.L., Sprague S.M., DeLaria G.A., et. al.: Acute renal failure associated with cardiac operations: a case-control study. J Thorac Cardiovasc Surg 1989; 98: pp. 1107-1112.
- Slogoff S., Reul G.J., Keats A.S., et. al.: Role of perfusion pressure and flow in major organ dysfunction after cardiopulmonary bypass. Ann Thorac Surg 1990; 50: pp. 911-918.
- Zanardo G., Michielon P., Paccagnella A., et. al.: Acute renal failure in the patient undergoing cardiac operation: prevalence, mortality rate, and main risk factors. J Thorac Cardiovasc Surg 1994; 107: pp. 1489-1495.
- Abrahamov D., Tamariz M., Fremes S., et. al.: Renal dysfunction after cardiac surgery. Can J Cardiol 2001; 17: pp. 565-570.
- Grayson A.D., Khater M., Jackson M., et. al.: Valvular heart operation is an independent risk factor for acute renal failure. Ann Thorac Surg 2003; 75: pp. 1829-1835.
- Antunes P.E., Prieto D.: Ferrão de Oliveira J, et al: Renal dysfunction after myocardial revascularization. Eur J Cardiothorac Surg 2004; 25: pp. 597-604.
- Oprea A.D., Del Rio J.M., Cooter M., et. al.: Pre- and postoperative anemia, acute kidney injury, and mortality after coronary artery bypass grafting surgery: a retrospective observational study. Can J Anaesth 2018; 65: pp. 46-59.
- Callahan M., Battleman D.S., Christos P., et. al.: Economic consequences of renal dysfunction among cardiopulmonary bypass surgery patients: a hospital-based perspective. Value Health 2003; 6: pp. 137-143.
- Koning H.M., Koning A.J., Defauw J.J.: Optimal perfusion during extra-corporeal circulation. Scand J Thorac Cardiovasc Surg 1987; 21: pp. 207-213.
- Swaminathan M., Phillips-Bute B.G., Conlon P.J., et. al.: The association of lowest hematocrit during cardiopulmonary bypass with acute renal injury after coronary artery bypass surgery. Ann Thorac Surg 2003; 76: pp. 784-791. discussion 792
- Brosius F.C., Hostetter T.H., Kelepouris E., et. al.: Detection of chronic kidney disease in patients with or at increased risk of cardiovascular disease: a science advisory from the American Heart Association Kidney and Cardiovascular Disease Council; Councils on High Blood Pressure Research, Cardiovascular Disease in the Young, and Epidemiology and Prevention; and the Quality of Care and Outcomes Research Interdisciplinary Working Group: developed in collaboration with the National Kidney Foundation. Circulation 2006; 114: pp. 1083-1087.
- Lema G., Meneses G., Urzua J., et. al.: Effects of extracorporeal circulation on renal function in coronary surgical patients. Anesth Analg 1995; 81: pp. 446-451.
- Davila-Roman V.G., Kouchoukos N.T., Schechtman K.B., et. al.: Atherosclerosis of the ascending aorta is a predictor of renal dysfunction after cardiac operations. J Thorac Cardiovasc Surg 1999; 117: pp. 111-116.
- Provenchere S., Plantefève G., Hufnagel G., et. al.: Renal dysfunction after cardiac surgery with normothermic cardiopulmonary bypass: incidence, risk factors, and effect on clinical outcome. Anesth Analg 2003; 96: pp. 1258-1264.
- Mori A., Watanabe K., Onoe M., et. al.: Regional blood flow in the liver, pancreas and kidney during pulsatile and nonpulsatile perfusion under profound hypothermia. Jpn Circ J 1988; 52: pp. 219-227.
- Reves J.G., Karp R.B., Buttner E.E., et. al.: Neuronal and adrenomedullary catecholamine release in response to cardiopulmonary bypass in man. Circulation 1982; 66: pp. 49-55.
- Blauth C.I.: Macroemboli and microemboli during cardiopulmonary bypass. Ann Thorac Surg 1995; 59: pp. 1300-1303.
- Donohoe J.F., Venkatachalam M.A., Bernard D.B., et. al.: Tubular leakage and obstruction after renal ischemia: structural-functional correlations. Kidney Int 1978; 13: pp. 208-222.
- Mora Mangano C.T., Neville M.J., Hsu P.H., et. al.: Aprotinin, blood loss, and renal dysfunction in deep hypothermic circulatory arrest. Circulation 2001; 104: pp. I276-I281.
- Swaminathan M., East C., Phillips-Bute B., et. al.: Report of a substudy on warm versus cold cardiopulmonary bypass: changes in creatinine clearance. Ann Thorac Surg 2001; 72: pp. 1603-1609.
- Harrington D.K., Lilley J.P., Rooney S.J., et. al.: Nonneurologic morbidity and profound hypothermia in aortic surgery. Ann Thorac Surg 2004; 78: pp. 596-601.
- Badner N.H., Murkin J.M., Lok P.: Differences in pH management and pulsatile/nonpulsatile perfusion during cardiopulmonary bypass do not influence renal function. Anesth Analg 1992; 75: pp. 696-701.
- Hessel E.A., Johnson D.D., Ivey T.D., et. al.: Membrane versus bubble oxygenator for cardiac operations: a prospective randomized study. J Thorac Cardiovasc Surg 1980; 80: pp. 111-122.
- Loef B.G., Epema A.H., Navis G., et. al.: Off-pump coronary revascularization attenuates transient renal damage compared with on-pump coronary revascularization. Chest 2002; 121: pp. 1190-1194.
- Jarvinen O., Laurikka J., Tarkka M.R.: Off-pump versus on-pump coronary bypass: comparison of patient characteristics and early outcomes. J Cardiovasc Surg (Torino) 2003; 44: pp. 167-172.
- Schwann N.M., Horrow J.C., Strong M.D., et. al.: Does off-pump coronary artery bypass reduce the incidence of clinically evident renal dysfunction after multivessel myocardial revascularization?. Anesth Analg 2004; 99: pp. 959-964.
- Berson A.J., Smith J.M., Woods S.E., et. al.: Off-pump versus on-pump coronary artery bypass surgery: does the pump influence outcome?. J Am Coll Surg 2004; 199: pp. 102-108.
- Ascione R., Nason G., Al-Ruzzeh S., et. al.: Coronary revascularization with or without cardiopulmonary bypass in patients with preoperative nondialysis-dependent renal insufficiency. Ann Thorac Surg 2001; 72: pp. 2020-2025.
- Beauford R.B., Saunders C.R., Niemeier L.A., et. al.: Is off-pump revascularization better for patients with non-dialysis-dependent renal insufficiency?. Heart Surg Forum 2004; 7: pp. E141-E146.
- Bucerius J., Gummert J.F., Walther T., et. al.: On-pump versus off-pump coronary artery bypass grafting: impact on postoperative renal failure requiring renal replacement therapy. Ann Thorac Surg 2004; 77: pp. 1250-1256.
- Cheungpasitporn W., Thongprayoon C., Kittanamongkolchai W., et. al.: Comparison of renal outcomes in off-pump versus on-pump coronary artery bypass grafting: a systematic review and meta-analysis of randomized controlled trials. Nephrology (Carlton) 2015; 20: pp. 727-735.
- Lamy A., Devereaux P.J., Yusuf S.: Off-pump or on-pump coronary-artery bypass grafting at 30 days. N Engl J Med 2012; 366: pp. 1489-1497.
- Lamy A., Devereaux P.J., Prabhakaran D., et. al.: Effects of off-pump and on-pump coronary-artery bypass grafting at 1 year. N Engl J Med 2013; 368: pp. 1179-1188.
- Deininger S., Hoenicka M., Müller-Eising K., et. al.: Renal function and urinary biomarkers in cardiac bypass surgery: a prospective randomized trial comparing three surgical techniques. Thorac Cardiovasc Surg 2016; 64: pp. 561-568.
- Shroyer A.L., Grover F.L., Hattler B., et. al.: On-pump versus off-pump coronary-artery bypass surgery. N Engl J Med 2009; 361: pp. 1827-1837.
- Garg A.X., Devereaux P.J., Yusuf S., et. al.: Kidney function after off-pump or on-pump coronary artery bypass graft surgery: a randomized clinical trial. JAMA 2014; 311: pp. 2191-2198.
- McCreath B.J., Swaminathan M., Booth J.V., et. al.: Mitral valve surgery and acute renal injury: port access versus median sternotomy. Ann Thorac Surg 2003; 75: pp. 812-819.
- Horwitz D., Fox Sm D., Goldberg L.I.: Effects of dopamine in man. Circ Res 1962; 10: pp. 237-243.
- ter Wee P.M., Smit A.J., Rosman J.B., et. al.: Effect of intravenous infusion of low-dose dopamine on renal function in normal individuals and in patients with renal disease. Am J Nephrol 1986; 6: pp. 42-46.
- Lassnigg A., Donner E., Grubhofer G., et. al.: Lack of renoprotective effects of dopamine and furosemide during cardiac surgery. J Am Soc Nephrol 2000; 11: pp. 97-104.
- Woo E.B., Tang A.T., el-Gamel A., et. al.: Dopamine therapy for patients at risk of renal dysfunction following cardiac surgery: science or fiction?. Eur J Cardiothorac Surg 2002; 22: pp. 106-111.
- Carcoana O.V., Mathew J.P., Davis E., et. al.: Mannitol and dopamine in patients undergoing cardiopulmonary bypass: a randomized clinical trial. Anesth Analg 2003; 97: pp. 1222-1229.
- Chiolero R., Borgeat A., Fisher A.: Postoperative arrhythmias and risk factors after open heart surgery. Thorac Cardiovasc Surg 1991; 39: pp. 81-84.
- Tang A.T., El-Gamel A., Keevil B., et. al.: The effect of ‘renal-dose’ dopamine on renal tubular function following cardiac surgery: assessed by measuring retinol binding protein (RBP). Eur J Cardiothorac Surg 1999; 15: pp. 717-721. discussion 721-722
- Better O.S., Rubinstein I., Winaver J.M., et. al.: Mannitol therapy revisited (1940-1997). Kidney Int 1997; 52: pp. 886-894.
- Ip-Yam P.C., Murphy S., Baines M., et. al.: Renal function and proteinuria after cardiopulmonary bypass: the effects of temperature and mannitol. Anesth Analg 1994; 78: pp. 842-847.
- Lim E., Ali Z.A., Attaran R., et. al.: Evaluating routine diuretics after coronary surgery: a prospective randomized controlled trial. Ann Thorac Surg 2002; 73: pp. 153-155.
- Singer I., Epstein M.: Potential of dopamine A-1 agonists in the management of acute renal failure. Am J Kidney Dis 1998; 31: pp. 743-755.
- Caimmi P.P., Pagani L., Micalizzi E., et. al.: Fenoldopam for renal protection in patients undergoing cardiopulmonary bypass. J Cardiothorac Vasc Anesth 2003; 17: pp. 491-494.
- Ranucci M., Soro G., Barzaghi N., et. al.: Fenoldopam prophylaxis of postoperative acute renal failure in high-risk cardiac surgery patients. Ann Thorac Surg 2004; 78: pp. 1332-1337. discussion 1337–1338
- Bertolissi M., Antonucci F., De Monte A., et. al.: Effects on renal function of a continuous infusion of nifedipine during cardiopulmonary bypass. J Cardiothorac Vasc Anesth 1996; 10: pp. 238-242.
- Zanardo G., Michielon P., Rosi P., et. al.: Effects of a continuous diltiazem infusion on renal function during cardiac surgery. J Cardiothorac Vasc Anesth 1993; 7: pp. 711-716.
- Amano J., Suzuki A., Sunamori M., et. al.: Effect of calcium antagonist diltiazem on renal function in open heart surgery. Chest 1995; 107: pp. 1260-1265.
- Bergman A.S., Odar-Cederlöf I., Westman L., et. al.: Diltiazem infusion for renal protection in cardiac surgical patients with preexisting renal dysfunction. J Cardiothorac Vasc Anesth 2002; 16: pp. 294-299.
- Kulka P.J., Tryba M., Zenz M.: Preoperative α 2 -adrenergic receptor agonists prevent the deterioration of renal function after cardiac surgery: results of a randomized, controlled trial. Crit Care Med 1996; 24: pp. 947-952.
- McIntyre R.W., Schwinn D.A.: Atrial natriuretic peptide. J Cardiothorac Anesth 1989; 3: pp. 91-98.
- Berendes E., Schmidt C., Van Aken H., et. al.: A-type and B-type natriuretic peptides in cardiac surgical procedures. Anesth Analg 2004; 98: pp. 11-19.
- Ohki S., Ishikawa S., Ohtaki A., et. al.: Hemodynamic effects of alpha-human atrial natriuretic polypeptide on patients undergoing open-heart surgery. J Cardiovasc Surg (Torino) 1999; 40: pp. 781-785.
- Sezai A., Hata M., Wakui S., et. al.: Low-dose continuous infusion of human atrial natriuretic peptide during and after cardiac surgery. Ann Thorac Surg 2000; 69: pp. 732-738.
- Sward K., Valson F., Ricksten S.E.: Long-term infusion of atrial natriuretic peptide (ANP) improves renal blood flow and glomerular filtration rate in clinical acute renal failure. Acta Anaesthesiol Scand 2001; 45: pp. 536-542.
- Kumar A.B., Suneja M.: Cardiopulmonary bypass-associated acute kidney injury. Anesthesiology 2011; 114: pp. 964-970.
- Nigwekar S.U., Navaneethan S.D., Parikh C.R., et. al.: Atrial natriuretic peptide for management of acute kidney injury: a systematic review and meta-analysis. Clin J Am Soc Nephrol 2009; 4: pp. 261-272.
- Demirkilic U., Kuralay E., Yenicesu M., et. al.: Timing of replacement therapy for acute renal failure after cardiac surgery. J Card Surg 2004; 19: pp. 17-20.
- Stevens L.M., El-Hamamsy I., Leblanc M., et. al.: Continuous renal replacement therapy after heart transplantation. Can J Cardiol 2004; 20: pp. 619-623.
- Zarbock A., Kellum J.A., Schmidt C., et. al.: Effect of early vs delayed initiation of renal replacement therapy on mortality in critically ill patients with acute kidney injury: the ELAIN randomized clinical trial. JAMA 2016; 315: pp. 2190-2199.
- Bhatt G.C., Das R.R.: Early versus late initiation of renal replacement therapy in patients with acute kidney injury – a systematic review & meta-analysis of randomized controlled trials. BMC Nephrol 2017; 18: pp. 78.
- Yang X.M., Tu G.W., Zheng J.L., et. al.: A comparison of early versus late initiation of renal replacement therapy for acute kidney injury in critically ill patients: an updated systematic review and meta-analysis of randomized controlled trials. BMC Nephrol 2017; 18: pp. 264.
- Ronco C., Bellomo R.: Prevention of acute renal failure in the critically ill. Nephron Clin Pract 2003; 93: pp. C13-C20.
- Gaudino M., Di Castelnuovo A., Zamparelli R., et. al.: Genetic control of postoperative systemic inflammatory reaction and pulmonary and renal complications after coronary artery surgery. J Thorac Cardiovasc Surg 2003; 126: pp. 1107-1112.
- MacKensen G.B., Swaminathan M., Ti L.K., et. al.: Preliminary report on the interaction of apolipoprotein E polymorphism with aortic atherosclerosis and acute nephropathy after CABG. Ann Thorac Surg 2004; 78: pp. 520-526.
- Boldt J., Brenner T., Lehmann A., et. al.: Is kidney function altered by the duration of cardiopulmonary bypass?. Ann Thorac Surg 2003; 75: pp. 906-912.
- Ellenberger C., Schweizer A., Diaper J., et. al.: Incidence, risk factors and prognosis of changes in serum creatinine early after aortic abdominal surgery. Intensive Care Med 2006; 32: pp. 1808-1816.
- Kertai M.D., Boersma E., Bax J.J., et. al.: Comparison between serum creatinine and creatinine clearance for the prediction of postoperative mortality in patients undergoing major vascular surgery. Clin Nephrol 2003; 59: pp. 17-23.
- Wahlberg E., Dimuzio P.J., Stoney R.J.: Aortic clamping during elective operations for infrarenal disease: the influence of clamping time on renal function. J Vasc Surg 2002; 36: pp. 13-18.
- Kudo F.A., Nishibe T., Miyazaki K., et. al.: Postoperative renal function after elective abdominal aortic aneurysm repair requiring suprarenal aortic cross-clamping. Surg Today 2004; 34: pp. 1010-1013.
- Nypaver T.J., Shepard A.D., Reddy D.J., et. al.: Repair of pararenal abdominal aortic aneurysms. an analysis of operative management. Arch Surg 1993; 128: pp. 803-811. discussion 811–813
- Schepens M.A., Defauw J.J., Hamerlijnck R.P., et. al.: Risk assessment of acute renal failure after thoracoabdominal aortic aneurysm surgery. Ann Surg 1994; 219: pp. 400-407.
- Svensson L.G., Crawford E.S., Hess K.R., et. al.: Thoracoabdominal aortic aneurysms associated with celiac, superior mesenteric, and renal artery occlusive disease: methods and analysis of results in 271 patients. J Vasc Surg 1992; 16: pp. 378-389. discussion 389–390
- Crawford E.S., Crawford J.L., Safi H.J., et. al.: Thoracoabdominal aortic aneurysms: preoperative and intraoperative factors determining immediate and long-term results of operations in 605 patients. J Vasc Surg 1986; 3: pp. 389-404.
- Safi H.J., Harlin S.A., Miller C.C., et. al.: Predictive factors for acute renal failure in thoracic and thoracoabdominal aortic aneurysm surgery. J Vasc Surg 1996; 24: pp. 338-344. discussion 344–345
- Carrel T.P., Berdat P.A., Robe J., et. al.: Outcome of thoracoabdominal aortic operations using deep hypothermia and distal exsanguination. Ann Thorac Surg 2000; 69: pp. 692-695.
- Breckwoldt W.L., Mackey W.C., Belkin M., et. al.: The effect of suprarenal cross-clamping on abdominal aortic aneurysm repair. Arch Surg 1992; 127: pp. 520-524.
- Johnston K.W.: Multicenter prospective study of nonruptured abdominal aortic aneurysm: part II. Variables predicting morbidity and mortality. J Vasc Surg 1989; 9: pp. 437-447.
- Chaikof E.L., Smith R.B., Salam A.A., et. al.: Ischemic nephropathy and concomitant aortic disease: a ten-year experience. J Vasc Surg 1994; 19: pp. 135-146. discussion 146–148
- Allen B.T., Anderson C.B., Rubin B.G., et. al.: Preservation of renal function in juxtarenal and suprarenal abdominal aortic aneurysm repair. J Vasc Surg 1993; 17: pp. 948-958. discussion 958–959
- Cambria R.P., Brewster D.C., L’Italien G.J., et. al.: Renal artery reconstruction for the preservation of renal function. J Vasc Surg 1996; 24: pp. 371-380. discussion 380–382
- Acher C.W., Belzer F.O., Grist T.M., et. al.: Late renal function in patients undergoing renal revascularization for control of hypertension and/or renal preservation. Cardiovasc Surg 1996; 4: pp. 602-606.
- Panneton J.M., Lassonde J., Laurendeau F.: Ruptured abdominal aortic aneurysm: impact of comorbidity and postoperative complications on outcome. Ann Vasc Surg 1995; 9: pp. 535-541.
- Bauer E.P., Redaelli C., von Segesser L.K., et. al.: Ruptured abdominal aortic aneurysms: predictors for early complications and death. Surgery 1993; 114: pp. 31-35.
- Hajarizadeh H., Rohrer M.J., Herrmann J.B., et. al.: Acute peritoneal dialysis following ruptured abdominal aortic aneurysms. Am J Surg 1995; 170: pp. 223-226.
- Berisa F., Beaman M., Adu D., et. al.: Prognostic factors in acute renal failure following aortic aneurysm surgery. Q J Med 1990; 76: pp. 689-698.
- White R.A., Donayre C.E., Walot I., et. al.: Preliminary clinical outcome and imaging criterion for endovascular prosthesis development in high-risk patients who have aortoiliac and traumatic arterial lesions. J Vasc Surg 1996; 24: pp. 556-569. discussion 569–571
- Sharma P.V., Babu S.C., Shah P.M., et. al.: Changing patterns of atheroembolism. Cardiovasc Surg 1996; 4: pp. 573-579.
- Powell R.J., Roddy S.P., Meier G.H., et. al.: Effect of renal insufficiency on outcome following infrarenal aortic surgery. Am J Surg 1997; 174: pp. 126-130.
- Shepard A.D., Tollefson D.F., Reddy D.J., et. al.: Left flank retroperitoneal exposure: a technical aid to complex aortic reconstruction. J Vasc Surg 1991; 14: pp. 283-291.
- Hallett J.W., Textor S.C., Kos P.B., et. al.: Advanced renovascular hypertension and renal insufficiency: trends in medical comorbidity and surgical approach from 1970 to 1993. J Vasc Surg 1995; 21: pp. 750-759. discussion 759–760
- Godet G., Fléron M.H., Vicaut E., et. al.: Risk factors for acute postoperative renal failure in thoracic or thoracoabdominal aortic surgery: a prospective study. Anesth Analg 1997; 85: pp. 1227-1232.
- Soukiasian H.J., Raissi S.S., Kleisli T., et. al.: Total circulatory arrest for the replacement of the descending and thoracoabdominal aorta. Arch Surg 2005; 140: pp. 394-398.
- Leurs L.J., Bell R., Degrieck Y., et. al.: Endovascular treatment of thoracic aortic diseases: combined experience from the EUROSTAR and United Kingdom thoracic endograft registries. J Vasc Surg 2004; 40: pp. 670-679. discussion 679–680
- Makaroun M.S., Dillavou E.D., Kee S.T., et. al.: Endovascular treatment of thoracic aortic aneurysms: results of the phase II multicenter trial of the GORE TAG thoracic endoprosthesis. J Vasc Surg 2005; 41: pp. 1-9.
- Ranucci M., Isgrò G., Cotza M., et. al.: Oxygen delivery during cardiopulmonary bypass and acute renal failure after coronary operations. Ann Thorac Surg 2005; 80: pp. 2213-2220.
- Resch T.A., et. al.: Combined staged procedures for the treatment of thoracoabdominal aneurysms. J Endovasc Ther 2006; 13: pp. 481-489.
- Black S.A., Wolfe J.H., Clark M., et. al.: Complex thoracoabdominal aortic aneurysms: endovascular exclusion with visceral revascularization. J Vasc Surg 2006; 43: pp. 1081-1089. discussion 1089
- Mehta R.L., Chertow G.M.: Acute renal failure definitions and classification: time for change?. J Am Soc Nephrol 2003; 14: pp. 2178-2187.
- Levey A.S., Bosch J.P., Lewis J.B., et. al.: Modification of Diet in Renal Disease Study Group. A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Ann Intern Med 1999; 130: pp. 461-470.
- Wijeysundera D.N., Karkouti K., Beattie W.S., et. al.: Improving the identification of patients at risk of postoperative renal failure after cardiac surgery. Anesthesiology 2006; 104: pp. 65-672.
- Finney H., Newman D.J., Gruber W., et. al.: Initial evaluation of cystatin C measurement by particle-enhanced immunonephelometry on the Behring Nephelometer Systems (BNA, BN II). Clin Chem 1997; 43: pp. 1016-1022.
- Dharnidharka V.R., Kwon C., Stevens G.: Serum cystatin C is superior to serum creatinine as a marker of kidney function: a meta-analysis. Am J Kidney Dis 2002; 40: pp. 221-226.
- Nguyen M.T., Ross G.F., Dent C.L., et. al.: Early prediction of acute renal injury using urinary proteomics. Am J Nephrol 2005; 25: pp. 318-326.
- Au V., Feit J., Barasch J., et. al.: Urinary neutrophil gelatinase-associated lipocalin (NGAL) distinguishes sustained from transient acute kidney injury after general surgery. Kidney Int Rep 2016; 1: pp. 3-9.
- Alge J.L., Arthur J.M.: Biomarkers of AKI: a review of mechanistic relevance and potential therapeutic implications. 2015; 10: pp. 147-155.
- Aronson S., Fontes M.L., Miao Y., et. al.: Risk index for perioperative renal dysfunction/failure: critical dependence on pulse pressure hypertension. Circulation 2007; 115: pp. 733-742.
- Mehta R.H., Grab J.D., O’Brien S.M., et. al.: Bedside tool for predicting the risk of postoperative dialysis in patients undergoing cardiac surgery. Circulation 2006; 114: pp. 2208-2216.
- Wijeysundera D.N., Karkouti K., Dupuis J.Y., et. al.: Derivation and validation of a simplified predictive index for renal replacement therapy after cardiac surgery. JAMA 2007; 297: pp. 1801-1809.
- Birnie K., Verheyden V., Pagano D., et. al.: Predictive models for Kidney Disease: Improving Global Outcomes (KDIGO) defined acute kidney injury in UK cardiac surgery. Crit Care 2014; 18: pp. 606.
- Prowle J.R., Chua H.R., Bagshaw S.M., et. al.: Clinical review: volume of fluid resuscitation and the incidence of acute kidney injury—a systematic review. Crit Care 2012; 16: pp. 230.

BÌNH LUẬN