Sách dịch: CÁC NGUYÊN LÝ Y HỌC HÔ HẤP, ẤN BẢN THỨ 8
Dịch và chú giải Tiếng Việt: Ts.Bs. Lê Nhật Huy, Ths.Bs. Lê Đình Sáng
CHƯƠNG 10. BỆNH NHU MÔ PHỔI LAN TOẢ LIÊN QUAN ĐẾN CÁC NGUYÊN NHÂN ĐÃ BIẾT
Diffuse parenchymal lung diseases associated with known etiologic agents
Steven E. Weinberger MD, MACP, FRCP, Barbara A. Cockrill MD and Jess Mandel MD, MACP, FRCP
Principles of Pulmonary Medicine, 10, 136-147
MỤC LỤC
Bệnh do Hít Phải Bụi Vô Cơ
Viêm Phổi Dị Ứng Ngoại Sinh Bệnh Phổi mô kẽ do Thuốc Bệnh Phổi do Xạ Trị |
Chương này tập trung vào một số nhóm chính của bệnh phổi mô kẽ (interstitial) lan tỏa mà tác nhân gây bệnh đã được xác định. Các nguyên tắc chung đã được thảo luận trong Chương 9 áp dụng cho hầu hết các tình trạng này, và các đặc điểm được nhấn mạnh ở đây là những điểm đặc trưng hoặc điển hình cho từng nguyên nhân. Xét đến số lượng lớn các bệnh phổi mô kẽ lan tỏa, chương này chỉ đề cập sơ lược về lượng thông tin hiện có. Khi một bác sĩ đối mặt với một bệnh nhân mắc một loại bệnh phổi mô kẽ lan tỏa cụ thể, tốt nhất là nên tìm hiểu lại các chi tiết về bệnh đó vào thời điểm đó.
CÁC BỆNH DO HÍT PHẢI BỤI VÔ CƠ
Nhiều loại bệnh phổi mô kẽ lan tỏa là do hít phải bụi vô cơ; thuật ngữ bệnh bụi phổi (pneumoconiosis) được sử dụng cho các tình trạng này. Ví dụ về nhiều tác nhân gây bệnh bao gồm silica, amiăng, than, talc, mica, nhôm, và beryllium. Trong hầu hết các trường hợp, việc phơi nhiễm đã xảy ra trong một thời gian dài do môi trường nghề nghiệp. Trong một số bệnh này, quá trình tổn thương nhu mô vẫn tiếp tục tiến triển ngay cả khi không còn tiếp xúc.
Để một hạt bụi vô cơ hít phải có thể khởi phát tổn thương cho nhu mô phổi, nó phải được lắng đọng tại một khu vực thích hợp của đường hô hấp dưới. Nếu kích thước hạt quá lớn hoặc quá nhỏ, chúng có xu hướng lắng đọng ở đường hô hấp trên hoặc trong các đường dẫn khí lớn hơn của cây khí-phế quản. Các hạt có đường kính khoảng 0,5 đến 5 µm có khả năng lắng đọng cao nhất trong các tiểu phế quản hô hấp hoặc các phế nang. Các hạt có đường kính từ 0,5 đến 5 µm có khả năng lắng đọng cao nhất trong các tiểu phế quản hô hấp hoặc các phế nang.
Không có phương pháp điều trị hiệu quả nào cho bệnh phổi mô kẽ do hầu hết các loại bụi vô cơ hít phải gây ra. Do đó, các vấn đề quan trọng mà các bác sĩ phải đối mặt là nhận biết và phòng ngừa các rối loạn này. Tránh hoàn toàn việc phơi nhiễm là hình thức phòng ngừa tối ưu, nhưng khi việc phơi nhiễm là cần thiết, các biện pháp phòng ngừa thích hợp với khẩu trang hoặc mặt nạ phòng độc hiệu quả là rất cần thiết.
Bốn loại bệnh bụi phổi được xem xét ở đây: bệnh bụi phổi silic, bệnh bụi phổi than (CWP), bệnh bụi phổi amiăng, và bệnh bụi phổi beryllium. Để biết thông tin về nhiều tác nhân khác, hãy tham khảo phần Đọc thêm chi tiết hơn ở cuối chương này.
Bệnh Bụi Phổi Silic
Bệnh bụi phổi silic là bệnh phổi mô kẽ lan tỏa do phơi nhiễm với silica (silicon dioxide). Trong số các dạng tinh thể của silica, thạch anh là dạng thường gặp nhất, thường là một thành phần của đá hoặc cát. Mặc dù đã biết rõ về độc tính, phơi nhiễm silica vẫn tiếp tục là một vấn đề trên toàn thế giới. Những người có nguy cơ bao gồm thợ phun cát, thợ mỏ đá cứng, công nhân mỏ đá, và thợ cắt đá. Gần đây, bệnh nặng được ghi nhận ở những người làm trong ngành sản xuất đá nhân tạo thường được sử dụng làm mặt bàn. Trong hầu hết các trường hợp, sự phát triển của bệnh cần ít nhất 20 năm phơi nhiễm. Tuy nhiên, với liều lượng silica hít phải đặc biệt cao, như có thể xảy ra ở thợ phun cát, một dạng cấp tính của bệnh có thể xảy ra với thời gian phơi nhiễm ngắn hơn nhiều.
Tác động gây bệnh của silica là do sự tạo ra các gốc oxy và độc tính đối với đại thực bào. Các hạt silica hít phải đi đến đường hô hấp dưới sẽ bị các đại thực bào phổi thực bào. Các hạt silica mới cắt có tính gây bệnh cao hơn các hạt cũ, có lẽ vì bề mặt mới cắt có khả năng phản ứng cao và tạo ra nhiều loài oxy phản ứng hơn. Sau khi nuốt hạt silica, đại thực bào được kích hoạt và giải phóng các chất trung gian gây viêm, bao gồm yếu tố hoại tử u (TNF)-α và interleukin (IL)-1. Việc thực bào các hạt silica dẫn đến cái chết tế bào theo chương trình của đại thực bào và giải phóng các hạt silica độc hại đã bị nuốt trước đó, quá trình này lặp lại sau khi các hạt được các đại thực bào khác tái hấp thu. Với mỗi chu kỳ kích hoạt và phá hủy, các đại thực bào giải phóng các chất trung gian hóa học khởi phát hoặc duy trì tình trạng viêm phế nang, cuối cùng dẫn đến sự phát triển của xơ hóa.
Về mặt bệnh học, quá trình viêm ban đầu được khu trú xung quanh các tiểu phế quản hô hấp nhưng cuối cùng trở nên lan tỏa hơn khắp nhu mô. Quá trình viêm đang diễn ra gây ra sẹo và tạo thành các nốt không tế bào đặc trưng được gọi là nốt silic, bao gồm mô liên kết (Hình 10.1). Các nốt silic được cho là những khu vực nơi chu kỳ đại thực bào nuốt, kích hoạt và phá hủy, và giải phóng các hạt silica độc hại xảy ra. Ban đầu các nốt nhỏ và rời rạc. Khi bệnh tiến triển, chúng trở nên lớn hơn và có thể hợp nhất. Tác động của silica lên phổi một phần liên quan đến tác dụng độc hại đối với các đại thực bào nuốt các hạt này.
Hình ảnh X-quang phổ biến nhất của bệnh bụi phổi silic là các bóng mờ tròn nhỏ hoặc nốt. Dạng này được mô tả là bệnh bụi phổi silic mạn tính đơn thuần.
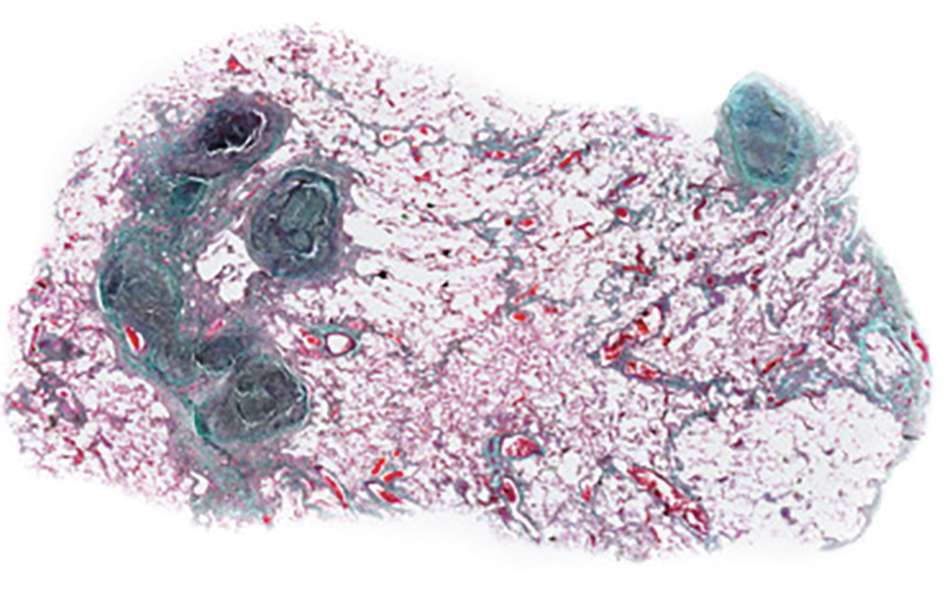
Hình 10.1 Bệnh bụi phổi silic (vi phẫu ở độ phóng đại thấp). Các nốt silic được bao bọc rõ ràng và có nhiều collagen dày đặc (nhuộm Masson trichrome).
Hiếm khi, các nốt trở nên lớn hơn và hợp nhất, trong trường hợp đó bệnh bụi phổi được gọi là thể phức tạp; thuật ngữ xơ hóa khối tiến triển cũng đã được sử dụng (Hình 10.2). Thông thường, các vùng đỉnh phổi ở bệnh nhân mắc bệnh bụi phổi silic bị ảnh hưởng nặng hơn các vùng đáy. Có thể thấy sự phì đại của các hạch bạch huyết rốn phổi, thường bị vôi hóa.
Ngoài vấn đề tiềm ẩn về tổn thương phổi tiến triển và suy hô hấp cuối cùng, sự rối loạn điều hòa miễn dịch có liên quan đến bệnh bụi phổi silic. Bệnh nhân có nguy cơ cao mắc một số bệnh tự miễn, bao gồm viêm khớp dạng thấp và xơ cứng bì hệ thống. Bệnh nhân mắc bệnh bụi phổi silic cũng đặc biệt nhạy cảm với nhiễm trùng mycobacteria, có lẽ do chức năng đại thực bào bị suy giảm. Các sinh vật cụ thể có thể là Mycobacterium tuberculosis, tác nhân gây bệnh lao, hoặc các loài mycobacteria khác, thường được gọi là mycobacteria không điển hình hoặc mycobacteria không lao (xem Chương 25). Thuật ngữ bệnh lao phổi trên nền bụi phổi silic (silicotuberculosis) được sử dụng khi bệnh lao phổi phát triển ở bệnh nhân có nền bệnh bụi phổi silic, và có thể cần các đợt điều trị thuốc chống lao dài hơn so với khi không có bệnh bụi phổi silic. Bệnh bụi phổi silic có liên quan đến rối loạn điều hòa miễn dịch và là một yếu tố nguy cơ cho nhiễm trùng thứ phát bởi mycobacteria.
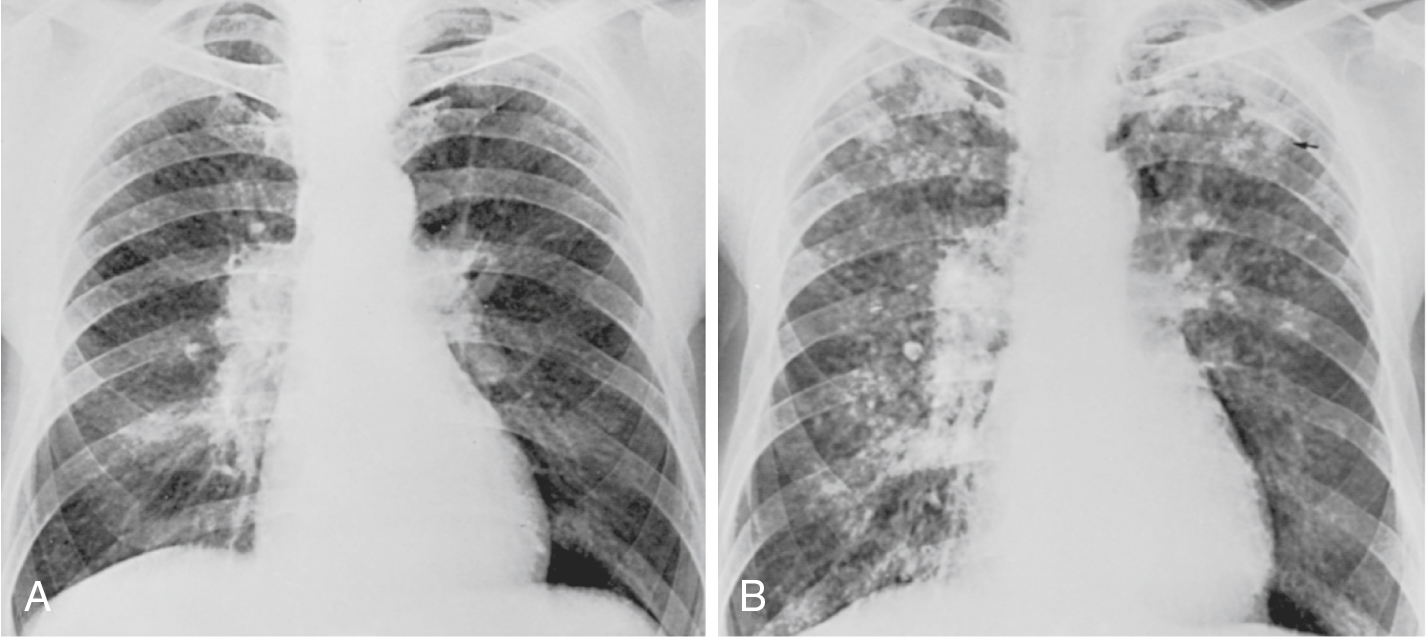
Hình 10.2 Hình ảnh X-quang của (A) bệnh bụi phổi silic đơn thuần và (B) phức tạp ở cùng một bệnh nhân. A, Các nốt nhỏ có mặt khắp cả hai phổi, đặc biệt ở các vùng đỉnh. Cũng có thể thấy một thành phần dạng lưới. B, Các nốt đã trở nên lớn hơn và hợp nhất ở các vùng đỉnh. Một trong những bóng mờ hợp lưu ở bên trái cho thấy sự tạo hang (mũi tên). Khoảng thời gian giữa các phim X-quang trong A và B là 11 năm.
Bệnh Bụi Phổi Than
Những cá nhân đã làm việc trong quá trình khai thác than và đã tiếp xúc với một lượng lớn bụi than có nguy cơ phát triển bệnh bụi phổi than (CWP). So với silica, bụi than là một vật liệu ít sinh xơ hơn, và phản ứng mô ít rõ rệt hơn nhiều đối với cùng một lượng bụi lắng đọng trong phổi. Ngoài vai trò trong sự phát triển của CWP, việc khai thác than cũng dường như có liên quan đến nguy cơ gia tăng của bệnh phổi tắc nghẽn mạn tính (COPD), bao gồm bằng chứng giải phẫu về khí phế thũng thường có phân bố ở trung tâm tiểu thùy. Phản ứng của mô đối với bụi than hít phải ít hơn nhiều so với silica.
Dấu hiệu bệnh học đặc trưng của CWP là đốm than, là một tập hợp khu trú của bụi than được bao quanh bởi sự thâm nhiễm tế bào hoặc xơ hóa tương đối ít (Hình 10.3). Các tổn thương ban đầu có xu hướng phân bố chủ yếu xung quanh các tiểu phế quản hô hấp. Có thể thấy các vùng khí phế thũng nhỏ liên quan, được gọi là khí phế thũng khu trú.
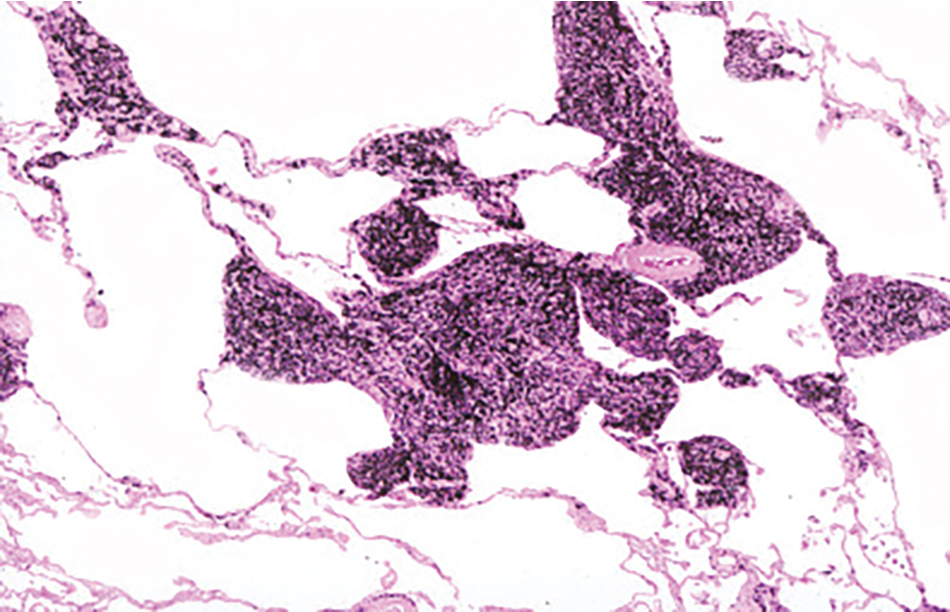
Hình 10.3 Hình ảnh mô học của một đốm bụi than cho thấy sự lắng đọng sắc tố kẽ khu trú. Trong ví dụ này, cũng có thể thấy sự phá hủy các vách phế nang liền kề.
Cũng như bệnh bụi phổi silic, bệnh này thường được chia thành các thể đơn thuần và phức tạp. Trong CWP đơn thuần, X-quang ngực bao gồm các bóng mờ tương đối nhỏ và rời rạc, thường có dạng nốt hơn là dạng đường. Ở giai đoạn này của bệnh, bệnh nhân có ít triệu chứng, và chức năng phổi thường được bảo tồn tương đối. Ở các giai đoạn sau của bệnh, mà chỉ một thiểu số nhỏ các cá nhân tiến triển đến, các dấu hiệu X-quang ngực và các triệu chứng lâm sàng rõ rệt hơn. Với bệnh lan rộng và các bóng mờ hợp nhất trên X-quang ngực, bệnh nhân được cho là mắc CWP phức tạp, còn được gọi là xơ hóa khối tiến triển. Chức năng phổi có thể cho thấy bệnh lý hạn chế, bệnh lý tắc nghẽn, hoặc một dạng hỗn hợp, tùy thuộc vào mức độ tương đối của xơ hóa, bệnh đường thở, và khí phế thũng.
Tại sao bệnh phức tạp phát triển ở một số bệnh nhân CWP vẫn chưa rõ ràng. Có thời điểm, người ta đã suy đoán rằng những bệnh nhân bị xơ hóa khối tiến triển cũng đã tiếp xúc với lượng silica độc hại và việc tiếp xúc đồng thời với silica là nguyên nhân chính của quá trình xơ hóa. Tuy nhiên, mặc dù một số bệnh nhân có dạng bệnh bụi phổi hỗn hợp do cả bụi than và phơi nhiễm silica, xơ hóa khối tiến triển có thể là kết quả của bụi than mà không có sự phơi nhiễm đồng thời với silica. Một số nghiên cứu chỉ ra rằng các đa hình di truyền có thể giúp giải thích các phản ứng lâm sàng khác nhau đối với việc phơi nhiễm qua đường hô hấp. Các triệu chứng và thay đổi chức năng phổi trong CWP có liên quan đến mức độ xơ hóa và COPD cùng tồn tại, nếu có.
Bệnh Bụi Phổi Amiăng
Amiăng, được sử dụng rộng rãi vì khả năng chịu nhiệt và chống cháy, là một dẫn xuất dạng sợi của silica, được gọi là silicat dạng sợi. Nó là một khoáng chất tự nhiên, do hình dạng dài và hẹp, có thể được dệt thành vải. Trong số các mối nguy hiểm cho sức khỏe mà nó gây ra là sự phát triển của xơ hóa kẽ lan tỏa, các mảng và tràn dịch màng phổi lành tính, và khả năng gây ra một số loại khối u ác tính, đặc biệt là carcinoma phế quản và u trung biểu mô. Những vấn đề sau này được thảo luận trong Chương 15, 20, và 21. Thuật ngữ bệnh bụi phổi amiăng (asbestosis) được dành riêng cho bệnh phổi mô kẽ lan tỏa xảy ra do phơi nhiễm amiăng, không chỉ đơn thuần là việc phơi nhiễm amiăng.
Amiăng vẫn là một vấn đề sức khỏe lớn ở nhiều nước đang phát triển nơi khoáng sản này được khai thác và sử dụng trong các ứng dụng công nghiệp. Những cá nhân có nguy cơ phát triển bệnh bụi phổi amiăng bao gồm thợ mỏ amiăng; công nhân cách nhiệt, đóng tàu, và xây dựng; và những người đã tiếp xúc do làm việc với má phanh. Mặc dù các mối nguy hiểm sức khỏe của amiăng đã được công nhận rộng rãi và việc sử dụng amiăng đã bị hạn chế ở các nước công nghiệp hóa, công nhân vẫn có thể bị phơi nhiễm trong quá trình phá dỡ, sửa chữa, hoặc tái cách nhiệt các đường ống hoặc các tòa nhà mà amiăng đã được sử dụng. Thời gian phơi nhiễm cần thiết để phát triển bệnh bụi phổi amiăng thường là hơn 10 đến 20 năm nhưng có thể thay đổi tùy thuộc vào cường độ phơi nhiễm.
Một giả thuyết về cơ chế bệnh sinh của bệnh bụi phổi amiăng cho rằng các sợi amiăng trực tiếp làm tổn thương các tế bào biểu mô phổi ở các tiểu phế quản hô hấp và chỗ chia đôi của ống phế nang, gây ra việc giải phóng các chất trung gian thu hút các tế bào viêm, bao gồm đại thực bào, bạch cầu trung tính và lympho bào. Không giống như silica, amiăng có lẽ không gây độc cho đại thực bào. Tức là, nó dường như không phá hủy hay “giết chết” đại thực bào theo cách mà silica làm. Cơ chế của phản ứng xơ hóa xảy ra với amiăng có thể liên quan đến việc giải phóng các chất trung gian từ đại thực bào (ví dụ: yếu tố tăng trưởng biến đổi [TGF]-β, TNF-α, fibronectin, yếu tố tăng trưởng giống insulin [IGF]-1, và yếu tố tăng trưởng có nguồn gốc từ tiểu cầu) có thể thúc đẩy sự tuyển mộ và sao chép của nguyên bào sợi. Một lĩnh vực nghiên cứu tích cực liên quan đến việc nghiên cứu tác động của sợi amiăng lên việc khởi phát các bất thường trong sự chết theo chương trình và tăng sinh của tế bào biểu mô phế nang. Các đa hình di truyền trong TGF-β và TNF-α đã được liên kết với sự tăng nhạy cảm với các tác động độc hại của amiăng.
Các tổn thương vi thể sớm nhất xuất hiện xung quanh các tiểu phế quản hô hấp, với tình trạng viêm tiến triển thành xơ hóa quanh tiểu phế quản. Sau đó, xơ hóa trở nên tổng quát hơn khắp các thành phế nang và có thể trở nên khá rõ rệt. Các khu vực của phổi bị ảnh hưởng nặng nề bởi quá trình xơ hóa bao gồm đáy phổi và các vùng dưới màng phổi.
Một phát hiện đặc trưng của phơi nhiễm amiăng là thể ferruginous, một thể hình que dưới kính hiển vi với các đầu hình dùi trống (Hình 10.4) có màu vàng nâu trong mô nhuộm.
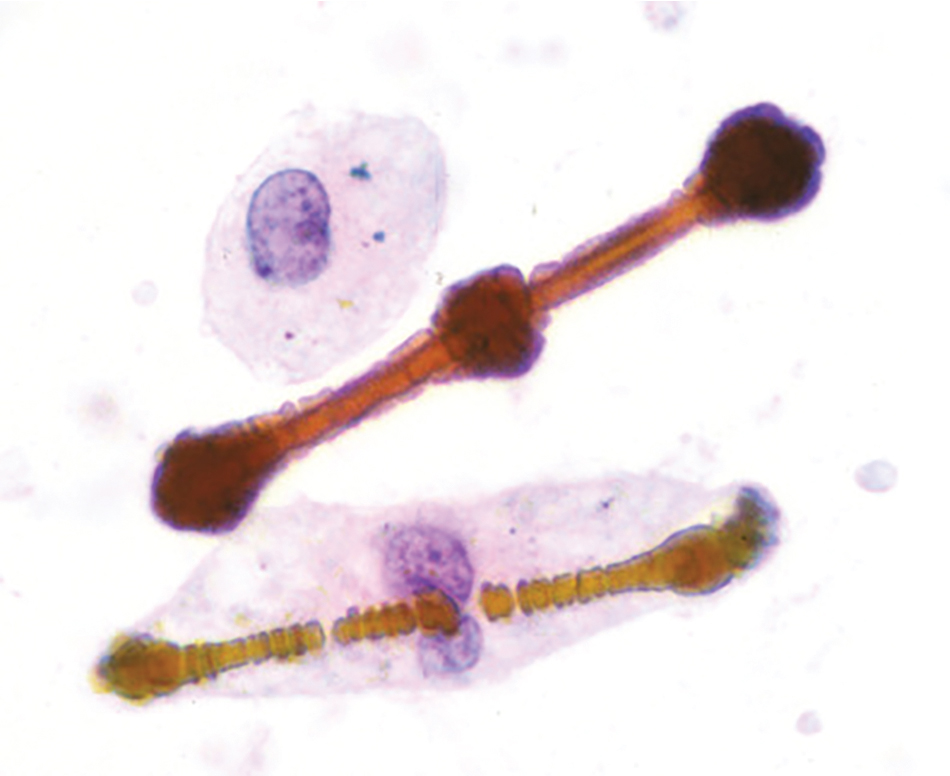
Hình 10.4 Vi phẫu ở độ phóng đại cao của các thể amiăng trong một mẫu tế bào học đờm. Các thể hình que với đầu hình dùi trống đại diện cho các sợi amiăng “được bao bọc”.
Thể sắt (Thể ferruginous) đại diện cho các sợi amiăng đã được đại thực bào bao bọc bởi một phức hợp sắt-protein. Mặc dù số lượng lớn các cấu trúc này thường được thấy bằng kính hiển vi quang học ở những bệnh nhân mắc bệnh bụi phổi amiăng, không phải tất cả các sợi được bao bọc như vậy đều là amiăng, và các thể sắt có thể được thấy ngay cả khi không có bệnh phổi mô kẽ. Các sợi amiăng không được bao bọc, dài và hẹp, không thể nhìn thấy bằng kính hiển vi quang học và cần kính hiển vi điện tử để phát hiện. Trong bệnh bụi phổi amiăng, việc kiểm tra mô phổi bằng kính hiển vi quang học thường cho thấy số lượng lớn các thể sắt.
Trên X-quang ngực của bệnh nhân mắc bệnh bụi phổi amiăng cho thấy một hình ảnh các dải mờ dạng đường thường nổi bật nhất ở đáy phổi (Hình 10.5A). Trong các trường hợp tiến triển, các phát hiện có thể khá lan rộng và liên quan đến việc tạo nang và hình ảnh tổ ong. Thường có bằng chứng về bệnh màng phổi liên quan, dưới dạng dày màng phổi lan tỏa hoặc các mảng khu trú (có thể bị vôi hóa) hoặc, ít thường xuyên hơn nhiều, dưới dạng tràn dịch màng phổi (Hình 10.5B). Bởi vì amiăng là một yếu tố nguy cơ trong sự phát triển của các khối u ác tính của phổi và màng phổi, một trong hai biến chứng này có thể được thấy trên X-quang ngực.
Các biến chứng phổi của phơi nhiễm amiăng như sau:
- Bệnh phổi mô kẽ lan tỏa (bệnh bụi phổi amiăng)
- Dày màng phổi lan tỏa
- Mảng màng phổi khu trú
- Tràn dịch màng phổi
- Ung thư phổi
- U ác tính màng phổi (u trung biểu mô)
Các đặc điểm lâm sàng, sinh lý bệnh và chẩn đoán của bệnh bụi phổi amiăng thường tuân theo mô tả chung về bệnh phổi mô kẽ lan tỏa đã thảo luận trong Chương 9. Tuy nhiên, trong số các bệnh bụi phổi đã thảo luận, bệnh bụi phổi amiăng có nhiều khả năng liên quan đến ngón tay dùi trống được thấy khi khám thực thể hơn là bệnh bụi phổi silic hay CWP.
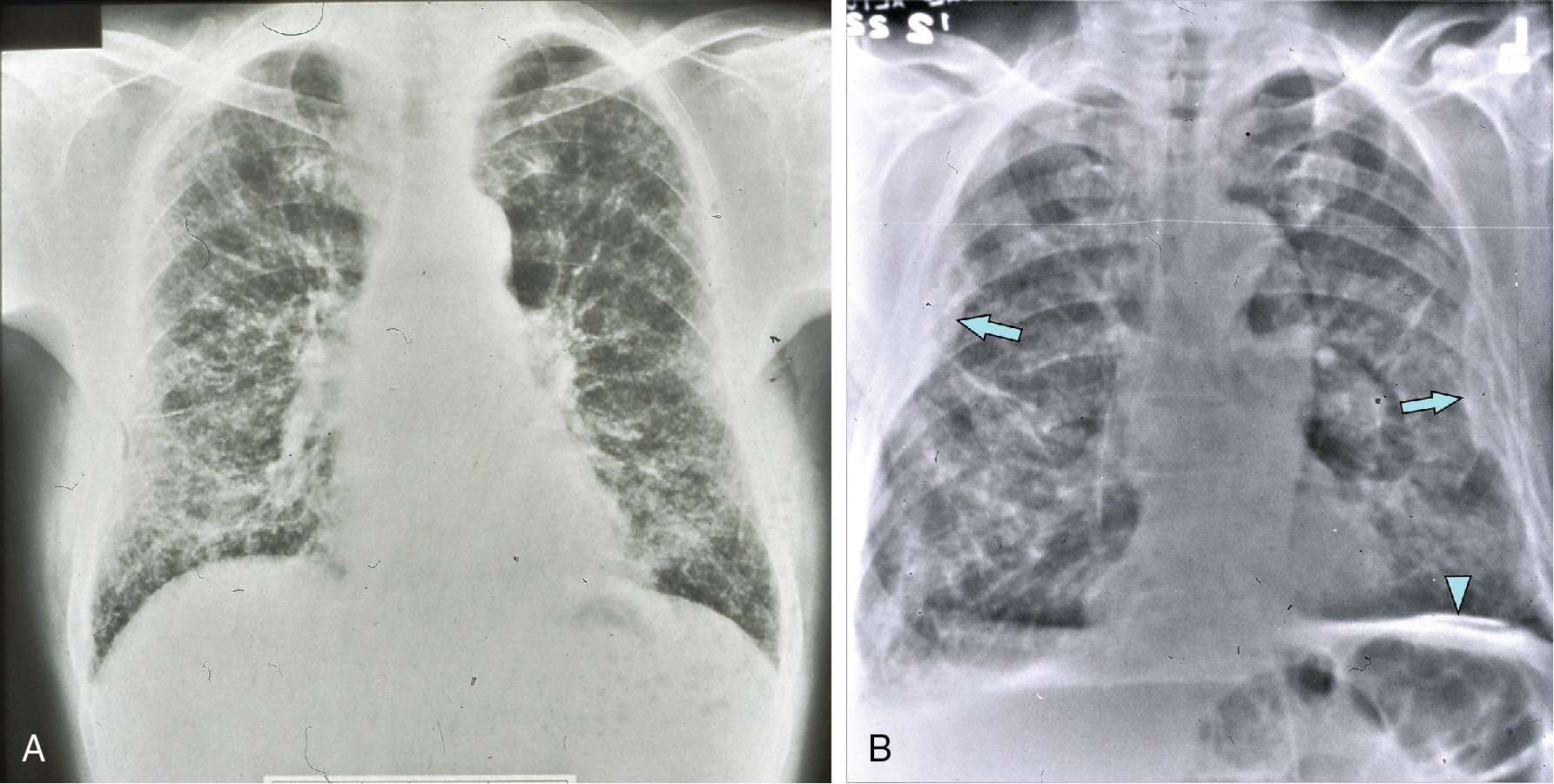
Hình 10.5 X-quang ngực cho thấy bệnh nhu mô và màng phổi thứ phát do phơi nhiễm amiăng. A, Bệnh phổi kẽ lan rộng ở bệnh nhân mắc bệnh bụi phổi amiăng. B, Tăng các dải mờ kẽ và bệnh màng phổi (mũi tên) với vôi hóa cơ hoành (đầu mũi tên), do phơi nhiễm amiăng trước đó.
Bệnh Bụi Phổi Beryllium
Bệnh bụi phổi Beryllium là một bệnh bụi phổi do hít phải bụi của kim loại beryllium. Bệnh ban đầu được mô tả ở những người sản xuất bóng đèn huỳnh quang, nhưng các trường hợp gần đây hơn liên quan đến công nhân trong các ngành công nghiệp hàng không vũ trụ, vũ khí hạt nhân và điện tử và các doanh nghiệp khác nơi beryllium được sử dụng. Hình ảnh mô học của bệnh do beryllium gây ra khá khác so với những gì thấy ở các bệnh bụi phổi khác đã được mô tả trước đó. Trong bệnh bụi phổi beryllium, phản ứng bệnh lý được tìm thấy trong phổi cũng như các hạch bạch huyết rốn phổi và trung thất và liên quan đến sự hình thành các u hạt giống như những u hạt thấy trong bệnh sarcoidosis.
Bệnh bụi phổi beryllium, giống bệnh sarcoidosis ở nhiều khía cạnh, đại diện cho một đáp ứng miễn dịch qua trung gian tế bào đối với beryllium. Bệnh bụi phổi beryllium hiện được biết là đại diện cho một đáp ứng miễn dịch qua trung gian tế bào (quá mẫn muộn) đối với beryllium. Các lympho bào thu được từ máu hoặc dịch rửa phế quản-phế nang (BAL) của bệnh nhân mắc bệnh bụi phổi beryllium cho thấy sự tăng sinh và biến đổi khi tiếp xúc với muối beryllium trong ống nghiệm. “Xét nghiệm tăng sinh lympho bào với beryllium” này không chỉ gợi ý về cơ chế bệnh sinh của bệnh mà còn là một xét nghiệm chẩn đoán hữu ích ở những cá nhân có biểu hiện lâm sàng phù hợp với bệnh bụi phổi beryllium. Ngoài ra, sự mẫn cảm với beryllium có thể được chứng minh ở một số công nhân trước khi khởi phát bệnh lâm sàng, một phát hiện có thể quan trọng để phòng ngừa hoặc can thiệp sớm nhằm ngăn chặn sự tiến triển từ bệnh cận lâm sàng sang bệnh lâm sàng.
Các khía cạnh của cơ chế bệnh sinh của bệnh phổi beryllium vẫn đang được làm sáng tỏ. Theo hiểu biết hiện tại, sau khi được hít vào, beryllium đến các phế nang, kết hợp với các kháng nguyên bạch cầu người trên bề mặt của các tế bào trình diện kháng nguyên (APC), và làm mẫn cảm các lympho bào CD4⁺. Trong các hạch bạch huyết, APC thúc đẩy sự mở rộng của các tế bào CD4⁺ đặc hiệu với beryllium, chúng giải phóng một số cytokine, bao gồm IL-2, IFN-γ, và TNF-α. Việc tiết ra IFN-γ và TNF-α rất quan trọng trong việc tuyển mộ các đại thực bào và sự hình thành các u hạt. Chỉ một thiểu số người tiếp xúc với beryllium phát triển bệnh. Sự biến đổi bẩm sinh trong các phức hợp hòa hợp mô chính ảnh hưởng đến phản ứng của APC đối với beryllium. Một dạng của sự nhạy cảm này được xác định bởi sự hiện diện của glutamate ở vị trí 69 của phân tử kháng nguyên bạch cầu người DPB1.
Về mặt lâm sàng và X-quang, bệnh này rất giống với bệnh sarcoidosis (xem Chương 11). Cụ thể, bệnh nhân mắc bệnh bụi phổi beryllium cho thấy tình trạng viêm u hạt trong nhu mô phổi và các hạch bạch huyết trong lồng ngực. Mặc dù có thể xảy ra tổn thương ngoài lồng ngực, nhưng nó ít phổ biến hơn so với bệnh sarcoidosis. Không giống như CWP và bệnh bụi phổi amiăng, trong đó xơ hóa là bệnh lý chính và ức chế miễn dịch không hiệu quả, bệnh bụi phổi beryllium đại diện cho tình trạng quá mẫn muộn với beryllium. Do đó, những bệnh nhân có triệu chứng và bất thường chức năng phổi do bệnh bụi phổi beryllium thường được điều trị bằng corticosteroid toàn thân, điển hình là prednisone uống, để ức chế đáp ứng miễn dịch.
VIÊM PHỔI TĂNG MẪN CẢM
Trong viêm phổi tăng mẫn cảm, các hiện tượng miễn dịch chống lại một kháng nguyên là nguyên nhân gây ra bệnh phổi mô kẽ lan tỏa. Rối loạn này đôi khi được gọi là viêm phế nang dị ứng ngoại lai. Các kháng nguyên gây ra chuỗi các sự kiện miễn dịch là các hạt hít phải và các kháng nguyên dạng khí dung từ nhiều nguồn khác nhau. Hầu hết tất cả các kháng nguyên đều có nguồn gốc từ vi sinh vật, protein thực vật và protein động vật. Việc phơi nhiễm thường liên quan đến nghề nghiệp hoặc một sở thích nào đó của bệnh nhân. Loại viêm phổi tăng mẫn cảm đầu tiên được mô tả là bệnh phổi của nông dân, là do các kháng nguyên từ vi sinh vật (xạ khuẩn ưa nhiệt) có thể có trên cỏ khô bị mốc. Danh sách các kháng nguyên và các loại phơi nhiễm khá phong phú và bao gồm các thực thể như bệnh phổi do điều hòa không khí hoặc máy làm ẩm (gây ra bởi các kháng nguyên từ vi sinh vật làm ô nhiễm hệ thống không khí cưỡng bức) và bệnh phổi của người nuôi chim (do các protein của chim). Trong một thực thể được gọi là “bệnh phổi bồn nước nóng,” các kháng nguyên gây bệnh là từ mycobacteria không lao, phổ biến nhất là các sinh vật được phân loại là phức hợp Mycobacterium avium, làm ô nhiễm nước trong bồn nước nóng. Viêm phổi tăng mẫn cảm đại diện cho một đáp ứng miễn dịch đối với một kháng nguyên hữu cơ hít phải.
Thật thú vị, ngay cả khi một số lượng lớn các cá nhân tiếp xúc với một kháng nguyên nhất định do nghề nghiệp hoặc sở thích của họ, bệnh chỉ phát triển ở một tỷ lệ nhỏ. Hiểu biết hiện tại về cơ chế bệnh sinh của viêm phổi tăng mẫn cảm chỉ ra rằng, ở những cá nhân có khuynh hướng di truyền, việc tiếp xúc lặp đi lặp lại với một kháng nguyên môi trường cụ thể (một “tác nhân gây khởi phát”) sẽ kích hoạt một chuỗi các sự kiện qua trung gian miễn dịch dẫn đến các biểu hiện lâm sàng. Hầu hết các đa hình di truyền liên quan đến viêm phổi tăng mẫn cảm đều liên quan đến các con đường xử lý hoặc trình diện kháng nguyên.
Mặc dù đã có nhiều nghiên cứu, chúng ta vẫn chưa hiểu đầy đủ về cơ chế bệnh sinh của viêm phổi tăng mẫn cảm. Một bước đầu tiên dường như là, ở những cá nhân có khuynh hướng di truyền, việc nhận dạng kháng nguyên lặp đi lặp lại bởi các thụ thể nhận dạng mẫu trên các APC của hệ miễn dịch bẩm sinh dẫn đến sự phiên mã của các cytokine tiền viêm và interferon. Một phản ứng miễn dịch loại IV (qua trung gian tế bào hoặc quá mẫn muộn, qua trung gian của các lympho bào T) gây ra viêm phế nang thể lympho bào được biết là có tầm quan trọng hàng đầu trong việc gây ra bệnh. Một cơ chế loại III (bệnh phức hợp miễn dịch) đóng một vai trò góp phần, đặc biệt là trong bệnh cấp tính. Bằng chứng cho thấy các lympho bào T ở đường hô hấp dưới trở nên mẫn cảm với kháng nguyên hữu cơ cụ thể. Sau đó, chúng có thể giải phóng các cytokine hòa tan thu hút các đại thực bào và có thể khiến chúng hình thành các u hạt trong phổi. Các phức hợp miễn dịch kháng nguyên-kháng thể cũng có thể tham gia, với sự gắn kết của bổ thể và kết quả là sản xuất các yếu tố hóa ứng động và kích hoạt các đại thực bào.
Kiểm tra bệnh học của phổi ở bệnh nhân viêm phổi tăng mẫn cảm cho thấy một tình trạng viêm phế nang bao gồm chủ yếu là các lympho bào và đại thực bào, cũng như sự hiện diện của các u hạt (Hình 10.6). Các u hạt thường được hình thành lỏng lẻo, không giống như các u hạt được xác định rõ đặc trưng của bệnh bụi phổi beryllium và bệnh sarcoidosis (xem Chương 11). Thường thì các thay đổi bệnh lý có sự nổi bật ở vùng quanh tiểu phế quản, do đó giải thích cho bằng chứng sinh lý thường xuyên về sự tắc nghẽn của các đường thở nhỏ.
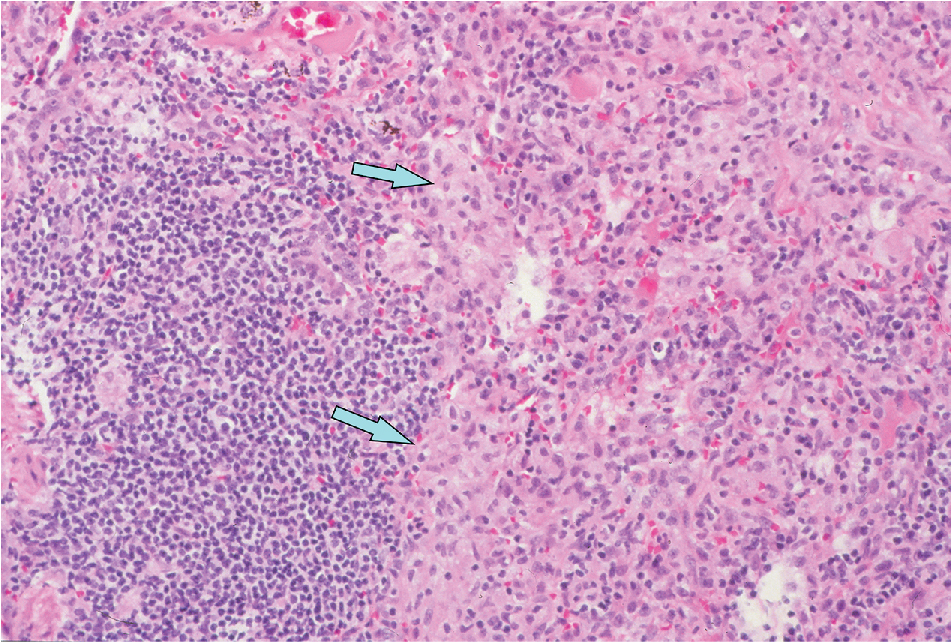
Hình 10.6 Bệnh học của viêm phổi tăng mẫn cảm, cho thấy một quá trình viêm mạn tính với các lympho bào nhỏ, đại thực bào và các u hạt hình thành kém (mũi tên).
Về mặt lâm sàng, viêm phổi tăng mẫn cảm biểu hiện theo nhiều cách khác nhau, từ các đợt cấp tính gồm khó thở, ho, sốt, và thâm nhiễm trên X-quang ngực (xảy ra khoảng 4-6 giờ sau khi tiếp xúc với kháng nguyên gây bệnh) đến một dạng mạn tính của bệnh phổi mô kẽ lan tỏa. Biểu hiện sau này có tính chất âm thầm hơn. Bệnh nhân thường báo cáo sự khởi phát dần dần của khó thở và ho, cùng với các triệu chứng toàn thân như mệt mỏi, chán ăn, và sụt cân. Việc tiếp xúc với kháng nguyên trong thời gian dài đã xảy ra trong những trường hợp này, và, bởi vì các đợt cấp không nhất thiết là một đặc điểm quan trọng, bệnh nhân không liên kết các triệu chứng với bất kỳ sự phơi nhiễm cụ thể nào. Viêm phổi tăng mẫn cảm xảy ra hoặc với các đợt cấp 4 đến 6 giờ sau khi tiếp xúc với kháng nguyên gây bệnh hoặc với diễn biến âm thầm hơn của bệnh phổi mô kẽ lan tỏa mạn tính.
Không giống như dạng cấp tính, dạng mạn tính của viêm phổi tăng mẫn cảm có thể hoạt động giống như các dạng khác của bệnh phổi mô kẽ xơ hóa, giống và bắt chước xơ phổi vô căn. Trừ khi bác sĩ chú ý đến khả năng rằng sự tăng mẫn cảm với một kháng nguyên trong môi trường có thể là nguyên nhân gây bệnh phổi của bệnh nhân, thực thể này có thể dễ dàng bị bỏ sót, và việc tiếp xúc với kháng nguyên có thể tiếp tục.
Với một đợt cấp của viêm phổi tăng mẫn cảm, X-quang ngực cho thấy các thâm nhiễm dạng đám hoặc lan tỏa. Khi bệnh trở nên mạn tính, bất thường có thể có chất lượng dạng nốt hơn, cuối cùng xuất hiện dưới dạng lưới nốt đặc trưng của các bệnh phổi mô kẽ lan tỏa mạn tính khác. Trong dạng mạn tính của bệnh, thường thấy sự ưu thế của các thay đổi X-quang ở thùy trên. Chụp cắt lớp vi tính lồng ngực độ phân giải cao (CT) có thể đặc biệt hữu ích trong việc gợi ý chẩn đoán, thường cho thấy một hình ảnh kính mờ khảm (xem Hình 3.9). Một sự phân biệt quan trọng, có thể được gợi ý bởi hình ảnh X-quang, là liệu có xơ hóa hay không. Điều này đã dẫn đến một khuôn khổ hiện đang được sử dụng để phân loại viêm phổi tăng mẫn cảm là thể xơ hóa hoặc không xơ hóa. Sự phân biệt giữa viêm phổi tăng mẫn cảm thể xơ hóa và không xơ hóa có ý nghĩa liên quan đến cả tiên lượng và khả năng cải thiện khi loại bỏ kháng nguyên và đáp ứng với điều trị.
Chẩn đoán có nhiều khả năng được xem xét hơn nếu bệnh nhân có tiền sử các đợt cấp xảy ra đơn lẻ hoặc xen kẽ với một bệnh mạn tính hơn. Các đặc điểm tiền sử liên quan đến nghề nghiệp, sở thích, và các phơi nhiễm môi trường khác của bệnh nhân có thể cung cấp những manh mối có giá trị để phát hiện yếu tố gây bệnh.
Một xét nghiệm chẩn đoán là tìm kiếm các kháng thể kết tủa đối với các kháng nguyên hữu cơ phổ biến được biết là gây ra viêm phổi tăng mẫn cảm. Thật không may, sự hiện diện của các kháng thể chỉ cho thấy sự phơi nhiễm chứ không nhất thiết là bệnh. Ví dụ, việc tìm thấy các kháng thể kết tủa đối với xạ khuẩn ưa nhiệt, tác nhân gây ra bệnh phổi của nông dân, là tương đối phổ biến ở những nông dân khỏe mạnh không có bất kỳ bằng chứng nào về bệnh. Ngoài ra, việc hỗ trợ chẩn đoán viêm phổi tăng mẫn cảm bằng cách tìm thấy các kháng thể kết tủa đòi hỏi kháng nguyên gây bệnh phải được bao gồm trong bảng kháng nguyên được xét nghiệm, điều này không phải lúc nào cũng có thể.
Nếu sinh thiết phổi được thực hiện để chẩn đoán bệnh phổi mô kẽ lan tỏa, các phát hiện khi kiểm tra dưới kính hiển vi thường bao gồm viêm mạn tính và các u hạt nhỏ, không rõ ràng, không hoại tử, như đã mô tả ở trên.
Phương pháp điều trị tốt nhất là tránh phơi nhiễm. Thật không may, dạng mạn tính của bệnh thường dẫn đến những thay đổi xơ hóa không thể đảo ngược trong phổi mà vẫn tồn tại sau khi việc phơi nhiễm đã chấm dứt. Đối với những bệnh nhân bị bệnh nặng hoặc những người mà việc tránh kháng nguyên không dẫn đến sự thuyên giảm, việc sử dụng corticosteroid được xem xét, nhưng kết quả rất khác nhau. Các thử nghiệm với các tác nhân chống xơ hóa đang được tiến hành ở những bệnh nhân phát triển các thay đổi xơ hóa mạn tính.
BỆNH PHỔI MÔ KẼ DO THUỐC
Khi danh sách các tác nhân dược lý có sẵn mở rộng mỗi năm, danh sách các biến chứng tiềm ẩn cũng vậy. Phổi chắc chắn là một trong những cơ quan đích cho các tác dụng phụ này, và bệnh phổi mô kẽ lan tỏa là một biểu hiện đặc biệt quan trọng của độc tính thuốc. Điều bắt buộc là phải xem xét độc tính của thuốc ở tất cả các bệnh nhân phát triển bệnh phổi mô kẽ lan tỏa. Mỗi loại thuốc không thể được xem xét chi tiết ở đây, cũng không thể cung cấp một danh sách đầy đủ về số lượng ngày càng tăng các loại thuốc đã được liên quan. Tuy nhiên, chương này thảo luận ngắn gọn về các nguyên tắc chung của bệnh phổi mô kẽ do thuốc và các tác nhân chính gây ra.
Các nhóm thuốc chính liên quan đến bệnh của thành phế nang, cùng với các ví dụ về mỗi nhóm, được trình bày trong Bảng 10.1. Một nhóm lớn bao gồm các tác nhân hóa trị liệu hoặc gây độc tế bào truyền thống, các loại thuốc được thiết kế chủ yếu như các tác nhân chống ung thư.
BẢNG 10.1 Các Thuốc Chọn Lọc Có Khả Năng Gây Bệnh Phổi Mô Kẽ Lan Tỏa
| Hóa Trị Độc Tế Bào |
|
| Thuốc Chống Chuyển Hóa |
|
| Thuốc Sinh Học Đích |
Khác
|
| Thuốc Khác
|
|
| Hội Chứng Do Thuốc |
|
Các loại thuốc riêng lẻ thường được liên quan đến sự phát triển của bệnh phổi bao gồm bleomycin, mitomycin, busulfan, cyclophosphamide, gemcitabine, taxanes, và các nitrosoureas, mặc dù một số loại khác đã được mô tả trong số lượng trường hợp nhỏ hơn. Gần đây, viêm phổi nặng và có khả năng gây tử vong đã được ghi nhận do liệu pháp miễn dịch ức chế điểm kiểm soát nhắm vào protein-4 liên quan đến tế bào lympho T gây độc (CTLA-4) hoặc các protein ức chế chết tế bào theo chương trình (PD-1 và PD-L1). Nhìn chung, nguy cơ phát triển bệnh phổi mô kẽ lan tỏa tăng lên với liều tích lũy cao hơn của một tác nhân cụ thể, nhưng đôi khi các trường hợp với liều tích lũy tương đối thấp cũng được mô tả. Trong hầu hết các trường hợp, bệnh phổi mô kẽ lan tỏa phát triển trong khoảng thời gian từ 1 tháng đến vài năm sau khi sử dụng tác nhân, nhưng một số tác nhân cũng có thể liên quan đến sự phát triển của bệnh cấp tính hơn. Busulfan đặc biệt đáng chú ý vì sự phát triển muộn của các biến chứng, thường là vài năm sau khi bắt đầu điều trị. Một loạt các nhóm thuốc khác nhau có liên quan đến bệnh phổi mô kẽ lan tỏa.
Cơ chế bệnh sinh của bệnh phổi mô kẽ lan tỏa do hóa trị liệu thường dường như liên quan đến hoặc là độc tính trực tiếp đối với các tế bào nhu mô phổi bình thường, đặc biệt là các tế bào biểu mô, hoặc là tổn thương oxy hóa do sự tạo ra các gốc oxy độc hại. Khi có tổn thương oxy hóa, như với bleomycin, các tác nhân khác thúc đẩy sự hình thành các gốc oxy tự do (ví dụ: xạ trị, nồng độ oxy hít vào cao) có thể làm tăng thêm tổn thương do tác nhân hóa trị liệu gây ra.
Hình ảnh bệnh học của bệnh phổi mô kẽ lan tỏa do các tác nhân gây độc tế bào gây ra thường đáng chú ý bởi sự hiện diện của các tế bào biểu mô phế nang loại II không điển hình, hình dạng kỳ quái với nhân tăng sắc. Khi đặc điểm này liên quan đến các phát hiện thông thường khác của bệnh phổi mô kẽ lan tỏa, nhà giải phẫu bệnh nên nghi ngờ rằng một tác nhân hóa trị liệu có thể là nguyên nhân. Bệnh phổi mô kẽ lan tỏa do thuốc gây độc tế bào cho thấy các tế bào biểu mô phế nang loại II không điển hình, hình dạng kỳ quái.
Methotrexate, một chất chống chuyển hóa ảnh hưởng đến chuyển hóa axit folic, được sử dụng ở liều thấp để điều trị viêm khớp dạng thấp và các bệnh thấp khớp khác, và ở liều cao hơn như một tác nhân chống ung thư, đặc biệt là để điều trị các bệnh ác tính huyết học. Một cơ chế quá mẫn dường như đóng một vai trò quan trọng trong cơ chế bệnh sinh của viêm phổi do methotrexate, bằng chứng là sự hiện diện thường xuyên của các u hạt trên bệnh học.
Các tác nhân sinh học, một nhóm thuốc lớn và đang tăng nhanh được phát triển từ các nguồn sinh học và thường liên quan đến việc sử dụng công nghệ gen tái tổ hợp, thường là các kháng thể đơn dòng hoặc các chất ức chế khác nhắm vào các cytokine và một loạt các con đường truyền tín hiệu. Ngoài việc điều trị ung thư, một số tác nhân này được sử dụng để điều trị các bệnh viêm hệ thống hoặc liên quan đến miễn dịch. Mặc dù tần suất độc tính trên phổi với hầu hết các tác nhân này là khá thấp, khả năng một biến chứng liên quan đến thuốc nên được xem xét ở bất kỳ bệnh nhân nào đang dùng một trong những tác nhân này mà phát triển bệnh phổi mô kẽ.
Một số loại thuốc không phải là tác nhân hóa trị liệu hoặc sinh học đã được liên quan đến sự phát triển của bệnh phổi mô kẽ. Nitrofurantoin, một loại kháng sinh, đã được liên kết với cả phản ứng cấp tính và mạn tính. Vấn đề cấp tính, được cho là một hiện tượng quá mẫn, thường được đặc trưng bởi thâm nhiễm phổi, tràn dịch màng phổi, sốt, và tăng bạch cầu ái toan trong máu ngoại vi. Vấn đề mạn tính, dường như không liên quan đến các đợt cấp trước đó, được đặc trưng bởi một viêm phổi kẽ không đặc hiệu và xơ hóa tương tự như của các bệnh phổi mô kẽ lan tỏa khác.
Thuốc chống loạn nhịp thường được sử dụng amiodarone có liên quan đến bệnh phổi mô kẽ có ý nghĩa lâm sàng ở khoảng 1% đến 5% bệnh nhân được điều trị. Độc tính phổi của amiodarone phụ thuộc vào liều và có thể gây tử vong. Ngoài viêm và xơ hóa không đặc hiệu, hình ảnh bệnh học của bệnh phổi mô kẽ lan tỏa do amiodarone gây ra đáng chú ý bởi các đại thực bào có vẻ bọt do các thể vùi phospholipid trong bào tương. Tuy nhiên, các đại thực bào dạng bọt tương tự với các thể vùi trong bào tương có thể được thấy trong mô phổi của những bệnh nhân được điều trị bằng amiodarone mà không có viêm kẽ và xơ hóa. Phát hiện này cho thấy rằng các thể vùi phospholipid là một dấu hiệu của việc sử dụng amiodarone nhưng không nhất thiết phải chịu trách nhiệm trực tiếp cho các hậu quả bệnh lý và lâm sàng quan trọng khác của amiodarone trên phổi. Về mặt X-quang, bệnh nhân bị bệnh phổi do amiodarone có thể phát triển các thâm nhiễm khu trú hoặc lan tỏa. Chụp CT thường cho thấy thâm nhiễm có đậm độ tương đối cao, là kết quả của hàm lượng iod cao trong phân tử amiodarone. Bệnh phổi do amiodarone là một nguyên nhân quan trọng của thâm nhiễm phổi khu trú hoặc lan tỏa.
Một số lượng lớn các loại thuốc đã được liên kết với sự phát triển của một bệnh giống như lupus ban đỏ hệ thống, và bệnh nhân mắc “lupus do thuốc” này có thể có bệnh phổi mô kẽ là một biểu hiện. Ngoài ra, một loạt các loại thuốc đã được liên kết với thâm nhiễm phổi và tăng bạch cầu ái toan trong máu ngoại vi. Tổ hợp thâm nhiễm phổi với tăng bạch cầu ái toan này, trong đó thuốc chỉ là một trong số các nguyên nhân có thể, thường được viết tắt là hội chứng PIE.
Về mặt lâm sàng, sốt là một triệu chứng đi kèm phổ biến với các triệu chứng hô hấp liên quan đến bệnh phổi mô kẽ lan tỏa do thuốc. Sự gia tăng bạch cầu ái toan trong máu ngoại vi thường được ghi nhận ở những bệnh nhân bị bệnh phổi do methotrexate và là đặc trưng của những bệnh nhân mắc hội chứng PIE.
Khi thâm nhiễm phổi phát triển ở những bệnh nhân bị bệnh ác tính hoặc bất kỳ ai đang dùng một loại thuốc liên quan đến ức chế đáp ứng miễn dịch, một số cân nhắc chẩn đoán nảy sinh, đặc biệt là khi biểu hiện lâm sàng đi kèm với sốt. Ngoài khả năng độc tính của thuốc, còn có mối lo ngại về nhiễm trùng (vì hệ thống phòng thủ của vật chủ có thể bị suy yếu do thuốc hoặc bệnh ác tính tiềm ẩn), sự lan tràn của bệnh ác tính qua phổi, chảy máu trong phổi, và, ở những bệnh nhân đã được xạ trị, các tác động độc hại từ chiếu xạ. Khi chẩn đoán không rõ ràng, một thủ thuật chẩn đoán như sinh thiết phổi hoặc BAL thường được thực hiện, chủ yếu để loại trừ một quá trình nhiễm trùng. Nếu tìm thấy các tế bào biểu mô không điển hình nhưng không có tác nhân nhiễm trùng nào, một quá trình do thuốc gây ra sẽ bị nghi ngờ.
Đối với những bệnh nhân được cho là bị bệnh phổi mô kẽ lan tỏa liên quan đến thuốc, lý tưởng nhất là nên ngưng sử dụng thuốc. Corticosteroid có thể được sử dụng, nhưng, cũng như việc sử dụng chúng trong các bệnh mô kẽ lan tỏa khác, kết quả rất khác nhau.
BỆNH PHỔI DO XẠ TRỊ
Bệnh phổi mô kẽ là một biến chứng tiềm ẩn của xạ trị đối với các khối u bên trong hoặc gần lồng ngực, đặc biệt là u lympho (lymphoma Hodgkin) và carcinoma vú hoặc phổi. Tỷ lệ mắc tổn thương có biểu hiện lâm sàng tăng lên với liều bức xạ cao hơn, một trường chiếu xạ lớn hơn, và việc sử dụng hóa trị đồng thời. Nguy cơ cao nhất ở ung thư phổi (5%-25%), tiếp theo là u lympho trung thất (5%-10%) và ung thư vú (1%-5%). Tuy nhiên, những thay đổi trên X-quang mà không có triệu chứng còn được thấy thường xuyên hơn, ở 20% đến 70% bệnh nhân bị phơi nhiễm.
Bệnh phổi do bức xạ thường được chia thành hai giai đoạn: viêm phổi sớm và xơ hóa muộn. Giai đoạn cấp tính của viêm phổi do bức xạ thường phát triển từ 1 đến 3 tháng sau khi hoàn thành một liệu trình điều trị và phụ thuộc vào tổng liều và thể tích phổi được chiếu xạ. Giai đoạn sau của xơ hóa do bức xạ có thể theo sau trực tiếp viêm phổi do bức xạ trước đó, có thể xảy ra sau một khoảng thời gian tiềm ẩn không có triệu chứng, hoặc đôi khi có thể phát triển mà không có bất kỳ bằng chứng lâm sàng nào trước đó về viêm phổi cấp tính. Xơ hóa, khi xảy ra, thường diễn ra từ 6 đến 12 tháng sau khi xạ trị đã hoàn tất. Bệnh phổi do bức xạ bao gồm một giai đoạn sớm của viêm phổi do bức xạ và một giai đoạn sau của xơ hóa do bức xạ.
Tổn thương phổi do bức xạ là kết quả của sự kết hợp giữa tổn thương trực tiếp đến các tế bào phổi bình thường và sự cảm ứng các con đường xơ hóa. Tổn thương sớm đến các tế bào nội mô mao mạch phổi dẫn đến tăng tính thấm. Tổn thương các tế bào loại I và loại II xảy ra sau đó, dẫn đến việc sản xuất các cytokine và tuyển mộ các tế bào viêm. Trong giai đoạn trước khi xơ hóa mạn tính, một tình trạng viêm phế nang phát triển và nỗ lực sửa chữa tổn thương của cơ thể dẫn đến sự phát triển của các thay đổi xơ hóa. Khả năng quá mẫn cũng đóng một vai trò trong cơ chế bệnh sinh của viêm phế nang đã được gợi ý bởi phát hiện tăng lympho bào trong dịch BAL của phổi không được chiếu xạ ở những bệnh nhân bị viêm phổi do bức xạ.
Những thay đổi bệnh học sớm bao gồm sưng các tế bào nội mô, phù kẽ, thâm nhiễm tế bào đơn nhân, và các tế bào biểu mô tăng sản không điển hình. Những thay đổi tiếp theo trong giai đoạn xơ hóa bao gồm xơ hóa tiến triển (không thể phân biệt được với xơ phổi do các nguyên nhân khác) và xơ cứng các mạch máu nhỏ, với sự tắc nghẽn một phần lớn của giường mao mạch trong khu vực bị ảnh hưởng.
Về mặt lâm sàng, bệnh nhân có thể bị sốt với viêm phổi cấp tính cùng với các triệu chứng hô hấp, và việc phân biệt viêm phổi do bức xạ với một viêm phổi không điển hình thường rất khó khăn. Trên X-quang ngực, viêm phổi cấp tính thường được đặc trưng bởi một thâm nhiễm có hình dạng và vị trí tương ứng với vùng phổi được chiếu xạ. Chụp CT ngực có thể đặc biệt hữu ích, cả vì nó có thể phát hiện các bất thường tinh tế sớm hơn so với X-quang ngực và vì các góc nhìn cắt ngang dễ dàng cho thấy sự tương ứng của các bất thường X-quang với các cổng chiếu xạ. Tuy nhiên, vì những lý do chưa rõ ràng, các thay đổi bổ sung bên ngoài trường chiếu xạ có thể phát triển ở một số bệnh nhân. Khi việc cung cấp bức xạ đã trở nên tinh vi hơn và đang sử dụng các phương pháp ba chiều, một biến chứng bổ sung là chùm tia bức xạ có thể được cung cấp qua nhiều hướng khác nhau để tối đa hóa việc cung cấp đến khối u và hạn chế phơi nhiễm cho mô phổi bình thường. Điều này có nghĩa là các đường viền tương đối thẳng của bệnh tương ứng với hướng của một chùm tia bức xạ cố định có thể không còn rõ ràng nữa.
Mô hình của xơ hóa do bức xạ mạn tính là sự gia tăng các dải mờ kẽ, một lần nữa thường tương ứng về vị trí với vùng phổi được chiếu xạ, thường đi kèm với mất thể tích. Với các phương thức cung cấp mới hơn không có hướng cố định của chùm tia bức xạ, khu vực xơ hóa có thể chủ yếu nằm trong vùng của khối u được chiếu xạ và có thể có các bờ khá không rõ ràng. Những thay đổi cấp tính của viêm phổi có khả năng hồi phục, trong khi những thay đổi xơ hóa mạn tính là vĩnh viễn. Mô hình kẽ trong bệnh phổi do bức xạ có thể tương ứng về phân bố với vùng phổi được chiếu xạ.
Các cân nhắc chẩn đoán thường tương tự như đối với bệnh phổi mô kẽ do thuốc. Tiền sử xạ trị gần đây xảy ra vào thời điểm thích hợp là rất quan trọng đối với chẩn đoán. Ngoài ra, việc tìm thấy các thay đổi trên X-quang phù hợp với cổng chiếu xạ, nếu có một đường viền tương đối thẳng, là rất gợi ý cho chẩn đoán.
Corticosteroid thường được sử dụng để điều trị viêm phổi do bức xạ, thường với kết quả khá tốt. Khi những thay đổi mạn tính của xơ hóa đã phát triển, corticosteroid ít hiệu quả hơn nhiều.
TÀI LIỆU THAM KHẢO ĐỀ XUẤT
- American Thoracic Society: Diagnosis and initial management of nonmalignant diseases related to asbestos. American Journal of Respiratory and Critical Care Medicine 2004; 170: pp. 691-715.
- Antonescu-Turcu A.L., Schapira R.M.: Parenchymal and airway diseases caused by asbestos. Current Opinion in Pulmonary Medicine 2010; 16: pp. 155-161.
- Balmes J.R., Abraham J.L., Dweik R.A., Fireman E., Fontenot A.P., Maier L.A., et. al.: An official American Thoracic Society statement: Diagnosis and management of beryllium sensitivity and chronic beryllium disease. American Journal of Respiratory and Critical Care Medicine 2014; 190: pp. e34-e59.
- Blackley D.J., Reynolds L.E., Short C., Carson R., Storey E., Halldin C.N., et. al.: Progressive massive fibrosis in coal miners from 3 clinics in Virginia. JAMA 2018; 319: pp. 500-501.
- Blanc P.D., Annesi-Maesano I., Balmes J.R., Cummings K.J., Fishwick D., Miedinger D., et. al.: The occupational burden of nonmalignant respiratory diseases. An official American Thoracic Society and European Respiratory Society statement. American Journal of Respiratory and Critical Care Medicine 2019; 199: pp. 1312-1334.
- Champlin J., Edwards R., Pipavath S.: Imaging of occupational lung disease. Radiologic Clinics of North America 2016; 54: pp. 1077-1096.
- Cullinan P., Muñoz X., Suojalehto H., Agius R., Jindal S., Sigsgaard T., et. al.: Occupational lung diseases: From old and novel exposures to effective preventive strategies. Lancet Respiratory Medicine 2017; 5: pp. 445-455.
- De Matteis S., Heederik D., Burdorf A., Colosio C., Cullinan P., Henneberger P.K., et. al.: Current and new challenges in occupational lung diseases. European Respiratory Review 2017; 26: pp. 170080.
- Deslauriers J.R., Redlich C.A.: Silica exposure, silicosis, and the new Occupational Safety and Health Administration silica standard. What pulmonologists need to know. Annals of the American Thoracic Society 2018; 15: pp. 1391-1392.
- Fontenot A.P.: Immunologic effects of beryllium exposure. Annals of the American Thoracic Society 2018; 15: pp. S81-S85.
- Harris E.J.A., Musk A., de Klerk N., Reid A., Franklin P., Brims F.J.H.: Diagnosis of asbestos-related lung diseases. Expert Review of Respiratory Medicine 2019; 13: pp. 241-249.
- MacMurdo M.G., Mroz M.M., Culver D.A., Dweik R.A., Maier L.A.: Chronic beryllium disease: Update on a moving target. Chest 2020; 158: pp. 2458-2466.
- Papali A., Hines S.E.: Evaluation of the patient with an exposure-related disease: The occupational and environmental history. Current Opinion in Pulmonary Medicine 2015; 21: pp. 155-162.
- Perret J.L., Plush B., Lachapelle P., Hinks T.S., Walter C., Clarke P., et. al.: Coal mine dust lung disease in the modern era. Respirology 2017; 22: pp. 662-670.
- Roggli V.L., Gibbs A.R., Attanoos R., Churg A., Popper H., Cagle P., et. al.: Pathology of asbestosis An update of the diagnostic criteria: Report of the Asbestosis Committee of the College of American Pathologists and Pulmonary Pathology Society. Archives of Pathology and Laboratory Medicine 2010; 134: pp. 462-480.
- Vanka K.S., Shukla S., Gomez H.M., James C., Palanisami T., Williams K., et. al.: Understanding the pathogenesis of occupational coal and silica dust-associated lung disease. European Respiratory Review 2022; 31: pp. 210-250.
- Fernández Pérez E.R., Travis W.D., Lynch D.A., Brown K.K., Johannson K.A., Selman M., et. al.: Executive summary. Diagnosis and evaluation of hypersensitivity pneumonitis: CHEST guideline and expert panel report. Chest 2021; 160: pp. 595-615.
- Koster M.A., Thomson C.C., Collins B.F., Jenkins A.R., Ruminjo J.K., Raghu G.: Diagnosis of hypersensitivity pneumonitis in adults, 2020 clinical practice guideline: Summary for clinicians. Annals of the American Thoracic Society 2021; 18: pp. 559-566.
- Vasakova M., Morell F., Walsh S., Leslie K., Raghu G.: Hypersensitivity pneumonitis: Perspectives in diagnosis and management. American Journal of Respiratory and Critical Care Medicine 2017; 196: pp. 680-689.
- Vasakova M., Selman M., Morell F., Sterclova M., Molina-Molina M., Raghu G.: Hypersensitivity pneumonitis: Current concepts of pathogenesis and potential targets for treatment. American Journal of Respiratory and Critical Care Medicine 2019; 200: pp. 301-308.
- Bielopolski D., Evron E., Moreh-Rahav O., Landes M., Stemmer S.M., Salamon F.: Paclitaxel-induced pneumonitis in patients with breast cancer: Case series and review of the literature. Journal of Chemotherapy 2016; 29: pp. 113-117.
- Camus P., Martin W.J.II, Rosenow E.C.III.: Amiodarone pulmonary toxicity. Clinics in Chest Medicine 2004; 25: pp. 65-75.
- Delaunay M., Prévot G., Collot S., Guilleminault L., Didier A., Mazières J.: Management of pulmonary toxicity associated with immune checkpoint inhibitors. European Respiratory Review 2019; 28: pp. 190012.
- Naidoo J., Wang X., Woo K.M., Iyriboz T., Halpenny D., Cunningham J., et. al.: Pneumonitis in patients treated with anti-programmed death-1/programmed death ligand 1 therapy. Journal of Clinical Oncology 2017; 35: pp. 709-717.
- Rashdan S., Minna J.D., Gerber D.E.: Diagnosis and management of pulmonary toxicity associated with cancer immunotherapy. Lancet Respiratory Medicine 2018; 6: pp. 472-478.
- Schwaiblmair M., Berghaus T., Haeckel T., Wagner T., von Scheidt W.: Amiodarone-induced pulmonary toxicity: An under-recognized and severe adverse effect?. Clinical Research in Cardiology 2010; 99: pp. 693-700.
- Skeoch S., Weatherley N., Swift A.J., Oldroyd A., Johns C., Hayton C., et. al.: Drug-induced interstitial lung disease: A systematic review. Journal of Clinical Medicine 2018; 7: pp. 356.
- Torrisi J.M., Schwartz L.H., Gollub M.J., Ginsberg M.S., Bosl G.J., Hricak H.: CT findings of chemotherapy-induced toxicity: What radiologists need to know about the clinical and radiologic manifestations of chemotherapy toxicity. Radiology 2011; 258: pp. 41-56.
- Benveniste M.F., Welsh J., Godoy M.C., Betancourt S.L., Mawlawi O.R., Munden R.F.: New era of radiotherapy: An update in radiation-induced lung disease. Clinical Radiology 2013; 68: pp. e275-e290.
- Ding N.H., Li J.J., Sun L.Q.: Molecular mechanisms and treatment of radiation-induced lung fibrosis. Current Drug Targets 2013; 14: pp. 1347-1356.
- Hanania A.N., Mainwaring W., Ghebre Y.T., Hanania N.A., Ludwig M.: Radiation-induced lung injury: Assessment and management. Chest 2019; 156: pp. 150-162.
BẢNG CHÚ GIẢI THUẬT NGỮ Y HỌC ANH-VIỆT
Chương 10. Bệnh nhu mô phổi lan toả liên quan đến các nguyên nhân đã biết
| STT | Thuật ngữ tiếng Anh | Phiên âm | Nghĩa Tiếng Việt |
|---|---|---|---|
| 1 | Diffuse parenchymal lung disease | /dɪˈfjuːz pəˈrenkɪməl lʌŋ dɪˈziːz/ | Bệnh phổi kẽ lan tỏa |
| 2 | Interstitial lung disease | /ˌɪntəˈstɪʃəl lʌŋ dɪˈziːz/ | Bệnh phổi kẽ |
| 3 | Etiologic agent | /ˌiːtiəˈlɒdʒɪk ˈeɪdʒənt/ | Tác nhân bệnh nguyên |
| 4 | Pneumoconiosis | /ˌnjuːməkəʊniˈəʊsɪs/ | Bệnh bụi phổi |
| 5 | Inorganic dust | /ˌɪnɔːˈɡænɪk dʌst/ | Bụi vô cơ |
| 6 | Silica | /ˈsɪlɪkə/ | Silic |
| 7 | Asbestos | /æsˈbestəs/ | Amiăng |
| 8 | Beryllium | /bəˈrɪliəm/ | Beryli |
| 9 | Respiratory bronchioles | /rɪˈspɪrətəri ˈbrɒŋkiəʊlz/ | Phế quản nhỏ hô hấp |
| 10 | Alveoli | /ælˈviːəlaɪ/ | Phế nang |
| 11 | Silicon dioxide | /ˈsɪlɪkən daɪˈɒksaɪd/ | Silic điôxít |
| 12 | Quartz | /kwɔːts/ | Thạch anh |
| 13 | Sandblasters | /ˈsændblaːstəz/ | Thợ phun cát |
| 14 | Hard rock miners | /hɑːd rɒk ˈmaɪnəz/ | Thợ mỏ đá cứng |
| 15 | Quarry workers | /ˈkwɒri ˈwɜːkəz/ | Thợ mỏ đá |
| 16 | Stonecutters | /ˈstəʊnkʌtəz/ | Thợ cắt đá |
| 17 | Engineered stone | /ˌendʒɪˈnɪəd stəʊn/ | Đá kỹ thuật |
| 18 | Oxygen radicals | /ˈɒksɪdʒən ˈrædɪkəlz/ | Gốc oxy |
| 19 | Macrophages | /ˈmækrəʊfeɪdʒɪz/ | Đại thực bào |
| 20 | Phagocytosed | /ˌfæɡəsaɪˈtəʊzd/ | Được thực bào |
| 21 | Reactive oxygen species | /riˈæktɪv ˈɒksɪdʒən ˈspiːʃiːz/ | Loại oxy phản ứng |
| 22 | Tumor necrosis factor | /ˈtjuːmə nəˈkrəʊsɪs ˈfæktə/ | Yếu tố hoại tử u |
| 23 | Interleukin | /ˌɪntəˈluːkɪn/ | Interleukin |
| 24 | Apoptotic cell death | /æpəpˈtɒtɪk sel deθ/ | Chết tế bào theo chương trình |
| 25 | Alveolitis | /ˌælviəˈlaɪtɪs/ | Viêm phế nang |
| 26 | Fibrosis | /faɪˈbrəʊsɪs/ | Xơ hóa |
| 27 | Silicotic nodules | /sɪlɪˈkɒtɪk ˈnɒdjuːlz/ | Nốt silic |
| 28 | Connective tissue | /kəˈnektɪv ˈtɪʃuː/ | Mô liên kết |
| 29 | Coalesce | /ˌkəʊəˈles/ | Hợp nhất |
| 30 | Progressive massive fibrosis | /prəˈɡresɪv ˈmæsɪv faɪˈbrəʊsɪs/ | Xơ hóa khối tiến triển |
| 31 | Hilar lymph nodes | /ˈhaɪlə lɪmf nəʊdz/ | Hạch rốn phổi |
| 32 | Calcify | /ˈkælsɪfaɪ/ | Vôi hóa |
| 33 | Respiratory failure | /rɪˈspɪrətəri ˈfeɪljə/ | Suy hô hấp |
| 34 | Immune regulation | /ɪˈmjuːn ˌreɡjʊˈleɪʃən/ | Điều hòa miễn dịch |
| 35 | Autoimmune diseases | /ˌɔːtəʊɪˈmjuːn dɪˈziːzɪz/ | Bệnh tự miễn dịch |
| 36 | Rheumatoid arthritis | /ˈruːmətɔɪd ɑːˈθraɪtɪs/ | Viêm khớp dạng thấp |
| 37 | Systemic sclerosis | /sɪˈstemɪk skləˈrəʊsɪs/ | Xơ cứng toàn thân |
| 38 | Mycobacteria | /ˌmaɪkəʊbækˈtɪəriə/ | Vi khuẩn lao |
| 39 | Mycobacterium tuberculosis | /ˌmaɪkəʊbækˈtɪəriəm tjuːˌbɜːkjʊˈləʊsɪs/ | Mycobacterium tuberculosis |
| 40 | Atypical mycobacteria | /eɪˈtɪpɪkəl ˌmaɪkəʊbækˈtɪəriə/ | Vi khuẩn lao không điển hình |
| 41 | Nontuberculous mycobacteria | /nɒntjuːˈbɜːkjʊləs ˌmaɪkəʊbækˈtɪəriə/ | Vi khuẩn phi lao |
| 42 | Silicotuberculosis | /ˌsɪlɪkəʊtjuːˌbɜːkjʊˈləʊsɪs/ | Bệnh lao-silic |
| 43 | Antituberculous medications | /ˌæntitjuːˈbɜːkjʊləs ˌmedɪˈkeɪʃənz/ | Thuốc kháng lao |
| 44 | Radiographic appearance | /ˌreɪdiəˈɡræfɪk əˈpɪərəns/ | Biểu hiện X-quang |
| 45 | Small rounded opacities | /smɔːl ˈraʊndɪd əʊˈpæsɪtiz/ | Tổn thương tròn nhỏ |
| 46 | Simple chronic silicosis | /ˈsɪmpəl ˈkrɒnɪk sɪlɪˈkəʊsɪs/ | Bệnh bụi phổi silic mãn tính đơn giản |
| 47 | Coal worker’s pneumoconiosis | /kəʊl ˈwɜːkəz ˌnjuːməkəʊniˈəʊsɪs/ | Bệnh bụi phổi than của thợ mỏ |
| 48 | Less fibrogenic | /les faɪbrəˈdʒenɪk/ | Ít gây xơ hóa |
| 49 | Tissue reaction | /ˈtɪʃuː riˈækʃən/ | Phản ứng mô |
| 50 | Chronic obstructive pulmonary disease | /ˈkrɒnɪk əbˈstrʌktɪv ˈpʌlmənəri dɪˈziːz/ | Bệnh phổi tắc nghẽn mãn tính |
| 51 | Emphysema | /ˌemfɪˈsiːmə/ | Khí phế thủng |
| 52 | Centrilobular distribution | /ˌsentrɪˈlɒbjʊlə ˌdɪstrɪˈbjuːʃən/ | Phân bố trung tâm tiểu thùy |
| 53 | Coal macule | /kəʊl ˈmækjuːl/ | Nốt than |
| 54 | Focal collection | /ˈfəʊkəl kəˈlekʃən/ | Tập hợp khu trú |
| 55 | Cellular infiltration | /ˈseljʊlə ˌɪnfɪlˈtreɪʃən/ | Thâm nhiễm tế bào |
| 56 | Focal emphysema | /ˈfəʊkəl ˌemfɪˈsiːmə/ | Khí phế thủng khu trú |
| 57 | Simple and complicated forms | /ˈsɪmpəl ænd ˈkɒmplɪkeɪtɪd fɔːmz/ | Dạng đơn giản và phức tạp |
| 58 | Discrete densities | /dɪˈskriːt ˈdensɪtiz/ | Tổn thương rời rạc |
| 59 | Nodular than linear | /ˈnɒdjʊlə ðæn ˈlɪniə/ | Dạng nốt hơn là dạng đường |
| 60 | Pulmonary function | /ˈpʌlmənəri ˈfʌŋkʃən/ | Chức năng phổi |
| 61 | Relatively preserved | /ˈrelətɪvli prɪˈzɜːvd/ | Được bảo tồn tương đối |
| 62 | Coalescent opacities | /ˌkəʊəˈlesənt əʊˈpæsɪtiz/ | Tổn thương hợp nhất |
| 63 | Complicated CWP | /ˈkɒmplɪkeɪtɪd siː dʌbəljuː piː/ | CWP phức tạp |
| 64 | Restrictive disease | /rɪˈstrɪktɪv dɪˈziːz/ | Bệnh hạn chế |
| 65 | Obstructive disease | /əbˈstrʌktɪv dɪˈziːz/ | Bệnh tắc nghẽn |
| 66 | Mixed pattern | /mɪkst ˈpætən/ | Mô hình hỗn hợp |
| 67 | Airway disease | /ˈeəweɪ dɪˈziːz/ | Bệnh đường thở |
| 68 | Genetic polymorphisms | /dʒəˈnetɪk ˌpɒlɪˈmɔːfɪzəmz/ | Đa hình di truyền |
| 69 | Inhalational exposures | /ˌɪnhəˈleɪʃənəl ɪkˈspəʊʒəz/ | Tiếp xúc qua hít phải |
| 70 | Fibrous derivative | /ˈfaɪbrəs dɪˈrɪvətɪv/ | Dẫn xuất xơ |
| 71 | Fibrous silicate | /ˈfaɪbrəs ˈsɪlɪkeɪt/ | Silicat xơ |
| 72 | Thermal resistance | /ˈθɜːməl rɪˈzɪstəns/ | Khả năng chống nhiệt |
| 73 | Fire resistance | /ˈfaɪə rɪˈzɪstəns/ | Khả năng chống cháy |
| 74 | Benign pleural plaques | /bɪˈnaɪn ˈplʊərəl plæks/ | Mảng màng phổi lành tính |
| 75 | Pleural effusions | /ˈplʊərəl ɪˈfjuːʒənz/ | Tràn dịch màng phổi |
| 76 | Bronchogenic carcinoma | /ˌbrɒŋkəʊˈdʒenɪk ˌkɑːsɪˈnəʊmə/ | Ung thư phế quản |
| 77 | Mesothelioma | /ˌmesoʊˈθiːliˌoʊmə/ | U trung biểu mô |
| 78 | Asbestosis | /æsˌbestəʊsɪs/ | Bệnh bụi phổi amiăng |
| 79 | Insulation workers | /ˌɪnsjʊˈleɪʃən ˈwɜːkəz/ | Công nhân cách nhiệt |
| 80 | Shipyard workers | /ˈʃɪpjɑːd ˈwɜːkəz/ | Công nhân đóng tàu |
| 81 | Construction workers | /kənˈstrʌkʃən ˈwɜːkəz/ | Công nhân xây dựng |
| 82 | Brake linings | /breɪk ˈlaɪnɪŋz/ | Má phanh |
| 83 | Demolishing | /dɪˈmɒlɪʃɪŋ/ | Phá dỡ |
| 84 | Remodeling | /ˌriːˈmɒdəlɪŋ/ | Cải tạo |
| 85 | Reinsulating | /ˌriːˈɪnsjʊleɪtɪŋ/ | Cách nhiệt lại |
| 86 | Pathogenesis | /ˌpæθəˈdʒenəsɪs/ | Cơ chế bệnh sinh |
| 87 | Pulmonary epithelial cells | /ˈpʌlmənəri ˌepɪˈθiːliəl selz/ | Tế bào biểu mô phổi |
| 88 | Alveolar duct bifurcations | /ælˈviːələ dʌkt ˌbaɪfəˈkeɪʃənz/ | Các nhánh ống phế nang |
| 89 | Inflammatory mediators | /ɪnˈflæmətəri ˈmiːdieɪtəz/ | Chất trung gian viêm |
| 90 | Neutrophils | /ˈnjuːtrəfɪlz/ | Bạch cầu trung tính |
| 91 | Lymphocytes | /ˈlɪmfəsaɪts/ | Bạch cầu lympho |
| 92 | Cytotoxic | /ˌsaɪtəˈtɒksɪk/ | Độc tế bào |
| 93 | Transforming growth factor | /trænsˈfɔːmɪŋ ɡrəʊθ ˈfæktə/ | Yếu tố tăng trưởng biến đổi |
| 94 | Fibronectin | /ˌfaɪbrəˈnektɪn/ | Fibronectin |
| 95 | Insulin-like growth factor | /ˈɪnsjʊlɪn laɪk ɡrəʊθ ˈfæktə/ | Yếu tố tăng trưởng giống insulin |
| 96 | Platelet-derived growth factor | /ˈpleɪtlət dɪˈraɪvd ɡrəʊθ ˈfæktə/ | Yếu tố tăng trưởng có nguồn gốc tiểu cầu |
| 97 | Fibroblast recruitment | /ˈfaɪbrəblæst rɪˈkruːtmənt/ | Thu hút nguyên bào sợi |
| 98 | Replication | /ˌreplɪˈkeɪʃən/ | Nhân bản |
| 99 | Alveolar epithelial cell | /ælˈviːələ ˌepɪˈθiːliəl sel/ | Tế bào biểu mô phế nang |
| 100 | Apoptosis | /ˌæpəpˈtəʊsɪs/ | Chết tế bào theo chương trình |
| 101 | Proliferation | /prəˌlɪfəˈreɪʃən/ | Tăng sinh |
| 102 | Peribronchiolar fibrosis | /ˌperɪbrɒŋkiˈəʊlə faɪˈbrəʊsɪs/ | Xơ hóa quanh phế quản nhỏ |
| 103 | Alveolar walls | /ælˈviːələ wɔːlz/ | Thành phế nang |
| 104 | Lung bases | /lʌŋ ˈbeɪsɪz/ | Đáy phổi |
| 105 | Subpleural regions | /sʌbˈplʊərəl ˈriːdʒənz/ | Vùng dưới màng phổi |
| 106 | Ferruginous body | /fəˈruːdʒɪnəs ˈbɒdi/ | Thể sắt |
| 107 | Rod-shaped body | /rɒd ʃeɪpt ˈbɒdi/ | Thể hình que |
| 108 | Clubbed ends | /klʌbd endz/ | Đầu dùi |
| 109 | Yellow-brown | /ˈjeləʊ braʊn/ | Màu vàng-nâu |
| 110 | Iron-protein complex | /ˈaɪən ˈprəʊtiːn ˈkɒmpleks/ | Phức hợp sắt-protein |
| 111 | Coated fibers | /ˈkəʊtɪd ˈfaɪbəz/ | Sợi được bao phủ |
| 112 | Uncoated asbestos fibers | /ʌnˈkəʊtɪd æsˈbestəs ˈfaɪbəz/ | Sợi amiăng không được bao phủ |
| 113 | Electron microscopy | /ɪˈlektrɒn maɪˈkrɒskəpi/ | Kính hiển vi điện tử |
| 114 | Light microscopy | /laɪt maɪˈkrɒskəpi/ | Kính hiển vi quang học |
| 115 | Linear streaking | /ˈlɪniə ˈstriːkɪŋ/ | Mô hình vạch tuyến tính |
| 116 | Cyst formation | /sɪst fɔːˈmeɪʃən/ | Hình thành nang |
| 117 | Honeycombing | /ˈhʌnikəʊmɪŋ/ | Tổ ong |
| 118 | Diffuse pleural thickening | /dɪˈfjuːz ˈplʊərəl ˈθɪkənɪŋ/ | Dày màng phổi lan tỏa |
| 119 | Localized plaques | /ˈləʊkəlaɪzd plæks/ | Mảng khu trú |
| 120 | Calcified | /ˈkælsɪfaɪd/ | Vôi hóa |
| 121 | Malignancies | /məˈlɪɡnənsiz/ | U ác tính |
| 122 | Clubbing of digits | /ˈklʌbɪŋ əv ˈdɪdʒɪts/ | Ngón tay dùi trống |
| 123 | Physical examination | /ˈfɪzɪkəl ɪɡˌzæmɪˈneɪʃən/ | Khám thực thể |
| 124 | Berylliosis | /ˌberɪˈlaɪəsɪs/ | Bệnh bụi phổi beryli |
| 125 | Fluorescent light bulbs | /ˌflʊəˈresənt laɪt bʌlbz/ | Đèn huỳnh quang |
| 126 | Aerospace industry | /ˈeərəspeɪs ˈɪndəstri/ | Ngành công nghiệp hàng không vũ trụ |
| 127 | Nuclear weapons | /ˈnjuːkliə ˈwepənz/ | Vũ khí hạt nhân |
| 128 | Electronics industries | /ɪlekˈtrɒnɪks ˈɪndəstriz/ | Ngành điện tử |
| 129 | Histologic appearance | /ˌhɪstəˈlɒdʒɪk əˈpɪərəns/ | Hình ảnh mô học |
| 130 | Mediastinal lymph nodes | /ˌmiːdiæˈstaɪnəl lɪmf nəʊdz/ | Hạch lympho trung thất |
| 131 | Granulomas | /ˌɡrænjʊˈləʊməz/ | U hạt |
| 132 | Sarcoidosis | /ˌsɑːkɔɪˈdəʊsɪs/ | Bệnh sarcoidosis |
| 133 | Cellular immune response | /ˈseljʊlə ɪˈmjuːn rɪˈspɒns/ | Phản ứng miễn dịch tế bào |
| 134 | Delayed hypersensitivity | /dɪˈleɪd ˌhaɪpəsenˈsɪtɪvəti/ | Quá mẫn chậm |
| 135 | Bronchoalveolar lavage | /ˌbrɒŋkəʊælˈviːələ ləˈvɑːʒ/ | Rửa phế quản phế nang |
| 136 | Proliferation and transformation | /prəˌlɪfəˈreɪʃən ænd ˌtrænsfəˈmeɪʃən/ | Tăng sinh và biến đổi |
| 137 | Beryllium salts | /bəˈrɪliəm sɔːlts/ | Muối beryli |
| 138 | In vitro | /ɪn ˈviːtrəʊ/ | Trong ống nghiệm |
| 139 | Beryllium lymphocyte proliferation test | /bəˈrɪliəm ˈlɪmfəsaɪt prəˌlɪfəˈreɪʃən test/ | Xét nghiệm tăng sinh lympho beryli |
| 140 | Subclinical disease | /ˌsʌbˈklɪnɪkəl dɪˈziːz/ | Bệnh dưới lâm sàng |
| 141 | Clinical disease | /ˈklɪnɪkəl dɪˈziːz/ | Bệnh lâm sàng |
| 142 | Antigen-presenting cells | /ˈæntɪdʒən prɪˈzentɪŋ selz/ | Tế bào trình diện kháng nguyên |
| 143 | Human leukocyte antigens | /ˈhjuːmən ˈluːkəsaɪt ˈæntɪdʒənz/ | Kháng nguyên bạch cầu người |
| 144 | CD4+ lymphocytes | /siː diː fɔː plʌs ˈlɪmfəsaɪts/ | Bạch cầu lympho CD4+ |
| 145 | Cytokines | /ˈsaɪtəkaɪnz/ | Cytokine |
| 146 | Interferon gamma | /ˌɪntəˈfɪərən ˈɡæmə/ | Interferon gamma |
| 147 | Macrophage recruitment | /ˈmækrəfeɪdʒ rɪˈkruːtmənt/ | Thu hút đại thực bào |
| 148 | Major histocompatibility complex | /ˈmeɪdʒə ˌhɪstəʊkəmˌpætəˈbɪləti ˈkɒmpleks/ | Phức hợp tương thích mô lớn |
| 149 | Glutamate | /ˈɡluːtəmeɪt/ | Glutamate |
| 150 | HLA-DPB1 molecule | /eɪtʃ el eɪ diː piː biː wʌn ˈmɒlɪkjuːl/ | Phân tử HLA-DPB1 |
