SÁCH DỊCH “Y HỌC CHU PHẪU: QUẢN LÝ HƯỚNG ĐẾN KẾT QUẢ, ẤN BẢN THỨ 2”
Được dịch và chuyển thể sang tiếng Việt từ sách gốc “Perioperative Medicine: Managing for Outcome, 2nd Edition”
Dịch và chú giải: Ths.Bs. Lê Đình Sáng – Hiệu đính: Ts.Bs.Lê Nhật Huy
Chương 13. Điều trị thiếu máu cục bộ chu phẫu, nhồi máu và suy thất trong phẫu thuật tim
Treatment of Perioperative Ischemia, Infarction, and Ventricular Failure in Cardiac Surgery – Muath Bishawi and Carmelo A. Milano
Perioperative Medicine, 13, 154-180
Thiếu máu cục bộ cơ tim và nhồi máu chu phẫu
ĐỊNH NGHĨA
Thiếu máu cục bộ cơ tim chu phẫu khó định nghĩa, vì nó thể hiện một dải liên tục với các biến cố không liên quan về mặt lâm sàng ở một đầu phổ và nhồi máu cơ tim (MI) dẫn đến suy thất hoàn toàn ở đầu kia. Việc chẩn đoán thiếu máu cục bộ cơ tim và/hoặc nhồi máu chu phẫu là một thách thức trong phẫu thuật tim, đặc biệt vì sự tăng cao của các enzyme tim đi kèm ngay cả trong các thủ thuật không biến chứng (Hình 13.1A,B). Ví dụ, sử dụng xét nghiệm troponin độ nhạy cao, Markman và cộng sự đã chứng minh sự tăng troponin ngay cả sau cấy ghép van động mạch chủ qua da. Tương tự, những thay đổi điện tâm đồ (ECG) điển hình của thiếu máu cục bộ và nhồi máu trong bối cảnh không phải phẫu thuật có thể thay vào đó phản ánh viêm màng ngoài tim sau phẫu thuật hoặc tổn thương cơ tim dưới lâm sàng xảy ra trong quá trình thao tác phẫu thuật thông thường. Do đó, việc xác định chính xác tình trạng thiếu máu cục bộ đang diễn ra thường đòi hỏi một phương pháp tiếp cận có hệ thống, đa phương diện, bao gồm đánh giá liên tục các thay đổi ECG, các dấu ấn sinh hóa, siêu âm tim, và thậm chí là chụp mạch. Quan trọng là, phát hiện sớm thiếu máu cục bộ chu phẫu có thể thúc đẩy các liệu pháp giảm thiếu máu cục bộ và giảm thiểu tỷ lệ nhồi máu sau đó.

Hình 13.1 (A) Thay đổi trong giá trị troponin T sau các phẫu thuật tim thông thường. (B) Các giá trị sinh hóa được đo ở người bệnh phẫu thuật tim không biến chứng. AVR: thay van động mạch chủ; CABG: phẫu thuật bắc cầu động mạch vành; CK-MB: creatine kinase-MB isoenzyme; MVR: sửa/thay van hai lá; OPCAB: phẫu thuật bắc cầu động mạch vành không dùng máy tim phổi nhân tạo; TAVI: thay van động mạch chủ qua đường đùi.
Việc diễn giải các thay đổi ECG vẫn có giá trị để xác định thiếu máu cục bộ trong giai đoạn chu phẫu. Bảng 13.1 tóm tắt các thực thể lâm sàng khác nhau có thể dẫn đến thay đổi đoạn ST trong bối cảnh này, bao gồm thiếu máu cục bộ cơ tim và nhồi máu. Sau phẫu thuật tim, ECG ban đầu có thể khó diễn giải do thay đổi vị trí điện cực liên quan đến băng phẫu thuật, do tạo nhịp tim, và do sự hiện diện phổ biến của các bất thường dẫn truyền. Ví dụ, blốc nhánh phải và blốc nhĩ thất (AV) độ một xảy ra rất thường xuyên nhưng thường hồi phục trong vài giờ đầu sau phẫu thuật.
Bảng 13.1. Các tình trạng ảnh hưởng đến thay đổi đoạn ST.
| Tình trạng | Đặc điểm điện tâm đồ |
|---|---|
| Blốc nhánh trái | Phức bộ QRS rộng
Lệch đoạn ST |
| Viêm màng ngoài tim cấp tính | Chênh ST lan tỏa
ST chênh xuống đối nghịch ở chuyển đạo aVR, không ở chuyển đạo aVL Chênh ST hiếm khi >5 mm Đoạn PR chênh xuống |
| Tăng kali máu | QRS rộng và sóng T cao, nhọn, hình lều
Sóng P biên độ thấp hoặc không có Đoạn ST thường dốc xuống |
| Thuyên tắc phổi | Thay đổi giống nhồi máu cơ tim, thường thấy ở cả chuyển đạo dưới và trước vách
Kinh điển có blốc nhánh phải và hình thái S1Q3T3, trục phải lệch |
| Sốc điện | Chênh ST rõ rệt, thường >10 mm, chỉ kéo dài vài phút ngay sau sốc điện một chiều |
| Thiếu máu cục bộ cơ tim | Đoạn ST dẹt, dốc xuống
Đảo ngược sóng T |
| Nhồi máu cơ tim | Chênh ST dạng cao nguyên, vai hoặc dốc lên
Hoạt động đối nghịch giữa aVL và III; tiến triển thành sóng Q |
Các bất thường ECG khác ở người bệnh phẫu thuật tim không phải là những phát hiện không phổ biến, như đã ghi nhận trong nghiên cứu Điều tra Tái thông mạch Bắc cầu Động mạch vành (BARI) (Bảng 13.2), và thường báo hiệu tăng tỷ lệ tử vong do tim, đặc biệt là sự phát triển các bất thường sóng Q theo mã Minnesota sau thủ thuật (Bảng 13.3). Do đó, hầu hết các trung tâm thực hiện ECG trước thủ thuật và ECG theo dõi liên tục sau thủ thuật. Tuy nhiên, chỉ riêng ECG có thể thiếu độ nhạy và độ đặc hiệu đủ để phát hiện thiếu máu cục bộ cơ tim. Siêu âm tim qua thực quản (TEE), đã trở thành một thành phần tiêu chuẩn của theo dõi chu phẫu tại hầu hết các trung tâm, cung cấp một phương tiện hỗ trợ rất hiệu quả cho chẩn đoán thiếu máu cục bộ cơ tim và nhồi máu. Trong quá trình tái thông mạch phẫu thuật, sự vận động thành tim bình thường cho thấy tái thông mạch hiệu quả, trong khi các bất thường vận động thành vùng mới phát hiện thường phản ánh thiếu máu cục bộ hoặc nhồi máu tiềm ẩn. Những bất thường vận động thành tim vùng này có thể bao gồm vô động hoặc vận động nghịch thường trong một đoạn thất mà trước đó là vận động bình thường hoặc giảm vận động. Một nghiên cứu trên 351 người bệnh bắc cầu động mạch vành (CABG) được theo dõi bằng TEE trong mổ và ECG đã chứng minh rằng các bất thường vận động thành phát hiện bởi TEE phổ biến hơn so với các thay đổi đoạn ST, nhưng chỉ có 17% sự phù hợp dương tính giữa hai phương thức. Ngoài ra, TEE được phát hiện có khả năng dự đoán cao gấp đôi so với ECG trong việc xác định những người bệnh cuối cùng đáp ứng tiêu chuẩn MI. Những kết quả này cho thấy TEE có thể là một phương pháp nhạy hơn để phát hiện thiếu máu cục bộ cơ tim trong bối cảnh chu phẫu và có lẽ nên được sử dụng thường xuyên trong theo dõi phẫu thuật tim. Một quan sát quan trọng với TEE là các bất thường thành vách liên thất mới xuất hiện dường như phổ biến sau thủ thuật nhưng không có vẻ liên quan đến tổn thương cơ tim không hồi phục. Quan trọng là, sự phát triển kỹ thuật của TEE chu phẫu đã dẫn đến những tiến bộ gần đây trong siêu âm tim 3D, chụp ảnh Doppler mô (TDI), và siêu âm tim có chất cản quang, tất cả đều đang được nghiên cứu về tính hữu ích của chúng để phát hiện tốt hơn tình trạng thiếu máu cục bộ chu phẫu trong một số nghiên cứu.
Bảng 13.2. Tỷ lệ mắc các bất thường điện tâm đồ mới trong số 1427 người bệnh sau phẫu thuật bắc cầu động mạch vành.
| Bất thường ECG mới | Tỷ lệ mắc
n (%) |
|---|---|
| Sóng Q lớn | 65 (4,6) |
| Chênh ST | 216 (15,1) |
| ST chênh xuống | 220 (15,4) |
| Bất thường sóng T | 557 (39,0) |
| Không có bất thường ECG | 557 (39,0) |
Bảng 13.3: Tỷ lệ tử vong 6 tháng sau phẫu thuật bắc cầu động mạch vành: tác động của bất thường điện tâm đồ xấu đi hai bước theo mã Minnesota.
| Bất thường ECG | Tần suất (%) | Chết (n) | Sống (n) | Tổng (n) | Tỷ lệ bệnh tật | Tỷ lệ bệnh tật tương đối | 95% CI | Tỷ lệ mắc (trên 100) | Nguy cơ tương đối | 95% CI |
|---|---|---|---|---|---|---|---|---|---|---|
| Không có hoặc xấu đi một bước | 54,4 | 74 | 1194 | 1268 | 0,062 | 1,00ᵃ | — | 5,84 | 1,00ᵃ | — |
| Xấu đi hai bước sóng T | 23,6 | 18 | 532 | 550 | 0,034 | 0,55ᵇ | 0,31-0,95 | 3,27 | 0,56ᵇ | 0,34-0,93 |
| Xấu đi hai bước đoạn ST chênh lên | 14,2 | 11 | 320 | 331 | 0,034 | 0,55 | 0,27-1,09 | 3,32 | 0,57 | 0,31-1,06 |
| Xấu đi hai bước đoạn ST chênh xuống | 2,7 | 4 | 59 | 63 | 0,068 | 1,09 | 0,33-3,24 | 6,35 | 1,09 | 0,41-2,88 |
| Xấu đi hai bước đoạn ST chênh lên và chênh xuống | 0,4 | 0 | 10 | 10 | 0,000 | 0,00 | — | 0,00 | 0,00 | — |
| Xấu đi hai bước sóng Q | 4,7 | 12 | 98 | 110 | 0,122 | 1,98 | 0,98-3,90 | 10,91 | 1,87ᵇ | 1,05-3,33 |
Các tiêu chí chẩn đoán chính xác để xác định thiếu máu cục bộ cơ tim chu phẫu chưa được áp dụng thống nhất, và do đó tỷ lệ đã công bố khác nhau. Một nghiên cứu gần đây phát hiện rằng 6,4% số người bệnh trải qua CABG (n = 2052) đã trải qua thiếu máu cục bộ cơ tim chu phẫu, sử dụng các tiêu chí sau: (1) tăng tỷ lệ creatine kinase-MB isoenzyme (CK/CK-MB) lớn hơn 10%; (2) mới xuất hiện thay đổi đoạn ST tăng cao với thời gian lớn hơn 1 phút và liên quan đến sự chuyển từ đường cơ sở ít nhất 0,1 mV và một sóng Q mới liên quan sau phẫu thuật; (3) tim nhanh thất tái phát hoặc kéo dài hoặc rung thất; và (4) suy giảm huyết động dưới sự hỗ trợ thuốc tăng co bóp cơ tim. Trong một phân tích tổng hợp các thử nghiệm đối chứng ngẫu nhiên ở người bệnh trải qua phẫu thuật tim, 20 thử nghiệm (n = 1522 người bệnh) có tỷ lệ biến cố thiếu máu cục bộ tổng thể là 17%. Thiếu máu cục bộ được định nghĩa là độ lệch đoạn ST trên ECG hoặc bất thường vận động thành mới trên TEE.
Cũng giống như thiếu máu cục bộ cơ tim, có nhiều bất đồng đáng kể về các tiêu chí chẩn đoán được sử dụng để xác định nhồi máu cơ tim chu phẫu (PMI), điều này một lần nữa giải thích các báo cáo không đồng nhất trong y văn về tỷ lệ và hàm ý tiên lượng của nó. Trong cùng phân tích tổng hợp đã trích dẫn trước đó, 22 thử nghiệm trên 1853 người bệnh có tỷ lệ PMI tổng thể là 5%. Trên toàn y văn, tỷ lệ PMI được báo cáo dao động từ 5% đến 15%. Mặc dù có những tiến bộ trong phẫu thuật tim, tỷ lệ này dường như không giảm. Chẩn đoán PMI đã cổ điển dựa nhiều vào sự phát triển của các sóng Q bệnh lý mới và kéo dài trên ECG, điều này có thể không phải lúc nào cũng thực sự đại diện cho hoại tử xuyên thành. Thật vậy, trong một nghiên cứu khám nghiệm tử thi được thực hiện trên người bệnh phẫu thuật tim đã tử vong trong vòng 1 tháng sau phẫu thuật, 23% người bệnh có hoại tử cơ tim xuyên thành đáng kể nhưng không có sóng Q bệnh lý, và 20% người bệnh không có hoại tử xuyên thành nhưng có sóng Q mới sau thủ thuật. Chỉ dựa vào sự hiện diện của sóng Q để chẩn đoán PMI có thể nguy hiểm bỏ qua các nhồi máu. Trong một nghiên cứu về người bệnh phẫu thuật tim, phân tích siêu âm tim qua thành ngực định lượng với ECG và chụp X quang tâm thất đã chứng minh PMI không sóng Q phổ biến gấp ba lần so với PMI có sóng Q, với những tác động bất lợi tương đương đến chức năng thất trái (LV). Một nghiên cứu đánh giá ý nghĩa lâm sàng của sóng Q mới sau phẫu thuật tim đã gợi ý rằng những người bệnh có thay đổi ECG bệnh lý này, mà không kèm theo sự tăng cao nào của các dấu ấn enzyme cơ tim hoặc các chỉ điểm khác của PMI, đã có kết quả không có biến cố. Những phát hiện này nhấn mạnh tầm quan trọng then chốt của việc kết hợp các phương thức chẩn đoán khác nhau để xác định PMI.
Mặc dù sóng Q không nhất thiết phản ánh hoại tử xuyên thành, việc đánh giá những thay đổi này và các thay đổi ECG khác và mối liên hệ của chúng với các kết quả bất lợi không thể bỏ qua. Các thay đổi đoạn ST mới trong chu phẫu (>0,1 mV) đã được xác định là một yếu tố dự báo độc lập của PMI, chiếm tới 40% tử vong CABG tiền phẫu. Trong Nghiên cứu Phẫu thuật Động mạch Vành (CASS; n = 1340 người bệnh), 62 người bệnh có sóng Q mới sau phẫu thuật đã trải qua tỷ lệ tử vong trong bệnh viện là 9,7%, so với 1,0% ở 1278 người bệnh còn lại. Ở những người bệnh sống sót đến khi xuất viện, sự hiện diện của sóng Q mới sau phẫu thuật không ảnh hưởng bất lợi đến tỷ lệ sống còn sau 3 năm. Trong số 1427 người bệnh CABG trong thử nghiệm BARI, tỷ lệ tử vong do tim trong 5 năm tăng lên với sự phát triển sóng Q mới (8,2% so với 3,7% đối với không có thay đổi ECG mới; nguy cơ tương đối điều chỉnh, 2,6) (Hình 13.2). Kết quả từ nghiên cứu BẢO VỆ trong Thiếu máu cục bộ Chống Hoại tử (GUARDIAN) trên 2918 người bệnh CABG có nguy cơ cao càng nhấn mạnh tác động tiêu cực của sự phát triển sóng Q đối với sự sống còn (Bảng 13.3).

Hình 13.2 (A) Nghiên cứu so sánh tái thông mạch bằng nong mạch vành và bắc cầu (BARI) – người bệnh ngẫu nhiên và đăng ký – tỷ lệ sống tích lũy không tử vong do tim. Các người bệnh đã trải qua phẫu thuật bắc cầu động mạch vành (CABG) hoặc nong mạch vành qua da (PTCA). Sự xuất hiện sóng Q lớn liên quan đến tăng đáng kể nguy cơ tử vong tim lâu dài ở người bệnh CABG (P = 0,02). (B) Tỷ lệ tử vong tim 5 năm theo Kaplan-Meier và nguy cơ tương đối điều chỉnh đối với tử vong tim cho bất kỳ thay đổi điện tâm đồ (ECG) sau thủ thuật. Tỷ lệ tử vong tim tăng đáng kể do xuất hiện sóng Q lớn mới sau thủ thuật, bất kể loại thủ thuật tái thông mạch vành nào được thực hiện.
Cùng với sự phát triển sóng Q mới sau phẫu thuật, các tiêu chí enzyme thường được sử dụng để xác định PMI và để tăng cường độ nhạy và độ đặc hiệu tổng thể của việc phát hiện PMI. Trong một nghiên cứu thực hiện trên 499 người bệnh phẫu thuật tim tại Bệnh viện Brigham và Phụ nữ, PMI xảy ra ở 5% người bệnh và được chỉ định bởi các tiêu chí sau: tổng CK đỉnh lớn hơn 7000 μg/L, CK-MB lớn hơn 30 ng/mL, và sóng Q mới trên ECG. Trong nghiên cứu GUARDIAN trên 2918 người bệnh CABG, tỷ lệ tử vong 6 tháng liên quan đến nồng độ đỉnh CK-MB sau phẫu thuật nhỏ hơn 5, từ 5 đến 10, từ 10 đến 20, và lớn hơn 20 lần giới hạn trên của bình thường (ULN) lần lượt là 3,4%, 5,8%, 7,8%, và 20,2% (Hình 13.3). Sự liên kết rất đáng kể này được bảo tồn ngay cả sau khi điều chỉnh cho các yếu tố nguy cơ khác. Kinh nghiệm của Phòng khám Cleveland với 3812 người bệnh CABG cho thấy mức CK-MB sau phẫu thuật gấp 10 lần ULN là yếu tố dự báo độc lập cho tỷ lệ tử vong tăng cao sau 3 năm (Bảng 13.4 và Hình 13.4). Nghiên cứu về Liệu pháp Tái thông mạch Động mạch (ARTS) đã đánh giá tiền cứu 496 người bệnh CABG và cũng chứng minh rằng mức tăng CK-MB (>5 lần ULN) có khả năng dự báo cao về tử vong do tim và tái phát MI sau giai đoạn hậu phẫu (Hình 13.5).

Hình 13.3 Mối liên hệ giữa tỷ lệ sống sót sau phẫu thuật bắc cầu động mạch vành (CABG) và mức độ creatine kinase-MB isoenzyme (CK-MB) sau phẫu thuật. Tất cả các so sánh theo cặp giữa các nhóm đều có ý nghĩa thống kê, ngoại trừ nhóm 5 và <10 lần giới hạn trên của bình thường (ULN) so với nhóm 10 và <20 ULN (P = 0,26).

Hình 13.4 Tỷ lệ sống tích lũy ở người bệnh phẫu thuật bắc cầu động mạch vành, phân tầng theo mức độ tăng creatine kinase-MB isoform sau phẫu thuật. ULN: Giới hạn trên của bình thường.

Hình 13.5 Mối quan hệ giữa mức creatine kinase-MB isoform (CK-MB) và biến chứng lớn sau phẫu thuật tim. Đường cong Kaplan-Meier minh họa tỷ lệ mắc các biến chứng tim mạch lớn sau 1 năm theo dõi ở người bệnh có mức CK-MB bình thường (đường gạch nối màu xanh), lớn hơn một đến ba lần bình thường (đường liền màu xanh), ba hoặc nhiều hơn đến năm lần bình thường (đường gạch nối màu đỏ), và lớn hơn năm lần bình thường (đường liền màu đen). MACCE: Kết hợp tử vong tim lớn, nhồi máu cơ tim, tái thông mạch, và biến cố mạch máu não.
Bảng 13.4: Tỷ lệ tử vong 3 năm liên quan đến tăng creatine kinase isoenzyme MB sau phẫu thuật bắc cầu động mạch vành.
| BỆNH NHÂN CABG (N = 3812) | ||
|---|---|---|
| Mức CK-MB | Nguy cơ, số (%) | Tử vong (%) |
| 1 × ULN | 386 (10) | 7,2 |
| 1-3 × ULN | 1922 (50) | 7,7 |
| 3-5 × ULN | 853 (22) | 6,3 |
| 5-10 × ULN | 427 (11) | 7,5 |
| >10 × ULN | 224 (6) | 20,8 |
| P (xu hướng) | — | <0,001 |
ULN: Giới hạn trên của bình thường
Độ đặc hiệu của CK và CK-MB như dấu ấn tổn thương cơ tim bị hạn chế bởi thực tế là những enzyme này cũng hiện diện trong và được giải phóng từ cơ xương. Tổn thương cơ xương đáng kể và giải phóng lượng lớn CK-MB xảy ra trong quá trình phẫu thuật tim. Một lượng lớn bằng chứng thực nghiệm đã xuất hiện trong y văn về độ nhạy và độ đặc hiệu vượt trội của troponin huyết thanh như dấu ấn sinh hóa của tổn thương cơ tim và yếu tố dự báo kết quả bất lợi. Các dạng troponin tim I và T (cTnI, cTnT) là các protein đặc hiệu cho tim tham gia vào điều hòa co cơ thông qua phức hợp tropomyosin. Không có phản ứng chéo với các dạng cơ xương đã được mô tả, và mức troponin tim không tăng ở người khỏe mạnh, ngay cả khi họ tiếp xúc với hoạt động cơ bắp mạnh mẽ hoặc sau các phẫu thuật không phải tim. Mức cTnI cũng dường như không bị thay đổi bởi rối loạn chức năng thận, và nồng độ huyết tương giảm rất chậm, cho phép phát hiện hồi cứu tổn thương cơ tim nếu cần thiết. Thú vị là, mức troponin lấy trước phẫu thuật cũng có thể cho phép phân tầng người bệnh thành các nhóm phụ có nguy cơ tăng cao đối với các biến chứng tim sau phẫu thuật, đặc biệt là PMI (Hình 13.6). Kết quả cho những người bệnh có nguy cơ cao này, những người có lẽ có tổn thương cơ tim đang diễn ra không được phát hiện, có thể được cải thiện với một phương pháp tiếp cận chu phẫu được điều chỉnh bao gồm hỗ trợ dược lý hoặc bơm bóng đối xung trong động mạch chủ (IABP).
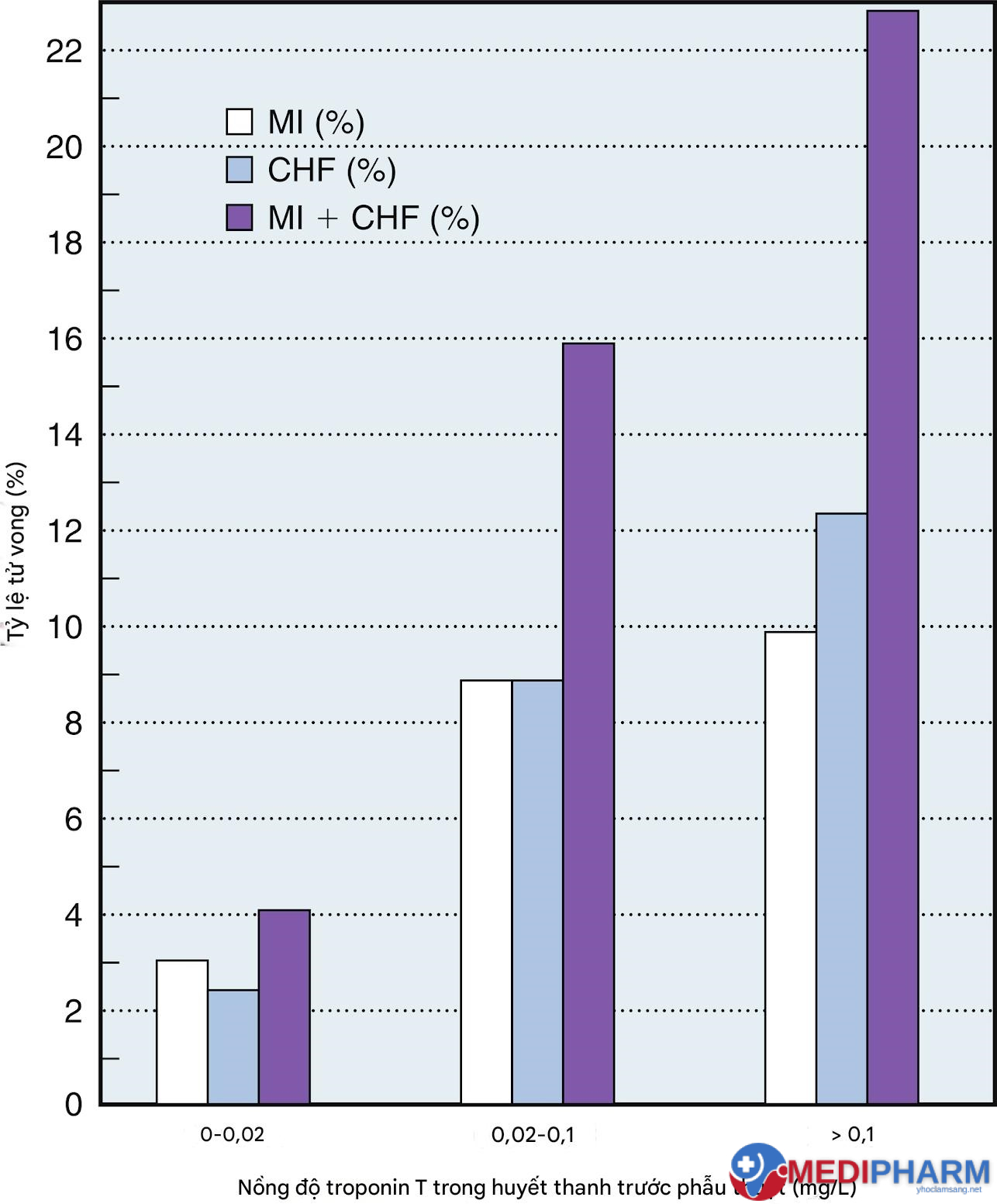
Hình 13.6 Giá trị dự đoán của mức troponin T huyết thanh trước phẫu thuật và các biến cố tim sau phẫu thuật bắc cầu động mạch vành. Mối tương quan tích cực giữa mức troponin T lưu hành trước phẫu thuật và tỷ lệ nhồi máu cơ tim (MI) sau phẫu thuật (P = 0,03), suy tim sung huyết (CHF) (P = 0,0006), và các biến cố tim kết hợp (MI + CHF) (P = 0,0001) là có ý nghĩa. Nhóm 2 bao gồm người bệnh có mức troponin T dưới giá trị phân biệt 0,02 μg/L. Người bệnh nhóm 1 có giá trị troponin T tăng cao và được chia thành hai nhóm phụ: những người có giá trị troponin T từ 0,02 đến 0,1 μg/L và những người có giá trị >0,1 μg/L.
Một nghiên cứu so sánh hiệu quả của cTnT và CK-MB trong một loạt 224 người bệnh phẫu thuật tim cho thấy nồng độ cTnT huyết thanh lớn hơn 1,58 ng/mL (đại diện cho phân vị trên) là yếu tố dự báo độc lập mạnh nhất về tử vong sau phẫu thuật hoặc sốc trong 24 giờ đầu tiên sau phẫu thuật. Greenson và đồng nghiệp đã chứng minh rằng phân tầng người bệnh phẫu thuật tim theo mức cTnI đỉnh dưới 40 và trên 60 ng/mL có khả năng dự đoán đặc biệt về thời gian lưu trú đơn vị chăm sóc tích cực (ICU), thở máy kéo dài, phát triển loạn nhịp mới, và đặc biệt là các biến cố tim (Hình 13.7). Kết quả tương tự đã đạt được trong một loạt lớn hơn với 502 người bệnh trải qua phẫu thuật tim thông thường, trong đó mức cTnI được chứng minh là yếu tố dự báo độc lập về tử vong trong bệnh viện và liên quan đến các biến chứng lớn sau phẫu thuật khác như PMI, loạn nhịp thất, cung lượng tim thấp, thở máy kéo dài, và suy thận cấp đòi hỏi lọc máu (Bảng 13.5). Giá trị tiên lượng dài hạn của mức cTnI cũng đã được xác nhận, và nó rõ ràng liên quan đến tăng tỷ lệ tử vong, tử vong do nguyên nhân tim, và các biến cố tim không gây tử vong trong vòng 2 năm sau CABG (Hình 13.8). Các ngưỡng cắt khác nhau của giá trị troponin dự đoán được báo cáo bởi các nghiên cứu khác nhau là đáng lo ngại và có thể được quy cho sự thiếu tiêu chuẩn hóa của các bộ phát hiện troponin bởi các nhà cung cấp khác nhau.


Hình 13.7 Sự hữu ích của troponin I tim (cTnI) ở người bệnh phẫu thuật tim. (A) Mức troponin I sau phẫu thuật tim. Mức troponin I được vẽ biểu đồ theo thời gian ở người bệnh có và không có biến cố tim. P <0,0001 giữa các nhóm khi sử dụng phân tích phương sai. (B) Biến cố tim theo mức troponin đỉnh. Người bệnh có và không có biến cố tim được hiển thị với mức cTnI đỉnh tương ứng. Mức trên 60 ng/mL và mức dưới 40 ng/mL được minh họa.

Hình 13.8 Tỷ lệ phần trăm tích lũy người bệnh sống sót theo sự tăng cao của troponin I tim (cTnI). Nhóm 1 (n = 174; cTnI, <13 ng/mL; đường đỏ liền) và nhóm 2 (n = 28; cTnI, ≥13 ng/mL; đường đỏ đứt). Chỉ có một người bệnh (trong nhóm 1) bị mất theo dõi sau 1 năm. Giá trị P đề cập đến so sánh giữa các nhóm (kiểm định log-rank).
Bảng 13.5: Nồng độ troponin I tim và kết quả lâm sàng trong số 502 người bệnh.
| Biến chứng | NỒNG ĐỘ CTNI (NG/ML) | |
|---|---|---|
| Có biến chứng
(Số người bệnh) |
Không có biến chứng
(Số người bệnh) |
|
| Nhồi máu cơ tim chu phẫu sóng Q | 56,5 [43; 175,5]ᵇ
(n = 7) |
4,2 [2,4; 7,6]
(n = 495) |
| Loạn nhịp thất | 8,4 [4,2; 28,2]ᵇ
(n = 17) |
4,3 [2,4; 8,0]
(n = 485) |
| Cung lượng tim thấp | 9,5 [4,4; 26,78]ᵇ
(n = 81) |
4,3 [2,4; 7,7]
(n = 421) |
| Thở máy kéo dài (>48 giờ) | 56,5 [5,2; 22,3]ᵇ
(n = 46) |
4,5 [2,5; 8,1]
(n = 456) |
| Suy thận cấp cần lọc máu | 18,2 [9,1; 33,5]ᵇ
(n = 18) |
4,6 [2,5; 8,2]
(n = 484) |
ᵃ Giá trị cTnI được biểu thị dưới dạng trung vị [phân vị thứ 25; phân vị thứ 75]. ᵇ P < 0,0001.
NGUYÊN NHÂN
Trong giai đoạn tiền thủ thuật của phẫu thuật tim, thiếu máu cục bộ cơ tim thường đại diện cho sự mở rộng của một biểu hiện mạch vành cấp tính được kích hoạt bởi tăng huyết áp, hạ huyết áp, thiếu oxy, nhịp tim nhanh, chảy máu, hoặc thao tác phẫu thuật. Các nguyên nhân gây tổn thương thiếu máu cục bộ cơ tim sau thủ thuật bao gồm bảo vệ cơ tim không đầy đủ trong phẫu thuật, thất bại của mạch ghép vành, co thắt mạch vành tự nhiên hoặc mạch ghép, mở rộng của một nhồi máu trước phẫu thuật, tái thông mạch không đầy đủ, tổn thương mạch vành thứ phát do thủ thuật van, và thuyên tắc mạch vành xa. Những cân nhắc về nguyên nhân này là những yếu tố dự báo tai tiếng của thiếu máu cục bộ cơ tim, PMI, và các kết quả bất lợi khác trong phẫu thuật tim. Các yếu tố dự báo của PMI đã được xác định và bao gồm tuổi cao, thủ thuật khẩn cấp, tái thông mạch trước đó, thời gian tuần hoàn ngoài cơ thể (CPB) hoặc thời gian cặp động mạch chủ kéo dài hơn, nhu cầu hỗ trợ thuốc tăng co bóp cơ tim, nhu cầu di chuyển mạch vành (hoặc cấy ghép lại), MI trước đó, và rối loạn chức năng thất trước phẫu thuật. Nhận thức về người bệnh có nguy cơ cao có thể tăng cường giám sát và cho phép can thiệp sớm hơn.
Trước khi thực hiện rộng rãi liệt tim bằng potassium (kali) lạnh và các tiến bộ khác trong bảo tồn cơ tim, PMI thường là kết quả của bảo tồn cơ tim không tối ưu. Nhất quán với nguyên nhân này là phát hiện bệnh lý về hoại tử dải co, cho thấy thiếu máu cục bộ trong mổ và tổn thương tái tưới máu sau đó. Một tỷ lệ cao của các nhồi máu được phân tích từ người bệnh trong những nghiên cứu ban đầu này là ở các vùng được cung cấp bởi các mạch ghép thông thoáng, một lần nữa gợi ý tổn thương được trung gian bởi hiện tượng thiếu máu cục bộ-tái tưới máu. Những cải tiến trong kỹ thuật bảo tồn cơ tim đã làm giảm tỷ lệ thiếu máu cục bộ cơ tim chu phẫu và PMI.
Các kỹ thuật bảo tồn cơ tim đã trải qua sự tiến hóa đáng kể trong năm thập kỷ qua. Việc thực hiện liệt tim tinh thể lạnh là một tiến bộ quan trọng ban đầu đã cải thiện kết quả tổng thể. Việc đưa ra liệt tim bằng máu dẫn đến những cải thiện hơn nữa trong việc duy trì dự trữ năng lượng cơ tim và giảm sản xuất lactat kỵ khí. Về mặt lâm sàng, lợi thế của liệt tim bằng máu được hỗ trợ trong các nghiên cứu cho thấy giảm PMI và các bệnh tật khác khi so sánh trực tiếp với liệt tim tinh thể. Sự ra đời của việc cung cấp liệt tim ngược dòng qua xoang vành là một tiến bộ quan trọng khác trong bảo vệ cơ tim, cho phép ít gián đoạn liệt tim hơn, tưới máu đến các vùng được cung cấp bởi các động mạch hẹp, và tăng cường cung cấp liệt tim đến vùng dưới nội tâm mạc.
Một tiến bộ quan trọng, tương đối gần đây trong liệt tim là sự giới thiệu và áp dụng rộng rãi liệt tim del Nido trong quần thể phẫu thuật tim người lớn. Các thành phần tinh thể của dung dịch này bao gồm dung dịch cơ bản Plasma-Lyte 1-L với mannitol, magnesium sulfate, sodium bicarbonate, potassium chloride, và lidocaine được thêm vào. Không giống như các dung dịch liệt tim khác, del Nido được đưa vào như một liều duy nhất, với ít nhu cầu liều bổ sung thường xuyên hơn. Ngay cả ở người bệnh CABG lần đầu có nguy cơ thấp, việc sử dụng liệt tim del Nido đã liên quan đến ít rung tim và chi phí thấp hơn. Việc sử dụng nó đã tăng lên đáng kể trong phẫu thuật tim xâm lấn tối thiểu, chủ yếu do nhu cầu giảm bớt liều bổ sung. Trong một nghiên cứu gần đây của Vistarini và cộng sự, dung dịch làm liệt tim del Nido được phát hiện là an toàn và dễ dàng trong một nhóm người bệnh liên tiếp trải qua thay van động mạch chủ xâm lấn tối thiểu. Hầu hết dữ liệu liên quan đến việc sử dụng del Nido ở người bệnh phẫu thuật tim người lớn mang tính hồi cứu, với sự thiếu vắng các thử nghiệm đối chứng ngẫu nhiên quy mô lớn.
Tổn thương thiếu máu cục bộ trong thời đại hiện tại có thể thường xuyên hơn là kết quả của các vấn đề kỹ thuật, tắc nghẽn mạch ghép sớm, hẹp miệng nối, co thắt mạch ghép hoặc mạch vành tự nhiên (Hình 13.9 đến 13.11), dòng chảy xa kém, tái thông mạch không hoàn toàn, hiện tượng đánh cắp, hoặc thuyên tắc. Thậm chí sự nén mạch ghép bởi ống dẫn lưu trung thất đã được mô tả như một nguyên nhân gây tổn thương thiếu máu cục bộ (Hình 13.12). Thuyên tắc vữa xơ động mạch trong vi tuần hoàn vành cũng có thể xảy ra trong khi phẫu thuật và dẫn đến PMI. Các nguồn thuyên tắc tiềm năng bao gồm mảng xơ vữa có trong động mạch chủ lên hoặc các động mạch vành ngoại biên chính. Trong bối cảnh tái phẫu thuật, sự gián đoạn cơ học của xơ vữa trong các mạch ghép tĩnh mạch cũ cũng đã được mô tả. Liệt tim ngược dòng có thể bảo vệ trong các trường hợp thuyên tắc mạch vành hoặc mạch ghép.

Hình 13.9 Điều trị co thắt động mạch vành phải (RCA) sau phẫu thuật bắc cầu động mạch vành (CABG). (A) Chụp mạch vành hiển thị co thắt lan tỏa của RCA vượt qua mức miệng nối (mũi tên) với động mạch vú trong phải (RIMA). (B) Giải quyết co thắt RCA sau khi truyền nitroglycerin trong lòng mạch vành.

Hình 13.10 Chụp mạch vành sau phẫu thuật bắc cầu động mạch vành (CABG). Hẹp mạch ghép động mạch vú trong trái đến động mạch liên thất trước (hình vuông). Đoạn trên miệng nối và đầu miệng nối bị hẹp. Không có đáp ứng với nitroglycerin trong lòng mạch. Mạch ghép này đã được sửa chữa phẫu thuật. Khi sửa chữa, tình trạng hẹp phía trên được chẩn đoán là co thắt, đã được cố định bằng keo fibrin. Tình trạng hẹp ở đầu là do kỹ thuật phẫu thuật. Sau khi sửa chữa, miệng nối mở và dòng chảy hoàn hảo đã hiện diện.
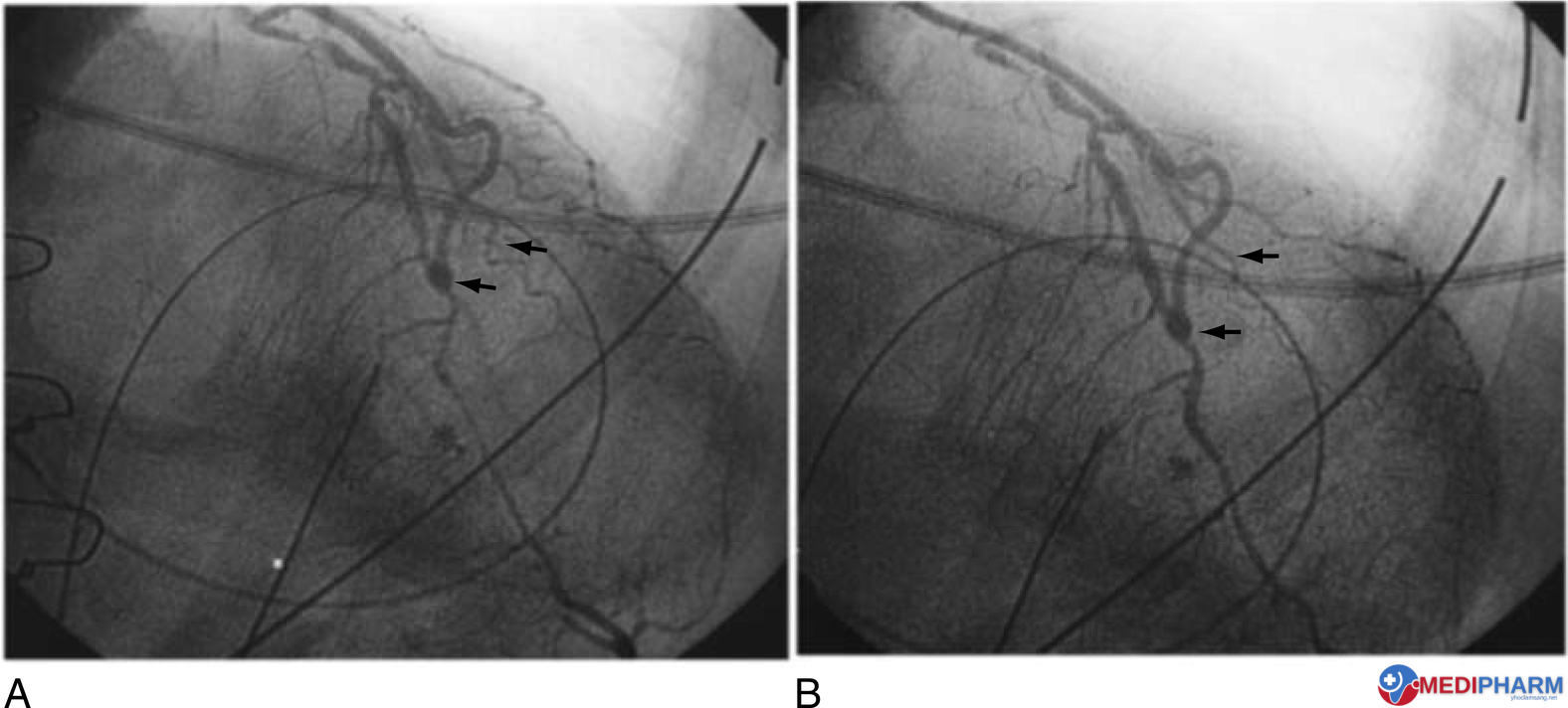
Hình 13.11 Co thắt động mạch vành sau phẫu thuật bắc cầu động mạch vành (CABG). (A) Chụp mạch vành sau phẫu thuật cho thấy co thắt động mạch liên thất trước (LAD) ngay phía xa miệng nối của động mạch vú trong trái (LIMA) đến LAD và co thắt động mạch vành chéo đầu tiên. (B) Kiểm soát chụp mạch sau phẫu thuật sau khi truyền verapamil và nitroglycerin trong lòng mạch vành làm giảm co thắt động mạch vành.

Hình 13.12 Chụp mạch cho nhồi máu cơ tim chu phẫu sau phẫu thuật bắc cầu động mạch vành. (A) Mạch ghép tĩnh mạch hiển đến động mạch xuống sau bị nén từ bên ngoài bởi ống dẫn lưu trung thất (mũi tên). (B) Tắc nghẽn đã được giải quyết bằng cách loại bỏ ống.
PMI do co thắt mạch vành xảy ra với tỷ lệ cao tới 1% và liên quan đến cả mạch đã ghép và chưa ghép. Co thắt mạch vành có thể dẫn đến suy sụp huyết động đột ngột và thường được báo hiệu bằng hạ huyết áp cấp tính. Các phương pháp điều trị thông thường cho hạ huyết áp chu phẫu, như các thuốc co mạch, chỉ có thể làm trầm trọng thêm phản ứng co thắt mạch trong kịch bản này. Tương tự, ở những người bệnh trải qua PMI liên quan đến trạng thái tăng động, mức catecholamine lưu hành tăng cao tạo ra một môi trường thuận lợi cho co thắt mạch vành kéo dài. Về cơ chế, việc ngừng đột ngột các thuốc chẹn kênh canxi trước phẫu thuật có thể dẫn đến co mạch phản ứng của các động mạch vành tự nhiên và là một yếu tố quan trọng cần xem xét trong kế hoạch trước phẫu thuật. Các yếu tố bổ sung có thể làm cho người bệnh phẫu thuật tim đặc biệt dễ bị co thắt mạch vành bao gồm giải phóng thromboxane gây ra bởi tương tác heparin-protamine, CPB, hoạt hóa tiểu cầu, phản ứng phản vệ, sử dụng canxi, và tăng trương lực alpha-adrenergic từ việc sử dụng thuốc co mạch.
Một nguyên nhân khác được mô tả rõ liên quan đến tổn thương thiếu máu cục bộ chu phẫu là hội chứng tưới máu kém của động mạch vú trong (IMA), gây ra bởi tưới máu cơ tim không đầy đủ qua mạch ghép IMA. Trong một loạt 2326 người bệnh CABG trong đó IMA được sử dụng, 45 người bệnh (1,9%) với hội chứng này đã được xác định. Mặc dù IMA là mạch ghép được chứng minh là lựa chọn tốt nhất cho tái thông mạch cơ tim, dòng chảy ngay lập tức qua mạch ghép động mạch này thường ít hơn qua mạch ghép tĩnh mạch hiển và có thể không đáp ứng đầy đủ nhu cầu cơ tim. Các yếu tố khác có thể gây ra hội chứng này bao gồm co thắt mạch, xoắn, hoặc căng quá mức của IMA; hiện tượng đánh cắp thông qua chuyển hướng dòng chảy vào các nhánh sườn lớn; và dòng chảy cạnh tranh còn sót lại từ động mạch vành tự nhiên. Cũng như với các mạch ghép động mạch quay, thao tác cơ học trực tiếp của IMA trong quá trình thu hoạch có thể gây ra rối loạn chức năng nội mô thoáng qua và kích thích phản ứng co thắt mạch.
Một số nghiên cứu chụp mạch lớn đã tương quan nghi ngờ lâm sàng của thiếu máu cục bộ cơ tim hoặc PMI với bằng chứng chụp mạch về thất bại của mạch ghép. Trong một loạt 2003 người bệnh CABG, 71 (3,5%) có nghi ngờ thiếu máu cục bộ cơ tim và trải qua chụp mạch lại cấp tính (n = 59) hoặc tái phẫu thuật ngay lập tức (n = 12) nếu họ không ổn định về huyết động. Các phát hiện chụp mạch trong nhóm đầu tiên bao gồm các mạch ghép tĩnh mạch tắc nghẽn (32%), dòng chảy xa kém đến mạch vành đã ghép (17%), hẹp IMA (7%), tắc nghẽn IMA (5%), hẹp mạch ghép tĩnh mạch (5%), và đánh cắp động mạch dưới đòn IMA (3%). Trong nhóm tái phẫu thuật ngay lập tức, 92% người bệnh có tắc nghẽn mạch ghép. Một nghiên cứu gần đây hơn bao gồm 2052 người bệnh CABG có phát hiện tương tự. Những nghiên cứu này nhấn mạnh rằng phần lớn người bệnh trải qua thiếu máu cục bộ cơ tim hoặc PMI sau tái thông mạch có thất bại mạch ghép tiềm ẩn đòi hỏi chụp mạch và can thiệp qua da hoặc phẫu thuật lại.
Các thủ thuật van có thể dẫn đến biến chứng kỹ thuật với một thiếu máu cục bộ cơ tim cụ thể. Sự gần kề của vòng van hai lá sau và động mạch vành mũ dễ gây tổn thương mũ và thiếu máu cục bộ thành bên LV với tái tạo van hai lá. Một tình huống tương tự tồn tại đối với phẫu thuật van ba lá và động mạch vành phải. Các thủ thuật van động mạch chủ có thể gây nguy hiểm cho cả lỗ mạch vành trái chính hoặc lỗ mạch vành phải, và các trường hợp huyết khối lỗ mạch vành với thiếu máu cục bộ nghiêm trọng đã được báo cáo. Cuối cùng, vật liệu van đã được làm sạch cũng có thể liên quan đến thuyên tắc mạch vành có hại.
QUẢN LÝ
Giai đoạn tiền thủ thuật trong mổ
Giai đoạn tiền thủ thuật là một giai đoạn quan trọng trong đó quản lý lâm sàng thích hợp có thể ngăn ngừa thiếu máu cục bộ cơ tim và PMI. Ổn định huyết áp và duy trì nhịp xoang bình thường nên là mục tiêu. Một sản phẩm tần số-huyết áp dưới 12.000 có thể giảm thiểu thiếu máu cục bộ cơ tim chu phẫu. Tầm quan trọng của các phép đo huyết động chính xác và liên tục không thể được nhấn mạnh quá mức. Tối thiểu nên bao gồm theo dõi liên tục ECG, huyết áp đo bằng băng, huyết áp động mạch trực tiếp, áp lực tĩnh mạch trung tâm (CVP), đo oxy mạch liên tục, và CO2 cuối kỳ thở ra. Đặt ống thông động mạch phổi (PA) được bảo đảm cho người bệnh có nguy cơ cao, ví dụ, trong các trường hợp đau thắt ngực không ổn định, phì đại thất, chức năng thất kém, và bệnh lý van kết hợp và động mạch vành. Ống thông PA cho phép đánh giá liên tục và duy trì áp lực đổ đầy tim, cung lượng tim, và độ bão hòa oxy tĩnh mạch hỗn hợp (MVO2) để ngăn ngừa thiếu máu cục bộ cơ tim.
Điều trị dược lý với các thuốc giãn mạch như nitroglycerin (NTG) tĩnh mạch có thể được yêu cầu trước phẫu thuật cho người bệnh có đau thắt ngực không ổn định. Sự giảm tổng gánh nặng thiếu máu cục bộ có thể cải thiện tiên lượng đối với sự tiến triển của nhồi máu và có thể ngăn chặn sự suy giảm chức năng LV. NTG tĩnh mạch cũng được chứng minh là cải thiện các bất thường vận động thành vùng sau khi gây mê trong một nghiên cứu tiền cứu của người bệnh CABG. Dựa trên những kết quả này, sử dụng NTG theo hướng dẫn của TEE sau khi gây mê có thể tạo ra một siêu âm tim cơ sở tối ưu hơn. Các liệu pháp dược lý quan trọng khác để giảm thiếu máu cục bộ bao gồm thuốc chẹn beta tĩnh mạch, với esmolol là tác nhân dễ điều chỉnh nhất. Thuốc chẹn beta làm giảm nhịp tim, co bóp, và huyết áp và do đó giảm đáng kể tổng công việc cơ tim. Thuốc chẹn beta cũng làm giảm tỷ lệ loạn nhịp thất và nhĩ do thiếu máu cục bộ. Sử dụng NTG tĩnh mạch và thuốc chẹn beta đòi hỏi theo dõi cẩn thận và điều chỉnh liều, vì cả hai loại thuốc đều có thể gây hạ huyết áp; ở người bệnh có hẹp động mạch vành cố định, giảm áp lực tưới máu có thể dẫn đến thiếu máu cục bộ nguy hiểm và sau đó là rối loạn chức năng cơ tim.
Ở người bệnh bị sốc tim hoặc thiếu máu cục bộ kháng trị về mặt nội khoa, ổn định trước phẫu thuật với IABP đã được chứng minh là làm giảm tỷ lệ tử vong phẫu thuật tổng thể và cải thiện kết quả ở người bệnh mạch vành có nguy cơ cao. Đối xung IABP tăng cường tưới máu cơ tim thông qua tăng cường huyết áp tâm trương và phân phối lại dòng máu mạch vành hướng tới các vùng thiếu máu cục bộ cơ tim. IABP cung cấp hỗ trợ LV một phần. Thời gian thích hợp bao gồm bơm bóng ngay sau khi đóng van động mạch chủ và xẹp ngay trước khi tâm thu (Hình 13.13). Bơm bóng trong thời kỳ tâm trương tăng cường tưới máu mạch vành, trong khi xẹp trong thời kỳ tâm thu làm giảm hậu gánh, giảm công việc tim (tiêu thụ oxy cơ tim), và tăng thể tích tống máu và cung lượng tim. Hiệu quả của hỗ trợ IABP được xác định bởi một số yếu tố, bao gồm thể tích bóng; vị trí trong động mạch chủ; tốc độ bơm và xẹp; và, quan trọng nhất, thời điểm tương ứng với chu kỳ tim. Đối xung IABP kém hiệu quả hơn khi có hở van động mạch chủ vừa hoặc nặng và nên tránh. Hơn nữa, thời gian có thể khó khăn do nhịp tim nhanh hoặc loạn nhịp. Bệnh tắc nghẽn chủ-chậu hoặc đùi có thể làm cho việc đặt khó khăn hơn và tăng nguy cơ thiếu máu chi.

Hình 13.13 Thời điểm bơm bóng đối xung trong động mạch chủ (IABP): đồng bộ hóa với chu kỳ tim. Sóng áp lực động mạch với thời điểm IABP chính xác. (A) Một chu kỳ tim hoàn chỉnh. (B) Áp lực cuối tâm trương động mạch chủ không hỗ trợ. (C) Áp lực tâm thu không hỗ trợ. (D) Tăng cường tâm trương. (E) Giảm áp lực cuối tâm trương động mạch chủ. (F) Giảm áp lực tâm thu được hỗ trợ.
Đánh giá hồi cứu 4756 trường hợp hỗ trợ IABP tại Bệnh viện Đa khoa Massachusetts cho thấy rằng một giai đoạn hỗ trợ IABP trước phẫu thuật từ 24 đến 48 giờ là tốt hơn trong đau thắt ngực không ổn định hoặc sau nhồi máu và cho phép phục hồi trước phẫu thuật của cơ tim bị thiếu máu cục bộ. Trong nghiên cứu này, đặt IABP trước phẫu thuật liên quan đến tỷ lệ tử vong thấp hơn (13,6%) so với sử dụng trong mổ (35,7%) hoặc sau phẫu thuật (35,9%). Một nghiên cứu tiền cứu, ngẫu nhiên được thực hiện trên 60 người bệnh CABG có nguy cơ cao để đánh giá thời điểm tối ưu cho việc đặt IABP trước phẫu thuật. Trong nghiên cứu này và các nghiên cứu khác, hỗ trợ IABP trước phẫu thuật dẫn đến giảm thời gian CPB, chỉ số tim cao hơn sau phẫu thuật, giảm tỷ lệ cung lượng tim thấp sau phẫu thuật, và giảm thời gian thở máy và nằm viện. Những nghiên cứu này gợi ý tác động có lợi của hỗ trợ IABP trước phẫu thuật ở người bệnh mạch vành có nguy cơ cao. Các yếu tố nguy cơ trước phẫu thuật đã chỉ định tình trạng nguy cơ cao trong những nghiên cứu này bao gồm phân suất tống máu thất trái (LVEF) trước phẫu thuật dưới 30%, đau thắt ngực không ổn định, hẹp động mạch vành chính trái lớn hơn 70%, bệnh động mạch vành lan tỏa, và CABG tái phẫu thuật.
Một phân tích tổng hợp gần đây đã xem xét các nghiên cứu từ năm 1977 đến 2015 về việc sử dụng IABP ở người bệnh trải qua phẫu thuật tim. Tổng cộng 46.067 người bệnh đã được đưa vào với 11 thử nghiệm đối chứng ngẫu nhiên và 22 nghiên cứu quan sát. Phân tích từ các thử nghiệm đối chứng ngẫu nhiên đã đưa vào gợi ý rằng IABP trước CABG liên quan đến thời gian ICU ngắn hơn (chênh lệch trung bình có trọng số [WMD], 1,47 ngày; khoảng tin cậy 95% [CI], 1,82 đến 1,12 ngày; P < 0,00001) và thời gian nằm viện ngắn hơn (WMD, 3,25 ngày; 95% CI, 5,18 đến 1,33 ngày; P = 0,0009). Quan trọng là, việc sử dụng IABP cũng được phát hiện có sự giảm đáng kể tỷ lệ tử vong tại bệnh viện (tỷ số chênh [OR], 0,20; 95% CI, 0,09-0,44; P < 0,0001) và tỷ lệ tử vong 30 ngày so với không có IABP trước phẫu thuật (OR, 0,43; 95% CI, 0,25-0,76; P = 0,003).
Người bệnh có thiếu máu cục bộ cơ tim trước thủ thuật sâu hoặc MI đang tiến triển có thể được hưởng lợi từ một chiến lược thiết lập CPB nhanh chóng. Hiện tại, nhiều trường hợp tái thông mạch phẫu thuật được thực hiện mà không cần CPB, và đối với những trường hợp khác, giai đoạn đầu thu hoạch mạch ghép được tiến hành ngoài CPB. Ở những người bệnh không ổn định, việc thiết lập CPB ngay lập tức có thể làm giảm đáng kể công việc cơ tim và nguy cơ tổn thương thiếu máu cục bộ. Thu hoạch mạch ghép và chuẩn bị phẫu thuật thêm có thể được thực hiện với trái tim được bảo vệ trên CPB. Trong bối cảnh phẫu thuật tim lại và mở xương ức trước đó, phẫu tích bẹn và đặt ống thông vào các mạch máu đùi có thể là phương pháp an toàn và nhanh nhất để thiết lập CPB. Sử dụng tích cực việc giảm gánh nặng cơ học có thể giúp tránh loạn nhịp thất do thiếu máu cục bộ và rối loạn chức năng thất, điều này có thể khó đảo ngược một khi đã thiết lập. Đáng chú ý, CPB không trực tiếp giảm gánh nặng cho tim trái và giảm gánh nặng LV thêm có thể đạt được với việc bổ sung thông gió LV.
Giai đoạn hậu thủ thuật trong mổ
Trong giai đoạn hậu thủ thuật trong mổ, cần phải tiếp tục chú ý nghiêm ngặt đến mẫu ECG, thông số huyết động, và phát hiện TEE. Như đã thảo luận trước đó, thông tin tập thể có thể thu được với các phương thức này có thể nhạy và đặc hiệu đối với thiếu máu cục bộ cơ tim trong mổ và PMI. Đối với các trường hợp tái thông mạch, mẫu ECG thiếu máu cục bộ trong mổ, bất thường vận động thành vùng mới, hoặc không ổn định huyết động yêu cầu đánh giá các mạch ghép để loại trừ thất bại của mạch ghép là nguyên nhân.
Đánh giá tính toàn vẹn của mạch ghép và tính thông thoáng của mạch ghép có thể được thực hiện dễ dàng bằng cách sử dụng đầu dò lưu lượng Doppler. Những đầu dò này cung cấp một phương pháp nhanh chóng và có độ nhạy cao để phát hiện thất bại của mạch ghép, như đã thể hiện trong một nghiên cứu gần đây về người bệnh trải qua CABG ngoài bơm. Trong nghiên cứu này, kết quả của đầu dò lưu lượng được tương quan với các phát hiện chụp mạch trong mổ, và phân tích Doppler chính xác 100% trong việc xác nhận tính thông thoáng của mạch ghép và phát hiện các mạch ghép thất bại. Để đủ điều kiện là một nghiên cứu Doppler bình thường, mẫu lưu lượng quan sát được phải chủ yếu là tâm trương, với vận tốc lưu lượng tâm trương lớn hơn 15 cm/s. Các thông số lưu lượng bổ sung cần xem xét khi đánh giá tính toàn vẹn của mạch ghép bao gồm tổng lưu lượng, lưu lượng tâm thu, tỷ lệ lưu lượng tâm trương trên tổng lưu lượng, lưu lượng đỉnh tâm thu, lưu lượng đỉnh tâm trương, chỉ số lưu lượng đỉnh tâm thu trên tâm trương, và chỉ số rung động (PI; được định nghĩa là sự khác biệt giữa lưu lượng đỉnh tâm thu và lưu lượng tâm trương chia cho lưu lượng trung bình). Giá trị PI nên nằm trong khoảng từ 1 đến 5, trong đó các giá trị cao hơn chỉ ra một vấn đề của mạch ghép. Khi gặp một nghiên cứu lưu lượng Doppler bất thường, cần cân nhắc sửa chữa lại mạch ghép có vấn đề. Tuy nhiên, quyết định này phức tạp và cuối cùng liên quan đến sự tự tin của phẫu thuật viên trong việc đạt được một kết quả kỹ thuật tốt hơn. Các động mạch vành đích nhỏ hoặc bị bệnh lan tỏa có thể dự đoán sẽ dẫn đến các mạch ghép có dòng chảy hạn chế. Trong một phân tích gần đây cho một thử nghiệm CABG đa trung tâm lớn, tỷ lệ thông thoáng của mạch ghép sau 1 năm và tỷ lệ sửa chữa trong mổ ở người bệnh trải qua CABG dựa trên đánh giá đầu dò lưu lượng trong mổ đã được đánh giá. Đối với 1607 người bệnh (2738 mạch ghép) có dữ liệu đầu dò lưu lượng có sẵn, tỷ lệ thông thoáng FitzGibbon grade A sau 1 năm và sửa chữa trong mổ được so sánh dựa trên các phép đo TTF (<20 [lưu lượng thấp] so với ≥20 mL/phút [lưu lượng bình thường]) và giá trị PI (<3, 3-5, và >5). Tỷ lệ thông thoáng FitzGibbon grade A ít phổ biến hơn nhiều ở các mạch ghép có lưu lượng thấp (71,3%) so với (87,2%) đối với mạch ghép có lưu lượng bình thường. Một mối quan hệ nghịch đảo được thấy giữa tỷ lệ thông thoáng 1 năm và giá trị PI trong mổ, với 85,6% mạch ghép có tỷ lệ thông thoáng FitzGibbon A khi PI <3, 74,7% với PI từ 3-5, và 67,9% với PI >5 (P.01). Như dự đoán, sửa chữa mạch ghép trong mổ thường xuyên hơn ở các mạch ghép có lưu lượng thấp ở mức 7,7% so với ở những mạch ghép có lưu lượng bình thường (0,4%; P<.01). Điều còn chưa rõ là tỷ lệ phần trăm của các mạch ghép có sự cải thiện có ý nghĩa sau khi sửa chữa so với những mạch ghép không có.
Có lẽ một trong những nguyên nhân phổ biến nhất của thiếu máu cục bộ cơ tim sau thủ thuật là thuyên tắc khí mạch vành. Sự kiện này quan trọng cần nhận ra; động mạch vành phải hoặc mạch ghép vành phải đặc biệt bị ảnh hưởng. Không khí thực sự có thể được nhìn thấy trong mạch ghép, và hút bằng kim của mạch ghép có thể giúp hạn chế vấn đề. Hệ thống mạch vành trái phụ thuộc hơn và ít khi liên quan. Rối loạn chức năng thất phải (RV) sâu có thể theo sau. TEE có thể cho thấy không khí trong cơ tim thành dưới của LV. Việc thông gió tim, động mạch chủ, hoặc mạch ghép được chỉ định. Thường thì, việc tạm thời tăng áp lực tưới máu với một chất chủ vận thụ thể alpha-adrenergic làm giảm vấn đề, có lẽ bằng cách đẩy không khí cản trở ra khỏi các nhánh động mạch vành chính. Thực hiện các thủ thuật dưới CO2, chất này hòa tan dễ dàng hơn trong máu, có thể giảm biến chứng này. Quan trọng là, khi không có thuyên tắc khí liên tục, thiếu máu cục bộ này nên giải quyết nhanh chóng, và bằng chứng thiếu máu cục bộ kéo dài đòi hỏi xem xét các nguyên nhân khác.
Giai đoạn sau phẫu thuật
Giai đoạn sau phẫu thuật sớm nên bao gồm theo dõi huyết động và lâm sàng cẩn thận. Cần đảm bảo cung cấp oxy đầy đủ và dòng máu hệ thống: MVO2, cung lượng tim, huyết áp, nhịp tim, lượng nước tiểu, tình trạng acid-base, và mạch đều phải được theo dõi cẩn thận. Sự hiện diện của thiếu máu cục bộ cơ tim có thể được chỉ ra bởi những thay đổi đoạn ST (thông qua theo dõi ECG), loạn nhịp thất, hoặc suy sụp huyết động. Trong các trường hợp khác, những thay đổi huyết động tinh tế hơn hoặc tăng yêu cầu thuốc tăng co bóp cơ tim có thể là các manh mối duy nhất. Nhiều đơn vị sau phẫu thuật tim thu thập ECG 12 chuyển đạo sau thủ thuật thường quy và kết quả enzyme tim huyết thanh theo dõi. Lo ngại về thiếu máu cục bộ cơ tim đòi hỏi siêu âm tim để đánh giá chức năng LV và vận động thành vùng.
Sử dụng thuốc đối kháng canxi trong thời kỳ sau phẫu thuật có thể làm giảm tỷ lệ thiếu máu cục bộ cơ tim, PMI, và tỷ lệ tử vong dài hạn. Các thuốc này tăng cường sự cân bằng giữa cung cấp và nhu cầu oxy cơ tim bằng cách trung gian điều tiết nhịp tim âm tính, co bóp tim âm tính, giảm hậu tải, và giãn mạch vành. Các nghiên cứu gần đây đã ủng hộ việc sử dụng liệu pháp này để ngăn ngừa co thắt mạch ghép sau CABG. Co thắt mạch vành tự nhiên hoặc mạch ghép luôn nên được nghi ngờ trong bối cảnh thiếu máu cục bộ sau phẫu thuật, và nên thiết lập quản lý tích cực với NTG và chẹn kênh canxi dưới lưỡi. Các thuốc này thường được khuyến nghị khi đã sử dụng các mạch ghép động mạch quay. Đáng tiếc là, thiếu máu cục bộ cơ tim sau phẫu thuật có thể thứ phát sau hạ huyết áp hoặc cung lượng tim thấp, hạn chế việc sử dụng chẹn kênh canxi và NTG.
Thiếu máu cục bộ sau phẫu thuật hoặc PMI kèm theo không ổn định huyết động đòi hỏi đặt IABP và phẫu thuật lại khẩn cấp. Ở những người bệnh ổn định hơn với bằng chứng thiếu máu cục bộ cơ tim đáng kể, nên xem xét mạnh mẽ việc chụp mạch vành. Chụp mạch sớm có thể xác định các vấn đề kỹ thuật và định hướng liệu pháp thêm trước khi tổn thương cơ tim vĩnh viễn xảy ra. Cụ thể, tắc nghẽn hoặc hẹp mạch ghép hoặc động mạch tự nhiên có thể được xác định, và có thể thực hiện an toàn nong mạch hoặc đặt stent cho các mạch tự nhiên hoặc mạch ghép mới. Tương tự, chụp mạch có thể xác định co thắt mạch vành tự nhiên hoặc mạch ghép và cho phép truyền trong lòng mạch có mục tiêu NTG hoặc chẹn kênh canxi (xem Hình 13.9 đến 13.11). Trong trường hợp hiện tượng đánh cắp IMA, thuyên tắc mạch ống thông qua mạch là một điều trị hiệu quả khác khả thi trong phòng chụp mạch. Hơn nữa, các vấn đề cụ thể có thể được xác định bằng chụp mạch đòi hỏi trở lại phòng mổ để sửa chữa phẫu thuật. Các ví dụ quan trọng bao gồm tái thông mạch không hoàn toàn và hội chứng tưới máu kém IMA, trong đó việc đặt thêm một mạch ghép tĩnh mạch hiển được coi rộng rãi là lựa chọn điều trị tối ưu.
Các nghiên cứu lâm sàng đã đánh giá các liệu pháp dược lý thay thế khác để ngăn ngừa tổn thương thiếu máu cục bộ-tái tưới máu và PMI trong bối cảnh phẫu thuật tim. Nghiên cứu Pexelizumab để Giảm Nhồi máu và Tử vong trong Phẫu thuật Bắc cầu Động mạch Vành (PRIMO-CABG) là một thử nghiệm tiền cứu ngẫu nhiên, mù đôi, có đối chứng với giả dược đánh giá liệu pexelizumab, một chất ức chế bổ thể C5, có làm giảm PMI ở người bệnh CABG hay không. Điều trị với thuốc này dẫn đến giảm đáng kể tỷ lệ tử vong hoặc MI trong 30 ngày ở 3099 người bệnh trải qua phẫu thuật CABG có hoặc không có phẫu thuật van. Một thử nghiệm tiếp theo ở người bệnh có nguy cơ cao hơn (PRIMO-CABG II) không đạt được điểm cuối chính là tử vong hoặc MI ở 30 ngày hoặc sự phát triển của suy tim sung huyết mới hoặc xấu đi. Tuy nhiên, trong một phân tích kết hợp của cả hai thử nghiệm (PRIMO-CABG I và II; N = 7353), tử vong ở 30 ngày đã giảm đáng kể đối với tập hợp con có nguy cơ lớn nhất (n = 2156; pexelizumab 5,7% so với giả dược 8,1%; P = 0,024).
Ức chế trao đổi natri-hydro với thuốc cariporide cũng đã chứng minh kết quả đầy hứa hẹn. Trong một nghiên cứu đánh giá đoàn hệ CABG của thử nghiệm GUARDIAN, điều trị với cariporide mang lại sự giảm nguy cơ khiêm tốn trong tử vong do mọi nguyên nhân và MI, điều này rõ ràng vào ngày 1 sau phẫu thuật và kéo dài đến 6 tháng sau phẫu thuật. Tuy nhiên, những liệu pháp này vẫn còn xa mới được áp dụng rộng rãi hơn trong lâm sàng.
Rối loạn chức năng và suy thất chu phẫu
Suy thất sau phẫu thuật với trạng thái cung lượng tim thấp sau phẫu thuật tim là một yếu tố dự báo quan trọng về tử vong chu phẫu và đột tử (Hình 13.14 và 13.15). Ngay cả những người bệnh có chức năng thất bình thường trước phẫu thuật cũng thể hiện rối loạn chức năng thoáng qua sau các phẫu thuật tim không có biến cố. Khi gặp rối loạn chức năng thất trong giai đoạn chu phẫu, điều trị nên bao gồm khôi phục cung cấp oxy đầy đủ để ngăn ngừa tổn thương cơ quan cuối và nhận biết và điều chỉnh nhanh chóng nguyên nhân tiềm ẩn. Ngoài ra, việc nhận biết các yếu tố nguy cơ trước phẫu thuật được mô tả rõ ràng cho sự phát triển của hội chứng cung lượng tim thấp có thể ngăn ngừa sự xuất hiện của nó thông qua can thiệp sớm hơn và tối ưu hóa trước phẫu thuật tích cực hơn. Một đánh giá hồi cứu 4558 người bệnh CABG đã xác định tám yếu tố dự báo độc lập về rối loạn chức năng thất sau phẫu thuật. Những yếu tố nguy cơ này bao gồm LVEF trước phẫu thuật dưới 20%, phẫu thuật lại, phẫu thuật cấp cứu, giới tính nữ, tuổi trên 70, hẹp động mạch vành chính trái, MI gần đây, và bệnh động mạch vành ba nhánh lan rộng. Tỷ lệ quan sát được của cung lượng tim thấp là 9,1% trong quần thể này, với tỷ lệ tử vong do phẫu thuật là 16,9%, trái ngược với 0,9% ở những người bệnh còn lại có chức năng thất bình thường. Trong một nghiên cứu khác trên hơn 20.000 người bệnh CABG, tỷ lệ hội chứng cung lượng tim thấp dao động từ 6% với LVEF trước phẫu thuật trên 40% đến 23% ở người bệnh có LVEF dưới 20%. Quan trọng là, những nghiên cứu này nhấn mạnh rằng tiến bộ trong các chiến lược quản lý điều trị đã dẫn đến sự suy giảm tỷ lệ tử vong và trạng thái cung lượng tim thấp chu phẫu mặc dù hồ sơ nguy cơ ngày càng tăng của người bệnh phẫu thuật tim.

Hình 13.14 Tử vong tại bệnh viện so với chỉ số tim. Mối quan hệ giữa chỉ số tim sau phẫu thuật (L/phút/m²) và xác suất tử vong ở người lớn sau khi thay van hai lá. Tỷ lệ tử vong tại bệnh viện tăng mạnh được ghi nhận ở những người bệnh có chỉ số tim dưới 2,0.

Hình 13.15 Ảnh hưởng của đồng bộ nhĩ-thất (AV) đến cung lượng tim sau phẫu thuật tim. Cung lượng tim với tạo nhịp thất (không có co bóp nhĩ đồng bộ) được so sánh với cung lượng tim với tạo nhịp nhĩ. Tăng cung lượng tim tổng thể khoảng 26% đạt được với A-pacing và khôi phục đồng bộ AV với tăng cường tiền tải cuối tâm trương thất trái.
KHÔNG THỂ CẮT TUẦN HOÀN NGOÀI CƠ THỂ
Không thể cắt CPB đại diện cho một sự kiện báo động trong mổ trong phẫu thuật tim và đòi hỏi thảo luận độc lập. Một thủ thuật tim được thực hiện nhanh chóng và đúng cách là chiến lược tốt nhất để tránh vấn đề này. Tuy nhiên, quá trình cắt CPB thành công rất phức tạp và có nhiều điều kiện tiên quyết, không chỉ là chức năng thất. Nhịp tim chậm và thiếu đồng bộ nhĩ thất (AV) rất có hại và phải được điều chỉnh bằng dây tạo nhịp tạm thời (Hình 13.15 và 13.16). Rung nhĩ nên được chuyển nhịp tích cực và điều trị bằng dược lý. Các co thắt thất sớm thường xuyên (PVCs) nên được ức chế bằng amiodarone hoặc lidocaine. Tiền tải thích hợp phải được xác định liên quan đến áp lực đổ đầy trước phẫu thuật, thời gian kẹp, và xem xét độ cứng của thất. Hậu tải thích hợp cung cấp áp lực tưới máu mạch vành quan trọng và có thể bị tổn hại bởi đáp ứng viêm đối với CPB kéo dài. Trong bối cảnh này, các thuốc thúc đẩy giãn mạch, như NTG và milrinone, phải được ngừng. Nên xem xét vasopressin hoặc chất chủ vận thụ thể alpha-adrenergic.

Hình 13.16 Cung lượng tim với tạo nhịp tuần tự nhĩ-thất so với tạo nhịp nhĩ: Tác động của thời gian PR. So sánh tạo nhịp tuần tự AV và tạo nhịp nhĩ ở người bệnh có khoảng PR kéo dài sau phẫu thuật. (Khoảng PR nội tại và được tạo nhịp được hiển thị bằng miligiây ở bên trái đối với tạo nhịp nhĩ và bên phải đối với tạo nhịp tuần tự AV.) Lưu ý sự tăng đồng nhất cung lượng tim mặc dù có sự khác biệt tuyệt đối trong việc rút ngắn khoảng PR do tạo nhịp và sự chồng chéo giữa khoảng PR tạo nhịp và khoảng PR nội tại giữa các người bệnh.
Để tránh không thể cắt CPB, một danh sách kiểm tra toàn diện các biến số lâm sàng nên được đánh giá có hệ thống trước khi bắt đầu nỗ lực cắt. Đầu tiên, nên thực hiện đánh giá TEE trong mổ về chức năng van nhân tạo và vận động thành thất, cũng như phân tích đầu dò lưu lượng Doppler của các mạch bắc cầu. Mọi bất thường về nhiệt độ cơ thể, nhịp tim và nhịp, tiền tải và áp lực tưới máu, tình trạng acid-base, điện giải, và hematocrit phải được giải quyết. Tăng kali máu, hạ canxi máu, toan máu, thiếu oxy, và thiếu máu đều có thể ức chế sâu sắc hiệu suất thất và phải được sửa chữa nhanh chóng. Có thể cần sửa chữa phẫu thuật cho các thiếu sót cơ học để tách CPB thành công. Tình trạng chức năng RV cũng phải được kiểm tra, do tác động quan trọng của nó đối với việc cắt CPB và kết quả tổng thể. Nên xem xét oxit nitric và các thuốc giãn mạch thuốc tăng co bóp cơ tim như milrinone. Bắt đầu phòng ngừa hỗ trợ thuốc tăng co bóp cơ tim ở những người bệnh có nguy cơ cao được lựa chọn có thể được ủng hộ để tăng khả năng tách CPB thành công.
Nếu việc cắt CPB vẫn không thành công sau những biện pháp tối ưu hóa này, có thể cần phải khởi động lại CPB để cho phép phục hồi thêm của choáng cơ tim. Mặc dù một giai đoạn nghỉ ngơi thất đã được chứng minh là hữu ích trong nhiều trường hợp, CPB kéo dài và những thất bại lặp đi lặp lại trong việc cắt có thể dẫn đến rối loạn đông máu xấu đi, nhấn mạnh tầm quan trọng của quyết định kịp thời để thiết lập hỗ trợ cơ học. Đặt IABP được đảm bảo trong giai đoạn nghỉ ngơi này. Suy thất kháng trị trong bối cảnh này đòi hỏi hỗ trợ cơ học tiên tiến hơn, bao gồm oxy hóa màng ngoài cơ thể (ECMO) hoặc thiết bị hỗ trợ thất (VAD); những lựa chọn cơ học này nên được thiết lập với ít do dự hơn nếu rối loạn chức năng thất trước phẫu thuật đã hiện diện (Hình 13.17). Hỗ trợ cơ học hoàn toàn có thể đóng vai trò như một cầu nối để phục hồi hoặc đến ghép hoặc như một liệu pháp thiết bị hỗ trợ thất trái (LVAD) đích. Một thảo luận chi tiết hơn về các lựa chọn thiết bị cho hỗ trợ cơ học, các thuốc thuốc tăng co bóp cơ tim khác nhau, và các chiến lược điều trị khác được trình bày sau đây.
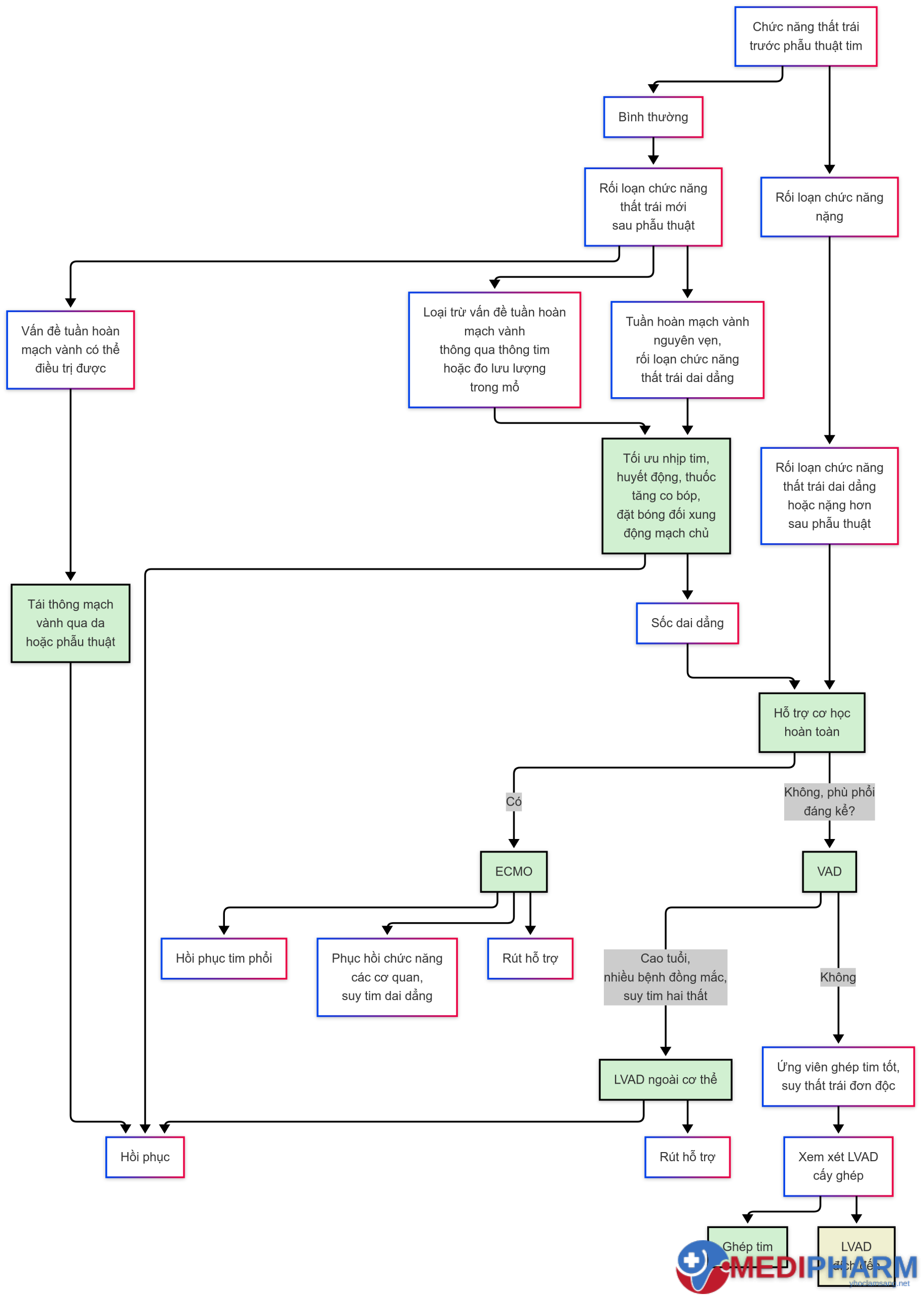
Hình 13.17 Thuật toán quản lý người bệnh suy thất sau phẫu thuật tim. ECMO: Oxy hóa màng ngoài cơ thể; IABP: bơm bóng đối xung trong động mạch chủ; LV: thất trái; LVAD: thiết bị hỗ trợ thất trái; PCI: can thiệp mạch vành qua da; VAD: thiết bị hỗ trợ thất.
TRẠNG THÁI CUNG LƯỢNG TIM THẤP SAU PHẪU THUẬT
Đánh giá
Đánh giá chung. Ngay khi đến ICU, người bệnh phẫu thuật tim phải được đánh giá kỹ lưỡng một cách có hệ thống. Một phần của đánh giá này nên bao gồm đường thở và thông khí, nhiệt độ cơ thể, mức điện giải huyết thanh, tình trạng acid-base, huyết động, và X quang ngực ban đầu sau phẫu thuật. Dữ liệu về bản chất của thủ thuật đã thực hiện, phản ứng của hệ thống tim mạch đối với thủ thuật, biến chứng trong mổ, thuốc hiện tại và trước phẫu thuật, và bệnh đồng mắc của người bệnh nên được thông báo cho nhóm ICU. Cung cấp oxy đầy đủ (một chức năng của cung lượng tim, nồng độ hemoglobin, và độ bão hòa oxy động mạch) là ưu tiên hàng đầu. Do đó, một đặc điểm trung tâm của đánh giá ban đầu là kiểm tra tất cả các thông số sinh lý và bệnh lý ảnh hưởng đến các yếu tố quyết định của cung cấp oxy và chức năng tim toàn cầu (Hình 13.18). Cung cấp oxy đầy đủ và loại bỏ CO2 có thể được xác nhận thông qua các phép đo độ bão hòa oxy mạch, đo oxy tĩnh mạch hỗn hợp, và áp lực khí động mạch.

Hình 13.18 Các thành phần của vận chuyển oxy. Đồ thị minh họa các yếu tố sinh lý quyết định vận chuyển oxy, bao gồm cung lượng tim, nồng độ hemoglobin và độ bão hòa oxy.
Nhịp tim và nhịp điệu là những yếu tố quyết định chính của cung lượng tim, và mọi nỗ lực được thực hiện để thiết lập và duy trì nhịp xoang bình thường và tần số đầy đủ trong giai đoạn hậu phẫu sớm. Loạn nhịp có thể đòi hỏi chuyển nhịp tim ngay lập tức, đặc biệt nếu dung nạp kém từ quan điểm huyết động. Rối loạn nhịp điệu cũng có thể do mất cân bằng điện giải hoặc acid-base, hạ thân nhiệt, các thuốc thuốc tăng co bóp cơ tim gây loạn nhịp, hoặc thậm chí một ống thông PA đặt không đúng chỗ kích ứng đường ra RV. Như đã thảo luận trước đó, những thay đổi ECG không mong đợi, như độ lệch đoạn ST hoặc sự phát triển sóng Q, rất có thể phản ánh thiếu máu cục bộ cơ tim hoặc PMI, điều này cũng có thể gây ra loạn nhịp.
Mặc dù có nỗ lực làm ấm lại trong mổ, hạ thân nhiệt còn sót lại thường được ghi nhận ở người bệnh phẫu thuật tim sau phẫu thuật, với nhiệt độ lõi dưới 35°C. Sự suy giảm đặc trưng về nhiệt độ sau khi tách CPB có thể được quy cho sự phân phối lại nhiệt trong cơ thể hoặc thực sự là mất nhiệt, đặc biệt nếu ngực vẫn mở trong một thời gian kéo dài sau khi làm ấm lại. Hạ thân nhiệt làm suy giảm chức năng tim, gây run (làm tăng đáng kể nhu cầu oxy cơ tim), làm trầm trọng thêm rối loạn nhịp điệu, và cản trở đông máu và chức năng tiểu cầu, điều này có thể góp phần vào chảy máu sau phẫu thuật. Để hạn chế những tác động có hại này, việc sử dụng chăn và các thiết bị sưởi ấm phụ trợ khác nên được thực hiện tích cực.
Nhận biết rối loạn điện giải và acid-base là một thành phần quan trọng khác của đánh giá. Các bất thường điện giải sau phẫu thuật điển hình ảnh hưởng tiêu cực đến chức năng thất bao gồm hạ kali máu, hạ magiê máu, và hạ canxi máu. Những thiếu hụt điện giải này nên được điều chỉnh tích cực và theo dõi. Tương tự, pH động mạch nên được kiểm tra và thường dao động rộng ở người bệnh phẫu thuật tim sau phẫu thuật. Các độ lệch pH từ bình thường theo bất kỳ hướng nào, bất kể nguyên nhân, đều ảnh hưởng bất lợi đến chức năng cơ tim và đáp ứng với các thuốc thuốc tăng co bóp cơ tim.
Khi đến ICU, nên chụp X quang ngực di động ngay lập tức. Các mục quan trọng bao gồm vị trí của ống nội khí quản và loại trừ tràn khí màng phổi, tràn máu màng phổi, hoặc xẹp thùy (Hình 13.19). Các đặc điểm quan trọng bổ sung bao gồm chiều rộng của bóng trung thất và vị trí chính xác của ống thông xâm lấn, dấu cản quang, dây thép xương ức, và ống dẫn lưu.

Hình 13.19 Suy hô hấp sớm ở người bệnh sau phẫu thuật đang thở máy thường khó đánh giá mà không có chụp X-quang ngực khẩn cấp. Tràn khí màng phổi, có thể gây áp lực trong lồng ngực và suy sụp huyết động, phải được phân biệt với xẹp phổi. X-quang ngực của người bệnh bị suy hô hấp sớm sau phẫu thuật mạch vành cho thấy tràn khí màng phổi phải căng lớn (A) được giải quyết nhanh chóng bằng đặt ống dẫn lưu ngực (B).
Đánh giá huyết động và siêu âm tim. Một ống thông định hướng bởi lưu lượng PA (Swan-Ganz) cho phép đo áp lực đổ đầy thất, cung lượng tim, và MVO2. Những ống thông này thường được sử dụng cho phẫu thuật tim có nguy cơ cao. Tuy nhiên, có những hạn chế đáng chú ý với các phép đo huyết động thu được qua ống thông PA. Ví dụ, các phép đo cung lượng tim thu được thông qua pha loãng nhiệt có thể không chính xác trong bối cảnh hở van ba lá. Tương tự, áp lực dương cuối thì thở ra (PEEP), một đặc điểm phổ biến của quản lý thông khí, có thể làm tăng nhân tạo áp lực đổ đầy. Hở van hai lá đáng kể có thể gây nhầm lẫn trong đánh giá chính xác áp lực mao mạch phổi bít. Shunt trong tim có thể phủ nhận tiện ích của các phép đo MVO2. Cuối cùng, vị trí không đúng hoặc thiết lập không đúng của ống thông PA có thể dẫn đến dữ liệu gây nhầm lẫn và quản lý không thích hợp. Do đó, mặc dù ống thông PA cung cấp thông tin người bệnh quan trọng, các điều kiện lâm sàng nên luôn được đánh giá và các hạn chế của ống thông PA được hiểu rõ.
Sau phẫu thuật tim, chỉ số tim ít nhất 2,2 L/phút/m2 thường được coi là cần thiết cho sự phục hồi bình thường. Điều chỉnh điều trị nhịp tim và nhịp điệu là quan trọng để tối ưu hóa cung lượng tim và thường đòi hỏi tạo nhịp tạm thời, ngoại biểu mô, nhĩ, và thất. Một khía cạnh cơ bản khác của quản lý sau phẫu thuật là duy trì tiền tải đầy đủ. Người bệnh phẫu thuật tim sau phẫu thuật thường thể hiện tình trạng giảm thể tích tương đối và trương lực mạch máu không ổn định do tiểu tiện tự phát, chảy máu đang diễn ra, rò rỉ mao mạch, và giãn mạch khi làm ấm lại. Kết quả cuối cùng của những thay đổi sinh lý này là tiền tải giảm, được chỉ ra bởi các phép đo áp lực mao mạch phổi bít (PCWP) và CVP thấp. Mở rộng thể tích có thể được thực hiện với việc sử dụng dịch truyền tinh thể hoặc keo, hoặc các sản phẩm máu. Điều kiện tiền tải tối ưu nên được cá nhân hóa, nhưng một phạm vi PCWP từ 14 đến 18 mm Hg đã được đề xuất. Người bệnh có thất trái phì đại đáng kể và không tuân thủ do hẹp động mạch chủ trước phẫu thuật có thể đòi hỏi áp lực đổ đầy cao hơn đáng kể để đạt được cung lượng tim đầy đủ.
Hậu tải thường tăng cao sau phẫu thuật tim, được chỉ ra bởi tăng huyết áp và kháng lực mạch máu hệ thống (SVR; >1200 dyn/s/cm5). Tần suất tăng cao thường thay đổi theo bệnh lý tim và thủ thuật phẫu thuật. Tỷ lệ được báo cáo dao động giữa 8% và 12% sau thay van và giữa 8% và 61% sau CABG. Các nguyên nhân tiềm ẩn bao gồm giảm độ nhạy của thụ thể áp lực, tăng hoạt động renin-angiotensin, tăng mức catecholamine, và đau sau phẫu thuật. Nếu cung lượng tim vẫn chưa tối ưu mặc dù có điều kiện tiền tải đầy đủ, giảm hậu tải bằng dược lý thường cải thiện thể tích tống máu và cung lượng tim. Quan trọng là, giảm hậu tải trong bối cảnh đổ đầy không đầy đủ có thể có hậu quả có hại, như nhịp tim nhanh bù trừ hoặc tăng kích thước nhồi máu.
Một số người bệnh thể hiện hội chứng giãn mạch ngay sau CPB, với SVR rất thấp và giảm phản ứng mạch máu. Hội chứng này, được đặc trưng thêm bởi hạ huyết áp nghiêm trọng và tăng yêu cầu về thể tích và thuốc co mạch, là kết quả của một phản ứng viêm hệ thống được khởi phát bởi CPB và có thể xảy ra ngay cả với chức năng thất bình thường trước phẫu thuật. Do sự giải phóng arginine vasopressin (AVP) trung gian phản xạ áp lực có khiếm khuyết có thể là nguyên nhân tiềm ẩn của hội chứng này, quản lý đòi hỏi sử dụng các thuốc co mạch để bình thường hóa hậu tải. Methylene blue và hydroxocobalamin đều đã được chứng minh là cải thiện huyết áp trong hội chứng giãn mạch sau phẫu thuật tim.
Đánh giá huyết động không nên xảy ra tại một thời điểm duy nhất. Người bệnh phẫu thuật tim sớm sau phẫu thuật thể hiện huyết động thay đổi nhanh chóng, và các điều trị hiếm khi mang lại cải thiện đột ngột. Do đó, nhiều đánh giá lặp lại về huyết động là được đảm bảo. Xu hướng nên được xác định và có tầm quan trọng lớn hơn trong việc ra lệnh can thiệp điều trị. Kiên nhẫn trong đánh giá xu hướng có thể dẫn đến hiểu biết tốt hơn về sinh lý tổng thể.
Nếu trạng thái cung lượng tim thấp sau phẫu thuật kéo dài và không đáp ứng với thao tác tiêu chuẩn của nhịp tim, tiền tải, và hậu tải, siêu âm tim có thể cung cấp thông tin bổ sung, như tình trạng đổ đầy thất, bản chất của rối loạn chức năng thất (toàn cầu, phân đoạn, phải hoặc trái), và liệu có bằng chứng về sự nén từ bên ngoài hay không. Khi các chỉ số ECG bất thường hoặc mức enzyme tim gợi ý thiếu máu cục bộ hoặc PMI, siêu âm tim có thể xác nhận các bất thường vận động thành và hướng dẫn liệu pháp thêm. Đối với người bệnh đã trải qua phẫu thuật van, trạng thái cung lượng tim thấp hoặc triệu chứng suy tim đòi hỏi siêu âm tim để loại trừ rò quanh van hoặc gián đoạn của việc sửa chữa. Cụ thể đối với các trường hợp sửa chữa van hai lá, có thể xảy ra vận động trước tâm thu của van và tắc nghẽn đường ra LV động, và được chẩn đoán tốt nhất bằng siêu âm tim. Siêu âm tim cũng có giá trị trong việc đánh giá tính đầy đủ của việc sửa chữa khuyết tâm thất.
Siêu âm tim có thể cung cấp dữ liệu bổ sung có giá trị để làm sáng tỏ chẩn đoán chèn ép tim. Ở người bệnh có tràn dịch màng ngoài tim chu vi, siêu âm tim thường phát hiện xẹp tâm trương RV, xẹp nhĩ phải, và xẹp nhĩ trái, đây là những dấu hiệu hữu ích của chèn ép tim. Bằng chứng gần đây cho thấy lõm vào tâm trương sớm của thành tự do LV và xẹp tâm trương LV có thể là một phát hiện siêu âm tim đặc biệt hữu ích để hỗ trợ chẩn đoán chèn ép tim. Các khối máu đông nén chọn lọc có thể ảnh hưởng đến tĩnh mạch chủ trên hoặc dưới hoặc tĩnh mạch phổi, dẫn đến chèn ép tim, và điều này thường có thể được xác định bằng siêu âm tim qua thành ngực hoặc TEE.
Chèn ép tim là do tích tụ chất lỏng hoặc máu đông trong trung thất, do đó hạn chế đổ đầy tâm trương của các tâm thất. Đáng chú ý, trong một số trường hợp, phù thành ngực và màng ngoài tim có thể gây nén đáng kể mà không có bằng chứng của máu đông hoặc tràn dịch. Các nghiên cứu chỉ ra rằng nó có thể xảy ra cấp tính ở 3% đến 6% người bệnh sau phẫu thuật tim. Các dấu hiệu đặc trưng của chèn ép tim cấp tính sau phẫu thuật bao gồm (1) tăng sự biến thiên huyết áp với hô hấp (mạch nghịch); (2) cân bằng và tăng cao CVP, áp lực tâm trương PA, và áp lực nhĩ trái hoặc PCWP; (3) giảm lượng nước tiểu; (4) dẫn lưu ống ngực quá mức hoặc, ngược lại, ngừng đột ngột dẫn lưu ống ngực, khi cục máu đông lớn làm tắc nghẽn ống ngực; (5) mở rộng trung thất trên X quang ngực; (6) cung lượng tim thấp (muộn); và (7) hạ huyết áp (muộn). Chèn ép tim được chẩn đoán xác định và xử lý bằng thăm dò phẫu thuật khẩn cấp và lấy khối máu tụ. Các biện pháp tạm thời bao gồm nạp dịch, hỗ trợ thuốc tăng co bóp cơ tim, và giảm áp lực đường thở (loại bỏ PEEP, thuốc gây mê, và giảm thể tích khí mỗi lần thở với tăng tần số thông khí). Mặc dù nhiều xét nghiệm có thể gợi ý chẩn đoán chèn ép tim, không có một nghiên cứu duy nhất nào có tính quyết định, và chẩn đoán vẫn là một phán đoán lâm sàng. Bởi vì tình trạng này dễ dàng điều trị được, nên áp dụng chiến lược tái thăm dò tích cực; tái thăm dò trong phòng mổ là có tính xác định, và, khi chèn ép tim không hiện diện, có rất ít rủi ro cho người bệnh. Điều trị kéo dài chèn ép tim bằng truyền dịch hoặc inotrope có thể dẫn đến suy sụp tuần hoàn, ngừng tim, và mở vết thương trong một bối cảnh nguy hiểm trong ICU. Tái thăm dò trì hoãn là một thất bại của phán đoán lâm sàng và có thể dẫn đến tử vong của người bệnh.
Các chiến lược quản lý tình trạng cung lượng tim thấp sau phẫu thuật
Tối ưu hóa nhịp tim và nhịp điệu. Các thông số huyết động đầu tiên cần được giải quyết trong quản lý cung lượng tim thấp sau phẫu thuật là nhịp tim và nhịp điệu. Duy trì nhịp xoang bình thường không thể được nhấn mạnh quá mức. Khi đạt được nhịp xoang, tốc độ tối ưu cho hầu hết người bệnh là từ 80 đến 100 nhịp/phút. Đồng bộ AV cung cấp tăng cường tiền tải cuối tâm trương và có thể tăng cung lượng tim lên 25% (xem Hình 13.15). Rối loạn nhịp tim phổ biến sau phẫu thuật tim và bao gồm nhịp xoang chậm, nhịp bộ nối, và blốc tim độ một, hai, hoặc ba. Những rối loạn này thường là tạm thời và có thể thứ phát sau dùng thuốc chẹn beta chu phẫu hoặc do rối loạn chuyển hóa từ ngừng tim do liệt tim. Thiếu máu cục bộ của hệ thống dẫn truyền do bảo vệ cơ tim không đầy đủ, hoặc tổn thương vĩnh viễn đến hệ thống dẫn truyền do chấn thương phẫu thuật trực tiếp là những nguyên nhân có thể khác.
Quản lý rối loạn nhịp tim phải được cá nhân hóa cho từng người bệnh và thường kết hợp sử dụng dây tạo nhịp tạm thời được đặt trong mổ. Nếu tạo nhịp ngoại biểu tạm thời không có sẵn, các lựa chọn thay thế bao gồm tạo nhịp qua tĩnh mạch hoặc qua thành ngực, hoặc điều trị dược lý cho loạn nhịp chậm (ví dụ, isoproterenol hoặc atropine). Đối với nhịp xoang chậm hoặc loạn nhịp bộ nối, tạo nhịp nhĩ đơn giản (phạm vi, 90 đến 110 nhịp/phút) là thích hợp. Ngược lại, blốc nút AV được điều trị bằng tạo nhịp AV. Với chiến lược này, khoảng AV tối ưu phụ thuộc vào nhịp tim được chọn (xem Hình 13.16). Điều quan trọng cần lưu ý là tạo nhịp AV dẫn đến mất chuỗi hoạt hóa thất bình thường và suy giảm chức năng thất từ 10% đến 15% cho một tiền tải và hậu tải nhất định. Do đó, cần phải điều chỉnh cẩn thận lựa chọn nhịp tim phải được tương quan với các phép đo cung lượng tim để xác định cài đặt tối ưu. Cài đặt nhịp tim chậm hơn có thể được ưa thích ở người bệnh có tắc nghẽn đường ra LV động. Trong những trường hợp này, nhịp tim nhanh ngăn cản đổ đầy thất và làm trầm trọng thêm tắc nghẽn đường ra.
Tiền tải và hậu tải. Các biện pháp điều trị để tối ưu hóa điều kiện tiền tải đã được thảo luận trước đó. Sốc giãn mạch, một trạng thái của hậu tải bị suy giảm nghiêm trọng, thường được quản lý hiệu quả với AVP. Tuy nhiên, hậu tải tăng cao nên được giảm bằng dược lý nếu cung lượng tim vẫn chưa tối ưu mặc dù có nạp dịch đầy đủ. Mức độ mà giảm hậu tải cải thiện thể tích tống máu phụ thuộc vào mối quan hệ áp lực-thể tích cuối tâm thu của mỗi người bệnh. Ở người bệnh có hở van hai lá và hở van động mạch chủ, giảm hậu tải có thể quan trọng hơn để tăng cường tống máu về phía trước. NTG, cardipine, và sodium nitroprusside (SNP) là các thuốc được sử dụng thường xuyên nhất để giảm hậu tải. SNP có thể làm trầm trọng thêm thiếu máu cục bộ cơ tim sau phẫu thuật bằng cách gây ra shunt trong mạch vành đáng kể. Tuy nhiên, SNP vẫn là thuốc ưa thích để điều trị tăng huyết áp sau phẫu thuật. NTG thường được sử dụng sau phẫu thuật CABG vì những tác dụng có lợi của nó trong việc cải thiện lưu lượng bàng hệ mạch vành và ngăn ngừa co thắt mạch vành.
Trạng thái thuốc tăng co bóp cơ tim. Rối loạn chức năng cơ tim sau phẫu thuật có thể đòi hỏi hỗ trợ thuốc tăng co bóp cơ tim khi các biện pháp tối ưu hóa nhịp tim, nhịp điệu, nồng độ hemoglobin, tiền tải, và hậu tải đã được sử dụng hết. Việc sử dụng thuốc thuốc tăng co bóp cơ tim để cải thiện chức năng tim phải được tiết chế cẩn thận vì kết quả là tăng tiêu thụ oxy cơ tim. Bảng 13.6 tóm tắt các thuốc thuốc tăng co bóp cơ tim hiện có để hỗ trợ dược lý chức năng tim. Thuốc thuốc tăng co bóp cơ tim thường được sử dụng bằng truyền liên tục qua ống thông tĩnh mạch trung tâm. Phần lớn thuốc thuốc tăng co bóp cơ tim hoạt động như chất chủ vận beta-adrenergic, dẫn đến tăng nồng độ cAMP và canxi nội bào. Những thuốc chủ vận beta-adrenergic này cũng thường được liên kết với những tác dụng gây loạn nhịp và nên được sử dụng một cách thận trọng. Hơn nữa, nhiều inotrope (ví dụ, dopamine, epinephrine, và norepinephrine) cũng có tính chất chủ vận alpha-adrenergic nổi bật và ở liều cao có thể gây ra các tác dụng co mạch nguy hiểm, dẫn đến tổn thương thiếu máu ở chi, mạc treo, hoặc thận. Các inotrope không thuộc adrenergic, như chất ức chế phosphodiesterase (ví dụ, amrinone, milrinone), có thể đặc biệt hiệu quả trong quản lý rối loạn chức năng tim phải. Sự kết hợp của milrinone và chất chủ vận thụ thể beta-adrenergic có thể có tác dụng hiệp đồng trong việc cải thiện chức năng cơ tim.
Bảng 13.6: Các thuốc điều trị cho suy thất sau phẫu thuật tim.
| Thuốc | Liều (mcg/kg/phút) | Hoạt hóa thụ thể | ĐÁP ỨNG SINH LÝ | ||||
|---|---|---|---|---|---|---|---|
| α1 β1 β2 | SVR | MAP | CO | HR | PAWP | ||
| Dopamine | <5 | + + | |||||
| >5 | ++ ++ | ↑↑ | ↑↑ | ↑ | ↑ | ↑ | |
| Dobutamine | 2-20 | ++ + | ↓ | ↑ | ↑↑ | ↓ | |
| Epinephrine | <0,05 | ++ + | ↓ | ↑ | ↑↑ | ↓ | |
| >0,05 | +++ + | ↑↑ | ↑↑ | ↑ | ↑ | ↑ | |
| Norepinephrine | 0,03-1,0 | +++ | ↑↑ | ↑↑ | ↑ | ||
| Isoproterenol | 0,03-0,15 | ++ ++ | ↓ | ↓ | |||
| Amrinone | 5-20 | PDEI | ↓ | ↑ | ↑ | ↑ |
α1: mạch máu ngoại vi; β1: cơ tim; β2: mạch máu ngoại vi và cơ tim; AR: hoạt hóa thụ thể adrenergic; CO: cung lượng tim; HR: nhịp tim; MAP: áp lực động mạch trung bình; PAWP: áp lực mao mạch phổi bít; PDEI: chất ức chế phosphodiesterase; SVR: kháng lực mạch máu hệ thống. ᵃ Liều tính theo đơn vị/phút.
Levosimendan, một chất làm nhạy canxi, cũng đã được sử dụng trong bối cảnh này, với nhiều nghiên cứu nhỏ hơn cho thấy lợi ích có thể có. Tuy nhiên, một thử nghiệm đa trung tâm quy mô lớn (Levosimendan ở Người bệnh Có Nguy cơ Cao Trải qua Phẫu thuật Tim [CHEETAH]) đã bị dừng sớm do vô ích (sau 506 người bệnh) với thất bại trong việc chứng minh sự khác biệt so với giả dược trong tỷ lệ tử vong 30 ngày.
Bơm bóng đối xung trong động mạch chủ. Khi các biện pháp thông thường không đạt được huyết động chấp nhận được, nên xem xét các thiết bị hỗ trợ tuần hoàn cơ học. Sau phẫu thuật tim, rối loạn chức năng thất đáng kể đòi hỏi hỗ trợ cơ học xảy ra ở dưới 5% người bệnh. Hầu hết những người bệnh này (60% đến 90%) có thể được ổn định với IABP, và chỉ một tỷ lệ nhỏ (0,2% đến 1%) đòi hỏi thiết bị hỗ trợ tuần hoàn tiên tiến hơn. Mục tiêu của hỗ trợ tuần hoàn cơ học ở người bệnh phẫu thuật tim sau phẫu thuật là cung cấp tuần hoàn đầy đủ và giảm công việc cơ tim, do đó cho phép phục hồi cơ tim bị choáng.
IABP đại diện cho hệ thống được sử dụng thường xuyên nhất để hỗ trợ cơ học LV, với ước tính >100.000 người bệnh được hỗ trợ hàng năm. Thiết kế phổ biến nhất bao gồm một ống được đặt qua da vào động mạch đùi chung sử dụng dây dẫn và một loạt các dụng cụ dãn nở. Việc đưa vào không có ống đã được ủng hộ để giảm biến chứng mạch máu ở người bệnh nhỏ hơn. Ống thông bóng có một lòng trung tâm để theo dõi áp lực động mạch và một lòng bên cho khí helium di chuyển; thể tích bóng điển hình là 40 mL, và đường kính là 8 đến 9,5 F. Ống thông bóng được đặt ở động mạch chủ ngực xuống, ngay phía xa động mạch dưới đòn trái. Vị trí thích hợp phải được xác nhận bằng soi chiếu huỳnh quang hoặc siêu âm tim. Bệnh động mạch xơ vữa chủ-chậu nặng có thể ngăn cản việc đặt an toàn bằng đường qua da đùi. Sự hiện diện của bệnh phình động mạch chủ hoặc mạch chậu hoặc sự hiện diện của một mảnh ghép nhân tạo động mạch chủ-đùi làm tăng nguy cơ đặt qua đường đùi, nhưng việc đặt IABP thành công vẫn khả thi trong cả hai bối cảnh này. Nếu không thể đặt qua đường đùi, IABP có thể được đặt qua động mạch chủ lên, thường với bóng được đặt qua một mảnh ghép polytetrafluoroethylene hoặc tĩnh mạch được khâu vào động mạch chủ. Kỹ thuật này ngăn chảy máu và cho phép thiết bị được cố định tốt. Việc loại bỏ IABP khỏi động mạch chủ lên thường đòi hỏi người bệnh trở lại phòng mổ để loại bỏ mở. Cuối cùng, sự hiện diện của hở van động mạch chủ vừa hoặc nặng đại diện cho một chống chỉ định tương đối, vì đối xung động mạch chủ không hiệu quả.
Một khi IABP được đặt đúng vị trí, người vận hành phải thực hiện một số lựa chọn trên bảng điều khiển. Bơm bóng có thể được kích hoạt theo một trong ba cách: bởi áp lực động mạch, sóng R của ECG, hoặc xung tạo nhịp từ máy tạo nhịp nhân tạo. Thông thường, kích hoạt sóng R hiệu quả nhất. Tuy nhiên, nếu người bệnh có loạn nhịp thường xuyên, như PVC hoặc rung nhĩ, áp lực động mạch có thể cung cấp một kích hoạt tốt hơn. Người vận hành cũng chọn liệu đối xung bóng sẽ xảy ra với mỗi chu kỳ tim (1:1) hay với mỗi chu kỳ khác hoặc mỗi chu kỳ thứ ba (1:2 hoặc 1:3). Thông thường, hỗ trợ 1:1 được sử dụng ban đầu, và 1:2 hoặc 1:3 được dành cho khi thiết bị được cai. Với loạn nhịp thường xuyên hoặc nhịp tim lớn hơn 120 nhịp/phút, hỗ trợ 1:2 có thể hiệu quả hơn. Tuy nhiên, cài đặt quan trọng nhất là thời gian bơm và xẹp bóng liên quan đến chu kỳ tim. Bơm bóng nên bắt đầu trong tâm trương sớm, ngay sau khấc động mạch chủ (đóng van động mạch chủ). Xẹp bóng nên kết thúc ngay trước tâm thu và tạo ra giảm áp lực tâm trương. Bơm đúng cách phục vụ để tăng tưới máu mạch vành, và xẹp đúng thời điểm giảm hậu tải LV và tiêu thụ oxy (xem Hình 13.13).
Thông thường, nỗ lực ngừng hỗ trợ IABP nên tiến hành cẩn thận và chỉ sau khi người bệnh được cai từ hỗ trợ thuốc tăng co bóp cơ tim đáng kể. Người bệnh thường được điều trị với thể tích đáng kể để hỗ trợ huyết động và nên được lợi tiểu tích cực trước khi loại bỏ thiết bị. Trong quá trình cai hỗ trợ IABP, độ bão hòa MVO2, cung lượng tim, và áp lực đổ đầy thất nên được theo dõi cẩn thận. Một suy giảm nhẹ trong huyết động có thể được dự đoán, nhưng giảm đáng kể cung lượng tim hoặc độ bão hòa tĩnh mạch hỗn hợp hoặc tăng lớn áp lực đổ đầy chỉ ra rằng chức năng thất chưa phục hồi đủ. Phát triển loạn nhịp thất hoặc nhĩ là một chỉ báo khác rằng không nên ngừng hỗ trợ IABP.
Đặt IABP sau phẫu thuật không đòi hỏi chống đông máu ngay lập tức. Người bệnh đòi hỏi hỗ trợ IABP sau phẫu thuật trong hơn 48 đến 72 giờ thường được chống đông máu bằng heparin, được đưa vào dưới dạng truyền liên tục mà không có liều bolus. Bivalirudin cũng đã được sử dụng để chống đông máu trong giai đoạn hậu phẫu sớm ở người bệnh có thể có giảm tiểu cầu do heparin. Không chống đông máu ở người bệnh có IABP trong một khoảng thời gian kéo dài có thể làm tăng nguy cơ biến chứng mạch máu. Biến chứng mạch máu đại diện cho bệnh tật thường gặp nhất liên quan đến IABP; những vấn đề này dao động từ tụ máu đơn giản hoặc phình động mạch giả đến thiếu máu chi nghiêm trọng hơn. Với IABP đùi, mạch bàn chân hoặc tín hiệu Doppler nên được theo dõi mỗi 2 giờ. Nếu không thể đánh giá tín hiệu Doppler bàn chân ở chi bên đó, rút introducer có thể thỉnh thoảng dẫn đến trở lại tưới máu chi đáng kể. Tuy nhiên, nếu tín hiệu Doppler bàn chân vẫn không có, cách tiếp cận an toàn nhất là loại bỏ bơm và đặt một thiết bị mới ở động mạch đùi đối bên. Nếu việc loại bỏ IABP thất bại trong việc khôi phục tưới máu cho chi, thăm dò phẫu thuật động mạch đùi được đảm bảo với thuyên tắc bằng ống thông Fogarty và sửa chữa động mạch. Nếu dòng vào động mạch đã bị mất, có thể thực hiện bắc cầu đùi-đùi.
Một biến chứng được công nhận tốt khác là vỡ bóng, với tỷ lệ được báo cáo từ 0,5% đến 6%. Nó được báo hiệu bằng máu trong ống thông bóng, và hậu quả quan trọng bao gồm thuyên tắc khí helium, nhiễm trùng, và mất hỗ trợ thất. IABP nên được dừng và loại bỏ ngay lập tức khi chẩn đoán này được thực hiện.
Oxy hóa màng ngoài cơ thể qua tĩnh mạch-động mạch. Quyết định tiến hành hỗ trợ tuần hoàn cơ học (MCS) tiên tiến hơn là rất quan trọng. Ví dụ, một người bệnh có thể được hỗ trợ với liều rất cao của epinephrine hoặc norepinephrine (>0,1 mg/kg/phút) trong nhiều giờ với huyết động không đầy đủ. Trong những kịch bản này, tổn thương thận hoặc mạc treo có thể xảy ra, hoặc người bệnh có thể trải qua ngừng tim. Do đó, một quyết định kịp thời cho MCS vẫn là một yếu tố quyết định quan trọng của kết quả tích cực. Nói chung, inotrope liều cao và IABP nên được thử đầu tiên. Hầu hết người bệnh thể hiện ổn định huyết động hoặc cải thiện dần dần. Nếu người bệnh không ổn định hoặc cải thiện trong vài giờ, nhóm điều trị nên tiến hành nhanh chóng đến MCS. Chờ đợi sự suy thoái tiến triển hơn với thiểu niệu, nhiễm toan, hoặc loạn nhịp là một lỗi phổ biến, và nó ngăn cản kết quả thành công. Sự quen thuộc lớn hơn với các chiến lược MCS thường dẫn đến ứng dụng sớm hơn và cải thiện kết quả.
Hỗ trợ oxy hóa màng ngoài cơ thể qua tĩnh mạch-động mạch (VA-ECMO) đã trở thành chiến lược hỗ trợ phổ biến nhất cho người bệnh không thể cai CPB. Hầu hết các trung tâm sẽ sử dụng IABP trước sau đó đến ECMO nếu chỉ hỗ trợ IABP không đầy đủ. Đáng chú ý, không giống như hỗ trợ IABP, VA-ECMO cung cấp trao đổi khí cũng như và không đòi hỏi tống máu LV tự nhiên. Do đó, ECMO tạo thành một phương pháp tạm thời để cung cấp hỗ trợ tim và phổi hoàn toàn. Kinh nghiệm ban đầu với ECMO cho sốc tim sau mổ báo cáo tỷ lệ sống sót kém (25%), nhưng tỷ lệ sống sót đã dần dần cải thiện lên 40% với những tiến bộ kỹ thuật trong thiết kế mạch và bộ trao đổi khí.
Trong một nghiên cứu trên 517 người bệnh nhận ECMO cho sốc sau mổ tim, hỗ trợ trung bình là 3,28 ngày, và 63,3% cai ECMO thành công. Tuy nhiên, chỉ có 24,8% tất cả người bệnh sống đến xuất viện.
Một đánh giá hệ thống gần đây đã được tiến hành đánh giá kết quả của ECMO qua 20 nghiên cứu quan sát (2877 người bệnh) trong sốc tim sau mổ. Tỷ lệ sống sót chung đến xuất viện là 34,0% (30,0%-38,0%), với tỷ lệ sống sót 1 năm là 24,0% (19,05%-30,0%). Các yếu tố nguy cơ tử vong sau hỗ trợ ECMO trong sốc tim bao gồm tuổi >65, lactate máu cao hơn, suy thận, thời gian hỗ trợ ECMO kéo dài hơn, và biến chứng thần kinh.
Một mạch ECMO điển hình bao gồm ống thông để dẫn lưu và dòng vào, một bơm ly tâm, một bộ trao đổi khí màng, và một bộ trao đổi nhiệt. Đơn vị được xây dựng với cấu hình tĩnh mạch-tĩnh mạch hoặc tĩnh mạch-động mạch; cái trước cung cấp chỉ hỗ trợ phổi (trao đổi khí), trong khi cái sau cung cấp cả hỗ trợ tim và phổi. Đặt ống thông cho VA-ECMO có thể được thực hiện trung tâm, sử dụng động mạch chủ và nhĩ phải, hoặc ngoại vi qua động mạch và tĩnh mạch đùi. Một bệnh tật quan trọng đối với người bệnh được hỗ trợ trên ECMO ngoại vi là biến chứng mạch máu dẫn đến thiếu máu chi. Tỷ lệ của biến chứng này dao động giữa 10,0% và 20,0% và có thể được giảm bớt bằng cách sử dụng một ống thông tưới máu trước xuôi dòng xa. Điều này thường bao gồm một ống thông 5- đến 7-French được đưa vào động mạch đùi nông và được gắn với đường ống máu vào ống thông động mạch chính. Các hạn chế bổ sung liên quan đến ECMO bao gồm không có khả năng giảm gánh nặng trực tiếp cho thất trái, điều này có thể dẫn đến áp lực siêu sinh lý trong tuần hoàn phổi và tổn thương phổi.
Thiết bị hỗ trợ thất. Lựa chọn loại VAD phù hợp nhất cho người bệnh có suy thất sau phẫu thuật rất phức tạp. Hình 13.20 cung cấp một tóm tắt về các VAD có sẵn. Ưu điểm của các thiết bị ngoài cơ thể bao gồm (1) dễ dàng cấy ghép, (2) khả năng cai, (3) dễ dàng loại bỏ, và (4) lựa chọn hỗ trợ hai thất (cả thiết bị hỗ trợ thất phải [RVAD] và LVAD). Mặt khác, các hệ thống LVAD trong cơ thể hoặc cấy ghép được (HeartWare và HeartMate III; Thoratec, Pleasanton, CA) (Hình 13.21 và 13.22) có những ưu điểm sau: (1) chúng cung cấp khả năng di chuyển lớn hơn và cho phép xuất viện từ ICU hoặc bệnh viện, (2) chúng có độ bền lớn hơn và có thể hỗ trợ người bệnh trong nhiều tháng hoặc năm, và (3) chúng được phê duyệt như cầu nối đến ghép hoặc liệu pháp đích. Do đó, các thiết bị ngoài cơ thể thích hợp hơn cho người bệnh có khả năng chỉ yêu cầu hỗ trợ ngắn hạn và có thể trải qua phục hồi thất. Chúng cũng thích hợp hơn cho người bệnh cần hỗ trợ hai thất. Thiết bị cấy ghép được sẽ là lựa chọn tốt hơn nếu khả năng phục hồi thất không có và người bệnh là ứng cử viên thích hợp cho ghép. Chức năng LV suy giảm nghiêm trọng trước phẫu thuật có thể dẫn đến chiến lược có kế hoạch về hỗ trợ LVAD trong cơ thể sau phẫu thuật như một chiến lược giải cứu nếu chức năng tim hạn chế sau phẫu thuật tim thông thường.

Hình 13.20 Các lựa chọn khác nhau cho thiết bị hỗ trợ tuần hoàn cơ học. Sự khác biệt quan trọng tồn tại, dựa trên chiến lược hỗ trợ ưa thích.

Hình 13.21 Minh họa về hệ thống Impella. Hệ thống dựa trên bơm dòng trục được gắn trên ống thông. Bên trái là hệ thống Impella 2.5/5 và bên phải là Impella RP.

Hình 13.22 Bơm HeartWare minh họa vị trí của bơm và mảnh ghép đường ra.
Mặt khác, chức năng thất bình thường trước phẫu thuật và chức năng thất kém không lường trước được sau phẫu thuật tim có thể để lại hy vọng lớn hơn cho sự phục hồi, và do đó hỗ trợ bằng VAD ngoài cơ thể có thể thích hợp hơn. Mô tả chi tiết về các loại cụ thể của VAD ngoài cơ thể và cấy ghép được theo sau. (Xem Hình 13.23.)

Hình 13.23 Bơm HeartMate III minh họa vị trí của bơm và mảnh ghép đường ra.
Một số bơm ly tâm thương mại có sẵn, tất cả đều hiển thị vận tốc đầu bơm (tính bằng vòng mỗi phút [RPM]) cũng như lưu lượng. Người vận hành thường có thể tăng RPM để đạt được lưu lượng bơm cao hơn dần dần. Nói chung, RPM được đặt thấp nhất có thể để đạt được dòng chảy lớn hơn 2,0 L/phút/m2; cách tiếp cận này hạn chế hiện tượng tan máu có thể xảy ra ở RPM cao hơn. Cuối cùng, lưu lượng với hệ thống này phụ thuộc vào kích thước và vị trí ống thông, tiền tải, và cài đặt RPM. Với loại hỗ trợ này, áp lực đổ đầy thất được theo dõi và giữ trong phạm vi sinh lý bình thường với truyền dịch keo hoặc các sản phẩm máu.
CentriMag. CentriMag (Thoratec, hiện là Abbott, Santa Clara, CA) là một bơm ly tâm ngoài cơ thể được sử dụng rộng rãi đã được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt, có thể cung cấp lên đến 10 L/phút lưu lượng máu. Nó có một rotor được treo từ tính để giảm ma sát và tan máu. Hệ thống CentriMag có thể được sử dụng cho cả hỗ trợ LV hoặc RV, cũng như bơm trong mạch ECMO.
Hệ thống Impella. Trong thập kỷ qua, các lựa chọn qua da cho hỗ trợ thất đã được phát triển, kiểm tra lâm sàng, và được FDA phê duyệt. Hệ thống phổ biến nhất là bơm Impella (Abiomed Inc, Danvers, MA) (Hình 13.23). Các hệ thống Impella 2.5 và 5.0 (Abiomed Inc) là các bơm lưu lượng trục được gắn trên ống thông, được điều khiển bằng điện, có thể được đặt qua van động mạch chủ và được sử dụng để giảm gánh nặng cho LV và hỗ trợ huyết áp hệ thống. Máu đi vào thiết bị qua một lỗ vào được đặt trong LV và sau đó được bơm ra phía trên van động mạch chủ. Các chiến lược đưa vào đã bao gồm động mạch đùi qua da và mở, động mạch nách, và động mạch chủ lên trực tiếp. Các hạn chế quan trọng của thiết bị này bao gồm tỷ lệ cao của sai vị trí hoặc di chuyển ống thông. Hơn nữa, khi RPM cao hơn được sử dụng, những thiết bị này liên quan đến tan máu đáng kể, do kích thước ống thông nhỏ và áp lực cắt trên hồng cầu. Biến chứng mạch máu tại vị trí đưa vào cũng phổ biến. Cuối cùng, khi so sánh với ECMO, hệ thống Impella cung cấp ít hỗ trợ huyết động hơn và không hỗ trợ trao đổi khí.
Nhiều bơm này đòi hỏi chống đông máu sớm bằng heparin để ngăn ngừa hình thành huyết khối trong đầu bơm. Liệu pháp kháng tiểu cầu với aspirin cũng nên được xem xét. Mục tiêu của chống đông máu thường là thời gian đông máu hoạt hóa từ 180 đến 200 giây hoặc thời gian prothrombin một phần khoảng 60 đến 80 giây. Chống đông máu phải cân bằng với chảy máu sau phẫu thuật và rối loạn đông máu, thường là vấn đề ở những người bệnh này. Hầu hết các bác sĩ phẫu thuật trì hoãn chống đông máu cho đến khi chảy máu sau phẫu thuật đã giảm xuống dưới 100 mL dẫn lưu ống ngực mỗi giờ. Kiểm tra định kỳ các bơm/bộ trao đổi khí là cần thiết, với thay đổi khi cần. Hơn nữa, tăng chống đông máu có thể được đảm bảo trong thời gian cai khi tỷ lệ lưu lượng được giảm.
Sau khi cấy ghép một thiết bị VAD ngoài cơ thể, có một số mục tiêu quản lý người bệnh quan trọng. Đầu tiên, chảy máu phải được kiểm soát để người bệnh có thể được chống đông máu đúng cách để ngăn ngừa huyết khối tắc mạch. Ngưng chảy máu sau phẫu thuật và đạt được chống đông máu thích hợp là rất quan trọng đối với kết quả tích cực. Ban đầu, những thiết bị này nên cung cấp giảm gánh nặng thất hoàn toàn, và inotrope nên được cai tích cực. Chức năng cơ quan cuối phải được theo dõi và hỗ trợ; lợi tiểu nên được kích thích để làm sạch phù phổi. Người bệnh có thể yêu cầu các giai đoạn lọc máu liên tục nếu chức năng thận bị suy giảm nghiêm trọng. Chức năng thần kinh được đánh giá hàng ngày. Siêu âm tim và nỗ lực cai có thể được bắt đầu sớm nhất là 3 ngày sau khi cấy ghép, nhưng một số người bệnh có thể đòi hỏi nhiều tuần hỗ trợ trước khi xảy ra phục hồi thất.
LVAD cấy ghép được (xem Bảng 13.7) đã nhận được sự phê duyệt của FDA như cầu nối đến ghép để phục hồi hoặc như liệu pháp đích. Đường dây điện được dẫn ra khỏi bụng trên và là thành phần duy nhất ra khỏi cơ thể. Những thiết bị này nhận dẫn lưu từ một ống thông đặt ở đỉnh LV; dòng ra là thông qua một mảnh ghép đến động mạch chủ lên. Những tiến bộ gần đây trong những thiết bị này đã dẫn đến cải thiện đáng kể kết quả của người bệnh cả trong ngắn hạn và dài hạn. LVAD cấy ghép được có ưu điểm chính là cho phép phục hồi thể chất hoàn toàn. Người bệnh với những thiết bị này có thể nhanh chóng tiếp tục đi lại và được xuất viện về nhà. Một số người bệnh thậm chí trở lại làm việc với những thiết bị này.
Bảng 13.7: Ví dụ về hỗ trợ cơ học cho suy thất.
| Thiết bị | Thiết kế bơm | Chỉ định |
|---|---|---|
| Hỗ trợ ngoài cơ thể tạm thời | ||
| Oxy hóa màng ngoài cơ thể | Ly tâm | Suy tim-phổi, cầu nối đến hồi phục |
| BioMedicus | Ly tâm | Rối loạn chức năng thất sau phẫu thuật tim, cầu nối đến hồi phục |
| Levitronix CentriMag | ||
| Hỗ trợ mạn tính trong cơ thể phổ biến | ||
| Thoratec HeartMate III | Ly tâm | Cầu nối đến ghép tim, liệu pháp đích |
| HeartWare | Ly tâm | Cầu nối đến ghép tim, liệu pháp đích |
Trong lịch sử, các biến cố huyết khối tắc mạch ảnh hưởng đến tới 20% người bệnh được hỗ trợ bằng LVAD cấy ghép được. Tuy nhiên, các thiết bị thế hệ mới hơn với rotor được treo từ tính hoàn toàn và thuật toán thay đổi tốc độ để tạo ra một số nhịp đập đã giảm đáng kể tỷ lệ biến cố huyết khối tắc mạch, bao gồm đột quỵ. Các biến cố bất lợi khác tiếp tục hạn chế ứng dụng rộng rãi hơn của những LVAD cấy ghép được này, bao gồm tỷ lệ cao chảy máu tiêu hóa, nhiễm trùng liên quan đến thiết bị, và suy tim phải. Thay đổi thiết kế thiết bị trong tương lai như các hệ thống cấy ghép hoàn toàn với cấp nguồn qua da có thể giảm một số tác dụng phụ này.
RỐI LOẠN CHỨC NĂNG THẤT PHẢI CHU PHẪU
Nguyên nhân
Các hội chứng cung lượng tim thấp chu phẫu thường được quy cho suy giảm LV hoặc hai thất, nhưng một số người bệnh thể hiện rối loạn chức năng RV đơn độc. Tỷ lệ suy RV cấp tính sau mổ tim kháng trị có phạm vi báo cáo từ 0,04% đến 0,1%, nhưng rối loạn chức năng RV cũng xảy ra ở 2% đến 3% người bệnh ghép tim sau phẫu thuật và gần 20% đến 30% người nhận LVAD. Rối loạn chức năng RV sau phẫu thuật có thể xuất hiện ngay cả khi chức năng RV trước phẫu thuật bình thường. Tuy nhiên, suy giảm chức năng RV trước phẫu thuật có thể dự đoán rối loạn chức năng RV nghiêm trọng hơn sau phẫu thuật. Trong bối cảnh chu phẫu, các bất thường về hiệu suất RV có thể liên quan đến rối loạn chức năng LV, thiếu máu cục bộ hoặc nhồi máu RV, bảo vệ cơ tim không đầy đủ, tăng kháng lực mạch máu phổi (PVR), và thay đổi cân bằng liên thất. Trong quá trình hỗ trợ LVAD, sự dịch chuyển sang trái của vách liên thất xảy ra khi LV được giảm gánh nặng. Sự thay đổi này trong cân bằng liên thất dẫn đến giảm đáng kể co bóp RV và hậu tải có thể biểu hiện như rối loạn chức năng RV, đặc biệt với thiếu máu cục bộ RV trước hoặc trong phẫu thuật.
Tương đối so với thất trái, thất phải có thành mỏng có dự trữ cơ giảm đáng kể, khiến nó nhạy cảm hơn với sự tăng hậu tải (PVR). Sự tăng PVR có thể đảo ngược trong và sau CPB đã được mô tả và có thể được quy cho sự nén ngoài mạch máu do ứ đọng phổi, các chất hoạt mạch được giải phóng từ tiểu cầu và bạch cầu hoạt hóa, hoặc tắc nghẽn các giường mạch máu phổi bởi bạch cầu hoặc kết tập tiểu cầu. Một khi đã thiết lập, rối loạn chức năng RV trong giai đoạn chu phẫu có ảnh hưởng có hại đến hiệu suất tim toàn cầu và có thể tự duy trì trừ khi được điều trị thích hợp. Cụ thể, thể tích tống máu RV giảm sẽ làm giảm đổ đầy LV, và giãn RV có thể gây ra dịch chuyển sang trái của vách liên thất và suy giảm khả năng giãn LV sau đó. Sự giảm cung lượng LV kết quả sẽ làm trầm trọng thêm RV đã rối loạn chức năng.
Chẩn đoán
Diễn giải chính xác chức năng RV rất phức tạp. Các thông số huyết động gợi ý rối loạn chức năng RV bao gồm cung lượng tim thấp do đổ đầy LV không đầy đủ, CVP tăng cao rõ rệt (>18 mm Hg), và PCWP bình thường hoặc thấp do đổ đầy nhĩ trái kém. Trong các trường hợp rối loạn chức năng RV nghiêm trọng, áp lực PA thấp do khả năng làm việc của RV giảm. Đánh giá siêu âm tim là một công cụ chẩn đoán quan trọng để xác định tình trạng chức năng RV và xác định các nguyên nhân tiềm ẩn của suy giảm RV. Hình ảnh siêu âm tim cổ điển của suy RV đơn độc là một RV giãn với LV nhỏ, trống, và tăng co bóp. Siêu âm tim có thể định lượng chức năng RV bằng đo phân suất tống máu RV, cung cấp đánh giá định tính về kích thước RV và cấu hình của vách liên thất, và phát hiện vô động hoặc vận động nghịch thường của thành tự do RV, chỉ ra tổn thương thiếu máu cục bộ tiềm ẩn hoặc nhồi máu.
Quản lý
Điều trị rối loạn chức năng RV nên bắt đầu với tối ưu hóa nhịp tim và nhịp điệu để tối đa hóa đóng góp của nhĩ vào đổ đầy RV. Cũng như với điều trị rối loạn chức năng LV, có thể cần tạo nhịp nhĩ hoặc AV tạm thời. Tiền tải, được phản ánh bởi CVP, nên được tăng cường bằng nạp dịch, với điều kiện có sự tăng tương ứng trong cung lượng tim. Nỗ lực tăng cường sức co bóp của RV thông qua sử dụng các thuốc kinh điển (ví dụ, epinephrine, norepinephrine, và dopamine) có thể nghịch lý làm tăng co mạch PA và PVR và do đó làm trầm trọng thêm suy RV. Thay vào đó, chất ức chế phosphodiesterase (ví dụ, milrinone, amrinone) là các điều trị dược lý thích hợp hơn vì tác dụng thuốc tăng co bóp cơ tim dương của chúng và khả năng giảm áp lực PA và PVR đồng thời. Giãn mạch phổi chọn lọc có thể đạt được với oxit nitric hít vào để tối ưu hóa chức năng RV với giảm hậu tải có mục tiêu. Các liệu pháp hiệu quả bổ sung cho giãn mạch phổi bao gồm sildenafil uống và prostaglandin hít, như iloprost. Một số tình trạng có thể điều trị có thể làm tăng PVR, bao gồm tăng CO2 máu, giảm oxy máu, tràn dịch màng phổi, và viêm phổi. Các tình trạng này nên được xác định và điều trị. Cuối cùng, rối loạn chức năng RV kháng trị có thể đòi hỏi đặt RVAD. Các lựa chọn cho hỗ trợ RVAD bao gồm một hệ thống đặt phẫu thuật với đặt ống thông mở nhĩ phải và PA và sử dụng một bơm ly tâm ngoài cơ thể. Một hạn chế của chiến lược hỗ trợ này là nhu cầu tái phẫu thuật qua một đường mổ ngực lớn để loại bỏ RVAD. Các hệ thống qua da cũng đã được phát triển; ví dụ, Impella RP (Abiomed) sử dụng một bơm lưu lượng trục dựa trên ống thông được đặt vào tĩnh mạch đùi và được định vị qua tim phải, lấy máu vào tại chỗ nối nhĩ phải/tĩnh mạch chủ dưới và bơm ra vào PA chính (Hình 13.21). Một hệ thống khác được đưa vào qua da là hệ thống Protek Duo (TandemHeart; TandemLife, Pittsburgh, PA). Hệ thống này bao gồm một ống thông với hai lòng riêng biệt. Máu được dẫn lưu vào ống thông tại nhĩ phải và sau đó được đẩy bằng một bơm ly tâm ngoài cơ thể qua một lòng cung cấp vào PA chính. Một nghiên cứu gần đây của nhóm chúng tôi trên 43 người bệnh đòi hỏi RVAD ngoài cơ thể; 67% (n = 29) được cấy ghép đồng thời, và 33% (n = 14) được cấy ghép như một giai đoạn sau LVAD. Tỷ lệ bệnh tật và tử vong của chế độ hỗ trợ hai thất này vẫn còn cao. Hai phần ba những người bệnh này có thể được cai xuống một LVAD đơn độc. Tỷ lệ tử vong 30 ngày cho đoàn hệ này là 14%. Tỷ lệ tử vong tổng thể trong giai đoạn nghiên cứu cho các lần cấy ghép giai đoạn là 71% so với 45% cho các lần cấy ghép đồng thời (P = 0,101). Ngoài ra, cấy ghép RVAD giai đoạn mang tỷ lệ suy thận sau phẫu thuật cao hơn đáng kể (64% so với 28%; P = 0,044). Những phát hiện này một lần nữa nhấn mạnh tầm quan trọng của việc ứng dụng sớm MCS bên phải trước khi xảy ra tổn thương cơ quan cuối.
HẾT CHƯƠNG 13.
Bảng chú giải thuật ngữ Anh – Việt – Chương 13
| STT | Thuật ngữ tiếng Anh | Phiên âm | Nghĩa Tiếng Việt |
|---|---|---|---|
| 1 | Perioperative | /ˌperēˈäpərədiv/ | Chu phẫu (thời kỳ trước, trong và sau phẫu thuật) |
| 2 | Ischemia | /iˈskēmēə/ | Thiếu máu cục bộ |
| 3 | Infarction | /inˈfärkSH(ə)n/ | Nhồi máu |
| 4 | Ventricular failure | /venˈtrikyələr ˈfeɪljər/ | Suy thất |
| 5 | Myocardial | /ˌmaɪəˈkɑrdiəl/ | Cơ tim |
| 6 | Electrocardiographic | /iˌlɛktrəˌkɑrdiəˈɡræfɪk/ | Điện tâm đồ |
| 7 | Cardiac enzymes | /ˈkɑrdiak ˈɛnzaɪmz/ | Enzyme tim |
| 8 | Wall motion abnormalities | /wɔl ˈmoʊʃən æbnɔrˈmælɪtiz/ | Bất thường vận động thành |
| 9 | Ejection fraction | /iˈʤɛkʃən ˈfrækʃən/ | Phân suất tống máu |
| 10 | Atrioventricular | /ˌeɪtrioʊvɛnˈtrɪkjələr/ | Nhĩ thất |
| 11 | Dyskinesia | /dɪskɪˈniʒə/ | Vận động bất thường |
| 12 | Hypokinetic | /ˌhaɪpəʊkɪˈnɛtɪk/ | Giảm vận động |
| 13 | Normokinetic | /ˌnɔːməʊkɪˈnɛtɪk/ | Vận động bình thường |
| 14 | Creatine kinase | /ˈkriəˌtin ˈkaɪˌneɪs/ | Creatine kinase |
| 15 | MB isoenzyme | /ɛm bi ˌaɪsəʊˈɛnzaɪm/ | Isoenzyme MB |
| 16 | Tachyarrhythmia | /ˌtækiəˈrɪðmiə/ | Loạn nhịp nhanh |
| 17 | Fibrillation | /fɪbrɪˈleɪʃən/ | Rung |
| 18 | Q-wave | /kju weɪv/ | Sóng Q |
| 19 | Transmural necrosis | /trænzˈmjʊərəl nəˈkroʊsɪs/ | Hoại tử xuyên thành |
| 20 | Troponin | /ˈtrəʊpənɪn/ | Troponin |
| 21 | T isoform | /ti ˈaɪsəʊfɔːm/ | Dạng đồng phân T |
| 22 | I isoform | /aɪ ˈaɪsəʊfɔːm/ | Dạng đồng phân I |
| 23 | Contraction band necrosis | /kənˈtrækʃən bænd nəˈkroʊsɪs/ | Hoại tử băng co thắt |
| 24 | Reperfusion injury | /riːpəˈfjuːʒən ˈɪnʤəri/ | Tổn thương tái tưới máu |
| 25 | Cardioplegia | /ˌkɑːdiəʊˈpliːʤiə/ | Liệt tim |
| 26 | Crystalloid cardioplegia | /ˈkrɪstəlɔɪd ˌkɑːdiəʊˈpliːʤiə/ | Dung dịch liệt tim tinh thể |
| 27 | Blood cardioplegia | /blʌd ˌkɑːdiəʊˈpliːʤiə/ | Dung dịch liệt tim máu |
| 28 | Retrograde delivery | /ˈrɛtrəˌɡreɪd dɪˈlɪvəri/ | Truyền ngược dòng |
| 29 | Coronary sinus | /ˈkɔrəˌnɛri ˈsaɪnəs/ | Xoang vành |
| 30 | Subendocardial | /ˌsʌbˌɛndoʊˈkɑrdiəl/ | Dưới nội tâm mạc |
| 31 | Defibrillation | /diːfɪbrɪˈleɪʃən/ | Khử rung tim |
| 32 | Coronary circulation | /ˈkɔrəˌnɛri ˌsɜrkjəˈleɪʃən/ | Tuần hoàn vành |
| 33 | Thromboembolic | /ˌθrɒmbəʊɛmˈbɒlɪk/ | Huyết khối tắc mạch |
| 34 | Anastomosis | /əˌnæstəˈmoʊsɪs/ | Miệng nối |
| 35 | Coronary stenosis | /ˈkɔrəˌnɛri stəˈnoʊsɪs/ | Hẹp động mạch vành |
| 36 | Malperfusion | /mælpərˈfjuːʒən/ | Tưới máu kém |
| 37 | Bypass graft | /ˈbaɪˌpæs ɡræft/ | Mạch ghép bắc cầu |
| 38 | Vein graft | /veɪn ɡræft/ | Mạch ghép tĩnh mạch |
| 39 | Internal mammary artery | /ɪnˈtɜrnəl ˈmæməri ˈɑrtəri/ | Động mạch vú trong |
| 40 | Collateral flow | /kəˈlætərəl floʊ/ | Dòng chảy bàng hệ |
| 41 | Native coronary artery | /ˈneɪtɪv ˈkɔrəˌnɛri ˈɑrtəri/ | Động mạch vành tự nhiên |
| 42 | Coronary vasospasm | /ˈkɔrəˌnɛri ˌveɪzoʊˈspæzəm/ | Co thắt mạch vành |
| 43 | Calcium channel blockers | /ˈkælsiəm ˈtʃænəl ˈblɒkərz/ | Thuốc chẹn kênh canxi |
| 44 | Hypotension | /ˌhaɪpəˈtɛnʃən/ | Hạ huyết áp |
| 45 | Bradycardia | /ˌbreɪdɪˈkɑrdiə/ | Nhịp tim chậm |
| 46 | Pulmonary artery | /ˈpʌlməˌnɛri ˈɑrtəri/ | Động mạch phổi |
| 47 | Cardiogenic shock | /ˌkɑrdiəˈʤɛnɪk ʃɑk/ | Sốc tim |
| 48 | Afterload | /ˈæftərˌloʊd/ | Hậu tải |
| 49 | Preload | /ˈpriˌloʊd/ | Tiền tải |
| 50 | Diastolic | /ˌdaɪəˈstɑlɪk/ | Tâm trương |
| 51 | Systolic | /sɪˈstɑlɪk/ | Tâm thu |
| 52 | Central venous pressure | /ˈsɛntrəl ˈviːnəs ˈprɛʃər/ | Áp lực tĩnh mạch trung tâm |
| 53 | Mixed venous oxygen saturation | /mɪkst ˈviːnəs ˈɒksɪʤən ˌsætʃəˈreɪʃən/ | Độ bão hòa oxy tĩnh mạch hỗn hợp |
| 54 | Cardiac output | /ˈkɑrdiak ˈaʊtˌpʊt/ | Cung lượng tim |
| 55 | Rate-pressure product | /reɪt-ˈprɛʃər ˈprɒdʌkt/ | Tích tần số-huyết áp |
| 56 | Contractility | /ˌkɒntrækˈtɪlɪti/ | Co bóp |
| 57 | Counterpulsation | /ˌkaʊntərpʌlˈseɪʃən/ | Đối xung |
| 58 | Hypothermia | /ˌhaɪpəˈθɜrmiə/ | Hạ thân nhiệt |
| 59 | Ventricular hypertrophy | /venˈtrikyələr haɪˈpɜrtrəfi/ | Phì đại thất |
| 60 | Pulmonary edema | /ˈpʌlməˌnɛri əˈdiːmə/ | Phù phổi |
| 61 | Tamponade | /ˌtæmpəˈneɪd/ | Chèn ép tim |
| 62 | Pericardial effusion | /ˌpɛrɪˈkɑrdiəl ɪˈfjuʒən/ | Tràn dịch màng ngoài tim |
| 63 | Hypoxia | /haɪˈpɒksiə/ | Giảm oxy |
| 64 | Alkalosis | /ˌælkəˈloʊsɪs/ | Kiềm máu |
| 65 | Acidosis | /ˌæsɪˈdoʊsɪs/ | Toan máu |
| 66 | Hyperkalemia | /ˌhaɪpərkəˈlimiə/ | Tăng kali máu |
| 67 | Hypokalemia | /ˌhaɪpəkəˈlimiə/ | Hạ kali máu |
| 68 | Hypocalcemia | /ˌhaɪpəkælˈsimiə/ | Hạ canxi máu |
| 69 | Hypomagnesemia | /ˌhaɪpəˌmæɡnəˈsimiə/ | Hạ magiê máu |
| 70 | Inotropic | /ˌɪnəˈtrɒpɪk/ | Tăng co bóp cơ tim |
| 71 | Vasodilator | /ˌveɪzoʊdaɪˈleɪtər/ | Giãn mạch |
| 72 | Pulmonary vascular resistance | /ˈpʌlməˌnɛri ˈvæskjələr rɪˈzɪstəns/ | Kháng lực mạch máu phổi |
| 73 | Cardiac index | /ˈkɑrdiak ˈɪndɛks/ | Chỉ số tim |
| 74 | Arrhythmia | /əˈrɪðmiə/ | Loạn nhịp |
| 75 | Premature ventricular contractions | /priˈmæʧər venˈtrikyələr kənˈtrækʃənz/ | Co thắt thất sớm |
| 76 | Pneumothorax | /ˌnuməˈθɔræks/ | Tràn khí màng phổi |
| 77 | Hemothorax | /ˌhiməˈθɔræks/ | Tràn máu màng phổi |
| 78 | Vasoplegia | /ˌveɪzəʊˈpliːʤiə/ | Giãn mạch |
| 79 | Vasopressor | /ˌveɪzəʊˈprɛsər/ | Thuốc co mạch |
| 80 | Tachycardia | /ˌtækɪˈkɑrdiə/ | Nhịp tim nhanh |
| 81 | Adrenergic | /ˌædrəˈnɜrʤɪk/ | Adrenergic |
| 82 | Alpha-adrenergic | /ˈælfə ædrəˈnɜrʤɪk/ | Alpha-adrenergic |
| 83 | Beta-adrenergic | /ˈbeɪtə ædrəˈnɜrʤɪk/ | Beta-adrenergic |
| 84 | Chronotropy | /krəˈnɒtrəpi/ | Điều hòa nhịp tim |
| 85 | Inotropy | /ɪˈnɒtrəpi/ | Điều hòa co bóp tim |
| 86 | Thromboembolism | /ˌθrɒmbəʊˈɛmbəlɪzəm/ | Thuyên tắc huyết khối |
| 87 | Hemolysis | /hɪˈmɒlɪsɪs/ | Tan máu |
| 88 | Coagulopathy | /koʊˌæɡjəˈlɒpəθi/ | Rối loạn đông máu |
| 89 | Cardiac tamponade | /ˈkɑrdiak ˌtæmpəˈneɪd/ | Chèn ép tim |
| 90 | Oliguria | /ˌɒlɪˈɡjʊəriə/ | Thiểu niệu |
| 91 | Pulsus paradoxus | /ˈpʌlsəs ˌpærəˈdɒksəs/ | Mạch nghịch |
| 92 | Anemia | /əˈnimiə/ | Thiếu máu |
| 93 | Renal dysfunction | /ˈrinəl dɪsˈfʌŋkʃən/ | Rối loạn chức năng thận |
| 94 | Hepatic dysfunction | /hɪˈpætɪk dɪsˈfʌŋkʃən/ | Rối loạn chức năng gan |
| 95 | Neurologic dysfunction | /ˌnʊrəˈlɒʤɪk dɪsˈfʌŋkʃən/ | Rối loạn chức năng thần kinh |
| 96 | Pulmonary dysfunction | /ˈpʌlməˌnɛri dɪsˈfʌŋkʃən/ | Rối loạn chức năng phổi |
| 97 | Systemic vascular resistance | /sɪˈstɛmɪk ˈvæskjələr rɪˈzɪstəns/ | Kháng lực mạch máu hệ thống |
| 98 | Baroreceptor | /ˌbærəʊrɪˈsɛptər/ | Thụ thể áp lực |
| 99 | Inflammatory response | /ɪnˈflæməˌtɔri rɪˈspɒns/ | Đáp ứng viêm |
| 100 | Cardiopulmonary bypass | /ˌkɑrdioʊˈpʌlməˌnɛri ˈbaɪˌpæs/ | Tuần hoàn ngoài cơ thể |
TÀI LIỆU THAM KHẢO
- Markman P.L., Tantiongco J.P., Bennetts J.S., et. al.: High-sensitivity troponin release profile after cardiac surgery. Heart Lung Circ 2017; 26: pp. 833-839.
- Holmvang L., Jurlander B., Rasmussen C., et. al.: Use of biochemical markers of infarction for diagnosing perioperative myocardial infarction and early graft occlusion after coronary artery bypass surgery. Chest 2002; 121: pp. 103-111.
- Wang K., Asinger R.W., Marriott H.J.L.: ST-segment elevation in conditions other than acute myocardial infarction. N Engl J Med 2003; 349: pp. 2128-2135.
- Raza S.S., Li J.M., John R., et. al.: Long-term mortality and pacing outcomes of patients with permanent pacemaker implantation after cardiac surgery. Pacing Clin Electrophysiol 2011; 34: pp. 331-338.
- Yokoyama Y., Chaitman B.R., Hardison R.M., et. al.: Association between new electrocardiographic abnormalities after coronary revascularization and five-year cardiac mortality in BARI randomized and registry patients. Am J Cardiol 2000; 86: pp. 819-824.
- Califf R.M., Abdelmeguid A.E., Kuntz R.E., et. al.: Myonecrosis after revascularization procedures. J Am Coll Cardiol 1998; 31: pp. 241-251.
- Comunale M.E., Body S.C., Ley C., et. al.: The concordance of intraoperative left ventricular wall-motion abnormalities and electrocardiographic S-T segment changes: Association with outcome after coronary revascularization. Multicenter Study of Perioperative Ischemia (McSPI) Research Group. Anesthesiology 1998; 88: pp. 945-954.
- Barron J.T.: Cardiac troponin I and non-Q-wave myocardial infarction: How useful is it after coronary artery bypass surgery?. Crit Care Med 1998; 26: pp. 1936-1937.
- Leischik R., Dworrak B., Sanchis-Gomar F., et. al.: Echocardiographic assessment of myocardial ischemia. Ann Transl Med 2016; 4: pp. 259.
- Fabricius A.M., Gerber W., Hanke M., et. al.: Early angiographic control of perioperative ischemia after coronary artery bypass grafting. Eur J Cardiothorac Surg 2001; 19: pp. 853-858.
- Wijeysundera D.N., Beattie W.S., Rao V., et. al.: Calcium antagonists are associated with reduced mortality after cardiac surgery: A propensity analysis. J Thorac Cardiovasc Surg 2004; 127: pp. 755-762.
- Wijeysundera D.N., Beattie W.S., Rao V., et. al.: Calcium antagonists reduce cardiovascular complications after cardiac surgery. J Am Coll Cardiol 2003; 41: pp. 1496-1505.
- Newman M.F.: Troponin I in cardiac surgery: Marking the future. Am Heart J 2001; 141: pp. 325-326.
- Gibson R.S.: Non-Q-wave myocardial infarction: Pathophysiology, prognosis, and therapeutic strategy. Annu Rev Med 1989; 40: pp. 395-410.
- Wu E., Judd R.M., Vargas J.D., et. al.: Visualisation of presence, location, and transmural extent of healed Q-wave and non-Q-wave myocardial infarction. Lancet 2001; 357: pp. 21-28.
- Bulkely B.H., Hutchins G.M.: Myocardial consequences of coronary artery bypass graft surgery: The paradox of necrosis in areas of revascularization. Circulation 1977; 56: pp. 906-913.
- Force T., Kemper A.J., Bloomfield P., et. al.: Non-Q wave perioperative myocardial infarction: Assessment of the incidence and severity of regional dysfunction with quantitative two-dimensional echocardiography. Circulation 1985; 72: pp. 781-789.
- Crescenzi G., Bove T., Pappalardo F., et. al.: Clinical significance of a new Q wave after cardiac surgery. Eur J Cardiothorac Surg 2004; 25: pp. 1001-1005.
- Slogoff S., Keats A.S.: Does perioperative myocardial ischemia lead to postoperative myocardial infarction?. Anesthesiology 1985; 62: pp. 107-114.
- Chaitman B.R., Alderman E.L., Sheffield L.T., et. al.: Use of survival analysis to determine the clinical significance of new Q waves after coronary bypass surgery. Circulation 1983; 67: pp. 302-309.
- Klatte K., Chaitman B.R., Theroux P., et. al.: Increased mortality after coronary artery bypass graft surgery is associated with increased levels of postoperative creatine kinase-myocardial band isoenzyme release. J Am Coll Cardiol 2001; 38: pp. 1070-1077.
- Namay D.L., Hammermeister K.E., Zia M.S., et. al.: Effect of perioperative myocardial infarction on late survival in patients undergoing coronary artery bypass surgery. Circulation 1982; 65: pp. 1066-1071.
- Crescenzi G., Cedrati V., Landoni G., et. al.: Cardiac biomarker release after CABG with different surgical techniques. J Cardiothorac Vasc Anesth 2004; 18: pp. 34-37. Available at http://www.ncbi.nlm.nih.gov/pubmed/14973796 Accessed July 19, 2019
- Greaves S.C., Rutherford J.D., Aranki S.F., et. al.: Current incidence and determinants of perioperative myocardial infarction in coronary artery surgery. Am Heart J 1996; 132: pp. 572-578.
- Brener S.J., Lytle B.W., Schneider J.P., et. al.: Association between CK-MB elevation after percutaneous or surgical revascularization and three-year mortality. J Am Coll Cardiol 2002; 40: pp. 1961-1967.
- Costa M.A., Carere R.G., Lichtenstein S.V., et. al.: Incidence, predictors, and significance of abnormal cardiac enzyme rise in patients treated with bypass surgery in the arterial revascularization therapies study (ARTS). Circulation 2001; 104: pp. 2689-2693.
- Greenson N., Macoviak J., Krishnaswamy P., et. al.: Usefulness of cardiac troponin I in patients undergoing open heart surgery. Am Heart J 2001; 141: pp. 447-455.
- Benoit M.O., Paris M., Silleran J., et. al.: Cardiac troponin I: Its contribution to the diagnosis of perioperative myocardial infarction and various complications of cardiac surgery. Crit Care Med 2001; 29: pp. 1880-1886.
- Carrier M., Pellerin M., Perrault L.P., et. al.: Troponin levels in patients with myocardial infarction after coronary artery bypass grafting. Ann Thorac Surg 2000; 69: pp. 435-440.
- Carrier M., Pelletier L.C., Martineau R., et. al.: In elective coronary artery bypass grafting, preoperative troponin T level predicts the risk of myocardial infarction. J Thorac Cardiovasc Surg 1998; 115: pp. 1328-1334.
- Eigel P., van Ingen G., Wagenpfeil S.: Predictive value of perioperative cardiac troponin I for adverse outcome in coronary artery bypass surgery. Eur J Cardiothorac Surg 2001; 20: pp. 544-549.
- Fellahi J.L., Gué X., Richomme X., et. al.: Short- and long-term prognostic value of postoperative cardiac troponin I concentration in patients undergoing coronary artery bypass grafting. Anesthesiology 2003; 99: pp. 270-274.
- Januzzi J.L., Lewandrowski K., MacGillivray T.E., et. al.: A comparison of cardiac troponin T and creatine kinase-MB for patient evaluation after cardiac surgery. J Am Coll Cardiol 2002; 39: pp. 1518-1523.
- Kathiresan S., Servoss S.J., Newell J.B., et. al.: Cardiac troponin T elevation after coronary artery bypass grafting is associated with increased one-year mortality. Am J Cardiol 2004; 94: pp. 879-881.
- Lasocki S., Provenchère S., Bénessiano J., et. al.: Cardiac troponin I is an independent predictor of in-hospital death after adult cardiac surgery. Anesthesiology 2002; 97: pp. 405-411.
- Vermes E., Mesguich M., Houel R., et. al.: Cardiac troponin I release after open heart surgery: A marker of myocardial protection?. Ann Thorac Surg 2000; 70: pp. 2087-2090.
- Bassan M.M., Oatfield R., Hoffman I., et. al.: New Q waves after aortocoronary bypass surgery: Unmasking of an old infarction. N Engl J Med 1974; 290: pp. 349-353.
- Cornu E., Lacroix P.H., Christides C., et. al.: Coronary artery damage during mitral valve replacement. J Cardiovasc Surg (Torino) 1995; 36: pp. 261-264. Available at http://www.ncbi.nlm.nih.gov/pubmed/7629211 Accessed July 19, 2019
- Tavilla G., Pacini D.: Damage to the circumflex coronary artery during mitral valve repair with sliding leaflet technique. Ann Thorac Surg 1998; 66: pp. 2091-2093.
- Keon W.J., Heggtveit H.A., Leduc J.: Perioperative myocardial infarction caused by atheroembolism. J Thorac Cardiovasc Surg 1982; 84: pp. 849-855. Available at http://www.ncbi.nlm.nih.gov/pubmed/6983005 Accessed July 19, 2019
- Force T., Hibberd P., Weeks G., et. al.: Perioperative myocardial infarction after coronary artery bypass surgery: Clinical significance and approach to risk stratification. Circulation 1990; 82: pp. 903-912.
- Jain U., Laflamme C.J., Aggarwal A., et. al.: Electrocardiographic and hemodynamic changes and their association with myocardial infarction during coronary artery bypass surgery. A multicenter study. Multicenter Study of Perioperative Ischemia (McSPI) Research Group. Anesthesiology 1997; 86: pp. 576-591.
- Cohen G., Borger M.A., Weisel R.D., et. al.: Intraoperative myocardial protection: Current trends and future perspectives. Ann Thorac Surg 1999; 68: pp. 1995-2001.
- Loop F.D., Higgins T.L., Panda R., et. al.: Myocardial protection during cardiac operations. Decreased morbidity and lower cost with blood cardioplegia and coronary sinus perfusion. J Thorac Cardiovasc Surg 1992; 104: pp. 608-618. Available at http://www.ncbi.nlm.nih.gov/pubmed/1513150 Accessed July 19, 2019
- Nicolini F., Beghi C., Muscari C., et. al.: Myocardial protection in adult cardiac surgery: Current options and future challenges. Eur J Cardiothorac Surg 2003; 24: pp. 986-993.
- Guajardo Salinas G.E., Nutt R., Rodriguez-Araujo G.: Del Nido cardioplegia in low risk adults undergoing first time coronary artery bypass surgery. Perfusion 2017; 32: pp. 68-73.
- Matte G.S., del Nido P.J.: History and use of Del Nido cardioplegia solution at Boston Children’s Hospital. J Extra Corpor Technol 2012; 44: pp. 98-103. Available at http://www.ncbi.nlm.nih.gov/pubmed/23198389 Accessed July 19, 2019
- Vistarini N., Laliberté E., Beauchamp P., et. al.: Del Nido cardioplegia in the setting of minimally invasive aortic valve surgery. Perfusion 2017; 32: pp. 112-117.
- Piana R.N., Adams M.R., Orford J.L., et. al.: Rescue percutaneous coronary intervention immediately following coronary artery bypass grafting. Chest 2001; 120: pp. 1417-1420.
- Buxton A.E., Goldberg S., Harken A., et. al.: Coronary-artery spasm immediately after myocardial revascularization: Recognition and management. N Engl J Med 1981; 304: pp. 1249-1253.
- Lemmer J.H., Kirsh M.M.: Coronary artery spasm following coronary artery surgery. Ann Thorac Surg 1988; 46: pp. 108-115.
- Pichard A.D., Ambrose J., Mindich B., et. al.: Coronary artery spasm and perioperative cardiac arrest. J Thorac Cardiovasc Surg 1980; 80: pp. 249-254. Available at http://www.ncbi.nlm.nih.gov/pubmed/7401678 Accessed July 19, 2019
- Zeff R.H., Iannone L.A., Kongtahworn C., et. al.: Coronary artery spasm following coronary artery revascularization. Ann Thorac Surg 1982; 34: pp. 196-200.
- Bonatti J., Danzmayr M., Schachner T., et. al.: Intraoperative angiography for quality control in MIDCAB and OPCAB. Eur J Cardiothoracic Surg 2003; 24: pp. 647-649.
- Caputo M., Nicolini F., Franciosi G., et. al.: Coronary artery spasm after coronary artery bypass grafting. Eur J Cardiothorac Surg 1999; 15: pp. 545-548.
- Trimboli S., Oppido G., Santini F., et. al.: Coronary artery spasm after off-pump coronary artery by-pass grafting. Eur J Cardiothorac Surg 2003; 24: pp. 830-833.
- Sarabu M.R., McClung J.A., Fass A., et. al.: Early postoperative spasm in left internal mammary artery bypass grafts. Ann Thorac Surg 1987; 44: pp. 199-200.
- Stone G.W., Hartzler G.O.: Spontaneous reversible spasm in an internal mammary artery graft causing acute myocardial infarction. Am J Cardiol 1989; 64: pp. 822-823.
- Boudoulas H., Lewis R.P., Vasko J.S., et. al.: Left ventricular function and adrenergic hyperactivity before and after saphenous vein bypass. Circulation 1976; 53: pp. 802-806.
- He G.W., Taggart D.P.: Spasm in arterial grafts in coronary artery bypass grafting surgery. Ann Thorac Surg 2016; 101: pp. 1222-1229.
- Carrel T., Kujawski T., Zund G., et. al.: The internal mammary artery malperfusion syndrome: Incidence, treatment and angiographic verification. Eur J Cardiothorac Surg 1995; 9: pp. 190-197.
- Cameron A., Davis K.B., Green G., et. al.: Coronary bypass surgery with internal-thoracic-artery grafts – effects on survival over a 15-year period. N Engl J Med 1996; 334: pp. 216-219.
- Loop F.D., Lytle B.W., Cosgrove D.M., et. al.: Influence of the internal-mammary-artery graft on 10-year survival and other cardiac events. N Engl J Med 1986; 314: pp. 1-6.
- Schmid C., Heublein B., Reichelt S., et. al.: Steal phenomenon caused by a parallel branch of the internal mammary artery. Ann Thorac Surg 1990; 50: pp. 463-464.
- Rasmussen C.: Significance and management of early graft failure after coronary artery bypass grafting feasibility and results of acute angiography and re-re-vascularization. Eur J Cardiothorac Surg 1997; 12: pp. 847-852.
- Pezzella T., Ferraris V., Lancey R.: Care of the adult cardiac surgery patient: Part I. Curr Probl Surg 2004; 41: pp. 458-516.
- Rao V., Ivanov J., Weisel R.D., et. al.: Predictors of low cardiac output syndrome after coronary artery bypass. J Thorac Cardiovasc Surg 1996; 112: pp. 38-51. Available at http://www.ncbi.nlm.nih.gov/pubmed/8691884 Accessed July 19, 2019
- Niimi Y., Morita S., Watanabe T., et. al.: Effects of nitroglycerin infusion on segmental wall motion abnormalities after anesthetic induction. J Cardiothorac Vasc Anesth 1996; 10: pp. 734-740.
- Christenson J.T., Simonet F., Badel P., Schmuziger M.: Optimal timing of preoperative intraaortic balloon pump support in high-risk coronary patients. Ann Thorac Surg 1999; 68: pp. 934-939.
- Torchiana D.F., Hirsch G., Buckley M.J., et. al.: Intraaortic balloon pumping for cardiac support: Trends in practice and outcome, 1968 to 1995. J Thorac Cardiovasc Surg 1997; 113: pp. 758-764. discussion 764–769 https://doi.org/10.1016/S0022-5223(97)70235-6
- Holman W.L., Li Q., Kiefe C.I., et. al.: Prophylactic value of preincision intra-aortic balloon pump: Analysis of a statewide experience. J Thorac Cardiovasc Surg 2000; 120: pp. 1112-1119. Available at http://www.ncbi.nlm.nih.gov/pubmed/11088035 Accessed July 19, 2019
- Poirier Y., Voisine P., Plourde G., et. al.: Efficacy and safety of preoperative intra-aortic balloon pump use in patients undergoing cardiac surgery: A systematic review and meta-analysis. Int J Cardiol 2016; 207: pp. 67-79.
- Lin J.C., Fisher D.L., Szwerc M.F., et. al.: Evaluation of graft patency during minimally invasive coronary artery bypass grafting with Doppler flow analysis. Ann Thorac Surg 2000; 70: pp. 1350-1354.
- Morota T., Duhaylongsod F.G., Burfeind W.R., et. al.: Intraoperative evaluation of coronary anastomosis by transit-time ultrasonic flow measurement. Ann Thorac Surg 2002; 73: pp. 1446-1450.
- Leong D.K.H., Ashok V., Nishkantha A., et. al.: Transit-time flow measurement is essential in coronary artery bypass grafting. Ann Thorac Surg 2005; 79: pp. 854-857. discussion 857–858 https://doi.org/10.1016/j.athoracsur.2004.06.010
- Quin J., Lucke J., Hattler B., et. al.: Surgeon judgment and utility of transit time flow probes in coronary artery bypass grafting surgery. JAMA Surg 2014; 149: pp. 1182-1187.
- Feldman R.L.: A review of medical therapy for coronary artery spasm. Circulation 1987; 75: pp. V96-V102. Available at http://www.ncbi.nlm.nih.gov/pubmed/2882876 Accessed July 19, 2019
- Verrier E.D., Shernan S.K., Taylor K.M., et. al.: Terminal complement blockade with pexelizumab during coronary artery bypass graft surgery requiring cardiopulmonary bypass: A randomized trial. JAMA 2004; 291: pp. 2319-2327.
- Smith P.K., Shernan S.K., Chen J.C., et. al.: Effects of C5 complement inhibitor pexelizumab on outcome in high-risk coronary artery bypass grafting: Combined results from the PRIMO-CABG I and II trials. J Thorac Cardiovasc Surg 2011; 142: pp. 89-98.
- Boyce S.W., Bartels C., Bolli R., et. al.: Impact of sodium-hydrogen exchange inhibition by cariporide on death or myocardial infarction in high-risk CABG surgery patients: Results of the CABG surgery cohort of the GUARDIAN study. J Thorac Cardiovasc Surg 2003; 126: pp. 420-427. Available at http://www.ncbi.nlm.nih.gov/pubmed/12928639 Accessed July 19, 2019
- Kouchoukos N.: Detection and treatment of impaired cardiac performance following cardiac surgery.Davila J.C.Henry Ford Hospital International Symposiumon Cardiac Surgery.1977.Appleton-Century-CroftsNew York:
- Lomivorotov V.V., Efremov S.M., Kirov M.Y., et. al.: Low-cardiac-output syndrome after cardiac surgery. J Cardiothorac Vasc Anesth 2017; 31: pp. 291-308.
- McKinlay K.H., Schinderle D.B., Swaminathan M., et. al.: Predictors of inotrope use during separation from cardiopulmonary bypass. J Cardiothorac Vasc Anesth 2004; 18: pp. 404-408. Available at http://www.ncbi.nlm.nih.gov/pubmed/15365918 Accessed July 19, 2019
- Yau T.M., Fedak P.W., Weisel R.D., et. al.: Predictors of operative risk for coronary bypass operations in patients with left ventricular dysfunction. J Thorac Cardiovasc Surg 1999; 118: pp. 1006-1013.
- Doyle A.R., Dhir A.K., Moors A.H., et. al.: Treatment of perioperative low cardiac output syndrome. Ann Thorac Surg 1995; 59: pp. S3-S11.
- Smedira N.G., Blackstone E.H.: Postcardiotomy mechanical support: Risk factors and outcomes. Ann Thorac Surg 2001; 71: pp. S60-S66.
- Levy J.H., SJ Michelsen L.: Kaplan J.A.Reich Dl K.S.Cardiac Anesthesia.1999.SaundersPhiladelphia:
- Milano C.A.S.P., Sellke F.W.: Swanson SJ del NP (ed): Critical Care for the Adult Cardiac. Patient 2005;
- Cook W.A., Webb W.R., Unal M.O.: Myocardial function capacity in response to compensated and uncompensated respiratory alkalosis. Surg Forum 1965; 16: pp. 186-188. Available at http://www.ncbi.nlm.nih.gov/pubmed/5835141 Accessed July 19, 2019
- Kirklin J.K., Kirklin J.W.: Management of the cardiovascular subsystem after cardiac surgery. Ann Thorac Surg 1981; 32: pp. 311-319.
- Harris PD, Malm JR, Bowman FO, et al. Epicardial pacing to control arrhythmias following cardiac surgery. Circulation. 1968;37(4 Suppl):II178-II183. https://doi.org/10.1161/01.CIR.37.4S2.II-178 .
- Hodam R.P., Starr A.: Temporary postoperative epicardial pacing electrodes. Ann Thorac Surg 1969; 8: pp. 506-510.
- Mills N.L., Ochsner J.L.: Experience with atrial pacemaker wires implanted during cardiac operations. J Thorac Cardiovasc Surg 1973; 66: pp. 878-886. Available at http://www.ncbi.nlm.nih.gov/pubmed/4759695 Accessed July 19, 2019
- Hanson E.L., Kane P.B., Askanazi J., et. al.: Comparison of patients with coronary artery or valve disease. Ann Thorac Surg 1976; 22: pp. 343-346.
- Crexells C., Chatterjee K., Forrester J.S., et. al.: Optimal level of filling pressure in the left side of the heart in acute myocardial infarction. N Engl J Med 1973; 289: pp. 1263-1266.
- Estafanous F.G., Tarazi R.C., Buckley S., et. al.: Arterial hypertension in immediate postoperative period after valve replacement. Br Heart J 1978; 40: pp. 718-724.
- Weinstein G.S., Zabetakis P.M., Clavel A., et. al.: The renin-angiotensin system is not responsible for hypertension following coronary artery bypass grafting. Ann Thorac Surg 1987; 43: pp. 74-77.
- Estafanous F.G., Tarazi R.C.: Systemic arterial hypertension associated with cardiac surgery. Am J Cardiol 1980; 46: pp. 685-694.
- Fouad F.M., Estafanous F.G., Bravo E.L., et. al.: Possible role of cardioaortic reflexes in postcoronary bypass hypertension. Am J Cardiol 1979; 44: pp. 866-872.
- Packer M.: Neurohormonal interactions and adaptations in congestive heart failure. Circulation 1988; 77: pp. 721-730.
- Whelton P.K., Flaherty J.T., MacAllister N.P., et. al.: Hypertension following coronary artery bypass surgery: Role of preoperative propranolol therapy. Hypertension 1980; 2: pp. 291-298. Available at http://www.ncbi.nlm.nih.gov/pubmed/6967050 Accessed July 19, 2019
- Chen A., Ashburn M.A.: Cardiac effects of opioid therapy. Pain Med 2015; 16: pp. S27-S31.
- Redwood D.R., Smith E.R., Epstein S.E.: Coronary artery occlusion in the conscious dog. Circulation 1972; 46: pp. 323-332.
- Mekontso-Dessap A., Houël R., Soustelle C., et. al.: Risk factors for post-cardiopulmonary bypass vasoplegia in patients with preserved left ventricular function. Ann Thorac Surg 2001; 71: pp. 1428-1432.
- Morales D.L., Gregg D., Helman D.N., et. al.: Arginine vasopressin in the treatment of 50 patients with postcardiotomy vasodilatory shock. Ann Thorac Surg 2000; 69: pp. 102-106.
- Cai Y., Mack A., Ladlie B.L., et. al.: The use of intravenous hydroxocobalamin as a rescue in methylene blue-resistant vasoplegic syndrome in cardiac surgery. Ann Card Anaesth 2017; 20: pp. 462-464.
- Chuttani K., Tischler M.D., Pandian N.G., et. al.: Diagnosis of cardiac tamponade after cardiac surgery: Relative value of clinical, echocardiographic. and hemodynamic signs. Am Heart J 1994; 127: pp. 913-918.
- Chuttani K., Pandian N.G., Mohanty P.K., et. al.: Left ventricular diastolic collapse. An echocardiographic sign of regional cardiac tamponade. Circulation 1991; 83: pp. 1999-2006.
- Craddock D.R., Logan A., Fadali A.: Reoperation for haemorrhage following cardiopulmonary by-pass. Br J Surg 1968; 55: pp. 17-20.
- Engelman R.M., Spencer F.C., Reed G.E., Tice D.A.: Cardiac tamponade following open-heart surgery. Circulation 1970; 41: pp. II165-II167.
- Nelson R.M., Jenson C.B., Smoot W.M.: Pericardial tamponade following open-heart surgery. J Thorac Cardiovasc Surg 1969; 58: pp. 510-516. Available at http://www.ncbi.nlm.nih.gov/pubmed/5348641 Accessed July 19, 2019
- Weeks K.R., Chatterjee K., Block S., et. al.: Bedside hemodynamic monitoring. Its value in the diagnosis of tamponade complicating cardiac surgery. J Thorac Cardiovasc Surg 1976; 71: pp. 250-252. Available at http://www.ncbi.nlm.nih.gov/pubmed/1082054 Accessed July 19, 2019
- Gorman J.H., Gorman R.C., Milas B.L., et. al.: Circulatory management of the unstable cardiac patient. Semin Thorac Cardiovasc Surg 2000; 12: pp. 316-325. Available at http://www.ncbi.nlm.nih.gov/pubmed/11154727 Accessed July 19, 2019
- Skinner N.S., Mitchell J.H., Wallace A.G., et. al.: Hemodynamic effects of altering the timing of atrial systole. Am J Physiol 1963; 205: pp. 499-503.
- Ellis R.J., Mavroudis C., Gardner C., et. al.: Relationship between atrioventricular arrhythmias and the concentration of K + ion in cardioplegic solution. J Thorac Cardiovasc Surg 1980; 80: pp. 517-526. Available at http://www.ncbi.nlm.nih.gov/pubmed/7421286 Accessed July 19, 2019
- Smith P.K., Buhrman W.C., Ferguson T.B., et. al.: Conduction block after cardioplegic arrest: Prevention by augmented atrial hypothermia. Circulation 1983; 68: pp. II41-II48. (3 Pt 2). Available at http://www.ncbi.nlm.nih.gov/pubmed/6872194
- Smith P.K., Buhrman W.C., Levett J.M., et. al.: Supraventricular conduction abnormalities following cardiac operations. A complication of inadequate atrial preservation. J Thorac Cardiovasc Surg 1983; 85: pp. 105-115. Available at http://www.ncbi.nlm.nih.gov/pubmed/6600279 Accessed July 19, 2019
- Zoll P.M.: Resuscitation of the heart in ventricular standstill by external electric stimulation. N Engl J Med 1952; 247: pp. 768-771.
- Hartzler G.O., Maloney J.D., Curtis J.J., et. al.: Hemodynamic benefits of atrioventricular sequential pacing after cardiac surgery. Am J Cardiol 1977; 40: pp. 232-236.
- Chatterjee K., Parmley W.W., Swan H.J.C., et. al.: Beneficial effects of vasodilator agents in severe mitral regurgitation due to dysfunction of subvalvar apparatus. Circulation 1973; 48: pp. 684-690.
- Chatterjee K., Parmley W.W.: The role of vasodilator therapy in heart failure. Prog Cardiovasc Dis 1977; 19: pp. 301-325. Available at http://www.ncbi.nlm.nih.gov/pubmed/401541 Accessed July 19, 2019
- Bolen J.L., Alderman E.L.: Hemodynamic consequences of afterload reduction in patients with chronic aortic regurgitation. Circulation 1976; 53: pp. 879-883.
- Chiariello M., Gold H.K., Leinbach R.C., et. al.: Comparison between the effects of nitroprusside and nitroglycerin on ischemic injury during acute myocardial infarction. Circulation 1976; 54: pp. 766-773.
- Bixler T.J., Gardner T.J., Donahoo J.S., et. al.: Improved myocardial performance in postoperative cardiac surgical patients with sodium nitroprusside. Ann Thorac Surg 1978; 25: pp. 444-448.
- Franciosa J., Limas C., Guiha N., et. al.: Improved left ventricular function during nitroprusside infusion in acute myocardial infarction. Lancet 1972; 299: pp. 650-654.
- Goldstein R.E., Stinson E.B., Scherer J.L., et. al.: Intraoperative coronary collateral function in patients with coronary occlusive disease. Circulation 1974; 49: pp. 298-308.
- Erdmann E.: The effectiveness of inotropic agents in isolated cardiac preparations from the human heart. Klin Wochenschr 1988; 66: pp. 1-6.
- Landoni G., Lomivorotov V.V., Alvaro G., et. al.: Levosimendan for hemodynamic support after cardiac surgery. N Engl J Med 2017; 376: pp. 2021-2031.
- DiGiorgi P., Kukuy E.L.: Naka Y OM. Left ventricular assist devices.Sellke F.W.Swanson S.J.del Nido P.J.Sabiston and Spencer Surgery of the Chest.2005.Elsevier SaundersPhiladelphia:pp. 1613-1629.
- Emery R.W., Joyce L.D.: Directions in cardiac assistance. J Card Surg 1991; 6: pp. 400-414. Available at http://www.ncbi.nlm.nih.gov/pubmed/1807522 Accessed July 19, 2019
- Miller L.W.: Mechanical assist devices in intensive cardiac care. Am Heart J 1991; 121: pp. 1887-1892.
- Ahmad Y., Sen S., Shun-Shin M.J., et. al.: Intra-aortic balloon pump therapy for acute myocardial infarction. JAMA Intern Med 2015; 175: pp. 931.
- Phillips S.J., Tannenbaum M., Zeff R.H., et. al.: Sheathless insertion of the percutaneous intraaortic balloon pump: An alternate method. Ann Thorac Surg 1992; 53: pp. 162.
- Tatar H., Ricek S., Demirkilic U., et. al.: Exact positioning of intra-aortic balloon catheter. Eur J Cardiothorac Surg 1993; 7: pp. 52-53.
- Unverzagt S, Buerke M, de Waha A, et al: Intra-aortic balloon pump counterpulsation (IABP) for myocardial infarction complicated by cardiogenic shock. Cochrane Database Syst Rev . 2015;(3):CD007398. https://doi.org/10.1002/14651858.CD007398.pub3 .
- Busch T., Sîrbu H., Zenker D., et. al.: Vascular complications related to intraaortic balloon counterpulsation: An analysis of ten years experience. Thorac Cardiovasc Surg 1997; 45: pp. 55-59.
- Hooshang Bolooki: Clinical Applications of the Intra-Aortic Balloon Pump. 3rd ed. New York, Futura.
- Pennock J.L., Pierce W.S., Wisman C.B., Bull A.P., Waldhausen J.A.: Survival and complications following ventricular assist pumping for cardiogenic shock. Ann Surg 1983; 198: pp. 469-478.
- Stolar C.J., Delosh T., Bartlett R.H.: Extracorporeal life support organization 1993. ASAIO J 1993; 39: pp. 976-979. Available at http://www.ncbi.nlm.nih.gov/pubmed/8123938
- Rastan A.J., Dege A., Mohr M., et. al.: Early and late outcomes of 517 consecutive adult patients treated with extracorporeal membrane oxygenation for refractory postcardiotomy cardiogenic shock. J Thorac Cardiovasc Surg 2010; 139: pp. 302-311, 311.e1.
- Wang L., Wang H., Hou X.: Clinical outcomes of adult patients who receive extracorporeal membrane oxygenation for postcardiotomy cardiogenic shock: A systematic review and meta-analysis. J Cardiothorac Vasc Anesth 2018; 32: pp. 2087-2093.
- Wudel J.H., Hlozek C.C., Smedira N.G., et. al.: Extracorporeal life support as a post left ventricular assist device implant supplement. ASAIO J 1997; 43: pp. M441-M443. Available at http://www.ncbi.nlm.nih.gov/pubmed/9360079 Accessed July 19, 2019
- Pagani F.D., Lynch W., Swaniker F., et. al.: Extracorporeal life support to left ventricular assist device bridge to heart transplant: A strategy to optimize survival and resource utilization. Circulation 1999; 100: pp. II-206-II-210.
- Kaplan R.S.N.: Goldstein D OM (ed).2000.Extracorporeal Membrane Oxygenation in AdultsNew York
- Ranney D.N., Benrashid E., Meza J.M., et. al.: Vascular complications and use of a distal perfusion cannula in femorally cannulated patients on extracorporeal membrane oxygenation. ASAIO J 2018; 64: pp. 328-333.
- Sen A., Larson J.S., Kashani K.B., et. al.: Mechanical circulatory assist devices: A primer for critical care and emergency physicians. Crit Care 2016; 20:
- Rogers J.G., Pagani F.D., Tatooles A.J., et. al.: Intrapericardial left ventricular assist device for advanced heart failure. N Engl J Med 2017; 376: pp. 451-460.
- Mehra M.R., Uriel N., Naka Y., et. al.: A fully magnetically levitated left ventricular assist device – final report. N Engl J Med 2019; 380: pp. 1618-1627.
- Lemaire A., Anderson M.B., Prendergast T., et. al.: Outcome of the Impella device for acute mechanical circulatory support. Innovations (Phila) 2013; 8: pp. 12-16.
- Batsides G., Massaro J., Cheung A., et. al.: Outcomes of Impella 5.0 in cardiogenic shock. Innov Technol Tech Cardiothorac Vasc Surg 2018; 13: pp. 254-260.
- Jensen P.B., Kann S.H., Veien K.T., et. al.: Single-centre experience with the Impella CP, 5.0 and RP in 109 consecutive patients with profound cardiogenic shock. Eur Hear J Acute Cardiovasc Care 2018; 7: pp. 53-61.
- Shishehbor M.H., Moazami N., MZ-Y Tong, et. al.: Cardiogenic shock: From ECMO to Impella and beyond. Cleve Clin J Med 2017; 84: pp. 287-295.
- Mehra M.R., Goldstein D.J., Uriel N., et. al.: Two-year outcomes with a magnetically levitated cardiac pump in heart failure. N Engl J Med 2018; 378: pp. 1386-1395.
- Bishawi M., Joseph J., Patel C., et. al.: Risk factors for stroke on left ventricular assist devices. J Card Surg 2018; 33: pp. 348-352.
- Kaul T.K., Fields B.L.: Postoperative acute refractory right ventricular failure: Incidence, pathogenesis. management and prognosis. Cardiovasc Surg 2000; 8: pp. 1-9. Available at http://www.ncbi.nlm.nih.gov/pubmed/10661697 Accessed July 19, 2019
- Wranne B., Pinto F.J., Hammarström E., et. al.: Abnormal right heart filling after cardiac surgery: Time course and mechanisms. Br Heart J 1991; 66: pp. 435-442.
- Santamore W.P., Austin E.H., Gray L.: Overcoming right ventricular failure with left ventricular assist devices. J Heart Lung Transplant 1997; 16: pp. 1122-1128. Available at http://www.ncbi.nlm.nih.gov/pubmed/9402511 Accessed July 19, 2019
- Heinonen J., Salmenperä M., Takkunen O.: Increased pulmonary artery diastolic-pulmonary wedge pressure gradient after cardiopulmonary bypass. Can Anaesth Soc J 1985; 32: pp. 165-170. Available at http://www.ncbi.nlm.nih.gov/pubmed/3872705 Accessed July 19, 2019
- Colman R.W.: Platelet and neutrophil activation in cardiopulmonary bypass. Ann Thorac Surg 1990; 49: pp. 32-34.
- Chenoweth D.E., Cooper S.W., Hugli T.E., et. al.: Complement activation during cardiopulmonary bypass: Evidence for generation of C3a and C5a anaphylatoxins. N Engl J Med 1981; 304: pp. 497-503.
- Trachte A.L., Lobato E.B., Urdaneta F., et. al.: Oral sildenafil reduces pulmonary hypertension after cardiac surgery. Ann Thorac Surg 2005; 79: pp. 194-197. discussion 194–197 https://doi.org/10.1016/j.athoracsur.2004.06.086
- Olschewski H., Rohde B., Behr J., et. al.: Pharmacodynamics and pharmacokinetics of inhaled iloprost, aerosolized by three different devices, in severe pulmonary hypertension. Chest 2003; 124: pp. 1294-1304.
- Hill G.E.D., Traudt R.J., Durham L.A., et. al.: Successful treatment of refractory status asthmaticus accompanied by right ventricular dysfunction using a Protek Duo Tandem Heart device. J Cardiothorac Vasc Anesth 2019; 33: pp. 3085-3089.
- Khorsandi M., Schroder J., Daneshmand M., et. al.: Outcomes after extracorporeal right ventricular assist device combined with durable left ventricular assist device support. Ann Thorac Surg 2019; 107: pp. 1768-1774.

BÌNH LUẬN