Sách dịch: CÁC NGUYÊN LÝ Y HỌC HÔ HẤP, ẤN BẢN THỨ 8
Dịch và chú giải: Ts.Bs. Lê Nhật Huy, Ths.Bs. Lê Đình Sáng
Chương 21. Ung thư phổi: Các khía cạnh lâm sàng
Lung cancer: Clinical aspects
Steven E. Weinberger MD, MACP, FRCP, Barbara A. Cockrill MD and Jess Mandel MD, MACP, FRCP
Principles of Pulmonary Medicine, 21, 251-264
MỤC LỤC CHƯƠNG
|
Đặc điểm lâm sàng Các triệu chứng liên quan đến tổn thương phổi nguyên phát Các triệu chứng liên quan đến di căn hạch và di căn xa Các hội chứng cận ung thư Phương pháp chẩn đoán Đánh giá đại thể Đánh giá vi thể và phân tử Đánh giá chức năng Tầm soát ung thư phổi Các nguyên tắc điều trị Điều trị Ung thư phổi không tế bào nhỏ Điều trị Ung thư phổi tế bào nhỏ Tái thông đường thở U carcinoid phế quản Nốt đơn độc ở phổi |
Mục tiêu của chương này là mở rộng thảo luận về ung thư phổi sang lĩnh vực lâm sàng và liên hệ các quá trình bệnh lý đã được xem xét trong Chương 20 với bối cảnh lâm sàng. Sau khi trình bày các đặc điểm lâm sàng chính của ung thư phổi, chương sẽ thảo luận về phương pháp chẩn đoán và các nguyên tắc quản lý chung. Chương kết thúc bằng một cuộc thảo luận ngắn gọn về u carcinoid phế quản và vấn đề lâm sàng của nốt phổi đơn độc.
ĐẶC ĐIỂM LÂM SÀNG
Bởi vì ung thư phổi có lẽ bắt đầu từ một tế bào ác tính duy nhất, một quá trình dài các chu kỳ phân chia và nhân đôi số lượng tế bào phải xảy ra trước khi khối u trở nên rõ ràng trên lâm sàng. Trong giai đoạn tiền lâm sàng này, ước tính có khoảng 30 lần phân chia diễn ra trước khi khối u đạt đường kính 1 cm. Quá trình này rất có thể đòi hỏi vài năm, trong thời gian đó bệnh nhân và bác sĩ không hề hay biết về khối u.
Khả năng bị ung thư phổi thường được đặt ra do các phát hiện trên các phương tiện chẩn đoán hình ảnh như X-quang ngực hoặc chụp cắt lớp vi tính (CT), hoặc do một loạt các triệu chứng xuất hiện. Phần này chủ yếu tập trung vào các triệu chứng; các phương tiện chẩn đoán hình ảnh và lấy mẫu chẩn đoán được thảo luận trong phần “Phương Pháp Chẩn Đoán.” Các triệu chứng tại thời điểm biểu hiện có thể liên quan đến tổn thương phổi nguyên phát, đến bệnh di căn (ở các hạch bạch huyết trong lồng ngực hoặc tại các vị trí xa), hoặc đến những gì thường được gọi là “hội chứng cận ung thư.”
Các Triệu Chứng Liên Quan Đến Tổn Thương Phổi Nguyên Phát
Có lẽ các triệu chứng phổ biến nhất liên quan đến ung thư phổi là ho và ho ra máu. Vì ung thư biểu mô phế quản thường phát triển ở những người hút thuốc, những bệnh nhân này thường bỏ qua các triệu chứng của họ (đặc biệt là ho) và cho rằng đó là các biến chứng thông thường của việc hút thuốc và viêm phế quản mạn tính. Với các khối u bắt nguồn từ các đường thở lớn, chẳng hạn như ung thư biểu mô vảy hoặc ung thư tế bào nhỏ, bệnh nhân cũng có thể gặp các vấn đề liên quan đến tắc nghẽn phế quản, chẳng hạn như viêm phổi sau tắc nghẽn hoặc khó thở do tắc nghẽn một phế quản chính. Ngược lại, với các khối u phát sinh ở ngoại vi của phổi, bao gồm nhiều loại ung thư biểu mô tuyến và ung thư tế bào lớn, bệnh nhân thường không có các triệu chứng liên quan đến phế quản, và các tổn thương của họ thường được phát hiện trên hình ảnh thu được vì các lý do không liên quan.
Khi khối u xâm lấn bề mặt màng phổi, dù do lan rộng trực tiếp hay do di căn, bệnh nhân có thể bị đau ngực, thường là đau kiểu màng phổi, hoặc khó thở do tích tụ một lượng lớn dịch màng phổi. Các cấu trúc lân cận khác, đặc biệt là tim và thực quản, có thể bị ảnh hưởng do xâm lấn trực tiếp hoặc chèn ép từ bên ngoài bởi khối u. Các biến chứng có thể xảy ra bao gồm tràn dịch màng ngoài tim, rối loạn nhịp tim và khó nuốt.
Các khối u bắt nguồn từ phần đỉnh cao nhất của phổi, được gọi là khối u rãnh trên hoặc u Pancoast, thường tạo ra một tập hợp các triệu chứng và dấu hiệu thực thể đặc trưng do lan rộng trực tiếp đến các cấu trúc lân cận. Sự xâm lấn các dây thần kinh tạo nên đám rối cánh tay có thể gây đau và yếu vai và cánh tay. Sự xâm lấn chuỗi hạch giao cảm cổ tạo ra các đặc điểm điển hình của hội chứng Horner—sụp mi (mí mắt trên bị sụp), co đồng tử (đồng tử bị co lại), và mất tiết mồ hôi (mất mồ hôi) ở trán và mặt—tất cả đều xảy ra ở cùng bên với khối u phổi. Xâm lấn các cấu trúc xương lân cận (ví dụ: xương sườn và đốt sống) là một biến chứng phổ biến.
|
Các vấn đề lâm sàng tiềm tàng với ung thư phổi:
|
Các Triệu Chứng Liên Quan Đến Di Căn Hạch và Di Căn Xa
Khi một khối u phổi nguyên phát di căn đến các hạch bạch huyết trung thất, các triệu chứng thường phát sinh do sự xâm lấn hoặc chèn ép các cấu trúc quan trọng trong trung thất, chẳng hạn như thần kinh hoành, thần kinh thanh quản quặt ngược, hoặc tĩnh mạch chủ trên. Do đó, các tình trạng sau đây có thể phát triển tương ứng: liệt cơ hoành (thường đi kèm với khó thở), liệt dây thanh (với khàn tiếng), và hội chứng chèn ép tĩnh mạch chủ trên (với phù mặt và chi trên do tắc nghẽn dòng máu tĩnh mạch trở về).
Di căn xa, phổ biến nhất đến não, xương hoặc tủy xương, gan và (các) tuyến thượng thận, thường không có triệu chứng. Trong các trường hợp khác, các triệu chứng phụ thuộc vào hệ cơ quan cụ thể bị ảnh hưởng, và các biểu hiện như co giật hoặc đau xương có thể phát triển. Ung thư tế bào nhỏ là loại tế bào có khả năng di căn xa cao nhất. Ung thư biểu mô vảy ít có khả năng nhất, và cả ung thư biểu mô tuyến và ung thư tế bào lớn đều ở vị trí trung gian.
Các Hội Chứng Cận Ung Thư
Nhiều khối u phổi có liên quan đến các hội chứng lâm sàng không phải do tính chất choán chỗ của khối u hoặc do sự xâm lấn trực tiếp của nó vào các cấu trúc hoặc cơ quan khác. Các hội chứng này được gọi là các biểu hiện “cận ung thư” của bệnh ác tính và thường do khối u sản xuất một hormone hoặc một chất giống hormone hoặc do sự hiện diện của các tự kháng thể được kích thích bởi các kháng nguyên trên khối u.
Khi một hormone được sản xuất bởi khối u phổi (hoặc bởi bất kỳ loại khối u nào khác), bệnh nhân được cho là có sản xuất hormone “lạc chỗ.” Đôi khi các triệu chứng lâm sàng là kết quả của nồng độ hormone lưu hành cao; trong các trường hợp khác, chỉ các kỹ thuật đo lường nhạy mới có thể phát hiện được sự sản xuất hormone.
Tại sao một số khối u sản xuất hormone lạc chỗ vẫn chưa rõ. Thông tin di truyền mã hóa cho hormone cụ thể có mặt nhưng không được biểu hiện trong các tế bào bình thường, không ác tính, và người ta đã giả thuyết rằng trong quá trình trở thành ác tính, tế bào trải qua một quá trình rối loạn điều hòa gen. Kết quả là, tế bào ác tính lấy lại khả năng biểu hiện vật liệu di truyền thường im lặng này để mã hóa cho việc sản xuất hormone.
Loại ung thư phổi thường xuyên liên quan đến sản xuất lạc chỗ các chất thể dịch nhất là ung thư phổi tế bào nhỏ (small-cell lung cancer – SCLC), có lẽ là do các đặc điểm nội tiết thần kinh của nó. Hormone chống bài niệu (antidiuretic hormone – ADH) và hormone vỏ thượng thận (adrenocorticotropic hormone – ACTH) là các hormone phổ biến nhất được SCLC sản xuất. Hội chứng tiết ADH không thích hợp (syndrome of inappropriate ADH – SIADH) gây hạ natri máu được thấy ở khoảng 10% bệnh nhân SCLC, và SCLC là nguyên nhân của hầu hết các trường hợp SIADH liên quan đến bệnh ác tính. Sản xuất ACTH lạc chỗ xảy ra ở khoảng 1% bệnh nhân SCLC. Một hội chứng cận ung thư thường liên quan đến ung thư phổi biểu mô vảy, chứ không phải SCLC, là tăng calci máu do sản xuất peptide liên quan đến hormone cận giáp, một peptide có hoạt tính giống hormone cận giáp. Việc sản xuất các hormone khác, chẳng hạn như calcitonin và gonadotropin màng đệm ở người, cũng được mô tả rõ với ung thư biểu mô phế quản.
SCLC là nguyên nhân phổ biến nhất của các hội chứng cận ung thư qua trung gian tự miễn ảnh hưởng đến hệ thần kinh. Cơ chế này được hiểu rõ nhất đối với hội chứng nhược cơ Lambert-Eaton, trong đó khối u biểu hiện một protein kênh canxi điều khiển bằng điện thế trên bề mặt của nó. Protein này thường có mặt tại điểm nối thần kinh-cơ và quan trọng trong việc điều hòa canxi. Các tự kháng thể được kích thích bởi protein trên khối u, và các kháng thể này phản ứng chéo với protein bình thường tại điểm nối thần kinh-cơ, làm gián đoạn sự dẫn truyền thần kinh-cơ và gây yếu cơ xương.
Các biểu hiện ở mô mềm và xương của ngón tay dùi trống và bệnh xương khớp phì đại (xem Chương 3) thường liên quan nhất đến ung thư biểu mô tuyến của phổi và có thể liên quan đến sự phân mảnh bất thường của các mẫu tiểu cầu trong phổi ở những bệnh nhân có biến chứng này. Các ảnh hưởng toàn thân không đặc hiệu của bệnh ác tính, chẳng hạn như chán ăn, sụt cân và mệt mỏi, là những hậu quả tiềm tàng của ung thư phổi, và người ta đã giả thuyết rằng việc sản xuất các chất trung gian khác nhau, chẳng hạn như yếu tố hoại tử khối u, có thể là trung gian cho các ảnh hưởng toàn thân này.
PHƯƠNG PHÁP CHẨN ĐOÁN
Một loạt các phương pháp chẩn đoán được sử dụng trong việc đánh giá các trường hợp ung thư phổi đã biết hoặc nghi ngờ. Nhiều nghiên cứu đánh giá phổi ở cấp độ đại thể nhằm mục đích chứng minh sự hiện diện, vị trí và khả năng lan rộng của ung thư biểu mô phế quản. Đánh giá ở cấp độ vi thể là cần thiết để xác định loại mô học của ung thư phổi và phân tích các dấu ấn hóa mô miễn dịch và di truyền của nó, đây là những yếu tố quan trọng trong việc xác định phương thức điều trị nào là phù hợp nhất. Đánh giá chức năng của bệnh nhân ung thư phổi chủ yếu đóng vai trò trong việc xác định mức độ nghiêm trọng của bệnh phổi tiềm ẩn, đặc biệt là bệnh phổi tắc nghẽn mạn tính do hút thuốc lá nhiều trước đó. Việc biết được giới hạn chức năng của bệnh nhân do bệnh phổi là rất cần thiết trước khi bác sĩ lâm sàng có thể quyết định liệu việc phẫu thuật cắt bỏ một khối u phổi có khả thi mà không gây ra suy hô hấp gây tàn phế hay không.
Đánh Giá Đại Thể
Xét nghiệm ban đầu để phát hiện và đánh giá đại thể ung thư biểu mô phế quản thường là X-quang ngực thẳng và nghiêng. Sự hiện diện của một nốt hoặc khối trong phổi trên phim X-quang ngực luôn đặt ra câu hỏi về ung thư phổi, đặc biệt là khi bệnh nhân có tiền sử hút thuốc lá đáng kể. Vị trí của tổn thương có thể cung cấp một manh mối gián tiếp về mô học của nó: các tổn thương ngoại vi có nhiều khả năng là ung thư biểu mô tuyến hoặc ung thư tế bào lớn, trong khi các tổn thương trung tâm về mặt thống kê có nhiều khả năng là ung thư biểu mô vảy hoặc ung thư tế bào nhỏ (Hình 21.1 và 21.2). X-quang ngực cũng hữu ích để xác định sự hiện diện của các tổn thương đáng ngờ khác, chẳng hạn như khối u nguyên phát thứ hai hoặc di căn từ khối ung thư ban đầu. Sự xâm lấn các hạch rốn phổi hoặc trung thất hoặc màng phổi (với kết quả là tràn dịch màng phổi) có thể được phát hiện trên X-quang ngực, và một phát hiện như vậy sẽ ảnh hưởng đáng kể đến phương pháp điều trị tổng thể.
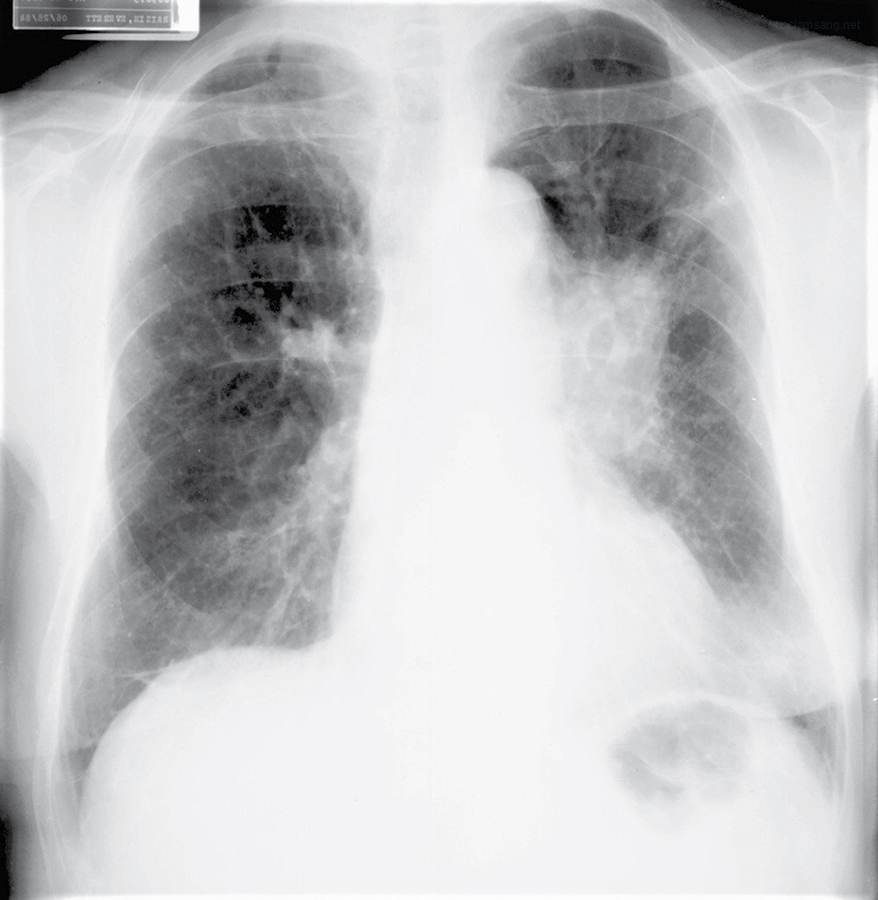
Hình 21.1 X-quang ngực cho thấy ung thư phổi tế bào nhỏ biểu hiện dưới dạng một khối ở rốn phổi trái.*
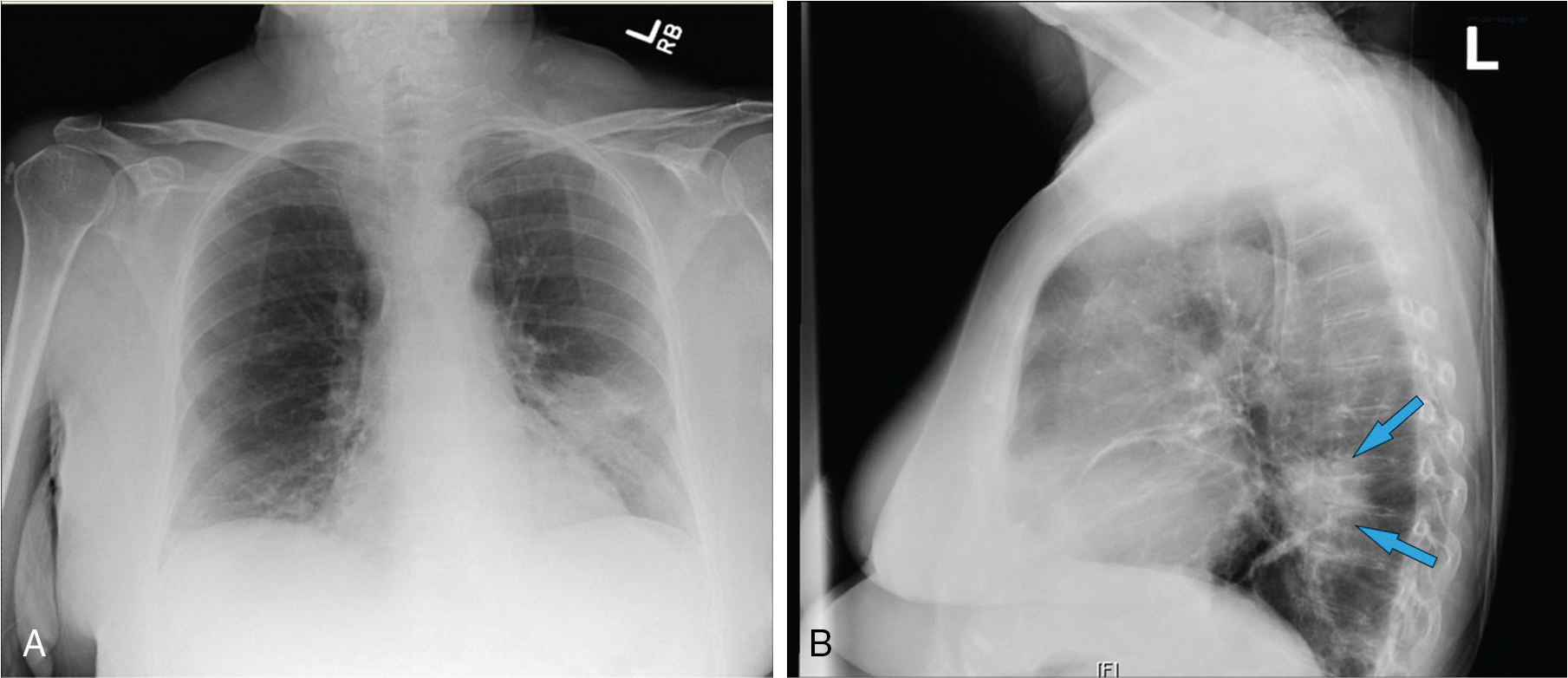
Hình 21.2 A, X-quang ngực thẳng (PA) cho thấy ung thư biểu mô tuyến biểu hiện dưới dạng một khối ở thùy dưới phổi trái. B, X-quang ngực nghiêng của cùng một bệnh nhân cho thấy khối u nằm sau bóng tim (mũi tên).*
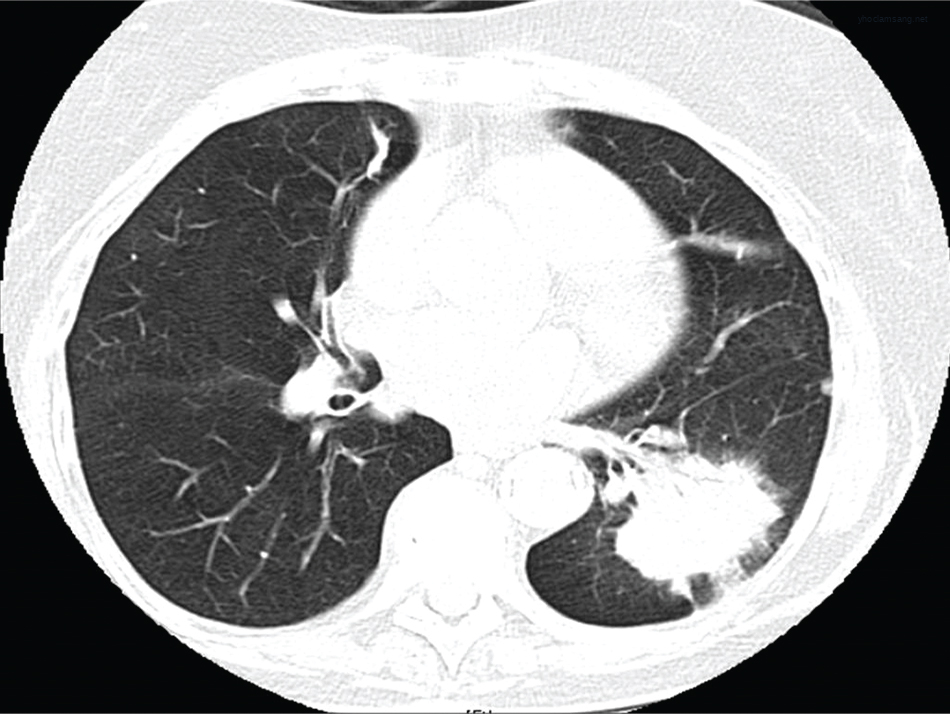
Hình 21.3 Hình ảnh CT ngực cắt ngang (axial) của cùng bệnh nhân trong Hình 21.2 cho thấy sự xuất hiện của ung thư biểu mô tuyến thùy dưới phổi trái.*
CT ngực và bụng trên là một phần tiêu chuẩn của việc đánh giá chẩn đoán ở bệnh nhân ung thư phổi (Hình 21.3). Bên cạnh việc giúp xác định vị trí, mức độ lan rộng của khối u trong lồng ngực, kỹ thuật này đặc biệt hữu ích để phát hiện các hạch bạch huyết phì đại, có khả năng ác tính trong trung thất, mà thường không nhìn thấy được bằng X-quang thông thường. Tuy nhiên, mặc dù CT xác định hiệu quả các hạch trung thất phì đại, nó không thể xác định liệu các hạch đó chỉ đơn thuần là tăng sản hay phì đại do sự xâm lấn của khối u. Do đó, việc lấy mẫu mô học của các hạch trung thất phì đại vẫn cần thiết để xác nhận sự xâm lấn của khối u vào các hạch. CT cũng rất quan trọng trong việc đánh giá gan và tuyến thượng thận vì đây là những vị trí di căn phổ biến của ung thư phổi.
Chụp cắt lớp phát xạ positron (Positron emission tomography – PET) (xem Chương 3) thường được kết hợp với chụp CT trong các đánh giá phân giai đoạn của ung thư phổi. Do hoạt động chuyển hóa cao, các tổn thương ác tính thường biểu hiện sự hấp thu cao chất đánh dấu ¹⁸F-fluorodeoxyglucose (FDG) (xem Hình 3.13). Sự hấp thu khu trú trong vùng của một nốt hoặc khối nhu mô cho thấy tổn thương là ác tính, và sự hấp thu ở trung thất hoặc tại các vị trí xa thường phản ánh sự lan rộng của khối u đến các vị trí đó. Tuy nhiên, các tổn thương có hoạt động chuyển hóa khác, chẳng hạn như các khu vực nhiễm trùng cục bộ, cũng có thể cho thấy sự hấp thu FDG. Do đó, một kết quả PET dương tính trong bối cảnh lâm sàng thích hợp rất gợi ý nhưng không phải là chẩn đoán xác định bệnh ác tính.
Cách tốt nhất để kiểm tra trực tiếp đường thở của bệnh nhân nghi ngờ hoặc đã biết bị ung thư biểu mô phế quản là bằng nội soi phế quản với ống soi mềm (xem Chương 3). Vị trí và mức độ lan rộng trong lòng phế quản của nhiều khối u có thể được quan sát trực tiếp, và các mẫu có thể được lấy từ tổn thương, để xét nghiệm tế bào học hoặc mô bệnh học (Hình 21.4). Ngoài ra, người nội soi có thể đánh giá xem một khối ung thư trong lòng phế quản có chèn ép đáng kể vào lòng phế quản và gây tắc nghẽn đường thở một phần hoặc hoàn toàn hay không. Các mẫu chẩn đoán có thể được lấy trong nhiều trường hợp ngay cả khi tổn thương nằm ngoài tầm nhìn trực tiếp của ống nội soi. Nội soi phế quản định vị điện từ, đặc biệt khi kết hợp với nền tảng robot, đặc biệt hữu ích trong việc lấy các mẫu bệnh phẩm ở vị trí xa hơn tầm quan sát của ống nội soi.
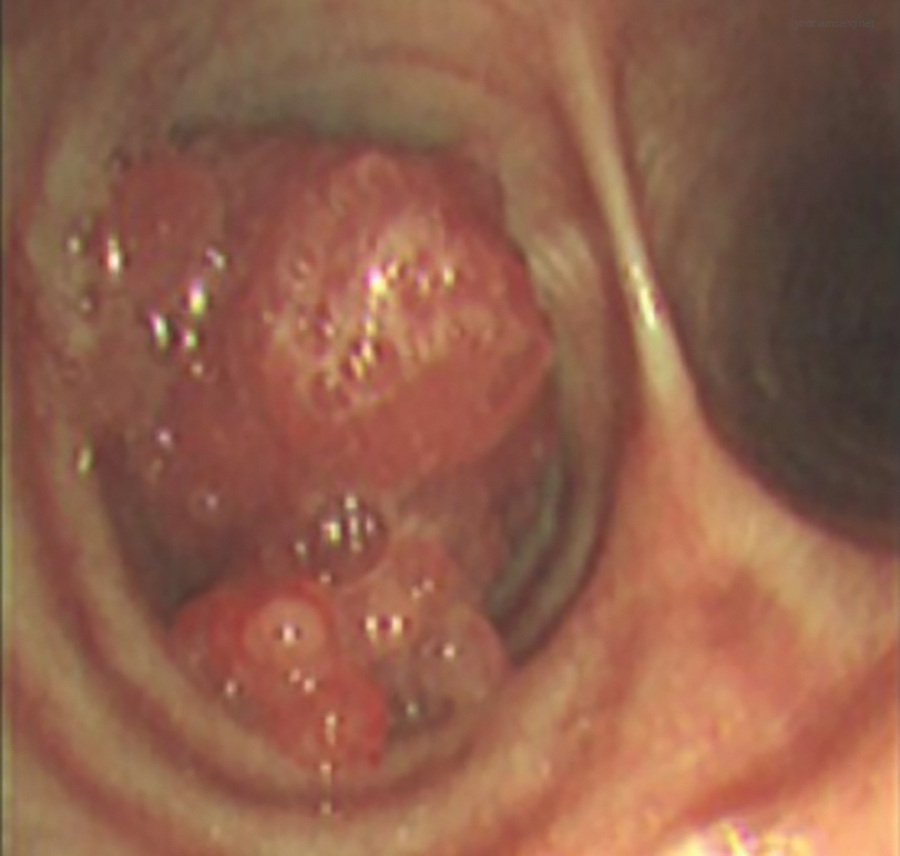
Hình 21.4 Hình ảnh nội soi phế quản của một khối ung thư phổi lớn, có thùy, gây tắc nghẽn phế quản gốc trái.*
Phân Giai Đoạn Ung Thư Phổi
Sau khi một khối u đã được xác định, việc đánh giá mức độ và sự lan rộng của bệnh ác tính được thực hiện chính thức bằng cách phân giai đoạn. Phân giai đoạn sử dụng hệ thống phân loại TNM, dựa trên (1) khối u nguyên phát trong lồng ngực (T)—kích thước, vị trí và các biến chứng tại chỗ của nó, chẳng hạn như lan rộng trực tiếp đến các cấu trúc lân cận hoặc tắc nghẽn lòng đường thở; (2) sự hiện diện hay vắng mặt của khối u trong các hạch bạch huyết rốn phổi và trung thất (N); và (3) sự lan rộng xa của khối u (tức là di căn) ra ngoài lồng ngực đến các mô hoặc hệ cơ quan khác (M) (Bảng 21.1). Dựa trên các đặc điểm T, N, và M của một khối u cụ thể, một giai đoạn khối u cụ thể (I-IV) được chỉ định (Bảng 21.2).
Bảng 21.1 Tổng quan về Phân loại TNM của Ung thư Phổi
|
Cơ sở để phân loại TNM chính thức và phân giai đoạn ung thư phổi bao gồm:
|
Thành phần đầu tiên của việc phân giai đoạn là xác định các đặc điểm của chính khối u nguyên phát, và nó thường được thực hiện bằng sự kết hợp giữa chẩn đoán hình ảnh ngực và nội soi phế quản. Thành phần thứ hai, dựa trên sự xâm lấn của khối u vào các hạch bạch huyết trung thất, thường được đánh giá ban đầu bằng CT được bổ sung bằng chụp PET-FDG. Chụp PET-FDG có thể xác định khối u có hoạt động chuyển hóa (>1 cm) trong trung thất và ở những nơi khác. Việc chồng hình ảnh hấp thu FDG-PET lên hình ảnh CT tương ứng cho phép định vị giải phẫu chính xác của sự hấp thu. Đánh giá dứt khoát về sự phì đại của hạch và/hoặc sự hấp thu FDG đòi hỏi sinh thiết và đánh giá mô học của (các) hạch, và điều này có thể được thực hiện bằng chọc hút kim nhỏ xuyên thành phế quản dưới hướng dẫn của siêu âm nội soi phế quản, hoặc bằng sinh thiết phẫu thuật, thông qua nội soi trung thất hoặc mở trung thất. Được thực hiện như một phần của thủ thuật nội soi phế quản mềm, chọc hút kim xuyên thành phế quản là một lựa chọn để lấy mẫu tế bào từ các hạch bạch huyết liền kề với các đường thở chính. Trong nội soi trung thất trên xương ức, trung thất được quan sát bằng một ống soi được đưa qua một vết rạch ngay trên hõm ức, và các mẫu sinh thiết có thể được lấy bằng kỹ thuật này. Trong mở trung thất cạnh xương ức, trung thất được kiểm tra thông qua một vết rạch nhỏ được thực hiện liền kề với xương ức, và các mẫu của các hạch đáng ngờ có thể được lấy. Sinh thiết một số hạch bạch huyết trung thất dưới hướng dẫn của siêu âm có thể được thực hiện thông qua một ống nội soi được đưa vào thực quản thay vì cây khí-phế quản. Khi có sẵn, chọc hút kim nhỏ xuyên thành phế quản dưới hướng dẫn của siêu âm nội soi phế quản được ưu tiên hơn so với nội soi trung thất phẫu thuật để lấy mẫu mô vì nó ít xâm lấn hơn và không phải lúc nào cũng cần gây mê toàn thân.
Thành phần thứ ba của việc phân giai đoạn liên quan đến việc xác định xem khối u đã lan đến các vị trí xa hay chưa. Nếu có sẵn, một lần chụp PET-FDG toàn thân thường sẽ chỉ ra các vị trí di căn xa ở xương, gan và tuyến thượng thận. Nếu không có chụp PET-FDG, bệnh di căn ở xương có thể được chứng minh rõ ràng bằng xạ hình xương. CT đặc biệt phù hợp để phát hiện di căn đến gan, não và tuyến thượng thận. Điều quan trọng là, chụp PET-FDG không hữu ích lắm để đánh giá di căn nội sọ vì mô não có hoạt động chuyển hóa rất cao ở mức cơ bản nên rất khó phân biệt giữa một khối di căn và mô não bình thường xung quanh. Thay vào đó, chụp CT hoặc cộng hưởng từ là tốt nhất để phát hiện di căn nội sọ.
Mặc dù hệ thống phân giai đoạn chính thức này có thể được áp dụng cho tất cả các loại ung thư phổi, một hệ thống đơn giản hóa hơn để phân loại SCLC thường được sử dụng cho mục đích điều trị. Cụ thể, SCLC được phân loại thành bệnh giai đoạn giới hạn hoặc giai đoạn lan rộng. Bệnh giai đoạn giới hạn được định nghĩa là khối u chỉ giới hạn ở một bên lồng ngực và các hạch bạch huyết vùng. Ngược lại, bệnh giai đoạn lan rộng đại diện cho sự lan ra ngoài khu vực này.
Bảng 21.2 Tổng quan về các giai đoạn và tiên lượng của ung thư phổi dựa trên phân loại TNM
Đánh Giá Vi Thể và Phân Tử
Chẩn đoán ban đầu về ung thư phổi có thể được xác định từ việc kiểm tra các mẫu tế bào học thu được từ đờm, từ dịch rửa hoặc chải phế quản thu được qua ống nội soi phế quản, hoặc từ vật liệu được hút ra từ khối u bằng một kim cỡ nhỏ. Tuy nhiên, việc mô tả đầy đủ về khối u đòi hỏi một mẫu sinh thiết lớn hơn, có thể được lấy bằng cách đưa một kìm sinh thiết qua ống nội soi phế quản, bằng cách sử dụng một kim cắt được đưa qua thành ngực trực tiếp vào khối u, hoặc bằng cách lấy mẫu mô trực tiếp tại thời điểm phẫu thuật.
Trong nhiều năm, đã có một sự thay đổi mô hình trong việc đánh giá và điều trị ung thư phổi. Trước đây, sự phân biệt chính là giữa SCLC và ung thư phổi không tế bào nhỏ (non-small-cell lung cancer – NSCLC), bao gồm ung thư biểu mô tuyến, ung thư biểu mô vảy, và ung thư tế bào lớn. Việc phân biệt giữa các phân nhóm của NSCLC ít quan trọng hơn vì các nguyên tắc điều trị nói chung là giống hệt nhau cho tất cả bệnh nhân NSCLC, tức là, dựa trên giai đoạn chứ không phải loại tế bào cụ thể.
Mặc dù sự phân biệt giữa SCLC và NSCLC vẫn rất quan trọng, việc nhận ra rằng các đột biến cụ thể trong một khối u NSCLC cho phép điều trị nhắm trúng đích (sẽ được thảo luận dưới đây) đã làm cho việc phân tích phân tử hoàn chỉnh hơn của các khối u phổi trở thành một thành phần bổ sung của việc đánh giá chẩn đoán. Mặc dù việc kiểm tra mô học của một khối u vẫn được thực hiện và có một số giá trị, việc phân tích hóa mô miễn dịch và di truyền sâu hơn cho các bất thường cụ thể bao gồm đột biến thụ thể yếu tố tăng trưởng biểu bì (epidermal growth factor receptor – EGFR) và chuyển vị kinase u lympho không biệt hóa (anaplastic lymphoma kinase – ALK)—hiện là thực hành tiêu chuẩn ở hầu hết các trung tâm.
Ngoài việc xác định đặc điểm di truyền, khối u có thể được kiểm tra để xác định xem nó có khả năng đáp ứng với liệu pháp miễn dịch hay không, các loại thuốc chống ung thư kích thích hệ thống miễn dịch của bệnh nhân tấn công bệnh ác tính. Thông thường, điều này bao gồm việc đánh giá tỷ lệ tế bào khối u biểu hiện ligand gây chết tế bào theo chương trình-1 (programmed cell death ligand-1 – PD-L1); nếu hơn 50% tế bào ác tính biểu hiện PD-L1, có khả năng cao đáp ứng với một nhóm thuốc được gọi là thuốc ức chế điểm kiểm soát miễn dịch (immune checkpoint inhibitors – ICI).
Đánh Giá Chức Năng
Đánh giá chức năng của bệnh nhân ung thư phổi cung cấp thông tin quan trọng để hướng dẫn bác sĩ lâm sàng trong việc lựa chọn phương pháp điều trị. Như đã thảo luận trong phần “Các Nguyên Tắc Điều Trị,” phẫu thuật thường là thủ thuật được lựa chọn nếu phân giai đoạn cho thấy bệnh còn khu trú và có khả năng chữa khỏi bằng phẫu thuật. Tuy nhiên, khi phẫu thuật được thực hiện, thường phải cắt bỏ một thùy và đôi khi là toàn bộ một lá phổi. Vì bệnh nhân thường là người hút thuốc, họ có nguy cơ cao bị bệnh phổi tắc nghẽn mạn tính tiềm ẩn đáng kể, và họ có thể không dung nạp được việc cắt bỏ một lượng lớn mô phổi.
Đo phế dung ký là hữu ích như bước đầu tiên trong việc xác định xem một bệnh nhân có phải là ứng cử viên phẫu thuật phù hợp hay không. Nếu kết quả đo phế dung ký ở mức ranh giới và không xác định rõ liệu bệnh nhân có thể dung nạp được việc cắt bỏ phổi hay không, các xét nghiệm khác được sử dụng để xác định khả năng gắng sức hoặc lượng chức năng tương đối do khu vực phổi sẽ bị cắt bỏ đóng góp. Việc đánh giá chức năng phổi giúp xác định liệu phẫu thuật cắt bỏ có thể được dung nạp bởi bệnh nhân bị suy giảm chức năng hay không.
TẦM SOÁT UNG THƯ PHỔI
Vì khả năng chữa khỏi ung thư phổi thông qua phẫu thuật cắt bỏ là lớn nhất khi tổn thương chưa di căn đến các hạch bạch huyết hoặc các vị trí xa, có vẻ hợp lý rằng việc tầm soát các cá nhân có nguy cơ cao để phát hiện các tổn thương nhỏ, sớm chưa gây ra triệu chứng sẽ cải thiện tỷ lệ sống còn chung. Trong quá khứ, các nghiên cứu có đối chứng về tế bào học đờm và X-quang ngực ở một quần thể người hút thuốc có nguy cơ cao đã không thể chứng minh được sự cải thiện tỷ lệ tử vong do ung thư phổi với việc sử dụng các kỹ thuật tầm soát này.
Tuy nhiên, trong một thay đổi lớn so với các khuyến nghị trước đây, dựa trên kết quả của Thử nghiệm Tầm soát Ung thư Phổi Quốc gia (National Lung Screening Trial – NSLT), việc tầm soát ung thư phổi bằng chụp cắt lớp vi tính liều thấp (low-dose computed tomography – LDCT) ngực hiện được khuyến nghị cho các cá nhân có nguy cơ cao. NSLT đã phân ngẫu nhiên hơn 50.000 bệnh nhân có nguy cơ cao mắc ung thư phổi vào nhóm tầm soát bằng LDCT hoặc X-quang ngực tiêu chuẩn. Thử nghiệm đã được dừng sớm khi phát hiện giảm 20% tỷ lệ tử vong ở nhóm LDCT. Tầm soát bằng LDCT hiện được Lực lượng Đặc nhiệm Dịch vụ Dự phòng Hoa Kỳ và các tổ chức khác khuyến nghị cho người lớn từ 50 đến 80 tuổi có tiền sử hút thuốc hơn 20 gói-năm, vẫn đang hút thuốc hoặc đã bỏ thuốc dưới 15 năm.
Tuy nhiên, có những cân nhắc bổ sung mà cả bác sĩ lâm sàng và bệnh nhân đều cần phải hiểu. Điều quan trọng cần lưu ý là gần 40% bệnh nhân trong nhóm LDCT có kết quả dương tính giả—tức là, một tổn thương được tìm thấy khi tầm soát nhưng được chứng minh không phải là ung thư phổi. Trong số tất cả các tổn thương được tìm thấy, 96% không phải là ung thư phổi. Chẩn đoán ung thư phổi đòi hỏi phải đánh giá vi thể các mẫu mô; do đó, nhiều bệnh nhân đã phải chịu đựng sự căng thẳng tâm lý và các thủ thuật xâm lấn chỉ để phát hiện ra tổn thương là lành tính. Một hậu quả tiềm tàng khác là chẩn đoán quá mức—điều này đề cập đến khả năng một khối ung thư phổi được phát hiện nhưng phát triển chậm và nếu không thì sẽ không ảnh hưởng đến tỷ lệ tử vong. Hy vọng rằng các nghiên cứu đang diễn ra để tinh chỉnh các tiêu chí tầm soát và cải thiện các kỹ thuật chẩn đoán sẽ giảm thiểu bất kỳ nhược điểm nào của việc tầm soát ung thư phổi.
CÁC NGUYÊN TẮC ĐIỀU TRỊ
Việc lựa chọn phương pháp điều trị ung thư phổi phụ thuộc vào tình trạng chức năng, loại tế bào, giai đoạn và các đặc điểm phân tử của khối u. Nói chung, các phác đồ điều trị bắt đầu bằng sự phân biệt giữa SCLC và NSCLC. Với những tiến bộ gần đây trong việc hiểu biết về sinh học phân tử của ung thư phổi, sự phát triển của liệu pháp nhắm trúng đích cho một số khối u, và việc sử dụng liệu pháp miễn dịch với ICI, phương pháp điều trị cho bệnh nhân ung thư phổi đang liên tục phát triển.
Năm hình thức điều trị chính có sẵn cho ung thư phổi là phẫu thuật, xạ trị, hóa trị, liệu pháp nhắm trúng đích phân tử nhắm vào các đột biến dẫn đường, và liệu pháp miễn dịch. Ngoài tình trạng chức năng của bệnh nhân và sự hiện diện hay vắng mặt của bệnh đồng mắc, bốn yếu tố chính liên quan đến khối u xác định cách điều trị một khối u cụ thể: giai đoạn của nó (tức là kích thước, vị trí và mức độ lan rộng), loại tế bào của nó, sự hiện diện của “đột biến dẫn đường” (các đột biến di truyền trong tế bào khối u thúc đẩy sự phát triển của tế bào và có thể bị nhắm mục tiêu bởi các chất ức chế cụ thể), và mức độ biểu hiện PD-L1 (tương quan với đáp ứng dự kiến với điều trị bằng ICI).
Điều Trị Ung Thư Phổi Không Tế Bào Nhỏ (NSCLC)
Miễn là bệnh nhân có đủ dự trữ chức năng phổi, phẫu thuật vẫn là phương pháp điều trị được lựa chọn cho NSCLC khu trú bất kể có hay không có các đột biến kích hoạt như EGFR. Cắt bỏ hoàn toàn toàn bộ khối u, thường bằng cách cắt bỏ toàn bộ thùy có khối u (cắt thùy phổi), mang lại cơ hội chữa khỏi tốt nhất. Do đó, bệnh nhân ở giai đoạn I, II và IIIA được xem xét phẫu thuật với mục đích chữa khỏi. Đối với bệnh nhân giai đoạn I hoặc II từ chối phẫu thuật hoặc được coi là không thể phẫu thuật do bệnh đồng mắc hoặc chức năng phổi hạn chế, xạ trị lập thể định vị thân (stereotactic body radiation therapy – SBRT) là một lựa chọn thay thế ngày càng được sử dụng. SBRT cung cấp liều bức xạ cao được nhắm mục tiêu chính xác vào khối u trong khi cố gắng giảm thiểu việc chiếu xạ đến các mô bình thường liền kề. Tùy thuộc vào giai đoạn, hóa trị cũng có thể được sử dụng như một liệu pháp bổ trợ trước hoặc sau phẫu thuật.
Khi khối u đã lan rộng trực tiếp đến màng phổi (với các tế bào ác tính được tìm thấy trong dịch màng phổi) hoặc đến các hạch bạch huyết ngoài lồng ngực cùng bên, nó thường được coi là không thể cắt bỏ, và hóa trị, xạ trị, liệu pháp nhắm trúng đích phân tử, liệu pháp miễn dịch, hoặc sự kết hợp của các phương thức được sử dụng. Có sự quan tâm lớn trong việc cố gắng xác định các phương thức điều trị tốt nhất cho những bệnh nhân mà lợi ích của phẫu thuật còn gây tranh cãi, chẳng hạn như những người có tổn thương hạch trung thất cùng bên hoặc tổn thương thành ngực.
Nếu di căn đến các mô hoặc cơ quan xa đã xảy ra, phẫu thuật thường không phải là một hình thức điều trị thích hợp; tuy nhiên, ở những bệnh nhân được lựa chọn cẩn thận có một khối di căn đơn độc, cả khối u nguyên phát và tổn thương di căn đều có thể được cắt bỏ. Ví dụ, việc phẫu thuật cắt bỏ một khối di căn não đơn độc trong các trường hợp được lựa chọn có thể liên quan đến việc cải thiện tỷ lệ sống còn. Ở hầu hết tất cả các bệnh nhân giai đoạn IV (di căn), các lựa chọn quản lý bao gồm hóa trị, liệu pháp nhắm trúng đích phân tử và liệu pháp miễn dịch.
Trước đây, hóa trị điển hình cho tất cả các loại NSCLC là một phác đồ dựa trên platin gây độc tế bào, thường khó dung nạp đối với bệnh nhân. Với việc nhận ra tầm quan trọng của các đặc điểm phân tử của khối u, việc điều trị được khuyến nghị cho NSCLC không thể phẫu thuật hoặc tái phát đã thay đổi đáng kể trong những năm gần đây. Bây giờ, khi có sẵn, việc xác định phân nhóm phân tử được thực hiện để đánh giá các đột biến dẫn đường có thể bị nhắm mục tiêu bởi các loại thuốc cụ thể để ức chế chức năng của chúng. Đột biến đầu tiên và được mô tả rõ nhất là đột biến EGFR, mặc dù nhiều đột biến khác đang được nhắm mục tiêu trên lâm sàng hoặc đang được nghiên cứu.
Đột biến ở EGFR xảy ra ở khoảng 15% bệnh nhân ung thư biểu mô tuyến ở Hoa Kỳ và lên đến 60% bệnh nhân như vậy từ các khu vực ở châu Á. Đột biến EGFR cũng có vẻ phổ biến hơn ở phụ nữ và ở những bệnh nhân ung thư phổi không hút thuốc. EGFR là một thụ thể bề mặt tế bào xuất hiện bình thường, được điều hòa cao; khi được kích hoạt, nó kích hoạt một tyrosine kinase nội bào, dẫn đến sự tăng sinh tế bào. Thụ thể EGFR bị đột biến không đáp ứng với các tín hiệu ức chế bình thường, dẫn đến sự kích hoạt liên tục của tyrosine kinase và sự phát triển tế bào không kiểm soát. Khi có đột biến EGFR, điều trị bằng các chất ức chế tyrosine kinase cụ thể (ví dụ: osimertinib) có liên quan đến thời gian sống không tiến triển bệnh dài hơn.
Phương pháp điều trị mới nhất cho bệnh nhân NSCLC giai đoạn tiến xa liên quan đến liệu pháp miễn dịch nhắm vào con đường chết theo chương trình (programmed death – PD). Nhiều khối u phổi biểu hiện PD-L1, tương tác với thụ thể PD-1 trên các tế bào hiệu ứng miễn dịch để đóng vai trò như một điểm kiểm soát hạn chế phản ứng miễn dịch với các tế bào khối u. Một số kháng thể đơn dòng hiện đã được phát triển để ngăn chặn sự liên kết của PD-L1 với PD-1, do đó điều hòa tăng phản ứng miễn dịch và cho phép các tế bào lympho T nhận biết và tiêu diệt các tế bào khối u. Các kháng thể này, được gọi là ICI, đã trở thành một trụ cột của liệu pháp điều trị NSCLC giai đoạn tiến xa, hoặc đơn độc hoặc kết hợp với hóa trị tiêu chuẩn. Đối với những bệnh nhân NSCLC giai đoạn tiến xa mà khối u của họ không có đột biến kích hoạt, các lựa chọn điều trị bao gồm liệu pháp gây độc tế bào tiêu chuẩn với việc xem xét bổ sung liệu pháp miễn dịch bằng ICI. Cuối cùng, bevacizumab, một kháng thể đơn dòng nhắm vào yếu tố tăng trưởng nội mô mạch máu (vascular endothelial growth factor – VEGF), là một tác nhân khác đã được sử dụng kết hợp với hóa trị gây độc tế bào ở một nhóm nhỏ bệnh nhân NSCLC.
Khi NSCLC không thể cắt bỏ dựa trên bất kỳ tiêu chí nào và không chứa đột biến có thể nhắm mục tiêu hoặc các lựa chọn liệu pháp miễn dịch khả thi, bác sĩ lâm sàng phải đối mặt với lựa chọn không điều trị, xạ trị hoặc hóa trị. Chiến lược cuối cùng thường bị ảnh hưởng nhiều không chỉ bởi khối u cụ thể mà còn bởi sự phán đoán của bác sĩ và sở thích của bệnh nhân. Trong một số trường hợp, các đợt xạ trị được tiến hành sớm nhằm thu nhỏ khối u và trì hoãn các biến chứng tại chỗ. Trong các trường hợp khác, việc điều trị được trì hoãn cho đến khi một biến chứng xảy ra, chẳng hạn như chảy máu hoặc tắc nghẽn đường thở. Các đợt xạ trị sau đó được thực hiện với mục tiêu giảm kích thước khối u để giảm tạm thời vấn đề cấp tính. Thật không may, điều này không chữa khỏi bệnh, và các vấn đề khác với khối u chắc chắn sẽ phát triển.
Một cái nhìn tổng quan chung về điều trị NSCLC đã được trình bày ở đây. Bởi vì các chi tiết về điều trị NSCLC rất phức tạp, liên tục phát triển và nằm ngoài phạm vi của văn bản này, người đọc được giới thiệu đến các bài đọc đề xuất chi tiết ở cuối chương.
Điều Trị Ung Thư Phổi Tế Bào Nhỏ (SCLC)
Vì SCLC đã lan rộng tại thời điểm chẩn đoán ở hầu hết tất cả các bệnh nhân, phẫu thuật không được coi là phương pháp điều trị được lựa chọn trừ khi khối u tế bào nhỏ cụ thể là một nốt ngoại vi đơn độc không có bất kỳ bằng chứng nào về sự lan rộng trung thất hoặc xa. Trong biểu hiện điển hình của SCLC là một khối trung tâm, bệnh không thể cắt bỏ gần như được đảm bảo, và hóa trị (có hoặc không có xạ trị) được coi là phương thức điều trị chính.
Đối với bệnh giai đoạn giới hạn, một phác đồ hóa trị kết hợp dựa trên platin thường được sử dụng, được bổ sung bằng xạ trị lồng ngực. Bệnh nhân đáp ứng với điều trị ban đầu này cũng sẽ thường được xạ trị sọ dự phòng. Bệnh nhân giai đoạn lan rộng được điều trị bằng một phác đồ hóa trị kết hợp, thường được bổ sung bằng liệu pháp miễn dịch với ICI. Như với bệnh giai đoạn giới hạn, các bệnh nhân được lựa chọn có đáp ứng tốt đôi khi có thể được xạ trị lồng ngực hoặc sọ dự phòng.
Đối với tất cả các bệnh nhân ung thư phổi, các nguyên tắc chăm sóc giảm nhẹ chính thức nên được tích hợp sớm như một phần trong việc quản lý của họ. Chúng bao gồm việc tập trung vào quản lý triệu chứng, sức khỏe tâm lý xã hội, và các mục tiêu chăm sóc, và có liên quan đến việc cải thiện chất lượng cuộc sống.
Tái Thông Đường Thở
Đối với cả NSCLC và SCLC, các hình thức điều trị khác đang được sử dụng để tái lập sự thông thoáng của một đường thở đã bị tắc nghẽn hoặc chèn ép một phần hoặc hoàn toàn bởi khối u. Việc điều trị thường được thực hiện bằng nội soi phế quản mềm hoặc cứng, sử dụng các kỹ thuật như laser, đông máu bằng plasma argon, liệu pháp quang động, liệu pháp lạnh, hoặc đốt điện để làm giảm kích thước của khối u trong lòng phế quản và tái lập một lòng ống hiệu quả. Ngoài ra hoặc như một phương pháp kết hợp được sử dụng thêm vào các kỹ thuật đó, một stent nội phế quản (tức là, một ống rỗng và tương đối cứng bằng nhựa hoặc kim loại) có thể được đặt trong lòng đường thở để giúp duy trì sự thông thoáng của đường thở.
U CARCINOID PHẾ QUẢN
U carcinoid phế quản, được phân loại là một loại khối u nội tiết thần kinh phế quản, chiếm khoảng 5% các khối u phổi nguyên phát. Trước đây được cho là các tổn thương lành tính, u carcinoid phế quản hiện được công nhận là một bệnh ác tính độ thấp. U carcinoid phổi được phân loại là điển hình, với tỷ lệ phân bào thấp và tăng trưởng chậm, hoặc không điển hình, với tỷ lệ phân bào trung bình và hành vi lâm sàng. Như đã lưu ý ở trên, SCLC và ung thư biểu mô nội tiết thần kinh tế bào lớn cũng là các khối u có đặc điểm nội tiết thần kinh; tuy nhiên, dựa trên phân tích di truyền phân tử và hành vi lâm sàng, u carcinoid phế quản được nhiều chuyên gia coi là thuộc một họ khối u khác. Hầu hết bệnh nhân mắc các khối u này có tiên lượng rất tốt và được chữa khỏi bằng phẫu thuật cắt bỏ.
Hai đặc điểm dịch tễ học quan trọng phân biệt u carcinoid phế quản với các khối u phổi khác được thảo luận ở đây. Thứ nhất, hút thuốc lá dường như không phải là một yếu tố nguy cơ. Thứ hai, xét theo nhóm, bệnh nhân mắc u carcinoid phế quản trẻ hơn những người mắc các bệnh ác tính phổi khác; thường xuyên, người trưởng thành trẻ tuổi bị ảnh hưởng.
U carcinoid phế quản phát sinh phổ biến nhất ở các đường thở trung tâm của cây khí-phế quản và thường được phát hiện trên phim X-quang ngực bất thường hoặc trong các đợt ho ra máu hoặc viêm phổi ở phần xa của một khối u đường thở gây tắc nghẽn. Có thể thấy sản xuất hormone lạc chỗ, liên quan đến nguồn gốc chế tiết thần kinh được cho là của các tế bào khối u. Hội chứng carcinoid, thường bao gồm các đợt đỏ bừng, tiêu chảy và khò khè do tác động của serotonin do khối u sản xuất, là không phổ biến, được tìm thấy ở dưới 5% tất cả các trường hợp u carcinoid phế quản.
Điều trị các khối u này là phẫu thuật cắt bỏ nếu có thể. Đối với nhiều bệnh nhân, tiên lượng là tuyệt vời, và bệnh tái phát hoặc di căn xa không xảy ra sau khi phẫu thuật cắt bỏ. Tuy nhiên, bệnh di căn được tìm thấy phổ biến hơn ở những bệnh nhân có khối u có mô học không điển hình, và tiên lượng xấu hơn đối với những bệnh nhân này.
|
Các đặc điểm chung của u carcinoid phế quản:
|
NỐT PHỔI ĐƠN ĐỘC
Một nốt phổi đơn độc trên phim X-quang ngực hoặc CT (được định nghĩa là một tổn thương đơn lẻ, tròn, có đường kính từ 3 cm trở xuống) là một biểu hiện phổ biến của ung thư phổi (Hình 21.5). Tuy nhiên, thực sự có một chẩn đoán phân biệt rộng rãi cho bất thường X-quang này, và chỉ khoảng 5% các nốt được xác định tình cờ là ác tính. Bác sĩ phải đối mặt với việc đánh giá khả năng một nốt là ác tính và lựa chọn con đường chẩn đoán và quản lý phù hợp. Vì ung thư phổi biểu hiện dưới dạng một nốt phổi có thể được chữa khỏi bằng phẫu thuật cắt bỏ, việc quản lý một tổn thương như vậy không nên bị bỏ qua cho đến khi tổn thương không còn có thể chữa khỏi. Mặt khác, việc bắt một bệnh nhân phải trải qua phẫu thuật mở lồng ngực, một thủ thuật phẫu thuật lớn, để cắt bỏ một tổn thương lành tính không cần điều trị cũng không mong muốn.
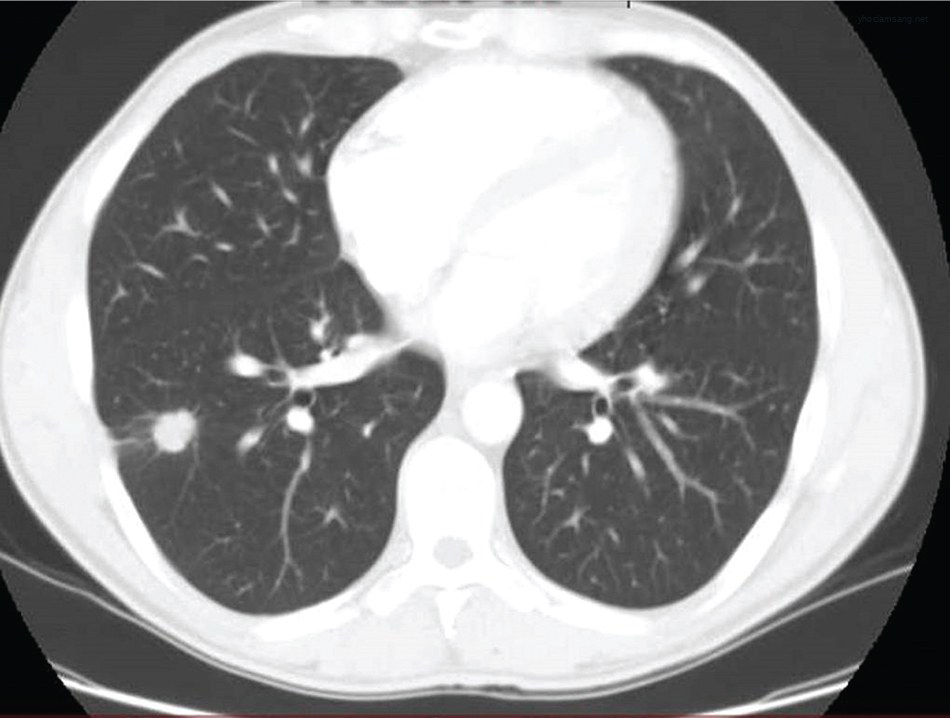
Hình 21.5 Hình ảnh CT ngực cắt ngang (axial) cho thấy một khối ung thư biểu mô tuyến thùy dưới phổi phải biểu hiện dưới dạng một nốt phổi đơn độc.*
Các khả năng chẩn đoán cho nốt phổi đơn độc được liệt kê trong Bảng 21.3. Bên cạnh ung thư phổi nguyên phát, các chẩn đoán thay thế chính là các khối u phổi lành tính, di căn đơn độc đến phổi từ một khối ung thư nguyên phát ở xa, và các bệnh nhiễm trùng (đặc biệt là các tổn thương u hạt đã lành từ bệnh lao hoặc bệnh nấm).
Bảng 21.3 Chẩn đoán phân biệt của Nốt Phổi Đơn Độc
- Kích thước. Nốt càng lớn, khả năng ác tính càng cao. Các nốt có đường kính dưới 5 mm là ác tính trong dưới 1% trường hợp, trong khi các nốt lớn hơn 20 mm đại diện cho một bệnh ác tính trong hơn 50% trường hợp.
- Sự phát triển. Có lẽ thông tin hữu ích nhất mà một bác sĩ có thể có là một phim X-quang ngực hoặc CT trước đó. So sánh các hình ảnh cũ và mới cho thấy một tổn thương có ổn định hay không và đưa ra một ước tính về tốc độ tăng trưởng. Mặc dù khó có thể nói chắc chắn một tổn thương là lành tính hay ác tính dựa trên tốc độ tăng trưởng, việc không có sự gia tăng kích thước trong ít nhất 2 năm là một dấu hiệu cực kỳ tốt (nhưng không phải là không thể sai lầm) rằng một tổn thương là lành tính.
- Độ suy giảm (Attenuation). Các nốt được phân loại là đặc hoặc bán đặc, và một số tổn thương là hỗn hợp đặc và bán đặc (còn gọi là bán đặc một phần). Một nốt bán đặc một phần có nguy cơ ác tính cao hơn.
- Sự vôi hóa. Sự hiện diện của vôi hóa trong một nốt phổi, được thể hiện rõ nhất trên phim CT, có thể ủng hộ chẩn đoán một tổn thương lành tính, đặc biệt là u hạt hoặc hamartoma. Nếu tìm thấy các kiểu vôi hóa nhất định—vôi hóa lấm tấm lan tỏa, vôi hóa đậm đặc, vôi hóa dạng lớp (vỏ hành), hoặc vôi hóa “bắp rang”—thì tổn thương gần như chắc chắn là lành tính. Mặt khác, vôi hóa ở ngoại vi của một tổn thương hoặc vôi hóa vô định hình trong tổn thương có thể gợi ý bệnh ác tính. Ví dụ, một vùng vôi hóa ngoại vi hoàn toàn phù hợp với một khối ung thư sẹo phát sinh trong vùng của một vết sẹo nhu mô cũ đã vôi hóa (ví dụ: một u hạt cũ đã vôi hóa).
- Bờ. Bờ không đều hoặc có gai (spiculated) gợi ý một tổn thương ác tính, trong khi một tổn thương lành tính thường có bờ nhẵn và rõ ràng.
- Vị trí. Một nốt ở các thùy trên có khả năng ác tính cao hơn các nốt ở các thùy dưới.
|
Các tiêu chí để đánh giá khả năng một nốt phổi đơn độc là ác tính như sau:
|
Các đặc điểm lâm sàng bổ sung gợi ý một tổn thương lành tính so với ác tính nhưng ít đáng tin cậy hơn. Ở những người dưới 35 tuổi, ung thư phổi nguyên phát là một chẩn đoán không thể xảy ra nhưng chắc chắn không phải là không thể. Tiền sử hút thuốc lá nhiều và/hoặc tiếp xúc với amiăng cho thấy nguy cơ cao đối với một tổn thương ác tính; tuy nhiên, việc không có tiền sử hút thuốc lá không loại trừ chẩn đoán ung thư phổi, đặc biệt là ung thư biểu mô tuyến ngoại vi. Cuối cùng, sự hiện diện của một khối ung thư xa đã được chẩn đoán trước đó rõ ràng đặt ra khả năng một nốt phổi là một ổ di căn của khối u.
Câu hỏi thực tế về cách đánh giá và quản lý các trường hợp này thường khó khăn, và quá trình ra quyết định phải được cá nhân hóa cho mỗi bệnh nhân. Một số công cụ tính toán trực tuyến có sẵn để ước tính khả năng ác tính dựa trên các đặc điểm của bệnh nhân và nốt. Ước tính này có thể hữu ích cho cả bác sĩ và bệnh nhân khi thảo luận và quyết định mức độ tích cực theo đuổi việc đánh giá chẩn đoán. Dựa trên khả năng ác tính ước tính, các lựa chọn quản lý bao gồm không cần thăm dò thêm, theo dõi bằng các lần chụp CT nối tiếp để tìm kiếm sự phát triển của tổn thương, lấy mẫu ngay lập tức thông qua thủ thuật sinh thiết, hoặc thậm chí là phẫu thuật cắt bỏ nốt.
Một xét nghiệm không xâm lấn đơn giản như xét nghiệm tế bào học đờm là hữu ích nếu kết quả dương tính; tuy nhiên, tỷ lệ thành công thấp, ngay cả với các nốt ngoại vi mà cuối cùng được chứng minh là ung thư. Trừ khi tổn thương đã ổn định trên phim X-quang ngực trong hơn 2 năm, chụp CT ngực được thực hiện thường quy để xem xét các đặc điểm của bờ, đánh giá sự hiện diện và kiểu vôi hóa, và xác định các bất thường khác, đặc biệt là các hạch bạch huyết trong trung thất. Nếu một nốt lớn hơn 1 cm, chụp PET-FDG (xem Chương 3), nếu có, là hữu ích khi chẩn đoán không chắc chắn sau khi đánh giá thông tin lâm sàng và các nghiên cứu hình ảnh khác. Sự hấp thu FDG được đánh dấu cho thấy tổn thương có hoạt động chuyển hóa cao và có thể là ác tính, trong khi việc thiếu hấp thu cho thấy một tổn thương lành tính, không hoạt động về mặt chuyển hóa.
Các thủ thuật xâm lấn hơn, chẳng hạn như chọc hút hoặc sinh thiết bằng kim qua da và sinh thiết xuyên phế quản (thông qua ống nội soi phế quản mềm), có thể được sử dụng để đưa ra chẩn đoán mô học. Tuy nhiên, trong nhiều trường hợp, kết quả sinh thiết âm tính với bệnh ác tính không loại bỏ sự cần thiết của phẫu thuật vì các tế bào ác tính có thể bị bỏ sót do việc lấy mẫu hạn chế của một cây kim hoặc kìm sinh thiết. Do đó, một phương pháp thường được sử dụng với một tổn thương nghi ngờ ung thư là tiến hành trực tiếp đến việc cắt bỏ bằng phẫu thuật lồng ngực có hỗ trợ video (video-assisted thoracic surgery – VATS) sử dụng ống soi lồng ngực, giả sử không có chống chỉ định phẫu thuật và không có bằng chứng lâm sàng cho thấy tổn thương đã lan rộng ra nơi khác hoặc đã di căn từ một khối u nguyên phát ở xa. Một cuộc phẫu thuật cắt bỏ triệt để hơn, chẳng hạn như cắt thùy phổi được thực hiện bằng phẫu thuật mở lồng ngực, sau đó được thực hiện nếu nốt được phát hiện là ác tính.
Khi ung thư phổi biểu hiện dưới dạng một nốt ngoại vi đơn độc, tiên lượng tốt hơn nhiều so với nhóm bệnh nhân ung thư phổi nói chung. Do phẫu thuật cắt bỏ thường có thể chữa khỏi, hơn 50% bệnh nhân có ung thư phổi ngoại vi đơn độc ban đầu sống sót sau 5 năm, so với dưới 10% bệnh nhân ung thư phổi nếu bệnh đã di căn ra ngoài lồng ngực.
TÀI LIỆU THAM KHẢO ĐỀ XUẤT
Ung thư phổi: Tổng quan chung và các khía cạnh lâm sàng
Anwar, A., Jafri, F., Ashraf, S., Jafri, M. A. S., & Fanucchi, M. (2019). Paraneoplastic syndromes in lung cancer and their management. Annals of Translational Medicine, 7, 359.
Byers, L. A., & Rudin, C. M. (2015). Small cell lung cancer: Where do we go from here? Cancer, 121, 664–672.
Thai, A. A., Solomon, B. J., Sequist, L. V., Gainor, J. F., & Heist, R. S. (2021). Lung cancer. Lancet, 398, 535–554.
Vachani, A., Sequist, L. V., & Spira, A. (2017). The shifting landscape for lung cancer: Past, present, and future. American Journal of Respiratory and Critical Care Medicine, 195, 1150–1160.
Ung thư phổi: Phương pháp chẩn đoán
Bashir, U., Siddique, M. M., Mclean, E., Goh, V., & Cook, G. J. (2016). Imaging heterogeneity in lung cancer: Techniques, applications, and challenges. American Journal of Roentgenology, 207, 534–543.
Cagle, P. T., Allen, T. C., Bernicker, E. H., Ge, Y., Haque, A., & Barrios, R. (2016). Impact of recent developments in lung cancer on the practice of pathology. Archives of Pathology and Laboratory Medicine, 140, 322–325.
Counts, S. J., & Kim, A. W. (2017). Diagnostic imaging and newer modalities for thoracic diseases: PET/computed tomographic imaging and endobronchial ultrasound for staging and its implication for lung cancer. Surgical Clinics of North America, 97, 733–750.
de Koning, H. J., van der Aalst, C. M., de Jong, P. A., Scholten, E. T., Nackaerts, K., Heuvelmans, M. A., et al. (2020). Reduced lung-cancer mortality with volume CT screening in a randomized trial. New England Journal of Medicine, 382, 503–513.
Farjah, F., & Tanner, N. T. (2021). Mediastinal staging for lung cancer. Chest, 160, 1552–1559.
Ho, C. C., Lin, C. K., Yang, C. Y., Chang, L. Y., Lin, S. Y., & Yu, C. J. (2016). Current advances of endobronchial ultrasonography in the diagnosis and staging of lung cancer. Journal of Thoracic Disease, 8(Suppl. 9), S690–S696.
Kauczor, H. U., Baird, A. M., Blum, T. G., Bonomo, L., Bostantzoglou, C., Burghuber, O., et al. (2020). ESR/ERS statement paper on lung cancer screening. European Respiratory Journal, 55, 1900506.
Mazzone, P. J., Silvestri, G. A., Souter, L. H., Caverly, T. J., Kanne, J. P., Katki, H. A., et al. (2021). Screening for lung cancer. CHEST guideline and expert panel report. Chest, 160, e427–e494.
Murgu, S. D. (2015). Diagnosing and staging lung cancer involving the mediastinum. Chest, 147, 1401–1412.
Rami-Porta, R., Asamura, H., Travis, W. D., & Rusch, V. W. (2017). Lung cancer – Major changes in the American Joint Committee on Cancer eighth edition cancer staging manual. CA Cancer Journal for Clinicians, 67, 138–155.
Rami-Porta, R., Call, S., Dooms, C., Obiols, C., Sánchez, M., Travis, W. D., et al. (2018). Lung cancer staging: A concise update. European Respiratory Journal, 51, 1800190.
Rooney, C., & Sethi, T. (2015). Advances in molecular biology of lung disease: Aiming for precision therapy in nonsmall cell lung cancer. Chest, 148, 1063–1072.
Sheikhbahaei, S., Mena, E., Yanamadala, A., Reddy, S., Solnes, L. B., Wachsmann, J., et al. (2017). The value of FDG PET/CT in treatment response assessment, follow-up, and surveillance of lung cancer. AJR American Journal of Roentgenology, 208, 420–433.
Tanoue, L. T. (2020). Lung cancer staging. Clinics in Chest Medicine, 41, 161–174.
Tanoue, L. T., Tanner, N. T., Gould, M. K., & Silvestri, G. A. (2015). Lung cancer screening. American Journal of Respiratory and Critical Care Medicine, 191, 19–33.
Zukotynski, K. A., & Gerbaudo, V. H. (2017). Molecular imaging and precision medicine in lung cancer. PET Clinics, 12, 53–62.
Ung thư phổi: Điều trị
Barnes, H., See, K., Barnett, S., & Manser, R. (2017). Surgery for limited-stage small-cell lung cancer. Cochrane Database of Systematic Reviews, 4, CD011917.
Brunelli, A. (2016). Preoperative functional workup for patients with advanced lung cancer. Journal of Thoracic Disease, 8(Suppl. 11), S840–S848.
Chaft, J. E., Rimner, A., Weder, W., Azzoli, C. G., Kris, M. G., & Cascone, T. (2021). Evolution of systemic therapy for stages I-III non-metastatic non-small-cell lung cancer. Nature Reviews Clinical Oncology, 18, 547–557.
Chee, J., Robinson, B. W. S., Holt, R. A., & Creaney, J. (2017). Immunotherapy for lung malignancies. From gene sequencing to novel therapies. Chest, 151, 891–897.
Ernst, A., Feller-Kopman, D., Becker, H. D., & Mehta, A. C. (2004). Central airway obstruction. American Journal of Respiratory and Critical Care Medicine, 169, 1278–1297.
Hiddinga, B. I., Raskin, J., Janssens, A., Pauwels, P., & Van Meerbeeck, J. P. (2021). Recent developments in the treatment of small cell lung cancer. European Respiratory Review, 30, 210079.
Hiley, C. T., Le Quesne, J., Santis, G., Sharpe, R., de Castro, D. G., Middleton, G., et al. (2016). Challenges in molecular testing in non-small-cell lung cancer patients with advanced disease. Lancet, 388, 1002–1011.
Hirsch, F. R., Suda, K., Wiens, J., & Bunn, P. A., Jr. (2016). New and emerging targeted treatments in advanced non-small-cell lung cancer. Lancet, 388, 1012–1024.
Howlader, N., Forjaz, G., Mooradian, M. J., Meza, R., Kong, C. Y., Cronin, K. A., et al. (2020). The effect of advances in lung-cancer treatment on population mortality. New England Journal of Medicine, 383, 640–649.
Lievense, L. A., Sterman, D. H., Cornelissen, R., & Aerts, J. G. (2017). Checkpoint blockade in lung cancer and mesothelioma. American Journal of Respiratory and Critical Care Medicine, 196, 274–282.
Luo, H., Yu, X., Liang, N., Xie, J., Deng, G., Liu, Q., et al. (2017). The effect of induction chemotherapy in patients with locally advanced nonsmall cell lung cancer who received chemoradiotherapy: A systematic review and meta-analysis. Medicine (Baltimore), 96, e6165.
McDonald, F., De Waele, M., Hendriks, L. E. L., Faivre-Finn, C., Dingemans, A. C., & Van Schil, P. E. (2017). Management of stage I and II nonsmall cell lung cancer. European Respiratory Journal, 49, 1600764.
Moon, E. K., Langer, C. J., & Albelda, S. M. (2017). The era of checkpoint blockade in lung cancer: Taking the brakes off the immune system. Annals of the American Thoracic Society, 14, 1248–1260.
Ramalingam, S. S., Vansteenkiste, J., Planchard, D., Cho, B. C., Gray, J. E., Ohe, Y., et al. (2020). Overall survival with osimertinib in untreated, EGFR-mutated advanced NSCLC. New England Journal of Medicine, 382, 41–50.
Reck, M., & Rabe, K. F. (2017). Precision diagnosis and treatment for advanced non-small-cell lung cancer. New England Journal of Medicine, 377, 849–861.
Steuer, C. E., Khuri, F. R., & Ramalingam, S. S. (2015). The next generation of epidermal growth factor receptor tyrosine kinase inhibitors in the treatment of lung cancer. Cancer, 121, E1–E6.
Suresh, K., Naidoo, J., Lin, C. T., & Danoff, S. (2018). Immune checkpoint immunotherapy for non-small cell lung cancer. Benefits and pulmonary toxicities. Chest, 154, 1416–1423.
Swanton, C., & Govindan, R. (2016). Clinical implications of genomic discoveries in lung cancer. New England Journal of Medicine, 374, 1864–1873.
Wang, C., Yu, X., & Wang, W. (2016). A meta-analysis of efficacy and safety of antibodies targeting PD-1/PD-L1 in treatment of advanced nonsmall cell lung cancer. Medicine (Baltimore), 95, e5539.
Wang, M., Herbst, R. S., & Boshoff, C. (2021). Toward personalized treatment approaches for non-small-cell lung cancer. Nature Medicine, 27, 1345–1356.
Zhou, G. W., Xiong, Y., Chen, S., Xia, F., Li, Q., & Hu, J. (2016). Anti-PD-1/PD-L1 antibody therapy for pretreated advanced nonsmall-cell lung cancer: A meta-analysis of randomized clinical trials. Medicine (Baltimore), 95, e4611.
Carcinoid phế quản
Caplin, M. E., Baudin, E., Ferolla, P., Filosso, P., Garcia-Yuste, M., Lim, E., et al. (2015). Pulmonary neuroendocrine (carcinoid) tumors: European Neuroendocrine Tumor Society expert consensus and recommendations for best practice for typical and atypical pulmonary carcinoids. Annals of Oncology, 26, 1604–1620.
Travis, W. D. (2014). Pathology and diagnosis of neuroendocrine tumors: Lung neuroendocrine. Thoracic Surgery Clinics, 24, 257–266.
Wolin, E. M. (2017). Advances in the diagnosis and management of well-differentiated and intermediate-differentiated neuroendocrine tumors of the lung. Chest, 151, 1141–1146.
Nốt đơn độc phổi
Anderson, I. J., & Davis, A. M. (2018). Incidental pulmonary nodules detected on CT images. JAMA, 320, 2260–2261.
Callister, M. E., & Baldwin, D. R. (2016). How should pulmonary nodules be optimally investigated and managed? Lung Cancer, 91, 48–55.
Choi, H. K., Ghobrial, M., & Mazzone, P. J. (2018). Models to estimate the probability of malignancy in patients with pulmonary nodules. Annals of the American Thoracic Society, 15, 1117–1126.
MacMahon, H., Naidich, D. P., Goo, J. M., Lee, K. S., Leung, A. N. C., Mayo, J. R., et al. (2017). Guidelines for management of incidental pulmonary nodules detected on CT images: From the Fleischner Society 2017. Radiology, 284, 228–243.
Mazzone, P. J., & Lam, L. (2022). Evaluating the patient with a pulmonary nodule. A review. JAMA, 327, 264–273.
Patel, V. K., Naik, S. K., Naidich, D. P., Travis, W. D., Weingarten, J. A., Lazzaro, R., et al. (2013). A practical algorithmic approach to the diagnosis and management of solitary pulmonary nodules. Part 1: Radiologic characteristics and imaging modalities. Chest, 143, 825–839.
Patel, V. K., Naik, S. K., Naidich, D. P., Travis, W. D., Weingarten, J. A., Lazzaro, R., et al. (2013). A practical algorithmic approach to the diagnosis and management of solitary pulmonary nodules. Part 2: Pretest probability and algorithm. Chest, 143, 840–846.
BẢNG CHÚ GIẢI THUẬT NGỮ Y HỌC ANH VIỆT
Chương 21. Ung thư phổi: Các khía cạnh lâm sàng
