Sách dịch: CÁC NGUYÊN LÝ Y HỌC HÔ HẤP, ẤN BẢN THỨ 8
Dịch và chú giải Tiếng Việt: Ts.Bs. Lê Nhật Huy, Ths.Bs. Lê Đình Sáng
CHƯƠNG 6. BỆNH PHỔI TẮC NGHẼN MẠN TÍNH
Chronic obstructive pulmonary disease
Steven E. Weinberger MD, MACP, FRCP, Barbara A. Cockrill MD and Jess Mandel MD, MACP, FRCP
Principles of Pulmonary Medicine, 6, 88-106
MỤC LỤC CHƯƠNG
|
Nguyên nhân và Cơ chế bệnh sinh Hút thuốc lá Ô nhiễm môi trường và trong nhà Nhiễm trùng Yếu tố di truyền Bệnh học Sinh lý bệnh Bất thường chức năng trong bệnh lý đường thở Bất thường chức năng trong khí phế thũng Cơ chế trao đổi khí bất thường Tăng áp động mạch phổi Các kiểu hình BPTNMT Đặc điểm lâm sàng Tiếp cận chẩn đoán và đánh giá Điều trị |
Thuật ngữ bệnh phổi tắc nghẽn mạn tính (BPTNMT) dùng để chỉ các rối loạn mạn tính gây cản trở luồng khí, dù cho quá trình nổi bật nhất là ở trong đường thở hay trong nhu mô phổi. Hai rối loạn phổ biến nhất trong nhóm này là viêm phế quản mạn tính và khí phế thũng. Mặc dù sinh lý bệnh của tắc nghẽn luồng khí có phần khác nhau ở hai rối loạn này, bệnh nhân thường có các đặc điểm của cả hai, vì vậy việc thảo luận chúng cùng nhau là hợp lý. Về mặt logic, hen phế quản cũng có thể thuộc nhóm này, nhưng nó được thảo luận trong Chương 5 vì thuật ngữ BPTNMT, theo cách sử dụng thông thường, không bao gồm hen phế quản. Quan trọng là, mặc dù bệnh nhân hen thường phục hồi chức năng phổi bình thường giữa các đợt kịch phát, bệnh nhân BPTNMT có bệnh phổi tắc nghẽn “mạn tính”, nghĩa là chức năng phổi của họ luôn bất thường. Các thuật ngữ khác đồng nghĩa với BPTNMT là giới hạn luồng khí mạn tính, tắc nghẽn luồng khí mạn tính, bệnh đường thở tắc nghẽn mạn tính, và bệnh phổi tắc nghẽn mạn tính. Vì BPTNMT là thuật ngữ được sử dụng phổ biến nhất, nó cũng được sử dụng ở đây. Khí phế thũng được thảo luận trong phần này của sách giáo khoa về bệnh lý đường thở, mặc dù các biểu hiện bệnh học rõ ràng và dễ thấy nhất của khí phế thũng ảnh hưởng đến nhu mô phổi thông qua sự phá hủy phế nang.
Viêm phế quản mạn tính là một chẩn đoán lâm sàng được sử dụng cho những bệnh nhân bị ho và khạc đờm mạn tính. Tình trạng này có những đặc điểm bệnh học nhất định, nhưng chẩn đoán này đề cập đến biểu hiện lâm sàng cụ thể. Về mặt dịch tễ học, định nghĩa chính thức là sự hiện diện của ho có đờm mạn tính vào hầu hết các ngày trong ít nhất 3 tháng mỗi năm trong 2 năm liên tiếp trở lên. Tuy nhiên, vì mục đích lâm sàng, bác sĩ không nhất thiết phải tuân thủ yêu cầu thời gian chính thức này. Bệnh nhân viêm phế quản mạn tính thường có các giai đoạn bệnh nặng hơn hoặc các đợt kịch phát, thường do nhiễm trùng đường hô hấp gây ra. Tuy nhiên, không giống như bệnh nhân hen, bệnh nhân viêm phế quản mạn tính đơn thuần vẫn có bệnh lý lâm sàng tồn dư ngay cả giữa các đợt kịch phát, và bệnh của họ không chủ yếu là do tăng phản ứng đường thở. Chẩn đoán viêm phế quản thể hen thường được đưa ra cho những bệnh nhân bị viêm phế quản mạn tính và có thành phần tăng phản ứng đường thở nổi bật, bởi vì có cả các đặc điểm của viêm phế quản mạn tính và hen. Gần đây, thuật ngữ hội chứng chồng lấp hen-BPTNMT đã bắt đầu được áp dụng cho những bệnh nhân này, những người có các đặc điểm của cả hen và BPTNMT.
Viêm phế quản mạn tính là một chẩn đoán được thực hiện dựa trên ho và khạc đờm mạn tính.
Trái ngược với chẩn đoán lâm sàng của viêm phế quản mạn tính, khí phế thũng về mặt chính thức là một chẩn đoán bệnh học, mặc dù một số đặc điểm lâm sàng, X-quang và xét nghiệm nhất định cũng rất gợi ý bệnh. Về mặt bệnh học, khí phế thũng được đặc trưng bởi sự phá hủy các thành phế nang và các vùng lớn hơn của nhu mô phổi, và sự giãn rộng của các khoang khí ở phần xa của tiểu phế quản tận. Vùng phổi từ các tiểu phế quản hô hấp xuống đến các phế nang đều bị ảnh hưởng, và việc xác định loại khí phế thũng cụ thể phụ thuộc vào kiểu phá hủy trong tiểu thùy phổi. Chẩn đoán khí phế thũng trước khi tử vong rõ ràng không có loại xác nhận như khi khám nghiệm tử thi phổi, và chẩn đoán này dựa trên bằng chứng lâm sàng và X-quang.
Khí phế thũng là một chẩn đoán được thực hiện dựa trên sự phá hủy nhu mô phổi và sự giãn rộng của các khoang khí ở phần xa của tiểu phế quản tận.
Vì viêm phế quản mạn tính và khí phế thũng cùng tồn tại ở các mức độ khác nhau ở các bệnh nhân khác nhau, thuật ngữ rộng hơn BPTNMT thường chính xác hơn. Việc hai rối loạn này có mối liên hệ chặt chẽ với nhau không có gì đáng ngạc nhiên. Một yếu tố nguyên nhân duy nhất – hút thuốc lá – là nguyên nhân chính cho cả hai quá trình. Viêm do khói thuốc lá gây ra, từ các đường thở lớn xuống đến các thành phế nang của nhu mô phổi, được cho là sợi dây chung liên kết nhiều biểu hiện đa dạng của BPTNMT. Trong suốt chương này, có những tham chiếu cụ thể đến viêm phế quản mạn tính hoặc khí phế thũng vì một số đặc điểm lâm sàng và sinh lý bệnh đủ khác biệt để cần được xem xét riêng. Tuy nhiên, bệnh nhân thường không hoàn toàn phù hợp với các loại chẩn đoán riêng biệt này.
Các vấn đề sức khỏe cộng đồng do BPTNMT gây ra là rất lớn. Trên toàn cầu, Tổ chức Y tế Thế giới ước tính có khoảng 65 triệu người mắc BPTNMT mức độ trung bình hoặc nặng, gây ra khoảng 3 triệu ca tử vong mỗi năm. Chỉ riêng tại Hoa Kỳ, khoảng 15 triệu người được chẩn đoán mắc BPTNMT, và đây là nguyên nhân gây tử vong phổ biến thứ ba. Tỷ lệ mắc bệnh về các triệu chứng mạn tính, số ngày nghỉ làm và tàn tật vĩnh viễn thậm chí còn đáng kinh ngạc hơn. Không giống như nhiều bệnh mà bác sĩ gặp phải, BPTNMT có thể phòng ngừa được trong phần lớn các trường hợp, bởi vì yếu tố nguyên nhân chính đã được xác định rõ và hoàn toàn có thể tránh được. May mắn thay, kể từ năm 1964, khi báo cáo đầu tiên của Tổng Y sĩ về hút thuốc và sức khỏe được công bố, tỷ lệ hút thuốc ở người trưởng thành Mỹ đã giảm từ 40% xuống còn khoảng 14%. Tuy nhiên, vẫn còn hơn 36 triệu người hiện đang hút thuốc và một số lượng lớn người đã từng hút thuốc, những người này đã đặt mình vào nguy cơ cao mắc BPTNMT và các bệnh liên quan đến hút thuốc khác. Điều quan trọng cần lưu ý là đại đa số người hút thuốc bắt đầu hút thuốc ở tuổi thiếu niên và đầu những năm 20; các chương trình phòng chống hút thuốc có hiệu quả nhất khi nhắm vào nhóm tuổi này. Trên toàn thế giới, tỷ lệ hút thuốc ngày càng tăng ở các nước đang phát triển đã khiến BPTNMT trở thành nguyên nhân gây tử vong phổ biến thứ ba trên toàn thế giới kể từ năm 2019.
NGUYÊN NHÂN VÀ CƠ CHẾ BỆNH SINH
Các yếu tố đã được cho là gây ra hoặc góp phần vào nguy cơ mắc BPTNMT bao gồm hút thuốc lá, bao gồm cả hút thuốc lá thụ động, ô nhiễm môi trường và không khí trong nhà, nhiễm trùng và di truyền. Trong bốn yếu tố này, hút thuốc lá rõ ràng là quan trọng nhất, và là yếu tố sẽ được chú ý nhiều nhất ở đây. Tuy nhiên, thực tế là BPTNMT có triệu chứng chỉ phát triển ở khoảng 20% người hút thuốc cho thấy các yếu tố khác điều chỉnh nguy cơ của một cá nhân. Một yếu tố nguy cơ di truyền được xác định rõ cho BPTNMT, sự thiếu hụt di truyền của protein -antitrypsin, được thảo luận chi tiết trong phần này, nhưng có khả năng các yếu tố đa gen khác chưa được xác định cũng ảnh hưởng đến nguy cơ.
Hút thuốc lá là yếu tố nguyên nhân chính của viêm phế quản mạn tính. Các chất ô nhiễm môi trường và trong nhà cùng yếu tố di truyền là những yếu tố bổ sung tiềm tàng ở những cá nhân bị phơi nhiễm. Nhiễm trùng đường hô hấp là một nguyên nhân quan trọng gây ra các đợt kịch phát của bệnh.
Hút thuốc lá
Hút thuốc lá ảnh hưởng đến phổi ở nhiều cấp độ: phế quản, tiểu phế quản và nhu mô phổi. Ở các đường thở lớn hơn – các phế quản – hút thuốc lá có tác động nổi bật đến cấu trúc và chức năng của bộ máy tiết chất nhầy, các tuyến nhầy phế quản. Sự tăng số lượng và kích thước của các tuyến này là nguyên nhân gây ra tình trạng chất nhầy quá mức trong lòng đường thở. Thành đường thở trở nên dày lên do các tuyến nhầy phì đại và tăng sản cũng như sự xâm nhập của các tế bào viêm (đặc biệt là đại thực bào, bạch cầu trung tính và tế bào lympho T gây độc tế bào ) vào thành đường thở. Sự dày lên của thành làm giảm kích thước lòng đường thở, và chất nhầy trong lòng càng làm ảnh hưởng thêm đến diện tích mặt cắt ngang của nó. Việc giải phóng nhiều loại chất trung gian từ các tế bào viêm, bao gồm leukotriene , interleukin-8 và yếu tố hoại tử khối u-, góp phần gây tổn thương mô và khuếch đại quá trình viêm ở cả đường thở và nhu mô phổi. Tương tự, stress oxy hóa do các loại oxy phản ứng có trong khói thuốc lá hoặc được giải phóng từ các tế bào viêm góp phần vào quá trình bệnh lý tổng thể.
Đồng thời với việc sản xuất nhiều chất nhầy hơn ở các đường thở lớn, việc thanh thải chất nhầy bị thay đổi do tác động của khói thuốc lá lên các lông mao lót trong lòng phế quản. Các thay đổi cấu trúc ở lông mao sau khi tiếp xúc lâu dài với khói thuốc lá đã được ghi nhận rõ ràng, và các nghiên cứu chức năng đã chứng minh sự suy giảm khả năng thanh thải nhầy-lông mao là hậu quả của việc hút thuốc lá.
Các tác động kết hợp của hút thuốc lá lên sản xuất chất nhầy, thanh thải nhầy-lông mao và viêm đường thở dễ dàng giải thích cho dữ liệu dịch tễ học chứng minh mối tương quan đáng kể giữa hút thuốc lá và các triệu chứng của viêm phế quản mạn tính: ho và khạc đờm. Hút tẩu và xì gà cũng là những yếu tố nguy cơ trong sự phát triển của viêm phế quản mạn tính, nhưng nguy cơ thấp hơn đáng kể so với hút thuốc lá, có lẽ vì khói tẩu và xì gà thường không được hít vào sâu.
Các đường thở nhỏ (tiểu phế quản có đường kính dưới 2 mm) bị ảnh hưởng rõ rệt bởi hút thuốc lá. Hút thuốc lá gây hẹp, viêm và xơ hóa tiểu phế quản, dẫn đến tắc nghẽn luồng khí. Những thay đổi này ở các đường thở nhỏ hoặc tiểu phế quản là nguyên nhân gây ra một thành phần quan trọng của tắc nghẽn luồng khí trong BPTNMT và có khả năng là yếu tố chính ở những bệnh nhân BPTNMT nhẹ (sẽ được thảo luận sau trong phần Sinh lý bệnh).
Trong nhu mô phổi, hút thuốc lá dẫn đến sự phát triển cuối cùng của khí phế thũng. Để hiểu được các khái niệm về cách hút thuốc lá dẫn đến sự phá hủy các thành phế nang, đặc trưng của khí phế thũng, cần phải quen thuộc với giả thuyết protease-antiprotease. Theo giả thuyết này, khí phế thũng là kết quả của sự phá hủy chất nền mô liên kết của thành phế nang bởi các enzyme phân giải protein (protease) do các tế bào viêm trong phế nang giải phóng ra. Các nghiên cứu trên động vật đã chứng minh rằng việc tiêm một số enzyme phân giải protein (tức là có khả năng phá vỡ protein) vào đường thở của động vật sẽ dẫn đến những thay đổi bệnh lý và sinh lý tương tự như của khí phế thũng trên lâm sàng.
Hút thuốc lá là nguyên nhân của hầu hết các trường hợp khí phế thũng. Thiếu hụt -antitrypsin trong huyết thanh là một yếu tố nguy cơ cho khí phế thũng trong một tỷ lệ nhỏ các trường hợp.
Các enzyme phân giải protein đặc biệt được cho là góp phần gây ra khí phế thũng là những enzyme có khả năng phá vỡ elastin, một protein cấu trúc phức tạp được tìm thấy trong thành của các phế nang. Elastase, một trong một số enzyme trong nhóm serine protease, dường như là enzyme phân giải protein quan trọng nhất. Bạch cầu trung tính là nguồn chính của elastase trong phổi; do đó, enzyme này thường được gọi là elastase của bạch cầu trung tính. Nếu elastase được phép phát huy tác dụng phân giải protein của nó lên elastin mỗi khi nó được giải phóng từ một bạch cầu trung tính, sự phá hủy protein cấu trúc quan trọng này của thành phế nang sẽ xảy ra. May mắn thay, một chất ức chế elastase của bạch cầu trung tính, thường được gọi là -antitrypsin, nhưng đôi khi cũng được gọi là -antiprotease hoặc chất ức chế -protease, thường được sản xuất ở gan, giải phóng vào máu và có mặt trong phổi. Người ta tin rằng sự cân bằng giữa elastase của bạch cầu trung tính và chất ức chế của nó ngăn chặn sự phá hủy lan tỏa của các thành phế nang. Khi sự cân bằng này bị xáo trộn, hoặc do tăng hoạt động của elastase của bạch cầu trung tính hoặc do giảm hoạt động của antielastase, tổn thương elastin và thành phế nang có thể xảy ra, dẫn đến sự hình thành cuối cùng của khí phế thũng.
Các giả thuyết cho rằng các enzyme phân giải protein (đặc biệt là elastase) được cân bằng bởi -antitrypsin. Nếu hút thuốc hoặc thiếu hụt -antitrypsin làm xáo trộn sự cân bằng này theo hướng có lợi cho các enzyme phân giải protein, khí phế thũng có thể xảy ra.
Tổn thương do khói thuốc lá gây ra được cho là được trung gian, một phần, bởi việc làm xáo trộn sự cân bằng giữa elastase và antielastase. Một số lượng lớn bạch cầu trung tính có thể được tìm thấy trong phổi của người hút thuốc, cung cấp một nguồn cho lượng elastase của bạch cầu trung tính tăng lên, do đó, làm thay đổi sự cân bằng theo hướng phá hủy elastin do proteolytic nhiều hơn. Ngoài ra, stress oxy hóa liên quan đến các chất oxy hóa có nguồn gốc từ khói thuốc lá và các tế bào viêm được cho là gây hại cho biểu mô đường thở cũng như các thành phần cấu trúc quan trọng của phổi, bao gồm elastin và collagen. Chuỗi bệnh sinh được giả thuyết cho sự phát triển của BPTNMT, bao gồm cả khí phế thũng, được tóm tắt trong Hình 6.1.
Ngoài việc phân hủy elastin trong thành phế nang, elastase của bạch cầu trung tính, khi được giải phóng trong đường thở, sẽ kích thích sự tiết chất nhầy. Sự bảo vệ chính chống lại tác động của elastase của bạch cầu trung tính trong đường thở được cung cấp bởi chất ức chế leukoprotease tiết ra, một antiprotease được sản xuất bởi các tế bào biểu mô đường thở và các tế bào tiết nhầy.
Elastase không phải là enzyme phân giải protein duy nhất có liên quan đến sự phát triển của tổn thương liên quan đến hút thuốc và khí phế thũng. Mối quan tâm bổ sung đã tập trung vào một nhóm enzyme được gọi là metalloproteinase nền (matrix metalloproteinases), được sản xuất bởi đại thực bào và bạch cầu trung tính và có khả năng phá vỡ nhiều thành phần cấu trúc của thành phế nang. Tương tự như mối quan hệ giữa elastase và chất ức chế của nó là -antitrypsin, metalloproteinase nền có một số chất ức chế tự nhiên, được gọi một cách thích hợp là các chất ức chế mô của metalloproteinase nền (TIMP). Do sự xâm nhập của bạch cầu trung tính và đại thực bào do khói thuốc lá gây ra, người ta tin rằng gánh nặng metalloproteinase nền tăng lên có thể là kết quả của việc hút thuốc, có khả năng lấn át khả năng của các TIMP và góp phần vào sự phá vỡ các thành phế nang.
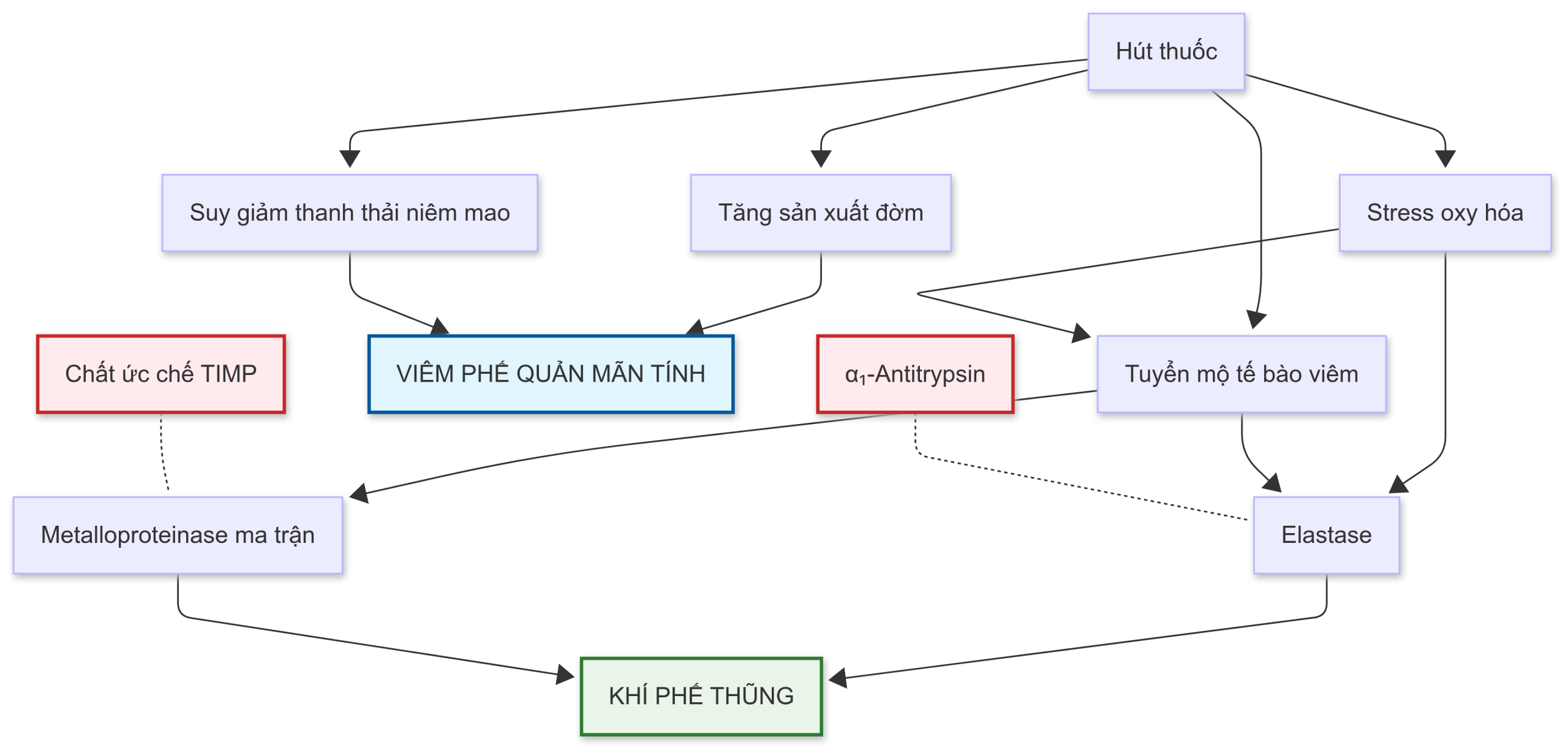
Hình 6.1. Sơ đồ tác động của hút thuốc lá lên tình trạng viêm đường thở và các thành phần cấu trúc của thành phế nang, trong đó tác động lên thành phế nang là do làm thay đổi mối quan hệ giữa elastase và -antitrypsin (còn gọi là chất ức chế -protease).
Ô nhiễm môi trường và trong nhà
Các yếu tố khác liên quan đến cơ chế bệnh sinh của BPTNMT (ô nhiễm môi trường, nhiễm trùng và di truyền) về mặt số lượng ít quan trọng hơn nhiều so với hút thuốc lá. Ô nhiễm không khí quan trọng chủ yếu vì khả năng gây ra các đợt kịch phát của bệnh đã có từ trước, chứ không phải là nguyên nhân khởi phát BPTNMT. Tuy nhiên, phơi nhiễm nghề nghiệp với các chất ô nhiễm hoặc kháng nguyên hữu cơ (ví dụ, ở công nhân mỏ hoặc công nhân nông nghiệp, tương ứng) dường như là một yếu tố quan trọng góp phần vào BPTNMT, đặc biệt là viêm phế quản mạn tính. Ngoài ra, ở những nơi trên thế giới sử dụng nhiên liệu sinh khối để nấu ăn trong nhà, phơi nhiễm môi trường với các chất ô nhiễm trong không gian kín trong nhà có thể đóng một vai trò quan trọng trong sự phát triển của BPTNMT và có thể giúp giải thích nguy cơ mắc BPTNMT cao hơn ở phụ nữ trong những hoàn cảnh này do thời gian ở trong nhà nhiều hơn.
Nhiễm trùng
Nhiễm trùng không khởi phát BPTNMT, nhưng chúng gây ra sự xấu đi tạm thời của các triệu chứng và chức năng phổi ở những bệnh nhân đã có BPTNMT từ trước. Trong số các loại nhiễm trùng đường hô hấp khác nhau, nhiễm virus dường như là nguyên nhân gây ra một số lượng lớn các đợt kịch phát lâm sàng của các triệu chứng. Nhiễm khuẩn có lẽ đóng một vai trò ít quan trọng hơn nhưng có thể gây bội nhiễm ở những bệnh nhân đã mắc phải một bệnh nhiễm virus cấp tính.
Một vai trò bổ sung thú vị của nhiễm trùng được gợi ý bởi dữ liệu cho thấy rằng nhiễm trùng đường hô hấp ở trẻ em có thể làm tăng nguy cơ phát triển BPTNMT sau này. Đây có thể là một trong những yếu tố giúp giải thích tại sao sự phát triển của BPTNMT không đồng đều ở tất cả những người hút thuốc. Nhiễm trùng hô hấp ở trẻ em có thể góp phần vào nguy cơ phát triển BPTNMT sau này bằng cách ảnh hưởng đến sự phát triển và chức năng của phổi trong thời thơ ấu. Người hút thuốc bắt đầu với mức chức năng thấp hơn do nhiễm trùng hô hấp ở trẻ em có thể có nhiều khả năng bị ảnh hưởng chức năng quan trọng do hút thuốc nhiều trong cuộc sống sau này.
Yếu tố di truyền
Các yếu tố di truyền có lẽ góp phần vào nguy cơ phát triển BPTNMT, nhưng bản chất của khuynh hướng này chưa được xác định rõ ràng. Yếu tố di truyền được xác định rõ nhất gây ra khí phế thũng là sự thiếu hụt protein huyết thanh -antitrypsin. -Antitrypsin là một glycoprotein thuộc họ chất ức chế serine protease (serpin) được sản xuất bởi gan và thường lưu thông trong máu. Những thay đổi nhỏ trong gen SERPINA1, gen mã hóa cho -antitrypsin, tạo ra những thay đổi trong cấu trúc của protein có thể được phát hiện bằng các phương pháp sinh hóa. Hơn 100 alen khác nhau của -antitrypsin đã được xác định. Mỗi người có hai gen mã hóa cho -antitrypsin: một có nguồn gốc từ mẹ và một có nguồn gốc từ cha. Alen bình thường (và phổ biến nhất) là alen M, và bộ gen bình thường gồm hai gen M được gọi là MM. Một người có kiểu gen MM có khoảng 200 mg/dL (2.0 g/L) chất ức chế protease loại M lưu thông trong máu. Với một trong các alen biến thể, được gọi là Z, chuỗi axit amin của protein bị thay đổi một chút, làm suy giảm sự bài tiết của protein từ nơi sản xuất của nó trong gan. Do đó, protein bất thường vẫn còn ở dạng tiểu cầu trong gan, nơi nó có thể dẫn đến bệnh gan, và chỉ một lượng nhỏ đi vào máu. Những cá nhân đồng hợp tử cho gen Z (tức là, có kiểu gen ZZ) có nồng độ -antitrypsin lưu thông khoảng 15% so với bình thường. Những người dị hợp tử có một gen M và một gen Z (kiểu gen MZ) có nồng độ -antitrypsin lưu thông ở mức trung bình trong khoảng 50% đến 60% mức bình thường. Khi có kiểu gen liên quan đến thiếu hụt -antitrypsin, nồng độ trong máu dưới 1.1 g/L khiến bệnh nhân có nguy cơ phát triển bệnh lâm sàng. Tuy nhiên, cần lưu ý rằng không phải tất cả các cá nhân có nồng độ dưới ngưỡng này cuối cùng đều phát triển bệnh lâm sàng.
Dạng thiếu hụt -antitrypsin quan trọng nhất có liên quan đến kiểu gen ZZ.
Kiểu gen ZZ là một yếu tố nguy cơ mạnh đối với sự phát triển sớm của khí phế thũng, đặc biệt nếu cá nhân đó là người hút thuốc. Khí phế thũng thường phát triển sớm nhất là ở thập kỷ thứ ba hoặc thứ tư của cuộc đời ở những người có kiểu gen ZZ (những người thường được cho là bị thiếu hụt -antitrypsin do nồng độ trong huyết thanh thấp). Như đã đề cập trước đó, sự toàn vẹn cấu trúc của các thành phế nang dường như phụ thuộc vào sự cân bằng giữa sự phân hủy elastin bởi elastase và sự bảo vệ khỏi sự phá hủy này được cung cấp bởi -antitrypsin. Ở những bệnh nhân thiếu hụt -antitrypsin, việc thiếu chất ức chế elastase được cho là cho phép hoạt động của elastase diễn ra một cách không kiểm soát, và sự phát triển sớm của khí phế thũng là hậu quả.
Một yếu tố khác đáng quan tâm, một yếu tố có lẽ ít nhất một phần được xác định bởi di truyền, là mức độ tăng phản ứng phế quản có từ trước của bệnh nhân. Dữ liệu ủng hộ giả thuyết rằng sự suy giảm chức năng phổi tăng tốc xảy ra ở những bệnh nhân có mức độ phản ứng phế quản cao hơn. Tuy nhiên, đây là một lĩnh vực gây tranh cãi, một phần vì khả năng hút thuốc gây ra những thay đổi trong phản ứng phế quản khiến việc xác định mối quan hệ nguyên nhân/kết quả trở nên khó khăn.
BỆNH HỌC
Phần lớn bệnh học trong viêm phế quản mạn tính liên quan đến chất nhầy và bộ máy tiết nhầy trong đường thở. Các tuyến tiết nhầy và tế bào hình đài chịu trách nhiệm sản xuất dịch tiết phế quản, nhưng các tuyến nhầy là nguồn quan trọng hơn (xem Chương 4). Trong viêm phế quản mạn tính, sự to ra (phì đại) của các tuyến tiết nhầy đã được đánh giá một cách khách quan bằng cách so sánh độ dày tương đối của các tuyến nhầy với tổng độ dày của thành đường thở. Tỷ lệ này, được gọi là chỉ số Reid, tăng ở những bệnh nhân bị viêm phế quản mạn tính. Nhìn chung, số lượng tế bào hình đài trong đường thở cũng tăng lên (tăng sản), và các tế bào này có nhiều ở các đường thở ngoại vi hơn bình thường. Những thay đổi này trong bộ máy tiết nhầy làm tăng lượng chất nhầy trong đường thở, và thành phần của nó có khả năng cũng bị thay đổi. Trên thực tế, dịch tiết được tìm thấy ở bệnh nhân thường đặc và nhớt hơn bình thường. Thành phế quản cho thấy bằng chứng của một quá trình viêm, với sự xâm nhập của tế bào và các mức độ xơ hóa khác nhau.
Viêm phế quản mạn tính được đặc trưng bởi sự to ra của các tuyến tiết nhầy và sự gia tăng số lượng tế bào hình đài.
Ở các đường thở nhỏ hơn (ví dụ, các tiểu phế quản), viêm, xơ hóa, chất nhầy trong lòng và sự gia tăng tế bào hình đài đều góp phần làm giảm đường kính lòng ống. Bởi vì sức cản của đường thở thay đổi tỷ lệ nghịch với lũy thừa bậc bốn của bán kính, ngay cả những thay đổi nhỏ về kích thước tiểu phế quản cũng có thể dẫn đến suy giảm đáng kể luồng khí ở cấp độ các đường thở nhỏ. Những thay đổi bệnh học này ở các đường thở nhỏ được cho là một yếu tố góp phần chính vào sự tắc nghẽn luồng khí trong BPTNMT, đặc biệt ở những bệnh nhân bị bệnh nhẹ.
Ở những bệnh nhân bị tắc nghẽn luồng khí mạn tính nặng, quá trình quan trọng nhất chịu trách nhiệm cho sự tắc nghẽn luồng khí là khí phế thũng. Như đã đề cập trước đó, bệnh học của khí phế thũng được đặc trưng bởi sự phá hủy các thành phế nang và sự giãn rộng của các khoang khí cuối. Một số loại khí phế thũng có các đặc điểm bệnh học riêng biệt, chủ yếu phụ thuộc vào sự phân bố của các tổn thương. Các loại quan trọng nhất là khí phế thũng toàn tiểu thùy (panacinar/panlobular) và khí phế thũng trung tâm tiểu thùy (centriacinar/centrilobular) (Hình 6.2 và 6.3).
Khí phế thũng toàn tiểu thùy được đặc trưng bởi sự liên quan tương đối đồng đều của tiểu thùy (acinus), vùng nằm ngoài tiểu phế quản tận, bao gồm các tiểu phế quản hô hấp, ống phế nang và túi phế nang. Việc kiểm tra một lát cắt phổi bị khí phế thũng toàn tiểu thùy cho thấy tổn thương trong một khu vực bị ảnh hưởng là tương đối lan tỏa (Hình 6.4). Thông thường, các vùng dưới của phổi bị ảnh hưởng nhiều hơn các vùng trên. Khí phế thũng toàn tiểu thùy là loại khí phế thũng thường được mô tả ở những bệnh nhân bị thiếu hụt -antitrypsin, mặc dù tình trạng này không giới hạn ở bối cảnh lâm sàng này.
Những thay đổi bệnh lý do hút thuốc thường bắt đầu ở các đường thở nhỏ, trước khi có những phát hiện tiến triển liên quan đến viêm phế quản mạn tính và khí phế thũng.
Trong khí phế thũng trung tâm tiểu thùy, sự liên quan và giãn nở chủ yếu được tìm thấy ở phần gần của tiểu thùy, là tiểu phế quản hô hấp. Hình dạng của một lát cắt phổi bị khí phế thũng trung tâm tiểu thùy khác với hình dạng của khí phế thũng toàn tiểu thùy. Trong khí phế thũng trung tâm tiểu thùy, sự liên quan trong một khu vực bị ảnh hưởng dường như không đều hơn, với mô phế nang dường như không bị ảnh hưởng nằm giữa các tiểu phế quản hô hấp bị giãn ở trung tâm tiểu thùy (Hình 6.5). Loại khí phế thũng này là dạng điển hình thấy ở những người hút thuốc. Có thể suy đoán rằng sự liên quan nổi bật tập trung quanh tiểu phế quản hô hấp là hậu quả của sự lan rộng của tình trạng viêm tiểu phế quản trong BPTNMT nhẹ.
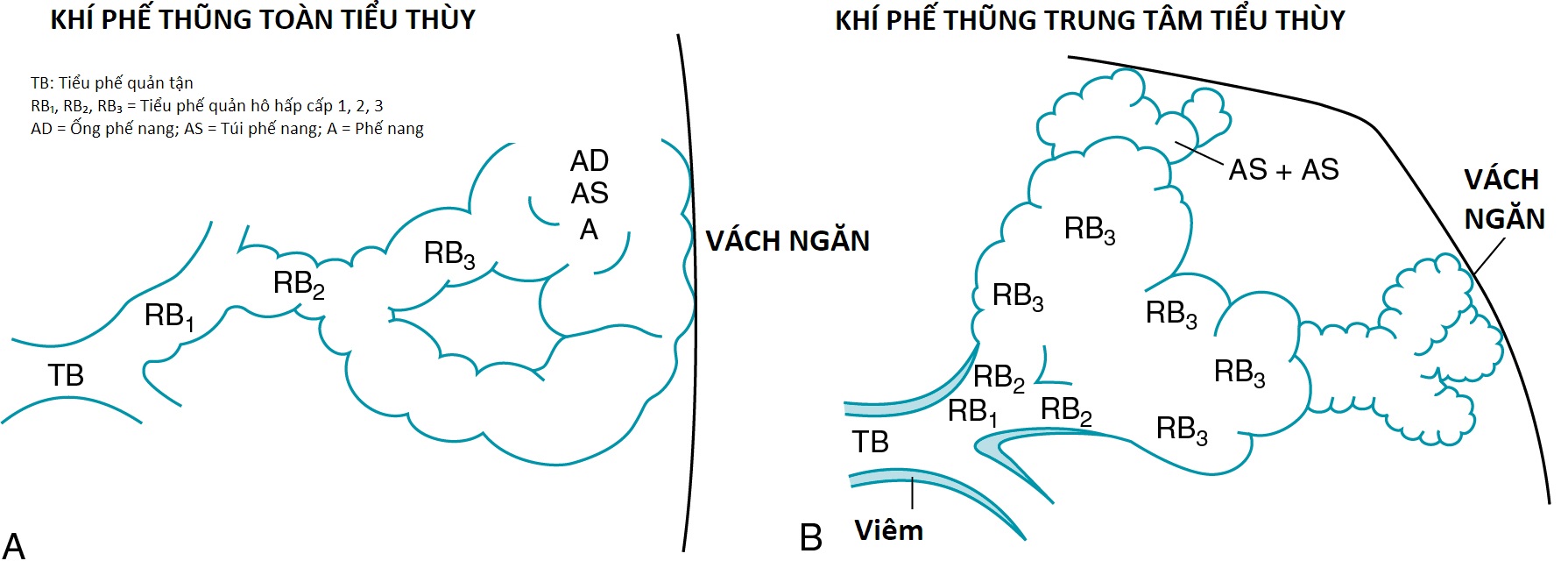
Hình 6.2 Sơ đồ khí phế thũng toàn tiểu thùy (A) và trung tâm tiểu thùy (B). Trong khí phế thũng toàn tiểu thùy (panacinar), sự giãn rộng của các khoang khí tương đối đồng đều trên toàn tiểu thùy. Trong khí phế thũng trung tâm tiểu thùy (centriacinar), sự giãn rộng của các khoang khí chủ yếu ở cấp độ các tiểu phế quản hô hấp. A, phế nang; AD, ống phế nang; AS, túi phế nang; , , , ba thế hệ tiểu phế quản hô hấp; TB, tiểu phế quản tận.
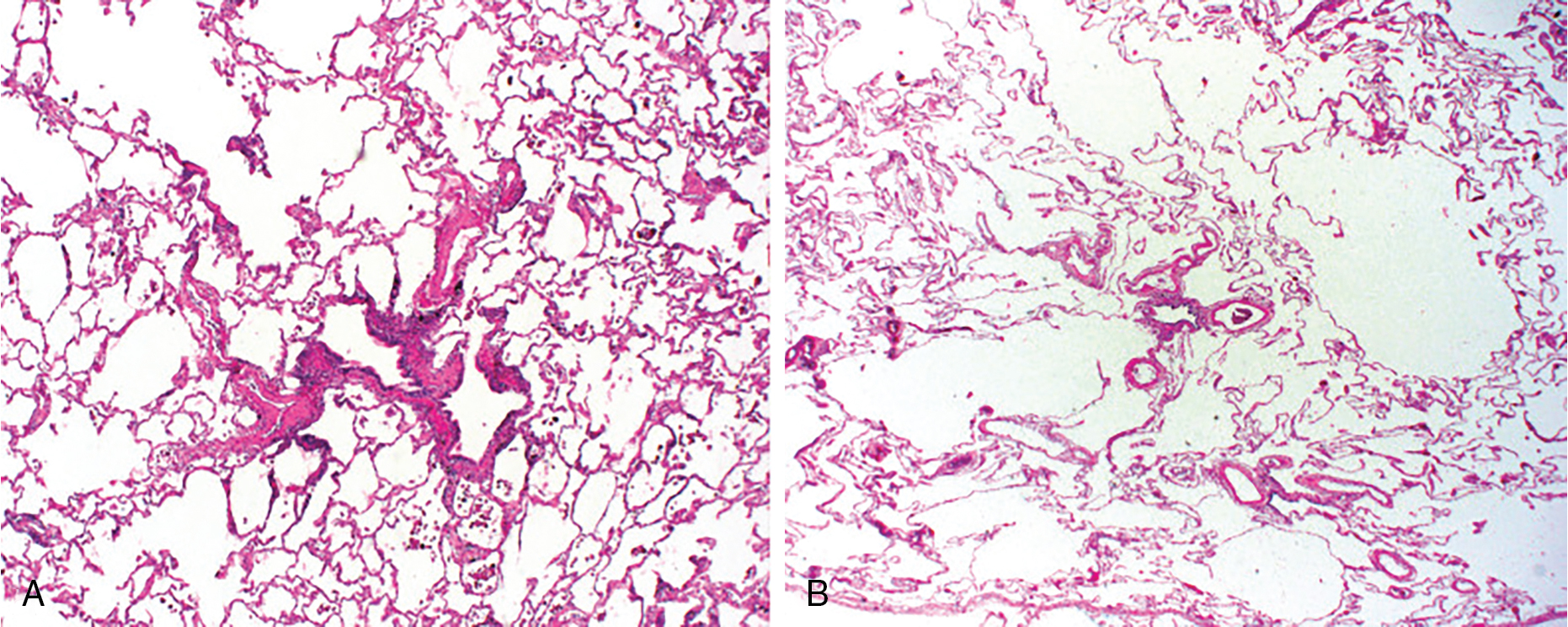
Hình 6.3 Các vi ảnh có độ phóng đại thấp của khí phế thũng. A, Khí phế thũng trung tâm tiểu thùy (centriacinar) với sự giãn nở của các khoang khí xung quanh một tiểu phế quản. B, Khí phế thũng toàn tiểu thùy (panacinar) với sự giãn nở khoang khí lan tỏa hơn.
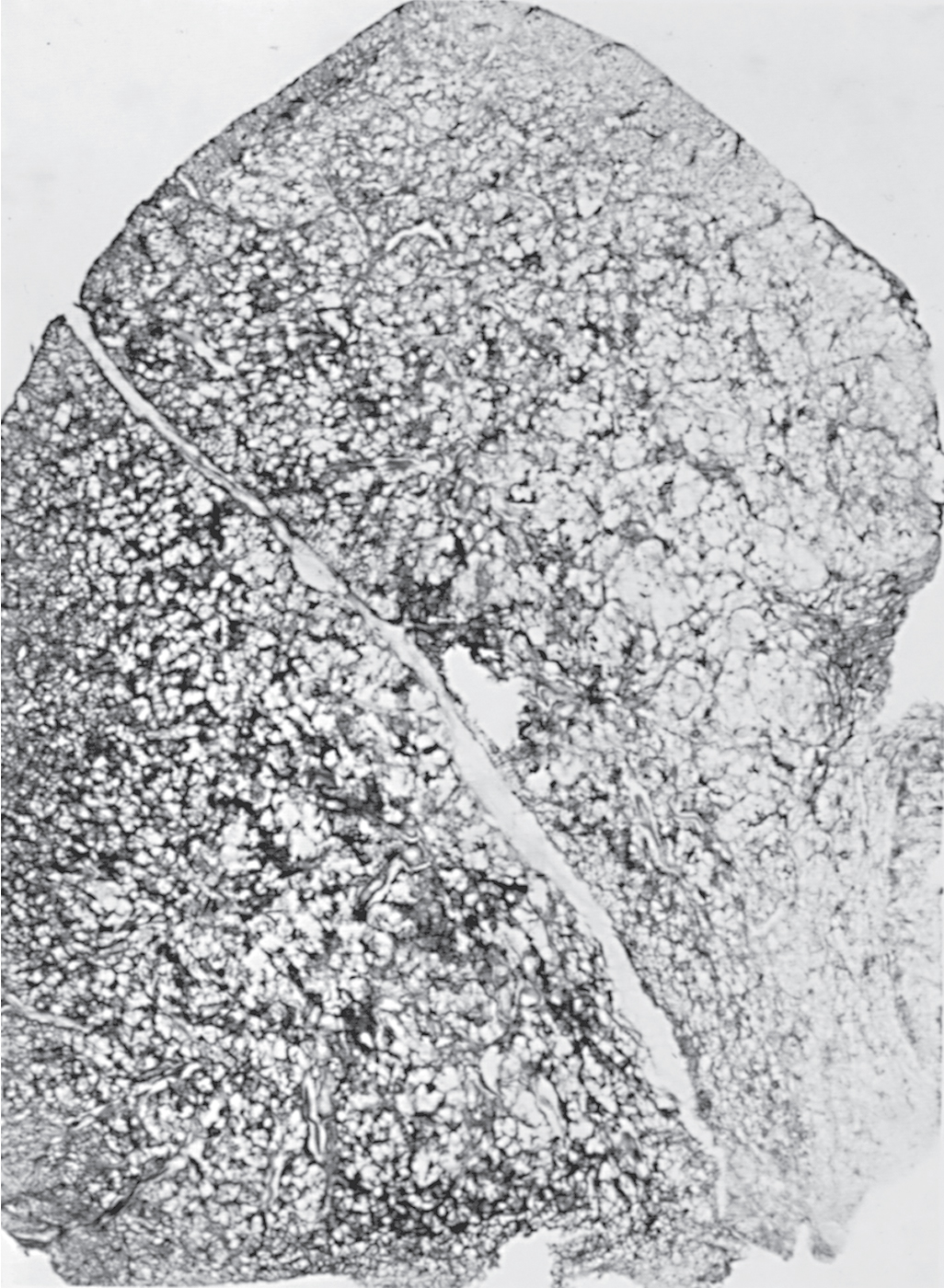
Hình 6.4 Lát cắt toàn bộ phổi cho thấy sự liên quan lan tỏa được thấy trong khí phế thũng toàn tiểu thùy.
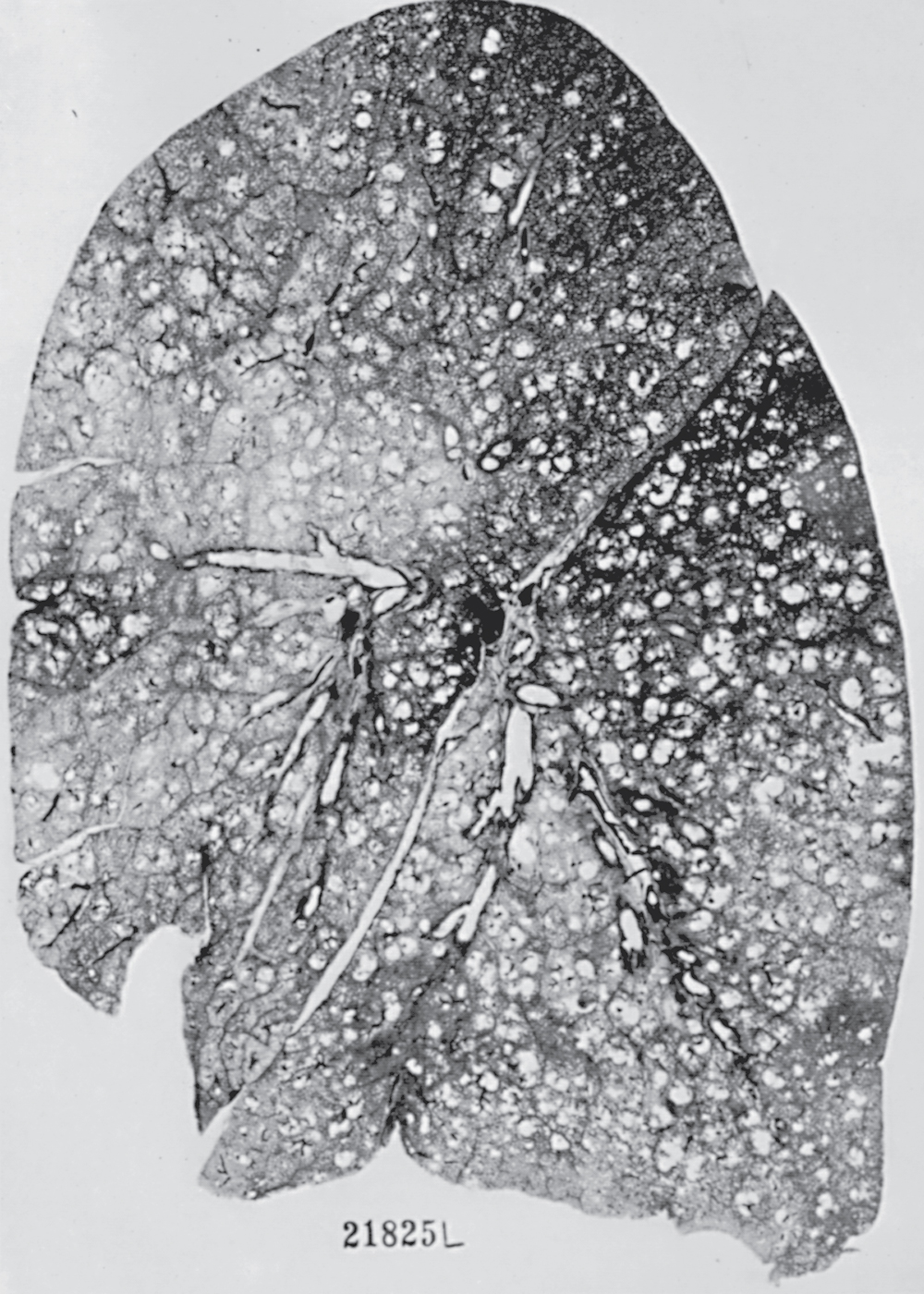
Hình 6.5 Lát cắt toàn bộ phổi cho thấy khí phế thũng trung tâm tiểu thùy. Liền kề với các khoang khí phế thũng (đại diện cho các tiểu phế quản hô hấp bị giãn) là các vùng nhu mô phổi không bị ảnh hưởng (đại diện cho các ống phế nang và các khoang phế nang).
SINH LÝ BỆNH
Cơ sở của việc thảo luận về sinh lý bệnh của BPTNMT là thực tế rằng hút thuốc lá ảnh hưởng đến các đường thở lớn, các đường thở nhỏ và nhu mô phổi. Các hậu quả sinh lý bệnh do bệnh ở mỗi cấp độ này góp phần vào bức tranh lâm sàng tổng thể của BPTNMT. Ngoài ra, mức độ phản ứng của đường thở, có lẽ bị ảnh hưởng bởi các yếu tố di truyền và môi trường, dường như điều chỉnh biểu hiện lâm sàng của bệnh ở một bệnh nhân nhất định. Phần này đơn giản hóa, tóm tắt và đặt vào một khuôn khổ khái niệm một số thông tin liên quan đến mối tương quan cấu trúc-chức năng cho mỗi khía cạnh của BPTNMT.
Bất thường chức năng trong bệnh lý đường thở
Ở các đường thở lớn hơn (phế quản), sự gia tăng bộ máy tiết nhầy và lượng chất nhầy được sản xuất dẫn đến các triệu chứng ho và khạc đờm quá mức đặc trưng của viêm phế quản mạn tính. Tuy nhiên, các triệu chứng này không nhất thiết tương quan với mức độ tắc nghẽn luồng khí, vì một số bệnh nhân có các triệu chứng điển hình của viêm phế quản mạn tính không có sức cản cao bất thường hoặc những thay đổi trong các phép đo luồng khí khác. Khi tắc nghẽn luồng khí tồn tại, nói chung, các yếu tố bệnh lý bổ sung, hoặc ở các đường thở nhỏ (viêm và xơ hóa) hoặc nhu mô phổi (khí phế thũng), là rất quan trọng cho sự hiện diện của tắc nghẽn. Trong tắc nghẽn luồng khí tương đối nhẹ liên quan đến viêm phế quản mạn tính, bệnh ở các đường thở nhỏ có khả năng là yếu tố quan trọng chịu trách nhiệm cho tắc nghẽn luồng khí. Khi tắc nghẽn luồng khí rõ rệt hơn, khí phế thũng cùng tồn tại, với đường kính các đường thở nhỏ giảm do mất sự níu giữ của đường thở, thường là lý do chính gây tắc nghẽn.
Bệnh đường thở nhỏ, khí phế thũng, hoặc cả hai góp phần đáng kể vào việc giảm lưu lượng thở ra trong BPTNMT.
Ở những bệnh nhân có thành phần tăng phản ứng đường thở góp phần vào bệnh của họ, biểu hiện lâm sàng thường là hội chứng chồng lấp hen-BPTNMT. Co thắt cơ trơn đường thở làm tăng thêm tình trạng tắc nghẽn luồng khí có thể hồi phục hơn so với những gì thường thấy ở bệnh nhân không có tăng phản ứng đường thở.
Vấn đề chung do các quá trình ảnh hưởng đến đường thở gây ra là sự giảm diện tích mặt cắt ngang tổng thể của đường thở. Sức cản đường thở tăng lên (tức là, trở nên tồi tệ hơn) bởi bất cứ điều gì làm giảm diện tích mặt cắt ngang của lòng đường thở: dịch tiết trong lòng ống, co thắt phế quản, hoặc dày lên thành đường thở do phù nề, các tế bào viêm, xơ hóa, hoặc sự to ra của bộ máy tiết nhầy, ví dụ. Khi bệnh chủ yếu ở các đường thở ngoại vi và ở mức độ nhẹ, hậu quả chức năng có thể tương đối tinh vi. Bởi vì các đường thở ngoại vi chỉ đóng góp khoảng 10% đến 20% tổng sức cản đường thở, tổng sức cản được duy trì trừ khi bệnh đường thở nhỏ là đáng kể, hoặc có thêm bệnh lý ảnh hưởng đến các đường thở lớn hơn.
Là một hậu quả khác của bệnh lý đường thở, các lưu lượng thở ra bao gồm thể tích thở ra gắng sức trong 1 giây (), tỷ lệ /dung tích sống gắng sức (FVC), và lưu lượng giữa kỳ thở ra tối đa (MMFR) – thường giảm. Việc sử dụng các thuốc giãn phế quản dạng hít có thể có hoặc không dẫn đến cải thiện đáng kể lưu lượng ở bệnh nhân BPTNMT. Bệnh nhân có hội chứng chồng lấp hen-BPTNMT và tăng phản ứng đường thở nhiều hơn thường có sự cải thiện rõ rệt nhất về lưu lượng sau khi dùng thuốc giãn phế quản dạng hít.
Trước khi thảo luận về cách các thể tích phổi thay đổi ở những bệnh nhân có bệnh lý đường thở liên quan đến BPTNMT, sẽ rất hữu ích khi xem lại các yếu tố quyết định các thể tích phổi chính: dung tích toàn phổi (TLC), dung tích cặn chức năng (FRC) và thể tích cặn (RV). TLC là điểm mà tại đó lực tối đa của các cơ hít vào tác động để làm nở phổi bằng với lực đàn hồi của hệ hô hấp (chủ yếu là lực đàn hồi của phổi) chống lại sự giãn nở (xem Chương 1). Tại FRC, điểm nghỉ của hệ hô hấp, có sự cân bằng giữa lực đàn hồi của phổi và lực đàn hồi của thành ngực, chúng tác động theo các hướng ngược nhau – phổi hướng vào trong và thành ngực hướng ra ngoài. Các yếu tố quyết định RV phụ thuộc một phần vào tuổi tác. Ở người trẻ khỏe mạnh, RV là điểm mà tại đó thành ngực tương đối cứng không thể bị các cơ thở ra nén thêm nữa. Khi tuổi tác tăng lên, một số lượng đủ các đường thở đóng lại ở thể tích phổi thấp để hạn chế sự thở ra thêm, và sự đóng đường thở là một yếu tố quyết định quan trọng của RV. Trong các tình trạng bệnh lý mà các đường thở có khả năng đóng lại ở thể tích phổi thấp, sự đóng đường thở có liên quan đến RV tăng cao, ngay cả ở bệnh nhân trẻ tuổi.
Ở những bệnh nhân chỉ có bệnh lý đường thở đơn thuần, về mặt lý thuyết, TLC vẫn gần như bình thường vì cả lực đàn hồi của phổi và sức mạnh của cơ hít vào đều không bị thay đổi. Tương tự, FRC cũng nên giữ ở mức bình thường vì lực đàn hồi của phổi và lực đàn hồi của thành ngực không thay đổi. Tuy nhiên, nếu lưu lượng thở ra giảm và tần số hô hấp cao, bệnh nhân có thể không có đủ thời gian trong lúc thở ra để đạt đến điểm cuối thì thở ra bình thường. Khi điều này xảy ra, thể tích phổi cuối kỳ thở ra tăng lên, dẫn đến sự gia tăng FRC đo được. RV cũng thường tăng lên trong các quá trình liên quan đến đường thở, bởi vì sự hẹp và tắc nghẽn của các đường thở nhỏ do dịch tiết và viêm dẫn đến bẫy khí trong quá trình thở ra.
Bất thường chức năng trong khí phế thũng
Mặc dù khí phế thũng (tức là sự phá hủy các thành phế nang) dẫn đến giảm lưu lượng thở ra, sinh lý bệnh lại khác với tình trạng bệnh lý đường thở đơn thuần. Vấn đề chính trong khí phế thũng là mất lực đàn hồi (tức là, mất đi xu hướng tự nhiên của phổi để chống lại và phục hồi sau khi giãn nở). Một hậu quả quan trọng của việc giảm lực đàn hồi là giảm áp lực đẩy khí ra khỏi phế nang trong quá trình thở ra. Một phép tương tự đơn giản là một quả bóng bay chứa đầy không khí, trong đó lực đàn hồi là “độ cứng” của quả bóng. Với một thể tích không khí nhất định bên trong một quả bóng chưa bịt kín, một quả bóng cứng hơn sẽ đẩy không khí ra nhanh hơn một quả bóng ít cứng hơn. Một lá phổi bị khí phế thũng giống như một quả bóng ít cứng hơn: một lực nhỏ hơn bình thường đẩy không khí ra khỏi phổi trong quá trình thở ra.
Trong khí phế thũng, lưu lượng thở ra giảm phần lớn là do mất lực đàn hồi của phổi, dẫn đến: 1. Áp lực đẩy thấp hơn cho luồng khí thở ra 2. Mất lực kéo xuyên tâm lên đường thở do các thành phế nang hỗ trợ cung cấp, do đó thúc đẩy sự xẹp đường thở trong quá trình thở ra
Mất áp lực đẩy trong quá trình thở ra không phải là hậu quả duy nhất của khí phế thũng. Nó cũng có một tác động gián tiếp lên khả năng xẹp của đường thở. Thông thường, các thành của đường thở được giữ mở và được kéo ra ngoài theo hướng xuyên tâm từ trung tâm lòng ống bởi một cấu trúc hỗ trợ từ mô nhu mô phổi lân cận. Khi mô phế nang bị phá vỡ, như trong khí phế thũng, cấu trúc hỗ trợ cho đường thở bị suy yếu, và ít lực kéo xuyên tâm được tác động để ngăn chặn sự xẹp đường thở (Hình 6.6). Trong một lần thở ra gắng sức, áp lực màng phổi dương mạnh thúc đẩy sự xẹp. Các đường thở thiếu cấu trúc hỗ trợ đầy đủ có nhiều khả năng bị xẹp hơn (và có lưu lượng giảm và bẫy khí) so với các đường thở được hỗ trợ bình thường.
Sự giảm lực đàn hồi trong khí phế thũng cũng làm thay đổi đường cong độ giãn nở (compliance curve) của phổi và các thể tích phổi đo được. Đường cong độ giãn nở liên quan đến áp lực xuyên phổi và thể tích khí tương ứng trong phổi (xem Chương 1). Bởi vì một lá phổi bị khí phế thũng có ít lực đàn hồi hơn (tức là, ít cứng hơn), nó chống lại sự giãn nở ít hơn so với lá phổi bình thường, đường cong độ giãn nở bị dịch chuyển lên trên và sang trái, và phổi có thể tích lớn hơn ở bất kỳ áp lực xuyên phổi cụ thể nào (Hình 6.7).
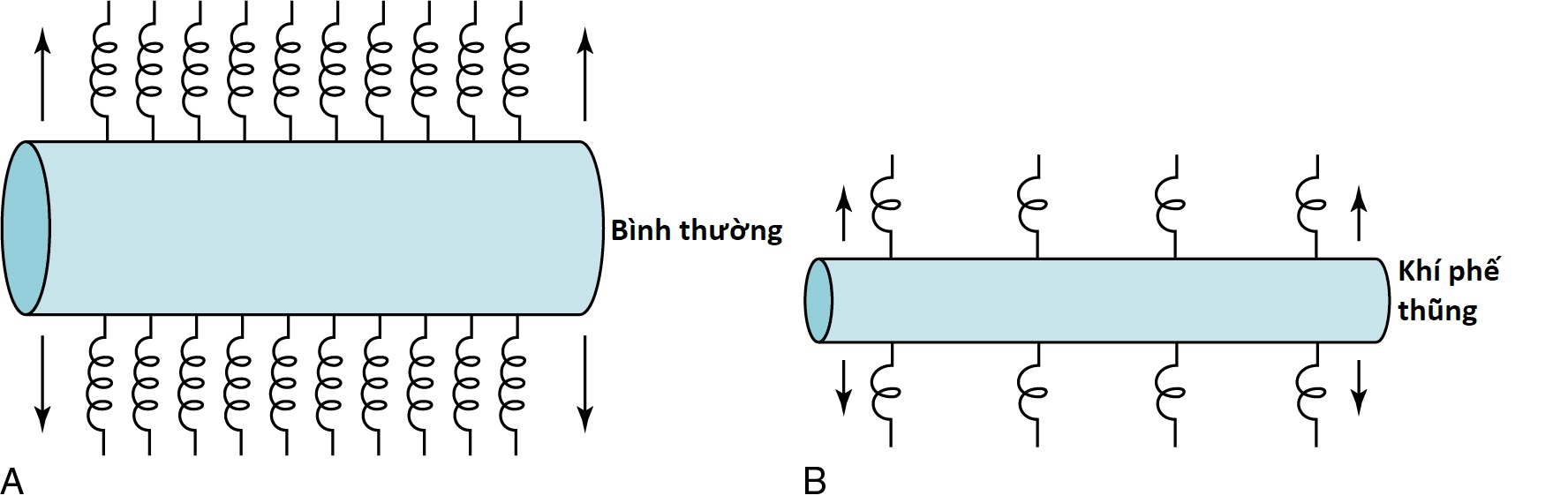
Hình 6.6 Sơ đồ lực kéo xuyên tâm do các thành phế nang (biểu thị bằng các lò xo) tác động để giữ cho đường thở mở. A, Tình trạng bình thường. B, Mất lực kéo xuyên tâm như thấy trong khí phế thũng.
TLC tăng lên vì mất lực đàn hồi dẫn đến một lực nhỏ hơn chống lại hoạt động của các cơ hít vào. FRC cũng tăng lên vì sự cân bằng giữa lực đàn hồi hướng ra ngoài của thành ngực và lực đàn hồi hướng vào trong của phổi bị dịch chuyển theo hướng có lợi cho thành ngực. Giống như trong viêm phế quản, RV tăng đáng kể trong khí phế thũng vì các đường thở được hỗ trợ kém dễ bị đóng lại hơn trong một lần thở ra tối đa.
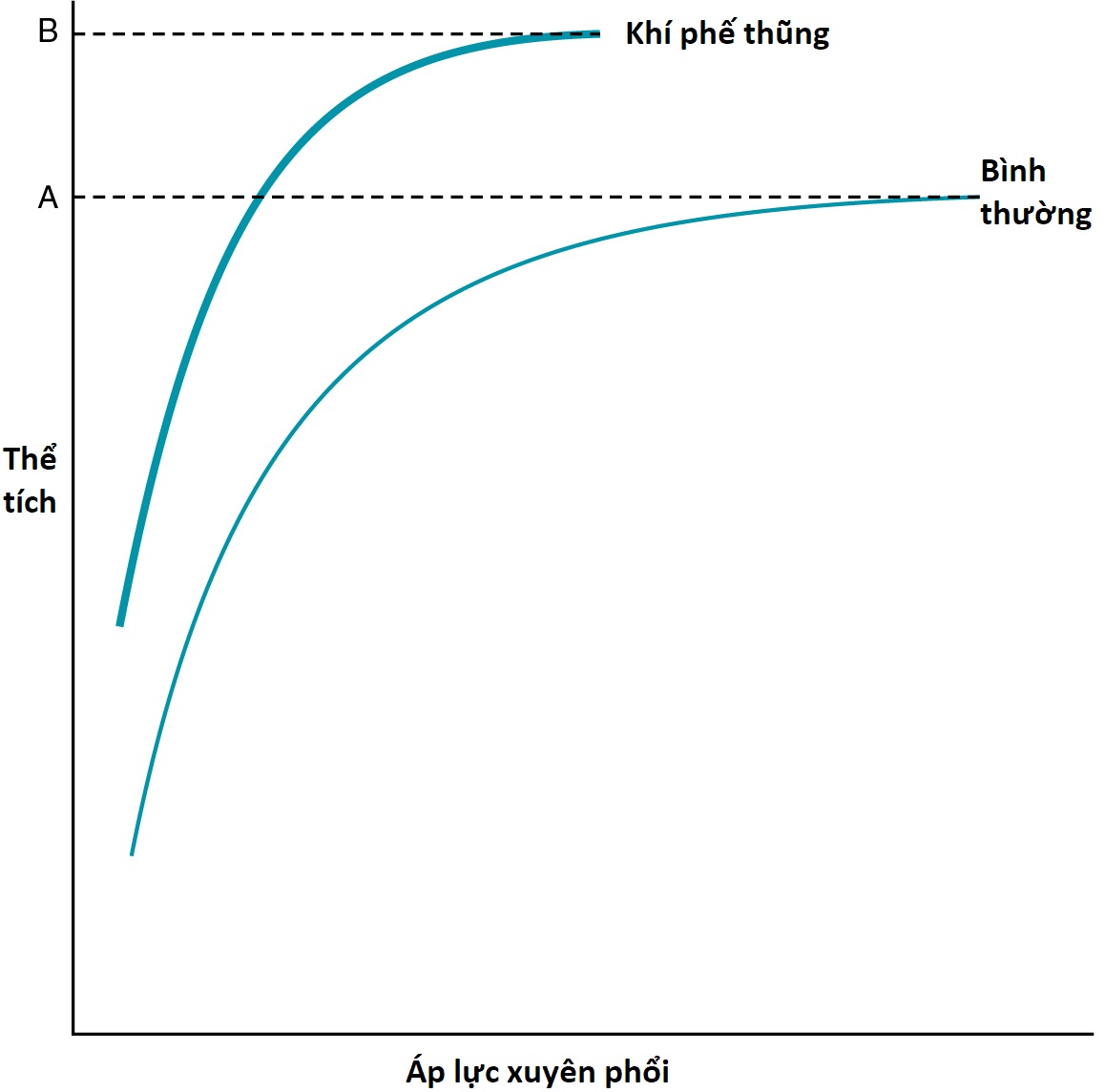
Hình 6.7 Đường cong độ giãn nở của phổi trong khí phế thũng so với phổi bình thường. Ngoài sự dịch chuyển của đường cong lên trên và sang trái, dung tích toàn phổi trong khí phế thũng (điểm B trên trục thể tích) lớn hơn dung tích toàn phổi bình thường (điểm A). Trong viêm phế quản mạn tính đơn thuần không có khí phế thũng, đường cong độ giãn nở là bình thường.
Cơ chế trao đổi khí bất thường
Trong bệnh phổi tắc nghẽn, nhiều thay đổi bệnh lý quan sát được ảnh hưởng đến luồng khí không được phân bố đồng đều. Ví dụ, trong viêm phế quản mạn tính, một số đường thở bị ảnh hưởng nhiều bởi dịch tiết và tắc nghẽn, nhưng những đường thở khác vẫn tương đối không bị ảnh hưởng, vì vậy thông khí không được phân bố đồng đều khắp phổi. Các vùng của phổi được cung cấp bởi các đường thở bị bệnh nhiều hơn sẽ nhận được thông khí giảm đi so với các vùng được cung cấp bởi các đường thở ít bị bệnh hơn. Mặc dù có thể có sự giảm bù trừ lưu lượng máu đến các phế nang bị giảm thông khí, sự bù trừ này không hoàn toàn hiệu quả, và sự bất tương xứng và không phù hợp giữa thông khí và tưới máu (V/Q mismatch) xảy ra. Loại rối loạn thông khí-tưới máu này, với một số vùng phổi có tỷ lệ thông khí-tưới máu thấp và đóng góp máu không bão hòa oxy, dẫn đến giảm oxy máu động mạch.
Trong bệnh phổi tắc nghẽn, sự không đồng nhất của quá trình bệnh lý dẫn đến bất tương xứng V/Q và giảm oxy máu.
Việc thải trừ carbon dioxide bị suy giảm ở một số bệnh nhân bị bệnh phổi tắc nghẽn. Cơ chế giảm thông khí phế nang và ứ đọng ít rõ ràng hơn cơ chế giảm oxy máu. Một số yếu tố có thể góp phần, bao gồm tăng công thở (do suy giảm luồng khí), bất thường của trung tâm điều khiển thông khí, và bất tương xứng thông khí-tưới máu tạo ra một số vùng có tỷ lệ thông khí-tưới máu cao hoạt động hiệu quả như khoảng chết. Một vấn đề bổ sung – sự mệt mỏi của các cơ hít vào – đã nhận được sự chú ý như một yếu tố góp phần vào ứ đọng cấp tính khi các bệnh nhân bị ảnh hưởng đang trong tình trạng suy hô hấp (xem Chương 19). Tầm quan trọng của sự mệt mỏi cơ hoành ở bệnh nhân ổn định bị tăng CO2 máu mạn tính ít chắc chắn hơn. Tuy nhiên, rõ ràng là sự co của cơ hoành, cơ chính của hít vào, kém hiệu quả hơn ở những bệnh nhân bị bệnh phổi tắc nghẽn. Khi FRC tăng, cơ hoành ở vị trí thấp hơn và dẹt hơn, và các sợi của nó bị rút ngắn ngay cả trước khi bắt đầu hít vào. Một cơ hoành bị rút ngắn, dẹt ở thế bất lợi về mặt cơ học so với một cơ hoành dài hơn, cong hơn và kém hiệu quả hơn như một cơ hít vào.
| Cơ chế góp phần vào giảm thông khí phế nang và ứ đọng trong bệnh phổi tắc nghẽn
1. Tăng công thở 2. Bất thường của trung tâm điều khiển thông khí 3. Bất tương xứng V/Q 4. Giảm hiệu quả của cơ hoành |
Tăng áp động mạch phổi
Một biến chứng tiềm tàng của BPTNMT là sự phát triển của tăng áp động mạch phổi (tức là, áp lực cao bất thường trong hệ thống động mạch phổi). Tăng áp động mạch phổi kéo dài đặt một gánh nặng công việc tăng thêm lên tâm thất phải, làm nó phì đại và cuối cùng có thể suy. Thuật ngữ tâm phế mạn được sử dụng để mô tả bệnh của tâm thất phải thứ phát sau bệnh phổi (hoặc BPTNMT hoặc các dạng bệnh phổi khác); chủ đề này được thảo luận trong Chương 14. Đặc điểm chính của BPTNMT dẫn đến tăng áp động mạch phổi và cuối cùng là tâm phế mạn, là tình trạng thiếu oxy mạn tính. Sự giảm là một kích thích mạnh mẽ cho sự co thắt của các tiểu động mạch phổi (xem Chương 12). Nếu tình trạng thiếu oxy được điều chỉnh, yếu tố co mạch phổi có thể đảo ngược, nhưng sự tái cấu trúc mạch máu do thiếu oxy mạn tính có thể không hoàn toàn đảo ngược.
Nguyên nhân chính gây tăng áp động mạch phổi trong BPTNMT là thiếu oxy. Các yếu tố bổ sung bao gồm tăng CO2 máu, đa hồng cầu và sự phá hủy của giường mạch máu phổi.
Một số yếu tố khác nhưng tương đối ít quan trọng hơn có thể góp phần vào tăng áp lực động mạch phổi là tăng CO2 máu, đa hồng cầu, và giảm diện tích của giường mạch máu phổi. Tăng CO2 máu, giống như thiếu oxy, có thể gây co mạch phổi. Ở một mức độ lớn, tác động này có thể được trung gian bởi sự thay đổi pH do tăng . Sự gia tăng hematocrit (tức là, đa hồng cầu) thường được tìm thấy ở bệnh nhân thiếu oxy mạn tính, làm tăng độ nhớt của máu và góp phần vào tăng áp lực động mạch phổi. Cuối cùng, trong khí phế thũng, sự phá hủy các thành phế nang đi kèm với sự mất đi các mao mạch phổi. Do đó, trong bệnh lan rộng, giường mạch máu phổi bị hạn chế có thể dẫn đến sức cản cao đối với lưu lượng máu và do đó, tăng áp lực động mạch phổi.
Các kiểu hình BPTNMT
Trước đây, các bác sĩ và nhà nghiên cứu thường phân biệt hai loại sinh lý bệnh của BPTNMT: loại A và loại B. Các loại phụ này không còn được đưa vào định nghĩa của BPTNMT, nhưng các thuật ngữ này đã ăn sâu vào y văn cũ, vì vậy một cuộc thảo luận ngắn sẽ được đưa ra ở đây. Theo quan niệm ban đầu, sinh lý bệnh loại A (được gọi là “người thổi hồng” – “pink puffer”) có liên quan đến khí phế thũng tiềm ẩn, thông khí phút cao, và động mạch tương đối bình thường. Sinh lý bệnh loại B (được gọi là “người phù xanh” – “blue bloater”) được coi tương đương với viêm phế quản mạn tính, giảm oxy máu, tăng CO2 máu, và tâm phế mạn. Hai loại này được cho là đại diện cho hai đầu của phổ BPTNMT: khí phế thũng “thuần túy” hoặc bệnh đường thở “thuần túy”. Hiện nay người ta đã nhận ra rằng khuôn khổ này không hữu ích trong việc phân loại bệnh nhân, bởi vì đại đa số bệnh nhân BPTNMT có cả hai khía cạnh của bệnh.
Hiện tại, có sự quan tâm sâu sắc đến việc phát triển một sự hiểu biết tốt hơn về các kiểu hình BPTNMT, với mục tiêu xác định các phân loại bệnh có liên quan lâm sàng khác nhau. Một hệ thống phân loại hiện tại quan trọng, sử dụng các loại từ A đến D, dựa trên việc đánh giá các triệu chứng của bệnh nhân cũng như nguy cơ các đợt kịch phát trong tương lai, dựa trên tiền sử các đợt kịch phát trước đó (Hình 6.8). Vị trí của bệnh nhân đối với hai yếu tố này sau đó có thể được sử dụng để cá nhân hóa phương pháp tiếp cận phác đồ điều trị của bệnh nhân.
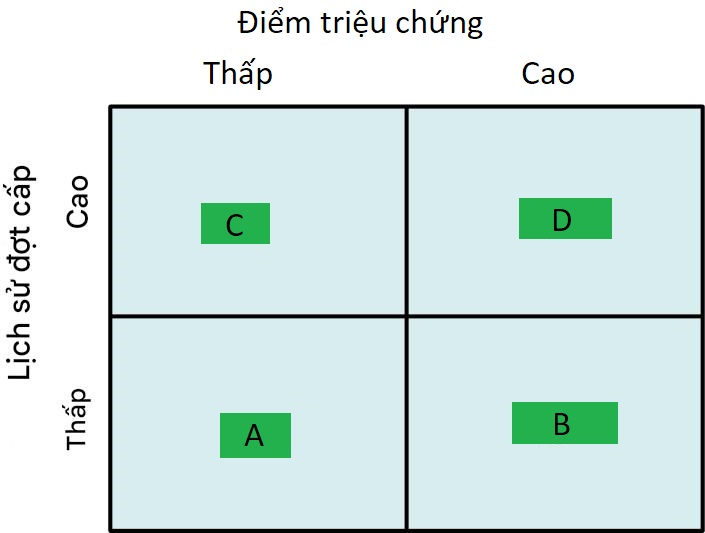
Hình 6.8 Mô tả đơn giản hóa sơ đồ phân loại lâm sàng cho BPTNMT xác định các kiểu hình từ A đến D dựa trên các triệu chứng và tiền sử các đợt kịch phát.
ĐẶC ĐIỂM LÂM SÀNG
Các triệu chứng thường gặp nhất ở bệnh nhân BPTNMT bao gồm khó thở và ho, thường có khạc đờm. Ho và khạc đờm có thể xuất hiện trước khi khó thở phát triển nhiều năm. Hầu hết bệnh nhân đều có triệu chứng, nhưng một số không có triệu chứng, và chẩn đoán BPTNMT được xác định dựa trên các xét nghiệm chức năng phổi.
Thông thường, bệnh nhân có một mức độ triệu chứng mạn tính nhất định, nhưng diễn biến bệnh của họ bị gián đoạn bởi các giai đoạn kịch phát. Đợt kịch phát được định nghĩa là một sự kiện cấp tính được đặc trưng bởi sự xấu đi của các triệu chứng cần thay đổi thuốc. Yếu tố khởi phát gây ra đợt kịch phát thường là nhiễm trùng đường hô hấp do virus hoặc vi khuẩn. Nhiều loại vi khuẩn thường xuyên có mặt trong cây khí-phế quản của bệnh nhân BPTNMT, và một đợt kịch phát cấp tính đôi khi có thể do mắc phải một chủng vi khuẩn định cư mới. Các yếu tố khác gây ra tình trạng xấu đi cấp tính ở bệnh nhân bao gồm phơi nhiễm với nhiều loại chất ô nhiễm không khí, co thắt phế quản (đặc biệt nếu bệnh nhân có thành phần hen chồng lấp), và suy tim. Tuy nhiên, trong tới một phần ba các trường hợp, nguyên nhân của đợt kịch phát không thể được xác định. Khi các đợt kịch phát nghiêm trọng, bệnh nhân có thể phát triển suy hô hấp rõ ràng, một biến chứng được thảo luận trong Chương 28.
Yếu tố khởi phát cho một đợt kịch phát BPTNMT thường là nhiễm virus hoặc vi khuẩn.
Ngoài các triệu chứng mạn tính như khó thở, ho, hoặc cả hai, có thể trở nên tồi tệ hơn trong các giai đoạn kịch phát cấp tính, bệnh nhân có thể gặp các biến chứng tim mạch thứ phát của bệnh phổi (tức là tâm phế mạn). Bệnh nhân bị giảm oxy máu và tăng CO2 máu mạn tính có nguy cơ cao bị tâm phế mạn.
Ở giai đoạn đầu của bệnh, khám thực thể có thể bình thường hoặc chỉ cho thấy thời gian thở ra kéo dài. Khi quá trình bệnh trở nên nghiêm trọng hơn, các phát hiện đặc trưng là phổ biến. Rì rào phế nang thường giảm cường độ lan tỏa, và thì thở ra kéo dài. Có thể nghe thấy tiếng ran rít nhưng không nhất thiết phản ánh co thắt phế quản có thể hồi phục. Một số bệnh nhân không có ran rít khi thở bình thường, nhưng có khi được yêu cầu thở ra gắng sức. Ở những bệnh nhân có dịch tiết đường thở nhiều, thường nghe thấy các âm thanh ngáy thô được gọi là ran ngáy. Khám lồng ngực thường cho thấy đường kính trước-sau tăng lên, cho thấy sự căng phồng của phổi. Khi đánh giá sự di động của cơ hoành bằng cách gõ đáy phổi trong khi hít vào và thở ra, sẽ thấy sự di động giảm.
Trong BPTNMT tiến triển, bệnh nhân có thể sử dụng các cơ hô hấp phụ (ví dụ, cơ ức đòn chũm và cơ thang), và các cơ liên sườn có thể co rút với mỗi lần hít vào. Bệnh nhân có thể ở tư thế “kiềng ba chân” đặc trưng, nghiêng người về phía trước trên hai cánh tay duỗi thẳng cho phép cố định xương đòn và sử dụng các cơ phụ hiệu quả hơn. Có thể quan sát thấy thở mím môi. Bệnh nặng cũng có thể phức tạp bởi sụt cân và teo cơ. Khi có tâm phế mạn, dù có suy thất phải rõ ràng hay không, bệnh nhân có các dấu hiệu tim mạch được mô tả trong Chương 14.
Hút thuốc không chỉ là yếu tố chính khởi phát BPTNMT mà còn là một yếu tố nguy cơ chính quyết định tiên lượng bệnh của bệnh nhân. Những bệnh nhân tiếp tục hút thuốc có sự suy giảm chức năng phổi tiến triển lớn nhất theo thời gian. Các đợt kịch phát và nhiễm trùng đường hô hấp thường gây ra suy giảm cấp tính chức năng phổi, nhưng ảnh hưởng của chúng đối với tốc độ suy giảm chức năng phổi trong dài hạn chưa được xác định rõ ràng. Tuy nhiên, nhiễm trùng là nguyên nhân quan trọng nhất gây tử vong cấp tính ở bệnh nhân BPTNMT, chỉ ra sự cần thiết của việc tiêm vắc-xin cúm, COVID-19 và phế cầu, cũng như điều trị nhanh chóng và phù hợp các bệnh nhiễm trùng đường hô hấp do vi khuẩn và cúm.
Tiếp tục hút thuốc là một yếu tố nguy cơ chính ảnh hưởng đến tiên lượng của BPTNMT.
Phổ mức độ nghiêm trọng của BPTNMT rất rộng, do đó tỷ lệ mắc bệnh do bệnh này thay đổi rất nhiều giữa các bệnh nhân. Bệnh nhân mắc bệnh nhẹ có thể tiếp tục công việc và lối sống bình thường của họ với những thay đổi tối thiểu, nếu có. Bệnh nhân mắc bệnh nặng bị hạn chế rất nhiều trong khả năng gắng sức, phải nhập viện thường xuyên và có thể có tuổi thọ dưới 5 năm.
TIẾP CẬN CHẨN ĐOÁN VÀ ĐÁNH GIÁ
Trong hầu hết các trường hợp, chẩn đoán BPTNMT được nghi ngờ dựa trên bệnh sử và khám thực thể, nhưng vẫn cần đo phế dung ký với bằng chứng tắc nghẽn luồng khí dai dẳng để xác nhận chẩn đoán trong bối cảnh lâm sàng này. Viêm phế quản mạn tính là một chẩn đoán lâm sàng, và bệnh sử đặc biệt quan trọng. Mặc dù khí phế thũng chính thức là một chẩn đoán bệnh học, nhưng sinh thiết phổi không được thực hiện để chẩn đoán. Xác nhận bệnh học thường chỉ có được khi khám nghiệm tử thi, nếu được thực hiện.
X-quang ngực có độ nhạy kém trong việc phát hiện BPTNMT nhưng có giá trị trong việc loại trừ các quá trình khác gây khó thở, chẳng hạn như suy tim, xơ phổi, hoặc bệnh màng phổi. Bệnh nhân chỉ bị viêm phế quản mạn tính thường có X-quang ngực bình thường. Khi có mặt, các dấu hiệu X-quang ngực gợi ý BPTNMT bao gồm các dấu hiệu căng phồng phổi, chẳng hạn như thể tích phổi lớn, vòm hoành dẹt, khoảng trống sau xương ức tăng, đường kính trước-sau tăng (nhìn trên phim nghiêng), và giảm các dấu hiệu mạch máu (Hình 6.9). Sự căng phồng phổi liên quan đến việc giảm các dấu hiệu mạch máu trong phổi là do sự phá hủy các vách phế nang và sự giãn rộng của các khoang phế nang, và đã được gọi là dạng khí phế thũng do thiếu máu động mạch. Ở những bệnh nhân thiếu hụt -antitrypsin và khởi phát khí phế thũng sớm, dạng thiếu máu động mạch khá nổi bật ở các thùy dưới, nơi có thể gần như mất hoàn toàn các dấu hiệu mạch máu.
| Các dấu hiệu X-quang đặc trưng trong dạng khí phế thũng do thiếu máu động mạch của BPTNMT
1. Thể tích phổi lớn 2. Vòm hoành dẹt 3. Đường kính trước-sau tăng 4. Mất các dấu hiệu mạch máu |
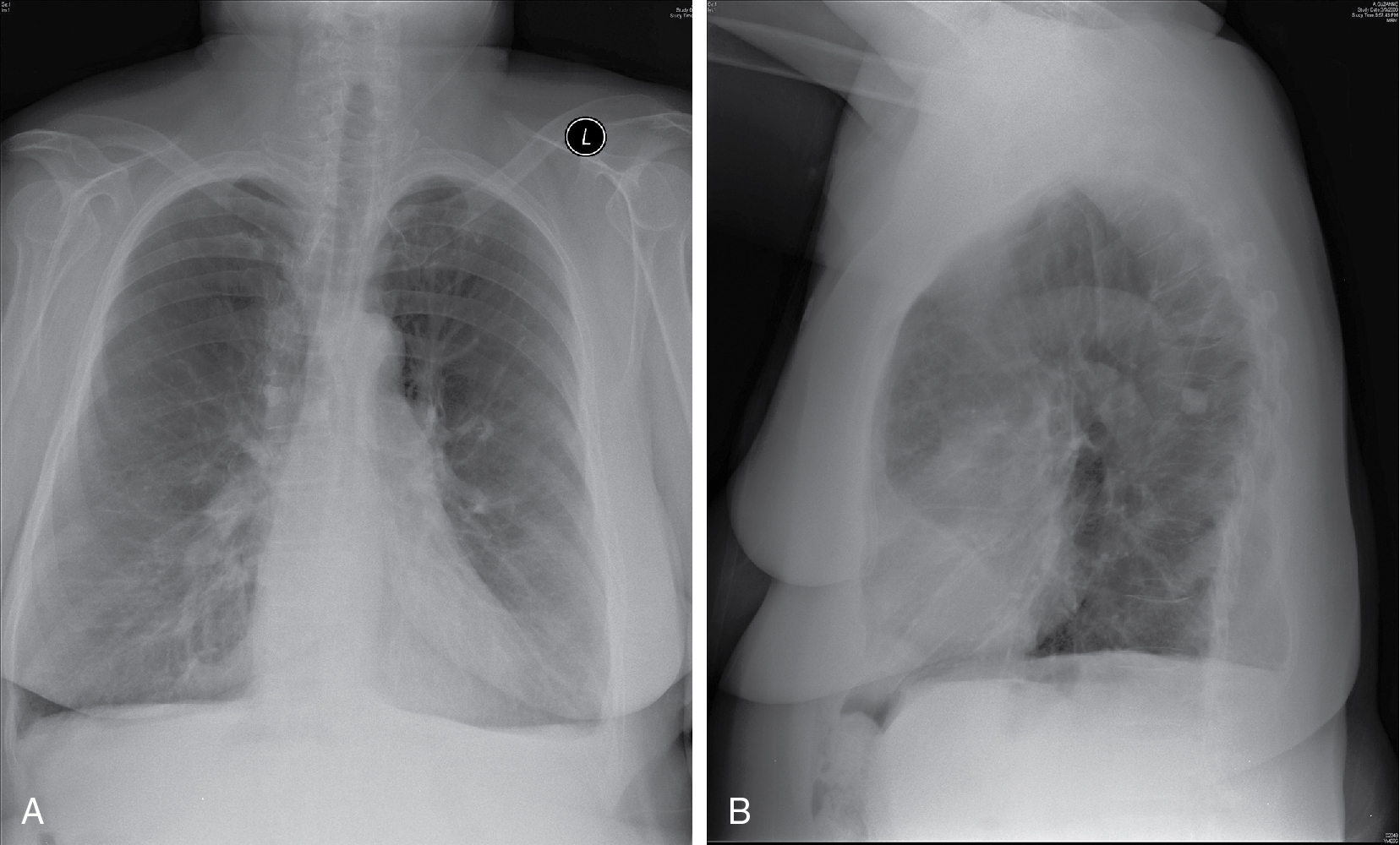
Hình 6.9 X-quang ngực của một bệnh nhân bị bệnh phổi tắc nghẽn mạn tính nặng. Phổi bị căng phồng và vòm hoành thấp và dẹt. A, Phim thẳng sau-trước. B, Phim nghiêng.
Khi tâm phế mạn phát triển ở bệnh nhân BPTNMT, có thể thấy các dấu hiệu tăng áp động mạch phổi. Chúng bao gồm sự giãn to của các động mạch phổi đoạn gần, sự thu nhỏ rõ rệt của các mạch máu đoạn xa, và tim to cho thấy phì đại hoặc giãn thất phải.
Chụp cắt lớp vi tính độ phân giải cao (HRCT) được công nhận là một phương pháp hình ảnh nhạy hơn so với chụp X-quang ngực thường quy để phát hiện khí phế thũng. Vì nó đắt tiền và hiếm khi thay đổi kế hoạch điều trị trong bối cảnh này, nó không nên được coi là một phần của đánh giá chẩn đoán thông thường đối với hầu hết bệnh nhân BPTNMT. Tuy nhiên, HRCT là một bước quan trọng trong việc xác định mức độ và sự phân bố của khí phế thũng ở những bệnh nhân đang được xem xét phẫu thuật giảm thể tích phổi.
Các phương pháp hỗ trợ sinh lý hữu ích nhất trong việc đánh giá bệnh nhân BPTNMT là xét nghiệm chức năng phổi và phân tích khí máu động mạch. Đo phế dung ký cho thấy tắc nghẽn luồng khí, với sự giảm FVC, , tỷ lệ /FVC, và MMFR. Đo lường thể tích phổi thường cho bằng chứng về bẫy khí, với sự tăng RV. Ở những bệnh nhân có độ giãn nở phổi tăng (tức là bệnh nhân bị khí phế thũng), TLC thường tăng cao. FRC đo được có thể tăng do tăng độ giãn nở (giảm lực đàn hồi) trong khí phế thũng hoặc do không đủ thời gian thở ra khi có tắc nghẽn luồng khí đáng kể, dẫn đến tăng thể tích phổi cuối thì thở ra. Việc có khí phế thũng hay không có thể được đánh giá gián tiếp bằng cách đo khả năng khuếch tán carbon monoxide. Ở bệnh nhân bị khí phế thũng, trong đó diện tích bề mặt trao đổi khí bị giảm, khả năng khuếch tán giảm. Trong bệnh lý đường thở đơn thuần (ví dụ, viêm phế quản mạn tính không có khí phế thũng), khả năng khuếch tán thường bình thường.
| Hộp: Xét nghiệm chức năng phổi trong BPTNMT cho thấy:
1. Tắc nghẽn luồng khí (giảm FVC, , FEV1/FVC, MMFR) 2. Bẫy khí và thường là căng phồng phổi (tăng RV, FRC, và thường là TLC) 3. Khả năng khuếch tán thường giảm trong khí phế thũng, bình thường trong viêm phế quản mạn tính |
Đo oxy xung thường được sử dụng để đánh giá bệnh nhân BPTNMT, vì oxy bổ sung là một phương pháp điều trị quan trọng ở bệnh nhân bị giảm oxy máu (xem phần sau). Nếu bác sĩ lâm sàng lo ngại về tình trạng ứ đọng hoặc độ chính xác của đo oxy xung, thì cần phải đo khí máu động mạch. Thông thường, bệnh nhân BPTNMT từ nhẹ đến trung bình có chênh lệch oxy phế nang-động mạch tăng và giảm oxy máu nhẹ. Trong bệnh nặng hơn, tình trạng giảm oxy máu trở nên tồi tệ hơn, và có thể phát triển tăng CO2 máu (ứ đọng ). Khi tăng mạn tính, thận điều chỉnh sự bài tiết bicarbonate để cố gắng bù trừ và đưa pH về mức bình thường. Trong các đợt kịch phát cấp tính của BPTNMT, tình trạng giảm oxy máu thường trở nên tồi tệ hơn và tình trạng ứ đọng trở nên rõ rệt hơn, do đó pH có thể giảm so với giá trị bù trừ ổn định.
| Hộp: Trong BPTNMT nặng, khí máu động mạch thường cho thấy giảm oxy máu có hoặc không có tăng CO2 máu. |
ĐIỀU TRỊ
Một số phương thức điều trị – được sử dụng riêng lẻ hoặc kết hợp – có sẵn cho bệnh nhân BPTNMT.
| Hộp: Các phương thức điều trị BPTNMT có sẵn như sau:
1. Thuốc giãn phế quản 2. Kháng sinh 3. Corticosteroid 4. Thuốc ức chế phosphodiesterase-4 5. Oxy bổ sung 6. Phục hồi chức năng bằng vận động 7. Vật lý trị liệu lồng ngực 8. Phẫu thuật (trường hợp chọn lọc) |
Mặc dù co thắt phế quản ở những bệnh nhân này ít hơn đáng kể so với bệnh nhân hen phế quản, thuốc giãn phế quản vẫn là một phần quan trọng trong điều trị của nhiều bệnh nhân BPTNMT. Các thuốc được sử dụng giống hệt với những thuốc đã thảo luận trong Chương 5, bao gồm các thuốc cường giao cảm (-agonists), thuốc kháng cholinergic, và methylxanthine. Các thuốc -agonist tác dụng ngắn dạng hít (ví dụ, albuterol), các thuốc kháng cholinergic tác dụng ngắn (ví dụ, ipratropium), hoặc cả hai thường được sử dụng khi cần thiết cho những bệnh nhân bị bệnh nhẹ chỉ cần điều trị không thường xuyên. Đối với những bệnh nhân bị bệnh nặng hơn cần điều trị thường xuyên, một thuốc -agonist tác dụng kéo dài (ví dụ, salmeterol, formoterol, arformoterol, indacaterol), một thuốc kháng cholinergic tác dụng kéo dài (kháng muscarinic) (ví dụ, tiotropium, aclidinium, umeclidinium), hoặc cả hai thường được sử dụng, mặc dù việc sử dụng thường xuyên các thuốc tác dụng ngắn là một lựa chọn thay thế. Theophylline, một methylxanthine, là một lựa chọn khác, nhưng lo ngại về các tác dụng phụ toàn thân đã khiến nó bị xếp vào vai trò thứ yếu so với các thuốc giãn phế quản dạng hít.
Việc sử dụng corticosteroid để điều trị BPTNMT phụ thuộc vào bối cảnh lâm sàng. Một đợt corticosteroid toàn thân từ 5 đến 14 ngày thường được chỉ định vào thời điểm có đợt kịch phát cấp tính, và hầu hết các nghiên cứu đều cho thấy lợi ích cải thiện chức năng phổi và giảm thất bại điều trị trong bối cảnh này. Mặt khác, chỉ một thiểu số bệnh nhân bị bệnh mạn tính, ổn định, nhưng nặng cho thấy chức năng phổi cải thiện sau một phác đồ corticosteroid uống. Corticosteroid dạng hít có ít tác dụng trong bối cảnh các đợt kịch phát cấp tính của BPTNMT. Tuy nhiên, nên xem xét thử nghiệm corticosteroid dạng hít ở những bệnh nhân BPTNMT từ trung bình đến nặng có các đợt kịch phát thường xuyên, vì một số bằng chứng cho thấy corticosteroid dạng hít có thể làm giảm tần suất hoặc mức độ nghiêm trọng của các đợt kịch phát. Ở những bệnh nhân có các đợt kịch phát thường xuyên, một lựa chọn thay thế cho liệu pháp kết hợp với một thuốc -agonist tác dụng kéo dài và một corticosteroid dạng hít là liệu pháp kết hợp với một thuốc -agonist tác dụng kéo dài và một thuốc kháng cholinergic (kháng muscarinic) tác dụng kéo dài, hoặc kết hợp cả ba nhóm thuốc.
Roflumilast, một thuốc ức chế phosphodiesterase-4, đại diện cho một nhóm thuốc tương đối mới cho BPTNMT. Các thuốc ức chế phosphodiesterase-4 làm giảm viêm và thúc đẩy sự giãn cơ trơn đường thở và giãn phế quản. Roflumilast thường được sử dụng ở những bệnh nhân bị bệnh nặng hơn và có các đợt kịch phát thường xuyên.
Bệnh nhân BPTNMT bị nhiễm trùng đường hô hấp cấp tính, hoặc bệnh nhân có đợt kịch phát bệnh mà không có yếu tố khởi phát rõ ràng, thường được điều trị bằng kháng sinh. Công dụng chính của kháng sinh là điều trị nhiễm khuẩn. Tuy nhiên, rất khó để xác định chắc chắn nguyên nhân do vi khuẩn, và nhiều đợt kịch phát được cho là không do nhiễm trùng hoặc do nhiễm virus đường hô hấp khởi phát. Trên thực tế, bệnh nhân thường được điều trị bằng kháng sinh khi có sự thay đổi về số lượng, màu sắc, và/hoặc độ đặc của đờm so với kiểu sản xuất đờm thông thường, bất kể có xác định được nhiễm khuẩn hay không. Trong số các mầm bệnh vi khuẩn tiềm tàng, những mầm bệnh thường bị liên quan nhất là Streptococcus pneumoniae, Haemophilus influenzae, và Moraxella catarrhalis. Do đó, việc lựa chọn kháng sinh theo kinh nghiệm nên bao phủ các sinh vật này. Một lĩnh vực đang được điều tra là việc sử dụng nồng độ protein phản ứng C và các dấu ấn sinh học khác để giúp định hướng việc sử dụng kháng sinh.
Gần đây hơn, cũng có sự quan tâm đến việc sử dụng mạn tính một kháng sinh macrolide (ví dụ, azithromycin) vì các đặc tính chống viêm cũng như kháng khuẩn của nó như một lựa chọn khác để giảm các đợt kịch phát ở bệnh nhân BPTNMT và có tiền sử các đợt kịch phát thường xuyên. Tuy nhiên, cũng như việc sử dụng mạn tính hầu hết mọi loại kháng sinh, có nguy cơ liên quan đến việc chọn lọc ra các chủng vi khuẩn kháng thuốc hơn.
Một liệu pháp quan trọng cho bệnh nhân bị giảm oxy máu đáng kể (tức là, độ bão hòa oxy động mạch toàn thân hoặc động mạch mm Hg) là cho thở oxy bổ sung. May mắn thay, của bệnh nhân giảm oxy máu bị BPTNMT thường đáp ứng khá tốt với một lượng tương đối nhỏ oxy bổ sung (khoảng 24%-28% ). Một lưu lượng thấp (1-2 L/phút) được cung cấp qua ống thông mũi là một phương pháp hiệu quả, được dung nạp tốt để đạt được các nồng độ hít vào này. Oxy đặc biệt quan trọng ở những bệnh nhân bị tăng áp động mạch phổi và những người bị đa hồng cầu thứ phát, vì mỗi biến chứng này phần lớn là do giảm oxy máu và đáp ứng với điều trị cho nó. Đối với những bệnh nhân giảm oxy máu đáng kể, như đã định nghĩa ở trên, việc cho thở oxy bổ sung đã được chứng minh là làm thay đổi diễn biến tự nhiên của bệnh và cải thiện sự sống còn lâu dài. Tuy nhiên, dường như không có lợi ích nào như vậy ở những bệnh nhân bị giảm oxy máu ít nghiêm trọng hơn hoặc từng cơn.
Mục tiêu của liệu pháp là đưa vào khoảng mà hemoglobin gần như bão hòa hoàn toàn (tức là, 60-65 mm Hg). Lý tưởng nhất, độ bão hòa nên được duy trì tốt liên tục trong suốt cả ngày và đêm. Ở một số bệnh nhân BPTNMT không bị giảm oxy máu đáng kể vào ban ngày, sự sụt giảm đáng kể và độ bão hòa có thể xảy ra vào ban đêm. Ở những bệnh nhân này, oxy vào ban đêm về mặt lý thuyết có thể có lợi, mặc dù điều này chưa được chứng minh. Ngoài liệu pháp oxy, cũng có một vai trò mới nổi của thông khí áp lực dương không xâm lấn vào ban đêm ở một số bệnh nhân bị BPTNMT nặng, đặc biệt nếu có tăng CO2 máu.
Đối với những bệnh nhân có dịch tiết đường thở gây ra các triệu chứng đáng kể, vật lý trị liệu lồng ngực và dẫn lưu tư thế đôi khi được sử dụng để giúp huy động và làm sạch dịch tiết. Các kỹ thuật này sử dụng vỗ lồng ngực để làm lỏng dịch tiết và gây ho, sau đó thay đổi tư thế để cho phép trọng lực hỗ trợ dẫn lưu dịch tiết. Các thiết bị làm sạch chất nhầy cầm tay cũng có sẵn. Để sử dụng các thiết bị này, bệnh nhân thở ra vào máy, máy sẽ áp dụng áp lực dương cuối kỳ thở ra dao động, cho phép làm sạch dịch tiết hiệu quả hơn. Tuy nhiên, tính hữu ích chung của vật lý trị liệu lồng ngực, dẫn lưu tư thế, hoặc các thiết bị làm sạch chất nhầy không được chấp nhận rộng rãi vì các nghiên cứu về kết quả chưa chứng minh rõ ràng lợi ích của chúng.
Ở một phân nhóm nhỏ bệnh nhân BPTNMT bị thiếu hụt -antitrypsin, có liệu pháp dưới dạng cô đặc -antitrypsin tiêm tĩnh mạch, được điều chế từ huyết tương người gộp lại. Cơ sở lý luận cho liệu pháp này là để thay thế chất ức chế protease bị thiếu hụt và cố gắng ức chế hoặc ngăn chặn sự phá hủy mô phế nang không kiểm soát do proteolytic. Mặc dù truyền tĩnh mạch -antitrypsin đã được chứng minh là làm tăng nồng độ của antiprotease này trong dịch lót biểu mô phế nang, nhưng liệu liệu pháp thay thế như vậy có làm thay đổi sự suy giảm chức năng phổi tăng tốc hay không vẫn chưa được biết một cách chắc chắn.
Ở những bệnh nhân bị suy giảm khả năng gắng sức thứ phát sau BPTNMT, một chương trình phục hồi chức năng tập trung vào giáo dục và một chế độ tập luyện thường rất có lợi. Hầu hết bệnh nhân tham gia một chương trình như vậy đều báo cáo cảm giác khỏe mạnh hơn đồng thời với việc cải thiện khả năng gắng sức. Giáo dục và hỗ trợ cai thuốc lá là những phần cực kỳ quan trọng của bất kỳ chương trình điều trị toàn diện nào. Hỗ trợ dược lý để giảm bớt tác động của hội chứng cai nicotine – liệu pháp thay thế nicotine, bupropion, hoặc varenicline – thường là một thành phần có giá trị của các nỗ lực cai thuốc lá. Tiêm phòng cúm, SARS-CoV-2, và phế cầu được chỉ định cho tất cả bệnh nhân như một chiến lược phòng ngừa và một thành phần của phác đồ điều trị tổng thể.
Hai phương pháp phẫu thuật đã được sử dụng cho những bệnh nhân bị BPTNMT nặng vẫn còn triệu chứng rõ rệt mặc dù đã điều trị tối ưu. Một phương pháp, phẫu thuật giảm thể tích phổi, ban đầu có vẻ phản trực giác vì nó bao gồm việc loại bỏ các phần của cả hai lá phổi khỏi những bệnh nhân có dự trữ phổi ở mức giới hạn. Tuy nhiên, có hai cơ sở lý luận sinh lý bệnh thú vị làm nền tảng cho phương pháp này. Đầu tiên, việc loại bỏ một số mô phổi làm giảm thể tích tổng thể trong lồng ngực, cho phép cơ hoành bị dẹt và co ngắn trở lại vị trí bình thường và tiếp tục cấu hình cong thông thường của nó. Một cơ hoành bị dẹt, co ngắn là một cơ hô hấp kém hiệu quả, và những thay đổi về vị trí và hình dạng của nó sau phẫu thuật tạo điều kiện cho hiệu quả của nó trong quá trình hít vào. Thứ hai, khi các vùng phổi bị bệnh nhiều nhất được loại bỏ một cách chọn lọc (tức là, các vùng có lực đàn hồi ít nhất), lực đàn hồi tổng thể của phổi sẽ cải thiện. Lực đàn hồi của phổi là một yếu tố quyết định quan trọng của luồng khí thở ra và sự xẹp đường thở, và việc cải thiện lực đàn hồi có lợi ích thứ cấp đối với sự thông thoáng của đường thở và luồng khí thở ra. Mặc dù giảm thể tích phổi, hoặc qua phẫu thuật hoặc qua việc cấy van nội phế quản qua nội soi phế quản, là một phương pháp mới lạ và có khả năng hấp dẫn, nó dường như chỉ có lợi ở những bệnh nhân được lựa chọn kỹ lưỡng. Các khía cạnh quan trọng của việc lựa chọn bệnh nhân bao gồm mức độ nghiêm trọng của bệnh và sự phân bố giải phẫu của các thay đổi khí phế thũng.
Phương pháp phẫu thuật khác để điều trị BPTNMT giai đoạn cuối là ghép phổi. Tuy nhiên, phương pháp này bị hạn chế đối với số lượng lớn cá nhân do nguồn lực cần thiết, sự thiếu hụt cơ quan hiến tặng, tuổi tác của hầu hết bệnh nhân BPTNMT, và sự hiện diện của các bệnh đi kèm không đủ điều kiện. Những bệnh nhân bị khí phế thũng do thiếu hụt -antitrypsin, trong đó bệnh xảy ra ở độ tuổi sớm, có thể là một phân nhóm đặc biệt thích hợp để xem xét ghép phổi.
Khi suy hô hấp cấp tính xảy ra như một phần của BPTNMT, có thể cần thông khí cơ học để hỗ trợ trao đổi khí và duy trì các giá trị khí máu động mạch chấp nhận được. Sự hỗ trợ thông khí như vậy với áp lực dương ngắt quãng có thể được cung cấp qua mặt nạ (thông khí áp lực dương không xâm lấn) hoặc ống nội khí quản, nhưng phương pháp không xâm lấn đầu tiên được ưa chuộng hơn. Thông tin chi tiết hơn về điều trị suy hô hấp cấp tính chồng lên bệnh mạn tính dạng tắc nghẽn được đề cập trong Chương 28. Thông khí cơ học được thảo luận trong Chương 30.
TÀI LIỆU THAM KHẢO ĐỀ XUẤT
Tổng quan
Celli, B. R., & Wedzicha, J. A. (2019). Update on clinical aspects of chronic obstructive pulmonary disease. New England Journal of Medicine, 381, 1257–1266.
Decramer, M., Janssens, W., & Miravitlles, M. (2012). Chronic obstructive pulmonary disease. Lancet, 379, 1341–1351.
Global Initiative for Chronic Obstructive Lung Disease. (2023). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease [report]. https://goldcopd.org/2023-gold-report-2/.
Miravitlles, M., Dirksen, A., Ferrarotti, I., Koblizek, V., Lange, P., Mahadeva, R., et al. (2017). European Respiratory Society statement: Diagnosis and treatment of pulmonary disease in α1-antitrypsin deficiency. European Respiratory Journal, 50, 1700610.
Riley, C. M., & Sciurba, F. C. (2019). Diagnosis and outpatient management of chronic obstructive pulmonary disease: A review. JAMA, 321, 786–797.
Singh, D., Agusti, A., Anzueto, A., Barnes, P. J., Bourbeau, J., Celli, B. R., et al. (2019). Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease: The GOLD science committee report 2019. European Respiratory Journal, 53, 1900164.
Strnad, P., McElvaney, N. G., & Lomas, D. A. (2020). Alpha1-antitrypsin deficiency. New England Journal of Medicine, 382, 1443–1455.
Vogelmeier, C. F., Criner, G. J., Martinez, F. J., Anzueto, A., Barnes, P. J., Bourbeau, J., et al. (2017). Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 report. GOLD executive summary. American Journal of Respiratory and Critical Care Medicine, 195, 557–582.
Nguyên nhân và Cơ chế bệnh sinh
Agustí, A., & Hogg, J. C. (2019). Update on the pathogenesis of chronic obstructive pulmonary disease. New England Journal of Medicine, 381, 1248–1256.
Barnes, P. J. (2014). Cellular and molecular mechanisms of chronic obstructive pulmonary disease. Clinics in Chest Medicine, 35, 71–86.
Brusselle, G. G., Joos, G. F., & Bracke, K. R. (2011). New insights into the immunology of chronic obstructive pulmonary disease. Lancet, 378, 1015–1026.
Cosio, M. G., Saetta, M., & Agusti, A. (2009). Immunologic aspects of chronic obstructive pulmonary disease. New England Journal of Medicine, 360, 2445–2454.
Criner, G. J., Cordova, F., Sternberg, A. L., & Martinez, F. J. (2011). The National Emphysema Treatment Trial (NETT): Part I: Lessons learned about emphysema. American Journal of Respiratory and Critical Care Medicine, 184, 763–770.
Djukanovic, R., & Gadola, S. D. (2008). Virus infection, asthma, and chronic obstructive pulmonary disease. New England Journal of Medicine, 359, 2062–2064.
Eisner, M. D., Anthonisen, N., Coultas, D., Kuenzli, N., Perez-Padilla, R., Postma, D., et al. (2010). An official American Thoracic Society public policy statement: Novel risk factors and the global burden of chronic obstructive pulmonary disease. American Journal of Respiratory and Critical Care Medicine, 182, 693–718.
Hogg, J. C., Paré, P. D., & Hackett, T. L. (2017). The contribution of small airway obstruction to the pathogenesis of chronic obstructive pulmonary disease. Physiological Reviews, 97, 529–552.
Martin, R. J., Bel, E. H., Pavord, I. D., Price, D., & Reddel, H. K. (2019). Defining severe obstructive lung disease in the biologic era: An endotype-based approach. European Respiratory Journal, 54, 1900108.
Maselli, D. J., Bhatt, S. P., Anzueto, A., Bowler, R. P., DeMeo, D. L., Diaz, A. A., et al. (2019). Clinical epidemiology of COPD: Insights from 10 years of the COPDGene Study. Chest, 156, 228–238.
Postma, D. S., Bush, A., & van den Berge, M. (2015). Risk factors and early origins of chronic obstructive pulmonary disease. Lancet, 385, 899–909.
Sethi, S., & Murphy, T. F. (2008). Infection in the pathogenesis and course of chronic obstructive pulmonary disease. New England Journal of Medicine, 359, 2355–2365.
Smith BM, Kirby M, Hoffman EA, Kronmal, R. A., Aaron, S. D., Allen, N. B., et al. (2020). Association of dysanapsis with chronic obstructive pulmonary disease among older adults. JAMA, 323, 2268–2280.
Smolonska, J., Wijmenga, C., Postma, D. S., & Boezen, H. M. (2009). Meta-analyses on suspected chronic obstructive pulmonary disease genes: A summary of 20 years’ research. American Journal of Respiratory and Critical Care Medicine, 180, 618–631.
Tuder, R. M., & Petrache, I. (2012). Pathogenesis of chronic obstructive pulmonary disease. Journal of Clinical Investigation, 122, 2749–2755.
Đặc điểm Lâm sàng
van den Berge, M., Ten Hacken, N. H. T., Cohen, J., Douma, W. R., & Postma, D. S. (2011). Small airway disease in asthma and COPD: Clinical implications. Chest, 139, 412–423.
Criner, G. J., Bourbeau, J., Diekemper, R. L., Ouellette, D. R., Goodridge, D., Hernandez, P., et al. (2015). Executive summary. Prevention of acute exacerbation of COPD: American College of Chest Physicians and Canadian Thoracic Society guideline. Chest, 147, 883–893.
Labaki, W. W., Martinez, C. H., Martinez, F. J., Galbán, C. J., Ross, B. D., Washko, G. R., et al. (2017). The role of chest computed tomography in the evaluation and management of the patient with chronic obstructive pulmonary disease. American Journal of Respiratory and Critical Care Medicine, 196, 1372–1379.
Nussbaumer-Ochsner, Y., & Rabe, K. F. (2011). Systemic manifestations of COPD. Chest, 139, 165–173.
Peinado, V. I., Pizarro, S., & Barberà, J. A. (2008). Pulmonary vascular involvement in COPD. Chest, 134, 808–814.
Postma, D. S., & Rabe, K. F. (2015). The asthma-COPD overlap syndrome. New England Journal of Medicine, 373, 1241–1249.
Press, V. G., Cifu, A. S., & White, S. R. (2017). Screening for chronic obstructive pulmonary disease. JAMA, 318, 1702–1703.
US Preventive Services Task Force. (2022). Screening for chronic obstructive pulmonary disease. US Preventive Services Task Force reaffirmation recommendation statement. JAMA, 327, 1806–1811.
Điều trị
Beghè, B., Rabe, K. F., & Fabbri, L. M. (2013). Phosphodiesterase-4 inhibitor therapy for lung diseases. American Journal of Respiratory and Critical Care Medicine, 188, 271–278.
Butler, C. C., Gillespie, D., White, P., Bates, J., Lowe, R., Thomas-Jones, E., et al. (2019). C-reactive protein testing to guide antibiotic prescribing for COPD exacerbations. New England Journal of Medicine, 381, 111–120.
Casaburi, R., & ZuWallack, R. (2009). Pulmonary rehabilitation for management of chronic obstructive pulmonary disease. New England Journal of Medicine, 360, 1329–1335.
Cazzola, M., Rogliani, P., Calzetta, L., & Matera, M. G. (2018). Triple therapy versus single and dual long-acting bronchodilator therapy in COPD: A systematic review and meta-analysis. European Respiratory Journal, 52, 1801586.
Celli, B. R. (2018). Pharmacological therapy of COPD: Reasons for optimism. Chest, 154, 1404–1415.
Criner, G. J. (2011). Alternatives to lung transplantation: Lung volume reduction for COPD. Clinics in Chest Medicine, 32, 379–397.
Dobler, C. C., Morrow, A. S., Beuschel, B., Farah, M. H., Majzoub, A. M., Wilson, M. E., et al. (2020). Pharmacologic therapies in patients with exacerbation of chronic obstructive pulmonary disease: A systematic review with meta-analysis. Annals of Internal Medicine, 172, 413–422.
Horita, N., Nagashima, A., & Kaneko, T. (2017). Long-acting β-agonists (LABA) combined with long-acting muscarinic antagonists or LABA combined with inhaled corticosteroids for patients with stable COPD. JAMA, 318, 1274–1275.
Khor, Y. H., Dudley, K. A., Herman, D., Jacobs, S. S., Lederer, D. J., Krishnan, J. A., et al. (2021). Summary for clinicians: Clinical practice guideline on home oxygen therapy for adults with chronic lung disease. Annals of the American Thoracic Society, 18, 1444–1449.
Lacasse, Y., Sériès, F., Corbeil, F., Baltzan, M., Paradis, B., Simão, P., et al. (2020). Randomized trial of nocturnal oxygen in chronic obstructive pulmonary disease. New England Journal of Medicine, 383, 1129–1138.
Leone, F. T., Zhang, Y., Evers-Casey, S., Evins, A. E., Eakin, M. N., Fathi, J., et al. (2020). Initiating pharmacologic treatment in tobacco-dependent adults. An official American Thoracic Society clinical practice guideline. American Journal of Respiratory and Critical Care Medicine, 202, e5–e31.
Leuppi, J. D., Schuetz, P., Bingisser, R., Bodmer, M., Briel, M., Drescher, T., et al. (2013). Short-term vs conventional glucocorticoid therapy in acute exacerbations of chronic obstructive pulmonary disease: The REDUCE randomized clinical trial. JAMA, 309, 2223–2231.
Lipson, D. A., Barnhart, F., Brealey, N., Brooks, J., Criner, G. J., Day, N. C., et al. (2018). Once-daily single-inhaler triple versus dual therapy in patients with COPD. New England Journal of Medicine, 378, 1671–1680.
Mackay, A. J., & Hurst, J. R. (2012). COPD exacerbations: Causes, prevention, and treatment. Medical Clinics of North America, 96, 789–809.
Mammen, M. J., Lloyd, D. R., Kumar, S., Ahmed, A. S., Pai, V., Kunadharaju, R., et al. (2020). Triple therapy versus dual or monotherapy with long-acting bronchodilators for chronic obstructive pulmonary disease. A systematic review and meta-analysis. Annals of the American Thoracic Society, 17, 1308–1318.
Miravitlles, M., & Anzueto, A. (2013). Antibiotics for acute and chronic respiratory infection in patients with chronic obstructive pulmonary disease. American Journal of Respiratory and Critical Care Medicine, 188, 1052–1057.
Nici, L., Mammen, M. J., Charbek, E., Alexander, P. E., Au, D. H., Boyd, C. M., et al. (2020). Pharmacologic management of chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice guideline. American Journal of Respiratory and Critical Care Medicine, 201, e56–e69.
Qaseem, A., Wilt, T. J., Weinberger, S. E., Hanania, N. A., Criner, G., van der Molen, T., et al. (2011). Diagnosis and management of stable chronic obstructive pulmonary disease: A clinical practice guideline update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society. Annals of Internal Medicine, 155, 179–191.
Ries, A. L., Bauldoff, G. S., Carlin, B. W., Casaburi, R., Emery, C. F., Mahler, D. A., et al. (2007). Pulmonary rehabilitation: Joint ACCP/AACVPR evidence-based clinical practice guidelines. Chest, 131, 4S–42S.
Shah, P. L., Herth, F. J., van Geffen, W. H., Deslee, G., & Slebos, D. J. (2017). Lung volume reduction for emphysema. Lancet. Respiratory Medicine, 5, 147–156.
Singh, D., Roche, N., Halpin, D., Agusti, A., Wedzicha, J. A., & Martinez, F. J. (2016). Current controversies in the pharmacological treatment of chronic obstructive pulmonary disease. American Journal of Respiratory and Critical Care Medicine, 194, 541–549.
Stoller, J. K., Panos, R. J., Krachman, S., Doherty, D. E., & Make, B. (2010). Oxygen therapy for patients with COPD: Current evidence and the long-term oxygen treatment trial. Chest, 138, 179–187.
Wedzicha, J. A. (2011). Choice of bronchodilator therapy for patients with COPD. New England Journal of Medicine, 364, 1167–1168.
Wedzicha, J. A., Banerji, D., Chapman, K. R., Vestbo, J., Roche, N., Ayers, R. T., et al. (2016). Indacaterol-glycopyrronium versus salmeterol-fluticasone for COPD. New England Journal of Medicine, 374, 2222–2234.
Wenzel, R. P., Fowler, A. A., III., & Edmond, M. B. (2012). Antibiotic prevention of acute exacerbations of COPD. New England Journal of Medicine, 367, 340–347.
Wilson, M. E., Dobler, C. C., Morrow, A. S., Beuschel, B., Alsawas, M., Benkhadra, R., et al. (2020). Association of home noninvasive positive pressure ventilation with clinical outcomes in chronic obstructive pulmonary disease: A systematic review and meta-analysis. JAMA, 323, 455–465.
Woodruff, P. G., Agusti, A., Roche, N., Singh, D., & Martinez, F. J. (2015). Current concepts in targeting chronic obstructive pulmonary disease pharmacotherapy: Making progress towards personalised management. Lancet, 385, 1789–1798.
Zhou, Y., Zhong, N., Li, X., Chen, S., Zheng, J., Zhao, D., et al. (2017). Tiotropium in early-stage chronic obstructive pulmonary disease. New England Journal of Medicine, 377, 923–935.
Bảng chú giải thuật ngữ y học Anh – Việt. Chương 6
| STT | Thuật ngữ tiếng Anh | Phiên âm | Nghĩa tiếng Việt |
|---|---|---|---|
| 1 | Chronic obstructive pulmonary disease (COPD) | /ˈkrɒnɪk əbˈstrʌktɪv ˈpʌlmənəri dɪˈziːz/ | Bệnh phổi tắc nghẽn mạn tính |
| 2 | Chronic bronchitis | /ˈkrɒnɪk brɒŋˈkaɪtɪs/ | Viêm phế quản mạn tính |
| 3 | Emphysema | /ˌemfɪˈsiːmə/ | Khí phế thũng |
| 4 | Pathophysiology | /ˌpæθoʊˌfɪziˈɒlədʒi/ | Sinh lý bệnh học |
| 5 | Airflow obstruction | /ˈeəfləʊ əbˈstrʌkʃən/ | Tắc nghẽn luồng khí |
| 6 | Airways | /ˈeəweɪz/ | Đường thở |
| 7 | Lung parenchyma | /lʌŋ pəˈreŋkɪmə/ | Nhu mô phổi |
| 8 | Asthma | /ˈæsmə/ | Hen phế quản |
| 9 | Exacerbations | /ɪɡˌzæsəˈbeɪʃənz/ | Các đợt cấp tính |
| 10 | Bronchial hyperreactivity | /ˈbrɒŋkiəl ˌhaɪpərriækˈtɪvɪti/ | Tăng phản ứng phế quản |
| 11 | Asthma-COPD overlap syndrome | /ˈæsmə siːoʊpiːˈdiː ˈoʊvərlæp ˈsɪndroʊm/ | Hội chứng chồng lấp hen phế quản-COPD |
| 12 | Productive cough | /prəˈdʌktɪv kɔːf/ | Ho có đờm |
| 13 | Sputum production | /ˈspjuːtəm prəˈdʌkʃən/ | Khạc đờm |
| 14 | Terminal bronchiole | /ˈtɜːrmɪnl ˈbrɒŋkioʊl/ | Phế quản tận cùng |
| 15 | Respiratory bronchioles | /rɪˈspɪrətɔːri ˈbrɒŋkioʊlz/ | Phế quản hô hấp |
| 16 | Alveolar ducts | /ælˈviːələr dʌkts/ | Ống phế nang |
| 17 | Alveolar sacs | /ælˈviːələr sæks/ | Túi phế nang |
| 18 | Acinus | /ˈæsɪnəs/ | Tiểu thùy (đơn vị cấu trúc phổi) |
| 19 | Smoking | /ˈsmoʊkɪŋ/ | Hút thuốc |
| 20 | Environmental pollution | /ɪnˌvaɪrənˈmentl pəˈluːʃən/ | Ô nhiễm môi trường |
| 21 | Indoor pollution | /ˈɪndɔːr pəˈluːʃən/ | Ô nhiễm không khí trong nhà |
| 22 | Infection | /ɪnˈfekʃən/ | Nhiễm trùng |
| 23 | Genetic factors | /dʒəˈnetɪk ˈfæktərz/ | Yếu tố di truyền |
| 24 | α1-antitrypsin deficiency | /ˈælfə wʌn æntiˈtrɪpsɪn dɪˈfɪʃənsi/ | Thiếu hụt α1-antitrypsin |
| 25 | Secondhand smoke | /ˈsekəndˌhænd smoʊk/ | Hút thuốc thụ động |
| 26 | Bronchi | /ˈbrɒŋkaɪ/ | Phế quản |
| 27 | Bronchioles | /ˈbrɒŋkioʊlz/ | Tiểu phế quản |
| 28 | Mucus-secreting apparatus | /ˈmjuːkəs sɪˈkriːtɪŋ ˌæpəˈreɪtəs/ | Bộ máy tiết nhầy |
| 29 | Bronchial mucous glands | /ˈbrɒŋkiəl ˈmjuːkəs ɡlændz/ | Tuyến nhầy phế quản |
| 30 | Hypertrophy | /haɪˈpɜːrtrəfi/ | Phì đại |
| 31 | Hyperplasia | /ˌhaɪpərˈpleɪziə/ | Tăng sinh |
| 32 | Inflammatory cells | /ɪnˈflæməˌtɔːri selz/ | Tế bào viêm |
| 33 | Macrophages | /ˈmækroʊˌfeɪdʒəz/ | Đại thực bào |
| 34 | Neutrophils | /ˈnuːtrəfɪlz/ | Bạch cầu trung tính |
| 35 | Cytotoxic T lymphocytes | /ˌsaɪtoʊˈtɒksɪk tiː ˈlɪmfəˌsaɪts/ | Tế bào T độc |
| 36 | CD8+ | /siː diː eɪt ˈpɒzətɪv/ | CD8 dương tính |
| 37 | Leukotriene B4 | /ˌluːkəˈtraɪiːn biː fɔːr/ | Leukotriene B4 (chất trung gian viêm) |
| 38 | Interleukin-8 | /ˌɪntərˈluːkɪn eɪt/ | Interleukin-8 (chất trung gian viêm) |
| 39 | Tumor necrosis factor-α | /ˈtuːmər nəˈkroʊsɪs ˈfæktər ˈælfə/ | Yếu tố hoại tử khối u-α |
| 40 | Oxidative stress | /ˈɒksɪˌdeɪtɪv stres/ | Tổn thương do oxy hóa |
| 41 | Reactive oxygen species | /riˈæktɪv ˈɒksɪdʒən ˈspiːʃiːz/ | Gốc oxy phản ứng |
| 42 | Cilia | /ˈsɪliə/ | Lông chuyển |
| 43 | Mucociliary clearance | /ˌmjuːkoʊˈsɪliˌeri ˈklɪrəns/ | Thanh thải nhầy-lông chuyển |
| 44 | Small airways | /smɔːl ˈeəweɪz/ | Đường thở nhỏ |
| 45 | Bronchiolar narrowing | /ˌbrɒŋkiˈoʊlər ˈnæroʊɪŋ/ | Hẹp tiểu phế quản |
| 46 | Fibrosis | /faɪˈbroʊsɪs/ | Xơ hóa |
| 47 | Protease-antiprotease hypothesis | /ˈproʊtiˌeɪs ˌæntiˈproʊtiˌeɪs haɪˈpɒθəsɪs/ | Giả thuyết protease-antiprotease |
| 48 | Proteolytic enzymes | /ˌproʊtiəˈlɪtɪk ˈenzaɪmz/ | Enzyme protease |
| 49 | Connective tissue matrix | /kəˈnektɪv ˈtɪʃuː ˈmeɪtrɪks/ | Ma trận ngoại bào |
| 50 | Alveolar walls | /ælˈviːələr wɔːlz/ | Thành phế nang |
| 51 | Elastin | /ɪˈlæstɪn/ | Elastin (protein đàn hồi) |
| 52 | Elastase | /ɪˈlæsteɪs/ | Elastase (enzyme phân giải elastin) |
| 53 | Serine proteases | /ˈsɪriːn ˈproʊtiˌeɪsəz/ | Serine protease |
| 54 | Neutrophil elastase | /ˈnuːtrəfɪl ɪˈlæsteɪs/ | Elastase bạch cầu trung tính |
| 55 | α1-antiprotease | /ˈælfə wʌn ˌæntiˈproʊtiˌeɪs/ | α1-antiprotease |
| 56 | α1-protease inhibitor | /ˈælfə wʌn ˈproʊtiˌeɪs ɪnˈhɪbɪtər/ | Chất ức chế α1-protease |
| 57 | Matrix metalloproteinases | /ˈmeɪtrɪks ˌmetəloʊˈproʊtiˌeɪsəz/ | Matrix metalloproteinase |
| 58 | Tissue inhibitors of matrix metalloproteinases (TIMP) | /ˈtɪʃuː ɪnˈhɪbɪtərz/ | Các chất ức chế matrix metalloproteinase của mô |
| 59 | Occupational exposure | /ˌɒkjəˈpeɪʃənl ɪkˈspoʊʒər/ | Tiếp xúc nghề nghiệp |
| 60 | Organic antigens | /ɔːrˈɡænɪk ˈæntɪdʒənz/ | Kháng nguyên hữu cơ |
| 61 | Biomass fuels | /ˈbaɪoʊˌmæs ˈfjuːəlz/ | Nhiên liệu sinh khối |
| 62 | Viral infection | /ˈvaɪrəl ɪnˈfekʃən/ | Nhiễm virus |
| 63 | Bacterial infection | /bækˈtɪriəl ɪnˈfekʃən/ | Nhiễm khuẩn |
| 64 | Superinfection | /ˌsuːpərɪnˈfekʃən/ | Nhiễm trùng chồng lấp |
| 65 | Glycoprotein | /ˌɡlaɪkoʊˈproʊtiːn/ | Glycoprotein |
| 66 | Serine protease inhibitor (serpin) | /ˈsɪriːn ˈproʊtiˌeɪs ɪnˈhɪbɪtər/ | Chất ức chế serine protease |
| 67 | SERPINA1 gene | /ˈsɜːrpɪn eɪ wʌn dʒiːn/ | Gen SERPINA1 |
| 68 | Alleles | /əˈliːlz/ | Allele (biến thể gen) |
| 69 | M allele | /em əˈliːl/ | Allele M |
| 70 | Z allele | /ziː əˈliːl/ | Allele Z |
| 71 | MM genotype | /em em ˈdʒiːnoʊˌtaɪp/ | Kiểu gen MM |
| 72 | ZZ genotype | /ziː ziː ˈdʒiːnoʊˌtaɪp/ | Kiểu gen ZZ |
| 73 | MZ genotype | /em ziː ˈdʒiːnoʊˌtaɪp/ | Kiểu gen MZ |
| 74 | Homozygous | /ˌhoʊməˈzaɪɡəs/ | Đồng hợp tử |
| 75 | Heterozygotes | /ˌhetərəˈzaɪɡoʊts/ | Dị hợp tử |
| 76 | Bronchial hyperresponsiveness | /ˈbrɒŋkiəl ˌhaɪpərrɪˈspɒnsɪvnəs/ | Tăng phản ứng phế quản |
| 77 | Goblet cells | /ˈɡɒblət selz/ | Tế bào cốc |
| 78 | Reid index | /riːd ˈɪndeks/ | Chỉ số Reid |
| 79 | Cellular infiltration | /ˈseljələr ˌɪnfɪlˈtreɪʃən/ | Xâm nhập tế bào |
| 80 | Intraluminal mucus | /ˌɪntrəˈluːmɪnl ˈmjuːkəs/ | Nhầy trong lòng |
| 81 | Luminal diameter | /ˈluːmɪnl daɪˈæmɪtər/ | Đường kính lòng |
| 82 | Panacinar emphysema | /ˌpænəˈsaɪnər ˌemfɪˈsiːmə/ | Khí phế thũng toàn tiểu thùy |
| 83 | Panlobular emphysema | /ˌpænˈlɒbjələr ˌemfɪˈsiːmə/ | Khí phế thũng toàn tiểu thùy |
| 84 | Centriacinar emphysema | /ˌsentrɪˈæsɪnər ˌemfɪˈsiːmə/ | Khí phế thũng trung tâm tiểu thùy |
| 85 | Centrilobular emphysema | /ˌsentrɪˈlɒbjələr ˌemfɪˈsiːmə/ | Khí phế thũng trung tâm tiểu thùy |
| 86 | Airways resistance | /ˈeəweɪz rɪˈzɪstəns/ | Sức cản đường thở |
| 87 | Cross-sectional area | /krɒs ˈsekʃənl ˈeəriə/ | Diện tích mặt cắt ngang |
| 88 | Intraluminal secretions | /ˌɪntrəˈluːmɪnl sɪˈkriːʃənz/ | Tiết dịch trong lòng |
| 89 | Bronchospasm | /ˈbrɒŋkoʊˌspæzəm/ | Co thắt phế quản |
| 90 | Edema | /ɪˈdiːmə/ | Phù |
| 91 | Forced expiratory volume in 1 second (FEV1) | /fɔːrst ɪkˈspaɪrətɔːri ˈvɒljuːm/ | Thể tích thở ra gắng sức trong 1 giây |
| 92 | Forced vital capacity (FVC) | /fɔːrst ˈvaɪtl kəˈpæsəti/ | Dung tích sống gắng sức |
| 93 | Maximal mid-expiratory flow rate (MMFR) | /ˈmæksɪməl mɪd ɪkˈspaɪrətɔːri floʊ reɪt/ | Tốc độ thở ra giữa tối đa |
| 94 | Total lung capacity (TLC) | /ˈtoʊtl lʌŋ kəˈpæsəti/ | Tổng dung tích phổi |
| 95 | Functional residual capacity (FRC) | /ˈfʌŋkʃənl rɪˈzɪdjuəl kəˈpæsəti/ | Dung tích cặn chức năng |
| 96 | Residual volume (RV) | /rɪˈzɪdjuəl ˈvɒljuːm/ | Thể tích dư |
| 97 | Elastic recoil | /ɪˈlæstɪk ˈriːkɔɪl/ | Độ đàn hồi |
| 98 | Inspiratory muscles | /ɪnˈspaɪrətɔːri ˈmʌsəlz/ | Cơ hít vào |
| 99 | Expiratory muscles | /ɪkˈspaɪrətɔːri ˈmʌsəlz/ | Cơ thở ra |
| 100 | Airway closure | /ˈeəweɪ ˈkloʊʒər/ | Đóng đường thở |
| 101 | Air trapping | /eər ˈtræpɪŋ/ | Ứ khí |
| 102 | Driving pressure | /ˈdraɪvɪŋ ˈpreʃər/ | Áp lực đẩy |
| 103 | Radial traction | /ˈreɪdiəl ˈtrækʃən/ | Lực kéo hướng tâm |
| 104 | Airway collapse | /ˈeəweɪ kəˈlæps/ | Xẹp đường thở |
| 105 | Compliance curve | /kəmˈplaɪəns kɜːrv/ | Đường cong độ giãn nở |
| 106 | Transpulmonary pressure | /ˌtrænspʌlˈmoʊnəri ˈpreʃər/ | Áp lực qua phổi |
| 107 | Ventilation-perfusion mismatch | /ˌventɪˈleɪʃən pərˈfjuːʒən ˈmɪsmætʃ/ | Mất cân bằng thông khí-tưới máu |
| 108 | V̇/Q̇ mismatch | /viː dɒt kjuː dɒt ˈmɪsmætʃ/ | Mất cân bằng V̇/Q̇ |
| 109 | Arterial hypoxemia | /ɑːrˈtɪriəl ˌhaɪpɒkˈsiːmiə/ | Giảm oxy máu động mạch |
| 110 | Carbon dioxide elimination | /ˈkɑːrbən daɪˈɒksaɪd ɪˌlɪməˈneɪʃən/ | Thải carbon dioxide |
| 111 | Alveolar hypoventilation | /ælˈviːələr ˌhaɪpoʊˌventɪˈleɪʃən/ | Giảm thông khí phế nang |
| 112 | CO2 retention | /siː oʊ tuː rɪˈtenʃən/ | Tăng CO2 |
| 113 | Work of breathing | /wɜːrk əv ˈbriːðɪŋ/ | Công thở |
| 114 | Central ventilatory drive | /ˈsentrəl ˈventɪləˌtɔːri draɪv/ | Điều khiển thông khí trung ương |
| 115 | Dead space | /ded speɪs/ | Khoảng chết sinh lý |
| 116 | Inspiratory muscle fatigue | /ɪnˈspaɪrətɔːri ˈmʌsəl fəˈtiːɡ/ | Mệt mỏi cơ hít vào |
| 117 | Respiratory failure | /rɪˈspaɪrətɔːri ˈfeɪljər/ | Suy hô hấp |
| 118 | Diaphragmatic fatigue | /ˌdaɪəfrægˈmætɪk fəˈtiːɡ/ | Mệt mỏi cơ hoành |
| 119 | Diaphragm | /ˈdaɪəˌfræm/ | Cơ hoành |
| 120 | Pulmonary hypertension | /ˈpʌlməˌneri ˌhaɪpərˈtenʃən/ | Tăng áp phổi |
| 121 | Pulmonary arterial system | /ˈpʌlməˌneri ɑːrˈtɪriəl ˈsɪstəm/ | Hệ động mạch phổi |
| 122 | Right ventricle | /raɪt ˈventrɪkəl/ | Thất phải |
| 123 | Right ventricular hypertrophy | /raɪt venˈtrɪkjələr haɪˈpɜːrtrəfi/ | Phì đại thất phải |
| 124 | Cor pulmonale | /kɔːr ˌpʌlməˈneɪli/ | Tim phổi |
| 125 | Chronic hypoxia | /ˈkrɒnɪk haɪˈpɒksiə/ | Giảm oxy mạn tính |
| 126 | Pulmonary arterioles | /ˈpʌlməˌneri ɑːrˈtɪrioʊlz/ | Tiểu động mạch phổi |
| 127 | Pulmonary vasoconstriction | /ˈpʌlməˌneri ˌveɪzoʊkənˈstrɪkʃən/ | Co mạch phổi |
| 128 | Vascular remodeling | /ˈvæskjələr riːˈmɒdəlɪŋ/ | Tái cấu trúc mạch máu |
| 129 | Hypercapnia | /ˌhaɪpərˈkæpniə/ | Tăng CO2 |
| 130 | Polycythemia | /ˌpɒlɪsaɪˈθiːmiə/ | Đa hồng cầu |
| 131 | Hematocrit | /hɪˈmætəˌkrɪt/ | Hematocrit |
| 132 | Blood viscosity | /blʌd vɪˈskɒsəti/ | Độ nhớt máu |
| 133 | Pulmonary capillaries | /ˈpʌlməˌneri ˈkæpəˌleriz/ | Mao mạch phổi |
| 134 | Pulmonary vascular bed | /ˈpʌlməˌneri ˈvæskjələr bed/ | Lòng mạch phổi |
| 135 | Type A (pink puffer) | /taɪp eɪ pɪŋk ˈpʌfər/ | Type A (người thở hồng hào) |
| 136 | Type B (blue bloater) | /taɪp biː bluː ˈbloʊtər/ | Type B (người phù xanh) |
| 137 | Minute ventilation | /ˈmɪnɪt ˌventɪˈleɪʃən/ | Thông khí phút |
| 138 | Arterial PO2 | /ɑːrˈtɪriəl piː oʊ tuː/ | PO2 động mạch |
| 139 | Clinical classification | /ˈklɪnɪkəl ˌklæsəfəˈkeɪʃən/ | Phân loại lâm sàng |
| 140 | Symptom score | /ˈsɪmptəm skɔːr/ | Điểm triệu chứng |
| 141 | Exacerbation history | /ɪɡˌzæsərˈbeɪʃən ˈhɪstəri/ | Tiền sử đợt cấp tính |
| 142 | Dyspnea | /dɪspˈniːə/ | Khó thở |
| 143 | Chronic symptoms | /ˈkrɒnɪk ˈsɪmptəmz/ | Triệu chứng mạn tính |
| 144 | Pulmonary function tests | /ˈpʌlməˌneri ˈfʌŋkʃən tests/ | Xét nghiệm chức năng phổi |
| 145 | Acute event | /əˈkjuːt ɪˈvent/ | Sự kiện cấp tính |
| 146 | Medication change | /ˌmedɪˈkeɪʃən tʃeɪndʒ/ | Thay đổi thuốc |
| 147 | Precipitating factor | /prɪˈsɪpɪˌteɪtɪŋ ˈfæktər/ | Yếu tố kích phát |
| 148 | Respiratory tract infection | /rɪˈspaɪrətɔːri trækt ɪnˈfekʃən/ | Nhiễm trùng đường hô hấp |
| 149 | Air pollutants | /eər pəˈluːtənts/ | Chất ô nhiễm không khí |
| 150 | Heart failure | /hɑːrt ˈfeɪljər/ | Suy tim |
