Sách dịch: CÁC NGUYÊN LÝ Y HỌC HÔ HẤP, ẤN BẢN THỨ 8
Dịch và chú giải Tiếng Việt: Ts.Bs. Lê Nhật Huy, Ths.Bs. Lê Đình Sáng
CHƯƠNG 9. TỔNG QUAN VỀ CÁC BỆNH PHỔI MÔ KẼ LAN TỎA
Overview of diffuse parenchymal lung diseases
Steven E. Weinberger MD, MACP, FRCP, Barbara A. Cockrill MD and Jess Mandel MD, MACP, FRCP
Principles of Pulmonary Medicine, 9, 124-135
MỤC LỤC CHƯƠNG
| Bệnh học Bệnh học của các loại Viêm phổi kẽ vô căn Bệnh phổi mô kẽ lan tỏa giai đoạn cuối Cơ chế bệnh sinh Sinh lý bệnh Giảm độ giãn nở Giảm các thể tích phổi Suy giảm khả năng khuếch tán Bất thường chức năng đường thở nhỏ Rối loạn trao đổi khí Tăng áp động mạch phổi Đặc điểm lâm sàng Phương pháp tiếp cận chẩn đoán |
Một nhóm lớn các rối loạn ảnh hưởng đến thành phế nang theo cách mà cuối cùng có thể dẫn đến sẹo hoặc xơ hóa lan tỏa. Các rối loạn này theo truyền thống được gọi là bệnh phổi kẽ, mặc dù thuật ngữ này không hoàn toàn chính xác (xem Chương 8). Về mặt chính thức, mô kẽ chỉ đề cập đến vùng của thành phế nang, không bao gồm và ngăn cách các tế bào biểu mô phế nang và tế bào nội mô mao mạch. Tuy nhiên, các bệnh phổi kẽ ảnh hưởng đến tất cả các thành phần của thành phế nang: tế bào biểu mô, tế bào nội mô, và các thành phần tế bào và phi tế bào của mô kẽ. Ngoài ra, quá trình bệnh lý thường lan rộng vào các khoang phế nang và do đó không chỉ giới hạn ở thành phế nang. Nhiều tác giả hiện nay ưa thích thuật ngữ bệnh phổi mô kẽ lan tỏa (diffuse parenchymal lung disease), và đây cũng là thuật ngữ thường được sử dụng trong cuốn sách này. Tuy nhiên, trên thực tế, người đọc nên hiểu rằng các thuật ngữ bệnh phổi mô kẽ lan tỏa và bệnh phổi kẽ thường đề cập đến cùng một nhóm rối loạn gây viêm và xơ hóa các cấu trúc phế nang. Một tên gọi khác, viêm phổi kẽ vô căn, xác định một nhóm các thực thể bệnh lý đại diện cho một phân nhóm của bệnh phổi mô kẽ lan tỏa. Các rối loạn nằm trong nhóm này sẽ được thảo luận chi tiết hơn trong phần Bệnh học của chương này, cũng như trong Chương 11, nơi chúng ta xem xét những bệnh phổi mô kẽ lan tỏa không có nguyên nhân rõ ràng.
Các loại viêm phổi kẽ vô căn là một phân nhóm trong danh mục rộng hơn của bệnh phổi mô kẽ lan tỏa. Có hơn 150 bệnh phổi mô kẽ lan tỏa. Bảng 9.1 liệt kê các rối loạn phổ biến nhất trong số này, được nhóm thành các danh mục rộng dựa trên việc nguyên nhân cơ bản của bệnh hiện đã được biết hay chưa biết. Một danh mục thứ ba là “Các rối loạn giả bệnh” được đưa vào để ghi nhận thực tế rằng một số vấn đề lâm sàng được xác định rõ khác có thể tạo ra các bất thường nhu mô lan tỏa trên hình ảnh ngực. Mặc dù các rối loạn giả bệnh này thường không được đưa vào danh sách truyền thống của các bệnh phổi mô kẽ lan tỏa, bác sĩ lâm sàng phải nhớ xem xét chúng trong các bối cảnh lâm sàng thích hợp.
Việc làm quen với số lượng lớn các bệnh cụ thể này là khó khăn ngay cả đối với chuyên gia phổi, vì vậy người mới bắt đầu trong y học phổi không thể mong đợi có được kiến thức sâu về từng thực thể. Thay vào đó, người đọc được khuyến khích trước tiên nên phát triển sự hiểu biết về các đặc điểm bệnh học, cơ chế bệnh sinh, sinh lý bệnh và lâm sàng chung của các rối loạn này. Chương này là một tổng quan về các khía cạnh chung của bệnh phổi mô kẽ lan tỏa và chỉ đề cập đến các bệnh riêng lẻ khi cần thiết. Chương 10 thảo luận về các rối loạn liên quan đến một tác nhân gây bệnh có thể xác định được; một thiểu số bệnh nhân mắc bệnh phổi mô kẽ lan tỏa thuộc loại này. Chương 11 thảo luận về các bệnh mà một tác nhân gây bệnh cụ thể chưa được xác định, đại diện cho phần lớn bệnh nhân mắc bệnh phổi mô kẽ lan tỏa. Các chương này chỉ tập trung vào một số ít các loại bệnh phổi mô kẽ đã được mô tả. Mục tiêu xuyên suốt là xem xét những rối loạn mà người đọc có nhiều khả năng gặp phải nhất. Các thực thể được đề cập trong ba chương này chủ yếu là các bệnh mạn tính (mặc dù đôi khi bán cấp và hiếm khi cấp tính) ảnh hưởng đến các cấu trúc phế nang. Một quá trình khác liên quan đến bệnh lan tỏa, hội chứng suy hô hấp cấp tính (ARDS), là do tổn thương cấp tính đối với các thành phần khác nhau của phế nang. ARDS, có tầm quan trọng lâm sàng như một nguyên nhân chính gây suy hô hấp cấp, được thảo luận chi tiết trong Chương 29.
Bảng 9.1 Phân loại một số bệnh phổi mô kẽ lan tỏa chọn lọc
BỆNH HỌC
Thông thường, các bệnh phổi mô kẽ lan tỏa, không phân biệt nguyên nhân, có hai thành phần bệnh học chính: một quá trình viêm ở thành phế nang và khoang phế nang (đôi khi được gọi là viêm phế nang – alveolitis) và một quá trình tạo sẹo hoặc xơ hóa (Hình 9.1). Cả hai đặc điểm này thường xảy ra đồng thời, mặc dù tỷ lệ tương đối của viêm và xơ hóa thay đổi tùy theo nguyên nhân cụ thể và giai đoạn của bệnh. Quan niệm chung cho rằng viêm hoạt động là quá trình chính và xơ hóa theo sau như một đặc điểm thứ phát. Tuy nhiên, xơ phổi vô căn (Idiopathic pulmonary fibrosis – IPF) là một ngoại lệ chính đối với quy luật chung này. Như đã thảo luận trong Chương 11, quá trình chính trong IPF dường như là tổn thương tế bào biểu mô và xơ hóa (đại diện cho sự sửa chữa bất thường của tổn thương) thay vì viêm phế nang (xem phần Cơ chế bệnh sinh).
Các bệnh phổi mô kẽ (nhu mô) lan tỏa được đặc trưng về mặt bệnh học bởi mức độ viêm và xơ hóa khác nhau. Khi có tình trạng viêm phế nang hoạt động, một loạt các tế bào viêm (ví dụ, đại thực bào, lympho bào, bạch cầu trung tính, bạch cầu ái toan và tương bào) xâm nhập vào thành phế nang. Các loại bệnh phổi mô kẽ lan tỏa riêng lẻ có thể liên quan đến sự nổi trội của một loại tế bào viêm cụ thể, chẳng hạn như bạch cầu ái toan trong viêm phổi tăng bạch cầu ái toan mạn tính. Ngoài sự hiện diện của các tế bào viêm, các đặc điểm bệnh học đặc trưng khác giúp xác định một rối loạn cụ thể có thể liên quan đến tình trạng viêm phế nang. Các mẫu riêng lẻ này hữu ích và trong nhiều trường hợp là rất quan trọng để chẩn đoán một thực thể bệnh học cụ thể.
Một trong những đặc điểm bệnh học quan trọng và đặc trưng nhất liên quan đến một số bệnh phổi mô kẽ lan tỏa là u hạt (granuloma). U hạt là một tập hợp khu trú của các tế bào được gọi là mô bào dạng biểu mô (epithelioid histiocytes), là những tế bào mô có nguồn gốc từ dòng monocyte/đại thực bào (Hình 9.2A). Các tế bào này thường đi kèm với các lympho bào T bên trong u hạt, và thường cũng tạo thành một vành bao quanh nó. Khi có hoại tử tế bào ở trung tâm của u hạt, thực thể này được gọi là u hạt hoại tử bã đậu hoặc hoại tử, nhưng các bệnh phổi mô kẽ lan tỏa hầu như chỉ liên quan đến u hạt không bã đậu hóa (tức là u hạt không có vùng trung tâm bị hoại tử). Ngược lại, u hạt hoại tử bã đậu là đặc trưng của các bệnh truyền nhiễm, đặc biệt là bệnh lao (xem Chương 25, Bệnh học). U hạt cũng thường có các tế bào khổng lồ đa nhân, là kết quả của sự hợp nhất của một số tế bào thực bào thành một tế bào lớn duy nhất với bào tương phong phú và nhiều nhân (Hình 9.2B). Ví dụ về các bệnh phổi mô kẽ lan tỏa trong đó u hạt là một phần của quá trình bệnh lý bao gồm bệnh sarcoidosis và viêm phổi quá mẫn. U hạt thường được coi là phản ánh một quá trình miễn dịch tiềm ẩn nào đó, cụ thể là một phản ứng miễn dịch với một tác nhân ngoại sinh. Trong trường hợp viêm phổi quá mẫn, nhiều tác nhân đã được xác định. Ngược lại, trong trường hợp bệnh sarcoidosis, chưa có tác nhân ngoại sinh cụ thể nào được xác định một cách chắc chắn. U hạt trong phổi còn có nhiều nguyên nhân khác (ví dụ, lao, một số bệnh nhiễm nấm, và dị vật), nhưng chúng không được đề cập ở đây vì các u hạt này thường không liên quan đến bệnh phổi mô kẽ lan tỏa.
Các bệnh phổi mô kẽ lan tỏa có u hạt bao gồm bệnh sarcoidosis và viêm phổi quá mẫn.
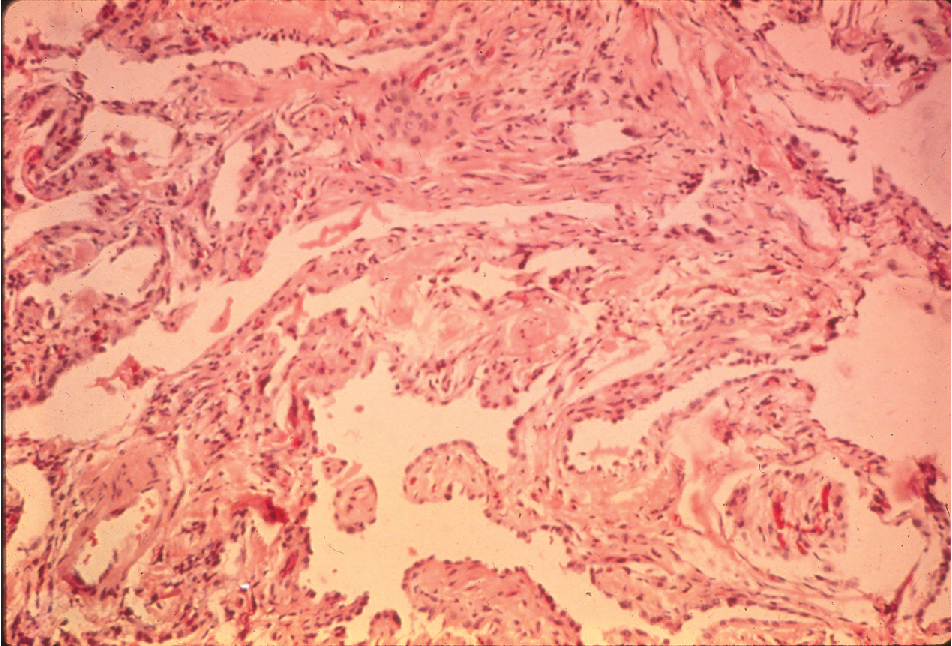
Hình 9.1 Vi ảnh của bệnh phổi mô kẽ lan tỏa cho thấy thành phế nang dày lên rõ rệt. Có hiện diện quá trình viêm tế bào và xơ hóa. So sánh với hình dạng của thành phế nang bình thường trong Hình 8.1.
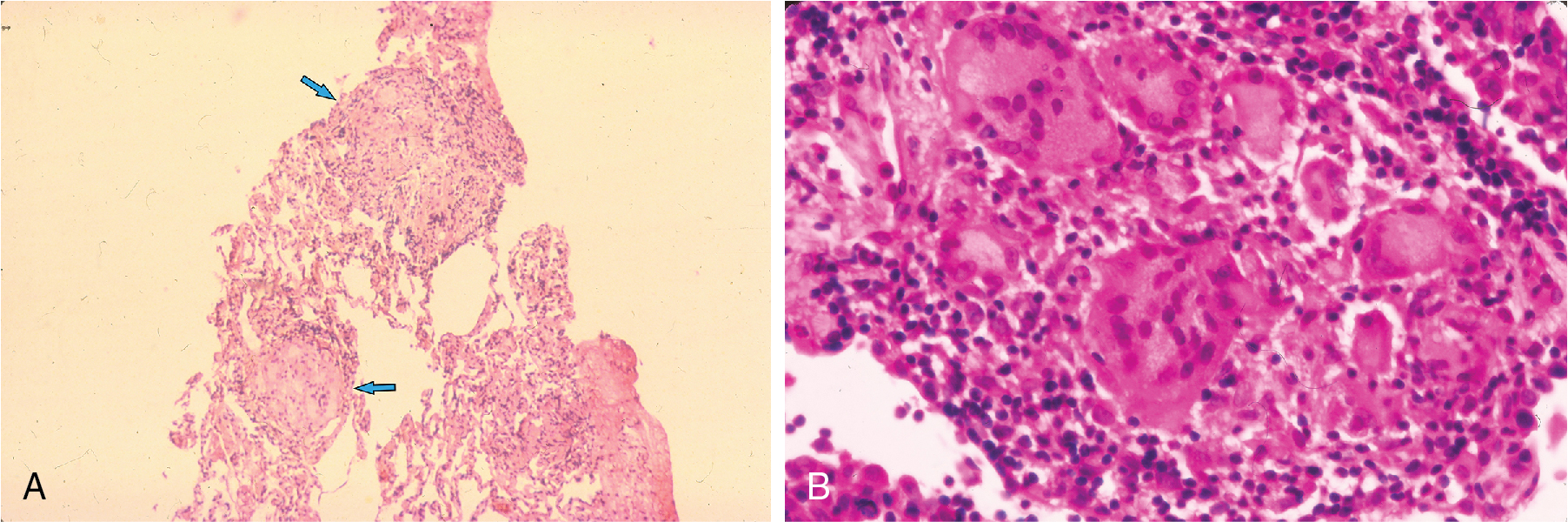
Hình 9.2 U hạt. A, Vi ảnh ở độ phóng đại thấp của sinh thiết phổi xuyên phế quản cho thấy các u hạt không hoại tử đặc trưng (mũi tên) từ một bệnh nhân mắc bệnh sarcoidosis. B, Vi ảnh ở độ phóng đại cao cho thấy một số tế bào khổng lồ đa nhân bên trong một u hạt.
Bệnh học của các loại Viêm phổi kẽ vô căn
Các loại viêm phổi kẽ vô căn là một phân nhóm bao gồm một số loại bệnh phổi mô kẽ lan tỏa. Mặc dù thuật ngữ “vô căn” trong tên gọi của phân nhóm này cho thấy rằng chưa xác định được tác nhân gây bệnh cụ thể cho các rối loạn này, nhưng hiện nay người ta đã nhận ra rằng hút thuốc lá đóng một vai trò góp phần đáng kể hoặc làm tăng nguy cơ phát triển một số loại viêm phổi kẽ vô căn. Các loại viêm phổi kẽ vô căn ban đầu được xác định dựa trên hình ảnh mô bệnh học của chúng; tuy nhiên, các thuật ngữ được sử dụng để mô tả bệnh học và rối loạn lâm sàng liên quan có thể khác nhau. Một ví dụ điển hình là mô tả bệnh học của viêm phổi kẽ thông thường (usual interstitial pneumonia – UIP) liên quan đến chẩn đoán lâm sàng là xơ phổi vô căn (IPF). Khi chúng ta có nhiều kinh nghiệm hơn với các nghiên cứu hình ảnh X-quang, chúng ta cũng nhận ra rằng các mô tả bệnh học cụ thể thường liên quan đến các dạng đặc trưng trên phim chụp cắt lớp vi tính độ phân giải cao (high-resolution computed tomography – HRCT). Bảng 9.2 tóm tắt các mối tương quan về bệnh học – lâm sàng – X-quang của các loại viêm phổi kẽ vô căn, điều này cũng sẽ được thảo luận thêm trong Chương 11.
Các nhà bệnh học và lâm sàng đã dành nhiều thời gian và công sức để tinh chỉnh và cập nhật định kỳ mô tả và phân loại các loại viêm phổi kẽ vô căn. Các rối loạn này biểu hiện mức độ viêm và xơ hóa không đặc hiệu khác nhau, và chúng không có u hạt hoặc các đặc điểm bệnh học cụ thể đặc trưng của các bệnh khác đã được xác định rõ trước đó. Việc phân loại các loại viêm phổi kẽ vô căn và xác định liệu các hình thái bệnh học khác nhau có đại diện cho các bệnh khác nhau hay, trong một số trường hợp, là các giai đoạn hoặc các phần khác nhau của quang phổ của một bệnh duy nhất đã gây ra sự không chắc chắn và nhầm lẫn, đặc biệt khi một mẫu sinh thiết có thể chứa nhiều hơn một trong những hình thái bệnh học này. Mặc dù lĩnh vực này vẫn đang phát triển, chương này cố gắng trình bày một khuôn khổ đơn giản hóa dựa trên các khái niệm bệnh học và lâm sàng hiện tại về các rối loạn này.
|
Các loại bệnh học được gộp chung dưới thuật ngữ viêm phổi kẽ vô căn bao gồm:
|
Sự nhầm lẫn đôi khi cũng phát sinh từ thực tế là một số hình thái bệnh học tương tự liên quan đến viêm phổi kẽ vô căn có thể được thấy trong bệnh phổi liên quan đến một số bệnh thấp khớp hệ thống (còn gọi là bệnh mô liên kết hoặc bệnh mạch máu collagen). Một ví dụ điển hình là hình thái bệnh học của NSIP, có thể là vô căn nhưng cũng là một biểu hiện bệnh học phổ biến của tổn thương phổi trong các bệnh như lupus ban đỏ hệ thống, viêm khớp dạng thấp, và xơ cứng bì hệ thống.
Chương này thảo luận về sáu thực thể bệnh học được gộp chung dưới thuật ngữ rộng là viêm phổi kẽ vô căn: (1) UIP, (2) NSIP, (3) RB-ILD, (4) DIP, (5) COP, và (6) AIP. Phần này mô tả ngắn gọn các đặc điểm bệnh học xác định sáu thực thể này, trong khi Chương 11 sẽ trình bày chi tiết hơn về các đặc điểm lâm sàng và X-quang của chúng. Bảng 9.2 cũng nhóm sáu rối loạn này thành ba loại—viêm phổi kẽ xơ hóa mạn tính, viêm phổi kẽ liên quan đến hút thuốc, và viêm phổi kẽ cấp tính/bán cấp—và liên hệ các đặc điểm bệnh học, lâm sàng, và X-quang của chúng.
UIP được đặc trưng bởi các vùng xơ hóa nhu mô và viêm kẽ không đồng nhất, xen kẽ giữa các vùng mô phổi tương đối được bảo tồn (Hình 9.3). Xơ hóa là thành phần nổi bật nhất của bệnh học, với các ổ tập trung của nguyên bào sợi tăng sinh được gọi là ổ nguyên bào sợi (fibroblastic foci). Xơ hóa thường liên quan đến hình ảnh tổ ong, đại diện cho các khoang khí dạng nang là kết quả của sự co kéo của mô phổi xơ hóa xung quanh. Quá trình viêm trong thành phế nang là không đặc hiệu, không nổi bật, và thường bao gồm nhiều loại tế bào khác nhau, bao gồm lympho bào, đại thực bào, và tương bào. Sự tăng sản của các tế bào phổi type II (tế bào biểu mô phế nang) có lẽ phản ánh một nỗ lực để thay thế các tế bào type I bị tổn thương. Quan trọng là, bệnh học của UIP được đặc trưng bởi sự hiện diện đồng thời của tất cả các giai đoạn xơ hóa: từ xơ hóa sớm với các nguyên bào sợi tăng sinh tích cực đến sẹo collagen không tế bào giai đoạn cuối. Người ta cho rằng quá trình xơ hóa trong UIP đang diễn ra liên tục và không liên quan đến một sự kiện duy nhất. Cho đến nay, rối loạn lâm sàng quan trọng nhất liên quan đến mẫu mô bệnh học của UIP là IPF, và các thuật ngữ này thường được sử dụng thay thế cho nhau. Tuy nhiên, hình thái bệnh học của UIP cũng có thể là kết quả của việc tiếp xúc với một số loại bụi hít phải (đặc biệt là amiăng), từ một số bệnh phổi do thuốc gây ra, và là một dạng của bệnh nhu mô phổi liên quan đến một số bệnh thấp khớp hệ thống. Điều quan trọng cần nhớ là thuật ngữ UIP đề cập đến kiểu hình mô học nhìn thấy dưới kính hiển vi, trong khi IPF đề cập đến bệnh lý lâm sàng liên quan đến UIP vô căn.
NSIP được đặc trưng bởi một thành phần mô bệnh học nổi bật là sự xâm nhập của tế bào đơn nhân trong thành phế nang (Hình 9.4). Mặc dù có tên gọi là “không đặc hiệu,” NSIP là một thực thể bệnh học riêng biệt, có thể xuất hiện dưới dạng vô căn hoặc liên quan đến một số bệnh thấp khớp hệ thống. Trái ngược với UIP, quá trình bệnh lý trong NSIP có vẻ tương đối đồng nhất, xơ hóa thay đổi nhưng thường ít rõ ràng hơn, và tiên lượng tốt hơn. Trước đây, mẫu bệnh học này thường không được công nhận là một thực thể riêng biệt so với UIP. Kết quả là, việc đưa nó vào nhiều nghiên cứu lâm sàng về IPF đã làm sai lệch sự hiểu biết của chúng ta về lịch sử tự nhiên và điều trị của IPF.
RB-ILD và DIP được cho là có liên quan với nhau, vì cả hai thường liên quan đến việc hút thuốc lá. RB-ILD được đặc trưng bởi sự hiện diện của các đại thực bào chứa sắc tố trong lòng các tiểu phế quản hô hấp, đi kèm với sự xâm nhập của lympho bào và đại thực bào. Tuy nhiên, khác với DIP, không có tình trạng viêm phế nang. RB-ILD gần như luôn luôn liên quan đến hút thuốc. Can thiệp lâm sàng quan trọng nhất là hỗ trợ bệnh nhân cai thuốc lá thành công. Đôi khi, sự phân biệt giữa RB-ILD và DIP rất khó khăn và có phần tùy tiện, và cả hai hình thái bệnh học có thể cùng tồn tại ở cùng một cá nhân.
DIP được đặc trưng bởi số lượng lớn các tế bào đơn nhân trong phế nang (Hình 9.5). Mặc dù ban đầu được cho là các tế bào biểu mô phế nang bị bong ra (do đó có tên gọi này), các tế bào này hiện được biết đến là các đại thực bào trong phế nang. Một thành phần ít nổi bật hơn của mô học là tình trạng viêm trong thành phế nang, và có rất ít xơ hóa liên quan. Trái ngược với UIP, quá trình này đồng nhất về mặt thời gian, và sự biến dạng cấu trúc là tối thiểu. Dựa trên một mối liên hệ mạnh mẽ (mặc dù không phải là phổ quát) của mẫu mô học này với tiền sử hút thuốc, cũng như sự chồng chéo rõ ràng ở một số bệnh nhân với tình trạng viêm tiểu phế quản hô hấp do hút thuốc với các đại thực bào chứa sắc tố, hút thuốc được cho là một nguyên nhân cơ bản quan trọng cho mẫu bệnh học này.
COP được đặc trưng bởi xơ hóa tổ chức hóa (còn được gọi là “mô hạt”) trong các đường thở nhỏ, liên quan đến một mức độ nhẹ của viêm kẽ mạn tính (Hình 9.6). Tổn thương trong lòng đường thở nhỏ là một đặc điểm chính và phân biệt COP với các loại viêm phổi kẽ vô căn khác. Kiểu hình mô học này còn được gọi là viêm tiểu phế quản tắc nghẽn tổ chức hóa (bronchiolitis obliterans organizing pneumonia – BOOP). Các phát hiện mô học trong BOOP có thể là vô căn hoặc liên quan đến các nguyên nhân đã biết cụ thể (ví dụ, nhiễm trùng, hít phải chất độc, bệnh thấp khớp hệ thống). Mặc dù các thuật ngữ đôi khi được sử dụng thay thế cho nhau, thuật ngữ COP thường dùng để chỉ dạng vô căn của BOOP.
AIP được cho là đại diện cho giai đoạn tổ chức hóa hoặc xơ hóa của tổn thương phế nang lan tỏa, là kiểu hình mô học được thấy trong ARDS (xem Chương 29). Trong hầu hết các trường hợp ARDS, có thể xác định được nguyên nhân khởi phát, trong khi ở AIP, không thể xác định được tác nhân khởi đầu nào cho ARDS. Mô học tương tự như các giai đoạn sau của ARDS, và cho thấy sự tăng sinh của nguyên bào sợi và tăng sản tế bào phổi type II trong bối cảnh dường như là tổn thương phế nang lan tỏa đang tổ chức hóa.
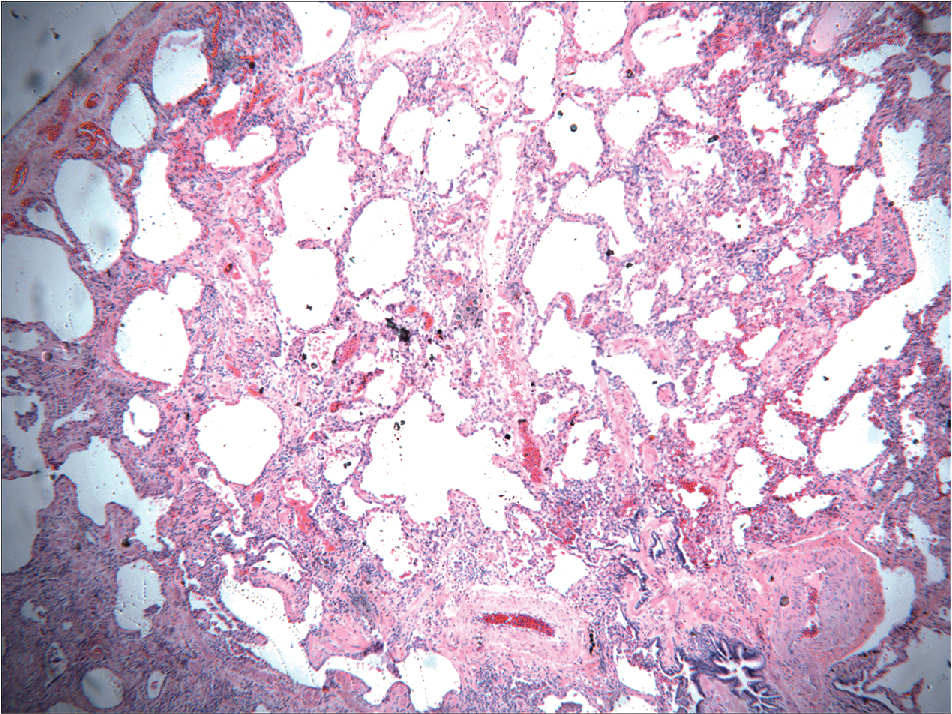
Hình 9.3 Vi ảnh ở độ phóng đại thấp của viêm phổi kẽ thông thường cho thấy xơ hóa nổi bật kèm theo hình ảnh tổ ong. (Tài liệu của Tiến sĩ Olivier Kocher.)
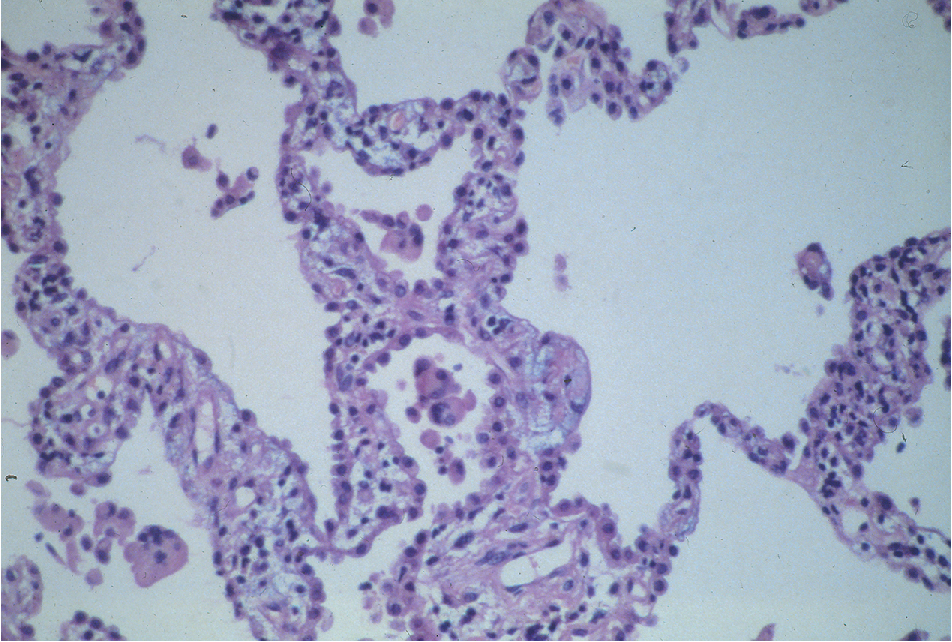
Hình 9.4 Vi ảnh ở độ phóng đại cao của viêm phổi kẽ không đặc hiệu cho thấy sự xâm nhập đặc trưng của tế bào đơn nhân trong thành phế nang mà không có xơ hóa đáng kể.
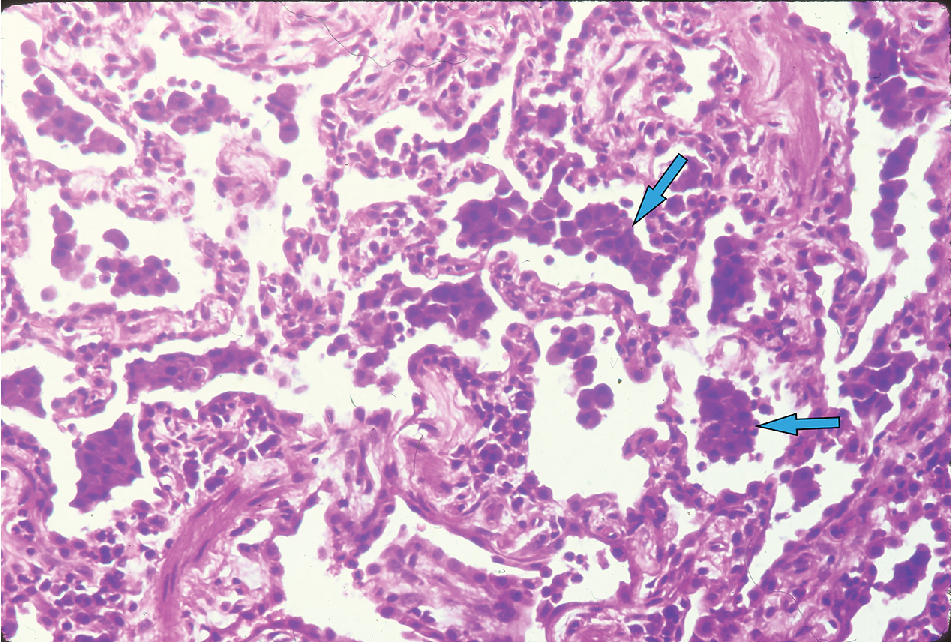
Hình 9.5 Vi ảnh ở độ phóng đại cao cho thấy các đại thực bào trong các tiểu phế quản hô hấp và khoang phế nang (mũi tên), đặc trưng cho quang phổ bao gồm viêm tiểu phế quản hô hấp – bệnh phổi kẽ (RB-ILD) và viêm phổi kẽ bong vảy (DIP).
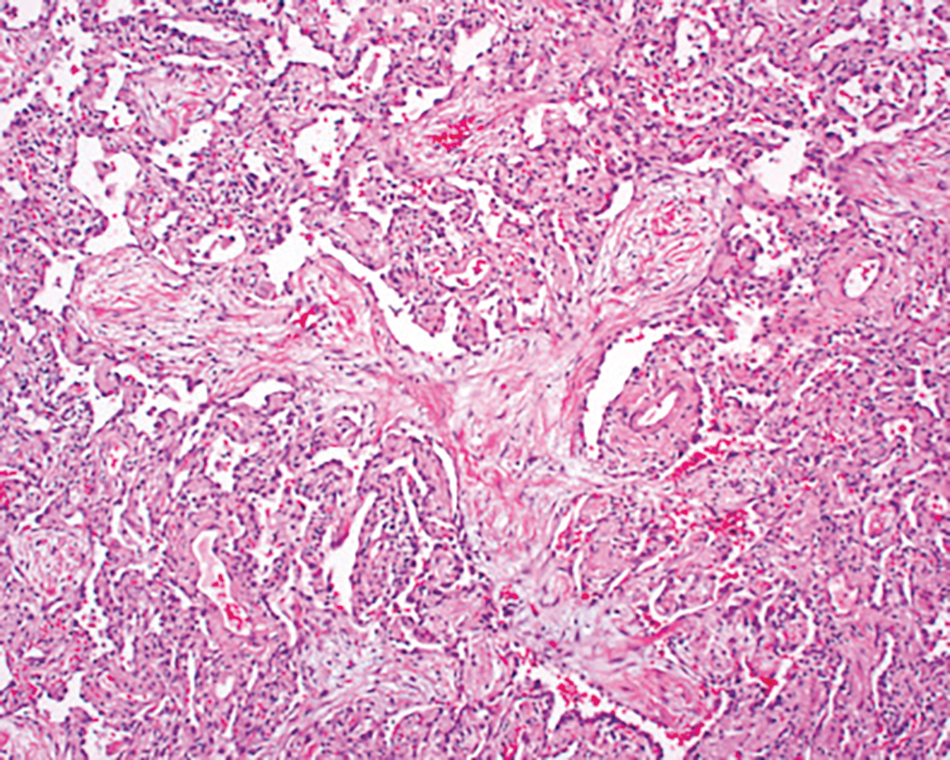
Hình 9.6 Vi ảnh ở độ phóng đại thấp của mẫu viêm phổi tổ chức hóa, như thấy trong viêm phổi tổ chức hóa vô căn (COP). Ngoài sự xâm nhập viêm kẽ, còn có một lưỡi mô nguyên bào sợi phân nhánh chiếm chỗ trong một đường thở nhỏ. (Từ Leslie, K. O., & Wick, M. R. (2018). Practical pulmonary pathology. A diagnostic approach (3rd ed.). Philadelphia, PA: Elsevier.)
Bảng 9.2 Các mối tương quan về Bệnh học, Lâm sàng và X-quang của các loại Viêm phổi kẽ vô căn
Bệnh phổi mô kẽ lan tỏa giai đoạn cuối
Khi bệnh phổi mô kẽ lan tỏa đã tồn tại trong một thời gian dài và liên quan đến tình trạng xơ hóa đáng kể, các đặc điểm riêng biệt của tình trạng viêm kẽ hoặc viêm phế nang trước đó thường bị mất đi. Ví dụ, sau khi một khoảng thời gian đủ dài trôi qua và một mức độ xơ hóa đáng kể đã phát triển, các u hạt có thể không còn xác định được trong các bệnh phổi có u hạt. Do đó, tại một thời điểm nhất định, nhiều bệnh phổi mô kẽ lan tỏa, nếu đủ nặng và mạn tính, có thể đi theo một con đường chung cuối cùng dẫn đến bệnh phổi mô kẽ lan tỏa giai đoạn cuối. Ở giai đoạn cuối, xơ hóa nặng dẫn đến biến dạng cấu trúc đáng kể của phổi có thể được nhìn thấy cả trên đại thể và vi thể, với các vùng co rút và các vùng khác cho thấy sự hình thành của các không gian dạng nang. Trong nhiều trường hợp, kết quả là “phổi tổ ong,” trong đó các vết sẹo dày đặc và các vùng nang xen kẽ làm cho các khu vực của phổi giống như một tổ ong (Hình 9.7).
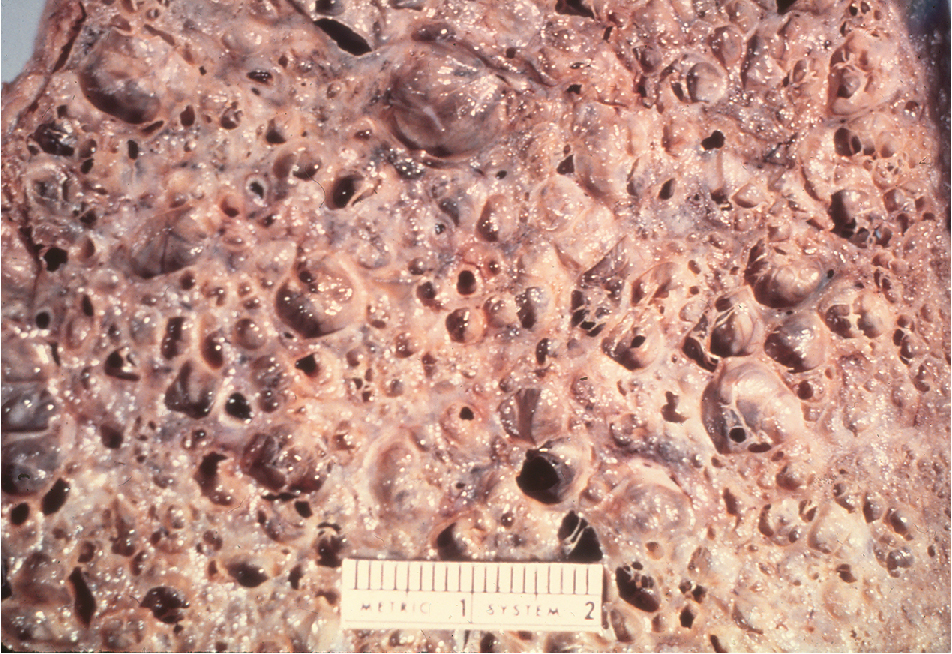
Hình 9.7 Hình ảnh phổi tổ ong từ bệnh nhân bị xơ phổi nặng. Nhiều vùng nang được nhìn thấy giữa các dải nhu mô phổi bị sẹo và co rút rộng.
CƠ CHẾ BỆNH SINH
Nhiều nghiên cứu trong 2 thập kỷ qua đã cố gắng làm rõ chuỗi các sự kiện trong cơ chế bệnh sinh của các loại bệnh phổi mô kẽ lan tỏa khác nhau. Tuy nhiên, trong hầu hết các trường hợp, các yếu tố khởi phát và duy trì các bệnh này vẫn chưa được biết, và sự hiểu biết của chúng ta về các sự kiện tế bào và sinh hóa tạo ra viêm và xơ hóa vẫn chủ yếu ở mức độ mô tả. Gần đây, đã có sự quan tâm nhiều hơn đến vai trò tiềm tàng của các yếu tố di truyền trong sự phát triển của một số bệnh phổi mô kẽ lan tỏa, hoặc là một yếu tố quyết định chính hoặc là một yếu tố điều chỉnh quan trọng đối với phản ứng của bệnh nhân với một phơi nhiễm có khả năng gây hại. Một số biến thể gen đặc biệt được quan tâm là những gen liên quan đến việc mã hóa cho các mucin (đặc biệt là MUC5B), các protein surfactant A và C, và các thành phần telomerase.
Phần này phác thảo sơ đồ chung của các sự kiện được cho là hoạt động trong việc tạo ra tình trạng viêm và xơ hóa nhu mô. Chương 10 và 11 thảo luận về các bệnh cụ thể và cung cấp thêm thông tin được cho là có liên quan đến cơ chế bệnh sinh của mỗi bệnh. Sơ đồ chung được phác thảo ở đây có các đặc điểm tương tự như các dạng tổn thương phổi khác được mô tả ở nơi khác trong cuốn sách này (ví dụ, khí phế thũng trong Chương 6 và ARDS trong Chương 29). Một câu hỏi cơ bản nhưng chưa được trả lời là điều gì quyết định liệu một tác nhân gây hại cuối cùng sẽ dẫn đến khí phế thũng, tổn thương phổi cấp tính (với ARDS), hay viêm và xơ hóa nhu mô mạn tính.
Hình 9.8 tóm tắt chuỗi sự kiện chung được cho là phổ biến đối với nhiều bệnh phổi mô kẽ lan tỏa. Các sự kiện có thể được chia thành ba giai đoạn: khởi phát, lan truyền (propagation), và hậu quả bệnh lý cuối cùng. Mỗi giai đoạn này sẽ được xem xét lần lượt.
|
Các đặc điểm cơ chế bệnh sinh của bệnh phổi mô kẽ lan tỏa như sau:
|
Tác nhân kích thích khởi phát các bệnh phổi mô kẽ lan tỏa thường được cho là một độc tố hoặc một kháng nguyên. Các độc tố được cho là rõ ràng nhất bao gồm một số hạt vô cơ hít phải (ví dụ, amiăng) gây ra bệnh bụi phổi. Hút thuốc cũng dường như là một yếu tố quan trọng cho sự phát triển của các bệnh viêm phổi kẽ liên quan đến hút thuốc (RB-ILD và DIP) cũng như bệnh mô bào Langerhans ở phổi (u hạt ái toan, được thảo luận trong Chương 11), và là một yếu tố nguy cơ cho IPF. Các kháng nguyên hít phải đã được xác định rõ nhất là nguyên nhân của viêm phổi quá mẫn. Trong bệnh sarcoidosis và có lẽ trong IPF, việc tiếp xúc với một hoặc nhiều kháng nguyên có thể khởi phát bệnh, nhưng chưa có kháng nguyên cụ thể nào được xác định.
Sau khi tiếp xúc với một tác nhân kích thích khởi phát, một chuỗi các sự kiện phức tạp liên quan đến nhau chịu trách nhiệm cho sự lan truyền của bệnh. Ở cấp độ vi thể, hậu quả của những sự kiện lan truyền này là tình trạng viêm, một dấu hiệu đặc trưng của nhiều nhưng không phải tất cả các bệnh phổi mô kẽ lan tỏa. Độc tố có thể gây tổn thương trực tiếp cho các tế bào nhu mô phổi (tế bào biểu mô phế nang), trong khi cả độc tố và kháng nguyên đều có thể dẫn đến sự kích hoạt và huy động các tế bào viêm và miễn dịch. Các tế bào viêm có thể giải phóng một loạt các chất trung gian (ví dụ, các enzyme phân giải protein, các gốc oxy độc hại) có thể gây tổn thương thêm cho các tế bào nhu mô phổi một cách thứ phát. Ngoài ra, một loạt các chất trung gian cytokine được sản xuất bởi các tế bào biểu mô, viêm, và miễn dịch đã được xác định. Các cytokine này có các tác động thứ phát phức tạp lên các tế bào viêm và miễn dịch khác, thường hoạt động để khuếch đại hoặc làm giảm phản ứng viêm. Một số cytokine (ví dụ, yếu tố tăng trưởng biến đổi [TGF]-B và yếu tố tăng trưởng có nguồn gốc từ tiểu cầu) có khả năng huy động và kích thích sự nhân lên của các nguyên bào sợi, vốn rất quan trọng cho việc sản xuất mô liên kết mới sau này. Hoạt động của các protease từ các tế bào viêm cũng có thể chịu trách nhiệm cho sự phân hủy các thành phần mô liên kết. Sự kết hợp giữa tổng hợp mới và phân hủy mô liên kết xác định sự rối loạn của chất nền mô liên kết, được nhìn thấy trên mô học là xơ hóa, hậu quả bệnh lý cuối cùng của bệnh phổi mô kẽ lan tỏa. Trong IPF, quan niệm mới nhất (và hiện đang chiếm ưu thế) là tổn thương biểu mô phế nang dẫn đến sự biểu hiện của các chất trung gian cytokine thúc đẩy xơ hóa, và tình trạng viêm, mặc dù có mặt ở các mức độ khác nhau, không phải là yếu tố kích hoạt quan trọng cho sự phát triển của xơ hóa.
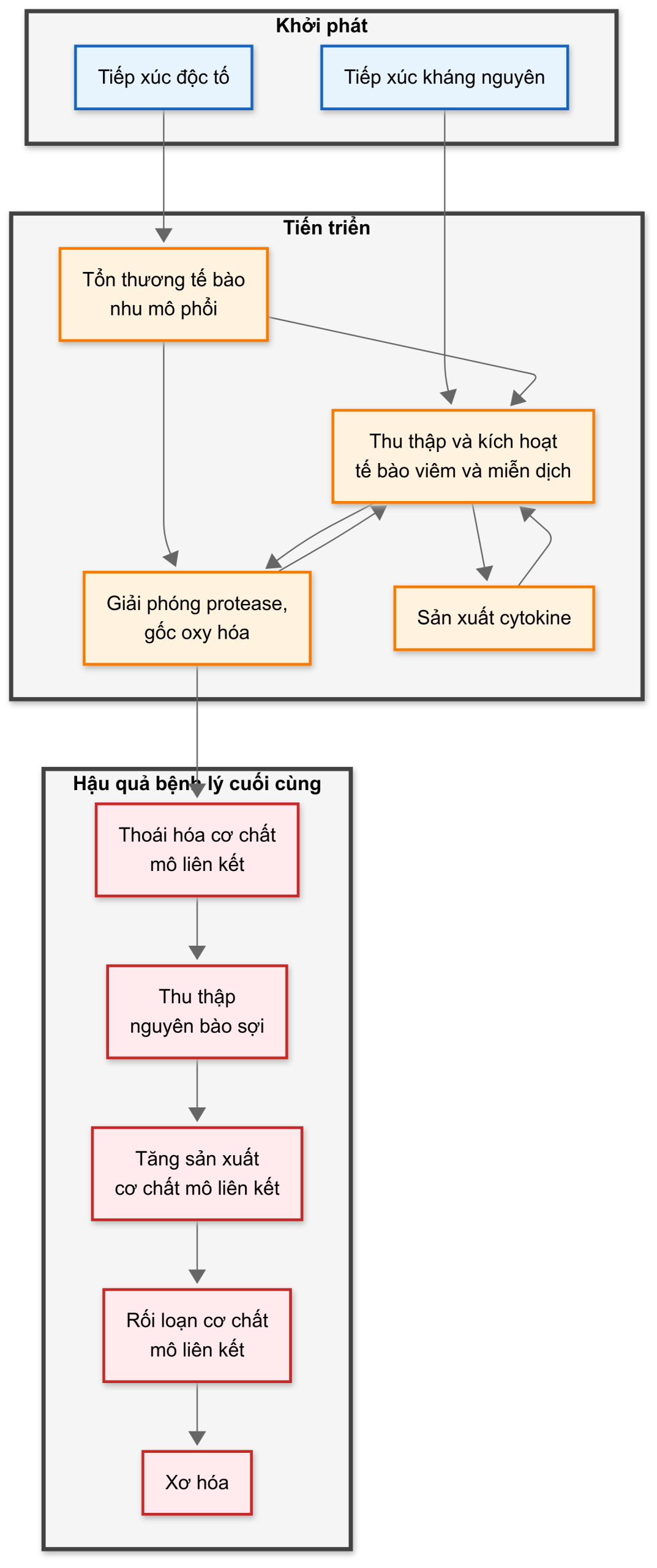
Hình 9.8 Sơ đồ minh họa các khía cạnh chung của cơ chế bệnh sinh của các bệnh phổi mô kẽ lan tỏa.
SINH LÝ BỆNH
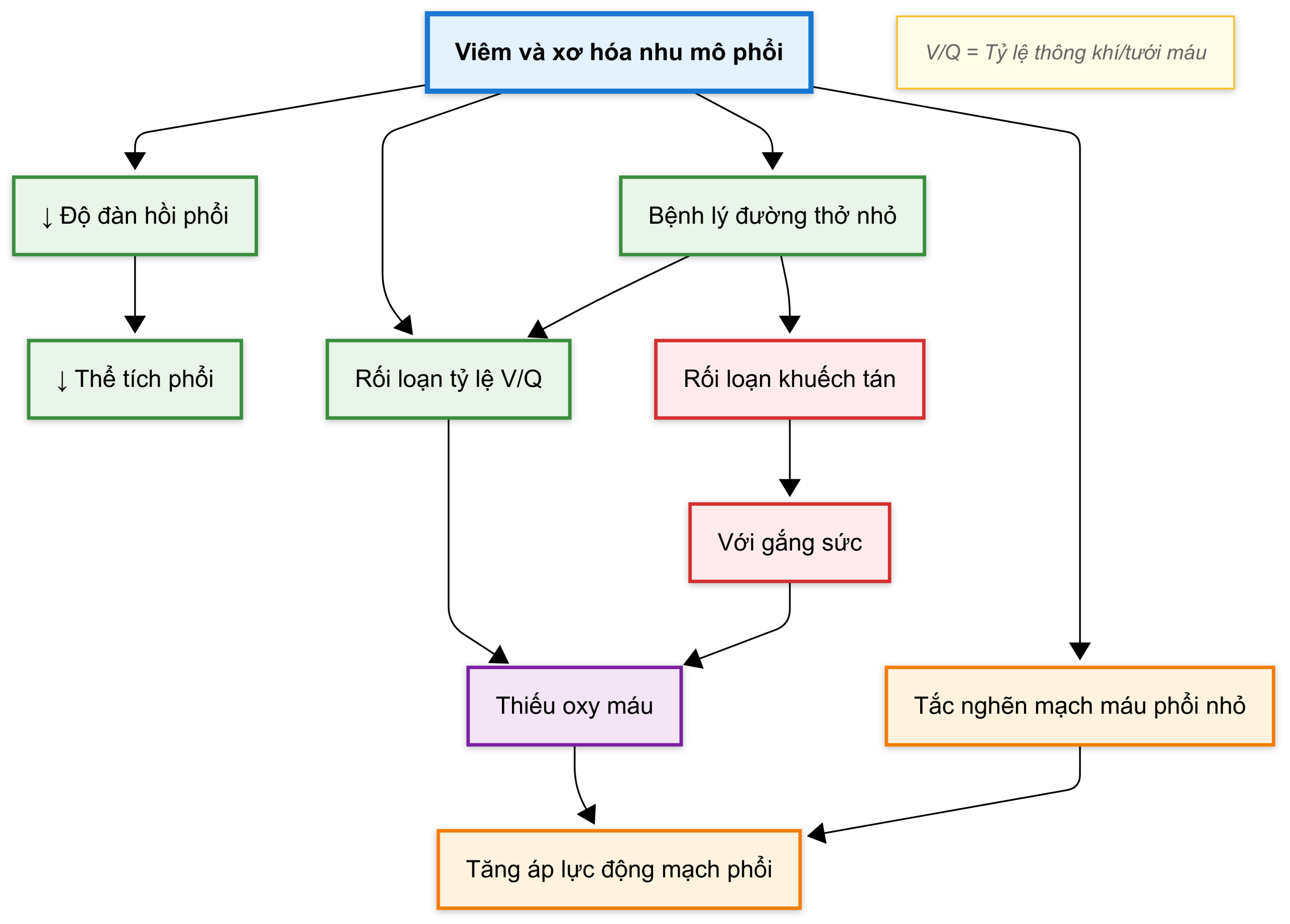
Với những ngoại lệ và biến thể nhỏ, các đặc điểm sinh lý bệnh của các bệnh phổi mô kẽ lan tỏa mạn tính là tương tự nhau và do đó được thảo luận ở đây như một nhóm duy nhất. Do tình trạng viêm và xơ hóa ảnh hưởng đến thành phế nang, các bất thường sau đây thường được thấy (Hình 9.9): (1) giảm độ giãn nở (tăng độ cứng) của phổi, (2) giảm tổng thể các thể tích phổi, (3) mất diện tích bề mặt phế nang-mao mạch dẫn đến suy giảm khả năng khuếch tán, (4) bất thường chức năng đường thở nhỏ mà không có tắc nghẽn đường thở tổng thể, (5) rối loạn trao đổi khí, thường bao gồm giảm oxy máu mà không có ứ đọng , và (6) trong một số trường hợp, tăng áp động mạch phổi. Mỗi đặc điểm này sẽ được xem xét ngắn gọn.
Giảm độ giãn nở
Khả năng giãn nở của phổi bị thay đổi đáng kể bởi các quá trình liên quan đến viêm và xơ hóa thành phế nang. Phổi trở nên cứng hơn nhiều, có lực đàn hồi co lại tăng lên đáng kể, và do đó đòi hỏi áp suất xuyên phổi lớn hơn để đạt được bất kỳ thể tích phổi nào. Đường cong áp suất-thể tích hoặc đường cong độ giãn nở bị dịch chuyển sang phải (xem Hình 8.3), và ở bất kỳ thể tích phổi nào, áp suất đàn hồi co lại cũng cao hơn nhiều so với phổi bình thường. Vì cần có những thay đổi lớn hơn trong áp suất xuyên phổi để đạt được thể tích khí lưu thông bình thường trong quá trình hít vào, công thở của bệnh nhân tăng lên. Do đó, bệnh nhân mắc bệnh phổi mô kẽ lan tỏa có xu hướng thở với thể tích khí lưu thông nhỏ hơn nhưng tần số hô hấp tăng lên. Phương pháp này cho phép bệnh nhân tiêu tốn ít năng lượng hơn cho mỗi nhịp thở nhưng vẫn duy trì được thông khí phế nang đầy đủ.
Các đường cong độ giãn nở trong bệnh phổi mô kẽ lan tỏa bị dịch chuyển xuống dưới và sang phải, phản ánh sự tăng độ cứng của phổi.
Giảm các thể tích phổi
Trong giai đoạn đầu của bệnh phổi mô kẽ lan tỏa, các thể tích phổi có thể bình thường. Tuy nhiên, trong hầu hết các trường hợp, một sự giảm các thể tích phổi được thấy ngay sau đó, bao gồm giảm dung tích toàn phổi (TLC), dung tích sống (VC), dung tích cặn chức năng (FRC), và ở mức độ thấp hơn, thể tích cặn (RV). Sự giảm TLC, FRC và RV là hậu quả trực tiếp của sự thay đổi độ giãn nở của phổi. Tại TLC, lực do các cơ hít vào tạo ra được cân bằng bởi lực đàn hồi co vào của phổi. Vì áp suất co lại tăng lên, sự cân bằng này đạt được ở một thể tích phổi thấp hơn hoặc TLC thấp hơn. Tại FRC, lực co ra của thành ngực được cân bằng bởi lực đàn hồi co vào của phổi. Sự cân bằng này đạt được ở một thể tích phổi thấp hơn hoặc FRC thấp hơn do lực đàn hồi của phổi lớn hơn. Như đã thảo luận trong Chương 1, RV chủ yếu được quyết định bởi sức mạnh của các cơ thở ra, nhưng một thành phần nhỏ được quyết định bởi lực đàn hồi co vào của phổi. Vì lực đàn hồi co lại lớn hơn trong bệnh phổi mô kẽ lan tỏa, RV nhỏ hơn một chút. Nhìn chung, TLC giảm nhiều hơn RV, do đó VC (đại diện cho sự khác biệt giữa TLC và RV) cũng giảm.
Các thể tích phổi đặc trưng bị giảm trong bệnh phổi mô kẽ lan tỏa.
Suy giảm khả năng khuếch tán
Đo lường khả năng khuếch tán bằng các kỹ thuật thông thường sử dụng carbon monoxide thường cho thấy sự giảm khả năng khuếch tán. Mặc dù sự dày lên của giao diện phế nang-mao mạch (do viêm và xơ hóa kẽ) có thể được cho là nguyên nhân gây ra sự giảm này, nhưng trên thực tế nó không phải là yếu tố chính. Thay vào đó, các quá trình viêm và xơ hóa phá hủy một phần giao diện phế nang-mao mạch và làm giảm diện tích bề mặt có sẵn để trao đổi khí. Sự giảm diện tích bề mặt này là cơ chế chính chịu trách nhiệm cho sự bất thường về khuếch tán được quan sát.
Khả năng khuếch tán bị giảm, với sự phá hủy một phần giao diện phế nang-mao mạch và giảm diện tích bề mặt để trao đổi khí.
Hình 9.9 Sơ đồ minh họa mối quan hệ giữa các đặc điểm bệnh học và sinh lý bệnh khác nhau của bệnh phổi mô kẽ lan tỏa.
Bất thường chức năng đường thở nhỏ
Các đường thở lớn thường hoạt động bình thường ở những bệnh nhân này, và tỷ lệ thể tích thở ra gắng sức trong 1 giây so với dung tích sống gắng sức () thường bình thường hoặc thậm chí tăng. Tuy nhiên, quá trình bệnh lý xảy ra ở thành phế nang cũng thường ảnh hưởng đến các đường thở nhỏ trong phổi. Kính hiển vi quang học thường cho thấy tình trạng viêm và xơ hóa ở các vùng quanh tiểu phế quản, với sự hẹp lòng của các đường thở nhỏ hoặc tiểu phế quản. Các xét nghiệm chức năng đường thở nhỏ thường cho thấy các ảnh hưởng sinh lý của sự hẹp này. Tầm quan trọng lâm sàng của rối loạn chức năng đường thở nhỏ khi không có bất thường đường thở lớn hơn là không chắc chắn, nhưng có khả năng là hậu quả của nó là bất tương hợp thông khí-tưới máu () và giảm oxy máu. Bằng chứng về tắc nghẽn đường thở đáng kể hơn có thể được thấy trong một số ít các rối loạn gây ra bệnh phổi mô kẽ lan tỏa. Vấn đề tương đối không thường xuyên này đôi khi là kết quả của xơ hóa và biến dạng đường thở nghiêm trọng.
Chức năng đường thở nhỏ thường bị rối loạn trong bệnh phổi mô kẽ lan tỏa. Chức năng đường thở lớn thường được bảo tồn.
Rối loạn trao đổi khí
Hậu quả về trao đổi khí của bệnh phổi mô kẽ lan tỏa thường bao gồm giảm oxy máu mà không có ứ đọng , và thực tế là tình trạng giảm máu (hypocapnia) thường xuất hiện. Quá trình bệnh lý ở thành phế nang không đồng đều, và sự tương hợp bình thường giữa thông khí và tưới máu bị phá vỡ. Do đó, bất tương hợp là yếu tố chính góp phần gây ra giảm oxy máu. Ở những bệnh nhân có bệnh đường thở nhỏ, rối loạn chức năng ở mức độ này có lẽ cũng góp phần vào bất tương hợp và giảm oxy máu.
Đặc trưng là bệnh nhân mắc bệnh phổi mô kẽ lan tỏa sẽ bị giảm oxy máu nhiều hơn khi gắng sức. Một lần nữa, cơ chế chính của sự giảm bão hòa oxy liên quan đến gắng sức là sự xấu đi của bất tương hợp , nhưng giới hạn khuếch tán cũng có thể là một yếu tố góp phần, đặc biệt với các mức độ gắng sức cao hơn và khi gắng sức được thực hiện ở độ cao lớn hơn. Sự kết hợp giữa suy giảm khuếch tán và giảm thời gian vận chuyển của hồng cầu trong khi gắng sức có thể ngăn cản sự cân bằng hoàn toàn của trong máu mao mạch phổi với phế nang. Mặc dù tình trạng giảm oxy máu thường sâu sắc ở những bệnh nhân bị xơ phổi nặng, thường bình thường hoặc thấp vì bệnh nhân có thể tăng thông khí phút đủ để bù đắp cho sự giảm thể tích khí lưu thông và cho bất kỳ khoảng chết bổ sung nào. Sự tăng thường không xảy ra cho đến những giai đoạn rất muộn của bệnh.
Khí máu động mạch trong bệnh phổi mô kẽ lan tỏa thường cho thấy giảm oxy máu (do bất tương hợp ) và bình thường hoặc giảm. giảm nhiều hơn nữa khi gắng sức.
Tăng áp động mạch phổi
Cuối cùng, bệnh nhân mắc bệnh phổi mô kẽ lan tỏa nặng có thể phát triển một mức độ tăng áp động mạch phổi. Thông thường, hai yếu tố chính góp phần là (1) giảm oxy máu và (2) sự tắc nghẽn các mạch máu phổi nhỏ do quá trình xơ hóa trong thành phế nang. Trong khi gắng sức, tăng áp động mạch phổi trở nên rõ rệt hơn; điều này một phần là do tình trạng giảm oxy máu xấu đi và một phần là do khả năng hạn chế của giường mao mạch phổi trong việc huy động các mạch máu mới và giãn nở bình thường để đáp ứng với sự gia tăng cung lượng tim liên quan đến gắng sức. Tuy nhiên, điều quan trọng là một phân nhóm bệnh nhân mắc bệnh phổi mô kẽ lan tỏa sẽ phát triển tăng áp động mạch phổi nặng hơn, và những thay đổi mạch máu phổi tương tự như ở những bệnh nhân bị tăng áp động mạch phổi vô căn (xem Chương 14). Ở những bệnh nhân này, tăng áp động mạch phổi là do một quá trình chính ảnh hưởng đến các mạch máu phổi ngoài sự phá hủy và xơ hóa của thành phế nang. Đáng chú ý, mức độ tăng áp động mạch phổi không tương quan tốt với mức độ xơ hóa ở bệnh nhân mắc bệnh phổi mô kẽ lan tỏa nhưng lại liên quan độc lập với tiên lượng xấu hơn. Do đó, mặc dù có mối liên quan rõ ràng giữa tăng áp động mạch phổi và các bệnh phổi mô kẽ lan tỏa, mối quan hệ sinh lý bệnh và lâm sàng chính xác vẫn chưa được làm sáng tỏ hoàn toàn.
Tăng áp động mạch phổi là phổ biến trong bệnh phổi mô kẽ lan tỏa nặng, do giảm oxy máu và tắc nghẽn các mạch máu phổi nhỏ.
ĐẶC ĐIỂM LÂM SÀNG
Bệnh nhân mắc bệnh phổi mô kẽ lan tỏa thường có triệu chứng khởi phát là khó thở. Khó thở ban đầu được nhận thấy khi gắng sức nhưng, với bệnh nặng, có thể cảm thấy ngay cả khi nghỉ ngơi. Ho, thường là ho khan, cũng phổ biến. Khi khám thực thể, nghe phổi đặc trưng cho thấy ran nổ khô, thường nổi bật nhất khi hít vào ở đáy phổi. Tuy nhiên, khả năng nghe thấy ran nổ phụ thuộc vào chẩn đoán cụ thể; ví dụ, ran nổ đặc biệt nổi bật trong IPF và ít gặp hơn trong bệnh sarcoidosis. Ngón tay dùi trống có thể có mặt, đặc biệt với một số loại bệnh phổi mô kẽ lan tỏa nhất định. Nếu tâm phế mạn phát triển, các dấu hiệu thực thể tim mạch có thể liên quan đến tăng áp động mạch phổi và phì đại thất phải.
Khám lồng ngực thường ghi nhận có ran nổ thì hít vào, đặc biệt ở đáy phổi.
PHƯƠNG PHÁP TIẾP CẬN CHẨN ĐOÁN
X-quang ngực là phương tiện quan trọng nhất để đánh giá đại thể ban đầu về bệnh phổi mô kẽ lan tỏa. Hình ảnh X-quang đặc trưng của tổn thương nhu mô lan tỏa chủ yếu liên quan đến thành phế nang được mô tả là dạng lưới (tăng các đường mờ) hoặc dạng lưới nốt (tăng các đường mờ và các nốt nhỏ; xem Hình 3.6). Kiểu hình này trước đây cũng được gọi là “kiểu hình kẽ” vì người ta tin rằng nó phản ánh một quá trình giới hạn ở thành phế nang. Tuy nhiên, mô bệnh học thường cho thấy một số quá trình này cũng lan vào các khoang phế nang. Việc không có bất thường trên X-quang ngực không loại trừ sự hiện diện của bệnh nhu mô lan tỏa; các kết quả X-quang ngực hoàn toàn bình thường đã được báo cáo ở tới 10% bệnh nhân. Kiểu hình trên X-quang ngực không đặc biệt hữu ích để đánh giá tỷ lệ tương đối của viêm so với xơ hóa, mỗi loại đều có thể dẫn đến một kiểu hình tương tự.
Các thay đổi dạng lưới hoặc lưới nốt thường lan tỏa khắp cả hai phế trường, mặc dù các nguyên nhân riêng lẻ của bệnh phổi mô kẽ lan tỏa có thể có nhiều khả năng dẫn đến sự chiếm ưu thế của các dấu hiệu bất thường ở thùy trên hoặc thùy dưới của phổi. Ngoài kiểu hình lưới hoặc lưới nốt, một số bệnh nhất định có thể cho thấy các dấu hiệu liên quan khác trên X-quang ngực, chẳng hạn như hạch rốn phổi hoặc bệnh màng phổi. Các đặc điểm bổ sung này được ghi nhận với một số bệnh sẽ được thảo luận trong Chương 10 và 11.
Kiểu hình lưới hoặc lưới nốt trên X-quang ngực là đặc trưng của nhiều bệnh phổi mô kẽ lan tỏa, nhưng có tới 10% bệnh nhân có kết quả X-quang bình thường.
Với bệnh kéo dài và nặng, phổi có thể bị biến dạng rõ rệt. Ngoài ra, các vùng hình thành nang giữa các khu vực phổi bị sẹo và co rút thường xảy ra (xem Hình 9.7). Một kiểu hình tương ứng là tổ ong trên X-quang ngực có thể rõ ràng. Tâm phế mạn có thể bị nghi ngờ trên X-quang ngực bởi sự hiện diện của phì đại thất phải, được đánh giá tốt nhất trên phim nghiêng (xem Hình 14.3).
Chụp cắt lớp vi tính độ phân giải cao (HRCT) ngực là một bước quan trọng trong việc đánh giá bệnh phổi mô kẽ lan tỏa (xem Hình 3.9 và 11.2). Do chất lượng hình ảnh của nhu mô phổi, những thay đổi sớm không rõ ràng trên X-quang ngực thông thường thường có thể được nhìn thấy bằng HRCT. Ngoài ra, kiểu hình bất thường cụ thể trên phim HRCT có thể gợi ý một chẩn đoán cơ bản cụ thể như IPF và có thể giúp phân biệt viêm với xơ hóa.
Rửa phế quản – phế nang (BAL) là một thủ thuật tương đối không xâm lấn để lấy mẫu quần thể tế bào của tình trạng viêm phế nang. Một ống nội soi phế quản mềm được đặt càng xa càng tốt vào một đường thở, và việc tưới hoặc rửa bằng nước muối sinh lý thông thường qua ống nội soi cho phép thu thập các tế bào từ các khoang phế nang. Những tế bào này được cho là đại diện cho các quần thể tế bào chịu trách nhiệm cho tình trạng viêm phế nang. Mặc dù kỹ thuật này đã hữu ích như một phương tiện tương đối không xâm lấn để lấy tế bào cho các nghiên cứu về bệnh phổi mô kẽ lan tỏa, nhưng tính hữu dụng lâm sàng của nó để chẩn đoán hoặc để đánh giá tuần tự hoạt động của bệnh là hạn chế. Các mẫu thu được bằng BAL trong đánh giá bệnh phổi mô kẽ lan tỏa chủ yếu hữu ích để loại trừ xuất huyết phổi hoặc nhiễm trùng.
Khi việc đánh giá cẩn thận các kết quả lâm sàng, X-quang, xét nghiệm, và chức năng phổi không cho phép bác sĩ lâm sàng đưa ra chẩn đoán chắc chắn, sinh thiết phổi sẽ được xem xét. Một loạt các thủ thuật sinh thiết đã được sử dụng để lấy mẫu mô từ phổi, sau đó được xử lý bằng một số kỹ thuật nhuộm thông thường. Các thủ thuật sinh thiết thường được sử dụng nhất cho mục đích này là sinh thiết phổi qua nội soi lồng ngực và sinh thiết xuyên phế quản (qua nội soi phế quản mềm). Gần đây hơn, sinh thiết lạnh bằng ống nội soi phế quản, sử dụng một chất làm lạnh lỏng để đóng băng mô được sinh thiết, đang được nghiên cứu như một phương tiện để lấy các mẫu lớn hơn, hữu ích hơn mà không cần phẫu thuật. Sinh thiết qua nội soi lồng ngực thường là thủ thuật thích hợp nhất để lấy một mẫu mô đủ lớn để kiểm tra. Tuy nhiên, khi nghi ngờ bệnh sarcoidosis (hoặc một số dạng bệnh nhu mô lan tỏa cụ thể khác), sinh thiết xuyên phế quản là một thủ thuật ban đầu đặc biệt phù hợp vì bệnh lý đặc trưng có mặt trong mô liền kề với các đường thở.
Các phát hiện về đánh giá chức năng của bệnh nhân mắc bệnh phổi mô kẽ lan tỏa đã được xem xét trong phần Sinh lý bệnh. Tóm lại, bệnh nhân có kiểu hình hạn chế trên xét nghiệm chức năng phổi, với các thể tích phổi giảm và luồng khí được bảo tồn. Khả năng khuếch tán thường giảm, cho thấy sự mất mát diện tích bề mặt để trao đổi khí. Giảm oxy máu thường (mặc dù không nhất thiết) có mặt, và giảm nhiều hơn nữa khi gắng sức. Tăng máu hiếm khi là một đặc điểm của bệnh. Khi nó xảy ra, tăng máu thường phản ánh bệnh giai đoạn tiền cuối hoặc một quá trình không liên quan bổ sung.
TÀI LIỆU THAM KHẢO ĐỀ XUẤT
- ATS/ERS Committee on Idiopathic Interstitial Pneumonias, Travis, W. D., Costabel, U., Hansell, D. M., King, T. E., Jr., Lynch, D. A., et al. (2013). An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. American Journal of Respiratory and Critical Care Medicine, 188, 733–748.
- Evans, C. M., Fingerlin, T. E., Schwarz, M. I., Lynch, D., Kurche, J., Warg, L., et al. (2016). Idiopathic pulmonary fibrosis: A genetic disease that involves mucociliary dysfunction of the peripheral airways. Physiological Reviews, 96, 1567–1592.
- Gruden, J. F., Naidich, D. P., Machnicki, S. C., Cohen, S. L., Girvin, F., & Raoof, S. (2020). An algorithmic approach to the interpretation of diffuse lung disease on chest CT imaging: A theory of almost everything. Chest, 157, 612–635.
- Hariri, L. P., Roden, A. C., Chung, J. H., Danoff, S. K., Gomez Manjarres, D. C., Hartwig, M., et al. (2021). The role of surgical lung biopsy in the diagnosis of fibrotic interstitial lung disease: Perspective from the Pulmonary Fibrosis Foundation. Annals of the American Thoracic Society, 18, 1601–1609.
- Iftikhar, I. H., Alghothani, L., Sardi, A., Berkowitz, D., & Musani, A. I. (2017). Transbronchial lung cryobiopsy and video-assisted thoracoscopic lung biopsy in the diagnosis of diffuse parenchymal lung disease. A meta-analysis of diagnostic test accuracy. Annals of the American Thoracic Society, 14, 1197–1211.
- Inoue, Y., Kaner, R. J., Guiot, J., Maher, T. M., Tomassetti, S., Moiseev, S., et al. (2020). Diagnostic and prognostic biomarkers for chronic fibrosing interstitial lung diseases with a progressive phenotype. Chest, 158, 646–659.
- Lama, V. N., & Martinez, F. J. (2004). Resting and exercise physiology in interstitial lung diseases. Clinics in Chest Medicine, 25, 435–453.
- Maldonado, F., Danoff, S. K., Wells, A. U., Colby, T. V., Ryu, J. H., Liberman, M., et al. (2020). Transbronchial cryobiopsy for the diagnosis of interstitial lung diseases: CHEST guideline and expert panel report. Chest, 157, 1030–1042.
- Plantier, L., Cazes, A., Dinh-Xuan, A. T., Bancal, C., Marchand-Adam, S., & Crestani, B. (2018). Physiology of the lung in idiopathic pulmonary fibrosis. European Respiratory Review, 27, 170062.
- Rackow, A. R., Nagel, D. J., McCarthy, C., Judge, J., Lacy, S., Freeberg, M. A. T., et al. (2020). The self-fulfilling prophecy of pulmonary fibrosis: A selective inspection of pathological signalling loops. European Respiratory Journal, 56, 2000075.
- Raj, R., Raparia, K., Lynch, D. A., & Brown, K. K. (2017). Surgical lung biopsy for interstitial lung diseases. Chest, 151, 1131–1140.
- Ryerson, C. J., Corte, T. J., Lee, J. S., Richeldi, L., Walsh, S. L. F., Myers, J. L., et al. (2017). A standardized diagnostic ontology for fibrotic interstitial lung disease. American Journal of Respiratory and Critical Care Medicine, 196, 1249–1254.
- Selman, M., & Pardo, A. (2021). When things go wrong: exploring possible mechanisms driving the progressive fibrosis phenotype in interstitial lung diseases. European Respiratory Journal, 58, 2004507.
- Spagnolo, P., Ryerson, C. J., Putman, R., Oldham, J., Salisbury, M., Sverzellati, N., et al. (2021). Early diagnosis of fibrotic interstitial lung disease: Challenges and opportunities. Lancet Respiratory Medicine, 9, 1065–1076.
- Verschakelen, J. A. (2010). The role of high-resolution computed tomography in the work-up of interstitial lung disease. Current Opinion in Pulmonary Medicine, 16, 503–510.
- Wells, A. U. (2010). The clinical utility of bronchoalveolar lavage in diffuse parenchymal lung disease. European Respiratory Review, 19, 237–241.
Bảng Chú Giải Thuật Ngữ Y Khoa Anh-Việt. Chương 9. Bệnh Phổi Nhu Mô Lan Tỏa
| STT | Thuật ngữ tiếng Anh | Cách phát âm | Nghĩa Tiếng Việt |
|---|---|---|---|
| 1 | Alveolar wall | /ælˈviːələr wɔːl/ | Thành phế nang |
| 2 | Diffuse scarring | /dɪˈfjuːz ˈskɑːrɪŋ/ | Sẹo lan tỏa |
| 3 | Fibrosis | /faɪˈbroʊsɪs/ | Xơ hóa (quá trình hình thành mô sợi) |
| 4 | Interstitial lung diseases | /ˌɪntərˈstɪʃəl lʌŋ dɪˈziːzɪz/ | Bệnh phổi kẽ |
| 5 | Misnomer | /mɪsˈnoʊmər/ | Tên gọi sai lệch |
| 6 | Interstitium | /ˌɪntərˈstɪʃəm/ | Mô kẽ (vùng giữa các tế bào) |
| 7 | Epithelial cells | /ˌepɪˈθiːliəl sɛlz/ | Tế bào biểu mô |
| 8 | Endothelial cells | /ˌɛndoʊˈθiːliəl sɛlz/ | Tế bào nội mô |
| 9 | Parenchymal lung disease | /pəˈrɛŋkɪməl lʌŋ dɪˈziːz/ | Bệnh nhu mô phổi |
| 10 | Idiopathic interstitial pneumonias | /ˌɪdioʊpəˈθɪk ˌɪntərˈstɪʃəl nuˈmoʊniəz/ | Viêm phổi kẽ vô căn |
| 11 | Pneumoconiosis | /ˌnuːmoʊˌkoʊniˈoʊsɪs/ | Bệnh phổi bụi |
| 12 | Asbestosis | /ˌæzbɛˈstoʊsɪs/ | Bệnh phổi amiăng |
| 13 | Silicosis | /ˌsɪlɪˈkoʊsɪs/ | Bệnh phổi silic |
| 14 | Hypersensitivity pneumonitis | /ˌhaɪpərsɛnsɪˈtɪvɪti nuˈmoʊnaɪtɪs/ | Viêm phổi quá mẫn |
| 15 | Iatrogenic | /aɪˌætrəˈdʒɛnɪk/ | Do y khoa gây ra |
| 16 | Radiation pneumonitis | /ˌreɪdiˈeɪʃən nuˈmoʊnaɪtɪs/ | Viêm phổi do xạ trị |
| 17 | Systemic rheumatic disease | /sɪˈstɛmɪk ruˈmætɪk dɪˈziːz/ | Bệnh thấp khớp toàn thân |
| 18 | Connective tissue disease | /kəˈnɛktɪv ˈtɪʃu dɪˈziːz/ | Bệnh mô liên kết |
| 19 | Sarcoidosis | /ˌsɑːrkɔɪˈdoʊsɪs/ | Bệnh sarcoid |
| 20 | Langerhans cell histiocytosis | /ˈlæŋərˌhænz sɛl ˌhɪstiˌoʊsaɪˈtoʊsɪs/ | Bệnh tăng sản tế bào Langerhans |
| 21 | Lymphangioleiomyomatosis | /lɪmˌfændʒioʊˌlaɪoʊˌmaɪəməˈtoʊsɪs/ | Bệnh lymphangioleiomyomatosis |
| 22 | Goodpasture syndrome | /ˈgʊdˌpæstʃər ˈsɪndroʊm/ | Hội chứng Goodpasture |
| 23 | Granulomatosis with polyangiitis | /ˌgrænjoʊləməˈtoʊsɪs wɪð ˌpɑlɪˌændʒiˈaɪtɪs/ | Viêm hạt với đa viêm mạch |
| 24 | Chronic eosinophilic pneumonia | /ˈkrɑnɪk ˌiːsɪnəˈfɪlɪk nuˈmoʊniə/ | Viêm phổi ái toan mãn tính |
| 25 | Alveolar proteinosis | /ælˈviːələr ˌproʊtiˈnoʊsɪs/ | Bệnh protein phế nang |
| 26 | Heart failure | /hɑrt ˈfeɪljər/ | Suy tim |
| 27 | Lymphangitic carcinomatosis | /ˌlɪmfænˈdʒɪtɪk ˌkɑrsɪnoʊməˈtoʊsɪs/ | Ung thư lan theo bạch huyết |
| 28 | Pneumocystis | /ˌnuːmoʊˈsɪstɪs/ | Vi khuẩn Pneumocystis |
| 29 | Viral pneumonia | /ˈvaɪrəl nuˈmoʊniə/ | Viêm phổi virus |
| 30 | Alveolitis | /ˌælviəˈlaɪtɪs/ | Viêm phế nang |
| 31 | Fibrotic process | /faɪˈbrɑtɪk ˈproʊsɛs/ | Quá trình xơ hóa |
| 32 | Idiopathic pulmonary fibrosis | /ˌɪdioʊpəˈθɪk ˈpʌlməˌnɛri faɪˈbroʊsɪs/ | Xơ phổi vô căn (IPF) |
| 33 | Epithelial cell injury | /ˌepɪˈθiːliəl sɛl ˈɪndʒəri/ | Tổn thương tế bào biểu mô |
| 34 | Abnormal repair | /æbˈnɔrməl rɪˈpɛr/ | Sửa chữa bất thường |
| 35 | Macrophages | /ˈmækroʊˌfeɪdʒəz/ | Đại thực bào |
| 36 | Lymphocytes | /ˈlɪmfəˌsaɪts/ | Tế bào lympho |
| 37 | Neutrophils | /ˈnutrəˌfɪlz/ | Bạch cầu trung tính |
| 38 | Eosinophils | /ˌiːsɪnəˈfɪlz/ | Bạch cầu ái toan |
| 39 | Plasma cells | /ˈplæzmə sɛlz/ | Tế bào plasma |
| 40 | Granuloma | /ˌgrænjoʊˈloʊmə/ | Hạt u (tổn thương viêm mạn tính) |
| 41 | Epithelioid histiocytes | /ˌepɪˈθiːliˌɔɪd ˈhɪstiəˌsaɪts/ | Tế bào biểu mô dạng histiocyte |
| 42 | Monocyte lineage | /ˈmɑnəˌsaɪt ˈlɪniɪdʒ/ | Dòng tế bào đơn nhân |
| 43 | T lymphocytes | /ti ˈlɪmfəˌsaɪts/ | Tế bào lympho T |
| 44 | Caseating granuloma | /ˈkeɪsiˌeɪtɪŋ ˌgrænjoʊˈloʊmə/ | Hạt u hoại tử |
| 45 | Necrotizing granuloma | /ˈnɛkrəˌtaɪzɪŋ ˌgrænjoʊˈloʊmə/ | Hạt u hoại tử |
| 46 | Noncaseating granulomas | /nɑnˈkeɪsiˌeɪtɪŋ ˌgrænjoʊˈloʊməz/ | Hạt u không hoại tử |
| 47 | Multinucleated giant cells | /ˌmʌltiˈnukliˌeɪtɪd ˈdʒaɪənt sɛlz/ | Tế bào khổng lồ đa nhân |
| 48 | Phagocytic cells | /ˌfægəˈsɪtɪk sɛlz/ | Tế bào thực bào |
| 49 | Abundant cytoplasm | /əˈbʌndənt ˈsaɪtəˌplæzəm/ | Tế bào chất dồi dào |
| 50 | Exogenous agent | /ɪkˈsɑdʒənəs ˈeɪdʒənt/ | Tác nhân ngoại sinh |
| 51 | Usual interstitial pneumonia | /ˈjuːʒuəl ˌɪntərˈstɪʃəl nuˈmoʊniə/ | Viêm phổi kẽ thông thường (UIP) |
| 52 | High-resolution computed tomography | /haɪ ˌrɛzəˈluʃən kəmˈpjutɪd təˈmɑgrəfi/ | Chụp cắt lớp vi tính độ phân giải cao (HRCT) |
| 53 | Nonspecific interstitial pneumonia | /nɑnspəˈsɪfɪk ˌɪntərˈstɪʃəl nuˈmoʊniə/ | Viêm phổi kẽ không đặc hiệu (NSIP) |
| 54 | Respiratory bronchiolitis | /rɪˈspɪrəˌtɔri ˌbrɑŋkiəˈlaɪtɪs/ | Viêm tiểu phế quản hô hấp |
| 55 | Interstitial lung disease | /ˌɪntərˈstɪʃəl lʌŋ dɪˈziːz/ | Bệnh phổi kẽ (RB-ILD) |
| 56 | Desquamative interstitial pneumonia | /dɪˈskwæməˌtɪv ˌɪntərˈstɪʃəl nuˈmoʊniə/ | Viêm phổi kẽ tróc vảy (DIP) |
| 57 | Cryptogenic organizing pneumonia | /ˌkrɪptoʊˈdʒɛnɪk ˈɔrgəˌnaɪzɪŋ nuˈmoʊniə/ | Viêm phổi tổ chức hóa vô căn (COP) |
| 58 | Organizing pneumonia | /ˈɔrgəˌnaɪzɪŋ nuˈmoʊniə/ | Viêm phổi tổ chức hóa |
| 59 | Bronchiolitis obliterans | /ˌbrɑŋkiəˈlaɪtɪs əˈblɪtəˌrænz/ | Viêm tắc tiểu phế quản |
| 60 | Acute interstitial pneumonia | /əˈkjut ˌɪntərˈstɪʃəl nuˈmoʊniə/ | Viêm phổi kẽ cấp (AIP) |
| 61 | Diffuse alveolar damage | /dɪˈfjuːz ælˈviːələr ˈdæmɪdʒ/ | Tổn thương phế nang lan tỏa (DAD) |
| 62 | Ground glass | /graʊnd glæs/ | Mờ kính mài (hình ảnh X-quang) |
| 63 | Reticular pattern | /rɪˈtɪkjələr ˈpætərn/ | Hình lưới |
| 64 | Honeycombing | /ˈhʌniˌkoʊmɪŋ/ | Tổ ong (hình ảnh X-quang) |
| 65 | Bronchial wall thickening | /ˈbrɑŋkiəl wɔl ˈθɪkənɪŋ/ | Dày thành phế quản |
| 66 | Centrilobular nodules | /ˌsɛntrɪˈlɑbjələr ˈnɑdjulz/ | Nốt ở trung tâm thùy phổi |
| 67 | Patchy consolidation | /ˈpætʃi kənˌsɑləˈdeɪʃən/ | Đông đặc thành mảng |
| 68 | Subpleural | /sʌbˈplʊrəl/ | Dưới màng phổi |
| 69 | Diffuse alveolar filling | /dɪˈfjuːz ælˈviːələr ˈfɪlɪŋ/ | Tràn đầy phế nang lan tỏa |
| 70 | Systemic lupus erythematosus | /sɪˈstɛmɪk ˈlupəs ˌɛrɪθiməˈtoʊsəs/ | Lupus ban đỏ hệ thống |
| 71 | Rheumatoid arthritis | /ˈruməˌtɔɪd ɑrˈθraɪtɪs/ | Viêm khớp dạng thấp |
| 72 | Systemic sclerosis | /sɪˈstɛmɪk skləˈroʊsɪs/ | Xơ cứng hệ thống |
| 73 | Scleroderma | /ˌsklɛrəˈdɜrmə/ | Bệnh da cứng |
| 74 | Parenchymal fibrosis | /pəˈrɛŋkɪməl faɪˈbroʊsɪs/ | Xơ hóa nhu mô |
| 75 | Interstitial inflammation | /ˌɪntərˈstɪʃəl ˌɪnfləˈmeɪʃən/ | Viêm mô kẽ |
| 76 | Fibroblastic foci | /ˌfaɪbroʊˈblæstɪk ˈfoʊsaɪ/ | Ổ nguyên bào sợi |
| 77 | Proliferating fibroblasts | /prəˈlɪfəˌreɪtɪŋ ˈfaɪbroʊˌblæsts/ | Nguyên bào sợi tăng sinh |
| 78 | Cystic air spaces | /ˈsɪstɪk ɛr ˈspeɪsəz/ | Khoang khí dạng nang |
| 79 | Retraction | /rɪˈtrækʃən/ | Co kéo |
| 80 | Fibrotic lung tissue | /faɪˈbrɑtɪk lʌŋ ˈtɪʃu/ | Mô phổi xơ hóa |
| 81 | Type II pneumocytes | /taɪp tu nuˈmoʊsaɪts/ | Tế bào phế nang loại II |
| 82 | Alveolar epithelial cells | /ælˈviːələr ˌepɪˈθiːliəl sɛlz/ | Tế bào biểu mô phế nang |
| 83 | Hyperplasia | /ˌhaɪpərˈpleɪʒə/ | Tăng sản |
| 84 | Type I cells | /taɪp wʌn sɛlz/ | Tế bào loại I |
| 85 | Acellular collagenous scarring | /eɪˈsɛljələr kəˈlædʒənəs ˈskɑrɪŋ/ | Sẹo collagen không có tế bào |
| 86 | Ongoing process | /ˈɔnˌgoʊɪŋ ˈproʊsɛs/ | Quá trình đang diễn ra |
| 87 | Histopathologic pattern | /ˌhɪstoʊˌpæθəˈlɑdʒɪk ˈpætərn/ | Mô hình mô bệnh học |
| 88 | Drug-induced lung diseases | /drʌg ɪnˈdust lʌŋ dɪˈziːzəz/ | Bệnh phổi do thuốc |
| 89 | Histologic pattern | /ˌhɪstəˈlɑdʒɪk ˈpætərn/ | Mô hình mô học |
| 90 | Clinical disease | /ˈklɪnɪkəl dɪˈziːz/ | Bệnh lâm sàng |
| 91 | Mononuclear cell infiltration | /ˌmɑnoʊˈnukliər sɛl ˌɪnfɪlˈtreɪʃən/ | Thâm nhiễm tế bào đơn nhân |
| 92 | Relatively uniform | /ˈrɛlətɪvli ˈjunəˌfɔrm/ | Tương đối đồng nhất |
| 93 | Natural history | /ˈnætʃərəl ˈhɪstəri/ | Tiến triển tự nhiên |
| 94 | Tobacco smoking | /təˈbækoʊ ˈsmoʊkɪŋ/ | Hút thuốc lá |
| 95 | Pigmented macrophages | /ˈpɪgmənəd ˈmækroʊˌfeɪdʒəz/ | Đại thực bào có sắc tố |
| 96 | Respiratory bronchioles | /rɪˈspɪrəˌtɔri ˈbrɑŋkiˌoʊlz/ | Tiểu phế quản hô hấp |
| 97 | Infiltrate | /ˈɪnfɪlˌtreɪt/ | Thâm nhiễm |
| 98 | Alveolar inflammation | /ælˈviːələr ˌɪnfləˈmeɪʃən/ | Viêm phế nang |
| 99 | Clinical intervention | /ˈklɪnɪkəl ˌɪntərˈvɛnʃən/ | Can thiệp lâm sàng |
| 100 | Quit smoking | /kwɪt ˈsmoʊkɪŋ/ | Bỏ hút thuốc |
| 101 | Intra-alveolar mononuclear cells | /ˌɪntrə ælˈviːələr ˌmɑnoʊˈnukliər sɛlz/ | Tế bào đơn nhân trong phế nang |
| 102 | Desquamated alveolar epithelial cells | /dɪˈskwæmeɪtəd ælˈviːələr ˌepɪˈθiːliəl sɛlz/ | Tế bào biểu mô phế nang bong tróc |
| 103 | Intra-alveolar macrophages | /ˌɪntrə ælˈviːələr ˈmækroʊˌfeɪdʒəz/ | Đại thực bào trong phế nang |
| 104 | Temporally uniform | /ˈtɛmpərəli ˈjunəˌfɔrm/ | Đồng nhất về thời gian |
| 105 | Architectural distortion | /ˌɑrkɪˈtɛktʃərəl dɪˈstɔrʃən/ | Biến dạng cấu trúc |
| 106 | Underlying etiology | /ˌʌndərˈlaɪɪŋ ˌitiˈɑlədʒi/ | Nguyên nhân gốc |
| 107 | Organizing fibrosis | /ˈɔrgəˌnaɪzɪŋ faɪˈbroʊsɪs/ | Xơ hóa tổ chức |
| 108 | Granulation tissue | /ˌgrænjoʊˈleɪʃən ˈtɪʃu/ | Mô hạt |
| 109 | Small airways | /smɔl ˈɛrˌweɪz/ | Đường thở nhỏ |
| 110 | Chronic interstitial inflammation | /ˈkrɑnɪk ˌɪntərˈstɪʃəl ˌɪnfləˈmeɪʃən/ | Viêm mô kẽ mãn tính |
| 111 | Intraluminal involvement | /ˌɪntrəˈlumənəl ɪnˈvɑlvmənt/ | Tổn thương trong lòng |
| 112 | Key feature | /ki ˈfitʃər/ | Đặc điểm then chốt |
| 113 | Toxic inhalants | /ˈtɑksɪk ɪnˈheɪlənts/ | Chất độc hít vào |
| 114 | Idiopathic form | /ˌɪdioʊpəˈθɪk fɔrm/ | Dạng vô căn |
| 115 | Organizing stage | /ˈɔrgəˌnaɪzɪŋ steɪdʒ/ | Giai đoạn tổ chức hóa |
| 116 | Acute respiratory distress syndrome | /əˈkjut rɪˈspɪrəˌtɔri dɪˈstrɛs ˈsɪndroʊm/ | Hội chứng suy hô hấp cấp (ARDS) |
| 117 | Inciting cause | /ɪnˈsaɪtɪŋ kɔz/ | Nguyên nhân khởi phát |
| 118 | Initiating trigger | /ɪˈnɪʃiˌeɪtɪŋ ˈtrɪgər/ | Yếu tố khởi động |
| 119 | Fibroblast proliferation | /ˈfaɪbroʊˌblæst prəˌlɪfəˈreɪʃən/ | Tăng sinh nguyên bào sợi |
| 120 | Type II pneumocyte hyperplasia | /taɪp tu nuˈmoʊsaɪt ˌhaɪpərˈpleɪʒə/ | Tăng sản tế bào phế nang loại II |
| 121 | End-stage disease | /ɛnd steɪdʒ dɪˈziːz/ | Bệnh giai đoạn cuối |
| 122 | Extended time | /ɪkˈstɛndəd taɪm/ | Thời gian kéo dài |
| 123 | Significant fibrosis | /sɪgˈnɪfɪkənt faɪˈbroʊsɪs/ | Xơ hóa đáng kể |
| 124 | Distinctive features | /dɪˈstɪŋktɪv ˈfitʃərz/ | Đặc điểm đặc biệt |
| 125 | Prior interstitial inflammation | /ˈpraɪər ˌɪntərˈstɪʃəl ˌɪnfləˈmeɪʃən/ | Viêm mô kẽ trước đó |
| 126 | Granulomatous lung diseases | /ˌgrænjoʊˈlɑmətəs lʌŋ dɪˈziːzəz/ | Bệnh phổi hạt u |
| 127 | Final common pathway | /ˈfaɪnəl ˈkɑmən ˈpæθˌweɪ/ | Đường chung cuối cùng |
| 128 | Architectural distortion | /ˌɑrkɪˈtɛktʃərəl dɪˈstɔrʃən/ | Biến dạng cấu trúc |
| 129 | Grossly and microscopically | /ˈgroʊsli ænd ˌmaɪkrəˈskɑpɪkli/ | Đại thể và vi thể |
| 130 | Contraction | /kənˈtrækʃən/ | Co kéo |
| 131 | Cystic spaces | /ˈsɪstɪk ˈspeɪsəz/ | Khoang nang |
| 132 | Honeycomb lung | /ˈhʌniˌkoʊm lʌŋ/ | Phổi tổ ong |
| 133 | Dense scarring | /dɛns ˈskɑrɪŋ/ | Sẹo dày đặc |
| 134 | Intervening cystic regions | /ˌɪntərˈvinɪŋ ˈsɪstɪk ˈridʒənz/ | Vùng nang xen kẽ |
| 135 | Pathogenetic sequence | /ˌpæθoʊdʒəˈnɛtɪk ˈsikwəns/ | Chuỗi bệnh sinh |
| 136 | Cellular and biochemical events | /ˈsɛljələr ænd ˌbaɪoʊˈkɛmɪkəl ɪˈvɛnts/ | Sự kiện tế bào và sinh hóa |
| 137 | Descriptive level | /dɪˈskrɪptɪv ˈlɛvəl/ | Mức độ mô tả |
| 138 | Genetic factors | /dʒəˈnɛtɪk ˈfæktərz/ | Yếu tố di truyền |
| 139 | Primary determinant | /ˈpraɪˌmɛri dɪˈtɜrmənənt/ | Yếu tố quyết định chính |
| 140 | Important modifier | /ɪmˈpɔrtənt ˈmɑdəˌfaɪər/ | Yếu tố điều chỉnh quan trọng |
| 141 | Potentially injurious exposure | /pəˈtɛnʃəli ɪnˈdʒʊriəs ɪkˈspoʊʒər/ | Tiếp xúc có khả năng gây tổn thương |
| 142 | Gene variants | /dʒin ˈvɛriənts/ | Biến thể gen |
| 143 | Mucins | /ˈmjusɪnz/ | Mucin (protein dạng gel) |
| 144 | MUC5B | /mjuk faɪv bi/ | Protein MUC5B |
