(SÁCH DỊCH) Sản Phụ khoa Căn bản – Essential Obstetrics and Gynaecology
Tác giả: Ian Symonds & Sabaratnam Arulkumaran – (C) NXB Elsevier
Ths.Bs. Lê Đình Sáng (Dịch và Chú giải)
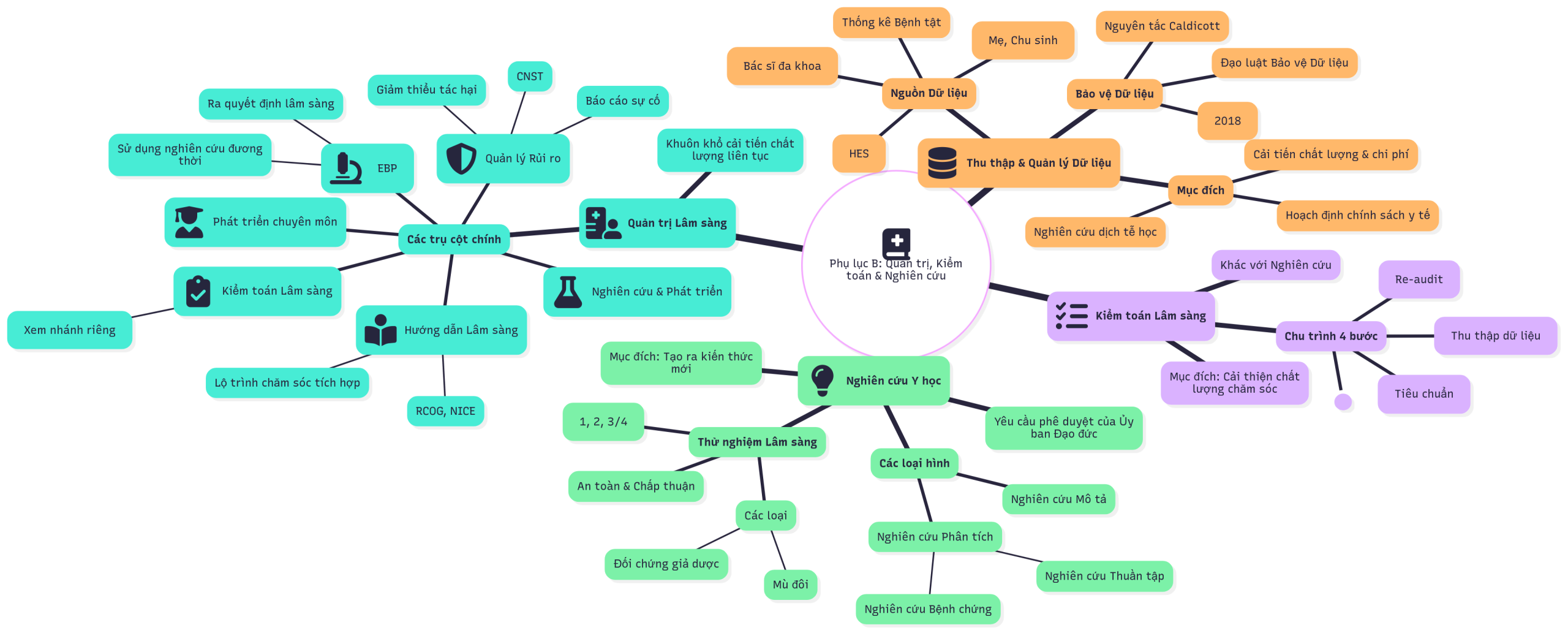
Phụ lục B. Quản trị, kiểm toán và nghiên cứu
Governance, audit and research
Tahir Mahmood; Sambit Mukhopadhyay
Essential Obstetrics and Gynaecology, Appendix B, 375-381
MỤC TIÊU HỌC TẬP
Sau khi học xong phụ lục này, bạn sẽ có thể:
Tiêu chí kiến thức
Kỹ năng và thái độ chuyên môn
|
Thu thập dữ liệu trong Dịch vụ Y tế Quốc gia (NHS)
Bệnh nhân kết nối với bác sĩ của họ ở tuyến chăm sóc ban đầu hoặc tại bệnh viện. Giao diện đầu tiên thường xảy ra ở tuyến chăm sóc ban đầu, chiếm 80% các cuộc tiếp xúc giữa bệnh nhân và hệ thống y tế.
Tại bệnh viện, bệnh nhân được khám tại các phòng khám ngoại trú hoặc trong tình trạng cấp cứu thông qua các đơn vị tiếp nhận cấp tính. Một tỷ lệ nhỏ bệnh nhân cuối cùng sẽ được nhập viện nội trú, để chẩn đoán sâu hơn hoặc cần can thiệp phẫu thuật hoặc nội khoa. Ở mỗi giai đoạn trong hành trình của bệnh nhân, thông tin được thu thập dưới dạng giấy (bệnh án) hoặc nhập vào hệ thống dữ liệu điện tử (bệnh án không giấy).
Thách thức đối với các nhà hoạch định chính sách y tế trước hết là đảm bảo rằng thông tin được thu thập tại các giao diện ban đầu và thứ cấp có thể được liên kết với cơ sở dữ liệu quốc gia để xác định xu hướng về mô hình bệnh tật, nhu cầu của dân số và lập kế hoạch cho dịch vụ y tế trong tương lai.
Thách thức thứ hai là đảm bảo các bộ dữ liệu phải mạnh mẽ và “sạch” ở định dạng có thể dễ dàng phân tích. Những dữ liệu này giúp thực hiện các nghiên cứu dịch tễ học như tỷ lệ tử vong mẹ. Dữ liệu này cũng cho phép so sánh quốc tế như báo cáo của Tổ chức Y tế Thế giới (WHO) về Tử vong mẹ và so sánh khu vực về tỷ lệ mổ lấy thai và cắt tử cung ở Anh. Thứ ba, các dự án cải tiến chất lượng tại địa phương và hiệu quả chi phí phụ thuộc rất nhiều vào tính chính xác của những dữ liệu này. NHS Right Care, một bộ phận của NHS Anh, cung cấp dữ liệu cho các ủy viên để cải thiện chi phí tiềm năng trong việc cung cấp dịch vụ chăm sóc sức khỏe.
Nguồn thu thập dữ liệu và hệ thống máy tính
Tư vấn và đăng ký của bác sĩ đa khoa
Tất cả các giao diện của bệnh nhân với chăm sóc ban đầu đều được ghi lại để có thể hình thành một bức tranh về lý do tại sao bệnh nhân liên hệ với bác sĩ đa khoa (GP) của họ, chẳng hạn như chẩn đoán trầm cảm, nhiễm trùng đường hô hấp trên, viêm khớp, chấn thương nhẹ, chảy máu âm đạo, nhu cầu tránh thai, v.v. Hơn nữa, những dữ liệu này cũng có thể được sử dụng để đáp ứng các mục tiêu chất lượng quốc gia bằng cách thiết lập các tín hiệu cảnh báo, ví dụ:
- Hơn 90% phụ nữ đủ điều kiện làm xét nghiệm tế bào học cổ tử cung đã được sàng lọc.
Đăng ký khai sinh và khai tử
Từ năm 1838, đã có một hệ thống đăng ký khai sinh và khai tử bắt buộc ở Anh và xứ Wales. Khi là một bác sĩ trẻ, bạn có thể được yêu cầu điền vào giấy chứng tử. Điều quan trọng là phải tuân thủ hướng dẫn một cách cẩn thận và điền thông tin chính xác. Giấy chứng tử có hai phần:
- Nguyên nhân trực tiếp gây tử vong
- Các yếu tố góp phần vào nguyên nhân tử vong
Việc đăng ký tất cả các ca sinh là một yêu cầu pháp lý, bất kể nơi sinh. Do đó, có thể biết chính xác tỷ lệ trẻ em được sinh tại nhà hoặc tại các đơn vị sản khoa.
Sử dụng những dữ liệu này, cũng có thể nghiên cứu chi tiết những thay đổi về tỷ lệ sinh và tỷ lệ tử trên 1000 dân. Việc lấy tỷ lệ sinh trừ đi tỷ lệ tử sẽ cho ra tốc độ tăng trưởng dân số hàng năm.
Thống kê Tình trạng Nhập viện (Hospital Episode Statistics – HES)
HES thu thập dữ liệu hành chính và lâm sàng của bệnh nhân nội trú được ghi chép từ bệnh án của họ. Dữ liệu lâm sàng bao gồm tình trạng chính gây ra việc nhập viện, các tình trạng liên quan khác và mô tả cũng như ngày thực hiện bất kỳ cuộc phẫu thuật nào. Dữ liệu hành chính bao gồm ngày bệnh nhân được đưa vào danh sách chờ, nguồn và ngày nhập viện, chuyên khoa, ngày xuất viện hoặc tử vong và nơi đến sau khi xuất viện hoặc chuyển viện. Dữ liệu cung cấp thông tin hoạt động tổng thể như số ca phẫu thuật được thực hiện như cắt tử cung và mổ lấy thai, và thông tin này có thể được sử dụng trong việc lập kế hoạch cho các dịch vụ bệnh viện như nhu cầu giường bệnh sản khoa tại địa phương.
Thống kê tỷ lệ tử vong
Những số liệu này được tính toán từ các ca nhập viện. Dữ liệu tử vong mẹ ở Vương quốc Anh đã được báo cáo thông qua một báo cáo ba năm một lần kể từ năm 1952. Các báo cáo này cho chúng ta biết rằng băng huyết sau sinh nặng, bệnh lý tăng huyết áp trong thai kỳ, nhiễm trùng và bệnh thuyên tắc tĩnh mạch vẫn là những nguyên nhân chính gây tử vong mẹ. Tuy nhiên, kể từ năm 2012, báo cáo tử vong mẹ hiện được công bố hàng năm và đề cập đến một chủ đề cụ thể đóng góp lớn hơn vào các ca tử vong mẹ. Báo cáo hàng năm của Cuộc điều tra Quốc gia về Kết cục và Tử vong của Bệnh nhân (NCEPOD) phân tích dữ liệu về các ca tử vong chu phẫu và đã báo cáo rằng chỉ có 22% nhóm nguy cơ cao được chăm sóc tại một đơn vị chăm sóc tích cực, do đó nhận được sự chăm sóc dưới mức tối ưu dẫn đến tử vong.
Dữ liệu về tỷ lệ tử vong chu sinh (PNMR) được thu thập hàng năm. Chúng bao gồm số ca thai chết lưu trong thai kỳ và tử vong trong tuần đầu tiên sau sinh trên 1000 ca sinh sống. Dữ liệu này bao gồm tất cả các thai nhi sau 20 tuần tuổi thai hoặc nặng 500g. Sinh non là nguyên nhân phổ biến nhất gây tử vong chu sinh, tiếp theo là dị tật bẩm sinh và trẻ nhẹ cân so với tuổi thai. PNMR là một chỉ số chính được sử dụng để so sánh chất lượng cung cấp dịch vụ chăm sóc sức khỏe giữa các đơn vị sản khoa trong một quốc gia và để so sánh chất lượng chăm sóc trên toàn thế giới. Hiệp hội Sản Phụ khoa Hoàng gia Anh (RCOG) đã được tài trợ để nghiên cứu sâu tất cả các ca thai chết lưu nhằm xác định (các) nguyên nhân cơ bản trong mỗi trường hợp để xem liệu những thay đổi chính sách trước sinh hoặc trong chuyển dạ trong các đơn vị sản khoa có thể làm giảm những mất mát này hay không. RCOG công bố một báo cáo hàng năm, Every Baby Counts (Mỗi đứa trẻ đều có giá trị), có thể truy cập tại www.rcog.org.uk.
Thống kê tỷ lệ bệnh tật
Dữ liệu nhập viện được sử dụng để xem xét dữ liệu bệnh tật liên quan đến các bệnh cụ thể: ví dụ, dữ liệu bệnh tật liên quan đến thai kỳ được ghi nhận bằng cách tính toán tỷ lệ mắc băng huyết sau sinh nặng (mất máu > 2,5 L), nhập viện tại đơn vị chăm sóc tích cực sau sinh, đột quỵ trong thai kỳ, thuyên tắc phổi và huyết khối tĩnh mạch sâu, v.v. Tại Scotland, tất cả các trường hợp bệnh tật nặng ở mẹ đều được báo cáo cho NHS Quality Improvement Scotland, và một báo cáo hàng năm (khảo sát suýt tử vong) được công bố cho thấy dữ liệu so sánh cho tất cả các đơn vị sản khoa.
Nghiên cứu và liên kết dữ liệu
Việc liên kết các hồ sơ cho chúng ta một bức tranh về toàn bộ quá trình bệnh tật và về các bệnh khác nhau xảy ra trong cuộc đời của một cá nhân. Cũng có thể sử dụng liên kết hồ sơ giữa các cơ sở dữ liệu khác nhau để phát triển các chỉ số chất lượng như tỷ lệ tái nhập viện của bệnh nhân trong vòng 28 ngày với chẩn đoán huyết khối tĩnh mạch sâu hoặc số bệnh nhân phải phẫu thuật lại.
Đạo luật Bảo vệ Dữ liệu
Các Đạo luật Bảo vệ Dữ liệu ở Vương quốc Anh và Úc tìm cách tạo ra sự cân bằng giữa quyền của cá nhân và các lợi ích đôi khi cạnh tranh của những người có lý do chính đáng để sử dụng thông tin cá nhân. Nhân viên nắm giữ hoặc xử lý dữ liệu cá nhân phải tuân thủ các nguyên tắc sau. Thông tin cá nhân phải được:
- Xử lý một cách công bằng và hợp pháp
- Xử lý cho các mục đích hạn chế
- Đầy đủ, phù hợp và không quá mức cần thiết
- Chính xác và cập nhật
- Không lưu giữ lâu hơn mức cần thiết
- Xử lý theo quyền của cá nhân
- Luôn được giữ an toàn
- Không chuyển đến các quốc gia khác trừ khi quốc gia đó có sự bảo vệ đầy đủ cho các cá nhân
Quy định chung về Bảo vệ Dữ liệu, 2018 (GDPR)
Các luật bảo vệ dữ liệu trước đây được ban hành trong những năm 1990 và đã không thể theo kịp với mức độ thay đổi công nghệ. Quy định chung về Bảo vệ Dữ liệu (GDPR) được giới thiệu vào ngày 25 tháng 5 năm 2018 để cập nhật các quy tắc về dữ liệu cá nhân. Đây là một quy định bắt buộc trong luật của EU về bảo vệ dữ liệu và quyền riêng tư cho tất cả các cá nhân trong Liên minh Châu Âu và Khu vực Kinh tế Châu Âu (EEA). Nó cũng đề cập đến việc xuất khẩu dữ liệu cá nhân ra ngoài EEA và EU. Do đó, ngay cả các công ty và tổ chức đăng ký bên ngoài EEA và EU nhưng hoạt động tại Châu Âu cũng phải tuân thủ quy định này.
Về cơ bản, GDPR cung cấp các quyền mới cho mọi người để truy cập thông tin mà các công ty/tổ chức nắm giữ về họ, và có những nghĩa vụ đối với các tổ chức để quản lý dữ liệu tốt hơn hoặc có nguy cơ bị phạt theo một chế độ mới.
Hai thuật ngữ chính trong GDPR liên quan đến dữ liệu cá nhân và dữ liệu nhạy cảm. Dữ liệu cá nhân có thể là bất cứ thứ gì cho phép một người sống được nhận dạng trực tiếp hoặc gián tiếp. Đây có thể là tên, địa chỉ hoặc thậm chí là địa chỉ IP. Nó bao gồm dữ liệu cá nhân tự động và dữ liệu ẩn danh nếu một người có thể được nhận dạng.
Dữ liệu cá nhân nhạy cảm bao gồm các loại thông tin đặc biệt. Chúng bao gồm khuynh hướng tình dục, niềm tin tôn giáo, quan điểm chính trị, thông tin về chủng tộc, v.v. Theo GDPR, việc sử dụng dữ liệu cá nhân phải:
- Công bằng (được định nghĩa là cách tiếp cận thiện chí đối với việc sử dụng dữ liệu)
- Hợp pháp (yêu cầu tuân thủ bất kỳ luật hiện hành nào)
- Minh bạch (bao gồm nghĩa vụ thông báo và truyền thông liên quan)
Cơ sở pháp lý – việc xử lý dữ liệu phải có một trong các điều kiện sau: sự đồng ý, hợp đồng, nghĩa vụ pháp lý, lợi ích sống còn, nhiệm vụ công và lợi ích hợp pháp. Ngoài ra, khi dữ liệu cá nhân liên quan đến sức khỏe, phải áp dụng một cơ sở pháp lý khác. Các cơ sở phù hợp nhất trong số này sẽ là:
- Việc cung cấp dịch vụ chăm sóc sức khỏe
- Sự đồng ý rõ ràng
- Bảo vệ lợi ích sống còn của một cá nhân khi họ không thể đồng ý
GDPR cũng quy định các quyền của chủ thể dữ liệu. Bệnh nhân có các quyền mới đối với dữ liệu của họ.
- Quyền được thông báo, thường được đề cập trong các thông báo về quyền riêng tư
- Quyền truy cập vào bệnh án, dù là điện tử hay giấy
- Quyền được cải chính
- Quyền được xóa bỏ
- Quyền hạn chế xử lý
- Quyền di chuyển dữ liệu
- Quyền phản đối
- Các quyền liên quan đến việc ra quyết định tự động và lập hồ sơ
GDPR cũng khuyên nên sử dụng các phương pháp đáng tin cậy để truyền dữ liệu. Nếu truyền dữ liệu qua Internet, nên sử dụng giao thức truyền thông được mã hóa. Máy fax chỉ nên được sử dụng như một phương sách cuối cùng, và máy fax chỉ nên được những người có quyền hợp pháp truy cập.
Hệ thống bưu chính cũ kỹ vẫn được coi là đáng tin cậy hơn.
Các nguyên tắc Caldicott
Tại Vương quốc Anh, Báo cáo Caldicott (1997) đã khuyến nghị việc bổ nhiệm một Người bảo vệ Caldicott trong mỗi tổ chức NHS và nhân viên xử lý thông tin nhận dạng bệnh nhân phải đảm bảo rằng các nguyên tắc Caldicott được đáp ứng mỗi khi thông tin được chuyển giao, tức là bằng lời nói, văn bản, phương tiện điện tử hoặc bất kỳ phương tiện nào khác.
Khi bạn xem xét việc thực hiện một cuộc kiểm toán lâm sàng đòi hỏi phải xem xét bệnh án, bạn phải xin phép Người bảo vệ Caldicott của bệnh viện. Quy trình này đảm bảo rằng bạn tuân thủ các nguyên tắc quản trị thông tin và dữ liệu được trích xuất phải được ẩn danh. Bạn không được lưu trữ dữ liệu trên máy tính cá nhân của mình. Bạn chỉ có thể sử dụng các ổ USB được mã hóa đã được cấp phép.
Mạng xã hội
Mạng xã hội đóng một vai trò quan trọng trong thực hành ngày nay. Các mạng xã hội quen thuộc nhất là Facebook, Twitter, Instagram và Snapchat. Trong mỗi nền tảng có thể có các mạng chuyên đề như LinkedIn, Mumsnet, Patients Like Me, Metoo, blog, chia sẻ video, v.v.
Ước tính có khoảng 60% dân số trưởng thành ở Vương quốc Anh sử dụng một số hình thức mạng xã hội. Tỷ lệ sử dụng trong giới trẻ cao hơn. Có những lợi ích và rủi ro tiềm tàng cho các bác sĩ và chuyên gia y tế nếu họ tham gia vào mạng xã hội. Mặc dù có những lợi thế của việc kết nối chuyên môn và xã hội và công chúng tiếp cận thông tin liên quan đến sức khỏe từ các chuyên gia, nhưng những thách thức tồn tại trong việc duy trì tính bảo mật và ranh giới nghề nghiệp và cá nhân. Do đó, điều quan trọng là tất cả các bác sĩ phải nhận thức và tuân thủ hướng dẫn của Hội đồng Y khoa Tổng quát về việc sử dụng mạng xã hội.
Chăm sóc sức khỏe dựa trên bằng chứng
Thực hành dựa trên bằng chứng là quá trình tìm kiếm và sử dụng một cách có hệ thống các kết quả nghiên cứu đương thời làm cơ sở cho việc ra quyết định lâm sàng và là một phần không thể thiếu của khuôn khổ quản trị lâm sàng. Để tạo điều kiện thuận lợi cho việc phát triển thực hành dựa trên bằng chứng, cần áp dụng các quy trình sau:
- Xác định các lĩnh vực trong thực hành mà từ đó có thể hình thành các câu hỏi lâm sàng rõ ràng.
- Xác định bằng chứng liên quan tốt nhất từ các tài liệu có sẵn như các hướng dẫn.
- Thẩm định phê bình bằng chứng về tính hợp lệ và hữu ích trên lâm sàng.
- Thực hiện và kết hợp các phát hiện phù hợp vào thực hành.
- Sau đó đo lường hiệu suất so với các kết quả mong đợi hoặc so với các đồng nghiệp.
- Đảm bảo nhân viên được hỗ trợ và phát triển thông qua việc cung cấp đủ nguồn lực cho các chương trình giáo dục và đào tạo về thực hành dựa trên bằng chứng.
Kiểm toán lâm sàng
Kiểm toán lâm sàng là sự phân tích có hệ thống và phê bình về chất lượng chăm sóc lâm sàng, bao gồm các quy trình được sử dụng để chẩn đoán và điều trị, việc sử dụng các nguồn lực liên quan và kết quả cuối cùng cho bệnh nhân. Một cuộc kiểm toán lâm sàng nên tìm cách cải thiện chất lượng và kết quả chăm sóc bệnh nhân thông qua việc các bác sĩ lâm sàng kiểm tra và sửa đổi thực hành của họ theo các tiêu chuẩn về những gì có thể đạt được dựa trên bằng chứng tốt nhất hiện có (Hộp B1.1).
Hộp B1.1 Những thông tin chính về kiểm toán lâm sàng
|
Bốn bước của một cuộc kiểm toán lâm sàng
Xác định thực hành tốt nhất
Lĩnh vực được xác định phải giải quyết các khía cạnh quan trọng của thực hành về chất lượng chăm sóc, chẳng hạn như tỷ lệ nhiễm trùng cao sau mổ lấy thai.
Giai đoạn tiếp theo là mô tả thực hành hiện tại để minh họa vấn đề và xác định các lĩnh vực cần cải thiện. Điều này có thể được thực hiện bằng cách xem xét các nguồn tài liệu như Hướng dẫn Green Top của RCOG, Mạng lưới Hướng dẫn Liên trường Scotland (SIGN), Viện Y tế và Chất lượng điều trị Quốc gia (NICE), các tuyên bố của RANZCOG về sức khỏe phụ nữ và trang web bằng chứng của NHS.
Cuối cùng, một lĩnh vực quan tâm cụ thể được xác định trong hướng dẫn sẽ giúp xác định một ‘tiêu chuẩn’ (một tuyên bố rộng về thực hành tốt dựa trên bằng chứng tốt nhất có thể) để đo lường thực hành hiện tại (điều này được gọi là tiêu chí). Các tiêu chí đề cập đến các nguồn lực được sử dụng để đạt được tiêu chuẩn thành công (cấu trúc), các hành động phải được thực hiện (quy trình) và kết quả (kết cục).
Chuẩn bị để theo dõi
Các tiêu chí phải dễ đo lường và thu thập dữ liệu liên quan, và dữ liệu thu thập được phải hữu ích về mặt lâm sàng. Dữ liệu cơ bản được thu thập trước tiên, cung cấp một điểm khởi đầu để từ đó có thể đo lường sự tiến bộ. Tiêu chuẩn nên được phổ biến rộng rãi thông qua các bản tin và các cuộc họp khoa phòng đến các khoa và nhân viên lâm sàng để họ nhận thức được về cuộc kiểm toán.
Theo dõi thành tích của bạn
Điều quan trọng là phải thống nhất về cỡ mẫu và khung thời gian với người giám sát lâm sàng của bạn để hoàn thành chu trình kiểm toán. Người quản lý hệ thống thông tin bệnh viện có thể có thông tin về số lượng bệnh nhân với các tình trạng lâm sàng cụ thể để bạn có thể ước tính mất bao lâu để thu thập dữ liệu của mình. Bước tiếp theo sẽ là thống nhất ai sẽ thu thập dữ liệu và ai sẽ ghi lại nó trên một gói phần mềm kiểm toán để tạo ra phản hồi kịp thời.
Lập kế hoạch cải tiến
Sau khi dữ liệu kiểm toán đã được thu thập, bản tóm tắt kiểm toán phải được hoàn thành và kết quả được xem xét cẩn thận để cung cấp phản hồi mang tính xây dựng cho nhóm lâm sàng. Kết quả nên được thảo luận với các nhóm chuyên môn để xin ý kiến của họ về việc giải thích kết quả và lập kế hoạch hành động. Các lĩnh vực thực hành tốt được nêu bật rõ ràng, và các lĩnh vực cần được giải quyết được ghi nhận rõ ràng. Một cá nhân được chỉ định nên được xác định để có thể thực hiện và theo dõi những thay đổi phù hợp trong chính sách.
Điều quan trọng cần nhớ là kiểm toán lâm sàng là một quá trình liên tục, và một cuộc kiểm toán lâm sàng thường dẫn đến một cuộc kiểm toán lâm sàng thứ hai để chứng minh rằng chu trình kiểm toán đầu tiên đã tạo ra những thay đổi có thể đo lường được, dẫn đến việc xác định lại chính sách của đơn vị hoặc áp dụng các phương pháp cung cấp dịch vụ chăm sóc mới để đáp ứng các tiêu chuẩn quốc gia. Do đó, trách nhiệm của bác sĩ thực hiện kiểm toán lâm sàng là viết một báo cáo chi tiết và đưa ra các khuyến nghị phù hợp về cách nhóm bác sĩ nền tảng tiếp theo có thể tiếp tục với cùng chủ đề để đảm bảo rằng chu trình kiểm toán thứ hai hoặc thứ ba được hoàn thành.
Kiểm toán lâm sàng quốc gia
Dữ liệu tử vong và bệnh tật của mẹ được sử dụng làm chỉ số chất lượng cho các dịch vụ sản khoa trên toàn quốc và quốc tế. Các ca tử vong mẹ được phân loại thành nguyên nhân trực tiếp khi có các nguyên nhân sản khoa và cái chết xảy ra trong thai kỳ hoặc trong vòng 42 ngày đầu sau sinh. Các nguyên nhân phổ biến nhất gây tử vong mẹ trực tiếp là băng huyết sau sinh nặng, bệnh lý tăng huyết áp trong thai kỳ, nhiễm trùng mắc phải trong cộng đồng và huyết khối tĩnh mạch sâu. Các nguyên nhân gián tiếp gây tử vong bao gồm các nguyên nhân không phải sản khoa như tự tử xảy ra trong vòng 1 năm sau khi sinh. Mỗi ca tử vong mẹ đều được một hội đồng chuyên gia phân tích sâu. Tương tự, dữ liệu tử vong chu sinh cũng được thu thập. Các phân tích của họ cung cấp dữ liệu và xu hướng về các nguyên nhân tử vong chu sinh, và các nguyên nhân chính là thai chết lưu không rõ nguyên nhân và tử vong liên quan đến sinh non.
Hướng dẫn lâm sàng
Hướng dẫn lâm sàng đã được định nghĩa là những tuyên bố được phát triển một cách có hệ thống để hỗ trợ các bác sĩ trong các quyết định quản lý bệnh nhân về việc chăm sóc sức khỏe phù hợp cho các hoàn cảnh lâm sàng cụ thể. Hướng dẫn Green Top của RCOG là một nguồn tài liệu tuyệt vời.
Việc phát triển các hướng dẫn lâm sàng là một quy trình khá tốn thời gian và có thể mất từ 18 đến 24 tháng để phát triển hướng dẫn từ khi bắt đầu đến khi hoàn thành nhiệm vụ. Ở giai đoạn đầu, các câu hỏi lâm sàng trong một hướng dẫn được thống nhất. Chúng cung cấp khuôn khổ cho việc tổng quan hệ thống các bằng chứng có sẵn. Các tài liệu được tổng hợp và bằng chứng được phân loại bằng cách sử dụng nhóm làm việc Phân loại Khuyến nghị, Đánh giá, Phát triển và Thẩm định (GRADE). Cũng được chấp nhận rằng đối với nhiều liệu pháp, các thử nghiệm ngẫu nhiên có đối chứng hoặc tổng quan hệ thống các thử nghiệm ngẫu nhiên có đối chứng có thể không có sẵn. Trong những trường hợp đó, dữ liệu quan sát có thể cung cấp bằng chứng tốt hơn, như thường thấy đối với kết cục của chúng.
- Các mức độ bằng chứng GRADE: Chúng được phân loại từ mức 1 (thử nghiệm ngẫu nhiên có đối chứng cho một tổng quan hệ thống) đến mức 4 (ý kiến chuyên gia): thông tin chi tiết hơn có tại www.sign.ac.uk. Sau khi bằng chứng đã được đối chiếu cho mỗi câu hỏi lâm sàng, nó sẽ được thẩm định và xem xét.
Dựa trên mức độ bằng chứng, các khuyến nghị được đưa ra trong một hướng dẫn lâm sàng.
- Phân loại khuyến nghị: Các khuyến nghị cho các hướng dẫn dựa trên bằng chứng được phân loại từ Hạng A (dựa trên phân tích gộp, tổng quan hệ thống hoặc thử nghiệm ngẫu nhiên có đối chứng) đến Điểm thực hành tốt nơi các bác sĩ lâm sàng đưa ra một khuyến nghị đồng thuận (www.rcog.org.uk).
Lộ trình chăm sóc tích hợp đã được mô tả là hành trình của một bệnh nhân qua tất cả các giao diện trong hệ thống chăm sóc sức khỏe và nên chăm sóc tất cả các bước trong hành trình của bệnh nhân từ chăm sóc ban đầu đến chăm sóc thứ cấp và tam cấp. Mỗi giai đoạn của một lộ trình chăm sóc tích hợp nên có một danh sách kiểm tra được xác định rõ ràng về các biện pháp được khuyến nghị để đảm bảo rằng các nhà cung cấp dịch vụ chăm sóc đã tuân thủ các khuyến nghị đó và sự chăm sóc phù hợp đã được cung cấp.
Các nguyên tắc được ghi trong một hướng dẫn lâm sàng cần được điều chỉnh cho phù hợp với việc sử dụng tại địa phương (quy trình địa phương) để một lộ trình chăm sóc được phát triển để dễ dàng truy cập vào các hướng dẫn về cách chăm sóc bệnh nhân trong phạm vi cung cấp dịch vụ tại địa phương và việc tuân thủ quy trình địa phương có thể được theo dõi.
Nghiên cứu
Mục đích chính của nghiên cứu là tạo ra kiến thức mới có thể khái quát hóa, trong khi mục đích của kiểm toán là đo lường các tiêu chuẩn chăm sóc.
Đối với nghiên cứu lâm sàng, đơn xin phê duyệt được gửi đến một ủy ban đạo đức nghiên cứu được thành lập phù hợp, trong khi thông thường không cần sự phê duyệt như vậy cho một cuộc kiểm toán lâm sàng.
Có một động lực pháp lý và đạo đức để đảm bảo rằng nghiên cứu được tiến hành với sự tôn trọng tối đa đối với những người tham gia và quyền riêng tư của họ, ngay cả khi nghiên cứu không liên quan đến chăm sóc lâm sàng. Người ta thường tin rằng cần phải có sự đồng ý rõ ràng để sử dụng dữ liệu cá nhân có thể nhận dạng cho nghiên cứu y học, đặc biệt là cho các nghiên cứu đa trung tâm hoặc thứ cấp nơi những người không phải là thành viên của nhóm lâm sàng cần truy cập vào dữ liệu. Kỹ năng, thái độ và cam kết của những người quản lý và sử dụng cơ sở dữ liệu nghiên cứu là quan trọng để bảo vệ quyền riêng tư của các chủ thể dữ liệu của nó.
Đã có những lo ngại được bày tỏ về hành vi sai trái phổ biến trong nghiên cứu. Sự thiếu trung thực này trong việc công bố các phát hiện sai lầm để thăng tiến sự nghiệp hoặc nhận phần thưởng tài chính đã làm suy yếu niềm tin của công chúng vào nghiên cứu y học.
Các loại hình nghiên cứu
Nghiên cứu mô tả
Nghiên cứu mô tả cung cấp thông tin có thể được sử dụng để kiểm định một giả thuyết nguyên nhân học được tạo ra bởi các phương pháp nghiên cứu khác. Ví dụ, các tác động độc hại lâu dài của thuốc lá và mối quan hệ với sự phát triển của ung thư phổi lần đầu tiên được phát hiện bởi các nghiên cứu dịch tễ học. Khá thường xuyên, các nghiên cứu mô tả đã được sử dụng để chứng minh những nghi ngờ nảy sinh từ các nguồn khác, ví dụ: ung thư biểu mô âm đạo ở trẻ em do mẹ điều trị stilboestrol, tăng đường huyết của mẹ trong thai kỳ liên quan đến trẻ to so với tuổi thai và u trung biểu mô màng phổi do phơi nhiễm amiăng. Tương tự, dữ liệu về bệnh đa xơ cứng cho thấy nó xảy ra với tần suất tương tự ở người Mỹ gốc Phi và người da trắng ở các bang phía bắc Hoa Kỳ. Quan sát này cho thấy rằng các ảnh hưởng môi trường là cực kỳ quan trọng trong việc xác định liệu bệnh có phổ biến hay hiếm gặp.
Nghiên cứu phân tích
Hai loại quan sát dịch tễ học được thực hiện trong các nhóm cá nhân thay vì quần thể và cung cấp bằng chứng cho thấy một sự kiện cụ thể có thể là nguyên nhân của một bệnh cụ thể. Nghiên cứu bệnh chứng so sánh những người mắc bệnh và những người không mắc bệnh. Nghiên cứu thuần tập so sánh những người tiếp xúc với nguyên nhân nghi ngờ và những người không tiếp xúc. Hai loại nghiên cứu này trả lời hai câu hỏi khác nhau.
Để giải thích điều này, giả sử rằng cần phải điều tra để xác định liệu việc sinh bằng kẹp forcep và chấn thương đi kèm với đầu của trẻ sơ sinh có thể dẫn đến tổn thương não, sau đó có thể biểu hiện thành bệnh động kinh ở trẻ em hay không.
Một nghiên cứu bệnh chứng sẽ bao gồm việc so sánh tiền sử sản khoa của một nhóm trẻ em bị động kinh với nhóm trẻ em đối chứng không bị động kinh. Nếu phát hiện ra rằng tỷ lệ trẻ em bị động kinh có tiền sử sinh bằng kẹp forcep vượt quá tỷ lệ trẻ em đối chứng, điều này sẽ cho thấy rằng việc sinh bằng kẹp forcep có thể là một nguyên nhân của bệnh động kinh; nhưng có nhiều yếu tố quyết định khác của bệnh động kinh nên trong nhóm bệnh nhân động kinh chỉ một tỷ lệ nhỏ các trường hợp có thể được quy cho việc sinh bằng kẹp forcep. Tỷ lệ này có thể được tính bằng một công thức toán học.
Một nghiên cứu thuần tập về cùng một vấn đề sẽ so sánh một nhóm trẻ em được sinh bằng kẹp forcep với một nhóm trẻ em được sinh thường. Nếu phát hiện ra rằng tỷ lệ trẻ em sinh bằng kẹp forcep phát triển bệnh động kinh vượt quá tỷ lệ trẻ em phát triển bình thường, điều này sẽ cho thấy rằng việc sinh bằng kẹp forcep có liên quan và có thể là một nguyên nhân của bệnh động kinh. Việc sinh bằng kẹp forcep không phải lúc nào cũng dẫn đến bệnh động kinh, chỉ xảy ra ở một tỷ lệ nhỏ trẻ em được sinh theo cách này. Bằng cách sử dụng các phép tính toán học, có thể tính toán nguy cơ vượt trội hoặc nguy cơ quy thuộc.
Thử nghiệm lâm sàng
Thử nghiệm lâm sàng được thực hiện trong nghiên cứu y học và phát triển thuốc để cho phép thu thập dữ liệu về an toàn và hiệu quả cho các can thiệp sức khỏe. Một thử nghiệm lâm sàng có thể được thiết kế để:
- Đánh giá sự an toàn và hiệu quả của thuốc mới, ví dụ: kháng sinh.
- Đánh giá sự an toàn và hiệu quả của một liều lượng thuốc khác với liều thường được sử dụng, ví dụ: liều 5 IU oxytocin thay vì liều 10 IU cho giai đoạn ba của chuyển dạ.
- Đánh giá sự an toàn và hiệu quả của một thiết bị phẫu thuật, ví dụ: dụng cụ phẫu thuật nội soi.
- So sánh hiệu quả của hai hoặc nhiều can thiệp đã được phê duyệt, ví dụ: so sánh thuốc 1 với thuốc 2.
Thử nghiệm lâm sàng thường được tiến hành theo ba giai đoạn:
- Giai đoạn 1 để thử nghiệm phương pháp điều trị trên một vài người khỏe mạnh để biết liệu nó có an toàn để sử dụng hay không.
- Giai đoạn 2 để thử nghiệm phương pháp điều trị trên một vài bệnh nhân để xem liệu nó có hoạt động chống lại bệnh trong ngắn hạn hay không.
- Thử nghiệm Giai đoạn 3/4 để thử nghiệm phương pháp điều trị trên vài trăm đến vài nghìn bệnh nhân, thường tại nhiều phòng khám hoặc bệnh viện khác nhau. Những thử nghiệm này thường so sánh phương pháp điều trị mới với một phương pháp điều trị đã được sử dụng hoặc đôi khi không có điều trị.
Các thử nghiệm lâm sàng ngẫu nhiên có thể là:
- Mù đôi: Các đối tượng và các nhà nghiên cứu tham gia vào nghiên cứu không biết họ nhận được phương pháp điều trị nào. Việc làm mù này là để ngăn chặn sự thiên vị để bác sĩ không biết bệnh nhân nào đang được điều trị nghiên cứu và bệnh nhân nào đang nhận giả dược hoặc, trong một nghiên cứu so sánh hai loại thuốc, liệu đó là thuốc A hay thuốc B.
- Đối chứng giả dược: Việc sử dụng giả dược (điều trị giả) cho phép các nhà nghiên cứu cô lập các tác động của phương pháp điều trị nghiên cứu. Điều quan trọng là phương pháp điều trị giả phải được kết hợp chặt chẽ với phương pháp điều trị bằng thuốc thật. Bệnh nhân trong cả hai nhóm nghiên cứu được theo dõi rất chặt chẽ về tác động của điều trị và các tác dụng phụ mà bệnh nhân ở cả hai nhóm gặp phải.
Tất cả các thử nghiệm lâm sàng phải được ủy ban đạo đức phê duyệt và được giám sát bởi một hội đồng chuyên gia. Điều quan trọng là trước khi tuyển một bệnh nhân vào một thử nghiệm lâm sàng, phải có một bản chấp thuận sau khi được thông tin đầy đủ đã được ký. Quá trình phân bổ ngẫu nhiên được thống nhất trước khi bắt đầu một thử nghiệm lâm sàng.
Trách nhiệm của nhà nghiên cứu lâm sàng là đảm bảo rằng sự an toàn của các đối tượng được theo dõi chặt chẽ đối với bất kỳ kết cục bất lợi nào. Do đó, các thử nghiệm lâm sàng về thuốc được thiết kế để loại trừ phụ nữ trong độ tuổi sinh đẻ, phụ nữ có thai và/hoặc phụ nữ có thai trong quá trình nghiên cứu.
Kết quả của các thử nghiệm thuốc được gửi đến cơ quan cấp phép quốc gia phù hợp.
Quản trị lâm sàng
Quản trị lâm sàng đã được định nghĩa là một khuôn khổ để cải tiến liên tục việc chăm sóc bệnh nhân bằng cách giảm thiểu các rủi ro lâm sàng (Hộp B1.2).
Hộp B1.2 Các thuộc tính chính liên quan đến việc thúc đẩy một tổ chức chất lượng
|
Quản lý rủi ro
Quản lý rủi ro đơn giản có nghĩa là ‘phát triển thực hành tốt và giảm thiểu sự xuất hiện của các sự cố có hại hoặc bất lợi’. Rủi ro lâm sàng được định nghĩa là ‘một sai sót lâm sàng khác với điều trị, chăm sóc, can thiệp điều trị hoặc kết quả chẩn đoán dự định; có thể có hoặc không có kết cục không mong muốn’. Ví dụ, nếu bệnh nhân trong một đơn vị sản khoa bị nhiễm trùng vết mổ sau mổ lấy thai, điều này dẫn đến thời gian nằm viện kéo dài, tăng sự khó chịu cho bệnh nhân và tăng khối lượng công việc cũng như chi phí cho nhân viên làm việc tại đơn vị đó. Điều quan trọng là phải xem xét các vấn đề rộng hơn xung quanh tình huống này, chẳng hạn như vệ sinh khoa phòng, không tuân thủ các chính sách kiểm soát nhiễm khuẩn, không tuân theo các hướng dẫn quốc gia về dự phòng nhiễm khuẩn huyết và giải quyết nhu cầu giáo dục và đào tạo của nhân viên. Mỗi đơn vị nên có một chiến lược rủi ro lâm sàng và một hệ thống để báo cáo, theo dõi và đánh giá các sự cố lâm sàng và các trường hợp suýt xảy ra. Các trường hợp suýt xảy ra đã được mô tả là ‘sự cố có khả năng gây hại có thể có hậu quả bất lợi cho bệnh nhân/người chăm sóc’. Tương tự, cần có một hệ thống để báo cáo, theo dõi và học hỏi từ các khiếu nại để cải thiện chăm sóc bệnh nhân.
Chương trình Bồi thường Sơ suất Lâm sàng Quốc gia cho các Quỹ Tín thác (CNST) được thành lập vào năm 1995. Với CNST đặc biệt trong sản khoa, mỗi đơn vị trả một khoản phí bảo hiểm dựa trên quy mô của đơn vị và mức độ đạt được thông qua các tiêu chuẩn CNST và nhận được chiết khấu cho việc quản lý rủi ro lâm sàng. Có ba cấp độ công nhận CNST: cấp độ bạn đạt được càng cao, chiết khấu càng cao. Người ta đã công nhận rằng các tiêu chuẩn CNST đã góp phần rất nhiều vào việc thúc đẩy quản lý rủi ro và giảm thiểu rủi ro lâm sàng.
Báo cáo sự cố lâm sàng
Báo cáo sự cố lâm sàng là cần thiết cho nhân viên và bệnh nhân trong việc nêu bật bất kỳ lĩnh vực nào mà một cá nhân hoặc tổ chức không cung cấp được tiêu chuẩn chăm sóc phù hợp. Báo cáo sự cố cung cấp một khuôn khổ để phát hiện các sự cố không mong muốn và các trường hợp suýt xảy ra, cho phép thực hiện các hành động và rút ra bài học, xem xét lại các thực hành và chia sẻ thông tin để ngăn chặn tái diễn. Chúng ta hãy lấy một ví dụ về việc theo dõi các vết rách tầng sinh môn độ ba và độ bốn trong một đơn vị sản khoa. Những sự cố này được báo cáo, và thông tin được đối chiếu. Các báo cáo hàng tháng sẽ xác định xem số lượng vết rách độ ba hoặc độ bốn có đang tăng lên sau các ca sinh có can thiệp dụng cụ hay không. Quan sát đó sẽ đặt ra câu hỏi liệu các bác sĩ thực hiện các thủ thuật đó có đủ kỹ năng, được đào tạo và giám sát phù hợp hay không.
Kết luận
Điều quan trọng là phải nhận thức rằng quản trị lâm sàng là về việc đảm bảo cải tiến chất lượng liên tục, bền vững, chỉ có thể đạt được bằng những nỗ lực quyết tâm và có ý thức của nhân viên lâm sàng và phi lâm sàng, những người có sự hỗ trợ thích hợp của tổ chức để cung cấp thực hành tốt nhất. Cải tiến chất lượng dựa trên các hệ thống và quy trình mạnh mẽ sau:
- quản lý rủi ro lâm sàng và kiểm toán lâm sàng
- thực hành và phát triển chuyên môn liên tục
- thực hiện và phát triển chuyên môn liên tục trong tổ chức NHS
- nghiên cứu và phát triển
- chăm sóc sức khỏe dựa trên bằng chứng.
TÓM TẮT Ý CHÍNH
Bảng chú giải thuật ngữ Anh-Việt
| STT | Thuật ngữ tiếng Anh | Phiên âm IPA | Nghĩa Tiếng Việt |
|---|---|---|---|
| 1 | Governance | /ˈɡʌvərnəns/ | Quản trị |
| 2 | Audit | /ˈɔːdɪt/ | Kiểm toán |
| 3 | Research | /ˈriːsɜːrtʃ/ | Nghiên cứu |
| 4 | Data | /ˈdeɪtə/ | Dữ liệu |
| 5 | Storage | /ˈstɔːrɪdʒ/ | Lưu trữ |
| 6 | Retrieval | /rɪˈtriːvl/ | Truy xuất |
| 7 | Analysis | /əˈnæləsɪs/ | Phân tích |
| 8 | Presentation | /ˌpriːzenˈteɪʃn/ | Trình bày |
| 9 | Clinical data | /ˈklɪnɪkl ˈdeɪtə/ | Dữ liệu lâm sàng |
| 10 | Interpretation | /ɪnˌtɜːrprəˈteɪʃn/ | Diễn giải |
| 11 | Confidentiality | /ˌkɑːnfɪˌdenʃiˈæləti/ | Tính bảo mật |
| 12 | Data Protection Act | /ˈdeɪtə prəˈtekʃn ækt/ | Đạo luật Bảo vệ Dữ liệu |
| 13 | Audit cycle | /ˈɔːdɪt ˈsaɪkl/ | Chu trình kiểm toán |
| 14 | Obstetrics | /əbˈstetrɪks/ | Sản khoa |
| 15 | Gynaecology | /ˌɡaɪnəˈkɑːlədʒi/ | Phụ khoa |
| 16 | Maternal mortality | /məˈtɜːrnl mɔːrˈtæləti/ | Tử vong mẹ |
| 17 | Perinatal mortality | /ˌperɪˈneɪtl mɔːrˈtæləti/ | Tử vong chu sinh |
| 18 | Guidelines | /ˈɡaɪdlaɪnz/ | Hướng dẫn |
| 19 | Integrated care pathways | /ˈɪntɪɡreɪtɪd ker ˈpæθweɪz/ | Lộ trình chăm sóc tích hợp |
| 20 | Protocols | /ˈproʊtəkɔːlz/ | Quy trình |
| 21 | National Institute for Health and Clinical Excellence (NICE) | /ˈnæʃnəl ˈɪnstɪtuːt fər helθ ænd ˈklɪnɪkl ˈeksələns/ | Viện Y tế và Chất lượng điều trị Quốc gia (NICE) |
| 22 | Royal College of Obstetricians and Gynaecologists (RCOG) | /ˈrɔɪəl ˈkɑːlɪdʒ əv ˌɑːbstəˈtrɪʃnz ænd ˌɡaɪnəˈkɑːlədʒɪsts/ | Hiệp hội Sản Phụ khoa Hoàng gia Anh (RCOG) |
| 23 | Clinical effectiveness | /ˈklɪnɪkl ɪˈfektɪvnəs/ | Hiệu quả lâm sàng |
| 24 | Evidence-based practice | /ˈevɪdəns beɪst ˈpræktɪs/ | Thực hành dựa trên bằng chứng |
| 25 | Clinical trial | /ˈklɪnɪkl ˈtraɪəl/ | Thử nghiệm lâm sàng |
| 26 | Evidence classification | /ˈevɪdəns ˌklæsɪfɪˈkeɪʃn/ | Phân loại bằng chứng |
| 27 | Grades of recommendation | /ɡreɪdz əv ˌrekəmenˈdeɪʃn/ | Mức độ khuyến nghị |
| 28 | Risk management | /rɪsk ˈmænɪdʒmənt/ | Quản lý rủi ro |
| 29 | Incident reporting | /ˈɪnsɪdənt rɪˈpɔːrtɪŋ/ | Báo cáo sự cố |
| 30 | Research design | /ˈriːsɜːrtʃ dɪˈzaɪn/ | Thiết kế nghiên cứu |
| 31 | Critical analysis | /ˈkrɪtɪkl əˈnæləsɪs/ | Phân tích phê bình |
| 32 | Statistics | /stəˈtɪstɪks/ | Thống kê |
| 33 | Ethical issues | /ˈeθɪkl ˈɪʃuːz/ | Vấn đề đạo đức |
| 34 | Primary care | /ˈpraɪmeri ker/ | Chăm sóc ban đầu |
| 35 | Hospital setting | /ˈhɑːspɪtl ˈsetɪŋ/ | Môi trường bệnh viện |
| 36 | Outpatient clinics | /ˈaʊtpeɪʃnt ˈklɪnɪks/ | Phòng khám ngoại trú |
| 37 | Emergency | /ɪˈmɜːrdʒənsi/ | Cấp cứu |
| 38 | Acute admission units | /əˈkjuːt ədˈmɪʃn ˈjuːnɪts/ | Đơn vị tiếp nhận cấp tính |
| 39 | Inpatient beds | /ˈɪnpeɪʃnt bedz/ | Giường bệnh nội trú |
| 40 | Diagnostic workup | /ˌdaɪəɡˈnɑːstɪk ˈwɜːrkʌp/ | Chẩn đoán sâu hơn |
| 41 | Surgical intervention | /ˈsɜːrdʒɪkl ˌɪntərˈvenʃn/ | Can thiệp phẫu thuật |
| 42 | Medical intervention | /ˈmedɪkl ˌɪntərˈvenʃn/ | Can thiệp nội khoa |
| 43 | Case notes | /keɪs noʊts/ | Bệnh án |
| 44 | Electronic data systems | /ɪˌlekˈtrɑːnɪk ˈdeɪtə ˈsɪstəmz/ | Hệ thống dữ liệu điện tử |
| 45 | Paperless notes | /ˈpeɪpərləs noʊts/ | Bệnh án không giấy |
| 46 | Health care planners | /helθ ker ˈplænərz/ | Nhà hoạch định chính sách y tế |
| 47 | National databases | /ˈnæʃnəl ˈdeɪtəbeɪsɪz/ | Cơ sở dữ liệu quốc gia |
| 48 | Disease patterns | /dɪˈziːz ˈpætərnz/ | Mô hình bệnh tật |
| 49 | Population needs | /ˌpɑːpjuˈleɪʃn niːdz/ | Nhu cầu của dân số |
| 50 | Health service planning | /helθ ˈsɜːrvɪs ˈplænɪŋ/ | Lập kế hoạch dịch vụ y tế |
| 51 | Data sets | /ˈdeɪtə sets/ | Bộ dữ liệu |
| 52 | Epidemiological studies | /ˌepɪˌdiːmiəˈlɑːdʒɪkl ˈstʌdiz/ | Nghiên cứu dịch tễ học |
| 53 | International comparisons | /ˌɪntərˈnæʃnəl kəmˈpærɪsnz/ | So sánh quốc tế |
| 54 | World Health Organization (WHO) | /wɜːrld helθ ˌɔːrɡənəˈzeɪʃn/ | Tổ chức Y tế Thế giới (WHO) |
| 55 | Caesarean section | /sɪˈzeriən ˈsekʃn/ | Mổ lấy thai |
| 56 | Hysterectomy | /ˌhɪstəˈrektəmi/ | Cắt tử cung |
| 57 | Quality improvement | /ˈkwɑːləti ɪmˈpruːvmənt/ | Cải tiến chất lượng |
| 58 | Cost efficiency | /kɔːst ɪˈfɪʃnsi/ | Hiệu quả chi phí |
| 59 | General practitioner (GP) | /ˈdʒenrəl prækˈtɪʃənər/ | Bác sĩ đa khoa |
| 60 | Depression | /dɪˈpreʃn/ | Trầm cảm |
| 61 | Upper respiratory tract infection | /ˈʌpər ˈrespərətɔːri trækt ɪnˈfekʃn/ | Nhiễm trùng đường hô hấp trên |
| 62 | Arthritis | /ɑːrˈθraɪtɪs/ | Viêm khớp |
| 63 | Vaginal bleeding | /ˈvædʒɪnl ˈbliːdɪŋ/ | Chảy máu âm đạo |
| 64 | Contraceptive requirements | /ˌkɑːntrəˈseptɪv rɪˈkwaɪərmənts/ | Nhu cầu tránh thai |
| 65 | Cervical cytology | /ˈsɜːrvɪkl saɪˈtɑːlədʒi/ | Tế bào học cổ tử cung |
| 66 | Screened | /skriːnd/ | Sàng lọc |
| 67 | Registration of births and deaths | /ˌredʒɪˈstreɪʃn əv bɜːrθs ænd deθs/ | Đăng ký khai sinh và khai tử |
| 68 | Death certificate | /deθ sərˈtɪfɪkət/ | Giấy chứng tử |
| 69 | Direct cause of death | /dəˈrekt kɔːz əv deθ/ | Nguyên nhân trực tiếp gây tử vong |
| 70 | Contributory factors | /kənˈtrɪbjətɔːri ˈfæktərz/ | Yếu tố góp phần |
| 71 | Birth rates | /bɜːrθ reɪts/ | Tỷ lệ sinh |
| 72 | Death rates | /deθ reɪts/ | Tỷ lệ tử |
| 73 | Annual growth rate | /ˈænjuəl ɡroʊθ reɪt/ | Tốc độ tăng trưởng hàng năm |
| 74 | Hospital Episode Statistics (HES) | /ˈhɑːspɪtl ˈepɪsoʊd stəˈtɪstɪks/ | Thống kê Tình trạng Nhập viện (HES) |
| 75 | Principal condition | /ˈprɪnsəpl kənˈdɪʃn/ | Tình trạng chính |
| 76 | Waiting list | /ˈweɪtɪŋ lɪst/ | Danh sách chờ |
| 77 | Source of admission | /sɔːrs əv ədˈmɪʃn/ | Nguồn nhập viện |
| 78 | Specialty | /ˈspeʃəlti/ | Chuyên khoa |
| 79 | Date of discharge | /deɪt əv dɪsˈtʃɑːrdʒ/ | Ngày xuất viện |
| 80 | Maternity beds | /məˈtɜːrnəti bedz/ | Giường bệnh sản khoa |
| 81 | Triennial report | /traɪˈeniəl rɪˈpɔːrt/ | Báo cáo ba năm một lần |
| 82 | Postpartum haemorrhage | /ˌpoʊstˈpɑːrtəm ˈhemərɪdʒ/ | Băng huyết sau sinh |
| 83 | Hypertensive disease of pregnancy | /ˌhaɪpərˈtensɪv dɪˈziːz əv ˈpreɡnənsi/ | Bệnh lý tăng huyết áp trong thai kỳ |
| 84 | Venous embolic disease | /ˈviːnəs emˈbɑːlɪk dɪˈziːz/ | Bệnh thuyên tắc tĩnh mạch |
| 85 | National Confidential Enquiry into Patient Outcome and Death (NCEPOD) | /ˈnæʃnəl ˌkɑːnfɪˈdenʃl ɪnˈkwaɪəri ˈɪntuː ˈpeɪʃnt ˈaʊtkʌm ænd deθ/ | Cuộc điều tra Quốc gia về Kết cục và Tử vong của Bệnh nhân (NCEPOD) |
| 86 | Perioperative deaths | /ˌperiˈɑːpərətɪv deθs/ | Tử vong chu phẫu |
| 87 | High-risk group | /haɪ rɪsk ɡruːp/ | Nhóm nguy cơ cao |
| 88 | Critical care unit | /ˈkrɪtɪkl ker ˈjuːnɪt/ | Đơn vị chăm sóc tích cực |
| 89 | Suboptimal care | /ˌsʌbˈɑːptɪməl ker/ | Chăm sóc dưới mức tối ưu |
| 90 | Perinatal mortality rates (PNMRs) | /ˌperɪˈneɪtl mɔːrˈtæləti reɪts/ | Tỷ lệ tử vong chu sinh (PNMR) |
| 91 | Stillbirths | /ˈstɪlbɜːrθs/ | Thai chết lưu |
| 92 | Live births | /laɪv bɜːrθs/ | Sinh sống |
| 93 | Gestation | /dʒeˈsteɪʃn/ | Tuổi thai |
| 94 | Pre-term births | /priː tɜːrm bɜːrθs/ | Sinh non |
| 95 | Birth defects | /bɜːrθ ˈdiːfekts/ | Dị tật bẩm sinh |
| 96 | Small-for-gestation babies | /smɔːl fər dʒeˈsteɪʃn ˈbeɪbiz/ | Trẻ nhẹ cân so với tuổi thai |
| 97 | Morbidity rates | /mɔːrˈbɪdəti reɪts/ | Tỷ lệ bệnh tật |
| 98 | Intensive care unit | /ɪnˈtensɪv ker ˈjuːnɪt/ | Đơn vị chăm sóc tích cực |
| 99 | Stroke | /stroʊk/ | Đột quỵ |
| 100 | Pulmonary embolism | /ˈpʊlməneri ˈembəlɪzəm/ | Thuyên tắc phổi |
| 101 | Deep vein thrombosis | /diːp veɪn θrɑːmˈboʊsɪs/ | Huyết khối tĩnh mạch sâu |
| 102 | Severe maternal morbidity | /səˈvɪr məˈtɜːrnl mɔːrˈbɪdəti/ | Bệnh tật nặng ở mẹ |
| 103 | Near-miss survey | /nɪr mɪs ˈsɜːrveɪ/ | Khảo sát suýt tử vong |
| 104 | Data linkage | /ˈdeɪtə ˈlɪŋkɪdʒ/ | Liên kết dữ liệu |
| 105 | Quality indicators | /ˈkwɑːləti ˈɪndɪkeɪtərz/ | Chỉ số chất lượng |
| 106 | Re-admission rates | /riː ədˈmɪʃn reɪts/ | Tỷ lệ tái nhập viện |
| 107 | Re-operation | /riː ˌɑːpəˈreɪʃn/ | Phẫu thuật lại |
| 108 | Personal information | /ˈpɜːrsənl ˌɪnfərˈmeɪʃn/ | Thông tin cá nhân |
| 109 | Lawfully processed | /ˈlɔːfəli ˈprɑːsest/ | Xử lý hợp pháp |
| 110 | General Data Protection Regulations (GDPR) | /ˈdʒenrəl ˈdeɪtə prəˈtekʃn ˌreɡjuˈleɪʃnz/ | Quy định chung về Bảo vệ Dữ liệu (GDPR) |
| 111 | Personal data | /ˈpɜːrsənl ˈdeɪtə/ | Dữ liệu cá nhân |
| 112 | Sensitive data | /ˈsensətɪv ˈdeɪtə/ | Dữ liệu nhạy cảm |
| 113 | IP address | /aɪˈpiː əˈdres/ | Địa chỉ IP |
| 114 | Anonymized data | /əˈnɑːnəmaɪzd ˈdeɪtə/ | Dữ liệu ẩn danh |
| 115 | Sexual orientation | /ˈsekʃuəl ˌɔːriənˈteɪʃn/ | Khuynh hướng tình dục |
| 116 | Religious beliefs | /rɪˈlɪdʒəs bɪˈliːfs/ | Niềm tin tôn giáo |
| 117 | Political opinions | /pəˈlɪtɪkl əˈpɪnjənz/ | Quan điểm chính trị |
| 118 | Racial information | /ˈreɪʃl ˌɪnfərˈmeɪʃn/ | Thông tin chủng tộc |
| 119 | Transparent | /trænsˈperənt/ | Minh bạch |
| 120 | Legal basis | /ˈliːɡl ˈbeɪsɪs/ | Cơ sở pháp lý |
| 121 | Consent | /kənˈsent/ | Sự đồng ý |
| 122 | Legal obligation | /ˈliːɡl ˌɑːblɪˈɡeɪʃn/ | Nghĩa vụ pháp lý |
| 123 | Vital interests | /ˈvaɪtl ˈɪntrəsts/ | Lợi ích sống còn |
| 124 | Public task | /ˈpʌblɪk tæsk/ | Nhiệm vụ công |
| 125 | Legitimate interest | /ləˈdʒɪtəmət ˈɪntrəst/ | Lợi ích hợp pháp |
| 126 | Explicit consent | /ɪkˈsplɪsɪt kənˈsent/ | Sự đồng ý rõ ràng |
| 127 | Data subject rights | /ˈdeɪtə ˈsʌbdʒɪkt raɪts/ | Quyền của chủ thể dữ liệu |
| 128 | Right to rectification | /raɪt tuː ˌrektɪfɪˈkeɪʃn/ | Quyền được cải chính |
| 129 | Right to erasure | /raɪt tuː ɪˈreɪʒər/ | Quyền được xóa bỏ |
| 130 | Right to restrict processing | /raɪt tuː rɪˈstrɪkt ˈprɑːsesɪŋ/ | Quyền hạn chế xử lý |
| 131 | Right to data portability | /raɪt tuː ˈdeɪtə ˌpɔːrtəˈbɪləti/ | Quyền di chuyển dữ liệu |
| 132 | Right to object | /raɪt tuː əbˈdʒekt/ | Quyền phản đối |
| 133 | Automated decision-making | /ˌɔːtəmeɪtɪd dɪˈsɪʒn ˈmeɪkɪŋ/ | Ra quyết định tự động |
| 134 | Profiling | /ˈproʊfaɪlɪŋ/ | Lập hồ sơ |
| 135 | Encrypted communication protocol | /ɪnˈkrɪptɪd kəˌmjuːnɪˈkeɪʃn ˈproʊtəkɔːl/ | Giao thức truyền thông được mã hóa |
| 136 | Fax machines | /fæks məˈʃiːnz/ | Máy fax |
| 137 | Caldicott principles | /ˈkɔːldɪkɑːt ˈprɪnsəplz/ | Các nguyên tắc Caldicott |
| 138 | Caldicott Guardian | /ˈkɔːldɪkɑːt ˈɡɑːrdiən/ | Người bảo vệ Caldicott |
| 139 | Patient-identifiable information | /ˈpeɪʃnt aɪˌdentɪˈfaɪəbl ˌɪnfərˈmeɪʃn/ | Thông tin nhận dạng bệnh nhân |
| 140 | Information governance | /ˌɪnfərˈmeɪʃn ˈɡʌvərnəns/ | Quản trị thông tin |
| 141 | Anonymized | /əˈnɑːnəmaɪzd/ | Ẩn danh |
| 142 | Encrypted USB drives | /ɪnˈkrɪptɪd juː es ˈbiː draɪvz/ | Ổ USB được mã hóa |
| 143 | Social media | /ˈsoʊʃl ˈmiːdiə/ | Mạng xã hội |
| 144 | Professional boundaries | /prəˈfeʃənl ˈbaʊndəriz/ | Ranh giới nghề nghiệp |
| 145 | General Medical Council | /ˈdʒenrəl ˈmedɪkl ˈkaʊnsl/ | Hội đồng Y khoa Tổng quát |
| 146 | Contemporaneous research findings | /kənˌtempəˈreɪniəs ˈriːsɜːrtʃ ˈfaɪndɪŋz/ | Kết quả nghiên cứu đương thời |
| 147 | Clinical decision-making | /ˈklɪnɪkl dɪˈsɪʒn ˈmeɪkɪŋ/ | Ra quyết định lâm sàng |
| 148 | Clinical governance framework | /ˈklɪnɪkl ˈɡʌvərnəns ˈfreɪmwɜːrk/ | Khuôn khổ quản trị lâm sàng |
| 149 | Clinical questions | /ˈklɪnɪkl ˈkwestʃənz/ | Câu hỏi lâm sàng |
| 150 | Critically appraise | /ˈkrɪtɪkli əˈpreɪz/ | Thẩm định phê bình |
| 151 | Validity | /vəˈlɪdəti/ | Tính hợp lệ |
| 152 | Clinical usefulness | /ˈklɪnɪkl ˈjuːsflnəs/ | Hữu ích trên lâm sàng |
| 153 | Clinical audit | /ˈklɪnɪkl ˈɔːdɪt/ | Kiểm toán lâm sàng |
| 154 | Quality of clinical care | /ˈkwɑːləti əv ˈklɪnɪkl ker/ | Chất lượng chăm sóc lâm sàng |
| 155 | Diagnosis | /ˌdaɪəɡˈnoʊsɪs/ | Chẩn đoán |
| 156 | Treatment | /ˈtriːtmənt/ | Điều trị |
| 157 | Resources | /ˈriːsɔːrsɪz/ | Nguồn lực |
| 158 | Outcome | /ˈaʊtkʌm/ | Kết cục |
| 159 | Stakeholders | /ˈsteɪkhoʊldərz/ | Các bên liên quan |
| 160 | Standard | /ˈstændərd/ | Tiêu chuẩn |
| 161 | Criteria | /kraɪˈtɪriə/ | Tiêu chí |
| 162 | Structure | /ˈstrʌktʃər/ | Cấu trúc |
| 163 | Process | /ˈprɑːses/ | Quy trình |
| 164 | Baseline data | /ˈbeɪslaɪn ˈdeɪtə/ | Dữ liệu cơ bản |
| 165 | Sample size | /ˈsæmpl saɪz/ | Cỡ mẫu |
| 166 | Time frame | /taɪm freɪm/ | Khung thời gian |
| 167 | Clinical supervisor | /ˈklɪnɪkl ˈsuːpərvaɪzər/ | Người giám sát lâm sàng |
| 168 | Constructive feedback | /kənˈstrʌktɪv ˈfiːdbæk/ | Phản hồi mang tính xây dựng |
| 169 | Action planning | /ˈækʃn ˈplænɪŋ/ | Lập kế hoạch hành động |
| 170 | Foundation doctors | /faʊnˈdeɪʃn ˈdɑːktərz/ | Bác sĩ nền tảng |
| 171 | Indirect causes of death | /ˌɪndəˈrekt ˈkɔːzɪz əv deθ/ | Nguyên nhân gián tiếp gây tử vong |
| 172 | Suicide | /ˈsuːɪsaɪd/ | Tự tử |
| 173 | Prematurity | /ˌpriːməˈtʃʊərəti/ | Sinh non |
| 174 | Systematic review | /ˌsɪstəˈmætɪk rɪˈvjuː/ | Tổng quan hệ thống |
| 175 | Randomized controlled trials | /ˈrændəmaɪzd kənˈtroʊld ˈtraɪəlz/ | Thử nghiệm ngẫu nhiên có đối chứng |
| 176 | Observational data | /ˌɑːbzərˈveɪʃənl ˈdeɪtə/ | Dữ liệu quan sát |
| 177 | Meta-analysis | /ˌmetə əˈnæləsɪs/ | Phân tích gộp |
| 178 | Good Practice point | /ɡʊd ˈpræktɪs pɔɪnt/ | Điểm thực hành tốt |
| 179 | Local protocol | /ˈloʊkl ˈproʊtəkɔːl/ | Quy trình địa phương |
| 180 | Generalizable new knowledge | /ˈdʒenərəlaɪzəbl njuː ˈnɑːlɪdʒ/ | Kiến thức mới có thể khái quát hóa |
| 181 | Research ethics committee | /ˈriːsɜːrtʃ ˈeθɪks kəˈmɪti/ | Ủy ban đạo đức nghiên cứu |
| 182 | Multi-centre research | /ˈmʌlti ˈsentər ˈriːsɜːrtʃ/ | Nghiên cứu đa trung tâm |
| 183 | Secondary research | /ˈsekənderi ˈriːsɜːrtʃ/ | Nghiên cứu thứ cấp |
| 184 | Misconduct in research | /mɪsˈkɑːndʌkt ɪn ˈriːsɜːrtʃ/ | Hành vi sai trái trong nghiên cứu |
| 185 | Descriptive studies | /dɪˈskrɪptɪv ˈstʌdiz/ | Nghiên cứu mô tả |
| 186 | Aetiological hypothesis | /ˌiːtiəˈlɑːdʒɪkl haɪˈpɑːθəsɪs/ | Giả thuyết nguyên nhân học |
| 187 | Analytical studies | /ˌænəˈlɪtɪkl ˈstʌdiz/ | Nghiên cứu phân tích |
| 188 | Case control studies | /keɪs kənˈtroʊl ˈstʌdiz/ | Nghiên cứu bệnh chứng |
| 189 | Cohort studies | /ˈkoʊhɔːrt ˈstʌdiz/ | Nghiên cứu thuần tập |
| 190 | Forceps delivery | /ˈfɔːrseps dɪˈlɪvəri/ | Sinh bằng kẹp forcep |
| 191 | Epilepsy | /ˈepɪlepsi/ | Động kinh |
| 192 | Attributable risk | /əˈtrɪbjətəbl rɪsk/ | Nguy cơ quy thuộc |
| 193 | Efficacy | /ˈefɪkəsi/ | Hiệu quả |
| 194 | Double blind | /ˈdʌbl blaɪnd/ | Mù đôi |
| 195 | Placebo controlled | /pləˈsiːboʊ kənˈtroʊld/ | Đối chứng giả dược |
| 196 | Randomization | /ˌrændəmaɪˈzeɪʃn/ | Phân bổ ngẫu nhiên |
| 197 | Adverse outcomes | /ˈædvɜːrs ˈaʊtkʌmz/ | Kết cục bất lợi |
| 198 | Clinical Negligence Scheme for Trusts (CNST) | /ˈklɪnɪkl ˈneɡlɪdʒəns skiːm fər trʌsts/ | Chương trình Bồi thường Sơ suất Lâm sàng cho các Quỹ Tín thác |
| 199 | Near-misses | /nɪr ˈmɪsɪz/ | Trường hợp suýt xảy ra |
| 200 | Perineal tears | /ˌperɪˈniːəl terz/ | Rách tầng sinh môn |
