Sổ tay Thận học Lâm sàng – Clinical Handbook of Nephrology
Tác giả: Brown, Robert Stephen, MD. Bản quyền © 2024 Nhà xuất bản Elsevier
Biên dịch và Chú giải: Ths.Bs. Lê Đình Sáng
CHƯƠNG 5: RỐI LOẠN KIỀM TOAN
Acid-base disorders
Alexander Morales; Alexander Goldfarb-Rumyantzev; Robert Stephen Brown
Clinical Handbook of Nephrology, CHAPTER 5, 49-59
5.1 Giới thiệu
Chương này thảo luận cách sử dụng kết quả khí máu động mạch hoặc tĩnh mạch và các chất điện giải trong huyết thanh thường quy để xác định một rối loạn thăng bằng kiềm-toan. 1,2
5.1.1 Phương trình Henderson-Hasselbalch
Việc diễn giải các kết quả khí máu bắt đầu bằng phương trình Henderson-Hasselbalch:

Hệ thống đệm của máu sử dụng bicarbonate làm base và acid carbonic làm acid; do đó, phương trình này có thể được viết lại như sau:
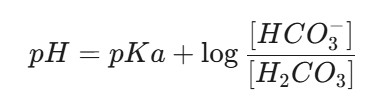
Sử dụng giá trị là 6.1 cho acid carbonic và hệ số chuyển đổi là 0.03 để biểu thị nồng độ acid theo áp suất riêng phần của động mạch (), được đo trong khí máu động mạch (ABGs), phương trình cuối cùng được viết lại như sau:

Vì biểu thức cuối cùng này bao gồm một logarit, gây khó khăn cho việc tính toán nhanh tại giường, một số công thức xấp xỉ đơn giản có thể được sử dụng, như được thảo luận trong các trang tiếp theo.
Lưu ý rằng ở pH bình thường là 7.4, nồng độ của base khoảng cao gấp 20 lần so với nồng độ acid carbonic là (hoặc là .
5.2 LƯU ĐỒ CHẨN ĐOÁN RỐI LOẠN THĂNG BẰNG KIỀM-TOAN
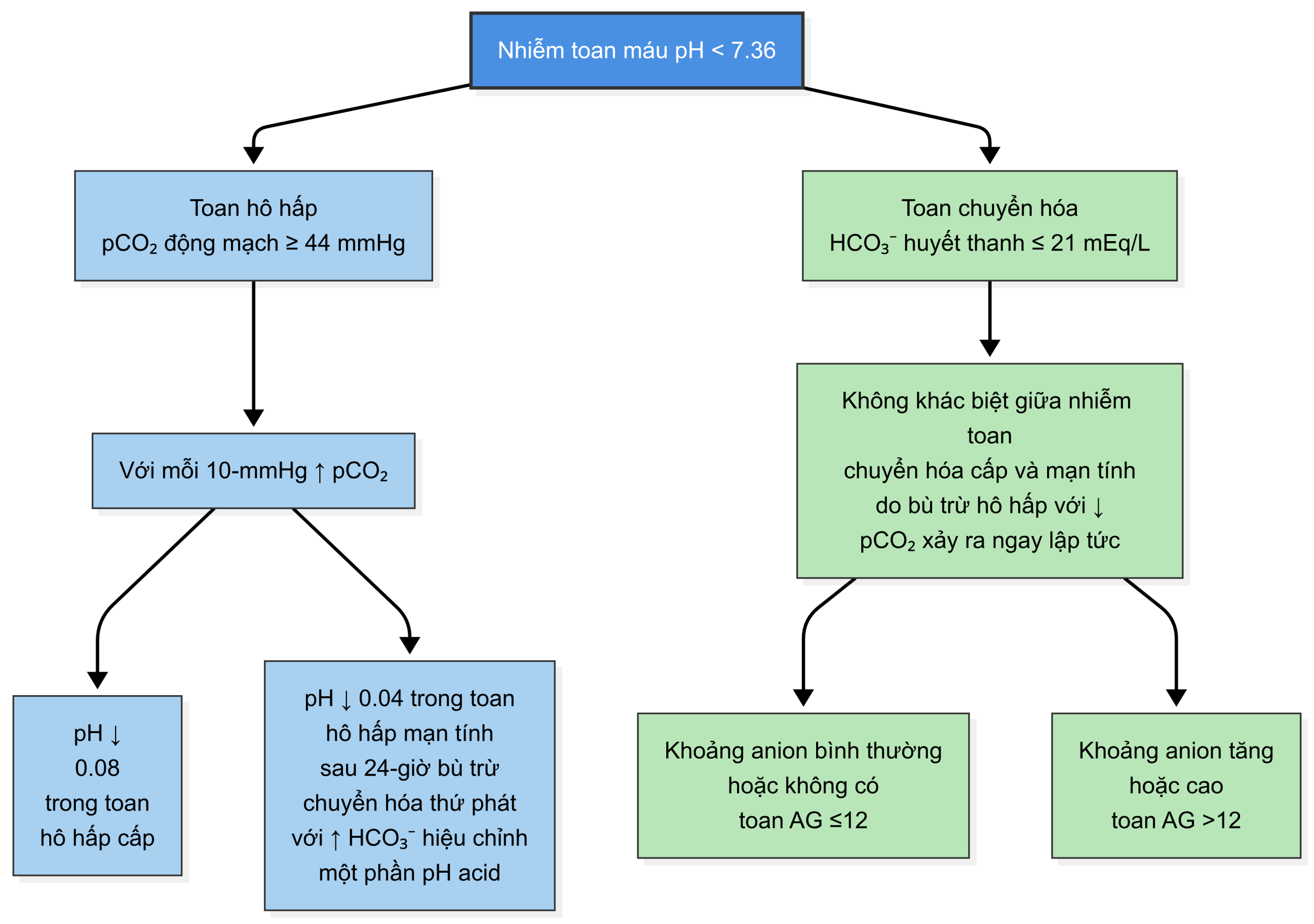
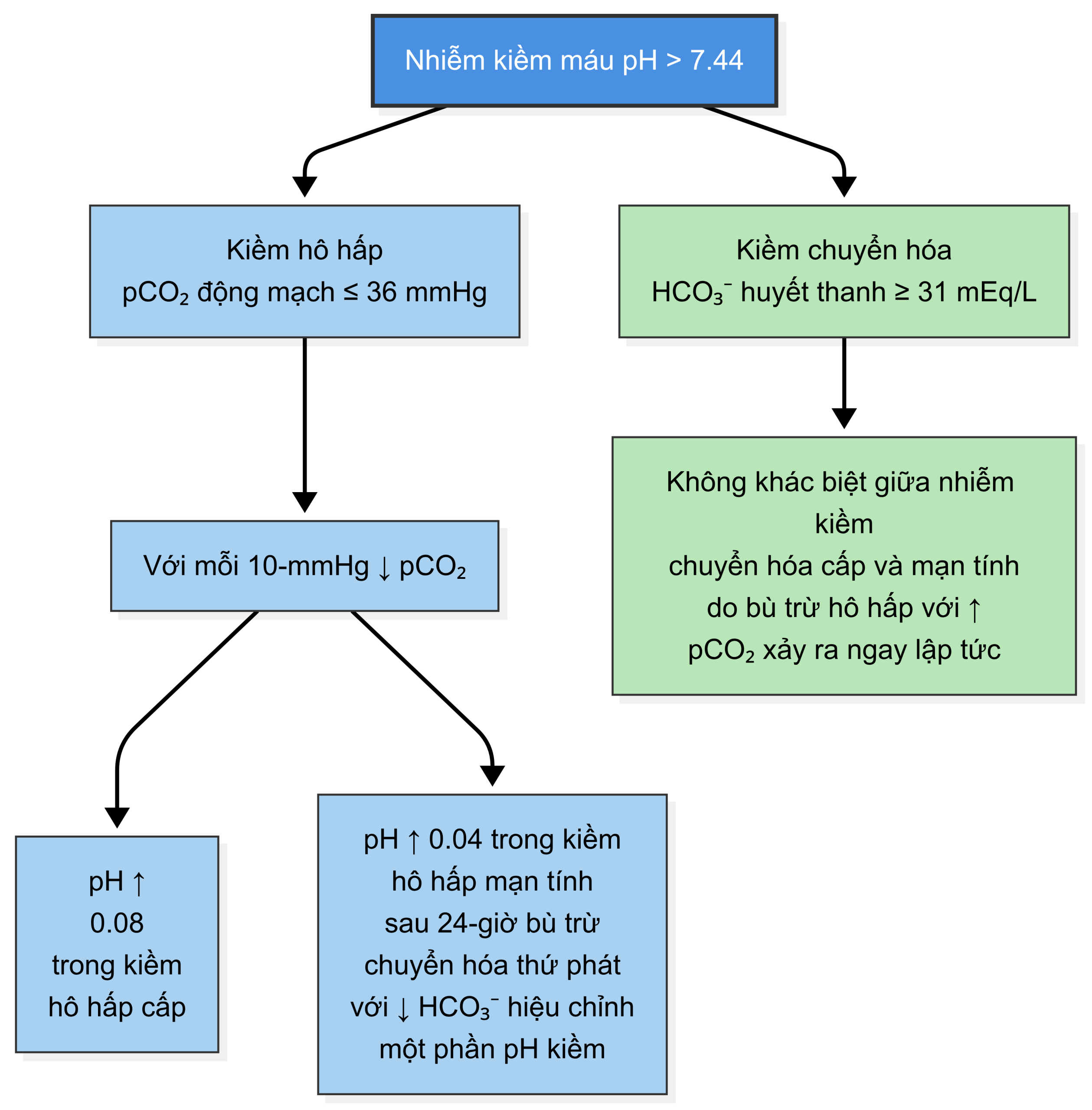
Lưu đồ này cung cấp một cách diễn giải khí máu động mạch kết hợp với hóa sinh huyết tương. Để sử dụng lưu đồ này:
- Kiểm tra pH và xác định tình trạng nhiễm toan (acidemia) hay nhiễm kiềm (alkalemia).
- Sử dụng nồng độ bicarbonate từ điện giải đồ huyết thanh và từ khí máu động mạch, xác định xem nguyên nhân chính của rối loạn là chuyển hóa hay hô hấp (xem lưu đồ khí máu động mạch bên dưới).
- Thực hiện tính toán để kiểm tra xem một rối loạn hô hấp nguyên phát có sự bù trừ chuyển hóa thích hợp hay không, hoặc một rối loạn chuyển hóa nguyên phát có sự bù trừ hô hấp thích hợp hay không (tham khảo bảng bù trừ ở trang tiếp theo). 3-5
Nếu cả hai trường hợp đều không đúng, một rối loạn nguyên phát thứ hai—được coi là một rối loạn thăng bằng kiềm-toan “phức tạp” (nghĩa là có nhiều hơn một rối loạn) thay vì một rối loạn thăng bằng kiềm-toan “đơn giản” (nghĩa là một rối loạn duy nhất)—đang là nguyên nhân cơ bản của những thay đổi quan sát được.”
Bảng Bù trừ Rối loạn Kiềm-Toan
Bù trừ cho Toan Hô hấp
| Loại | Mô tả |
|---|---|
| Cấp tính | Dự kiến HCO₃⁻ huyết thanh tăng khoảng 1 mEq/L cho mỗi 10 mmHg tăng pCO₂ để bù trừ chuyển hóa bình thường |
| Mạn tính | Sau 24 giờ, dự kiến HCO₃⁻ huyết thanh tăng khoảng 3.5 mEq/L cho mỗi 10 mmHg tăng pCO₂ để bù trừ chuyển hóa bình thường |
Bù trừ cho Toan Chuyển hóa
Có ba cách phổ biến để đánh giá phản ứng bù trừ hô hấp bình thường (±2 mmHg):
- Dự kiến pCO₂ giảm 1.2 mmHg cho mỗi 1 mEq/L giảm HCO₃⁻
- pCO₂ = 1.5 × (HCO₃⁻) + 8
- Cách dễ: pCO₂ = hai chữ số cuối của pH (xuống đến pH 7.10)
Bù trừ cho Kiềm Hô hấp
| Loại | Mô tả |
|---|---|
| Cấp tính | Dự kiến HCO₃⁻ huyết thanh giảm khoảng 2 mEq/L cho mỗi 10 mmHg giảm pCO₂ để bù trừ chuyển hóa bình thường |
| Mạn tính | Sau 24 giờ, dự kiến HCO₃⁻ huyết thanh giảm khoảng 5 mEq/L cho mỗi 10 mmHg giảm pCO₂ để bù trừ chuyển hóa bình thường |
Bù trừ cho Kiềm Chuyển hóa
Có ba cách phổ biến để đánh giá phản ứng bù trừ hô hấp bình thường (±2 mmHg):
- Dự kiến pCO₂ tăng 0.7 mmHg cho mỗi 1 mEq/L tăng HCO₃⁻
- pCO₂ = HCO₃⁻ huyết thanh + 15 mmHg (lên đến pCO₂ khoảng 60, khi đó pCO₂ không tăng thêm)
- Cách dễ: pCO₂ = hai chữ số cuối của pH (lên đến pH 7.60)
5.2.1 Các gợi ý hữu ích
- Các rối loạn thăng bằng kiềm-toan không bù trừ hoàn toàn, vì vậy nếu pH có tính acid, hãy giả định là toan; nếu có tính kiềm, hãy giả định là kiềm.
- Trong việc diễn giải nồng độ bicarbonate huyết thanh:
- Nếu ↑, có thể là kiềm chuyển hóa nguyên phát hoặc bù trừ cho toan hô hấp.
- Nếu ↓, có thể là toan chuyển hóa nguyên phát hoặc bù trừ cho kiềm hô hấp.
- Nếu bình thường, có thể là trạng thái kiềm-toan bình thường hoặc có thể có một rối loạn phức tạp (kép hoặc ba).
- Khoảng trống anion ↑ hầu như luôn chỉ ra một tình trạng toan chuyển hóa.
- Nồng độ huyết thanh có thể hữu ích. Nếu ↓, thường là kiềm; nếu ↑, thường là toan.
- Khi nồng độ ure máu (BUN) và creatinin ↑, suy thận có thể liên quan đến toan chuyển hóa, thường có khoảng trống anion bình thường khi nhẹ, và khoảng trống anion tăng khi suy thận nặng hơn.
- Suy gan thường liên quan đến toan chuyển hóa.
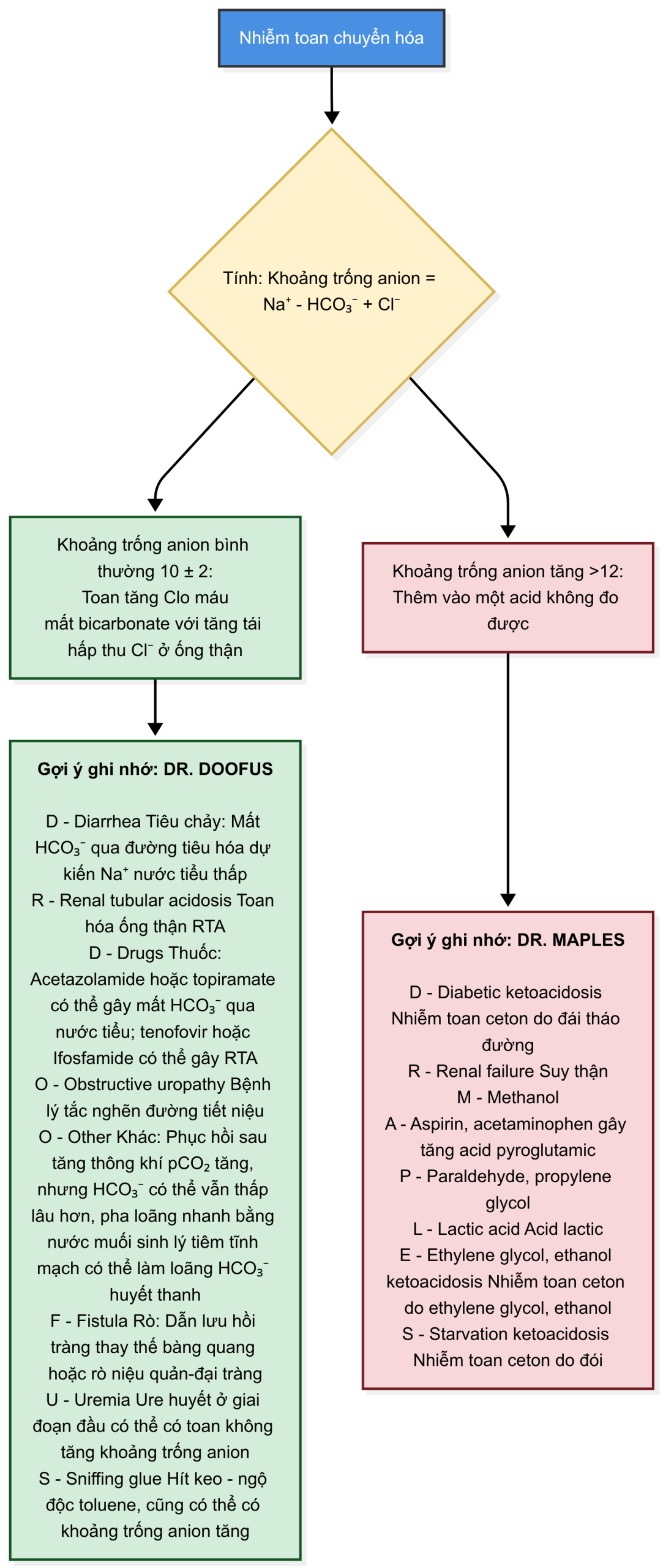
5.3 Toan Chuyển hóa
5.3.1 NGUYÊN NHÂN GÂY TOAN CHUYỂN HÓA
- Một khi chẩn đoán toan chuyển hóa được xác lập, bước tiếp theo là xác định nguyên nhân.
- Để xác định nguyên nhân, hãy đánh giá xem toan chuyển hóa có liên quan đến khoảng trống anion bình thường hay khoảng trống anion tăng bất thường, như được trình bày trong lưu đồ dưới đây.
- Khoảng trống anion tăng cho thấy sự hiện diện của các acid không đo được, có thể là nội sinh (ví dụ: acid lactic) hoặc ngoại sinh (ví dụ: acid oxalic từ ngộ độc ethylene glycol).7,8
- Toan chuyển hóa với khoảng trống anion bình thường là do mất bicarbonate (từ đường tiêu hóa [GI] hoặc trong nước tiểu) hoặc do thận không bài tiết được acid .
5.3.2 KHOẢNG TRỐNG THẨM THẤU HUYẾT THANH
Sử dụng khoảng trống thẩm thấu huyết thanh hoặc huyết tương sẽ giúp phân biệt giữa toan không có khoảng trống thẩm thấu (thường là nội sinh) và toan có khoảng trống thẩm thấu cao (độc tố ngoại sinh). Khoảng trống thẩm thấu được xác định bằng cách so sánh độ thẩm thấu huyết thanh hoặc huyết tương đo được với độ thẩm thấu huyết thanh được tính toán.
Độ thẩm thấu huyết thanh: Độ thẩm thấu huyết thanh tính toán (Osm, để so sánh với đo được để đánh giá khoảng trống thẩm thấu):

Ghi chú:
- Hệ số 18 để chuyển đổi glucose từ mg/dL sang mOsm/kg
- Hệ số 2.8 để chuyển đổi BUN từ mg/dL sang mOsm/kg
- Hệ số 2 cho natri để tính cả anion đi kèm (chủ yếu là chloride)
5.3.2.1 Toan Chuyển hóa Không Tăng Khoảng trống Anion
5.3.2.1.1 Toan hóa Ống thận So với Mất qua Đường Tiêu hóa.
Trong toan chuyển hóa có khoảng trống anion bình thường, bicarbonate huyết thanh thấp là do mất bicarbonate từ đường tiêu hóa do tiêu chảy, hoặc do thận không bảo tồn được bicarbonate hoặc không tái tạo bicarbonate bằng cách bài tiết acid. Chẩn đoán phân biệt giữa hai tình trạng này dựa trên việc chứng minh một phản ứng bình thường của thận đối với tình trạng toan máu trong trường hợp mất qua đường tiêu hóa. Thứ nhất, pH nước tiểu phải có tính acid. Thứ hai, khoảng trống anion nước tiểu phải âm, cho thấy sự hiện diện của cation nước tiểu không đo được, , cung cấp thêm sự bài tiết acid. 6-8 Nếu sự bài tiết ở ống thận bị suy giảm, khoảng trống anion nước tiểu vẫn dương hoặc gần bằng không. Hãy nhớ rằng việc tính toán khoảng trống anion nước tiểu không có vai trò trong toan chuyển hóa tăng khoảng trống anion vì có một anion không đo được trong nước tiểu làm che khuất lượng cation không đo được. 10,11
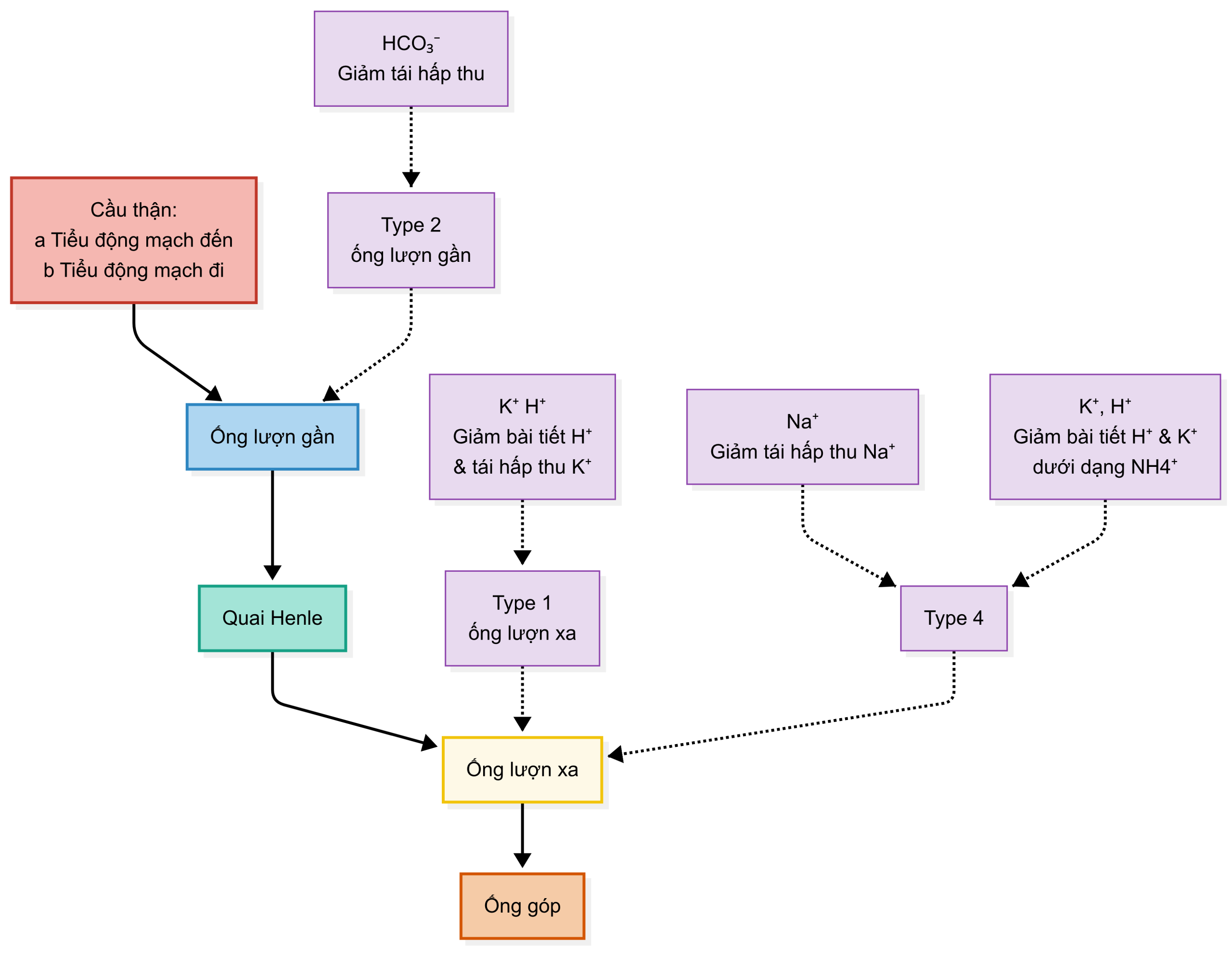
5.3.3 CÁC LOẠI TOAN HÓA ỐNG THẬN
Các dạng toan hóa ống thận (RTA) type 1, 2, và 4 được mô tả trong các biểu đồ trên và bảng dưới đây. 15,16 RTA type 3 (hỗn hợp của type 1 và 2), liên quan đến suy thận và không còn được công nhận. Vị trí của khiếm khuyết trong nephron được mô tả trong bảng dưới đây.
Bảng 5.1 – Các loại Toan hóa Ống thận
| Đặc điểm | Ống lượn gần (Type 2)¹³ | Ống lượn xa (Type 1)¹² | Tăng Kali máu (Type 4)¹⁴ |
|---|---|---|---|
| Cơ chế | • Giảm khả năng tái hấp thu HCO₃⁻ đã lọc với sự lãng phí bicarbonate (ví dụ, thuốc ức chế carbonic anhydrase) → tăng clo máu, K⁺ huyết thanh bình thường hoặc thấp, nước tiểu acid: pH <5.5 khi bicarbonate huyết thanh thấp
• Không liên quan đến sỏi thận trừ khi sau điều trị thay thế HCO₃⁻ hoặc khi thuốc ức chế carbonic anhydrase gây lãng phí HCO₃⁻ ở ống lượn gần |
• Thiếu hụt chọn lọc bài tiết H⁺ ở nephron xa với tăng bài tiết K⁺ → nước tiểu kiềm với tăng clo máu và hạ kali máu
• Thường có thể liên quan đến tăng calci niệu thứ phát, giảm citrat niệu và sỏi thận |
• Thường được gọi là hội chứng giảm renin-giảm aldosteron (mặc dù nồng độ renin thường không thấp)
• Aldosteron ↓ → suy giảm tái hấp thu Na ở ống thận dẫn đến suy giảm bài tiết K⁺ và H⁺ với giảm khả năng tạo NH₄⁺ → bài tiết NH₄⁺ ↓ → tăng clo máu, tăng kali máu, nước tiểu acid • Cũng có thể do các bệnh thận-mô kẽ (ví dụ, viêm thận lupus), gây ra tình trạng không đáp ứng với aldosteron |
| Nguyên nhân cơ bản | • Đa u tủy với bệnh thận do chuỗi nhẹ
• Ngộ độc Toluene • Kim loại nặng • Hội chứng Sjögren • Viêm khớp dạng thấp • Tenofovir • Ifosfamide • Xơ gan đang hoạt động • Bệnh lý tắc nghẽn đường tiết niệu và SLE có thể gây RTA type 1 với tăng kali máu • Di truyền ở trẻ em |
• Gia đình | • Bệnh thận do đái tháo đường hoặc tăng huyết áp (thường với giảm aldosteron)
• Các bệnh lý ống thận-mô kẽ • Thuốc lợi tiểu giữ kali, thuốc ức chế men chuyển, thuốc chẹn thụ thể angiotensin và trimethoprim có thể gây RTA type 4 do thuốc |
Ghi chú:
- ¹² Type 1 (Distal RTA): Toan hóa ống thận xa
- ¹³ Type 2 (Proximal RTA): Toan hóa ống thận gần
- ¹⁴ Type 4 (Hyperkalemic RTA): Toan hóa ống thận tăng kali máu
ACE, Angiotensin-converting-enzyme (men chuyển angiotensin); ARB, angiotensin receptor blocker (thuốc chẹn thụ thể angiotensin); RTA, renal tubular acidosis (toan hóa ống thận); SLE, systemic lupus erythematosus (lupus ban đỏ hệ thống).
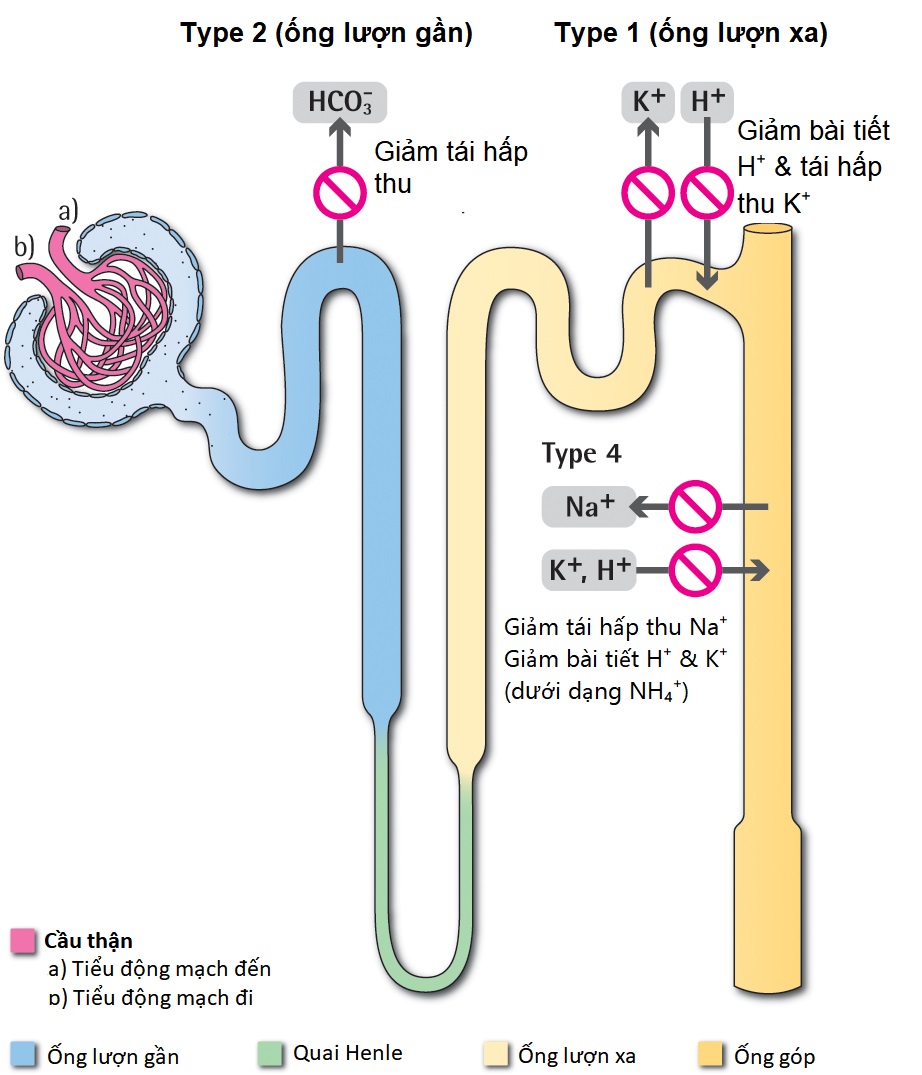
Hình 5.1 Vị trí tổn thương trong các loại Toan hóa Ống thận
5.3.4 CÁC LOẠI TOAN LACTIC
Toan lactic là một trong những loại toan chuyển hóa phổ biến nhất liên quan đến tăng khoảng trống anion. Sơ đồ dưới đây minh họa các nguyên nhân cơ bản của toan lactic type A (do thiếu oxy mô) và type B (liên quan đến các nguyên nhân khác làm tăng sản xuất hoặc giảm bài tiết lactate).7,17-26
Bảng 5.2 – Các loại Toan Lactic
| Type A | Type B |
|---|---|
| Thiếu oxy mô | Sản xuất quá mức và/hoặc giảm loại bỏ lactate ở gan |
| • Suy tuần hoàn (sốc, suy tim) | • Hạ đường huyết (bệnh dự trữ glycogen) |
| • Thiếu máu nặng | • Co giật |
| • Bệnh tả | • Đái tháo đường |
| • Nhiễm trùng huyết | • Ethanol |
| • Hội chứng ly giải u | • Suy gan |
| • Thiếu máu cục bộ vùng, bỏng | • Bệnh ác tính |
| • Thuốc: carboplatin, thuốc kháng retrovirus, salicylates, metformin | |
| • Khiếm khuyết và chất ức chế enzyme ty thể (CO, cyanide) | |
| • Thiếu thiamine (đồng yếu tố trong quá trình phosphoryl hóa oxy hóa) | |
| • Toan D-lactic |
Phân loại và Cơ chế
Type A (Thiếu oxy mô):
- Nguyên nhân chính: Giảm cung cấp oxy hoặc tăng nhu cầu oxy của mô
- Cơ chế: Chuyển hướng metabolism từ oxy hóa sang lên men kỵ khí
- Tiên lượng: Thường nghiêm trọng hơn Type B
Type B (Không thiếu oxy mô):
- Nguyên nhân chính: Rối loạn chuyển hóa lactate
- Cơ chế: Sản xuất lactate tăng hoặc clearance lactate giảm
- Phân nhóm:
- B1: Bệnh lý cơ bản (gan, thận, ác tính)
- B2: Thuốc và độc tố
- B3: Lỗi bẩm sinh chuyển hóa
Điều trị toan lactic:
- Điều trị tình trạng cơ bản (ví dụ, phục hồi tưới máu mô)
- Tránh thuốc co mạch, nhưng cần thận trọng để tránh quá tải dịch do bù dịch
- Điều trị bằng bicarbonate cho pH < 7.1 (lưu ý rằng bicarbonate kích thích phosphofructokinase → dẫn đến tăng sản xuất lactate, có thể làm tăng và gây kiềm hóa quá mức sau khi lactate chuyển thành bicarbonate) 27,28
5.3.5 LIỆU PHÁP KIỀM HÓA
Liệu pháp kiềm hóa cho tình trạng toan máu nặng, trong đó natri bicarbonate là tác nhân được sử dụng phổ biến nhất, nên được xem xét trong toan chuyển hóa không tăng khoảng trống anion và khi pH < 7.1.
Hướng dẫn sử dụng bicarbonate:
- Mục tiêu: đưa pH về ≥ và bicarbonate huyết thanh về > 8 đến 10 (mục tiêu là pH 7.45-7.5 trong trường hợp ngộ độc salicylate để tăng cường bài tiết).29
- Tính toán lượng bicarbonate thiếu hụt ban đầu bằng cách sử dụng thể tích phân bố của bicarbonate là 0.5 × trọng lượng cơ thể (kg). Đây là một ước tính do cần phải kiềm hóa cả và các hệ đệm khác.
- Truyền natri bicarbonate liên tục trong trường hợp toan máu nặng.
- Kiểm tra lại nồng độ bicarbonate sau khi đã qua ≥ phút kể từ khi hoàn thành truyền.
Các biến chứng tiềm ẩn của liệu pháp bicarbonate:
- Quá tải dịch
- Nhiễm kiềm xảy ra dưới dạng kiềm hô hấp sau phục hồi hoặc kiềm chuyển hóa “quá mức” (trong toan lactic, khi lactate được chuyển thành bicarbonate)
- Tăng natri máu, tăng áp lực thẩm thấu
- Có thể thúc đẩy sự kết tủa của canxi photphat và có thể gây ra hoặc làm trầm trọng thêm tình trạng hạ canxi máu
- Có thể làm tăng với tình trạng toan hóa nội bào nghịch lý 30
Các tác nhân kiềm hóa thay thế cho :
- Carbicarb³¹—Natri bicarbonate + Natri carbonat
- Hạn chế tạo ra
- Tăng ở mức tối thiểu
- Hạn chế tạo ra
- THAM—0.3N tromethamine³¹ đệm các acid chuyển hóa và hô hấp (nhưng hiếm khi được sử dụng): Vì THAM là một chất nhận proton³² , acid carbonic được đệm như sau: .
- Hạn chế tạo ra
- Tác dụng phụ: tăng kali máu, hạ đường huyết, ức chế hô hấp, tổn thương tại chỗ trong trường hợp thoát mạch, hoại tử gan ở trẻ sơ sinh
- Hạn chế tạo ra
5.4 Kiềm Chuyển hóa
5.4.1 NGUYÊN NHÂN GÂY KIỀM CHUYỂN HÓA
Kiềm chuyển hóa là do mất và Cl-, hoặc do tích tụ bicarbonate. 33
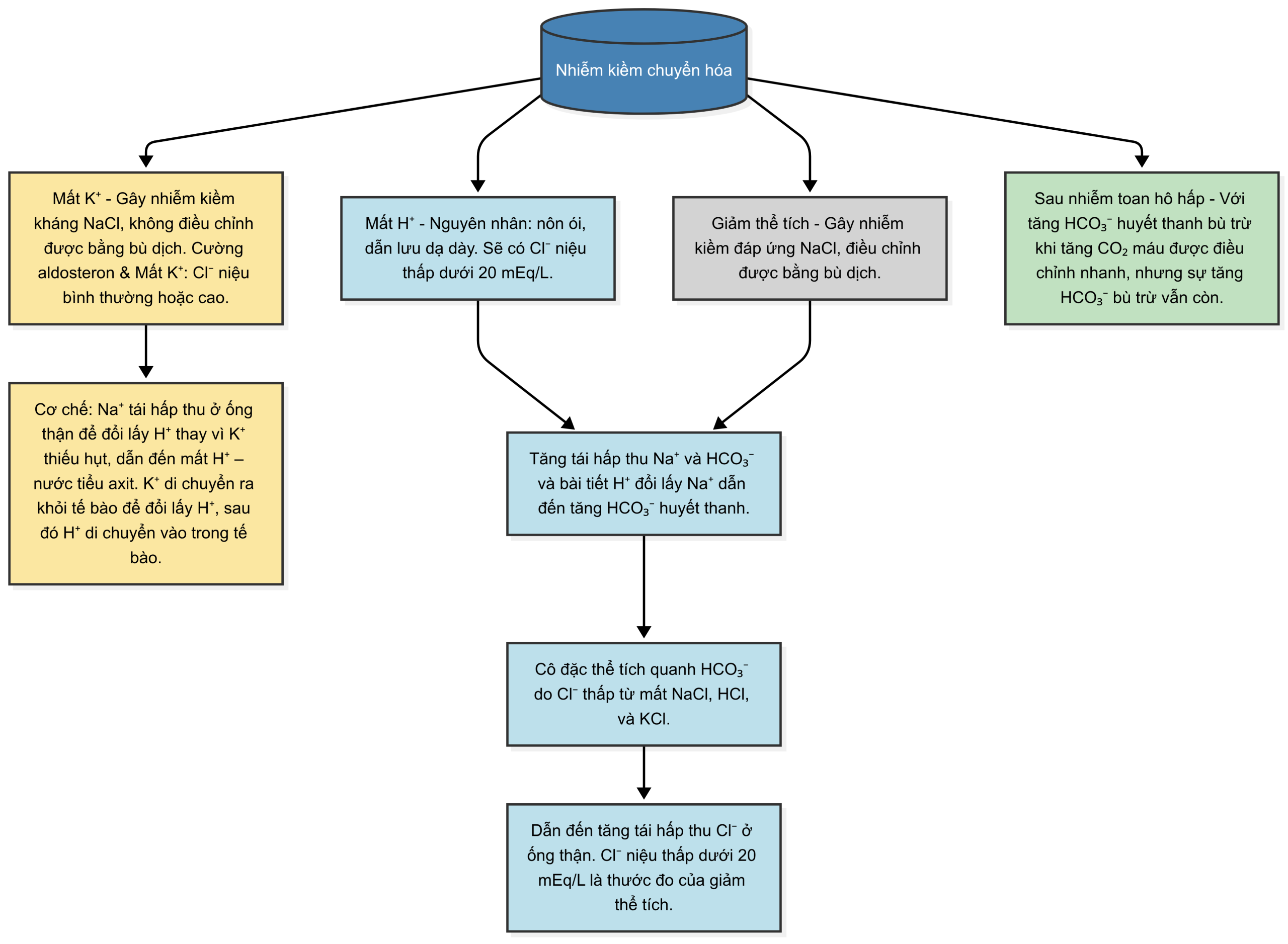
5.4.2 TIẾP CẬN CHẨN ĐOÁN
Tiếp cận chẩn đoán nguyên nhân gây kiềm chuyển hóa dựa trên các xét nghiệm sau: nồng độ clorua và kali trong nước tiểu, và huyết áp động mạch. 1,6,33
Hình dưới đây cho thấy một lưu đồ của quá trình tiếp cận:

- Truyền muối cho kiềm chuyển hóa đáp ứng với NaCl do giảm thể tích hoặc mất qua đường tiêu hóa
- Kali clorua cho tình trạng thiếu hụt K và Cl trong kiềm chuyển hóa kháng muối (cộng với muối nếu lạm dụng lợi tiểu gây co thể tích)
- Acetazolamide để hạ bicarbonate huyết thanh cao sau tăng CO₂ máu hoặc khi có tăng thể tích
- HCl 0.3N hiếm khi được sử dụng (cần truyền qua catheter tĩnh mạch trung tâm)
5.5 Rối loạn Thăng bằng Kiềm-Toan
5.5.1 MỐI TƯƠNG QUAN GIỮA KALI VÀ THĂNG BẰNG KIỀM-TOAN
Sơ đồ dưới đây minh họa mối liên quan giữa nhiễm kiềm và hạ kali máu và giữa nhiễm toan và tăng kali máu.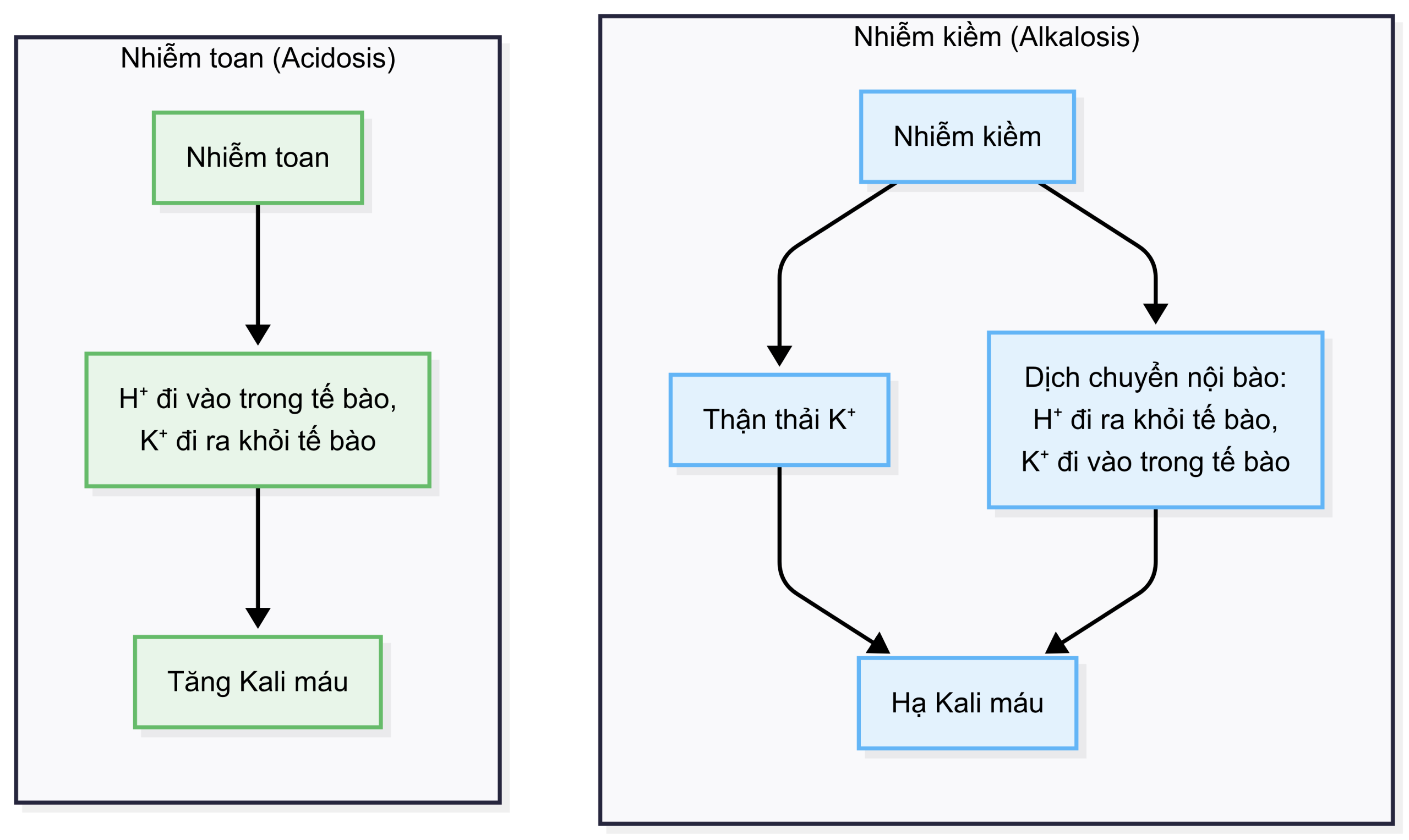 5.5.2 RỐI LOẠN THĂNG BẰNG KIỀM-TOAN “PHỨC TẠP” (KÉP HOẶC BA)
5.5.2 RỐI LOẠN THĂNG BẰNG KIỀM-TOAN “PHỨC TẠP” (KÉP HOẶC BA)
Một bệnh nhân có thể có hai hoặc thậm chí ba rối loạn thăng bằng kiềm-toan nguyên phát. Ví dụ, một tình trạng kiềm hô hấp nguyên phát do thở quá nhanh và một tình trạng toan chuyển hóa tăng khoảng trống anion đồng thời có thể được thấy trong nhiễm trùng huyết hoặc ngộ độc salicylate. 34,35 Cũng có thể có một tình trạng toan chuyển hóa nguyên phát (ví dụ, nhiễm toan ceton do đái tháo đường) và đồng thời một tình trạng kiềm chuyển hóa nguyên phát (ví dụ, nôn mửa gây mất HCl). Hai rối loạn chuyển hóa này có thể được chẩn đoán bằng cách sử dụng khoảng trống anion. Trong một tình trạng toan chuyển hóa tăng khoảng trống anion, một tình trạng kiềm chuyển hóa “ẩn” có thể được phát hiện bằng khái niệm “delta/delta”. Nó dựa trên giả định rằng với một sự gia tăng nhất định của khoảng trống anion (ΔAG), có một sự giảm đồng thời của nồng độ bicarbonate (Δ) do acid không đo được được thêm vào đã chuẩn độ hết bicarbonate. 7,8,36
Tính toán Delta/Delta:
ΔAG = AG đo được – AG bình thường (10-12 mEq/L) = Anion không đo được Δ = bình thường (24 mEq/L) – đo được = Mức giảm
Nếu ΔAG/Δ > 2, nó gợi ý một tình trạng kiềm chuyển hóa đồng thời.
Nhìn theo một cách khác, nếu các anion không đo được trong toan chuyển hóa có khoảng trống anion lớn được chuyển hóa nhanh chóng thành , bệnh nhân sẽ có nồng độ bicarbonate huyết thanh cao và trở nên nhiễm kiềm. Điều này sẽ cho thấy sự đồng thời của cả toan chuyển hóa và kiềm chuyển hóa. Nếu một bệnh nhân như vậy cũng thở quá nhanh hoặc thở quá chậm, rối loạn hô hấp nguyên phát được thêm vào (kiềm hô hấp hoặc toan hô hấp) sẽ gây ra một rối loạn thăng bằng kiềm-toan ba.
Điều quan trọng cần lưu ý là vì có các hệ đệm khác ngoài bicarbonate huyết thanh, AG thường tăng nhiều hơn một chút so với mức giảm của bicarbonate huyết thanh, do đó ΔAG/Δ thường >1; do đó, từ 1 đến 2 là bình thường, trong một toan chuyển hóa tăng khoảng trống anion đơn giản.
Tuy nhiên, nếu AG thấp hơn đáng kể so với mức giảm của bicarbonate huyết thanh, điều đó cho thấy có thể có một tình trạng toan chuyển hóa không tăng khoảng trống anion nguyên phát đồng thời do mất (ví dụ, do tiêu chảy). Điều này có thể được tính như sau:
ΔAG/Δ < 1 gợi ý một tình trạng toan không tăng khoảng trống anion kết hợp ngoài toan chuyển hóa tăng khoảng trống anion. 8,37
TÀI LIỆU THAM KHẢO
- Hamm LL, Nakhoul N, Hering-Smith KS: Acid-base homeostasis . Clin J Am Soc Nephrol 2015; 10 (12): pp. 2232-2242. doi:10.2215/CJN.07400715. .
- Adrogué HJ, Madias NE: Secondary responses to altered acid-base status: the rules of engagement . J Am Soc Nephrol 2010; 21 (6): pp. 920-923. doi:10.1681/ASN.2009121211. .
- Bushinsky DA, Coe FL, Katzenberg C: Arterial pCO2 in chronic metabolic acidosis . Kidney Int 1982; 22 (3): pp. 311-314. doi:10.1038/KI.1982.172. .
- Fulop M: A guide for predicting arterial CO2 tension in metabolic acidosis . Am J Nephrol 1997; 17 (5): pp. 421-424. doi:10.1159/000169134. .
- Narins RG, Emmett M: Simple and mixed acid-base disorders: a practical approach . Medicine (Baltimore) 1980; 59 (3): pp. 161-187. doi:10.1097/00005792-198005000-00001. .
- Emmett M, Narins RG: Clinical use of the anion gap . Medicine (Baltimore) 1977; 56 (1): pp. 38-54. doi:10.1097/00005792-197756010-00002. .
- Reddy P, Mooradian AD: Clinical utility of anion gap in deciphering acid-base disorders . Int J Clin Pract 2009; 63 (10): pp. 1516-1525. doi:10.1111/J.1742-1241.2009.02000.X. .
- Kraut JA, Xing SX: Approach to the evaluation of a patient with an increased serum osmolal gap and high-anion-gap metabolic acidosis . Am J Kidney Dis 2011; 58 (3): pp. 480-484. doi:10.1053/j.ajkd.2011.05.018. .
- Kamel KS, Halperin ML: Use of urine electrolytes and urine osmolality in the clinical diagnosis of fluid, electrolytes, and acid-base disorders . Kidney Int Reports 2021; 6 (5): pp. 1211-1224. doi:10.1016/j.ekir.2021.02.003. .
- Uribarri J, Oh MS: The urine anion gap: common misconceptions . J Am Soc Nephrol 2021; 32 (5): pp. 1025-1028. doi:10.1681/ASN.2020101509. .
- Soares SBM, de Menezes Silva LAW, de Carvalho Mrad FC, Simões e Silva AC: Distal renal tubular acidosis: genetic causes and management . World J Pediatr 2019; 15 (5): pp. 422-431. doi:10.1007/S12519-019-00260-4. .
- Kashoor I, Batlle D: Proximal renal tubular acidosis with and without Fanconi syndrome . Kidney Res Clin Pract 2019; 38 (3): pp. 267-281. doi:10.23876/J.KRCP.19.056. .
- Batlle D, Arruda J: Hyperkalemic forms of renal tubular acidosis: clinical and pathophysiological aspects . Adv Chronic Kidney Dis 2018; 25 (4): pp. 321-333. doi:10.1053/j.ackd.2018.05.004. .
- Soleimani M, Rastegar A: Pathophysiology of renal tubular acidosis: core curriculum 2016 . Am J Kidney Dis 2016; 68 (3): pp. 488-498. doi:10.1053/J.AJKD.2016.03.422. .
- Palmer BF, Kelepouris E, Clegg DJ: Renal tubular acidosis and management strategies: a narrative review . Adv Ther 2021; 38 (2): pp. 949-968. doi:10.1007/S12325-020-01587-5. .
- Blohm E, Lai J, Neavyn M: Drug-induced hyperlactatemia . Clin Toxicol (Phila) 2017; 55 (8): pp. 869-878. doi:10.1080/15563650.2017.1317348. .
- Hashim H, Sahari NS, Sazlly Lim SM, Hoo FK: Fatal tenofovir-associated lactic acidosis: a case report . Iran Red Crescent Med J 2015; 17 (10): pp. e19546. doi:10.5812/IRCMJ.19546. .
- Pedrós C, Ávila M, Gómez-Lumbreras A, Manríquez M, Morros R: Lactic acidosis associated with metformin in patients with moderate to severe chronic kidney disease: study protocol for a multicenter population-based case-control study using health databases . BMC Nephrol 2019; 20 (1): pp. 193. doi:10.1186/S12882-019-1389-8. .
- Garcia-Alvarez M, Marik P, Bellomo R: Sepsis-associated hyperlactatemia . Crit Care 2014; 18 (5): pp. 503. doi:10.1186/S13054-014-0503-3. .
- Reddy AJ, Lam SW, Bauer SR, Guzman JA: Lactic acidosis: clinical implications and management strategies . Cleve Clin J Med 2015; 82 (9): pp. 615-624. doi:10.3949/CCJM.82A.14098. .
- Brivet FG, Slama A, Prat D, Jacobs FM: Carboplatin: a new cause of severe type B lactic acidosis secondary to mitochondrial DNA damage . Am J Emerg Med 2011; 29 (7): pp. 842.e5-842.e7. doi:10.1016/J.AJEM.2010.07.005. .
- Claessens YE, Chiche JD, Mira JP, Cariou A: Bench-to-bedside review: severe lactic acidosis in HIV patients treated with nucleoside analogue reverse transcriptase inhibitors . Crit Care 2003; 7 (3): pp. 226-232. doi:10.1186/CC2162. .
- Lalau JD, Lacroix C, Compagnon P, et al.: Role of metformin accumulation in metformin-associated lactic acidosis . Diabetes Care 1995; 18 (6): pp. 779-784. doi:10.2337/DIACARE.18.6.779. .
- Ruiz JP, Singh AK, Hart P: Type B lactic acidosis secondary to malignancy: case report, review of published cases, insights into pathogenesis, and prospects for therapy . ScientificWorldJournal 2011; 11: pp. 1316-1324. doi:10.1100/TSW.2011.125. .
- Uppal N, Workeneh B, Rondon-Berrios H, Jhaveri K: Electrolyte and acid-base disorders associated with cancer immunotherapy . Clin J Am Soc Nephrol 2022; 17 (6): pp. 922-933. doi:10.2215/CJN.14671121. .
- Jaber S, Paugam C, Futier E, et al.: Sodium bicarbonate therapy for patients with severe metabolic acidaemia in the intensive care unit (BICAR-ICU): a multicentre, open-label, randomised controlled, phase 3 trial . Lancet 2018; 392 (10141): pp. 31-40. doi:10.1016/S0140-6736(18)31080-8. .
- Kraut JA, Kurtz I: Use of base in the treatment of severe acidemic states . Am J Kidney Dis 2001; 38 (4): pp. 703-727. doi:10.1053/AJKD.2001.27688. .
- Mirrakhimov AE, Ayach T, Barbaryan A, Talari G, Chadha R, Gray A: The role of sodium bicarbonate in the management of some toxic ingestions . Int J Nephrol 2017; 2017: pp. 7831358. doi:10.1155/2017/7831358. .
- Kraut JA, Madias NE: Treatment of acute metabolic acidosis: a pathophysiologic approach . Nat Rev Nephrol 2012; 8 (10): pp. 589-601. doi:10.1038/NRNEPH.2012.186. .
- Kraut JA, Madias NE: Lactic acidosis: current treatments and future directions . Am J Kidney Dis 2016; 68 (3): pp. 473-482. doi:10.1053/J.AJKD.2016.04.020. .
Cross Reference
- Nahas GG, Sutin KM, Fermon C, et al.: Guidelines for the treatment of acidaemia with THAM . Drugs 1998; 55 (2): pp. 191-224. doi:10.2165/00003495-199855020-00003. .
- Emmett M: Metabolic alkalosis: a brief pathophysiologic review . Clin J Am Soc Nephrol 2020; 15 (12): pp. 1848-1856. doi:10.2215/CJN.16041219. .
- Singh V, Khatana S, Gupta P: Blood gas analysis for bedside diagnosis . Natl J Maxillofac Surg 2013; 4 (2): pp. 136. doi:10.4103/0975-5950.127641. .
- Palmer BF, Clegg DJ: Salicylate toxicity . N Engl J Med 2020; 382 (26): pp. 2544-2555. doi:10.1056/NEJMRA2010852/SUPPL_FILE/NEJMRA2010852_DISCLOSURES.PDF. .
- Yan MT, Chau T, Cheng CJ, Lin SH: Hunting down a double gap metabolic acidosis . Ann Clin Biochem 2010; 47 (Pt 3): pp. 267-270. doi:10.1258/ACB.2010.009213. .
- Rastegar A: Clinical utility of Stewart’s method in diagnosis and management of acid-base disorders . Clin J Am Soc Nephrol 2009; 4 (7): pp. 1267-1274. doi:10.2215/CJN.01820309. .