Sperling Nội tiết học Nhi khoa, Ấn bản thứ 5 – Biên dịch: Ths.Bs. Lê Đình Sáng
Sperling Pediatric Endocrinology, Fifth Edition
Tác giả: Sperling, Mark A., MD – Nhà xuất bản: Elsevier Inc.
PHẦN III. NỘI TIẾT HỌC TRẺ EM VÀ THANH THIẾU NIÊN
Chương 16. Dậy thì ở Nữ và các Rối loạn liên quan
Robert L. Rosenfield; David W. Cooke; Sally Radovick
Puberty in the Female and Its Disorders
Sperling Nội tiết học Nhi khoa, 16, 528-626
Dậy thì là giai đoạn phát triển trong đó các đặc điểm sinh dục thứ phát xuất hiện và có sự chuyển đổi từ giai đoạn chưa trưởng thành về mặt sinh dục sang giai đoạn trưởng thành. Vị thành niên là một thuật ngữ được sử dụng rộng rãi và thường đồng nghĩa với dậy thì, nhưng nó thường mang thêm ý nghĩa văn hóa như một giai đoạn trưởng thành về mặt tâm lý xã hội.
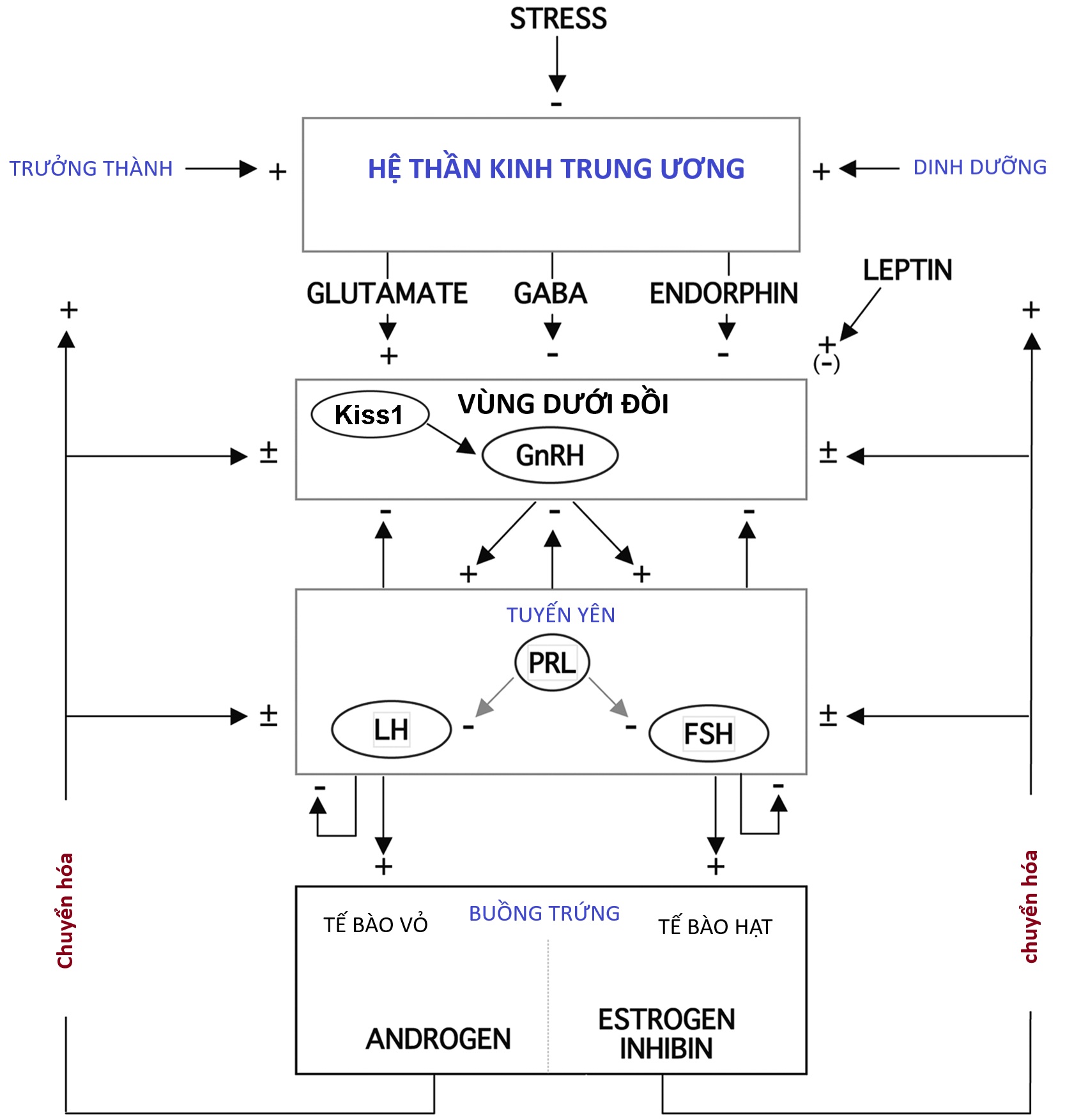
Vào giữa những năm 1960, một khái niệm chung về các yếu tố chính liên quan đến sự khởi phát dậy thì đã được thiết lập (Hình 16.1). Sự giảm nhạy cảm của “bộ điều chỉnh sinh dục” (gonadostat) của não bộ đối với cơ chế điều hòa ngược âm tính của hormone sinh dục được cho là sự kiện chính. Điều này báo hiệu cho vùng dưới đồi tiết ra các chất thần kinh-thể dịch (khi đó chưa được xác định), từ đó kích thích tuyến yên giải phóng gonadotropin. Sự gia tăng bài tiết gonadotropin, hormone tạo hoàng thể (LH) và hormone kích thích nang trứng (FSH), được cho là nguyên nhân trực tiếp làm tăng sản xuất estrogen của buồng trứng. Một mối quan hệ trưởng thành được cho là đã phát triển, trong đó nồng độ estrogen và gonadotropin trong máu được điều hòa tương hỗ thông qua bộ điều chỉnh sinh dục, giống như cách một lò sưởi được điều chỉnh bởi một bộ điều nhiệt. Tuyến tùng được xác định là có đặc tính ức chế tuyến sinh dục. Sự gia tăng bài tiết 17-ketosteroid (17-KS) của vỏ thượng thận, trở nên rõ rệt vào khoảng thời gian dậy thì (“adrenarche” – dậy thì thượng thận), được cho là do một yếu tố từ tuyến yên kích thích androgen thượng thận hiệp đồng với hormone vỏ thượng thận (ACTH).
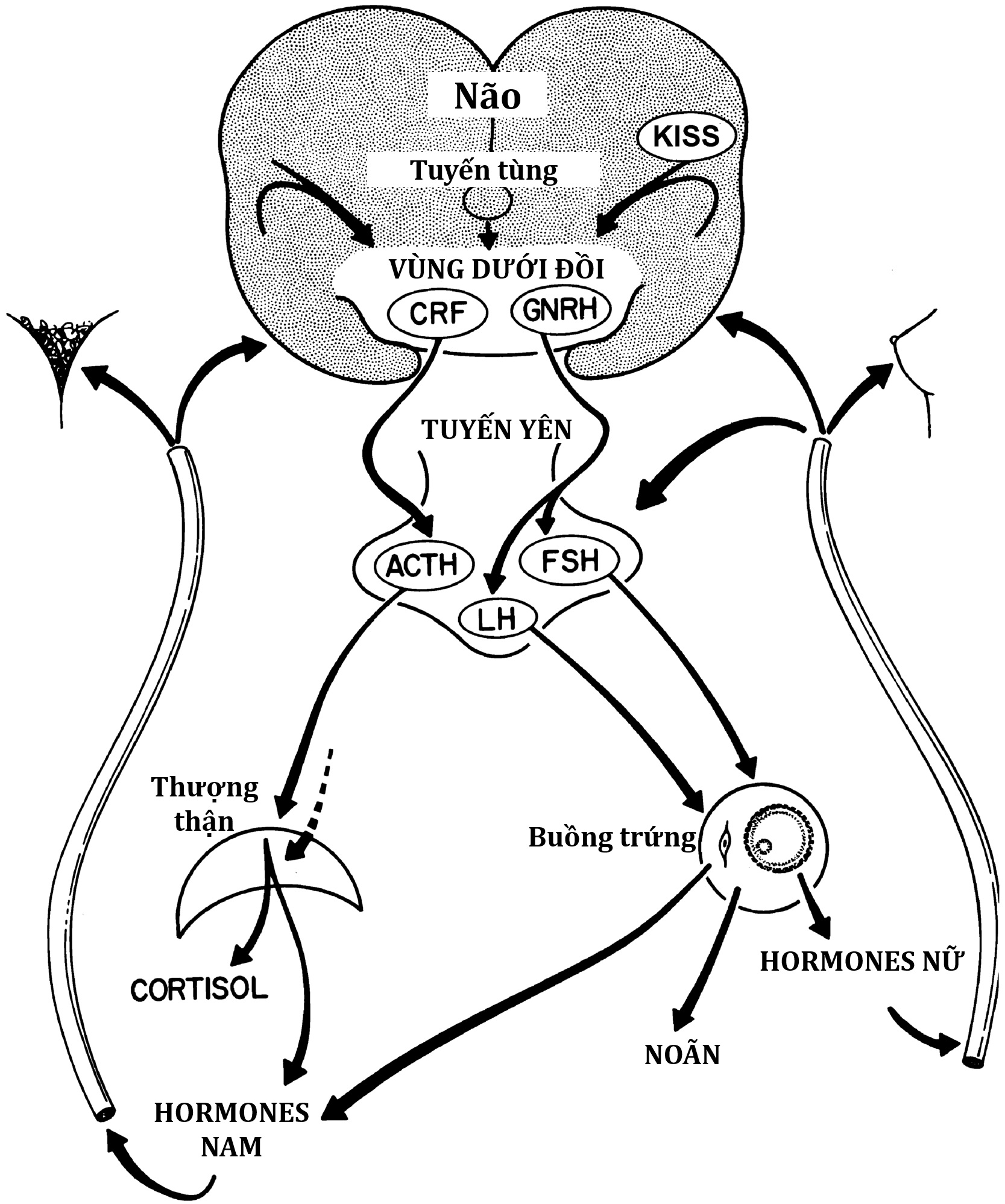
Hình 16.1 Sơ đồ biểu diễn trục thần kinh-nội tiết-buồng trứng liên quan đến sự phát triển dậy thì bình thường. ACTH, Hormone vỏ thượng thận; CRF, yếu tố giải phóng corticotropin; FSH, hormone kích thích nang trứng; GnRH, hormone giải phóng gonadotropin; KISS, kisspeptin; LH, hormone tạo hoàng thể.
Những tiến bộ khoa học nhanh chóng kể từ năm 1965 đã cho phép kiểm chứng khái niệm này bằng những phương pháp ngày càng tinh vi. Trong thập kỷ tiếp theo, xét nghiệm miễn dịch phóng xạ (RIA), ban đầu được phát triển bởi Yalow và Berson, đã được áp dụng để đo lường gonadotropin và steroid sinh dục; hormone giải phóng gonadotropin (GnRH) cho cả LH và FSH đã được các nhóm của Guillemin và Schally phân lập, xác định và tổng hợp. Cyclic adenosine-3′,5′-monophosphate (cAMP), được Sutherland giả thuyết là trung gian cho hoạt động của các hormone peptide, đã được phát hiện là trung gian cho các tác động của gonadotropin lên nang trứng. Những bước đầu tiên trong cơ chế hoạt động của hormone steroid đã được Jensen, Gorski và các nhóm của họ xác định. Tính chất đột phá của nhiều khám phá này đã được công nhận bằng việc trao giải Nobel Y học cho Sutherland vào năm 1971 và cho Yalow, Schally và Guillemin vào năm 1977.
Quan điểm hiện tại của chúng ta về các cơ chế kiểm soát dậy thì đã được tinh chỉnh và phức tạp hơn trước, mặc dù sơ đồ trước đó vẫn đúng về mặt tổng quát. Bộ điều chỉnh sinh dục rõ ràng là một khái niệm quá đơn giản cho một hệ thống phức tạp điều chỉnh hoạt động của bộ tạo xung GnRH ở vùng dưới đồi, một mạng lưới các tế bào thần kinh GnRH được kết nối chức năng và đồng bộ hóa. Ngưỡng của bộ điều chỉnh sinh dục dường như thay đổi trong suốt thời thơ ấu theo kiểu hai pha. Khái niệm này được minh họa trong Hình 16.2. Trong phần lớn cuộc đời bào thai và chu sinh, bộ điều chỉnh sinh dục không nhạy cảm với cơ chế điều hòa ngược âm tính của hormone steroid sinh dục; tại thời điểm này, trục thần kinh-nội tiết-tuyến sinh dục non trẻ hoạt động ở mức độ của tuổi dậy thì. Bộ điều chỉnh sinh dục ngày càng trở nên nhạy cảm với cơ chế điều hòa ngược âm tính trong giai đoạn sơ sinh nhưng chỉ trở nên rất nhạy cảm vào giữa thời thơ ấu, lúc này hoạt động của bộ tạo xung GnRH là tối thiểu. Trong giai đoạn tiền dậy thì muộn, bộ điều chỉnh sinh dục bắt đầu giảm bớt sự ức chế. Điều này cho phép bắt đầu dậy thì. Sự thay đổi ngưỡng ban đầu cho phép tăng cường bài tiết GnRH theo từng đợt. Sau đó là sự gia tăng nhạy cảm của các tế bào gonadotropic của tuyến yên với GnRH. Sự thay đổi trong bài tiết LH và FSH lần đầu tiên có thể phát hiện được trong khi ngủ. Dần dần, các tuyến sinh dục ngày càng nhạy cảm với sự kích thích của gonadotropin, phát triển với tốc độ nhanh hơn và làm tăng nồng độ hormone steroid sinh dục trong huyết tương một cách bền vững. Một số hiện tượng này hiệp đồng với các hiện tượng khác, do đó xảy ra sự tự khuếch đại và tốc độ thay đổi tăng nhanh. Cuối cùng, ngưỡng giải phóng gonadotropin thay đổi đủ để bao gồm một cơ chế điều hòa ngược dương tính.
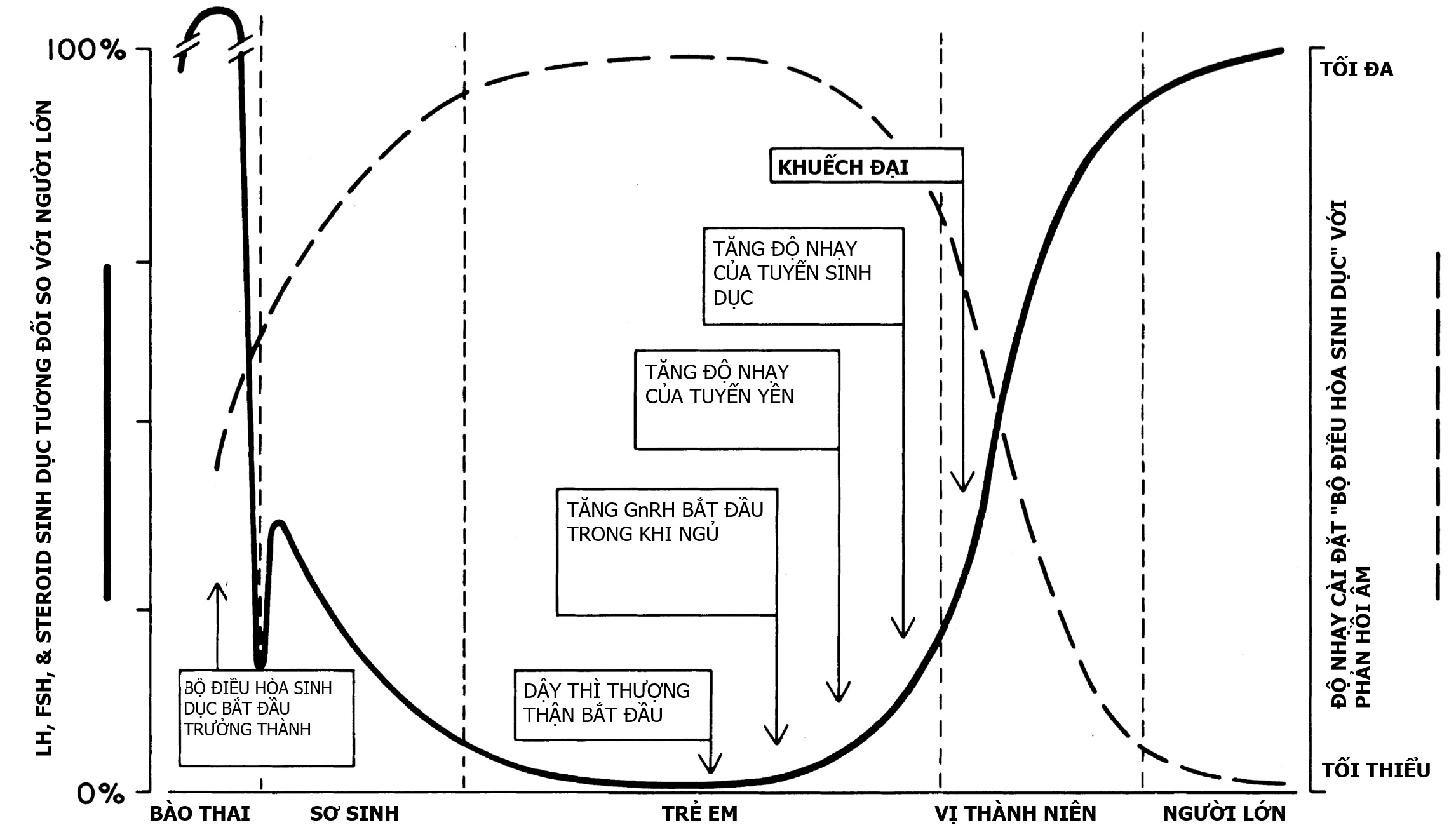
Hình 16.2. Sự thay đổi nồng độ gonadotropin và hormone sinh dục trong huyết thanh từ giai đoạn bào thai đến khi trưởng thành trong mối quan hệ với độ nhạy cảm biểu kiến của “bộ điều chỉnh sinh dục” của hệ thần kinh trung ương đối với tác động điều hòa ngược âm tính của hormone sinh dục và các sự kiện nội tiết tiềm ẩn. FSH, Hormone kích thích nang trứng; GnRH, hormone giải phóng gonadotropin; LH, hormone tạo hoàng thể.(Chỉnh sửa từ Grumbach, M., Grave, C., Mayer, F. (Eds.) (1974), The Control of the Onset of Puberty. New York, John Wiley & Sons.)
Dữ liệu làm cơ sở cho mô hình này sẽ được trình bày sau. Sau đó, dữ liệu mới nhất về môi trường nội tiết và các giai đoạn phát triển thể chất đi kèm của dậy thì bình thường sẽ được trình bày. Dậy thì bất thường sẽ được thảo luận sau đó: nguyên nhân, chẩn đoán phân biệt và quản lý.
Sự phát triển của hệ sinh sản nữ
Sự trưởng thành của Trục Não bộ-Nội tiết-Buồng trứng
Thai nhi
Đơn vị Thần kinh-Nội tiết
Thùy trước của tuyến yên, có nguồn gốc từ ngoại bì khoang miệng, và thùy sau, có nguồn gốc thần kinh, biệt hóa vào tuần thứ 11 của thai kỳ. Đến thời điểm này, các tế bào thần kinh GnRH đã di chuyển từ mảng khứu giác vào vị trí trong vùng dưới đồi nền giữa. GnRH vùng dưới đồi sau đó tăng song song với LH và FSH của tuyến yên và huyết thanh thai nhi. Tất cả đều đạt đỉnh vào khoảng 20 đến 24 tuần, khi các kết nối của hệ thống cửa tuyến yên hoàn tất, đạt đến mức độ mà chỉ thấy lại ở thời kỳ mãn kinh.
Nồng độ LH và FSH trong huyết thanh ở thai nhi nữ cao hơn thai nhi nam. Ở chuột, các tế bào thần kinh chứa GnRH phát triển sớm hơn ở con cái so với con đực, và có sự khác biệt giới tính về mức độ tạo synap của các bó thần kinh cụ thể với các gai đuôi gai trong nhân tiền thị, một trong những khu vực chứa GnRH chính của vùng dưới đồi. Những khác biệt này có thể được quyết định bởi sự sản xuất hormone steroid sinh dục của tuyến sinh dục. Trong tất cả các loài được nghiên cứu, sự bài tiết LH của thai nhi, đặc biệt là tần số xung LH, bị mất nhạy cảm vĩnh viễn với cơ chế điều hòa ngược âm tính của estradiol-progesterone do sự nam hóa của thai nhi. Ở chuột, điều này đã được chứng minh là qua trung gian bởi sự suy giảm vĩnh viễn biểu hiện gen thụ thể progesterone (PR) do estradiol gây ra.
Vào cuối thai kỳ, sự bài tiết GnRH của vùng dưới đồi và gonadotropin của tuyến yên ở thai nhi giảm xuống mức thấp. Những thay đổi này có thể được giải thích bằng tác động điều hòa ngược âm tính của các steroid sinh dục cao do đơn vị thai nhi-nhau thai sản xuất. Trong khi đó, sự trưởng thành của các bó thần kinh trung ương ức chế bài tiết GnRH của vùng dưới đồi và trung gian cho các tín hiệu điều hòa ngược âm tính của tuyến sinh dục dường như tiến triển trong suốt thai kỳ.
Việc sản xuất gonadotropin của tuyến yên thai nhi dường như tạo điều kiện cho sự phát triển bình thường của buồng trứng. Cắt bỏ tuyến yên của thai nhi khỉ rhesus đã được báo cáo là làm giảm số lượng tế bào mầm và noãn bào, cũng như tính toàn vẹn của lưới buồng trứng (rete ovarii). Do đó, có vẻ như sự tồn tại của giao tử phụ thuộc vào sự bài tiết của tuyến yên thai nhi.
Buồng trứng
Buồng trứng biệt hóa ở gờ niệu-sinh dục liền kề với mầm của vỏ thượng thận và thận. Tế bào hạt là tương đồng của tế bào Sertoli của tinh hoàn. Tế bào vỏ, tế bào kẽ và tế bào rốn buồng trứng là tương đồng của tế bào Leydig; tế bào rốn buồng trứng thậm chí có thể chứa các tinh thể giống như tế bào Leydig. Các di tích vỏ thượng thận đôi khi được tìm thấy ở rốn buồng trứng. Ngược lại, các di tích buồng trứng đã được xác định trong tuyến thượng thận.
Các tế bào mầm nguyên thủy di chuyển vào buồng trứng từ nội bì túi noãn hoàng trong tháng đầu tiên của thai kỳ. Tinh hoàn có thể phân biệt được về mặt mô học vào tuần thứ 8 của thai kỳ. Buồng trứng phát triển trong trường hợp không có sự phát triển của tinh hoàn được bật lên bởi dòng tín hiệu do gen SRY trên nhiễm sắc thể Y khởi xướng. Sự kích hoạt con đường tín hiệu β-catenin bởi Wnt-4 và R-spondin1 cho phép yếu tố phiên mã forkhead (Fox) L2 biểu hiện bởi các tế bào mầm để kích hoạt sự biệt hóa buồng trứng bằng cách duy trì sự phát triển của noãn bào và tế bào hạt và ức chế sự biệt hóa của tế bào Sertoli và Leydig; chúng cũng hỗ trợ các khía cạnh sau này của sự phát triển nang trứng. Yếu tố tạo steroid-1 (SF-1) WT-1, LIM-1, và có thể cả gen DAX-1 đóng vai trò trong sự hình thành buồng trứng. Các protein hình thái xương (BMP) của tế bào mầm là cần thiết cho sự tăng sinh của tế bào mầm nguyên thủy.
Các tế bào mầm nguyên thủy trải qua quá trình phân bào để trở thành nguyên noãn bào, một quá trình đạt tối đa ở tuần thứ 8 đến 12. Nguyên noãn bào sau đó trải qua quá trình tạo noãn, đi vào kỳ đầu của giảm phân để trở thành noãn bào bậc một bắt đầu từ tuần thứ 12 đến 16. Số lượng noãn bào đạt đỉnh vào tuần thứ 20 khi có 6,8 triệu tế bào mầm, trong đó 80% dường như còn sống (Hình 16.3). Khi noãn bào đi vào giai đoạn diplotene của kỳ đầu giảm phân, chúng phải được cung cấp các tế bào hạt để tạo thành một nang trứng nguyên thủy, nếu không chúng sẽ bị thoái hóa.
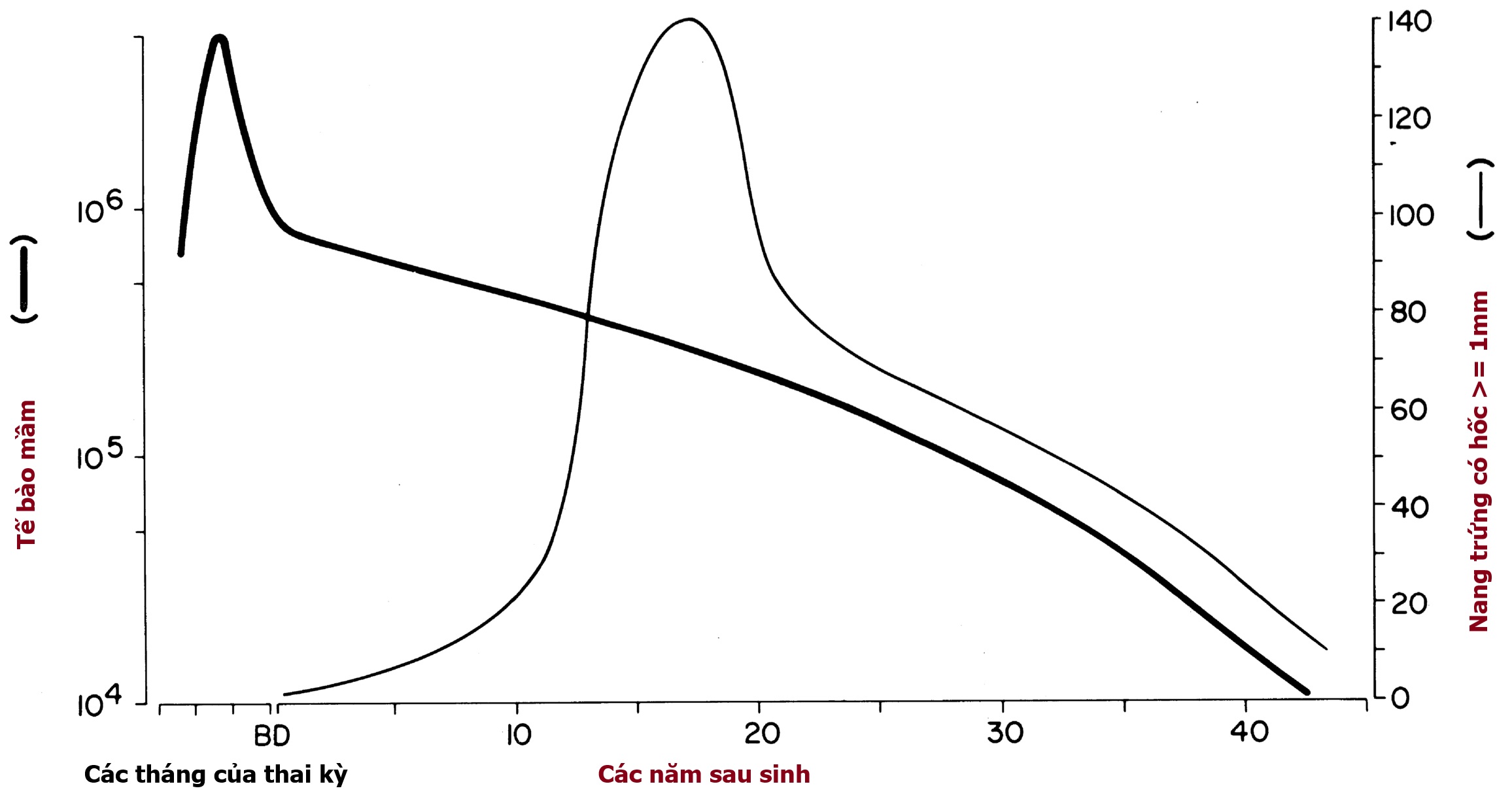
Hình 16.3 Sự phát triển của nang trứng từ giai đoạn bào thai đến khi trưởng thành. Các đường cong cho tổng số tế bào mầm còn sống (đường đậm) và các nang trứng có hốc lớn (đường mảnh) được làm mịn từ dữ liệu của Baker và Block. Số lượng tế bào mầm đạt tối đa vào tháng thứ năm của cuộc đời bào thai. Sự mất mát tế bào mầm diễn ra theo cấp số nhân trong suốt cuộc đời sau khi sinh. Ở tuổi dậy thì, một sự thay đổi rõ rệt xảy ra trong mô hình phát triển của nang trứng. Một phần lớn hơn phát triển đến kích thước có hốc lớn.
Buồng trứng vẫn chưa biệt hóa về mặt mô học cho đến khi các nang trứng nguyên thủy xuất hiện vào khoảng tuần 16, khi biểu mô của các dây sinh dục thứ cấp cung cấp các tế bào hạt cho các noãn bào. Tuy nhiên, buồng trứng thai nhi có khả năng hình thành và truyền tín hiệu androgen và estrogen, mặc dù ở mức độ thấp hơn nhiều so với tinh hoàn, vào tuần thứ 12. Các nang trứng nguyên thủy trở thành nang trứng sơ cấp khi lớp tế bào hạt bao quanh trở thành hình khối. Nang trứng nguyên thủy và nang trứng sơ cấp nhỏ (Hình 16.4) là những nang trứng ở trạng thái nghỉ, là kho dự trữ chính của các tế bào mầm. Lượng tế bào mầm này chỉ bị suy giảm rất chậm trong thời thơ ấu (xem Hình 16.3). Sự tồn tại của các nang trứng nguyên thủy trong vỏ buồng trứng hạn chế sự tiến triển của chúng một phần do độ cứng cơ học của vỏ. Các hiệu ứng cơ học được trung gian bởi con đường tín hiệu Hippopotamus hạn chế tăng trưởng và bởi tính thấm của mạch máu thông qua con đường tín hiệu của yếu tố tăng trưởng nội mô mạch máu.
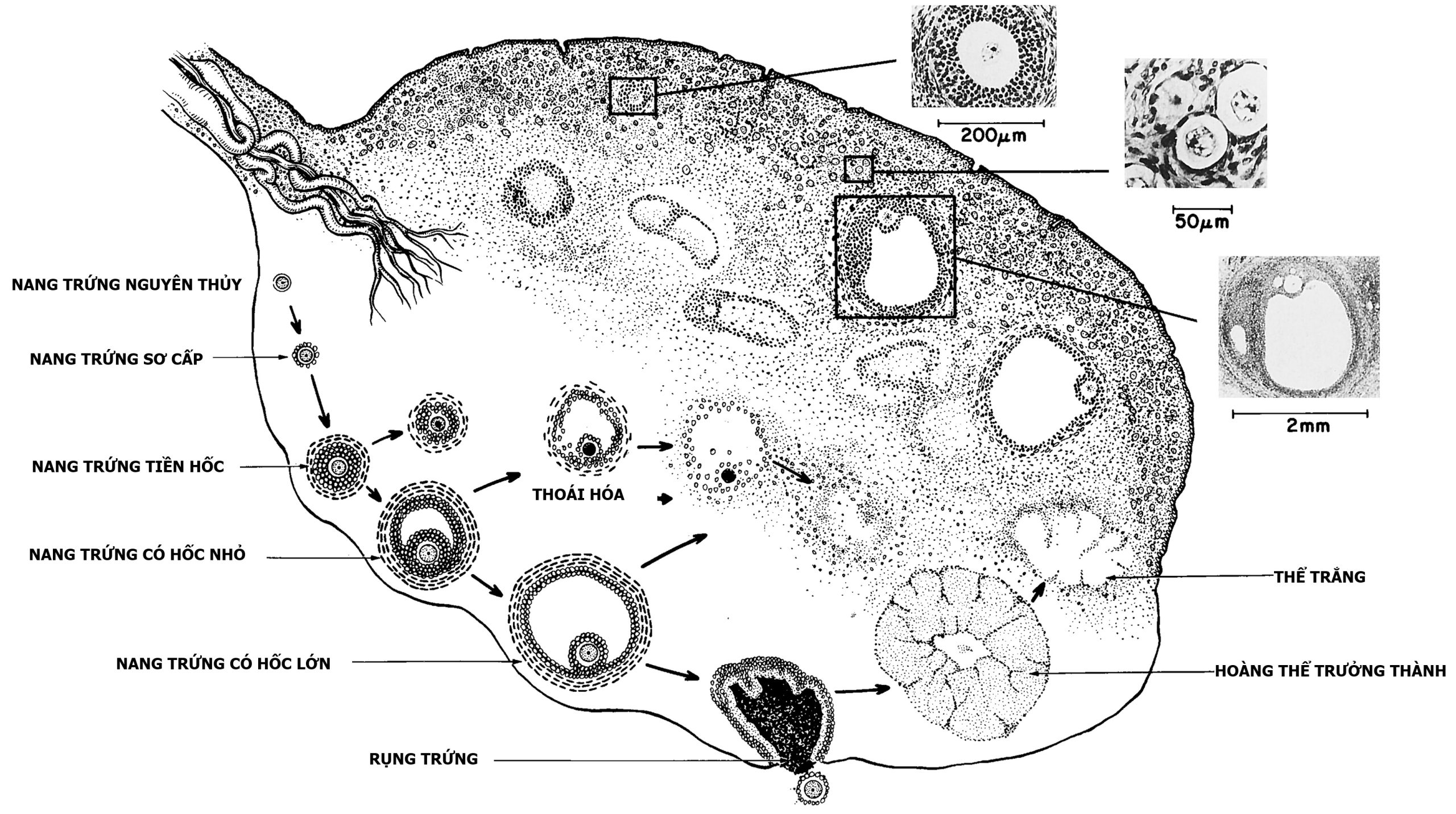
Hình 16.4. Buồng trứng người. Phần dưới của hình cho thấy sự phân loại các nang trứng. Nang trứng tiền hốc chứa tới 300 tế bào hạt, và đường kính của chúng dao động từ 50 đến 200 μm. Đường kính noãn bào tăng từ 25 hoặc nhỏ hơn lên 80 μm. Nang trứng có hốc (Graafian, bậc ba, hoặc nang nước) có một hốc chứa đầy dịch và một noãn bào phát triển đầy đủ, được lót bởi hơn 300 tế bào hạt, và có một lớp vỏ phát triển tốt. Chúng có đường kính lớn hơn 200 μm. Kích thước của buồng trứng trưởng thành xấp xỉ 1.25 × 2.75 × 4 cm. Phần trên của hình minh họa hình ảnh mô học của buồng trứng quanh tuổi có kinh.(Hình ảnh vi mô từ Peters, H. (1979). The human ovary in childhood and early maturity. Eur J Obstet Gynecol Reprod Biol, 9(3), 137; chỉnh sửa từ Ross, G.T., Schreiber, J.R. (1978). The ovary. In: Yen, S.S.C., Jaffe, R. (eds.), Reproductive Endocrinology. Philadelphia, WB Saunders, p. 63.)
Nang trứng thứ cấp và nang trứng tiền hốc, đặc trưng tương ứng bởi sự tổ chức của một lớp tế bào vỏ riêng biệt và sự tăng sinh của các lớp tế bào hạt, sau đó xuất hiện liên tiếp. Nang trứng tiền hốc phát triển ở tuần 24 đến 26. Nang trứng có hốc (Graafian) xuất hiện gần cuối thai kỳ, và những tế bào hạt bao bọc noãn bào trở thành gò noãn. Sự sản xuất estrogen của buồng trứng dường như hầu như không đáp ứng với gonadotropin cho đến khi các nang trứng có hốc sớm phát triển ở tuổi thai gần đủ tháng. Một hoặc hai nang trứng có hốc đường kính 1 đến 2 mm có mặt trong buồng trứng khi đủ tháng. Tại thời điểm này, sự phát triển của nang trứng đã hoàn tất, và số lượng trứng nhiều hơn bất kỳ thời điểm nào khác trong cuộc đời sau sinh (xem Hình 16.3), tổng cộng là 2 triệu, trong đó một nửa dường như bị thoái hóa.
Cả hai nhiễm sắc thể X đều hoạt động trong noãn bào, và các noãn bào tiết ra các yếu tố, chẳng hạn như yếu tố tăng trưởng biệt hóa-9 (GDF9), cần thiết cho sự hình thành lớp tế bào hạt, điều kiện cần cho sự tồn tại của noãn bào. Các chemokine và yếu tố phiên mã đặc hiệu cho noãn bào sau đó phối hợp điều khiển sự hình thành các nang trứng nguyên thủy và sự phát triển tiếp theo của chúng thành nang trứng sơ cấp. Tương tác của GDF9 với các yếu tố tăng trưởng, chẳng hạn như BMP 9 và yếu tố tăng trưởng biến đổi beta (TGF-β), sau đó rất quan trọng cho sự tăng sinh của tế bào hạt nang trứng sơ cấp. Sau đó, các nang trứng tiền hốc phát triển khi GDF9, phối hợp với các yếu tố tăng trưởng khác, tạo ra lớp tế bào vỏ từ các tế bào gốc giống nguyên bào sợi. Một loạt các yếu tố tại chỗ sau đó điều chỉnh sự tăng trưởng và phát triển của nang trứng; ví dụ, yếu tố phiên mã forkhead FOXL2, được biểu hiện đặc biệt trong các tế bào hạt, ngăn cản GDF9 kích hoạt sự tăng trưởng nang trứng sớm.
Sự biểu hiện của thụ thể estrogen (ER) là rất quan trọng cho sự phát triển của lớp tế bào hạt. Insulin và androgen thúc đẩy quá trình chuyển đổi từ nang trứng nguyên thủy sang nang trứng sơ cấp. Chỉ khi đạt đến giai đoạn nang trứng có hốc sớm, sự phát triển của nang trứng mới phụ thuộc hoàn toàn vào hoạt động của FSH.
Số lượng nang trứng được quyết định bởi sự cân bằng giữa sự tồn tại và sự thoái hóa của các tế bào mầm buồng trứng. Vốn tế bào mầm buồng trứng được cho là được xác định trong cuộc đời bào thai vì các tế bào mầm của buồng trứng, không giống như của tinh hoàn, dường như là một quần thể không tự đổi mới. Tuy nhiên, các tế bào gốc dòng mầm nữ có thể nhân lên, điều này cho thấy rằng các yếu tố môi trường bên ngoài noãn bào giữ nó ở trạng thái hoạt động tiềm tàng. Vốn nang trứng cũng có thể bị ảnh hưởng bởi các yếu tố lưu hành, chẳng hạn như độc tố và suy nhau thai. Một số bằng chứng lâm sàng cho thấy suy dinh dưỡng bào thai làm chậm tốc độ thoái hóa. Các nghiên cứu trên chuột chỉ ra rằng dậy thì dường như là một cửa sổ phát triển quan trọng để điều hòa quần thể nang trứng vì một làn sóng suy giảm nang trứng nguyên thủy được kích hoạt bởi hoạt động của gonadotropin trên con đường apoptosis nội tại.
Nhau thai
Đơn vị thai nhi-nhau thai trở thành nguồn chính của hormone sinh dục ở thai nhi nữ trong nửa sau của thai kỳ: tuyến thượng thận của thai nhi cung cấp 17-KS làm cơ chất cho sự hình thành các steroid sinh dục mạnh bởi nhau thai. Androgen dư thừa, từ bất kỳ nguồn nào, ở thai nhi nữ sẽ nam hóa sự biệt hóa sinh dục, như đã thảo luận trong các chương khác. Điều này cũng lập trình cho sự tăng LH và kháng insulin trong cuộc sống trưởng thành. Một yếu tố khác dẫn đến kháng insulin sau sinh là suy nhau thai, thông qua tình trạng thiếu oxy và kết quả là hoạt hóa quá mức sản xuất prostaglandin và bài tiết cortisol của thai nhi.
Trẻ sơ sinh và Trẻ nhỏ
Đơn vị Thần kinh-Nội tiết
Trục dưới đồi-tuyến yên-tuyến sinh dục (HPG) hoạt động tạm thời trong giai đoạn sơ sinh. Điều này đôi khi được gọi là dậy thì mini ở trẻ sơ sinh; không giống như dậy thì thực sự, các biểu hiện lâm sàng chỉ mới chớm và không tiến triển. Sự điều hòa bài tiết gonadotropin ở trẻ sơ sinh, giống như trong tuổi dậy thì, vẫn chưa được biết đầy đủ.
FSH và LH huyết thanh thấp trong máu cuống rốn và duy trì ở mức thấp cho đến khi nồng độ estrogen giảm từ mức ức chế khi đơn vị thai nhi-nhau thai bị gián đoạn lúc sinh. Sau đó, nồng độ LH và FSH của trẻ sơ sinh nhanh chóng bắt đầu tăng theo kiểu xung đến mức dậy thì sớm trong tuần đầu tiên của cuộc đời (xem Hình 16.5).
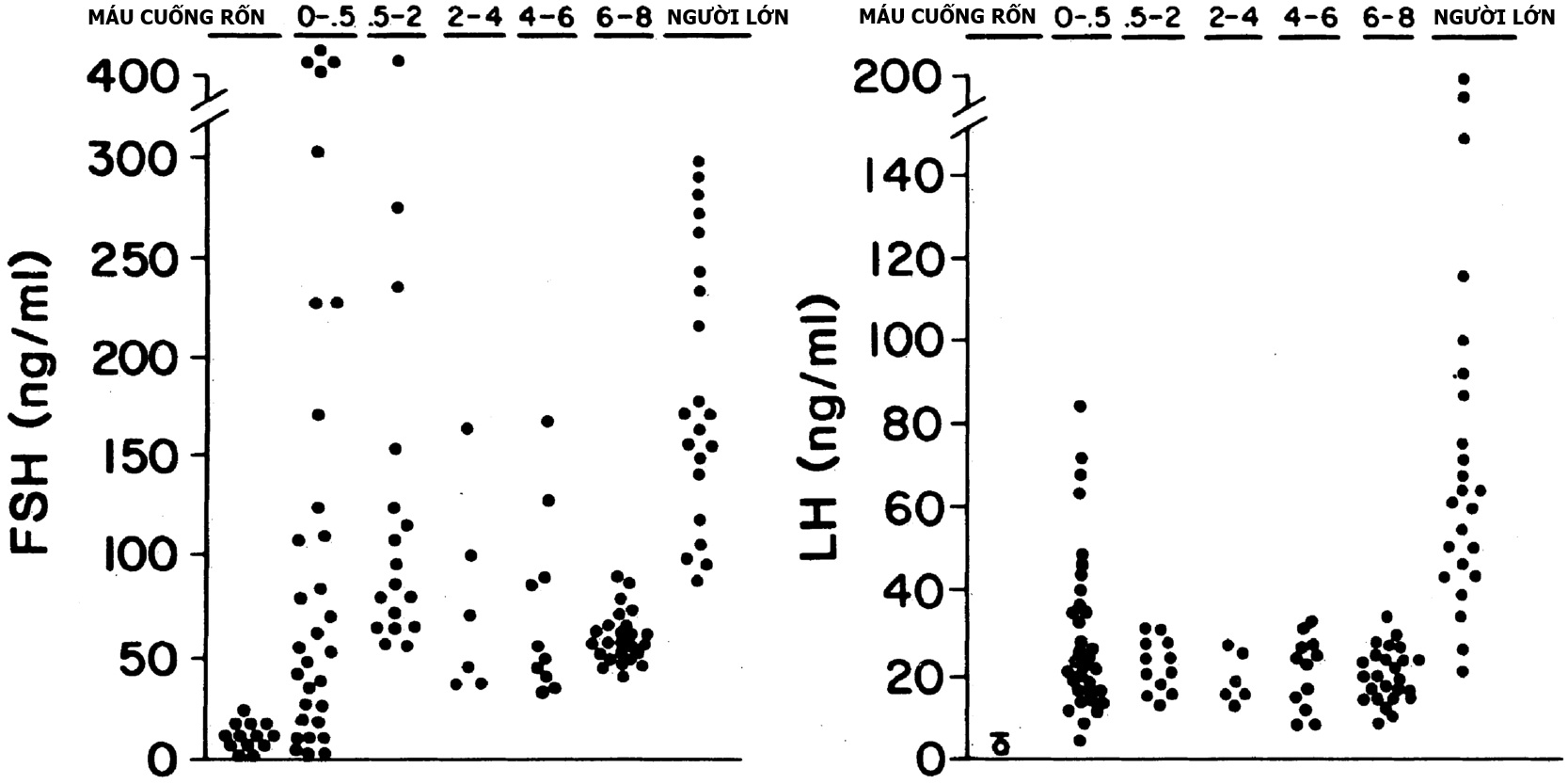
Hình 16.5. Trái: Phân bố nồng độ gonadotropin trong huyết thanh theo các xét nghiệm miễn dịch phóng xạ thế hệ đầu từ sơ sinh đến tuổi trưởng thành (tuổi tính bằng năm). Trái: hormone kích thích nang trứng (FSH). Phải: nồng độ hormone tạo hoàng thể (LH). Nồng độ LH trong máu cuống rốn được đo bằng xét nghiệm miễn dịch phóng xạ đặc hiệu cho tiểu đơn vị beta. Chuẩn LER-907: 100 ng tương đương với 2 mIU FSH và 6 mIU LH của Chế phẩm Tham chiếu Quốc tế Đầu tiên của gonadotropin tuyến yên người để xét nghiệm sinh học.(Dữ liệu từ Winter, J., Faiman, C., Hobson, W., Prasad, A., Reyes, F. (1975). Pituitary-gonadal relations in infancy: I. Patterns of serum gonadotropin concentrations from birth to four years of age in man and chimpanzee. J Clin Endocrinol Metab, 40, 545; Kaplan, S., Grumbach, M., Aubert, M. (1976). The ontogenesis of pituitary hormones and hypothalamic factors in the human fetus. Recent Prog Horm Res, 32, 161.)
Nồng độ LH và FSH trong huyết thanh tăng cao hơn ở trẻ sinh non nữ so với nam, đạt đến ngưỡng sau mãn kinh. Sự khác biệt giới tính này dường như liên quan đến việc thiếu cơ chế điều hòa ngược âm tính do sự phát triển nang trứng bị chậm lại: sự phát triển nang trứng có hốc bắt đầu gần tuổi thai đủ tháng. Có tình trạng tăng prolactin máu song song mà không có sự khác biệt giới tính.
Ở đỉnh điểm từ lúc đủ tháng đến 4 tháng tuổi, gonadotropin huyết thanh và tỷ lệ LH/FSH ở trẻ gái thấp hơn ở trẻ trai, rõ ràng là do trẻ gái thiếu sự gia tăng nhịp xung GnRH được lập trình bởi androgen. Đáp ứng với GnRH và chất chủ vận GnRH tương tự như dậy thì sớm (xem Hình 16.6). Trong tình trạng không có tuyến sinh dục bẩm sinh, gonadotropin đạt mức sau mãn kinh trong giai đoạn sơ sinh.
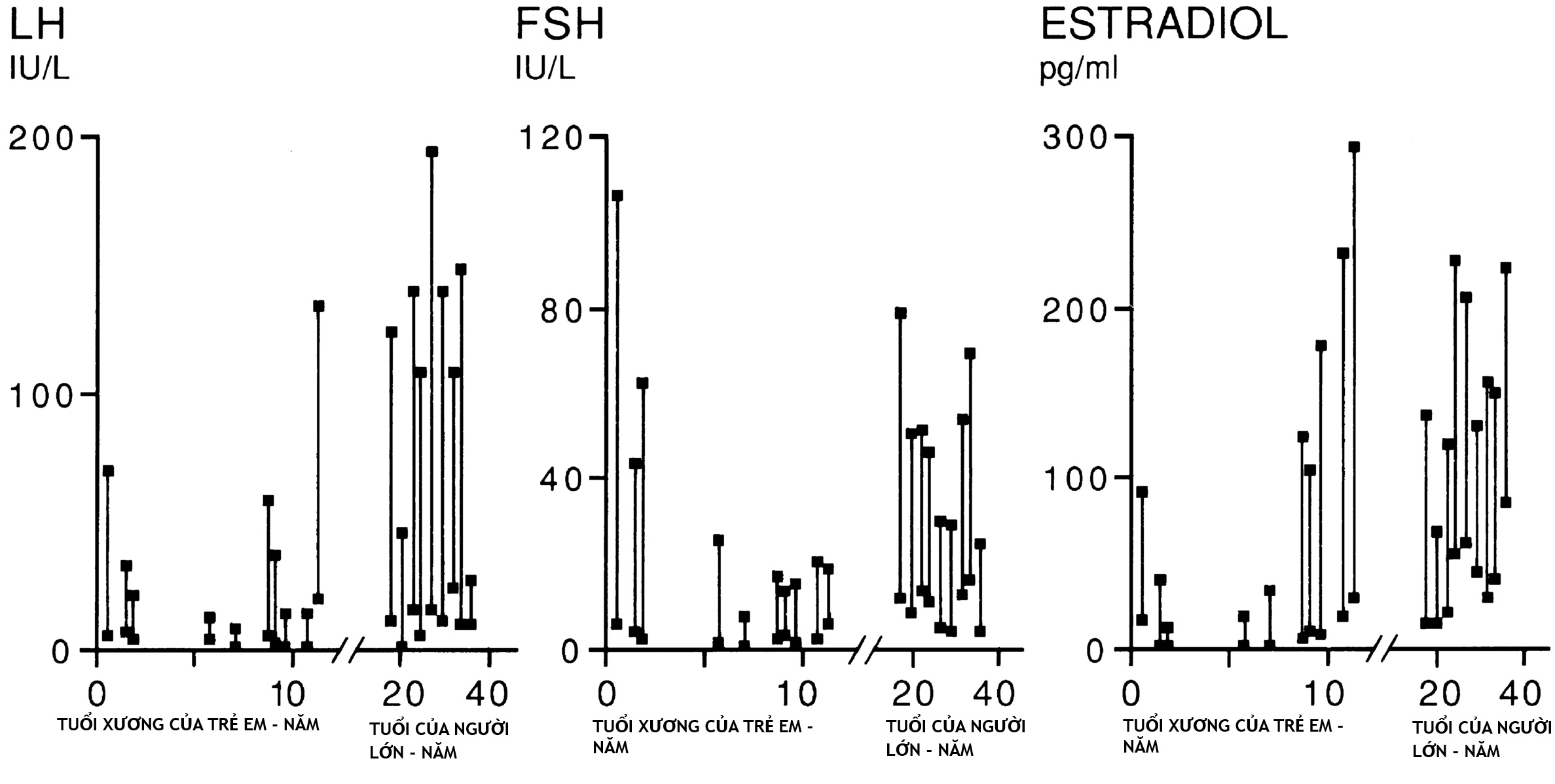
Hình 16.6 Đáp ứng cơ bản và đỉnh với chất chủ vận hormone giải phóng gonadotropin nafarelin (1 mcg/kg tiêm dưới da) trong quá trình phát triển. Các đường nối đáp ứng cơ bản và đỉnh ở trẻ em đối chứng. Các đáp ứng liên quan đến tuổi xương ở trẻ em và tuổi đời ở người lớn. Lưu ý mô hình hai pha của các đáp ứng. Chúng cao ở giai đoạn sơ sinh, thấp hơn ở giữa thời thơ ấu, và tăng trở lại trong tuổi dậy thì. Đáp ứng gonadotropin đỉnh xảy ra vào khoảng 4 giờ, và đáp ứng estradiol đỉnh xảy ra vào 20 giờ. FSH, Hormone kích thích nang trứng; LH, hormone tạo hoàng thể. (Từ Rosenfield, R.L., Burstein, S., Cuttler, L., et al. (1989). Use of nafarelin for testing pituitary-ovarian function. J Reprod Med, 34, 1044.)
Sau khoảng 4 tháng sau khi đủ tháng, nồng độ gonadotropin và prolactin bắt đầu giảm dần vào khoảng tiền dậy thì (xem Hình 16.5). FSH ở trẻ gái cao hơn trẻ trai, một xu hướng có xu hướng tồn tại đến đầu thời thơ ấu. Điều này một phần dường như liên quan đến cơ chế điều hòa ngược âm tính bởi nồng độ activin-A trong huyết thanh cao hơn và inhibin-B thấp hơn ở trẻ gái so với trẻ trai. Sự bài tiết GnRH cũng dường như lớn hơn ở trẻ gái so với trẻ trai vào thời điểm này.
Sự suy giảm gonadotropin có thể một phần liên quan đến sự trưởng thành của các bó thần kinh dẫn truyền tín hiệu ức chế từ hệ thần kinh trung ương và/hoặc sự gia tăng các thụ thể steroid sinh dục ở vùng dưới đồi. Các thụ thể ER ở vùng dưới đồi tăng theo một mô hình đối nghịch với sự sụt giảm gonadotropin trong huyết thanh ở chuột (xem Hình 16.7), cũng như các thụ thể DHT ở vùng dưới đồi. Sự nhạy cảm ngày càng tăng của vùng dưới đồi đối với cơ chế điều hòa ngược âm tính của hormone steroid sinh dục có thể giải thích cho tác động ức chế của một lượng nhỏ estradiol và testosterone lưu hành.
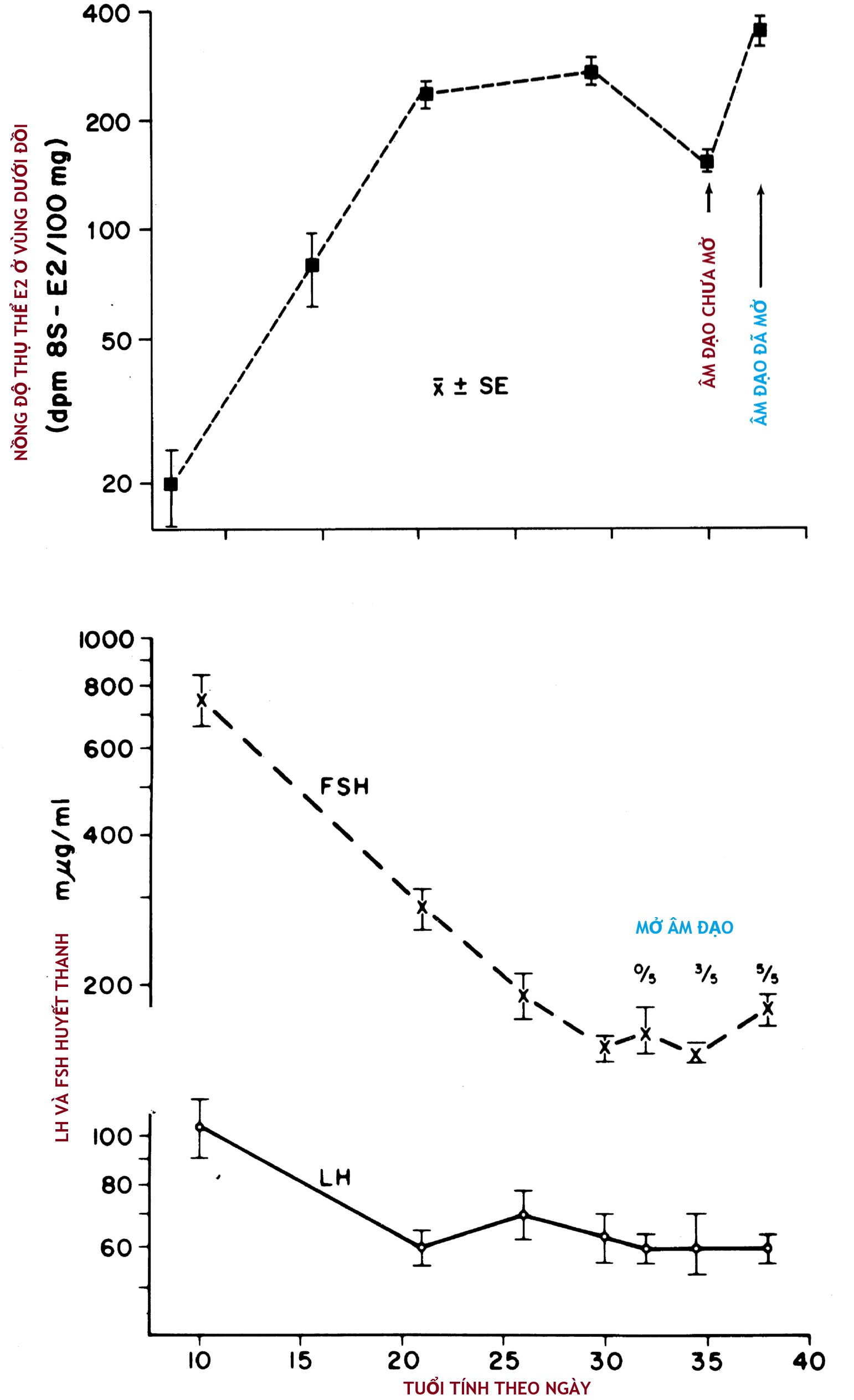
Hình 16.7 Mối quan hệ giữa sự trưởng thành của các thụ thể estrogen ở vùng dưới đồi (trên) với nồng độ gonadotropin trong huyết thanh (dưới) ở chuột cái đang phát triển. FSH, Hormone kích thích nang trứng; LH, hormone tạo hoàng thể. (Từ Rosenfield, R.L. (1977). Hormonal events and disorders of puberty. In: Givens, J.R. (ed.), Gynecologic Endocrinology. Chicago, Year Book Medical. Được phép của Mosby-Year Book.)
Mức đáy của cả hai gonadotropin trong huyết thanh xảy ra vào khoảng 6 tuổi (xem Hình 16.2 và 16.5). Ở độ tuổi này, đáp ứng của LH và FSH với GnRH là tối thiểu, dường như do thiếu sự kích thích của GnRH. Hơn nữa, ở giai đoạn này, tình trạng không có tuyến sinh dục hiếm khi được phản ánh qua sự gia tăng gonadotropin trong huyết thanh hoặc dự trữ gonadotropin.
Tuy nhiên, sản xuất gonadotropin không bị ức chế hoàn toàn vào giữa thời thơ ấu. Gonadotropin đã được phát hiện trong nước tiểu của trẻ nhỏ tiền dậy thì, ở giới hạn độ nhạy của các xét nghiệm sinh học cổ điển: bài tiết LH trung bình bằng 3% và FSH bằng 15% so với lượng của người lớn. Các xét nghiệm dựa trên kháng thể đơn dòng đặc hiệu đã cho thấy LH giảm xuống dưới 0.2 U/L vào ban ngày trong khi FSH vẫn có thể phát hiện được và các gonadotropin được sản xuất ở giai đoạn này được bài tiết theo các xung vi mô tăng gần gấp đôi liên quan đến giấc ngủ. Các gonadotropin cũng dường như có hoạt tính sinh học dựa trên sự nhạy cảm của chúng với cơ chế điều hòa ngược âm tính của estradiol ở loài linh trưởng và sự hình thành tích cực của các nang trứng có hốc trong thời thơ ấu, cho thấy sự kích thích của gonadotropin, như được thảo luận trong phần sau về người lớn.
Từ 7 đến 10 tuổi, ngay cả những bé gái tiền dậy thì cũng có những sự gia tăng tinh tế nhưng đáng kể về nồng độ gonadotropin. Sự thay đổi này tương ứng với sự gia tăng bài tiết GnRH. Những dữ liệu này chỉ ra rằng mô hình bài tiết hormone của trẻ 10 tuổi tiền dậy thì khác với trẻ 7 tuổi và cho thấy rằng những thay đổi nội tiết báo hiệu sự phát triển của tuổi dậy thì được tìm thấy vào cuối thập kỷ đầu tiên của cuộc đời, trước một thời gian so với sự phát triển của các đặc điểm sinh dục thứ phát.
Buồng trứng
Buồng trứng của trẻ sơ sinh và trẻ nhỏ không ở trạng thái im lìm. Sự khởi đầu tăng trưởng và phát triển của các nang trứng nghỉ ngơi xảy ra trong suốt thời thơ ấu. Buồng trứng sơ sinh thường chứa một nang trứng có hốc với sự hoàng thể hóa lớp vỏ, và số lượng nang trứng có hốc tăng gần gấp đôi so với giai đoạn sơ sinh vào 7 tuổi và gấp bốn lần vào 9 tuổi (xem Hình 16.3). Tất cả các nang trứng có hốc này thường bị thoái hóa trong thời thơ ấu, và điều này làm tăng lượng mô đệm. Do đó, vào giữa thời thơ ấu, buồng trứng của các bé gái bình thường có tới năm nang trứng có hốc đường kính từ 4 đến 9 mm, và thể tích buồng trứng tăng lên đến khoảng 3.5 cc. Sự phát triển nang trứng bắt đầu tăng tốc ngay trước khi bắt đầu có các dấu hiệu lâm sàng của dậy thì.
Trong vài tháng đầu đời, nồng độ hormone buồng trứng trong máu ở mức dậy thì sớm được tìm thấy như một phần của sự kích hoạt tạm thời trục HPG xảy ra ở trẻ sơ sinh. Nồng độ estradiol và inhibin-B trong huyết thanh song song với nồng độ FSH. Trong giai đoạn sơ sinh, chúng bắt đầu tăng đến mức dậy thì sớm, duy trì ở đó trong vài tháng đầu đời, và giảm xuống mức thấp trong thời thơ ấu (xem Hình 16.8). Các chi tiết về những thay đổi nội tiết sẽ được thảo luận sau (xem Các giai đoạn phát triển nội tiết và sinh dục bình thường).
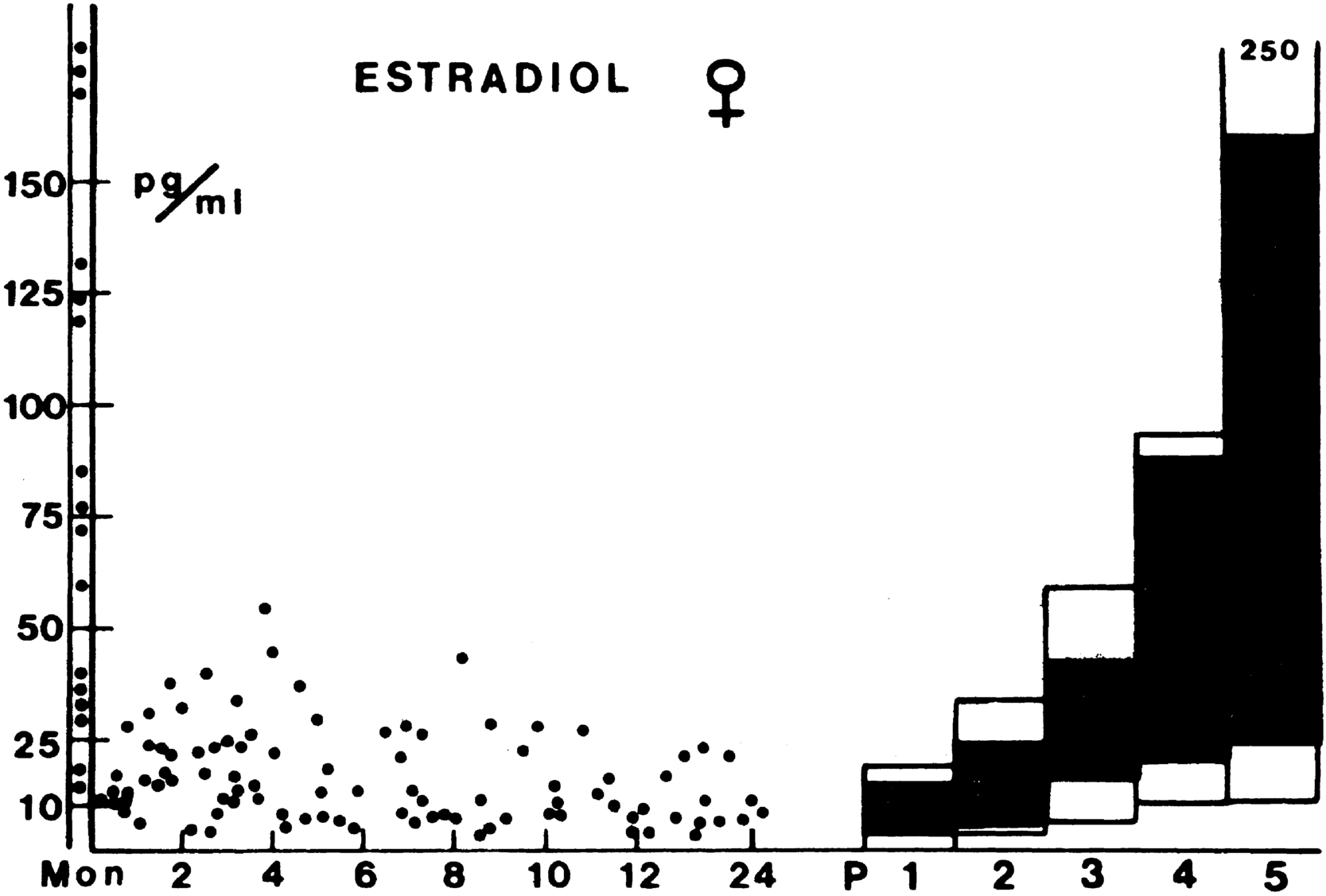
Hình 16.8 Phân bố nồng độ estradiol huyết tương ở trẻ sơ sinh nữ so với nồng độ ở nữ giới tuổi dậy thì và trưởng thành. Các cột đại diện cho khoảng giá trị bình thường cho các giai đoạn khác nhau của dậy thì. Vùng giữa phân vị thứ 10 và 90 có màu tối. Giai đoạn P1 bao gồm tất cả các bé gái tiền dậy thì lớn hơn 2 tuổi. Các giá trị giữa các trục tung được tìm thấy trong khoảng từ 2 đến 5 ngày tuổi. (Từ Bidlingmaier, F., Knorr, D. (1978). Oestrogens: physiologic and clinical aspects. Pediatr Adolesc Endocrinol, 4, 41–84.)
Vị thành niên
Những thay đổi nội tiết của dậy thì thực sự bắt đầu vào cuối giai đoạn tiền vị thành niên trước khi các đặc điểm sinh dục thứ phát xuất hiện, như vừa được xem xét. Sự kiện cơ bản tiềm ẩn là sự gia tăng bài tiết GnRH của vùng dưới đồi. Dậy thì là hệ quả của việc vùng dưới đồi giải phóng GnRH với tần số và biên độ ngày càng tăng, đầu tiên chỉ vào ban đêm, sau đó dần dần trong suốt cả ngày.
Sự gia tăng bài tiết GnRH ở người ban đầu được suy ra khi Kastin, Job, Grumbach và các cộng sự của họ chứng minh rằng trẻ em tiền vị thành niên có dự trữ LH và FSH trong tuyến yên có thể giải phóng được bởi GnRH (Hình 16.6 và 16.9). Sau đó, có báo cáo rằng ở người, sản lượng một mảnh GnRH có hoạt tính miễn dịch bắt đầu tăng vào cuối thời thơ ấu và tăng đến mức người lớn trong tuổi dậy thì. Các nghiên cứu trên chuột cho thấy GnRH vùng dưới đồi tăng trong suốt tuổi dậy thì.
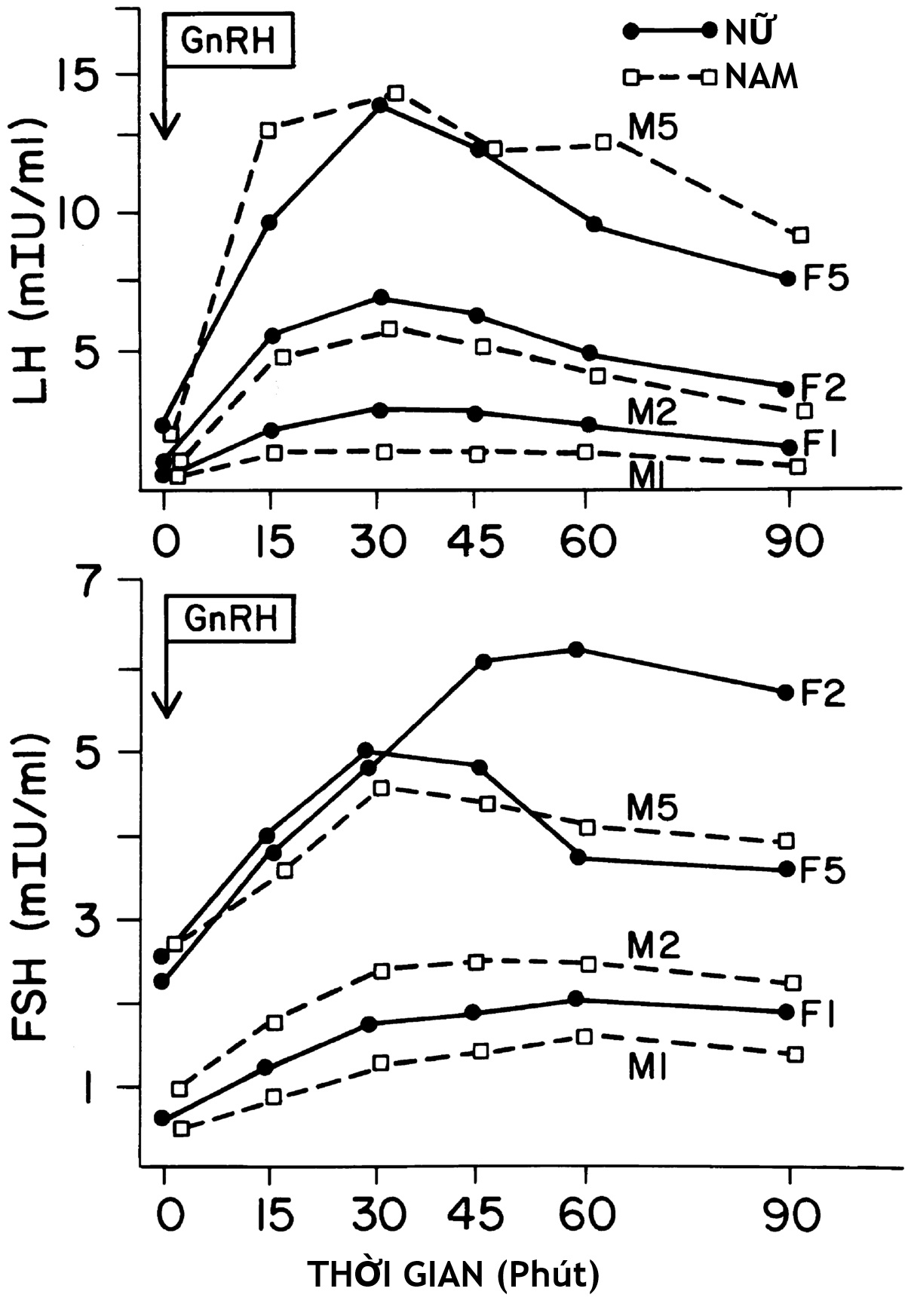
Hình 16.9 Đáp ứng của hormone tạo hoàng thể (LH) và hormone kích thích nang trứng (FSH) với một liều bolus hormone giải phóng gonadotropin (GnRH) (50 mcg/kg/ngày) ở nam (M) và nữ (F) trong giai đoạn tiền dậy thì (tuổi 5–6: F1, M1), dậy thì sớm (F2, M2), và dậy thì muộn (F5, M5). Các đáp ứng với GnRH có xu hướng tiến triển cùng với sự tiến triển của dậy thì. Tuy nhiên, các bé gái dậy thì sớm có một lượng FSH dự trữ dễ giải phóng lớn hơn so với các thanh thiếu niên tiến triển hơn. Đáp ứng đỉnh của các bé gái có xu hướng lớn hơn một chút so với các bé trai ở các giai đoạn tương đương. (Chỉnh sửa với sự cho phép từ Ehrmann et al, Polycysticovary syndrome as a form of functional ovarian hyperandrogenism due to dysregulation ofandrogen secretion. Endocr Rev. 1995;16:322–353.)
Knobil sau đó đã chỉ ra rằng có thể gây dậy thì ở khỉ rhesus cái chưa trưởng thành bằng cách tiêm GnRH theo các xung hàng giờ tạo ra nồng độ trong máu khoảng 2000 pg/mL. Việc tiêm GnRH kéo dài theo phác đồ này đầu tiên dần dần gây ra sự gia tăng thoáng qua của LH và FSH. Điều này sau đó gây ra sự phát triển nang trứng theo chu kỳ. Sự tăng estradiol vừa phải sau đó có cường độ đủ để gây ra kinh nguyệt do chảy máu kinh nguyệt do ngưng thuốc trong một chu kỳ không rụng trứng (Hình 16.10). Việc tiếp tục cùng một phác đồ GnRH dẫn đến sự phát triển của các kỳ kinh nguyệt rụng trứng hàng tháng bình thường. Các xung GnRH sinh lý ở người có thể đạt nồng độ thấp hơn (200 pg/mL) và xảy ra ở khoảng cách rộng hơn một chút so với ở khỉ. Do đó, các xung LH ở phụ nữ trưởng thành xảy ra ở khoảng cách khoảng 1.5 giờ trong giai đoạn nang trứng, chậm lại trong giai đoạn hoàng thể.
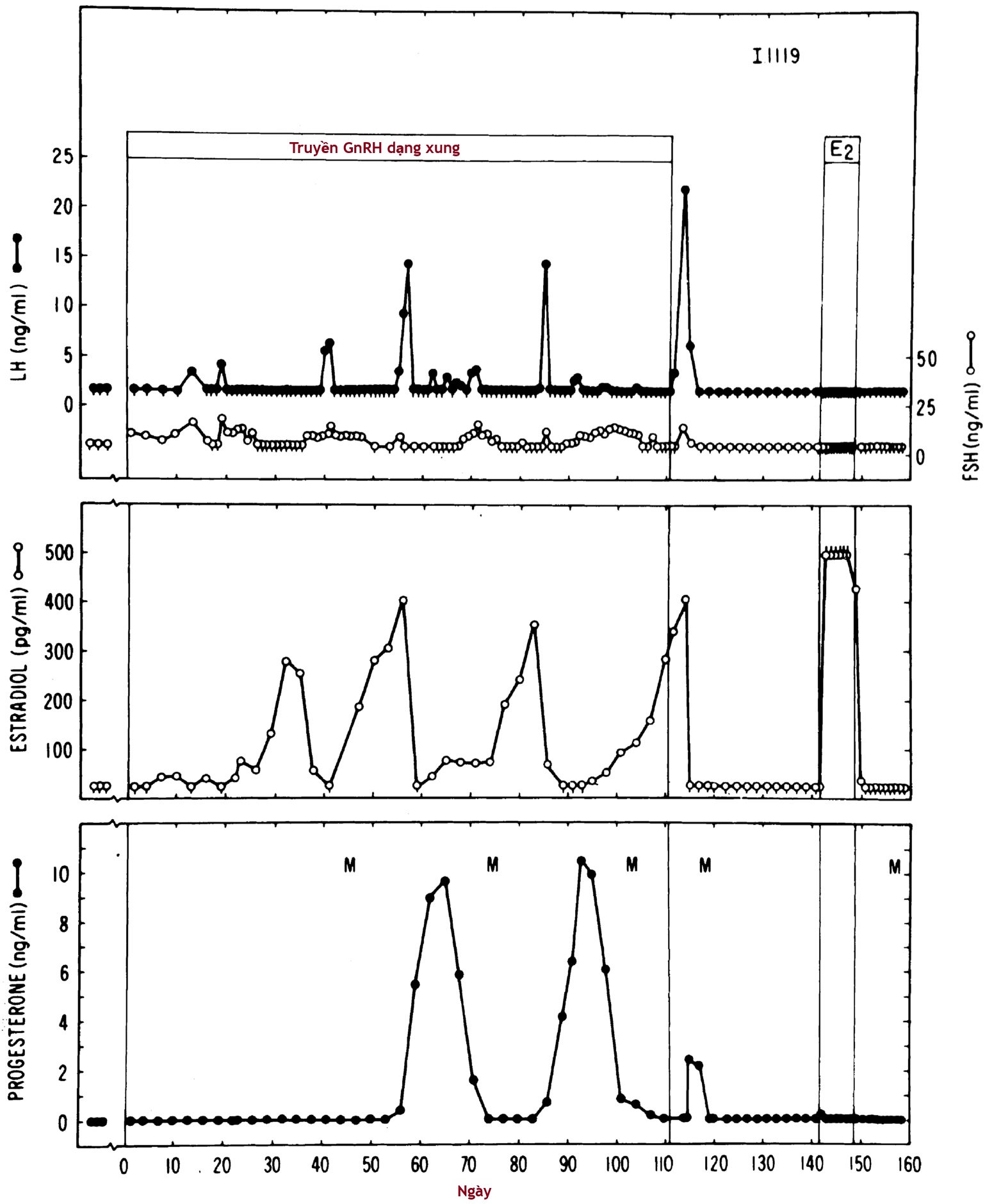
Hình 16.10 Gây dậy thì ở một con khỉ rhesus 13 tháng tuổi tiền dậy thì bằng một phác đồ gonadotropin-releasing hormone (GnRH) dạng xung không đổi (1 mcg/phút × 6 phút mỗi giờ). Hormone tạo hoàng thể (LH), hormone kích thích nang trứng (FSH), estradiol (E2), và progesterone không thể phát hiện được trước khi truyền GnRH. Khi truyền GnRH, sự gia tăng FSH là thay đổi đầu tiên có thể phát hiện được bằng cách lấy mẫu giữa buổi sáng giữa các xung GnRH. Một đợt tăng E2 đáng kể xảy ra khoảng 1 tháng sau đó. Đợt tăng LH tiếp theo quá khiêm tốn để gây rụng trứng, nhưng kinh nguyệt (M) đã xảy ra vài ngày sau khi đợt tăng E2 kéo dài một tuần giảm xuống—kỳ kinh đầu tiên là kết quả của một chu kỳ không rụng trứng. Việc tiếp tục GnRH đã dẫn đến sự xuất hiện bền vững của các chu kỳ kinh nguyệt có rụng trứng cách nhau 28 ngày. Một kết quả tương tự xảy ra nếu một con vật trưởng thành bị tổn thương vùng cung trải qua phác đồ GnRH này. Đợt tăng LH thứ ba xảy ra 2 ngày sau khi ngừng GnRH. Sự bài tiết progesterone từ hoàng thể bị cùn và thoáng qua khi không có sự bài tiết LH bền vững. Sự gia tăng sau đó của E2 huyết tương do cấy E2 dưới da đã không gây ra một đợt tăng gonadotropin, cho thấy con vật đã trở lại trạng thái chưa trưởng thành. Kinh nguyệt cuối cùng tự phát tái phát ở những con vật này vào độ tuổi thông thường (khoảng 27 tháng). Các vạch dọc nhỏ bên dưới các điểm dữ liệu cho biết các giá trị dưới độ nhạy của xét nghiệm. Lưu ý rằng gonadotropin và E2 thường không thể phát hiện được (trong khoảng tiền dậy thì) trong thời kỳ dậy thì được gây ra. (Từ Knobil, E. (1980). The neuroendocrine control of the menstrual cycle. Recent Prog Horm Res, 36, 53.)
Dậy thì bắt đầu để đáp ứng với sự gia tăng bài tiết GnRH. LH huyết thanh đầu tiên bắt đầu tăng không tương xứng với FSH; sự chênh lệch LH-FSH này đặc biệt rõ rệt trong khi ngủ, điều này được phản ánh trong các đáp ứng với GnRH hoặc chất chủ vận GnRH (Bảng 16.1). Dậy thì trở nên rõ ràng về mặt lâm sàng dưới dạng phát triển vú (Phát triển vú) khi nồng độ estradiol được duy trì > 10 pg/mL. Dường như sự gia tăng inhibin-B khi các nang trứng buồng trứng ngày càng phát triển đóng một vai trò điều hòa ngược âm tính quan trọng trong việc hạn chế sự gia tăng thêm nồng độ FSH trong tuổi dậy thì. Nồng độ FSH trở nên ít phụ thuộc vào GnRH hơn trong tuổi dậy thì. Các cơ chế điều hòa khác biệt của FSH và LH sẽ được thảo luận sau trong chương này.
Bảng 16.1 Khoảng giá trị bình thường điển hình ở nữ giới cho Hormone Tạo hoàng thể, Hormone Kích thích nang trứng, và Steroid buồng trứng lúc đói và đáp ứng với các nghiệm pháp Hormone Vỏ thượng thận và chất chủ vận Hormone Giải phóng Gonadotropin a
| LH (U/L) | FSH(U/L) | Estradiol (pg/mL) | Estrone (pg/mL) | Testosterone (ng/dL) | Androstene-dione (ng/dL) | DHEA (ng/dL) | 17PROG (ng/dL) | 17PREG (ng/dL) | DHEAS (mcg/dL) | |
|---|---|---|---|---|---|---|---|---|---|---|
| Nền (8:00 sáng) | ||||||||||
| Trẻ sinh non, 26–28 tuần, ngày 4 | 0.1–175 | 2–200 | — | — | < 45 | 60–940 | 80–1485 | 100–2000 | 375–3550 | 125–880 |
| Trẻ đủ tháng, ngày 1 | — | — | 300–500 | 300–500 | 16–75 | 100–410 | 300–2600 | 150–850 | 110–3000 | 20–410 |
| Trẻ đủ tháng, ngày 3–7 | — | — | < 15 | < 20 | < 20 | 280 | 40–1300 | < 80 | 35–800 | 90–360 |
| Trẻ đủ tháng, tối đa 1–6 tháng | ≤ 1.1 | 1.2–19 | <7–55 | ≤ 20 | <10–45 | ≤ 40 | ≤ 950 | ≤ 110 | 40–765 | ≤ 115 |
| Trẻ em, 1–5 tuổi | < 0.15 | < 0.16–3.5 | 0.5 | 0.5 | 0.5 | 10–50 | 20–130 | 5–115 | 10–105 | 5–35 |
| Trẻ em, 6–10 tuổi | ≤ 0.3 | ≤ 2.9 | 0.9 | 0.9 | 0.9 | 10–75 | 20–345 | 5–115 | 10–200 | 10–115 |
| Dậy thì trước kinh nguyệt, 9–13 tuổi | ≤ 7.2 | 1.1– 9.0 | ≤55 | 10–35 | 10–35 | 40–175 | 40–600 | 16–220 | 35–350 | 35–130 |
| Sau kinh nguyệt, pha nang trứng sớm | 1.5–5.6 | 3.6–7.9 | 20–85 | 20–50 | 20–60 | 50–200 | 100–850 | ≤ 130 b | 55–360 | 75–255 |
| Đỉnh sau ACTH 1–24 (30–60 phút sau ≥ 10 mcg/m2 IV) | ||||||||||
| Trẻ em, 1–5 tuổi | — | — | <20 | 16–70 | 25–100 | 50–270 | 45–350 | 5–35 | ||
| Trẻ em, 6–10 tuổi | — | — | <20 | 25–100 | 70–320 | 85–300 | 60–650 | 10–115 | ||
| Dậy thì trước kinh nguyệt, 9–13 tuổi | — | — | 10–35 | 55–230 | 70–725 | 90–400 | 150–750 | 35–130 | ||
| Sau kinh nguyệt, pha nang trứng sớm | — | — | 20–60 | 60–250 | 250–1470 | 35–160 b | 150–1070 | 75–255 | ||
| Đỉnh sau chất chủ vận GnRH (Leuprolide acetate 10 mcg/kg SC) | ||||||||||
| Tiền dậy thì, 6–9 tuổi | 1.2–8.9 | 9.3–37 | ≤ 55 | — | < 20 c | 25–50 c | 25–70 c | < 25 c | — | — |
| Dậy thì trước kinh nguyệt, 9–13 tuổi | 2.8–99 | 14–40 | 30–350 | — | 10–45 c | 25–165 c | 60–185 c | < 155 c | — | — |
| Sau kinh nguyệt, pha nang trứng sớm | 30–135 | 16–60 | 65–260 | — | 10–60 c | 50––180 c | 60–450 c | 30–135 c | — | — |
| Hệ số chuyển đổi sang đơn vị SI | 3.67 (pmol/L) | 3.70 (pmol/L) | 0.0347 (nmol/L) | 0.0349 (nmol/L) | 0.0347 (nmol/L) | 0.0303 (nmol/L) | 0.0316 (nmol/L) | 0.0271 (μmol/L) |
17PREG, 17-Hydroxypregnenolone; 17PROG, 17-hydroxyprogesterone; ACTH, hormone vỏ thượng thận; DHEA, dehydroepiandrosterone; GnRH, hormone giải phóng gonadotropin; FSH, hormone kích thích nang trứng; IV, tĩnh mạch; LH, hormone tạo hoàng thể; SC, dưới da.
(Dữ liệu từ Rosenfield, R,L. (2007). Identifying children at risk of polycystic ovary syndrome. J Clin Endocrinol Metab, 92, 787–791; Rosenfield, R.L., Bordini, B., Yu, C. (2013). Comparison of detection of normal puberty in girls by a hormonal sleep test and a gonadotropin-releasing hormone agonist test. J Clin Endocrinol Metab, 98, 1591–1601; Mortensen, M., Ehrmann, D.A., Littlejohn, E., Rosenfield, R.L. (2009). Asymptomatic volunteers with a polycystic ovary are a functionally distinct but heterogeneous population. J Clin Endocrinol Metab, 94, 1579–1586; Forest, M. (1979). Function of the ovary in the neonate and infant. Eur J Obstet Gynecol Reprod Biol, 9, 145–160; de Peretti, E., Forest, M.G. (1982). Pitfalls in the etiological diagnosis of congenital adrenal hyperplasia in the early neonatal period. Horm Res, 16, 10–22; Bidlingmaier, F., Knorr, D. (1978). Oestrogens: physiologic and clinical aspects. Pediatr Adolesc Endocrinol, 4, 41–84; Chellakooty, M., Schmidt, I.M., Haavisto, A.M., Boisen, K.A., Damgaard, I.N., Mau, C., et al. (2003). Inhibin A, inhibin B, follicle-stimulating hormone, luteinizing hormone, estradiol, and sex hormone-binding globulin levels in 473 healthy infant girls. J Clin Endocrinol Metab, 88, 3516–3520; Greaves, R.F., Pitkin, J., Ho, C.S., Baglin, J., Hunt, R.W., Zacharin, M.R. (2015). Hormone modeling in preterm neonates: establishment of pituitary and steroid hormone reference intervals. J Clin Endocrinol Metab, 100, 1097–1103; Johannsen, T.H., Main, K.M., Ljubicic, M.L., Jensen, T.K., Andersen, H.R., Andersen, M.S., et al. (2018). Sex differences in reproductive hormones during mini-puberty in infants with normal and disordered sex development. J Clin Endocrinol Metab, 103, 3028–3037; Endocrine Sciences/LabCorp. 2018 Expected Values and S.I. Unit Conversion Tables.)
Các chu kỳ gonadotropin dậy thì dường như phát triển tốt trước khi có kinh và có khả năng gây ra sản xuất estrogen theo chu kỳ. Mô hình làm việc của chúng tôi về bản chất động học của tuyến yên-buồng trứng trong giai đoạn dậy thì sớm được minh họa trong Hình 16.11.
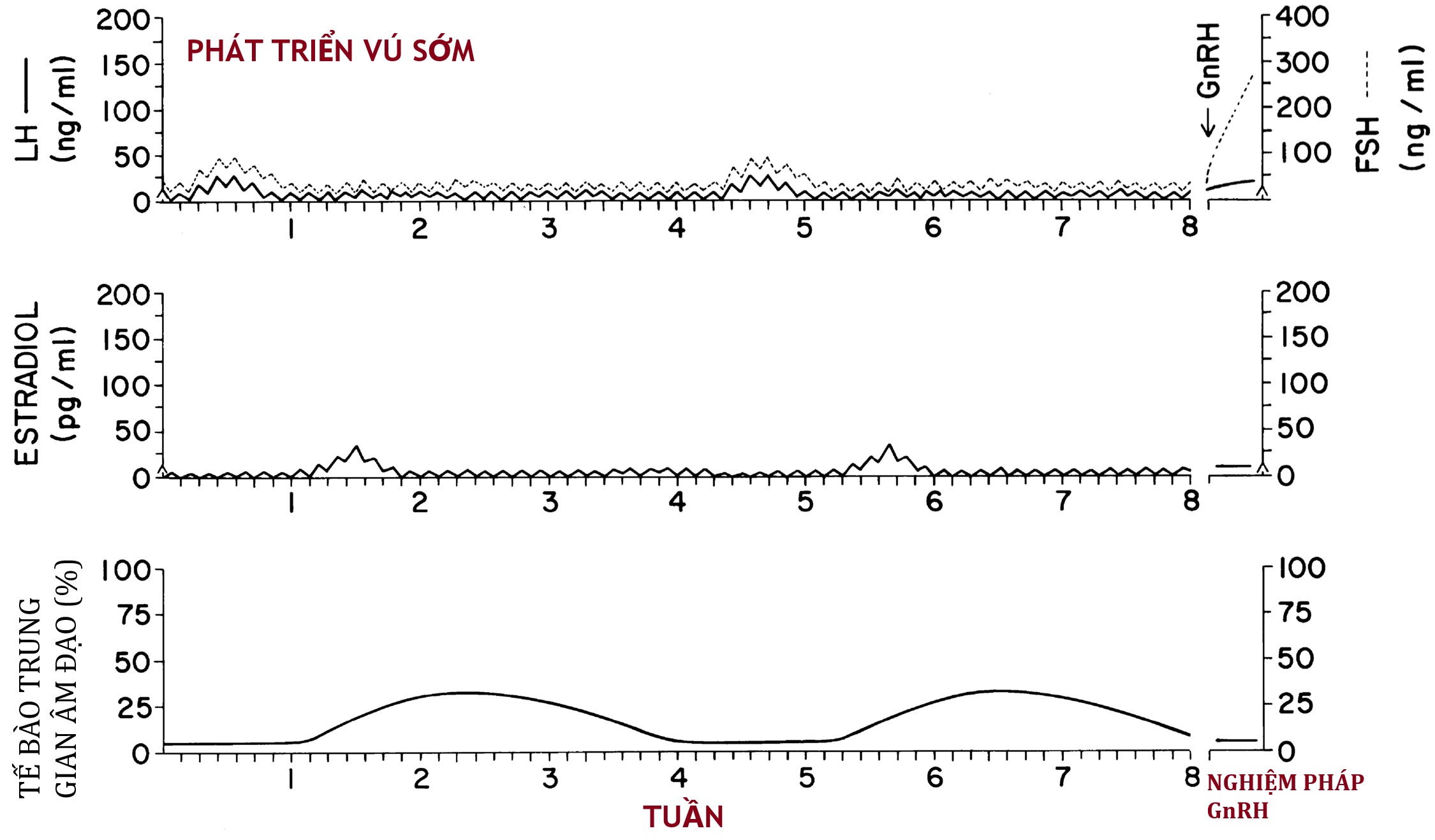
Hình 16.11 Sơ đồ mô tả giả thuyết làm việc của chúng tôi về các mô hình nội tiết ở các bé gái trong giai đoạn dậy thì rất sớm. Chúng tôi hình dung mô hình này xảy ra cả theo chu kỳ trong giai đoạn sớm nhất của dậy thì bình thường và đôi khi trong dậy thì sớm không bền vững (tức là hầu hết các trường hợp phát triển vú sớm vô căn ở Hoa Kỳ). Nồng độ hormone trong huyết thanh ban ngày và ban đêm (gonadotropin so với tiêu chuẩn LER-907) và tỷ lệ tế bào trung gian trên phết tế bào âm đạo được hiển thị. Đáp ứng điển hình với nghiệm pháp hormone giải phóng gonadotropin (GnRH) được minh họa. Các chu kỳ nội tiết cận lâm sàng kéo dài khoảng 1 tháng là kết quả của vài ngày tăng bài tiết hormone kích thích nang trứng (FSH) và hormone tạo hoàng thể (LH). Bởi vì động lực giải phóng gonadotropin tương đối yếu, sản xuất FSH và LH bị ức chế nhanh chóng và trong một thời gian dài bởi một lượng estradiol (E2) khiêm tốn. Estradiol chỉ có thể phát hiện được trong huyết tương trong vài ngày mỗi tháng. Tuy nhiên, sự trưởng thành của niêm mạc âm đạo có thể phát hiện được trong khoảng 2 tuần sau khi sản xuất E2 đã giảm.
Dậy thì tiến triển khi LH tăng. Trong khi nồng độ FSH huyết thanh tăng khoảng 2.5 lần trong suốt quá trình dậy thì, nồng độ LH tăng 25 lần hoặc hơn. Sự thay đổi ban đầu trong bài tiết LH vào đầu tuổi dậy thì là sự gia tăng bài tiết LH hàng đêm bắt đầu trong vòng 20 phút sau khi bắt đầu ngủ. Sau đó, LH tăng nhiều hơn khi bắt đầu ngủ, duy trì ở mức cao lâu hơn và giảm ít hơn trong giờ thức. Khi trẻ đến gần tuổi có kinh, nồng độ LH ban ngày tiếp tục tăng cho đến khi nhịp điệu ngày đêm thường bị mất đi. Nồng độ FSH theo một mô hình tương tự, mặc dù những thay đổi của FSH ít nổi bật hơn. Nhịp điệu ngày đêm của gonadotropin trong tuổi dậy thì dường như hoàn toàn liên quan đến giấc ngủ, không giống như nhịp điệu sinh học của cortisol. Có một độ trễ khoảng 12 giờ giữa mức LH đỉnh trong khi ngủ và đỉnh estradiol, do đó nồng độ estradiol đạt tối đa vào khoảng cuối buổi sáng đến đầu buổi chiều. Nhịp điệu gonadotropin và estradiol ở một bé gái dậy thì sớm được thể hiện trong Hình 16.12.
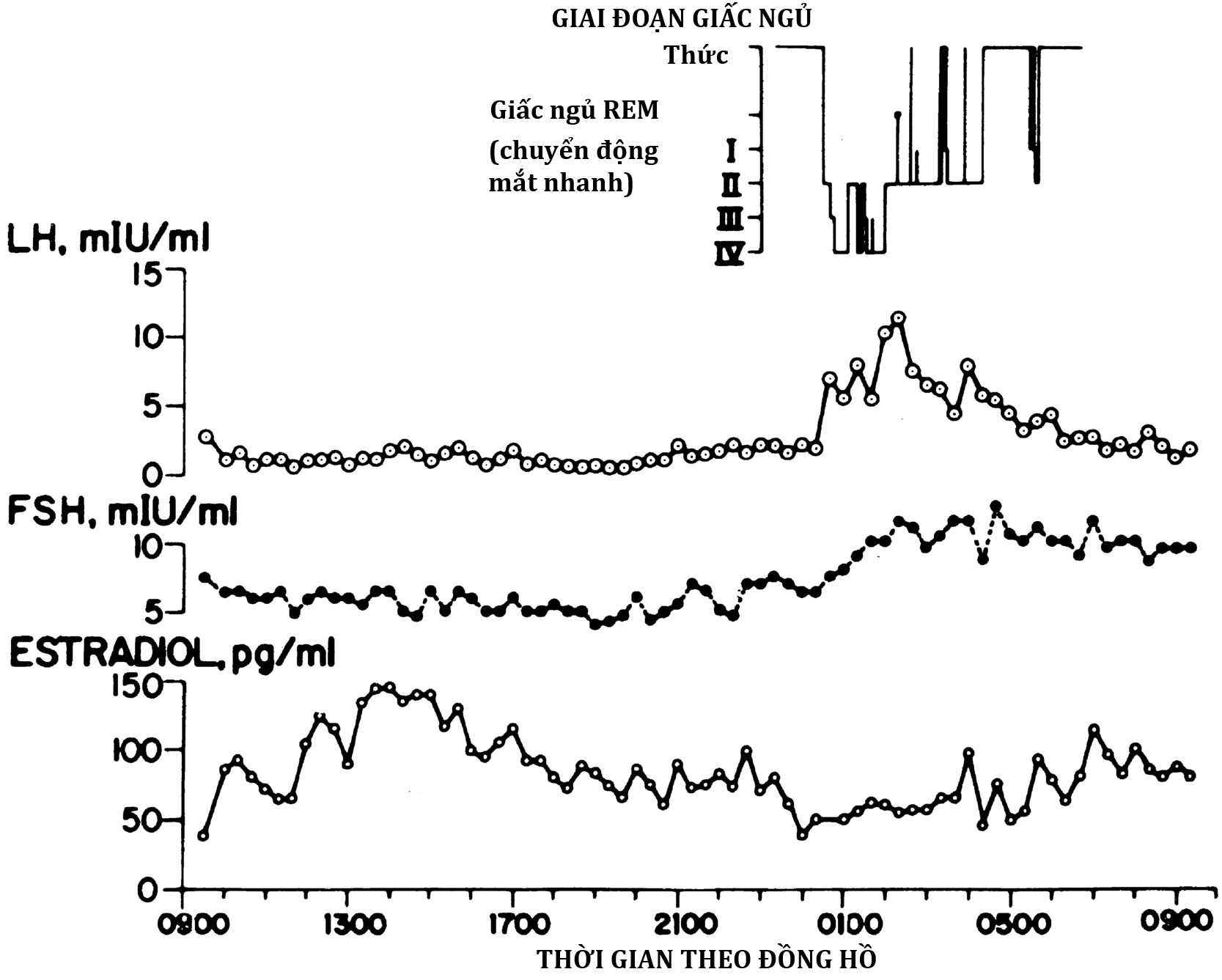
Hình 16.12. Sự tăng cường hoạt tính sinh học của LH huyết thanh xảy ra trong quá trình tiến triển dậy thì. Hoạt tính sinh học của LH huyết tương tăng gần gấp năm lần trong suốt quá trình dậy thì so với LH được đo bằng RIA đa dòng. Sự thay đổi của LH có hoạt tính sinh học được phản ánh tốt bởi các xét nghiệm miễn dịch đo lường dựa trên kháng thể đơn dòng “thế hệ thứ ba” (“nhi khoa”) có độ đặc hiệu rất cao đối với các epitope LH có hoạt tính sinh học. Tuy nhiên, sự khác biệt về tỷ lệ LH có hoạt tính sinh học trên LH có hoạt tính miễn dịch (B/I) vẫn tồn tại với các xét nghiệm này, vì những lý do liên quan đến sự không đồng nhất vi mô phân tử của gonadotropin, sẽ được thảo luận sau. FSH huyết thanh tăng trong tuổi dậy thì theo xét nghiệm miễn dịch nhiều hơn so với xét nghiệm sinh học.
Sản lượng estradiol tăng nhanh trong năm gần đến kỳ kinh nguyệt đầu tiên. Điều này dường như là kết quả của một loạt các hiện tượng tự khuếch đại tạo điều kiện cho dậy thì, sự trưởng thành của nang trứng vượt trội và sự rụng trứng. Những điều này được tóm tắt trong Hộp 16.1. Những hiện tượng này xảy ra ở tất cả các cấp của trục. Hệ thần kinh trung ương được kích thích bởi nồng độ estradiol tiền rụng trứng để tăng biên độ xung GnRH. Ở cấp độ tuyến yên, có hiệu ứng tự mồi của GnRH, theo đó một xung GnRH làm nhạy cảm tuyến yên để có đáp ứng LH lớn hơn với một xung GnRH giống hệt sau đó. Các mô hình quan trọng của bài tiết estradiol và progesterone tăng cường đáp ứng của LH và FSH tuyến yên với GnRH. Ở cấp độ tuyến sinh dục, chuỗi các sự kiện được tăng cường bởi sự cảm ứng hoạt động aromatase và sản xuất progestin của FSH trong các tế bào hạt, những hiện tượng trong đó androgen đóng một vai trò hiệp đồng. Hơn nữa, FSH kích thích sự phân bào của tế bào hạt và cảm ứng các thụ thể LH, những hiện tượng trong đó estradiol có thể đóng một vai trò hiệp đồng. Sau đó, LH có thể tăng cường hơn nữa các tác động của aromatase và progesterone. Bản thân progesterone đóng một vai trò hiệp đồng trong việc kích thích tổng hợp progesterone và prostaglandin của tế bào hạt kết hợp với cả FSH và LH. Ở chuột, các vị trí thụ thể GnRH của buồng trứng cũng giảm ngay trước khi rụng trứng, và vào khoảng thời gian này, buồng trứng thay đổi mô hình chuyển hóa của nó để sự bài tiết androstanediol-3β-monosulfate giảm xuống mức không còn ức chế sự bài tiết LH nữa.
| Hộp 16.1. Các quá trình tự khuếch đại liên quan đến tiến triển dậy thì, trưởng thành nang trứng và rụng trứng
Bài tiết KISS1 và GnRH của hệ thần kinh trung ương tăng thông qua:
Đáp ứng của LH và FSH tuyến yên với GnRH tăng thông qua:
Đáp ứng của tuyến sinh dục với FSH và LH tăng thông qua:
E2, Estradiol; FSH, hormone kích thích nang trứng; GnRH, hormone giải phóng gonadotropin; IGF-1, yếu tố tăng trưởng giống insulin-1; KISS1, kisspeptin; LH, hormone tạo hoàng thể. |
Sự tăng vọt gonadotropin tiền rụng trứng xảy ra khi tất cả các quá trình xếp tầng này lên đến đỉnh điểm trong việc kích hoạt cơ chế điều hòa ngược dương tính, một đặc điểm độc đáo của hệ thống thần kinh-nội tiết nữ. Điều hòa ngược dương tính đề cập đến việc hệ thống thần kinh-nội tiết có được khả năng tiết ra một đợt tăng LH giữa chu kỳ để đáp ứng với sự gia tăng bài tiết estrogen của một nang trứng tiền rụng trứng, tức là, khi buồng trứng báo hiệu thông qua việc tăng bài tiết estrogen rằng nó đã sẵn sàng cho sự rụng trứng.
Kinh nguyệt không nhất thiết cho thấy sự trưởng thành hoàn toàn của trục thần kinh-nội tiết-buồng trứng. Như các nghiên cứu của Knobil minh họa (xem Hình 16.10), kinh nguyệt có thể do chảy máu do ngưng estrogen—và khoảng một nửa số trường hợp là như vậy—nhưng các chu kỳ rụng trứng có thể theo sau ngay sau đó. Các đặc điểm chung của buồng trứng trưởng thành được thể hiện trong Hình 16.4.
Hình thái của buồng trứng vị thành niên bình thường từ lâu đã được coi là đa nang, và kiểm tra mô học thường cho thấy sự hoàng thể hóa lớp vỏ. Trong giai đoạn quanh tuổi có kinh, sự kết hợp của số lượng nang trứng cao và sự kích thích gonadotropin trưởng thành dẫn đến số lượng nang trứng có hốc từ 2 đến 9 mm nhiều hơn trong vòng một năm sau khi có kinh so với bất kỳ giai đoạn nào khác (xem Hình 16.3). Điều này thường dẫn đến hình ảnh siêu âm “đa nang” mà chồng lấn với tiêu chuẩn hình thái buồng trứng đa nang ở người lớn trong một phần ba đến một nửa số thanh thiếu niên bình thường (xem phần hội chứng buồng trứng đa nang).
Người trưởng thành
Giai đoạn nang trứng của mỗi chu kỳ kinh nguyệt tái hiện lại tuổi dậy thì ở nhiều khía cạnh. Nồng độ gonadotropin và hormone sinh dục thấp trong giai đoạn tiền kinh nguyệt của chu kỳ trưởng thành (Hình 16.13 A). Nồng độ gonadotropin sau đó tăng vào thời điểm có kinh, FSH chiếm ưu thế trong giai đoạn nang trứng sớm, trong khi nhịp xung LH về đêm chậm (Hình 16.13 B). Nhịp xung LH tăng lên theo mô hình circhoral (khoảng 1 giờ) quanh một đường nền ổn định, và sản xuất estradiol bắt đầu từ từ khi các nang trứng có hốc phát triển (Hình 16.13 C). Nồng độ estradiol tăng dần và nồng độ FSH huyết thanh giảm tương ứng (Hình 16.13 D). Khi hình thành một nang trứng vượt trội, nồng độ estradiol huyết thanh tăng theo cấp số nhân. Điều này bắt đầu khuếch đại một cách chọn lọc đáp ứng LH của tuyến yên với GnRH khi estradiol đạt khoảng 90 pg/mL trong hơn 3 ngày (Hình 16.13 E).
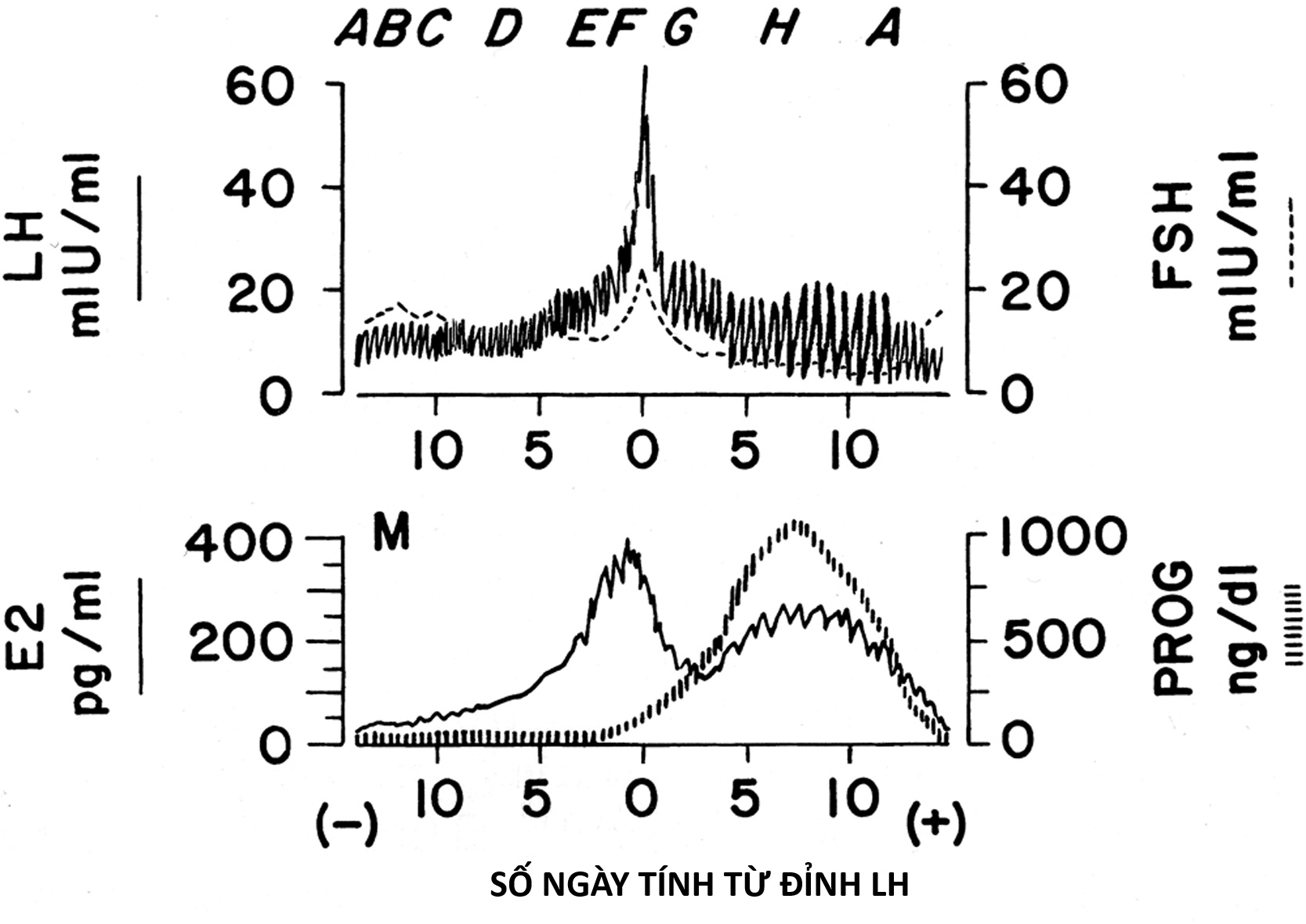
Hình 16.13 Sơ đồ nồng độ gonadotropin và hormone nữ trong chu kỳ kinh nguyệt bình thường. Các mức được đặt trung tâm tham chiếu đến ngày đỉnh hormone tạo hoàng thể (LH) giữa chu kỳ (ngày 0). Các chữ cái từ A đến F phía trên bảng trên cùng tương ứng với các giai đoạn phát triển nang trứng trong Hình 16.14. G và H được thảo luận trong văn bản. M (bảng dưới cùng) cho thấy thời gian có kinh. E2, Estradiol; FSH, hormone kích thích nang trứng; PROG, progesterone. (Dữ liệu từ Abraham, G.E. (1974). Ovarian and adrenal contributions to peripheral androgens during the menstrual cycle. J Clin Endocrinol Metab, 39, 340; Ross, G.T., Cargille, C.M., Lipsett, M.B., Rayford, P.L., Marshall, J.R., Strott, C.A., Rodbard, D. (1970). Pituitary and gonadal hormones in women during spontaneous and induced ovulatory cycles. Recent Prog Horm Res, 26, 1; và Soules, M., Steiner, R., Clifton, D., Cohen, N., Aksel, S., Bremner, W. (1984). Progesterone modulation of pulsatile luteinizing hormone secretion in normal women. J Clin Endocrinol Metab, 58, 378.)
Khi estradiol huyết thanh tăng lên trên 200 đến 300 pg/mL trong 36 giờ, cơ chế điều hòa ngược dương tính được kích hoạt và đợt tăng gonadotropin giữa chu kỳ bắt đầu (Hình 16.13 F). Estradiol sau đó dường như gây ra biểu hiện PR ở vùng dưới đồi và tuyến yên. Sự gia tăng progesterone lên 100 ng/dL tạo điều kiện cho đợt tăng LH, rút ngắn thời gian mà estradiol cần thiết cho đợt tăng xuống còn 24 giờ, và gây ra một đợt tăng FSH. Cơ chế hoạt động của progesterone bao gồm việc ức chế sự phân cắt GnRH. Androgen cũng có thể đóng một vai trò trong việc tạo điều kiện giải phóng FSH và GnRH. Đợt tăng LH sau đó chủ yếu chịu trách nhiệm cho việc hoàng thể hóa nang trứng tiền rụng trứng (xem Hình 16.13 F). Tại thời điểm này, các xung LH trở nên lớn hơn về biên độ nhưng chậm hơn về tần số và hoạt tính sinh học biểu kiến của chúng tăng lên. Sau đó rụng trứng xảy ra.
Khi nang trứng bị vỡ do rụng trứng, nồng độ estrogen giảm (Hình 16.13 G). Trong khi đó, progesterone huyết thanh tăng đều đặn khi hoàng thể bắt đầu hình thành, và được duy trì ở mức rất cao trong vài ngày, cùng với sự gia tăng ít hơn của 17-hydroxyprogesterone (17-OHP) và sự trở lại của estradiol về mức cuối giai đoạn nang trứng (Hình 16.13 H). Để đáp ứng với nồng độ progesterone cao, các xung LH trở nên chậm và lớn. Trong trường hợp không có sự gia tăng gonadotropin màng đệm người (hCG) từ hợp tử, tuổi thọ của hoàng thể sẽ kết thúc và sản xuất progesterone và estradiol của nó suy yếu. Sau đó, FSH bắt đầu tăng không tương xứng với LH. Ngay sau khi các steroid sinh dục rút lui, nội mạc tử cung bong ra, gây ra dòng chảy kinh nguyệt. Trong khi đó, sự tăng trưởng nang trứng được gây ra trước đó bởi FSH bắt đầu tăng tốc và chu kỳ tiếp theo bắt đầu.
Buồng trứng Giai đoạn Nang trứng (Tăng sinh)
Các chức năng nội tiết của nang trứng có hai mục đích phải được phối hợp chặt chẽ: thay đổi môi trường của noãn bào để chuẩn bị cho sự rụng trứng và báo hiệu cho tuyến yên gửi tín hiệu rụng trứng, tức là đợt tăng LH. Do đó, buồng trứng là bộ tạo nhịp (zeitgeber) cho chu kỳ; mô hình bài tiết hormone buồng trứng theo chu kỳ bình thường gây ra đợt tăng gonadotropin của tuyến yên giữa chu kỳ, ngay cả khi có các xung GnRH circhoral không đổi. Hormone buồng trứng cũng làm tăng biên độ đáp ứng GnRH, đây là một cơ chế “an toàn” “đảm bảo” một đợt tăng gonadotropin tiền rụng trứng.
Sự phát triển của nang trứng buồng trứng và sự bài tiết steroid trong mối quan hệ với sự thay đổi nồng độ gonadotropin được minh họa trong Hình 16.14. FSH và LH đóng vai trò chính trong sự biệt hóa của tế bào hạt và tế bào vỏ, tương ứng, trong khi một loạt các yếu tố tại chỗ điều chỉnh hoạt động của gonadotropin. Ví dụ, sự trưởng thành của nang trứng để đáp ứng với gonadotropin được tăng cường bởi các yếu tố tăng trưởng giống insulin (IGF), TGF-β và yếu tố tăng trưởng nguyên bào sợi, trong khi nó bị ức chế bởi TGF-α.
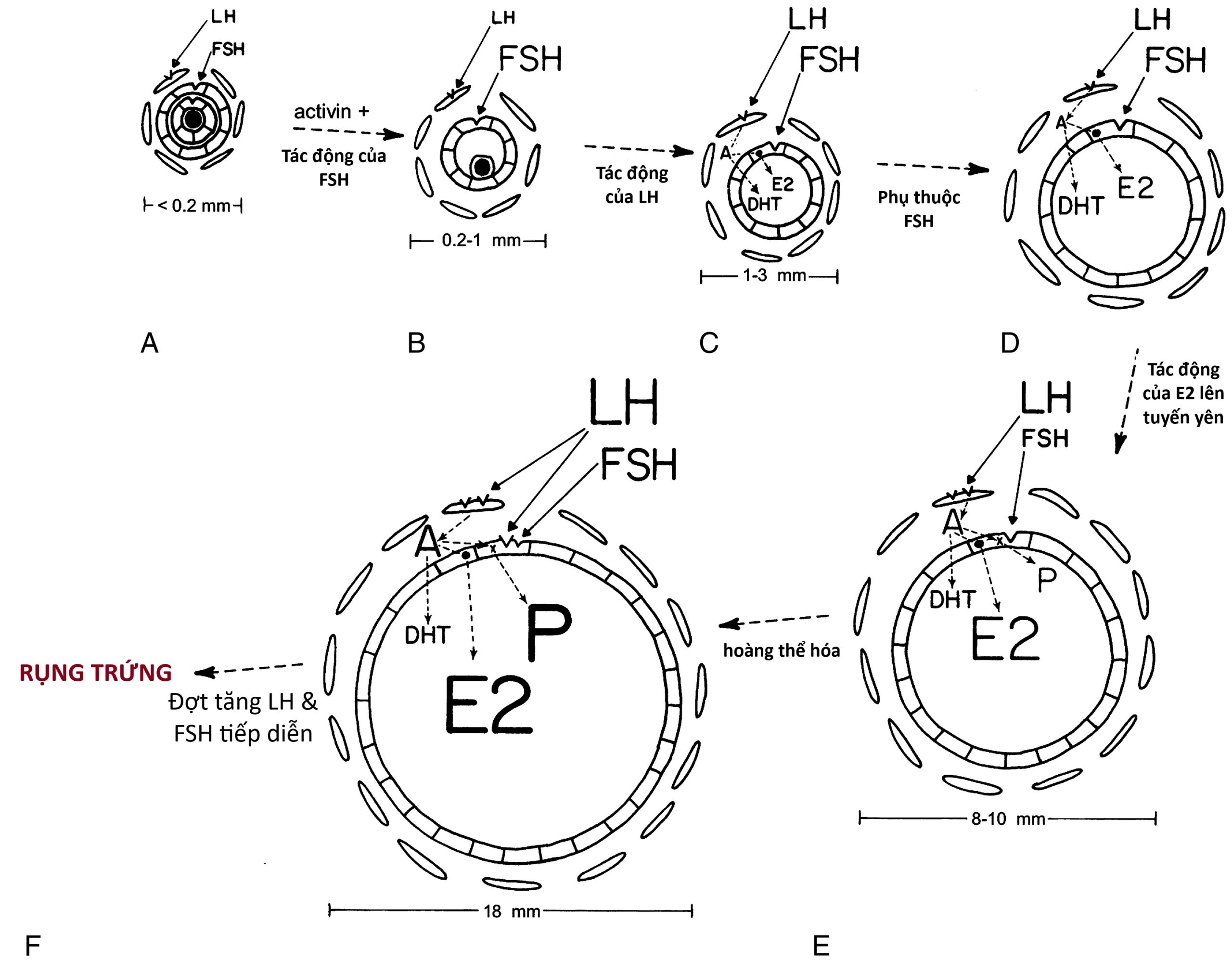
Hình 16.14 Mối quan hệ giữa gonadotropin, nang trứng buồng trứng và steroid buồng trứng theo mô hình hai tế bào-hai gonadotropin của quá trình sinh tổng hợp steroid buồng trứng. A đến F: Các giai đoạn phát triển nang trứng buồng trứng được tìm thấy trong các thời điểm của chu kỳ kinh nguyệt được chỉ định bởi các chữ cái tương ứng trên Hình 16.13. Kích thước của các chữ cái chỉ định hormone liên quan đến độ lớn của nồng độ trong huyết thanh và/hoặc nang trứng của chúng. (A) Nang trứng tiền hốc với các thụ thể hormone tạo hoàng thể (LH) và hormone kích thích nang trứng (FSH) trong tế bào vỏ và tế bào hạt, tương ứng. Không có hốc bao quanh noãn bào (vùng chấm ở trung tâm). (B) Nang trứng có hốc nhỏ. Activin điều hòa tăng các thụ thể FSH, và sự kích hoạt thụ thể FSH là cần thiết để bắt đầu hình thành hốc. (C) Nang trứng có hốc lớn hơn (≥ 1 mm). Hoạt động của aromatase (.) đã được gây ra trong các tế bào hạt. Tương tác giữa tế bào vỏ và tế bào hạt, trong đó tế bào vỏ sản xuất androgen (androstenedione [A], dẫn đến tăng tổng hợp estradiol [E2] và dihydrotestosterone [DHT]. (D) Sự nhân lên của tế bào hạt phụ thuộc FSH (không được hiển thị) chịu trách nhiệm cho sự tăng trưởng nang trứng nhiều hơn và tổng hợp E2 nhiều hơn. (E) Estradiol tăng cường bài tiết LH của tuyến yên để đáp ứng với GnRH, đồng thời ức chế bài tiết FSH của tuyến yên. LH tăng gây ra nhiều thụ thể LH ở vỏ và kích thích sản xuất androgen. Androgen đóng vai trò là cơ chất cho sự hình thành E2 và hiệp đồng với FSH để kích thích bài tiết progesterone (P). (F) Trong nang trứng tiền rụng trứng, FSH gây ra các thụ thể LH trên tế bào hạt, hoàn thành quá trình hoàng thể hóa. Sự bài tiết steroid được tăng cường hơn nữa. Sau đó, progesterone tăng khuếch đại hiệu ứng điều hòa ngược dương tính của E2 để bắt đầu đợt tăng gonadotropin tiền rụng trứng.
Sự tăng trưởng và phát triển của nang trứng nguyên thủy không phụ thuộc vào gonadotropin. Sau đó, các tế bào hạt của nang trứng tiền hốc phát triển các thụ thể FSH, và các tế bào vỏ, bao quanh các tế bào hạt, phát triển các thụ thể LH (xem Hình 16.14 A). Activin gây ra sự điều hòa tăng các thụ thể FSH không phụ thuộc FSH trong các nang trứng tiền hốc, mặc dù nó chống lại sự kích thích của FSH đối với sự phát triển của nang trứng có hốc. Sự tăng trưởng của nang trứng nguyên thủy bị kìm hãm một cách cấu thành bởi yếu tố phiên mã forkhead hạt nhân Foxo3; khi Foxo3 được giải phóng để đáp ứng với sự kích thích của con đường PTEN-PI3K-Akt, sự tăng trưởng nang trứng tiến triển đến điểm mà nang trứng trở nên đáp ứng với FSH.
Sự hình thành hốc đòi hỏi một lượng nhỏ (tiền dậy thì) kích hoạt thụ thể FSH (xem Hình 16.14 B). FSH kích thích biểu hiện thụ thể androgen trong các nang trứng sơ cấp, và androgen lần lượt kích thích biểu hiện thêm các thụ thể FSH và các giai đoạn đầu của sự tăng trưởng nang trứng. Hoạt động của androgen cũng cần thiết cho sự phát triển của một số lượng nang trứng đầy đủ, và androgen dư thừa kích thích số lượng nang trứng quá mức. LH kích thích sự xuất hiện trong các tế bào vỏ của các enzyme cần thiết cho quá trình sinh tổng hợp androgen. Bằng chứng cho thấy các tế bào vỏ của các nang trứng có hốc nhỏ hình thành estradiol là rất ít.
Khi các nang trứng có hốc phát triển với đường kính trên 2.5 mm, các tế bào hạt của chúng bắt đầu hình thành estradiol từ androgen do các tế bào vỏ cung cấp (xem Hình 16.14 C). Sản xuất androgen ở mức độ thấp có thể hiệp đồng với FSH để kích thích hoạt động của aromatase trong các tế bào hạt.
Ở giai đoạn này, các nang trứng ngày càng phụ thuộc vào FSH và do đó đáp ứng đồng đều với FSH. IGF-1 là cần thiết cho sự tăng trưởng nang trứng vượt quá giai đoạn có hốc sớm để đáp ứng với FSH. Các nang trứng có hốc không phát triển quá 5 mm đường kính mà không có sự kích thích FSH ở mức độ dậy thì. Vào giữa giai đoạn nang trứng, sự tăng sinh của các tế bào hạt đáp ứng với FSH dẫn đến tốc độ sản xuất estradiol tăng nhanh và sự chuyển đổi ưu tiên của androstenedione thành estradiol thay vì dihydrotestosterone (DHT) bởi các tế bào này (xem Hình 16.14 D). Bản thân estradiol rõ ràng kích thích sự tăng sinh của các tế bào hạt và sự tồn tại của noãn bào ở loài gặm nhấm. Ở người, estradiol dường như thúc đẩy sự tăng trưởng có hốc độc lập với LH và hiệp đồng với FSH trong việc phát triển nang trứng vượt trội.
Một nang trứng vượt trội được chọn vào đầu chu kỳ kinh nguyệt từ một nhóm nang trứng được tuyển chọn 2.5 tháng trước đó. Việc tuyển chọn một nhóm nang trứng thường được thúc đẩy bởi đợt tăng FSH giữa chu kỳ và thoái triển khi sự bài tiết progesterone của hoàng thể tăng lên. Một làn sóng tăng trưởng nang trứng khác vào cuối giai đoạn hoàng thể được thúc đẩy bởi sự gia tăng FSH khi sự bài tiết progesterone và estradiol của hoàng thể suy yếu. Nang trứng được chọn là nang trứng nhạy cảm nhất với FSH (ngưỡng “FSH” thấp nhất). FSH cực kỳ quan trọng trong giai đoạn nang trứng để phát triển tối ưu nang trứng vượt trội này. Vào giữa giai đoạn nang trứng của chu kỳ, nang trứng này trở thành nguồn estradiol duy nhất (xem Hình 16.14 E). Thông thường, chỉ có một nang trứng như vậy. Chỉ có nang trứng này tiếp tục phát triển để đạt đường kính từ 10 mm trở lên. Tất cả các nang trứng phụ thuộc gonadotropin khác đều bị thoái hóa.
Ở giai đoạn này, nồng độ estradiol tăng đang ức chế bài tiết FSH và tăng cường đáp ứng LH của tuyến yên với GnRH. FSH có hoạt tính sinh học cao hơn trong nang trứng vượt trội vì nó được cô đặc hiệu quả hơn và vì các yếu tố tại chỗ làm tăng đáp ứng của buồng trứng với FSH. LH tăng gây ra sự tăng sinh thêm của các tế bào vỏ và sự gia tăng hàm lượng thụ thể LH của chúng. Sản xuất androgen do đó được tăng lên. Điều này hiệp đồng với FSH để vừa tăng cường hoạt động của aromatase vừa gây ra sự gia tăng bài tiết progesterone bởi các tế bào hạt được estrogen hóa tốt của các nang trứng này. Progesterone sau đó tăng cường sự tổng hợp của chính nó và estradiol. Sự gia tăng sản xuất androstenedione của vỏ được chuyển hướng nhiều hơn đến sinh tổng hợp estradiol hơn là DHT. Nồng độ steroid trong dịch nang trứng phản ánh những thay đổi này (xem Hình 16.15). Activin hoạt động để ngăn chặn sự hoàng thể hóa sớm của các tế bào hạt, và trương lực activin dường như suy yếu khi giai đoạn tiền rụng trứng đến gần.
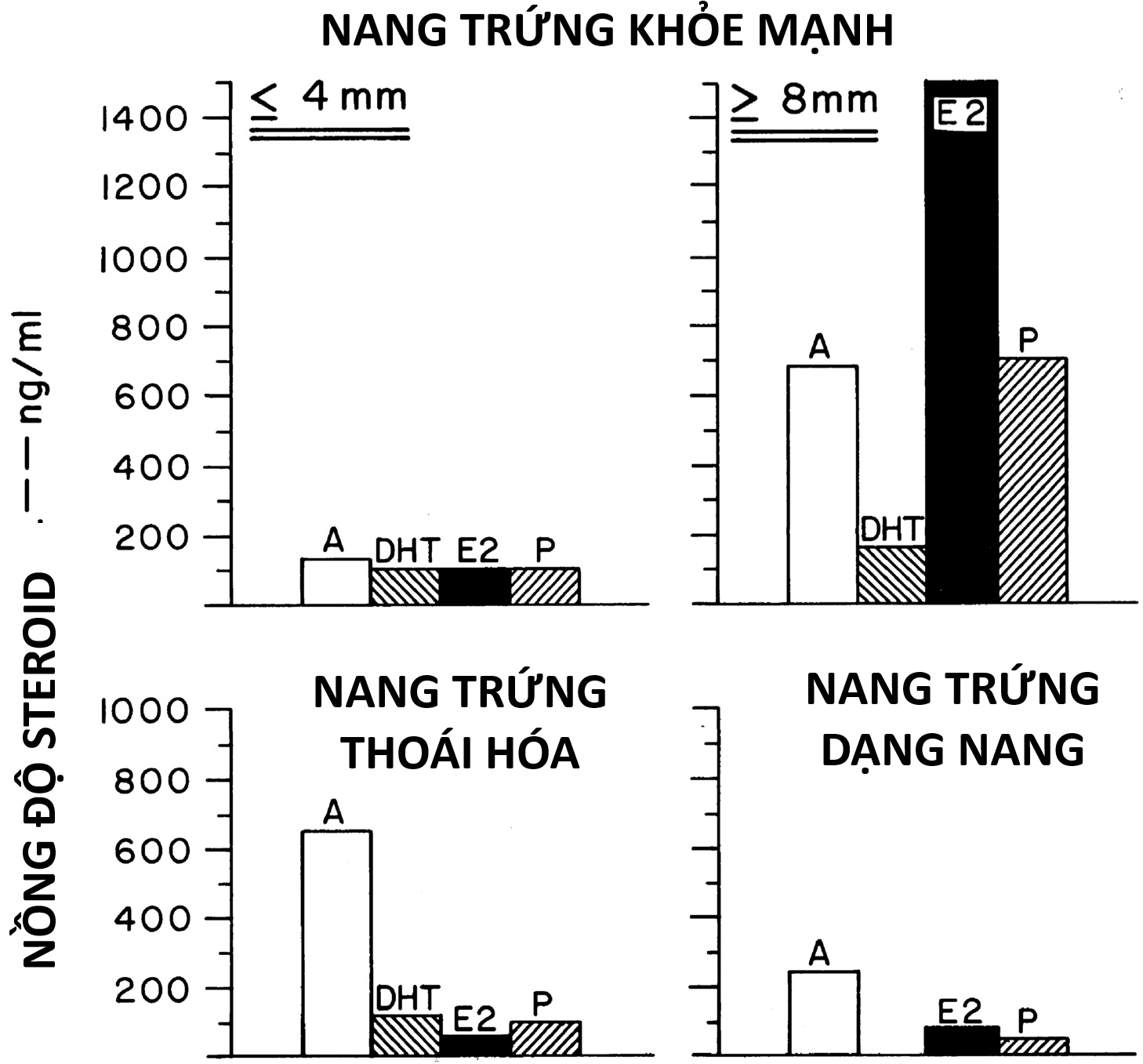
Hình 16.15. Nồng độ steroid trong dịch nang trứng có hốc bình thường của người. Các nang trứng khỏe mạnh có nhiều tế bào hạt (≥ 50% số lượng tối đa). Các nang trứng khỏe mạnh dường như có khả năng phát triển thêm vì nhiều trong số chúng (75%) chứa các noãn bào có vẻ khỏe mạnh (các túi mầm còn nguyên vẹn về mặt mô học), 96% trong số đó có thể sống được trong môi trường nuôi cấy. Các nang trứng khá lớn (đường kính 8 mm trở lên) chỉ xuất hiện vào giữa giai đoạn nang trứng của chu kỳ và chứa hormone kích thích nang trứng. Dữ liệu chỉ được hiển thị cho những nang trứng lớn có nhiều tế bào hạt, trong đó thường chỉ có một nang trứng phát sinh trong giai đoạn nang trứng của mỗi chu kỳ kinh nguyệt. Nang trứng thoái hóa là những nang trứng nhỏ bắt đầu có những thay đổi thoái hóa về số lượng tế bào hạt và hình dạng của noãn bào. Nang trứng dạng nang có xu hướng là những nang trứng lớn hơn chỉ có một lớp lót tế bào hạt thưa thớt. Hàm lượng testosterone trong dịch nang trứng bằng khoảng một phần ba so với dihydrotestosterone (DHT) do mô hình chuyển hóa androstenedione (A) của tế bào hạt. E2, Estradiol; P, progesterone.(Dữ liệu từ McNatty, K.P., Makris, A., Reinhold, V.N., De Grazia, C., Osathanondh, R., Ryan, K.J. (1979). Metabolism of androstenedione by human ovarian tissues in vitro with particular reference to reductase and aromatase activity. Steroids, 34, 429–443.)
FSH tiếp theo gây ra các thụ thể LH trong các tế bào hạt, hoàng thể hóa chúng (xem Hình 16.14 F). Androgen và insulin hiệp đồng với FSH trong việc gây ra các thụ thể LH này. LH sau đó tham gia cùng FSH tác động lên các tế bào hạt đã được hoàng thể hóa để tăng cường sản xuất estradiol và progestin.
Đợt tăng LH và FSH sau đó xảy ra để đáp ứng với hoạt động điều hòa ngược dương tính của estradiol ở cả cấp độ hệ thần kinh trung ương và tuyến yên, một hiệu ứng được khuếch đại bởi nồng độ progesterone tăng. Các bước cuối cùng trong quá trình trưởng thành của nang trứng diễn ra nhanh chóng: đợt tăng LH gây ra thụ thể PR và prostaglandin synthase ở tế bào hạt trong khi ức chế phiên mã gen cyclin, và đợt tăng FSH điều hòa tăng yếu tố tăng trưởng nội mô mạch máu. Trong trường hợp không có các bước quan trọng này, sự rụng trứng và vỡ nang trứng không xảy ra. Sau đó, nang trứng nhanh chóng trở nên mất nhạy cảm với LH và FSH và ngừng phát triển. Tiếp theo là một phản ứng kiểu viêm. Hoạt động của protease, sản xuất prostaglandin và tính thấm của mạch máu tăng lên; các mối nối tế bào lỏng lẻo; và các tế bào gò noãn tạo thành một lớp vỏ mucopolysaccharide xung quanh noãn bào (sự giãn nở của gò noãn).
Sự trưởng thành giảm phân của noãn bào tiếp tục để đáp ứng với một phosphodiesterase cụ thể, tạo thành giao tử đơn bội (noãn bào bậc hai) và thể cực thứ nhất để đáp ứng với đợt tăng LH. Sau đó, sự rụng trứng của phức hợp gò noãn-noãn bào xảy ra. Sự hiện diện của một môi trường steroid nang trứng thuận lợi là cần thiết cho cả sự rụng trứng (một đợt tăng LH sớm ở một đối tượng có nang trứng chưa chín sẽ không dẫn đến rụng trứng) và khả năng phát triển sau đó của noãn bào. Giảm phân sẽ hoàn thành và thể cực thứ hai sẽ được đẩy ra chỉ khi có sự tiếp xúc với tinh trùng.
Các quá trình kích thích sự nổi lên của nang trứng vượt trội được cân bằng một cách tinh vi bởi các quá trình ngăn cản nó. Dường như nồng độ androgen trong buồng trứng không trở nên quá mức là rất quan trọng. Androgen dư thừa cản trở khả năng sống của nang trứng vượt quá giai đoạn khoảng 8 mm và hiệp đồng với FSH gây ra sự hoàng thể hóa sớm. Điều này cản trở sự nổi lên của các nang trứng vượt trội. Các nang trứng bị bắt giữ trong sự tăng trưởng của chúng sẽ bị thoái hóa, và các nang trứng thoái hóa chứa nồng độ androgen tương đối cao (xem Hình 16.15). Progesterone cũng ức chế sự biệt hóa thêm của các nang trứng không vượt trội bằng một số cơ chế tương tự. Nồng độ estrogen cao đóng một vai trò quan trọng trong việc ức chế sự lựa chọn các nang trứng vượt trội ở loài linh trưởng. Nếu có sự can thiệp vào quá trình estrogen hóa, nhiều nang trứng dạng nang lớn phát triển bị suy giảm khả năng rụng trứng và trải qua quá trình thoái hóa phụ thuộc androgen.
Hormone kháng Müllerian (AMH) và inhibin đã nổi lên như những yếu tố tế bào hạt khác quan trọng trong việc điều hòa sự phát triển của nang trứng. AMH là chất ức chế paracrine chính của sự tiến triển nang trứng nguyên thủy. Nó được sản xuất bởi các tế bào hạt của các nang trứng nhỏ đang phát triển. Khi nang trứng phát triển, nồng độ AMH trong nang trứng tăng đủ để ức chế việc tuyển chọn các nang trứng nguyên thủy sang giai đoạn nang trứng sơ cấp; nó cũng ức chế hoạt động của P450c17, giải phóng GnRH, và sự kích thích của FSH đối với hoạt động của aromatase. Bởi vì estradiol ức chế sản xuất AMH, có một vòng điều hòa ngược âm tính ngắn trong nang trứng giới hạn biểu hiện AMH ở các nang trứng có đường kính lên đến khoảng 8 mm. Do đó, AMH dường như hoạt động như một người gác cổng nang trứng, đảm bảo rằng mỗi nang trứng có hốc nhỏ sản xuất ít estradiol trước khi lựa chọn nang trứng vượt trội, điều này cho phép một cuộc đối thoại trực tiếp giữa buồng trứng và tuyến yên điều chỉnh sự phát triển của nang trứng được chọn để rụng trứng.
Inhibin-B là dạng inhibin chiếm ưu thế. Nó phát sinh từ các tế bào hạt trong các nang trứng nhỏ trước khi aromatase được biểu hiện và được điều chỉnh bởi FSH trong một vòng điều hòa ngược âm tính chậm chạp. Nó điều hòa tăng sinh tổng hợp steroid của vỏ, như sẽ được thảo luận sau. Inhibin-A là một sản phẩm của nang trứng tiền rụng trứng (và hoàng thể) đáp ứng với cả LH và FSH.
Thoái hóa là số phận của tất cả ngoại trừ vài trăm nang trứng được chọn để rụng trứng trong suốt cuộc đời của một cá nhân. Hầu hết các nang trứng ngoài giai đoạn nguyên thủy đều bị thoái hóa. Thoái hóa xảy ra theo quá trình chết tế bào theo chương trình. Quá trình apoptosis này có nhiều yếu tố quyết định đa dạng, bao gồm các gen gây cảm ứng và kìm hãm chết tế bào. Sự hỗ trợ của FSH ngày càng trở nên cần thiết cho sự tồn tại khi nang trứng trưởng thành, và thông thường chỉ có nang trứng có ngưỡng FSH thấp nhất mới thoát khỏi sự thoái hóa.
Buồng trứng Giai đoạn Hoàng thể (Chế tiết)
Sự vỡ của nang trứng vượt trội khi rụng trứng (xem Hình 16.13 G) được theo sau bởi sự tăng sinh xâm lấn của các mao mạch và nguyên bào sợi từ lớp vỏ phá vỡ màng đáy ngăn cách. Các tế bào hạt và tế bào vỏ đã được hoàng thể hóa sau đó trộn lẫn và hoàn thành quá trình hoàng thể hóa bằng cách hình thành hoàng thể.
Về mặt mô học, hoàng thể hóa là một quá trình tích tụ các giọt lipid bắt đầu khi nang trứng vượt trội hình thành. Dấu hiệu sinh hóa của tế bào hạt được hoàng thể hóa là sự hình thành các thụ thể LH, với khả năng sau đó hình thành progesterone, 17-OHP và estrogen để đáp ứng với LH/hCG.
Trong suốt vòng đời chức năng của nó, hoàng thể thường là nguồn chính của các hormone sinh dục do buồng trứng tiết ra. Chức năng của hoàng thể đạt đến đỉnh điểm khoảng 4 ngày sau khi rụng trứng và bắt đầu suy yếu khoảng 4 ngày trước khi có kinh (xem Hình 16.13 H). Mất nhạy cảm với LH và estradiol báo hiệu sự lão hóa của hoàng thể. Sự thoái triển của hoàng thể—tiêu thể vàng—xảy ra nếu thai kỳ không cung cấp hCG. Tiêu thể vàng có thể được trung gian bởi prostaglandin. Sau đó xảy ra sự biến đổi của hoàng thể thành một vết sẹo vô mạch, thể trắng (corpus albicans).
Sự gia tăng bài tiết cả estradiol và progesterone trong giai đoạn hoàng thể sớm gây ra sự biến đổi chế tiết và tăng sản nội mạc tử cung, điều này cần thiết cho sự làm tổ của trứng đã thụ tinh. Sự sụt giảm sau đó trong bài tiết hormone nữ xuống mức không đủ để duy trì nội mạc tử cung dẫn đến kinh nguyệt (xem Hình 16.13 A). Việc ngừng progesterone đặc biệt chịu trách nhiệm cho sự co thắt của các động mạch xoắn, sự tích tụ prostaglandin tại chỗ, và sau đó là hoại tử do thiếu máu cục bộ của nội mạc tử cung. Dòng chảy kinh nguyệt bình thường sau đó là kết quả của sự bong tróc hoàn toàn của nội mạc tử cung chế tiết.
Việc xác định sự rụng trứng có thể được thực hiện bằng cách chứng minh sự xẹp của nang trứng vượt trội bằng theo dõi siêu âm hoặc bằng cách đánh giá sự chuyển đổi hoàng thể trong tỷ lệ estradiol/progesterone, phát hiện đợt tăng LH, hoặc chứng minh sự gia tăng bình thường của progesterone huyết thanh giữa giai đoạn hoàng thể một cách trực tiếp hoặc gián tiếp bằng sự gia tăng nhiệt độ cơ thể cơ bản. Sự gia tăng đáng kể nhiệt độ cơ thể cơ bản, trung bình 0.55° C, thường xảy ra khi progesterone huyết thanh đạt 400 ng/dL hoặc hơn và tiếp tục miễn là mức đó được duy trì. Mặc dù kết quả của các phương pháp này có tương quan, các đợt tăng LH đôi khi không đủ để kích thích một nang trứng đủ trưởng thành để phát triển thành một hoàng thể hoạt động bình thường, đặc biệt là trong giai đoạn vị thành niên (xem Khiếm khuyết Giai đoạn Hoàng thể). …
Điều hòa Trục Thần kinh-Nội tiết-Buồng trứng
Các yếu tố Kiểm soát Khởi phát Dậy thì
Khởi phát dậy thì nằm dưới sự kiểm soát của một mạng lưới điều hòa phức tạp có khả năng đáp ứng linh hoạt với nhiều tín hiệu nội sinh và môi trường. Các tế bào thần kinh GnRH đóng một vai trò phân cấp quan trọng trong việc tích hợp trực tiếp và gián tiếp các tín hiệu trung ương và ngoại vi này. Sự phát triển sinh sản được kết hợp với các tín hiệu chuyển hóa có thể làm gián đoạn quá trình trưởng thành. Các cơ chế mà các yếu tố thần kinh-nội tiết và di truyền kiểm soát sự phát triển dậy thì vẫn chưa được biết rõ. Các nghiên cứu dịch tễ học chỉ ra rằng dinh dưỡng, sắc tộc và các yếu tố di truyền thường đóng vai trò quan trọng trong quá trình dậy thì. Hóa chất môi trường và bệnh viêm mãn tính có thể làm gián đoạn quá trình này.
Bằng chứng cho thấy có các yếu tố di truyền liên quan đến thời điểm dậy thì đến từ nhiều nghiên cứu. Người ta ước tính rằng từ 50% đến 80% sự biến thiên về thời điểm dậy thì được quyết định bởi di truyền. Một số nghiên cứu liên kết toàn bộ bộ gen (GWAS) lớn về tuổi có kinh đã xem xét thời điểm dậy thì ở nữ giới khỏe mạnh để xác định các gen chịu trách nhiệm. Những nghiên cứu này đã chứng minh rằng có sự không đồng nhất di truyền đáng kể về thời điểm dậy thì trong dân số nói chung, có khả năng liên quan đến hàng trăm biến thể phổ biến. Gen tương đồng Lin-28 B (LIN28B) là locus đầu tiên được liên kết với tuổi có kinh. LIN28B là ortholog ở người của gen Caenorhabditis elegans kiểm soát thời gian phát triển thông qua micro ribonucleic acid (microRNA). Các đột biến ở LIN28B chưa được xác định ở người bị rối loạn dậy thì. Dự án 1000 Genomes đã nghiên cứu dữ liệu kiểu gen ở khoảng 370.000 phụ nữ và xác định được 389 tín hiệu độc lập (P < 5 × 10−8) cho tuổi có kinh, với kích thước ảnh hưởng trên mỗi alen dao động từ 1 tuần đến 5 tháng. Những tín hiệu này chỉ giải thích được khoảng 7.4% phương sai dân số về tuổi có kinh. Các gen liên quan đến tín hiệu GnRH, phát triển tuyến yên, điều hòa nội tiết, sinh tổng hợp acid béo và cân bằng nội môi năng lượng đã được đề cập. Mặc dù các đột biến ở những gen này đã được chứng minh là gây ra sự gián đoạn sinh lý trong quá trình phát triển, vai trò của chúng trong việc khởi phát dậy thì vẫn chưa được biết rõ. Cụ thể, các đa hình đơn nucleotide (SNP) trong gen GnRH và thụ thể GnRH không liên quan đến sự thay đổi về thời điểm dậy thì trong dân số nói chung.
Chìa khóa trong việc khởi phát dậy thì là sự kích hoạt bộ tạo xung GnRH ở vùng dưới đồi. Các sự kiện phân tử kiểm soát bộ tạo xung bao gồm một sự tương tác phức tạp giữa cả các yếu tố ức chế và kích thích. Cơ chế kích hoạt trung ương của dậy thì đầu tiên dường như là hệ quả của việc loại bỏ một cơ chế kìm hãm, với sự gia tăng bài tiết gonadotropin (ban đầu là trong khi ngủ). Sự kìm hãm này trong bộ tạo xung GnRH không phụ thuộc vào sự hiện diện của tuyến sinh dục và mạnh mẽ hơn ở nam giới. Một phương pháp tiếp cận gen mục tiêu ở chuột đã xác nhận rằng ERα (còn được gọi là ESR1) trong các tế bào thần kinh Kiss1 làm trung gian cho sự ức chế phản hồi của cả biểu hiện Kiss1 và bài tiết gonadotropin trong giai đoạn tiền dậy thì.
Tuy nhiên, nồng độ testosterone cao mà thai nhi nam tiếp xúc trong giai đoạn biệt hóa giới tính có thể là nguyên nhân gây ra sự ức chế giải phóng GnRH kéo dài hơn ở nam giới so với nữ giới. Một vai trò của việc giảm độ nhạy phản hồi estrogen của bộ tạo xung dưới đồi gần thời điểm dậy thì cũng đã được chỉ ra.
Bằng chứng gần đây chỉ ra vai trò quan trọng của thụ thể kisspeptin 1 (KISS1R), một thụ thể kết hợp G-protein (trước đây gọi là GPR54), và phối tử của nó, kisspeptin, một neuropeptide kích thích, như một tín hiệu cho việc giải phóng GnRH dậy thì. Biểu hiện của cả hai protein này đã được phát hiện là tăng lên trước khi bắt đầu dậy thì, liên quan đến sự gia tăng hoạt động của bộ tạo xung GnRH ở vùng dưới đồi. Kisspeptin gắn vào thụ thể của nó trên các tế bào thần kinh GnRH sẽ kích thích bài tiết GnRH. Chuột bị loại bỏ gen Kiss1r đã được phát hiện là vô sinh mặc dù có các tế bào thần kinh GnRH bình thường. Leptin và androgen hiệp đồng điều hòa tăng hệ thống này, và estrogen đối kháng nó. Các đột biến ở KISS1R dẫn đến suy sinh dục do giảm gonadotropin. Tuy nhiên, các đột biến ở KISS1R chưa được tìm thấy ở các bé trai bị chậm dậy thì, và các trình tự đa hình cũng không liên quan đến sự chậm phát triển dậy thì. Các nghiên cứu tinh vi ở loài linh trưởng đã chứng minh sự gia tăng kisspeptin trong quá trình phát triển dậy thì với sự gia tăng tương ứng của KISS1R liên quan đến sự gia tăng LH. Mức độ biểu hiện tối đa của kisspeptin và KISS1R ở vùng dưới đồi ở cả nam và nữ xảy ra vào tuổi dậy thì. Ở mỗi giai đoạn Tanner, các bé gái có xu hướng có nồng độ kisspeptin cao hơn các bé trai, có khả năng giải thích cho sự khởi phát dậy thì sớm hơn của họ.
Việc tiêm kisspeptin mãn tính cho chuột cái chưa trưởng thành gây ra sự kích hoạt sớm của trục trung ương. Ngoài ra, điều trị mãn tính bằng kisspeptin phục hồi sự phát triển dậy thì trong một mô hình suy dinh dưỡng ở chuột. Do đó, kisspeptin không chỉ có thể ảnh hưởng đến việc khởi động dậy thì, mà còn cả sự tích hợp tình trạng dinh dưỡng và năng lượng. Mặc dù rõ ràng rằng sự kích hoạt các tế bào thần kinh GnRH bởi kisspeptin xảy ra ở tuổi dậy thì và GnRH ngày càng nhạy cảm với sự kích hoạt của kisspeptin trong quá trình phát triển, các con đường khác cũng góp phần vào sự kích hoạt GnRH vì tình trạng suy sinh dục liên quan đến sự thiếu hụt KISS1 hoặc KISS1R không hoàn toàn.
Tín hiệu Neurokinin B (NKB) dường như rất quan trọng cho việc khởi phát dậy thì. Một số tế bào thần kinh kisspeptin, tế bào thần kinh KNDy, đồng biểu hiện NKB, dynorphin A, và các thụ thể của chúng (TAC3R và KOR), chức năng chính của chúng dường như là đồng bộ hóa nhịp xung của tế bào thần kinh kisspeptin. Các thụ thể cho NKB cũng nằm trên các tế bào thần kinh GnRH, nơi chúng dường như điều chỉnh sự giải phóng hoặc vận chuyển GnRH. Các đột biến mất chức năng ở TAC3 và thụ thể của nó TACR3 ở những bệnh nhân bị thiếu hụt GnRH không kèm mất khứu giác và suy dậy thì đã xác định vai trò của neuropeptide này trong việc kiểm soát bài tiết GnRH. Mặc dù kisspeptin trực tiếp điều chỉnh biểu hiện và bài tiết GnRH, các chất chủ vận NKB không kích thích giải phóng GnRH ở loài gặm nhấm. Dường như rất có khả năng một cơ chế hợp tác bao gồm cả tín hiệu kisspeptin và NKB đến các tế bào thần kinh GnRH là cần thiết cho chức năng sinh sản ở nữ giới. Để điều tra sự tương tác của kisspeptin và NKB ở người, các tác động của việc đồng sử dụng kisspeptin-54, NKB, và một chất đối kháng thụ thể opioid, naltrexone, đối với nhịp xung LH đã được nghiên cứu. Các đối tượng nhận kisspeptin và naltrexone đã tăng LH và nhịp xung LH, trong khi NKB đơn độc không ảnh hưởng đến gonadotropin. NKB và kisspeptin được dùng cùng nhau có sự gia tăng gonadotropin thấp hơn đáng kể so với kisspeptin đơn độc. Những kết quả này cho thấy sự tương tác đáng kể giữa các neuropeptide KNDy đối với việc tạo xung GnRH ở người. Hơn nữa, chuột bị loại bỏ gen Tacr3 bị vô sinh, mặc dù chúng dường như bị suy sinh dục trung ương có thể hồi phục. Điều thú vị là, một đột biến ở TAC3R đã được tìm thấy ở một bệnh nhân bị chậm tăng trưởng và phát triển dậy thì có tính chất cơ địa (CDGP) trong một nghiên cứu trên 50 bệnh nhân, trong khi không có báo cáo nào ở TAC3.
Các đột biến phá vỡ ở protein ngón tay vòng makorin 3 (MKRN3), một gen được in dấu, biểu hiện từ cha, nằm ở locus hội chứng Prader-Willi, có liên quan đến dậy thì sớm trung ương. Điều này cho thấy sự hiện diện của một con đường ức chế giải phóng GnRH tập trung ở nhân cung.
Sự khởi đầu của dậy thì liên quan đến những thay đổi phối hợp trong giao tiếp qua synap và giữa tế bào thần kinh-tế bào đệm. Trung gian cho sự kìm hãm dậy thì là các hệ thống ức chế chính: gamma-aminobutyric acid (GABA)ergic, một số đóng góp của opioidergic, và hormone ức chế gonadotrophin (GnIH), một peptide liên quan đến RFamide (RFRP). Các hệ thống kích thích chính bao gồm tín hiệu glutamate và kisspeptin, với các tế bào đệm tạo điều kiện cho bài tiết GnRH theo nhiều cách khác nhau (Hình 16.16). Dường như tín hiệu thụ thể GABA phát triển trước tín hiệu glutamate. Tín hiệu tăng qua các thụ thể glutamate của một số loại (ionotropic và metabotropic) dường như là sự thay đổi gần nhất trong dẫn truyền thần kinh liên quan đến khởi phát dậy thì. Tuy nhiên, ở tuổi dậy thì, dường như là hệ quả của tín hiệu thụ thể glutamate, tín hiệu thụ thể GABA-A trên các tế bào thần kinh GnRH làm tăng bài tiết GnRH. Các tế bào đệm tạo điều kiện cho quá trình này thông qua việc sản xuất các TGF (đặc biệt là TGF-β1), IGF-1, neuregulin, prostaglandin E2, và việc sản xuất các enzyme kiểm soát nồng độ glutamate (glutamic dehydrogenase, xúc tác cho quá trình tổng hợp glutamate, và glutamine synthase, chuyển đổi glutamate thành glutamine).
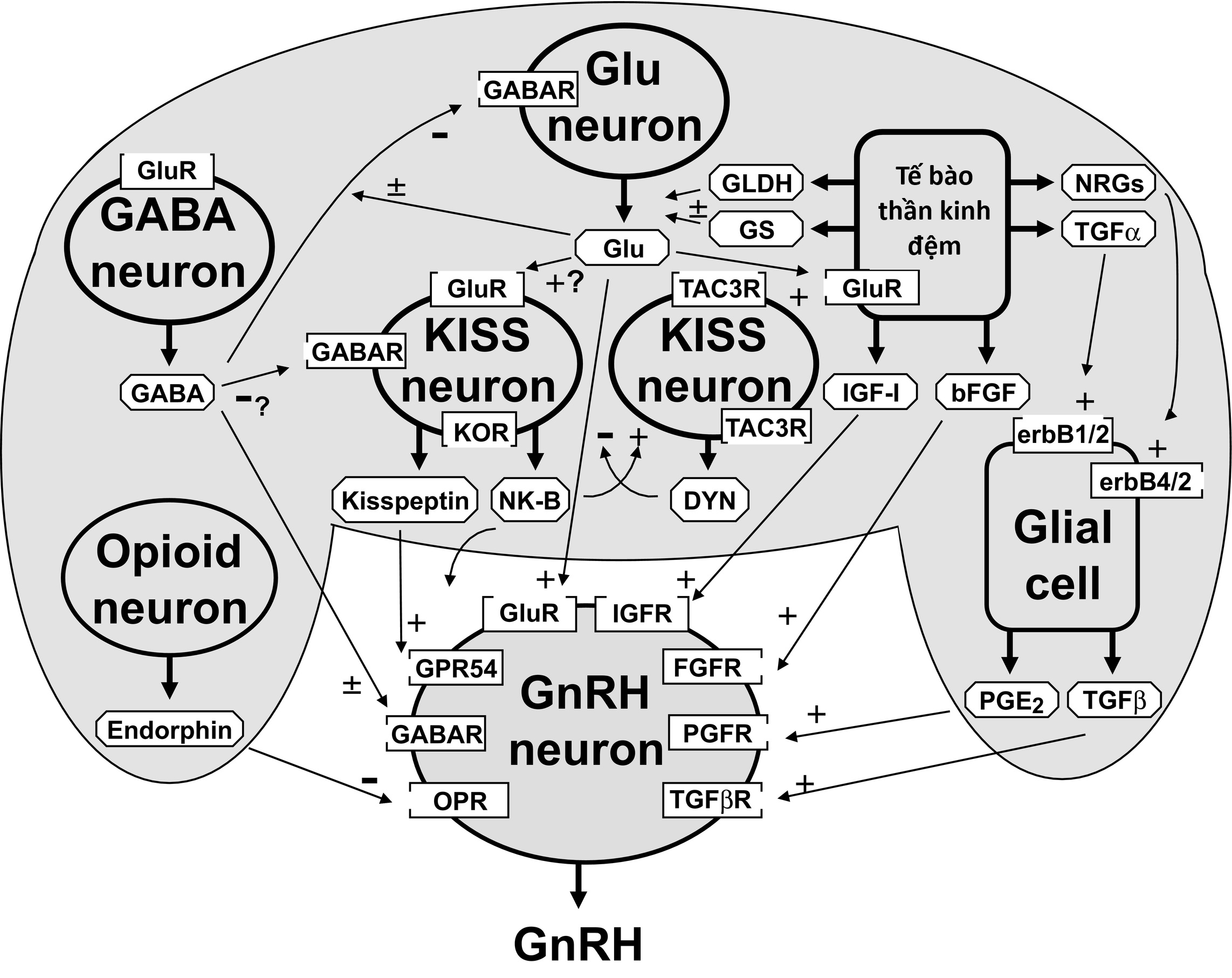
Hình 16.16. Cơ sở sinh học phân tử cho các con đường hypothalamic gần nhất đã biết điều chỉnh sự bài tiết hormone giải phóng gonadotropin (GnRH). Cột bên trái mô tả các con đường ức chế chính, liên quan đến tín hiệu gamma-aminobutyric acid (GABA) thông qua thụ thể GABA và tín hiệu opiodergic thông qua thụ thể endorphin (OPR). Cột trung tâm mô tả các con đường kích thích chính, liên quan đến tín hiệu glutamate (Glu) thông qua họ thụ thể glutamate và tín hiệu kisspeptin (KISS) thông qua GPR54. Cột bên phải cho thấy các yếu tố tế bào đệm chính tạo điều kiện cho việc giải phóng GnRH. Chúng bao gồm việc sản xuất các enzyme glutamic dehydrogenase (GLDH) và glutamine synthase (GS), điều chỉnh nồng độ glutamate và việc sản xuất một loạt các yếu tố tăng trưởng. Hầu hết các tế bào thần kinh kisspeptin đồng biểu hiện neurokinin B (NK-B), dynorphin A (DYN), và các thụ thể của chúng (TAC3R và KOR), chức năng chính của chúng dường như là đồng bộ hóa nhịp xung của tế bào thần kinh kisspeptin; các thụ thể cho NKB cũng nằm trên các tế bào thần kinh GnRH. +, kích thích dương;–, ức chế; ±, một trong hai; ?, chưa biết; bFGF, yếu tố tăng trưởng nguyên bào sợi cơ bản; erbB 1-4, các tiểu đơn vị cho các thụ thể TGF-β và NRG; IGF-1, yếu tố tăng trưởng giống insulin 1; NRG, neuroregulins; PGE, prostaglandin E; R, thụ thể; TGFβ, yếu tố tăng trưởng khối u β. (Chỉnh sửa từ Ojeda, S.R., Lomniczi, A., Mastronardi, C., et al. Minireview: the neuroendocrine regulation of puberty: is the time ripe for a systems biology approach? Endocrinology, 147, 1166–1174).
Cơ sở của sự thay đổi cân bằng dẫn truyền thần kinh đang trở nên rõ ràng hơn. Một cấp độ kiểm soát thứ hai dường như là sự điều chỉnh các quá trình này bằng cách tăng biểu hiện ở vùng dưới đồi vào tuổi dậy thì của các gen ức chế khối u hoạt động để tích hợp các tương tác giữa tế bào đệm-tế bào thần kinh. Một cấp cao hơn nữa của các gen ứng cử viên ở vùng dưới đồi đã được xác định là các chất điều chỉnh phiên mã của các gen cấp hai. Những gen này bao gồm Oct-2, một chất điều chỉnh của các gen homeobox miền POU, được tăng cường ở tuổi dậy thì 1 (EAP1), loại bỏ gen này làm chậm dậy thì và giảm khả năng sinh sản của chuột, yếu tố phiên mã tuyến giáp I (TTF1), yin yang 1 (YY1), và CUX1. Các gen liền kề với elastin dường như có liên quan đến tốc độ dậy thì: việc xóa đoạn nhiễm sắc thể 7q11.23 trong hội chứng Williams thường dẫn đến khởi phát dậy thì bình thường sớm nhưng tốc độ dậy thì nhanh với một đợt tăng trưởng dậy thì bị rút ngắn. Sự dư thừa đáng kể của các mạng lưới này và các chất hóa học thần kinh truyền tín hiệu tồn tại vì sự khởi đầu của dậy thì phụ thuộc vào sự biểu hiện của nhiều gen, có khả năng được sắp xếp trong một mạng lưới phối hợp. Các sản phẩm gen có thể hoạt động như chất kích hoạt hoặc chất ức chế các mục tiêu quan trọng cho sự khởi đầu và tiến triển của dậy thì. Steroid sinh dục đã được cho là những chất điều biến quan trọng trong việc khởi phát dậy thì.
Các microRNA, cụ thể là họ miR-200/429 và miR-155, đã được chứng minh là quan trọng trong việc điều hòa biểu sinh của dậy thì bằng cách điều chỉnh phiên mã gen GnRH. miR-7a2 rất quan trọng cho sự phát triển bình thường của tuyến yên và sự thiếu hụt dẫn đến thiếu hụt gonadotropin.
Do đó, sự khởi đầu của dậy thì được kiểm soát bởi sự gia tăng đối nghịch của tín hiệu kích thích và sự giảm tương ứng của tín hiệu ức chế từ các mạng lưới thần kinh nhắm vào tế bào thần kinh GnRH. Các nghiên cứu về tổn thương cho thấy các bó ức chế chủ yếu dường như được định tuyến qua vùng dưới đồi sau và các bó kích thích qua vùng tiền thị dưới đồi trước. Những nghiên cứu này đã được bổ sung bởi các nghiên cứu trên các mô hình chuột được biến đổi gen. Trong một mô hình như vậy, quần thể tế bào thần kinh nhân quanh não thất trước bụng (AVPV) đã được chứng minh là vị trí của phản hồi dương estrogen trong việc kiểm soát tiến triển dậy thì, và các tế bào kisspeptin trong nhân cung của vùng dưới đồi đã được chứng minh là rất quan trọng cho phản hồi âm estradiol. Thật vậy, dường như các tế bào thần kinh KNDy tích hợp phản hồi âm của steroid sinh dục để điều chỉnh bài tiết GnRH. Các mô dưới đồi sau khi chết được Ngân hàng Não Hà Lan thu thập, và các lát cắt được nhuộm kisspeptin bằng hóa mô miễn dịch để xác định số lượng tế bào thần kinh phản ứng miễn dịch với kisspeptin trong nhân phễu. Nghiên cứu này cho thấy số lượng tế bào thần kinh kisspeptin lớn hơn trong giai đoạn sơ sinh/tiền dậy thì và người già so với giai đoạn trưởng thành. Ở người chuyển giới từ nam sang nữ (MTF), nhưng không phải ở nam giới đồng tính luyến ái, biểu hiện kisspeptin điển hình của nữ đã được quan sát. Các tác giả cho rằng các tế bào thần kinh kisspeptin ở nhân phễu nhạy cảm với các hormone steroid sinh dục lưu hành và sự đảo ngược giới tính quan sát được ở người chuyển giới MTF có thể phản ánh một phần sự biệt hóa giới tính não bộ không điển hình. Sự nam hóa sơ sinh, làm mất khả năng tạo ra một đợt tăng LH giữa chu kỳ, đã được chứng minh là ức chế một cách chọn lọc sự phát triển của quần thể tế bào thần kinh kisspeptin AVPV.
Một cái nhìn tổng quan về các hệ thống liên quan đến việc điều chỉnh sự khởi đầu của dậy thì được thể hiện trong Hình 16.17. Sự trưởng thành dậy thì và sự trưởng thành xương dường như có các yếu tố quyết định chung. Bằng chứng lâm sàng phong phú chỉ ra rằng hormone steroid sinh dục là một trong những yếu tố quyết định này. Do đó, các gen liên quan đến chuyển hóa và hoạt động của hormone steroid sinh dục là các gen ứng cử viên điều chỉnh sự khởi đầu của dậy thì. Dữ liệu về vai trò của các hóa chất gây rối loạn nội tiết đối với thời điểm dậy thì còn hạn chế và không nhất quán, mặc dù một số bằng chứng trên động vật và dịch tễ học ủng hộ khả năng một số hợp chất làm tăng tốc thời điểm khởi phát dậy thì và một số khác làm chậm thời điểm. Kinh nghiệm với diethylstilbestrol cho thấy rằng việc phơi nhiễm trong thai kỳ có thể có tác động biểu sinh. Hệ thống hormone tăng trưởng (GH)-IGF là một yếu tố quyết định khác. GH tạo điều kiện cho sự khởi đầu và nhịp độ của dậy thì. Các nghiên cứu thực nghiệm cho thấy điều này xảy ra thông qua các hoạt động của GH hoặc IGF ở tất cả các cấp của trục thần kinh-nội tiết-buồng trứng. Các bé gái thường bước vào tuổi dậy thì khi đạt được tuổi xương dậy thì. Giai đoạn dậy thì thường tương quan tốt hơn với tuổi xương (r = 0.82) so với tuổi đời (r = 0.72, dữ liệu chưa công bố của RLR), đặc biệt là khi đến gần tuổi có kinh. Tuổi xương tương quan tốt hơn với tuổi có kinh so với tuổi đời, chiều cao, hoặc cân nặng, và phương sai của nó ở tuổi có kinh bằng một nửa so với tuổi đời. Tuổi xương khi bắt đầu phát triển vú trung bình khoảng 10.75 tuổi, và ở tuổi có kinh trung bình khoảng 13.0 tuổi. Các rối loạn làm tăng tốc độ trưởng thành xương, chẳng hạn như tăng sản thượng thận bẩm sinh (CAH) hoặc cường giáp, có xu hướng đẩy nhanh tuổi khởi phát dậy thì thực sự. Các rối loạn làm chậm sự trưởng thành xương, chẳng hạn như thiếu hụt GH, suy giáp, hoặc thiếu máu, có xu hướng làm chậm sự khởi đầu của dậy thì. Mặt khác, một số dữ liệu cho thấy các yếu tố liên quan đến chậm tăng trưởng trong tử cung, mặc dù không nhất thiết là bản thân sự chậm tăng trưởng, có khuynh hướng gây dậy thì sớm.
Hình 16.17 Sơ đồ các cơ chế chính kiểm soát sự phát triển và chức năng của bài tiết hormone sinh dục bởi nang trứng có hốc chưa chín. Điều hòa có thể là kích thích (+) hoặc ức chế (–). Hệ thần kinh trung ương (CNS) ảnh hưởng đến bài tiết kisspeptin (KISS1) và hormone giải phóng gonadotropin (GnRH) cả tiêu cực và tích cực. Để CNS từ bỏ sự kiểm soát ức chế đối với bài tiết GnRH, nó phải đạt đến một mức độ trưởng thành cao. Ngay cả sau khi điều này đạt được, căng thẳng tâm lý hoặc thể chất có thể ảnh hưởng tiêu cực đến hệ thống. Dinh dưỡng phải tối ưu. Leptin là một trung gian quan trọng của hiệu ứng dinh dưỡng. Steroid sinh dục có tác dụng làm trưởng thành. Liệu các bó ly tâm từ vùng dưới đồi đến đại não có đóng vai trò trong chức năng sinh sản hay không vẫn chưa được biết. Sự bài tiết melatonin và các chất khác của tuyến tùng được biết là có tác dụng ức chế GnRH ở các động vật bậc thấp (không được hiển thị). Kisspeptin kích thích GnRH, từ đó kích thích hormone tạo hoàng thể (LH) và hormone kích thích nang trứng (FSH). Phản hồi paracrine và autocrine của gonadotropin đối với giải phóng GnRH và đối với sự giải phóng của chính chúng, tương ứng, được hiển thị. Prolactin (PRL) có nhiều tác động lên bài tiết gonadotropin. Trong các nang trứng có hốc chưa chín, LH tác động lên các tế bào vỏ và tế bào kẽ và FSH tác động lên các tế bào hạt. Androstenedione và testosterone được tiết ra bởi các tế bào vỏ được aromat hóa bởi tế bào hạt, dưới ảnh hưởng của FSH, thành estradiol. Tế bào hạt cũng là nơi sản xuất chất ức chế FSH inhibin B. Estradiol có tác dụng hai pha lên tuyến yên trưởng thành và lên giải phóng GnRH ở vùng dưới đồi. Androgen dường như thường có tầm quan trọng nhỏ trong việc điều chỉnh giải phóng gonadotropin ở nữ giới. Các cơ chế trong buồng trứng dường như điều chỉnh hoạt động của LH để phối hợp sự hình thành androgen của vỏ với sự hình thành estrogen của tế bào hạt. Các yếu tố paracrine và autocrine, bao gồm các yếu tố tăng trưởng giống insulin, có liên quan. GABA, Gamma-aminobutyric acid.
Dinh dưỡng tối ưu rõ ràng là cần thiết cho việc khởi đầu và duy trì các chu kỳ kinh nguyệt bình thường. Giả thuyết rằng mỡ cơ thể là yếu tố kích hoạt liên quan đến cân nặng cho sự phát triển dậy thì bắt nguồn từ khám phá của Frisch và các đồng nghiệp rằng cân nặng tương quan với sự khởi đầu của đợt tăng trưởng dậy thì, tốc độ tăng trưởng đỉnh, và tuổi có kinh tốt hơn so với tuổi đời hoặc chiều cao. Giai đoạn giữa thời thơ ấu có thể là một giai đoạn quan trọng để cân nặng ảnh hưởng đến sự khởi đầu của dậy thì. Dinh dưỡng dưới mức tối ưu liên quan đến các yếu tố kinh tế xã hội là một yếu tố quan trọng trong việc khởi phát dậy thì muộn hơn ở các nước kém phát triển so với các nước phát triển. Ngược lại, béo phì dường như là một yếu tố quan trọng trong việc thúc đẩy sự khởi đầu của dậy thì ở Hoa Kỳ. Một số tác động của béo phì có thể được trung gian bởi IGF-1 và androgen thượng thận.
Leptin dường như là một liên kết quan trọng giữa dinh dưỡng và việc đạt được cũng như duy trì khả năng sinh sản. Thiếu hụt leptin gây ra béo phì và thiếu hụt gonadotropin. Nghịch lý thay, leptin dư thừa kéo dài có thể điều hòa giảm thụ thể leptin và giải phóng GnRH. Leptin được tiết ra bởi các tế bào mỡ trắng, tác động lên vùng dưới đồi để giảm cảm giác thèm ăn và kích thích bài tiết gonadotropin. Một mức ngưỡng quan trọng dường như báo hiệu rằng các kho dự trữ dinh dưỡng đã đủ cho chức năng trưởng thành của bộ tạo xung GnRH và do đó, cho phép dậy thì. Nồng độ leptin trong máu tăng trong suốt thời thơ ấu và dậy thì để đạt mức cao hơn ở trẻ gái so với trẻ trai và có liên quan tích cực đến tình trạng béo phì và tiêu cực với nồng độ testosterone. Protein gắn leptin, một dạng cắt ngắn của thụ thể leptin, giảm khi dậy thì bắt đầu, điều này cho thấy rằng leptin lưu hành trở nên có hoạt tính sinh học cao hơn. Liệu leptin có vai trò trực tiếp trong việc kích hoạt dậy thì của bộ tạo xung GnRH hay không vẫn chưa được biết. Trong các mô hình thiếu hụt leptin, việc sử dụng kisspeptin đã gây ra bài tiết LH. Ngược lại, tác động của leptin đối với dậy thì không cần tín hiệu trong các tế bào thần kinh kisspeptin trong các mô hình chuột khác.
Các yếu tố khác cũng liên kết dinh dưỡng và chức năng gonadotropic. Một phần tác động của leptin được trung gian bởi sự ức chế hình thành neuropeptide Y (NPY) ở vùng dưới đồi. NPY là một thành viên của họ polypeptide tuyến tụy có tác dụng kích thích thèm ăn mạnh, trực tiếp ức chế giải phóng GnRH trong thời gian thiếu ăn. Tuy nhiên, ở trạng thái tiền rụng trứng, nó kích thích giải phóng GnRH, một tác động được trung gian bởi một mạng lưới thần kinh khác tác động lên một phân nhóm thụ thể NPY khác trên tế bào thần kinh GnRH. NPY cũng bị ức chế bởi peptide YY (PYY) gây chán ăn, một hormone đường ruột được tiết ra để đáp ứng với thức ăn và bị ức chế bởi GH; sự sụt giảm PYY ở tuổi dậy thì đã được giả thuyết là cho phép sự gia tăng phối hợp của cảm giác thèm ăn và gonadotropin ở tuổi dậy thì. Insulin cũng có thể truyền tín hiệu về tình trạng dinh dưỡng đến các tế bào thần kinh KNDy, vì việc xóa thụ thể insulin trong các tế bào thần kinh KNDy ở chuột biến đổi gen đã dẫn đến chậm dậy thì và giảm nồng độ LH huyết thanh ở cả hai giới. Điều thú vị là, khả năng sinh sản của người trưởng thành không bị ảnh hưởng.
Các nghiên cứu GWAS về thời điểm dậy thì đã chỉ ra một số gen liên quan đến trọng lượng cơ thể ngoài leptin và thụ thể leptin và bao gồm protein liên quan đến khối lượng mỡ và béo phì (FTO), SEC16 homolog B (SEC16B), protein xuyên màng 18 (TMEM18), và chất điều hòa tăng trưởng thần kinh 1 (NEGR1). Các biến thể dị hợp tử hiếm gặp ở FTO đã được xác định trong các phả hệ bị CDGP liên quan đến chỉ số khối cơ thể (BMI) thấp và chậm tăng trưởng và dậy thì. Chuột được tạo ra dị hợp tử cho việc loại bỏ gen FTO cho thấy dậy thì muộn, nhưng không biểu hiện khối lượng cơ thể thấp. Các chất trung gian khác liên kết dinh dưỡng và dậy thì bao gồm các thụ thể melanocortin (MC)3/4, tín hiệu từ hormone kích thích alpha-melanocyte (MSH) để tăng biểu hiện Kiss1 và trung gian cho các tác động cho phép của leptin đối với dậy thì, và ghrelin và các đột biến ở thụ thể ghrelin, thụ thể secretagogue hormone tăng trưởng (GHSR). Một nhóm nhỏ gồm 31 bệnh nhân CDGP đã được phân tích về các đột biến ở GHSR, và 5 bệnh nhân được phát hiện có các đột biến điểm trong gen này.
Các tín hiệu khác cung cấp thông tin về tình trạng dinh dưỡng cho trục sinh sản trung ương có thể bao gồm glucose, ghrelin, và insulin. Tác động của các yếu tố này đối với nhịp xung LH có thể được trung gian trực tiếp ở cấp độ gonadotroph hoặc gián tiếp bởi những thay đổi trong bài tiết GnRH. Có rất ít bằng chứng về vai trò của các chất bài tiết của tuyến tùng trong sinh sản ở người được tìm thấy ở các động vật bậc thấp.
Yếu tố thiết yếu cho sự khởi đầu của dậy thì là sự gia tăng bài tiết GnRH theo xung của vùng dưới đồi, được điều chỉnh bởi một sự tương tác phức tạp của các tín hiệu kích thích và ức chế vẫn chưa được hiểu đầy đủ hoặc làm sáng tỏ. Trong thời thơ ấu, hoạt động của hệ thống tạo xung GnRH bị kìm hãm, sự thức tỉnh của bộ tạo xung xảy ra dần dần trong cuối thời thơ ấu, và nhịp độ kích hoạt tế bào thần kinh GnRH tăng lên trong tuổi dậy thì. Các cơ chế cơ bản cho tất cả những thay đổi này đều không rõ ràng. Sự suy giảm trương lực ở tuổi dậy thì của các trung tâm CNS ức chế bài tiết GnRH của vùng dưới đồi trong thời thơ ấu theo truyền thống được coi là kết quả của việc giảm độ nhạy của một “bộ điều chỉnh sinh dục” đối với phản hồi âm của steroid sinh dục. Tuy nhiên, điều này bây giờ dường như là một khái niệm quá đơn giản cho một cơ chế dường như liên quan đến sự thay đổi trong sự cân bằng của các tín hiệu ức chế và kích thích thần kinh tác động lên tế bào thần kinh GnRH.
Nhiều nghiên cứu đã được thực hiện để giúp hiểu các sự kiện phát triển khởi đầu hoặc “cơ chế kích hoạt” cho sự khởi phát dậy thì. Trên thực tế, ngày càng rõ ràng rằng không có một “cơ chế kích hoạt” duy nhất cho dậy thì, mà là sự gia tăng dần dần nhịp xung GnRH liên quan đến một sự tương tác phức tạp của các yếu tố và các chương trình phát triển của vùng dưới đồi. Do đó, “độ nhạy cảm của bộ điều chỉnh sinh dục” biểu kiến dường như ngày càng có khả năng phản ánh mức độ hoạt động của tế bào thần kinh GnRH. Tức là, khi hoạt động bài tiết GnRH bị suy giảm, bộ tạo xung dễ bị ức chế; khi tế bào thần kinh GnRH hoạt động, bộ tạo xung tương đối không nhạy cảm với phản hồi âm.
Sự tích hợp của các hệ thống tín hiệu dưới đồi cùng với những thay đổi phát triển trong việc kiểm soát chức năng của tế bào thần kinh GnRH dường như hội tụ để kích hoạt sự khởi đầu của dậy thì. Ở chuột, sự tái cấu trúc của tế bào thần kinh GnRH đã được chứng minh trong quá trình tiến triển dậy thì bằng sự gia tăng mật độ của các gai đuôi gai và gai thân tế bào; tỷ lệ phần trăm tổng số tế bào thần kinh có gai thấp nhất khi sinh và tăng dần sau sinh cho đến tuổi dậy thì. Các quá trình gai của tế bào thần kinh là vị trí của các synap kích thích quan trọng trong tính dẻo của tế bào thần kinh. Tỷ lệ phần trăm tế bào thần kinh phức tạp lớn nhất là trong giai đoạn quanh dậy thì, với tỷ lệ phần trăm giảm sau khi hoàn thành dậy thì. Những thay đổi phát triển này tương quan với sự gia tăng đầu vào synap kích thích đến tế bào thần kinh GnRH, kích hoạt sự khởi đầu của dậy thì ở chuột. Đầu vào synap kích thích nào (ví dụ, tín hiệu glutamatergic, kisspeptinergic, hoặc các tín hiệu hóa học thần kinh chưa được biết) đóng một vai trò trong sự gia tăng bài tiết GnRH ở tuổi dậy thì vẫn chưa được biết. Liệu các tế bào thần kinh GnRH của loài linh trưởng hoặc người có trải qua quá trình tái cấu trúc kích thích synap trong quá trình phát triển hay không cũng chưa được biết.
Kể từ khi được phát hiện, nhiều nghiên cứu đã chứng minh sự biểu hiện của hệ thống tín hiệu kisspeptin ở một số vị trí ngoại vi, cho thấy nó có liên quan đến các quá trình sinh học, chẳng hạn như điều hòa chức năng buồng trứng, làm tổ của phôi, hình thành nhau thai, tạo mạch, và bài tiết insulin. Tuy nhiên, liệu kisspeptin có được tiết ra từ các vị trí biểu hiện ngoại vi và tác động lên trục sinh sản hiện vẫn chưa rõ ràng.
Điều hòa bài tiết Gonadotropin
Một đặc điểm thiết yếu của trục HPG trưởng thành là sự kiểm soát phản hồi âm vòng dài của bài tiết gonadotropin bởi các sản phẩm bài tiết của tuyến sinh dục, như được mô tả trong Hình 16.17. Bản chất trương lực nói chung của bài tiết gonadotropin được điểm xuyết bởi hai loại chu kỳ nổi bật: các xung LH gấp hai đến ba lần trên mức đáy ở khoảng cách 1.5 giờ và, ở nữ giới trưởng thành về mặt sinh dục, bởi một đợt tăng gonadotropin tiền rụng trứng, giữa chu kỳ, thoáng qua. Đợt tăng sau được đặc trưng bởi sự gia tăng nhanh chóng của LH hơn 10 lần và sự gia tăng ít hơn của FSH. Đợt tăng này được tạo ra bởi phản hồi dương khi đạt được một mức độ estradiol quan trọng, được tạo điều kiện bởi sự gia tăng khiêm tốn của progesterone, trong một khoảng thời gian quan trọng, như đã thảo luận liên quan đến Hình 16.13.
Estradiol, kết hợp với inhibin, điều hòa tương hỗ FSH trong một vòng phản hồi âm nhạy cảm, theo liều logarit. Progesterone ở nồng độ cao (giai đoạn hoàng thể) là một chất điều hòa âm chính của tần số xung GnRH-LH. Androgen có mối quan hệ phản hồi vòng dài hai pha với gonadotropin: ở mức tăng khiêm tốn, chúng kích thích giải phóng gonadotropin và ở mức rất cao, chúng ức chế nó.
Estradiol có tác dụng ba pha, và progesterone có tác dụng hai pha, đối với bài tiết gonadotropin. Khi estradiol tăng sau điểm giữa của giai đoạn nang trứng, nó làm giảm một cách chọn lọc đáp ứng FSH với GnRH, và khi nó đạt đến mức tiền rụng trứng, nó tạm thời có tác dụng phản hồi dương lên LH và, ở mức độ thấp hơn, FSH. Ở mức cao kéo dài, estradiol ức chế cả hai gonadotropin. Khi progesterone đạt đến mức tiền rụng trứng, nó tăng cường hiệu ứng phản hồi dương của estradiol, nhưng ở mức cao hơn xảy ra trong giai đoạn hoàng thể, nó ức chế tần số xung LH trong khi tăng cường biên độ xung LH.
Các tế bào thần kinh GnRH chịu trách nhiệm chính cho việc duy trì chu kỳ sinh sản là các tế bào của nhân cung (nhân phễu) (Hình 16.18). Các tế bào thần kinh GnRH vốn có tính xung. Sự đồng bộ được thúc đẩy bởi các dòng ion canxi vào các tế bào này và phản hồi ức chế GnRH tự tiết. Sự bài tiết GnRH được điều chỉnh bởi nhiều loại chất dẫn truyền thần kinh và yếu tố tăng trưởng liên quan đến việc khởi phát dậy thì. Sự đồng bộ của mạng lưới các tế bào thần kinh GnRH gây ra nhịp xung được tạo ra khi nồng độ GABA ở vùng dưới đồi định kỳ giảm từ mức ức chế đối với các thụ thể GABAA khi có mặt một chất dẫn truyền thần kinh kích thích. EAP1, một protein dưới đồi trước đây được chứng minh là quan trọng cho sự khởi phát dậy thì, cũng đã được liên quan đến việc kiểm soát chu kỳ kinh nguyệt ở loài linh trưởng.
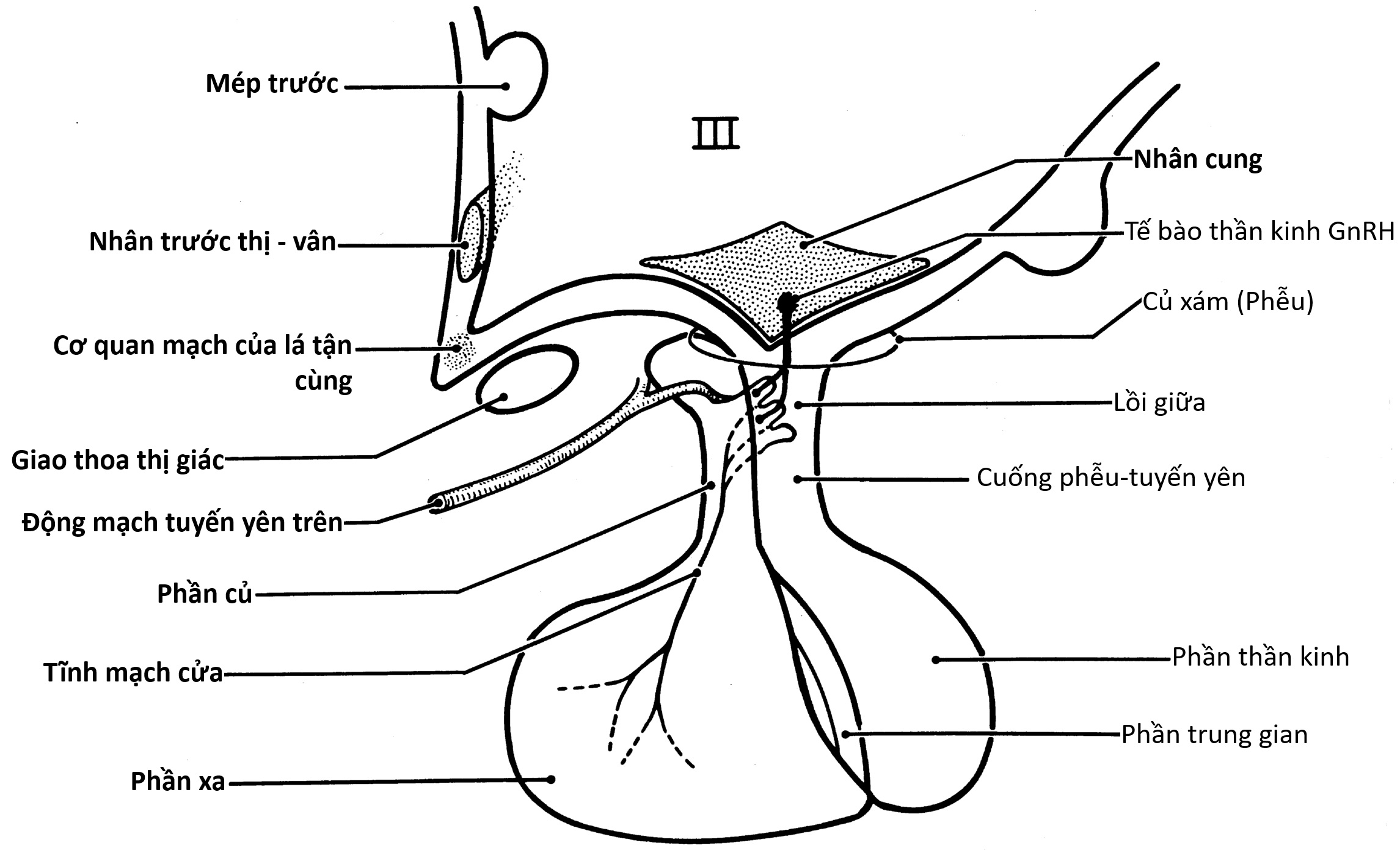
Hình 16.18 Vị trí của các tế bào thần kinh chứa hormone giải phóng gonadotropin (GnRH) chính (vùng tô bóng) trong mối quan hệ với vùng dưới đồi và tuyến yên. Các tế bào thần kinh có mật độ cao nhất trong các nhân cung và trong thành quanh não thất của vùng dưới đồi nền giữa. Các tế bào thần kinh này chiếu đến gò giữa liền kề, quần thể tế bào thần kinh GnRH dày đặc thứ hai nằm ở khu vực tiền thị-vân. Sự phát triển của một số bị thay đổi bởi sự androgen hóa sớm. Một số được kết nối bởi dải tận cùng với hạch hạnh nhân. Các hình chiếu khác từ khu vực này dường như kết nối gián tiếp với gò giữa, có lẽ thông qua cơ quan mạch máu của lá tận cùng—một cấu trúc đường giữa giống với gò giữa. Các tĩnh mạch cửa tuyến yên vận chuyển máu giàu các yếu tố giải phóng đến các xoang bao quanh các tế bào tuyến yên trước.
Các tín hiệu steroid sinh dục một phần được truyền đến các tế bào thần kinh GnRH một cách gián tiếp. Sự điều hòa bài tiết GnRH bởi estrogen một phần liên quan đến việc cảm ứng các PR ở vùng dưới đồi. Các dòng tế bào thần kinh GnRH đã được nghiên cứu trong đó estradiol trực tiếp kích thích và ức chế biểu hiện gen GnRH trong các điều kiện thí nghiệm khác nhau. Mặc dù progesterone có tác dụng ức chế chính đối với bài tiết GnRH, nó có tác động ở các cấp độ CNS cao hơn và ở cấp độ tuyến yên. Prolactin ức chế biểu hiện thụ thể GnRH ở cả vùng dưới đồi và gonadotropin.
Các yếu tố liên quan lâm sàng khác ảnh hưởng đến việc giải phóng GnRH là giấc ngủ, endorphin (opioid nội sinh), và interleukin. Ở phụ nữ trưởng thành về mặt sinh dục, giấc ngủ ức chế tần số xung GnRH và tác dụng này dường như được khuếch đại bởi các hormone nữ. Endorphin là những chất điều hòa sinh lý quan trọng của việc giải phóng GnRH sau khi dậy thì đã bắt đầu. β-endorphin dưới đồi ức chế bài tiết GnRH do cắt buồng trứng khởi xướng, và các chất đối kháng opiate đảo ngược tác dụng này, cũng như tác dụng của giấc ngủ. Tác dụng ức chế của căng thẳng đối với việc giải phóng gonadotropin dường như được trung gian bởi β-endorphin được giải phóng từ proopiomelanocortin để đáp ứng với hormone giải phóng corticotropin (CRH). Interleukin cũng ức chế giải phóng gonadotropin. Serotonin dường như điều chỉnh nhịp xung LH và tạo điều kiện cho đợt tăng LH.
Các thụ thể GnRH trên gonadotroph được duy trì ở trạng thái hoạt động tối ưu chỉ khi GnRH được cung cấp theo các xung cách nhau khoảng 1 đến 2 giờ ở người. Các xung ít thường xuyên hơn đáng kể sẽ dẫn đến tình trạng suy giảm gonadotropin. Nghịch lý thay, việc sử dụng liên tục một liều GnRH ban đầu có tác dụng kích thích sẽ dẫn đến sự điều hòa giảm sản xuất gonadotropin, sau một đợt giải phóng gonadotropin ban đầu. Đây là cơ sở sinh lý cho sự thành công của các chất chủ vận gonadotropin tác dụng kéo dài trong việc ức chế dậy thì ở trẻ em bị dậy thì sớm trung ương thực sự. Tuy nhiên, trong khi gonadotropin bị điều hòa giảm, sản xuất tiểu đơn vị alpha tự do lại tăng và đáp ứng với GnRH.
Chức năng thụ thể GnRH của vùng dưới đồi được điều chỉnh bởi các yếu tố tự tiết và cận tiết, bao gồm cả chính GnRH và kisspeptin. Các thụ thể GnRH của tuyến yên dường như bị điều hòa giảm trực tiếp và gián tiếp bởi GnRH, gonadotropin, và inhibin, cũng như các steroid sinh dục. Bản thân LH và FSH ức chế giải phóng GnRH (phản hồi vòng ngắn) và ức chế sự giải phóng của chính chúng (phản hồi tự tiết).
Làm thế nào để sự điều hòa khác biệt của việc giải phóng LH và FSH của gonadotrope được thực hiện để đáp ứng với một xung GnRH duy nhất? Tần số của xung GnRH là một yếu tố quyết định. Tần số tăng của tín hiệu này kích thích biểu hiện gen tiểu đơn vị β-LH, trong khi làm chậm tín hiệu này sẽ kích thích biểu hiện gen tiểu đơn vị β-FSH và ức chế biểu hiện gen follistatin, làm thay đổi tỷ lệ FSH/LH. Polypeptide kích hoạt adenylate cyclase của tuyến yên khuếch đại đáp ứng LH với GnRH trong khi ngăn chặn tác động của nó lên FSH.
Môi trường hormone sinh dục cũng rõ ràng là một yếu tố điều biến khác biệt chính của việc giải phóng LH và FSH của gonadotrope. FSH nhạy cảm hơn LH với sự ức chế của estrogen; tác động này của mức độ estradiol khiêm tốn có khởi đầu nhanh và kéo dài. LH nhạy cảm hơn với các tác động kích thích của nồng độ estradiol cao hơn; tác động này có khởi đầu muộn hơn và tồn tại trong thời gian ngắn. Các mối quan hệ tương tự cũng tồn tại ở chuột không có aromatase. Chuột không có ER đã tiết lộ ER-alpha là đồng dạng thụ thể chiếm ưu thế truyền tín hiệu điều hòa phản hồi âm đến gonadotroph. Progesterone có cả tác động phản hồi âm và dương ở cấp độ tuyến yên, và những tác động này bị đối kháng bởi androgen. Chất chuyển hóa progesterone 3α-hydroxyprogesterone ức chế giải phóng FSH.
Androgen có những tác động phức tạp lên động học của gonadotropin. Hoạt động androgen bình thường tạo điều kiện cho đợt tăng gonadotropin giữa chu kỳ để đáp ứng với phản hồi dương. Testosterone tăng cao làm tăng biên độ và tần số xung LH cơ bản trong khi ức chế khả năng tạo ra đợt tăng gonadotropin. Những hành động này dường như là kết quả của việc đối kháng với hoạt động của progesterone.
Inhibin có nguồn gốc từ tuyến sinh dục dường như là chất điều hòa phản hồi âm không steroid đặc hiệu chính của quá trình tổng hợp và bài tiết FSH của tuyến yên. Inhibin ức chế giải phóng FSH ở cấp độ tuyến yên, nhưng chúng cũng có thể hoạt động ở cấp độ cao hơn. Nồng độ trong huyết thanh của cả hai loại inhibin đều tăng khi có sự kích thích của FSH. Inhibin-B, được sản xuất bởi các nang trứng có hốc nhỏ để đáp ứng với FSH, gần như là phần inhibin duy nhất trong máu trong tuổi dậy thì. Nồng độ trong máu của nó tăng trong giai đoạn nang trứng sớm và sau đó giảm, ngoại trừ một đỉnh nhỏ sau rụng trứng, nói chung song song với những thay đổi của FSH huyết thanh; đỉnh sau có thể có chức năng làm giảm đợt tăng FSH. Inhibin-A huyết thanh, một dấu hiệu của nang trứng tiền rụng trứng và hoàng thể, bắt đầu tăng vào cuối giai đoạn nang trứng và sau đó song song với nồng độ progesterone; sự sụt giảm của nó vào cuối giai đoạn hoàng thể dường như góp phần vào sự gia tăng nồng độ FSH trong giai đoạn nang trứng sớm.
Các activin có cấu trúc liên quan dường như quan trọng như những chất điều hòa cả chức năng của tuyến yên và buồng trứng. Activin được hình thành bởi chính các gonadotrope và vai trò chính của nó là kích thích giải phóng FSH. Nó cũng điều hòa tăng follistatin, protein gắn activin, phát sinh trong các tế bào nang-sao của thùy trước tuyến yên. Follistatin, bằng cách ức chế cạnh tranh sự gắn kết của activin với thụ thể của nó, ức chế một cách đặc hiệu sự kích thích của activin đối với bài tiết FSH.
Điều hòa bài tiết của buồng trứng
Bài tiết của buồng trứng là kết quả của các hoạt động kết hợp của LH và FSH, như đã thảo luận trước đó liên quan đến Hình 16.13 và 16.14. Nang trứng giai đoạn nang trứng sớm hoạt động theo mô hình hai tế bào, hai gonadotropin được minh họa trong Hình 16.19. Để đáp ứng với LH, androstenedione, steroid dồi dào nhất được hình thành trong buồng trứng, được tiết ra bởi khoang tế bào vỏ-kẽ-mô đệm (vỏ). Để đáp ứng với sự điều hòa của FSH, aromatase sau đó hình thành estrogen từ tiền chất androstenedione trong các tế bào hạt. FSH cũng kích thích các tế bào hạt tiết ra inhibin. Là sản phẩm phụ của sự bài tiết cả estradiol buồng trứng và cortisol thượng thận, androgen thường không đóng góp vào việc điều hòa phản hồi âm của gonadotropin. Tuy nhiên, chúng có tác dụng hai pha đối với bài tiết gonadotropin: mức tăng khiêm tốn làm tăng tần số xung GnRH bằng cách can thiệp vào phản hồi âm của progesterone và mức rất cao trực tiếp ức chế bài tiết gonadotropin.
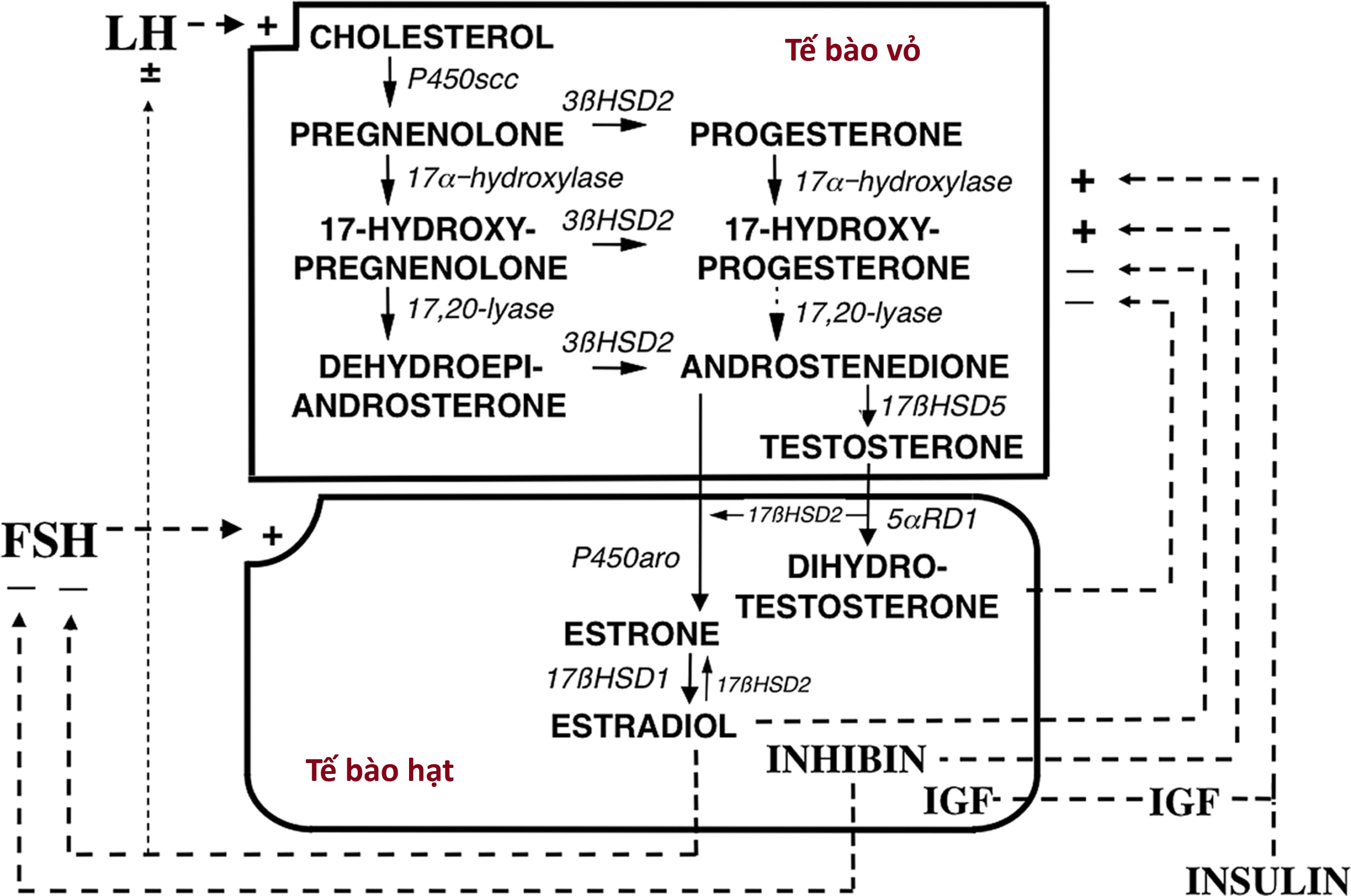
Hình 16.19. Mô tả sự tổ chức và điều hòa các con đường sinh tổng hợp steroid chính trong nang trứng có hốc nhỏ của buồng trứng theo mô hình hai gonadotropin, hai tế bào của quá trình sinh tổng hợp steroid buồng trứng. Hormone tạo hoàng thể (LH) kích thích sự hình thành androgen trong các tế bào vỏ thông qua con đường sinh steroid chung cho tuyến sinh dục và tuyến thượng thận. Hormone kích thích nang trứng (FSH) điều chỉnh sinh tổng hợp estradiol từ androgen bởi các tế bào hạt. Phản hồi âm vòng dài của estradiol đối với bài tiết gonadotropin không dễ dàng ức chế LH ở mức độ estradiol sinh lý và kích thích LH trong các trường hợp phản hồi dương. Sự hình thành androgen để đáp ứng với LH dường như được điều chỉnh bởi phản hồi trong buồng trứng ở các mức độ 17-hydroxylase và 17, 20-lyase, cả hai đều là hoạt động của cytochrome P450c17 chỉ được biểu hiện trong các tế bào vỏ. Lượng tương đối của sự hình thành androstenedione thông qua 17-OHP (mũi tên chấm) trong nang trứng nguyên vẹn có lẽ là nhỏ, cũng như lượng progesterone được hình thành từ hoạt động P450scc của tế bào hạt để đáp ứng với FSH (không được hiển thị). Hoạt động 17βHSD2 là nhỏ trong buồng trứng, và estradiol chủ yếu được hình thành từ androstenedione. Androgen và estradiol ức chế (–) và inhibin, insulin, và yếu tố tăng trưởng giống insulin-I (IGF) kích thích (+) các hoạt động 17-hydroxylase và 17, 20-lyase. Các vị trí biểu hiện gen aromatase và IGF dường như thay đổi theo giai đoạn phát triển của nang trứng. Các peptide khác cũng điều chỉnh đáp ứng sinh steroid với LH. Các hoạt động enzyme liên quan được in nghiêng: các hoạt động 17-hydroxylase và 17,20-lyase của P450c17 được hiển thị, nếu không các chữ viết tắt của enzyme như trong văn bản. 5α-R, 5α-Reductase; 17β-HSD5, loại 5 17β-HSD; HSD, hydroxysteroid dehydrogenase.(Chỉnh sửa với sự cho phép từ Ehrmann et al, Polycysticovary syndrome as a form of functional ovarian hyperandrogenism due to dysregulation ofandrogen secretion. Endocr Rev. 1995;16:322–353. Tái bản với sự cho phép từ Rosenfield, R.L., Ehrmann, D.A. (2016). The pathogenesis of polycystic ovary syndrome (PCOS): the hypothesis of PCOS as functional ovarian hyperandrogenism revisited. Endocr Rev, 37, 467–520.)
Sự điều hòa nồng độ androgen trong buồng trứng là rất quan trọng đối với chức năng buồng trứng. Androgen rất quan trọng cho chức năng buồng trứng. Androgen là cơ chất bắt buộc cho quá trình sinh tổng hợp estradiol. Androgen cũng làm tăng sự tuyển chọn các nang trứng nguyên thủy vào nhóm nang trứng đang phát triển và sau đó hoạt động kết hợp với gonadotropin trên các tế bào hạt để kích thích sự phát triển của nang trứng tiền hốc thành các nang trứng có hốc nhỏ, điều này tăng cường sự điều hòa tăng hoạt động aromatase của FSH. Androgen cũng hiệp đồng với FSH để hoàng thể hóa các nang trứng bằng cách gây ra các thụ thể LH. Tuy nhiên, ở mức độ dư thừa, androgen làm suy yếu sự lựa chọn nang trứng vượt trội ở phụ nữ; điều này dường như có khả năng là kết quả của sự hoàng thể hóa sớm của các nang trứng, do đó khiến nang trứng bị thoái hóa. Do đó, quá trình tổng hợp androgen phải được giữ ở mức tối thiểu cần thiết để tối ưu hóa sự phát triển của nang trứng. Điều này có nghĩa là quá trình tổng hợp androgen của buồng trứng phải được phối hợp với nhu cầu của nang trứng. Điều này đạt được bằng cách điều chỉnh hoạt động của LH trong buồng trứng theo cơ chế nội tiết, tự tiết và cận tiết (xem Hình 16.19).
LH kích thích sự phát triển và sinh tổng hợp steroid của tế bào vỏ và cần thiết cho sự biểu hiện của các enzyme sinh steroid của tuyến sinh dục và bài tiết hormone sinh dục. Tuy nhiên, một khi đạt được mức LH của người trưởng thành, sự gia tăng LH thêm thường có ít tác động hơn đối với mức androgen vì LH dư thừa gây ra sự mất nhạy cảm tương đồng của các tế bào vỏ. Sự mất nhạy cảm bao gồm sự điều hòa giảm biểu hiện thụ thể LH và sinh tổng hợp steroid. Bởi vì sự điều hòa giảm sinh tổng hợp steroid chủ yếu được tác động lên hoạt động 17,20-lyase, chuyển đổi 17-hydroxycorticoid thành 17-KS, mức 17-OHP tăng để đáp ứng với mức LH tăng, nhưng sự gia tăng androgen bị hạn chế.
Một mô hình về sự tương tác trong buồng trứng giữa các chất điều hòa chính của quá trình sinh tổng hợp steroid được thể hiện trong Hình 16.19. Sự kích thích bài tiết androgen bởi LH dường như được tăng cường bởi các yếu tố phụ thuộc FSH trong buồng trứng cụ thể, chẳng hạn như inhibin và IGF. Những quá trình này dường như thường được cân bằng bởi các quá trình phụ thuộc FSH khác điều hòa giảm sự hình thành androgen khi sự kích thích của LH tăng lên. Bản thân androgen và estrogen dường như làm trung gian cho ít nhất một phần của sự mất nhạy cảm này với LH, với estrogen là rất quan trọng thông qua một cơ chế phụ thuộc ERα.
Insulin và IGF là những chất đồng điều hòa quan trọng của chức năng buồng trứng. Insulin điều hòa tăng các vị trí thụ thể LH và hoạt động của tế bào vỏ và ở mức độ thấp hơn là sinh tổng hợp estrogen để đáp ứng với FSH. Toàn bộ hệ thống IGF được đại diện trong buồng trứng: IGF-1 tăng cường biểu hiện và hoạt động của thụ thể FSH. và dường như làm trung gian cho việc thúc đẩy sinh tổng hợp steroid của tế bào hạt của GH. Insulin có hiệu lực tương đương với IGF-1 trong việc kích thích sinh tổng hợp androgen của vỏ, và, mặc dù insulin có thể hoạt động thông qua các dạng lai của thụ thể insulin và IGF-1 và ở mức rất cao tương tác với thụ thể IGF-1, nó dường như chủ yếu hoạt động thông qua thụ thể của chính nó.
Các tế bào sinh steroid biểu hiện androgen biểu hiện một biến thể protein chưa được nhận biết trước đây, DENND (biểu hiện khác biệt trong sự phát triển bình thường và tân sinh) 1A.V2, tạo điều kiện cho quá trình sinh tổng hợp steroid: nó điều hòa tăng hoạt động cơ bản và được kích thích bởi cAMP của cytochrome P450c17 và các hoạt động phân cắt chuỗi bên. Cơ chế mà DENND1A.V2 điều chỉnh quá trình sinh tổng hợp steroid hiện vẫn chưa được biết. DENND1A là một thành viên của họ protein connecdenn, có liên quan đến việc vận chuyển protein, các quá trình nội thực bào và tái chế thụ thể. Do đó, thật hấp dẫn khi suy đoán rằng nó hoạt động bằng cách điều hòa tăng tín hiệu thụ thể LH.
Nhiều peptide khác điều chỉnh sự tăng trưởng hoặc chức năng của tế bào buồng trứng để đáp ứng với gonadotropin. Inhibin kích thích sản xuất androgen của buồng trứng, trong khi androgen ngược lại kích thích sản xuất inhibin của buồng trứng. Activin chống lại tác dụng của inhibin. Một loạt các peptide buồng trứng khác cũng có khả năng điều chỉnh quá trình tổng hợp androgen của vỏ. Các chất kích thích bao gồm catecholamine, mà có một hệ thống trong buồng trứng, prostaglandin, và angiotensin. Các chất ức chế bao gồm leptin, CRH, yếu tố tăng trưởng biểu bì (EGF), yếu tố hoại tử khối u, TGF-β, và GDF9. Leptin đối kháng với các tác dụng của IGF-1. TGF-β đặc biệt thú vị vì nó ức chế sinh tổng hợp androgen và kích thích hoạt động của aromatase; nó cũng kích thích sự trưởng thành giảm phân của noãn bào. Các peptide khác tác động lên các tế bào hạt bao gồm các cytokine, có các tác dụng đa dạng, và AMH, ức chế aromatase. GnRH cũng có khả năng điều chỉnh quá trình sinh tổng hợp steroid của vỏ. Một protein giống GnRH đã được mô tả trong buồng trứng có thể hoạt động thông qua các thụ thể GnRH của buồng trứng để ức chế quá trình sinh tổng hợp steroid trong buồng trứng người. Nó ức chế sự cảm ứng của FSH đối với bài tiết progesterone, hoạt động của aromatase, và các thụ thể LH trong các tế bào hạt, điều hòa giảm các thụ thể LH, và ức chế sự kích thích của hCG đối với bài tiết progesterone bởi các tế bào hoàng thể.
Prolactin có những tác động phức tạp lên quá trình sinh tổng hợp steroid. Ở nồng độ thấp, nó tăng cường bài tiết estradiol và progesterone của buồng trứng bằng cách tăng các thụ thể LH. Mặt khác, nồng độ prolactin cao ức chế sinh tổng hợp estradiol và progesterone của buồng trứng. Prolactin cũng kích thích sản xuất androgen thượng thận.
Dậy thì thượng thận và Điều hòa bài tiết Androgen thượng thận
Dậy thì thượng thận (adrenarche) là sự khởi đầu của việc tăng sản xuất androgen thượng thận, bắt đầu dần dần vào giữa thời thơ ấu, trước cả khi trục thần kinh-nội tiết-tuyến sinh dục trưởng thành về mặt dậy thì. Androgen trong giai đoạn dậy thì thượng thận góp phần vào sự xuất hiện của lông mu (sự phát triển lông mu) và sự phát triển của tuyến bã nhờn và tuyến apocrine.
Dậy thì thượng thận là kết quả của sự thay đổi trong mô hình đáp ứng bài tiết của tuyến thượng thận với ACTH (Hình 16.20). Nó được đặc trưng bởi sự gia tăng không tương xứng trong các đáp ứng với ACTH của các △5-3β-hydroxysteroid là 17-hydroxypregnenolone và dehydroepiandrosterone (DHEA), trong khi sự bài tiết cortisol không thay đổi. Dehydroepiandrosterone sulfate (DHEAS) là dấu hiệu chủ yếu cho dậy thì thượng thận. Mức DHEAS trên 40 mcg/dL thường được coi là đã vào giai đoạn dậy thì thượng thận. Các androgen và tiền chất khác trong huyết thanh thường ở mức cao của khoảng tiền dậy thì khi bắt đầu dậy thì thượng thận.
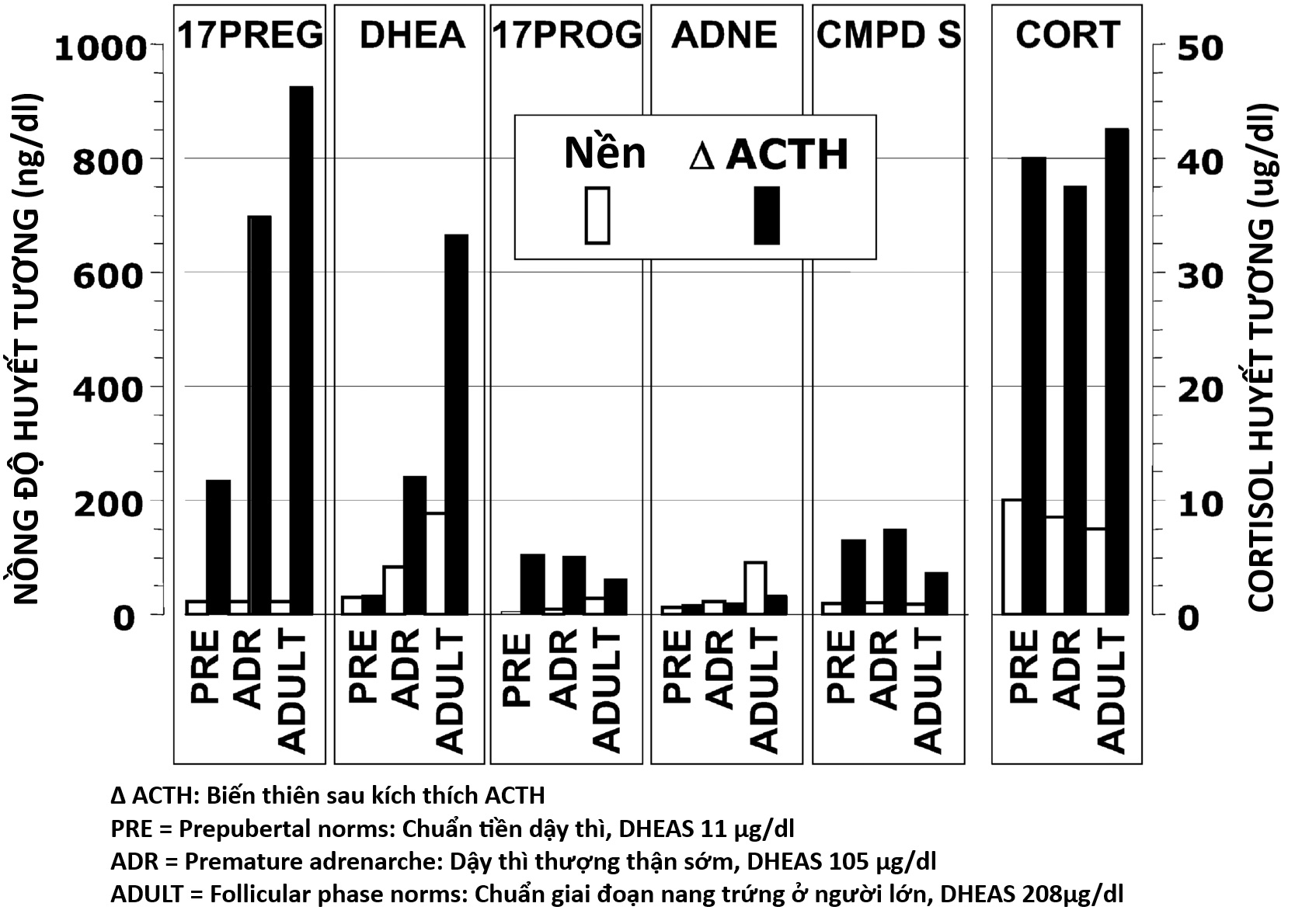
Hình 16.20Sự thay đổi mô hình đáp ứng sinh steroid thượng thận với hormone vỏ thượng thận theo sự trưởng thành. Hiển thị là nồng độ steroid huyết tương trước (nền, 8:00 sáng sau dexamethasone 1 mg/m2) và sự gia tăng (Δ) 30 phút sau khi tiêm cosyntropin (ACTH) (10 μg/m2) ở trẻ em tiền dậy thì khỏe mạnh, trẻ em bị dậy thì thượng thận sớm như một hiện tượng đơn độc, và phụ nữ trưởng thành trong giai đoạn nang trứng. Lưu ý rằng các đáp ứng 17-hydroxypregnenolone (17PREG) và dehydroepiandrosterone (DHEA) của trẻ em bị dậy thì thượng thận sớm là trung gian giữa đáp ứng tiền dậy thì và đáp ứng của người lớn. 17PROG, 17-hydroxyprogesterone; ADNE, androstenedione; CMPD S, 11-deoxycortisol; CORT, cortisol; DHEAS, dehydroepiandrosterone sulfate. (Dữ liệu từ Rich, B.H., Rosenfield, R.L., Lucky, A.W., Helke, J.C., Otto, P. (1981). Adrenarche: Changing adrenal response to adrenocorticotropin. J Clin Endocrinol Metab, 52, 1129.)
Dậy thì thượng thận phản ánh sự phát triển của lớp lưới vỏ thượng thận (zona reticularis). Con người và một số loài linh trưởng bậc cao là độc nhất trong việc có một vùng thượng thận với các mối quan hệ cấu trúc-chức năng-giai đoạn phát triển tương tự. Mặc dù lớp lưới giống với vùng bào thai của vỏ thượng thận về vị trí và chức năng, nó dường như bắt nguồn từ các tế bào gốc nằm ở vùng xác định bên ngoài của tuyến thượng thận bào thai. Vùng này trở nên liên tục vào khoảng 5 tuổi và mở rộng đều đặn trong thập kỷ tiếp theo. Sự phát triển ngày càng tăng của nó tương quan với nồng độ DHEAS.
Mô hình bài tiết của vùng này là kết quả của một hồ sơ biểu hiện enzyme độc đáo: nó biểu hiện 3β-hydroxysteroid dehydrogenase loại 2 (HSD3B2) thấp, nhưng hoạt động của cytochrome b5 (một chất tăng cường hoạt động 17,20-lyase của cytochrome P450c17) và steroid sulfotransferase (SULT2A1) cao. Sự bài tiết cao của DHEA và DHEAS chủ yếu là do các hoạt động này. Biểu hiện tăng cường của 17β-hydroxysteroid dehydrogenase loại 5 (HSD17B5) bởi vùng này giải thích cho sự đóng góp nhỏ nhưng đáng kể của tuyến thượng thận vào việc bài tiết testosterone. Cả testosterone và androstenedione đều được chuyển hóa thêm bởi 11β-hydroxylase loại 1 (CYP11B1) của lớp lưới, là cơ sở cho sự bài tiết 11β-hydroxyandrostenedione và 11β-hydroxytestosterone của tuyến thượng thận. Các chất này được chuyển hóa thêm, chủ yếu ở ngoại vi, bởi 11β-hydroxysteroid dehydrogenase thành các chất tương đồng 11-keto của chúng. Các chất chuyển hóa 11-oxy này của testosterone có hiệu lực bằng một phần năm so với testosterone ở liều nửa tối đa (ED50).
Các yếu tố gây ra và điều hòa sự phát triển của lớp lưới vẫn chưa rõ ràng. Sự tăng trưởng cơ thể có liên quan đến dậy thì thượng thận. Insulin, IGF-1, và leptin đã được đề xuất là các yếu tố quyết định của mối quan hệ này. Insulin và IGF-1 kích thích biểu hiện các hoạt động P450c17 và 3βHSD2 của tuyến thượng thận và có thể liên quan đến sự tăng sinh của tế bào tiền thân. Leptin, một hormone tế bào mỡ, kích thích hoạt động 17,20-lyase của các tế bào vỏ thượng thận, làm chuyển hướng quá trình sinh steroid thượng thận sang sản xuất DHEAS.
Tình trạng dinh dưỡng, đặc biệt, dường như đóng một vai trò trong sự phát triển của dậy thì thượng thận, đặc biệt là ở các bé gái. Trẻ sơ sinh nhẹ cân so với tuổi thai có nồng độ DHEAS cao hơn ở độ tuổi 5 đến 8, và trẻ sơ sinh nặng cân so với tuổi thai có nồng độ thấp hơn so với những trẻ có cân nặng khi sinh bình thường. Béo phì có liên quan đến nồng độ DHEAS, và tăng cân nhanh trong thời thơ ấu có liên quan đến nồng độ androgen thượng thận độc lập với cân nặng khi sinh.
Một hormone tuyến yên (“yếu tố dậy thì thượng thận”) có thể cần thiết để mang lại sự phát triển dậy thì thượng thận của chúng. Nó đã được giả thuyết là một hormone liên quan đến ACTH khác biệt với ACTH vì sản xuất androgen thượng thận nhạy cảm hơn với sự ức chế của glucocorticoid so với sản xuất cortisol, giảm chậm hơn cortisol sau khi dùng dexamethasone, và tăng chậm hơn sau khi ngưng thuốc. Các ứng cử viên cho một yếu tố dậy thì thượng thận có thể bị dexamethasone ức chế bao gồm các peptide liên quan đến pro-ACTH và CRH, nhưng dữ liệu không thuyết phục. Prolactin dường như là cần thiết. Hiện tại, hormone kích thích androgen thượng thận duy nhất được xác định ở giai đoạn sau sinh là ACTH. Bởi vì mô hình bài tiết của dậy thì thượng thận đại diện cho một sự thay đổi trong mô hình đáp ứng sinh steroid với ACTH, một yếu tố dậy thì thượng thận chỉ cần kiểm soát sự tăng trưởng và biệt hóa của các tế bào lớp lưới hoặc điều chỉnh mô hình biểu hiện enzyme sinh steroid độc đáo của chúng.
Tác động của ACTH lên sản xuất androgen thượng thận được điều chỉnh bởi các mạng lưới tín hiệu đa dạng. Các chất điều biến đáp ứng androgenic với ACTH bao gồm một đồng dạng kích thích của DENND1A (protein chứa miền DENN/MADD 1A; DENND1A.V2) được biết là biểu hiện quá mức trong các tế bào vỏ của hội chứng buồng trứng đa nang (PCOS), và BMP4, có tác dụng ức chế. Cortisol trong tuyến thượng thận có thể tham gia vào việc điều hòa bài tiết DHEA thượng thận thông qua việc ức chế hoạt động của 3β-hydroxysteroid dehydrogenase (3β-HSD). Ngoài ra, interleukin-6 được biểu hiện mạnh ở lớp lưới, nơi nó trực tiếp kích thích sản xuất tất cả các loại steroid thượng thận độc lập với ACTH. Mặc dù loạn sản tuyến sinh dục có liên quan đến dậy thì thượng thận sớm hơn, nghịch lý là, cắt bỏ buồng trứng lại gây ra sự suy giảm sớm nồng độ DHEAS mà không thể đảo ngược bằng liệu pháp thay thế estrogen.
Nồng độ androgen trong giai đoạn dậy thì thượng thận đủ để khởi đầu lần lượt sự phát triển của tuyến bã nhờn, sự phát triển của tuyến apocrine, và sự phát triển của lông mu. Sự sulfat hóa DHEA trong vỏ thượng thận ngăn ngừa cường androgen thượng thận, và DHEAS lưu hành là tiền chất cho sự hình thành testosterone của buồng trứng. Người ta đã đề xuất rằng sự tăng DHEAS để đáp ứng với béo phì có tác dụng bảo vệ lipid huyết tương. Liệu dậy thì thượng thận có đóng một vai trò cơ bản hơn trong dậy thì bình thường hay không vẫn chưa được xác định.
Đã có sự quan tâm đáng kể đến khả năng các steroid trong giai đoạn dậy thì thượng thận đóng một vai trò trong sự phát triển thần kinh sinh học của con người. Nồng độ DHEA và testosterone huyết thanh có tương quan khác biệt với các thay đổi phát triển cấu trúc cụ thể trong hệ thống vỏ-viền não. DHEAS và tiền chất của nó, pregnenolone sulfate, cũng như chất chuyển hóa progesterone allopregnanolone, có các tác động thần kinh trực tiếp không qua gen, bao gồm điều chỉnh tín hiệu dẫn truyền thần kinh và tính dẻo thần kinh. Các steroid sulfate này được vận chuyển tích cực qua hàng rào máu não. Sự liên quan của những thay đổi trong giai đoạn dậy thì thượng thận với sự xuất hiện của sự hấp dẫn tình dục lưỡng hình giới tính, hành vi thích ứng với căng thẳng và trưởng thành xã hội trong giai đoạn giữa thời thơ ấu, trước dậy thì thực sự, đã dẫn đến gợi ý rằng các steroid trong giai đoạn dậy thì thượng thận đóng một vai trò trong việc kích hoạt các hành vi này. Nhiều chức năng được cho là của DHEAS không nhất quán, và liệu chúng có khác với các chức năng của testosterone liều thấp hay không vẫn cần được xác định.
Bài tiết, Vận chuyển, Chuyển hóa và Tác động của Hormone
Hormone Peptide
Các hormone peptide hoạt động sau khi gắn vào các thụ thể đặc hiệu nằm ở màng huyết tương của các tế bào đích. Thụ thể GnRH và thụ thể gonadotropin là thành viên của họ thụ thể 7-lần-xuyên-màng. Các thụ thể này cần thiết cho hoạt động của các hormone tương ứng. Các thụ thể được biểu hiện ở các vị trí không cổ điển không nhất thiết phải trưởng thành về mặt chức năng. Các thụ thể trưởng thành truyền tín hiệu sau khi kết hợp với một tiểu đơn vị guanine nucleotide (protein-G) (Hình 16.21). Tín hiệu Gs kích hoạt adenylate cyclase và hoạt động thông qua cAMP được điều hòa bởi phosphodiesterase để kích hoạt protein kinase A. Tín hiệu Gq kích hoạt phospholipase C, hoạt động thông qua protein kinase C và Ca2+; Ca2+ cũng có thể được huy động bởi các yếu tố khác ảnh hưởng đến các kênh ion. Sự phosphoryl hóa các protein tế bào chất và nhân khác nhau cuối cùng làm trung gian cho hoạt động của các hormone peptide, và thứ hai liên quan đến các dòng tín hiệu RAS và EGF trong trường hợp của gonadotropin. Sự đa dạng trong các đáp ứng của các tế bào đích đối với hoạt động của protein kinase một phần liên quan đến sự đa dạng và loại kinase, sự phân ngăn trong tế bào, sự sẵn có của cơ chất, và các khác biệt khác trong biểu hiện gen đặc hiệu cho mỗi loại tế bào đích.
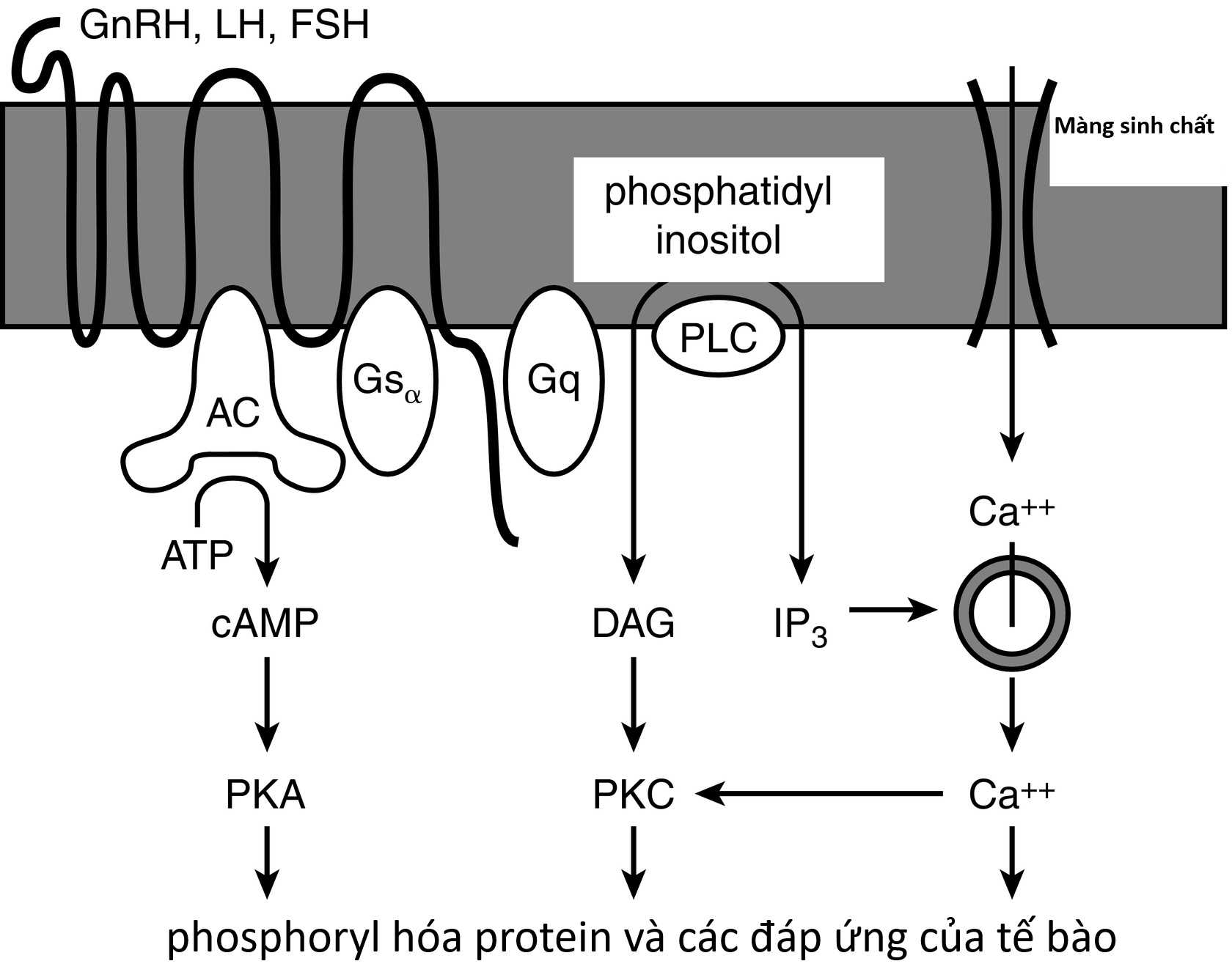
Hình 16.21 Tổng quan về các con đường đã được thiết lập để trung gian cho hoạt động của hormone giải phóng gonadotropin (GnRH) và gonadotropin. Các thụ thể cho các hormone này là thành viên của họ thụ thể bảy-lần-xuyên-màng. Sự gắn kết hormone-thụ thể làm thay đổi cấu hình của thụ thể. Một hệ quả là kết hợp thụ thể với adenylate cyclase (AC) thông qua tiểu đơn vị alpha kích thích của protein-G (GSα). Điều này cho phép tạo ra hiệu quả cyclic adenosine monophosphate (cAMP) từ adenosine triphosphate (ATP). Một hệ quả khác là kết hợp phospholipase C (PLC) với thụ thể thông qua Gq. PLC là một phosphodiesterase thủy phân phosphatidyl inositol thành diacylglycerol (DAG) và inositol-1,4,5-triphosphate (IP3). DAG kích thích protein kinase C (PKC) nhạy cảm với canxi. IP3 huy động canxi ion (Ca2+) từ các bào quan nội bào và kích thích dòng Ca2+ vào qua các kênh ion canxi. Protein kinase A (PKA), PKC, và Ca2+ sau đó mang lại các đáp ứng tế bào thông qua các quá trình phosphoryl hóa protein. FSH, Hormone kích thích nang trứng; LH, hormone tạo hoàng thể.
GnRH là một decapeptide [pyro]Glu-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2. Một gen mã hóa cho protein tiền chất duy nhất cho cả GnRH và yếu tố ức chế giải phóng prolactin. GnRH không chỉ có tác dụng giải phóng nhanh chóng các gonadotropin đã được hình thành sẵn (“pool dễ giải phóng”), mà còn kích thích sự tổng hợp gonadotropin (“pool dự trữ”). Việc sử dụng lặp lại GnRH làm tăng đáp ứng của tuyến yên đối với các xung GnRH tiếp theo (“tự mồi”). Điều này một phần được cho là do sự điều hòa tăng của các thụ thể GnRH. GnRH có một tác dụng nghịch lý quan trọng. Như đã thảo luận trước đây, nó kích thích bài tiết gonadotropin một cách cấp tính, nhưng, khi sử dụng kéo dài, liên tục, nó lại điều hòa giảm bài tiết gonadotropin của tuyến yên. Tầm quan trọng của sự biểu hiện của GnRH và thụ thể của nó trong các mô sinh sản không thuộc vùng dưới đồi vẫn chưa rõ ràng.
Một dạng GnRH được bảo tồn về mặt tiến hóa (GnRH-II) hoạt động chủ yếu thông qua thụ thể GnRH loại 2; GnRH-II và thụ thể GnRH loại 2 là sản phẩm của các gen độc nhất, thay vì là các sản phẩm biến đổi của gen GnRH hoặc thụ thể GnRH loại 1. Thân tế bào của các tế bào thần kinh GnRH-II nằm chủ yếu ở não giữa và chỉ một thiểu số chiếu đến khu vực dưới đồi-tuyến yên. Chức năng của GnRH-II ở người chưa được biết; có giả thuyết cho rằng nó là một chất dẫn truyền thần kinh liên quan đến hành vi tình dục. Một nghiên cứu gần đây sử dụng hình ảnh thần kinh chức năng đã chứng minh rằng việc sử dụng kisspeptin đã tăng cường hoạt động não bộ ở vùng viền để đáp ứng với các kích thích tình dục và gắn kết cặp đôi và làm giảm tâm trạng tiêu cực. Liệu kisspeptin có thể trở thành một tác nhân điều trị cho bệnh nhân bị rối loạn chức năng sinh sản hay không hiện vẫn chưa rõ ràng.
LH và FSH được tổng hợp trong một loại tế bào duy nhất, và cả hai đôi khi được xác định trong cùng một tế bào. Một quần thể tế bào tuyến yên tiết hCG còn sót lại đã được mô tả. LH, FSH, và hCG là các hormone glycoprotein bao gồm hai chuỗi. Sau khi tổng hợp các hormone này trên ribosome, các phần carbohydrate, chiếm khoảng 16% trọng lượng, được thêm vào trong lưới nội chất hạt và bộ máy Golgi. Chuỗi α của LH, FSH, hCG, và hormone kích thích tuyến giáp (TSH) giống hệt nhau về trình tự axit amin (92 axit amin). Mặc dù chuỗi β của mỗi hormone khác nhau cả về trình tự axit amin chính và chiều dài, các chuỗi β này vẫn có 30% đến 80% tương đồng axit amin. Hoạt tính sinh học được tạo ra khi một chuỗi α và β được glycosyl hóa và lắp ráp trong tế bào. Dimer α/β được ổn định bởi một “dây an toàn” có nguồn gốc từ tiểu đơn vị β quấn quanh tiểu đơn vị α. Cả tiểu đơn vị protein α hay β đã được glycosyl hóa riêng lẻ đều không thể hiện hoạt tính sinh học trừ khi được gắn kết không cộng hóa trị với nhau.
Các gonadotropin thể hiện sự không đồng nhất phân tử đáng kể. Cơ sở chính cho điều này là sự biến đổi về mức độ tương đối của sự sialyl hóa hoặc sulfon hóa glycosyl, các bước xảy ra tương hỗ trong tuyến yên. Những khác biệt này ảnh hưởng đến hoạt tính sinh học trong ống nghiệm và trong cơ thể sống. Các đa hình trong trình tự axit amin của gen LH-β và hCG-β cũng có thể ảnh hưởng đến sự biểu hiện hoặc hoạt tính sinh học của LH hoặc hCG. Tình trạng sinh sản ảnh hưởng đến sự phân bố đồng dạng, với các dạng sialyl hóa chiếm ưu thế trong trạng thái suy sinh dục. Androgen tăng và estrogen giảm hiệu lực sinh học của LH trong ống nghiệm bằng cách thay đổi sự sialyl hóa của LH. Do đó, tuyến yên chứa nhiều đồng dạng của LH và FSH khác nhau về hoạt tính sinh học. Do đó, các tiêu chuẩn LH và FSH tuyến yên khác nhau, cũng như huyết thanh, chứa các tỷ lệ biến đổi của vật liệu có hoạt tính miễn dịch với hoạt tính sinh học khác nhau.
Một hệ quả của sự không đồng nhất phân tử là các kháng thể được tạo ra từ các phần gonadotropin này phát hiện các epitope không đồng nhất không nhất thiết phải có hoạt tính sinh học; thực tế một số thậm chí có thể hoạt động như chất đối kháng gonadotropin. Những yếu tố này kết hợp lại gây ra sự thay đổi B/I của gonadotropin trong nhiều hoàn cảnh khác nhau. Các tiêu chuẩn tinh khiết nhất, ngay cả những tiêu chuẩn tái tổ hợp, tương tác rất khác nhau trong các hệ thống xét nghiệm miễn dịch đa dạng. Tương tự như vậy, mức độ giả định của LH hoặc FSH trong một mẫu huyết thanh khác nhau đáng kể giữa các xét nghiệm miễn dịch. Hơn nữa, các đánh giá hoạt tính sinh học thay đổi theo hệ thống mô hình xét nghiệm sinh học. Các xét nghiệm miễn dịch đo lường dựa trên kháng thể đơn dòng cho kết quả tương quan với, nhưng không nhất thiết phải tương đương với, kết quả của xét nghiệm sinh học. Các xét nghiệm miễn dịch đo lường “thế hệ thứ ba” có lợi thế là nhạy cảm và đặc hiệu hơn đối với nồng độ gonadotropin thấp trong huyết thanh so với RIA dựa trên kháng huyết thanh đa dòng, nhưng sự khác biệt B/I vẫn còn.
Yếu tố quyết định chính của hoạt tính sinh học gonadotropin trong cơ thể sống là thời gian bán hủy trong huyết thanh. Các gốc axit sialic ở đầu cuối làm chậm quá trình thanh thải bởi gan, nơi chuyển hóa chính, trong khi các gốc sulfon hóa lại tạo điều kiện thuận lợi cho việc thanh thải. Khoảng 10% đến 15% gonadotropin được bài tiết qua nước tiểu theo RIA; chỉ khoảng một phần ba trong số này ở dạng có hoạt tính sinh học.
LH được thanh thải khỏi máu nhanh hơn FSH hoặc hCG. LH biến mất khỏi máu theo một mô hình hàm số mũ: RIA chỉ ra rằng thời gian bán hủy của thành phần đầu tiên là khoảng 20 phút và của thành phần thứ hai là khoảng 4 giờ. Thời gian bán hủy của LH có hoạt tính sinh học ngắn hơn khoảng 25% đến 50%. Các thành phần tương ứng này đối với FSH có hoạt tính miễn dịch là 4 và 70 giờ; đối với hCG là 11 và 23 giờ. Tốc độ sản xuất hormone ở phụ nữ giai đoạn nang trứng, gần bằng giá trị giữa dậy thì, được đưa ra trong Bảng 16.2.
Bảng 16.2 Tốc độ sản xuất hormone trung bình trong máu ở phụ nữ giai đoạn giữa nang trứng. a
| Hormone | Tốc độ sản xuất |
|---|---|
| Hormone tạo hoàng thể | 615 IU/ngày b |
| Hormone kích thích nang trứng | 215 IU/ngày b |
| Androstenedione | 3.4 mg/ngày |
| Dehydroepiandrosterone | 7.0 mg/ngày |
| Dehydroepiandrosterone sulfate | 7.0 mg/ngày c |
| Dihydrotestosterone | 0.06 mg/ngày |
| Estradiol | 0.1 mg/ngày |
| Estrone | 0.1 mg/ngày |
| Progesterone | 1.1 mg/ngày |
| 17-Hydroxyprogesterone | 1.2 mg/ngày |
| Testosterone | 0.2 mg/ngày |
Prolactin có những điểm tương đồng về cấu trúc và chức năng với GH và lactogen nhau thai. Prolactin có mức độ không đồng nhất về cấu trúc đáng kể; điều này là kết quả của các sự kiện di truyền và sau dịch mã trong các tế bào tuyến yên, cũng như các biến đổi, chẳng hạn như glycosyl hóa ở ngoại vi. Sự tăng trưởng của tế bào lactotrope và bài tiết prolactin được kích thích bởi estrogen. Sự giải phóng prolactin từ thùy trước tuyến yên chủ yếu nằm dưới sự kiểm soát ức chế của vùng dưới đồi, có lẽ chủ yếu được trung gian bởi dopamine. Một yếu tố ức chế giải phóng prolactin đã được mô tả trong cùng một protein tiền chất với GnRH, do đó cung cấp một cơ chế tiềm năng cho sự kiểm soát tương hỗ của hai peptide này. Bài tiết prolactin cũng bị ức chế bởi thyroxine và đáp ứng trực tiếp với hormone giải phóng thyrotropin (TRH). Estrogen và việc cho con bú là những yếu tố kích thích. Những tín hiệu này có thể được trung gian tích cực bởi α-MSH.
Inhibin và activin là thành viên của siêu họ TGF-β và truyền tín hiệu tương ứng. Inhibin được phát hiện là kết quả của việc tìm kiếm hormone tuyến sinh dục không steroid có khả năng ức chế đặc hiệu FSH. Activin được phát hiện một cách tình cờ là hoạt động kích thích FSH trong các phân đoạn phụ trong các nghiên cứu này. Các hormone này được hình thành bởi sự dimer hóa liên kết disulfide khác biệt của hai trong ba tiểu đơn vị (α, βA, và βB), mỗi tiểu đơn vị được mã hóa bởi một gen riêng biệt. Sự kết hợp của một tiểu đơn vị α- và β- tạo ra các inhibin, inhibin-A (αβA) và inhibin-B (αβB). Activin là các dimer của các tiểu đơn vị β, βAβA, βBβB, và βAβB (activin-A, B, và AB). Inhibin đối kháng với tất cả các hoạt động đã biết của activin. Các gen cho cả ba tiểu đơn vị được biểu hiện khác nhau trong nhiều loại mô. Hơn nữa, các yếu tố này, đặc biệt là activin, đã được chứng minh là có tác động không chỉ lên các gonadotrope, mà còn trong các tế bào tuyến yên khác, tuyến sinh dục, và trong các mô đích không liên quan đến sinh dục.
Hormone Steroid
Buồng trứng và lớp lưới vỏ thượng thận chia sẻ phần cốt lõi của con đường sinh tổng hợp steroid (Hình 16.22). Cholesterol của tuyến sinh dục ở người dường như chủ yếu có nguồn gốc từ các este cholesterol của lipoprotein mật độ thấp. Hầu hết các bước sinh steroid được trung gian bởi các thành viên của họ cytochrome P450. Đây là các enzyme cuối cùng trong chuỗi truyền điện tử, bao gồm P450 oxidoreductase (POR) là chất cho điện tử liên quan lâm sàng cho tất cả trong lưới nội chất. Bước đầu tiên trong quá trình sinh tổng hợp tất cả các hormone steroid là sự chuyển đổi cholesterol thành pregnenolone. Đây là một quá trình hai giai đoạn. Tốc độ của quá trình phụ thuộc vào việc vận chuyển cholesterol từ màng ty thể ngoài vào màng ty thể trong bởi protein điều hòa cấp tính sinh steroid (StAR). Bản thân sự chuyển đổi được thực hiện bởi hoạt động phân cắt chuỗi bên cholesterol (scc) của cytochrome P450scc. Các bước tiếp theo là bước 3β-HSD hoặc 17α-hydroxyl hóa. 3β-HSD chuyển đổi các △5-3β-hydroxysteroid thành các steroid có cấu hình △4-3-keto (ví dụ, pregnenolone thành progesterone, 17-hydroxypregnenolone thành 17-OHP, và DHEA thành androstenedione). Bước này là bắt buộc đối với quá trình tổng hợp tất cả các hormone steroid mạnh. Đồng enzyme 3β-HSD loại 2 chiếm phần lớn hoạt động 3β trong buồng trứng và tuyến thượng thận của con người; đồng enzyme loại 1 chiếm hoạt động 3β-HSD ở gan và da. Pregnenolone có thể trải qua một quá trình chuyển đổi hai bước thành 17-KS DHEA dọc theo con đường △5-steroid: quá trình chuyển đổi này được thực hiện thông qua cytochrome P450c17. P450c17 là một enzyme duy nhất có hoạt động 17α-hydroxylase và 17,20-lyase, hoạt động sau kém hiệu quả hơn và phụ thuộc nghiêm ngặt vào việc truyền điện tử từ cytochrome b5. Progesterone trải qua một sự biến đổi song song thành androstenedione trong con đường Δ4-steroid: 17α-hydroxyl hóa progesterone bởi P450c17 tạo thành 17-hydroxyprogesterone, nhưng ở người, P450c17 không sử dụng hiệu quả 17-hydroxyprogesterone làm cơ chất cho hoạt động 17,20-lyase, do đó P450c17 dường như tạo ra rất ít hoặc không tạo ra androstenedione. Có một số bằng chứng về sự tồn tại của một con đường Δ4 độc lập với P450c17 đến androstenedione, nhưng hầu hết dường như được hình thành từ DHEA bởi hoạt động của 3β-HSD. Sulfotransferase 2A1 được biểu hiện độc nhất trong lớp lưới vỏ thượng thận và đòi hỏi đồng yếu tố 3′-phosphoadenosine-5′-phosphosulfate synthase loại 2. Các sulfotransferase khác (ví dụ, để hình thành estrone sulfate) và steroid sulfatase (cho phản ứng ngược lại) được biểu hiện rộng rãi.
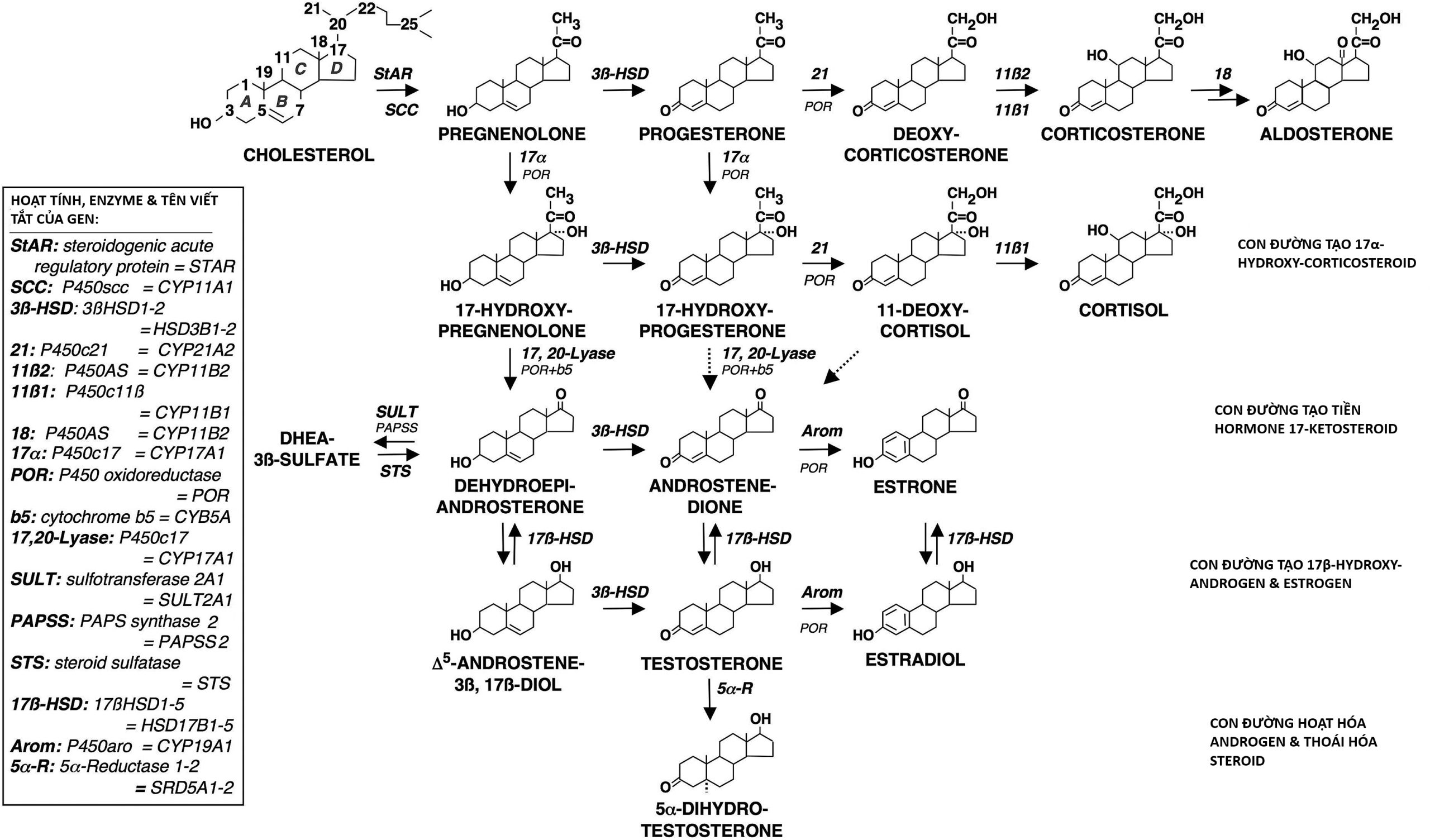
Hình 16.22. Các con đường chính của quá trình sinh tổng hợp hormone steroid từ cholesterol. Các nguyên tử carbon của cholesterol được chỉ định bằng các số thông thường và các vòng bằng các chữ cái thông thường. Dòng chảy của quá trình sinh hormone thường đi xuống và sang phải. Hàng trên cùng cho thấy con đường đến progesterone và mineralocorticoid, hàng thứ hai là con đường đến glucocorticoid, hàng thứ ba là các tiền hormone 17-ketosteroid, hàng thứ tư là các 17β-hydroxysteroid mạnh, và hàng dưới cùng là sự kích hoạt androgen. Các enzyme sinh steroid được in nghiêng. Các chữ viết tắt cho các enzyme bao gồm các hoạt động của enzyme cytochrome P450 sau: phân cắt chuỗi bên cholesterol (scc); 17α-hydroxylase (17α); 21-hydroxylase (21); 11β-hydroxylase (11β1); aldosterone synthase (11β2, 18-hydroxylase/oxidase); aromatase (Arom). Các chữ viết tắt hoạt động của enzyme không phải P450 bao gồm Δ5-isomerase-3β-hydroxysteroid dehydrogenase (3β) và 17β-hydroxysteroid dehydrogenase (17β-HSD). Các enzyme truyền điện tử liên quan lâm sàng bao gồm P450 oxidoreductase (POR), cytochrome b5 (b5), và 3’-phosphoadenosine-5’-phosphosulfate synthase loại 2 (PAPSS).(Chỉnh sửa từ Rosenfield, R.L., Lucky, A.W., Allen, T.D. (1980). The diagnosis and management of intersex. Curr Prob in Pediatr, 10, 1.)
Các hoạt động 17β-Hydroxysteroid dehydrogenase (17β-HSD) và aromatase là cần thiết cho sự hình thành các steroid sinh dục mạnh. Trong buồng trứng, androstenedione là tiền chất chính cho các steroid sinh dục. Sự chuyển đổi 17-KS thành 17β-hydroxysteroid bởi 17β-HSD là cần thiết cho sự hình thành cả androgen và estrogen: testosterone được hình thành trong buồng trứng bởi 17β-HSD loại 5 (còn được gọi là aldoketoreductase, AKR,1C3), trong khi sự hình thành estradiol đòi hỏi 17β-HSD loại 1. Hoạt động của aromatase, được thực hiện bởi P450arom, là cần thiết cho sự hình thành estradiol. Các promoter thay thế được sử dụng bởi gen P450arom trong tuyến sinh dục, nhau thai, và mô mỡ, tạo ra các dạng aromatase được nối xen kẽ. Sự tổ chức và điều hòa sinh steroid trong nang trứng đang phát triển được mô tả trong Hình 16.19.
Buồng trứng thường chiếm khoảng 25% bài tiết testosterone ở nữ giới trưởng thành (0.06 mg mỗi ngày), nhưng nó bài tiết androstenedione nhiều hơn khoảng 30 lần (1.6 mg mỗi ngày). Những lượng này tương tự như lượng được bài tiết bởi tuyến thượng thận. Tuy nhiên, buồng trứng bài tiết DHEA ít hơn 1/10 so với tuyến thượng thận.
“Tốc độ sản xuất” của một hormone bằng tốc độ bài tiết của nó cộng với (trong trường hợp các hormone được hình thành bên ngoài các tuyến nội tiết) tốc độ hình thành hormone bằng cách chuyển đổi ngoại vi của các tiền chất được bài tiết. “Tốc độ sản xuất trong máu” được tính bằng tốc độ thanh thải chuyển hóa X nồng độ trong huyết thanh; ở trạng thái ổn định, lượng hormone rời khỏi khoang huyết tương một cách không thể đảo ngược bằng lượng đi vào nó. Do sự chuyển đổi qua lại rộng rãi của steroid, lượng các hormone này được bài tiết qua nước tiểu không nhất thiết phản ánh lượng đến các mô đích. Ví dụ, một phần lớn testosterone glucuronide trong nước tiểu được hình thành trực tiếp từ androstenedione bằng cách chuyển hóa theo khoang trong gan đến mức phạm vi bài tiết testosterone qua nước tiểu ở phụ nữ chồng lấn với ở nam giới (Hình 16.23). Estrone sulfate, giống như DHEAS trong con đường androgen, tạo thành một kho dự trữ tuần hoàn của estrogen không hoạt động có thể được trả lại vào pool hoạt động bởi hoạt động sulfatase của gan. Tốc độ sản xuất trong máu của các hormone steroid đại diện được đưa ra trong Bảng 16.2 và được hiển thị cho estrogen trong Hình 16.24. Trong giai đoạn hoàng thể của chu kỳ kinh nguyệt, sản xuất estradiol tăng gấp đôi và sản xuất progesterone tăng 16 lần hoặc hơn.
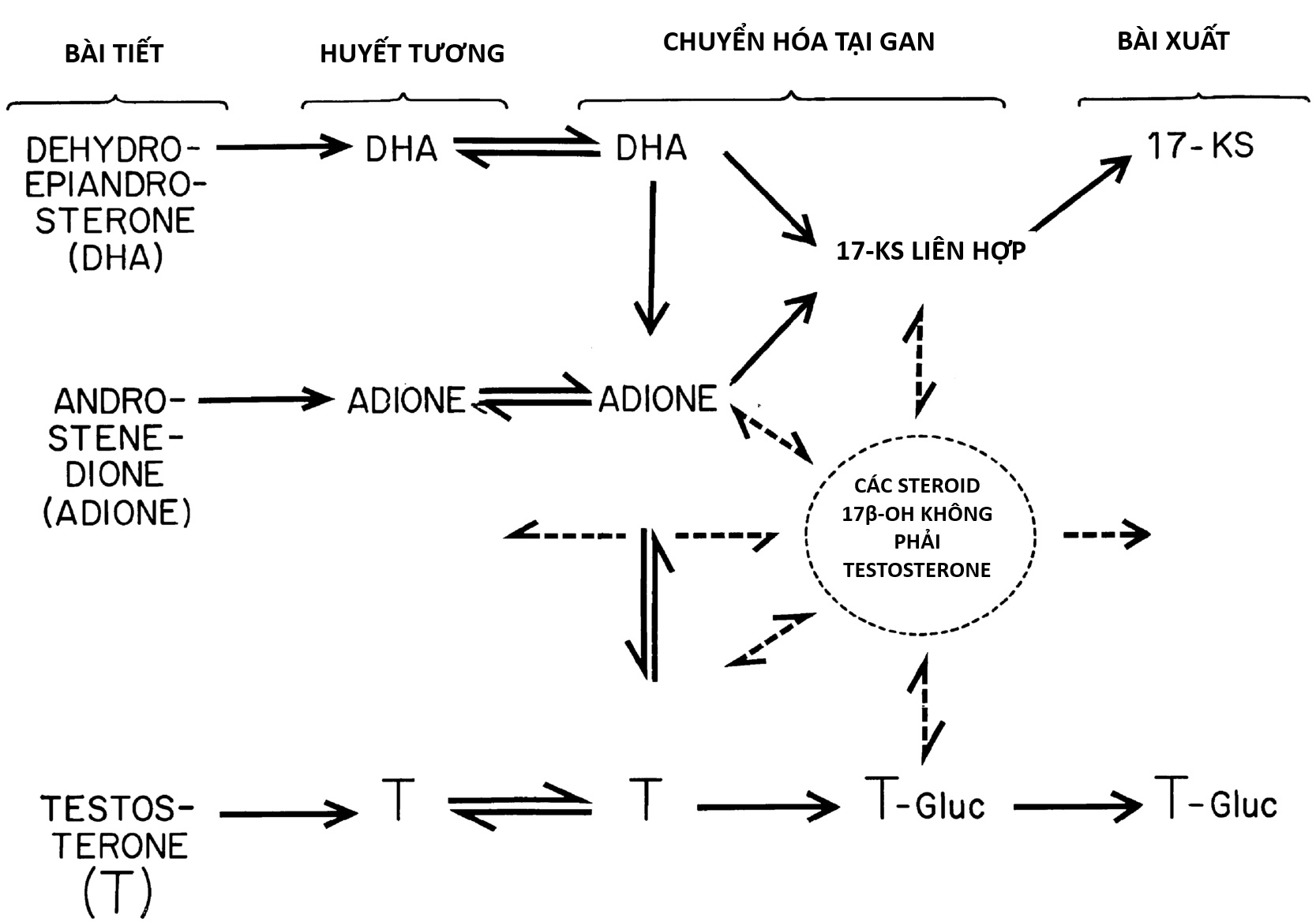
Hình 16.23. Sơ đồ minh họa mối quan hệ giữa các steroid được bài tiết, trong huyết tương và trong nước tiểu. Sự bài tiết 17-Ketosteroid (17-KS) không phản ánh chính xác sự bài tiết của các androgen huyết tương quan trọng nhất. Chỉ có 25% hoặc ít hơn testosterone được bài tiết dưới dạng các chất chuyển hóa 17-KS. Do đó, những thay đổi quan trọng trong sản xuất testosterone có thể không ảnh hưởng đáng kể đến sự bài tiết 7-KS qua nước tiểu. Hơn nữa, ngay cả 17-KS chính (DHA-sulfate) cũng được bài tiết kém cho đến khi tốc độ sản xuất của nó trở nên khá cao. Mặt khác, khoảng một nửa 17-KS không được xác định bằng xét nghiệm đo màu tiêu chuẩn và 2 mg 17-KS mỗi ngày ở người lớn là kết quả của quá trình chuyển hóa hydrocortisone. Ngoài ra, sự bài tiết testosterone glucuronide không phản ánh chính xác nồng độ testosterone trong huyết tương: ít hơn 2% testosterone xuất hiện trong nước tiểu dưới dạng đó. Hơn nữa, 17-KS androstenedione trong huyết tương có thể được chuyển đổi thành testosterone glucuronide mà không bao giờ lưu thông dưới dạng testosterone không liên hợp. (Từ Rosenfield, R.L. (1973). Relationship of androgens to female hirsutism and infertility. J Reprod Med, 11, 87.)
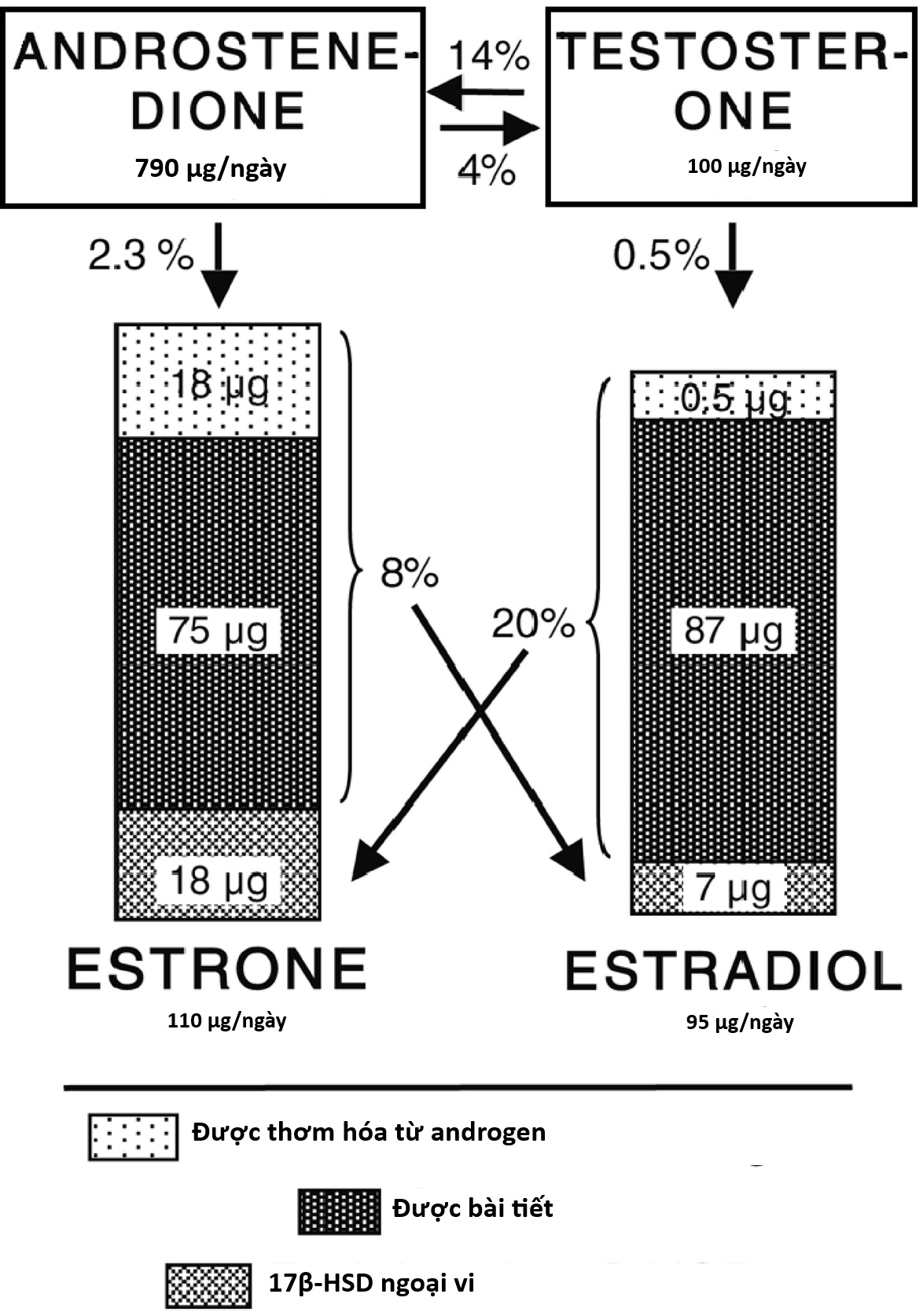
Hình 16.24. Nguồn gốc của estrone và estradiol trong máu của phụ nữ tiền mãn kinh trong giai đoạn nang trứng. Estrogen có nguồn gốc từ sự bài tiết trực tiếp của tuyến sinh dục, sự thơm hóa androgen, hoặc sự chuyển đổi của một tiền chất estrogen bởi các hoạt động 17β-hydroxysteroid dehydrogenase (17β-HSD). Tỷ lệ phần trăm cơ chất được chuyển đổi mỗi ngày và tổng sản lượng xấp xỉ tính bằng microgam mỗi ngày được ghi nhận cho mỗi nguồn.(Chỉnh sửa từ Alonso, L.C., và Rosenfield, R.L. (2002). Oestrogens and puberty. Best Pract Res Clin Endocrinol Metab, 16, 13.)
Các hormone sinh dục cũng có nguồn gốc từ môi trường. Các estrogen sinh học có cấu trúc khác biệt bao gồm estrogen ngựa và phytoestrogen có nguồn gốc thực vật. Các estrogen tổng hợp bao gồm các hợp chất dược lý, chẳng hạn như ethinyl estradiol, diethylstilbestrol, các chất điều biến thụ thể ER chọn lọc (SERM), và một số hóa chất công nghiệp, chẳng hạn như organochlorine (p,p”-dichlorodiphenyltrichloroethane [DDT] và các chất khác) và các chất làm dẻo (như bisphenol A và phthalate). Các hóa chất gây rối loạn nội tiết (EDC) can thiệp vào bất kỳ khía cạnh nào của hoạt động hormone, với các cơ chế bao gồm bắt chước hoặc ngăn chặn tín hiệu hormone thông qua thụ thể của nó, và điều chỉnh sự tổng hợp, giải phóng, vận chuyển, chuyển hóa, liên kết hoặc loại bỏ các hormone tự nhiên. Do đó, các hợp chất này có thể ảnh hưởng đến sự phát triển của đường sinh sản và chức năng của trục sinh sản. Các nghiên cứu trên động vật đã chỉ ra rằng EDC có thể làm suy yếu sự phát triển của buồng trứng, ức chế sự phát triển của nang trứng, tăng sự thoái hóa nang trứng và phá vỡ nồng độ hormone steroid.
Sự chuyển đổi ngoại vi của các tiền hormone được bài tiết bởi các cơ quan không phải nội tiết chiếm một phần lớn trong sản xuất hormone sinh dục. Buồng trứng và vỏ thượng thận là nguồn cung cấp tiền hormone, cũng như các hormone được bài tiết. Khoảng 50% testosterone huyết thanh (0.1 mg mỗi ngày) thường được hình thành gián tiếp bằng cách chuyển đổi ngoại vi. Mặc dù 85% sản xuất estrogen bình thường ở phụ nữ phát sinh do bài tiết vào giữa chu kỳ, 50% sản xuất estrogen có thể phát sinh từ các nguồn ngoài tuyến trong các giai đoạn estrogen thấp của chu kỳ kinh nguyệt. Sự hình thành ngoại vi của các steroid hoạt động xảy ra ở nhiều vị trí, bao gồm gan, mỡ, và các cơ quan đích. Ví dụ, gan có nồng độ cao các hoạt động 3α- 3β-, và 17β-hydroxysteroid dehydrogenase và 5α-reductase (xem Hình 16.22).
Chuyển hóa androgen ngoại vi không được điều hòa chặt chẽ bởi hệ thống thần kinh-nội tiết. Dường như nó được quyết định ở một mức độ nào đó bởi môi trường androgen chu sinh, tác động của nó có thể được trung gian bởi GH. Sau khi sinh, nó bị ảnh hưởng bởi nồng độ globulin gắn hormone sinh dục (SHBG) và tình trạng dinh dưỡng. Mô mỡ trở thành một vị trí chính của sự chuyển đổi androstenedione thành cả estrone và testosterone ở người béo phì. Các oxidase chức năng hỗn hợp cytochrome P450, quan trọng nhất trong số đó là CYP3A4, ảnh hưởng đến hiệu lực của steroid bằng cách hình thành các chất chuyển hóa steroid hydroxyl hóa có hiệu lực khác nhau. Chúng có thể bị cảm ứng hoặc ức chế bởi nhiều loại thuốc. Phytoestrogen làm tăng khả dụng sinh học của estradiol bằng cách ức chế sulfotransferase ở gan.
Các steroid huyết tương dường như đến các vị trí hoạt động và chuyển hóa của chúng bằng cách khuếch tán đơn giản từ khoang mạch máu. Phần có hoạt tính sinh học của testosterone huyết thanh dường như là testosterone tự do và một phần của testosterone gắn với albumin khác nhau giữa các mô tùy theo đặc điểm khuếch tán của giường mạch máu. Khoảng 98% testosterone và estradiol huyết thanh được gắn với albumin và SHBG. Nồng độ SHBG quyết định phần testosterone và các phối tử khác trong huyết thanh (ví dụ, estradiol, DHT) là tự do hoặc gắn với albumin. Nó cũng là một yếu tố quyết định chính của việc phối tử thoát ra khỏi huyết tương (Hình 16.25). Một số tác động của steroid sinh dục có thể được trung gian bởi sự gắn kết của SHBG với các thụ thể màng và sự kích hoạt của adenylate cyclase. Một số trạng thái sinh lý và bệnh lý ảnh hưởng đến nồng độ SHBG. Nó được tăng lên bởi estrogen và dư thừa hormone tuyến giáp; nó bị giảm bởi androgen, béo phì kháng insulin, glucocorticoid, GH, và các cytokine gây viêm.
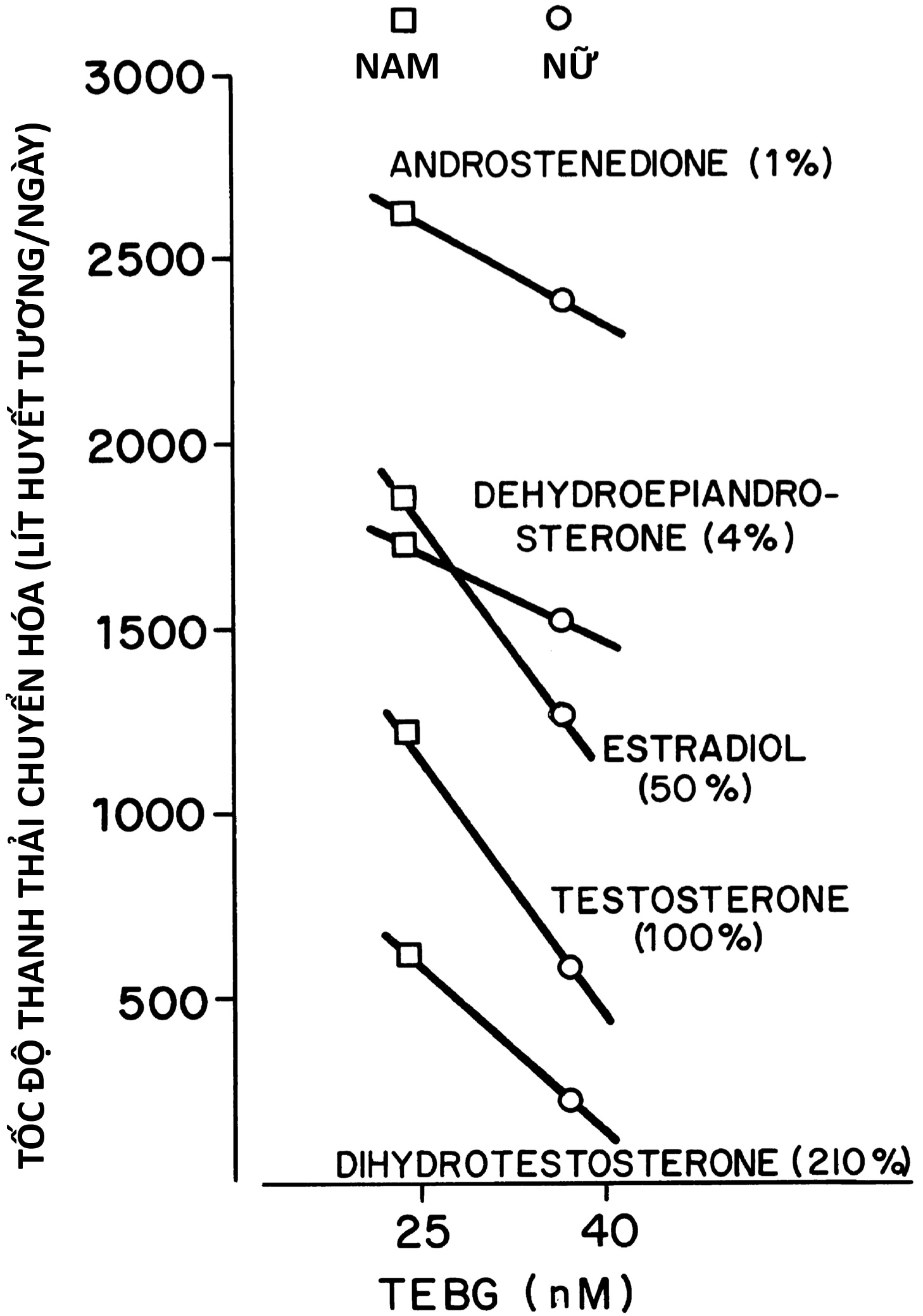
Hình 16.25 Mối quan hệ giữa tốc độ thanh thải chuyển hóa (MCR) và sự gắn kết của các hormone sinh dục với globulin gắn hormone sinh dục (SHBG = globulin gắn testosterone-estradiol [TEBG]). MCR của mỗi steroid đã được liên hệ với nồng độ SHBG trung bình của nam và nữ. Ái lực gần đúng của mỗi steroid đối với SHBG so với testosterone được chỉ định trong ngoặc đơn. (Từ Rosenfield, R.L. (1975). Studies of the relation of plasma androgen levels to androgen action in women. J Steroid Biochem, 6, 695.)
Sự chuyển hóa ở tế bào đích ảnh hưởng đến đáp ứng của tế bào đối với các hormone steroid đến nó (Hình 16.26). Sự chuyển đổi nội bào của testosterone thành DHT bởi một trong hai đồng enzyme của 5α-reductase là quan trọng đối với nhiều nhưng không phải tất cả các tác động của testosterone, phụ thuộc vào mô hình chuyển hóa steroid đặc hiệu của mô. Một phương thức hoạt động quan trọng của testosterone là thông qua estradiol, đáng chú ý là trong não. Mặc dù sự biến đổi không phải là cơ bản đối với phương thức hoạt động của estradiol, hiệu quả của estradiol bị ảnh hưởng bởi sự chuyển hóa ở tế bào đích: sự cảm ứng của quá trình oxy hóa 17β-hydroxysteroid trong các mô đích bởi progesterone, dẫn đến sự chuyển đổi estradiol thành estrogen kém hiệu lực hơn là estrone, làm cân bằng lại quá trình estrogen hóa. Cũng có bằng chứng cho thấy các chất chuyển hóa steroid mới có tác động đặc hiệu theo mô.
Hình 16.26Mô hình cơ chế hoạt động của androgen nhấn mạnh ảnh hưởng của quá trình chuyển hóa steroid trong một tế bào đích đối với phương thức hoạt động. Mũi tên liền chỉ ra các con đường chuyển hóa steroid từ các tiền chất 17-ketosteroid như được trình bày trong Hình 14.23. Mũi tên đứt nét chỉ ra sự vận chuyển. Mô hình chuyển hóa steroid C19 nội bào đặc hiệu của tế bào quyết định sự sẵn có tương đối của testosterone hoặc dihydrotestosterone (DHT) đối với thụ thể trong bào tương để chuyển vị vào nhân. Trong các tế bào, chẳng hạn như tế bào hạt của chuột, trong đó hoạt động Δ5,3β-hydroxysteroid dehydrogenase cao, androstenediol (Δ5-diol) có hiệu lực như testosterone. Tuyến bã nhờn của người có mô hình chuyển hóa steroid tương tự. A, androstenedione; AD, androstanedione; A’DIOLS, androstanediols; ANDRO, androsterone; DHA, dehydroepiandrosterone. E2, estradiol; T, testosterone.(Từ Nimrod, A., Rosenfield, R.L., Otto, P. (1980). Relationship of androgen action to androgen metabolism in isolated rat granulosa cells. J Steroid Biochem, 13, 1015. Với sự cho phép của Elsevier Science.)
Bên trong các tế bào đích, tất cả các hormone steroid điều chỉnh bộ gen một cách tương tự, bắt đầu bằng việc gắn vào các thụ thể nội bào có ái lực cao (Hình 16.27). Các thụ thể hormone steroid thuộc siêu họ thụ thể hormone hạt nhân. Do đó, các thụ thể estrogen, progesterone, và androgen là tương đồng. Các tác động cổ điển của hormone sinh dục được tạo ra bởi sự tương tác của steroid với thụ thể, chứ không phải bởi một mình cái nào. Sự gắn kết của steroid kích hoạt sự phân ly của các protein sốc nhiệt chaperon ức chế khỏi thụ thể. Phức hợp thụ thể-phối tử hoạt động sau đó trải qua quá trình dimer hóa không cộng hóa trị và gắn vào yếu tố đáp ứng hormone đặc hiệu của nó trên gen. Phức hợp steroid-thụ thể gắn deoxyribonucleic acid (DNA) hoạt động như một chất điều chỉnh phiên mã của promoter gen đích. Độ nhạy cảm với steroid cũng được điều chỉnh bởi các protein chaperon phân tử ảnh hưởng đến cấu hình thụ thể, vận chuyển nội bào, và vòng đời của thụ thể, tất cả đều là các yếu tố quyết định hoạt động của steroid.
Hình 16.27. Một mô hình cho cơ chế hoạt động của estrogen (E) nhấn mạnh vai trò của sự tương tác của thụ thể estrogen với chất đồng điều hòa thụ thể steroid (SRC) và tín hiệu phosphoryl hóa. Estrogen làm cho tiểu đơn vị 4S và các protein sốc nhiệt phân ly khỏi thụ thể estrogen chưa gắn phối tử. Sau đó, việc estrogen đi vào túi gắn kết gây ra một sự thay đổi cấu dạng trong thụ thể. Estrogen cũng kích thích sự phosphoryl hóa của SRC theo một mô hình cụ thể (Ps), có thể thông qua thụ thể estrogen gắn màng (ER) đã gắn phối tử như cách nó làm với một số yếu tố phiên mã, và tuyển dụng nó vào phức hợp deoxyribonucleic acid (DNA) steroid-thụ thể hạt nhân với yếu tố đáp ứng estrogen (ERE). SRC lần lượt tuyển dụng các chất đồng kích hoạt khác, chẳng hạn như protein gắn yếu tố đáp ứng cyclic adenosine monophosphate (cAMP) (CBP) và methyltransferase liên kết với chất đồng kích hoạt (CARM1) vào phức hợp gắn hormone. Toàn bộ phức hợp này sau đó tương tác với phức hợp khởi đầu protein gắn TATA (TBPc) để khởi đầu phiên mã gen đặc hiệu cho estrogen. Tác động estrogen qua gen được điều chỉnh bởi các tác động của các tín hiệu môi trường lên các yếu tố phiên mã đặc hiệu của tế bào khác (TF), một số trong đó liên quan đến các phức hợp SRC được phosphoryl hóa khác biệt (TFc) trong việc kích hoạt gen, một số khác liên quan đến ER không phụ thuộc phối tử. Các đường chấm chấm chỉ ra các con đường kinase đa dạng. Quá trình tái chế ER không được hiển thị.(Từ Katzenellenbogen, B.S., Montano, M.M., Ediger, T.R., et al. (2000). Estrogen receptors: selective ligands, partners, and distinctive pharmacology. Recent Prog Horm Res, 55, 163–193; O’Malley, B.W. (2005). A life-long search for the molecular pathways of steroid hormone action. Mol Endocrinol, 19, 1402–1411; McDevitt, M.A., Glidewell-Kenney, C., Jimenez, M.A., et al. (2008). New insights into the classical and nonclassical actions of estrogen: evidence from estrogen receptor knock-out and knock-in mice. Mol Cell Endocrinol, 290, 24–30.)
Các đặc tính gắn kết của steroid với các thụ thể tương ứng của chúng là những yếu tố quyết định ban đầu của hoạt động steroid cổ điển. Tính chọn lọc dựa trên phối tử là một yếu tố của sự tương tác này. Estradiol là một estrogen mạnh hơn estrone và estriol một phần vì nó gắn tốt nhất với miền gắn steroid của ER. DHT là một androgen mạnh hơn testosterone một cách tự nhiên chủ yếu do hằng số tốc độ kết hợp cao hơn và hằng số tốc độ phân ly thấp hơn của nó.
Các chất kháng estrogen tamoxifen và clomiphene và các chất kháng androgen cyproterone acetate và spironolactone ức chế cạnh tranh các phối tử hoạt động khỏi việc gắn vào các vị trí thụ thể đặc hiệu của chúng bằng cách chiếm các vị trí thụ thể một cách yếu và thoáng qua. Những khác biệt này là kết quả của việc các chất chủ vận mạnh vừa khít vào túi gắn kết, gây ra một cấu dạng thụ thể khác với cấu dạng của thụ thể gắn chất đối kháng. Một thay đổi như vậy là đuôi C-cuối của thụ thể lật qua để đóng “cửa” khi một chất chủ vận mạnh đi vào; điều này đồng thời cung cấp một bề mặt bên ngoài khác để tương tác với các protein đồng điều hòa.
Do đó, tính chọn lọc dựa trên phối tử phát sinh không chỉ vì sự gắn kết phối tử chặt chẽ hơn, mà còn vì các phối tử thay thế tạo ra cả những thay đổi cấu dạng trung gian và độc đáo trong thụ thể, từ đó gây ra các tương tác thụ thể bị thay đổi với các protein đồng điều hòa dẫn đến một phổ các hoạt động. Do đó, steroid không chỉ đơn giản là bật các thụ thể; chúng gây ra các chức năng chọn lọc phụ thuộc vào bản chất của các chất đồng điều hòa được tuyển dụng vào phức hợp. Một phần, tính chọn lọc này phát sinh vì các miền khác nhau của các thụ thể này làm trung gian cho các chức năng khác nhau này. Ví dụ, miền chức năng kích hoạt (AF)-1 của ER làm trung gian cho các tương tác với protein kinase được kích hoạt bởi mitogen (MAP) và TGF-β3, trong khi miền AF-2 làm trung gian cho các tương tác với các protein đồng điều hòa. Các chất đồng kích hoạt, lần lượt, điều chỉnh sự nối xen kẽ, sự kích hoạt và kìm hãm gen (trong một số trường hợp thông qua các chức năng enzyme kép của chúng), sự thay đổi vòng đời của phức hợp thụ thể-đồng điều hòa qua trung gian ubiquitin-proteosome, và cũng quyết định các hoạt động đặc hiệu theo tế bào, dựa trên vị trí, như sẽ được thảo luận sau.
Tính chọn lọc dựa trên thụ thể là yếu tố thứ hai trong hoạt động của steroid. Hiện nay người ta biết có hai đồng dạng của mỗi thụ thể steroid sinh dục. Các dạng α và β của ER, mặc dù tương đồng, được mã hóa bởi các gen riêng biệt. Các dạng A và B của thụ thể progesterone và androgen tồn tại. Các dạng PR này phát sinh do sự phiên mã từ các promoter thay thế trong cùng một gen, trong khi các dạng của thụ thể androgen phát sinh từ sự biến đổi sau dịch mã của một RNA thông tin (m) duy nhất. Các đồng dạng này đã được chứng minh là biểu hiện một mô hình biểu hiện mô khác biệt và đáp ứng khác nhau với các chất đối kháng. Tương tác của một steroid với các dạng thụ thể khác nhau có thể điều chỉnh một số gen đích một cách khác biệt. Một vai trò của ERβ dường như là điều chỉnh hoạt động của ERα: ERα và ERβ có thể có các hoạt động đối nghịch tại các vị trí AP-1 và SP-1, và các nghiên cứu về hoạt động phiên mã trong mô xương và vú của chuột chỉ ra một tác dụng kìm hãm của ERβ đối với các đáp ứng với estradiol. Do đó, các mô đích khác nhau tiếp xúc với cùng một hormone có thể đáp ứng một cách chọn lọc do một tập hợp biểu hiện đồng dạng thụ thể riêng biệt. Một số ví dụ đáng chú ý. Mặc dù cả hai dạng ER đều được biểu hiện ở hầu hết các mô đích, dạng cổ điển của ER, ERα, đóng vai trò chính trong việc điều hòa các hoạt động của LH và estrogen đối với tử cung, vú, hành vi đặc trưng giới tính và xương. Trong buồng trứng chuột, các thí nghiệm loại bỏ gen cho thấy ERα được biểu hiện ở các tế bào vỏ, nơi nó ngăn ngừa sự dư thừa androgen để đáp ứng với LH. Ngược lại, ERβ chỉ được biểu hiện ở các tế bào hạt, nơi sự ức chế biểu hiện thụ thể androgen của nó là rất quan trọng để ngăn ngừa sự thoái hóa nang trứng sớm. Cả hai đều cần thiết cho sự sống còn của noãn bào và khả năng vỡ của các nang trứng tiền rụng trứng. Hơn nữa, việc mất cả hai gây ra sự biến đổi khác biệt của các tế bào hạt thành các tế bào giống Sertoli và cái chết hàng loạt của noãn bào. PR A đã được gắn phối tử là cần thiết cho sự rụng trứng và là chất đối kháng hiệu quả hơn đối với hoạt động của ER. Ngoài ra, sự biến đổi trình tự trong các yếu tố đáp ứng hormone góp phần vào sự điều hòa gen khác biệt.
Tính chọn lọc dựa trên vị trí tác động là một biến số thứ ba trong hoạt động của hormone sinh dục cổ điển. Nói cách khác, hiệu lực và đặc tính của một đáp ứng đối với một phức hợp phối tử-thụ thể không chỉ đơn giản là các thuộc tính vốn có của phức hợp. Thay vào đó, chúng phụ thuộc vào tập hợp các phân tử tác động có mặt tại vị trí hoạt động. Do đó, tập hợp các gen được biểu hiện tại chỗ và mức độ biểu hiện tương đối của các chất đồng điều hòa (chất đồng kích hoạt và chất đồng kìm hãm) là cực kỳ quan trọng trong việc xác định các đáp ứng thích hợp và theo cấp độ đối với một phối tử bởi một tế bào đích. Sự dị dimer hóa của ER với các thụ thể hạt nhân khác có thể điều chỉnh hoạt động của nó. Androgen dường như có một số tác động qua gen của chúng bằng cách tạo phức trực tiếp với các yếu tố phiên mã khác ngoài thụ thể androgen. Cả estrogen và androgen dường như có tác động chống apoptosis trong các nguyên bào xương và tế bào xương bằng cách kích hoạt một con đường tín hiệu qua trung gian kinase phụ thuộc phối tử, nhưng không qua gen.
Các chất đồng kích hoạt thụ thể hạt nhân rất quan trọng trong việc cảm nhận các tín hiệu môi trường đặc hiệu của tế bào và để phối hợp các tín hiệu phát ra từ các thụ thể màng với hoạt động của thụ thể hạt nhân. Các thụ thể bề mặt gửi tín hiệu thông qua các con đường kinase dẫn đến các mô hình phosphoryl hóa serine/threonine đặc hiệu của các chất đồng kích hoạt. Các mô hình phosphoryl hóa này đóng vai trò như một mã để chất đồng kích hoạt ưu tiên gắn kết và kích hoạt các tập hợp riêng biệt của các yếu tố phiên mã hạ nguồn (xem Hình 16.27). Sự biểu hiện quá mức của chất đồng kích hoạt thụ thể steroid-3 (SRC-3) cũng quan trọng trong cơ chế bệnh sinh của một số bệnh ung thư vú như là tính dương tính của ER.
Tác động của một phức hợp phối tử-ER nhất định thường khác với tác động của phức hợp estradiol (E2)-ER giữa các loại tế bào. Đây là cơ sở cho sự phát triển của SERM: các hợp chất này có tác động theo cách đặc hiệu của mô tùy thuộc vào bối cảnh tế bào. Cấu trúc hóa học của một SERM—hay bất kỳ phối tử ER nào, nói cho cùng—quyết định cấu hình của ER, dẫn đến một phổ các hoạt động từ chất chủ vận đến chất đối kháng, tùy thuộc vào chất đồng điều hòa nào có sẵn để tuyển dụng trong tế bào đích. Raloxifene là một chất chủ vận estradiol trong xương và sụn tăng trưởng nhưng lại có tác dụng kháng estrogen trong tử cung và vú; tamoxifen có tác dụng estrogen trong tử cung nhưng kháng estrogen trong vú và xương. Cả hai dường như vẫn giữ được hoạt động estrogen ở thần kinh và nội mô.
Các cơ chế không cổ điển đóng một vai trò trong hoạt động của steroid sinh dục. Các cơ chế không cổ điển có hai loại chung: (1) tín hiệu không phụ thuộc yếu tố đáp ứng estrogen (ERE) có tác động đến gen, trong đó ER đã gắn phối tử hoạt động như một chất đồng điều hòa của các yếu tố phiên mã khác hoạt động thông qua các yếu tố đáp ứng DNA đặc hiệu của chúng và (2) tín hiệu không tác động đến gen, trong đó sự gắn kết của E2 với các thụ thể liên kết màng, bao gồm cả ERα, kích thích nhanh chóng các con đường phosphoryl hóa.
Các tác động không qua gen thông qua tín hiệu màng xảy ra nhanh chóng (trong vòng vài phút) và có thể làm trung gian cho sự tăng sinh, apoptosis, và di chuyển của tế bào theo những cách đặc hiệu của tế bào. Các hoạt động không qua gen của E2 chiếm hầu hết các tác động ức chế LH và cân bằng năng lượng của E2. Những tác động này có thể được trung gian bởi sự gắn kết với ER hạt nhân trong các miền màng huyết tương được cung cấp bởi các protein giàn giáo, chẳng hạn như caveolin. Trên các nền tảng như vậy, phức hợp E2-ER hoạt động giống như một thụ thể màng, kết hợp với các protein-G và kích hoạt các con đường tế bào chất liên quan đến SRC và MAP kinase. Androgen dường như hoạt động tương tự. Các hoạt động không qua gen của PR hạt nhân cũng đã được báo cáo. Một số tác động không qua gen dường như liên quan đến sự kích hoạt của các thụ thể xuyên màng kết hợp G-protein mới cho E2 và progesterone tương tác với steroid hoặc các chất chuyển hóa của chúng.
Tín hiệu ER qua gen cũng có thể không phụ thuộc phối tử. Ví dụ, tín hiệu màng tế bào bởi các yếu tố tăng trưởng hoặc các peptide khác kích thích sự phosphoryl hóa ER. EGF kích hoạt sự phosphoryl hóa của ER và mô phỏng các tác động đa dạng của estrogen. Sự kích hoạt ERα chưa gắn phối tử dường như có liên quan đến việc kìm hãm biểu hiện của đồng dạng 17β-HSD của tinh hoàn có tính androgen trong buồng trứng.
Các steroid hoạt động bằng cách gắn vào các thụ thể gắn màng trong não được gọi là thần kinh hoạt động. Các steroid thần kinh hoạt động được tổng hợp trong não được gọi là neurosteroid. Các tác động được ghi nhận rõ nhất của những chất này là lên các chất dẫn truyền thần kinh, kiểm soát các kênh ion. Allopregnanolone (3α-hydroxy-5α-tetrahydroprogesterone) và 3α-androstanediol là các chất chủ vận thụ thể GABAA và do đó có đặc tính an thần và chống động kinh. Pregnenolone sulfate và DHEAS có tác dụng ngược lại, chất trước cũng kích thích các thụ thể glutamate. Các thụ thể cho 5-hydroxytryptamine đã được cho là có liên quan đến việc trung gian một số tác động của steroid sinh dục và một số chất chuyển hóa của chúng. Một số tác động của estrogen trong não được trung gian qua màng.
Các sự kiện sau phiên mã đặc hiệu của mô liên quan đến tín hiệu steroid sinh dục còn ít được hiểu rõ. Estradiol và progesterone điều chỉnh các hoạt động của nhau thông qua các tác động lên các thụ thể đặc hiệu của chúng: estrogen tăng trong giai đoạn tiền rụng trứng của chu kỳ điều hòa tăng các thụ thể của cơ quan đích cho cả estradiol và progesterone; nồng độ progesterone trong giai đoạn hoàng thể sau đó ức chế sản xuất cả hai thụ thể. Estrogen ngăn ngừa mất xương bằng cách ngăn chặn sản xuất các cytokine tiền viêm. Hoạt động của androgen đã được báo cáo là được trung gian bởi prostaglandin ở cơ quan sinh dục, và testosterone kích thích hệ thống IGF-1 trong sụn tăng trưởng.
Sự trưởng thành của các cơ quan đích của Hormone sinh dục
Đường sinh dục
Hệ thống Müller của phôi thai tạo ra tử cung, cổ tử cung, phần trên âm đạo, và vòi trứng trong trường hợp không có sự bài tiết AMH của tinh hoàn bào thai trong ba tháng đầu thai kỳ. Nếp sinh dục phát triển để bao bọc gốc âm vật giống dương vật từ tuần 11 đến 20 của thai kỳ, song song với sự phát triển của hệ thống nang trứng. Các thụ thể ER được biểu hiện ở môi nhỏ, bao quy đầu, và quy đầu ở nữ giới, nhưng không có ở các cấu trúc tương đồng của nam giới. Một mối liên hệ giữa chất kháng estrogen và sự mơ hồ về bộ phận sinh dục đã được báo cáo. Diethylstilbestrol gây ra loạn sản đường sinh dục. Những dữ liệu này cho thấy estrogen có thể đóng một vai trò trực tiếp trong sự biệt hóa đường sinh dục nữ. Tuy nhiên, việc loại bỏ các thụ thể ER không có tác động rõ ràng đối với sự biệt hóa đường sinh dục.
Tử cung và cổ tử cung của trẻ sơ sinh phình to dưới ảnh hưởng của estrogen trong tuổi dậy thì. Nội mạc tử cung và các tuyến cổ tử cung sau đó trải qua những thay đổi theo chu kỳ đồng bộ với chức năng buồng trứng theo chu kỳ. Để đáp ứng với sự gia tăng estrogen trong giai đoạn nang trứng của chu kỳ, biểu mô và mô đệm nội mạc tử cung tăng sinh. Các tuyến tử cung tăng về số lượng và chiều dài. Tăng sản nội mạc tử cung được ngăn chặn bởi progestin và androgen dư thừa. Để đáp ứng với sự bài tiết progesterone sau khi rụng trứng, nội mạc tử cung tăng độ dày: xảy ra phù nề mô đệm, và các tuyến tử cung phình to, trở nên có túi, và tiết ra một chất lỏng nhầy giàu glycogen. Các động mạch cuộn dài ra thêm trong thời gian này và ngày càng xoắn. Những thay đổi này rất quan trọng để cho phép làm tổ. Progestin liều cao là một biện pháp tránh thai sau giao hợp hiệu quả vì nó ngăn cản sự làm tổ khi được dùng trong vòng 3 ngày sau khi giao hợp không được bảo vệ.
Các chất bài tiết của tuyến nội cổ tử cung bôi trơn vòm âm đạo. Chất nhầy nội cổ tử cung ít và tương đối mỏng trong giai đoạn estrogen thấp của chu kỳ. Sự gia tăng dòng chảy chất nhầy cùng với sự phát triển nang trứng dường như đòi hỏi sự kích thích đặc hiệu của mô đối với chất điều hòa độ dẫn truyền xuyên màng của bệnh xơ nang bởi estrogen. Chất nhầy cổ tử cung trở nên nhớt và đàn hồi hơn khi estrogen tăng vào cuối giai đoạn nang trứng của chu kỳ—mức độ mà nó có thể được kéo thành một sợi dài, spinnbarkeit, là một hàm số của nồng độ estrogen.
Niêm mạc âm đạo và đường niệu-sinh dục bao gồm biểu mô vảy phân tầng đáp ứng với hormone (Hình 16.28). Lớp đáy là khu vực tái tạo. Trong trường hợp không có estrogen, chỉ có một lớp tế bào cận đáy trên lớp này, và âm đạo mỏng, có xu hướng kiềm, điều này khiến nó dễ bị nhiễm trùng tại chỗ (viêm âm đạo không đặc hiệu). Để đáp ứng với estrogen, sự tăng sinh biểu mô xảy ra, với sự hình thành liên tiếp các lớp trung gian và bề mặt. Với sự trưởng thành này, tế bào chất của mỗi tế bào đầu tiên nở ra, dẫn đến sự hình thành các tế bào trung gian nhỏ. Với sự estrogen hóa hơn nữa, các nhân trở nên co lại và các tế bào trung gian lớn hình thành. Sự estrogen hóa lớn hơn mang lại sự biến đổi của chúng thành các tế bào bề mặt vảy sừng hóa: tế bào chất thay đổi từ ưa base sang ưa axit với sự tích tụ glycogen. Sức đề kháng với nhiễm trùng của niêm mạc âm đạo phát triển đầy đủ là kết quả của độ dày của nó và từ độ pH axit của nó, xảy ra do sự lên men glycogen của các tế bào bề mặt. Để đáp ứng với progesterone giai đoạn hoàng thể, những thay đổi thoái hóa xuất hiện trong các tế bào niêm mạc âm đạo: các tế bào bề mặt giảm, tế bào chất có dạng “nhăn nheo”, các tế bào thoái hóa, và sự tăng sinh vi khuẩn tăng lên.
Hình 16.28. Các lớp biểu mô âm đạo của người lớn được estrogen hóa tốt. Lớp bề mặt chứa các tế bào bề mặt đã được sừng hóa (vảy) với tế bào chất ưa eosin và nhân co lại (a) cũng như các tế bào nội biểu mô lớn cũng bị co nhân nhưng ưa base (b). Vùng trung gian chứa các tế bào ưa base có ít tế bào chất hơn và nhân kích thước trung bình (c). Các tế bào đáy và cận đáy có một lượng tương đối nhỏ tế bào chất ưa base và nhân tương đối có không bào (d, e).(Chỉnh sửa từ Wilkins, L. (1968). The Diagnosis and Treatment of Endocrine Disorders in Childhood and Adolescence. Springfield, IL, Charles C Thomas.)
Phết tế bào âm đạo cho thấy những thay đổi theo chu kỳ đặc trưng trong các loại tế bào cấu thành biểu mô âm đạo (xem Hình 16.28). Trong những năm tiền dậy thì, các tế bào cận đáy chiếm ưu thế, và đặc trưng là 10% hoặc ít hơn là các tế bào trung gian nhỏ. Một mô hình bao gồm hoàn toàn các tế bào trung gian là điển hình của giai đoạn dậy thì sớm. Giai đoạn nang trứng sớm của chu kỳ kinh nguyệt được đặc trưng bởi sự chiếm ưu thế của các tế bào trung gian lớn với ít, nếu có, các tế bào bề mặt. Sự trưởng thành đỉnh điểm đạt được vào giữa chu kỳ, tại thời điểm đó 35% đến 85% các tế bào nhìn thấy trên phết tế bào âm đạo là bề mặt; phần còn lại là các tế bào trung gian lớn. Sự sừng hóa này phát triển trong khoảng thời gian 1 tuần để đáp ứng với nồng độ estradiol khoảng 70 pg/mL và tồn tại từ 1 đến 2 tuần sau khi ngừng estrogen (xem Hình 16.11).
Progesterone đối kháng với các tác động của estrogen lên biểu mô âm đạo và cổ tử cung. Sự ức chế quá trình chín của cổ tử cung bởi progestin được sử dụng để ngăn ngừa sinh non tự phát tái phát.
Nhiều biến thể bình thường đã được nhận biết trong hình dạng của màng trinh. Đường kính ngang tăng theo tuổi.
Tuyến vú
Nhiều ống dẫn sữa phân nhánh thô sơ được tìm thấy bên dưới núm vú ở trẻ sơ sinh; chúng phát triển và phân nhánh rất chậm trong những năm tiền dậy thì. Estrogen kích thích núm vú phát triển, sự phân nhánh của ống dẫn sữa cuối cùng tiến triển đến giai đoạn hình thành các tiểu quản, và sự phát triển của mô đệm mỡ tăng lên cho đến khi nó chiếm khoảng 85% khối lượng của vú. GH (thông qua IGF-1) và glucocorticoid đóng một vai trò cho phép. Những hormone này tương tác với mô đệm vú và các yếu tố tăng trưởng tại chỗ để kích thích sự phát triển của biểu mô vú. Sự hình thành tiểu thùy xuất hiện vào khoảng tuổi có kinh, khi nhiều chồi túi mù hình thành bằng cách phân nhánh của các ống dẫn cuối cùng. Những tác động này là do sự hiện diện của progesterone. Mô đệm vú sưng lên theo chu kỳ trong mỗi giai đoạn hoàng thể. Sự phát triển đầy đủ của phế nang thường chỉ xảy ra trong thai kỳ dưới ảnh hưởng của progesterone và prolactin bổ sung. Prolactin không đóng vai trò trong sự phát triển của vú nếu không có sự mồi của các hormone nữ.
Estrogen và progesterone cũng đóng một vai trò trong khả năng mắc bệnh ung thư vú. Tuổi có kinh sớm hơn trung bình là một yếu tố nguy cơ khiêm tốn đối với ung thư vú, bất kể tình trạng BRCA; tuy nhiên, đáng chú ý là, nguy cơ ung thư vú chưa được chứng minh là tăng ở những người dậy thì sớm. Gen BRCA1 thường kìm hãm sự phát triển của vú, ít nhất một phần, bằng cách ức chế biểu hiện của ERα và PR, và các đột biến liên quan đến ung thư đảo ngược các quá trình này.
Đơn vị Lông-Bã nhờn
Đơn vị lông-bã nhờn (PSU), với một vài ngoại lệ, bao gồm cả thành phần lông và thành phần bã nhờn. Androgen là một điều kiện tiên quyết cho sự tăng trưởng và phát triển của PSU theo mô hình đặc trưng của chúng. Androgen có tác động lên cả nhú bì, điều chỉnh chu kỳ phát triển của lông, và lên biểu mô PSU. Trước tuổi dậy thì, PSU phụ thuộc androgen bao gồm một nang lông tơ tiền dậy thì, trong đó các thành phần lông và tuyến bã nhờn gần như không thể nhìn thấy bằng mắt thường (Hình 16.29). Dưới ảnh hưởng của androgen, ở các khu vực có lông sinh dục, PSU chuyển sang sản xuất một nang lông vĩnh viễn có tủy, biểu hiện một loại keratin độc đáo đáp ứng với androgen. Sự khác biệt về mật độ biểu kiến của lông sinh dục giữa nam và nữ là do sự khác biệt về mật độ của các sợi lông vĩnh viễn phát triển để đáp ứng với androgen. Ở vùng da đầu có xu hướng hói ở những người có khuynh hướng di truyền bị rụng tóc kiểu nam, androgen làm suy yếu nhẹ chu kỳ phát triển của lông, do đó PSU dần dần chỉ tạo ra các nang lông tơ. Ở các khu vực dễ bị mụn trứng cá, androgen làm cho nang lông tơ tiền dậy thì phát triển thành một nang lông bã nhờn, trong đó biểu mô bã nhờn phát triển và lông vẫn là lông tơ. Nồng độ androgen trong giai đoạn dậy thì thượng thận đủ để khởi đầu lần lượt sự phát triển của tuyến bã nhờn và sự phát triển của lông mu. Nói chung, cần một lượng androgen ngày càng lớn hơn để kích thích sự phát triển của lông vĩnh viễn dọc theo một gradient từ mu đến đỉnh đầu. Tất cả những tác động này của androgen ở một mức độ nào đó có thể đảo ngược bởi các chất kháng androgen.
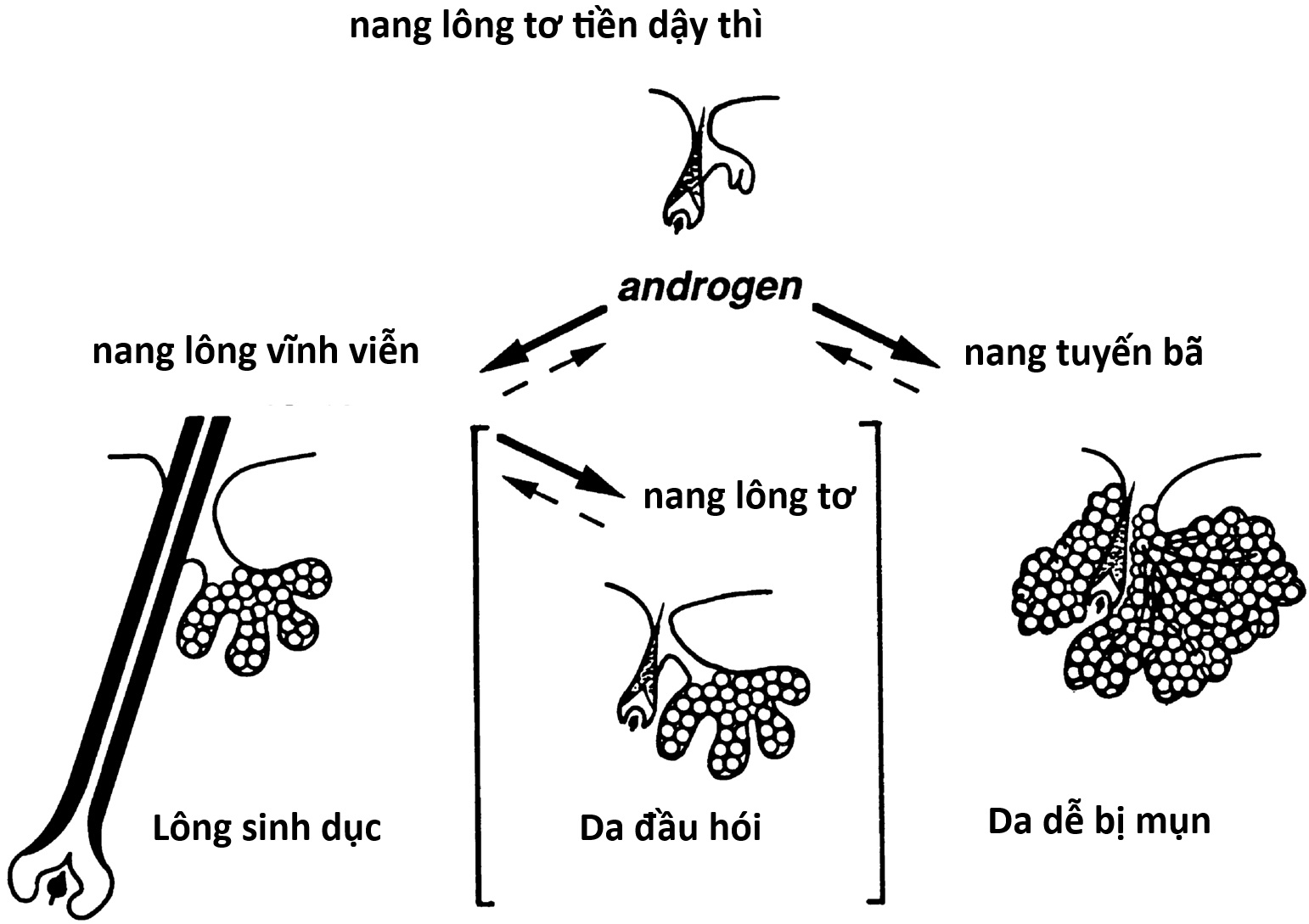
Hình 16.29. Vai trò của androgen trong sự phát triển của đơn vị lông-bã nhờn. Androgen (đường liền) chịu trách nhiệm cho sự biệt hóa theo khuôn mẫu của đơn vị lông-bã nhờn ở tuổi dậy thì. Đường chấm chấm chỉ ra tác động của các chất kháng androgen. Lông chỉ được mô tả trong giai đoạn anagen (tăng trưởng) của chu kỳ phát triển. Ở da đầu hói (khu vực trong ngoặc), các sợi lông vĩnh viễn trước đây không phụ thuộc vào androgen thoái triển thành lông tơ dưới ảnh hưởng của androgen.(Từ Rosenfield, R.L., Deplewski, D. (1994). Role of androgens in the developmental biology of the pilosebaceous unit. Am J Med, 97(5A), 80.)
Estrogen kích thích sự phát triển của lông một cách khiêm tốn, có lẽ bằng cách ức chế giai đoạn catagen (nghỉ ngơi) của chu kỳ lông; điều này rất có thể là do sự cảm ứng của các thụ thể androgen bởi estrogen. Estrogen cũng trực tiếp ức chế bài tiết bã nhờn. GH hiệp đồng với hoạt động của androgen trên PSU, một phần thông qua tín hiệu IGF-1. Các chất chủ vận thụ thể axit retinoic đối kháng với các tác động của androgen lên tuyến bã nhờn bằng cách ức chế sự tăng sinh và biệt hóa của tế bào bã nhờn. Insulin, prolactin, glucocorticoid, thyroxine, và catecholamine cũng đóng vai trò trong sự tăng trưởng, phát triển, và chức năng của PSU.
Xương
Sự gia tăng bài tiết hormone sinh dục rõ ràng khởi đầu cho đợt tăng trưởng dậy thì. Khoảng một nửa tác động này của hormone sinh dục là do chúng kích thích trục GH-IGF. Phần còn lại của các tác động của steroid sinh dục đối với sự tăng trưởng xương là trực tiếp.
Sự khác biệt giữa các hoạt động của hormone sinh dục góp phần làm cho xương của phụ nữ ngắn hơn và hẹp hơn so với nam giới. Cơ sở cho những khác biệt này là đa dạng và liên quan đến sự tương tác với IGF-1 và các tác động lên sự hình thành xương vỏ, xương xốp, và màng xương.
Cả estrogen và androgen đều kích thích sự phát triển của sụn tăng trưởng. Estradiol là hormone quan trọng mang lại sự đóng của sụn tăng trưởng. Estrogen cũng đặc biệt hiệu quả trong việc giảm chu chuyển xương. Ở một mức độ nào đó, những tác động này có thể được lập trình từ trước khi sinh. Sự tích lũy xương trong tuổi dậy thì là một yếu tố quyết định chính của nguy cơ gãy xương ở người trưởng thành. Tuổi có kinh sau 15 tuổi mang lại nguy cơ gãy xương tăng 1.5 lần, và nguy cơ tăng theo tuổi có kinh.
Mô mỡ
Phụ nữ có tỷ lệ mỡ cơ thể lớn hơn nam giới. Trong tuổi dậy thì, họ phát triển cả số lượng và kích thước tế bào mỡ lớn hơn nam giới ở phần dưới cơ thể, điều này ủng hộ sự phân bố mỡ ở phần dưới cơ thể (gluteofemoral), trái ngược với sự tích tụ mỡ ở phần trên cơ thể (nội tạng) của nam giới. Các giai đoạn quan trọng để thiết lập quần thể tế bào mỡ là cuộc đời bào thai và vị thành niên, sau đó sự tích tụ lipid xảy ra chủ yếu bằng cách phì đại tế bào. Nồng độ leptin trong huyết thanh tăng trong suốt tuổi dậy thì để đạt mức cao hơn ở nữ giới so với nam giới, trong khi nồng độ của adipocytokine chống ly giải mỡ adiponectin vẫn ổn định ở nữ giới nhưng giảm ở nam giới để đáp ứng với androgen.
Tín hiệu insulin có tầm quan trọng lớn đối với kích thước và chức năng của mô mỡ—kích thích quá trình tạo mỡ (sự phát triển của các tiền tế bào mỡ thành tế bào mỡ) và quá trình sinh mỡ, trong khi ức chế quá trình ly giải mỡ. Các catecholamine beta-adrenergic kích thích quá trình ly giải mỡ, chống lại sự ức chế của insulin. Quá trình ly giải mỡ của mô mỡ trắng nội tạng (VWAT) ít nhạy cảm với insulin và nhạy cảm hơn với catecholamine so với SCWAT dưới da.
Androgen gây ra vóc dáng nam tính ở tuổi dậy thì chủ yếu bằng cách ức chế quá trình tạo mỡ một cách tương hỗ với việc kích thích quá trình tạo cơ. Chúng hoạt động bằng cách ức chế sự biệt hóa tạo mỡ của các tế bào gốc đa năng trung mô của con người một cách tương hỗ với sự kích thích của chúng đối với dòng tạo cơ, theo cách phụ thuộc vào liều lượng. Việc tạo androgen tại chỗ bởi mô mỡ khi nó biệt hóa để đáp ứng với insulin có khả năng phục vụ để hạn chế quá trình tạo mỡ do insulin tạo ra. Trong các tế bào mỡ, androgen đã được báo cáo là ức chế quá trình sinh mỡ. Androgen cũng ức chế quá trình ly giải mỡ do catechol kích thích ở SCWAT nữ, đối kháng với tác động của insulin, nhưng không có ở WAT mạc nối.
Estrogen đã được báo cáo là ức chế quá trình sinh mỡ thông qua việc ức chế hoạt động lipoprotein lipase của tế bào mỡ, theo hầu hết các nghiên cứu trong ống nghiệm. Estradiol làm giảm đáp ứng ly giải mỡ với catecholamine, đặc biệt là ở các tế bào mỡ SCWAT, nhưng lại thúc đẩy quá trình ly giải mỡ bằng cách kích thích lipase nhạy cảm với hormone. Sự phát triển của béo phì ở phụ nữ sau mãn kinh và các mô hình động vật bị cắt buồng trứng đã dẫn đến khái niệm rằng sự thiếu hụt estrogen gây ra béo phì, nhưng vai trò của sự tăng FSH trong việc trung gian cho tình trạng béo phì này bằng cách ức chế sự hình thành mô mỡ nâu đã làm phức tạp việc giải thích tất cả các nghiên cứu như vậy. Progesterone thường chống lại các tác động của estrogen và androgen lên mô mỡ trắng và nâu trong các mô hình thực nghiệm.
Tác động của steroid sinh dục nữ lên lipid huyết thanh là khiêm tốn. Thay thế estradiol sinh lý (qua da) làm tăng nhẹ cholesterol lipoprotein mật độ cao (HDL-C) và làm giảm triglyceride lipoprotein mật độ rất thấp (VLDL). LDL-C thấp hơn trong giai đoạn hoàng thể bình thường dường như chủ yếu là do sự tiêu thụ của nó bởi hoàng thể làm cơ chất sinh steroid. Liệu pháp thay thế estrogen đường uống làm tăng HDL-C nhiều hơn so với thay thế qua da, nhưng khác với nó ở chỗ làm tăng triglyceride-VLDL và giảm LDL-C, trong khi các progestin có tính androgen làm giảm HDL-C.
Sự thiếu hụt progesterone chịu trách nhiệm cho sự gia tăng nồng độ triglyceride chylomicron sau bữa ăn xảy ra do hoạt động lipoprotein lipase ngoại vi thấp khi trục tuyến yên-tuyến sinh dục bị ức chế cấp tính. Ở người, việc sử dụng chất tương tự progesterone megestrol acetate được chấp thuận để kích thích sự thèm ăn và tăng cân; việc sử dụng progestin có liên quan đến kháng insulin.
Cơ
Sử dụng testosterone làm tăng khối lượng cơ và giảm khối lượng mỡ một cách tương hỗ. Androgen làm điều này bằng cách thúc đẩy sự cam kết của các tế bào gốc đa năng trung mô vào dòng tạo cơ trong khi ức chế quá trình tạo mỡ. Tác động của testosterone được tạo ra thông qua các con đường qua trung gian thụ thể androgen và không cổ điển. Sự hình thành DHT của cơ xương người được trung gian chủ yếu bởi 5-alpha-reductase loại 3. Androgen sau đó có tác dụng kích thích phì đại tế bào cơ theo liều lượng, cũng như tăng sản cùng với các mô liên quan, chẳng hạn như các tế bào thần kinh vận động. Phụ nữ cường androgen có khối lượng và sức mạnh cơ bắp tăng, điều này dường như mang lại cho họ lợi thế trong thi đấu thể thao. Do đó, có một cuộc tranh luận sôi nổi về việc điều chỉnh nồng độ androgen của phụ nữ trong thi đấu thể thao đỉnh cao.
Hệ Thần kinh Trung ương
Sự phù hợp của bản dạng giới (tự nhận mình là nam hay nữ) và xu hướng giới tính (sở thích tình dục) với giới tính được chỉ định trên cơ sở giải phẫu bộ phận sinh dục là tiêu chuẩn, điều này phù hợp với một vai trò quan trọng của androgen trong việc lập trình các khía cạnh này của sự phát triển thần kinh-tâm lý-xã hội. Tuy nhiên, các yếu tố di truyền và biểu sinh không phải hormone ảnh hưởng đến các khía cạnh lưỡng hình giới tính của sự phát triển con người.
Trước khi sự khác biệt về hormone sinh dục có thể phát hiện được, một số gen được biểu hiện khác nhau trong não của chuột đực và cái. Các nhiễm sắc thể giới tính trực tiếp lập trình sự biệt hóa thần kinh lưỡng hình giới tính và các hành vi, chẳng hạn như hung hăng, nuôi dạy con cái, và tương tác xã hội. Nhiễm sắc thể X được thừa hưởng từ mẹ được biểu hiện ưu tiên trong các tế bào thần kinh glutamatergic của vỏ não, và sự in dấu đặc hiệu theo giới tính của các gen trên nhiễm sắc thể thường của vùng dưới đồi là phổ biến và dường như là trạng thái mặc định ở nữ giới.
Sự phơi nhiễm với testosterone trong cả giai đoạn kích hoạt thoáng qua của trục HPG trong giai đoạn bào thai-chu sinh và một lần nữa trong tuổi dậy thì đóng một vai trò trong việc tổ chức biểu hiện gen thần kinh và sự phát triển theo một cách lưỡng hình giới tính theo các nghiên cứu sâu rộng trên các mô hình động vật, phù hợp với các quan sát ở người. Giai đoạn quan trọng cho việc lập trình nội tiết này đối với các mô hình hành vi kết thúc sau tuổi dậy thì. Điều này có hậu quả đối với cả chức năng thần kinh-nội tiết đặc trưng giới tính và hành vi đặc trưng giới tính và không liên quan đến giới tính được kích hoạt bởi môi trường nội tiết dậy thì.
Giai đoạn quan trọng cho sự nhạy cảm của hormone đối với các khu vực lưỡng hình giới tính của não xảy ra trong giai đoạn sơ sinh sớm của loài gặm nhấm, được cho là tương đương với đầu tam cá nguyệt thứ hai của con người. Ở chuột, nhân tiền thị của vùng dưới đồi lớn hơn ở con đực, và việc điều trị chuột cái sơ sinh bằng testosterone (hoặc estradiol) làm tăng vĩnh viễn sự phát triển của tế bào thần kinh để sao chép hiệu ứng này và gây ra hành vi tình dục nam hóa sau đó và không rụng trứng. Sự không rụng trứng là kết quả của sự nam hóa mô hình bài tiết LH (tức là, cả sự bài tiết LH tăng và khả năng tạo ra các đợt tăng LH bị ức chế để đáp ứng với sự mồi estrogen) dường như là hệ quả của sự ức chế vĩnh viễn biểu hiện PR ở vùng dưới đồi.
Việc sử dụng testosterone cho các động vật thí nghiệm kích thích sự phát triển của các vùng não lưỡng hình giới tính đến kích thước của nam giới trưởng thành. Việc duy trì sự khác biệt về kích thước nhân ở người trưởng thành và biểu hiện thụ thể androgen của các vùng não lưỡng hình giới tính phụ thuộc vào nồng độ androgen xung quanh. Việc sử dụng testosterone và hormone nữ quanh tuổi dậy thì có những tác động khác nhau đối với hành vi.
Một số cấu trúc não người có tính lưỡng hình giới tính, một số trở nên như vậy vào tuổi dậy thì. Các khác biệt giới tính đặc trưng của vỏ não và dưới vỏ có thể phân biệt được ở tuổi dậy thì bằng hình ảnh cộng hưởng từ (MRI) cấu trúc, mặc dù hầu hết các bộ não người đều có một sự pha trộn của các đặc điểm “nam” và “nữ”. Testosterone trong nước ối của thai nhi được báo cáo là có tương quan dương với nhiều đặc điểm lưỡng hình giới tính nam khu vực trong chất xám, bao gồm cả hạch hạnh nhân, cũng như với các khác biệt đa dạng trong hành vi giới tính. MRI chức năng đã cho thấy nồng độ testosterone nội sinh tương quan với, và việc sử dụng testosterone ngoại sinh cho nữ giới kích hoạt, các vùng hạch hạnh nhân và cạnh hồi hải mã và các vùng não khác để đáp ứng với các kích thích cảm xúc-xã hội. Các nghiên cứu ở người chuyển giới đã cho thấy rằng các liều testosterone gây nam hóa ảnh hưởng đến kích thước của các vùng vỏ não và dưới vỏ cụ thể, và điều trị kháng androgen/estrogen đã ức chế mạnh mẽ kích thước của hồi hải mã.
Một số tác động của testosterone là đặc hiệu của androgen. Tuy nhiên, nhiều tác động hành vi của testosterone dường như được trung gian bởi sự thơm hóa testosterone thành estradiol trong tế bào thần kinh theo một cách được điều chỉnh theo vị trí cụ thể bởi androgen và estrogen. Do đó, người ta đã giả thuyết rằng nồng độ estradiol thấp thúc đẩy sự phát triển của não và nồng độ lớn hơn sẽ nam hóa nó. Những nồng độ estradiol cao hơn này được tạo ra trong não nam giới bằng cách thơm hóa testosterone lưu hành trong tế bào thần kinh. Việc loại bỏ ERα ở chuột cái làm giảm hành vi tình dục và hành vi nuôi dạy con cái, trong khi tăng tính hung hăng.
Cơ chế mà estrogen làm trung gian cho sự nam hóa hành vi tình dục của loài gặm nhấm do androgen gây ra liên quan đến sự trung gian của prostaglandin E2. Estradiol hoạt động thông qua ERα để cảm ứng các tế bào vi đệm, các tế bào miễn dịch thường trú của não, để tiết ra prostaglandin E2, làm giảm hoạt động của DNA methyl transferase để giải phóng sự kìm hãm biểu sinh của trạng thái hành vi nữ mặc định; điều này khởi đầu sự hình thành gai đuôi gai thần kinh tăng cường và hành vi nam hóa. Việc giải phóng sự kìm hãm biểu sinh dường như là một cơ chế quan trọng sau thụ thể của hoạt động testosterone trong não, cũng ảnh hưởng đến các tế bào gốc thần kinh phôi thai. Sự tham gia của prostaglandin E2 trong việc trung gian cho tác động của androgen lên sự tạo synap thần kinh cho thấy vai trò của androgen dư thừa góp phần vào các rối loạn phổ tự kỷ.
Tổ chức nội tiết này của não liên quan đến các tác động đặc hiệu của hormone lên sự tăng sinh so với sự sống còn của tế bào và sự hình thành so với sự cắt tỉa synap. Androgen có tác động dinh dưỡng lên các tế bào gai đuôi gai của các nhân lưỡng hình giới tính của loài gặm nhấm, thúc đẩy mật độ synap tăng. Estrogen làm thay đổi mô hình kết nối synap theo các mô hình không gian cụ thể và chính xác, dường như tinh chỉnh độ nhạy của một số vùng não đối với các axit amin kích thích và ức chế. Những thay đổi ở vùng dưới đồi trong việc tái cấu trúc synap đã được tương quan với đợt tăng GnRH tiền rụng trứng. Cũng có sự lưỡng hình giới tính trong các thụ thể progestin ở đại não, và progesterone làm giảm tác động của testosterone lên não. Việc sử dụng progestin-estrogen có tác dụng bảo vệ thần kinh trong các nghiên cứu trên động vật. Những hormone này có thể chống lại tổn thương não và tủy sống ở phụ nữ trưởng thành, nhưng không ở trạng thái chưa trưởng thành về mặt sinh dục.
Trung bình, phụ nữ có xu hướng thực hiện tốt hơn nam giới trong các nhiệm vụ liên quan đến trí nhớ vật thể, kỹ năng lời nói, tốc độ và độ chính xác xử lý, và các kỹ năng vận động tinh, trong khi nam giới có xu hướng vượt trội về trí nhớ không gian-thị giác, trong khi hai giới không khác nhau về từ vựng hoặc kỹ năng toán học. Những khác biệt này khiêm tốn về mặt định lượng, khoảng 0.4 đến 1.0 độ lệch chuẩn (SD), do đó, dẫn đến sự chồng chéo lớn về các kỹ năng này giữa hai giới. Lợi thế của nam giới về kỹ năng không gian-thị giác được thiết lập vào 4.5 tuổi. Bởi vì cả bé trai và bé gái bị thiếu hụt hormone sinh dục bẩm sinh đều tương đối kém về khả năng không gian-thị giác, và việc điều trị bằng hormone sinh dục ở tuổi dậy thì không cải thiện những thiếu hụt này, sự khác biệt này dường như là kết quả của việc tạo khuôn mẫu qua trung gian estrogen ở cả hai giới. Mức độ mà sự khác biệt này là bẩm sinh hay do các yếu tố văn hóa-xã hội là một chủ đề gây tranh cãi đáng kể.
Một loạt các hành vi lưỡng hình giới tính được tìm thấy ở trẻ nhỏ, nhưng thường chúng có một đặc tính khác so với ở người lớn. Bản dạng giới được thiết lập vào giữa thời thơ ấu, có lẽ vào 3 tuổi. Xu hướng tình dục được thiết lập vào 10 tuổi; người ta đã giả thuyết rằng điều này phụ thuộc vào dậy thì thượng thận hơn là dậy thì thực sự. Lượng androgen hoặc estrogen ở giai đoạn dậy thì sớm có ít tác động lên các hành vi tình dục, nhưng làm tăng một số khía cạnh của hành vi hung hăng. Chỉ ở giai đoạn dậy thì muộn hơn mới có sự kích hoạt của ham muốn tình dục, đã được lập trình trong quá trình phát triển sớm hơn.
Bản dạng giới không phù hợp (chuyển giới) và xu hướng tình dục (đồng tính luyến ái, song tính luyến ái) xảy ra ở một tỷ lệ nhỏ dân số. Tỷ lệ mắc của chúng dường như tăng lên trong các rối loạn phát triển giới tính (DSD). Các nghiên cứu về DSD chỉ ra rằng một mức độ androgen của nam giới hoạt động thông qua thụ thể androgen trước hoặc quanh khi sinh là một yếu tố quyết định quan trọng của hành vi giới tính nam (vai trò) và gây rối loạn nhẹ cho bản dạng giới nữ. Tuy nhiên, DSD không phổ biến ở những người đồng tính luyến ái và chuyển giới, trong khi các ước tính về khả năng di truyền xấp xỉ 20% đến 60%. Các nghiên cứu hình ảnh thần kinh cho thấy rằng những rối loạn này có cơ sở sinh học. Đồng tính luyến ái có liên quan đến việc mất đi sự khác biệt giới tính trong các cấu trúc não và chuyển giới có liên quan đến sự biệt hóa ít hơn của các vùng não liên quan đến nhận thức về cơ thể và bản thân. Hình ảnh thần kinh cho thấy những người đồng tính luyến ái nam có một mô hình kích hoạt hạt nhân để đáp ứng với các tín hiệu hóa học giống pheromone giống như phụ nữ dị tính luyến ái hơn là nam giới dị tính luyến ái, và phụ nữ đồng tính luyến ái có một loại kích hoạt trung gian.
Các chất chuyển hóa của androgen và estrogen trong mồ hôi và nước tiểu, chứa các steroid bất thường, chẳng hạn như androst-4,14-diene-3-one, đã được phát hiện là có tác dụng kích hoạt lưỡng hình giới tính của vùng dưới đồi trước độc lập với mùi của chúng. Do đó, chúng dường như hoạt động như các tín hiệu hóa học tương đương pheromone. Pheromone ở người dường như điều chỉnh thời điểm rụng trứng và tâm trạng. Có khả năng một quần thể chuyên biệt của các thụ thể khứu giác chiếu đến các tế bào thần kinh GnRH hoạt động như các thụ thể pheromone.
Các cơ quan đích khác của tác động Hormone sinh dục
Các hormone steroid sinh dục ảnh hưởng đến nhiều loại mô theo những cách thường không được nhận biết. Một tác động của estrogen lên việc ổn định tính toàn vẹn của cơ đã được ghi nhận trong bệnh loạn dưỡng cơ.
Các rối loạn tự miễn nói chung phổ biến hơn ở nữ giới, đặc biệt là sau tuổi dậy thì. Estrogen điều hòa giảm nồng độ cytokine gây viêm interleukin-6 trong máu và biểu hiện gen điều hòa tự miễn của tuyến ức (AIRE). Progesterone có tác dụng tương tự và androgen có tác dụng ngược lại đối với AIRE. Sự khác biệt giới tính trong khuynh hướng mắc các rối loạn tự miễn một phần có thể được giải thích bằng tác động của hormone sinh dục lên các gen mạng lưới AIRE trong giai đoạn dậy thì mini ở trẻ sơ sinh. Tuy nhiên, kiểu gen giới tính ảnh hưởng đến hệ thống tự miễn độc lập với các steroid sinh dục.
Tác động tim mạch của estrogen bao gồm việc điều hòa tăng các thụ thể estrogen và PR trong mô mạch máu và các tác động không qua gen lên nitric oxide synthase nội mô. Estrogen cải thiện rối loạn chức năng nội mô ở phụ nữ trẻ suy sinh dục và cần thiết cho tác dụng bảo vệ tim của việc tập thể dục. Liệu pháp thay thế estradiol, đường uống hoặc qua da, làm giảm huyết áp, mặc dù estradiol gây giữ muối và nước. Điều này trái ngược với các biện pháp tránh thai chứa estrogen mạnh hơn là ethinyl estradiol, làm tăng huyết áp đáng kể, trừ khi chứa một progestin kháng mineralocorticoid.
Estrogen và progestin cũng có tác dụng cầm máu liên quan đến việc tăng sức đề kháng với tác dụng chống đông máu của protein C hoạt hóa. Thuốc tránh thai kết hợp đường uống chứa estrogen có nguy cơ thuyên tắc huyết khối tĩnh mạch tăng khoảng bốn lần ở những người sử dụng lần đầu. Nguy cơ giảm khi giảm liều estrogen và thời gian sử dụng và tăng khoảng 50% ở những người chứa progestin thế hệ thứ ba (ví dụ, desogestrel) và progestin kháng androgen. Tuy nhiên, nguy cơ này thấp hơn so với khi mang thai. Thuốc tránh thai chỉ chứa progestin không liên quan đến bất kỳ sự gia tăng nguy cơ huyết khối tĩnh mạch hoặc động mạch nào.
Sự khác biệt giữa hai giới về nồng độ lipid không được giải thích bởi sự khác biệt sinh lý về nồng độ estrogen. Mặc dù estrogen đường uống làm tăng triglyceride, điều này là do tác động chuyển hóa lần đầu qua gan. Sự khác biệt về nồng độ androgen (làm giảm HDL-cholesterol) và progesterone (làm giảm triglyceride và HDL-cholesterol) chỉ giải thích một phần của sự khác biệt.
Các giai đoạn phát triển nội tiết và sinh dục bình thường
Thai nhi và Trẻ sơ sinh
Thai nhi phát triển trong một môi trường steroid phong phú hơn so với nữ giới tuổi dậy thì do chức năng của đơn vị thai nhi-nhau thai. Nồng độ estrogen trong huyết thanh thai nhi cực kỳ cao. Nồng độ testosterone tự do trong huyết tương máu cuống rốn cao hơn một chút so với phụ nữ trưởng thành bình thường. Dehydroepiandrosterone sulfate ở mức của giai đoạn dậy thì thượng thận. Trẻ sơ sinh cho thấy một số dấu hiệu của mức độ kích thích nội tiết của tuổi dậy thì từ môi trường trong tử cung. Môi nhỏ phì đại và sự biến đổi tế bào bề mặt của biểu mô niệu-sinh dục là những tác động của estrogen được quan sát thấy một cách nhất quán, và một nụ vú có thể sờ thấy được có mặt khi đủ tháng ở một phần ba số trẻ sơ sinh. Chiều dài tử cung trung bình (SD) khi sinh là 4.15 ± 0.56 cm. Sự phì đại của tuyến bã nhờn là kết quả của tình trạng androgen, và thân âm vật đôi khi nổi rõ, đặc biệt là ở trẻ sinh non nhỏ.
Nồng độ hormone steroid từ khi sinh cho đến tuổi dậy thì được thể hiện trong Bảng 16.1. Khi sinh ra, xảy ra sự rút lui khỏi môi trường trong tử cung. Nồng độ hormone của trục tuyến yên-tuyến sinh dục giảm xuống mức đáy giống như tiền dậy thì trong vòng vài ngày sau khi rút lui khỏi môi trường trong tử cung. Chảy máu kinh nguyệt và sản xuất sữa non đôi khi xảy ra khi trẻ sơ sinh được rút khỏi môi trường estrogen. Sau đó, giai đoạn dậy thì mini của trẻ sơ sinh bắt đầu.
Giai đoạn dậy thì mini sơ sinh này tiến triển theo một chương trình phát triển được xác định bởi tuổi thai. Ở tuổi thai đủ tháng, nó bắt đầu bằng sự gia tăng dần dần nhưng thoáng qua đến nồng độ hormone của tuổi dậy thì. Ở các bé gái, những nồng độ này đạt giá trị tối đa trong khoảng dậy thì sớm vào 3 đến 4 tháng tuổi, muộn hơn khoảng 2 tháng so với các bé trai, trước khi chúng thoái lui như thấy trong Hình 16.5 và 16.8. Sự kích hoạt trục HPG của trẻ sơ sinh kích thích sự phát triển của vú và đường sinh dục thường kéo dài trong vài tháng.
Trẻ sơ sinh non tháng, trái ngược với trẻ sơ sinh đủ tháng, phát triển nồng độ gonadotropin cao, ở mức độ thấy trong suy buồng trứng, kéo dài cho đến khi sự phát triển nang trứng có hốc bắt đầu gần 40 tuần tuổi thai. Khi các nang trứng có hốc phát triển, sự bài tiết estrogen và AMH của buồng trứng bắt đầu, và nồng độ gonadotropin cao bù trừ dần dần giảm xuống mức thấp bình thường đối với trẻ đủ tháng. Đồng thời, sự đóng góp của tuyến thượng thận vào nồng độ các chất trung gian steroid cao hơn ở trẻ sinh non do sự tồn tại của vùng vỏ thượng thận bào thai và sự chưa trưởng thành về kích thước và hoạt động 11β-hydroxylase biểu kiến của các vùng vỏ thượng thận xác định.
Tăng kích thích buồng trứng thoáng qua đã được báo cáo ở trẻ sinh non là hệ quả của nồng độ gonadotropin cao kéo dài cho đến hoặc vượt quá tuổi thai điều chỉnh cuối kỳ. Nó biểu hiện ở vài tháng tuổi dưới dạng các nang buồng trứng với cường estrogen, gây sưng bộ phận sinh dục, phát triển vú kéo dài, và/hoặc chảy máu kinh nguyệt muộn.
Những hiện tượng này sau đó thoái lui dần dần trong giai đoạn sơ sinh muộn hơn khi trương lực ức chế của trục thần kinh-nội tiết-tuyến sinh dục trải qua quá trình trưởng thành của tuổi vị thành niên. Tuy nhiên, theo một xét nghiệm sinh học tế bào tái tổ hợp siêu nhạy, nồng độ estrogen của các bé gái trong giai đoạn sơ sinh muộn cao hơn vài lần so với các bé trai, trung bình là 1 pg/mL và dao động lên đến 3 pg/mL. Đôi khi, có thể có các tác động estrogen cận lâm sàng nhưng có thể phát hiện được trên tế bào học niệu-sinh dục. Liệu hoạt động “dậy thì mini” thoáng qua của trục thần kinh-nội tiết-tuyến sinh dục ở trẻ sơ sinh có ảnh hưởng lập trình lên các hành vi sau này hay không vẫn chưa rõ ràng.
Mô hình phát triển của AMH huyết thanh khác với các hormone sinh sản khác vì nó phản ánh sự tăng trưởng và phát triển của nang trứng hơn là hoạt động thần kinh-nội tiết. AMH tăng từ không thể phát hiện đến mức thấp trong máu cuống rốn lên 0.6 đến 4.1 ng/mL (4.3–29 pM) ở 3 tháng; sau đó nó tiếp tục tăng chậm khoảng 1.5 lần nữa để đạt mức người lớn vào giai đoạn sau có kinh.
Thời thơ ấu
Khi trục thần kinh-nội tiết-tuyến sinh dục trở nên im lìm và vùng bào thai của vỏ thượng thận thoái lui, nồng độ hormone steroid giảm trong suốt giai đoạn sơ sinh để đạt mức đáy vào giữa thời thơ ấu (xem Bảng 16.1). Thay đổi nội tiết sớm nhất trong thời thơ ấu là sự gia tăng DHEAS huyết thanh trong giai đoạn dậy thì thượng thận có thể nhận thấy vào khoảng 6 tuổi (xem Bảng 16.1). Mặc dù nồng độ gonadotropin thời thơ ấu thấp và hiếm khi có sự phát triển sinh dục rõ ràng là hệ quả của việc sản xuất gonadotropin tiền dậy thì, vẫn có một mức độ sản xuất gonadotropin có hoạt tính sinh học thấp và sự phát triển nang trứng và đôi khi có bằng chứng về sự bài tiết estrogen thoáng qua. Vào giữa thời thơ ấu, sự kích thích bài tiết gonadotropin bằng chất chủ vận GnRH gây ra một sự gia tăng nhỏ và nhanh chóng trong bài tiết estradiol. Nồng độ AMH của các bé gái tăng tối thiểu vào giữa thời thơ ấu, đến mức khoảng 3% so với các bé trai.
Vào cuối giai đoạn tiền dậy thì, các bé gái bắt đầu trải qua sự gia tăng sản xuất gonadotropin theo nhịp ngày đêm, và nồng độ estradiol tăng theo kiểu ngày đêm để xấp xỉ 10 pg/mL vào giữa buổi sáng.
Vị thành niên
Nội tiết
Những thay đổi nội tiết sớm nhất của dậy thì thực sự xảy ra dần dần trong giai đoạn cuối tiền vị thành niên. Trẻ 10 tuổi tiền dậy thì trên lâm sàng phát triển nồng độ gonadotropin và hormone sinh dục trung bình lớn hơn so với trẻ 7 tuổi tiền dậy thì.
Ở một bé gái trung bình, gonadotropin huyết thanh đạt mức dậy thì sau 8 tuổi. Tuy nhiên, tuổi đời khi bắt đầu dậy thì thay đổi đáng kể giữa các trẻ. Do đó, sự gia tăng gonadotropin dậy thì được đánh giá tốt nhất bằng cách liên hệ nồng độ gonadotropin với giai đoạn dậy thì. LH huyết thanh ban ngày tăng 25 lần từ tiền dậy thì đến cuối dậy thì theo xét nghiệm sinh học, nhưng sự gia tăng này bị đánh giá thấp bởi RIA đa dòng. Các xét nghiệm miễn dịch đo lường “thế hệ thứ ba”, sử dụng các kháng thể đơn dòng và một tiêu chuẩn tinh khiết hơn so với các RIA trước đây, cho thấy một sự gia tăng tương tự như được tìm thấy bằng xét nghiệm sinh học.
Dấu hiệu của dậy thì sớm là sự gia tăng LH liên quan đến giấc ngủ (xem Hình 16.12). Lấy mẫu ban ngày đánh giá thấp sự gia tăng gonadotropin trong giai đoạn dậy thì sớm vì nó không phát hiện được phần lớn sự gia tăng liên quan đến giấc ngủ này. Trong giai đoạn dậy thì sớm, các xét nghiệm hiện tại cho thấy LH tăng trong khi ngủ để đạt đến đỉnh ở mức thấp của người lớn, thường trên 1.0 U/L và sau đó thường giảm trong ngày xuống 0.6 U/L hoặc thấp hơn. Một mẫu ban ngày duy nhất cũng không nhất thiết đại diện thực sự cho tình trạng dậy thì của trẻ vì nó không tính đến những thay đổi theo từng đợt và theo chu kỳ trong bài tiết gonadotropin. Đáp ứng LH huyết thanh với GnRH chỉ ra tình trạng dậy thì nhiều hơn một chút so với một mẫu nền buổi sáng (xem Hình 16.9) (Bảng 16.1). Mức LH 1 giờ sau khi dùng chất chủ vận GnRH từ 3.2 U/L trở lên có độ nhạy 90% và từ 5.5 U/L trở lên có độ đặc hiệu 95% cho sự khởi đầu của dậy thì ở các bé gái. Đáp ứng của LH với việc sử dụng GnRH hoặc chất chủ vận GnRH tăng nhiều hơn so với FSH trong tuổi dậy thì, với kết quả là sự gia tăng tỷ lệ LH:FSH. Các chất chủ vận GnRH thêm một chiều vào xét nghiệm GnRH: chúng cung cấp một kích thích đủ mạnh và kéo dài để giải phóng LH và FSH nhằm mang lại sự gia tăng bài tiết estradiol của buồng trứng ở các bé gái dậy thì. Những đáp ứng này cũng tăng một cách đặc trưng cùng với sự trưởng thành sinh dục (xem Hình 16.6).
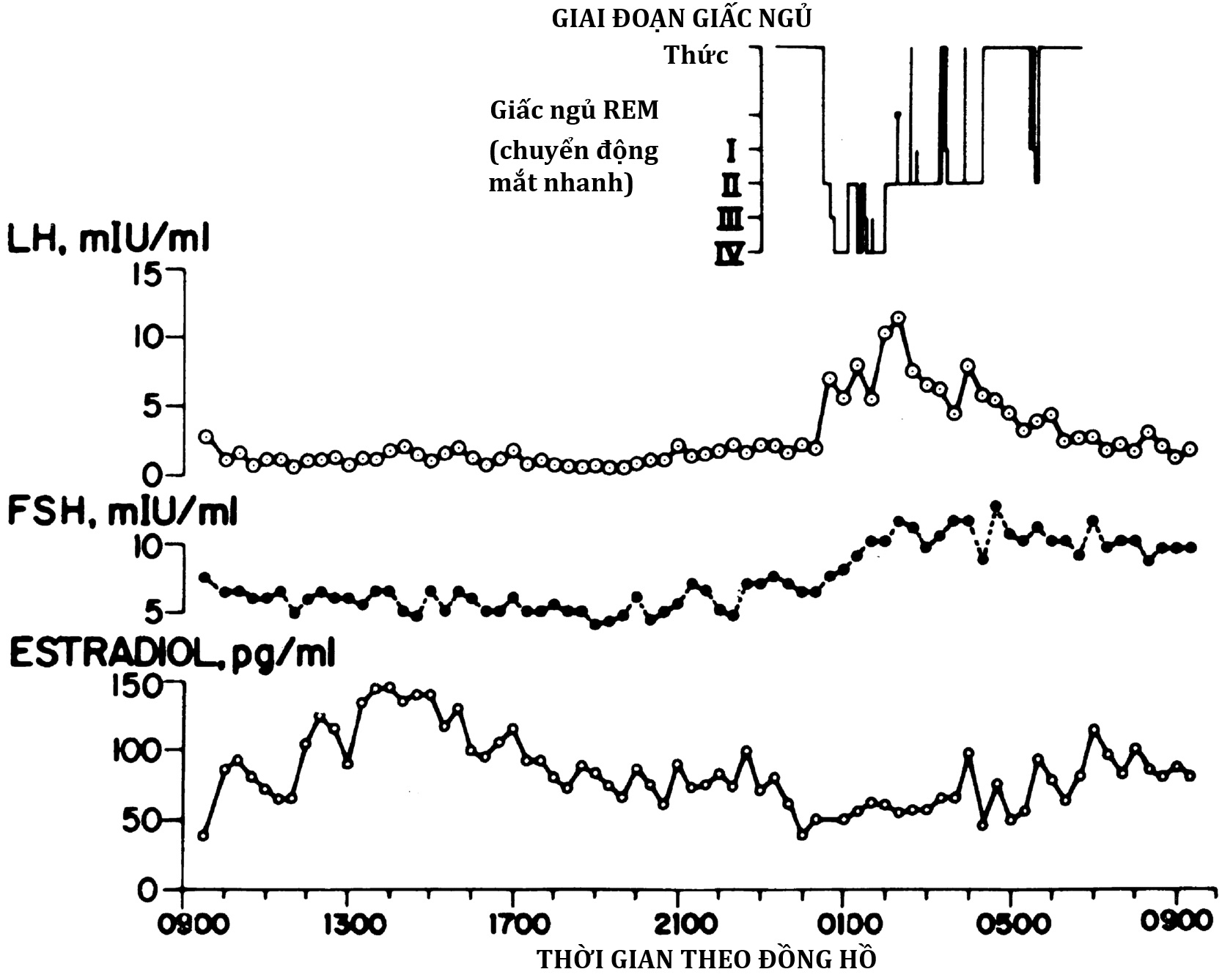
Hình 16.12Các mô hình của hormone tạo hoàng thể (LH), hormone kích thích nang trứng (FSH), và estradiol (E2) trong huyết thanh điển hình của dậy thì sớm ở nữ. Lưu ý rằng nồng độ gonadotropin ban ngày nằm trong khoảng tiền dậy thì. Cũng lưu ý bản chất từng đợt của việc giải phóng LH ở các khoảng thời gian từ 1 đến 3 giờ. Nồng độ estradiol được thấy dao động đáng kể trong ngày, tăng đến mức đỉnh khoảng 12 giờ sau các đợt tăng gonadotropin tối đa về đêm. (Từ Boyar, R.M., Wu, R.H.K., Roffwarg, H., et al. (1976). Human puberty: 24-hour estradiol patterns in pubertal girls. J Clin Endocrinol Metab, 43, 1418.)
Nồng độ hormone sinh dục tăng thêm là hệ quả của sự trưởng thành của buồng trứng và tuyến thượng thận. Nồng độ dậy thì là trung gian giữa nồng độ của các cá nhân tiền dậy thì và trưởng thành về mặt sinh dục. Bảng 16.1 cho thấy các khoảng giá trị bình thường điển hình cho nồng độ trong huyết thanh của các hormone steroid chính. Một khi đạt được nồng độ estrogen và androgen của tuổi dậy thì, các tác động của chúng thường trở nên rõ ràng trong vòng 6 tháng.
Nồng độ AMH huyết thanh ổn định ở mức người lớn từ 0.5 đến 6.2 ng/mL (3.5–45 pM) ở nữ giới sau có kinh có hình thái buồng trứng bình thường. Chúng không dao động trong chu kỳ kinh nguyệt bình thường, phản ánh sự cân bằng giữa việc tuyển chọn các nang trứng đang phát triển và sự phát triển của các nang trứng có hốc. Nồng độ AMH huyết thanh là một chỉ số về số lượng nang trứng đang phát triển, và do đó lập chỉ mục kích thước của pool noãn bào (“dự trữ buồng trứng”); AMH bắt đầu giảm cùng với pool noãn bào ở người lớn tiền mãn kinh và trở nên không thể phát hiện được sau mãn kinh. Nồng độ AMH cũng phản ánh tình trạng androgen trong nang trứng của phụ nữ có khả năng sinh sản, có lẽ vì androgen kích thích các giai đoạn đầu của sự phát triển nang trứng. Prolactin huyết thanh tăng vừa phải ở nữ giới vào khoảng 14 tuổi. Đây có thể là một đáp ứng với bài tiết estrogen vì nó không xảy ra ở các bé trai.
Lâm sàng
Dấu hiệu thể chất đầu tiên của dậy thì là sự phát triển vú (Phát triển vú). Ở một số ít bé gái, sự phát triển lông mu xảy ra trước Phát triển vú. Phát triển vú đại diện cho một đáp ứng với estrogen, và sự phát triển lông mu là một đáp ứng với androgen. Khi sự phát triển lông mu có trước Phát triển vú, nó thường là một sự phản ánh của việc sản xuất androgen thượng thận (dậy thì thượng thận) hơn là một dấu hiệu của dậy thì thực sự. Các giai đoạn phát triển của vú và lông mu được thể hiện trong Hình 16.30. Giai đoạn 1 theo Tanner là tiền dậy thì. Giai đoạn ban đầu của sự phát triển vú (giai đoạn 2, B2) được nhận biết như một nụ dưới quầng vú có thể sờ thấy trước khi nó có thể được nhìn thấy như một sự nhô lên. Giai đoạn B3 là sự phình to và nhô lên rõ ràng của toàn bộ vú. Giai đoạn B4, giai đoạn gò quầng vú, rất thoáng qua và có thể không nhất thiết xuất hiện. Giai đoạn B5 là giai đoạn đạt được đường nét vú trưởng thành. Lông mu đầu tiên bắt đầu như sự phát triển lông mu tiền sinh dục (PH2)—những sợi lông ngắn hơn, nhạt màu hơn, và thẳng hơn so với lông mu sinh dục, nhưng dài hơn lông tơ trên cơ thể. Rậm lông đôi khi bị nhầm lẫn với lông mu giai đoạn 2; những trường hợp này có thể được phân biệt bằng cách so sánh lông bộ phận sinh dục với lông trên cẳng tay. Sự phát triển lông mu sinh dục (PH3)—lông xoăn vĩnh viễn (dài, sẫm màu)—thường bắt đầu ở môi lớn trước khi lan ra vùng mu. Lông mu sau đó dần dần tiến triển đến hình dạng khiên mu nữ trưởng thành (mô hình tam giác ngược, giai đoạn 5). Lông nách thường xuất hiện khoảng một năm sau lông mu và trải qua các giai đoạn tương tự.
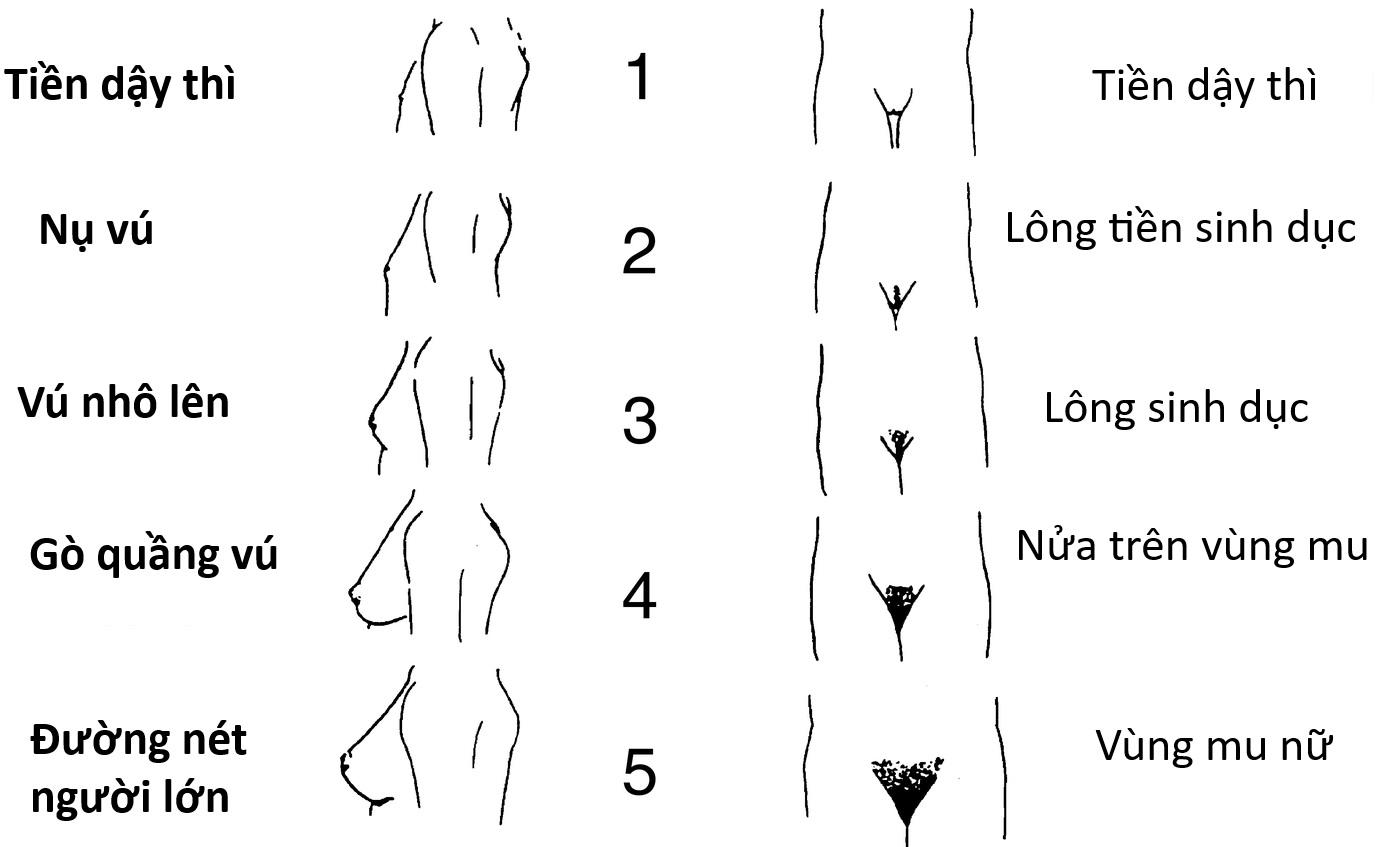
Hình 16.30 Các giai đoạn phát triển của vú và lông mu. (Chỉnh sửa từ Ross, G.T., Vande Wiele, R. (1974). The ovary. In: Williams, R.H. (ed.), Textbook of Endocrinology, 5th ed. Philadelphia, WB Saunders.)
Tuổi mà các mốc dậy thì thường đạt được không được biết một cách chắc chắn. Đã có nhiều tranh luận về tính bình thường của những thay đổi dậy thì trong khoảng từ 6.0 đến 8.0 tuổi. Cuộc tranh luận xuất phát từ các quan sát thực hành tại phòng khám cho thấy sự phát triển vú và lông mu được tìm thấy thường xuyên hơn dự kiến ở các bé gái da đen trong độ tuổi này. Tỷ lệ hiện mắc của các mốc dậy thì sau đó đã được ước tính cho dân số chung của Hoa Kỳ bằng cách lập mô hình dữ liệu cắt ngang được thu thập từ năm 1988 đến 1994 trên trẻ em từ 8.0 tuổi trở lên bởi Khảo sát Kiểm tra Sức khỏe và Dinh dưỡng Quốc gia III (NHANES III). Dữ liệu NHANES có lợi thế là lấy mẫu đại diện toàn quốc, nhưng dữ liệu giai đoạn vú dựa trên quan sát và do đó chất lượng dữ liệu còn bị nghi ngờ, và các giả định lập mô hình cho phép ngoại suy đến các độ tuổi trẻ hơn có thể không hợp lệ. Tuổi trung vị mà các mốc dậy thì chính đạt được ở các bé gái Hoa Kỳ có cân nặng bình thường theo cơ sở dữ liệu này được đưa ra trong Bảng 16.3. Những dữ liệu này chỉ ra rằng dậy thì bắt đầu trước 8.0 tuổi ở ít hơn 5% dân số nữ bình thường nói chung, mặc dù vú có thể xuất hiện bình thường trong năm thứ bảy ở người da đen và người Mỹ gốc Mexico.
Bảng 16.3 Đạt được các mốc dậy thì ở các bé gái có chỉ số khối cơ thể bình thường trong dân số chung của Hoa Kỳ, NHANES III, 1988-1994.
| Giai đoạn | 5% | 50% | 95% |
|---|---|---|---|
| Giai đoạn Vú 2 | 8.25 | 10.2 | 12.1 |
| Giai đoạn Lông mu 3 | 9.25 | 11.6 | 13.9 |
| Kinh nguyệt | 11.0 | 12.6 | 14.1 |
(Chỉnh sửa từ Rosenfield, R.L., Lipton, R.B., Drum, M.L. (2009). Phát triển vú, sự phát triển lông mu, and menarche attainment in children with normal and elevated body mass index. Pediatrics, 123, 84–88.)
Trước 8.0 tuổi, vú xuất hiện ở 12% đến 19% và lông mu sinh dục (giai đoạn 3) ở ≤ 3% các bé gái có chỉ số khối cơ thể bình thường không phải gốc Tây Ban Nha da đen và người Mỹ gốc Mexico. Các mốc kinh nguyệt đạt được ở các độ tuổi tương tự trong các nhóm dân tộc này ngoại trừ phân vị thứ 5 sớm hơn đáng kể ở người da đen (10.5 tuổi) so với người da trắng không phải gốc Tây Ban Nha (11.3 tuổi).
Một nghiên cứu đương đại hơn về dậy thì ở nữ được thực hiện từ năm 2004 đến 2011. Thiết kế đã được cải thiện: thu thập dữ liệu theo chiều dọc và sự phát triển của vú được xác định bằng cách sờ nắn. Tuy nhiên, mặc dù thiết kế bao gồm đại diện rộng rãi về chủng tộc/dân tộc và kinh tế xã hội, nó không đại diện cho toàn quốc, ví dụ, quần thể nghiên cứu được làm giàu thêm người châu Á. Phân bố tổng thể về thời điểm dậy thì đã dịch chuyển sang các độ tuổi sớm hơn khoảng 0.75 năm đối với sự phát triển vú và 0.35 năm đối với kinh nguyệt so với NHANES III. Dữ liệu xác nhận rằng các bé gái da đen không phải gốc Tây Ban Nha có cân nặng bình thường đạt được các mốc dậy thì sớm hơn các bé gái da trắng, khoảng 0.75 đến 1.0 năm đối với Phát triển vú và 0.5 đến 0.75 năm đối với kinh nguyệt; do đó, Phát triển vú thường có thể xảy ra trong năm thứ bảy của cuộc đời ở người da đen. Các mốc dậy thì ở các bé gái châu Á tương tự như ở người da trắng, và ở người gốc Tây Ban Nha tương tự như người da đen.
Béo phì và các yếu tố dân tộc hiện nay dường như là các yếu tố độc lập làm sớm sự khởi đầu của dậy thì và kinh nguyệt, với béo phì có ảnh hưởng lớn hơn. Nghiên cứu theo chiều dọc chỉ ra rằng béo phì có liên quan đến việc làm sớm tuổi Phát triển vú (0.7 năm) một cách chặt chẽ hơn và gấp đôi so với việc làm sớm tuổi có kinh (0.3 năm).
Nhịp độ dậy thì, khoảng thời gian giữa sự khởi đầu của phát triển vú (B2) và kinh nguyệt, thường là 2.3 ± 1.0 năm. Tuy nhiên, béo phì nghịch lý lại có liên quan đến việc làm sớm đáng kể tuổi Phát triển vú trong khi làm chậm đáng kể nhịp độ dậy thì và bảo tồn tiềm năng chiều cao. Có thể việc làm sớm tuổi Phát triển vú do béo phì không hoàn toàn là do sự sớm của dậy thì thần kinh-nội tiết mà một phần phát sinh từ sự hình thành estrogen ngoài tuyến sinh dục từ các tiền chất thượng thận trong mô mỡ dư thừa; điều này có thể giải thích, một phần, sự cùn đi biểu kiến của dậy thì thần kinh-nội tiết sớm ở các bé gái béo phì có Phát triển vú sớm. Mặt khác, một phân nhóm trưởng thành sớm có tiền sử chậm tăng trưởng trong tử cung dường như có một nhịp độ dậy thì nhanh bất thường và mất tiềm năng chiều cao.
Sự khởi đầu của dậy thì có liên quan chặt chẽ hơn với tuổi xương của một cá nhân so với tuổi đời. Điều này đặc biệt quan trọng trong trường hợp các đối tượng bước vào tuổi dậy thì muộn hơn so với trung bình, như đã thảo luận trước đây. Phần lớn các bé gái có thể được dự kiến sẽ bắt đầu dậy thì vào thời điểm tuổi xương của chúng đạt 12.5 tuổi và có kinh nguyệt vào thời điểm tuổi xương đạt 14 tuổi.
Đợt tăng trưởng dậy thì ở các bé gái xảy ra trong giai đoạn đầu vị thành niên. Đỉnh của vận tốc tăng trưởng tuyến tính tương ứng chặt chẽ nhất với giai đoạn B2 và sự gia tăng nồng độ phosphatase kiềm trong huyết thanh với B3. Sự tích tụ mỡ tăng lên và sự phân bố mỡ cũng thay đổi. Là hệ quả của những thay đổi dậy thì này xảy ra không đồng bộ với tuổi đời, các bé gái bắt đầu khác biệt đáng kể về kích thước và thể trạng trong năm thứ chín của cuộc đời.
Chu kỳ Kinh nguyệt của Người trưởng thành
Chu kỳ kinh nguyệt của người trưởng thành trẻ tuổi trung bình dài 28 ngày (người lớn bình thường 24–38 ngày). Sự thay đổi về độ dài chu kỳ gần như hoàn toàn là do sự khác biệt về thời gian của giai đoạn nang trứng. Giai đoạn hoàng thể, thời gian giữa rụng trứng và bắt đầu có kinh, luôn kéo dài 14 ± 1 (SD) ngày.
Những thay đổi theo chu kỳ của nồng độ LH, FSH, estradiol, và progesterone trong huyết thanh trong chu kỳ kinh nguyệt được thể hiện trong Hình 16.13. Các dao động theo nhịp ngày đêm và từng đợt được chồng lên những thay đổi theo chu kỳ này. Vì testosterone và androstenedione có cả nguồn gốc từ tuyến thượng thận và buồng trứng, nồng độ của chúng dao động ở một mức độ nào đó theo các mô hình chu kỳ, ngày đêm, và từng đợt. Ví dụ, nồng độ testosterone có xu hướng cao hơn 20% vào buổi sáng so với buổi tối và tăng gấp đôi vào giữa chu kỳ. Khoảng giá trị bình thường cho hầu hết các nồng độ hormone sinh dục buồng trứng quan trọng của phụ nữ trong giai đoạn nang trứng sớm của chu kỳ kinh nguyệt được đưa ra trong Bảng 16.1. Nồng độ progesterone dưới 100 ng/dL cho đến giai đoạn quanh rụng trứng của chu kỳ và sau đó đạt đỉnh trên 500 ng/dL vào giữa giai đoạn hoàng thể. Tốc độ sản xuất hormone cho giai đoạn giữa nang trứng ở phụ nữ được đưa ra trong Bảng 16.2. Prolactin huyết thanh tăng thoáng qua vào giữa chu kỳ với sự bài tiết estradiol buồng trứng tối đa. Nồng độ prolactin cũng tăng thoáng qua để đáp ứng với sự kích thích vú và các yếu tố tâm lý.
Các biến thể bình thường trong sự phát triển dậy thì
Mặc dù sự khởi đầu của phát triển vú (giai đoạn B2) đặc trưng có trước sự xuất hiện của lông mu sinh dục (PH3) và sự khởi đầu của kinh nguyệt một cách đáng kể (xem Bảng 16.3), có sự thay đổi đáng kể trong trình tự của các sự kiện này. Lông mu có thể xuất hiện trước khi vú bắt đầu phát triển, một tình huống phát sinh do thiếu sự liên kết trực tiếp giữa dậy thì thượng thận và dậy thì tuyến sinh dục. Kinh nguyệt có thể xảy ra trong vòng vài tháng sau khi vú xuất hiện; tuy nhiên, điều này rất bất thường đến mức sự xuất hiện của nó đòi hỏi phải loại trừ một trạng thái cường estrogen bất thường.
Một biến thể bình thường phổ biến là sự khởi đầu phát triển vú một bên. Sự phát triển vú một bên có thể tồn tại đến 2 năm trước khi vú bên kia có thể sờ thấy. Hiện tượng này dường như liên quan đến một sự bất đối xứng thường tồn tại đến tuổi trưởng thành. Sinh thiết cắt bỏ một nhú vú một bên bình thường để tìm kiếm một khối u không tồn tại nên được tránh, vì một thủ thuật như vậy sẽ cắt bỏ toàn bộ mầm vú.
Hai biến thể cực đoan của bình thường là những nguyên nhân phổ biến nhất của sự phát triển sinh dục sớm. Đó là sự xuất hiện đơn độc của sự phát triển vú (Phát triển vú sớm) và sự xuất hiện đơn độc của lông sinh dục (sự phát triển lông mu sớm).
Phát triển vú sớm
Sự phát triển vú trước 8.0 tuổi theo truyền thống được coi là sớm. Phát triển vú sớm là một dạng dậy thì sớm không hoàn toàn, rất nhẹ, không tiến triển hoặc tiến triển chậm, là một biến thể của bình thường. Trong nhóm tuổi từ 6 đến 8, nó thường là do béo phì, có thể làm tăng tốc độ khởi phát dậy thì, giải thích cho việc tăng sản xuất estrogen ngoại vi, hoặc gây ra tình trạng vú to do mỡ giả. Nếu không, nó thường dường như là do sự hoạt động quá mức tinh tế vô căn của trục tuyến yên-buồng trứng, xảy ra ở những bé gái có nồng độ FSH có xu hướng được duy trì ở khoảng cuối trên của khoảng giá trị bình thường tiền dậy thì. Nồng độ FSH huyết thanh trung bình lúc đói và đáp ứng với GnRH tăng đáng kể, trong khi nồng độ LH thì không. Nồng độ estradiol thường dưới mức phát hiện trong hầu hết các xét nghiệm tiêu chuẩn, nhưng tăng đáng kể theo xét nghiệm siêu nhạy, và đôi khi tìm thấy sự estrogen hóa cấp thấp không liên tục của niêm mạc niệu-sinh dục (xem Hình 16.11). Siêu âm buồng trứng cho thấy sự gia tăng tỷ lệ hiện mắc của các nang trứng có hốc (“vi nang”) và tử cung to ra. Tuy nhiên, không có đợt tăng trưởng đột biến nào xảy ra, tốc độ tiến triển của tuổi xương không bất thường, và kinh nguyệt không xuất hiện cho đến tuổi thông thường.
Ở trẻ sơ sinh, hội chứng này dường như là do sự chậm trễ trong việc ức chế sự kích hoạt thoáng qua của trục HPG của trẻ sơ sinh và thường không bền vững. Ở trẻ lớn hơn, sự phát triển của vú có nhiều khả năng tồn tại hơn. Một phân nhóm bị “Phát triển vú quá mức” có tốc độ tăng trưởng tăng với sự tiến triển của tuổi xương tương đối tương xứng. Sự kích hoạt thần kinh-nội tiết không bền vững hoặc không liên tục của chúng dường như nằm trên một phổ giữa Phát triển vú sớm thông thường và dậy thì sớm thực sự (Hình 16.31). Tuy nhiên, đột biến hội chứng McCune-Albright được tìm thấy trong máu ngoại vi của khoảng 25% bệnh nhân như vậy. Phát triển vú sớm có thể là dấu hiệu đầu tiên của các rối loạn gây nữ hóa (xem Dậy thì sớm). Do đó, việc theo dõi những bệnh nhân này là cần thiết.

Hình 16.31. Phổ bài tiết gonadotropin ở các bé gái có dậy thì bình thường và bất thường. Các bé gái bình thường được hình dung là có một lượng nhỏ kích hoạt trục tuyến yên-buồng trứng, nhiều hơn so với các bé gái bị suy sinh dục bẩm sinh. Phát triển vú sớm, Phát triển vú quá mức, dậy thì sớm tiến triển chậm, và dậy thì sớm tiến triển nhanh nằm trên một phổ tăng dần kích hoạt của trục—với sự suy giảm tiềm năng chiều cao chỉ xảy ra ở những người gần cuối phổ kích hoạt nhất. CPP, dậy thì sớm trung ương.(Chỉnh sửa từ Kreiter, M.L., Cara, J.F., Rosenfield, R.L. (1993). Modifying the outcome of complete precocious puberty: To treat or not to treat. In: Grave, G.D., Cutler, G.B. (eds.), Sexual Precocity: Etiology, Diagnosis, and Management. New York, Raven Press, p. 109–120.)
Sự phát triển lông mu sớm
Sự xuất hiện đơn độc của lông mu sinh dục trước 8.0 tuổi ở các bé gái (sự phát triển lông mu sớm) thường là do dậy thì thượng thận sớm, như sẽ được thảo luận tiếp theo. Tuy nhiên, nó có thể xảy ra ở nồng độ androgen bình thường đối với trẻ mẫu giáo (sự phát triển lông mu sớm vô căn). Điều này có khả năng phản ánh sự tăng nhạy cảm của PSU với nồng độ androgen thấp trước dậy thì thượng thận, tương tự như rậm lông vô căn ở người lớn, trong đó sự phát triển lông sinh dục tăng lên mà không có bằng chứng khác về cường androgen. Cơ chế có thể là do hoạt động của gen thụ thể androgen tăng lên.
Dậy thì thượng thận sớm là một dạng dậy thì sớm không hoàn toàn, rất nhẹ, tiến triển chậm, thường là một biến thể của bình thường. Nó thường dường như là do sự phát triển sớm của lớp lưới như được chỉ ra bởi sự gia tăng nồng độ androgen thượng thận trên mức của trẻ mẫu giáo. Tình trạng này thường được phát hiện khi một đứa trẻ có biểu hiện sự phát triển lông mu sớm hoặc các biểu hiện lâm sàng khác của hoạt động androgen, chẳng hạn như mùi cơ thể kiểu người lớn hoặc mụn trứng cá. Sự dư thừa androgen thường rất tinh tế đến mức không có đợt tăng trưởng đột biến rõ ràng, tuổi xương thường không tiến triển bất thường, và không có các dấu hiệu khác của sự trưởng thành sinh dục. Chẩn đoán đòi hỏi phải chứng minh bằng hóa sinh một mô hình steroid huyết thanh chỉ ra dậy thì thượng thận trước 8 tuổi ở các bé gái, ví dụ, DHEAS 40 đến 130 mcg/dL và các nồng độ androgen khác chỉ tăng nhẹ so với tuổi (xem Bảng 16.1). Thuật ngữ này đôi khi được sử dụng để mô tả bằng chứng hóa sinh của dậy thì thượng thận bất kể các biểu hiện lâm sàng.
Dậy thì thượng thận quá mức là một loại dậy thì thượng thận sớm cực đoan về mặt lâm sàng. Những bé gái này có các đặc điểm lâm sàng gợi ý sự dư thừa androgen tinh tế (ví dụ, sự tiến triển đáng kể của tuổi xương, nhưng không có phì đại âm vật) hoặc kháng insulin (ví dụ, béo phì trung tâm hoặc gai đen). Những đứa trẻ như vậy thường có sự khởi đầu dậy thì thực sự hơi sớm, nhưng tiềm năng chiều cao không bị ảnh hưởng. Thuật ngữ dậy thì thượng thận quá mức đã được áp dụng khác nhau nhưng ở đây được dùng khi bức tranh lâm sàng không điển hình có liên quan đến nồng độ androgen huyết thanh trên mức bình thường đối với dậy thì sớm (xem Bảng 16.1), ví dụ, DHEAS trên 130 mcg/dL hoặc testosterone trên 35 ng/dl, hoặc tuổi xương trên tuổi chiều cao 20%. Các rối loạn gây nam hóa nên được loại trừ ở các bé gái bị dậy thì thượng thận quá mức được định nghĩa như vậy.
Nguyên nhân của dậy thì thượng thận sớm thường dường như đơn giản là do sự khởi đầu sớm của sự phát triển lớp lưới bình thường, nhưng đôi khi nó dường như là một biểu hiện sớm của sự rối loạn điều hòa sinh steroid của hội chứng buồng trứng đa nang. Dậy thì thượng thận sớm dường như có nguy cơ phát triển hội chứng buồng trứng đa nang khoảng 10% đến 20%; không rõ liệu những người bị dậy thì thượng thận quá mức có phải là những người có nguy cơ chính hay không. Dậy thì thượng thận sớm với kháng insulin có liên quan độc lập với béo phì, tăng cân nhanh trong thời thơ ấu, và cân nặng khi sinh thấp. Sự dư thừa IGF-1 của liệu pháp GH có thể là một yếu tố nguy cơ. Các mối liên quan cũng tồn tại giữa dậy thì thượng thận sớm và các tổn thương thùy thái dương và vẹo cột sống do bại liệt. Các yếu tố di truyền cũng rất quan trọng. Khả năng di truyền của nồng độ DHEAS sulfate trong máu được ước tính là 26% đến 66%. Những người mang gen CAH có thể có tỷ lệ cao hơn trong nhóm này. Lập trình biểu sinh dường như là một yếu tố: sự nam hóa trước khi sinh của các loài linh trưởng không phải người gây ra cường androgen thượng thận chức năng như một phần của phổ PCOS, và suy dinh dưỡng bào thai đã được giả thuyết là lập trình cho kháng insulin bằng cách kích hoạt hệ thống limbic-dưới đồi-tuyến yên-thượng thận để gây ra dư thừa corticoid bào thai.
Chẩn đoán phân biệt của sự phát triển lông mu và adrenarche sớm bao gồm các rối loạn gây nam hóa, trong đó CAH không điển hình là phổ biến nhất. Các bé gái bị dậy thì thượng thận sớm nên được theo dõi qua tuổi dậy thì để phát hiện khả năng phát triển cường androgen. Một phương pháp tiếp cận được đề xuất để loại trừ các rối loạn cường androgen nghiêm trọng trong thời thơ ấu được gợi ý trong thuật toán đi kèm (Hình 16.32).
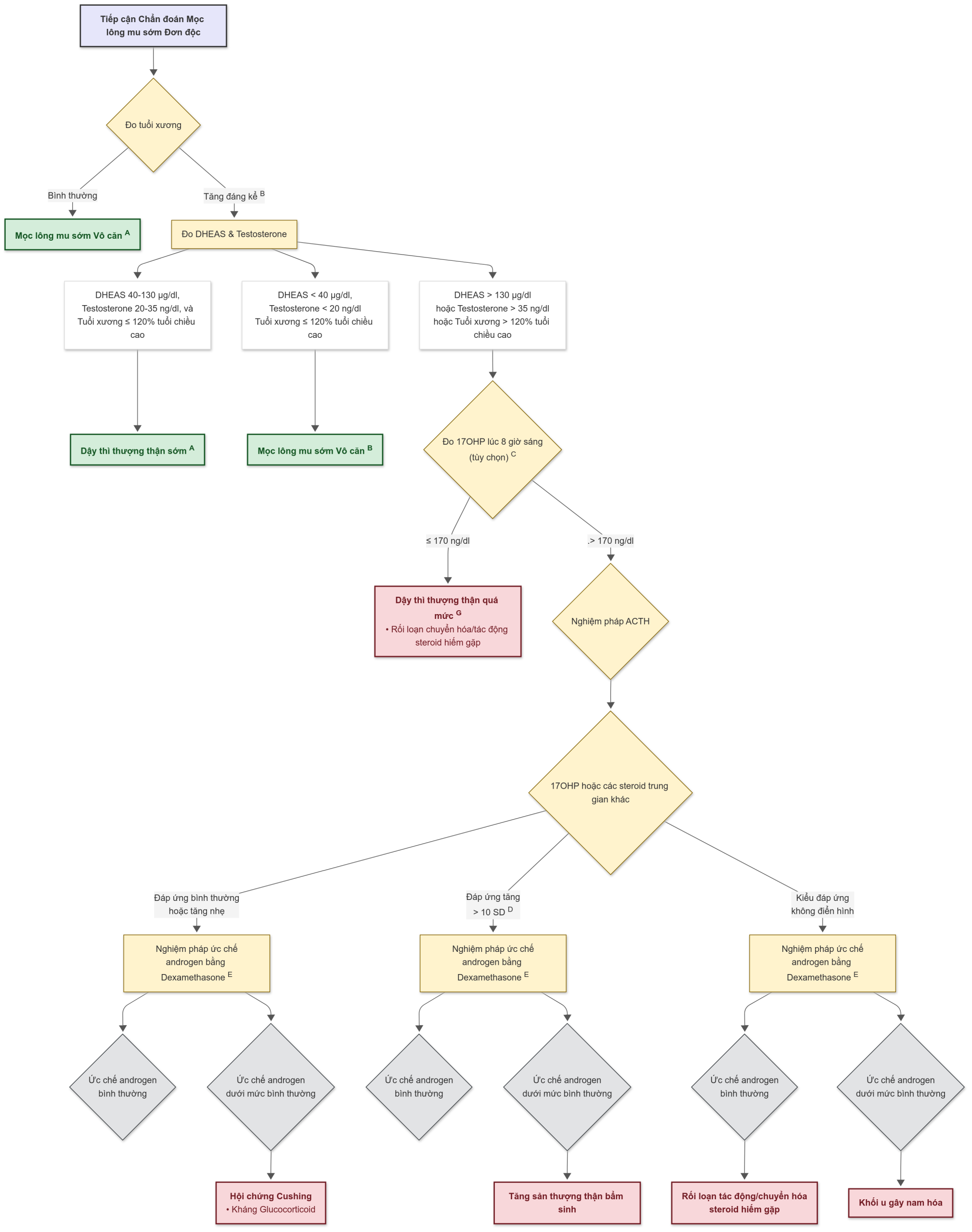
Hình 16.32 Một quy trình làm việc để sàng lọc các rối loạn cường androgen-gây nam hóa là nguyên nhân của sự phát triển lông mu sớm. Dậy thì thượng thận sớm hoặc quá mức chiếm phần lớn các trường hợp sự phát triển lông mu sớm; tăng sản thượng thận bẩm sinh không điển hình do thiếu hụt 21-hydroxylase, nguyên nhân cường androgen phổ biến nhất, chiếm ít hơn 10% ở hầu hết các quần thể/nhóm dân tộc. SD, độ lệch chuẩn. (Chỉnh sửa với sự cho phép từ Rosenfield, R.L. (2018). Premature adrenarche. UpToDate.)
Chú thích: A. Các chẩn đoán sự phát triển lông mu sớm vô căn, dậy thì thượng thận sớm, hoặc dậy thì thượng thận quá mức, hoặc dựa trên tuổi xương và/hoặc các phép đo nội tiết là các chẩn đoán tạm thời. Ngay cả khi các xét nghiệm này bình thường hoặc chỉ tăng nhẹ, việc theo dõi lâm sàng là cần thiết để loại trừ sự tiến triển quá mức của sự phát triển lông mu hoặc bằng chứng nam hóa. Điều này là do việc giải thích tuổi xương và độ chính xác của các xét nghiệm testosterone ở mức độ thấp thường có vấn đề, và vì thuật toán này sẽ không phát hiện được một số trường hợp cường androgen rất nhẹ. B. Một tuổi xương tiến triển đáng kể so với tuổi đời là một chỉ định cho một quy trình xét nghiệm sàng lọc cường androgen thời thơ ấu, bao gồm nồng độ dehydroepiandrosterone sulfate (DHEAS) và testosterone. Một tuổi xương vượt quá tuổi chiều cao cho thấy tiềm năng chiều cao thấp hơn trung bình. Một tiềm năng chiều cao bị tổn hại (được chỉ ra bởi chiều cao người lớn dự đoán thấp hơn dự kiến cho gia đình hoặc tuổi xương > 120% tuổi chiều cao ở một đứa trẻ nhỏ) hoặc nồng độ DHEAS hoặc testosterone trên khoảng giá trị dậy thì thượng thận bình thường (tương ứng là 130 mcg/dL và 35 ng/dL) cho thấy rằng sự phát triển lông mu sớm có thể là do một rối loạn gây nam hóa chứ không phải là dậy thì thượng thận sớm thông thường. C. Một phép đo nền 17-hyroxyprogesterone (17-OHP) lúc 8:00 sáng là một lựa chọn thay cho nghiệm pháp hormone vỏ thượng thận (ACTH) trong một gia đình, quần thể, hoặc nhóm dân tộc có nguy cơ tương đối thấp đối với tăng sản thượng thận bẩm sinh không điển hình do thiếu hụt 21-hydroxylase. Mức trên 170 ng/mL (5.1 nmol/L) có độ nhạy và độ đặc hiệu từ 95% trở lên đối với rối loạn này ở những bệnh nhân sự phát triển lông mu sớm khi được lấy vào lúc 8:00 sáng, trước khi nồng độ giảm dần cùng với sự bài tiết ACTH theo nhịp ngày đêm. Một mức nền bình thường không nhất thiết loại trừ rối loạn này hoặc các dạng tăng sản thượng thận bẩm sinh không điển hình hiếm gặp hơn. D. Đối với nghiệm pháp ACTH, đáp ứng điển hình trong tăng sản thượng thận bẩm sinh (CAH) là steroid ngay trước khối enzyme tăng rất cao, và các steroid sớm hơn trong con đường sinh tổng hợp tăng ít hơn liên tiếp càng xa khối. Ví dụ, trong thiếu hụt 21-hydroxylase, 17-OHP tăng rất cao và androstenedione và testosterone tăng ít hơn liên tiếp; trong thiếu hụt 3beta-hydroxysteroid dehydrogenase loại 2, các đáp ứng 17-hydroxypregnenolone và DHEA tăng rất cao và 17-hydroxyprogesterone, androstenedione, và testosterone tăng từ nhẹ đến trung bình. Một mức nền 17-OHP tăng cao có thể ngăn cản một đáp ứng rõ ràng với nghiệm pháp ACTH. Đối với nghiệm pháp ACTH, một mô hình đáp ứng không điển hình là một mô hình không điển hình cho bất kỳ loại CAH nào. Một ví dụ về một đáp ứng không điển hình sẽ là sự tăng androstenedione hoặc testosterone nền hoặc sau ACTH lớn hơn so với 17-OHP. E. Nghiệm pháp ức chế androgen bằng dexamethasone bao gồm việc sử dụng dexamethasone, 1 mg/m2/ngày chia làm ba đến bốn liều mỗi ngày trong 4 ngày, và sau đó đo cortisol, DHEAS, và androgen trong huyết thanh vào buổi sáng ngày thứ năm sau một liều dexamethasone cuối cùng. Thông thường, cortisol huyết thanh giảm xuống dưới 1 mcg/dL (28 nmol/L), testosterone xuống dưới 10 ng/dL, và DHEAS xuống dưới 40 mcg/dL. Các chất trung gian androgen trong huyết thanh cũng giảm xuống nồng độ tiền dậy thì.
Chậm tăng trưởng và phát triển dậy thì có tính chất cơ địa
Theo định nghĩa thống kê, dậy thì muộn xảy ra ở 3% các bé gái. Hầu hết những bé gái này đều bình thường, trong trường hợp đó, tình trạng này được gọi là chậm tăng trưởng và phát triển dậy thì có tính chất cơ địa (CDGP). Nó có tính chất gia đình; 80% trong một loạt nghiên cứu lớn có cha hoặc mẹ bị dậy thì muộn một cách khách quan. Tiền sử gia đình bị dậy thì muộn được tìm thấy ở 50% đến 75% bệnh nhân bị CDGP. Mặc dù sự di truyền của nó có khả năng phức tạp, một số yếu tố di truyền có khuynh hướng dường như có tác động trội. Từ lâu người ta đã nhận ra rằng dậy thì muộn có tỷ lệ cao hơn trong các gia đình có các trường hợp suy sinh dục do giảm gonadotropin vô căn hoặc vô kinh do vùng dưới đồi, và các biến thể hiếm gặp trong các gen nền tảng của các tình trạng này dường như góp phần vào nguyên nhân. Điều tra phân tử gần đây cho thấy rằng CDGP thực sự phân ly trong các gia đình với các mô hình di truyền phức tạp bao gồm liên kết X, trội và lặn trên nhiễm sắc thể thường và hai dòng, mặc dù các trường hợp lẻ tẻ cũng xảy ra. Trội trên nhiễm sắc thể thường là mô hình di truyền phổ biến nhất (có hoặc không có độ thấm hoàn toàn). Ban đầu, các gen ứng cử viên liên quan đến CDGP đã được xác định bằng cách sử dụng GWAS, phân tích liên kết, và các chiến lược giải trình tự mục tiêu. Tuy nhiên, gần đây giải trình tự toàn bộ exome và bộ gen đang ngày càng được sử dụng để xác định các gen ứng cử viên mới. Bất chấp những tiến bộ này, cơ sở di truyền và sinh lý bệnh thần kinh-nội tiết vẫn chưa được biết ở phần lớn bệnh nhân bị CDGP.
Các đột biến ở một số gen đã được liên kết với CDGP. Sáu gia đình không có quan hệ họ hàng từ một đoàn hệ Phần Lan bị dậy thì muộn đã được phát hiện có hai đột biến ở thành viên siêu họ immunoglobulin 10 (IGSF10) và bốn gia đình khác được phát hiện có hai biến thể hiếm gặp có ý nghĩa chưa rõ. Các đột biến ở IGSF10 dường như gây ra mức độ biểu hiện IGSF10 giảm trong quá trình phát triển phôi, dẫn đến sự di chuyển chậm của các tế bào thần kinh GnRH từ các hành khứu giác đến vùng dưới đồi. Sự rối loạn điều hòa di chuyển của tế bào thần kinh GnRH dẫn đến một cấu hình bất thường của mạng lưới tế bào thần kinh GnRH và một khiếm khuyết chức năng trong bài tiết GnRH trở nên quan trọng khi phải đạt được một mức ngưỡng bài tiết GnRH để khởi phát dậy thì. Các đột biến IGSF10 cũng được tìm thấy ở những phụ nữ bị vô kinh do vùng dưới đồi và ở những bệnh nhân bị suy sinh dục do giảm gonadotropin bẩm sinh (CHH), mặc dù những đột biến này dường như không đủ để gây ra kiểu hình một mình. Các đột biến mất chức năng ở IGSF1 đã được xác định ở những bệnh nhân bị suy giáp trung ương liên kết X, chậm tăng trưởng dậy thì, và chậm tăng nồng độ testosterone.
Các đột biến trong các gen được tìm thấy ở bệnh nhân bị CHH cũng được tìm thấy ở CDGP. Các đột biến ở heparan sulfate 6-O-sulfotransferase 1 (HS6ST1), thụ thể yếu tố tăng trưởng nguyên bào sợi 1 (FGFR1), và Klotho β (KLB) đã được tìm thấy ở một số họ hàng bị CHH và những người thân của họ bị CDGP. Các biến thể trong các gen mã hóa cho thụ thể hormone giải phóng gonadotropin (GNRHR), tachykinin 3 (TAC3) và thụ thể của nó (TACR3), thụ thể interleukin-17 D (IL17RD), và semaphorin 3A (SEMA3A) được biết là gây ra CHH đã được tìm thấy ở những bệnh nhân bị CDGP. Các đột biến ở 24 gen liên quan đến thiếu hụt GnRH được tìm thấy ở các proband bị CHH với tần suất lớn hơn so với ở CDGP, dẫn đến kết luận rằng CHH và CDGP có khả năng có nền tảng di truyền khác nhau. Các đột biến trong các gen hội chứng Kallmann như anosmin 1 (ANOS1) và yếu tố tín hiệu synaptonuclear và di chuyển tế bào thần kinh của thụ thể N-methyl-D-aspartic acid (NSMF) cho đến nay chưa được xác định trong các phả hệ bị CDGP. Các đột biến mất chức năng trong thụ thể GnRH là nguyên nhân thường gặp nhất của CHH lặn trên nhiễm sắc thể thường, chiếm 16% đến 40% bệnh nhân. Các đột biến đã được tìm thấy trong các miền ngoại bào, xuyên màng, và nội bào của thụ thể dẫn đến suy giảm hoạt động của GnRH. Một đột biến mất chức năng một phần đồng hợp tử ở GNRHR đã được tìm thấy ở hai anh em, một người bị CDGP và một người bị HH vô căn, và một đột biến dị hợp tử khác đã được tìm thấy ở một nam giới bị CDGP tự giới hạn. Do đó, nền tảng di truyền của CHH và GDGP có thể khác nhau, hoặc được chia sẻ bởi các gen chưa được phát hiện.
Các bé gái bị chậm phát triển có tính chất cơ địa thường có thể trạng mảnh mai hơn và có mật độ khoáng xương thấp hơn khi bước vào tuổi dậy thì so với các bé gái trưởng thành sớm hơn. Các bé gái thường không lo lắng về điều này cho đến khi họ vào trường trung học ở tuổi 14 và nhận ra rằng không chỉ sự phát triển dậy thì chưa bắt đầu, mà hầu hết bạn bè của họ đã có kinh nguyệt. Khi dậy thì xảy ra ở những đối tượng như vậy, nó hoàn toàn bình thường về nhịp độ. Tình trạng nội tiết bình thường đối với giai đoạn dậy thì. Chẩn đoán phân biệt bao gồm bệnh nội tiết, chuyển hóa, và hệ thống mãn tính của gần như bất kỳ loại nào, cũng như thiếu hụt gonadotropin, mà nó rất giống và khó phân biệt (xem Thiếu hụt Gonadotropin và Không rụng trứng do Vùng dưới đồi Chức năng).
Không rụng trứng sinh lý ở tuổi vị thành niên
Sự chưa trưởng thành của trục dưới đồi-tuyến yên-buồng trứng làm cho các chu kỳ kinh nguyệt dài hơn và không đều hơn trong những năm đầu sau có kinh (Hình 16.33). Khoảng một nửa số chu kỳ kinh nguyệt trong 2 năm đầu sau có kinh là không rụng trứng theo các tiêu chuẩn tiêu chuẩn; một nửa trong số này thực sự có bằng chứng về sự rụng trứng suy giảm dẫn đến suy hoàng thể (xem Khiếm khuyết Giai đoạn Hoàng thể). Mặc dù khoảng một nửa số chu kỳ có bất thường về rụng trứng này không đều, một nửa có độ dài bình thường theo tiêu chuẩn người lớn, do đó, chu kỳ kinh nguyệt của thanh thiếu niên bình thường chỉ khác một chút so với của người lớn ở độ tuổi sinh sản. Do đó, hầu hết các bất thường về rụng trứng ở thanh thiếu niên đều không có triệu chứng, với việc chảy máu kinh nguyệt theo chu kỳ xảy ra ở khoảng cách 21 đến 45 ngày ngay cả trong năm đầu tiên sau có kinh (Hình 16.34): nghịch lý này phát sinh vì chức năng buồng trứng theo chu kỳ chưa trưởng thành thường xảy ra trong các khoảng thời gian này. Những thay đổi nội tiết trong huyết thanh trong các chu kỳ kinh nguyệt của thanh thiếu niên bình thường xác nhận rằng sự phát triển nang trứng theo chu kỳ đáng kể nhưng chưa trưởng thành xảy ra ở những cô gái như vậy và một số thanh thiếu niên không có hoàng thể (Hình 16.35).
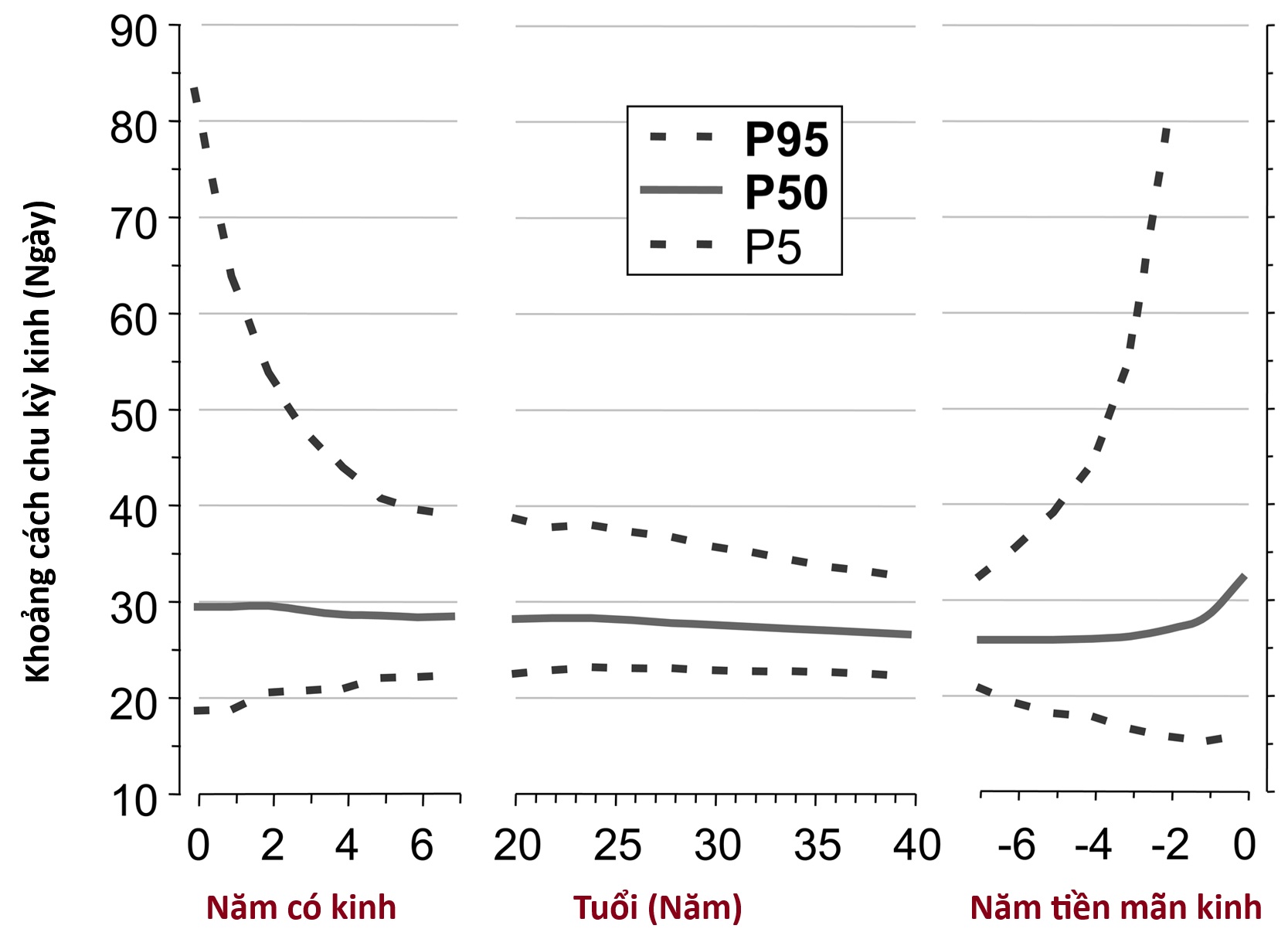
Hình 16.33. Khoảng giá trị bình thường cho khoảng cách giữa các chu kỳ kinh nguyệt. Lưu ý rằng khoảng cách chu kỳ trung bình hơn 90 ngày hoặc ít hơn 21 (19 ngày trong năm đầu tiên sau có kinh) ngày là bất thường ở mọi lứa tuổi. P5 và P95 = phân vị thứ 5 và 95, tương ứng. (Chỉnh sửa từ Treloar, A., Boynton, R., Benn, B., Brown, B. (1967). Variation of human menstrual cycle through reproductive life. Int J Fertil, 12, 77–84.)
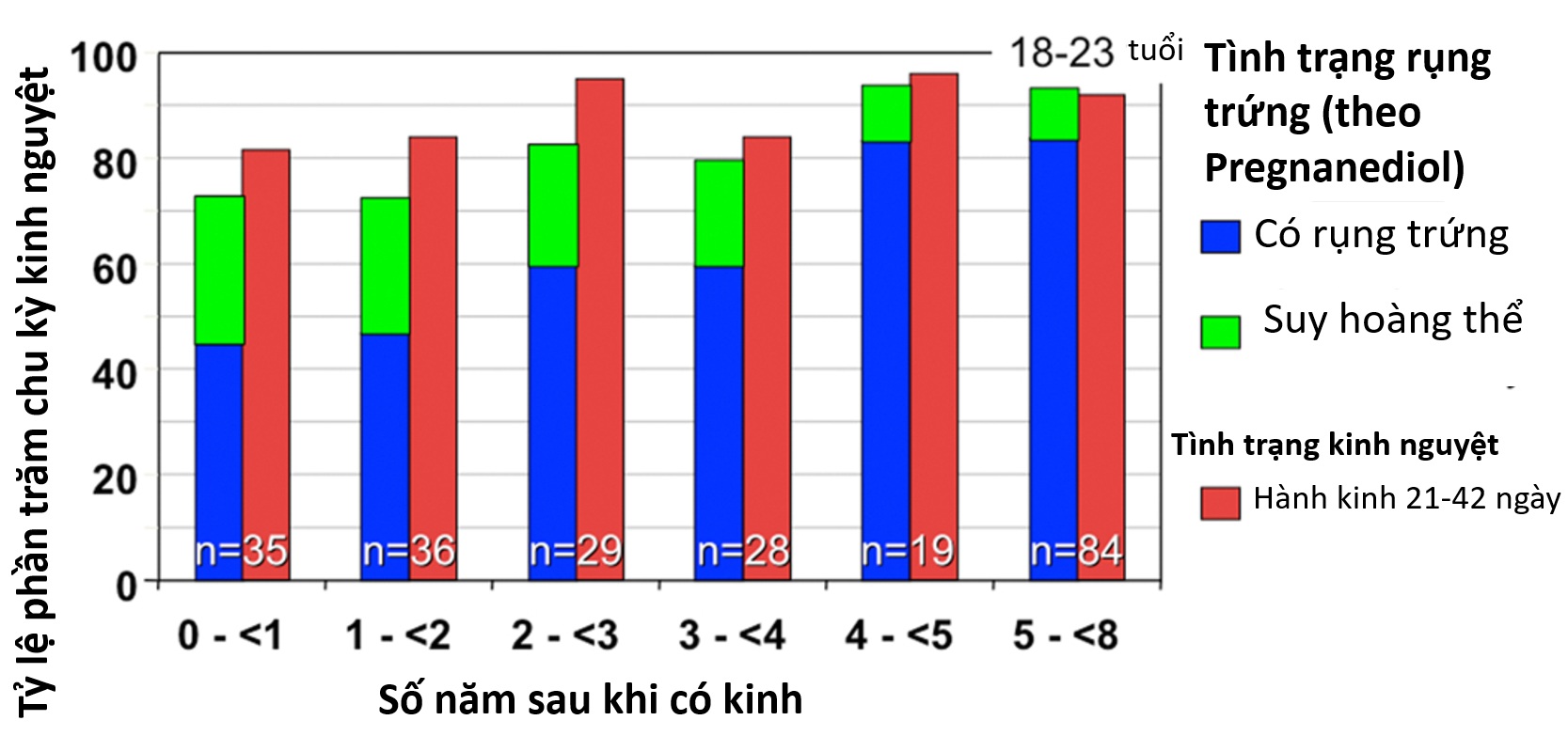
Hình 16.34. So sánh tỷ lệ phần trăm các chu kỳ kinh nguyệt có thời gian từ 21 đến 42 ngày (màu đỏ) và tỷ lệ phần trăm các chu kỳ kinh nguyệt có rụng trứng (màu xanh) theo tuổi sau có kinh cho đến tuổi trưởng thành trẻ. Nhiều chu kỳ kinh nguyệt đều đặn (21–42 ngày) hơn là các chu kỳ rụng trứng trưởng thành, bình thường. Tính bình thường của rụng trứng được xác định dựa trên các tiêu chuẩn của người lớn về chất chuyển hóa chính của progesterone trong nước tiểu, pregnanediol glucuronide, trong các mẫu hàng tuần được thu thập trong 12 ngày cuối của mỗi chu kỳ kinh nguyệt. Pregnanediol có thể phát hiện rõ ràng nhưng dưới mức bình thường ở đây được chỉ định là bị suy hoàng thể (màu xanh lá cây). Có thể thấy rằng hầu hết các chu kỳ không phải là rụng trứng trưởng thành đều có đủ hoạt động nang trứng theo chu kỳ để tạo ra một hoàng thể chưa trưởng thành, cho thấy sự rụng trứng trước đó, thay vì thực sự không rụng trứng như các nhà điều tra đã dán nhãn cho chúng. (Dữ liệu từ Metcalf, M.G., Skidmore, D.S., Lowry, G.F., Mackenzie, J.A. (1983). Incidence of ovulation in the years after the menarche. J Endocrinol, 97, 213–219; Rosenfield, R.L. (2015). The diagnosis of polycystic ovary syndrome in adolescents. Pediatrics, 136, 1154–1165. Với sự cho phép.)
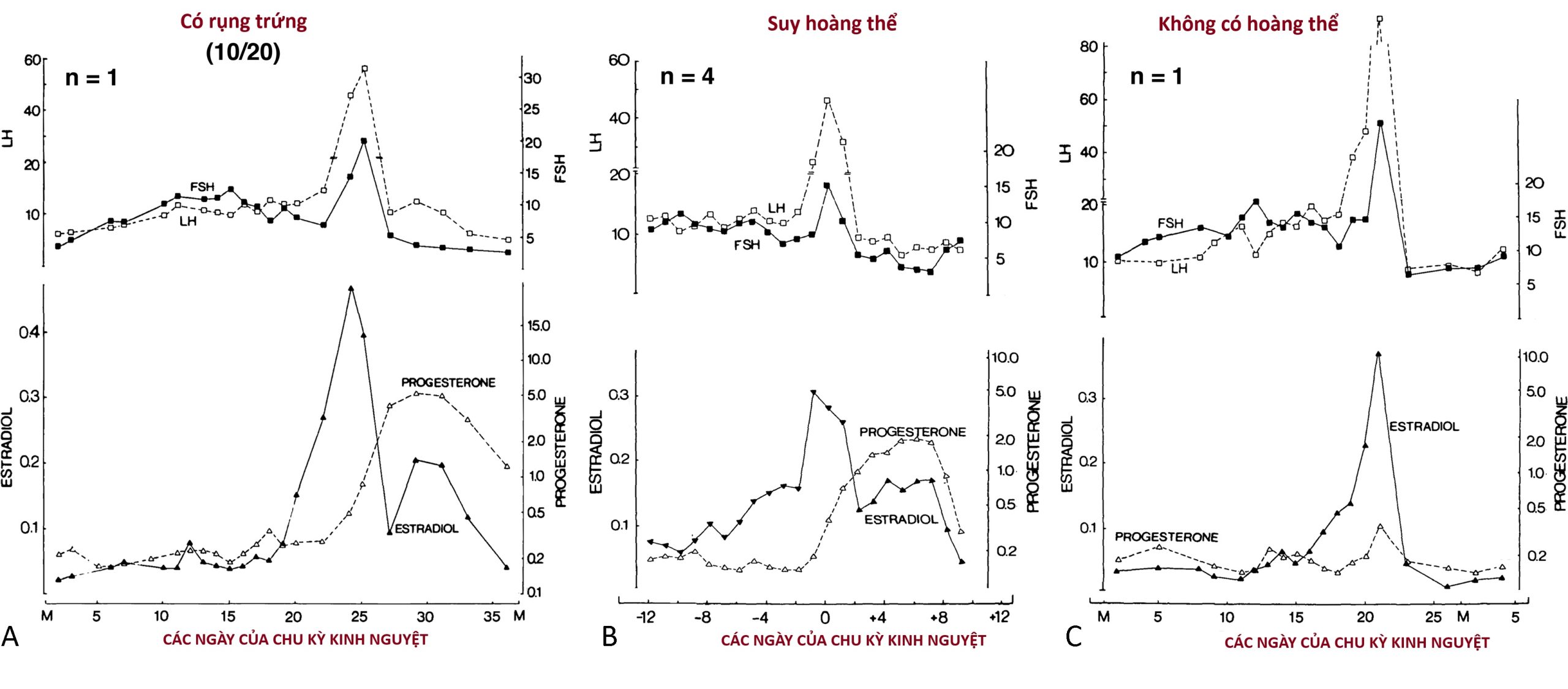
Hình 16.35 Các mô hình nội tiết huyết thanh của các chu kỳ kinh nguyệt bình thường ở thanh thiếu niên trong số 20 nữ sinh khỏe mạnh. Bảng A. Một chu kỳ rụng trứng bình thường ở một nữ 16 tuổi, đại diện cho 10/20 của nhóm nghiên cứu có rụng trứng. Lưu ý sự gia tăng bình thường của estradiol và progesterone trước rụng trứng, các đợt tăng hormone tạo hoàng thể (LH) và hormone kích thích nang trứng (FSH) giữa chu kỳ sau đó, tiếp theo là nồng độ progesterone đạt 5.0 ng/mL hoặc cao hơn trong giai đoạn hoàng thể của chu kỳ kinh nguyệt. Mặc dù đây là một tiêu chuẩn tiêu chuẩn cho một chu kỳ rụng trứng, chu kỳ được minh họa sẽ được coi là suy hoàng thể ở người lớn. Bảng B. Nồng độ hormone trung bình của nhóm được xác định là bị suy hoàng thể: các giai đoạn hoàng thể ngắn của họ kéo dài từ 4 đến 8 ngày, nhưng độ dài chu kỳ là bình thường (23–30 ngày) do giai đoạn nang trứng kéo dài. Lưu ý estradiol trước rụng trứng hơi thấp và không có sự gia tăng progesterone, tiếp theo là các đợt tăng LH và FSH giữa chu kỳ bị cùn đi báo trước nồng độ progesterone thấp của các giai đoạn hoàng thể ngắn. Bảng C. Một chu kỳ không rụng trứng không có hoàng thể ở một nữ 14 tuổi. Lưu ý các đợt tăng estradiol và LH trước rụng trứng bình thường, nhưng không có sự gia tăng progesterone trước rụng trứng báo trước sự không có sự gia tăng progesterone trong giai đoạn hoàng thể. Phần còn lại của năm đối tượng nghiên cứu không rụng trứng không đạt được sự phát triển trước rụng trứng rõ ràng và nồng độ progesterone luôn dưới 1.0 ng/mL, tuy nhiên các chu kỳ kinh nguyệt chỉ dài bất thường ở 2/5. M, kinh nguyệt. Các thang đo khác nhau một chút, và thang đo progesterone là logarit. Nồng độ steroid tính bằng ng/mL, nồng độ LH và FSH tính bằng mIU/mL. (Dữ liệu từ Apter, D., Viinikka, L., Vihko, R. (1978). Hormonal pattern of adolescent menstrual cycles. J Clin Endocrinol Metab, 47, 944–954; Chỉnh sửa từ Rosenfield, R.L. (2013). Clinical review: adolescent Không rụng trứng: maturational mechanisms and implications. J Clin Endocrinol Metab, 98, 3572–3583. Với sự cho phép.)
Mặc dù có sự thay đổi đáng kể về thời gian để các chu kỳ kinh nguyệt trưởng thành, sự đều đặn của kinh nguyệt xấp xỉ các tiêu chuẩn của người lớn ở hầu hết các bé gái trong vòng một năm sau khi có kinh: ba phần tư có độ dài chu kỳ từ 21 đến 45 ngày, và thêm 5% nữa nằm trong giới hạn này mỗi năm trong 3 năm tiếp theo. Đến 5 năm phụ khoa, 90% các chu kỳ kinh nguyệt kéo dài từ 22 đến 40 ngày, và khoảng 80% các chu kỳ là rụng trứng bình thường. Độ dài chu kỳ kinh nguyệt thu hẹp lại còn 24 đến 38 ngày vào giữa tuổi trưởng thành khi tỷ lệ rụng trứng đạt gần 90%.
Các bất thường về kinh nguyệt ở tuổi vị thành niên có thể được định nghĩa tương tự như chảy máu tử cung bất thường ở người lớn. Vô kinh nguyên phát là không bắt đầu có kinh ở độ tuổi bình thường (trước 15 tuổi hoặc trong vòng 3 năm sau Phát triển vú khi nó bị trì hoãn). Vô kinh thứ phát là không có kinh nguyệt trong 90 ngày hoặc hơn sau khi đã có kinh lần đầu. Kinh thưa được định nghĩa là tần suất kinh nguyệt dưới mức bình thường, giới hạn bình thường của nó dần dần thay đổi trong 6 năm sau có kinh (Hộp 16.2). Các chu kỳ không rụng trứng cũng có thể gây chảy máu tử cung quá nhiều, như được thảo luận trong phần sau Rối loạn chức năng rụng trứng: Chảy máu tử cung do rối loạn chức năng.
Hộp 16.2. Định nghĩa các loại Chảy máu Tử cung Bất thường ở Vị thành niên (Rosenfield, R.L. (2015).
| Mô tả | Định nghĩa |
|---|---|
| Vô kinh nguyên phát | Không có kinh nguyệt trước 15 tuổi hoặc trước 3 năm sau khi bắt đầu phát triển vú a |
| Vô kinh thứ phát | Hơn 90 ngày không có kinh nguyệt sau khi đã có kinh lần đầu (trong các kỳ liên tiếp trong năm đầu tiên sau có kinh) |
| Kinh thưa (chảy máu tử cung bất thường không thường xuyên) | Năm đầu sau có kinh: độ dài chu kỳ trung bình > 90 ngày (ít hơn bốn kỳ kinh trong năm) |
| Năm thứ hai sau có kinh: độ dài chu kỳ trung bình > 60 ngày (ít hơn sáu kỳ kinh trong năm) | |
| Năm thứ ba sau có kinh: độ dài chu kỳ trung bình > 45 ngày (ít hơn tám kỳ kinh mỗi năm) | |
| Các năm sau có kinh ≥ 4: độ dài chu kỳ > 38 ngày (< 9 kỳ kinh mỗi năm) | |
| Chảy máu tử cung quá nhiều b | “Chảy máu kinh nguyệt xảy ra thường xuyên hơn 21 ngày một lần (19 ngày trong năm 1) hoặc kéo dài (> 7 ngày) hoặc nhiều (thấm ướt hơn một băng vệ sinh hoặc tampon mỗi 1–2 giờ, có cục máu đông lớn, hoặc chảy ồ ạt)” |
The diagnosis of polycystic ovary syndrome in adolescents. Pediatrics, 136, 1154–1165. Với sự cho phép; Chỉnh sửa theo Teede, H.J., Misso, M.L., Costello, M.F., et al. (2018). Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Fertil Steril, 110, 364–79).
Các bất thường về kinh nguyệt có triệu chứng ở thanh thiếu niên ngày càng ít có khả năng đại diện cho Không rụng trứng “sinh lý” ở thanh thiếu niên theo thời gian. Đến 1 năm sau có kinh, việc không thiết lập và duy trì được một mô hình kinh nguyệt người lớn bình thường có nguy cơ tồn tại thiểu năng rụng trứng khoảng 50%, và việc không làm được điều đó sau 2 năm có kinh có nguy cơ khoảng hai phần ba (Hình 16.36). Do đó, sự tồn tại của kinh nguyệt không đều trong 1 đến 2 năm hoặc hơn là một chỉ định mạnh mẽ để điều tra (xem phần Dậy thì bất thường).
Hình 16.36 Xác suất một thanh thiếu niên có bất thường kinh nguyệt có triệu chứng đủ nghiêm trọng để phải đến khám phụ khoa sẽ tiếp tục có bất thường kinh nguyệt. Các đường biểu thị tỷ lệ tích lũy mà các đối tượng có bất thường kinh nguyệt chuyển sang mô hình bình thường. Đường cong đậm cho thấy tỷ lệ trung bình của bất thường kinh nguyệt tiếp diễn ở thanh thiếu niên khi xem xét tất cả các trường hợp có triệu chứng của chảy máu tử cung bất thường đến khám tại một phòng khám nội tiết sinh sản bất kể thời gian khởi phát triệu chứng. (Dữ liệu từ Southam, A.L., Richart, E.M. (1966). The prognosis for adolescents with menstrual abnormalities. Am J Obstet Gynecol, 94, 637.) Chảy máu tử cung do rối loạn chức năng khởi phát trong vòng 1 năm sau có kinh có tiên lượng xấu nhất khác xa trung bình về việc tiếp tục bất thường kinh nguyệt, và kinh thưa có thời gian tương đối ngắn xảy ra sau khi một mô hình kinh nguyệt bình thường đã được thiết lập có tiên lượng tốt nhất khác xa trung bình. Lưu ý rằng nếu bất thường kinh nguyệt tồn tại trong 1 năm, có khoảng 50% xác suất, và nếu trong 2 năm, có hơn 60% xác suất, rằng bệnh nhân sẽ không tự phát tiến triển đến các chu kỳ bình thường. Tương tự, nếu vấn đề tồn tại trong 5 năm, có 80% khả năng tồn tại của sự bất thường. Các đường cong “Cường androgen” và “Không cường androgen” là giả thuyết, dựa trên dữ liệu được xem xét trong Rosenfield, R.L. (2015). The diagnosis of polycystic ovary syndrome in adolescents. Pediatrics, 136, 1154–1165. Các trường hợp cường androgen chủ yếu là sự kết hợp của Không rụng trứng sinh lý và hội chứng buồng trứng đa nang (PCOS), với PCOS tồn tại. Các trường hợp không cường androgen là sự kết hợp của Không rụng trứng sinh lý và các trường hợp suy sinh dục, từ suy sinh dục nguyên phát đến vô kinh do vùng dưới đồi đến suy sinh dục do giảm gonadotropin, với các trường hợp suy sinh dục tồn tại. (Chỉnh sửa từ Rosenfield, R.L. (2015). The diagnosis of polycystic ovary syndrome in adolescents. Pediatrics, 136, 1154–1165.)
Nồng độ LH, testosterone, và androstenedione trong huyết thanh cao hơn đáng kể ở thanh thiếu niên có chu kỳ không rụng trứng so với những người có chu kỳ rụng trứng. Không rõ liệu đây là nguyên nhân hay kết quả của sự không rụng trứng; tuy nhiên, nếu tìm thấy cường androgen máu, nó hiếm khi thoái lui. Buồng trứng đa nang phổ biến ở thanh thiếu niên và thường là một biến thể của bình thường, trừ khi có liên quan đến bất thường kinh nguyệt hoặc cường androgen.
Các biến thể bình thường khác ở tuổi vị thành niên
Ba phần tư các bé gái vị thành niên bị mụn trứng cá dạng nhân từ nhẹ đến nặng, và một phần tư bị mụn trứng cá viêm nhẹ. Rậm lông nhẹ cũng thường phát sinh ở các bé gái quanh tuổi có kinh. Tuy nhiên, mụn trứng cá viêm từ trung bình đến nặng (tức là > 10 tổn thương ở mặt hoặc vùng khác) không phổ biến trong những năm quanh tuổi có kinh, và cường androgen nên được xem xét ở những bé gái như vậy cũng như ở những người bị rậm lông nhẹ và kinh nguyệt không đều (xem Cường androgen ở Vị thành niên). Sự khởi đầu của mụn trứng cá có liên quan chặt chẽ hơn với nồng độ DHEAS trong máu so với các androgen khác, cũng như mụn trứng cá dạng nang.
Những thay đổi tâm lý sâu sắc xảy ra trong tuổi vị thành niên. Các bé gái chưa trưởng thành về mặt sinh dục có xu hướng chưa trưởng thành về mặt xã hội, và sự khởi đầu của dậy thì có liên quan đến sự độc lập tăng lên và những thay đổi sâu sắc trong quan điểm về cuộc sống và năng lực trí tuệ. Mức độ mà những sự phát triển này xảy ra để phản ứng với những thay đổi thể chất của dậy thì và mức độ chúng là tác động trực tiếp của hormone sinh dục vẫn chưa được biết. Các đặc điểm nam tính kiểu tomboy thường không có cơ sở nội tiết rõ ràng, mặc dù có một số bằng chứng cho thấy chúng có thể có các yếu tố quyết định nội tiết trước khi sinh. Các tương tác xã hội có tác động lên các khía cạnh này của sự phát triển. Chúng thậm chí còn ảnh hưởng đến sự đồng bộ của chu kỳ kinh nguyệt.
Mặc dù có quan niệm phổ biến rằng vị thành niên vốn là một giai đoạn hỗn loạn, phần lớn thanh thiếu niên không phát triển các khó khăn đáng kể về xã hội, cảm xúc, hoặc hành vi. Thỉnh thoảng thử nghiệm và chấp nhận rủi ro là bình thường, cũng như việc rút lui khỏi và xung đột với cha mẹ. Hành vi của thanh thiếu niên phải được hiểu trong bối cảnh của tính nhạy cảm cá nhân, sự nuôi dưỡng và tương tác gia đình, tương tác nhóm bạn bè, những thay đổi trong sự trưởng thành của não bộ, và phản ứng của thanh thiếu niên đối với nhận thức của họ về những thay đổi cơ thể và đối với những ham muốn tình dục là hệ quả trực tiếp của dậy thì. Đơn giản chỉ vì một vấn đề được thể hiện trong tuổi vị thành niên không có nghĩa là nó là một hệ quả trực tiếp của dậy thì.
Nhiều vấn đề về hành vi nổi lên trong tuổi vị thành niên có nguồn gốc từ trước đó. Mặc dù tỷ lệ trầm cảm tăng trong tuổi dậy thì, nhiều trẻ em phát triển trầm cảm trong tuổi vị thành niên đã có các triệu chứng đau khổ tâm lý từ trước. Tương tự như vậy, hầu hết các thanh thiếu niên phạm pháp đã có các vấn đề trước đó ở nhà và ở trường.
Các bé gái trưởng thành sớm trong các nền văn hóa phương Tây được yêu mến hơn, nhưng họ có nhiều vấn đề về cảm xúc hơn; hình ảnh bản thân thấp hơn; và tỷ lệ trầm cảm, lo âu, và rối loạn ăn uống cao hơn so với bạn bè đồng trang lứa. Sự trưởng thành sớm dường như đặc biệt là một yếu tố nguy cơ đối với hành vi có vấn đề ở các bé gái có tiền sử khó khăn trước tuổi vị thành niên, khi họ có nhiều tình bạn và mối quan hệ với người khác giới hơn, và khi họ học ở các trường đồng giáo dục.
Việc sử dụng testosterone hoặc estrogen trong thời gian ngắn có tác động tối thiểu đến hành vi hoặc tâm trạng ở thanh thiếu niên. Do đó, sự thay đổi nồng độ hormone chỉ chiếm một phần nhỏ trong các vấn đề tình cảm của thanh thiếu niên, và các ảnh hưởng xã hội chiếm một phần lớn hơn đáng kể. Mặc dù có ít bằng chứng cho thấy những khó khăn tâm lý bắt nguồn trực tiếp từ những thay đổi nội tiết trong quá trình dậy thì bình thường, có khả năng những thay đổi cơ thể của tuổi vị thành niên đóng một vai trò trong sự phát triển của một hình ảnh cơ thể tiêu cực khi chúng xảy ra không đồng bộ với các chuẩn mực văn hóa-xã hội.
Các vấn đề với việc bắt đầu và duy trì giấc ngủ là phổ biến ở thanh thiếu niên và góp một phần nhỏ vào kết quả học tập kém. Mặc dù thiếu ngủ có thể là do các yếu tố môi trường (ví dụ, áp lực xã hội và học tập), các yếu tố nội tại rõ ràng đóng một vai trò quan trọng. Sự suy giảm 50% cường độ của giấc ngủ sâu (sóng chậm, delta) xảy ra trong tuổi vị thành niên, và một nửa sự thay đổi này xảy ra trong khoảng từ 12 đến 14 tuổi. Bằng chứng gần đây chỉ ra rằng sự thay đổi này có liên quan đến tuổi tác và giới tính, bắt đầu sớm hơn ở các bé gái, nhưng không liên quan đến giai đoạn dậy thì. Người ta đã đề xuất rằng sự thay đổi này là một biểu hiện của sự cắt tỉa synap lan rộng có liên quan đến sự xuất hiện của năng lực nhận thức của người trưởng thành.
Hướng nhân quả của mối liên hệ giữa sự phát triển dậy thì và chất lượng các mối quan hệ gia đình đã được đặt câu hỏi. Một số nghiên cứu đã chỉ ra rằng động lực gia đình có thể ảnh hưởng đến thời điểm và quá trình dậy thì, với sự trưởng thành sớm hơn và nhanh hơn được quan sát thấy ở những thanh thiếu niên được nuôi dưỡng trong những gia đình có nhiều xung đột hơn và ở những bé gái từ những gia đình không có cha ruột.
Dậy thì bất thường
Phát triển bất thường
Rối loạn Phát triển Giới tính
Bệnh nhân bị Rối loạn Phát triển Giới tính (DSD) (trước đây gọi là lưỡng giới)—những người có bộ phận sinh dục không rõ ràng hoặc không phù hợp với giới tính tuyến sinh dục do bệnh lý nội tiết—có thể đến khám bác sĩ lần đầu tiên vào tuổi dậy thì. Các hội chứng này đã được phân loại thành DSD 46,XX, bao gồm các trường hợp trước đây được gọi là lưỡng giới giả nữ và bao gồm DSD tinh hoàn 46,XX (trước đây gọi là đảo ngược giới tính XX); DSD 46,XY, bao gồm các trường hợp trước đây được gọi là lưỡng giới giả nam và bao gồm loạn sản tuyến sinh dục hoàn toàn 46,XY (đảo ngược giới tính XY, hội chứng Swyer); và DSD nhiễm sắc thể giới tính, bao gồm hội chứng Turner, hội chứng Klinefelter, loạn sản tuyến sinh dục hỗn hợp, và DSD buồng trứng-tinh hoàn thể khảm. Trong trường hợp không có thể khảm nhiễm sắc thể, DSD buồng trứng-tinh hoàn, trước đây được gọi là lưỡng giới thật, được phân loại là DSD 46,XX hoặc DSD 46,XY. Bệnh nhân mắc bất kỳ rối loạn nào trong số này có thể trải qua dậy thì không phù hợp. Họ có thể có biểu hiện phì đại âm vật và khi khám có thể thấy một mức độ không rõ ràng của bộ phận sinh dục đã bị bỏ qua trước đây. Nam hóa bắt đầu ở tuổi dậy thì đôi khi là than phiền chính. DSD buồng trứng-tinh hoàn hoặc DSD 46,XX do CAH có thể có khả năng sinh sản. Hội chứng không nhạy cảm androgen ở một người nam di truyền có thể biểu hiện là vô kinh nguyên phát ở một bé gái vị thành niên có kiểu hình bình thường. Các rối loạn biệt hóa giới tính được xem xét chi tiết trong Chương 6.
Sự nam hóa bẩm sinh của nữ giới lập trình sự xuất hiện của PCOS ở tuổi dậy thì. Những quan sát này phù hợp với các nghiên cứu về sự androgen hóa bào thai của nữ giới ở một số loài, bao gồm cả các loài linh trưởng. Có sự gia tăng dai dẳng tần số xung LH và suy giảm tác dụng phản hồi âm của progesterone lên sự giải phóng LH, dường như liên quan đến sự ức chế biểu hiện PR ở vùng dưới đồi để đáp ứng với estradiol. Các động vật thí nghiệm tiếp xúc với androgen dư thừa sớm trong thai kỳ phát triển các đặc điểm PCOS cổ điển: những động vật này có nồng độ LH tăng, cường androgen buồng trứng và thượng thận, kinh thưa, và buồng trứng đa nang. Chúng cũng bị béo phì vùng bụng, kháng insulin, giảm dung nạp glucose, và rối loạn lipid máu, những điều này dường như cũng là kết quả của việc lập trình phát triển.
Nam giới di truyền bị không nhạy cảm androgen hoàn toàn có nồng độ LH thấp và đáp ứng LH kém với GnRH trong giai đoạn sơ sinh. Tuy nhiên, nồng độ gonadotropin bình thường đến cao ở tuổi dậy thì, và, nghịch lý thay, tín hiệu androgen thông qua thụ thể androgen lại tăng cường khả năng của nữ giới tạo ra một đợt tăng LH để đáp ứng với phản hồi dương estrogen.
Các Rối loạn Loạn sản sinh dục khác
Việc không bắt đầu có kinh có thể là kết quả của các bất thường cấu trúc của đường sinh dục không có cơ sở nội tiết. Màng trinh có thể không thủng, dẫn đến ứ dịch âm đạo nếu âm đạo còn nguyên vẹn. Âm đạo có thể bị bất sản, sẽ dẫn đến ứ dịch máu tử cung-âm đạo nếu tử cung còn nguyên vẹn. Tử cung có thể bị bất sản bẩm sinh. Dính buồng tử cung phát triển là hệ quả của viêm nội mạc tử cung, có thể là kết quả của nhiễm trùng hoặc chiếu xạ (hội chứng Asherman). Bất sản âm đạo bẩm sinh có thể liên quan đến các mức độ bất sản tử cung khác nhau; đây là hội chứng Mayer-Rokitansky-Kuster-Hauser. Hội chứng này dường như xảy ra như một khiếm khuyết gen đơn lẻ hoặc như một sự kiện gây quái thai mắc phải liên quan đến sự phát triển của trung bì và thận trung bì, điều sau dẫn đến các bất thường của đường sinh dục và đôi khi là đường tiết niệu. Một phân nhóm do khiếm khuyết gen Wnt4 có liên quan đến cường androgen.
Dậy thì sớm
Nguyên nhân
Khi sự phát triển vú hoặc lông mu sinh dục bắt đầu trước 8.0 tuổi hoặc kinh nguyệt bắt đầu trước 9.5 tuổi, dậy thì theo truyền thống được coi là sớm, hoặc non. Cần lưu ý rằng sự phát triển vú trong năm thứ bảy là trong giới hạn bình thường ở các bé gái dân tộc thiểu số. Ngoài ra, lông mu tiền sinh dục (giai đoạn 2) có thể bình thường ở các bé gái dân tộc thiểu số 6 và 7 tuổi.
Dậy thì có thể xảy ra sớm như một biến thể cực đoan của bình thường, do một sự xáo trộn trong trục HPG thường liên quan đến sự trưởng thành sinh dục, hoặc do một sự xáo trộn bên ngoài trục HPG. Tùy thuộc vào phần nào của trục nội tiết này có liên quan, các dạng dậy thì sớm khác nhau được phân biệt. Phân loại các nguyên nhân gây dậy thì sớm cùng với các phát hiện điển hình được đưa ra trong Bảng 16.4.
Bảng 16.4 Các phát hiện điển hình trong Dậy thì sớm ở Nữ
| Vị trí | Loại | HA a | BA a | Estrogen ↑ | Androgen ↑ | LH/FSH ↑ | Bệnh học | Đặc điểm |
|---|---|---|---|---|---|---|---|---|
| Dậy thì sớm hoàn toàn (Trung ương, Phụ thuộc Gonadotropin) | ||||||||
| Vùng dưới đồi | Đồng giới | + | ++ | + | + | + | Vô căn, Thần kinh, Trưởng thành thể chất sớm | 95% các trường hợp nữ |
| Dậy thì sớm không hoàn toàn (Ngoại vi, Không phụ thuộc Gonadotropin) | ||||||||
| Biến thể bình thường | Đồng giới | – | − | ± | − | ± | Không có | Phát triển vú |
| Đồng giới | − | − | − | ± | − | Không có | Phát triển lông mu/Dậy thì thượng thận | |
| Thần kinh-nội tiết | Trái giới | + | ++ | − | + | +/+++ | Dư thừa LH/hCG | Gia đình hoặc khối u |
| Đồng giới | Thấp | Thấp | − | − | ± | Suy giáp | Ngừng tăng trưởng | |
| Buồng trứng | Đồng giới | + | ++ | +/+++ | − | − | McCune-Albright | Tổn thương xương ± nốt ruồi ± nang buồng trứng |
| Đồng giới/trái giới | + | ++ | +/+++ | +/+++ | _ | Khối u | ||
| Thượng thận | Trái giới | + | ++ | ± | +++ | − | Tăng sản thượng thận bẩm sinh | Ức chế bằng Dexamethasone |
| Trái giới/đồng giới | + | ++ | +/+++ | +/+++ | − | Khối u | ||
| Lạc chỗ | Đồng giới | + | ++ | +/+++ | − | − | Dư thừa Aromatase | |
| Ngoại sinh | Trái giới/đồng giới | ± | ± | − | − | − | Tiếp xúc với steroid sinh dục | |
| Cơ quan đích | Đồng giới/trái giới | − | − | − | − | = | “Dị vật âm đạo, lạm dụng, khối u” |
Nồng độ hormone; − bình thường tiền dậy thì; + mức dậy thì; ++ mức người lớn; +++ cao bất thường. FSH, Hormone kích thích nang trứng; hCG, gonadotropin màng đệm người; LH, hormone tạo hoàng thể.
Điều quan trọng là phải phân biệt giữa dậy thì sớm thực sự và dậy thì sớm giả. Dậy thì sớm thực sự phụ thuộc vào gonadotropin; do đó, trung ương là một thuật ngữ khác được áp dụng cho loại dậy thì sớm này. Sự trưởng thành là hoàn toàn: cả vú và lông mu đều phát triển do CNS kích hoạt tuyến yên bài tiết các gonadotropin tương ứng là FSH và LH (mặc dù sự phát triển vú có thể là biểu hiện duy nhất của dậy thì sớm hoàn toàn sớm trong vòng 6–12 tháng). Bệnh nhân bị dậy thì sớm thực sự có dậy thì sớm “đồng giới” vì các đặc điểm sinh dục thứ phát phù hợp với giới tính của trẻ. Dậy thì sớm giả không phụ thuộc vào gonadotropin; nó không được trung gian bởi sự bài tiết gonadotropin của tuyến yên ở tuổi dậy thì và đôi khi được gọi là ngoại vi. Sự trưởng thành không hoàn toàn, chỉ có một loại đặc điểm sinh dục thứ phát phát triển sớm. Dậy thì sớm ngoại vi có nhiều nguyên nhân khác nhau. Ở một số bệnh nhân bị dậy thì sớm giả, sự phát triển dậy thì là đồng giới, ở những người khác là “trái giới”, nghĩa là các đặc điểm của giới tính đối lập được biểu hiện.
Dậy thì sớm hoàn toàn
Dậy thì sớm đồng giới thực sự là kết quả của chức năng dậy thì của trục HPG. Khoảng 95% các trường hợp dậy thì sớm thực sự ở các bé gái là vô căn. Dậy thì sớm thực sự vô căn dường như là do sự kích hoạt sớm của cơ chế dậy thì bình thường. Sự phát triển dậy thì thường bình thường về chất và lượng ngoại trừ việc nó xảy ra sớm. Sự chiếm ưu thế của các trường hợp vô căn ở nữ giới và bản chất lành tính của nó tương thích với khả năng rối loạn này là một sự phóng đại cực đoan của xu hướng bình thường của các bé gái có nồng độ gonadotropin cao hơn các bé trai. Hầu hết các trường hợp là lẻ tẻ, một vài trường hợp có tính gia đình. Phần lớn những bệnh nhân này dường như sẽ có các chu kỳ kinh nguyệt và khả năng sinh sản bình thường. Thật vậy, việc mang thai đã được ghi nhận xảy ra sớm nhất là ở 4 tuổi.
Dậy thì tiến triển nhanh với một đợt tăng trưởng đột biến xảy ra khi sự kích hoạt của trục tuyến yên-buồng trứng được duy trì. Tuy nhiên, dậy thì sớm không nhất thiết phải đủ mạnh hoặc kéo dài để gây ra sự tiến triển không thể ngăn cản hoặc làm suy giảm tiềm năng chiều cao. Dậy thì sớm trong độ tuổi từ 6 đến 8 thường không tiến triển nhanh và thường dường như là do béo phì quá mức.
Bất kỳ loại xáo trộn nội sọ nào cũng có thể gây ra dậy thì sớm đồng giới thực sự. Những xáo trộn thần kinh này được cho là gây ra dậy thì sớm thực sự bằng cách tăng tỷ lệ các đầu vào kích thích hoặc bằng cách can thiệp vào sự ức chế của CNS đối với bài tiết GnRH của vùng dưới đồi. Chúng bao gồm rối loạn chức năng não bẩm sinh, chẳng hạn như bại não hoặc não úng thủy, hoặc các rối loạn mắc phải, chẳng hạn như chiếu xạ, chấn thương, các rối loạn viêm mãn tính, hoặc các khối u trong vùng dưới đồi. Sự kích hoạt giải phóng GnRH do tổn thương vùng dưới đồi có thể được trung gian bởi TGF-β, chấn thương, các rối loạn viêm mãn tính, hoặc các khối u trong vùng dưới đồi. Hố yên rỗng đôi khi được tìm thấy. Dậy thì sớm của bệnh u xơ thần kinh loại I (bệnh von Recklinghausen) thường là kết quả của một u thần kinh đệm thị giác, thường có độ ác tính thấp, hoặc từ một hamartoma, mặc dù đôi khi không có cả hai. Hamartoma của vùng dưới đồi có thể gây ra dậy thì sớm trung ương; tác động này rất có thể là do một tác động giải phẫu lên các cấu trúc dưới đồi hơn là hoạt động như một “vùng dưới đồi phụ” giải phóng các xung GnRH vào tuần hoàn cửa tuyến yên. Hình 16.37 cho thấy một hamartoma dưới đồi.
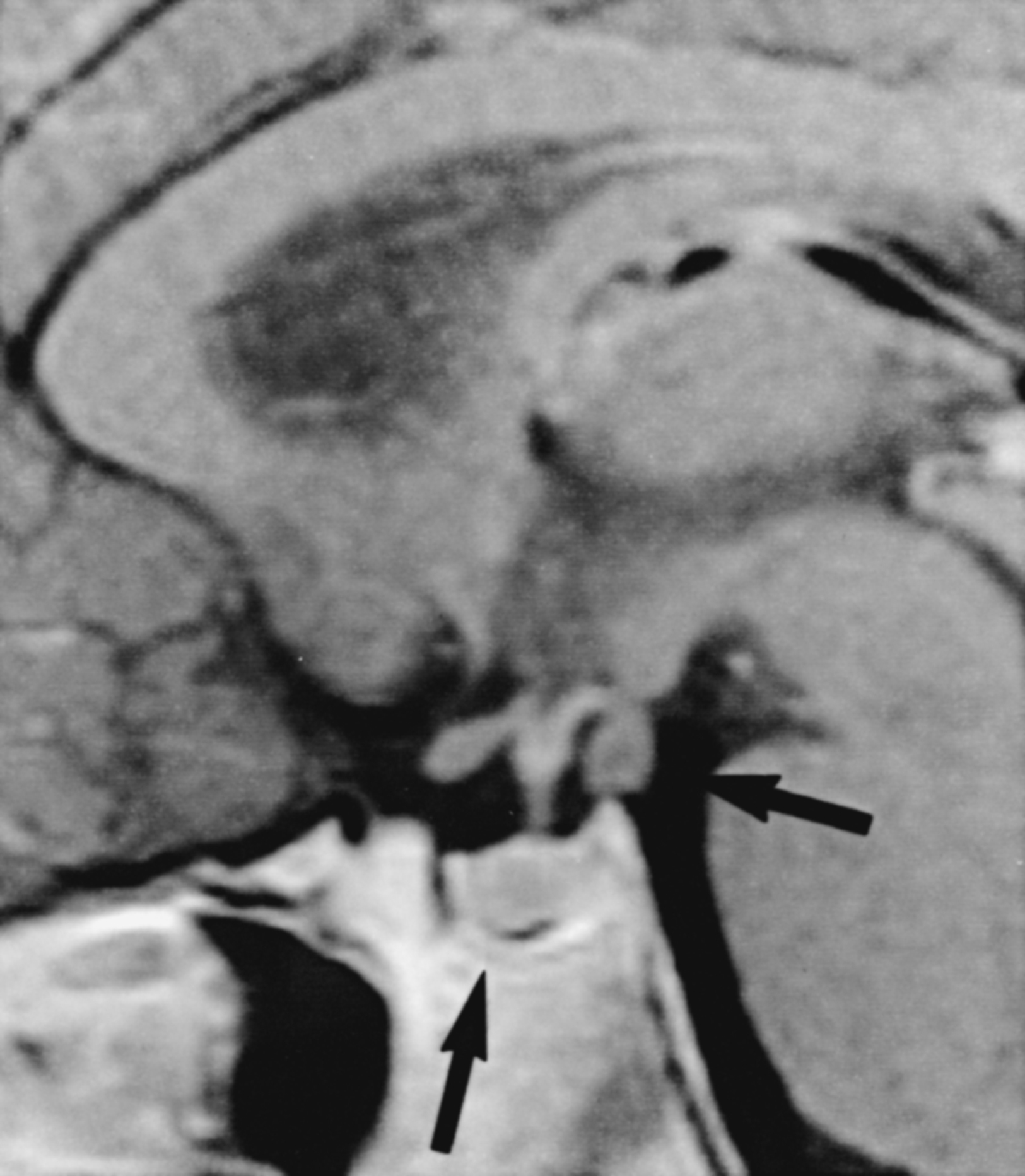
Hình 16.37 Hình ảnh cộng hưởng từ cho thấy một hamartoma dưới đồi (mũi tên bên phải) là nguyên nhân gây dậy thì sớm thực sự ở một bé gái 2.5 tuổi. Hamartoma đang treo từ sàn của vùng dưới đồi ngay sau phễu tuyến yên. Hố yên (mũi tên dưới) chứa một tuyến yên bình thường với cuống tuyến yên treo từ phễu.
Một tỷ lệ nhỏ các khối u tuyến tùng gây ra dậy thì sớm thực sự. Tỷ lệ dậy thì sớm cao hơn khoảng 3.5 lần ở các khối u không phải nhu mô (chẳng hạn như u thần kinh đệm và u quái) so với các khối u nhu mô tuyến tùng. Điều này cho thấy rằng những khối u này gây ra dậy thì sớm thông qua sự vắng mặt của một yếu tố ức chế tuyến tùng bình thường hơn là do các tác động phá hủy lên các bó ức chế. Mặc dù các khối u tuyến tùng có thể gây liệt liếc lên trên do áp lực lên các củ não sinh tư, dấu hiệu này chỉ có ở một số ít trường hợp.
Các khối u tế bào mầm tiết hCG ở tuyến tùng hoặc vùng dưới đồi đôi khi gây ra dậy thì sớm thực sự. Vì hCG là một chất chủ vận thụ thể LH, các giải thích khả dĩ cho tình huống bất thường này là sự mất ức chế giải phóng GnRH của vùng dưới đồi được cho là do hiệu ứng khối của khối u, tác động FSH yếu của sự tăng hCG ồ ạt, hoặc khả năng của một số u loạn sản mầm tiết ra estradiol, cũng như hCG.
Sự tiến triển của trưởng thành thể chất do các rối loạn nội tiết ngoại vi làm sớm tuổi xương đến mức dậy thì đôi khi gây ra dậy thì sớm thực sự. Do đó, dậy thì thực sự có thể bắt đầu sau khi điều chỉnh các rối loạn gây nam hóa hoặc nữ hóa đã làm sớm tuổi xương đến 10 đến 12 tuổi.
Tăng gonadotropin của suy buồng trứng sớm (POI) đã được báo cáo là gây ra dậy thì sớm hoặc tiến triển nhanh của dậy thì trước khi suy buồng trứng sớm. Mặc dù PCOS đôi khi đã được báo cáo theo sau dậy thì sớm thực sự, hiện tại không có bằng chứng rõ ràng về một mối liên quan đáng kể.
Tiền sử gia đình bị dậy thì sớm hoàn toàn (CPP) là phổ biến ở những bệnh nhân bị dậy thì sớm; tuy nhiên, nguyên nhân di truyền rõ ràng thường không được biết. Các nguyên nhân đơn gen của CPP gần đây đã được xác định ở bốn gen. Các đột biến tăng chức năng đã được tìm thấy ở kisspeptin và thụ thể của nó, KISS1R. Các bệnh nhân là dị hợp tử đối với các đột biến, với sự di truyền trội trên nhiễm sắc thể thường. Đột biến đầu tiên được mô tả là ở một bé gái được nhận nuôi có Phát triển vú tiến triển từ khi sinh, với tốc độ tăng trưởng và sự trưởng thành xương được ghi nhận ở 7 tuổi. Một đột biến hoạt hóa dị hợp tử của KISS1R (p. Arg386Pro) đã được xác định và các nghiên cứu trong ống nghiệm cho thấy đột biến này dẫn đến sự kích hoạt kéo dài của các con đường tín hiệu nội bào, dẫn đến sự tích tụ inositol phosphate duy trì cao hơn. Một đột biến ở kisspeptin, p. Pro74Ser, đã được xác định ở một bé trai bị CPP ở 1 tuổi, với nồng độ LH và testosterone huyết thanh cao. Điều thú vị là, mẹ và bà ngoại của cậu bé có sự phát triển dậy thì bình thường, mang đột biến p. Pro74Ser ở trạng thái dị hợp tử, cho thấy sự thấm không hoàn toàn. Trong ống nghiệm, protein đột biến có thể kích thích truyền tín hiệu ở mức độ lớn hơn so với loại hoang dã, cho thấy nó có thể kháng lại sự phân hủy tốt hơn, dẫn đến khả dụng sinh học của kisspeptin lớn hơn. Tuy nhiên, các nghiên cứu quy mô lớn ở trẻ em bị CPP đã không thể xác định thêm bệnh nhân và gia đình bị CPP có các đột biến này, do đó các đột biến hoạt hóa kisspeptin và KISS1R là những nguyên nhân tương đối hiếm gặp của CPP.
Một bất thường di truyền khác liên quan đến CPP liên quan đến các đột biến mất chức năng trong gen protein ngón tay vòng Makorin 3 (MKRN3), một gen được in dấu từ mẹ nằm trên nhánh dài của nhiễm sắc thể 15 (vùng Prader-Willi) mã hóa một protein có liên quan đến phiên mã gen và ubiquitin hóa. Biểu hiện của MKRN3 được tìm thấy là cao ở nhân cung ở chuột tiền dậy thì, giảm trước tuổi dậy thì, và thấp sau tuổi dậy thì, do đó MKRN3 dường như hoạt động như một chất ức chế dậy thì. Điều thú vị là, MKRN3 polyubiquinyl hóa Nptx1, một protein khác có chức năng chưa rõ cũng được biểu hiện ở mức độ thấp trước tuổi dậy thì, và cao trong tuổi dậy thì. Mười lăm gia đình có tiền sử CPP đã được nghiên cứu, và các đột biến ở MKRN3 dẫn đến các protein bị cắt ngắn hoặc các đột biến sai nghĩa được dự đoán sẽ phá vỡ chức năng của protein đã được tìm thấy ở một phần ba trong số đó. Hiện tại, 10 đột biến khác nhau đã được tìm thấy, và bao gồm các đột biến dịch khung, sai nghĩa, hoặc vô nghĩa được dự đoán sẽ dẫn đến mất chức năng của protein. MKRN3 được methyl hóa từ mẹ, giải thích cho sự di truyền trội trên nhiễm sắc thể thường từ cha trong tất cả các trường hợp, không có đột biến de novo nào được mô tả. Tất cả các bệnh nhân được mô tả cho đến nay đều biểu hiện một mô hình phát triển dậy thì sớm điển hình. Một vài bệnh nhân có đột biến MKRN3 được mô tả là có các đặc điểm hội chứng bao gồm lác trong, vòm miệng cao, bất thường về răng, tật dính ngón, và ưỡn cột sống thắt lưng. Trong một nghiên cứu di truyền trên 20 bé trai bị CPP vô căn, tám người được phát hiện có đột biến MKRN3 và một người có đột biến hoạt hóa KISS1, có lẽ cho thấy rằng các đột biến MKRN3 là một nguyên nhân tương đối thường gặp của CPP.
Delta-like homolog 1 (DLK1), một gen được in dấu biểu hiện từ cha, mã hóa một protein được biểu hiện trong các tế bào thần kinh biểu hiện kisspeptin. DLK1 là một phần của con đường delta-notch, một con đường tín hiệu được bảo tồn về mặt tiến hóa có vai trò trong sự tăng sinh và biệt hóa trong quá trình phát triển. Trong tuyến yên, DLK1 và tín hiệu notch dường như quan trọng trong sự biệt hóa loại tế bào tuyến yên. Một đột biến ở DLK1 đã được tìm thấy trong một gia đình có năm bé gái bị CPP. Đột biến này là một sự xóa đoạn 14 kb cùng với một sự lặp đoạn 269 bp. Nồng độ DLK1 trong huyết thanh không thể phát hiện được ở những bé gái này. Trong một nghiên cứu khác, gen DLK1 đã được giải trình tự ở 60 bé gái bị CPP vô căn, và không tìm thấy đột biến nào.
Các bất thường nhiễm sắc thể riêng biệt liên quan đến các hội chứng cụ thể có thể bao gồm CPP. Chúng bao gồm: xóa đoạn 1p36, vi xóa đoạn 7q11.23 (hội chứng Williams-Beuren), xóa đoạn 9p, lưỡng bội đơn cha mẹ của nhiễm sắc thể 7 (hội chứng Silver-Russell) và 14 (hội chứng Temple), lặp đoạn đảo ngược của nhiễm sắc thể 15, xóa đoạn kẽ de novo và lưỡng bội đơn cha mẹ của nhiễm sắc thể 15 (hội chứng Prader-Willi), và một sự xóa đoạn de novo trong gen kinase giống cyclin-dependent 5 (CDKL5; nằm ở vùng Xp22) (kiểu hình tương tự hội chứng Rett).
Dậy thì sớm không hoàn toàn
Các nguyên nhân phổ biến nhất của dậy thì sớm không hoàn toàn ở các bé gái là các biến thể cực đoan của bình thường đã được đề cập trước đây, Phát triển vú sớm và sự phát triển lông mu sớm. Đây là những dạng dậy thì sớm không hoàn toàn trong đó hoặc sự phát triển vú (Phát triển vú) hoặc sự phát triển lông sinh dục (sự phát triển lông mu) ở một mức độ phù hợp với một giai đoạn sớm của dậy thì và đồng giới. Kinh nguyệt tiền dậy thì đơn độc là một rối loạn hiếm gặp đã được cho là do hoạt động buồng trứng thoáng qua.
Các khối u sản xuất LH hoặc hCG chưa được báo cáo là gây nam hóa các bé gái, có lẽ do khả năng sản xuất androgen vỏ của chúng bị hạn chế trong các khoảng thời gian ngắn. Tuy nhiên, sự tăng LH đơn độc có tính gia đình đã được báo cáo là gây nam hóa nhẹ ở anh chị em: một trong số đó là một bé gái phát triển sự phát triển lông mu sớm và phì đại âm vật ở 4 tuổi, với sự tiến triển nhẹ đến trung bình về chiều cao và tuổi xương liên quan đến nồng độ DHEAS của giai đoạn dậy thì thượng thận và nồng độ testosterone tăng vừa phải (91 ng/dL).
Hội chứng van Wyk-Grumbach là một trong những phức hợp nhi khoa khó hiểu nhất. Đây là một hội chứng bất thường của dậy thì sớm liên quan đến suy giáp ở trẻ vị thành niên. Một trường hợp được minh họa trong Hình 16.38. Hội chứng này thường được đặc trưng bởi tiết sữa, thường không tự phát; một vài giọt dịch trắng sữa có thể trở nên rõ ràng chỉ khi “vắt” mô ống dưới quầng vú. Các buồng trứng đa nang thường có thể chứng minh được bằng siêu âm. Các xét nghiệm hiện đại cho thấy nồng độ LH lúc đói và sau GnRH bị ức chế và nồng độ FSH ở giai đoạn dậy thì sớm. Có rất ít, nếu có, sự phát triển lông sinh dục. Có một đặc điểm lâm sàng độc đáo khác về dậy thì sớm của suy giáp: đó là dạng dậy thì sớm duy nhất trong đó sự tăng trưởng bị ngừng lại thay vì được kích thích và là một ngoại lệ đối với quy tắc chung, thực sự được tuân theo bởi hầu hết trẻ em bị suy giáp mãn tính, rằng một mô hình tăng trưởng chậm có liên quan đến dậy thì muộn.

Hình 16.38 Dậy thì sớm do suy giáp ở một bé gái 9.1 tuổi có vú phát triển từ 7 tuổi và có kinh vào 9.0 tuổi. Đã xảy ra suy giảm tăng trưởng, và tuổi chiều cao của bé là 6 tuổi. Ngoài việc vú to và tiết sữa, môi nhỏ được ghi nhận là to và có sắc tố. Không có lông sinh dục hoặc phì đại âm vật. Khám trực tràng cho thấy một cổ tử cung to và có thể sờ thấy mà không có khối u phần phụ. Có những phát hiện thể chất điển hình của suy giáp. Tuổi xương là 6.2 tuổi. Thyroxine dưới 1 mcg/dL. Hormone kích thích tuyến giáp là 438 μU/mL. Prolactin là 66 ng/mL. Estrogen huyết thanh là 72 đến 182 pg/mL. Phết tế bào âm đạo cho thấy 45% tế bào bề mặt và 55% tế bào trung gian lớn. Hormone tạo hoàng thể (LH) và hormone kích thích nang trứng có hoạt tính miễn dịch lần lượt là 300 và 174 ng LER-907/mL (xem Hình 16.5 để tham khảo các khoảng giá trị). Tuy nhiên, LH có hoạt tính sinh học không thể phát hiện được. Gonadotropin có hoạt tính miễn dịch không bị ức chế khi sử dụng estrogen. Đáp ứng của chúng với một liều bolus 100-mcg hormone kích thích gonadotropin là tối thiểu, và chúng dường như đáp ứng với hormone giải phóng thyrotropin. Tất cả những phát hiện nội tiết này không khác biệt rõ ràng so với những bé gái suy giáp không bị dậy thì sớm ngoại trừ estrogen cao hơn. Bé bị chảy máu do ngừng thuốc và có bằng chứng thoái triển của sự phát triển vú trong 3 tháng đầu điều trị thay thế hormone tuyến giáp. Sau 6 tháng điều trị, dậy thì bình thường bắt đầu. Kinh nguyệt xảy ra ở 12.5 tuổi.
Van Wyk và Grumbach đã giả thuyết rằng hội chứng này là kết quả của sự “chồng chéo” nội tiết trong việc điều hòa phản hồi âm của bài tiết hormone tuyến yên, với sự sản xuất quá mức gonadotropin, cũng như TSH để đáp ứng với sự thiếu hụt tuyến giáp. Bản chất cụ thể của sự chồng chéo nội tiết đã được làm rõ đáng kể trong những năm gần đây, nhưng cơ chế bệnh sinh của dậy thì sớm vẫn chưa rõ ràng. Sự gia tăng TSH và prolactin trong huyết thanh đặc trưng cho hội chứng này rất có thể là do các hệ thống kiểm soát thần kinh-humoral chung, TRH kích thích và dopamine ức chế cả hai hormone. Thay vào đó, người ta đã đề nghị rằng thụ thể FSH của buồng trứng được kích hoạt bởi hoạt động FSH nội tại yếu của sự tăng TSH cực đoan, tương tự như hội chứng tăng kích thích buồng trứng hiếm gặp trong đó nồng độ hCG của thai kỳ kích hoạt thụ thể FSH.
Dư thừa prolactin đã được giả thuyết là nền tảng cho mô hình gonadotropin chiếm ưu thế FSH bằng cách làm chậm các xung GnRH, và chính sự kích thích FSH này của buồng trứng đã được TSH làm nhạy cảm dường như là nguyên nhân gần của dậy thì sớm. Tăng prolactin máu đơn thuần không tương ứng với sự phát triển dậy thì ở trẻ em bình thường hoặc suy giáp. Tuy nhiên, bản thân tăng prolactin máu cũng có thể làm nhạy cảm buồng trứng với gonadotropin. Tăng prolactin máu gây ra gây dậy thì sớm ở chuột cái. Đáp ứng của estrogen và progesterone buồng trứng với hCG được tăng lên bởi prolactin, có thể do sự cảm ứng của nó đối với các thụ thể LH của buồng trứng. Ngược lại, sự ức chế tăng prolactin máu trong suy giáp thực nghiệm ngăn chặn sự hình thành nang buồng trứng đặc trưng của suy giáp.
Hội chứng McCune-Albright là một rối loạn hấp dẫn khác gây ra nữ hóa đồng giới không hoàn toàn. Đây là một hội chứng của dậy thì sớm, các mảng sắc tố café-au-lait xuất hiện ở các nốt ruồi có bờ không đều (“bờ biển Maine”), và loạn sản xơ đa xương. Rối loạn này là do một đột biến hoạt hóa soma của protein tiểu đơn vị Gs-alpha kết hợp các thụ thể xuyên màng với adenylate cyclase. Hội chứng này đã được nhận biết chủ yếu ở nữ giới và xảy ra ở các dạng không hoàn toàn, cũng như các dạng mở rộng. Dậy thì sớm hoặc các tổn thương xương đơn ổ có thể xảy ra mà không có sắc tố da; không phải tất cả các bệnh nhân đều bị dậy thì sớm. Dậy thì sớm thuộc loại không phụ thuộc vào gonadotropin. Các nang trứng hoàng thể hóa trong buồng trứng hoạt động một cách tự chủ. Các u tuyến yên có khả năng tiết ra dư thừa LH, FSH, GH, và/hoặc prolactin đã được báo cáo. Bệnh nhân có thể bị hội chứng Cushing và cường giáp do tăng sản đa nốt tự chủ. Những bé gái này có thể có nguy cơ ung thư vú cao hơn. Các bất thường không phải nội tiết bao gồm bệnh tim phổi, tăng huyết áp, và bệnh gan mật (bao gồm cả ứ mật sơ sinh nặng). Các nghiên cứu phân tử đã cho thấy một đột biến R201H ở hơn 90% các trường hợp có thể nghiên cứu được một mô bị ảnh hưởng, nhưng chỉ ở 50% các mẫu máu. Do sự thay đổi về số lượng và mức độ liên quan của mô ở từng bệnh nhân, phần lớn là do mức độ khảm hiện có, dậy thì sớm có thể là đặc điểm duy nhất có mặt ở một cá nhân bị khảm đối với đột biến hoạt hóa của Gs-alpha. Do đó, những đột biến này đã được tìm thấy trong các mẫu máu từ 25% đến 33% các đối tượng bị dậy thì sớm không phụ thuộc vào gonadotropin đơn độc hoặc Phát triển vú quá mức.
CAH là một nguyên nhân nổi tiếng của sự phát triển lông mu sớm. Hoặc là CAH không điển hình, một dạng của rối loạn này nhẹ đến mức không có khiếm khuyết bộ phận sinh dục ở các bé gái, hoặc kiểm soát kém CAH cổ điển có thể là nguyên nhân. Mỗi dạng đôi khi đã được báo cáo là bắt chước dậy thì sớm thực sự.
Khối u có thể gây ra sự phát triển đồng giới hoặc trái giới. Khối u phổ biến nhất là nang trứng nang lành tính gây nữ hóa. Hầu hết là đơn độc và lớn (> 1.0 cm đường kính). Các tế bào lót các nang này thường bị hoàng thể hóa. Nồng độ estrogen có thể tăng rõ rệt. Nồng độ testosterone có xu hướng ở trong khoảng của phụ nữ trưởng thành (khoảng 40 ng/dL). Nhiều nang hoạt động không liên tục. Chúng có thể phụ thuộc vào gonadotropin và đáp ứng với liệu pháp chủ vận GnRH hoặc progestin. Một trường hợp được minh họa trong Hình 16.39. Khối u buồng trứng hoạt động nội tiết phổ biến thứ hai ở các bé gái là u tế bào hạt vị thành niên. Chúng có các mức độ khác nhau của các yếu tố dây sinh dục-mô đệm buồng trứng và thường được khu trú và lành tính mặc dù có hình dạng mô học ác tính. Chúng thường gây nữ hóa hơn là nam hóa ở trẻ nhỏ. Chúng có thể sản xuất hCG, AMH, và inhibin. Sự tăng hCG được tìm thấy ở nhiều u loạn sản mầm buồng trứng (một khối u tế bào mầm nguyên thủy), với tăng canxi máu ở một số trường hợp, mặc dù ít thường xuyên hơn so với ung thư biểu mô tế bào nhỏ. U tế bào hạt-vỏ đôi khi có liên quan đến các hội chứng loạn sản trung bì. Nó đã được báo cáo ở tuyến thượng thận, có lẽ phát sinh từ một di tích buồng trứng. Các đột biến FOXL2 là điển hình của các khối u tế bào hạt loại người lớn, nhưng chỉ được tìm thấy ở 10% loại vị thành niên. Một khối u dây sinh dục-mô đệm buồng trứng gây nữ hóa liên quan có thể là do mất một gen ức chế khối u, như trong hội chứng Peutz-Jeghers. Ung thư biểu mô buồng trứng loại người lớn có nguồn gốc từ tế bào biểu mô là hiếm gặp. Các khối u buồng trứng gây nam hóa được thảo luận trong phần Cường androgen ở Vị thành niên.
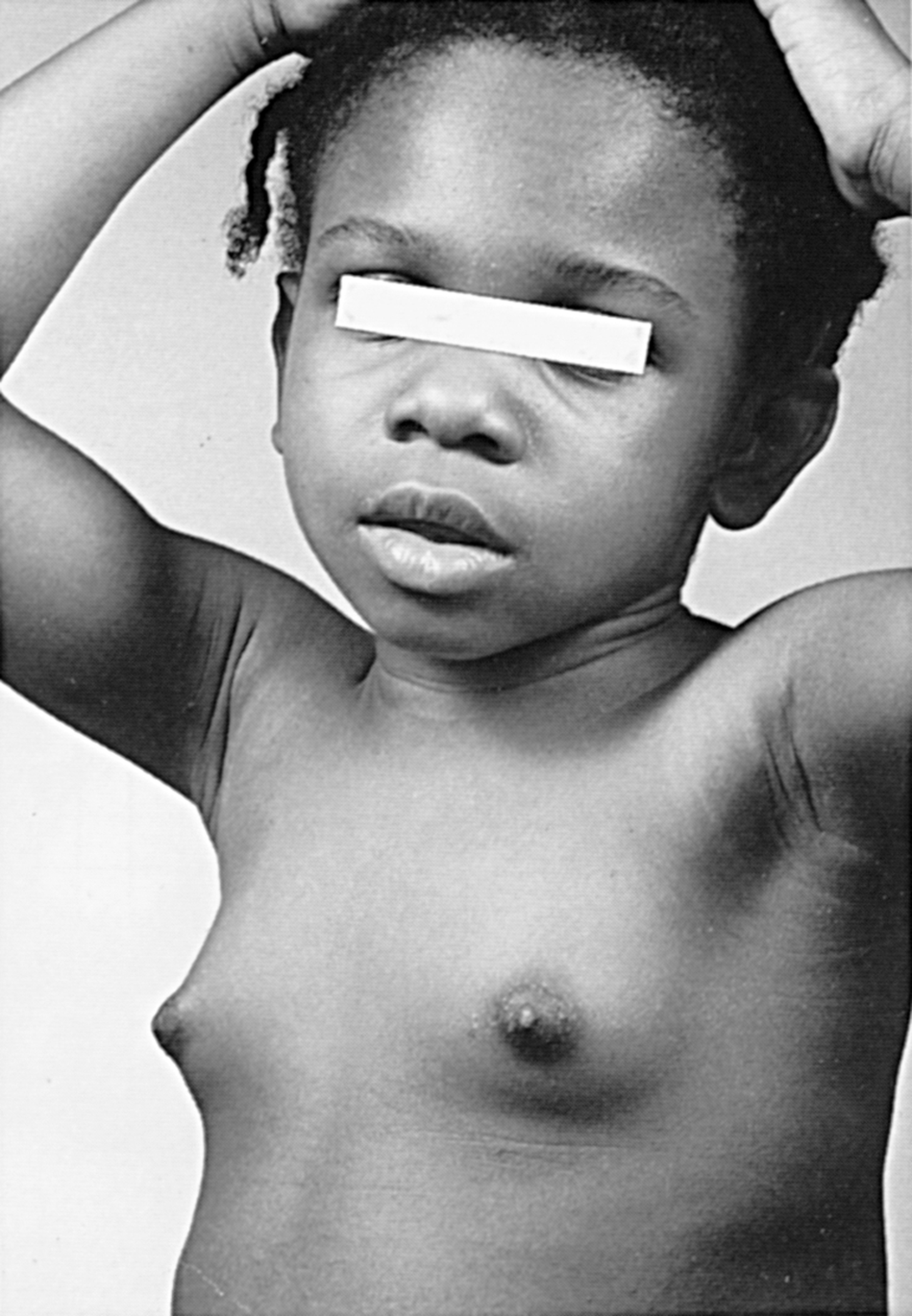
Hình 16.39 Hình ảnh của một đứa trẻ 5.2 tuổi bị dậy thì sớm đồng giới hoàn toàn do một nang trứng nang hoàng thể hóa. Sự phát triển vú của bé không khác gì so với những bé gái bị Phát triển vú sớm vô căn. Bé đến khám lúc 4.7 tuổi với tiền sử phát triển vú 2 tuần. Tuổi chiều cao và tuổi xương là 5 tuổi. Trong khoảng thời gian theo dõi 5 tháng, sự phát triển vú tiến triển, bé phát triển lông mu sinh dục và lông nách tiền sinh dục, và kinh nguyệt bắt đầu ở các khoảng thời gian từ 3 đến 5 tuần. Bốn lần xác định hàng tuần nồng độ estrogen không liên hợp trong huyết tương (estradiol và estrone) cho thấy chúng luôn dao động trong khoảng từ 158 đến 215 pg/mL. Hormone tạo hoàng thể ở mức dậy thì và hormone kích thích nang trứng bị ức chế (lần lượt trung bình là 50 và 13 ng LER-907/mL; xem Hình 16.5 để tham khảo các khoảng giá trị). Testosterone là 37 ng/dL, và dehydroepiandrosterone sulfate (DHEAS) là 82 mcg/dL. Phẫu thuật thăm dò ổ bụng được thực hiện khi bé 5.2 tuổi. Tuổi chiều cao của bé là 5.8 tuổi, và tuổi xương là 7.5. Phẫu thuật thăm dò cho thấy một nang buồng trứng phải đường kính khoảng 5 cm, đã được cắt bỏ. Sau đó, có một sự sụt giảm nhanh chóng nồng độ estrogen và testosterone trong huyết tương xuống mức tiền dậy thì. Tuy nhiên, DHEAS không thay đổi. Kinh nguyệt ngừng lại, nhưng sự sừng hóa âm đạo không liên tục (chỉ số trưởng thành 90/10/0 đến 0/90/10) đã được tìm thấy nhiều lần. Sự to ra của vú và sự phát triển của lông sinh dục lại tiếp tục ở 8.5 tuổi, với nồng độ hormone sinh dục dậy thì bình thường. Kinh nguyệt xảy ra ở 9.5 tuổi.
Các khối u vỏ thượng thận, như được thảo luận trong Chương 14, thường gây ra nam hóa nhanh chóng được đặc trưng bởi sản xuất DHEAS rất cao; tuy nhiên, androstenedione là androgen chiếm ưu thế trong nhiều trường hợp. Một cuộc thảo luận trường hợp được đưa ra với Hình 16.40. Nhiều trường hợp đi kèm với những thay đổi dạng Cushing. Đôi khi, chúng gây ra nữ hóa. Khi các khối u vỏ thượng thận tiết ra cả androgen và estrogen, bức tranh lâm sàng có thể giống như dậy thì sớm đồng giới hoàn toàn. Các bất thường cấu trúc của nhiễm sắc thể 11p15 và các đột biến của gen ức chế khối u p53 khá phổ biến ở các khối u vỏ thượng thận ở trẻ em.
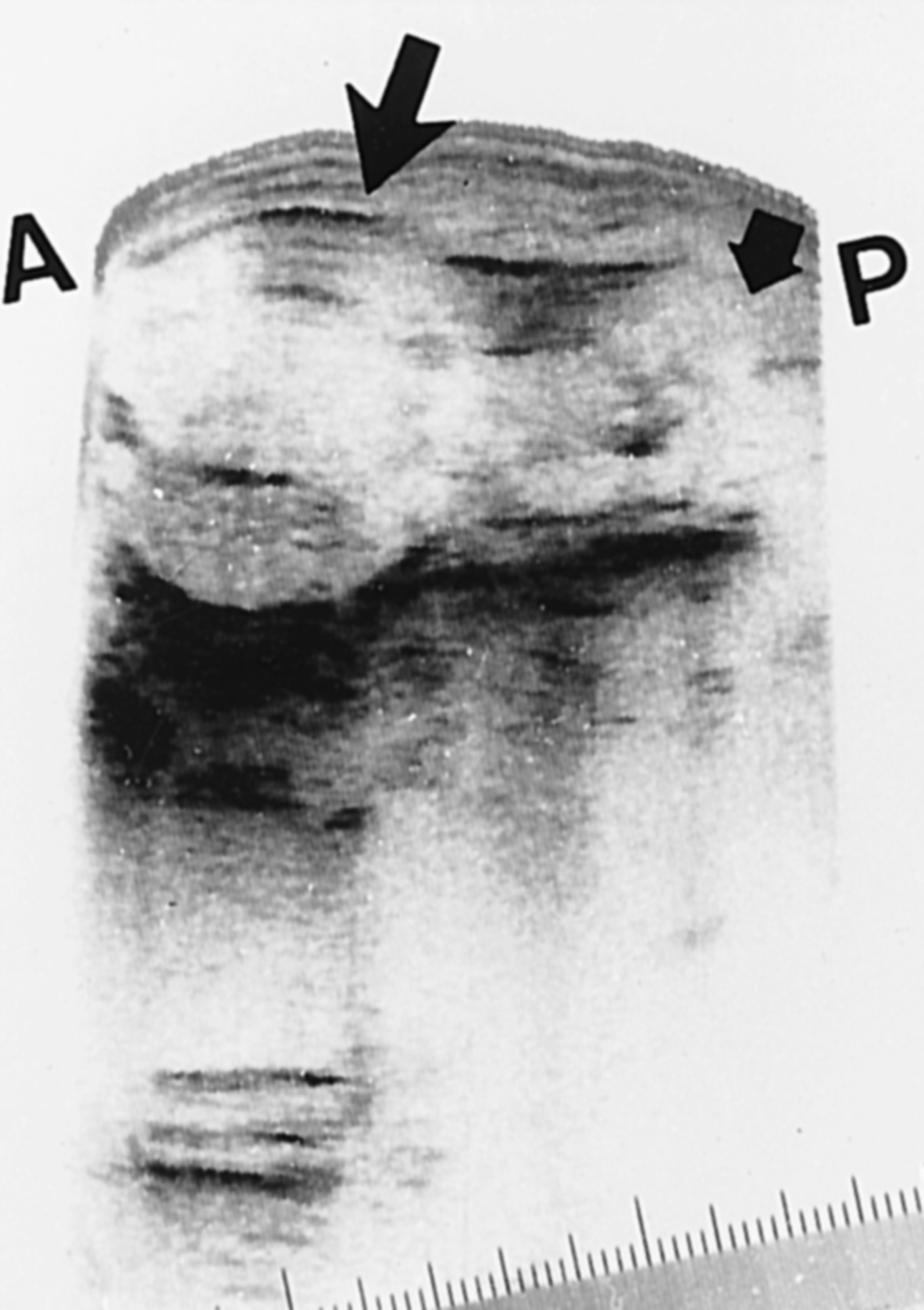
Hình 16.40 Siêu âm bụng (tư thế nằm nghiêng) cho thấy một u tuyến thượng thận có cuống được bao bọc 5 cm (mũi tên lớn) gần cực trên của thận (mũi tên nhỏ). Bé gái 1.3 tuổi này bị nam hóa. Lông mu đã xuất hiện 2 tháng trước, chiều cao đã thay đổi từ phân vị thứ 10 lên 30, và đã xảy ra phì đại âm vật. Tuổi xương là 2.3 tuổi. Dehydroepiandrosterone sulfate là 3000 đến 4271 mcg/dL. Testosterone là 121 ng/dL. A, trước; P, sau.
Hội chứng dư thừa aromatase là một nguyên nhân hiếm gặp của nữ hóa lạc chỗ. Đây là một rối loạn trội trên nhiễm sắc thể thường với độ thấm thay đổi, là kết quả của sự biểu hiện quá mức của gen aromatase một cách cấu thành.
Các steroid ngoại sinh có thể gây dậy thì sớm. Thuốc tránh thai và kem chứa estrogen có sẵn rộng rãi. Một số trường hợp Phát triển vú sớm có thể là do ăn phải thực phẩm bị nhiễm estrogen nhân tạo. Sữa công thức đậu nành là nguồn tiềm năng của phytoestrogen, cũng như nhiều loại thực phẩm, thảo dược, và các sản phẩm bôi ngoài da thường được tiêu thụ (bao gồm các sản phẩm chứa dầu oải hương và dầu cây trà). Người ta đã đề xuất rằng việc tiếp xúc thời thơ ấu với các chất gây ô nhiễm estrogen ở các nước kém phát triển có khuynh hướng gây dậy thì sớm khi trẻ em di cư đến các nước phát triển. Sự phát triển lông mu hoặc mụn trứng cá sớm có thể là kết quả của việc sử dụng steroid đồng hóa. Việc sử dụng androgen không kê đơn bôi ngoài da bởi cha mẹ, chẳng hạn như cho rối loạn chức năng tình dục hoặc các tác dụng đồng hóa, có thể gây ra sự phát triển lông mu sớm mà không nhất thiết có thể phát hiện được bằng các xét nghiệm tiêu chuẩn.
Chảy máu âm đạo trong trường hợp không có sự phát triển vú gợi ý dị vật, lạm dụng tình dục, hoặc các khối u của đường sinh dục. Một nguyên nhân hiếm gặp là “kinh nguyệt sớm”, có thể là kết quả của một biến thể cực đoan trong sự kích hoạt buồng trứng không liên tục bình thường của các bé gái. Dịch tiết có mùi hôi rất gợi ý dị vật. Lỗ màng trinh lớn hơn 5 mm hoặc các vết khía phía sau tương thích với lạm dụng tình dục. U xơ thần kinh đã được báo cáo là mô phỏng sự phát triển vú và phì đại âm vật.
Chẩn đoán phân biệt
Một bác sĩ không cần phải có kinh nghiệm về nội tiết để chẩn đoán và quản lý hầu hết các bé gái có biểu hiện phát triển vú hoặc lông mu sớm. Phần lớn, sự xuất hiện đơn độc của một trong những dấu hiệu này là do các quá trình lành tính của Phát triển vú sớm hoặc sự phát triển lông mu sớm. Một bệnh sử và khám thực thể bình thường, cùng với một tuổi xương bình thường, là đủ để làm việc.
Trong bệnh sử, bác sĩ nên hỏi về khả năng tiếp xúc hoặc truy cập vào các steroid ngoại sinh dưới dạng thuốc viên, chế độ ăn uống, hoặc các chất bôi ngoài da (chẳng hạn như kem estrogen hoặc các sản phẩm chăm sóc cá nhân chứa dầu oải hương hoặc dầu cây trà). Khả năng lạm dụng tình dục, nhiễm trùng âm đạo, hoặc dị vật phải được ghi nhớ khi đánh giá trẻ bị chảy máu âm đạo đơn độc. Trong quá trình khám, bác sĩ nên tìm kiếm các nốt ruồi, gai đen, các dấu hiệu có thể gợi ý bệnh nội sọ hoặc bệnh vùng bụng-chậu, và kiểm tra bộ phận sinh dục ngoài. Chiều cao và cân nặng của trẻ nên được ghi lại cẩn thận, biểu đồ tăng trưởng được kiểm tra, và phân vị BMI được vẽ.
Nếu bệnh sử và khám không có gì đặc biệt, chỉ cần xác định tuổi xương để sàng lọc xem triệu chứng có thực sự là một hiện tượng đơn độc hay có sự dư thừa hormone đáng kể hay không. Nếu tuổi xương không tiến triển bất thường so với tuổi chiều cao, có khả năng triệu chứng hiện tại là một biến thể cực đoan đơn độc và lành tính của bình thường, không cần điều trị. Để xác nhận chẩn đoán Phát triển vú sớm hoặc adrenarche sớm, trẻ phải được tái đánh giá tương tự sau 3 đến 6 tháng. Nếu kết quả vẫn âm tính, gia đình có thể được trấn an với một mức độ tin cậy cao rằng dậy thì thực sự, bao gồm cả kinh nguyệt, sẽ không xảy ra cho đến tuổi thông thường.
Nếu có nhiều hơn một dấu hiệu của dậy thì sớm hoặc phát triển hoặc nếu sự tăng trưởng được tăng tốc, một quy trình làm việc sâu hơn là cần thiết. Ví dụ, nếu một bé gái nhỏ có sự phát triển vú sớm bắt đầu mọc lông mu, hoặc ngược lại, thì có điều gì đó còn hơn cả Phát triển vú sớm hoặc adrenarche sớm. Điều tương tự cũng đúng nếu bé có một đợt tăng trưởng đột biến hoặc nếu bé bắt đầu có kinh nguyệt. Những dấu hiệu bổ sung này cho thấy cần phải có các nghiên cứu sâu hơn. Chảy máu âm đạo đơn độc, tức là chảy máu không có các đặc điểm sinh dục thứ phát, gợi ý lạm dụng tình dục, dị vật, hoặc khối u đường sinh dục, hiếm khi là kinh nguyệt đơn độc. Tế bào học, cấy kỵ khí, siêu âm tiểu khung, và xét nghiệm estradiol huyết thanh là cần thiết.
Sự tiến triển của tuổi xương không tương xứng với chiều cao (như được chỉ ra bởi tiềm năng chiều cao bị tổn hại hoặc tuổi xương ≥ 20% lớn hơn tuổi chiều cao) gợi ý một sự dư thừa hormone sinh dục kéo dài, và là một chỉ định cho một cuộc điều tra sâu hơn để xác định nguyên nhân của sự sớm. Một phương pháp tiếp cận theo thuật toán để chẩn đoán phân biệt sự phát triển lông mu sớm được trình bày trong Hình 16.32. Tầm quan trọng của việc kiểm tra lại được minh họa bằng trường hợp được trình bày trong Hình 16.39.
Cần phải đặc biệt lưu ý rằng các bé gái bị dậy thì sớm do thần kinh, đặc biệt là những người đã được chiếu xạ sọ não, có nguy cơ bị thiếu hụt GH đồng thời một cách nghịch lý. Thiếu hụt GH đồng thời che giấu sự nghiêm trọng của dậy thì sớm: tốc độ tăng trưởng bình thường (không tăng tốc) và sự phát triển vú bị suy giảm. Tuy nhiên, sự chênh lệch giữa tuổi xương và tuổi chiều cao là cực đoan.
Nếu bức tranh lâm sàng và tuổi xương gợi ý rằng sự phát triển vú sớm có thể là do dậy thì sớm, việc điều tra trong phòng thí nghiệm về sự phát triển dậy thì sớm đòi hỏi phải xác định các steroid sinh dục, LH, và FSH bằng các xét nghiệm có độ nhạy cao: ít nhất 10 pg/mL đối với estradiol, 10 ng/dL đối với testosterone, 5 mcg/dL đối với DHEAS, và 0.2 U/L đối với LH và FSH. Các xét nghiệm nền tảng đa kênh hiện đại có sẵn rộng rãi thường đáp ứng các thông số kỹ thuật này cho các xét nghiệm DHEAS, LH, và FSH, nhưng chúng hoàn toàn không đủ cho testosterone và estradiol. Những xét nghiệm này đòi hỏi các xét nghiệm có độ nhạy và độ đặc hiệu cao, chẳng hạn như được cung cấp bởi RIA sau sắc ký hoặc khối phổ song song, trong các phòng thí nghiệm có các khoảng giá trị bình thường được thiết lập tốt cho trẻ em. Nồng độ estradiol tiền dậy thì thường dưới 10 pg/mL, và testosterone tiền dậy thì dưới 20 ng/dL. Việc đo thyroxine và prolactin huyết thanh được chỉ định nếu dậy thì sớm đi kèm với ngừng tăng trưởng và/hoặc tiết sữa.
Trong dậy thì sớm trung ương, nồng độ estradiol huyết thanh ban ngày thường ở mức dậy thì, 10 pg/mL (37 pmol/L) hoặc hơn. Một nồng độ estradiol trong khoảng giá trị bình thường tiền kinh nguyệt trên (≥ 75 pg/mL) là không điển hình và đòi hỏi phải có một quy trình làm việc nhanh chóng để phân biệt khối u buồng trứng hoặc thượng thận với dậy thì sớm đồng giới thực sự. Nếu nồng độ estradiol cao bất thường, việc xác định estradiol hàng tuần có thể hữu ích để xác định xem nồng độ có dao động theo kiểu chu kỳ bình thường của dậy thì sớm thực sự hay không. Do bản chất từng đợt và theo chu kỳ của bài tiết hormone sinh dục, việc kiểm tra niêm mạc âm đạo (xem Hình 16.28) để tìm tác động của estrogen là một chỉ số nhạy cảm hơn về sự hiện diện của dậy thì sớm so với nồng độ estradiol trong máu, vì nó đại diện cho tác động tích hợp của estrogen trong 2 đến 3 tuần trước đó. Kích thước tử cung (ví dụ, chiều dài tử cung > 3.8 cm và độ dày nội mạc tử cung ≥ 2 mm) đã được sử dụng như một chỉ số khách quan của sự estrogen hóa tổng thể. Nồng độ androgen phù hợp với giai đoạn sự phát triển lông mu trong dậy thì sớm thực sự.
Các xét nghiệm miễn dịch “nhi khoa” thế hệ thứ ba, dựa trên kháng thể đơn dòng, đối với gonadotropin là cần thiết để phát hiện sớm và theo dõi điều trị. LH nền buổi sáng sớm lớn hơn 0.3 đến 0.6 U/L đã được báo cáo là có độ nhạy từ 62% đến 95% và độ đặc hiệu từ 92% đến 100% cho chẩn đoán dậy thì sớm trung ương ở các bé gái. Đỉnh LH sau GnRH lớn hơn 6.9 U/L đã được báo cáo là có độ nhạy 92% và độ đặc hiệu 100%, trong khi đỉnh LH sau chất chủ vận GnRH trên 4.0 đến 5.0 U/L đã được báo cáo là có độ chính xác từ 90% trở lên cho chẩn đoán dậy thì sớm trung ương.
Một nghiên cứu về nồng độ LH được kích thích bởi chất chủ vận GnRH ở các bé gái tiền dậy thì khỏe mạnh cho thấy nồng độ trung bình là 5.2 ± 4.0 và 2.9 ± 2.5 U/L ở các bé gái từ 0.8 đến 3 tuổi và từ 3 đến 6 tuổi, gợi ý một mức cắt LH là 9 U/L và tỷ lệ LH/FSH là 0.4 ở các bé gái dưới 3 tuổi. Độ đặc hiệu chẩn đoán của xét nghiệm chất chủ vận GnRH bị phức tạp hóa bởi sự chồng chéo giữa các đáp ứng gonadotropin của các bé gái tiền dậy thì và dậy thì. Một nghiên cứu trên các bé gái khỏe mạnh từ 6 đến 13 tuổi cho thấy phân vị thứ 95 đối với các bé gái tiền dậy thì là 8.9 U/L và phân vị thứ 5 đối với các bé gái dậy thì là 2.8 U/L (Bảng 16.1). Trong một phân nhóm các bé gái quanh tuổi dậy thì từ 8 đến 11 tuổi, các giá trị LH phân biệt nhất là 3.2 U/L (đặc hiệu 85%) và 5.5 U/L (nhạy 72%) 1 giờ sau khi dùng chất chủ vận GnRH. Xét nghiệm chất chủ vận GnRH cũng cho phép đánh giá khả năng đáp ứng của buồng trứng với gonadotropin: một đỉnh estradiol từ 34 pg/mL trở lên có độ nhạy khoảng 90% và từ 60 pg/mL trở lên có độ đặc hiệu 95% đối với dậy thì (xem Bảng 16.1).
Nồng độ FSH không hữu ích trong chẩn đoán vì các giá trị tiền dậy thì chồng chéo đáng kể với các giá trị dậy thì và chúng có thể tăng trong Phát triển vú sớm. Để đáp ứng với xét nghiệm GnRH hoặc chất chủ vận GnRH, trẻ em bị dậy thì giả không bền vững như các biến thể của bình thường sẽ có một đáp ứng gonadotropin tối thiểu, trong khi trẻ em bị dậy thì sớm không phụ thuộc vào gonadotropin sẽ có các đáp ứng bị ức chế. Việc chứng minh sự gia tăng LH huyết thanh liên quan đến giấc ngủ là một thủ thuật chẩn đoán thay thế. Hộp 16.3 tóm tắt các tiêu chí phòng thí nghiệm cho chẩn đoán dậy thì sớm hoàn toàn.
| Hộp 16.3. Tiêu chí xét nghiệm để Chẩn đoán Dậy thì sớm hoàn toàn ở Bé gái Sự tiến triển của Tuổi xương
Nồng độ LH dậy thì a
Nồng độ Hormone sinh dục dậy thì
DHEA, Dehydroepiandrosterone; GnRH, hormone giải phóng gonadotropin; LH, hormone tạo hoàng thể. |
Sự phát triển lông mu sớm phải được phân biệt với rậm lông, sự phát triển quá mức lan tỏa của lông tơ trên cơ thể nổi bật ở các khu vực không liên quan đến sinh dục. Nguyên nhân phổ biến nhất, cho đến nay, của sự phát triển lông mu sớm là dậy thì thượng thận sớm. Dậy thì thượng thận sớm phải được phân biệt với các rối loạn gây nam hóa, phổ biến nhất trong số đó là CAH không điển hình gây nam hóa và nghiêm trọng nhất, mặc dù hiếm gặp, là khối u gây nam hóa.
Việc xác định mô hình androgen huyết thanh nền buổi sáng sớm rất hữu ích trong việc phân biệt giữa các nguyên nhân gây sự phát triển lông mu sớm và nam hóa. Dậy thì thượng thận sớm được đặc trưng bởi nồng độ DHEAS ở mức dậy thì, trong khi testosterone và androstenedione huyết thanh, nhiều nhất, chỉ tăng nhẹ trên khoảng giá trị tiền dậy thì. Một nồng độ DHEAS tăng cao đáng kể gợi ý hoặc là khối u thượng thận hoặc là dạng thiếu hụt 3β-HSD của CAH. Nồng độ androstenedione và 17-OHP tăng không tương xứng so với nồng độ testosterone hoặc DHEAS trong các dạng khác của CAH gây nam hóa và nhiều khối u buồng trứng.
Một nghiệm pháp kích thích ACTH là xét nghiệm cuối cùng để loại trừ CAH. Chúng tôi khuyên nên thực hiện một nghiệm pháp ACTH ở trẻ em bị sự phát triển lông mu sớm có androgen huyết thanh cao bất thường và tuổi xương tiến triển và nồng độ 17-OHP huyết thanh buổi sáng sớm trên 170 ng/dL (5.1 nmol/L) (Hình 16.32), mặc dù nồng độ trên 1500 ng/dL không cần một nghiệm pháp kích thích ACTH xác nhận. Chẩn đoán CAH được thảo luận chi tiết trong Chương 14. Chẩn đoán phân biệt các rối loạn cường androgen được thảo luận thêm trong phần Cường androgen ở Vị thành niên.
Siêu âm được chỉ định để sàng lọc các khối u bụng hoặc tiểu khung khi nghi ngờ các rối loạn gây nữ hóa hoặc nam hóa. Buồng trứng của các bé gái bị dậy thì sớm thực sự giống với buồng trứng của các bé gái dậy thì bình thường. Một “nang” có đường kính từ 10 mm trở lên thường là do một nang trứng tiền rụng trứng thoáng qua. Tuy nhiên, chẩn đoán phân biệt của một nang tồn tại hoặc buồng trứng đa nang bao gồm hội chứng McCune-Albright, khối u, và suy buồng trứng sớm.
Khả năng của siêu âm trong việc phát hiện các khối u thượng thận nhỏ phụ thuộc rất nhiều vào chuyên môn của người siêu âm. Trong những trường hợp hiếm hoi, siêu âm không nhạy trong việc phát hiện một khối u buồng trứng ở người lớn. Chụp cắt lớp vi tính và MRI cho phép hình dung tốt hơn và đánh giá chi tiết hơn các khối u.
Một tổng quan hệ thống bao gồm 1853 đối tượng đã phát hiện ra rằng MRI não đã xác định được một phát hiện bệnh lý ở 9% các bé gái bị dậy thì sớm trung ương, với tỷ lệ hiện mắc cao hơn nhiều ở những người dưới 6 tuổi (25%), so với những người từ 6 đến 8 tuổi (3%). Phát hiện phổ biến nhất là một hamartoma dưới đồi ở khoảng 3.7%, trong khi 1.3% các đối tượng có một loại khối u CNS khác. Do đó, MRI vùng dưới đồi-tuyến yên được chỉ định trong dậy thì sớm trung ương tiến triển ở những người dưới 6 tuổi hoặc những người có nguy cơ có nguyên nhân thực thể do tình trạng cơ bản hoặc các triệu chứng và dấu hiệu thần kinh của họ, trong khi sự cần thiết của việc chụp ảnh như vậy ở các bé gái có biểu hiện từ 6 đến 8 tuổi không có chỉ định thần kinh là ít chắc chắn hơn. Một lập luận cho việc xét nghiệm di truyền cho bệnh nhân bị CPP đã được đưa ra, trích dẫn tính hiệu quả về chi phí và sự an toàn trong các trường hợp cần MRI có an thần.
Điều trị
Các mục tiêu trong quản lý là loại trừ một rối loạn thực thể cần điều trị riêng và xác định xem dậy thì sớm có đang làm tổn hại đến tiềm năng chiều cao hay dẫn đến các rối loạn cảm xúc thứ phát quan trọng ở trẻ hay không.
Tình huống một bé gái có biểu hiện khởi phát phát triển vú hoặc lông mu trong khoảng từ 6.0 đến 8.0 tuổi cần được xem xét đặc biệt. Sự phát triển vú trong khoảng từ 7.0 đến 8.0 tuổi là bình thường ở người da đen và người gốc Tây Ban Nha. Mặc dù lông mu tiền sinh dục (giai đoạn 2) có thể được thấy ở các bé gái da đen và gốc Tây Ban Nha từ 6 đến 8 tuổi, lông mu sinh dục (giai đoạn 3) là bất thường nếu có mặt trước 8 tuổi (xem Bảng 16.3). Tuy nhiên, sự phát triển dậy thì ở các bé gái trong độ tuổi từ 6.0 đến 8.0 có thể liên quan đến bệnh lý, với béo phì quá mức là mối quan tâm chính ở hầu hết các trường hợp.
Nhiều bé gái từ 6.0 đến 8.0 tuổi bị dậy thì sớm trung ương, bao gồm cả người da trắng, có dậy thì sớm tiến triển chậm, với thời điểm có kinh bình thường, và có nguy cơ thấp bị tầm vóc thấp ở người lớn. Hầu hết các bé gái như vậy không cần điều trị bằng chất chủ vận GnRH để bảo tồn tầm vóc người lớn. Do đó, một cuộc điều tra ít toàn diện hơn có thể được bảo đảm ở các bé gái được chọn có biểu hiện Phát triển vú hoặc lông mu giai đoạn 2 trong độ tuổi từ 6 đến 8. Đối với hầu hết các bé gái như vậy, một bệnh sử và khám thực thể đầy đủ, bao gồm đánh giá béo phì và xác định tuổi xương, có thể là tất cả những gì cần thiết, cùng với việc theo dõi theo chiều dọc cẩn thận để loại trừ một rối loạn cần điều trị. Tuy nhiên, các bé gái từ 6 đến 8 tuổi có dấu hiệu gợi ý androgen hóa hoặc nữ hóa tiến triển nhanh hoặc quá mức, các triệu chứng thần kinh, tăng tốc độ tăng trưởng tuyến tính, hoặc tiến triển tuổi xương đáng kể nên được đánh giá đầy đủ hơn, như đã nêu trước đó.
Các tổn thương nội sọ phải được điều trị bằng các biện pháp thích hợp, chẳng hạn như phẫu thuật thần kinh hoặc chiếu xạ. Dẫn lưu cho não úng thủy có thể ngăn chặn dậy thì sớm. Các khối u tế bào hạt giới hạn ở buồng trứng có tiên lượng tốt để chữa khỏi bằng cách cắt bỏ buồng trứng một bên. Tuy nhiên, tái phát khối u có thể xảy ra đến 20 năm sau phẫu thuật ban đầu. Sinh thiết buồng trứng đối diện được chỉ định trong các khối u buồng trứng một bên. Phì đại buồng trứng bù trừ có thể được mong đợi ở mọi lứa tuổi sau khi cắt bỏ một buồng trứng.
Biến chứng thể chất vĩnh viễn duy nhất của dậy thì sớm đồng giới thực sự, khi mọi thứ khác đều bình thường, là chiều cao người lớn thấp. Không có sự gia tăng nguy cơ béo phì, các rối loạn chuyển hóa (tiểu đường, tăng huyết áp, rối loạn lipid máu), hoặc ung thư ở người lớn có tiền sử dậy thì sớm trung ương, cho dù họ có được điều trị bằng chất chủ vận GnRH hay không. Phụ nữ có tiền sử dậy thì sớm trung ương, dù được điều trị hay không, có tỷ lệ rậm lông và kinh nguyệt không đều cao hơn, và những phụ nữ không được điều trị dậy thì sớm có thể bị giảm khả năng sinh sản và cần hỗ trợ sinh sản nhiều hơn. Tuy nhiên, khả năng sinh sản là bình thường ở những phụ nữ được điều trị bằng chất chủ vận GnRH hoặc bằng cyproterone acetate cho dậy thì sớm trung ương, với tỷ lệ mang thai tự nhiên không khác so với nhóm đối chứng. Kết quả mang thai là bình thường ở cả phụ nữ được điều trị và không được điều trị có tiền sử dậy thì sớm trung ương. Về chiều cao, việc sản xuất hormone sinh dục quá mức trong thập kỷ đầu tiên của cuộc đời gây ra sự trưởng thành sớm của các sụn tăng trưởng, dẫn đến sự đóng sớm của chúng. Khoảng một nửa số bé gái mắc rối loạn này đạt chiều cao người lớn từ 53 đến 59 inch và phần còn lại cao trên 60 inch. Sự không phù hợp giữa sự phát triển thể chất, nội tiết, và tâm lý có thể gây ra những thay đổi hành vi từ rút lui xã hội đến hung hăng hoặc tình dục. Tuy nhiên, các vấn đề hành vi rõ ràng là không phổ biến ở các bé gái và do đó bản thân chúng hiếm khi là chỉ định điều trị.
Khi dậy thì sớm trung ương đi kèm với sự tiến triển được ghi nhận của sự phát triển dậy thì làm tăng tốc độ tăng trưởng và làm tổn hại đến tiềm năng chiều cao bình thường, việc điều trị bằng chất chủ vận GnRH được chỉ định. Việc ghi nhận thường đòi hỏi 3 đến 6 tháng quan sát, mặc dù điều này có thể không cần thiết nếu dậy thì tiến triển đáng kể về mặt lâm sàng và nội tiết khi có biểu hiện. Tác dụng điều hòa giảm của các chất chủ vận GnRH đối với việc giải phóng gonadotropin của tuyến yên ức chế bài tiết gonadotropin trong vòng 1 tháng. Các tiêu chí đề xuất cho việc sử dụng các loại thuốc này được trình bày trong Hộp 16.4. Các tác nhân thường được sử dụng ở Hoa Kỳ là leuprolide acetate (thường được dùng dưới dạng Lupron Depot-Ped® 7.5–15 mg/tháng hoặc 11.25–30 mg/3 tháng tiêm bắp [IM]), nafarelin acetate (Synarel® 800 mcg hai lần mỗi ngày xịt mũi), một cấy ghép histrelin (Supprelin® LA 50 mg cấy ghép hàng năm), và triptorelin (Triptodur® 22.5 mg/24 tuần IM). Liều lượng có thể được điều chỉnh sau đó nếu cần.
Hộp 16.4. Chỉ định điều trị Dậy thì sớm bằng Chất chủ vận Hormone giải phóng Gonadotropin
(Chỉnh sửa từ Rosenfield, R.L. (1994). Selection of children with precocious puberty for treatment with gonadotropin releasing hormone analogs. J Pediatr, 124, 989–991.) |
Điều trị được coi là đủ nếu nồng độ estradiol và LH nền trở về mức tiền dậy thì hoặc LH dưới 4.0 (1 giờ) đến 6.6 U/L (2 giờ) sau khi dùng chất chủ vận GnRH 1 tháng sau khi bắt đầu điều trị. Chảy máu do ngừng thuốc có thể xảy ra vào thời điểm đó, nhưng không nên mong đợi có thêm sau đó. Sự ngừng phát triển vú và đợt tăng trưởng dậy thì trở nên rõ ràng sau 3 đến 6 tháng. Đồng thời, sự đóng sụn tăng trưởng bị trì hoãn và tiềm năng chiều cao người lớn được cải thiện, vì một loại tăng trưởng bắt kịp xảy ra trong đó tuổi chiều cao bắt kịp tuổi xương. Chiều cao người lớn lớn nhất khi điều trị được bắt đầu ngay sau khi khởi phát ở độ tuổi sớm, mang lại mức tăng chiều cao trung bình trên dự đoán chiều cao trước điều trị khoảng 1.4 cm cho mỗi năm điều trị. Dự đoán chiều cao người lớn vào cuối điều trị có xu hướng được đánh giá quá cao từ tuổi xương. Do đó, việc kéo dài điều trị quá tuổi đời hoặc tuổi xương từ 12.0 đến 12.5 tuổi thường dẫn đến ít sự gia tăng thêm về tiềm năng chiều cao người lớn, bất kể dự đoán về tiềm năng chiều cao còn lại. Kinh nguyệt xảy ra trung bình từ 12 đến 20 tháng sau khi ngừng điều trị bằng chất chủ vận GnRH.
Thiếu hụt GH đồng thời phải được điều trị để tăng trưởng tối ưu. Bệnh nhân đủ GH bị dậy thì sớm trung ương bắt đầu điều trị tương đối muộn và có vận tốc chiều cao giảm xuống dưới 4 cm/năm sau 2 đến 3 năm, dường như tăng trung bình 2 cm/năm khi thêm liệu pháp GH.
Việc sử dụng dạng depot của chất chủ vận GnRH bị phức tạp bởi các áp xe vô trùng tại các vị trí tiêm ở khoảng 5% các trường hợp. Cấy ghép histrelin bị gãy khi lấy ra hơn 20% trường hợp, đòi hỏi phải cẩn thận để lấy hết cấy ghép. Sốc phản vệ là một biến chứng hiếm gặp. Không có tác dụng phụ nghiêm trọng nào khác được phát hiện. Trong quá trình điều trị, các bé gái bị dậy thì sớm trung ương không khác biệt về chức năng nhận thức hoặc tâm lý xã hội so với nhóm đối chứng. Dữ liệu an toàn dài hạn vẫn chưa đầy đủ, nhưng các nghiên cứu hiện tại theo dõi các đối tượng đến tuổi trưởng thành trẻ là đáng yên tâm, bao gồm không có sự khác biệt về đặc điểm chu kỳ kinh nguyệt hoặc kết quả mang thai của các đối tượng được điều trị so với các đối tượng không được điều trị và một số bằng chứng về khả năng sinh sản được cải thiện với điều trị bằng chất chủ vận GnRH so với ở những phụ nữ có tiền sử dậy thì sớm trung ương không được điều trị. Điều trị bằng chất chủ vận GnRH dường như không gây ra hoặc làm nặng thêm tình trạng béo phì, được đánh giá từ BMI. Mật độ khoáng xương giảm khi bắt đầu điều trị, nhưng trở lại bình thường sau khi ngừng điều trị bằng chất chủ vận GnRH cho dậy thì sớm.
Các bé gái bị dậy thì tiến triển chậm vô căn khởi phát trong độ tuổi từ 6 đến 8 hoặc bị dậy thì nhanh sớm trong độ tuổi từ 8 đến 9 có xu hướng cao khi bắt đầu dậy thì, theo một mô hình tăng trưởng sớm, và đạt được chiều cao mục tiêu của họ mà không cần điều trị bằng chất chủ vận GnRH. Do đó, phương pháp điều trị này chỉ được chỉ định nếu tiềm năng chiều cao bị tổn hại hoặc có những lý do thuyết phục khác để làm chậm nhịp độ dậy thì.
Medroxyprogesterone acetate (Depo-Provera) hữu ích để ngừng kinh nguyệt và như một biện pháp tránh thai ở các bé gái bị khuyết tật trí tuệ mà việc bảo tồn tiềm năng chiều cao không quan trọng. Nó được bắt đầu với liều lượng bắt đầu từ 50 mg/tháng tiêm bắp. Các liều cao tới 400 mg/tháng đã được sử dụng, mặc dù các tác dụng phụ dạng Cushing có thể được quan sát thấy ở mức này. Mặc dù phương pháp điều trị này đảo ngược một số thay đổi thể chất của dậy thì sớm, nó không đảo ngược sự trưởng thành quá nhanh của bộ xương, có thể là do tính androgen yếu vốn có của nó. Ngoài ra, việc sử dụng medroxyprogesterone acetate có liên quan đến việc mất mật độ khoáng xương, điều này phải được xem xét nếu đang xem xét việc sử dụng lâu dài.
Một loạt các loại thuốc đã được sử dụng ngoài nhãn để điều trị dậy thì sớm không phụ thuộc vào gonadotropin. Cả phương pháp điều trị kháng estrogen và ức chế aromatase đều đã chứng minh hiệu quả một phần đối với hội chứng McCune-Albright. Tuy nhiên, nên có một khoảng thời gian quan sát trước khi bắt đầu điều trị cho bệnh nhân bị hội chứng McCune-Albright, vì có thể có sự thay đổi rõ rệt trong diễn biến lâm sàng, với một số bệnh nhân có các giai đoạn bệnh không hoạt động kéo dài mà việc điều trị có thể không được chỉ định. Đã có các báo cáo về can thiệp phẫu thuật ở trẻ em bị hội chứng McCune-Albright, bao gồm cắt bỏ một nang buồng trứng hoặc cắt bỏ buồng trứng. Tuy nhiên, trong nhiều trường hợp này, đã có sự tái phát của các triệu chứng dậy thì sớm. Do đó, phương pháp điều trị như vậy chỉ nên được xem xét trong các tình huống rất chọn lọc, chẳng hạn như một bé gái có một nang buồng trứng lớn có nguy cơ xoắn buồng trứng. Ketoconazole, một chất chống nấm ức chế hoạt động 17,20-lyase và các enzyme sinh steroid khác, có thể hữu ích. Điều trị bằng chất chủ vận GnRH có thể cần thiết cho những người mà dậy thì thực sự trở nên chồng chất vì tuổi xương đã đạt đến mức dậy thì. Bisphosphonate thường có hiệu quả trong việc giảm đau xương của loạn sản xơ trong hội chứng McCune-Albright, mặc dù chúng dường như không có tác động đến diễn biến của các tổn thương và không phải là một phương pháp điều trị lâu dài phù hợp.
Bệnh nhân bị Phát triển vú hoặc sự phát triển lông mu sớm như các biến thể của bình thường được tư vấn như sau. Sự phát triển sớm của trẻ dường như là vấn đề của một giai đoạn dậy thì bình thường xảy ra sớm. Nó là do một loại dậy thì không hoàn toàn, chậm hoặc do tăng nhạy cảm với nồng độ hormone vi lượng thường có mặt trong thời thơ ấu. Nữ hóa với sự phát triển vú và cuối cùng là kinh nguyệt có thể được mong đợi xảy ra ở một độ tuổi thích hợp. Không có chỉ định điều trị. Để loại trừ sự dư thừa hormone sinh dục tinh tế hoặc các hội chứng không rụng trứng cuối cùng, việc theo dõi lâu dài là nên làm.
Ngoài việc đối phó với các hậu quả thể chất của dậy thì sớm đồng giới thực sự, bác sĩ phải sẵn sàng giúp đỡ gia đình và trẻ đối phó với các vấn đề tâm lý đi kèm với sự trưởng thành thể chất sớm. Bác sĩ có thể giúp gia đình bằng cách giải thích rằng mặc dù con của họ trông lớn hơn và trưởng thành hơn những đứa trẻ khác cùng tuổi, đứa trẻ sẽ không hành xử trưởng thành hơn. Ham muốn tình dục của trẻ nhỏ bị dậy thì sớm không tăng. Gia đình nên được khuyên nên thực hiện một số biện pháp phòng ngừa để giảm bớt sự chú ý đến sự phát triển của con mình, ví dụ, trong việc lựa chọn quần áo và đồ bơi. Ban đầu, trẻ em mắc các rối loạn này có xu hướng thu mình vì chúng cảm thấy mình khác biệt so với bạn bè đồng trang lứa. Sau này, chúng có xu hướng bước vào các mối quan hệ lãng mạn sớm. Điều quan trọng là phải nhắc nhở gia đình và đứa trẻ rằng trong vài năm nữa, đứa trẻ sẽ không còn đặc biệt từ quan điểm phát triển sinh dục. Các cuốn sách sau đây có thể hữu ích trong việc giải thích về dậy thì sớm: cho trẻ em, Chuyện gì đang xảy ra với tôi?, của Peter Mayle (Lyle Stuart, Inc., Secaucus, NJ, 1973); cho cha mẹ, Những sai lầm giới tính của cơ thể, của John Money (Paul H Brookes Publishing Co., Inc, Baltimore, MD, ed. 2, 1994).
Suy sinh dục
Nguyên nhân
Nếu suy sinh dục hoàn toàn và có mặt trước tuổi dậy thì, nó sẽ gây ra tình trạng ấu trĩ sinh dục. Ở nam giới di truyền, suy sinh dục nguyên phát bẩm sinh cũng có thể gây ra một kiểu hình hoàn toàn nữ hoặc không rõ ràng (xem Chương 6). Nếu suy sinh dục ở các bé gái là một phần hoặc khởi phát ở những năm đầu tuổi vị thành niên, sự nữ hóa sẽ ở mức độ quá hạn chế để cho phép bắt đầu có kinh ở độ tuổi bình thường (vô kinh nguyên phát). Các dạng suy sinh dục nhẹ hơn, một phần, hoặc không hoàn toàn có thể biểu hiện ở tuổi vị thành niên với chảy máu tử cung bất thường (Hộp 16.2). Do đó, các rối loạn gây suy sinh dục xuất hiện trong chẩn đoán phân biệt của các rối loạn biệt hóa giới tính, ấu trĩ sinh dục, thất bại trong tiến triển dậy thì, và kinh nguyệt không đều. Các nguyên nhân gây suy sinh dục được liệt kê trong chẩn đoán phân biệt của vô kinh trong Hộp 16.5.
| Hộp 16.5. Chẩn đoán phân biệt Vô kinh: Các Rối loạn Cấu trúc và Không rụng trứng
Cấu trúc sinh dục bất thường
Các Rối loạn Không rụng trứng Suy estrogen, FSH tăng
Suy estrogen, FSH không tăng
Được estrogen hóa
FSH, Hormone kích thích nang trứng. |
Suy buồng trứng nguyên phát
Suy buồng trứng nguyên phát được đặc trưng bởi nồng độ gonadotropin cao, đặc biệt là FSH. Có hai ngoại lệ đối với quy tắc này. Thứ nhất, gonadotropin có thể không tăng cho đến khi sự trưởng thành của CNS đạt đến giai đoạn dậy thì, như được chỉ ra bởi tuổi xương khoảng 10 đến 11 tuổi (Bảng 16.5). Thứ hai, bệnh nhân bị suy buồng trứng sớm hoặc một phần (suy buồng trứng sớm), như thường xảy ra trong quá trình chuyển đổi mãn kinh, không có nồng độ gonadotropin nền cao. FSH có thể đáp ứng quá mức với GnRH và estrogen đáp ứng kém với thử thách chất chủ vận GnRH. Dường như một số ít nang buồng trứng—quá ít để cho phép sự xuất hiện theo chu kỳ của các nang tiền rụng trứng—là đủ để ngăn chặn sự gia tăng đặc trưng của nồng độ FSH nền. Nồng độ AMH huyết thanh là một chỉ số kém nhạy hơn về suy buồng trứng so với FSH nhưng có thể hữu ích trong việc tiên lượng khả năng sinh sản.
Bảng 16.5 Tuổi xương trong quy trình làm việc của các bé gái ấu trĩ sinh dục có nồng độ Hormone kích thích nang trứng bình thường
| Tuổi xương (Năm) | |||
|---|---|---|---|
| < 11 | 11–13 | > 13 | |
| Suy sinh dục nguyên phát | Có | ||
| Dậy thì muộn | Có | Có | |
| Thiếu hụt Gonadotropin | Có | Có | Có |
(Từ Rosenfield, R.L., Barnes, R.B. (1993). Menstrual disorders in adolescence. Endocrinol Metab Clin North Am, 22, 491.)
Suy buồng trứng nguyên phát có thể xảy ra trước hoặc trong tuổi dậy thì, gây ra vô kinh nguyên phát, hoặc sau khi đã dậy thì, gây ra vô kinh thứ phát. Tình trạng sau được gọi là suy buồng trứng sớm (POI; ở dạng hoàn toàn được gọi là suy buồng trứng sớm) và về mặt lâm sàng giống như mãn kinh sớm, ngoại trừ việc khoảng 25% các trường hợp đôi khi phục hồi chức năng buồng trứng và có tỷ lệ mang thai tự nhiên là 4.4%.
Loạn sản tuyến sinh dục do thiếu hụt các gen trên nhiễm sắc thể X là nguyên nhân phổ biến nhất của suy buồng trứng nguyên phát và POI. Nó thường là do một sự xóa đoạn vật liệu nhiễm sắc thể X trên quy mô tương đối lớn, có liên quan đến một kiểu hình đặc trưng, nhưng thay đổi, và được gọi là hội chứng Turner (xem Chương 17). Các thai nhi có karyotype 45,X có một số lượng noãn bào bình thường trong buồng trứng vào giữa thai kỳ, nhưng một sự giảm mạnh về số lượng nang trứng, dường như gây ra các dải tuyến sinh dục thông qua một tốc độ apoptosis tăng nhanh. Tuy nhiên, loạn sản tuyến sinh dục, giống như các đặc điểm khác của hội chứng, thường được biểu hiện không hoàn toàn. Do đó, hội chứng Turner nên được xem xét ở tất cả các bé gái bị suy sinh dục nguyên phát hoặc vô kinh thứ phát cho dù họ có các dấu hiệu điển hình của hội chứng Turner hay không.
Các vị trí cụ thể trên nhiễm sắc thể X có liên quan đến suy buồng trứng nguyên phát. Xp11.2 chứa BMP15, một yếu tố biệt hóa buồng trứng đặc hiệu, đột biến dị hợp tử của nó là một nguyên nhân hiếm gặp của loạn sản tuyến sinh dục. Xq chứa hai vị trí độc lập, ngoài tiền đột biến X giòn, có liên quan đến khoảng 5% các trường hợp POI lẻ tẻ và 14% các trường hợp POI có tính gia đình. Tiền đột biến là một sự mở rộng của các lần lặp lại CGG trong gen chậm phát triển tâm thần X giòn 1 (FMR1) không đủ dài để gây ra hội chứng X giòn. Phụ nữ có alen tiền đột biến có nguy cơ POI tăng đáng kể, có thể là do nồng độ mRNA nội bào tăng cao có thể cô lập các protein gắn CGG quan trọng cho quá trình xử lý RNA.
Loạn sản tuyến sinh dục cũng là kết quả của loạn sản tuyến sinh dục hoàn toàn 46,XY và một số dạng lệch bội nhiễm sắc thể thường. Một nguyên nhân hiếm gặp là đột biến bất hoạt thụ thể ERβ (ESR2). Một mức độ loạn sản buồng trứng thay đổi xảy ra trong trisomy 21; kinh nguyệt muộn, các chu kỳ không rụng trứng, và suy tuyến sinh dục nguyên phát đôi khi được thấy. Tuy nhiên, việc mang thai đã được báo cáo; con cái bị trisomy là phổ biến. Noãn bào gần như vắng mặt trong các trisomy 13 và 18. Loạn sản buồng trứng cũng đôi khi xảy ra như một phần của hội chứng Denys-Drash do đột biến WT-1. Loạn sản tuyến sinh dục cũng xảy ra trong các rối loạn sửa chữa DNA làm suy giảm meiosis, chẳng hạn như thất điều-giãn mạch và hội chứng Fanconi. Các rối loạn di truyền trên nhiễm sắc thể thường khác gây suy buồng trứng sớm bao gồm các đột biến bất hoạt của FOXL2, được tìm thấy trong các trường hợp lẻ tẻ, cũng như trong hội chứng hẹp khe mi loại 1 trội trên nhiễm sắc thể thường. POI cũng xảy ra trong bệnh galactosemia, các bệnh loạn dưỡng chất trắng, và loạn dưỡng cơ. Đột biến tiểu đơn vị alpha của inhibin có khuynh hướng gây POI, một tác động dường như thay đổi tùy thuộc vào dân tộc; điều này được giả thuyết là do sự tương tác paracrine thiếu hụt với các thụ thể họ TGFβ. Các đột biến ở các gen trên nhiễm sắc thể thường khác đã được liên kết với POI bao gồm: NOBOX, FSHR (mã hóa thụ thể FSH), và TRIM37 (các đột biến của nó gây ra rối loạn lùn Mulibrey). Các đột biến ở NR5A1, mã hóa yếu tố phiên mã SF-1, có thể dẫn đến loạn sản tuyến sinh dục 46,XY hoặc POI, cũng như là một nguyên nhân của suy thượng thận do sự phát triển tuyến thượng thận bị suy giảm. Các biến thể trong các gen bổ sung đã được xác định ở bệnh nhân bị POI bao gồm PGRMCI ở Xq22-q24 (mã hóa một thụ thể màng gắn progesterone giả định) và các gen trên nhiễm sắc thể thường SPIDR, GDF9, FIGLA, NANOS3, SYCEI, MCM8/9, và HFMI. Có một số gen ứng cử viên khác với bằng chứng nhân quả ít rõ ràng hơn, và các đột biến bị quy kết trong suy buồng trứng của các mô hình chuột hoặc trong các gen liên quan đến sự phát triển nang trứng có thể cũng được xác định trong tương lai là nguyên nhân của suy buồng trứng nguyên phát ở người.
Tổn thương buồng trứng là một nguyên nhân phổ biến của suy buồng trứng nguyên phát. Viêm buồng trứng do quai bị là một nguyên nhân cổ điển nhưng hiếm gặp của suy buồng trứng. Điều trị estrogen liều rất cao ở tuổi vị thành niên làm tăng nguy cơ suy giảm khả năng sinh sản do tăng gonadotropin.
Chiếu xạ và hóa trị cho các khối u ở trẻ em là những nguyên nhân thường xuyên của suy buồng trứng nguyên phát hiện nay khi cuộc sống được kéo dài một cách hiệu quả. Các phương pháp điều trị như vậy có thể gây ra suy buồng trứng cấp tính hoặc giảm dự trữ nang trứng. Suy buồng trứng cấp tính dẫn đến thiếu sự phát triển dậy thì khi nó xảy ra trước tuổi dậy thì, hoặc ngừng phát triển dậy thì hoặc vô kinh thứ phát khi nó xảy ra ở các bé gái tuổi dậy thì hoặc sau dậy thì. Giảm dự trữ nang trứng dẫn đến suy buồng trứng sớm. Bức xạ ion hóa và các tác nhân alkyl hóa làm hỏng DNA cho dù tế bào có đang nhân lên hay không. Do đó, các nang trứng nguyên thủy không nhân lên không được tha khỏi các tác nhân này, mặc dù buồng trứng tiền dậy thì có thể ít nhạy cảm với tổn thương hơn buồng trứng tuổi dậy thì hoặc sau dậy thì. Tổn thương liên quan đến liều lượng và tổn thương nặng hơn khi kết hợp chiếu xạ và hóa trị so với các phương pháp điều trị chỉ với một trong các phương thức này. Một liều bức xạ từ 15 Gy trở lên gây suy buồng trứng cấp tính ở hơn 80% các bé gái tiền dậy thì, trong khi một liều hơn 10 Gy sẽ gây tổn thương tương đương ở các bé gái sau dậy thì. Tuy nhiên, các liều thấp tới 2 Gy cũng sẽ ảnh hưởng đến chức năng buồng trứng lâu dài bằng cách làm cạn kiệt pool nang trứng tới 50%. Một liều cyclophosphamide tích lũy trên 7.5 g/m2 sẽ gây suy buồng trứng cấp tính ở hơn 80% nữ giới dưới 20 tuổi. Green và cộng sự đã phát triển một phương pháp để định lượng một “liều tương đương cyclophosphamide (CED)” cho các tác nhân alkyl hóa khác. Sau khi điều trị ung thư trước tuổi dậy thì, 94% các bé gái có thể được dự đoán sẽ bước vào tuổi dậy thì và có kinh nguyệt đều đặn, nhưng 8% trong số này sẽ phát triển mãn kinh sớm không do phẫu thuật do số lượng noãn bào giảm. Nguy cơ mãn kinh sớm là 30% ở những người đã nhận cả xạ trị và hóa trị, 5% đến 13% ở những người chỉ nhận một trong hai. Một số người bị tăng gonadotropin sớm sẽ trải qua sự phục hồi buồng trứng với chức năng tuyến yên-buồng trứng bình thường sau vài năm, nhưng vô sinh xảy ra. Một số hóa trị liệu không phải alkyl hóa cũng gây độc cho tuyến sinh dục (bao gồm các tác nhân platin và anthracycline), trong khi các loại khác (chẳng hạn như methotrexate, fluorouracil, và vincristine) có nguy cơ gây độc cho tuyến sinh dục rất thấp hoặc không có. Tuy nhiên, dữ liệu còn khan hiếm, và sự tương tác giữa các loại tác nhân hóa trị liệu khác nhau còn ít được hiểu rõ. Điều trị bằng xạ trị cho bệnh ác tính cũng có thể dẫn đến vô sinh bằng cách gây ra suy sinh dục do giảm gonadotropin, hoặc thông qua tổn thương tử cung. Là hệ quả của sự tăng gonadotropin khi suy tuyến sinh dục bắt đầu, dậy thì có thể tiến triển nhanh chóng.
Triệt sản bằng chiếu xạ có thể được tránh bằng cách chuyển vị buồng trứng ra khỏi trường chiếu xạ nếu có thể. Bằng chứng cho thấy buồng trứng tiền dậy thì dường như ít nhạy cảm hơn với tổn thương do chiếu xạ và hóa trị đã gợi ý rằng liệu pháp chủ vận GnRH có thể bảo vệ chức năng buồng trứng ở các bé gái tuổi dậy thì/sau dậy thì được điều trị như vậy. Mặc dù có một số dữ liệu mâu thuẫn, không có lợi ích rõ ràng nào đối với việc điều trị như vậy. Imitinab (Gleevec®) là một phương pháp điều trị bảo vệ noãn bào tiềm năng, vì nó ngăn chặn một con đường apoptosis được kích hoạt bởi bức xạ và cisplatin trong các noãn bào chuột.
Kháng gonadotropin (hội chứng Savage) có thể phát sinh từ các đột biến mất chức năng lặn trên nhiễm sắc thể thường của thụ thể LH hoặc FSH. Các trường hợp được báo cáo đã có một mức độ phát triển dậy thì sau đó là vô kinh nguyên phát hoặc thứ phát hoặc kinh thưa. Buồng trứng của các đột biến thụ thể LH chứa các nang trứng ở mọi giai đoạn phát triển, trong khi của các đột biến thụ thể FSH thay đổi từ thiểu sản đến kích thước bình thường, với sự phát triển nang trứng có hốc thay đổi từ không có đến 5 mm. Kháng gonadotropin một phần là phổ biến trong dạng loạn dưỡng xương Albright của giả suy cận giáp, như một phần của khiếm khuyết chung trong truyền tín hiệu protein-G.
Viêm buồng trứng tự miễn là cơ sở của khoảng một nửa số trường hợp suy buồng trứng sớm tự phát, mặc dù các ước tính thay đổi từ 5% đến 85% trong các loạt nghiên cứu khác nhau. Nó được chẩn đoán bởi sự liên quan của nó với bất kỳ một loạt các rối loạn nội tiết hoặc không nội tiết tự miễn, biểu hiện hoặc cận lâm sàng, có chung các khiếm khuyết trong chức năng ức chế của tế bào T. Tự miễn dịch có thể được hướng đến tế bào hạt, noãn bào, hoặc tế bào vỏ. Bức tranh lâm sàng có thể giống như sự kháng tương đối chọn lọc với FSH hoặc, ít thường xuyên hơn, với LH. Điều sau là kết quả của sự phá hủy lympho bào của các tế bào vỏ, trong khi các tế bào hạt từ các nang trứng có hốc nhỏ được tha, thiếu cơ chất để hình thành estradiol và chỉ có thể đáp ứng với sự gia tăng bù trừ của FSH bằng cách sản xuất inhibin-B. Những bệnh nhân này có tự kháng thể chống lại các tế bào sinh steroid và có nguy cơ bị suy thượng thận. Thường thì những kháng thể này được hướng đến 21-hydroxylase, ít thường xuyên hơn đến enzyme phân cắt chuỗi bên hoặc 17-hydroxylase, hiếm khi đến 3β-HSD. Liệu pháp thay thế glucocorticoid có thể tạm thời cải thiện viêm buồng trứng miễn dịch trong những trường hợp như vậy. Một trường hợp có tự kháng thể chống lại testosterone đã được báo cáo. Các đột biến gen AIRE đã được xác định là nguyên nhân gây suy đa nội tiết loại 1. Các phát hiện siêu âm và mô học có thể thay đổi trong suy buồng trứng sớm và bao gồm buồng trứng lớn hoặc nhỏ, buồng trứng không hoạt động hoặc đa nang, mất hoặc bảo tồn các nang trứng nguyên thủy, và sự xâm nhập của các tế bào lympho hoặc tương bào.
Suy buồng trứng chức năng cũng có thể là kết quả của các khiếm khuyết lặn trên nhiễm sắc thể thường đặc hiệu trong quá trình sinh tổng hợp các steroid sinh dục. Cả thiếu hụt androgen và estrogen đều xảy ra trong CAH dạng mỡ (đột biến StAR và phân cắt chuỗi bên, xem Hình 16.22), thiếu hụt 17α-hydroxylase, thiếu hụt P450 oxidoreductase, và thiếu hụt 17,20-lyase. Do đó, nam giới di truyền bị ảnh hưởng có thể có kiểu hình nữ. Suy estrogen có liên quan đến nam hóa trong thiếu hụt aromatase và 3β-HSD. Aromatase là duy nhất trong số các khiếm khuyết sinh steroid của buồng trứng ở chỗ không liên quan đến CAH. Tăng sản thượng thận dạng mỡ bẩm sinh là duy nhất ở chỗ thiếu hụt StAR cơ bản có quá ít tác động trực tiếp lên chức năng buồng trứng để can thiệp vào các giai đoạn đầu của dậy thì, nhưng sự tích tụ dần dần của các lắng đọng lipid trong buồng trứng là kết quả của sự thiếu hụt enzyme—một “cú đánh thứ hai”—gây tổn thương buồng trứng với không rụng trứng và suy buồng trứng muộn. Thiếu hụt SF-1 (NR5A1) có thể gây suy buồng trứng nguyên phát mà không có suy thượng thận.
Kháng estrogen do đột biến bất hoạt của ERα đã được báo cáo. Suy estrogen và cường estrogen máu là sâu sắc, buồng trứng to và đa nang, và nồng độ gonadotropin và testosterone tăng nhẹ đến rõ ràng.
Thiếu hụt Gonadotropin (Suy sinh dục do giảm Gonadotropin)
Thiếu hụt gonadotropin bẩm sinh có thể xảy ra liên quan đến rối loạn chức năng não, vùng dưới đồi, hoặc tuyến yên như một khiếm khuyết đơn độc. Các khiếm khuyết bẩm sinh trong sự hình thành vùng dưới đồi-tuyến yên có thể liên quan đến các khiếm khuyết mặt đường giữa. Rối loạn chức năng vùng dưới đồi bẩm sinh có thể liên quan đến các rối loạn chức năng thần kinh hoặc nội tiết khác, chẳng hạn như trong hội chứng Prader-Willi (giảm trương lực bẩm sinh, và không phát triển ở trẻ sơ sinh sau đó là béo phì do vùng dưới đồi, đôi khi có suy tuyến yên) hoặc hội chứng Laurence-Moon-Biedl (viêm võng mạc sắc tố, béo phì, thiểu năng trí tuệ).
Suy sinh dục do giảm gonadotropin bẩm sinh thường là kết quả của các đột biến (Bảng 16.6). Các dạng lặn trên nhiễm sắc thể thường của thiếu hụt hormone tuyến yên kết hợp bẩm sinh do các đột biến PROP1, HESX1, LHX3, và OTX-2 có liên quan đến thiếu hụt gonadotropin. Các đột biến bất hoạt leptin và thụ thể leptin gây thiếu hụt gonadotropin kết hợp với béo phì từ trung bình đến cực đoan. Báo cáo về một trường hợp mang thai tự nhiên ở một phụ nữ có đột biến đồng hợp tử trong thụ thể leptin gây tranh cãi cho khái niệm hiện tại rằng chức năng leptin là cần thiết cho sinh sản.
Bảng 16.6 Các đột biến gen gây suy gonadotropin bẩm sinh
| Đột biến Gen | Rối loạn |
|---|---|
| CCDC141, CHD1, DUSP6, FGF8 và 17, FEZF1, FGFR1, FLRT3, IGFS10, IL17RD, KAL1, HS6ST1, KLB, PROK2, PROKR2, SEMA3A và 3E, SMCHD1, SPRY4, WDR11 | Sự di chuyển bị gián đoạn của các tế bào thần kinh hormone giải phóng gonadotropin (GnRH) (hội chứng Kallmann) |
| DAX1 (NROB1), HESX-1, LHX3, NR5A1, PROP-1, SOX2 | Sự phát triển bất thường của vùng dưới đồi và tuyến yên |
| LEP, LEPR, PC1 | Liên quan đến béo phì |
| GNRH1, KISS1, KISS1R, TAC3, TACR3 | Sự tạo xung GnRH bất thường |
| GNRHR, FSHB, LHB | Các gonadotrope bất thường |
| DMXL2 | Liên quan đến đái tháo đường týp 1, suy giáp trung ương, chậm phát triển, bệnh thần kinh ngoại biên |
| OTUD4, PHPLA6, RNF216, STUB1 | Hội chứng Gordon Holmes (thất điều tiểu não, loạn dưỡng võng mạc) |
| POLR3A và 3B | Hội chứng 4H (thiểu sản myelin, thiểu sản răng, suy sinh dục do giảm gonadotropin) |
| RAB18, 3GAP1 và 3GAP2 | Hội chứng Warburg Micro (đầu nhỏ, chậm phát triển, giác mạc nhỏ, teo thị thần kinh) |
Thiếu hụt gonadotropin có thể liên quan đến mất khứu giác (loạn sản khứu giác-sinh dục hoặc hội chứng Kallmann). Hội chứng này ở nữ giới ít thường xuyên hơn 1/10 so với nam giới. Các đột biến trong gen KAL-1 ở vùng giả nhiễm sắc thể thường của nhiễm sắc thể X, mã hóa anosmin, một protein quan trọng cho sự di chuyển của tế bào thần kinh GnRH, gây ra dạng liên kết X có độ thấm cao và hiếm khi ảnh hưởng đến nữ giới. Các đột biến bất hoạt của các gen khác trong con đường tín hiệu anosmin (FGF8/FGFR1, PROK2/R2, NELF, và CHD7) chiếm phần lớn các trường hợp nữ; những trường hợp này được di truyền như các tính trạng trội hoặc lặn trên nhiễm sắc thể thường (dị hợp tử, dị hợp tử phức hợp, hoặc hai gen) với độ thấm thay đổi. Các bất thường thần kinh và thể chất, chẳng hạn như vận động đồng bộ, thất điều tiểu não, điếc thần kinh giác quan, thiểu năng trí tuệ, bất sản thận một bên, và hở hàm ếch, là các đặc điểm di truyền liên quan thay đổi của hội chứng Kallmann. Các cá nhân bị ảnh hưởng hiếm gặp chỉ bị dậy thì muộn. Những đột biến tương tự này đôi khi chịu trách nhiệm cho thiếu hụt GnRH vô căn có khứu giác bình thường; các đột biến CHD7 thường có các đặc điểm của hội chứng CHARGE. Nghiên cứu đang ngày càng tiết lộ các yếu tố mới trong con đường phát triển và tín hiệu GnRH. Ví dụ, một đa hình đơn nucleotide trong gen EAP1 đã được liên kết với vô kinh/kinh thưa ở các loài linh trưởng.
Các đột biến thụ thể GnRH chiếm khoảng một nửa số trường hợp thiếu hụt gonadotropin đơn độc, có khứu giác bình thường được di truyền lặn trên nhiễm sắc thể thường. Mức độ suy sinh dục có thể thay đổi, ngay cả trong một gia đình, với dậy thì muộn và kinh nguyệt muộn là các biểu hiện.
Các đột biến mất chức năng của GnRH và trong các hệ thống tín hiệu điều chỉnh sự giải phóng GnRH (KISS/KISS1R, NKB/TAC3R) là những nguyên nhân hiếm gặp. Suy sinh dục của hầu hết các đối tượng có đột biến neurokinin B/TAC3R được đảo ngược bằng liệu pháp steroid sinh dục, cho thấy rằng hệ thống tín hiệu này quan trọng cho sự khởi đầu của dậy thì, nhưng không phải cho việc duy trì nó. Suy sinh dục do giảm gonadotropin đơn độc cũng đã được báo cáo ở một phụ nữ đồng hợp tử đối với một đột biến vô nghĩa của gen thụ thể hạt nhân mồ côi DAX1 liên kết X, có liên quan đến thiểu sản thượng thận bẩm sinh liên kết X ở các anh em của cô.
Thiếu hụt FSH đơn độc do đột biến ở tiểu đơn vị β đã được báo cáo là gây vô kinh nguyên phát liên quan đến một bảng xét nghiệm độc đáo—FSH thấp, LH tăng, và nồng độ testosterone thấp. Hội chứng glycoprotein thiếu carbohydrate (thiếu hụt phosphomannomutase) được đặc trưng bởi nồng độ cao của các gonadotropin có hoạt tính miễn dịch, nhưng không có hoạt tính sinh học, bắt chước suy buồng trứng sớm. Thiếu hụt LH đơn độc do các đột biến điểm bất hoạt gen LHβ đã được báo cáo là dẫn đến vô kinh thứ phát sau khi phát triển dậy thì bình thường, nhưng LH không thể phát hiện được, FSH cao, estradiol thấp, và buồng trứng có nang lớn. Tuy nhiên, một số đột biến LH bất hoạt ở nam giới có nồng độ LH có hoạt tính miễn dịch cao hoặc thấp. Các đột biến trong các gen chịu trách nhiệm cho sự phát triển của thùy trước tuyến yên có thể gây thiếu hụt gonadotropin dẫn đến dậy thì muộn hoặc CHH. LIM Homeobox 3 (LHX3), SRY-Box 2 (SOX2), và HESX homeobox 1 (HESX1) chịu trách nhiệm cho việc tạo khuôn mẫu não trước sớm và sự phát triển của tế bào tuyến yên. Yếu tố homeodomain giống cặp 1 (PROP1) quan trọng cho sự phát triển của các somatotroph, lactotroph, thyrotroph, và gonadotroph và bệnh nhân có đột biến PROP1 có các kiểu hình thay đổi từ CDGP đến CHH. Thiếu hụt gonadotropin cũng có thể liên quan đến các tình trạng khác, đặc biệt là với các kiểu hình thần kinh. Các đột biến ở tiểu đơn vị RNA polymerase III A và B (POLR3A/B) dẫn đến hội chứng 4H (thiểu sản myelin, thiểu sản răng, và suy sinh dục do giảm gonadotropin). Protein ngón tay vòng 216 (RNF216), OTU deubiquitinase 4 (OTUD4) và miền phospholipase giống Patatin chứa 6 (PNPLA6) CHH, và thất điều (còn được gọi là hội chứng Gordon-Holmes). Các đột biến DMX like 2 (DMXL2) có liên quan đến CHH, các thiếu hụt nội tiết khác, và các bệnh đa dây thần kinh. Các đột biến ở tiểu đơn vị xúc tác protein hoạt hóa RAB3 GTPase 1 (RAB3GAP1) dẫn đến sự rối loạn điều hòa chu trình RAB3, dẫn đến hội chứng Warburg Micro với các khiếm khuyết về mắt, phát triển thần kinh, và sinh sản trung ương.
Thiếu hụt gonadotropin mắc phải có thể là hệ quả của các khối u, chấn thương, viêm tuyến yên tự miễn, các rối loạn thoái hóa liên quan đến vùng dưới đồi và tuyến yên, chiếu xạ, hóa trị, hoặc bệnh mãn tính. Suy sinh dục do giảm gonadotropin sẽ phát triển ở khoảng một phần ba những người nhận chiếu xạ sọ não từ 20 đến 30 Gy, trong khi nó là điển hình ở những người nhận > 50 Gy. U tuyến yên, u sọ hầu, và u loạn sản mầm là những khối u thần kinh-nội tiết phổ biến nhất chịu trách nhiệm cho suy tuyến yên ở trẻ em. Hầu hết các u tuyến yên “không hoạt động” là các u tuyến gonadotrope, tiết ra các tiểu đơn vị gonadotropin để đáp ứng với TRH. Một trường hợp khối u vùng dưới đồi được trình bày với Hình 16.41. U tuyến tùng thường gây ra ấu trĩ sinh dục. Chúng có thể hoạt động bằng cách tiết ra một chất ức chế, thay vì bằng cách chèn ép các khu vực quan trọng của vùng dưới đồi.
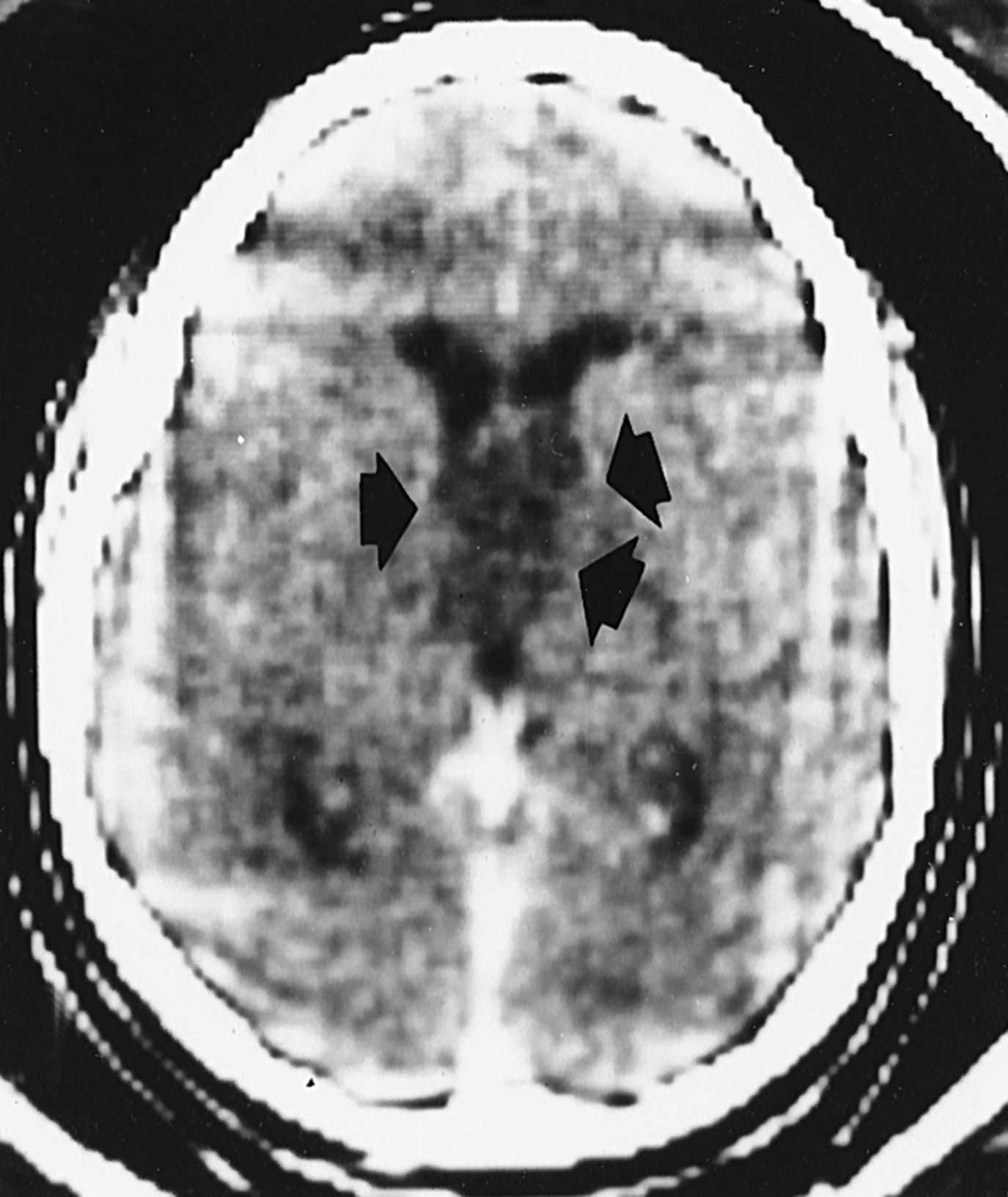
Hình 16.41 Chụp cắt lớp vi tính não của một bé gái 16 tuổi bị u sao bào vùng dưới đồi. Khối u mật độ thấp (mũi tên) kéo dài lên trên từ vùng dưới đồi, xóa bỏ não thất ba, và chèn ép một phần các sừng trán của các não thất bên (đặc biệt là bên phải). Bệnh nhân này có biểu hiện vô kinh thứ phát. Kinh nguyệt đã xảy ra ở 13 tuổi, và kinh nguyệt bình thường cho đến 15.3 tuổi. Bệnh nhân sau đó bị vô kinh liên quan đến tình trạng lơ mơ, đau đầu từng đợt, đa niệu, và tăng cân—mặc dù ít thay đổi về cảm giác thèm ăn. Khám thực thể âm tính. X-quang sọ, điện não đồ, thị trường, và nồng độ prolactin và thyroxine huyết thanh bình thường—và trọng lượng riêng nước tiểu là 1.016. Sau khi sinh thiết thành nang, các nghiên cứu cho thấy bé bị thiếu hụt gonadotropin, hormone tăng trưởng, và hormone chống bài niệu một phần.
Chán ăn tâm thần là dạng nguyên mẫu của các rối loạn ăn uống, và là một nguyên nhân phổ biến của suy gonadotropin ở thanh thiếu niên. Đó là một hội chứng suy dinh dưỡng do đói tự nguyện với một rối loạn chức năng tâm lý đặc biệt dẫn đến vô kinh. Những bệnh nhân này đồng nhất coi mình quá béo trước những bằng chứng khách quan rằng họ thiếu cân. Các tiêu chí tâm thần phân biệt rối loạn này với chứng ăn kiêng lập dị và sợ béo phì bao gồm: (1) hạn chế năng lượng ăn vào so với yêu cầu, dẫn đến cân nặng thấp đáng kể; (2) sợ hãi mãnh liệt về việc tăng cân hoặc trở nên béo, hoặc hành vi dai dẳng cản trở việc tăng cân, ngay cả khi đang ở mức cân nặng thấp đáng kể; và (3) sự xáo trộn trong cách trải nghiệm cân nặng hoặc hình dáng cơ thể của một người, ảnh hưởng quá mức của cân nặng hoặc hình dáng cơ thể lên sự tự đánh giá, hoặc sự thiếu nhận thức dai dẳng về mức độ nghiêm trọng của tình trạng cân nặng thấp hiện tại. BMI phân vị thứ 10 nên là mục tiêu duy trì ban đầu.
Chứng ăn vô độ tâm thần, rối loạn ăn uống biến thể ăn uống vô độ/thanh lọc, tương tự ở việc đánh giá quá cao hình dáng và cân nặng cơ thể và việc sử dụng các hành vi kiểm soát cân nặng cực đoan. Hoạt động thể chất có xu hướng cao. Những rối loạn này có thể biểu hiện ở giai đoạn đầu dưới dạng các rối loạn ăn uống không điển hình, trước khi đáp ứng các tiêu chí về cân nặng hoặc vô kinh hoặc khi cơn ăn uống vô độ là chủ quan. Khiếm khuyết nhận thức rằng cân nặng có thể đóng vai trò là giá trị chủ yếu trong việc đánh giá giá trị bản thân là trung tâm của chứng chán ăn tâm thần. Trái ngược với các cá nhân trầm cảm khác, những bệnh nhân này thường hài lòng với bản thân trong các lĩnh vực thành tích trí tuệ và nghề nghiệp.
Nguyên nhân là đa yếu tố. Nó liên quan đến một khuynh hướng di truyền. Tỷ lệ tương hợp đối với loại chán ăn là khoảng 50% đối với các cặp song sinh cùng trứng, so với khoảng 5% đối với các cặp song sinh khác trứng. Nhiều yếu tố nguy cơ khác đã được liên quan. Các yếu tố gia đình cũng bao gồm các rối loạn ăn uống thuộc bất kỳ loại nào, trầm cảm, lạm dụng chất gây nghiện, và các tương tác gia đình bất lợi. Các trải nghiệm tiền bệnh, chẳng hạn như lạm dụng tình dục hoặc áp lực xã hội, hoặc các đặc điểm tiền bệnh, chẳng hạn như lòng tự trọng thấp, tính cưỡng chế, và chủ nghĩa hoàn hảo, cũng rất quan trọng. Ăn kiêng đáp ứng một nhu cầu được chấp thuận trong nền văn hóa của chúng ta với sự nhấn mạnh vào việc hạn chế ăn uống và sự gầy gò là mục tiêu cho phụ nữ. Chán ăn thường được thúc đẩy ở những đứa trẻ dễ bị tổn thương bởi một trải nghiệm mới, chẳng hạn như dậy thì, rời nhà hoặc bắt đầu học đại học, hoặc bởi các sự kiện cuộc sống bất lợi. Rối loạn này được duy trì bởi các biến chứng của việc đói, chẳng hạn như trầm cảm và giảm tốc độ làm rỗng dạ dày.
Sự khởi phát có xu hướng ở 12 tuổi hoặc muộn hơn. Sự khởi phát sớm hơn có liên quan đến ngừng tăng trưởng, chậm dậy thì, và vô kinh nguyên phát. Rối loạn chức năng của trục dưới đồi-tuyến yên trong chứng chán ăn tâm thần không chỉ bao gồm suy sinh dục do giảm gonadotropin, mà còn thiếu hụt GH và tăng cortisol máu; kháng GH và bệnh không do tuyến giáp cũng xảy ra như là hậu quả của suy dinh dưỡng.
Các biến chứng y tế của chứng chán ăn tâm thần rất nghiêm trọng. Nguy cơ tử vong tăng khoảng 10 lần: mất cân bằng điện giải, hạ đường huyết, bất ổn tim mạch, giảm tế bào tủy xương có khuynh hướng gây nhiễm trùng thầm lặng, và suy thận chiếm khoảng một nửa số ca tử vong, phần còn lại là tự tử.
Những thay đổi về cân nặng dẫn đến việc ngừng hoặc phục hồi các chu kỳ kinh nguyệt nằm trong khoảng 10% đến 15% trọng lượng cơ thể. Sự phục hồi có liên quan đến việc đạt được một mức dự trữ mỡ cơ thể tới hạn trên phân vị thứ 10 (trên khoảng 20% mỡ cơ thể) (xem Hình 16.42), ở một BMI khoảng 20, tức là, trung bình bình thường. Có một mối quan hệ nghịch đảo giữa trọng lượng cơ thể và sự trưởng thành của việc giải phóng gonadotropin ở những bệnh nhân này. Mô hình 24 giờ của việc giải phóng gonadotropin có xu hướng chưa trưởng thành (tiền dậy thì hoặc dậy thì), và mô hình LH ngày đêm trở nên trưởng thành khi phục hồi sau suy dinh dưỡng. Xung LH thấp và có thể được phục hồi bởi các chất đối kháng opiate. Đáp ứng gonadotropin với GnRH và đáp ứng rụng trứng với clomiphene citrate bị cùn đi ở trạng thái suy dinh dưỡng và trở lại bình thường khi tăng cân đến khoảng 80% trọng lượng lý tưởng. Nồng độ leptin giảm đáng kể và là một yếu tố góp phần chính vào cả thiếu hụt gonadotropin và những thay đổi trong các trục tuyến giáp và GH.
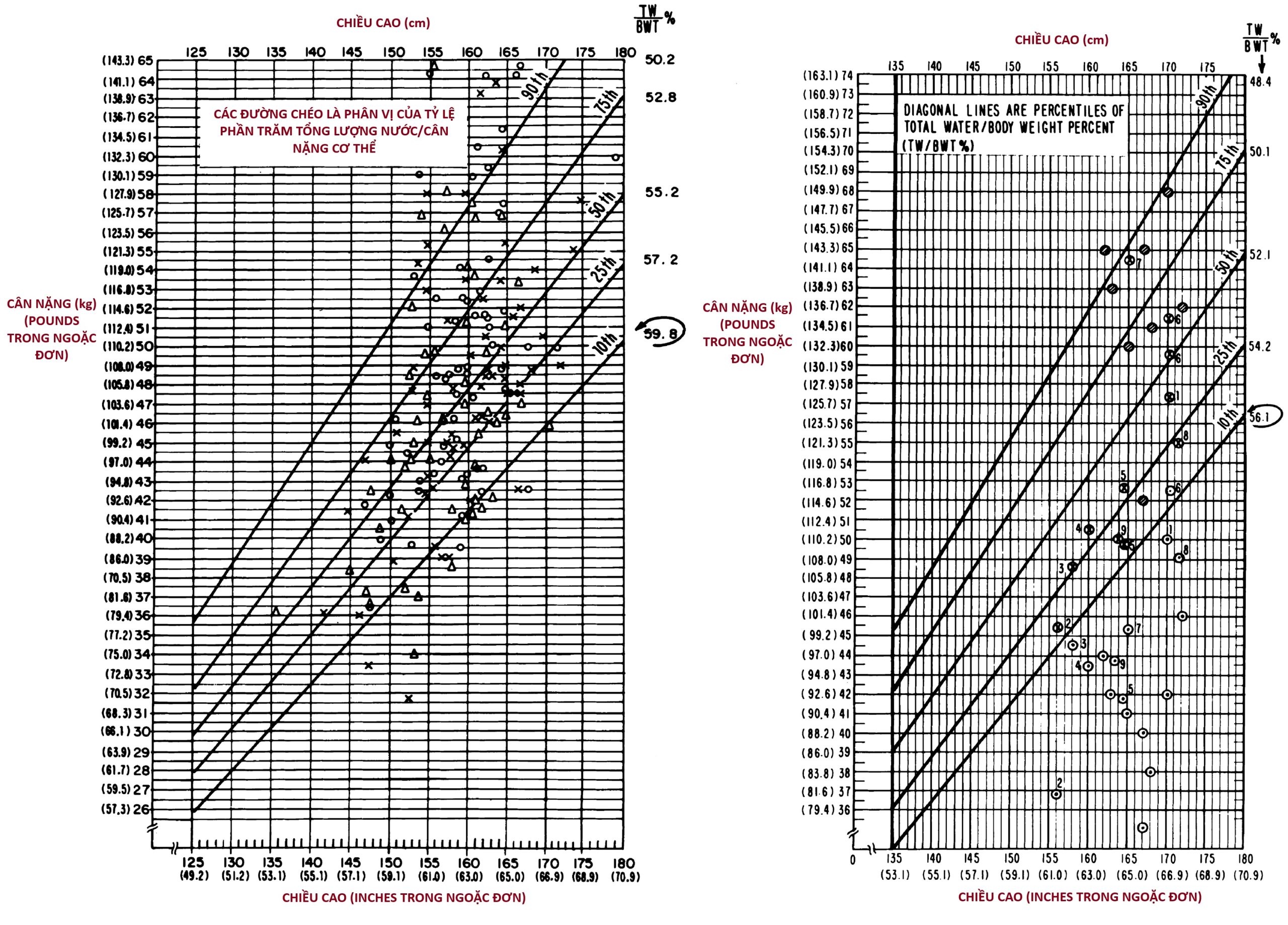
Hình 16.42 Phân vị của độ béo (đường chéo) cho các bé gái da trắng khi có kinh (trái) và sau khi có kinh (phải) được quy đổi với các phân vị được tính toán của tổng lượng nước dưới dạng phần trăm của tổng trọng lượng cơ thể. Cân nặng tối thiểu cần thiết ở một chiều cao cụ thể để bắt đầu hoặc duy trì kinh nguyệt rất gần với phân vị thứ 10 của độ béo trên các biểu đồ tương ứng này. Dữ liệu cho các trường hợp chán ăn tâm thần được hiển thị trên biểu đồ bên phải: • khi có biểu hiện; x khi có kinh trở lại. (Từ Frisch, R.E., McArthur, J.W. (1974). Menstrual cycles: Fatness as a determinant of minimum weight for height necessary for their maintenance or onset. Science, 185, 949. Bản quyền © bởi Hiệp hội vì sự tiến bộ của Khoa học Hoa Kỳ.)
Tăng cortisol máu nhẹ thường xuyên và có thể góp phần vào sự không rụng trứng bằng các cơ chế được thảo luận thêm dưới phần Không rụng trứng do Vùng dưới đồi. Nồng độ ACTH và cortisol buổi chiều cao hơn đáng kể và đáp ứng với CRH thấp hơn đáng kể so với bình thường. Trái ngược với hội chứng Cushing, nồng độ DHEAS có xu hướng bị cùn đi là hệ quả của suy dinh dưỡng.
Một khiếm khuyết thần kinh-tâm lý cơ bản hoặc một rối loạn vùng dưới đồi đã bị nghi ngờ vì một số bệnh nhân bị vô kinh trước khi giảm cân, và khoảng một nửa số trường hợp vẫn bị vô kinh sau khi điều trị. Các hệ thống serotonergic liên quan đến việc điều chỉnh ăn uống và tâm trạng dường như vẫn bị thay đổi ngay cả sau khi phục hồi cân nặng. Có bằng chứng tồn tại về sự khác biệt cá nhân rõ rệt trong khả năng phản ứng của hệ thống thần kinh-nội tiết đối với căng thẳng. Các tác giả ủng hộ khái niệm rằng các vấn đề tâm lý dẫn đến vô kinh chỉ ở những phụ nữ có khuynh hướng do một rối loạn chức năng vùng dưới đồi có từ trước.
Một số đặc điểm được cho là do rối loạn chức năng vùng dưới đồi, chẳng hạn như không chịu được lạnh, có thể là do tình trạng suy giáp tinh tế thứ phát sau suy dinh dưỡng. Nồng độ triiodothyronine huyết thanh luôn thấp, nồng độ thyroxine huyết thanh có xu hướng thấp hơn trung bình (mặc dù thường trong giới hạn bình thường), mô hình giải phóng TSH cho thấy thiếu hụt TRH, và tình trạng phản xạ gân sâu và chuyển hóa phù hợp với suy giáp. Suy giáp có thể một phần làm phức tạp thêm tình trạng kháng GH của suy dinh dưỡng xảy ra như là hệ quả của sự can thiệp vào việc tạo IGF-1: IGF-1 thấp khởi đầu sự dư thừa GH, giải phóng somatostatin bù trừ, và sau đó là ức chế đáp ứng của thyrotropin với TRH. Suy dinh dưỡng cũng làm chuyển hướng việc tạo ra các chất chuyển hóa của thyroxine khỏi triiodothyronine sang reverse triiodothyronine.
Tăng prolactin máu là một nguyên nhân có thể hồi phục của thiếu hụt gonadotropin. Tiết sữa có mặt ở khoảng một nửa số bệnh nhân, đặc biệt là những người có sản xuất estrogen còn lại. Các nguyên nhân gây tăng prolactin máu rất đa dạng, bao gồm các rối loạn vùng dưới đồi hoặc tuyến yên, thuốc, suy giáp, suy thận hoặc gan, bệnh thần kinh ngoại biên, căng thẳng, tự miễn, macroprolactinemia, di truyền, và vô căn. Nồng độ prolactin huyết thanh tăng cao xảy ra với một loạt các khối u gây cắt cuống tuyến yên chức năng hoặc giải phẫu, do đó ngăn chặn sự kiểm soát ức chế của tuyến yên bằng dopaminergic. Khoảng một phần ba phụ nữ tăng prolactin máu có một u tuyến yên có thể xác định được. Các u tuyến prolactin có đường kính dưới 1 cm (microadenoma) không gây ra vấn đề gì do sự lan rộng tại chỗ. U tuyến prolactin có thể liên quan đến tân sinh đa nội tiết loại 1. Ở khoảng một phần tư các trường hợp tăng prolactin máu ở người lớn, sự cố là do việc sử dụng các loại thuốc, chẳng hạn như phenothiazine, estrogen, hoặc cocaine. Tăng prolactin máu đáng kể là vô căn: sự giảm nhạy cảm với sự ức chế của dopaminergic có thể là nền tảng cho những trường hợp như vậy.
Macroprolactinemia là do một phân tử biến thể hoặc sự hình thành tự kháng thể bao gồm prolactin và các protein huyết tương, thường do các kháng thể tự động prolactin-immunoglobin (Ig)G gây ra. Trong tình huống này, xét nghiệm miễn dịch trực tiếp cho thấy nồng độ prolactin tăng cao. Tuy nhiên, nồng độ prolactin có sẵn hoặc có hoạt tính sinh học là bình thường; do đó không có hậu quả sinh lý nào đối với macroprolactinemia.
Tăng prolactin máu dẫn đến các xung LH có xu hướng không thường xuyên và bài tiết LH thay đổi để đáp ứng với GnRH. Dư thừa prolactin chọn lọc gây ra các mức độ thiếu hụt gonadotropin khác nhau, từ nặng đến một phần (vô kinh do vùng dưới đồi). Cường androgen thượng thận, rậm lông, và tăng tiết bã nhờn là phổ biến.
Nam hóa rõ ràng do nồng độ androgen rất cao ức chế nồng độ gonadotropin và do đó gây ra sự mất nữ hóa. Tuy nhiên, các rối loạn cường androgen vừa phải được thảo luận sau này, phổ biến hơn, có liên quan đến sự estrogen hóa bình thường.
Chẩn đoán phân biệt
Chẩn đoán phân biệt của suy sinh dục được bao gồm trong Hộp 16.5. Việc điều tra nên bắt đầu đối với suy sinh dục khi dậy thì bị trì hoãn hoặc không tiến triển bình thường. Dậy thì muộn được chỉ định bởi việc không có Phát triển vú trước 13 tuổi theo tuổi đời hoặc tuổi xương. Sự tiến triển bất thường của dậy thì được gợi ý bởi việc không có kinh nguyệt trong vòng 3.0 năm kể từ khi bắt đầu có Phát triển vú hoặc nếu vô kinh thứ phát hoặc kinh thưa đã tồn tại trong 1 năm. Như đã thảo luận trước đó, tần suất kinh nguyệt bình thường thay đổi theo thời gian sau khi có kinh, nhưng một khoảng thời gian dai dẳng lớn hơn bình thường (Hộp 16.2) nên thúc đẩy một cuộc đánh giá. Tiền sử gia đình bị dậy thì muộn tương thích với việc sự chậm trễ là có tính chất cơ địa hơn là có cơ sở thực thể. Bệnh sử nên bao gồm một bệnh sử y tế và tổng quan các hệ thống kỹ lưỡng, bao gồm các triệu chứng nội sọ, thị giác, khứu giác, cảm xúc, bụng, hoặc tiểu khung và các triệu chứng toàn thân có thể chỉ ra các rối loạn nội tiết, chuyển hóa, hoặc hệ thống mãn tính làm chậm dậy thì. Khi khám bệnh nhân, chiều cao và cân nặng nên được đo cẩn thận và tốc độ tăng trưởng và sự phù hợp của cân nặng so với chiều cao được xác định (xem Hình 16.42). Việc phân loại cẩn thận giai đoạn phát triển của vú và lông sinh dục là cần thiết. Việc kiểm tra bộ phận sinh dục ngoài được chỉ định, nhưng một cuộc khám tiểu khung bên trong hiếm khi cần thiết cho chẩn đoán. Khám vú trưởng thành nên bao gồm một nỗ lực để vắt sữa từ các ống dẫn ra núm vú. Việc tìm thấy một bất thường cấu trúc sinh dục có thể chỉ ra rằng vô kinh là do sự phát triển đường sinh dục bất thường, trong khi phì đại âm vật là một manh mối cho một rối loạn gây nam hóa. Khám thần kinh nên bao gồm đánh giá các cử động mắt, thị trường, và đáy mắt, cũng như tìm kiếm mất khứu giác và các khiếm khuyết đường giữa.
Nếu một rối loạn hoặc hội chứng liên quan đến suy sinh dục được nhận biết trong giai đoạn sơ sinh, có thể tận dụng giai đoạn dậy thì mini của trẻ sơ sinh để cố gắng chẩn đoán trong vài tháng đầu đời. Ví dụ, suy sinh dục do tăng gonadotropin của hội chứng Turner và suy sinh dục do giảm gonadotropin của suy tuyến yên có thể được ghi nhận trong giai đoạn quan trọng này trước khi sự kiềm chế sinh lý của dậy thì trong giai đoạn sơ sinh muộn và thời thơ ấu làm cho việc này trở nên khó khăn trước tuổi dậy thì bình thường.
Một phương pháp tiếp cận theo thuật toán để làm việc với bệnh nhân bị rối loạn kinh nguyệt được thể hiện trong Hình 16.43 đến 16.45. Quy trình xét nghiệm phụ thuộc vào mức độ estrogen hóa, như được đánh giá ban đầu từ giai đoạn phát triển của vú: nó bao gồm một phim X-quang tuổi xương ở thanh thiếu niên chưa trưởng thành về mặt sinh dục và thường bắt đầu với một bảng xét nghiệm bệnh mãn tính, và xác định gonadotropin, estradiol, và nồng độ testosterone. Một xét nghiệm mang thai được chỉ định ở một thanh thiếu niên trưởng thành về mặt sinh dục. Các cân nhắc chẩn đoán khác nhau ở cô gái không rụng trứng không có sự tăng FSH, tùy thuộc vào việc cô ấy bị suy estrogen hay được estrogen hóa (xem Hộp 16.5 và xem Hình 16.43 và 16.44).
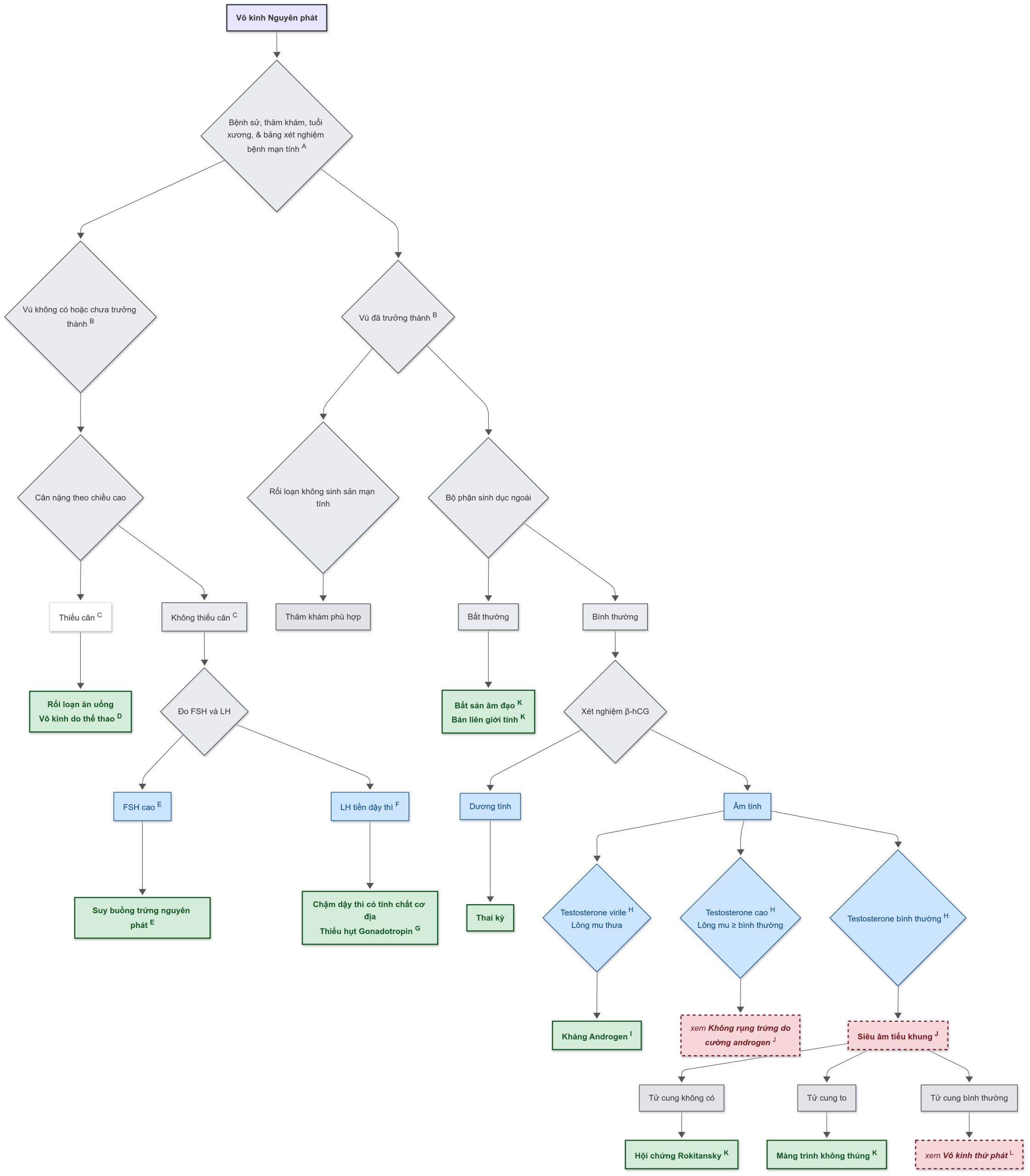
Hình 16.43. Chẩn đoán phân biệt vô kinh nguyên phát. (Chỉnh sửa từ Rosenfield, R.L. (2003). Menstrual disorders and hyperandrogenism in adolescence. In: Radovick, S., MacGillivray, M.H. eds. Pediatric Endocrinology a Practical Clinical Guide. Totowa, N. J., Humana Press, Inc., p. 451–478. Với sự cho phép.)
Chú thích: A. Nguyên nhân hàng đầu của vô kinh nguyên phát là các rối loạn làm chậm hoặc làm suy giảm tăng trưởng. Trong trường hợp không có các triệu chứng hoặc dấu hiệu cụ thể để định hướng quy trình làm việc, đánh giá xét nghiệm cho bệnh mãn tính thường bao gồm phim X-quang tuổi xương nếu thanh thiếu niên chưa trưởng thành về mặt sinh dục và một bảng xét nghiệm bệnh mãn tính (công thức máu toàn phần và vi sai, tốc độ lắng máu, bảng chuyển hóa toàn diện, bảng xét nghiệm celiac, bảng xét nghiệm tuyến giáp, nồng độ cortisol và yếu tố tăng trưởng giống insulin-I, và phân tích nước tiểu).
B. Sự phát triển vú thường biểu thị sự khởi đầu của sự nữ hóa dậy thì. Tuy nhiên, sự phát triển vú trưởng thành không đảm bảo sự bài tiết estrogen dậy thì đang diễn ra.
C. Chỉ số khối cơ thể (BMI) dưới phân vị thứ 10 thường tương ứng với thành phần cơ thể < 20% mỡ cơ thể, là yếu tố quan trọng.
D. BMI có thể không phản ánh chính xác lượng mỡ cơ thể ở các vận động viên nghiêm túc (những người có khối lượng cơ lớn không cân đối) hoặc chứng ăn vô độ tâm thần.
E. Hormone kích thích nang trứng (FSH) được ưu tiên tăng cao hơn hormone tạo hoàng thể (LH) trong suy buồng trứng nguyên phát. Nguyên nhân phổ biến nhất của vô kinh nguyên phát do suy buồng trứng nguyên phát là loạn sản tuyến sinh dục do hội chứng Turner, nhưng các nguyên nhân mắc phải phải được xem xét (chẳng hạn như liệu pháp gây độc tế bào). Quy trình làm việc của suy buồng trứng nguyên phát được xem xét chi tiết trong thuật toán tiếp theo (vô kinh thứ phát và kinh thưa). Việc không có sự tăng FSH gần như loại trừ suy buồng trứng nguyên phát chỉ khi tuổi xương phù hợp với dậy thì (≥ 11 tuổi).
F. Các xét nghiệm gonadotropin “nhi khoa” nhạy cảm với 0.15 U/L hoặc thấp hơn là rất quan trọng để chẩn đoán chính xác thiếu hụt gonadotropin và dậy thì muộn. Một nồng độ LH thấp đặc trưng hơn cho các rối loạn này so với một nồng độ FSH thấp. Thiếu hụt gonadotropin bẩm sinh rất giống với biến thể cực đoan phổ biến hơn của bình thường, chậm dậy thì có tính chất cơ địa.
G. Bệnh sử và khám có thể mang lại các manh mối về nguyên nhân của suy sinh dục do giảm gonadotropin, chẳng hạn như bằng chứng về suy tuyến yên (khiếm khuyết mặt đường giữa, tầm vóc cực thấp, khiếm khuyết thị trường) hoặc mất khứu giác (hội chứng Kallmann) hoặc rối loạn chức năng vùng dưới đồi (chứng ăn vô độ, tập thể dục quá mức). Nồng độ LH ngẫu nhiên ở bệnh nhân giảm gonadotropin thường dưới 0.15 IU/L, nhưng thường chồng chéo với nồng độ của trẻ em tiền và giữa dậy thì bình thường. Xét nghiệm hormone giải phóng gonadotropin (GnRH), đo đáp ứng gonadotropin với một liều bolus 50 đến 100-mcg, ở thanh thiếu niên tiền kinh nguyệt gợi ý mạnh mẽ thiếu hụt gonadotropin nếu đỉnh LH dưới 4.2 IU/L bằng xét nghiệm đơn dòng. Inhibin-B dưới 20 pg/mL hoặc các đáp ứng với xét nghiệm chất chủ vận GnRH (ví dụ, tiêm leuprolide acetate 10 mcg/kg SC) được báo cáo là phân biệt tốt giữa thiếu hụt gonadotropin và chậm phát triển có tính chất cơ địa (xem văn bản). Có thể không thể xác định chẩn đoán thiếu hụt gonadotropin một cách dứt khoát cho đến khi dậy thì không bắt đầu trước 16 tuổi hoặc tiến triển theo một nhịp độ bình thường.
H. Testosterone toàn phần trong huyết tương thường là 20 đến 60 ng/dL (0.7–2.1 nM) ở phụ nữ, 300 đến 1200 ng/dL ở nam giới, nhưng có phần thay đổi giữa các phòng thí nghiệm. Testosterone tự do (hoặc có sẵn sinh học) trong huyết tương nhạy hơn khoảng 50% so với testosterone toàn phần trong việc phát hiện cường androgen máu. Tuy nhiên, có nhiều cạm bẫy trong các xét nghiệm testosterone ở mức độ thấp của phụ nữ, các xét nghiệm testosterone đáng tin cậy không có sẵn cho nhiều bác sĩ, và việc xét nghiệm testosterone tự do đưa ra các nguồn sai sót tiềm ẩn khác. Do đó, hợp lý khi bắt đầu đánh giá bằng một xét nghiệm testosterone toàn phần nếu một xét nghiệm testosterone tự do trong một phòng thí nghiệm chuyên khoa đáng tin cậy không có sẵn cho bác sĩ.
I. Kháng androgen được đặc trưng bởi một nồng độ testosterone huyết tương hoàn toàn của nam giới khi sự trưởng thành sinh dục hoàn tất, karyotype nam (46,XY), và không có tử cung. Bộ phận sinh dục ngoài có thể không rõ ràng (dạng một phần) hoặc nữ bình thường (dạng hoàn toàn).
J. Chẩn đoán phân biệt của cường androgen được thể hiện trong một thuật toán sau này.
K. Bất sản âm đạo ở một bé gái có buồng trứng bình thường có thể liên quan đến bất sản tử cung (hội chứng Rokitansky-Kustner-Hauser). Khi âm đạo bị bịt kín và tử cung bất sản, rối loạn này phải được phân biệt với kháng androgen. Nếu bộ phận sinh dục ngoài không rõ ràng, nó phải được phân biệt với các rối loạn phát triển giới tính khác (lưỡng giới).
L. Chẩn đoán phân biệt vô kinh thứ phát được trình bày trong Hình 16.43. hCG, Human chorionic gonadotropin.
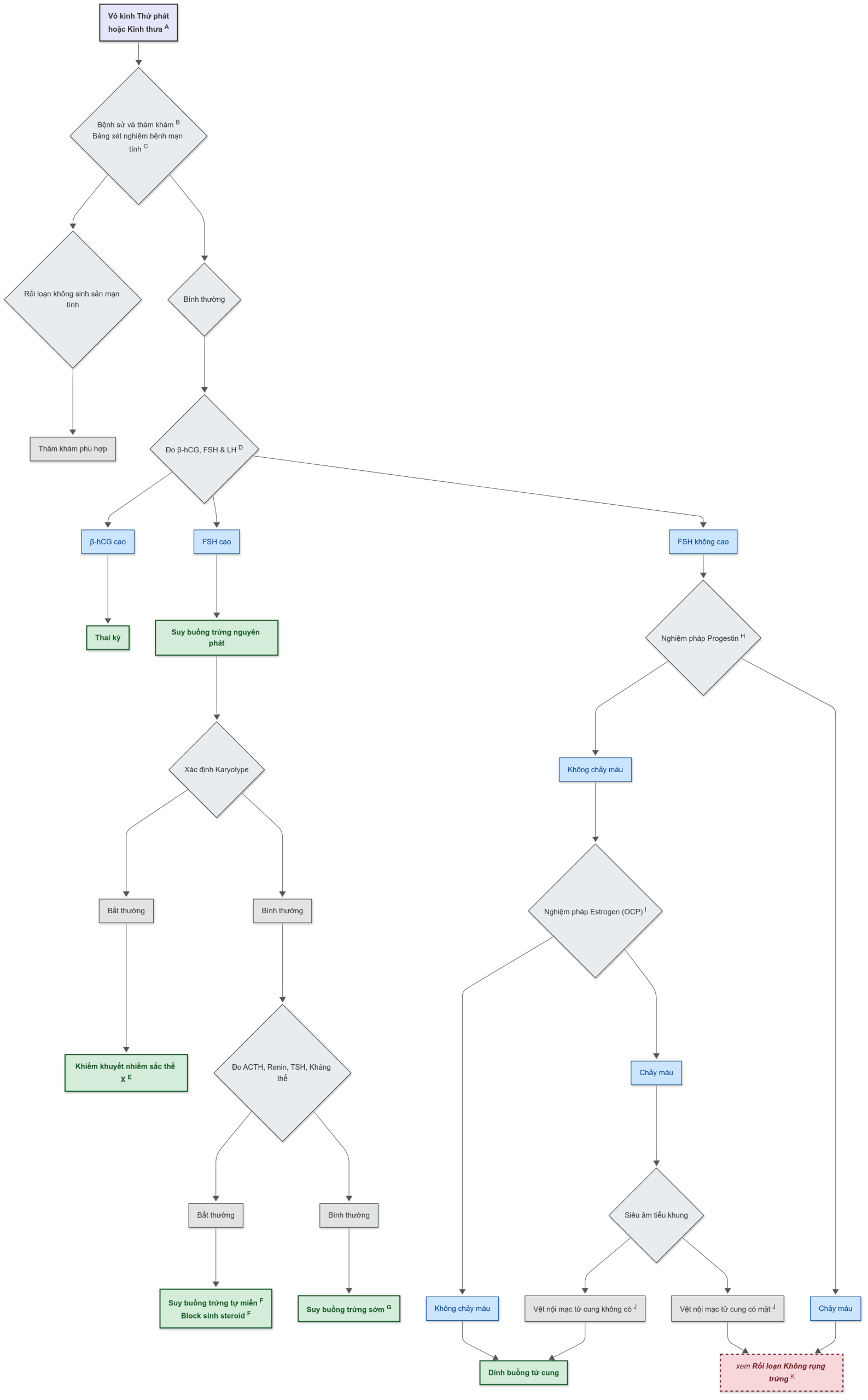
Hình 16.44 Chẩn đoán phân biệt vô kinh thứ phát hoặc kinh thưa. (Chỉnh sửa từ Rosenfield, R.L. (2003). Menstrual disorders and hyperandrogenism in adolescence. In: Radovick, S., MacGillivray, M.H. eds. Pediatric Endocrinology a Practical Clinical Guide. Totowa, N. J., Humana Press, Inc., p. 451–478. Với sự cho phép.)
Chú thích:
A. Các đặc điểm sinh dục thứ phát trưởng thành là đặc trưng vì sự xuất hiện của kinh nguyệt cho thấy một mức độ phát triển đáng kể của hệ thống sinh sản đã diễn ra; tuy nhiên, sự hiện diện của chúng không loại trừ sự thoái triển sau đó của chức năng tuyến sinh dục.
B. Các rối loạn đa dạng của nhiều hệ thống gây ra không rụng trứng. Bệnh sử có thể tiết lộ việc tập thể dục quá mức, các triệu chứng trầm cảm, các triệu chứng tiêu hóa, xạ trị vào não hoặc tiểu khung, hoặc nam hóa nhanh chóng. Các phát hiện thực thể có thể bao gồm tăng huyết áp (các dạng tăng sản thượng thận bẩm sinh, suy thận mãn tính), tầm vóc thấp (suy tuyến yên, hội chứng Turner, giả suy cận giáp), cân nặng bất thường so với chiều cao (chán ăn tâm thần, béo phì), giảm khứu giác (hội chứng Kallmann), bất thường đĩa thị hoặc thị trường (u tuyến yên), các bất thường về da (u xơ thần kinh, lupus), bướu cổ, tiết sữa, rậm lông, hoặc khối u bụng.
C. Trong trường hợp không có các triệu chứng hoặc dấu hiệu cụ thể để định hướng quy trình làm việc, đánh giá cho bệnh mãn tính ở một thanh thiếu niên trưởng thành về mặt sinh dục thường bao gồm công thức máu toàn phần và vi sai, tốc độ lắng máu, bảng chuyển hóa toàn diện, bảng xét nghiệm celiac, bảng xét nghiệm tuyến giáp, nồng độ cortisol và yếu tố tăng trưởng giống insulin-I, và phân tích nước tiểu.
D. Các xét nghiệm gonadotropin “nhi khoa” nhạy cảm với 0.15 U/L hoặc thấp hơn là rất quan trọng để chẩn đoán sớm nhiều rối loạn không rụng trứng. Hormone tạo hoàng thể (LH) đi vào chẩn đoán phân biệt của các rối loạn không rụng trứng do giảm gonadotropin, được phác thảo trong Hình 16.45.
E. Bệnh nhân chỉ thiếu một phần nhỏ của một nhiễm sắc thể X có thể không có kiểu hình hội chứng Turner. Thật vậy, trong số các bệnh nhân 45,X, kiểu hình hội chứng Turner cổ điển được tìm thấy ở ít hơn một phần ba (ngoại trừ tầm vóc thấp ở 99%). Chức năng buồng trứng đủ để khoảng 10% trải qua một số phát triển dậy thì tự phát và 5% có kinh nguyệt. Nếu các nghiên cứu nhiễm sắc thể là bình thường và không có giải thích rõ ràng nào cho suy sinh dục, các nghiên cứu đặc biệt cho tiền đột biến X giòn và viêm buồng trứng tự miễn nên được xem xét.
F. Suy buồng trứng tự miễn có thể liên quan đến các kháng thể đặc hiệu của mô và các bệnh nội tiết tự miễn, chẳng hạn như viêm tuyến giáp tự miễn mãn tính, tiểu đường, suy thượng thận, và suy cận giáp. Các rối loạn tự miễn không phải nội tiết có thể xảy ra, chẳng hạn như nấm candida niêm mạc da, bệnh celiac, và viêm gan mãn tính. Các đột biến gen hiếm gặp gây suy buồng trứng bao gồm các khiếm khuyết sinh steroid ảnh hưởng đến tình trạng mineralocorticoid (thiếu hụt 17-hydroxylase có liên quan đến dư thừa mineralocorticoid và tăng sản thượng thận dạng mỡ với thiếu hụt mineralocorticoid) và các đột biến của gonadotropin hoặc các thụ thể của chúng. Sinh thiết buồng trứng không có ý nghĩa tiên lượng hoặc điều trị. LH tăng không tương xứng trong các khiếm khuyết sinh steroid hoặc bệnh tự miễn đặc biệt ảnh hưởng đến các tế bào vỏ.
G. Bệnh sử có thể cung cấp một chẩn đoán (ví dụ, hóa trị hoặc xạ trị ung thư). Các nguyên nhân mắc phải khác bao gồm phẫu thuật và tự miễn dịch. Các nguyên nhân nhiễm sắc thể của suy buồng trứng sớm bao gồm vị trí giòn và các đột biến điểm của nhiễm sắc thể X. Các nguyên nhân di truyền khác bao gồm các hội chứng kháng gonadotropin, chẳng hạn như đột biến thụ thể LH hoặc hormone kích thích nang trứng (FSH) và giả suy cận giáp. Một siêu âm tiểu khung cho thấy sự bảo tồn các nang buồng trứng mang lại một số hy vọng về khả năng sinh sản.
H. Chảy máu do ngừng thuốc để đáp ứng với một liệu trình progestin từ 5 đến 10 ngày (ví dụ, medroxyprogesterone acetate 10 mg HS) gợi ý một nồng độ estradiol tổng thể lớn hơn 40 pg/mL. Tuy nhiên, điều này không hoàn toàn đáng tin cậy và do đó vì lợi ích của việc chẩn đoán kịp thời, thường đáng để tiến hành các nghiên cứu sâu hơn.
I. Một chu kỳ của một viên thuốc tránh thai đường uống (OCP) chứa 30 đến 35 mcg ethinyl estradiol thường đủ để gây chảy máu do ngừng thuốc nếu niêm mạc nội mạc tử cung còn nguyên vẹn.
J. Một vạch tử cung mỏng gợi ý suy estrogen. Một vạch dày gợi ý tăng sản nội mạc tử cung, như có thể xảy ra trong hội chứng buồng trứng đa nang.
K. Chẩn đoán phân biệt của các rối loạn không rụng trứng khác tiếp tục trong Hình 16.45. ACTH, adrenocorticotropic hormone; hCG, Human chorionic gonadotropin; TSH, thyroid-stimulating hormone.
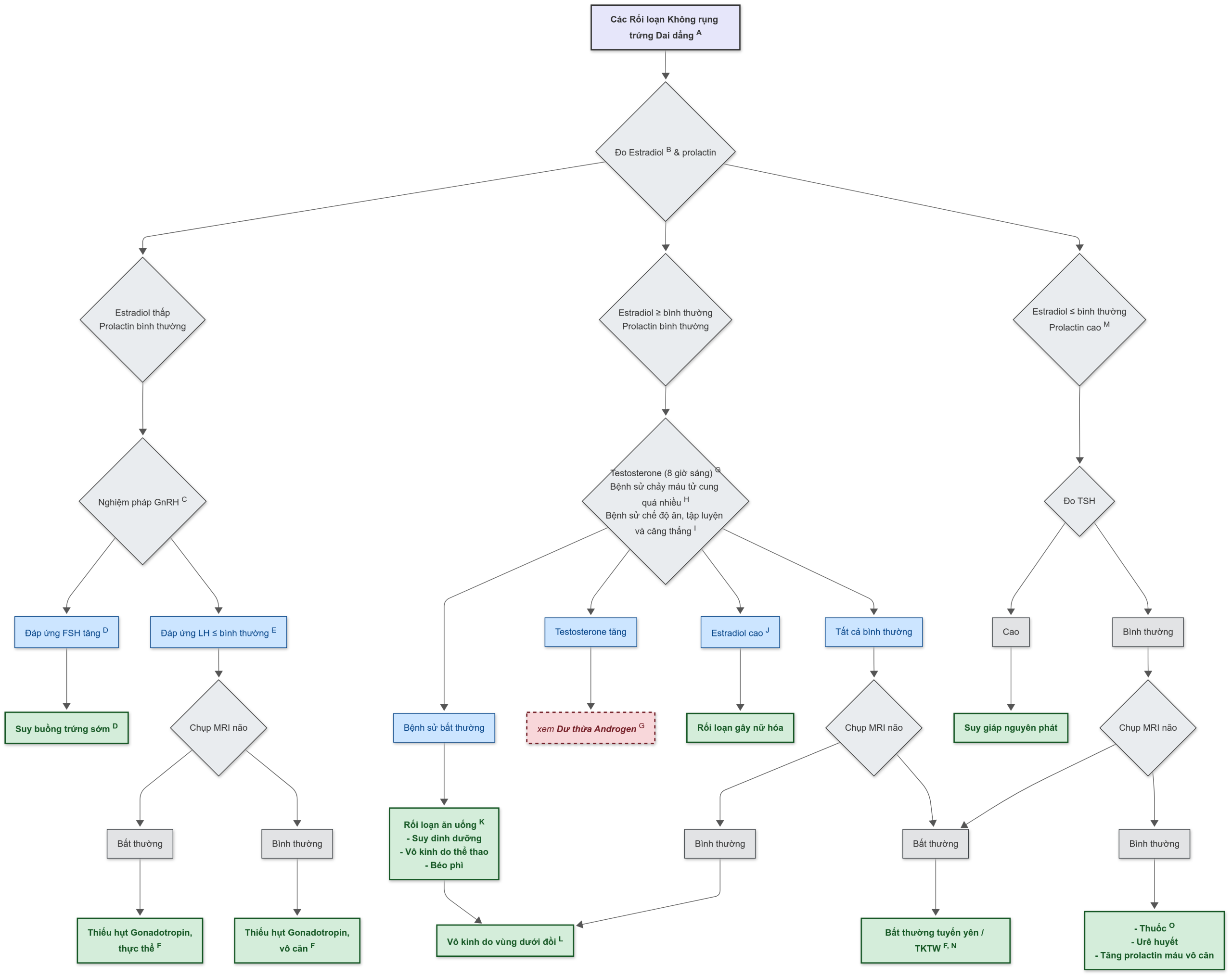
Hình 16.45 Chẩn đoán phân biệt các rối loạn không rụng trứng dai dẳng. (Chỉnh sửa từ Rosenfield, R.L. (2003). Menstrual disorders and hyperandrogenism in adolescence. In: Radovick, S., MacGillivray, M.H. eds. Pediatric Endocrinology a Practical Clinical Guide. Totowa, N. J., Humana Press, Inc., p. 451–478. Với sự cho phép.)
Chú thích:
A. Các rối loạn không rụng trứng nên được xem xét ở bất kỳ bé gái nào bị vô kinh hoặc kinh thưa không giải thích được kéo dài, chảy máu kinh nguyệt không đều, chu kỳ ngắn, hoặc chảy máu kinh nguyệt quá nhiều. Không rụng trứng sinh lý ở tuổi vị thành niên, một biến thể thoáng qua của bình thường, là nguyên nhân phổ biến nhất của rối loạn chức năng kinh nguyệt trong những năm đầu sau có kinh. Quy trình làm việc trong thuật toán này tiến triển từ các nghiên cứu âm tính trong thuật toán trước đó.
B. Một khi sự phát triển vú đã trưởng thành, đường nét của vú không thoái triển đáng kể nếu suy estrogen phát triển. Suy estrogen được gợi ý nếu estradiol huyết tương luôn dưới 40 pg/mL trong một xét nghiệm “nhi khoa” nhạy cảm với dưới 10 pg/mL. Tuy nhiên, một nồng độ estradiol duy nhất có thể gây hiểu nhầm do các biến thể theo chu kỳ hoặc từng đợt.
C. Xét nghiệm hormone giải phóng gonadotropin (GnRH) thường được thực hiện bằng cách xét nghiệm hormone tạo hoàng thể (LH) và hormone kích thích nang trứng (FSH) trước và 0.5 giờ sau khi tiêm 1 mcg/kg GnRH tĩnh mạch. Xét nghiệm chất chủ vận GnRH có thể được thực hiện thay thế bằng cách tiêm 10 mcg/kg leuprolide acetate dưới da và xét nghiệm LH và FSH vào 3 đến 4 giờ để đánh giá dự trữ gonadotropin và vào 18 đến 24 giờ để đánh giá đáp ứng steroid của buồng trứng với việc giải phóng gonadotropin nội sinh.
D. Nồng độ gonadotropin nền có thể bình thường khi buồng trứng bắt đầu suy, như trong giai đoạn mãn kinh sớm, nhưng một đáp ứng FSH quá mức với GnRH và một đáp ứng estradiol dưới mức bình thường với sự tăng gonadotropin do thử thách chất chủ vận GnRH cấp tính gây ra là đặc trưng. Xem thêm Suy buồng trứng sớm trong hình trước.
E. Các đáp ứng LH với GnRH có thể thay đổi từ không có đến bình thường trong thiếu hụt gonadotropin: các đáp ứng LH và FSH bình thường khi có suy estrogen cho thấy sự bài tiết GnRH của vùng dưới đồi bù trừ không đủ.
F. Thiếu hụt gonadotropin có thể là bẩm sinh hoặc mắc phải, thực thể hoặc chức năng. Các nguyên nhân bẩm sinh bao gồm các dị dạng não đường giữa hoặc các rối loạn di truyền đặc hiệu, chẳng hạn như hội chứng Prader-Willi, hội chứng Laurence-Moon-Biedl, hoặc hội chứng Kallmann. Kallmann, sự kết hợp của mất khứu giác với thiếu hụt gonadotropin, xảy ra ở cả dạng liên kết X và lặn trên nhiễm sắc thể thường. Các hình ảnh cộng hưởng từ (MRI) đặc biệt thường cho thấy sự vắng mặt của các dải khứu giác. Thiếu hụt gonadotropin mắc phải có thể là thứ phát sau một loạt các rối loạn hệ thần kinh trung ương (CNS) thực thể, từ khối u vùng dưới đồi-tuyến yên đến tổn thương do bức xạ đến hội chứng hố yên rỗng. Viêm tuyến yên tự miễn là một rối loạn hiếm gặp, đôi khi đi kèm với một hội chứng thiếu hụt đa nội tiết. Dạng nguyên mẫu của thiếu hụt gonadotropin chức năng là chán ăn tâm thần. Thiếu hụt gonadotropin vô căn đôi khi có thể xảy ra trong các gia đình có mất khứu giác, gợi ý một mối quan hệ với hội chứng Kallmann.
G. Testosterone tự do (hoặc có sẵn sinh học) trong huyết tương nhạy hơn khoảng 50% so với testosterone toàn phần trong việc phát hiện cường androgen máu. Tuy nhiên, có nhiều cạm bẫy trong các xét nghiệm testosterone ở mức độ thấp của phụ nữ, các xét nghiệm testosterone đáng tin cậy không có sẵn cho nhiều bác sĩ, và việc xét nghiệm testosterone tự do đưa ra các nguồn sai sót tiềm ẩn khác. Do đó, hợp lý khi bắt đầu đánh giá bằng một xét nghiệm testosterone toàn phần nếu một xét nghiệm testosterone tự do trong một phòng thí nghiệm chuyên khoa đáng tin cậy không có sẵn cho bác sĩ. Xét nghiệm đồng thời 17-hydroxyprogesterone được chỉ định ở các đối tượng có nguy cơ cao bị tăng sản thượng thận bẩm sinh, chẳng hạn như người Do Thái Ashkenazi. Đánh giá ban đầu để phân biệt giữa các nguyên nhân gây dư thừa androgen được phác thảo trong Hình 16.49.
H. Chảy máu tử cung quá nhiều (“do rối loạn chức năng”) không được kiểm soát bằng liệu pháp progestin hoặc thuốc tránh thai đường uống còn đòi hỏi một cuộc siêu âm tiểu khung (để tìm khối u đường sinh dục hoặc khối u gây nữ hóa), một quy trình làm việc đông máu (bao gồm số lượng tiểu cầu, thời gian prothrombin, xét nghiệm tạo thromboplastin, thời gian chảy máu, và yếu tố von Willebrand), và xem xét khả năng lạm dụng tình dục.
I. Tương đương 20 dặm mỗi tuần hoặc hơn thường được yêu cầu trước khi dự trữ mỡ cơ thể giảm đến mức xảy ra vô kinh. Căng thẳng thể chất hoặc tâm lý xã hội có thể gây vô kinh.
J. Khoảng giá trị bình thường cho estradiol trong chu kỳ kinh nguyệt là rộng: các giá trị trên 95 pg/mL thường chỉ ra giai đoạn tiền rụng trứng hoặc hoàng thể, nhưng tương thích với một rối loạn gây nữ hóa.
K. Lượng mỡ cơ thể thấp do các dạng rối loạn căng thẳng nhẹ (chán ăn tâm thần, chứng ăn vô độ tâm thần, và vô kinh do thể thao) có thể liên quan đến vô kinh do vùng dưới đồi chức năng mắc phải thay vì thiếu hụt gonadotropin rõ ràng. Hàm lượng mỡ cơ thể thấp của vô kinh do thể thao có thể không được phản ánh bằng cân nặng so với chiều cao do khối lượng cơ cao. Chụp hấp thụ tia X năng lượng kép có thể hữu ích trong việc ghi nhận lượng mỡ cơ thể dưới 20%. Bệnh nhân bị chán ăn tâm thần có thể bị vô kinh trước hoặc khi bắt đầu giảm cân, cho thấy một thành phần tâm lý quan trọng đối với nguyên nhân. Béo phì cũng liên quan đến các chu kỳ không rụng trứng và làm tăng khả năng mắc hội chứng Cushing.
L. Vô kinh do vùng dưới đồi là một chẩn đoán loại trừ. Nó là một dạng thiếu hụt gonadotropin một phần trong đó bài tiết estrogen nền là bình thường nhưng một đợt tăng LH tiền rụng trứng không thể được tạo ra. Nó có thể là kết quả của các rối loạn CNS thực thể hoặc là chức năng, do căng thẳng, suy dinh dưỡng hoặc béo phì, các loại rối loạn chức năng nội tiết đa dạng, bệnh mãn tính, hoặc vô căn. Nó có thể khó phân biệt với cường androgen máu.
M. Tăng prolactin máu không đồng nhất trong biểu hiện của nó. Một số có không rụng trứng với estrogen bình thường, có thể biểu hiện dưới dạng không rụng trứng do vùng dưới đồi, cường androgen, chảy máu tử cung do rối loạn chức năng, hoặc giai đoạn hoàng thể ngắn. Mặt khác, một số bị suy estrogen; những người này không có tiết sữa.
N. Các khối u vùng dưới đồi-tuyến yên lớn hoặc các loại tổn thương CNS khác gây ra rối loạn chức năng tuyến yên thay đổi, có thể bao gồm thiếu hụt gonadotropin hoàn toàn hoặc một phần và các biểu hiện khác nhau của suy tuyến yên (bao gồm cả suy giáp thứ phát). Nếu chúng làm gián đoạn cuống tuyến yên, tăng prolactin máu sẽ xảy ra. Tăng prolactin máu cũng có thể là do các u tuyến prolactin.
O. Các loại thuốc, đặc biệt là các thuốc an thần kinh thuộc loại phenothiazone hoặc ba vòng, có thể gây tăng prolactin máu.
Sự tăng FSH chỉ ra suy buồng trứng nguyên phát (xem Hình 16.43–16.45). Các bất thường nhiễm sắc thể thường là mối quan tâm đầu tiên vì nguyên nhân phổ biến nhất là hội chứng Turner và các biến thể của nó. Những cá nhân bị suy buồng trứng nguyên phát không phải do hội chứng Turner và các biến thể của nó nên được điều tra về tiền đột biến X giòn, viêm buồng trứng tự miễn, và các khiếm khuyết sinh steroid.
Việc không có sự tăng FSH ở một bệnh nhân tiền dậy thì không loại trừ suy buồng trứng nguyên phát nếu tuổi xương dưới 11 tuổi vì dậy thì thần kinh-nội tiết có thể chưa xảy ra; trong tình huống này, suy buồng trứng nguyên phát không phải là tăng gonadotropin (xem Bảng 16.5). Nếu FSH không tăng và tuổi xương đã đạt 11 tuổi, ở một bé gái tiền dậy thì không có rối loạn làm suy giảm hoặc làm chậm tăng trưởng, chúng ta đang đối phó với hoặc là chậm dậy thì có tính chất cơ địa hoặc là thiếu hụt gonadotropin đơn độc (xem Hình 16.43). Chậm dậy thì “có tính chất cơ địa” là chẩn đoán có khả năng nhất cho đến khi tuổi xương đạt 11 đến 13 tuổi (xem Bảng 16.5). Việc phân biệt nó với thiếu hụt gonadotropin đơn độc có thể khó khăn. Các đặc điểm giúp phân biệt nó với thiếu hụt gonadotropin đơn độc được liệt kê trong Hộp 16.6 và được thảo luận trong chú thích của Hình 16.43. Xét nghiệm hữu ích nhất là nồng độ LH để đáp ứng với xét nghiệm GnRH vì nồng độ LH ngẫu nhiên ở bệnh nhân giảm gonadotropin thường chồng chéo với nồng độ của trẻ em tiền và giữa dậy thì bình thường. Xét nghiệm chất chủ vận GnRH có thể phân biệt giữa các rối loạn này tốt hơn vì đáp ứng LH vào 3 đến 4 giờ là chỉ số tốt nhất về dự trữ bài tiết gonadotropin và vì xét nghiệm này cho phép đánh giá đáp ứng bài tiết của tuyến sinh dục với các gonadotropin được bài tiết vào 24 giờ. Kisspetin đã được đưa ra trong một quy trình thử nghiệm cho trẻ em bị CDGP để xác định xem nó có thể là một xét nghiệm chẩn đoán để dự đoán việc bước vào tuổi dậy thì hay không. Trẻ em cho thấy một loạt các phản ứng, từ một phản ứng mạnh mẽ đến ít hoặc không có phản ứng. Do đó, tiện ích của nó như một yếu tố dự báo sự phát triển sinh sản trong tương lai vẫn còn là một câu hỏi.
| Hộp 16.6. Các đặc điểm Phân biệt Thiếu hụt Gonadotropin với Chậm dậy thì có tính chất cơ địa
Ở một bé gái tiền dậy thì khỏe mạnh bị chậm phát triển có BA > 11 tuổi và FSH tiền dậy thì, thiếu hụt gonadotropin là:
BA, Tuổi xương; BMI, chỉ số khối cơ thể; CNS, hệ thần kinh trung ương; CT, chụp cắt lớp vi tính; FSH, hormone kích thích nang trứng; LH, hormone tạo hoàng thể; MRI, chụp cộng hưởng từ. (Chỉnh sửa từ Rosenfield, R.L., Barnes, R.B. (1993). Menstrual disorders in adolescence. Endocrinol Metab Clin North Am, 22, 491–505. Với sự cho phép.) |
Việc đánh giá mức độ estrogen hóa của một thanh thiếu niên thường khó khăn. Sự phát triển vú cho thấy đã có sự tiếp xúc với estrogen, nhưng không có nghĩa là nó đang diễn ra. Việc xác định estradiol huyết thanh là xét nghiệm đơn giản nhất, nhưng các biến thể theo ngày và theo chu kỳ phải được xem xét. Việc xác định các tác động của nội tiết tố lên tế bào học âm đạo là chỉ số tốt nhất về sự tiếp xúc với estrogen tổng thể (xem Hình 16.28), nhưng ít được bệnh nhân chấp nhận hơn. Một thử nghiệm thử thách progestin thường hữu ích. Một phụ nữ không bị chảy máu do ngừng progestin (xem Hình 16.44) có lẽ có nồng độ estradiol xung quanh dưới khoảng 40 pg/mL. Nếu chảy máu không xảy ra để đáp ứng với thao tác này, tính toàn vẹn của tử cung có thể được chứng minh bằng cách gây chảy máu do ngừng thuốc sau một liệu trình estrogen-progestin trong 3 tuần, được sử dụng thuận tiện nhất dưới dạng thuốc tránh thai.
Một nồng độ prolactin được chỉ định trong quy trình làm việc ban đầu của bệnh nhân có gonadotropin bình thường, bất kể tình trạng estrogen của họ (Hình 16.45). Nồng độ prolactin tương quan với kích thước của các u tuyến prolactin, và một nồng độ trên 200 ng/mL là điển hình của một macroprolactinoma. Một nồng độ prolactin không tương quan với kích thước của một khối u tuyến yên lớn cho thấy hoặc là khối u không phải là một u tuyến prolactin và đang gây ra một sự cắt cuống tuyến yên chức năng hoặc đó là một macroprolactinoma tạo ra nồng độ prolactin cao đến mức làm giảm giả tạo nồng độ prolactin có thể đo được bằng xét nghiệm miễn dịch do “hiệu ứng móc câu”. Nồng độ prolactin trong máu hoặc dịch não tủy rất cao gợi ý tính xâm lấn. Quy trình làm việc cho điều này nên bao gồm việc kiểm tra chính thức các thị trường (đo thị trường Goldman hoặc đáp ứng gợi). Các microadenoma tuyến yên có thể là “incidentaloma” không có ý nghĩa lâm sàng, được đánh giá từ tỷ lệ mắc khoảng 10% trong các tài liệu khám nghiệm tử thi. Tuy nhiên, chúng đòi hỏi phải đánh giá cẩn thận chức năng tuyến yên và theo dõi. Macroprolactinemia nên được xem xét trong trường hợp không có các triệu chứng liên quan rõ ràng và khi MRI âm tính hoặc trong bối cảnh bệnh tự miễn. Macroprolactinemia được xác nhận khi nồng độ prolactin được đo sau khi kết tủa huyết thanh bằng polyethylene glycol là bình thường (hoặc giảm đáng kể so với nồng độ được đo trong huyết thanh chưa được xử lý).
Các nghiên cứu hình ảnh là những biện pháp bổ trợ quan trọng. Siêu âm tiểu khung có thể chứng minh buồng trứng thiểu sản, các rối loạn nội mạc tử cung, hoặc buồng trứng đa nang. MRI vùng dưới đồi-tuyến yên quan trọng trong quy trình làm việc của thiếu hụt gonadotropin, tăng prolactin máu, và không rụng trứng do vùng dưới đồi. MRI có thể không cần thiết nếu bệnh nhân có tiền sử gợi ý vô kinh do vùng dưới đồi chức năng nhưng được chỉ định trong những trường hợp có các triệu chứng liên quan như đau đầu, nôn mửa, thay đổi thị lực, thay đổi về khát hoặc tần suất đi tiểu, một cuộc khám thần kinh bất thường, hoặc bằng chứng về các bất thường nội tiết tố tuyến yên khác.
Bệnh nhân chán ăn đòi hỏi phải đánh giá tâm thần và xem xét khối u não và tắc ruột một phần. Việc ăn kiêng lập dị và nghiện thể thao có thể khó phân biệt với chứng chán ăn tâm thần. Gầy có tính chất cơ địa là một biến thể của bình thường với kinh nguyệt bình thường và một hồ sơ nội tiết đặc biệt. Không rõ liệu hội chứng động mạch mạc treo tràng trên có phải là một rối loạn nguyên phát bắt chước chứng chán ăn tâm thần hay là một biến chứng của nó.
Điều trị
Các rối loạn cơ bản phải được điều trị một cách thích hợp. Ví dụ, các khối u cần phẫu thuật và/hoặc xạ trị.
Đối với u tuyến prolactin, điều trị bằng dopaminergic là lựa chọn điều trị ban đầu trừ khi tình trạng hoặc thị lực của bệnh nhân nguy kịch. Tăng prolactin máu sẽ được ức chế tối đa trong vòng 1 tháng và chu kỳ kinh nguyệt được bình thường hóa trong vòng 3 tháng bằng một phác đồ chủ vận dopaminergic hiệu quả. Cabergoline 0.5 đến 1.0 mg một hoặc hai lần mỗi tuần thường sẽ kiểm soát được tiết sữa và làm co nhỏ các u tuyến prolactin. Để giảm thiểu buồn nôn, tốt nhất là bắt đầu với một liều thấp trước khi đi ngủ. Bromocriptine không kích hoạt thụ thể serotonin 5-hydroxytriptamine (2B), cơ chế được đề xuất qua đó cabergoline được cho là kích thích rối loạn chức năng van tim ở người già, và do đó bromocriptine dường như không liên quan đến nguy cơ hở van tim tăng lên, và có thể được coi là một sự thay thế cho điều trị bằng cabergoline, mặc dù là một phương pháp kém hiệu quả hơn. Liều duy trì bromocriptine thông thường là 0.25 đến 0.5 mg hai lần mỗi ngày. Sau 2 năm điều trị, nếu nồng độ prolactin bình thường và không có khối u rõ ràng trên MRI, chất chủ vận dopamine có thể được giảm liều và có thể ngừng. Nồng độ prolactin sau đó được đo để theo dõi sự tái phát.
Chán ăn tâm thần được quản lý tốt nhất bởi một đội ngũ đa ngành có kinh nghiệm. Bồi dưỡng lại là ưu tiên hàng đầu, và một khi sự tăng cân ổn định là rõ ràng, các vấn đề tâm động học có thể được giải quyết. Liệu pháp gia đình cho các trường hợp chán ăn tâm thần không phức tạp về mặt y tế trên cơ sở ngoại trú thường mang lại kết quả tốt nhất, với sự cải thiện tốt ở hơn một nửa số bệnh nhân. Chăm sóc nội trú là cần thiết nếu có nhịp tim chậm nghiêm trọng, hạ huyết áp hoặc hạ huyết áp tư thế, hoặc mất cân bằng điện giải, và có thể cần thiết nếu không tăng cân trong quá trình điều trị ngoại trú. Kinh nguyệt thường trở lại khi liệu pháp tâm lý có hiệu quả và mỡ cơ thể được phục hồi bình thường (xem Hình 16.42). Việc gây ra kinh nguyệt bằng cách thay thế estrogen-progestin thường là không khôn ngoan vì nó mang lại một cảm giác phục hồi sai lầm và không mang lại sự phục hồi mất xương xảy ra khi tăng cân. Tuy nhiên, ở những thanh thiếu niên có mật độ xương thấp chưa có kinh trở lại sau một thử nghiệm hợp lý về can thiệp dinh dưỡng và tâm lý (có lẽ là 6–12 tháng), có thể xem xét điều trị ngắn hạn bằng estradiol qua da và progestin đường uống theo chu kỳ (không phải thuốc tránh thai đường uống hoặc ethinyl estradiol) để bảo vệ sức khỏe xương của bệnh nhân. Mặc dù cơn cấp tính thường có thể được điều trị thành công, có một tỷ lệ cao về khuyết tật tâm thần và các biến chứng y tế đang diễn ra. Chán ăn tâm thần “ủy quyền” đã được mô tả ở con cái của các bệnh nhân cũ.
Có hai khía cạnh của liệu pháp thường liên quan đến việc quản lý suy sinh dục—hỗ trợ tâm lý và sử dụng hormone. Bệnh nhân bị chậm phát triển là một biến thể của bình thường nên được trấn an rằng không có gì sai, chỉ là sự chậm trễ về thời điểm bắt đầu dậy thì. Sự thay đổi bình thường rộng rãi trong mô hình và thời gian của đợt tăng trưởng dậy thì nên được giải thích chi tiết và cô gái nên được thông báo về chiều cao cuối cùng dự đoán của mình. Phần lớn trẻ em bị dậy thì muộn không có các triệu chứng tâm lý rõ ràng. Các sự bù trừ và thăng hoa phức tạp rõ ràng xảy ra. Tuy nhiên, áp lực nhóm bạn bè có thể làm cho việc thích nghi với tình trạng ấu trĩ sinh dục đặc biệt khó khăn khi đến 13 tuổi, và một hình ảnh bản thân kém có thể dẫn đến sự rút lui xã hội và cảm giác vô vọng. Sự chưa trưởng thành về thể chất có thể kéo dài sự chưa trưởng thành về tâm lý. Một liệu trình điều trị bằng hormone sinh dục sinh lý từ 6 đến 12 tháng vào thời điểm này có thể giúp giảm bớt những lo lắng này. Bác sĩ nên thảo luận về thực tế, khi có bằng chứng ủng hộ, rằng khả năng cao là “bộ đếm thời gian trong vùng tiềm thức của não” cuối cùng sẽ bật. Khi nào điều này sẽ xảy ra có thể được ước tính từ tuổi xương. Không nên ngần ngại khuyên nên tư vấn tâm lý chuyên sâu hơn nếu rõ ràng rằng mối quan tâm về dậy thì chỉ là một khía cạnh của một sự khó thích nghi chung hơn. Cuối cùng, quyết định về việc có nên điều trị cho dậy thì muộn hay không là tùy thuộc vào bệnh nhân và gia đình của họ.
Hãy đảm bảo với thanh thiếu niên có cơ sở hữu cơ cho suy estrogen rằng sự nữ hóa sẽ xảy ra, mặc dù để đáp ứng với điều trị hormone thích hợp. Một số dạng thiếu hụt gonadotropin di truyền thực sự được đảo ngược bằng liệu pháp steroid sinh dục. Tuy nhiên, hầu hết sẽ cần liệu pháp thay thế hormone suốt đời. Cần lưu ý rằng việc đạt được sự phát triển vú bình thường ở cô gái bị suy toàn bộ tuyến yên đòi hỏi phải thay thế các thiếu hụt GH và cortisol. Tuy nhiên, rất khó để gây ra các đặc điểm sinh dục thứ phát ở một số bệnh nhân bị bệnh viêm hệ thống mãn tính, chẳng hạn như lupus ban đỏ.
Ở những bệnh nhân mà tầm vóc thấp là một mối quan tâm quan trọng, như trong hội chứng Turner, tiềm năng tăng trưởng phải được xem xét trước khi tiến hành thay thế estrogen. Liệu pháp GH cải thiện tiềm năng chiều cao người lớn của bệnh nhân bị hội chứng Turner, đặc biệt là khi bắt đầu ngay khi suy giảm tăng trưởng trở nên rõ ràng. Liệu pháp GH ở Hoa Kỳ thường được bắt đầu với liều được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt là 0.375 mg/kg·tuần. Nếu chiều cao người lớn có khả năng không đạt yêu cầu, nên xem xét điều trị đồng thời với oxandrolone 0.03–0.05 mg/kg/ngày. Phì đại âm vật thường không đáng kể ở liều lượng này; chức năng gan nên được theo dõi.
Hai nghiên cứu có đối chứng đã cho thấy rằng liệu pháp thay thế estrogen dậy thì là an toàn và hiệu quả trong việc tối đa hóa tiềm năng tăng trưởng và sự nữ hóa phù hợp với lứa tuổi khi bắt đầu ở độ tuổi trẻ từ 11 đến 12 tuổi bằng cách sử dụng liều estrogen rất thấp, thấp hơn nhiều so với những liều có sẵn theo đơn, kết hợp với liệu pháp GH trong hội chứng Turner. Hàm lượng estrogen của thuốc tránh thai đường uống (OCP) là siêu sinh lý để gây ra sự phát triển vú hoặc để tăng trưởng tuyến tính.
Chúng tôi ủng hộ việc sử dụng một trong các phác đồ thay thế hormone sau đây. Dù sử dụng dạng estrogen nào, sự phát triển dậy thì và tăng trưởng nên được theo dõi sau mỗi 6 tháng, với việc xác định tuổi xương ở các khoảng thời gian từ 6 đến 12 tháng để tránh mất tiềm năng tăng trưởng không lường trước được.
Estradiol depot tiêm bắp với liều khởi đầu 0.2 mg/tháng thường sẽ gây ra sự nhú vú; liều lượng nên được tăng thêm 0.2 mg sau mỗi 6 tháng. Một liều giữa dậy thì từ 1.0 đến 1.5 mg mỗi tháng, bằng một nửa liều thay thế của người lớn, thường gây ra kinh nguyệt trong vòng 1 năm. Một phác đồ uống thay thế bắt đầu với 5 mcg/kg estradiol micronized (Estrace®, 0.25 mg cho một cô gái 50 kg) hàng ngày; liều thay thế của người lớn là 1 đến 2 mg/ngày.
Estradiol qua da là một dạng điều trị thuận tiện, sinh lý, dường như có lợi ích sức khỏe lâu dài hơn so với các loại estrogen đường uống thường được sử dụng, nhưng có rất ít dữ liệu về việc sử dụng chúng để gây dậy thì. Chúng tôi đề nghị bắt đầu nữ hóa qua da với 14 mcg mỗi ngày trong 1 tuần mỗi tháng, một liều nữ hóa cận biên phù hợp với các hướng dẫn hiện hành, và tăng dần sau các khoảng thời gian 6 tháng đến liều người lớn sau 3 năm. Một phác đồ đề xuất cho việc gây dậy thì nữ cho bệnh nhân suy sinh dục được cung cấp trong Bảng 16.7.
Bảng 16.7 Một phác đồ thay thế Estradiol qua da cho dậy thì bắt đầu ở 11 tuổi
| Tuổi | Liều Estradiol |
|---|---|
| 0–6 tháng | “14 mcg, ngày 1–7 mỗi tháng” |
| 6–12 tháng | “14 mcg, ngày 1–14 mỗi tháng” |
| 1–1.5 năm | “14 mcg, ngày 1–21 mỗi tháng” |
| 1.5–2 năm | “25 mcg, ngày 1–21 mỗi tháng” |
| 2–2.5 năm | “37.5 mcg, ngày 1–21 mỗi tháng” |
| 2.5–3 năm | “Chu kỳ 28 ngày: 50 mcg ngày 1–21 và Prometrium® 100 mg b ngày 12–21 mỗi 28 ngày HOẶC Liên tục: 50 mcg ngày 1–14, sau đó Combipatch® (50 mcg estradiol/0.14 mg norethindrone) ngày 16–28 mỗi 28 ngày” |
| 3–3.5 năm | Chu kỳ 28 ngày: 75 mcg ngày 1–21 và Prometrium® 100 mg ngày 12–21 mỗi 28 ngày HOẶC Liên tục: 75 mcg ngày 1–14 sau đó Combipatch® (50 mcg estradiol/norethindrone) ngày 16–28 mỗi 28 ngày |
| 3.5–4 năm | Chu kỳ 28 ngày: 100 mcg ngày 1–21 và Prometrium® 100mg ngày 12–21 mỗi 28 ngày HOẶC 100 mcg ngày 1–14 sau đó Combipatch® (50 mcg estradiol/norethindrone) ngày 16–28 mỗi 28 ngày |
| > 4.0 năm | Tiếp tục phác đồ hoặc đề nghị thuốc tránh thai đường uống |
a (Chỉnh sửa từ Klein, K.O., Rosenfield, R.L., Santen, R.J., et al. (2018). Estrogen replacement in Turner syndrome: literature review and practical considerations. J Clin Endocrinol Metab, 103, 1790–1803.)
Đối với các bé gái bị suy sinh dục và có tử cung còn nguyên vẹn, nên thêm progestin theo chu kỳ sau 2 năm điều trị bằng estrogen hoặc khi bắt đầu có chảy máu vào những thời điểm không thể đoán trước. Một phác đồ đơn giản là sử dụng 100 mg progesterone micronized (Prometrium®) trước khi đi ngủ trong 7 đến 14 ngày trong tuần thứ hai đến thứ ba của liệu pháp estrogen hoặc các liều tương đương của medroxyprogesterone acetate (5–10 mg/ngày) hoặc norethindrone acetate (5 mg/ngày). Điều này sẽ mang lại kinh nguyệt bình thường trong tuần trước khi tiếp tục liệu pháp estrogen. Việc bổ sung progestin sẽ làm giảm nguy cơ tăng sản nội mạc tử cung và ung thư nội mạc tử cung, nhưng các triệu chứng tiền kinh nguyệt nên được lường trước.
Một khi đạt được chiều cao tối ưu, hầu hết các bệnh nhân thích chuyển sang thuốc tránh thai kết hợp đường uống (OCP) như một dạng liệu pháp estrogen-progestin thuận tiện. Nên dùng các loại thuốc chứa liều estrogen thấp nhất sẽ dẫn đến các chu kỳ kinh nguyệt bình thường. Các nguy cơ tiềm ẩn của thuốc tránh thai đường uống phải được ghi nhớ khi tư vấn cho thanh thiếu niên. Liều estrogen thấp nhất hiện có trong các loại thuốc tránh thai kết hợp ở Hoa Kỳ chứa 20 mcg (Mircette®) đến 30 mcg (Yasmin®) ethinyl estradiol. Việc thay thế androgen liều thấp đã gây tranh cãi, nhưng có thể mang lại lợi ích cho thành phần cơ thể, nhận thức, khoáng hóa xương, và ham muốn tình dục.
Bệnh nhân giảm gonadotropin có thể đạt được sự rụng trứng bằng liệu pháp gonadotropin. Thiếu hụt GnRH của vùng dưới đồi có thể được điều trị thành công bằng GnRH dạng xung. Gần đây, kisspeptin đã được coi là một phương thức điều trị cho CHH; tuy nhiên, thời gian bán hủy ngắn của nó đã cản trở các nỗ lực. Do đó, các chất tương tự kisspeptin đã được thiết kế để giảm sự phân hủy của protease và thanh thải qua thận. Các chất tương tự này gây ra tác động kích thích trực tiếp lên các tế bào thần kinh GnRH, làm sớm dậy thì, và đồng bộ hóa sự rụng trứng ở cừu. Tiềm năng điều trị các rối loạn sinh sản ở người vẫn chưa được xác định. Vì một số gen trong hệ thống tín hiệu GnRH được biểu hiện ở tuyến sinh dục, một số bệnh nhân giảm gonadotropin có các khiếm khuyết nguyên phát trong chức năng tuyến sinh dục. Việc gây rụng trứng tốt nhất nên được thực hiện bởi một bác sĩ phụ khoa chuyên về nội tiết sinh sản.
Bảo tồn khả năng sinh sản là có thể ở một số bệnh nhân bị suy buồng trứng nguyên phát. Đông lạnh noãn bào để thụ tinh trong ống nghiệm sau này là khả thi ở các bé gái tuổi dậy thì sau khi gây rụng trứng. Các bé gái phải ở tuổi dậy thì để gây rụng trứng thành công. Ngoài ra, việc đông lạnh phôi đòi hỏi phải có tinh trùng, có khả năng hạn chế sự phù hợp của phương pháp này ở bệnh nhân nhi. Đông lạnh mô buồng trứng là một kỹ thuật hứa hẹn có thể hữu ích để bảo tồn khả năng sinh sản ở các bé gái tiền dậy thì bị suy buồng trứng, mặc dù đây hiện là một phương pháp tiếp cận điều tra. Cuối cùng, việc kích hoạt sự phát triển của các nang trứng còn lại trong các mảnh ghép tự thân gần đây đã được thực hiện ở người lớn bị POI, với kết quả mang thai thành công sau khi chuyển phôi. Nghiên cứu tế bào gốc dòng mầm nữ hứa hẹn là một phương pháp điều trị vô sinh trong tương lai. Thông tin cập nhật cho các bác sĩ và bệnh nhân có thể được tìm thấy thông qua Hiệp hội Oncofertility (www.myoncofertility.org).
Ở các bé gái bị hội chứng Turner, việc bảo tồn khả năng sinh sản bằng cách sử dụng đông lạnh noãn bào hoặc phôi hiện chỉ hữu ích ở những người đã trải qua dậy thì tự phát. Những bé gái này nên được tư vấn về những khả năng này để bảo tồn khả năng sinh sản. Ở những bé gái này, việc theo dõi nồng độ AMH có thể hữu ích như một dấu hiệu của chức năng buồng trứng. Mặt khác, các nang trứng nguyên thủy đã được tìm thấy trong mô buồng trứng được thu thập để đông lạnh từ các bé gái bị hội chứng Turner thể khảm hoặc không khảm, mặc dù khả năng tìm thấy các nang trứng thấp hơn nhiều ở những người có karyotype 45,X (10.7%) so với những người có thể khảm 46,XX/45,X (86%). Tuy nhiên, như đã lưu ý trước đó, việc đông lạnh buồng trứng vẫn là một thủ thuật điều tra. Trong các trường hợp mang thai tự phát hiếm gặp đã xảy ra ở phụ nữ bị hội chứng Turner, tỷ lệ bất thường bẩm sinh và nhiễm sắc thể ở thai nhi là khoảng 50%, điều này phải được xem xét khi sử dụng noãn bào tự thân từ bất kỳ phương pháp tiếp cận nào. Cuối cùng, phụ nữ bị hội chứng Turner có nguy cơ cao bị các biến chứng thai kỳ ở thai nhi và mẹ do các bất thường tử cung, không dung nạp carbohydrate, và các biến chứng tim mạch tiềm ẩn bao gồm cả vỡ động mạch chủ. (Để thảo luận về các khía cạnh khác trong việc chăm sóc các bé gái bị hội chứng Turner, xem Chương 17.)
Rối loạn Kinh nguyệt không do suy giảm Estrogen
Không rụng trứng do vùng dưới đồi
Không rụng trứng do vùng dưới đồi gây ra các rối loạn kinh nguyệt ở phụ nữ trưởng thành về mặt sinh dục thông qua sự thiếu hụt bài tiết GnRH quá tinh vi để gây ra suy giảm estrogen rõ rệt. Hệ thống thần kinh-nội tiết kích thích buồng trứng bài tiết estrogen đến một mức độ bình thường đối với một phụ nữ ở giai đoạn nang trứng sớm hoặc giữa, nhưng sự phát triển nang trứng không đủ để một nang trứng trội bình thường xuất hiện. Vô kinh hoặc kinh thưa có thể xảy ra. Tuy nhiên, ở một số bệnh nhân, sự estrogen hóa đủ để gây ra chảy máu tử cung do rối loạn chức năng, điều này sẽ được thảo luận trong phần tiếp theo.
Giảm xung LH và/hoặc không tạo ra được một đợt tăng LH giữa chu kỳ là đặc trưng. Sinh lý bệnh dường như được trung gian chủ yếu bởi suy dinh dưỡng và/hoặc dư thừa CRH. Cân bằng năng lượng âm có thể có ngay cả ở những bệnh nhân có cân nặng và dự trữ mỡ bình thường, nhưng dưới mức trung bình. Thiếu hụt leptin là một yếu tố quyết định quan trọng của việc giảm xung LH. Ghrelin có thể đóng một vai trò trong việc ức chế LH. Sự không rụng trứng do căng thẳng tâm lý hoặc thể chất dường như liên quan đến dư thừa CRH. Trong não, CRH giải phóng β-endorphin từ proopiomelanocortin, và endorphin lần lượt ức chế sự giải phóng GnRH. Việc phong tỏa tác động của opioid bằng naloxone sẽ bình thường hóa sự bài tiết gonadotropin. Trong tuyến yên, CRH làm tăng điểm đặt cho sự giải phóng ACTH. Điều này tạo ra một trạng thái ổn định mới của sự bài tiết cortisol tăng lên. Đáp ứng ACTH tiếp theo đối với CRH bị cùn đi bởi phản hồi âm của sự dư thừa cortisol này. Kết quả là một nhịp cortisol dạng Cushing nhẹ. Bản thân sự dư thừa cortisol có thể góp phần gây ra vô kinh bằng cách ức chế đáp ứng với GnRH, cũng như đối kháng với một số tác động của hormone sinh dục. Androgen thượng thận tăng ở các vận động viên thi đấu duy trì dự trữ mỡ cơ thể.
Nguyên nhân
Vô kinh do vùng dưới đồi chức năng (FHA) mô tả tình trạng không rụng trứng do vùng dưới đồi không giải thích được bằng một nguyên nhân CNS thực thể có thể xác định được hoặc bệnh mãn tính. Những bệnh nhân này có LH huyết thanh bình thường hoặc hơi thấp, FSH bình thường, và estradiol trong khoảng giai đoạn nang trứng sớm-giữa (20–50 pg/mL). Nó là do thiếu hụt năng lượng (do giảm cân và/hoặc tập thể dục mạnh) hoặc căng thẳng tâm lý hoặc sự kết hợp của cả hai. Giống như bệnh nhân bị chán ăn tâm thần và các loại không rụng trứng do vùng dưới đồi do thể thao hoặc tâm lý, họ thường có tăng cortisol máu đáng kể. Tuy nhiên, có những bệnh nhân bị FHA không thể xác định được là có một trong những nguyên nhân này. Khoảng 24% phụ nữ như vậy trong một loạt nghiên cứu có tiền sử kinh nguyệt muộn. Một mô hình trên động vật linh trưởng chỉ ra rằng không rụng trứng do vùng dưới đồi phát triển ở những cá thể nhạy cảm với căng thẳng từ sự kết hợp vô hại của căng thẳng nhẹ và hạn chế calo nhẹ. Tính dị hợp tử đối với các gen liên quan đến hội chứng Kallmann đã được xác định là một yếu tố có khuynh hướng ở 13% các trường hợp; hơn một nửa phân nhóm này có tiền sử gia đình bị vô kinh do vùng dưới đồi hoặc dậy thì muộn.
Vô kinh do thể thao là thuật ngữ được đặt cho tình trạng không rụng trứng do vùng dưới đồi liên quan đến việc tập thể dục quá mức và dự trữ mỡ cơ thể thấp. Chạy từ 20 dặm trở lên mỗi tuần có liên quan đến tỷ lệ vô kinh tăng lên. Bộ ba nữ vận động viên bao gồm rối loạn kinh nguyệt, rối loạn ăn uống, và loãng xương. Vô kinh nguyên phát hoặc thứ phát, kinh thưa, hoặc giai đoạn hoàng thể ngắn là phổ biến ở các vận động viên. Chức năng buồng trứng giảm xấp xỉ tương ứng với lượng hoạt động thể chất và hạn chế ăn uống. Tập thể dục chịu trọng lượng chỉ bảo vệ một phần khỏi các tác động của suy giảm estrogen lên xương chịu trọng lượng. Có lo ngại rằng các vận động viên bị vô kinh có thể bị thiếu hụt vĩnh viễn khối lượng xương. Giảm cân đến 10% dưới trọng lượng cơ thể lý tưởng và lượng mỡ cơ thể dưới 12% là các yếu tố nguy cơ gây vô kinh. BMI không phản ánh chính xác dự trữ mỡ cơ thể ở các vận động viên do khối lượng cơ của họ. Cân bằng năng lượng dường như quan trọng hơn dự trữ mỡ cơ thể thấp trong việc trung gian cho sự không rụng trứng. Kinh nguyệt có thể xảy ra hoặc kinh nguyệt trở lại khi mức độ hoạt động của vận động viên đột ngột giảm và trước khi tăng cân. Các yếu tố khác cũng góp phần gây ra vô kinh. Thiếu hụt dinh dưỡng có thể cùng tồn tại. Suy dinh dưỡng mãn tính có thể ức chế chức năng tuyến giáp như trong chứng chán ăn tâm thần. Vô kinh do thể thao giống với chứng chán ăn tâm thần ở nỗi ám ảnh của bệnh nhân về việc kiểm soát cân nặng.
Vô kinh do tâm lý do căng thẳng tâm lý nghiêm trọng đã được biết đến từ lâu (ví dụ, “vô kinh ở trường nội trú”). Sự khởi phát của vô kinh do tâm lý có thể được xác định là có liên quan đến một sự kiện riêng biệt, nhưng rối loạn chức năng buồng trứng có xu hướng kéo dài. Thiếu hụt dinh dưỡng tinh vi góp phần.
Động kinh gây ra các rối loạn kinh nguyệt dường như là kết quả của sự điều hòa thần kinh-nội tiết bất thường độc lập với việc điều trị bằng thuốc.
Mang thai giả là một dạng vô kinh do tâm lý cực kỳ hiếm gặp, là do sự tồn tại của hoàng thể. Hội chứng này có xu hướng xảy ra ở những phụ nữ vô sinh có mong muốn mang thai mãnh liệt và chứng cuồng loạn chuyển đổi. Dư thừa prolactin và LH dường như trung gian cho hội chứng hiếm gặp này.
Chẩn đoán phân biệt
Các rối loạn bên ngoài trục thần kinh-nội tiết-tuyến sinh dục có thể gây ra hoặc bắt chước tình trạng không rụng trứng do vùng dưới đồi. Chúng bao gồm mang thai, rối loạn dinh dưỡng, dư thừa glucocorticoid, rối loạn chức năng tuyến giáp, lạm dụng thuốc, bệnh mãn tính, tăng prolactin máu, và bài tiết gonadotropin lạc chỗ.
Mang thai phải được loại trừ ở tất cả các thanh thiếu niên trưởng thành về mặt sinh dục bị vô kinh. Sự tăng nồng độ β-hCG trong huyết thanh là dấu hiệu xét nghiệm sớm nhất. hCG của nhau thai ban đầu thúc đẩy sự sản xuất quá mức liên tục của estrogen và progestin bởi hoàng thể của mẹ, sau đó việc sản xuất estrogen và các steroid sinh dục khác chuyển sang đơn vị thai nhi-nhau thai và ức chế sự giải phóng gonadotropin của tuyến yên mẹ.
Khối lượng mỡ tối ưu là cần thiết cho nồng độ gonadotropin bình thường ở phụ nữ trưởng thành về mặt sinh dục, và cả béo phì và suy dinh dưỡng đều ức chế gonadotropin: do đó, đáp ứng gonadotropin với khối lượng mỡ tương đối dường như có hai pha. Béo phì có liên quan đến biên độ xung LH bị cùn đi, một phần là do tốc độ thanh thải LH tăng lên. Việc sản xuất quá mức estrogen từ các tiền chất huyết tương trong mô mỡ có thể đóng một vai trò trong việc ức chế xung LH. Mức độ mà sự gián đoạn giấc ngủ có thể góp phần vào việc ức chế LH là không rõ ràng. Tác động của suy dinh dưỡng dường như được trung gian bởi các yếu tố liên quan đến cân bằng năng lượng, như đã thảo luận trong phần Không rụng trứng do Vùng dưới đồi.
Hội chứng Cushing (dư thừa glucocorticoid) thuộc bất kỳ nguyên nhân nào cũng gây ra không rụng trứng bằng cách ức chế đáp ứng gonadotropin với GnRH. Thiếu hụt hormone tuyến giáp ức chế sự giải phóng gonadotropin thông qua hormone ức chế gonadotropin, và cản trở tác động của gonadotropin lên buồng trứng. Lạm dụng thuốc với tetrahydrocannabinol, ethanol, hoặc opiate gây ra không rụng trứng do vùng dưới đồi. Cocaine gây ra kinh nguyệt không đều bằng cách ức chế bài tiết gonadotropin thông qua các cơ chế bao gồm sự cạn kiệt dự trữ dopaminergic, dẫn đến tăng prolactin máu, và kích thích giải phóng CRH. Bệnh viêm cấp tính làm gián đoạn đợt tăng LH do estradiol gây ra, và bệnh mãn tính gây ra thiếu hụt gonadotropin, có thể được trung gian một phần bởi suy dinh dưỡng và một phần bởi các cytokine. Các rối loạn đa dạng như đái tháo đường và quá tải sắt đều ảnh hưởng đến bài tiết GnRH. Suy thận mãn tính gây ra rối loạn chức năng phức tạp của hệ thống sinh sản, bao gồm cả việc thanh thải kém gonadotropin và prolactin khi có sự ức chế gonadotropin bởi một yếu tố không thể thẩm tách.
Tăng prolactin máu đôi khi gây ra vô kinh thứ phát mà không có suy giảm estrogen rõ rệt. Tình huống này có lẽ là kết quả của sự giảm nhẹ trong bài tiết FSH chỉ ức chế sự xuất hiện của một nang trứng trội và, do đó, là sự rụng trứng.
Vô kinh sau dùng thuốc tránh thai là một thuật ngữ được áp dụng cho tình trạng vô kinh đôi khi xảy ra sau khi sử dụng lâu dài các biện pháp tránh thai nội tiết. Điều này trong quá khứ được cho là do sự ức chế quá mức, nhưng không nên mong đợi sự ức chế quá mức là trường hợp với thế hệ thuốc tránh thai đường uống hiện nay. Khoảng một phần ba bệnh nhân bị vô kinh thứ phát sau khi ngừng thuốc chứa estrogen và progestin có tiền sử rối loạn kinh nguyệt trước đó và các vấn đề kinh nguyệt đang diễn ra. Một phần ba khác có thể mong đợi sự thuyên giảm tự phát của vô kinh. Khoảng một nửa số trường hợp còn lại sẽ có sự giải quyết rối loạn kinh nguyệt của họ sau khi mang thai được gây ra. Nguyên nhân phổ biến nhất của vô kinh sau dùng thuốc tránh thai có lẽ là tăng prolactin máu vì hơn 20% các trường hợp như vậy có tiết sữa. Tần suất điều này có trước khi uống thuốc tránh thai là không rõ. Kinh nguyệt có thể được phục hồi ở các trường hợp có prolactin bình thường bằng cách điều trị bằng dopaminergic, cho thấy rằng trong những trường hợp như vậy có sự bài tiết prolactin của tuyến yên quá mức quá tinh vi để có thể phát hiện được bằng cách đo nồng độ trong huyết thanh. Sự không rụng trứng do tránh thai bằng depot-medroxyprogesterone acetate có liên quan đến tốc độ hấp thụ và chuyển hóa cực kỳ chậm của steroid này; kinh nguyệt trở lại khi nồng độ progestin này trong máu giảm xuống dưới ngưỡng ức chế đợt tăng LH, và chỉ hiếm khi nó có liên quan đến rối loạn bài tiết prolactin.
Sự bài tiết gonadotropin hoặc hCG bởi một khối u có thể gây ra không rụng trứng với estrogen bình thường hoặc tăng. Trong một khối u sản xuất LH, nồng độ steroid sinh dục là bình thường; việc không có nam hóa được cho là do sự mất nhạy cảm của buồng trứng với LH, trong khi ở một trường hợp khác, nam hóa đã xảy ra, được cho là do hội chứng buồng trứng đa nang-tăng sản vỏ từ trước và sự tăng LH cực đoan. Các rối loạn tăng estrogen khác gây chảy máu không rụng trứng được thảo luận dưới phần Dậy thì sớm.
Không rụng trứng do vùng dưới đồi thường là một chẩn đoán loại trừ. Việc đánh giá y tế nên được thực hiện như đã thảo luận trong phần trước, với sự chú ý đặc biệt đến các khả năng gây căng thẳng cảm xúc, tập thể dục quá mức, việc sử dụng thuốc tránh thai hoặc các loại thuốc khác, và tình trạng sức khỏe. Khám thực thể nên được hướng đặc biệt đến tình trạng dinh dưỡng, các khả năng mắc bệnh nội sọ hoặc hệ thống, tiết sữa, rối loạn chức năng tuyến giáp, dư thừa glucocorticoid, rậm lông, và béo phì. Nếu quy trình làm việc này âm tính, một MRI vùng dưới đồi-tuyến yên được chỉ định. Không rụng trứng do vùng dưới đồi có thể được ghi nhận bằng cách chứng minh tần số xung LH dưới mức bình thường, nhưng điều này thường không thực tế. Nồng độ leptin có xu hướng thấp nhưng không có giá trị chẩn đoán. Đáp ứng với xét nghiệm chất chủ vận GnRH là bình thường nhưng dường như thiếu đáp ứng mồi bình thường khi xét nghiệm lặp lại. Chảy máu tử cung quá nhiều do không rụng trứng do vùng dưới đồi phải được phân biệt với chảy máu do các nguyên nhân khác (xem phần tiếp theo).
Điều trị
Nhiều bệnh nhân bị không rụng trứng do vùng dưới đồi sẽ được hưởng lợi từ tư vấn dinh dưỡng. Những người ăn kiêng lập dị và các vận động viên nên được khuyên về sự cần thiết của việc dự trữ năng lượng cơ thể tối ưu để duy trì các chu kỳ kinh nguyệt bình thường (xem Hình 16.42). Ý nghĩa mục đích luận của điều này có thể được chỉ ra, cụ thể là, vốn có trong quá trình tiến hóa là sự ức chế mang thai trong thời gian nguồn cung cấp thực phẩm không đủ. Tư vấn tâm lý liên tục được khuyến khích cho những bệnh nhân không thể thay đổi chế độ ăn uống hoặc thói quen tập thể dục của họ do một hình ảnh cơ thể bất thường. Thay thế estrogen chỉ sửa chữa một phần khoáng hóa xương trừ khi dinh dưỡng được tối ưu hóa. Tuy nhiên, nếu kinh nguyệt tự phát không trở lại sau 6 đến 12 tháng thử nghiệm cải thiện dinh dưỡng, sửa đổi chế độ tập thể dục của bệnh nhân, và/hoặc tư vấn tâm lý, nên xem xét việc sử dụng ngắn hạn estradiol qua da và progestin đường uống theo chu kỳ (không phải thuốc tránh thai đường uống hoặc ethinyl estradiol) ở những người có mật độ xương thấp để bảo vệ sức khỏe xương lâu dài của bệnh nhân. Các cô gái béo phì nên được khuyên rằng có một khả năng đáng kể rằng việc giảm cân xuống mức bình thường sẽ dẫn đến sự phục hồi kinh nguyệt và cải thiện khả năng sinh sản.
Những thanh thiếu niên trưởng thành có tình trạng vô kinh không giải thích được nên được đảm bảo rằng họ có khả năng sinh sản cao với điều trị nội tiết thích hợp. Tuy nhiên, việc điều trị như vậy không có khả năng mang lại lợi ích gì cho họ cho đến khi họ muốn có thai. Trong khi đó, mục tiêu chính của liệu pháp là bình thường hóa chu kỳ nội mạc tử cung bằng cách sử dụng progestin định kỳ. Vì mục đích này, progestin (progesterone micronized 100–200 mg uống trước khi đi ngủ trong 14 ngày liên tiếp) thường có hiệu quả trong việc gây ra các kỳ kinh do ngừng thuốc. Trong vài năm đầu sau khi có kinh, hợp lý khi sử dụng phương pháp điều trị này cách tháng để cho phép phát hiện sự trưởng thành muộn của một chu kỳ kinh nguyệt đều đặn.
Việc gây ra một chu kỳ rụng trứng đã được báo cáo là đôi khi dẫn đến sự trở lại của kinh nguyệt bình thường tự phát. Một chu kỳ rụng trứng thường có thể được gây ra bằng cách sử dụng clomiphene citrate một lần mỗi đêm trong năm liều. Nếu điều trị thành công, kinh nguyệt thường xảy ra khoảng 1 tháng kể từ khi bắt đầu điều trị. Nên bắt đầu với liều 50 mg vì liều lớn hơn có thể gây tăng kích thích buồng trứng với sự phát triển của các nang buồng trứng. Vì lý do này, nên thực hiện một cuộc siêu âm để loại trừ các nang buồng trứng trước khi chuyển sang liều 100 đến 150 mg. Tuy nhiên, phương pháp điều trị này thường không được khuyến khích ở tuổi vị thành niên. Liệu pháp dopaminergic đã được báo cáo là thành công trong việc gây ra sự trở lại của rụng trứng trong vô kinh sau dùng thuốc tránh thai, suy dinh dưỡng vừa phải, và các trường hợp vô kinh thứ phát không giải thích được khác. Nếu không, việc gây rụng trứng tốt nhất nên để cho bác sĩ phụ khoa nội tiết giám sát vào thời điểm người phụ nữ muốn có con. Phần lớn bệnh nhân không có nguyên nhân rõ ràng cho tình trạng vô kinh thứ phát của họ sẽ có thai sau khi điều trị thích hợp bằng estrogen, clomiphene, chất chủ vận dopaminergic, gonadotropin mãn kinh người, hoặc liệu pháp GnRH dạng xung.
Chảy máu Tử cung Quá nhiều do Rối loạn chức năng rụng trứng
Nguyên nhân
Chảy máu tử cung nhiều có thể xảy ra bất thường thường xuyên, như được chỉ ra bởi các khoảng thời gian dưới 21 ngày, kéo dài quá mức, như được chỉ ra bởi dòng kinh kéo dài hơn 7 ngày, hoặc nhiều, như được chỉ ra bởi việc thấm ướt hơn một băng vệ sinh hoặc tampon mỗi 2 giờ, ra cục máu đông lớn, hoặc cảm giác chảy ồ ạt (Hộp 16.2). Nó thường là do chảy máu từ một nội mạc tử cung tăng sản. Nó là một biểu hiện của rối loạn chức năng rụng trứng, có thể dẫn đến các chu kỳ không rụng trứng hoặc rụng trứng chưa trưởng thành. “Chảy máu tử cung do rối loạn chức năng” (DUB) này thường là một biểu hiện của không rụng trứng sinh lý ở tuổi vị thành niên (Hộp 16.7). Cường androgen, đặc biệt là hội chứng buồng trứng đa nang, và bệnh đông máu là những nguyên nhân phổ biến nhất gây thiếu máu nặng, có thể đe dọa tính mạng. Các nguyên nhân ít phổ biến hơn là không rụng trứng do vùng dưới đồi, các nang hoặc khối u sản xuất estrogen, suy giáp, tăng prolactin máu, và suy buồng trứng sớm sắp xảy ra. Do đó, quy trình làm việc nên bao gồm việc đo nồng độ androgen, estradiol, prolactin, tuyến giáp, gonadotropin trong huyết thanh và một cuộc đánh giá cho các rối loạn chảy máu.
Hộp 16.7. Chẩn đoán phân biệt Chảy máu sinh dục quá nhiều ở Vị thành niên
(Từ Rosenfield, R.L., Barnes, R.B. (1993). Menstrual disorders in adolescence. Endocrinol Metab Clin North Am, 22, 491.) |
Khiếm khuyết Giai đoạn Hoàng thể
Một nồng độ progesterone tối thiểu trong huyết thanh phải được tạo ra bởi hoàng thể để nội mạc tử cung duy trì sự phát triển đủ để hỗ trợ sự làm tổ. Một mức độ thấp hơn là nguyên nhân của “suy hoàng thể” là nguyên nhân gây vô sinh. Suy hoàng thể có thể biểu hiện dưới dạng các chu kỳ ngắn (< 21 ngày) với chảy máu kinh nguyệt thường xuyên hoặc là vô sinh với các chu kỳ kinh nguyệt bình thường trong đó giai đoạn hoàng thể ngắn theo sau một giai đoạn nang trứng kéo dài (xem Hình 16.35). Nó là bình thường trong những năm đầu sau có kinh.
Một yếu tố quyết định chính của sự hình thành và chức năng hoàng thể bình thường là sự phát triển tối ưu của tiền thân của hoàng thể, nang trứng trội. Suy hoàng thể có thể phát sinh từ sự thiếu hụt tinh vi của inhibin, LH hoặc FSH trong giai đoạn nang trứng, một đợt tăng LH tiền rụng trứng không đủ, hoặc sự không đáp ứng của hoàng thể với LH: tất cả những bất thường này đều gây ra sự xuất hiện không hoàn toàn của một nang trứng trội và sự hình thành sau đó của một hoàng thể không đủ. Suy hoàng thể phổ biến trong các chu kỳ sau có kinh sớm, nơi nó được coi là do sự chưa trưởng thành của rụng trứng (xem Hình 16.35) và nếu không có thể là kết quả của tăng prolactin máu, béo phì, vô kinh do vùng dưới đồi, hoặc cường androgen.
Các phép đo hàng ngày chỉ ra rằng nồng độ progesterone huyết thanh đỉnh tối thiểu thường đạt được trong giữa giai đoạn hoàng thể bình thường dao động từ 900 đến 3000 ng/dL (28–95 nmol/L). Cả các biến thể theo chu kỳ và theo giờ trong bài tiết progesterone làm cho việc ghi nhận mức độ đủ tối thiểu trở nên khó khăn. Do đó, thực hành lâm sàng hiện tại thường định nghĩa bằng chứng rụng trứng là một nồng độ progesterone trên 300 đến 500 ng/dL (9–15 nmol/L), đủ để làm tăng nhiệt độ cơ thể cơ bản: mức cắt thấp hơn trong số này cao hơn khoảng hai lần so với mức tối đa bình thường một ngày trước khi rụng trứng, và mức cao nhất trong số này không nhất thiết chỉ ra một chu kỳ rụng trứng trưởng thành bình thường. Tuy nhiên, một giá trị progesterone lớn hơn 165 ng/dL ở một thanh thiếu niên cho thấy rằng rụng trứng đã xảy ra, mặc dù không nhất thiết là một giai đoạn hoàng thể trưởng thành.
Chẩn đoán phân biệt
DUB phải được phân biệt với các nguyên nhân khác gây chảy máu sinh dục bất thường được liệt kê trong Hộp 16.7. Khả năng nó liên quan đến thai kỳ phải được xem xét và một xét nghiệm mang thai được thực hiện. Lạm dụng tình dục là một mối quan tâm hàng đầu trong chảy máu âm đạo tái phát. Các khối u đường sinh dục hoặc gây nữ hóa đặc trưng gây ra chảy máu không thể kiểm soát bằng liệu pháp progestin hoặc estrogen-progestin theo chu kỳ. Dòng kinh nguyệt nặng bất thường ở thanh thiếu niên thường là vô căn (“rong kinh thiết yếu”); nó được lý thuyết hóa là kết quả của sự mất cân bằng của tác động prostanoid gây giãn mạch và co mạch lên nội mạc tử cung. Tuy nhiên, các nguyên nhân bệnh lý phải được xem xét vì các rối loạn chảy máu có mặt ở khoảng 20% thanh thiếu niên bị rong kinh cần nhập viện và ở 50% những người có biểu hiện khi có kinh. Bệnh nhân cần nhập viện vì chảy máu bất thường nên được thực hiện đếm tiểu cầu, thời gian prothrombin, thời gian thromboplastin một phần, thời gian chảy máu, và nồng độ yếu tố von Willebrand. Siêu âm qua ngã âm đạo, thường không khả thi ở thanh thiếu niên còn trinh, đáng tin cậy như nội soi tử cung trong việc xác định xem khoang nội mạc tử cung có bình thường hay không.
Việc nồng độ progesterone huyết thanh không tăng trên 500 ng/dL trong giai đoạn hoàng thể là chẩn đoán suy hoàng thể với độ chính xác 71%. Tuy nhiên, một nồng độ progesterone cao hơn mức này phải được duy trì để biến đổi nội mạc tử cung đủ để hỗ trợ sự làm tổ.
Điều trị
Các tác nhân chống viêm không steroid có thể làm giảm DUB. Một thuốc tránh thai đường uống estrogen-progestin với 35 mcg ethinyl estradiol là phương pháp điều trị hàng đầu để cầm máu do rối loạn chức năng cấp tính hoặc liên quan đến thiếu máu. Đối với chảy máu đang hoạt động, liều lượng được tăng nhanh cho đến khi ngừng chảy máu, tối đa 4 lần mỗi ngày, và sau đó duy trì trong 7 ngày. Điều trị sau đó được ngừng trong 5 ngày, và bệnh nhân được cảnh báo rằng chảy máu do ngừng thuốc nhiều với chuột rút có thể xảy ra. Liệu pháp với một viên thuốc liều thấp, được dùng như để tránh thai, sau đó được bắt đầu để ngăn ngừa tái phát chảy máu do rối loạn chức năng và được tiếp tục trong khoảng 3 chu kỳ. Hemoglobin nên được theo dõi và bổ sung sắt được kê đơn.
Progestin theo chu kỳ có thể được sử dụng như một sự thay thế cho OCP để ngăn ngừa chảy máu do rối loạn chức năng tái phát ở một bệnh nhân không hoạt động tình dục. Progesterone micronized 100 đến 200 mg/ngày trong 1 tuần được dùng ở các khoảng thời gian từ 3 đến 4 tuần. Sau tháng thứ ba, liệu pháp được ngừng và bệnh nhân được quan sát trong 1 đến 2 tháng để tìm chảy máu tự phát. Nếu không có gì xảy ra, progestin có thể được dùng cách tháng (ví dụ, medroxyprogesterone 5–10 mg) trong 7 đến 14 ngày để ngăn ngừa chảy máu do rối loạn chức năng tái phát. Nếu trong tháng không dùng progestin, một kỳ kinh tự phát bình thường xảy ra, progestin được giữ lại trong tháng tiếp theo để xác định xem bệnh nhân có phát triển các chu kỳ rụng trứng đều đặn hay không.
Bất ổn huyết động do mất máu nặng và/hoặc cấp tính là một chỉ định nhập viện và điều trị bằng một loại thuốc chống tiêu sợi huyết (ví dụ, axit aminocaproic 100 mg/kg hoặc axit tranexamic 10 mg/kg) được bắt đầu tiêm tĩnh mạch, và dịch truyền tĩnh mạch và các sản phẩm máu nếu cần. Premarin® có thể được sử dụng với liều 25 mg tiêm tĩnh mạch mỗi 3 đến 4 giờ cho 3 đến 4 liều. Khi điều trị nội khoa thất bại, nên xem xét một bệnh lý chảy máu hoặc một bất thường cấu trúc tử cung (xem sau). Nếu chảy máu nhiều vẫn tiếp diễn, mặc dù đã điều trị bằng nội tiết tố và chống tiêu sợi huyết, can thiệp phẫu thuật được chỉ định bởi một bác sĩ phụ khoa.
Rong kinh không giải thích được (“thiết yếu”) được điều trị gần giống như đau bụng kinh. Liệu pháp OCP sẽ làm giảm lượng máu kinh mất khoảng 50% ở những phụ nữ này. Các thuốc chống prostaglandin, chẳng hạn như naproxen 500 mg hai lần một ngày, làm giảm lượng máu mất gần như hiệu quả tương tự.
Các triệu chứng quanh kỳ kinh
Đau bụng kinh
Chuột rút tử cung là đặc trưng của các chu kỳ rụng trứng bình thường, dường như là kết quả của việc giải phóng prostaglandin trong nội mạc tử cung khi ngừng progesterone. Đau khi có kinh trở thành một nguồn gây bệnh ở 14% thanh thiếu niên. Khi đau cấp tính và khác về chất so với cơn đau kinh nguyệt thông thường, phải xem xét đến thai ngoài tử cung. Một thai ngoài tử cung thường gây chảy máu âm đạo xảy ra muộn hơn 2.5 tuần so với thời điểm dự kiến của kỳ kinh tiếp theo và thường nhẹ. Tuy nhiên, chảy máu có thể nhiều và do đó giống như một đợt chảy máu tử cung do rối loạn chức năng. Thai ngoài tử cung thường có thể chẩn đoán được bằng sự kết hợp của siêu âm, nồng độ β-hCG huyết thanh trên 1000 IU/L, và nồng độ progesterone dưới 2500 ng/dL.
Ở những bệnh nhân bị đau vùng chậu mãn tính không đáp ứng với các thuốc chống prostaglandin hoặc OCP, có thể có yếu tố tâm lý, nhưng cần chú ý đến khả năng bị lạc nội mạc tử cung, tắc nghẽn đường ra của tử cung, các khối u đường phụ khoa, hoặc thực thể được định nghĩa kém là đau âm hộ. Siêu âm và nội soi ổ bụng có thể được chỉ định để đánh giá thêm những bệnh nhân này. Lạc nội mạc tử cung là một rối loạn phụ thuộc estrogen chiếm khoảng một nửa số trường hợp đau vùng chậu mãn tính ở thanh thiếu niên. Các yếu tố di truyền và tắc nghẽn bẩm sinh của đường sinh dục có khuynh hướng gây lạc nội mạc tử cung, và sự hình thành estradiol bất thường trong mô đệm nội mạc tử cung đã bị quy kết trong cơ chế bệnh sinh. Liệu pháp chủ vận GnRH được chấp thuận để giảm triệu chứng, nhưng thanh thiếu niên có nguy cơ mất xương đặc biệt, và liệu pháp progestin có thể là một giải pháp thay thế hiệu quả.
Đau bụng kinh có thể được cải thiện bằng liệu pháp chống prostaglandin. Naproxen (275 mg 4 lần mỗi ngày [QID] sau một liều nạp 550 mg) đã được chứng minh là vượt trội so với aspirin (650 mg QID) hoặc giả dược khi bắt đầu 2 ngày trước khi dự kiến bắt đầu có kinh. OCP là một giải pháp thay thế sẽ làm giảm đau bụng kinh ở khoảng 90% các trường hợp bằng cách giảm khối lượng nội mạc tử cung. Vì hút thuốc, uống rượu, và thừa cân là các yếu tố nguy cơ, tư vấn về lối sống là nên làm.
Hội chứng Tiền kinh nguyệt
Đây là thuật ngữ được áp dụng khi những thay đổi tâm trạng theo chu kỳ chỉ giới hạn ở nửa sau của chu kỳ kinh nguyệt trở nên suy nhược. Nó thường gây rối loạn chức năng cá nhân, xã hội, và nghề nghiệp của phụ nữ. Nếu các triệu chứng thay đổi tâm trạng rõ rệt, tâm trạng chán nản, lo âu, và cáu kỉnh xảy ra, nó được phân loại là rối loạn khó chịu tiền kinh nguyệt. Các triệu chứng thần kinh-tâm thần có thể bao gồm động kinh và hành vi kỳ quái. Những điều này dường như đại diện cho các phản ứng bất thường đối với những thay đổi nội tiết tố theo chu kỳ bình thường. Sự kích hoạt dưới mức bình thường của trục dưới đồi-tuyến yên-thượng thận để đáp ứng với progesterone đã được tìm thấy. Một số bằng chứng chỉ ra rằng sự thay đổi trong mức độ chuyển hóa progesterone thành các steroid có hoạt tính thần kinh ảnh hưởng đến mức độ nghiêm trọng của các triệu chứng. Liệu pháp tránh thai đường uống với progestin chống mineralocorticoid drospirenone được chỉ định nếu liệu pháp tâm thần không thành công. Việc điều hòa giảm bài tiết gonadotropin của tuyến yên bằng liệu pháp chủ vận GnRH có hiệu quả, nhưng tính hữu dụng của nó bị hạn chế bởi các tác dụng phụ của sự thiếu hụt estrogen. Mối quan hệ của hội chứng tiền kinh nguyệt với các triệu chứng khác của giai đoạn hoàng thể, chẳng hạn như sốt tái phát và các triệu chứng tự miễn, có thể liên quan đến sự tăng đáp ứng của các cytokine với progesterone.
Cường androgen ở Vị thành niên
Cường androgen ở mức độ từ nhẹ đến trung bình là nguyên nhân phổ biến nhất của bất thường kinh nguyệt với estrogen bình thường và/hoặc rậm lông dai dẳng. Cường androgen phát triển trong tuổi vị thành niên thường là do hội chứng buồng trứng đa nang (PCOS), nhưng chẩn đoán phân biệt của cường androgen bao gồm các rối loạn buồng trứng hoặc thượng thận khác, sự hình thành androgen ngoại vi bất thường, và thuốc (xem Hộp 16.8).
Nguyên nhân
Định nghĩa của PCOS đã phát triển kể từ khi được Stein và Leventhal mô tả như một hội chứng vô kinh và buồng trứng đa nang, thường đi kèm với rậm lông, mụn trứng cá, và/hoặc béo phì. Trong những thập kỷ gần đây, các tiêu chí chẩn đoán được chấp nhận quốc tế đã được phát triển cho người lớn dựa trên các sự kết hợp khác nhau của cường androgen không giải thích được, không rụng trứng, và buồng trứng đa nang, tất cả đều được bao gồm trong các tiêu chí đồng thuận Rotterdam. Các tiêu chí này tạo ra bốn kiểu hình, được liệt kê ở đây theo thứ tự giảm dần của độ đặc hiệu chẩn đoán của các kiểu hình (Hộp 16.9) làm nền tảng cho các cuộc tranh cãi trong việc chấp nhận các loại nhẹ hơn. Kháng insulin, béo phì, và dư thừa LH, mặc dù không phải là các đặc điểm chẩn đoán của hội chứng, là phổ biến và góp phần vào cơ chế bệnh sinh của nó; giống như cường androgen, mức độ nghiêm trọng của chúng thường được chứng minh là tương quan với độ đặc hiệu. Vào năm 2015, các tiêu chí chẩn đoán đồng thuận cho PCOS ở thanh thiếu niên đã được phát triển bởi các hội chuyên khoa nhi quốc tế: đây là một sự sửa đổi phù hợp với lứa tuổi và giai đoạn của “tiêu chí của Viện Y tế Quốc gia” (tức là, không rụng trứng cường androgen dai dẳng không giải thích được) (xem Hộp 16.9).
| Hộp 16.8. Các nguyên nhân gây Cường androgen ở Vị thành niên
Không rụng trứng sinh lý ở Vị thành niên Cường androgen chức năng của Tuyến sinh dục
(Chỉnh sửa với sự cho phép từ Buggs, C., Rosenfield, R.L. (2005). Polycystic ovary syndrome in adolescence. Endocrinol Metab Clin North Am, 34, 677–705.) |
Các tiêu chí đồng thuận cho thanh thiếu niên cố gắng tạo ra sự cân bằng giữa việc chẩn đoán thiếu và chẩn đoán thừa hội chứng này. Thanh thiếu niên bình thường thường có các chu kỳ kinh nguyệt bất thường theo tiêu chuẩn người lớn, do đó các tiêu chí không rụng trứng phải phù hợp với lứa tuổi và giai đoạn dậy thì (xem Hộp 16.2). Sự tồn tại của bất thường kinh nguyệt là cần thiết để tránh chẩn đoán nhầm không rụng trứng sinh lý ở thanh thiếu niên thành PCOS. Không giống như các tiêu chuẩn người lớn, rậm lông nhẹ không phải là một tiêu chí cho cường androgen vì một nửa số trường hợp cường androgen nhẹ không có bất thường kinh nguyệt là một biến thể bình thường. Hình thái buồng trứng đa nang (PCOM) không phải là một tiêu chí vì nhiều thanh thiếu niên bình thường đáp ứng các tiêu chí PCOM của người lớn và các tiêu chuẩn cho thanh thiếu niên chưa được xác định rõ ràng.
Biểu hiện lâm sàng
PCOS ở thanh thiếu niên giống với PCOS ở người lớn, với sự không đồng nhất về lâm sàng và nội tiết tương tự. Các triệu chứng chính thường bắt đầu khi đạt được nồng độ gonadotropin trưởng thành, trong giai đoạn quanh có kinh, do đó PCOS đã được ghi nhận ở trẻ em nhỏ nhất là 10 tuổi. Các trường hợp bị “PCOS có rụng trứng” có một bất thường rụng trứng tinh vi không được chú ý cho đến khi có biểu hiện ở tuổi trưởng thành với vô sinh không giải thích được hoặc sảy thai tái phát.
Bất thường kinh nguyệt có triệu chứng dai dẳng (vô kinh nguyên phát hoặc thứ phát, kinh thưa-vô kinh, hoặc chảy máu tử cung quá nhiều) (xem Hộp 16.2) ở một bé gái được nữ hóa bình thường có thể là biểu hiện duy nhất của cường androgen. Trong khoảng một phần ba các trường hợp, rối loạn chức năng kinh nguyệt xảy ra mà không có các biểu hiện trên da.
Một mô hình kinh nguyệt bất thường thường là bằng chứng của kinh thưa và không rụng trứng. Mô hình kinh nguyệt nên được giải thích trong bối cảnh tuổi phụ khoa của bệnh nhân (xem Hộp 16.2), như đã thảo luận trước đó trong phần Không rụng trứng sinh lý ở Vị thành niên. Mặc dù sự tồn tại của bất thường kinh nguyệt trong 2 năm là cần thiết để chẩn đoán PCOS ở một thanh thiếu niên (xem Hộp 16.9), một chẩn đoán tạm thời có thể—và nên—được đưa ra trong vòng 1 năm trong những trường hợp cần điều trị. PCOS là một trạng thái vô sinh tương đối, không phải tuyệt đối, trong đó rụng trứng thường xảy ra không thể đoán trước và, mặt khác, trong đó sự đều đặn của kinh nguyệt không nhất thiết chỉ ra sự đều đặn của rụng trứng.
Các dấu hiệu trên da của cường androgen là các biểu hiện thay đổi của sự dư thừa androgen. Chúng có mặt ở khoảng hai phần ba các trường hợp. Rậm lông là biểu hiện phổ biến nhất ở đơn vị nang lông-tuyến bã. Tuy nhiên, mụn trứng cá, hoặc hiếm khi là tăng tiết bã nhờn hoặc hói đầu, có thể là biểu hiện duy nhất ở đơn vị nang lông-tuyến bã của cường androgen.
Rậm lông được định nghĩa trên lâm sàng là lông vĩnh viễn mọc quá nhiều theo kiểu nam giới (lông sinh dục). Nó thường được phân loại theo hệ thống Ferriman-Gallwey dựa trên nội tiết tố, định lượng mức độ phát triển của lông ở các khu vực nhạy cảm với androgen nhất (xem Hình 16.46). Điểm số bình thường thấp hơn ở một số quần thể châu Á và cao hơn ở các quần thể Địa Trung Hải, gốc Tây Ban Nha, và Trung Đông.
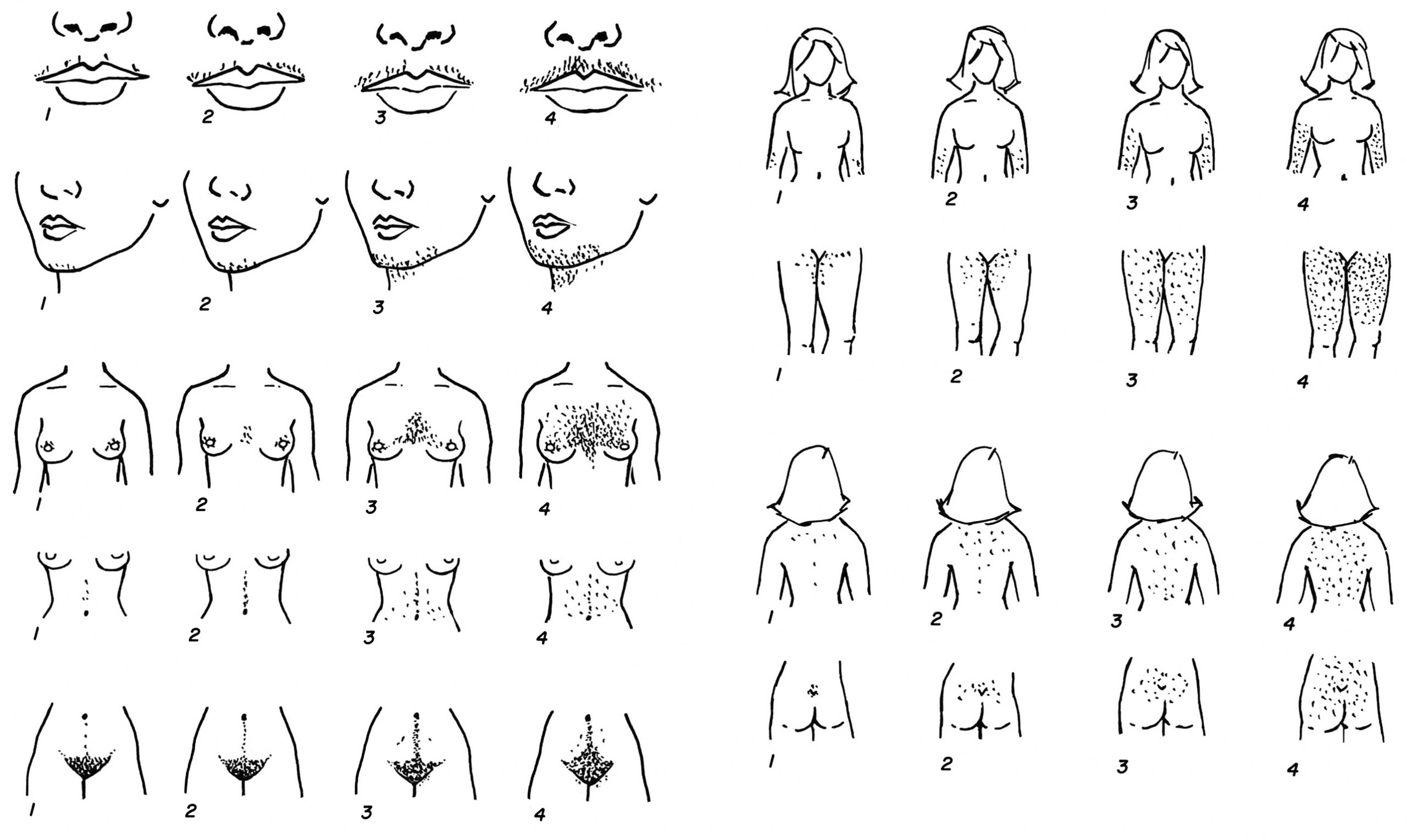
Hình 16.46. Hệ thống chấm điểm rậm lông Ferriman-Gallwey. Mỗi trong số chín vùng cơ thể nhạy cảm nhất với androgen được gán một điểm từ 0 (không có lông) đến 4 (nam hóa rõ rệt), và chúng được cộng lại để cung cấp một điểm số rậm lông do nội tiết tố. Rậm lông lan tỏa (điểm ≥ 8) là bất thường trong dân số chung của Hoa Kỳ, trong khi sự phát triển lông quá mức cục bộ (điểm 1–7) là một biến thể bình thường phổ biến có thể quan trọng về mặt thẩm mỹ đối với bệnh nhân. Điểm số bình thường thấp hơn ở một số quần thể châu Á và cao hơn ở các quần thể Địa Trung Hải, gốc Tây Ban Nha, và Trung Đông (xem văn bản). (Từ Hatch, R., Rosenfield, R.L., Kim, M.H., Tredway, D. (1981). Hirsutism: implications, etiology, and management. Am J Obstet Gynecol, 140, 816–830. Với sự cho phép.)
Sự vắng mặt của rậm lông ở khoảng một phần ba người lớn bị cường androgen dường như là do sự nhạy cảm tương đối thấp của đơn vị nang lông-tuyến bã của họ với androgen. Do đó, cường androgen máu hóa sinh có thể hoàn toàn khó nhận biết, không biểu hiện cả dấu hiệu trên da lẫn các triệu chứng không rụng trứng. Ngược lại, rậm lông không có nồng độ androgen lưu hành tăng cao hoặc bằng chứng lâm sàng khác của cường androgen—”rậm lông vô căn”—chiếm khoảng một nửa số trường hợp rậm lông nhẹ và một phần sáu số trường hợp rậm lông trung bình-nặng.
Mặc dù mụn trứng cá dạng nhân là phổ biến ở các bé gái vị thành niên, các tổn thương mụn trứng cá viêm từ trung bình đến nặng (> 10) ở bất kỳ vùng da nào là không phổ biến trong những năm quanh tuổi có kinh và là một chỉ định để xét nghiệm cường androgen máu.
Gai đen, một biểu hiện của tăng insulin kháng insulin, và béo phì liên quan là những than phiền chính trong khoảng một phần ba các trường hợp, đôi khi trước khi các bất thường kinh nguyệt phát triển. Khoảng một nửa số bệnh nhân PCOS bị béo phì. Béo phì đôi khi bắt đầu vào giữa thời thơ ấu. Hàm lượng mỡ trung tâm cơ thể tăng độc lập với BMI, và ít nhất một phần ba bệnh nhân PCOS có cân nặng bình thường có tăng mỡ trong ổ bụng.
Biểu hiện Xét nghiệm
Sự tăng dai dẳng của testosterone huyết thanh trên các tiêu chuẩn người lớn trong một phòng thí nghiệm tham chiếu đáng tin cậy là bằng chứng tốt nhất của cường androgen (Hộp 16.9). Bản chất có vấn đề của nhiều xét nghiệm androgen được thảo luận sau trong phần Chẩn đoán phân biệt. Testosterone tự do trong huyết thanh tăng là chỉ số nhạy nhất của cường androgen máu vì phần có hoạt tính sinh học của testosterone huyết thanh là phần tự do. Nồng độ SHBG huyết thanh chi phối phần testosterone tự do; chúng bị giảm bởi béo phì và chính sự dư thừa androgen. Nồng độ androstenedione và DHEAS huyết thanh thường tăng trong PCOS và nên được đo nếu nghi ngờ mạnh mẽ về sự dư thừa androgen mặc dù nồng độ testosterone toàn phần và tự do bình thường. Nồng độ DHT huyết thanh có ít giá trị chẩn đoán.
| Hộp 16.9. Tiêu chí Chẩn đoán Hội chứng Buồng trứng Đa nang
Tiêu chí Chẩn đoán Người lớn (Rotterdam) Các kiểu hình thay thế không giải thích được: A. Kiểu hình 1 (“Hội chứng buồng trứng đa nang [PCOS] cổ điển”/”Hội chứng Stein-Leventhal”) a a. Bằng chứng lâm sàng và/hoặc hóa sinh của cường androgen b. Bằng chứng của kinh thưa-không rụng trứng c. Bằng chứng siêu âm của một buồng trứng đa nang B. Kiểu hình 2 (Tiêu chí Thiết yếu của Viện Y tế Quốc gia) a a. Bằng chứng lâm sàng và/hoặc hóa sinh của cường androgen b. Bằng chứng của kinh thưa-không rụng trứng C. Kiểu hình 3 (“PCOS có rụng trứng”) a. Bằng chứng lâm sàng và/hoặc hóa sinh của cường androgen b. Bằng chứng siêu âm của một buồng trứng đa nang D. Kiểu hình 4 (PCOS không cường androgen) a. Bằng chứng của kinh thưa-không rụng trứng b. Bằng chứng siêu âm của một buồng trứng đa nang Tiêu chí Chẩn đoán Vị thành niên Sự kết hợp không giải thích được của:
(Chỉnh sửa và tái bản với sự cho phép từ Rosenfield, R.L. (2015). The diagnosis of polycystic ovary syndrome in adolescents. Pediatrics, 136, 1154–1165.) |
Một loại cường androgen buồng trứng chức năng (FOH nguyên phát) độc đáo có thể được ghi nhận ở 85% các trường hợp PCOS bằng các xét nghiệm đặc hiệu về chức năng androgen của buồng trứng. Xét nghiệm chất chủ vận GnRH và xét nghiệm hCG đánh giá đáp ứng của tuyến sinh dục với, tương ứng, sự giải phóng gonadotropin nội sinh hoặc việc sử dụng hCG tương tự LH ngoại sinh. Ở hai phần ba bệnh nhân PCOS, các xét nghiệm này cho thấy một mô hình đặc biệt của sự tăng đáp ứng sinh steroid của buồng trứng, trong đó sự tăng đáp ứng của 17-OHP là dấu hiệu tốt nhất; không có bằng chứng về một khối steroidogenic, và, thực sự, estradiol tăng đáp ứng đáng kể. Xét nghiệm ức chế androgen bằng dexamethasone (DAST)—dựa trên nguyên tắc rằng nồng độ androgen còn lại sau khi ức chế chức năng thượng thận bằng cách sử dụng glucocorticoid thường phát sinh từ buồng trứng—cho thấy testosterone tăng sau DAST ở 80% bệnh nhân PCOS: điều này bao gồm hầu hết những người có sự tăng đáp ứng 17-OHP đối với kích thích gonadotropin và hai phần ba những người không có nó. Những xét nghiệm này chỉ được chỉ định trong trường hợp chẩn đoán không chắc chắn.
Một khiếm khuyết sinh steroid thượng thận liên quan được tìm thấy ở 25% đến 50% PCOS: cường androgen thượng thận chức năng nguyên phát (FAH). Điều này được chỉ ra bởi sự tăng đáp ứng DHEA đối với ACTH; điều này tương quan (r = 0.7) với sự tăng DHEAS. FAH đơn độc là khiếm khuyết sinh steroid duy nhất ở khoảng 5% PCOS.
Việc xác định và ý nghĩa lâm sàng của PCOM đặt ra những vấn đề nan giải. Về mặt siêu âm, PCOM đã được định nghĩa ở người lớn theo các tiêu chí đồng thuận là một buồng trứng có thể tích lớn hơn 10.0 cc theo một công thức đơn giản hóa hoặc số lượng nang trứng có hốc nhỏ (đường kính 2–9 mm) từ 12 trở lên mỗi buồng trứng. Tuy nhiên, các tiêu chí này đã trở nên có vấn đề ở người trưởng thành trẻ tuổi, đặc biệt là vì các kỹ thuật hình ảnh âm đạo độ nét cao mới hơn cho thấy rằng số lượng nang trứng có hốc nhỏ lên đến 24 là bình thường. Các tiêu chí PCOM của người lớn đặc biệt có vấn đề khi áp dụng cho thanh thiếu niên. Một điều là, không thể xác định được một số lượng nang trứng có hốc chính xác bằng phương pháp siêu âm qua ổ bụng cần thiết ở thanh thiếu niên còn trinh. Hơn nữa, dữ liệu hiện tại cho thấy rằng thể tích buồng trứng và số lượng nang trứng có hốc ở thanh thiếu niên hơi cao hơn ở người lớn. Do đó, một phần ba đến một nửa số thanh thiếu niên bình thường đáp ứng các tiêu chí người lớn cho PCOM. Cho đến khi nghiên cứu sâu hơn thiết lập các tiêu chí dứt khoát, bằng chứng hiện tại cho thấy rằng thể tích buồng trứng trung bình 12 cc (hoặc một buồng trứng duy nhất > 15 cc) nên được coi là to ở thanh thiếu niên, và PCOM không phải là một tiêu chí chẩn đoán cho PCOS ở thanh thiếu niên.
PCOM có liên quan thay đổi với cường androgen. Một mặt, nó vắng mặt ở 5% đến 20% PCOS ở người lớn. Mặt khác, PCOM là một phát hiện phổ biến ở những phụ nữ khỏe mạnh. Khi đã cẩn thận loại trừ những người có các đặc điểm PCOS, khoảng một phần tư số tình nguyện viên bình thường có PCOM có rối loạn chức năng androgen của buồng trứng cận lâm sàng nhẹ nằm trong khoảng PCOS; người ta đã giả thuyết rằng đây là những người mang gen PCOS hoặc có nguy cơ mắc PCOS.
Nồng độ AMH có liên quan độc lập với PCOM, vì chúng chỉ ra một số lượng nang trứng đang phát triển nhỏ tăng lên, và với cường androgen. Mặc dù một nồng độ AMH tăng nhẹ là phổ biến ở những phụ nữ không có triệu chứng có PCOM và đã được đề xuất như một chỉ số thay thế của nó, sự tăng AMH từ hai lần trở lên trên giới hạn bình thường trên gợi ý PCOS với độ đặc hiệu cao.
LH huyết thanh và tỷ lệ LH/FSH tăng ở khoảng một nửa số đối tượng PCOS. Bằng chứng tích lũy cho thấy rằng nồng độ LH trong PCOS được quyết định bởi mức độ nghiêm trọng của cường androgen máu, các mức độ vừa phải của nó kích thích sản xuất LH, và mức độ béo phì, làm giảm nồng độ LH.
Kháng insulin trong PCOS là đáng kể độc lập với béo phì. Kháng insulin tương tác với béo phì và tuổi tác để gây ra hội chứng chuyển hóa, mang lại nguy cơ mắc bệnh tim mạch, rối loạn nhịp thở khi ngủ, và bệnh gan nhiễm mỡ không do rượu.
Khoảng một nửa số bệnh nhân PCOS có một mức độ kháng insulin bất thường, và khoảng một nửa trong số này có hội chứng chuyển hóa. Kháng insulin, được xác định bằng kẹp euglycemic, có mặt ở 50% thanh thiếu niên béo phì bị PCOS so với nhóm đối chứng phù hợp với BMI (75% so với nhóm đối chứng có BMI bình thường) và khoảng một nửa số bé gái như vậy có hội chứng chuyển hóa. Do đó, thanh thiếu niên bị PCOS có nguy cơ giảm dung nạp glucose tăng lên. Họ cũng có khuynh hướng bị rối loạn chức năng tế bào beta tuyến tụy của đái tháo đường týp 2. Tỷ lệ rối loạn lipid máu thường thấp, nhưng nó có liên quan đến mức độ béo phì và kháng insulin.
Sinh lý bệnh
PCOS thông thường dường như là do sự dư thừa androgen trong buồng trứng (xem Hình 16.47). FOH nguyên phát chiếm phần lớn (khoảng 85%) các trường hợp PCOS (Hình 16.48). PCOS chức năng điển hình, chiếm hai phần ba các trường hợp, là do FOH điển hình, xảy ra do một loại rối loạn chức năng sinh steroid độc đáo, sự rối loạn điều hòa sinh steroid. Một sự rối loạn điều hòa thượng thận liên quan, FAH, xảy ra ở cả FOH điển hình và không điển hình.
Hình 16.47 Mô hình tối thiểu thống nhất về sinh lý bệnh của hội chứng buồng trứng đa nang (PCOS). Bảng A: Cường androgen buồng trứng chức năng (FOH) có mặt ở gần 90% các trường hợp PCOS và có thể giải thích tất cả các đặc điểm lâm sàng chính của hội chứng: cường androgen máu, kinh thưa-không rụng trứng, và buồng trứng đa nang (bước 1). Sự bài tiết hormone tạo hoàng thể (LH) của tuyến yên là cần thiết để duy trì sự dư thừa androgen của buồng trứng, nhưng nó không đủ để gây ra nó. Bảng B: Khoảng một nửa số bệnh nhân bị FOH có một mức độ tăng insulin kháng insulin bất thường (bước 2). Tăng insulin kháng insulin tác động lên các tế bào vỏ để làm trầm trọng thêm tình trạng cường androgen, hiệp đồng với androgen trong việc hoàng thể hóa sớm các tế bào hạt, và kích thích sự tích tụ mỡ. Tình trạng cường androgen máu tăng lên gây ra sự dư thừa LH, sau đó tác động lên cả tế bào vỏ và tế bào hạt đã được hoàng thể hóa để làm trầm trọng thêm tình trạng cường androgen (bước 3). LH cũng kích thích các tế bào hạt đã được hoàng thể hóa để bài tiết estradiol (bước 4), ức chế sự bài tiết hormone kích thích nang trứng (FSH). Những thay đổi này do tăng insulin khởi xướng trong chức năng tế bào hạt càng làm trầm trọng thêm hình thái buồng trứng đa nang (PCOM) và cản trở sự rụng trứng hơn nữa. Béo phì làm tăng kháng insulin, và sự tăng insulin do đó làm trầm trọng thêm tình trạng cường androgen (bước 5). Chữ đậm và phông chữ lớn hơn thể hiện mức độ nghiêm trọng lớn hơn. Cả FOH và kháng insulin thường có một cơ sở nội tại. Mô hình này không loại trừ khả năng rằng các khiếm khuyết buồng trứng nội tại chưa biết làm nền tảng cho rối loạn chức năng sinh steroid của buồng trứng cũng liên quan đến sự hình thành nang trứng của tế bào hạt và các hệ thống khác. Hình này cũng không mô tả các khiếm khuyết liên quan khác, chẳng hạn như cường androgen thượng thận chức năng thường đi kèm với cường androgen buồng trứng và sự đóng góp của lượng mỡ dư thừa vào việc sản xuất androgen ngoại vi và ức chế gonadotropin. (Chỉnh sửa từ Rosenfield, R.L., Ehrmann, D.A. (2016). The pathogenesis of polycystic ovary syndrome (PCOS): the hypothesis of PCOS as functional ovarian hyperandrogenism revisited. Endocr Rev, 37, 467–520. Với sự cho phép.)
Hình 16.48 Phân loại chức năng của hội chứng buồng trứng đa nang (PCOS) liên quan đến nguồn androgen và tỷ lệ hiện mắc của nó. Hầu hết PCOS (85%) là do cường androgen buồng trứng chức năng nguyên phát (FOH); khoảng 30% trong số này có cường androgen thượng thận chức năng nguyên phát đi kèm. Khoảng hai phần ba PCOS có PCOS chức năng điển hình, tức là, họ có FOH điển hình, được đặc trưng bởi sự tăng đáp ứng của 17-OHP đối với xét nghiệm GnRHag hoặc hCG. Một phần ba còn lại của các trường hợp PCOS có PCOS chức năng không điển hình, thiếu sự tăng đáp ứng 17-OHP. Hầu hết trong số này có FOH chức năng không điển hình, trong đó sự dư thừa androgen buồng trứng được chỉ ra bằng một xét nghiệm ức chế androgen bằng dexamethasone. Một số lượng nhỏ (5%) là do cường androgen thượng thận chức năng đơn độc. Trong một số ít trường hợp, nguồn androgen không thể được xác định là buồng trứng hay thượng thận: hầu hết trong số này có PCOS chức năng không điển hình của béo phì (5%); nguồn androgen không giải thích được (vô căn) ở ít hơn 20% nhóm PCOS chức năng không điển hình ((≥5)% của PCOS). 17-OHP, 17-Hydroxyprogesterone. (Chỉnh sửa và tái bản với sự cho phép từ Rosenfield, Polycystic ovary syndrome in adolescents. In: Rose BD, ed. UpToDate: 2014. Waltham, MA, www.uptodate.com/index.)
FOH điển hình được đặc trưng bởi sự tăng đáp ứng sinh steroid tổng quát đối với LH, trong đó 17-OHP là dấu hiệu nhất quán nhất. Một phần ba PCOS là không điển hình về mặt chức năng, ở chỗ bất thường 17-OHP không thể chứng minh được. Một nửa trong số này có FOH chức năng không điển hình, có thể xác định được bằng sự ức chế androgen dưới mức bình thường bởi dexamethasone. Trong phần còn lại, chiếm một thiểu số nhỏ (15%) các trường hợp PCOS, một nguồn buồng trứng cho sự dư thừa androgen, không thể chứng minh được. Sự dư thừa androgen của những trường hợp PCOS chức năng không điển hình sau này dường như phát sinh từ FAH đơn độc ở khoảng một phần ba các trường hợp và từ béo phì ở hầu hết phần còn lại. Đây là những ngoại lệ đối với quy tắc chung rằng sự dư thừa androgen ngoài buồng trứng vừa phải không cản trở chức năng buồng trứng.
Sự rối loạn điều hòa sinh steroid dường như là kết quả của sự mất cân bằng giữa các yếu tố nội tại và ngoại tại khác nhau liên quan đến sự điều biến của tác động hormone dinh dưỡng. Trong buồng trứng, dường như có những sai sót trong các quá trình thường phối hợp bài tiết androgen và estrogen để đáp ứng với kích thích gonadotropin (xem Hình 16.19). Các tế bào vỏ từ buồng trứng đa nang của bệnh nhân PCOS cổ điển được nuôi cấy lâu dài có một sự rối loạn điều hòa sinh steroid nội tại có thể giải thích cho những bất thường sinh steroid này: các tế bào này biểu hiện quá mức hầu hết các enzyme sinh steroid một cách cấu thành, nổi bật nhất ở mức độ hoạt động của 17-hydroxylase và 17,20-lyase, cả hai đều là thuộc tính của P450c17, là các bước giới hạn tốc độ trong quá trình sinh tổng hợp các tiền chất testosterone. Giống như trong buồng trứng, sự rối loạn điều hòa của các quá trình điều hòa sinh steroid tại chỗ trong vỏ thượng thận dường như gây ra một loại FAH nguyên phát đặc trưng trong đó dehydroepiandrosterone dư thừa được hình thành để đáp ứng với ACTH như một sản phẩm phụ của bài tiết cortisol.
Là hệ quả của sự rối loạn điều hòa sinh steroid, các tế bào vỏ PCOS không trải qua sự mất nhạy cảm tương đồng bình thường đối với LH với sự điều hòa giảm sinh steroid để đáp ứng với sự kích thích LH dư thừa. Do đó, chúng quá nhạy cảm với sự kích thích LH. “Thoát khỏi” sự mất nhạy cảm tương đồng đối với dư thừa LH dường như là cơ sở cho mô hình đặc biệt của sự tăng đáp ứng sinh steroid đối với xét nghiệm chất chủ vận GnRH hoặc hCG, được đặc trưng bởi sự tăng đáp ứng không tương xứng của 17-OHP so với các steroid buồng trứng khác mà không có bằng chứng về một khối steroidogenic.
Các chức năng của tế bào hạt cũng bị khiếm khuyết trong PCOS. Sự hình thành nang trứng của các nang trứng nhỏ là quá mức, được cho là do sự dư thừa androgen, mặc dù không thể loại trừ một khiếm khuyết tế bào hạt nguyên phát, giải thích cho việc sản xuất AMH dư thừa. Sự tăng đáp ứng inhibin-B đối với FSH cũng dường như làm trầm trọng thêm sự bài tiết androgen của tế bào vỏ thông qua một tác động paracrine và cũng góp phần làm giảm sản xuất FSH.
Lý do cho tỷ lệ béo phì cao trong PCOS không hoàn toàn rõ ràng. Béo phì làm tăng kháng insulin, và lần lượt sự tăng insulin kháng insulin dường như tăng cường béo phì vì tín hiệu insulin trong mô mỡ dưới da của người vẫn còn nguyên vẹn trong PCOS. Các cơ chế mà béo phì gây ra kháng insulin cũng không rõ ràng, nhưng chúng bao gồm các adipokine nhạy cảm với insulin thiếu hụt, chẳng hạn như adiponectin, và các cytokine tiền viêm dư thừa, chẳng hạn như TNF-alpha, vừa làm trầm trọng thêm kháng insulin và cường androgen, được bài tiết bởi các đại thực bào mô mỡ độc đáo. Cường androgen cũng làm nhạy cảm các tế bào đơn nhân lưu hành để bài tiết các cytokine gây viêm để đáp ứng với việc ăn glucose và chất béo bão hòa. Mỡ nội tạng góp phần nhiều hơn vào kháng insulin của PCOS so với mỡ bụng vì đáp ứng phân giải mỡ của nó đối với catecholamine, kích thích phân giải mỡ chính ở người, được tăng cường một cách độc đáo.
Kháng insulin là một yếu tố làm trầm trọng thêm không nhất quán trong cơ chế bệnh sinh của FOH có mặt ở khoảng một nửa số trường hợp (Hình 16.47, bảng B). Nó thường nhẹ, đặc biệt là trong giai đoạn phát triển (thanh thiếu niên) của hội chứng. Nó không giải thích cho rối loạn chức năng tế bào vỏ nội tại đặc trưng của PCOS thông thường và chỉ đóng một vai trò gây bệnh chính trong sự phát triển của PCOS làm phức tạp thêm các hội chứng kháng insulin nặng hoặc cực đoan.
Kháng insulin của PCOS là chọn lọc đối với các tác động chuyển hóa của insulin. Điều này tạo ra một nghịch lý trong đó sự tăng insulin máu bù trừ cho sự kháng lại tác động chuyển hóa glucose của insulin, tuy nhiên, gây ra tác động insulin dư thừa ở một số mô. Do đó, các tác động sinh steroid, gây tăng sinh, và chuyển hóa protein của insulin vẫn còn nguyên vẹn.
Sự tăng insulin kháng insulin này (tăng insulin) làm trầm trọng thêm sự rối loạn điều hòa sinh steroid của buồng trứng và thượng thận của PCOS. Nó có liên quan chặt chẽ với sự không rụng trứng của PCOS. Insulin, giống như các IGF, điều biến tác động của gonadotropin và ACTH. Do đó, khi dư thừa, nó hiệp đồng với chúng. Trong buồng trứng, insulin hiệp đồng với LH bằng cách tăng biểu hiện vị trí thụ thể LH của tế bào vỏ để gây ra “thoát khỏi” sự mất nhạy cảm. Do đó, tăng insulin tăng cường sản xuất androgen của tế bào vỏ và tăng sản tế bào vỏ và mô đệm. Sự dư thừa insulin cũng hiệp đồng với androgen để hoàng thể hóa sớm các tế bào hạt bằng cách gây ra biểu hiện thụ thể LH, do đó tăng cường sản xuất estrogen, progesterone, và inhibin-B và ngăn chặn sự phát triển của nang trứng trội.
Tăng insulin cũng dường như đóng một vai trò trong việc trung gian cho sự phát triển của béo phì trong PCOS. Yếu tố phiên mã KLF15 dường như đóng một vai trò quan trọng trong việc trung gian cho sự kích thích của insulin đối với cả sự hình thành mỡ và sự hình thành testosterone.
PCOS phụ thuộc vào gonadotropin; gonadotropin là cần thiết cho sự biểu hiện của các enzyme sinh steroid của tuyến sinh dục. Tuy nhiên, sự dư thừa LH dường như thông thường không phải là nguyên nhân cơ bản của cường androgen. Sự dư thừa LH có thể thay đổi (được tìm thấy ở 50%–75% các trường hợp) và dường như phụ thuộc vào sự cân bằng androgen-béo phì, tương ứng, làm tăng và giảm nồng độ gonadotropin. Sự mất nhạy cảm tương đồng thường giới hạn đáp ứng androgen đối với sự tăng LH: do đó, sự dư thừa LH đơn độc dường như không có khả năng gây ra cường androgen của PCOS, mặc dù nó có thể làm trầm trọng thêm nó trong PCOS, nơi rối loạn chức năng buồng trứng nội tại gây ra “thoát khỏi” sự mất nhạy cảm. Bằng chứng đang tích lũy cho thấy rằng sự dư thừa androgen gây ra sự dư thừa LH bằng cách can thiệp vào tác động phản hồi âm của progesterone-estrogen lên bài tiết LH. Tuy nhiên, khả năng có một vai trò chính của sự dư thừa LH vẫn còn, đặc biệt là trong PCOS thứ phát sau các rối loạn gây nam hóa bẩm sinh.
Một mô hình sinh lý bệnh của PCOS được thể hiện trong Hình 16.47. Nồng độ androgen trong buồng trứng cao phát sinh từ rối loạn chức năng tế bào vỏ của FOH có thể gây ra tất cả các đặc điểm thiết yếu của hội chứng (Hình 16.47, bảng A). Sự bài tiết androgen dư thừa gây ra các biểu hiện ở đơn vị nang lông-tuyến bã của hội chứng. Nồng độ androgen trong buồng trứng rất cao tại chỗ tác động lên các tế bào hạt để cản trở sự xuất hiện của một nang trứng trội, gây ra kinh thưa-không rụng trứng. Tác động paracrine này của sự dư thừa androgen lớn được kết hợp với sự kích thích của nó đối với sự tăng sinh của các nang trứng nhỏ gây ra PCOM. Tăng insulin kháng insulin làm trầm trọng thêm mức độ nghiêm trọng của PCOS bằng cách tác động kết hợp với sự dư thừa androgen để hoàng thể hóa sớm các nang trứng, gây tăng sản vỏ và mô đệm. Cường androgen máu tăng vừa phải gây ra sự tăng LH thứ phát bằng cách can thiệp vào phản hồi âm của hormone nữ; trong khi đó, sự dư thừa estrogen và inhibin-B ức chế bài tiết FSH. Khi có sự thoát khỏi mất nhạy cảm tương đồng do tăng insulin gây ra, sự dư thừa LH này khuếch đại rối loạn chức năng buồng trứng. Tăng insulin cũng thúc đẩy tình trạng béo phì, lần lượt làm trầm trọng thêm tình trạng kháng insulin.
Trong FAH nguyên phát, mô hình sinh steroid đáp ứng với ACTH giống như một giai đoạn dậy thì thượng thận quá mức và trong quá khứ đã bị nhầm lẫn với thiếu hụt 3β-HSD không điển hình. FAH này có liên quan đến sự to ra nhẹ của tuyến thượng thận và một mức độ nhỏ của chức năng vỏ thượng thận tự chủ trong một số trường hợp. Mô hình bài tiết của tuyến thượng thận tương thích với sự rối loạn điều hòa sinh steroid của lớp lưới nổi bật ở mức độ hoạt động của 17-hydroxylase/17,20-lyase của P450c17 và nó tương quan với bằng chứng về sự rối loạn điều hòa buồng trứng liên quan. Tuy nhiên, nó là bất thường sinh steroid duy nhất ở một thiểu số nhỏ của PCOS.
Các trường hợp PCOS còn lại thiếu bằng chứng về các bất thường bài tiết steroid. Hầu hết trong số này là béo phì (Hình 16.48), một số ít là vô căn. Mô mỡ dư thừa dường như đủ để giải thích cho tình trạng không rụng trứng cường androgen và do đó gây ra PCOS không điển hình của béo phì. Các tế bào mỡ hình thành testosterone từ androstenedione thông qua 17β-hydroxysteroid dehydrogenase loại 5, được điều hòa tăng bởi insulin. Béo phì cũng ức chế rụng trứng và nồng độ LH; biên độ xung LH bị cùn đi ít nhất một phần là do sự chuyển hóa LH tăng nhanh. PCOS không điển hình của béo phì nói chung được đặc trưng bởi cường androgen máu nhẹ (testosterone toàn phần bình thường, testosterone tự do tăng nhẹ, DHEAS bình thường, SHBG thấp), và hầu hết có buồng trứng kích thước bình thường, nồng độ AMH bình thường, và nồng độ LH bình thường; kháng insulin của họ không đáng kể đối với PCOS.
Một trong những câu đố lớn về cơ chế bệnh sinh của PCOS là liệu cường androgen có thể gây ra kháng insulin hay không. Androgen trong ống nghiệm có một số tác dụng chống insulin. Một loạt các nghiên cứu chỉ ra rằng việc sử dụng androgen đường uống hoặc liều androgen gây nam hóa cho người gây ra kháng insulin. Việc gây ra cường androgen vừa phải không làm điều này ở phụ nữ bình thường, nhưng ở các loài linh trưởng không phải người, nó sẽ gây ra kháng insulin khi kết hợp với một chế độ ăn gây béo phì. Tuy nhiên, việc đảo ngược sự dư thừa androgen của PCOS đã không cải thiện được kháng insulin trong phần lớn các nghiên cứu.
Nguyên nhân
PCOS dường như phát sinh như một đặc điểm phức tạp là kết quả của sự tương tác của các yếu tố di truyền và môi trường đa dạng một khi đạt được nồng độ gonadotropin trưởng thành quanh tuổi dậy thì. Những tương tác phức tạp này thường bắt chước một mô hình di truyền trội trên nhiễm sắc thể thường với độ thấm thay đổi. Khả năng di truyền của PCOS đã được ước tính là trên 70%, dựa trên các nghiên cứu ở các chị em song sinh cùng trứng. Các yếu tố di truyền bao gồm PCOS và PCOM của mẹ, cường androgen máu, và hội chứng chuyển hóa.
GWAS đã xác định sự biểu hiện quá mức của DENND1A.V2 ở hầu hết các quần thể PCOS. Protein không được nghi ngờ trước đây này có mặt trong các tế bào vỏ và lớp lưới và được biểu hiện quá mức trong PCOS. Nó tạo điều kiện thuận lợi cho quá trình sinh steroid; cơ chế chưa được biết, nhưng người ta đã suy đoán rằng nó điều hòa tăng tín hiệu thụ thể LH bằng cách ảnh hưởng đến sự vận chuyển của thụ thể. Sự biểu hiện quá mức gây ra của nó trong các tế bào vỏ bình thường đã tái tạo kiểu hình di truyền và hóa sinh PCOS này trong ống nghiệm. Một loạt các biến thể gen khác có liên kết và/hoặc liên quan đến PCOS đã được xác định bằng các nghiên cứu gen ứng cử viên và di truyền phân tử, và các dấu hiệu mới được báo cáo thường xuyên. Các biến thể được phát hiện trong fibrillin 3 đã được đề xuất để làm rối loạn điều hòa tín hiệu TGF-β và giải thích cho sự tăng sản mô đệm buồng trứng. Các biến thể mã hóa AMH với tín hiệu giảm có khả năng gây ra hội chứng đã được báo cáo ở 6.7% bệnh nhân PCOS.
Các yếu tố môi trường bao gồm phơi nhiễm androgen trước khi sinh và cả suy dinh dưỡng và thừa dinh dưỡng. CAH gây nam hóa đôi khi bị biến chứng bởi PCOS ở những bệnh nhân có CAH được kiểm soát tốt. Sự nam hóa bẩm sinh của một số loài động vật, bao gồm cả các loài linh trưởng không phải người, đã được chứng minh là lập trình cho tình trạng không rụng trứng cường androgen và kháng insulin ở con cái. Những quan sát này cho thấy rằng những tổn thương đối với môi trường trong tử cung gây ra những thay đổi biểu sinh dẫn đến sự biểu hiện gen bị thay đổi và bệnh tật trong cuộc sống sau này. Bởi vì sự dư thừa androgen trong tử cung từ buồng trứng PCOS của thai nhi hoặc mẹ không có khả năng giải thích cho việc lập trình này trong PCOS thông thường, các mô hình lập trình androgen thay vào đó cho thấy rằng những thay đổi trong tử cung ở các chất trung gian trong tín hiệu androgen phổ biến cho các con đường tác động khác, chẳng hạn như prostaglandin, có thể đóng một vai trò trong cơ chế bệnh sinh của PCOS bằng cách thay đổi hệ gen biểu sinh.
Các yếu tố nguy cơ môi trường sau khi sinh có thể được xem như một “cú đánh thứ hai”, làm cho một đặc điểm nhạy cảm di truyền hoặc được lập trình bẩm sinh tiềm ẩn biểu hiện thành PCOS. Các yếu tố sau khi sinh bao gồm béo phì mắc phải, kháng insulin, và cường androgen có nguồn gốc không phải từ buồng trứng. Sự đa dạng của các con đường liên quan và sự thiếu một sợi dây chung chứng tỏ bản chất đa yếu tố và không đồng nhất của hội chứng.
Tăng insulin kháng insulin từ trung bình đến nặng đặc trưng cho hai hội chứng béo phì khó chữa ở trẻ em báo hiệu PCOS ở tuổi vị thành niên: hội chứng giả-Cushing và bệnh giả-to cực. Dậy thì thượng thận sớm dường như có nguy cơ tăng vừa phải (tổng thể khoảng hai lần) để phát triển PCOS. Bản chất của mối liên quan là không rõ ràng. Chúng tôi ủng hộ khái niệm rằng dậy thì thượng thận sớm đôi khi là một biểu hiện sớm của sự rối loạn điều hòa sinh steroid làm nền tảng cho PCOS, mặc dù ở một số quần thể, cân nặng khi sinh thấp có thể là yếu tố nguy cơ cơ bản.
Các nguyên nhân khác của Cường androgen buồng trứng chức năng
Trong những năm đầu sau có kinh, không rụng trứng sinh lý có thể có biểu hiện cường androgen máu nhẹ mà không có bằng chứng lâm sàng về sự dư thừa androgen ở khoảng một phần tư các trường hợp, nhưng tình trạng không rụng trứng cường androgen không kéo dài. PCOS thứ phát có thể là kết quả của một số rối loạn (xem Hộp 16.8). CAH gây nam hóa thường gây ra cường androgen buồng trứng. Có ba cơ chế liên quan. Một là, việc kiểm soát kém cường androgen thượng thận gây ra buồng trứng đa nang và vô kinh do các tác động trực tiếp lên buồng trứng. Di tích thượng thận ở buồng trứng có thể gây ra buồng trứng đa nang và cường androgen. Cuối cùng, bệnh nhân bị CAH, đặc biệt là những người bị CAH cổ điển, có nguy cơ cao bị PCOS xuất hiện ở tuổi dậy thì do lập trình phát triển (xem phần trước Rối loạn phát triển giới tính).
Tất cả các dạng kháng insulin nặng hoặc cực đoan đã biết, bao gồm các trường hợp di truyền của đột biến thụ thể insulin và loạn dưỡng mỡ mắc phải, đều đi kèm với PCOS, có thể bằng cách tác động thông qua con đường truyền tín hiệu IGF-1 để gây ra sự thoát khỏi mất nhạy cảm với LH. Bản thân bệnh to cực có liên quan đến PCOS. Thuốc chống động kinh axit valproic gây ra cường androgen và buồng trứng đa nang, và có thể có mối liên quan giữa bản thân bệnh động kinh với PCOS.
Các nguyên nhân hiếm gặp của cường androgen bao gồm các khối steroidogenic buồng trứng nguyên phát. Những bệnh này (thiếu hụt aromatase và CAH gây nam hóa do thiếu hụt 3β-HSD) gây ra cường androgen liên quan đến buồng trứng đa nang rõ rệt và nồng độ LH tăng cao. Thiếu hụt 17-ketosteroid reductase của buồng trứng đã được báo cáo là chịu trách nhiệm cho một bức tranh giống PCOS ở hai gia đình, nhưng chưa có xác nhận phân tử về một đột biến cơ bản. Cường androgen buồng trứng chức năng cũng có thể là kết quả của một rối loạn phát triển giới tính lưỡng tính. Kích thích hCG quá mức trung gian cho cường androgen của tăng phản ứng hoàng thể và u hoàng thể của thai kỳ, và LH dư thừa dường như trung gian cho tăng sản tế bào rốn ở một trường hợp nang buồng trứng kháng FSH. Một nồng độ hCG cực kỳ cao do khối u đã được báo cáo là gây nam hóa một phụ nữ không mang thai bị PCOS từ trước.
Các nguyên nhân khác của Cường androgen thượng thận chức năng
Loại FAH nguyên phát kiểu PCOS dường như phát sinh từ sự rối loạn điều hòa sinh steroid thượng thận xảy ra như một thực thể đơn độc, không liên quan đến FOH, ở 5% phụ nữ bị cường androgen. Điều này đôi khi có thể là một kết quả của dậy thì thượng thận sớm. Loại rối loạn chức năng thượng thận này trước đây bị nhầm lẫn với thiếu hụt 3β-HSD không điển hình, hiện được biết là một rối loạn hiếm gặp.
Ít hơn 10% cường androgen thượng thận là do các rối loạn khác được liệt kê trong Hộp 16.8. Phổ biến nhất trong số này là CAH không điển hình, chiếm 4.2% phụ nữ bị cường androgen trên toàn thế giới, chỉ đứng sau PCOS (tỷ lệ hiện mắc > 80%) là nguyên nhân phổ biến nhất của cường androgen ở nữ thanh thiếu niên và người lớn. Tỷ lệ hiện mắc thay đổi từ 0.1% đến 2% trong dân số chung của Hoa Kỳ đến 4% ở người Do Thái Ashkenazi, đến 10% ở các nước Địa Trung Hải-Trung Đông. Cường androgen thượng thận trong những trường hợp hiếm gặp có thể phát sinh từ các rối loạn bẩm sinh hiếm gặp khác về tác động hoặc chuyển hóa steroid thượng thận, chẳng hạn như kháng glucocorticoid, thiếu hụt cortisone reductase biểu kiến, và thiếu hụt sulfotransferase biểu kiến.
Khoảng 40% phụ nữ tăng prolactin máu có cường androgen, đôi khi liên quan đến buồng trứng đa nang. Phần lớn (khoảng 85%) những phụ nữ này có tiết sữa; sự kết hợp của rậm lông, tiết sữa, và vô kinh bao gồm hội chứng Forbes-Albright. Sự dư thừa prolactin gây ra cường androgen thượng thận do nhiều tác động của sự dư thừa prolactin lên sản xuất androgen thượng thận và chuyển hóa androgen. Giá trị prolactin huyết thanh hơn 25 ng/mL ở phụ nữ bị cường androgen thường có một nguyên nhân có thể xác định được, thay vì bản thân PCOS: phổ biến nhất là u tuyến yên và các loại thuốc chống dopaminergic.
Sản xuất Androgen ngoại vi quá mức
Ở khoảng 10% bệnh nhân PCOS, một nguồn buồng trứng hoặc thượng thận không thể được xác định chắc chắn bằng các xét nghiệm kỹ lưỡng (xem Hình 16.48). “PCOS chức năng không điển hình” này dường như trong hầu hết các trường hợp là do béo phì: mô mỡ dư thừa có khả năng vừa gây ra không rụng trứng vừa hình thành testosterone từ androstenedione. Ở khoảng 20% các trường hợp như vậy (≤ 5% PCOS), nguồn gốc của cường androgen máu không giải thích được: điều này được gọi là cường androgen vô căn (khác với “rậm lông vô căn”). Những điểm kỳ quặc trong chuyển hóa steroid ngoại vi đã bị nghi ngờ là nguyên nhân.
PCOS cũng đã được báo cáo là một biến chứng của shunt cửa-hệ thống. Chuyển hóa steroid bị suy giảm đã được giả thuyết là cơ chế.
Cường androgen do khối u
Các khối u gây nam hóa rất hiếm, chiếm khoảng 0.2% các trường hợp cường androgen; khoảng một nửa là ác tính. Khoảng một nửa là ở buồng trứng, một nửa ở tuyến thượng thận. Các khối u mô đệm-dây sinh dục gây nam hóa của buồng trứng không phổ biến trước tuổi vị thành niên. U tế bào Leydig-Sertoli (androblastoma, arrhenoblastoma) là loại phổ biến nhất. U tế bào hạt-vỏ gây nam hóa (thecoma) không phổ biến trước tuổi mãn kinh. Các u loạn sản mầm chỉ gây nam hóa nếu chúng có các yếu tố tế bào kẽ. Các khối u tế bào lipid có xu hướng đáp ứng với ACTH, cũng như LH và sản xuất 17-OHP; do đó chúng phải được xem xét trong chẩn đoán phân biệt của CAH khởi phát muộn. Sự biệt hóa bất thường làm nền tảng cho sự hình thành khối u thường dẫn đến một mô hình bài tiết steroid bất thường với androstenedione chiếm ưu thế lớn so với bài tiết testosterone. Tuy nhiên, một số thecoma đã được báo cáo là chủ yếu bài tiết testosterone. Các u tuyến sinh dục là các khối u gây nam hóa gần như chỉ giới hạn ở những cá nhân có tuyến sinh dục loạn sản với vật liệu nhiễm sắc thể Y trong bộ gen của họ. Một số khối u mô đệm-dây sinh dục buồng trứng gây nam hóa có thể là do các đột biến kích hoạt của các protein-G kích thích. Các khối u tế bào Leydig và di tích thượng thận của buồng trứng là những nguyên nhân cực kỳ hiếm gặp của sự nam hóa ở trẻ em. Các khối u gây nam hóa thượng thận hiếm gặp ở tuổi vị thành niên; tỷ lệ mắc cao nhất của chúng là ở trẻ nhỏ và tuổi trưởng thành (xem các phần Dậy thì sớm và Dậy thì sớm không hoàn toàn).
Thuốc Androgenic
Sự nam hóa do thuốc ở tuổi vị thành niên thường gặp nhất ở các vận động viên. Bệnh sử rất quan trọng trong việc phát hiện vì các xét nghiệm cận lâm sàng tiêu chuẩn cho androgen không hữu ích trong việc phát hiện cả androgen tự nhiên và nhân tạo. Điều này cũng đúng đối với sự nam hóa là kết quả của việc tiếp xúc không chủ ý với các androgen tại chỗ được sử dụng bởi cha mẹ hoặc bạn tình. Việc sử dụng axit valproic ở bệnh nhân động kinh làm tăng nồng độ testosterone và có thể bắt chước PCOS.
Chẩn đoán phân biệt
Cường androgen nên được xem xét ở bất kỳ cô gái nào có biểu hiện rậm lông hoặc mụn trứng cá viêm từ trung bình đến nặng, rối loạn kinh nguyệt, hoặc gai đen với béo phì trung tâm (chu vi vòng eo > 88 cm) trong tuổi dậy thì.
Rậm lông phải được phân biệt với sự phát triển lông quá mức cục bộ khi không có điểm số rậm lông bất thường (“rậm lông quan trọng đối với bệnh nhân”) và với chứng rậm lông, sự phát triển quá mức lan tỏa của lông tơ đôi khi xảy ra trên cơ sở di truyền hoặc ở những bệnh nhân dùng glucocorticoid, phenytoin, diazoxide, hoặc cyclosporine. Chứng rậm lông được phân bố theo một mô hình không phải sinh dục (ví dụ, phân bố lan tỏa hoặc phân bố nổi bật hơn trên trán hoặc vai) và không phải do dư thừa androgen, mặc dù nó có thể bị làm trầm trọng thêm bởi sự dư thừa androgen.
Khả năng mắc PCOS tăng lên nếu rậm lông, mụn trứng cá kháng trị, hoặc kinh nguyệt không đều có liên quan đến tiền sử các yếu tố nguy cơ trước dậy thì đối với PCOS—các rối loạn gây nam hóa bẩm sinh; dậy thì thượng thận sớm; béo phì khó chữa trước dậy thì, đặc biệt nếu có liên quan đến hội chứng giả-Cushing hoặc bệnh giả-to cực; hoặc tiền sử gia đình bị PCOS hoặc hội chứng chuyển hóa.
Phương pháp Chẩn đoán
Mục tiêu của việc đánh giá xét nghiệm cho cường androgen là để có được bằng chứng về cường androgen máu và xác định nguyên nhân cụ thể. Chẩn đoán cường androgen dựa trên cơ sở vững chắc nhất nếu cường androgen máu được chứng minh bằng hóa sinh, thay vì dựa vào rậm lông như một đại diện lâm sàng cho nó, mặc dù việc ghi nhận cường androgen máu có thể có vấn đề.
Việc đánh giá bắt đầu bằng một sự đánh giá kỹ lưỡng các triệu chứng và dấu hiệu lâm sàng gợi ý PCOS và cho các rối loạn bắt chước nó (Hình 16.49).
Hình 16.49 Đánh giá ban đầu ở phụ nữ về nguy cơ mắc các rối loạn dư thừa androgen. Sự phát triển lông cục bộ quan trọng đối với bệnh nhân khi có điểm số rậm lông bình thường (“rậm lông cục bộ”), nhưng không đi kèm với các yếu tố nguy cơ dư thừa androgen khác, không cần phải làm xét nghiệm nội tiết trước khi bắt đầu điều trị da liễu tại chỗ. Ở những phụ nữ bị rậm lông cục bộ có các yếu tố nguy cơ dư thừa androgen khác hoặc điểm số rậm lông tăng, nên đánh giá nồng độ androgen. PCOS là nguyên nhân phổ biến nhất cần được xem xét, nhưng các khối u sản xuất androgen, tăng sản thượng thận bẩm sinh, và các rối loạn androgen đa dạng, như được hiển thị, nên được loại trừ. Các loại thuốc gây rậm lông bao gồm các steroid đồng hóa hoặc androgenic (xem xét ở các vận động viên và bệnh nhân bị rối loạn chức năng tình dục) và axit valproic (xem xét ở các rối loạn thần kinh), gây ra cường androgen máu. Testosterone huyết thanh được đánh giá tốt nhất vào sáng sớm, vào các ngày 4-10 của chu kỳ kinh nguyệt ở phụ nữ có kinh đều hoặc vào các ngày ngẫu nhiên ở phụ nữ vô kinh, bằng một xét nghiệm chính xác và đặc hiệu như sắc ký lỏng/khối phổ. Phụ nữ bị rậm lông nhẹ (điểm 8-15), nồng độ testosterone toàn phần bình thường, và không có yếu tố nguy cơ có lẽ bị rậm lông vô căn, có thể đáp ứng với liệu pháp nội tiết. Testosterone tự do trong huyết thanh nên được đo như được chỉ định bởi một xét nghiệm tham chiếu chuyên khoa nếu testosterone toàn phần trong huyết thanh bình thường khi có các yếu tố nguy cơ hoặc sự tiến triển của rậm lông khi điều trị. Xét nghiệm đồng thời 17-hydroxyprogesterone được chỉ định ở các đối tượng có nguy cơ cao bị tăng sản thượng thận bẩm sinh. Một số thanh thiếu niên được chẩn đoán bị rậm lông vô căn bằng thuật toán này sẽ có buồng trứng đa nang trên siêu âm khi trưởng thành, điều này không có khả năng quan trọng trừ khi vấn đề là khả năng sinh sản. Sự tiến triển của cường androgen khi có testosterone tự do trong huyết thanh bình thường là rất bất thường; những bệnh nhân như vậy nên được đánh giá lại kỹ lưỡng, có thể cũng đo các steroid khác liên quan đến dư thừa androgen, chẳng hạn như 17-hydroxyprogesterone, androstenedione và DHEAS. Quy trình xét nghiệm ban đầu cho dư thừa androgen được hiển thị trong Hình 16.50. (Chỉnh sửa với sự cho phép từ Martin, và cộng sự. Đánh giá và điều trị rậm lông ở phụ nữ tiền mãn kinh: một Hướng dẫn Thực hành Lâm sàng của Hiệp hội Nội tiết. Bản quyền Hiệp hội Nội tiết.)
Mức độ và sự phân bố của sự phát triển lông sinh dục nên được xác định, thường được thực hiện bằng cách sử dụng thang điểm Ferriman-Gallwey (xem Hình 16.46). Rậm lông từ trung bình đến nặng (điểm rậm lông > 15) cấu thành bằng chứng lâm sàng của cường androgen ở một thanh thiếu niên (xem Hộp 16.9). Bệnh sử nên khám phá cụ thể xem bệnh nhân có đang dùng các loại thuốc có thể che giấu các triệu chứng (ví dụ, sử dụng thuốc tẩy lông) hoặc gây rậm lông (ví dụ, steroid đồng hóa, valproate).
Mụn trứng cá viêm từ trung bình đến nặng (> 10 tổn thương ở bất kỳ khu vực nào, ví dụ, mặt, ngực, lưng) hoặc mụn trứng cá dai dẳng và đáp ứng kém với liệu pháp da liễu tại chỗ gợi ý khả năng cường androgen.
Đánh giá cũng nên bao gồm việc đánh giá các triệu chứng hoặc dấu hiệu gợi ý một rối loạn cường androgen khác ngoài PCOS, bao gồm nam hóa (ví dụ, rậm lông tiến triển nhanh, phì đại âm vật), khối u bụng, tiết sữa, các thay đổi dạng Cushing hoặc to cực, bằng chứng rối loạn chức năng tuyến giáp, hoặc tiền sử gia đình bị các rối loạn cường androgen. Việc kiểm tra bộ phận sinh dục ngoài được chỉ định, nhưng một cuộc khám tiểu khung bên trong hiếm khi cần thiết.
Nếu rậm lông là cục bộ hoặc nhẹ (điểm rậm lông < 8) và nếu kinh nguyệt đều đặn không có bằng chứng lâm sàng khác về các yếu tố nguy cơ gợi ý một nguyên nhân cơ bản, sự phát triển lông sinh dục không mong muốn hoặc quá mức có thể được quản lý bằng các phương pháp da liễu mà không cần theo đuổi đánh giá xét nghiệm thêm. Trừ khi khả năng sinh sản trở thành một vấn đề ở tuổi trưởng thành đối với các đối tượng bị rậm lông cục bộ hoặc rậm lông vô căn, việc chứng minh hình thái buồng trứng đa nang để chẩn đoán PCOS có rụng trứng không có khả năng ảnh hưởng đến việc quản lý.
Đánh giá xét nghiệm cho cường androgen bắt đầu bằng việc đo testosterone huyết thanh: đây là androgen quan trọng nhất để đánh giá (Hình 16.49). Mặc dù các androgen khác có mặt trong máu, việc đánh giá chúng thường ít tạo ra sự khác biệt trong chẩn đoán và quản lý nếu testosterone tự do trong huyết thanh là bình thường. Testosterone tự do trong huyết thanh nhạy hơn khoảng 50% trong việc phát hiện sản xuất androgen quá mức vì phụ nữ bị cường androgen có nồng độ SHBG tương đối thấp. Có nhiều cạm bẫy trong các xét nghiệm testosterone ở mức độ thấp được tìm thấy ở phụ nữ và trẻ em, và các xét nghiệm testosterone đáng tin cậy không có sẵn ở hầu hết các phòng thí nghiệm địa phương. Các xét nghiệm có độ nhạy và độ đặc hiệu cao, chẳng hạn như được cung cấp bởi RIA sau sắc ký hoặc khối phổ song song bởi các phòng thí nghiệm chuyên khoa, là cần thiết. Việc xét nghiệm nồng độ testosterone tự do đưa ra các nguồn sai sót tiềm ẩn khác. Các xét nghiệm trực tiếp nồng độ testosterone tự do là không chính xác và nên được tránh. Các phương pháp tốt nhất để tính toán testosterone tự do là sản phẩm của testosterone toàn phần và một hàm của SHBG: testosterone tự do = testosterone toàn phần × phần trăm testosterone tự do, trong đó phần trăm testosterone tự do được xác định chính xác nhất bằng thẩm tách, hoặc được tính toán thay thế từ nồng độ SHBG. Sự kết hợp của một testosterone toàn phần cao-bình thường và một SHBG thấp-bình thường mang lại một nồng độ testosterone tự do cao.
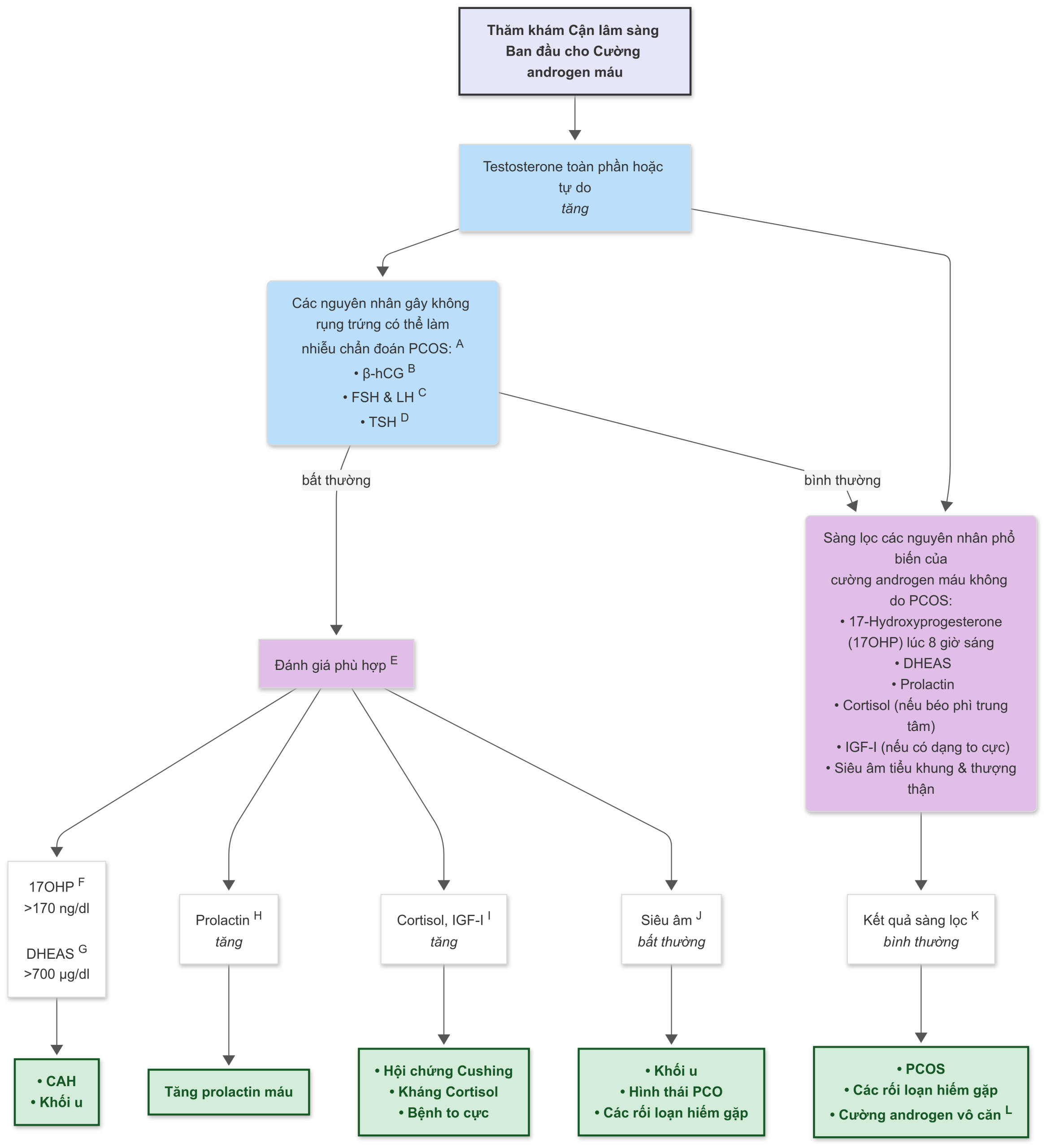
Hình 16.50 Quy trình xét nghiệm ban đầu cho nguyên nhân gây dư thừa androgen. Hội chứng buồng trứng đa nang là một chẩn đoán loại trừ: thuật toán này xác định các nguyên nhân phổ biến khác của cường androgen máu và không rụng trứng cường androgen. (Chỉnh sửa từ Rosenfield, R.L. (2018). Polycystic ovary syndrome in adolescence. Clinical features and diagnosis of polycystic ovary syndrome in adolescents. UpToDate. Với sự cho phép.) Chú thích: A. Những xét nghiệm này cho các rối loạn không rụng trứng được khuyến khích cho bệnh nhân cường androgen máu có bất thường kinh nguyệt, vì chúng có thể làm phức tạp chẩn đoán hội chứng buồng trứng đa nang (PCOS). B. Mang thai có liên quan đến nồng độ testosterone cao. C. Hormone tạo hoàng thể (LH) tăng nhẹ và hormone kích thích nang trứng (FSH) thấp nhẹ là phổ biến trong PCOS. FSH cao gợi ý suy sinh dục nguyên phát. LH thấp gợi ý suy sinh dục do giảm gonadotropin. D. Rối loạn chức năng tuyến giáp có thể làm thay đổi nồng độ testosterone toàn phần bằng cách thay đổi globulin gắn hormone sinh dục. Suy giáp có thể gây ra buồng trứng đa nang và lông thô có thể bị nhầm lẫn với rậm lông. E. Xem các thuật toán trước cho quy trình làm việc của các rối loạn không rụng trứng. F. 17-hydroxyprogesterone (17-OHP) lúc 8:00 sáng trên 170 ng/dL nhạy khoảng 95% và đặc hiệu 90% để phát hiện tăng sản thượng thận bẩm sinh không điển hình loại phổ biến (thiếu hụt 21-hydroxylase) (NCCAH) ở phụ nữ không rụng trứng hoặc giai đoạn nang trứng sớm-giữa. NCCAH là rối loạn phổ biến nhất bắt chước PCOS. Sự tăng 17-OHP dương tính giả được tìm thấy trong PCOS, phụ nữ giai đoạn hoàng thể, và các khối u gây nam hóa. G. Dehydroepiandrosterone sulfate (DHEAS) lớn hơn 700 mcg/dL gợi ý khối u gây nam hóa thượng thận hoặc dạng thiếu hụt 3β-hydroxysteroid dehydrogenase hiếm gặp của NCCAH. H. Tăng prolactin máu có thể gây ra suy sinh dục do giảm gonadotropin hoặc không rụng trứng cường androgen (thường đi kèm với tiết sữa, hội chứng Forbes-Albright). I. Các xét nghiệm tùy chọn là cortisol và yếu tố tăng trưởng giống insulin 1 (IGF-I). Hội chứng Cushing nội sinh nên được xem xét trong các trường hợp béo phì trung tâm. Cortisol huyết tương dưới 10 mcg/dL về cơ bản loại trừ hội chứng Cushing nội sinh trừ khi chỉ số nghi ngờ lâm sàng cao. Bệnh to cực nên được loại trừ bằng sàng lọc IGF-I nếu bệnh nhân có sự phát triển quá mức dạng to cực. J. Siêu âm sàng lọc khối u buồng trứng và thượng thận. Hình thái buồng trứng đa nang là hỗ trợ, nhưng nó không đặc hiệu cho, cũng không phải là một tiêu chí cho, chẩn đoán PCOS ở thanh thiếu niên. Siêu âm có thể phát hiện rối loạn phát triển giới tính lưỡng tính (lưỡng giới thực sự) hoặc các rối loạn liên quan đến gonadotropin màng đệm người (hCG) của thai kỳ. K. Việc loại trừ các rối loạn trước đó ở một bệnh nhân cường androgen có rối loạn chức năng kinh nguyệt đáp ứng các tiêu chí chẩn đoán tiêu chuẩn cho PCOS với độ tin cậy khoảng 99%. Tuy nhiên, quy trình làm việc này không xác định các rối loạn thượng thận hiếm gặp (ví dụ, các loại hiếm gặp của tăng sản thượng thận bẩm sinh [CAH] và các rối loạn chuyển hóa steroid thượng thận, các khối u rất nhỏ, chẳng hạn như khối u tiết testosterone hiếm gặp) hoặc cường androgen vô căn. L. Cường androgen vô căn (cường androgen máu được ghi nhận không có nguồn gốc có thể chứng minh được) xảy ra ở khoảng 1% phụ nữ bị cường androgen. Điều này khác với “rậm lông vô căn” phổ biến hơn (rậm lông không có bằng chứng lâm sàng khác của cường androgen). TSH, Hormone kích thích tuyến giáp.
Việc loại trừ các rối loạn cường androgen bắt chước PCOS (xem Hộp 16.8) là quan trọng để đáp ứng các tiêu chí chẩn đoán. Bởi vì PCOS chiếm 95% các trường hợp cường androgen, một chiến lược chẩn đoán là cần thiết có tính đến sở thích cá nhân của bệnh nhân, bao gồm các lợi ích liên quan đến tiết kiệm chi phí và thời gian. Các hướng dẫn thay đổi một chút, nhưng hầu hết đề nghị sàng lọc cho CAH không điển hình, chiếm hầu hết các trường hợp cường androgen không phải PCOS, tăng prolactin máu, bệnh tuyến giáp, và khối u gây nam hóa, là nghiêm trọng nhất mặc dù hiếm gặp; xét nghiệm cho hội chứng Cushing và bệnh to cực thường được đề nghị cho những người có các đặc điểm lâm sàng gợi ý. Kết quả bình thường của một bảng xét nghiệm sàng lọc nội tiết đơn giản để loại trừ các nguyên nhân khác gây cường androgen máu này (xem Hình 16.50) đảm bảo chẩn đoán PCOS với độ tin cậy khoảng 99%.
Thực hành thay đổi về các chỉ định siêu âm ở các bé gái được xác nhận bị cường androgen máu. Mục đích chính của siêu âm là để sàng lọc khối u thượng thận hoặc buồng trứng hiếm gặp nhưng nghiêm trọng, vì nó không bắt buộc để chẩn đoán. Siêu âm cũng cung cấp cơ hội để trấn an và giáo dục bệnh nhân. Đối với nhiều phụ nữ, chẩn đoán “nang” buồng trứng làm dấy lên lo ngại về các khối u, vì vậy thật yên tâm khi biết rằng một khối u đã không được nhìn thấy.
Một số xét nghiệm đòi hỏi phải xem xét thời gian trong ngày hoặc giai đoạn của chu kỳ mà việc lấy mẫu được thực hiện. Nồng độ testosterone huyết thanh cao hơn 20% vào buổi sáng so với buổi chiều và tăng gấp đôi vào giữa chu kỳ; các tiêu chuẩn dựa trên nhóm đối chứng giai đoạn giữa nang trứng. Một nồng độ 17-OHP sáng sớm trên 170 ng/dL (> 5.1 nmol/L) nhạy khoảng 95% và đặc hiệu 90% đối với CAH không điển hình, nhưng chúng không nhạy vào giữa buổi sáng. Nguyên nhân phổ biến nhất của các kết quả dương tính giả là PCOS, nguyên nhân nghiêm trọng nhất là các khối u gây nam hóa. Sự tăng DHEAS thường là do FAH của PCOS; DHEAS lớn hơn 700 mcg/dL gợi ý khối u gây nam hóa thượng thận hoặc một loại CAH hiếm gặp (thiếu hụt 3β-HSD). Một nồng độ cortisol dưới 10 mcg/dL (276 nmol/L) là bằng chứng yên tâm chống lại hội chứng Cushing nội sinh trừ khi chỉ số nghi ngờ lâm sàng cao.
Thực hành của tác giả chính là thường bắt đầu quy trình làm việc cụ thể cho PCOS tại lần đánh giá ban đầu cho tình trạng không rụng trứng cường androgen, một đánh giá bao gồm testosterone (xem Hình 16.49), bằng cách thêm một vài xét nghiệm cho các nguyên nhân không phải PCOS phổ biến của cường androgen (xem Hình 16.50). Vì các lý do thực tế, việc lấy mẫu cho 17-OHP huyết thanh sáng sớm và siêu âm thường được lên lịch; đồng thời, bất kỳ quy trình làm việc nào khác có thể được chỉ định bởi các kết quả xét nghiệm ban đầu (ví dụ, testosterone tự do sáng sớm nếu testosterone giữa ngày không rõ ràng khi có chỉ số nghi ngờ lâm sàng cao đối với cường androgen).
Một đánh giá nội tiết toàn diện hơn đôi khi được chỉ định vì đánh giá cơ bản được mô tả trước đó không loại trừ các rối loạn gây nam hóa hiếm gặp (xem Hộp 16.8). Cách tiếp cận các nghiên cứu sâu hơn để xác định nguồn gốc của cường androgen máu thay đổi giữa các chuyên gia phụ và với nhu cầu của từng bệnh nhân.
Sở thích của chúng tôi là sử dụng DAST để cố gắng đưa ra một chẩn đoán dương tính về rối loạn chức năng buồng trứng của PCOS so với việc xác định xem có cần làm thêm xét nghiệm cho các dạng CAH hiếm gặp hoặc các rối loạn thượng thận hiếm gặp khác hay không (Hình 16.51). Sự ức chế androgen và cortisol huyết thanh để đáp ứng với một xét nghiệm ức chế dexamethasone liều thấp phân loại bệnh nhân về mặt chẩn đoán. Sự ức chế testosterone dưới mức bình thường với sự ức chế vỏ thượng thận bình thường cho thấy một nguồn androgen khác ngoài nguồn thượng thận phụ thuộc ACTH và được tìm thấy ở 80% PCOS. Tuy nhiên, khối u hoặc các bệnh lý buồng trứng khác phải được loại trừ bằng siêu âm. Nếu cả sự ức chế cortisol và androgen đều dưới mức bình thường, thì sự dư thừa androgen có thể là thứ phát sau việc không tuân thủ dexamethasone, hội chứng Cushing nội sinh, hoặc kháng glucocorticoid. Nếu sự ức chế testosterone là bình thường, thì nên xét nghiệm kích thích ACTH (cosyntropin) để loại trừ CAH không điển hình. Nếu cả xét nghiệm dexamethasone và ACTH đều bình thường, chẩn đoán có khả năng nhất là PCOS không điển hình của béo phì hoặc cường androgen vô căn.
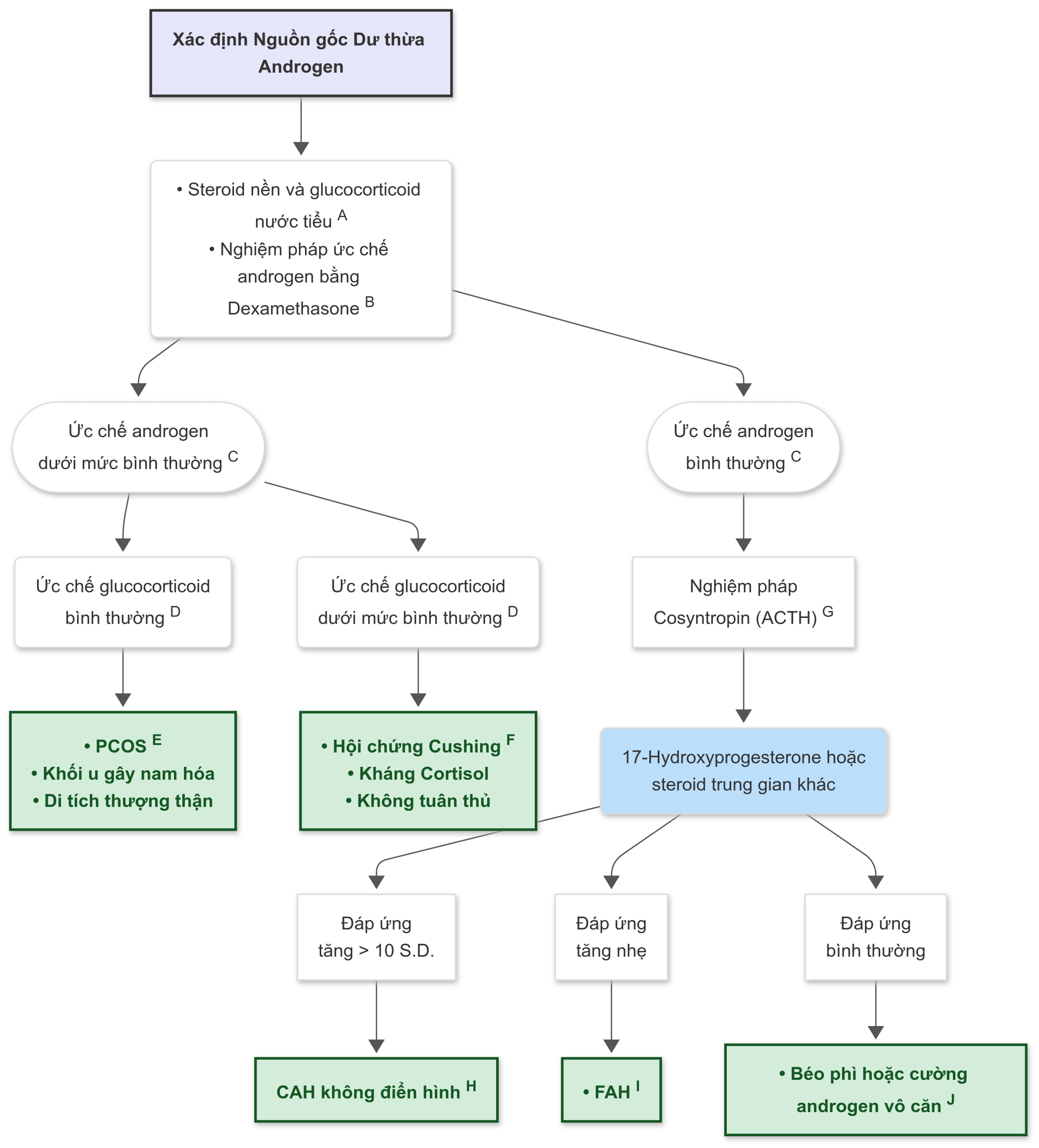
Hình 16.51 Một phương pháp tiếp cận để xác định nguồn gốc của sự dư thừa androgen. Việc xác định nguồn gốc của androgen dư thừa thường cho phép một chẩn đoán dương tính về rối loạn chức năng buồng trứng và thượng thận đặc trưng của hội chứng buồng trứng đa nang (PCOS) và sẽ làm sáng tỏ các rối loạn hiếm gặp bắt chước PCOS. (Từ Buggs C, Rosenfield RL. Polycystic ovary syndrome in adolescence. Endocrinol Metab Clin North Am 2005; 34:677.)
Chú thích:
A. Sau khi lấy một mẫu máu sáng sớm cho các chất trung gian steroid nền (ví dụ, 17-hydroxypregnenolone, 17-hydroxyprogesterone, 11-deoxycortisol, dehydroepiandrosterone, và androstenedione) và một mẫu nước tiểu 24 giờ cho glucocorticoid (tức là, cortisol tự do và 17alpha-hydroxycorticosteroid, cũng như creatinine để kiểm soát tính đầy đủ của việc thu thập), một xét nghiệm ức chế androgen bằng dexamethasone (DAST) được thực hiện.
B. Một DAST ngắn (lấy mẫu máu 4 giờ sau một liều dexamethasone 0.5 mg vào giữa trưa) ức chế tối đa testosterone toàn phần và tự do và 17-hydroxyprogesterone, nhưng dehydroepiandrosterone sulfate (DHEAS) và cortisol không bị ức chế tối đa so với DAST 4 ngày. Một DAST dài (4 ngày) là một xét nghiệm dứt khoát: điều này bao gồm một liệu trình dexamethasone 0.5 mg 4 lần mỗi ngày trong 4 ngày trước một mẫu máu sau xét nghiệm sáng sớm vào ngày 5.
C. Sự ức chế androgen bình thường để đáp ứng với DAST 4 ngày được chỉ ra trong phòng thí nghiệm của chúng tôi bởi testosterone toàn phần dưới 28 ng/dL (1.0 nmol/L), testosterone tự do dưới 8 pg/mL (28 pmol/L), DHEAS dưới 40 mcg/dL (1.0 micromol/L) (> 75% giảm), và 17-hydroxyprogesterone dưới 26 ng/dL (0.8 nmol/L).
D. Sự ức chế glucocorticoid bình thường được chỉ ra bởi cortisol huyết thanh dưới 1.5 mcg/dL (40 nmol/L) và cortisol nước tiểu dưới 10 mcg (27 nmol) mỗi 24 giờ vào ngày thứ hai của việc sử dụng dexamethasone.
E. Sự ức chế androgen dưới mức bình thường và sự ức chế cortisol và DHEAS bình thường là đặc trưng của PCOS, nhưng khối u gây nam hóa thượng thận hoặc di tích thượng thận hiếm gặp (< 1% các trường hợp) nên được xem xét trên cơ sở các đặc điểm lâm sàng. Các khối u gây nam hóa thường được đặc trưng bởi một mô hình bất thường của sự tăng các chất trung gian steroid không điển hình cho tăng sản thượng thận bẩm sinh (CAH).
F. Sự ức chế cả cortisol và androgen dưới mức bình thường phù hợp với hội chứng Cushing nội sinh hoặc kháng cortisol. Sự ức chế kém cũng có thể là kết quả của việc không tuân thủ phác đồ dexamethasone.
G. Một xét nghiệm kích thích cosyntropin (ACTH) là thích hợp nếu sự ức chế androgen bằng dexamethasone là bình thường. Xét nghiệm ACTH thường được thực hiện bằng cách tiêm 250 mcg cosyntropin tĩnh mạch và lấy máu cho các steroid sau 30 đến 60 phút.
H. Chẩn đoán CAH được gợi ý nếu đáp ứng với ACTH cao hơn 10 độ lệch chuẩn (SDs) so với mức trung bình: điều này tương ứng với, ví dụ, 17-hydroxyprogesterone lớn hơn 1500 ng/dL (45 nmol/L), 17-hydroxypregnenolone lớn hơn 5000 ng/dL (158 nmol/L).
I. Cường androgen thượng thận chức năng nguyên phát (FAH) (được gợi ý bởi sự tăng vừa phải của 17-hydroxypregnenolone hoặc 17-hydroxyprogesterone không đáp ứng các tiêu chí chẩn đoán CAH) đôi khi là nguồn duy nhất có thể chứng minh được của sự dư thừa androgen trong PCOS. Một dạng bắt chước hiếm gặp của FAH và cường androgen máu vô căn là thiếu hụt cortisone reductase (biểu kiến): glucocorticoid nước tiểu nền chủ yếu bao gồm các chất chuyển hóa của cortisone thay vì các chất chuyển hóa của cortisol, do đó sự bài tiết 17alpha-hydroxycorticosteroid tăng lên, nhưng sự bài tiết cortisol là bình thường.
J. Khi nguồn gốc của tình trạng không rụng trứng cường androgen máu vẫn không giải thích được sau khi điều tra chuyên sâu (khoảng 10% các trường hợp), nó thường dường như là do PCOS không điển hình của béo phì. Nếu không, chẩn đoán là cường androgen vô căn (khác với rậm lông vô căn) nếu thiếu hụt cortisone reductase (biểu kiến) đã được loại trừ.
Một DAST ngắn (4 giờ), như được mô tả trong chú thích của Hình 16.51, là đủ khi không có nghi ngờ cao về rối loạn gây nam hóa. Nó hữu ích trong việc phân biệt PCOS giả có thể hồi phục của béo phì đơn giản, trong trường hợp đó testosterone ức chế bình thường, với rối loạn chức năng buồng trứng dai dẳng của PCOS thông thường. Tuy nhiên, một liệu trình dexamethasone liều thấp kéo dài hơn (DAST dài, 4 ngày) là cần thiết để ức chế cường androgen của CAH.
Các nghiên cứu chẩn đoán sâu rộng hơn ngoài những nghiên cứu được chỉ định trong Hình 16.50 hiếm khi được chỉ định trừ khi có lý do để nghi ngờ một khối u gây nam hóa hoặc một rối loạn biệt hóa giới tính. Chụp cắt lớp vi tính và MRI cho phép hình dung tốt nhất và đánh giá chi tiết hơn các khối u, đặc biệt là của tuyến thượng thận. Trong những trường hợp hiếm hoi, siêu âm không nhạy trong việc phát hiện một khối u buồng trứng gây nam hóa ở người lớn. Quy trình làm việc sâu hơn hoặc thay thế có thể bao gồm xét nghiệm chất chủ vận GnRH cấp tính, hoặc đánh giá đáp ứng với điều trị ức chế nội tiết tố để xác định nguồn gốc của androgen.
Điều trị
Việc quản lý cường androgen được cá nhân hóa theo các triệu chứng và mục tiêu của bệnh nhân—rậm lông và mụn trứng cá; kinh nguyệt không đều; béo phì—và nguyên nhân của sự dư thừa androgen. Ở đây, chúng ta sẽ thảo luận về việc quản lý PCOS.
Rậm lông và Mụn trứng cá
Các biện pháp thẩm mỹ là nền tảng của việc chăm sóc lông không mong muốn. Tẩy trắng và cạo là đủ đối với nhiều người. Các tác nhân tẩy lông và các phương pháp điều trị bằng sáp rất hữu ích, nhưng dễ gây kích ứng da. Việc bôi kem eflornithine hydrochloride tại chỗ lặp đi lặp lại mang lại sự giảm đáng kể tình trạng rậm lông cục bộ trong vòng 6 đến 8 tuần. Nó là một liệu pháp bổ trợ hữu ích cho việc triệt lông bằng ánh sáng, mang lại một đáp ứng nhanh hơn. Benzoyl peroxide và retinoid tại chỗ là nền tảng của việc chăm sóc mụn trứng cá; kháng sinh đường uống có nguồn gốc từ tetracycline ngắn hạn là thích hợp cho mụn trứng cá viêm từ trung bình đến nặng.
Đối với rậm lông hoặc mụn trứng cá cần nhiều hơn các biện pháp da liễu này, phương pháp điều trị hàng đầu cho cả cường androgen máu và các bất thường kinh nguyệt của PCOS thường là OCP, giúp khắc phục cả hai, với một số được FDA chấp thuận để điều trị mụn trứng cá. Điều trị bằng thuốc kháng androgen cho các triệu chứng trên da được đề nghị cho hầu hết phụ nữ bị cường androgen trước khi tiến hành điều trị bằng triệt lông bằng ánh sáng hoặc isotretinoin đường uống (Accutane®).
Liệu pháp nội tiết được hướng đến việc làm gián đoạn sản xuất hoặc hoạt động của androgen. Điều này làm cho đơn vị nang lông-tuyến bã trở lại loại lông tơ tiền dậy thì (xem Hình 16.29). Tác dụng tối đa lên tuyến bã nhờn xảy ra trong vòng 3 tháng, nhưng tác dụng lên lông sinh dục cần từ 9 đến 12 tháng điều trị, do thời gian dài của chu kỳ phát triển của lông. Rậm lông đòi hỏi phải sử dụng liệu pháp nội tiết miễn là bệnh nhân muốn duy trì sự cải thiện.
Các OCP kết hợp, liệu pháp nội tiết hàng đầu cho phụ nữ có các bất thường về da hoặc kinh nguyệt của PCOS, hoạt động bằng cách ức chế androgen huyết thanh, chủ yếu bằng cách ức chế chức năng buồng trứng. Chúng cũng làm tăng SHBG, ức chế phần tự do của testosterone huyết thanh, và làm giảm vừa phải nồng độ DHEA sulfate. Chúng bình thường hóa nồng độ androgen sau 3 tuần điều trị.
Tất cả các sự kết hợp estrogen-progestin kết hợp với các biện pháp thẩm mỹ đều có hiệu quả tương tự đối với phụ nữ bị mụn trứng cá hoặc rậm lông nhẹ. Có thể dự đoán được sự cải thiện trung bình 7 điểm trên thang điểm rậm lông. So với levonorgestrel hoặc norethindrone, các progestin có tính androgen thấp, chẳng hạn như norgestimate, và các progestin kháng androgen, chẳng hạn như drospironone, tối ưu hóa hồ sơ lipid huyết thanh tốt hơn liên tiếp, nhưng làm tăng nguy cơ thuyên tắc huyết khối tĩnh mạch (VTE) liên tiếp, mặc dù nguy cơ này thường thấp ở tuổi vị thành niên và thấp hơn nhiều so với khi mang thai. Nguy cơ VTE cũng liên quan đến liều estrogen, nhưng các OCP chứa 20 đến 35 mcg ethinyl estradiol thường có tỷ lệ lợi ích-nguy cơ thuận lợi. Các OCP chứa drospirenone cũng có hoạt tính kháng mineralocorticoid và do đó có thể liên quan đến việc tăng cân ít hơn so với các OCP khác.
Các thuốc kháng androgen mang lại sự cải thiện nhẹ về rậm lông vượt xa mức có thể đạt được với OCP. Sự kết hợp này có thể được kỳ vọng sẽ làm giảm điểm số Ferriman-Gallwey từ 15% đến 40%, mặc dù có sự thay đổi đáng kể giữa các cá nhân. Việc sử dụng thuốc kháng androgen cho mục đích này là ngoài nhãn vì tất cả đều có nguy cơ gây ra sự thiếu nam hóa của thai nhi nam. Do đó, tất cả các thuốc kháng androgen nên được kê đơn cùng với một biện pháp tránh thai, tốt nhất là một OCP. Chúng có thể có một tác động khiêm tốn lên các bất thường chuyển hóa liên quan đến PCOS.
Spironolactone liều cao có lẽ là thuốc kháng androgen an toàn và hiệu quả nhất hiện có ở Hoa Kỳ. Các hướng dẫn khuyến nghị bắt đầu với 100 mg hai lần một ngày cho đến khi đạt được hiệu quả tối đa và sau đó cố gắng giảm liều xuống 50 mg hai lần một ngày để điều trị duy trì. Spironolactone thường được dung nạp tốt, nhưng nó chống chỉ định ở những bệnh nhân bị suy thượng thận, gan, hoặc thận. Phụ nữ có nguy cơ bị tăng kali máu nếu đang dùng thuốc lợi tiểu tiết kiệm kali, các chất bổ sung kali, các loại thuốc chống viêm không steroid hàng ngày, các chất ức chế men chuyển angiotensin, heparin, hoặc các loại thuốc như vậy. Do đó, nên theo dõi điện giải. Một mình, nó có xu hướng gây chảy máu không đều.
Các thuốc kháng androgen khác đã được đánh giá rộng rãi để điều trị rậm lông và các tình trạng tương đương rậm lông, bao gồm cyproterone acetate, flutamide, và finasteride. Cyproterone acetate là một thuốc kháng androgen có hoạt tính progestational mạnh được sử dụng với estrogen trong một phác đồ tuần tự ngược: 50 đến 100 mg được dùng trong các ngày từ 1 đến 10 của các chu kỳ trong đó estrogen được dùng từ ngày 1 đến 21. Flutamide là một thuốc kháng androgen đặc hiệu hơn có hiệu quả tương tự như cyproterone và spironolactone, nhưng nó không được khuyến nghị do nguy cơ nhiễm độc gan gây tử vong dường như là đặc ứng. Finasteride, một chất ức chế 5-alpha-reductase loại 1, có xu hướng kém hiệu quả hơn một chút so với các thuốc kháng androgen khác trong điều trị rậm lông và hói đầu kiểu mẫu ở nữ giới. Các thuốc kháng androgen khác mạnh hơn và chọn lọc hơn đang ở giai đoạn đánh giá sớm hơn. Mặc dù minoxidil tại chỗ là loại thuốc duy nhất được chấp thuận để điều trị rụng tóc, liệu pháp antiandrogen-OCP có thể vượt trội ở những người bị PCOS.
Liệu pháp chủ vận GnRH với liệu pháp bổ sung estrogen-progestin nên được xem xét để điều trị cho phụ nữ bị rậm lông chỉ khi họ không dung nạp OCP hoặc nếu OCP không hiệu quả đối với cường androgen máu nặng. Glucocorticoid có hiệu quả hạn chế trong việc quản lý rậm lông của FAH của PCOS.
Kinh nguyệt không đều
OCP, được thảo luận chi tiết trước đó là liệu pháp nội tiết hàng đầu thông thường cho rậm lông và mụn trứng cá không đáp ứng với các biện pháp thẩm mỹ, cũng thường là liệu pháp hàng đầu cho kinh nguyệt không đều. Ngoài các mối quan tâm về vệ sinh, kinh nguyệt không đều cần điều trị vì không rụng trứng mãn tính có liên quan đến nguy cơ tăng sản nội mạc tử cung và ung thư. Mặc dù liều estrogen thấp hơn là an toàn nhất, 30 đến 35 mcg ethinyl-estradiol thường cần thiết ở các bé gái lớn hơn để cung cấp sự đều đặn của kinh nguyệt.
Có một số hạn chế đối với việc sử dụng OCP trong việc quản lý PCOS ở thanh thiếu niên. OCP có thể chống chỉ định ở những bệnh nhân có nguy cơ cao bị huyết khối tĩnh mạch, và chúng nên được sử dụng một cách thận trọng và với liều estrogen thấp nhất có thể ở những bệnh nhân bị đau nửa đầu. OCP phải được ngừng khi bệnh nhân mong muốn có thai. OCP sẽ làm ngừng tăng trưởng ở các bé gái quanh tuổi có kinh. Hậu quả lâu dài của các tác nhân này đối với khả năng sinh sản là không rõ; mặc dù có khả năng lý thuyết về vô kinh sau dùng thuốc tránh thai, estrogen liều rất cao bắt đầu ở tuổi vị thành niên sớm làm tăng nguy cơ suy buồng trứng sớm thay vì suy giảm gonadotropin.
Nên kiểm tra lại bệnh nhân sau 3 tháng điều trị để đánh giá hiệu quả của điều trị và sự bình thường hóa nồng độ androgen. Để ghi nhận sự tồn tại của PCOS và để hạn chế những niềm tin sai lầm rằng việc điều trị là chữa khỏi, nên ngừng OCP trong khoảng 3 tháng khi bệnh nhân đã trưởng thành về mặt phụ khoa để xác định sự tồn tại của tình trạng không rụng trứng cường androgen. Tuy nhiên, khi làm như vậy, phải ghi nhớ rằng tình trạng vô sinh không rụng trứng của PCOS là tương đối, không phải tuyệt đối, do đó cần tư vấn về biện pháp tránh thai.
Liệu pháp chỉ dùng progestin là một sự thay thế cho OCP để kiểm soát sự bất thường của kinh nguyệt. Progesterone micronized (Prometrium®) 100 đến 200 mg mỗi ngày trước khi đi ngủ trong 7 đến 10 ngày gây ra chảy máu do ngừng thuốc ở phần lớn bệnh nhân, nhưng một số không đáp ứng, dường như là do tác động kháng estrogen của sự dư thừa androgen lên nội mạc tử cung, và chảy máu giữa kỳ có khả năng xảy ra nhiều hơn so với OCP. Liệu pháp progestin có sức hấp dẫn ở chỗ cho phép phát hiện sự xuất hiện của chu kỳ kinh nguyệt bình thường. Tuy nhiên, nó không hiệu quả trong việc cải thiện nồng độ androgen hoặc rậm lông. Cô gái quanh tuổi có kinh đáp ứng tốt với liệu pháp progestin có thể được duy trì ở các chu kỳ khoảng 6 tuần để cho phép phát hiện kinh nguyệt tự phát. Các tác dụng phụ của progestin bao gồm các triệu chứng tâm trạng (trầm cảm), đầy hơi, và đau vú. Bệnh nhân phải được thông báo rằng progestin đường uống được dùng theo cách này không phải là một phương tiện tránh thai.
Béo phì và Hội chứng Chuyển hóa
Một xét nghiệm dung nạp glucose đường uống, nhạy hơn để phát hiện tiền đái tháo đường so với hemoglobin A1c, và bảng lipid, được đề nghị ở bệnh nhân PCOS béo phì. Những người bị hội chứng chuyển hóa nên được sàng lọc rối loạn nhịp thở khi ngủ và bệnh gan nhiễm mỡ. Chúng tôi cũng khuyên nên sàng lọc người thân cấp một về hội chứng chuyển hóa và PCOS, vì PCOS có liên quan chặt chẽ đến hội chứng chuyển hóa của cha mẹ và PCOS của mẹ. Phụ nữ bị PCOS có nguy cơ trầm cảm, lo âu, và các rối loạn lưỡng cực, phổ tự kỷ, và thiếu tập trung chú ý tăng đáng kể và nên được sàng lọc các rối loạn này.
Các phương pháp điều trị giảm insulin cho béo phì, từ giảm cân đến điều trị bằng thuốc, cải thiện một cách đồng đều nhưng khiêm tốn tình trạng cường androgen. Sửa đổi lối sống là phương pháp điều trị hàng đầu cho tình trạng thừa cân và béo phì của PCOS. Giảm calo được chỉ định, như với bất kỳ đối tượng béo phì nào. Bệnh nhân béo phì trải qua sự cải thiện các triệu chứng không rụng trứng của họ xấp xỉ tương ứng với lượng cân nặng giảm được. Tuy nhiên, sự cải thiện về rậm lông là tối thiểu.
Phẫu thuật giảm béo đã dẫn đến sự cải thiện về rậm lông, nồng độ androgen, và kinh nguyệt ở phần lớn người lớn béo phì bị PCOS. Phần lớn điều này dường như là do dạng không điển hình của PCOS do béo phì gây ra. Phẫu thuật giảm béo chỉ được đề nghị cho một số thanh thiếu niên được chọn có BMI cực kỳ cao và có quyền truy cập vào các trung tâm chuyên khoa cao.
Metformin thường được sử dụng như một liệu pháp bổ trợ cho việc quản lý béo phì và các bất thường chuyển hóa kháng insulin ở bệnh nhân bị PCOS, mặc dù dung nạp glucose bất thường là chỉ định duy nhất được chấp thuận cho nó. Nó thường được dùng bằng cách tăng liều trong 3 đến 4 tuần từ 500 mg đến 2000 mg chia làm hai liều (hoặc một liều duy nhất của dạng phóng thích kéo dài) hàng ngày, tùy theo khả năng dung nạp, để giảm thiểu chứng chán ăn và buồn nôn. Các tác dụng như vậy góp phần vào việc giảm cân nhưng cũng là nguyên nhân của tỷ lệ bỏ cuộc khoảng 15%. Hiệu quả của Metformin đối với PCOS bị giảm thiểu khi không kiểm soát được cân nặng. Ba thử nghiệm ngẫu nhiên, mù đôi, có đối chứng giả dược đã so sánh metformin với tư vấn lối sống trong 3 đến 6 tháng ở thanh thiếu niên bị PCOS. Metformin được phát hiện là cải thiện đáng kể nồng độ cholesterol HDL. Nó làm tăng khả năng có kinh một cách đáng kể chỉ trong nghiên cứu ngắn nhất trong ba nghiên cứu, với chỉ những xu hướng không đáng kể về sự gia tăng các chu kỳ rụng trứng trong các nghiên cứu khác. Nó không làm giảm nồng độ testosterone hoặc cân nặng tốt hơn đáng kể so với lối sống/giả dược, điều này có khả năng giải thích các tác động không nhất quán của nó lên nồng độ insulin trong các thử nghiệm này. Những kết quả này kém khả quan hơn so với các thử nghiệm nhãn mở.
Các thử nghiệm ngẫu nhiên hiện có so sánh metformin với OCP ở thanh thiếu niên chưa được làm mù, điều này hạn chế chất lượng của chúng. Mặc dù sự ức chế trung bình của nồng độ testosterone tự do là lớn nhất khi dùng OCP, kích thước tương đối nhỏ của các nghiên cứu đã gây khó khăn trong việc chứng minh sự khác biệt thống kê giữa các phương pháp điều trị. Khi metformin và OCP được sử dụng kết hợp, các tác động chuyển hóa tích cực của metformin bị cùn đi bởi các tác động tiêu cực của OCP lên lipid. Metformin đã được báo cáo là cải thiện tác động tiêu cực của một COC lên sự tạo thrombin.
Nên lấy một bảng chuyển hóa toàn diện ban đầu để xác nhận chức năng gan và thận bình thường trước khi bắt đầu liệu pháp metformin. Mặc dù cực kỳ hiếm, nhiễm toan lactic là một biến chứng tiềm tàng của việc sử dụng metformin.
Các liệu pháp chuyển hóa khác chỉ có một vị trí trong việc quản lý PCOS trong chừng mực chúng có thể được chỉ định để kiểm soát bệnh đái tháo đường hoặc tăng lipid máu cùng tồn tại. Do hiệu quả hạn chế và lo ngại về tăng cân và độc tính, thiazolidinedione thường không được khuyến khích ở thanh thiếu niên bị PCOS.
Các xu hướng tương lai
Những tiến bộ to lớn tiếp tục xảy ra trong sự hiểu biết của chúng ta về dậy thì. Việc xác định các gen liên quan đến sự biệt hóa buồng trứng, việc phát hiện ra các hormone và thụ thể hormone mới, những hiểu biết mới về sự điều hòa phiên mã gen và truyền tín hiệu, việc xác định thêm vai trò của các yếu tố di truyền và sự ghi dấu hệ gen biểu sinh trước khi sinh đối với các rối loạn dậy thì, và những tiến bộ trong việc áp dụng khối phổ vào các xét nghiệm steroid cũng có thể được dự đoán sẽ xảy ra trong 5 năm tới. Chúng ta đang ở giữa một sự bùng nổ thông tin trong các ngành khoa học sinh học. Rõ ràng là cơ thể sử dụng một kho dự trữ hormone và các yếu tố tăng trưởng rộng lớn nhưng hữu hạn cho vô số các công dụng bất ngờ. Nhiều khái niệm mà chúng ta trân trọng vào lúc này có khả năng cao nhất là sẽ được chứng minh là những sự đơn giản hóa quá mức, tệ nhất là sai. Thông tin mới xuất hiện nhanh hơn chúng ta có thể tiếp thu. Sự hiểu biết về sự tương tác của bộ gen người với các yếu tố môi trường có thể được kỳ vọng sẽ mang lại những hiểu biết mới về sự hiểu biết của chúng ta về dậy thì và các rối loạn của nó.
BẢNG CHÚ GIẢI THUẬT NGỮ ANH – VIỆT – CHƯƠNG 16
| STT | Tên thuật ngữ tiếng Anh | Phiên âm | Nghĩa tiếng Việt |
|---|---|---|---|
| 1 | Puberty | /ˈpjuːbəti/ | Dậy thì |
| 2 | Secondary sexual characteristics | /ˈsɛkəndəri ˈsɛkʃuəl ˌkærəktəˈrɪstɪks/ | Đặc điểm sinh dục thứ phát |
| 3 | Adolescence | /ˌædəˈlɛsəns/ | Tuổi vị thành niên |
| 4 | Psychosocial | /ˌsaɪkoʊˈsoʊʃəl/ | Tâm lý xã hội |
| 5 | Gonadostat | /ɡəˈnædəstæt/ | Bộ điều hòa sinh dục (hệ thống điều hòa hormone sinh dục) |
| 6 | Sex hormone | /sɛks ˈhɔːrmoʊn/ | Hormone sinh dục |
| 7 | Negative feedback | /ˈnɛɡətɪv ˈfiːdbæk/ | Phản hồi âm |
| 8 | Hypothalamus | /ˌhaɪpoʊˈθæləməs/ | Vùng dưới đồi |
| 9 | Neurohumors | /ˌnʊəroʊˈhjuːmərz/ | Chất dẫn truyền thần kinh |
| 10 | Pituitary | /pɪˈtuːɪˌtɛri/ | Tuyến yên |
| 11 | Gonadotropins | /ɡoʊˌnædəˈtroʊpɪnz/ | Gonadotropin (Hormone hướng sinh dục) |
| 12 | Luteinizing hormone (LH) | /ˈluːtiəˌnaɪzɪŋ ˈhɔːrmoʊn/ | Hormone tạo hoàng thể |
| 13 | Follicle-stimulating hormone (FSH) | /ˈfɑːlɪkəl ˈstɪmjəˌleɪtɪŋ ˈhɔːrmoʊn/ | Hormone kích thích nang trứng |
| 14 | Estrogen | /ˈɛstrədʒən/ | Estrogen |
| 15 | Ovary | /ˈoʊvəri/ | Buồng trứng |
| 16 | Pineal | /ˈpaɪniəl/ | Tuyến tùng |
| 17 | Adrenocortical secretion | /əˌdriːnoʊˈkɔːrtɪkəl sɪˈkriːʃən/ | Sự bài tiết của vỏ thượng thận |
| 18 | Adrenarche | /ˌædrəˈnɑːrki/ | Dậy thì thượng thận |
| 19 | Adrenocorticotropic hormone (ACTH) | /əˌdriːnoʊˌkɔːrtɪkoʊˈtroʊpɪk ˈhɔːrmoʊn/ | Hormone vỏ thượng thận |
| 20 | Radioimmunoassay (RIA) | /ˌreɪdioʊˌɪmjunoʊˈæseɪ/ | Xét nghiệm miễn dịch phóng xạ |
| 21 | Sex steroids | /sɛks ˈstɪəˌrɔɪdz/ | Steroid sinh dục |
| 22 | Gonadotropin-releasing hormone (GnRH) | /ɡoʊˌnædəˈtroʊpɪn rɪˈliːsɪŋ ˈhɔːrmoʊn/ | Hormone giải phóng gonadotropin |
| 23 | Peptide hormones | /ˈpɛptaɪd ˈhɔːrmoʊnz/ | Hormone peptide |
| 24 | Ovarian follicle | /oʊˈvɛəriən ˈfɑːlɪkəl/ | Nang trứng buồng trứng |
| 25 | Steroid hormones | /ˈstɪəˌrɔɪd ˈhɔːrmoʊnz/ | Hormone steroid |
| 26 | GnRH pulse generator | /dʒiː ɛn ɑːr eɪtʃ pʌls ˈdʒɛnəˌreɪtər/ | Bộ tạo xung GnRH |
| 27 | Fetal life | /ˈfiːtəl laɪf/ | Đời sống bào thai |
| 28 | Perinatal life | /ˌpɛrɪˈneɪtəl laɪf/ | Giai đoạn chu sinh |
| 29 | Infancy | /ˈɪnfənsi/ | Giai đoạn sơ sinh |
| 30 | Prepuberty | /ˌpriːˈpjuːbərti/ | Tiền dậy thì |
| 31 | Pituitary gonadotropic cells | /pɪˈtuːɪˌtɛri ˌɡoʊnədoʊˈtroʊpɪk sɛlz/ | Tế bào hướng sinh dục của tuyến yên |
| 32 | Positive feedback mechanism | /ˈpɑːzətɪv ˈfiːdbæk ˈmɛkəˌnɪzəm/ | Cơ chế phản hồi dương |
| 33 | Anterior lobe | /ænˈtɪəriər loʊb/ | Thùy trước (tuyến yên) |
| 34 | Posterior lobe | /pɒˈstɪəriər loʊb/ | Thùy sau (tuyến yên) |
| 35 | Gestational age | /dʒɛˈsteɪʃənəl eɪdʒ/ | Tuổi thai |
| 36 | Olfactory placode | /oʊlˈfæktəri ˈplækoʊd/ | Mảng khứu giác |
| 37 | Medial basal hypothalamus | /ˈmiːdiəl ˈbeɪsəl ˌhaɪpoʊˈθæləməs/ | Vùng dưới đồi nền giữa |
| 38 | Pituitary portal system | /pɪˈtuːɪˌtɛri ˈpɔːrtəl ˈsɪstəm/ | Hệ thống cửa tuyến yên |
| 39 | Menopause | /ˈmɛnəˌpɔːz/ | Mãn kinh |
| 40 | Sexual dimorphisms | /ˈsɛkʃuəl daɪˈmɔːrfɪzəmz/ | Dị hình giới tính |
| 41 | Preoptic nucleus | /priːˈɒptɪk ˈnuːkliəs/ | Nhân trước thị |
| 42 | Virilization | /ˌvɪrələˈzeɪʃən/ | Nam hóa |
| 43 | Progesterone receptor (PR) | /proʊˈdʒɛstəˌroʊn rɪˈsɛptər/ | Thụ thể progesterone |
| 44 | Fetoplacental unit | /ˌfiːtoʊpləˈsɛntəl ˈjuːnɪt/ | Đơn vị thai nhi-nhau thai |
| 45 | Central nervous system (CNS) | /ˈsɛntrəl ˈnɜːrvəs ˈsɪstəm/ | Hệ thần kinh trung ương |
| 46 | Hypophysectomy | /ˌhaɪpəfɪˈsɛktəmi/ | Cắt bỏ tuyến yên |
| 47 | Germ cells | /dʒɜːrm sɛlz/ | Tế bào mầm |
| 48 | Oocytes | /ˈoʊəˌsaɪts/ | Noãn bào |
| 49 | Gametes | /ˈɡæmiːts/ | Giao tử |
| 50 | Urogenital ridge | /ˌjʊəroʊˈdʒɛnɪtəl rɪdʒ/ | Gờ niệu-sinh dục |
| 51 | Anlage | /ˈɑːnlɑːɡə/ | Mầm (cơ quan) |
| 52 | Granulosa cells | /ˌɡrænjəˈloʊsə sɛlz/ | Tế bào hạt |
| 53 | Sertoli cells | /sərˈtoʊli sɛlz/ | Tế bào Sertoli |
| 54 | Theca cells | /ˈθiːkə sɛlz/ | Tế bào vỏ |
| 55 | Interstitial cells | /ˌɪntərˈstɪʃəl sɛlz/ | Tế bào kẽ |
| 56 | Hilus cells | /ˈhaɪləs sɛlz/ | Tế bào rốn (buồng trứng) |
| 57 | Leydig cells | /ˈlaɪdɪɡ sɛlz/ | Tế bào Leydig |
| 58 | Adrenocortical rests | /əˌdriːnoʊˈkɔːrtɪkəl rɛsts/ | Di tích vỏ thượng thận |
| 59 | Yolk sac endoderm | /joʊk sæk ˈɛndoʊˌdɜːrm/ | Nội bì túi noãn hoàng |
| 60 | Signaling cascade | /ˈsɪɡnəlɪŋ kæˈskeɪd/ | Chuỗi tín hiệu |
| 61 | Transcription factor | /trænˈskrɪpʃən ˈfæktər/ | Yếu tố phiên mã |
| 62 | Ovarian differentiation | /oʊˈvɛəriən ˌdɪfəˌrɛnʃiˈeɪʃən/ | Biệt hóa buồng trứng |
| 63 | Primordial germ cell | /praɪˈmɔːrdiəl dʒɜːrm sɛl/ | Tế bào mầm nguyên thủy |
| 64 | Oogonia | /ˌoʊəˈɡoʊniə/ | Noãn nguyên bào |
| 65 | Oogenesis | /ˌoʊəˈdʒɛnəsɪs/ | Quá trình tạo noãn |
| 66 | Meiosis | /maɪˈoʊsɪs/ | Giảm phân |
| 67 | Primary oocytes | /ˈpraɪˌmɛri ˈoʊəˌsaɪts/ | Noãn bào sơ cấp |
| 68 | Diplotene stage | /ˈdɪploʊˌtiːn steɪdʒ/ | Giai đoạn diplotene (của giảm phân) |
| 69 | Primordial follicle | /praɪˈmɔːrdiəl ˈfɑːlɪkəl/ | Nang trứng nguyên thủy |
| 70 | Atresia | /əˈtriːʒə/ | Thoái hóa (nang trứng) |
| 71 | Epithelium | /ˌɛpəˈθiːliəm/ | Biểu mô |
| 72 | Primary follicles | /ˈpraɪˌmɛri ˈfɑːlɪkəlz/ | Nang trứng sơ cấp |
| 73 | Ovarian cortex | /oʊˈvɛəriən ˈkɔːrtɛks/ | Vỏ buồng trứng |
| 74 | Vascular permeability | /ˈvæskjələr ˌpɜːrmiəˈbɪləti/ | Tính thấm thành mạch |
| 75 | Secondary follicles | /ˈsɛkənˌdɛri ˈfɑːlɪkəlz/ | Nang trứng thứ cấp |
| 76 | Preantral follicles | /priːˈæntrəl ˈfɑːlɪkəlz/ | Nang trứng tiền hốc |
| 77 | Antral (graafian) follicles | /ˈæntrəl (ˈɡræfiən) ˈfɑːlɪkəlz/ | Nang trứng có hốc (nang Graaf) |
| 78 | Cumulus | /ˈkjuːmjələs/ | Gò noãn |
| 79 | Apoptotic pathway | /ˌæpəpˈtɑːtɪk ˈpæθˌweɪ/ | Con đường chết theo chương trình |
| 80 | Placenta | /pləˈsɛntə/ | Nhau thai |
| 81 | Insulin resistance | /ˈɪnsəlɪn rɪˈzɪstəns/ | Kháng insulin |
| 82 | Prostaglandin | /ˌprɑːstəˈɡlændɪn/ | Prostaglandin |
| 83 | Cortisol | /ˈkɔːrtɪˌsɔːl/ | Cortisol |
| 84 | Thelarche | /θɪˈlɑːrki/ | Phát triển vú |
| 85 | Menarche | /mɪˈnɑːrki/ | Kinh nguyệt lần đầu |
| 86 | Anovulatory cycle | /ænˈɒvjələˌtɔːri ˈsaɪkəl/ | Chu kỳ không rụng trứng |
| 87 | Ovulatory menstrual periods | /ˈɒvjələˌtɔːri ˈmɛnstruəl ˈpɪəriədz/ | Chu kỳ kinh nguyệt có rụng trứng |
| 88 | Follicular phases | /fəˈlɪkjələr ˈfeɪzɪz/ | Giai đoạn nang trứng |
| 89 | Luteal phase | /ˈluːtiəl feɪz/ | Giai đoạn hoàng thể |
| 90 | Autoamplification | /ˌɔːtoʊˌæmplɪfɪˈkeɪʃən/ | Tự khuếch đại |
| 91 | Dominant follicle | /ˈdɒmɪnənt ˈfɑːlɪkəl/ | Nang trứng trội |
| 92 | Ovulation | /ˌoʊvjəˈleɪʃən/ | Rụng trứng |
| 93 | Preovulatory gonadotropin surge | /priːˈɒvjələˌtɔːri ˌɡoʊnədoʊˈtroʊpɪn sɜːrdʒ/ | Đợt tăng gonadotropin trước rụng trứng |
| 94 | Estrogen-withdrawal bleeding | /ˈɛstrədʒən wɪθˈdrɔːəl ˈbliːdɪŋ/ | Chảy máu do ngừng estrogen |
| 95 | Corpus luteum | /ˈkɔːrpəs ˈluːtiəm/ | Hoàng thể |
| 96 | Polycystic ovary morphology | /ˌpɒliˈsɪstɪk ˈoʊvəri mɔːrˈfɒlədʒi/ | Hình thái buồng trứng đa nang |
| 97 | Premenstrual phase | /ˌpriːˈmɛnstruəl feɪz/ | Giai đoạn tiền kinh nguyệt |
| 98 | Menstruation | /ˌmɛnstruˈeɪʃən/ | Hành kinh |
| 99 | Midcycle surge | /ˌmɪdˈsaɪkəl sɜːrdʒ/ | Đợt tăng giữa chu kỳ |
| 100 | Endometrium | /ˌɛndoʊˈmiːtriəm/ | Nội mạc tử cung |
| 101 | Zeitgeber | /ˈzaɪtɡeɪbər/ | Yếu tố định nhịp (sinh học) |
| 102 | Paracrine | /ˈpærəkrɪn/ | Cận tiết |
| 103 | Autocrine | /ˈɔːtoʊkrɪn/ | Tự tiết |
| 104 | Fibroblast growth factor | /ˈfaɪbroʊˌblæst ɡroʊθ ˈfæktər/ | Yếu tố tăng trưởng nguyên bào sợi |
| 105 | Aromatase | /əˈroʊməˌteɪs/ | Aromatase (enzyme) |
| 106 | Luteinization | /ˌluːtiənaɪˈzeɪʃən/ | Hoàng thể hóa |
| 107 | Phosphodiesterase | /ˌfɒsfoʊdaɪˈɛstəˌreɪs/ | Phosphodiesterase (enzyme) |
| 108 | Secondary oocyte | /ˈsɛkənˌdɛri ˈoʊəˌsaɪt/ | Noãn bào thứ cấp |
| 109 | Polar body | /ˈpoʊlər ˈbɒdi/ | Thể cực |
| 110 | Anti-Müllerian hormone (AMH) | /ˌænti mjuːˈlɪəriən ˈhɔːrmoʊn/ | Hormone kháng Müller |
| 111 | Inhibins | /ɪnˈhɪbɪnz/ | Inhibin |
| 112 | Apoptosis | /ˌæpəpˈtoʊsɪs/ | Chết theo chương trình |
| 113 | Programmed cell death | /ˈproʊɡræmd sɛl dɛθ/ | Chết tế bào theo chương trình |
| 114 | Capillaries | /ˈkæpəˌlɛriz/ | Mao mạch |
| 115 | Fibroblasts | /ˈfaɪbroʊˌblæsts/ | Nguyên bào sợi |
| 116 | Basement membrane | /ˈbeɪsmənt ˈmɛmbreɪn/ | Màng đáy |
| 117 | Luteolysis | /ˌluːtiˈɒlɪsɪs/ | Tiêu hoàng thể |
| 118 | Corpus albicans | /ˈkɔːrpəs ˈælbɪkənz/ | Thể trắng |
| 119 | Implantation | /ˌɪmplænˈteɪʃən/ | Sự làm tổ |
| 120 | Spiral arteries | /ˈspaɪrəl ˈɑːrtəriz/ | Động mạch xoắn |
| 121 | Ischemic necrosis | /ɪˈskiːmɪk nɪˈkroʊsɪs/ | Hoại tử do thiếu máu cục bộ |
| 122 | Basal body temperature | /ˈbeɪsəl ˈbɒdi ˈtɛmpərətʃər/ | Thân nhiệt cơ sở |
| 123 | Luteal phase defects | /ˈluːtiəl feɪz ˈdiːfɛkts/ | Khiếm khuyết giai đoạn hoàng thể |
| 124 | Neuroendocrine | /ˌnʊəroʊˈɛndəkrɪn/ | Thần kinh-nội tiết |
| 125 | Genome-wide association studies (GWAS) | /ˈdʒiːnoʊm waɪd əˌsoʊsiˈeɪʃən ˈstʌdiz/ | Nghiên cứu liên kết toàn bộ gen |
| 126 | Single nucleotide polymorphisms (SNPs) | /ˈsɪŋɡəl ˈnuːkliəˌtaɪd ˌpɒliˈmɔːrfɪzəmz/ | Đa hình đơn nucleotide |
| 127 | G-protein–coupled receptor | /dʒiː ˈproʊˌtiːn ˈkʌpəld rɪˈsɛptər/ | Thụ thể kết cặp với protein G |
| 128 | Neuropeptide | /ˌnʊəroʊˈpɛptaɪd/ | Neuropeptide |
| 129 | Hypogonadotropic hypogonadism | /ˌhaɪpoʊˌɡoʊnədoʊˈtroʊpɪk ˌhaɪpoʊˈɡoʊnəˌdɪzəm/ | Suy sinh dục do giảm gonadotropin |
| 130 | Pubertal delay | /pjuːˈbɜːrtəl dɪˈleɪ/ | Dậy thì muộn |
| 131 | Undernutrition | /ˌʌndərnuːˈtrɪʃən/ | Suy dinh dưỡng |
| 132 | Neurokinin B (NKB) | /ˌnʊəroʊˈkaɪnɪn biː/ | Neurokinin B |
| 133 | Dynorphin A | /daɪˈnɔːrfɪn eɪ/ | Dynorphin A |
| 134 | Pulsatility | /ˌpʌlsəˈtɪləti/ | Tính xung |
| 135 | Loss-of-function mutations | /lɔːs əv ˈfʌŋkʃən mjuːˈteɪʃənz/ | Đột biến mất chức năng |
| 136 | Normosmic | /nɔːrˈmɒzmɪk/ | Khứu giác bình thường |
| 137 | Constitutional delay of growth and pubertal development (CDGP) | /ˌkɒnstɪˈtjuːʃənəl dɪˈleɪ əv ɡroʊθ ænd pjuːˈbɜːrtəl dɪˈvɛləpmənt/ | Chậm tăng trưởng và phát triển dậy thì có tính chất cơ địa |
| 138 | Makorin ring finger protein 3 (MKRN3) | /ˈmækərɪn rɪŋ ˈfɪŋɡər ˈproʊˌtiːn θriː/ | Protein ngón tay vòng makorin 3 |
| 139 | Imprinted gene | /ɪmˈprɪntɪd dʒiːn/ | Gen bị ghi dấu |
| 140 | Prader-Willi syndrome | /ˈprɑːdər ˈwɪli ˈsɪndroʊm/ | Hội chứng Prader-Willi |
| 141 | Arcuate nucleus | /ˈɑːrkjuɪt ˈnuːkliəs/ | Nhân cung |
| 142 | Transsynaptic | /ˌtrænzsɪˈnæptɪk/ | Xuyên synap |
| 143 | Glial-neuronal communication | /ˈɡliːəl nʊəˈroʊnəl kəˌmjuːnɪˈkeɪʃən/ | Giao tiếp tế bào thần kinh đệm-tế bào thần kinh |
| 144 | Gamma-aminobutyric acid (GABA) | /ˈɡæmə əˌmiːnoʊbjuːˈtɪərɪk ˈæsɪd/ | Axit gamma-aminobutyric |
| 145 | Opioidergic | /ˌoʊpiɔɪˈdɜːrdʒɪk/ | (Thuộc) hệ opioid |
| 146 | Gonadotrophin-inhibiting hormone (GnIH) | /ˌɡoʊnədoʊˈtroʊfɪn ɪnˈhɪbɪtɪŋ ˈhɔːrmoʊn/ | Hormone ức chế gonadotropin |
| 147 | Glutamate | /ˈɡluːtəˌmeɪt/ | Glutamate |
| 148 | Glial cells | /ˈɡliːəl sɛlz/ | Tế bào thần kinh đệm |
| 149 | Ionotropic | /aɪˌɒnoʊˈtroʊpɪk/ | (Thụ thể) hướng ion |
| 150 | Metabotropic | /ˌmɛtəboʊˈtroʊpɪk/ | (Thụ thể) hướng chuyển hóa |
| 151 | Neurotransmission | /ˌnʊəroʊtrænzˈmɪʃən/ | Dẫn truyền thần kinh |
| 152 | Tumor-suppressor genes | /ˈtuːmər səˈprɛsər dʒiːnz/ | Gen ức chế khối u |
| 153 | Homeobox genes | /ˈhoʊmioʊˌbɒks dʒiːnz/ | Gen hộp đồng dạng |
| 154 | Williams syndrome | /ˈwɪliəmz ˈsɪndroʊm/ | Hội chứng Williams |
| 155 | Epigenetic regulation | /ˌɛpɪdʒəˈnɛtɪk ˌrɛɡjəˈleɪʃən/ | Điều hòa biểu sinh |
| 156 | Anteroventral periventricular nucleus (AVPV) | /ˌæntəroʊˈvɛntrəl ˌpɛrɪvɛnˈtrɪkjələr ˈnuːkliəs/ | Nhân quanh não thất trước bụng |
| 157 | Skeletal maturation | /ˈskɛlɪtəl ˌmætʃəˈreɪʃən/ | Trưởng thành xương |
| 158 | Congenital adrenal hyperplasia (CAH) | /kənˈdʒɛnɪtəl əˈdriːnəl ˌhaɪpərˈpleɪʒə/ | Tăng sản thượng thận bẩm sinh |
| 159 | Hyperthyroidism | /ˌhaɪpərˈθaɪrɔɪˌdɪzəm/ | Cường giáp |
| 160 | GH deficiency | /dʒiː eɪtʃ dɪˈfɪʃənsi/ | Thiếu hụt hormone tăng trưởng |
| 161 | Hypothyroidism | /ˌhaɪpoʊˈθaɪrɔɪˌdɪzəm/ | Suy giáp |
| 162 | Intrauterine growth retardation | /ˌɪntrəˈjuːtərɪn ɡroʊθ ˌriːtɑːrˈdeɪʃən/ | Chậm tăng trưởng trong tử cung |
| 163 | Endocrine-disrupting chemicals | /ˈɛndəkrɪn dɪsˈrʌptɪŋ ˈkɛmɪkəlz/ | Hóa chất gây rối loạn nội tiết |
| 164 | Growth hormone (GH) | /ɡroʊθ ˈhɔːrmoʊn/ | Hormone tăng trưởng |
| 165 | Bone age | /boʊn eɪdʒ/ | Tuổi xương |
| 166 | Body fat | /ˈbɒdi fæt/ | Mỡ cơ thể |
| 167 | Adiposity | /ˌædɪˈpɒsəti/ | Tình trạng béo |
| 168 | Leptin | /ˈlɛptɪn/ | Leptin |
| 169 | Adipose cells | /ˈædɪˌpoʊs sɛlz/ | Tế bào mỡ |
| 170 | Neuropeptide Y (NPY) | /ˌnʊəroʊˈpɛptaɪd waɪ/ | Neuropeptide Y |
| 171 | Anorexogenic | /ˌænəˌrɛksɪˈdʒɛnɪk/ | Gây chán ăn |
| 172 | Ghrelin | /ˈɡrɛlɪn/ | Ghrelin |
| 173 | Body mass index (BMI) | /ˈbɒdi mæs ˈɪndɛks/ | Chỉ số khối cơ thể |
| 174 | Melanocortin | /ˌmɛlənoʊˈkɔːrtɪn/ | Melanocortin |
| 175 | Alpha-melanocyte–stimulating hormone (MSH) | /ˈælfə məˈlænoʊˌsaɪt ˈstɪmjəˌleɪtɪŋ ˈhɔːrmoʊn/ | Hormone kích thích tế bào hắc tố alpha |
| 176 | Growth hormone secretagogue receptor (GHSR) | /ɡroʊθ ˈhɔːrmoʊn səˈkriːtəˌɡɒɡ rɪˈsɛptər/ | Thụ thể chất kích thích tiết hormone tăng trưởng |
| 177 | Dendritic spines | /dɛnˈdrɪtɪk spaɪnz/ | Gai đuôi gai |
| 178 | Neuronal plasticity | /nʊəˈroʊnəl plæˈstɪsəti/ | Tính dẻo của tế bào thần kinh |
| 179 | Synaptic input | /sɪˈnæptɪk ˈɪnpʊt/ | Đầu vào synap |
| 180 | Long-loop feedback | /lɔːŋ luːp ˈfiːdbæk/ | Phản hồi vòng dài |
| 181 | Short-loop feedback | /ʃɔːrt luːp ˈfiːdbæk/ | Phản hồi vòng ngắn |
| 182 | Infundibular nucleus | /ˌɪnfʌnˈdɪbjələr ˈnuːkliəs/ | Nhân phễu |
| 183 | Ionic calcium | /aɪˈɒnɪk ˈkælsiəm/ | Canxi ion hóa |
| 184 | Autocrine feedback | /ˈɔːtoʊkrɪn ˈfiːdbæk/ | Phản hồi tự tiết |
| 185 | Opiate antagonists | /ˈoʊpiɪt ænˈtæɡənɪsts/ | Chất đối kháng opiate |
| 186 | Proopiomelanocortin | /proʊˌoʊpiəˌmɛlənoʊˈkɔːrtɪn/ | Proopiomelanocortin |
| 187 | Corticotropin releasing hormone (CRH) | /ˌkɔːrtɪkoʊˈtroʊpɪn rɪˈliːsɪŋ ˈhɔːrmoʊn/ | Hormone giải phóng corticotropin |
| 188 | Interleukins | /ˌɪntərˈluːkɪnz/ | Interleukin |
| 189 | Serotonin | /ˌsɛrəˈtoʊnɪn/ | Serotonin |
| 190 | Downregulation | /ˌdaʊnˌrɛɡjəˈleɪʃən/ | Điều hòa giảm |
| 191 | Upregulation | /ˌʌpˌrɛɡjəˈleɪʃən/ | Điều hòa tăng |
| 192 | Follistatin | /ˌfɒlɪˈstætɪn/ | Follistatin |
| 193 | Activins | /ˈæktɪvɪnz/ | Activin |
| 194 | Folliculostellate cells | /fəˌlɪkjəloʊˈstɛleɪt sɛlz/ | Tế bào hình sao nang |
| 195 | Minipuberty of the newborn | /ˈmɪniˈpjuːbərti əv ðə ˈnuːˌbɔːrn/ | Dậy thì mini ở trẻ sơ sinh |
| 196 | Cord blood | /kɔːrd blʌd/ | Máu cuống rốn |
| 197 | Hyperprolactinemia | /ˌhaɪpərˌproʊlækˌtɪˈniːmiə/ | Tăng prolactin máu |
| 198 | Stroma | /ˈstroʊmə/ | Mô đệm |
| 199 | Ovarian volume | /oʊˈvɛəriən ˈvɒljuːm/ | Thể tích buồng trứng |
| 200 | Two-cell, two-gonadotropin model | /tuː sɛl tuː ˌɡoʊnədoʊˈtroʊpɪn ˈmɒdəl/ | Mô hình hai tế bào, hai gonadotropin |
| 201 | Intracrine | /ˈɪntrəkrɪn/ | Nội tiết |
| 202 | Homologous desensitization | /həˈmɒləɡəs diːˌsɛnsɪtaɪˈzeɪʃən/ | Mất nhạy cảm tương đồng |
| 203 | Intraovarian | /ˌɪntrəoʊˈvɛəriən/ | Trong buồng trứng |
| 204 | Adrenal cortex | /əˈdriːnəl ˈkɔːrtɛks/ | Vỏ thượng thận |
| 205 | Zona reticularis | /ˈzoʊnə rɪˌtɪkjəˈlɛərɪs/ | Lớp lưới |
| 206 | Sự phát triển lông mu | /pjuːˈbɑːrki/ | Mọc lông mu |
| 207 | Sebaceous gland | /sɪˈbeɪʃəs ɡlænd/ | Tuyến bã |
| 208 | Apocrine gland | /ˈæpəkrɪn ɡlænd/ | Tuyến mồ hôi dầu |
| 209 | 3β-hydroxysteroid dehydrogenase | /θriː ˈbeɪtə haɪˌdrɒksiˈstɪəˌrɔɪd ˌdiːhaɪˈdrɒdʒəˌneɪs/ | 3β-hydroxysteroid dehydrogenase (enzyme) |
| 210 | Cytochrome b5 | /ˈsaɪtəˌkroʊm biː faɪv/ | Cytochrome b5 |
| 211 | Steroid sulfotransferase | /ˈstɪəˌrɔɪd ˌsʌlfoʊˈtrænsfəˌreɪs/ | Steroid sulfotransferase (enzyme) |
| 212 | 17β-hydroxysteroid dehydrogenase | /ˌsɛvənˈtiːn ˈbeɪtə haɪˌdrɒksiˈstɪəˌrɔɪd ˌdiːhaɪˈdrɒdʒəˌneɪs/ | 17β-hydroxysteroid dehydrogenase (enzyme) |
| 213 | 11β-hydroxylase | /ɪˈlɛvən ˈbeɪtə haɪˈdrɒksɪˌleɪs/ | 11β-hydroxylase (enzyme) |
| 214 | Progenitor cell | /proʊˈdʒɛnɪtər sɛl/ | Tế bào tiền thân |
| 215 | Glucocorticoid | /ˌɡluːkoʊˈkɔːrtɪˌkɔɪd/ | Glucocorticoid |
| 216 | Neurobiological development | /ˌnʊəroʊˌbaɪəˈlɒdʒɪkəl dɪˈvɛləpmənt/ | Phát triển thần kinh sinh học |
| 217 | Corticolimbic system | /ˌkɔːrtɪkoʊˈlɪmbɪk ˈsɪstəm/ | Hệ thống vỏ não-limbic |
| 218 | Neuroactive | /ˌnʊəroʊˈæktɪv/ | Có hoạt tính thần kinh |
| 219 | Blood-brain barrier | /blʌd breɪn ˈbæriər/ | Hàng rào máu-não |
| 220 | Sexual attraction | /ˈsɛkʃuəl əˈtrækʃən/ | Hấp dẫn giới tính |
| 221 | Stress-adaptive | /strɛs əˈdæptɪv/ | Thích ứng với căng thẳng |
| 222 | Social maturational behavior | /ˈsoʊʃəl ˌmætʃəˈreɪʃənəl bɪˈheɪvjər/ | Hành vi trưởng thành xã hội |
| 223 | Plasma membranes | /ˈplæzmə ˈmɛmbreɪnz/ | Màng huyết tương |
| 224 | Guanine nucleotide (G-protein) | /ˈɡwɑːniːn ˈnuːkliəˌtaɪd (dʒiː ˈproʊˌtiːn)/ | Nucleotide guanin (protein G) |
| 225 | Adenylate cyclase | /əˈdɛnəˌleɪt ˈsaɪˌkleɪs/ | Adenylate cyclase (enzyme) |
| 226 | Protein kinase | /ˈproʊˌtiːn ˈkaɪˌneɪs/ | Protein kinase |
| 227 | Phosphorylation | /ˌfɒsfəraɪˈleɪʃən/ | Phosphoryl hóa |
| 228 | Decapeptide | /ˌdɛkəˈpɛptaɪd/ | Decapeptide (peptide 10 acid amin) |
| 229 | Prolactin release-inhibiting factor | /proʊˈlæktɪn rɪˈliːs ɪnˈhɪbɪtɪŋ ˈfæktər/ | Yếu tố ức chế giải phóng prolactin |
| 230 | Glycoprotein | /ˌɡlaɪkoʊˈproʊˌtiːn/ | Glycoprotein |
| 231 | Endoplasmic reticulum | /ˌɛndoʊˈplæzmɪk rɪˈtɪkjələm/ | Lưới nội chất |
| 232 | Golgi apparatus | /ˈɡoʊldʒi ˌæpəˈrætəs/ | Bộ máy Golgi |
| 233 | Carbohydrate moieties | /ˌkɑːrboʊˈhaɪdreɪt ˈmɔɪətiz/ | Các gốc carbohydrate |
| 234 | Amino acid sequence | /əˈmiːnoʊ ˈæsɪd ˈsiːkwəns/ | Trình tự axit amin |
| 235 | Glycosylation | /ˌɡlaɪkəsaɪˈleɪʃən/ | Glycosyl hóa |
| 236 | Molecular heterogeneity | /məˈlɛkjələr ˌhɛtəroʊdʒəˈniːəti/ | Tính không đồng nhất phân tử |
| 237 | Sialylation | /ˌsaɪəlɪˈleɪʃən/ | Sialyl hóa |
| 238 | Sulfonation | /ˌsʌlfəˈneɪʃən/ | Sulfonat hóa |
| 239 | Bioactivity | /ˌbaɪoʊækˈtɪvəti/ | Hoạt tính sinh học |
| 240 | Polymorphisms | /ˌpɒliˈmɔːrfɪzəmz/ | Tính đa hình |
| 241 | Isoform | /ˈaɪsoʊˌfɔːrm/ | Dạng đồng phân |
| 242 | Epitopes | /ˈɛpɪˌtoʊps/ | Epitope (quyết định kháng nguyên) |
| 243 | Gonadotropin antagonists | /ˌɡoʊnədoʊˈtroʊpɪn ænˈtæɡənɪsts/ | Chất đối kháng gonadotropin |
| 244 | Immunometric assays | /ˌɪmjənoʊˈmɛtrɪk əˈseɪz/ | Xét nghiệm miễn dịch đo lường |
| 245 | Serum half-life | /ˈsɪərəm hæf laɪf/ | Thời gian bán thải trong huyết thanh |
| 246 | Production rates | /prəˈdʌkʃən reɪts/ | Tốc độ sản xuất |
| 247 | Placental lactogen | /pləˈsɛntəl ˈlæktoʊdʒən/ | Lactogen nhau thai |
| 248 | Lactotrope | /ˈlæktoʊˌtroʊp/ | Tế bào tiết prolactin |
| 249 | Dopamine | /ˈdoʊpəˌmiːn/ | Dopamine |
| 250 | Thyrotropin-releasing hormone (TRH) | /ˌθaɪroʊˈtroʊpɪn rɪˈliːsɪŋ ˈhɔːrmoʊn/ | Hormone giải phóng thyrotropin |
| 251 | Dimerization | /daɪˌmɛrɪˈzeɪʃən/ | Đime hóa |
| 252 | Steroid biosynthesis | /ˈstɪəˌrɔɪd ˌbaɪoʊˈsɪnθəsɪs/ | Sinh tổng hợp steroid |
| 253 | Cholesterol esters | /kəˈlɛstəˌrɔːl ˈɛstərz/ | Este cholesterol |
| 254 | Low-density lipoprotein | /loʊ ˈdɛnsəti ˌlaɪpoʊˈproʊˌtiːn/ | Lipoprotein tỷ trọng thấp |
| 255 | Mitochondrial membrane | /ˌmaɪtəˈkɒndriəl ˈmɛmbreɪn/ | Màng ty thể |
| 256 | Steroidogenic acute regulatory protein (StAR) | /ˌstɪərɔɪˈdɑːdʒənɪk əˈkjuːt ˈrɛɡjələˌtɔːri ˈproʊˌtiːn/ | Protein điều hòa cấp tính sinh steroid |
| 257 | Side chain cleavage | /saɪd tʃeɪn ˈkliːvɪdʒ/ | Cắt chuỗi bên |
| 258 | 17α-hydroxylation | /ˌsɛvənˈtiːn ˈælfə haɪˌdrɒksɪˈleɪʃən/ | 17α-hydroxyl hóa |
| 259 | Isozyme | /ˈaɪsoʊˌzaɪm/ | Isozyme (enzym đồng dạng) |
| 260 | Cytochrome P450 oxidoreductase (POR) | /ˈsaɪtəˌkroʊm piː ˌfɔːrˈfɪfti ˌɒksɪdoʊrɪˈdʌkˌteɪs/ | Cytochrome P450 oxidoreductase |
| 261 | Steroid sulfatase | /ˈstɪəˌrɔɪd ˈsʌlfəˌteɪs/ | Steroid sulfatase (enzyme) |
| 262 | Metabolic clearance rate | /ˌmɛtəˈbɒlɪk ˈklɪərəns reɪt/ | Tốc độ thanh thải chuyển hóa |
| 263 | Urinary testosterone glucuronide | /ˈjʊərɪˌnɛri tɛˈstɒstəˌroʊn ɡluːˈkjʊərəˌnaɪd/ | Testosterone glucuronide trong nước tiểu |
| 264 | Phytoestrogens | /ˌfaɪtoʊˈɛstrədʒənz/ | Phytoestrogen (estrogen thực vật) |
| 265 | Selective ER modulators (SERMs) | /sɪˈlɛktɪv iː ɑːr ˈmɒdʒəˌleɪtərz/ | Chất điều biến thụ thể estrogen chọn lọc |
| 266 | Plasticizers | /ˈplæstɪˌsaɪzərz/ | Chất hóa dẻo |
| 267 | Prehormones | /ˌpriːˈhɔːrmoʊnz/ | Tiền hormone |
| 268 | Adipose tissue | /ˈædɪˌpoʊs ˈtɪʃuː/ | Mô mỡ |
| 269 | Mixed function oxidases | /mɪkst ˈfʌŋkʃən ˈɒksɪˌdeɪsɪz/ | Oxidase chức năng hỗn hợp |
| 270 | Sex hormone binding globulin (SHBG) | /sɛks ˈhɔːrmoʊn ˈbaɪndɪŋ ˈɡlɒbjəlɪn/ | Globulin gắn hormone sinh dục |
| 271 | 5α-reductase | /faɪv ˈælfə rɪˈdʌkˌteɪs/ | 5α-reductase (enzyme) |
| 272 | Cytosol receptor | /ˈsaɪtəˌsɔːl rɪˈsɛptər/ | Thụ thể bào tương |
| 273 | Nuclear hormone receptors | /ˈnuːkliər ˈhɔːrmoʊn rɪˈsɛptərz/ | Thụ thể hormone nhân |
| 274 | Chaperone heat shock proteins | /ˈʃæpəˌroʊn hiːt ʃɒk ˈproʊˌtiːnz/ | Protein sốc nhiệt chaperone |
| 275 | Hormone response element | /ˈhɔːrmoʊn rɪˈspɒns ˈɛləmənt/ | Yếu tố đáp ứng hormone |
| 276 | Transcriptional regulator | /trænˈskrɪpʃənəl ˈrɛɡjəˌleɪtər/ | Chất điều hòa phiên mã |
| 277 | Ligand | /ˈlaɪɡənd/ | Phối tử |
| 278 | Agonists | /ˈæɡənɪsts/ | Chất chủ vận |
| 279 | Antagonist | /ænˈtæɡənɪst/ | Chất đối kháng |
| 280 | Coregulator proteins | /ˌkoʊˈrɛɡjələˌtɔːri ˈproʊˌtiːnz/ | Protein đồng điều hòa |
| 281 | Coactivators | /ˌkoʊˈæktɪˌveɪtərz/ | Chất đồng kích hoạt |
| 282 | Corepressors | /ˌkoʊrɪˈprɛsərz/ | Chất đồng ức chế |
| 283 | Mitogen-activated protein (MAP) kinase | /ˈmaɪtədʒən ˈæktɪˌveɪtɪd ˈproʊˌtiːn ˈkaɪˌneɪs/ | Kinase protein được hoạt hóa bởi mitogen |
| 284 | Heterodimerization | /ˌhɛtəroʊˌdaɪmərəˈzeɪʃən/ | Dị đime hóa |
| 285 | Antiapoptotic effects | /ˌæntiˌæpəpˈtɑːtɪk ɪˈfɛkts/ | Tác dụng chống chết theo chương trình |
| 286 | Osteoblasts | /ˈɒstioʊˌblæsts/ | Nguyên bào xương |
| 287 | Osteocytes | /ˈɒstioʊˌsaɪts/ | Tế bào xương |
| 288 | Nongenomic | /ˌnɒndʒəˈnoʊmɪk/ | Không qua gen |
| 289 | Genotropic | /ˌdʒiːnoʊˈtroʊpɪk/ | Hướng gen |
| 290 | Nongenotropic | /ˌnɒndʒiːnoʊˈtroʊpɪk/ | Không hướng gen |
| 291 | Scaffolding proteins | /ˈskæfoʊldɪŋ ˈproʊˌtiːnz/ | Protein giàn giáo |
| 292 | Neurosteroids | /ˌnʊəroʊˈstɪəˌrɔɪdz/ | Neurosteroid (steroid thần kinh) |
| 293 | Müllerian system | /mjuːˈlɪəriən ˈsɪstəm/ | Hệ thống Müller |
| 294 | Genital swelling | /ˈdʒɛnɪtəl ˈswɛlɪŋ/ | Sưng sinh dục |
| 295 | Labia minora | /ˈleɪbiə maɪˈnɔːrə/ | Môi nhỏ |
| 296 | Prepuce | /ˈpriːpjuːs/ | Bao quy đầu |
| 297 | Glans | /ɡlændz/ | Quy đầu |
| 298 | Genital ambiguity | /ˈdʒɛnɪtəl ˌæmbɪˈɡjuːəti/ | Mơ hồ giới tính |
| 299 | Dysplasia | /dɪsˈpleɪʒə/ | Loạn sản |
| 300 | Cervical glands | /ˈsɜːrvɪkəl ɡlændz/ | Tuyến cổ tử cung |
| 301 | Endometrial hyperplasia | /ˌɛndoʊˈmiːtriəl ˌhaɪpərˈpleɪʒə/ | Tăng sản nội mạc tử cung |
| 302 | Progestin | /proʊˈdʒɛstɪn/ | Progestin (progesterone tổng hợp) |
| 303 | Endocervical gland | /ˌɛndoʊˈsɜːrvɪkəl ɡlænd/ | Tuyến nội mạc cổ tử cung |
| 304 | Vaginal vault | /ˈvædʒɪnəl vɔːlt/ | Vòm âm đạo |
| 305 | Cervical mucus | /ˈsɜːrvɪkəl ˈmjuːkəs/ | Chất nhầy cổ tử cung |
| 306 | Spinnbarkeit | /ˈʃpɪnbɑːrkaɪt/ | Độ kéo sợi (chất nhầy) |
| 307 | Urogenital tract | /ˌjʊəroʊˈdʒɛnɪtəl trækt/ | Đường niệu-sinh dục |
| 308 | Stratified squamous epithelium | /ˈstrætɪˌfaɪd ˈskweɪməs ˌɛpəˈθiːliəm/ | Biểu mô lát tầng |
| 309 | Basal layer | /ˈbeɪsəl ˈleɪər/ | Lớp đáy |
| 310 | Parabasal layer | /ˌpærəˈbeɪsəl ˈleɪər/ | Lớp cận đáy |
| 311 | Superficial layer | /ˌsuːpərˈfɪʃəl ˈleɪər/ | Lớp bề mặt |
| 312 | Vaginal smears | /ˈvædʒɪnəl smɪərz/ | Phết tế bào âm đạo |
| 313 | Cornification | /ˌkɔːrnɪfɪˈkeɪʃən/ | Sừng hóa |
| 314 | Hymen | /ˈhaɪmən/ | Màng trinh |
| 315 | Mammary glands | /ˈmæməri ɡlændz/ | Tuyến vú |
| 316 | Mammary ducts | /ˈmæməri dʌkts/ | Ống dẫn sữa |
| 317 | Nipple | /ˈnɪpəl/ | Núm vú |
| 318 | Ductules | /ˈdʌktjuːlz/ | Ống nhỏ |
| 319 | Lobulation | /ˌlɒbjəˈleɪʃən/ | Tạo thùy |
| 320 | Alveolar development | /ælˈviːələr dɪˈvɛləpmənt/ | Phát triển phế nang |
| 321 | Pilosebaceous unit (PSU) | /ˌpaɪloʊsɪˈbeɪʃəs ˈjuːnɪt/ | Đơn vị nang lông-tuyến bã |
| 322 | Piliary | /ˈpɪliəri/ | (Thuộc) lông |
| 323 | Vellus follicle | /ˈvɛləs ˈfɑːlɪkəl/ | Nang lông tơ |
| 324 | Terminal hair follicle | /ˈtɜːrmɪnəl hɛər ˈfɑːlɪkəl/ | Nang lông vĩnh viễn |
| 325 | Keratin | /ˈkɛrətɪn/ | Keratin |
| 326 | Male-pattern alopecia | /meɪl ˈpætərn ˌæləˈpiːʃə/ | Hói đầu kiểu nam |
| 327 | Sebaceous follicle | /sɪˈbeɪʃəs ˈfɑːlɪkəl/ | Nang tuyến bã |
| 328 | Catagen | /ˈkætədʒən/ | Giai đoạn thoái triển (của lông) |
| 329 | Retinoic acid | /ˌrɛtɪˈnoʊɪk ˈæsɪd/ | Axit retinoic |
| 330 | Sebocyte | /ˈsiːboʊˌsaɪt/ | Tế bào tuyến bã |
| 331 | Epiphyseal growth | /ˌɛpɪˈfɪziəl ɡroʊθ/ | Tăng trưởng đầu xương |
| 332 | Epiphyseal closure | /ˌɛpɪˈfɪziəl ˈkloʊʒər/ | Đóng đầu xương |
| 333 | Cortical bone | /ˈkɔːrtɪkəl boʊn/ | Xương vỏ |
| 334 | Cancellous bone | /ˈkænsələs boʊn/ | Xương xốp |
| 335 | Periosteal bone | /ˌpɛriˈɒstiəl boʊn/ | Xương màng ngoài |
| 336 | Bone accrual | /boʊn əˈkruːəl/ | Sự tích lũy xương |
| 337 | Gluteofemoral fat | /ˌɡluːtioʊˈfɛmərəl fæt/ | Mỡ vùng mông-đùi |
| 338 | Visceral fat | /ˈvɪsərəl fæt/ | Mỡ nội tạng |
| 339 | Adipocyte | /ˈædɪpoʊˌsaɪt/ | Tế bào mỡ |
| 340 | Adipogenesis | /ˌædɪpoʊˈdʒɛnəsɪs/ | Quá trình tạo mỡ |
| 341 | Lipogenesis | /ˌlaɪpoʊˈdʒɛnəsɪs/ | Quá trình tổng hợp lipid |
| 342 | Lipolysis | /laɪˈpɒlɪsɪs/ | Quá trình phân giải lipid |
| 343 | Adipokine | /ˌædɪpoʊˈkaɪn/ | Adipokine |
| 344 | Myogenesis | /ˌmaɪoʊˈdʒɛnəsɪs/ | Quá trình tạo cơ |
| 345 | Mesenchymal pluripotent stem cells | /ˌmɛsənˈkaɪməl ˌplʊərɪˈpoʊtənt stɛm sɛlz/ | Tế bào gốc trung mô đa năng |
| 346 | Myogenic lineage | /ˌmaɪoʊˈdʒɛnɪk ˈlɪniɪdʒ/ | Dòng tạo cơ |
| 347 | Lipoprotein lipase | /ˌlaɪpoʊˈproʊˌtiːn ˈlaɪˌpeɪs/ | Lipoprotein lipase (enzyme) |
| 348 | Subcutaneous white adipose tissue (SCWAT) | /ˌsʌbkjuːˈteɪniəs waɪt ˈædɪˌpoʊs ˈtɪʃuː/ | Mô mỡ trắng dưới da |
| 349 | Hormone-sensitive lipase | /ˈhɔːrmoʊn ˈsɛnsətɪv ˈlaɪˌpeɪs/ | Lipase nhạy cảm với hormone |
| 350 | Oophorectomy | /ˌoʊəfəˈrɛktəmi/ | Cắt buồng trứng |
| 351 | Brown adipose tissue | /braʊn ˈædɪˌpoʊs ˈtɪʃuː/ | Mô mỡ nâu |
| 352 | Chylomicron | /ˌkaɪloʊˈmaɪkrɒn/ | Chylomicron |
| 353 | Triglyceride | /traɪˈɡlɪsəˌraɪd/ | Triglyceride |
| 354 | Muscle mass | /ˈmʌsəl mæs/ | Khối lượng cơ |
| 355 | Muscle cell hypertrophy | /ˈmʌsəl sɛl haɪˈpɜːrtrəfi/ | Phì đại tế bào cơ |
| 356 | Hyperplasia | /ˌhaɪpərˈpleɪʒə/ | Tăng sản |
| 357 | Motor neurons | /ˈmoʊtər ˈnʊərɒnz/ | Tế bào thần kinh vận động |
| 358 | Gender identity | /ˈdʒɛndər aɪˈdɛntəti/ | Bản dạng giới |
| 359 | Gender orientation | /ˈdʒɛndər ˌɔːriənˈteɪʃən/ | Xu hướng tính dục |
| 360 | Epigenetic factors | /ˌɛpɪdʒəˈnɛtɪk ˈfæktərz/ | Yếu tố biểu sinh |
| 361 | Glutamatergic neurons | /ˌɡluːtəməˈtɜːrdʒɪk ˈnʊərɒnz/ | Tế bào thần kinh glutamatergic |
| 362 | Sex-specific imprinting | /sɛks spəˈsɪfɪk ɪmˈprɪntɪŋ/ | Ghi dấu đặc hiệu giới tính |
| 363 | Autosomal genes | /ˌɔːtəˈsoʊməl dʒiːnz/ | Gen trên nhiễm sắc thể thường |
| 364 | Synapse formation | /ˈsɪnæps fɔːrˈmeɪʃən/ | Hình thành synap |
| 365 | Synapse pruning | /ˈsɪnæps ˈpruːnɪŋ/ | Cắt tỉa synap |
| 366 | Dendritic spine cells | /dɛnˈdrɪtɪk spaɪn sɛlz/ | Tế bào gai đuôi gai |
| 367 | Microglia | /maɪˈkroʊɡliə/ | Vi bào thần kinh đệm |
| 368 | Visual-spatial skills | /ˈvɪʒuəl ˈspeɪʃəl skɪlz/ | Kỹ năng không gian-thị giác |
| 369 | Gender dimorphic behaviors | /ˈdʒɛndər daɪˈmɔːrfɪk bɪˈheɪvjərz/ | Hành vi lưỡng hình giới tính |
| 370 | Libido | /lɪˈbiːdoʊ/ | Ham muốn tình dục |
| 371 | Transsexualism/transgenderism | /trænsˈsɛkʃuəˌlɪzəm/trænsˈdʒɛndərɪzəm/ | Chuyển giới |
| 372 | Homosexuality | /ˌhoʊmoʊˌsɛkʃuˈæləti/ | Đồng tính luyến ái |
| 373 | Bisexuality | /ˌbaɪˌsɛkʃuˈæləti/ | Song tính luyến ái |
| 374 | Pheromone | /ˈfɛrəˌmoʊn/ | Pheromone (chất dẫn dụ giới tính) |
| 375 | Olfactory receptors | /oʊlˈfæktəri rɪˈsɛptərz/ | Thụ thể khứu giác |
| 376 | Muscular dystrophy | /ˈmʌskjələr ˈdɪstrəfi/ | Loạn dưỡng cơ |
| 377 | Autoimmune disorders | /ˌɔːtoʊɪˈmjuːn dɪsˈɔːrdərz/ | Rối loạn tự miễn |
| 378 | Inflammatory cytokine | /ɪnˈflæməˌtɔːri ˈsaɪtəˌkaɪn/ | Cytokine gây viêm |
| 379 | Cardiovascular | /ˌkɑːrdioʊˈvæskjələr/ | Tim mạch |
| 380 | Endothelial nitric oxide synthase | /ˌɛndoʊˈθiːliəl ˈnaɪtrɪk ˈɒksaɪd ˈsɪnθeɪs/ | Nitric oxide synthase nội mô |
| 381 | Endothelial dysfunction | /ˌɛndoʊˈθiːliəl dɪsˈfʌŋkʃən/ | Rối loạn chức năng nội mô |
| 382 | Antimineralocorticoid | /ˌæntiˌmɪnərəloʊˈkɔːrtɪˌkɔɪd/ | Kháng mineralocorticoid |
| 383 | Hemostatic effects | /ˌhiːmoʊˈstætɪk ɪˈfɛkts/ | Tác dụng cầm máu |
| 384 | Anticoagulant | /ˌæntiˌkoʊˈæɡjələnt/ | Chống đông máu |
| 385 | Venous thromboembolism | /ˈviːnəs ˌθrɒmboʊˈɛmbəˌlɪzəm/ | Thuyên tắc huyết khối tĩnh mạch |
| 386 | Arterial thrombosis | /ɑːrˈtɪəriəl θrɒmˈboʊsɪs/ | Huyết khối động mạch |
| 387 | High-density lipoprotein cholesterol (HDL-C) | /haɪ ˈdɛnsəti ˌlaɪpoʊˈproʊˌtiːn kəˈlɛstəˌrɔːl/ | Cholesterol lipoprotein tỷ trọng cao |
| 388 | Very low-density lipoprotein (VLDL) | /ˈvɛri loʊ ˈdɛnsəti ˌlaɪpoʊˈproʊˌtiːn/ | Lipoprotein tỷ trọng rất thấp |
| 389 | Low-density lipoprotein (LDL-C) | /loʊ ˈdɛnsəti ˌlaɪpoʊˈproʊˌtiːn kəˈlɛstəˌrɔːl/ | Cholesterol lipoprotein tỷ trọng thấp |
| 390 | Colostrum | /kəˈlɒstrəm/ | Sữa non |
| 391 | Ovarian insufficiency | /oʊˈvɛəriən ˌɪnsəˈfɪʃənsi/ | Suy buồng trứng |
| 392 | Adrenocortical zone | /əˌdriːnoʊˈkɔːrtɪkəl zoʊn/ | Vùng vỏ thượng thận |
| 393 | Hyperestrogenism | /ˌhaɪpərˌɛstroʊdʒəˈnɪzəm/ | Cường estrogen |
| 394 | Urogenital cytology | /ˌjʊəroʊˈdʒɛnɪtəl saɪˈtɒlədʒi/ | Tế bào học niệu-sinh dục |
| 395 | Ovarian reserve | /oʊˈvɛəriən rɪˈzɜːrv/ | Dự trữ buồng trứng |
| 396 | Diurnal | /daɪˈɜːrnəl/ | (Theo) nhịp ngày đêm |
| 397 | Pubertal stage | /pjuːˈbɜːrtəl steɪdʒ/ | Giai đoạn dậy thì |
| 398 | Hypertrichosis | /ˌhaɪpərtrɪˈkoʊsɪs/ | Chứng rậm lông |
| 399 | Escutcheon | /ɪˈskʌtʃən/ | Vùng lông mu |
| 400 | Axillary hair | /ˈæksəˌlɛri hɛər/ | Lông nách |
| 401 | Pubertal tempo | /pjuːˈbɜːrtəl ˈtɛmpoʊ/ | Nhịp độ dậy thì |
| 402 | Linear growth velocity | /ˈlɪniər ɡroʊθ vɪˈlɒsəti/ | Vận tốc tăng trưởng chiều cao |
| 403 | Alkaline phosphatase | /ˈælkəˌlaɪn ˈfɒsfəˌteɪs/ | Phosphatase kiềm |
| 404 | Habitus | /ˈhæbɪtəs/ | Thể trạng |
| 405 | Gynecological age | /ˌɡaɪnɪkəˈlɒdʒɪkəl eɪdʒ/ | Tuổi phụ khoa |
| 406 | Anovulatory | /ænˈɒvjələˌtɔːri/ | Không rụng trứng |
| 407 | Luteal insufficiency | /ˈluːtiəl ˌɪnsəˈfɪʃənsi/ | Suy hoàng thể |
| 408 | Primary amenorrhea | /ˈpraɪˌmɛri əˌmɛnəˈriːə/ | Vô kinh nguyên phát |
| 409 | Secondary amenorrhea | /ˈsɛkənˌdɛri əˌmɛnəˈriːə/ | Vô kinh thứ phát |
| 410 | Oligomenorrhea | /ˌɒlɪɡoʊˌmɛnəˈriːə/ | Kinh thưa |
| 411 | Unilateral | /ˌjuːnɪˈlætərəl/ | Một bên |
| 412 | Excisional biopsy | /ɪkˈsɪʒənəl ˈbaɪɒpsi/ | Sinh thiết cắt bỏ |
| 413 | Premature Phát triển vú | /ˌpriːməˈtʃʊər θɪˈlɑːrki/ | Phát triển vú sớm (Phát triển vú sớm) |
| 414 | Adipomastia | /ˌædɪpoʊˈmæstiə/ | Vú to do mỡ |
| 415 | Premature sự phát triển lông mu | /ˌpriːməˈtʃʊər pjuːˈbɑːrki/ | Sự phát triển lông mu sớm (Mọc lông mu sớm) |
| 416 | Premature adrenarche | /ˌpriːməˈtʃʊər ˌædrəˈnɑːrki/ | Dậy thì thượng thận sớm |
| 417 | Acanthosis nigricans | /ˌæˌkænθoʊsɪs ˈnaɪɡrɪkənz/ | Gai đen |
| 418 | Virilizing disorders | /ˈvɪrəˌlaɪzɪŋ dɪsˈɔːrdərz/ | Rối loạn gây nam hóa |
| 419 | Temporal lobe lesions | /ˈtɛmpərəl loʊb ˈliːʒənz/ | Tổn thương thùy thái dương |
| 420 | Poliomyelitic scoliosis | /ˌpoʊlioʊˌmaɪəˈlɪtɪk ˌskoʊliˈoʊsɪs/ | Vẹo cột sống do bại liệt |
| 421 | Epigenetic programming | /ˌɛpɪdʒəˈnɛtɪk ˈproʊɡræmɪŋ/ | Lập trình biểu sinh |
| 422 | Limbic-hypothalamic-pituitary-adrenal system | /ˈlɪmbɪk ˌhaɪpoʊθəˈlæmɪk pɪˈtuːɪˌtɛri əˈdriːnəl ˈsɪstəm/ | Hệ limbic-dưới đồi-tuyến yên-thượng thận |
| 423 | Constitutional delay | /ˌkɒnstɪˈtjuːʃənəl dɪˈleɪ/ | Chậm phát triển có tính chất cơ địa |
| 424 | Hypothalamic amenorrhea | /ˌhaɪpoʊθəˈlæmɪk əˌmɛnəˈriːə/ | Vô kinh do vùng dưới đồi |
| 425 | Comedonal acne | /ˌkɒmɪˈdoʊnəl ˈækni/ | Mụn trứng cá nhân |
| 426 | Inflammatory acne | /ɪnˈflæməˌtɔːri ˈækni/ | Mụn trứng cá viêm |
| 427 | Hirsutism | /ˈhɜːrsəˌtɪzəm/ | Rậm lông |
| 428 | Tomboyish traits | /ˈtɒmˌbɔɪɪʃ treɪts/ | Đặc điểm nam tính (ở nữ) |
| 429 | Pseudohermaphroditism | /ˌsuːdoʊhɜːrˈmæfrəˌdaɪtɪzəm/ | Lưỡng tính giả |
| 430 | Testicular DSD | /tɛˈstɪkjələr diː ɛs diː/ | Rối loạn phát triển giới tính tinh hoàn |
| 431 | Complete gonadal dysgenesis | /kəmˈpliːt ɡoʊˈnædəl dɪsˈdʒɛnəsɪs/ | Loạn sản tuyến sinh dục hoàn toàn |
| 432 | Swyer syndrome | /ˈswaɪər ˈsɪndroʊm/ | Hội chứng Swyer |
| 433 | Sex chromosome DSD | /sɛks ˈkroʊməˌsoʊm diː ɛs diː/ | Rối loạn phát triển giới tính nhiễm sắc thể giới tính |
| 434 | Turner syndrome | /ˈtɜːrnər ˈsɪndroʊm/ | Hội chứng Turner |
| 435 | Klinefelter syndrome | /ˈklaɪnˌfɛltər ˈsɪndroʊm/ | Hội chứng Klinefelter |
| 436 | Mixed gonadal dysgenesis | /mɪkst ɡoʊˈnædəl dɪsˈdʒɛnəsɪs/ | Loạn sản tuyến sinh dục hỗn hợp |
| 437 | Chimeric ovotesticular DSD | /kaɪˈmɪərɪk ˌoʊvoʊtɛˈstɪkjələr diː ɛs diː/ | Rối loạn phát triển giới tính noãn-tinh hoàn dạng khảm |
| 438 | True hermaphroditism | /truː hɜːrˈmæfrəˌdaɪtɪzəm/ | Lưỡng tính thật |
| 439 | Clitoromegaly | /ˌklaɪtərəˈmɛɡəli/ | Phì đại âm vật |
| 440 | Androgen insensitivity syndrome | /ˈændrədʒən ɪnˌsɛnsɪˈtɪvəti ˈsɪndroʊm/ | Hội chứng không nhạy cảm với androgen |
| 441 | Imperforate hymen | /ɪmˈpɜːrfərɪt ˈhaɪmən/ | Màng trinh không thủng |
| 442 | Hydrocolpos | /ˌhaɪdroʊˈkɒlpoʊs/ | Ứ dịch âm đạo |
| 443 | Aplastic | /eɪˈplæstɪk/ | Bất sản |
| 444 | Hydrometrocolpos | /ˌhaɪdroʊˌmiːtroʊˈkɒlpoʊs/ | Ứ dịch tử cung-âm đạo |
| 445 | Uterine synechiae | /ˈjuːtərɪn sɪˈniːkiˌiː/ | Dính buồng tử cung |
| 446 | Asherman syndrome | /ˈæʃərmən ˈsɪndroʊm/ | Hội chứng Asherman |
| 447 | Mayer-Rokitansky-Kuster-Hauser syndrome | /ˈmeɪər ˌroʊkɪˈtænski ˈkʊstər ˈhaʊzər ˈsɪndroʊm/ | Hội chứng Mayer-Rokitansky-Kuster-Hauser |
| 448 | Precocious puberty | /prɪˈkoʊʃəs ˈpjuːbərti/ | Dậy thì sớm |
| 449 | Gonadotropin-dependent | /ˌɡoʊnədoʊˈtroʊpɪn dɪˈpɛndənt/ | Phụ thuộc gonadotropin |
| 450 | Central precocious puberty | /ˈsɛntrəl prɪˈkoʊʃəs ˈpjuːbərti/ | Dậy thì sớm trung ương |
| 451 | Isosexual | /ˌaɪsoʊˈsɛkʃuəl/ | Đồng giới |
| 452 | Pseudoprecocious puberty | /ˌsuːdoʊprɪˈkoʊʃəs ˈpjuːbərti/ | Dậy thì sớm giả |
| 453 | Gonadotropin-independent | /ˌɡoʊnədoʊˈtroʊpɪn ˌɪndɪˈpɛndənt/ | Không phụ thuộc gonadotropin |
| 454 | Peripheral precocity | /pəˈrɪfərəl prɪˈkɒsəti/ | Dậy thì sớm ngoại biên |
| 455 | Contrasexual | /ˌkɒntrəˈsɛkʃuəl/ | Trái giới |
| 456 | Neurogenic | /ˌnʊəroʊˈdʒɛnɪk/ | (Nguồn gốc) thần kinh |
| 457 | Cerebral palsy | /ˈsɛrəbrəl ˈpɔːlzi/ | Bại não |
| 458 | Hydrocephalus | /ˌhaɪdroʊˈsɛfələs/ | Não úng thủy |
| 459 | Irradiation | /ɪˌreɪdiˈeɪʃən/ | Chiếu xạ |
| 460 | Hamartoma | /ˌhæmɑːrˈtoʊmə/ | U mô thừa |
| 461 | Neurofibromatosis type I | /ˌnʊəroʊˌfaɪbroʊməˈtoʊsɪs taɪp wʌn/ | Bệnh u xơ thần kinh loại I |
| 462 | Optic glioma | /ˈɒptɪk ɡliˈoʊmə/ | U thần kinh đệm thị giác |
| 463 | Pineal tumors | /ˈpaɪniəl ˈtuːmərz/ | U tuyến tùng |
| 464 | Premature ovarian insufficiency (POI) | /ˌpriːməˈtʃʊər oʊˈvɛəriən ˌɪnsəˈfɪʃənsi/ | Suy buồng trứng sớm |
| 465 | Gain-of-function mutations | /ɡeɪn əv ˈfʌŋkʃən mjuːˈteɪʃənz/ | Đột biến tăng chức năng |
| 466 | Maternally imprinted gene | /məˈtɜːrnəli ɪmˈprɪntɪd dʒiːn/ | Gen bị ghi dấu từ mẹ |
| 467 | Paternally expressed imprinted gene | /pəˈtɜːrnəli ɪkˈsprɛst ɪmˈprɪntɪd dʒiːn/ | Gen bị ghi dấu biểu hiện từ cha |
| 468 | Delta-like homolog 1 (DLK1) | /ˈdɛltə laɪk ˈhɒməˌlɒɡ wʌn/ | Đồng đẳng delta-like 1 |
| 469 | Uniparental disomy | /ˌjuːnɪpəˈrɛntəl ˈdaɪsoʊmi/ | Lưỡng bội đơn thân |
| 470 | Silver-Russell syndrome | /ˈsɪlvər ˈrʌsəl ˈsɪndroʊm/ | Hội chứng Silver-Russell |
| 471 | Temple syndrome | /ˈtɛmpəl ˈsɪndroʊm/ | Hội chứng Temple |
| 472 | Rett syndrome | /rɛt ˈsɪndroʊm/ | Hội chứng Rett |
| 473 | Van Wyk-Grumbach syndrome | /væn waɪk ˈɡrʌmbɑːk ˈsɪndroʊm/ | Hội chứng van Wyk-Grumbach |
| 474 | Galactorrhea | /ɡəˌlæktəˈriːə/ | Tiết sữa |
| 475 | Multicystic ovaries | /ˌmʌltiˈsɪstɪk ˈoʊvəriz/ | Buồng trứng đa nang |
| 476 | McCune-Albright syndrome | /məˈkuːn ˈɔːlbraɪt ˈsɪndroʊm/ | Hội chứng McCune-Albright |
| 477 | Cafe-au-lait pigmentation | /kæˈfeɪ oʊ ˈleɪ ˌpɪɡmənˈteɪʃən/ | Sắc tố cà phê sữa |
| 478 | Polyostotic fibrous dysplasia | /ˌpɒliɒˈstɒtɪk ˈfaɪbrəs dɪsˈpleɪʒə/ | Loạn sản xơ đa xương |
| 479 | Mosaicism | /moʊˈzeɪɪˌsɪzəm/ | Thể khảm |
| 480 | Follicular cyst | /fəˈlɪkjələr sɪst/ | Nang nang trứng |
| 481 | Granulosa cell tumor | /ˌɡrænjəˈloʊsə sɛl ˈtuːmər/ | U tế bào hạt |
| 482 | Ovarian sex cord-stromal elements | /oʊˈvɛəriən sɛks kɔːrd ˈstroʊməl ˈɛləmənts/ | Yếu tố dây sinh dục-mô đệm buồng trứng |
| 483 | Hypercalcemia | /ˌhaɪpərkælˈsiːmiə/ | Tăng calci máu |
| 484 | Small cell carcinoma | /smɔːl sɛl ˌkɑːrsɪˈnoʊmə/ | Ung thư biểu mô tế bào nhỏ |
| 485 | Peutz-Jeghers syndrome | /pɔɪts ˈjeɪɡərz ˈsɪndroʊm/ | Hội chứng Peutz-Jeghers |
| 486 | Ovarian carcinoma of epithelial cell origin | /oʊˈvɛəriən ˌkɑːrsɪˈnoʊmə əv ˌɛpɪˈθiːliəl ˈɔːrɪdʒɪn/ | Ung thư biểu mô buồng trứng nguồn gốc biểu mô |
| 487 | Adrenocortical tumors | /əˌdriːnoʊˈkɔːrtɪkəl ˈtuːmərz/ | U vỏ thượng thận |
| 488 | Aromatase excess syndrome | /əˈroʊməˌteɪs ɪkˈsɛs ˈsɪndroʊm/ | Hội chứng dư thừa aromatase |
| 489 | Ectopic feminization | /ɛkˈtɒpɪk ˌfɛmənaɪˈzeɪʃən/ | Nữ hóa lạc chỗ |
| 490 | Exogenous steroids | /ɛkˈsɒdʒənəs ˈstɪəˌrɔɪdz/ | Steroid ngoại sinh |
| 491 | Anabolic steroid | /ˌænəˈbɒlɪk ˈstɪəˌrɔɪd/ | Steroid đồng hóa |
| 492 | Foreign body | /ˈfɔːrən ˈbɒdi/ | Dị vật |
| 493 | Sexual abuse | /ˈsɛkʃuəl əˈbjuːs/ | Lạm dụng tình dục |
| 494 | Neurofibromas | /ˌnʊəroʊfaɪˈbroʊməz/ | U xơ thần kinh |
| 495 | Endometrial thickness | /ˌɛndoʊˈmiːtriəl ˈθɪknəs/ | Bề dày nội mạc tử cung |
| 496 | Hemodynamic instability | /ˌhiːmoʊdaɪˈnæmɪk ˌɪnstəˈbɪləti/ | Bất ổn huyết động |
| 497 | Antifibrinolytic drug | /ˌæntiˌfaɪbrɪnoʊˈlɪtɪk drʌɡ/ | Thuốc chống tiêu sợi huyết |
| 498 | Dysmenorrhea | /ˌdɪsmɛnəˈriːə/ | Đau bụng kinh |
| 499 | Ectopic pregnancy | /ɛkˈtɒpɪk ˈprɛɡnənsi/ | Thai ngoài tử cung |
| 500 | Endometriosis | /ˌɛndoʊˌmiːtriˈoʊsɪs/ | Lạc nội mạc tử cung |
| 501 | Uterine outlet obstruction | /ˈjuːtərɪn ˈaʊtlɛt əbˈstrʌkʃən/ | Tắc nghẽn đường ra tử cung |
| 502 | Vulvodynia | /ˌvʌlvoʊˈdɪniə/ | Đau âm hộ |
| 503 | Laparoscopy | /ˌlæpəˈrɒskəpi/ | Nội soi ổ bụng |
| 504 | Premenstrual syndrome | /ˌpriːˈmɛnstruəl ˈsɪndroʊm/ | Hội chứng tiền kinh nguyệt |
| 505 | Premenstrual dysphoric disorder | /ˌpriːˈmɛnstruəl dɪsˈfɔːrɪk dɪsˈɔːrdər/ | Rối loạn khó chịu tiền kinh nguyệt |
| 506 | Sexual infantilism | /ˈsɛkʃuəl ˈɪnfənˌtɪlɪzəm/ | Tình trạng ấu trĩ sinh dục |
| 507 | Gonadal dysgenesis | /ɡoʊˈnædəl dɪsˈdʒɛnəsɪs/ | Loạn sản tuyến sinh dục |
| 508 | Oophorectomy | /ˌoʊəfəˈrɛktəmi/ | Cắt buồng trứng |
| 509 | Radiotherapy | /ˌreɪdioʊˈθɛrəpi/ | Xạ trị |
| 510 | Chemotherapy | /ˌkiːmoʊˈθɛrəpi/ | Hóa trị |
| 511 | Oophoritis | /ˌoʊəfəˈraɪtɪs/ | Viêm buồng trứng |
| 512 | Menopausal | /ˌmɛnəˈpɔːzəl/ | (Thuộc) mãn kinh |
| 513 | Follicular reserve | /fəˈlɪkjələr rɪˈzɜːrv/ | Dự trữ nang trứng |
| 514 | Ovarian failure | /oʊˈvɛəriən ˈfeɪljər/ | Suy buồng trứng |
| 515 | Gonadotropin resistance | /ˌɡoʊnədoʊˈtroʊpɪn rɪˈzɪstəns/ | Kháng gonadotropin |
| 516 | Autoimmune oophoritis | /ˌɔːtoʊɪˈmjuːn ˌoʊəfəˈraɪtɪs/ | Viêm buồng trứng tự miễn |
| 517 | T cell suppressor function | /tiː sɛl səˈprɛsər ˈfʌŋkʃən/ | Chức năng ức chế của tế bào T |
| 518 | Autoantibodies | /ˌɔːtoʊˈæntiˌbɒdiz/ | Tự kháng thể |
| 519 | Polyendocrine failure | /ˌpɒliˈɛndəkrɪn ˈfeɪljər/ | Suy đa tuyến nội tiết |
| 520 | Lipoid congenital adrenal hyperplasia | /ˈlɪpɔɪd kənˈdʒɛnɪtəl əˈdriːnəl ˌhaɪpərˈpleɪʒə/ | Tăng sản thượng thận bẩm sinh dạng lipid |
| 521 | P450 oxidoreductase deficiency | /piː ˌfɔːrˈfɪfti ˌɒksɪdoʊrɪˈdʌkˌteɪs dɪˈfɪʃənsi/ | Thiếu hụt P450 oxidoreductase |
| 522 | Estrogen resistance | /ˈɛstrədʒən rɪˈzɪstəns/ | Kháng estrogen |
| 523 | Hypogonadotropic hypogonadism | /ˌhaɪpoʊˌɡoʊnədoʊˈtroʊpɪk ˌhaɪpoʊˈɡoʊnəˌdɪzəm/ | Suy sinh dục do giảm gonadotropin |
| 524 | Combined pituitary hormone deficiency | /kəmˈbaɪnd pɪˈtuːɪˌtɛri ˈhɔːrmoʊn dɪˈfɪʃənsi/ | Thiếu hụt hormone tuyến yên kết hợp |
| 525 | Anosmia | /æˈnɒzmiə/ | Mất khứu giác |
| 526 | Olfactory-genital dysplasia | /oʊlˈfæktəri ˈdʒɛnɪtəl dɪsˈpleɪʒə/ | Loạn sản khứu giác-sinh dục |
| 527 | Kallmann syndrome | /ˈkælmən ˈsɪndroʊm/ | Hội chứng Kallmann |
| 528 | Synkinesia | /ˌsɪnkɪˈniːʒə/ | Đồng vận |
| 529 | Cerebellar ataxia | /ˌsɛrəˈbɛlər əˈtæksiə/ | Thất điều tiểu não |
| 530 | Sensorineural deafness | /ˌsɛnsəriˈnʊərəl ˈdɛfnəs/ | Điếc thần kinh giác quan |
| 531 | Mental retardation | /ˈmɛntəl ˌriːtɑːrˈdeɪʃən/ | Chậm phát triển tâm thần |
| 532 | Renal agenesis | /ˈriːnəl eɪˈdʒɛnəsɪs/ | Bất sản thận |
| 533 | Cleft palate | /klɛft ˈpælət/ | Hở hàm ếch |
| 534 | CHARGE syndrome | /tʃɑːrdʒ ˈsɪndroʊm/ | Hội chứng CHARGE |
| 535 | X-linked adrenal hypoplasia congenita | /ɛks lɪŋkt əˈdriːnəl ˌhaɪpoʊˈpleɪʒə kənˈdʒɛnɪtə/ | Thiểu sản thượng thận bẩm sinh liên kết X |
| 536 | Carbohydrate-deficient glycoprotein syndrome | /ˌkɑːrboʊˈhaɪdreɪt dɪˈfɪʃənt ˌɡlaɪkoʊˈproʊˌtiːn ˈsɪndroʊm/ | Hội chứng glycoprotein thiếu carbohydrate |
| 537 | Autoimmune hypophysitis | /ˌɔːtoʊɪˈmjuːn ˌhaɪpoʊfɪˈsaɪtɪs/ | Viêm tuyến yên tự miễn |
| 538 | Craniopharyngioma | /ˌkreɪnioʊfəˌrɪndʒiˈoʊmə/ | U sọ hầu |
| 539 | Gonadotrope adenomas | /ˌɡoʊnədoʊˈtroʊp ˈædɪˌnoʊməz/ | U tuyến tế bào hướng sinh dục |
| 540 | Anorexia nervosa | /ˌænəˌrɛksiə nɜːrˈvoʊsə/ | Chán ăn tâm thần |
| 541 | Hypercortisolemia | /ˌhaɪpərˌkɔːrtɪsəˈliːmiə/ | Tăng cortisol máu |
| 542 | Nonthyroidal illness | /ˌnɒnθaɪˈrɔɪdəl ˈɪlnəs/ | Bệnh không do tuyến giáp |
| 543 | Bulimia nervosa | /bʊˈliːmiə nɜːrˈvoʊsə/ | Chứng ăn ói tâm thần |
| 544 | Electrolyte imbalance | /ɪˈlɛktrəˌlaɪt ɪmˈbæləns/ | Rối loạn điện giải |
| 545 | Hypoglycemia | /ˌhaɪpoʊɡlaɪˈsiːmiə/ | Hạ đường huyết |
| 546 | Cardiovascular instability | /ˌkɑːrdioʊˈvæskjələr ˌɪnstəˈbɪləti/ | Bất ổn tim mạch |
| 547 | Bone marrow hypocellularity | /boʊn ˈmæroʊ ˌhaɪpoʊˌsɛljəˈlærəti/ | Giảm tế bào tủy xương |
| 548 | Renal failure | /ˈriːnəl ˈfeɪljər/ | Suy thận |
| 549 | Opiate antagonists | /ˈoʊpiɪt ænˈtæɡənɪsts/ | Chất đối kháng opiate |
| 550 | Prolactinoma | /proʊˌlæktɪˈnoʊmə/ | U tuyến tiết prolactin |
| 551 | Macroprolactinoma | /ˌmækroʊproʊˌlæktɪˈnoʊmə/ | U tuyến tiết prolactin lớn |
| 552 | Microadenomas | /ˌmaɪkroʊˌædɪˈnoʊməz/ | U tuyến nhỏ |
| 553 | Multiple endocrine neoplasia type 1 | /ˈmʌltɪpəl ˈɛndəkrɪn ˌniːoʊˈpleɪʒə taɪp wʌn/ | Đa u tuyến nội tiết loại 1 |
| 554 | Macroprolactinemia | /ˌmækroʊproʊˌlækˌtɪˈniːmiə/ | Tăng prolactin đại phân tử trong máu |
| 555 | Defeminization | /diːˌfɛmənaɪˈzeɪʃən/ | Mất nữ tính |
| 556 | Panhypopituitarism | /ˌpænˌhaɪpoʊpɪˈtuːɪtəˌrɪzəm/ | Suy toàn bộ tuyến yên |
| 557 | Oxandrolone | /ɒkˈsændroʊˌloʊn/ | Oxandrolone (steroid đồng hóa) |
| 558 | Transdermal | /trænzˈdɜːrməl/ | Qua da |
| 559 | Endometrial hyperplasia | /ˌɛndoʊˈmiːtriəl ˌhaɪpərˈpleɪʒə/ | Tăng sản nội mạc tử cung |
| 560 | Endometrial carcinoma | /ˌɛndoʊˈmiːtriəl ˌkɑːrsɪˈnoʊmə/ | Ung thư biểu mô nội mạc tử cung |
| 561 | Oral contraceptive pills (OCP) | /ˈɔːrəl ˌkɒntrəˈsɛptɪv pɪlz/ | Thuốc tránh thai đường uống |
| 562 | Oocyte cryopreservation | /ˈoʊəˌsaɪt ˌkraɪoʊˌprɛzərˈveɪʃən/ | Trữ lạnh noãn |
| 563 | In vitro fertilization | /ɪn ˈviːtroʊ ˌfɜːrtələˈzeɪʃən/ | Thụ tinh trong ống nghiệm |
| 564 | Embryo | /ˈɛmbrioʊ/ | Phôi |
| 565 | Ovarian tissue cryopreservation | /oʊˈvɛəriən ˈtɪʃuː ˌkraɪoʊˌprɛzərˈveɪʃən/ | Trữ lạnh mô buồng trứng |
| 566 | Autografts | /ˈɔːtoʊˌɡræfts/ | Ghép tự thân |
| 567 | Germline stem cell | /ˈdʒɜːrmˌlaɪn stɛm sɛl/ | Tế bào gốc dòng mầm |
