Khí máu và các Xét nghiệm trong Hồi sức Cấp cứu, Ấn bản thứ 3
(Blood Gases and Critical Care Testing, Third Edition)
Tác giả: Toffaletti, John G., PhD – Nhà xuất bản Elsevier – Biên dịch: Ths.Bs Lê Đình Sáng
Chương 1. Giới thiệu về xét nghiệm khí máu và sinh lý khí máu
Introduction to blood-gas tests and blood-gas physiology
John G. Toffaletti, PhD; Craig R. Rackley, MD
Blood Gases and Critical Care Testing, Chapter 1, 1-21
Giới thiệu và lịch sử của khí máu
Thuật ngữ “khí máu” đề cập đến các thông số pH, , và được đo trong máu. Lưu ý rằng chữ “p” nhỏ trong pH là viết tắt của logarit âm, trong khi chữ p nhỏ in nghiêng trong và là viết tắt của áp suất riêng phần (partial pressure) của mỗi loại khí này. Ngoài pH, , và , các máy “phân tích khí máu” hiện đại cũng có thể đo các thành phần hemoglobin, chất điện giải và các chất chuyển hóa như natri, kali, calci ion hóa, clorua, bicarbonate, glucose và lactat. Một số máy phân tích còn tích hợp cả phép đo creatinin, ure và magnesi ion hóa.
Lịch sử của khí máu và đo oxy có lẽ là một trong những lịch sử lâu đời nhất, được ghi nhận đầy đủ nhất, và đối với một số người trong chúng ta, là lịch sử phát triển thú vị nhất trong lĩnh vực xét nghiệm y khoa. Lịch sử này bao gồm nhiều nhân vật đáng chú ý, trong đó có Joseph Priestley, người đã bị cuốn hút khi quan sát lượng khí lớn tạo ra trong quá trình làm bia và sau đó đã phân lập được 10 loại khí khác nhau, bao gồm cả oxy vào cuối những năm 1700. Cùng thời điểm đó, Henry Cavendish, một người lập dị và cực kỳ giàu có (nhờ một tài sản thừa kế bất ngờ), từng được mô tả là “người giàu có nhất trong số những người có học, và có lẽ cũng là người có học nhất trong số những người giàu”, đã phát hiện ra hydro, mô tả đặc tính của carbon dioxide, và là người đầu tiên phân tích chính xác thành phần không khí. Lịch sử ban đầu của khí máu thậm chí còn có sự góp mặt của Benjamin Franklin, một đồng nghiệp của nhiều nhà khoa học bao gồm Priestley và là một trong những người cha sáng lập của Hợp chúng quốc Hoa Kỳ. Diễn giải theo lời của Alan Grogono: “Ngoài việc xuất bản báo, soạn thảo hiến pháp, làm tổng cục trưởng bưu điện, thả diều trong giông bão, khám phá Dòng hải lưu Gulf Stream, và duy trì tình bạn với các quý bà người Pháp, Benjamin Franklin còn dành thời gian để đưa ra một phỏng đoán không may mắn về việc gọi các điện tích “thủy tinh” là “dương”. Quyết định này sau đó đã dẫn đến việc gán điện tích “âm” cho các electron và điện tích “dương” cho các ion hydro.
Nhiều nhà khoa học lỗi lạc đã góp phần vào định nghĩa về một acid. Vào cuối những năm 1800, Arrhenius định nghĩa acid là muối hydro. Đầu những năm 1900, Lawrence Henderson và Karl Hasselbalch đã lần lượt mô tả mối quan hệ đệm giữa một acid và một base, từ đó tạo ra phương trình cùng tên Henderson-Hasselbalch, mặc dù họ chưa bao giờ thực sự biết nhau. Brønsted và Lowry đồng thời nhưng độc lập, đã định nghĩa acid là những chất có thể cho một ion hydro, và Gilbert Lewis sau này đã mô tả acid là bất kỳ hợp chất nào có thể nhận một cặp electron để tạo thành một liên kết cộng hóa trị.
Donald Van Slyke đã chấp nhận ý tưởng rằng tình trạng kiềm-toan một phần được quyết định bởi các chất điện giải, một ý tưởng đã được Peter Stewart mở rộng thành một giải thích rất phức tạp về cân bằng kiềm-toan gọi là Hiệu số Ion mạnh (Strong-Ion-Difference). Điều quan trọng là, Van Slyke được ghi nhận là người đã mở rộng các phân tích hóa học vào bệnh viện và được coi là người sáng lập ra “hóa học lâm sàng”. Một trong những khám phá đáng chú ý nhất của ông là phương pháp đo khí (gasometric method), dùng để đo lượng khí được giải phóng và do đó đo được độ bão hòa oxy trong máu. Trước và trong Chiến tranh Thế giới thứ hai, Kurt Kramer, J.R. Squires, và Glen Millikan đã có những tiến bộ đáng kể trong lĩnh vực đo oxy, dẫn đến việc tích hợp nó vào các hệ thống cung cấp oxy, giúp các chuyến bay quân sự ở độ cao lớn an toàn hơn. Những phát triển này cuối cùng đã dẫn Takuo Aoyagi đến khám phá ra máy đo oxy xung (pulse oximetry) vào những năm 1970, cho phép tách biệt sự hấp thụ hemoglobin của động mạch khỏi sự hấp thụ của mô bằng cách sử dụng bản chất xung của tín hiệu hấp thụ động mạch.
Điện cực nguyên mẫu để đo áp suất riêng phần của oxy được Leland Clark phát triển vào năm 1954, sử dụng màng polyethylene và các vật liệu khác có giá chưa đến một đô la. Cũng trong năm 1954, Richard Stowe đã bọc một điện cực pH bằng một bao ngón tay cao su để phát triển một nguyên mẫu của điện cực đo áp suất riêng phần của carbon dioxide ngày nay. Những câu chuyện này và nhiều câu chuyện khác dẫn đến sự phát triển của máy phân tích khí máu đã được ghi lại trong một cuốn sách của Astrup và Severinghaus.
Phương pháp đo khí máu lâm sàng đã phát triển vượt bậc từ các máy phân tích chủ yếu cồng kềnh dành riêng cho phòng xét nghiệm sang các máy phân tích lai có thể thích ứng với cả môi trường phòng xét nghiệm và tại giường bệnh. Cũng đã có một sự tăng trưởng lớn trong việc sử dụng các máy phân tích cầm tay di động phù hợp cho các phòng xét nghiệm nhỏ hơn và sử dụng tại giường bệnh trong bệnh viện, phòng khám, hoặc các địa điểm xa xôi. Xét nghiệm khí máu được sử dụng rộng rãi như một công cụ để chẩn đoán các rối loạn và đánh giá hiệu quả của các can thiệp điều trị.
Giải thích các thuật ngữ về khí máu, kiềm-toan, và co-oximetry
pH. pH là một chỉ số về độ acid hay độ kiềm của máu. pH máu động mạch bình thường là 7,35-7,45. Một pH < 7,35 cho thấy tình trạng toan, và một cho thấy tình trạng kiềm. Nhiễm toan máu (Acidemia) đề cập đến tình trạng máu quá acid, và tình trạng toan (acidosis) đề cập đến quá trình chuyển hóa hoặc hô hấp trong cơ thể bệnh nhân gây ra nhiễm toan máu. Tính từ của quá trình này là toan (acidotic). Các thuật ngữ tương tự được sử dụng cho tình trạng kiềm: nhiễm kiềm máu (alkalemia), tình trạng kiềm (alkalosis), và kiềm (alkalotic). Bởi vì tất cả các enzyme và quá trình sinh lý đều có thể bị ảnh hưởng bởi pH, nên pH thường được điều hòa trong một phạm vi sinh lý rất hẹp, đặc biệt là trong một cá thể, nhưng cũng áp dụng cho các khoảng tham chiếu (xem Bảng 1.1).
Bảng 1.1. Khoảng tham chiếu cho máu tĩnh mạch và động mạch
| Tuổi / Nhóm | Thông số | Động mạch (mmHg / mmol/L / %) | Tĩnh mạch (mmHg / mmol/L / %) | Nguồn tham khảo |
|---|---|---|---|---|
| pH | ||||
| 1–2 giờ | pH | 7,35 – 7,45 | – | Duke Medical Center |
| 20–76 tuổi | pH | 7,35 – 7,45 ; 7,38 – 7,46 | 7,31 – 7,41 | Tham khảo (31,33,36) |
| 60–90 tuổi | pH | – | 7,32 – 7,42 | Tham khảo (32) |
| pCO₂ (mmHg) | ||||
| 1–2 giờ | pCO₂ | 32 – 45 | – | Duke Medical Center |
| 20–76 tuổi | pCO₂ | 35 – 45 ; 32–45 (nữ), 35–48 (nam) | 41 – 51 | Tham khảo (31,33,36) |
| pO₂ (mmHg) | ||||
| 1–2 giờ | pO₂ | 65 – 96 | 39 – 55 | Duke Medical Center |
| 20–39 tuổi | pO₂ | 83 – 115 | – | Tham khảo (36) |
| 40–76 tuổi | pO₂ | 70 – 110 | – | Tham khảo (36) |
| 2 ngày – 60 tuổi | pO₂ | 75 – 108 ; 80 – 100 | 30 – 55 ; 30 – 40 | Tham khảo (31,33,36) |
| Độ bão hòa O₂ (sO₂, %) | sO₂ | >95 | ~75 | Tham khảo (31,33) |
| Base excess (mEq/L) | BE | –3,0 → +3,0 | – | Tham khảo (32) |
| BE | –3,0 → +2,8 | – | Tham khảo (36) | |
| HCO₃⁻ (mmol/L) | 2 tuổi – người lớn | 21 – 27 ; 22 – 28 | 21 – 30 ; 21 – 29 ; 23 – 29 | Tham khảo (31,33,36) |
| Tổng CO₂ | – | – | – | – |
| Anion gap (mmol/L) | – | 5 – 11 | – | Tham khảo (32) |
. là một thước đo về sức căng hay áp suất của carbon dioxide hòa tan trong máu. của máu thể hiện sự cân bằng giữa việc sản xuất và khuếch tán từ tế bào vào máu và việc loại bỏ khỏi máu qua thông khí. Một ổn định, bình thường cho thấy phổi đang loại bỏ khỏi máu với tốc độ gần bằng tốc độ được sản xuất trong các mô khuếch tán vào máu. Một sự thay đổi trong cho thấy một sự thay đổi trong sự cân bằng này. là một khí có tính acid, phần lớn được kiểm soát bởi tốc độ và độ sâu của nhịp thở hoặc thông khí của chúng ta, vốn thay đổi để phù hợp với tốc độ sản xuất của quá trình chuyển hóa. được phân loại là thành phần hô hấp hoặc thông khí của cân bằng kiềm-toan.
. là một thước đo về sức căng hay áp suất của oxy hòa tan trong máu. của máu động mạch chủ yếu liên quan đến khả năng của oxy đi vào phổi và khuếch tán qua các phế nang vào máu. Như được thể hiện trong Hình 1.1, có một gradient liên tục từ không khí khí quyển (150 mmHg) đến phế nang (~110 mmHg), đến máu động mạch (~100 mmHg), mao mạch (~60 mmHg) và máu tĩnh mạch (~40 mmHg), và cuối cùng đến ty thể trong các tế bào với thấp nhất khoảng 8-12 mmHg. Những gradient này thúc đẩy sự di chuyển, gắn kết và giải phóng oxy giữa các hệ thống này.
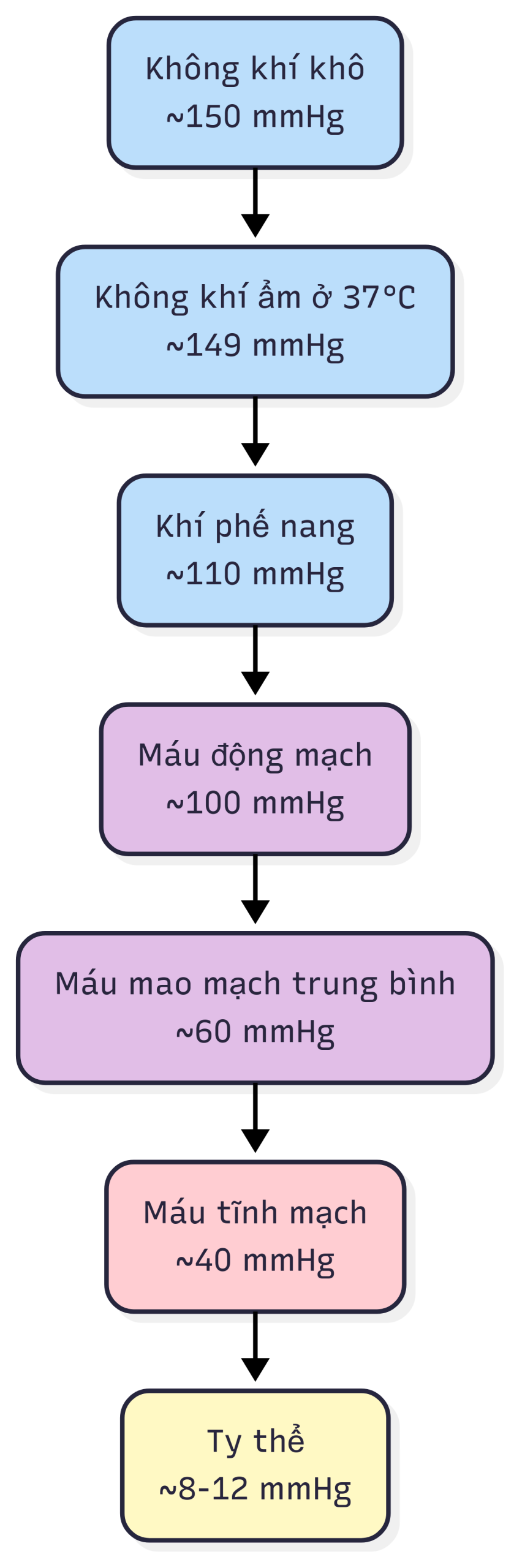
Hình 1.1 Gradient của pO2 từ không khí khí quyển đến máu và đến ty thể.
Các nguyên nhân phổ biến gây giảm động mạch được liệt kê dưới đây, với các chi tiết được trình bày thêm trong Chương 4:
- Giảm thông khí (Hypoventilation): Thông khí phế nang thấp so với sự hấp thu và sản xuất , dẫn đến giảm phế nang và tăng phế nang. Ví dụ: bệnh phổi tắc nghẽn nặng.
- Môi trường oxy thấp: Áp suất riêng phần của oxy trong không khí hít vào thấp hơn 160 mmHg. Điều này thường thấy nhất ở độ cao lớn.
- Bất tương xứng thông khí/tưới máu (V/Q mismatch): Các khu vực trong phổi nhận được không khí hít vào, nhưng tưới máu đến phần đó của phổi bị hạn chế. Ví dụ: thuyên tắc phổi, nơi một cục máu đông kẹt trong động mạch phổi làm hạn chế lưu lượng máu đến một đơn vị phổi vẫn hoạt động bình thường.
- Shunt (Nối tắt): Một phần máu đi từ hệ tĩnh mạch sang hệ động mạch mà không tiếp xúc với một đơn vị phế nang chức năng. Ví dụ: bệnh phổi nơi máu chảy qua các phần của phổi không được thông khí do tắc nghẽn đường thở hoàn toàn, xẹp phổi, hoặc bị lấp đầy bởi dịch hoặc tế bào.
- Suy giảm khuếch tán: Oxy không thể vận chuyển hiệu quả qua hàng rào máu-khí của phế nang. Ví dụ: dày lên hàng rào máu-khí do xơ hóa, phù nề, hoặc thâm nhiễm tế bào viêm.
Bicarbonate. Mặc dù ion bicarbonate hiện có thể được đo trực tiếp, một số máy phân tích khí máu tính toán bằng phương trình Henderson-Hasselbalch từ các phép đo pH và . Bicarbonate là một chỉ số về khả năng đệm của máu và được phân loại là thành phần chuyển hóa của cân bằng kiềm-toan.
Base Excess (Base dư). Base dư (BE) là một thuật ngữ được tính toán mô tả lượng bicarbonate tương đối so với . Base dư chuẩn (Standard BE) chỉ phản ánh thành phần chuyển hóa của các rối loạn kiềm-toan. Nó dựa trên thể tích dịch có thể chuẩn độ trên toàn cơ thể (cả ngoại mạch và nội mạch (máu)) và cũng bao gồm sự đóng góp của Hb vào các rối loạn kiềm-toan.
Khái niệm BE có một lịch sử lâu dài với một số tranh cãi sôi nổi được Johan Kofstad, một đồng nghiệp chuyên môn và người bạn rất lịch thiệp mà tôi đã gặp ở Oslo trong chuyến đi đầu tiên của mình đến châu Âu vào năm 1983, xem xét lại. Base dư được Astrup hình thành vào những năm 1950 và được Siggaard-Andersen tinh chỉnh bằng các phương trình và biểu đồ vào năm 1960. Năm 1977, nhằm giải quyết các tranh cãi về BE giữa người Mỹ và Đan Mạch, Severinghaus đã đề xuất một biểu đồ sửa đổi. Tuy nhiên, các quan điểm khác nhau liên quan đến việc liệu BE nên được tính trong máu hay trong dịch ngoại bào vẫn chưa được dung hòa cho đến ngày nay.
Các phương trình để tính base dư ngoại bào từ pH và hoặc (mmHg) có vẻ khác nhau nhưng lại tương tự một cách kỳ lạ. Dưới đây là hai phương trình được sử dụng để tính BE:
Khoảng tham chiếu “bình thường” cho BE là từ -3 đến +3 mmol/L. So sánh BE tính toán với khoảng tham chiếu cho BE có thể giúp xác định liệu một rối loạn kiềm/toan là vấn đề hô hấp, chuyển hóa, hay hỗn hợp chuyển hóa/hô hấp. Một giá trị base dư vượt quá +3 cho thấy tình trạng kiềm chuyển hóa, nghĩa là bệnh nhân cần thêm một lượng acid để đưa pH máu về trung tính nếu bình thường. Một giá trị base dư dưới -3 cho thấy tình trạng toan chuyển hóa và cần loại bỏ acid dư thừa khỏi máu để đưa pH về trung tính nếu bình thường. Quan điểm cá nhân của tôi là việc tính toán BE không bổ sung nhiều thông tin so với việc diễn giải đơn giản sự chênh lệch của bicarbonate đo được so với 24, đặc biệt là đối với pH từ 7,3 đến 7,5, như được ghi nhận dưới đây và trong Bảng 1.2.
Bảng 1.2. So sánh base dư với chênh lệch bicarbonate
| pH | HCO₃ (mmol/L) | pCO₂ (mmHg) | BE (mEq/L) | HCO₃–24 (mEq/L) |
|---|---|---|---|---|
| 7,2 | 11 | 30 | –14 | –13 |
| 7,2 | 15 | 40 | –11 | –9 |
| 7,2 | 19 | 50 | –8 | –5 |
| 7,2 | 23 | 60 | –4 | –1 |
| 7,3 | 14 | 30 | –11 | –10 |
| 7,3 | 19 | 40 | –6 | –5 |
| 7,3 | 24 | 50 | –2 | 0 |
| 7,4 | 18 | 30 | –6 | –6 |
| 7,4 | 24 | 40 | –0,4 | 0 |
| 7,4 | 30 | 50 | +5 | +6 |
| 7,5 | 23 | 30 | –0,3 | –1 |
| 7,5 | 30 | 40 | +7 | +6 |
| 7,5 | 38 | 50 | +14 | +14 |
| 7,6 | 19 | 20 | –2 | –5 |
| 7,6 | 29 | 30 | +7 | +5 |
| 7,6 | 38 | 40 | +15 | +14 |
Khi giá trị của BE là một số âm, nó thường được gọi là thâm hụt base (base deficit – BD). BD thường được sử dụng để hướng dẫn hồi sức ở những bệnh nhân bị sốc, nơi tình trạng giảm tưới máu dẫn đến việc cung cấp oxy không đủ cho mô, gây ra toan chuyển hóa. Khi bệnh nhân được hồi sức thành công và việc cung cấp oxy được phục hồi, BD sẽ bắt đầu trở lại bình thường. Ở những bệnh nhân bị chấn thương thể chất cấp tính, BD có giá trị tiên lượng đáng kể.
Bảng 1.2 cho thấy mối quan hệ giữa BE và chênh lệch đơn giản của (bicarbonate đo được – 24 mmol/L) thường là 2 mmol/L hoặc ít hơn, đặc biệt đối với pH từ 7,3 đến 7,5 như đã nói ở trên. Chúng tôi để cho mỗi độc giả tự xác định tầm quan trọng lâm sàng của việc tính toán BE so với việc sử dụng nồng độ bicarbonate.
Khoảng trống Anion (Anion gap)
Khoảng trống anion (AG) là một thuật ngữ được tính toán cho sự khác biệt giữa các cation thường được đo ( và đôi khi là ) và các anion thường được đo ( và ). Do đó, nó đại diện cho các anion không được đo như các protein tích điện âm (đặc biệt là albumin) và lactat, phosphat, sulfat, urat và các thể ceton do cơ thể sản xuất. Các độc tố và thuốc ngoại sinh, bao gồm methanol, salicylate và ethylene glycol (cùng các chất chuyển hóa của nó), cũng góp phần vào khoảng trống anion khi có mặt.
Khoảng trống Anion (AG) được tính như sau:
Nếu được bao gồm trong tính toán, công thức như sau:
Việc điều chỉnh AG cho các nồng độ albumin bất thường là quan trọng vì nó là yếu tố đóng góp lớn nhất cho AG ở người khỏe mạnh. Nói chung, với mỗi g/dL giảm albumin, AG giảm khoảng 2,5 mmol/L (hoặc 0,25 mmol/L cho mỗi g/L giảm albumin) hoặc tăng tương tự khi albumin huyết thanh tăng. AG hữu ích trong việc chẩn đoán toan chuyển hóa và phân biệt các nguyên nhân, như được thể hiện trong Bảng 1.3.
Bảng 1.3. Thay đổi của khoảng trống anion trong các rối loạn kiềm-toan
| Rối loạn | Mất | Tăng | Ảnh hưởng đến AG |
|---|---|---|---|
| Tiêu chảy | HCO₃⁻ | Cl⁻ | Ít thay đổi |
| Toan ống thận | HCO₃⁻ | Cl⁻ | Ít thay đổi |
| Toan lactic | HCO₃⁻ | Lactat | Tăng |
| Toan ceton | HCO₃⁻ | Acid ceton | Tăng |
| Rối loạn hỗn hợp: Toan ceton + Kiềm chuyển hóa | HCO₃⁻ | Acid ceton và HCO₃⁻ | Tăng (ít thay đổi tổng CO₂) |
Mặc dù thường rất hữu ích, AG được tính từ ba hoặc bốn phép đo và có thể có sự biến thiên lên đến ±4 mmol/L. Do đó, nó chỉ có thể phát hiện lactat tăng trong khoảng một nửa số trường hợp. Ngay cả ở những bệnh nhân có AG trong khoảng 20-29 mmol/L, chỉ có khoảng hai phần ba sẽ bị toan chuyển hóa, trong khi tất cả các bệnh nhân có AG cao hơn mức này sẽ bị toan chuyển hóa.
Khoảng trống Delta và Tỷ lệ delta
“Khoảng trống Delta” là sự khác biệt giữa sự gia tăng của AG và sự giảm của , trong khi “Tỷ lệ delta” là tỷ lệ của sự gia tăng AG chia cho sự giảm của . Chúng có thể giúp xác định xem tình trạng toan chuyển hóa có khoảng trống anion cao có được giải thích hoàn toàn bởi sự giảm hay không, hoặc liệu có khả năng tồn tại một rối loạn kiềm-toan hỗn hợp. Các tính toán này và ứng dụng của chúng sẽ được thảo luận trong Chương 2.
Hiệu số Ion mạnh (Strong ion difference)
Hiệu số ion mạnh (SID) là một khái niệm được Peter A. Stewart phát triển vào năm 1981 nhằm giải thích những thay đổi pH và đánh giá các rối loạn kiềm-toan lâm sàng. Nó dựa trên sự khác biệt giữa các cation phân ly mạnh và các anion phân ly mạnh và lactat. Stewart đã sử dụng tính trung hòa điện và mức độ phân ly (mạnh hoặc yếu) của các chất điện giải để giải thích sinh lý học kiềm-toan. Về cơ bản, tổng điện tích dương phải bằng tổng điện tích âm. Để duy trì tính trung hòa điện, khái niệm SID cho rằng nồng độ của , và một loạt các acid và base yếu khác (và do đó là pH) phụ thuộc vào sự khác biệt giữa các cation phân ly mạnh (như và ) và các anion (như và lactat). Một SID cao hơn tạo điều kiện cho môi trường kiềm và một SID thấp hơn tạo điều kiện cho môi trường acid.
Khái niệm SID phức tạp về mặt toán học, không dễ nắm bắt về mặt hóa học, và chịu sự biến thiên phân tích vì nhiều phép đo được sử dụng trong việc tính toán SID. Càng khó hiểu hơn là có nhiều phương trình và chất phân tích dường như được sử dụng trong việc tính toán SID.
Một số phương trình tương đối rõ ràng cho SID là:
Cũng có những chương trình tính toán SID, trong đó có một chương trình yêu cầu đến 11 kết quả trong tính toán, bao gồm pH, , lactat, phosphat và albumin. Một báo cáo khác mô tả một máy tính ion mạnh yêu cầu tối thiểu , pH, và . Ví dụ về SID trong các dung dịch khác nhau được thể hiện trong Bảng 1.4.
Bảng 1.4. Ví dụ về hiệu số ion mạnh
| Thông số | Dung dịch giả định với SID = 0 | Dung dịch giả định với SID = –10 |
|---|---|---|
| Na⁺ (mmol/L) | 100 | 100 |
| K⁺ (mmol/L) | 0 | 0 |
| H⁺ (nmol/L) | ~0 | 10 |
| Cl⁻ (mmol/L) | 100 | 110 |
| Lactat (mmol/L) | 0 | 0 |
| SID (mmol/L) | 0 | –10 |
| pH | Trung tính | Rất acid |
Bởi vì Stewart coi albumin là acid yếu quan trọng nhất, Story và cộng sự đã đề xuất một số phương trình tương đối đơn giản (nhưng vẫn khó nắm bắt) để dự đoán hiệu ứng ion không đo được (UIE) từ base dư chuẩn (SBE), hiệu ứng Na-Cl, và hiệu ứng albumin:
Cách tiếp cận này có thể giải thích tại sao giảm albumin đôi khi liên quan đến kiềm chuyển hóa.
Ví dụ, SID có thể giúp xác định cách những thay đổi nồng độ gây ra những thay đổi pH đáng kể. Nếu di chuyển qua một màng, nó phải hoặc mang theo một cation hoặc trao đổi với một anion khác để duy trì tính trung hòa điện. Nếu mang theo một ion phân ly mạnh khác, chẳng hạn như , sẽ không có thay đổi ròng trong SID và không có thay đổi pH. Tuy nhiên, nếu trao đổi với một ion yếu hơn, SID của dung dịch nhận sẽ giảm và dung dịch sẽ trở nên acid hơn, và dung dịch nhận sẽ trở nên kiềm hơn.
Mặc dù lý thuyết SID có thể giải thích chính xác một số chuyển động ion và thay đổi pH thực tế, nó hiếm khi được sử dụng trên lâm sàng để hiểu chẩn đoán và quản lý các rối loạn kiềm-toan, như đã được ghi nhận ở nơi khác.
Hemoglobin và các dẫn xuất
Hb và các dẫn xuất của nó được đo bằng co-oximetry. Đó là oxyhemoglobin , deoxyhemoglobin (HHb), carboxyhemoglobin (COHb), và methemoglobin (metHb). Nói ngắn gọn, có bốn phân tử oxy gắn vào mỗi nhóm heme trong phân tử hemoglobin. HHb là dạng hemoglobin đã nhả oxy. COHb có carbon monoxide (CO) gắn rất chặt vào một vị trí gắn trên nhóm heme, làm tăng ái lực của ba nhóm heme còn lại đối với các phân tử , và ngăn chặn việc nhả oxy cho đến khi CO được giải phóng. MetHb là Hb không hoạt động (không thể gắn ) vì ion sắt II của nó đã bị oxy hóa thành ion sắt III . Chức năng của hemoglobin sẽ được thảo luận thêm ở phần sau của chương này.
là phần trăm độ bão hòa oxy, là tỷ lệ phần trăm của Hb chức năng đã gắn với oxy. được tính bằng nồng độ của chia cho tổng Hb chức năng. có thể thay đổi từ 0% đến 100%.
(trước đây gọi là độ bão hòa Hb phân đoạn) là tỷ lệ phần trăm của tổng Hb đã bão hòa với oxy. có thể được sử dụng để xác định hàm lượng oxy trong máu và do đó, việc cung cấp oxy và tiêu thụ oxy .
*** QuickLaTeX cannot compile formula:
\[%O2Hb = O2Hb / (O2Hb + HHb + COHb + MetHb) \quad (1.9)\]
*** Error message:
Missing $ inserted.
leading text: \end{document}
Display math should end with $$.
leading text: \end{document}
\begin{equation*} on input line 12 ended by \end{document}.
leading text: \end{document}
You can't use `\end' in internal vertical mode.
leading text: \end{document}
\begin{equation*} on input line 12 ended by \end{document}.
leading text: \end{document}
Emergency stop.
Sự khác biệt giữa và thường ít có ý nghĩa lâm sàng, nhưng nó có thể khá đáng kể trong bối cảnh nồng độ COHb hoặc metHb cao bệnh lý. Do đó, điều quan trọng là phải hiểu sự khác biệt giữa hai thuật ngữ này đối với oxy gắn với hemoglobin ( và ).
COHb và metHb
Carboxyhemoglobin (COHb) và methemoglobin (metHb) cùng nhau thường chỉ chiếm 1%-2% tổng Hb trong máu. Cả hai đều không thể thực hiện chức năng vận chuyển và giải phóng . COHb là Hb có carbon monoxide (CO) gắn rất chặt vào một vị trí thường gắn . Phơi nhiễm với carbon monoxide sẽ làm tăng %COHb từ mức cơ bản bình thường khoảng 1% lên 5%-10% ở người hút thuốc và 50% hoặc hơn ở những người phơi nhiễm với mức độ độc hại hoặc gây chết người, như có thể xảy ra trong bối cảnh cháy ở khu vực thông gió kém. Methemoglobin là Hb có ion bị oxy hóa thành , khiến metHb không thể gắn hiệu quả.
và
Cả (cung cấp oxy) và (tiêu thụ oxy) đều là các thông số để đánh giá chức năng tim, nhu cầu chuyển hóa và chức năng ty thể ở những bệnh nhân nặng. Hiện có một số cách để xác định các thông số này bằng các phép đo xét nghiệm. tính bằng mL/phút yêu cầu đo các giá trị sau trong máu động mạch: Hb tính bằng g/L, từ 0 đến 1.0, tính bằng mmHg (có tầm quan trọng nhỏ trong tính toán này), và cung lượng tim (CO) tính bằng L/phút. Phép tính này về cơ bản là xác định lượng oxy được tải lên hemoglobin hoặc hòa tan trong máu và được tim bơm đến cơ thể mỗi phút.
*** QuickLaTeX cannot compile formula:
\[DO2 = CO \times (1.34 \times Hb \times %O2Hb + 0.03 \times pO2) = CO \times (O2a) \quad (1.10)\]
*** Error message:
Unicode character (U+200B)
leading text: \[DO2
Missing $ inserted.
leading text: \end{document}
Display math should end with $$.
leading text: \end{document}
\begin{equation*} on input line 12 ended by \end{document}.
leading text: \end{document}
You can't use `\end' in internal vertical mode.
leading text: \end{document}
\begin{equation*} on input line 12 ended by \end{document}.
leading text: \end{document}
Emergency stop.
trong đó = hàm lượng oxy động mạch.
là sự tiêu thụ oxy của các cơ quan và mô trong cơ thể. Nó là sự khác biệt về hàm lượng oxy giữa máu động mạch và máu tĩnh mạch nhân với cung lượng tim (CO):
Sinh lý sản xuất acid và base
Giới thiệu. Hầu hết các quá trình enzyme và chuyển hóa thiết yếu cho sự sống đều phụ thuộc nghiêm trọng vào pH. Do đó, nồng độ ion hydro (và pH) được điều hòa chặt chẽ trong cơ thể người. Mặc dù chỉ có pH ngoại bào (máu) được đo cho các mục đích lâm sàng, hầu hết các phản ứng phụ thuộc pH xảy ra bên trong tế bào, nơi pH có tính acid hơn một chút. Toan chuyển hóa có thể phát triển nếu tích tụ hoặc bị mất. Trong khi đó, kiềm chuyển hóa có thể phát triển do mất hoặc tăng . Toan hô hấp là kết quả của việc tăng trong máu, trong khi kiềm hô hấp là kết quả của việc giảm trong máu, cả hai quá trình này phần lớn liên quan đến tốc độ thông khí phế nang hiệu quả.
“Acid chuyển hóa”. Phần lớn (khoảng 20 mol mỗi ngày) acid chuyển hóa của chúng ta thực chất là được sản xuất trong ty thể như một trong những sản phẩm phụ cuối cùng của quá trình oxy hóa glucose, với một lượng nhỏ hơn được sản xuất từ quá trình chuyển hóa chất béo và acid amin. Hầu hết kết hợp với để tạo ra acid carbonic, chất này dễ dàng được chuyển đổi trở lại thành để loại bỏ qua thông khí phế nang. Do đó, mặc dù được sản xuất bởi quá trình chuyển hóa thông thường, nó được coi là thành phần “hô hấp” của cân bằng kiềm-toan của chúng ta vì thông khí phế nang ảnh hưởng trực tiếp đến máu.
Toan “Lactic”: Trái với quan niệm phổ biến, acid lactic hầu như KHÔNG BAO GIỜ được sản xuất. Trên thực tế, phản ứng duy nhất trong cơ thể người tạo ra lactat là khi pyruvat được chuyển đổi thành lactat, một phản ứng thực sự tiêu thụ acid do sự tham gia của NADH và được chuyển đổi thành . Vậy tình trạng toan đến từ đâu trong thời gian thiếu oxy? Nó được tạo ra nhiều bước sinh hóa sau đó khi ATP được chuyển đổi thành ADP, phosphat, và các ion hydro. Bình thường, quá trình phosphoryl hóa oxy hóa chuyển đổi các sản phẩm này trở lại thành ATP với ít thay đổi ròng về ion H. Tuy nhiên, không có oxy, ADP không thể trải qua quá trình phosphoryl hóa oxy hóa và các ion H (acid) tích tụ. Lactat được sản xuất độc lập từ sự tích tụ NADH, tạo điều kiện cho việc chuyển đổi pyruvat thành lactat bởi enzyme lactat dehydrogenase. Do đó, lactat là một dấu hiệu cho thấy sự thiếu hụt oxy cung cấp cho các mô, tế bào, và ty thể, hoặc khả năng của ty thể không thể chiết xuất oxy trong bối cảnh ngộ độc carbon monoxide, một số cytokine, các loại oxy phản ứng, hoặc các yếu tố tế bào khác có mặt trong nhiễm trùng huyết.
Toan ceton (Ketoacidosis). Toan ceton xảy ra trong bối cảnh sản xuất ceton không được điều hòa gây ra sự tích tụ nghiêm trọng của các acid ceton trong máu. Biểu hiện lâm sàng phổ biến nhất của toan ceton xảy ra với toan ceton do đái tháo đường, phát triển khi một người có quá ít insulin khiến glucose không thể đi vào tế bào để tạo ra năng lượng. Gan bắt đầu phân giải chất béo để lấy năng lượng, tạo ra các acid ceton độc hại được hình thành do sự khử amin của các acid amin và sự phân hủy của các acid béo. Hai thể ceton acid phổ biến được sản xuất trong quá trình này là acetoacetat và β-hydroxybutyrat. Toan ceton cũng có thể xảy ra khi nhịn đói kéo dài hoặc nghiện rượu nặng, khi cơ thể đã cạn kiệt nguồn carbohydrate dự trữ và buộc phải phân giải chất béo để duy trì sự sống.
Các acid không bay hơi. Những acid này được tạo ra dưới dạng phosphat và sulfat chủ yếu từ quá trình chuyển hóa protein, phospholipid, và acid nucleic. Các acid từ những nguồn này chiếm <1% lượng acid được sản xuất mỗi ngày.
Sản xuất base. Nhìn chung, hầu hết các hợp chất base “mới” đến từ các nguồn thực phẩm, với rất ít sự sản xuất bicarbonate hoặc các chất kiềm khác trực tiếp từ quá trình chuyển hóa. Bicarbonate được tạo ra khi kết hợp với và phân ly thành và , tuy nhiên, không có sự gia tăng ròng của một chất kiềm trừ khi được bài tiết. Thận có thể giữ lại hoặc bài tiết tùy thuộc vào nhu cầu sinh lý.
Chuyển hóa amoniac trong thận rất phức tạp, nhưng về cơ bản amoniac (khoảng 98% dưới dạng và 2% dưới dạng ở pH 7.4) và được sản xuất với lượng tương đương mol bởi một số phản ứng enzyme liên quan đến glutamin (lưu ý: thuật ngữ “amoniac” đề cập đến sự kết hợp của cả và trong chuyển hóa). Để đáp ứng với tình trạng toan, amoniac và bicarbonate được tạo ra. Khi được bài tiết, bicarbonate vẫn còn lại, đây là một cơ chế chính của việc tạo ra bicarbonate ở thận. Ống lượn gần là nơi chính hình thành amoniac. Trong bệnh thận mạn tính, thận không thể sản xuất và bài tiết đủ amoniac, dẫn đến sự tích tụ acid và phát triển toan chuyển hóa. Bicarbonate có thể tăng nếu bị mất do nôn mửa hoặc do mất qua thận do thuốc lợi tiểu. Nhìn chung, bất kỳ sự mất acid nào cũng sẽ làm tăng tỷ lệ từ . Bicarbonate được dùng quá mức để điều trị toan là một nguồn base do thầy thuốc gây ra.
Các hệ thống đệm
Bicarbonate-carbon dioxide (acid carbonic). Bicarbonate là base có nồng độ cao nhất (~24 mmol/L) trong huyết tương và có tầm quan trọng trung tâm trong việc đệm acid trong máu. là một khí acid dễ bay hơi, tan trong nước (hệ số hòa tan 0,03 mmol/mmHg) và là acid chính được tạo ra như một sản phẩm của quá trình chuyển hóa năng lượng. được sản xuất bởi quá trình chuyển hóa dễ dàng khuếch tán từ tế bào vào máu, nơi nó kết hợp với để tạo ra acid carbonic, chất này ngay lập tức phân ly thành và các ion hydro.
pH, , và (tính bằng mmHg) có liên quan với nhau theo phương trình:
Lưu ý rằng pK được định nghĩa là pH tại đó nồng độ và (hoặc ) bằng nhau. Tức là, tỷ lệ của chúng là 1, và log của 1 bằng 0.
Ở tỷ lệ nồng độ bình thường trong máu là 20:1 (“lý tưởng” sẽ là 1:1), và với pK là 6.1 (“lý tưởng” sẽ là 7.4), hệ thống đệm có vẻ không phù hợp để đệm pH trong máu. Tuy nhiên, lượng base dư thừa này (), cùng với tính dễ bay hơi của , mang lại khả năng to lớn để ngăn chặn sự tích tụ acid quá mức. Phổi thực sự biến hệ thống này thành một hệ thống mở, với khả năng thở ra cung cấp khả năng đệm gần như không giới hạn. Như phương trình trên đã chỉ ra, pH của máu phần lớn được quyết định bởi tỷ lệ của so với . Do đó, ở tỷ lệ nồng độ 15:0,75 có cùng pH với tỷ lệ 20:1,0, nhưng sẽ có khả năng đệm thấp hơn.
Hemoglobin. Hb hoạt động như một chất đệm bằng cách vận chuyển acid từ các mô đến phổi. Một đặc điểm đáng chú ý của Hb là nó tăng ái lực với các ion hydro khi nó giải phóng oxy. Tức là, deoxy-Hb (còn gọi là Hb khử) có ái lực với lớn hơn so với . Khi oxy-Hb đi vào các mao mạch mô, môi trường có thấp hơn và và cao hơn làm tăng sự gắn kết của với Hb, do đó thúc đẩy việc giải phóng nhiều hơn cho các mô. Khi deoxy-Hb đi vào tuần hoàn phế nang và gắn vào Hb, nó giải phóng kết hợp với để cuối cùng tạo thành khuếch tán vào phế nang và được thở ra. 2,3-Diphosphoglycerat (2,3-DPG) cũng ảnh hưởng đến sự gắn kết của Hb với vì nó gắn vào Hb trong các mô (làm giảm ái lực của Hb với ) và giải phóng khỏi Hb trong phế nang (làm tăng ái lực của Hb với ). Các mối quan hệ này được thể hiện trong Hình 1.2 và Hình 1.3.
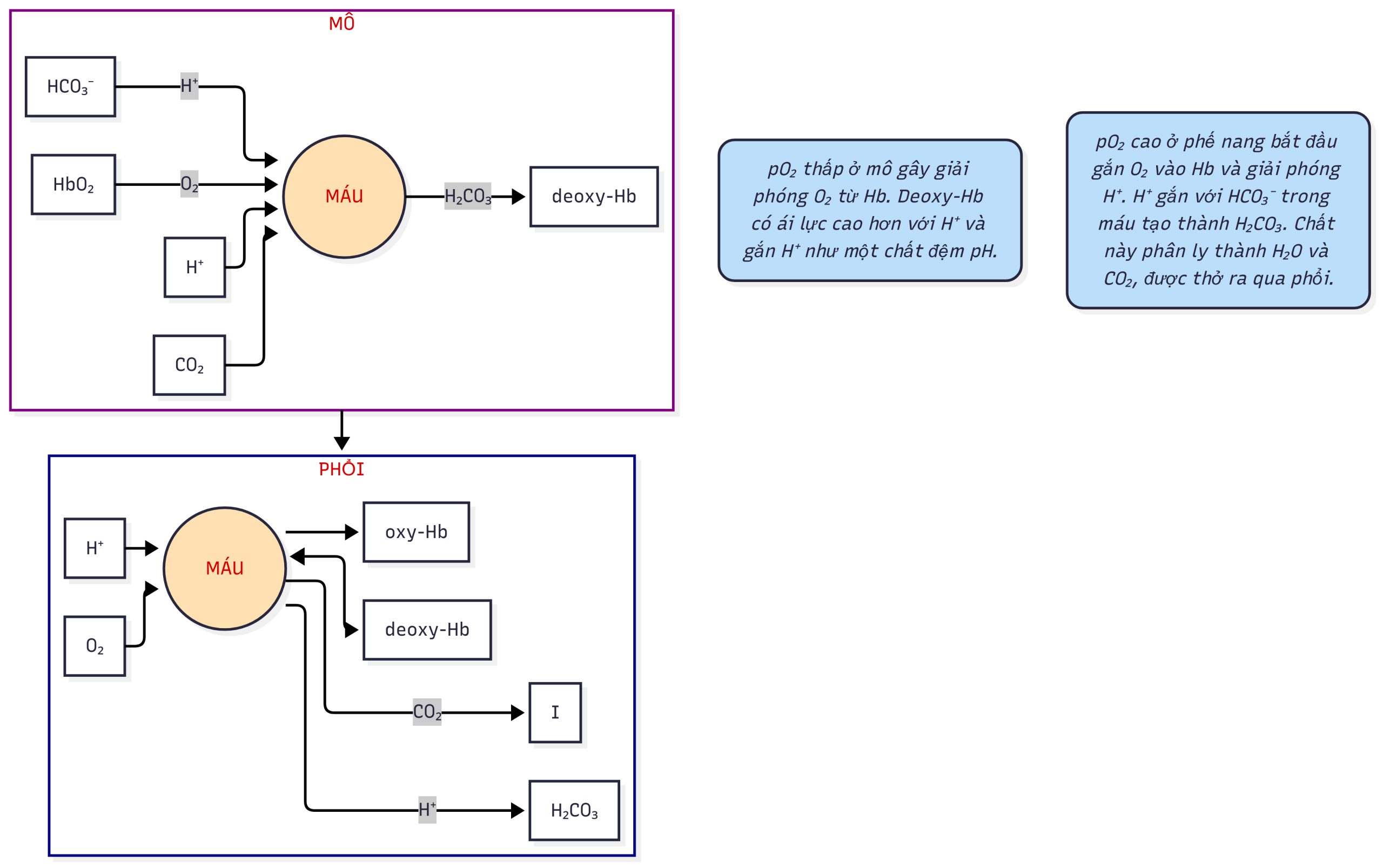
Hình 1.2 Mối tương quan của hệ thống bicarbonate và hemoglobin (Hb) trong việc đệm H+ và trong sự gắn kết và giải phóng oxy ở phổi và mô.
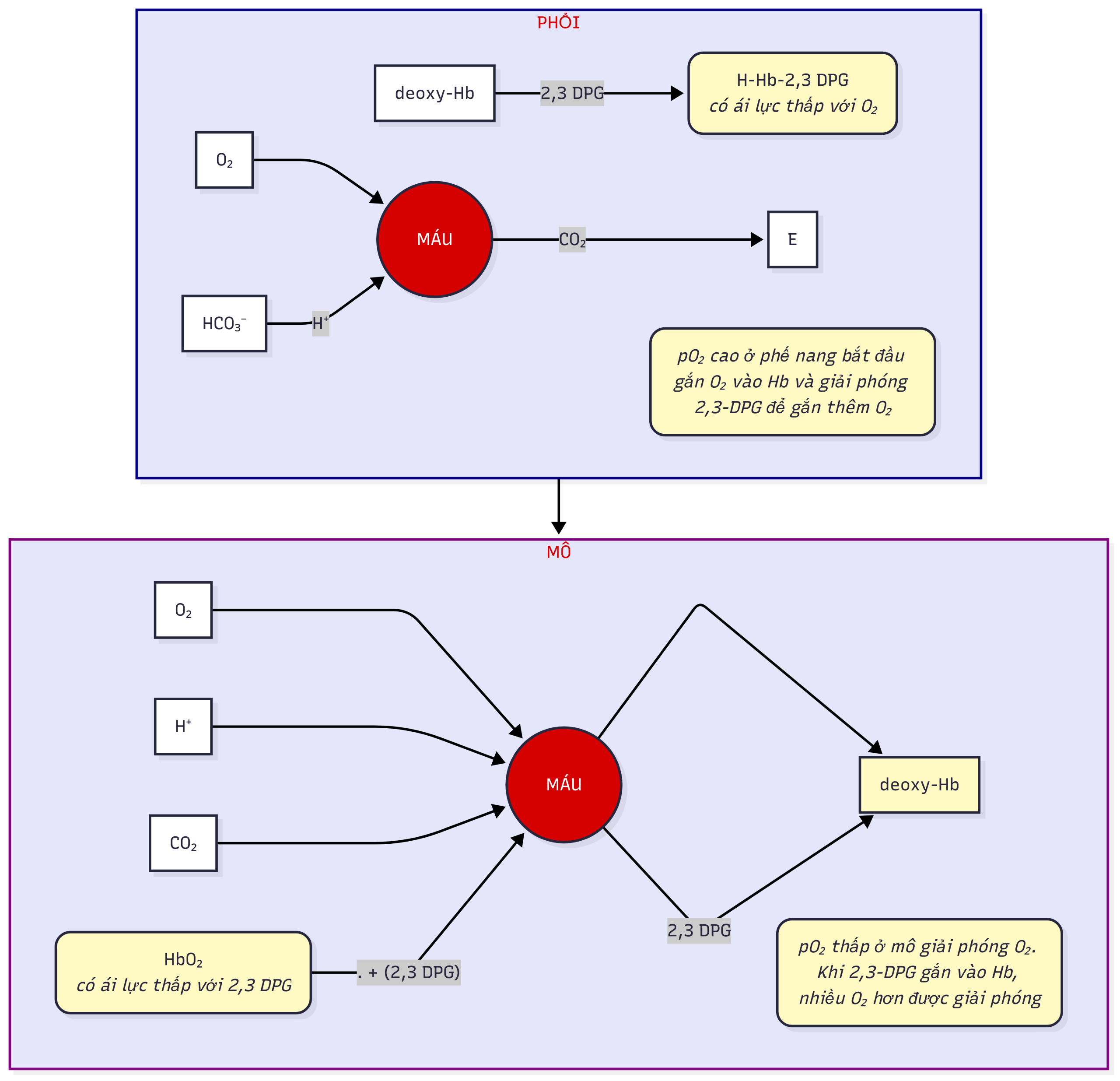
Hình 1.3 Mối tương quan của hemoglobin (Hb), 2,3-diphosphoglycerate (2,3-DPG), và H+ trong sự gắn kết và giải phóng oxy ở phổi và mô.
Phosphat. HPO₄²⁻ / H₂PO₄⁻ có tầm quan trọng nhỏ như một chất đệm trong huyết tương, với nồng độ ~1 mmol/L (3,1 mg/dL). Nó có tầm quan trọng lớn hơn, và ở nồng độ cao hơn, như một chất đệm nội bào.
Albumin và các protein khác. Chủ yếu do các nhóm imidazol trên acid amin histidin, với pK khoảng 7.4, albumin và các protein khác cũng hoạt động như các chất đệm pH. Albumin là anion “không đo được” chính trong máu, và nó thường là yếu tố đóng góp lớn nhất cho khoảng trống anion. Bệnh nhân nặng và/hoặc suy dinh dưỡng thường bị giảm albumin máu, điều này có thể làm giảm AG và có khả năng ảnh hưởng đến việc diễn giải thông số này.
Điều hòa kiềm-toan
Cân bằng kiềm-toan bình thường, chuyển hóa oxy, và các rối loạn liên quan có thể bao gồm một sự tương tác phức tạp của nhiều hệ cơ quan, đặc biệt là phổi, thận, gan và tiêu hóa. Não có thể bị bỏ qua nhưng nó đóng một vai trò cực kỳ quan trọng trong việc điều hòa kiềm-toan.
Hệ hô hấp (phổi). Vì động mạch bị ảnh hưởng lớn bởi thông khí phế nang, được coi là thành phần hô hấp của hệ thống đệm bicarbonate-. Vì là sản phẩm cuối cùng của nhiều quá trình chuyển hóa hiếu khí, việc đệm và loại bỏ là cần thiết liên tục để điều hòa pH. Miễn là có đủ gradient giữa mô và máu, sẽ dễ dàng khuếch tán vào máu. Như đã đề cập trước đó, kết hợp một cách enzyme với để tạo thành không ổn định, chất này nhanh chóng phân ly thành và các ion . Deoxy-Hb đóng một vai trò quan trọng ở đây bằng cách dễ dàng chấp nhận và vận chuyển nó từ các mô đến phổi. Khi được trao đổi lấy oxy trong phổi, nhanh chóng kết hợp với để tạo ra , chất này phân ly thành và hòa tan, khuếch tán vào không khí phế nang để loại bỏ qua thông khí (xem Hình 1.2).
động mạch đại diện cho sự cân bằng giữa sản xuất ở mô và khuếch tán vào máu và sự loại bỏ của phổi. Một tăng cao thường cho thấy thông khí không đủ (giảm thông khí) và toan hô hấp. Ngược lại, một giảm thường cho thấy thông khí quá mức (tăng thông khí) và kiềm hô hấp. Có một số nguyên nhân gây ra các bất thường hô hấp.
Toan hô hấp (suy hô hấp) có thể được gây ra bởi những điều sau:
- Bệnh phổi tắc nghẽn: viêm phế quản mạn tính, khí phế thũng, hen suyễn
- Suy giảm trung tâm điều khiển hô hấp: chấn thương đầu, thuốc an thần, opioid, gây mê
- Cơ hoành yếu hoặc rối loạn
- Giảm thông khí do máy thở cơ học
Kiềm hô hấp (tăng thông khí) có thể được gây ra bởi những điều sau:
- Giảm oxy máu (kích thích tăng thông khí)
- Lo lắng
- Đau
- Tăng thông khí do máy thở cơ học
- Toan chuyển hóa
- Nhiễm trùng huyết
Hệ chuyển hóa (thận). Khi nồng độ lệch khỏi mức bình thường, thận phản ứng bằng cách tái hấp thu hoặc bài tiết hydro, , và các ion khác để điều hòa pH của máu. Vì chủ yếu được điều hòa bởi thận, nó được coi là thành phần chuyển hóa của hệ thống đệm HCO₃⁻ / CO₂. Trong suy thận, nhiễm toan máu trở nên có khả năng xảy ra hơn vì thận ít có khả năng tạo ra amoniac và bicarbonate, do đó ít được bài tiết, để lại ít bicarbonate hơn để đệm ion hydro.
Hệ chuyển hóa (gan). Chu trình ure trong gan về cơ bản chuyển đổi bicarbonate và amoniac thành ure, một hợp chất trung tính. Vì tình trạng toan làm giảm sản xuất ure của gan, nhiều amoniac hơn được chuyển đổi thành glutamin, giúp tiết kiệm bicarbonate và làm giảm tình trạng toan.
Hệ não. Não có thể là một vùng bị bỏ qua nhưng rất quan trọng cho việc điều hòa kiềm-toan. Việc điều hòa pH não khác với việc điều hòa pH ngoại vi bằng cách liên quan đến các cơ chế tế bào cho phép não bù trừ trở lại gần mức bình thường trong mỗi rối loạn kiềm-toan chính: toan và kiềm chuyển hóa, và toan và kiềm hô hấp. Việc điều chỉnh pH hệ thống khi pH não bị rối loạn, chẳng hạn như trong đột quỵ, có thể làm gián đoạn sự bù trừ quan trọng của não.
Aldosterone trong cân bằng kiềm-toan. Aldosterone là một chất điều hòa cân bằng kiềm-toan rất mạnh mẽ và liên kết điều này với chức năng chính của nó trong việc điều hòa cân bằng muối và kali.
Bù trừ (Compensation). Bù trừ là một phản ứng nội môi đối với một rối loạn kiềm-toan, trong đó cơ thể cố gắng phục hồi pH về mức bình thường bằng cách điều chỉnh tỷ lệ trở lại tỷ lệ bình thường 20:1. Bù trừ bao gồm hoặc một phản ứng thông khí tương đối nhanh (thay đổi ) đối với một bất thường chuyển hóa hoặc một phản ứng chuyển hóa tương đối chậm (thay đổi ) đối với một bất thường thông khí. Mặc dù một sự thay đổi trong thông khí phế nang có thể thay đổi pH động mạch trong vài phút, thận cần hàng giờ đến hàng ngày để ảnh hưởng đáng kể đến pH bằng cách thay đổi sự bài tiết .
Khi bù trừ đưa pH trở lại bình thường, quá trình bù trừ do pH điều khiển sẽ chậm lại, sau đó dừng lại trước khi pH được bình thường hóa hoàn toàn, điều này có lợi cho sự sống còn. Các cơ chế cho điều này rất phức tạp, nhưng trong toan chuyển hóa, pH acid và bicarbonate thấp kích thích trung tâm hành tủy tăng thông khí. Bởi vì tăng thông khí làm tăng tiêu thụ năng lượng, sự bù trừ không hoàn toàn đưa pH trở lại đủ gần mức bình thường trong khi tiết kiệm năng lượng để duy trì các quá trình sống còn khác.
Trong kiềm chuyển hóa, giảm thông khí xảy ra để giảm pH. Tuy nhiên, sự bù trừ hoàn toàn bị hạn chế vì tình trạng hạ kali máu, giảm thể tích và cường aldosteron cùng tồn tại phát triển và duy trì một tình trạng kiềm chuyển hóa nhẹ. Lợi ích của sự bù trừ không hoàn toàn này là cân bằng nước, muối và kali được duy trì.
Trong khi sự bù trừ hô hấp bằng cách tăng thông khí khá dễ dự đoán trong toan chuyển hóa, phản ứng hô hấp bằng cách giảm thông khí lại ít dự đoán hơn trong kiềm chuyển hóa. Mặc dù giảm thông khí gần như luôn xảy ra trong kiềm chuyển hóa, các yếu tố khác như đau và giảm oxy máu có thể kích thích thông khí và vượt qua tác dụng giảm thông khí của kiềm chuyển hóa.
Sự bù trừ dự kiến cho mỗi bất thường kiềm-toan sẽ được thảo luận sau trong các phần “Các Rối loạn Lâm sàng của Cân bằng Kiềm-Toan” và “Các rối loạn kiềm-toan hỗn hợp.”
Chức năng của Hemoglobin
Hb là một protein có khối lượng 64.500 Da, bao gồm bốn phân tử heme gắn với bốn phân tử globin. Hb chắc chắn là một phân tử “đẳng cấp”, có khả năng thiết yếu để gắn kết, vận chuyển và giải phóng oxy đến các mô, và vận chuyển và carbon dioxide từ các mô đến phổi. Mỗi trong bốn nhóm heme chứa một ion và có thể gắn một phân tử oxy. Những thay đổi cấu trúc xảy ra khi gắn oxy dẫn đến những thay đổi màu sắc của phân tử. HHb (deoxyhemoglobin) làm cho máu có màu tím đậm, trong khi làm cho máu có màu đỏ tươi. 2,3-DPG là một phân tử chứa trong hồng cầu hợp tác với Hb để gắn hoặc giải phóng . Khi Hb gắn trong phế nang, điều này tạo điều kiện cho việc giải phóng 2,3-DPG, làm tăng thêm ái lực của Hb đối với việc gắn (Hình 1.3). Điều này cuối cùng dẫn đến sự bão hòa của Hb với oxy và một mối quan hệ hình sigma giữa và , như được thể hiện trong đường cong phân ly Hb-oxy trong Hình 1.4. Hemoglobin sẽ được thảo luận chi tiết trong Chương 4.
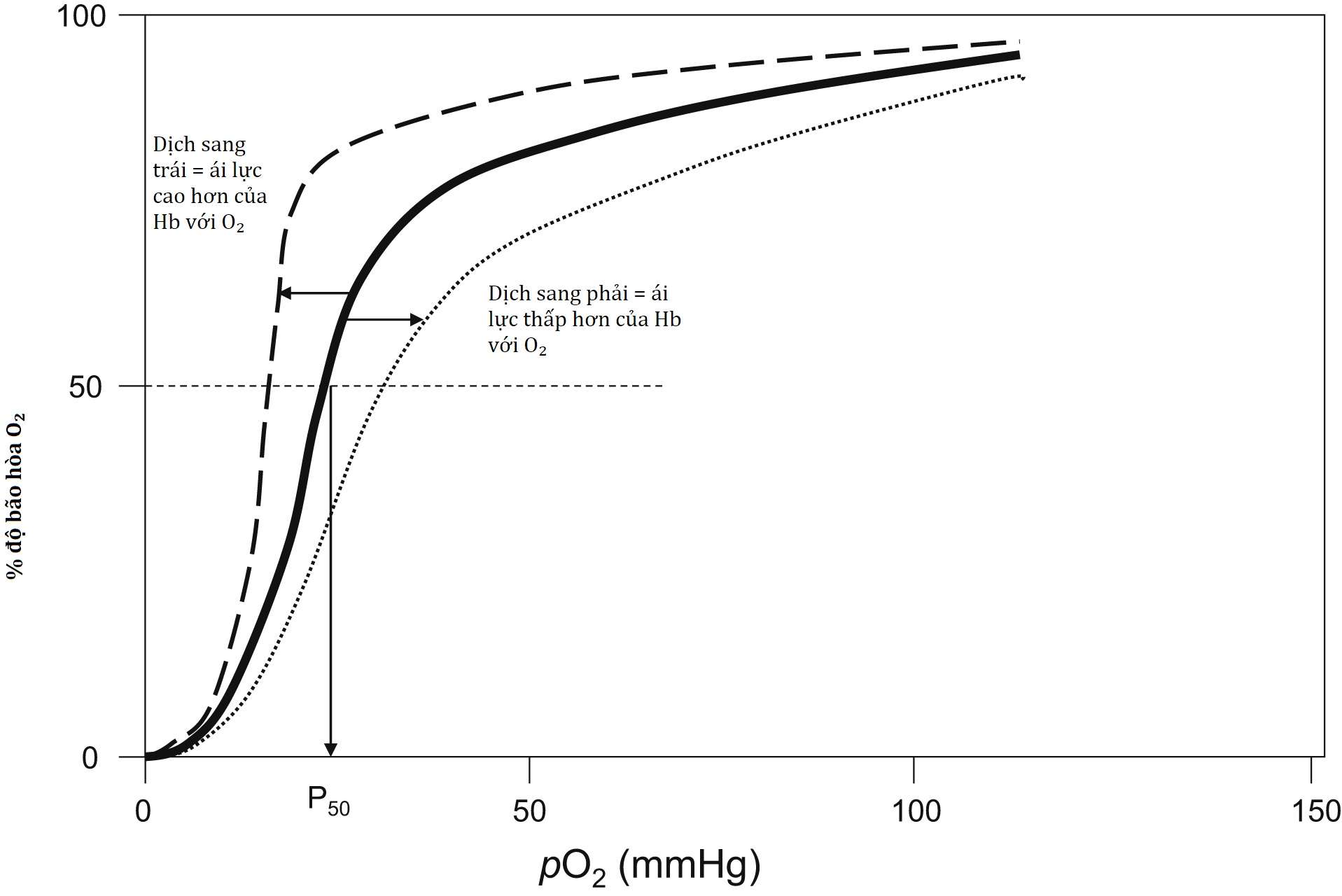
Hình 1.4 Đường cong phân ly Oxyhemoglobin cho máu toàn phần. Đường cong đậm ở giữa biểu thị phần trăm Hb được bão hòa oxy khi pO2 tăng. Đường cong đứt nét biểu thị sự dịch chuyển sang trái của đường cong khi ái lực của Hb đối với O2 tăng do nhiệt độ lạnh hơn, pH cao hơn, hoặc giải phóng 2,3-DPG. Đường cong chấm chấm biểu thị sự dịch chuyển sang phải của đường cong khi ái lực của Hb đối với O2 giảm do nhiệt độ ấm hơn, pH thấp hơn, hoặc gắn kết 2,3-DPG. P50 là áp suất oxy (pO2) làm bão hòa Hb 50% và là một chỉ số về ái lực tổng thể của Hb đối với O2. Sự dịch chuyển sang trái của đường cong làm giảm P50 và sự dịch chuyển sang phải làm tăng P50.
Khoảng tham chiếu cho khí máu
Higgins cung cấp bài thảo luận xuất sắc thường thấy của mình về tầm quan trọng và nguồn gốc của các khoảng tham chiếu, đặc biệt là cho khí máu. Bởi vì giá trị lâm sàng của kết quả xét nghiệm phụ thuộc vào chất lượng của các khoảng tham chiếu, chúng nên được xem xét và cập nhật thường xuyên. Ông cũng lưu ý về sự thiếu hụt các nghiên cứu tốt về khoảng tham chiếu cho khí máu động mạch, điều này có thể hiểu được do nguy cơ và sự đau đớn liên quan đến việc lấy máu động mạch. Higgins trích dẫn một nghiên cứu từ Đan Mạch thực hiện năm 2011, trong đó máu động mạch được lấy từ 182 người lớn khỏe mạnh (96 nữ; 86 nam) tuổi từ 20-76. Điều cực kỳ quan trọng đối với kết quả khí máu là tất cả các mẫu đều được phân tích trong vòng 10 phút sau khi lấy. Các khoảng tham chiếu từ nghiên cứu này được bao gồm trong Bảng 1.1 cùng với các khoảng tham chiếu từ nhiều nguồn khác nhau.
Các khoảng tham chiếu cho cần được giải thích thêm. Thứ nhất, vì có một số biến thiên theo tuổi, đủ dữ liệu được cung cấp để chỉ ra sự khác biệt cho các nhóm tuổi khác nhau. Sau 60 tuổi, trung bình giảm, mặc dù có tranh cãi về tốc độ xảy ra điều này. Theo truyền thống, được cho là giảm khoảng 1 mmHg mỗi năm sau 60 tuổi, nhưng điều này đã bị thách thức. Mặc dù giới hạn tham chiếu dưới cho là 70 mmHg là hợp lý ở tuổi 70, đó cũng có thể là giới hạn dưới cho những người trên 70 tuổi có sức khỏe tương đối tốt. Thứ hai, một số người cho rằng đối với những người thở không khí phòng, động mạch không nên vượt quá 100 mmHg. Điều này dựa trên giả định rằng phế nang xấp xỉ 50 mmHg đối với một tĩnh mạch là 40 mmHg. Bởi vì không khí phế nang là một hỗn hợp của không khí khí quyển đi vào (pO2~150 mmHg) và với sự đóng góp của vào không khí phế nang là ~ 50 mmHg, phế nang không nên cao hơn ~100 mmHg. Tuy nhiên, ở những người trẻ tuổi, các nghiên cứu rõ ràng chỉ ra rằng động mạch có thể lên tới ~110 mmHg.
Ở trẻ sơ sinh, Brouillette và Waxman đã chỉ ra rằng khí máu thay đổi nhanh chóng trong 60 phút đầu sau khi sinh, sau đó ổn định vào khoảng 60-120 phút sau khi sinh ở các mức độ tương tự như người lớn.
Tự lượng giá và ôn tập
- Ai được ghi nhận là người phát hiện ra khái niệm đo oxy xung? a. Leland Clarke b. Peter Stewart c. Takuo Aoyagi d. John Toffaletti e. Van Slyke
- Thông số nào liên quan chặt chẽ nhất đến base dư? a. Khoảng trống anion b. Na c. Cl d. HCO3
- Anion nào góp phần vào khoảng trống anion? a. Albumin b. Acetoacetat c. Phosphat d. Lactat e. Tất cả các câu trên
- Phân tử nào gắn chặt nhất với hemoglobin? a. Oxy b. Ion hydro c. CO d.
- là gì? a. Vanadium dioxide b. Tần số thở mỗi phút c. Tiêu thụ oxy d. Cung cấp oxy e. Phần trăm oxy trong không khí hít vào
- Phát biểu nào sau đây là sai? a. Chuyển hóa bình thường tạo ra nhiều hợp chất kiềm hơn acid b. Mất tạo ra tình trạng toan c. Mất ion H tạo ra tình trạng kiềm d. pH ngoại bào cao hơn pH nội bào
- Sản phẩm chuyển hóa nào tạo ra tình trạng acid nhất? a. b. NAD+ c. ATP d. Lactat
- Hầu hết amoniac được sản xuất dưới dạng a. b. Acid amin c. d. Creatinin
- Chức năng của hemoglobin là gì? Chọn tất cả các câu trả lời đúng. a. Đệm pH b. Vận chuyển c. Giải phóng d. Sử dụng 2,3-DPG trong việc gắn và giải phóng
- Cơ quan nào góp phần điều hòa kiềm-toan? a. Phổi b. Thận c. Gan d. Não e. Tất cả các câu trên
- Sự bù trừ trong điều hòa kiềm-toan đáp ứng với thông số nào sau đây trong máu? a. Thay đổi lactat b. Thay đổi pH c. Thay đổi natri d. Thay đổi creatinin
- động mạch là sự cân bằng giữa: a. Sản xuất và sự gắn kết bởi Hb b. Sản xuất ở mô và loại bỏ khỏi máu của phổi c. Giữ lại và bài tiết HCO3 bởi thận d. Giảm thông khí và tăng thông khí e. Sản xuất lactat và cạn kiệt ATP
Đáp án:
- c
- d
- e
- c
- c
- a
- a
- a
- a, b, c, d
- e
- b
- b
TÀI LIỆU THAM KHẢO
- Grogono, A. W. Acid-Base Tutorial: Acid-Base History. http:/www.acid-base.com/history. (accessed December 2020).
- Story, D. A. Bench-to-Bedside Review: A Brief History of Clinical Acid-Base. Crit. Care 2004, 8, 253-258.
- Astrup, A.; Severinghaus, J. W. The History of Blood Gases, Acids and Bases; Munksgaard: Copenhagen, 1986.
- Grogono, A. W. Acid-Base Tutorial: Terminology: Base Excess. http:/www.acid-base.com. (accessed December 2020).
- Kofstad, J. All About Base Excess to BE or Not to BE, July 2003. www.acutecaretesting. org.
- Base Excess & Calculated Bicarbonate. http://www-users.med.cornell.edu/~spon/picu/calc/ basecalc.htm. (accessed October 2020).
- Connelly, C. R.; Schreiber, M. A. Endpoints in resuscitation. Curr. Opin. Crit. Care 2015, 21(6), 512-519.
- Ibrahim, I.; Chor, W. P.; Chue, K. M.; et al. Is arterial base deficit still a useful prognostic marker in trauma? A systematic review. Am. J. Emerg. Med. 2016, 34(3), 626-635.
- Kraut, J. A.; Nagami, G. T. The Serum Anion Gap in the Evaluation of Acid-Base Disorders: What Are Its Limitations and Can Its Effectiveness Be Improved? Clin. J. Am. Soc. Nephrol. 2013, 8, 2018-2024.
- Feldman, M.; Soni, N.; Dickson, B. Influence of Hypoalbuminemia or Hyperalbuminemia on the Serum Anion Gap. J. Lab. Clin. Med. 2005, 146, 317-320.
- Brandis, K. Acid-Base Physiology: The Anion Gap. From http://anaesthesiaMCQ.com/ AcidBaseBook/ab3_2. (accessed December 2020).
- Iberti, T. J.; Leibowitz, A. B.; Papadakos, P. J.; Fischer, E. P. Low Sensitivity of the Anion Gap as a Screen to Detect Hyperlactatemia in Critically III Patients. Crit. Care Med. 1990, 18, 275-277.
- Story, D. A.; Morimatsu, H.; Bellomo, R. Strong Ions, Weak Acids and Base Excess: A Simplified Fencl-Stewart Approach to Clinical Acid-Base Disorders. Br. J. Anaesth. 2004, 92, 54-60.
- Grogono, A. W. Acid-Base Tutorial: Stewart’s Strong Ion Difference. http:/www.acid-base. com/strong-ion-difference. (accessed December 2020).
- Moviat, M.; Terpstra, A. M.; Ruitenbeek, W.; Kluijtmans, L. A. J.; Pickkers, P.; van der Hoeven, J. G. Contribution of Various Metabolites to the “Unmeasured” Anions in Critically III Patients with Metabolic Acidosis. Crit. Care Med. 2008, 36 (3), 752-758.
- ICU Calculator Blood Gas (Stewart). https://intensivecarenetwork.com/Calculators/Files/ Gazo.html.
- Lloyd, P. Strong Ion Calculator A Practical Bedside Application of Modern Quantitative Acid-Base Physiology. Crit. Care Resusc. 2004, 6, 285-294.
- Masevicius, F. D.; Dubin, A. Has Stewart Approach Improved Our Ability to Diagnose Acid- Base Disorders in Critically III Patients? World J. Crit. Care Med. 2015, 4 (1), 62-70.
- Scott, M. G.; LeGrys, V. A.; Hood, J. L. Electrolytes and Blood Gases. In Tietz Textbook of Clinical Chemistry and Molecular Diagnostics; Burtis, C. A., Ashwood, E. R., Bruns, D. E., Eds., 5th ed.; Elsevier Saunders: St Louis, 2012; pp 807-835.
- Toffaletti, J.; Zijlstra, W. G. Misconceptions in Reporting Oxygen Saturation. Anesth. Analg. 2007, 105, S5-S9.
- Seifter, J. L.; Chang, H.-Y. Disorders of Acid-Base Balance: A New Perspective. Kidney Dis. (Basel) 2017, 2 (4), 170-186.
- Robergs, R. A.; Ghiasvand, F.; Parker, D. Biochemistry of Exercise-Induced Metabolic Acidosis. Am. J. Physiol. Regul. Integr. Comp. Physiol. 2004, 287, R502-R516.
- Gotts, J. E.; Matthay, M. A. Sepsis: Pathology and Clinical Management. Br. Med. J. 2016, 353, 11585.
- Mohiuddin, S. S.; Khattar, D. Biochemistry, Ammonia; NCBI Bookshelf, July 2020.
- Kraut, J. A.; Madias, N. E. Serum Anion Gap: Its Uses and Limitations in Clinical Medicine. Clin. J. Am. Soc. Nephrol. 2007, 2, 162-174.
- Patel, S.; Sharma, S. Respiratory Acidosis; NCBI Bookshelf, June 2020. www.ncbi.nlm.nih. gob/books/NBK482430/.
- Brandis, K. Respiratory Alkalosis Causes. http://www.anaesthesiaMCQ.com. (accessed November 2020).
- Wagner, C. A. Effect of Mineralocorticoids on Acid-Base Balance. Nephron. Physiol. 2014, 128, 26-34.
- Brandis, K. Acid-Base physiology: Metabolic Alkalosis Compensation. From http://www. anaesthesiaMCQ.com/AcidBaseBook/ab7_5. (accessed January 2020).
- Why/How is Blood Red? (Colours of Hemoglobin). https://chemistry.stackexchange.com/ questions/49940/why-how-is-blood-red-colours-of-hemoglobin.
- Higgins, C. Adult Reference Intervals for Blood Gases, January 2012. www.acutecaretesting. org.
- Higgins, C. Central Venous Blood Gas Analysis, July 2011. www.acutecaretesting.org.
- Klaestrup, E.; Trydal, T.; Pedersen, J.; Larsen, J.; Lundbye-Christensen, S.; Kristensen, S. Reference Intervals and Age and Gender Dependency for Arterial Blood Gases and Elec- trolytes in Adults. Clin. Chem. Lab. Med. 2011, 49, 1495-1500.
- Hardie, J. A.; Vollmer, W. M.; Buist, S.; Ellingsen, I.; Morkve, O. Reference Values for Arterial Blood Gases in the Elderly. Chest 2004, 125, 2053-2060.
- Sorenson, H. M. Arterial Oxygenation in the Elderly. Elite Learn. 2006, 19 (2), 17. https:// www.elitecme.com/resource-center/respiratory-care-sleep-medicine/arterial-oxygenation-in- the-elderly.
- Brouillette, R. T.; Waxman, D. H. Evaluation of the Newborn’s Blood Gas Status. Clin. Chem. 1997, 43 (1), 215-221.
BẢNG CHÚ GIẢI THUẬT NGỮ Y HỌC ANH VIỆT. CHƯƠNG 1
| STT | Thuật ngữ tiếng Anh | Phiên âm IPA | Nghĩa Tiếng Việt |
|---|---|---|---|
| 1 | Blood gas | /ˈblʌd ɡæs/ | Khí máu |
| 2 | pH | /piːˈeɪtʃ/ | pH |
| 3 | Partial pressure | /ˈpɑːrʃəl ˈprɛʃər/ | Áp suất riêng phần |
| 4 | Hemoglobin | /ˌhiːməˈɡloʊbɪn/ | Hemoglobin |
| 5 | Electrolytes | /ɪˈlɛktrəˌlaɪts/ | Chất điện giải |
| 6 | Metabolites | /məˈtæbəˌlaɪts/ | Chất chuyển hóa |
| 7 | Ionized calcium | /ˈaɪəˌnaɪzd ˈkælsiəm/ | Calci ion hóa |
| 8 | Bicarbonate | /ˌbaɪˈkɑːrbənɪt/ | Bicarbonate |
| 9 | Lactate | /ˈlækˌteɪt/ | Lactat |
| 10 | Oximetry | /ɒkˈsɪmɪtri/ | Đo oxy |
| 11 | Acid | /ˈæsɪd/ | Acid |
| 12 | Base | /beɪs/ | Base |
| 13 | Henderson-Hasselbalch equation | /ˈhɛndərsən ˈhæsəlbɑːk ɪˈkweɪʒən/ | Phương trình Henderson-Hasselbalch |
| 14 | Covalent bond | /koʊˈveɪlənt bɒnd/ | Liên kết cộng hóa trị |
| 15 | Acid-base status | /ˈæsɪd beɪs ˈsteɪtəs/ | Tình trạng kiềm-toan |
| 16 | Strong-Ion-Difference (SID) | /strɔŋ ˈaɪən ˈdɪfərəns/ | Hiệu số Ion mạnh |
| 17 | Clinical chemistry | /ˈklɪnɪkəl ˈkɛmɪstri/ | Hóa học lâm sàng |
| 18 | Oxygen saturation | /ˈɒksɪdʒən ˌsætʃəˈreɪʃən/ | Độ bão hòa oxy |
| 19 | Pulse oximetry | /pʌls ɒkˈsɪmɪtri/ | Đo oxy xung |
| 20 | Electrode | /ɪˈlɛktroʊd/ | Điện cực |
| 21 | Acidity | /əˈsɪdɪti/ | Độ acid |
| 22 | Alkalinity | /ˌælkəˈlɪnɪti/ | Độ kiềm |
| 23 | Acidemia | /ˌæsɪˈdiːmiə/ | Nhiễm toan máu |
| 24 | Acidosis | /ˌæsɪˈdoʊsɪs/ | Tình trạng toan |
| 25 | Alkalemia | /ˌælkəˈliːmiə/ | Nhiễm kiềm máu |
| 26 | Alkalosis | /ˌælkəˈloʊsɪs/ | Tình trạng kiềm |
| 27 | Ventilation | /ˌvɛntɪˈleɪʃən/ | Thông khí |
| 28 | Alveoli | /ælˈviːəlaɪ/ | Phế nang |
| 29 | Gradient | /ˈɡreɪdiənt/ | Gradient, chênh lệch |
| 30 | Mitochondria | /ˌmaɪtəˈkɒndriə/ | Ty thể |
| 31 | Hypoventilation | /ˌhaɪpoʊˌvɛntɪˈleɪʃən/ | Giảm thông khí |
| 32 | Ventilation/perfusion (V/Q) mismatch | /ˌvɛntɪˈleɪʃən pərˈfjuːʒən ˈmɪsmætʃ/ | Bất tương xứng thông khí/tưới máu |
| 33 | Pulmonary embolism | /ˈpʊlməˌnɛri ˈɛmbəˌlɪzəm/ | Thuyên tắc phổi |
| 34 | Shunt | /ʃʌnt/ | Shunt, nối tắt |
| 35 | Diffusion impairment | /dɪˈfjuːʒən ɪmˈpɛərmənt/ | Suy giảm khuếch tán |
| 36 | Buffer | /ˈbʌfər/ | Hệ đệm, chất đệm |
| 37 | Base Excess (BE) | /beɪs ɪkˈsɛs/ | Base dư |
| 38 | Metabolic | /ˌmɛtəˈbɒlɪk/ | Chuyển hóa |
| 39 | Respiratory | /ˈrɛspərəˌtɔːri/ | Hô hấp |
| 40 | Base deficit (BD) | /beɪs ˈdɛfɪsɪt/ | Thâm hụt base |
| 41 | Resuscitation | /rɪˌsʌsɪˈteɪʃən/ | Hồi sức |
| 42 | Hypoperfusion | /ˌhaɪpoʊpərˈfjuːʒən/ | Giảm tưới máu |
| 43 | Anion gap (AG) | /ˈænaɪən ɡæp/ | Khoảng trống Anion |
| 44 | Cation | /ˈkætaɪən/ | Cation |
| 45 | Anion | /ˈænaɪən/ | Anion |
| 46 | Albumin | /ælˈbjuːmɪn/ | Albumin |
| 47 | Ketoacids | /ˌkiːtoʊˈæsɪdz/ | Axit ceton |
| 48 | Delta gap | /ˈdɛltə ɡæp/ | Delta gap |
| 49 | Delta ratio | /ˈdɛltə ˈreɪʃioʊ/ | Tỷ lệ delta |
| 50 | Electroneutrality | /ɪˌlɛktroʊnuːˈtræləti/ | Tính trung hòa điện |
| 51 | Co-oximetry | /koʊ ɒkˈsɪmɪtri/ | Đo co-oximetry |
| 52 | Oxyhemoglobin (O2Hb) | /ˌɒksiˌhiːməˈɡloʊbɪn/ | Oxyhemoglobin |
| 53 | Deoxyhemoglobin (HHb) | /diːˌɒksiˌhiːməˈɡloʊbɪn/ | Deoxyhemoglobin |
| 54 | Carboxyhemoglobin (COHb) | /kɑːrˌbɒksiˌhiːməˈɡloʊbɪn/ | Carboxyhemoglobin |
| 55 | Methemoglobin (metHb) | /mɛtˌhiːməˈɡloʊbɪn/ | Methemoglobin |
| 56 | Ferrous ion () | /ˈfɛrəs ˈaɪən/ | Ion sắt II |
| 57 | Ferric ion () | /ˈfɛrɪk ˈaɪən/ | Ion sắt III |
| 58 | Oxygen delivery () | /ˈɒksɪdʒən dɪˈlɪvəri/ | Cung cấp oxy |
| 59 | Oxygen consumption () | /ˈɒksɪdʒən kənˈsʌmpʃən/ | Tiêu thụ oxy |
| 60 | Cardiac output (CO) | /ˈkɑːrdiæk ˈaʊtˌpʊt/ | Cung lượng tim |
| 61 | Extracellular | /ˌɛkstrəˈsɛljələr/ | Ngoại bào |
| 62 | Intracellular | /ˌɪntrəˈsɛljələr/ | Nội bào |
| 63 | Glucose oxidation | /ˈɡluːkoʊs ˌɒksɪˈdeɪʃən/ | Oxy hóa glucose |
| 64 | Carbonic acid | /kɑːrˈbɒnɪk ˈæsɪd/ | Acid carbonic |
| 65 | Pyruvate | /paɪˈruːveɪt/ | Pyruvat |
| 66 | Oxidative phosphorylation | /ˈɒksɪˌdeɪtɪv ˌfɒsfɔːrɪˈleɪʃən/ | Phosphoryl hóa oxy hóa |
| 67 | Sepsis | /ˈsɛpsɪs/ | Nhiễm trùng huyết |
| 68 | Ketoacidosis | /ˌkiːtoʊˌæsɪˈdoʊsɪs/ | Toan ceton |
| 69 | Acetoacetate | /əˌsiːtoʊˈæsɪˌteɪt/ | Acetoacetat |
| 70 | β-hydroxybutyrate | /ˈbeɪtə haɪˌdrɒksiˈbjuːtəˌreɪt/ | β-hydroxybutyrat |
| 71 | Nonvolatile acids | /nɒnˈvɒləˌtaɪl ˈæsɪdz/ | Các acid không bay hơi |
| 72 | Ammonia | /əˈmoʊniə/ | Amoniac |
| 73 | Glutamine | /ˈɡluːtəˌmiːn/ | Glutamin |
| 74 | Chronic kidney disease | /ˈkrɒnɪk ˈkɪdni dɪˈziːz/ | Bệnh thận mạn tính |
| 75 | Diuretics | /ˌdaɪjʊˈrɛtɪks/ | Thuốc lợi tiểu |
| 76 | Iatrogenic | /ˌaɪætroʊˈdʒɛnɪk/ | Do thầy thuốc gây ra |
| 77 | Volatile | /ˈvɒləˌtaɪl/ | Dễ bay hơi |
| 78 | Solubility | /ˌsɒljʊˈbɪlɪti/ | Độ hòa tan |
| 79 | 2,3-Diphosphoglycerate (2,3-DPG) | /tuː θriː daɪˌfɒsfoʊˈɡlɪsəˌreɪt/ | 2,3-Diphosphoglycerat |
| 80 | Phosphate | /ˈfɒsfeɪt/ | Phosphat |
| 81 | Imidazole | /ˌɪmɪˈdæzoʊl/ | Imidazol |
| 82 | Histidine | /ˈhɪstɪˌdiːn/ | Histidin |
| 83 | Hypoalbuminemia | /ˌhaɪpoʊˌælbjuːmɪˈniːmiə/ | Giảm albumin máu |
| 84 | Pulmonary | /ˈpʊlməˌnɛri/ | (Thuộc) Phổi |
| 85 | Renal | /ˈriːnəl/ | (Thuộc) Thận |
| 86 | Hepatic | /hɪˈpætɪk/ | (Thuộc) Gan |
| 87 | Gastrointestinal | /ˌɡæstroʊɪnˈtɛstɪnəl/ | (Thuộc) Tiêu hóa |
| 88 | Aerobic | /ɛəˈroʊbɪk/ | Hiếu khí |
| 89 | Urea cycle | /jʊˈriːə ˈsaɪkəl/ | Chu trình ure |
| 90 | Aldosterone | /ælˈdɒstəˌroʊn/ | Aldosteron |
| 91 | Homeostatic | /ˌhoʊmioʊˈstætɪk/ | Nội môi, cân bằng nội môi |
| 92 | Compensation | /ˌkɒmpɛnˈseɪʃən/ | Bù trừ |
| 93 | Hypokalemia | /ˌhaɪpoʊkəˈliːmiə/ | Hạ kali máu |
| 94 | Volume depletion | /ˈvɒljuːm dɪˈpliːʃən/ | Giảm thể tích |
| 95 | Hyperaldosteronism | /ˌhaɪpərælˈdɒstəˌroʊnɪzəm/ | Cường aldosteron |
| 96 | Hemoglobin dissociation curve | /ˌhiːməˈɡloʊbɪn dɪˌsoʊʃiˈeɪʃən kɜːrv/ | Đường cong phân ly hemoglobin |
| 79 | P50 | /piː ˈfɪfti/ | P50 |
| 98 | Reference interval | /ˈrɛfərəns ˈɪntərvəl/ | Khoảng tham chiếu |
| 99 | Neonate | /ˈniːəʊneɪt/ | Trẻ sơ sinh |
| 100 | Arterial | /ɑːrˈtɪəriəl/ | (Thuộc) Động mạch |
| 101 | Venous | /ˈviːnəs/ | (Thuộc) Tĩnh mạch |
| 102 | Capillary | /ˈkæpɪˌlɛri/ | Mao mạch |
