Khí máu và các Xét nghiệm trong Hồi sức Cấp cứu, Ấn bản thứ 3
(Blood Gases and Critical Care Testing, Third Edition)
Tác giả: Toffaletti, John G., PhD – Nhà xuất bản Elsevier – Biên dịch: Ths.Bs Lê Đình Sáng
Chương 5: Sinh lý và đánh giá lâm sàng về canxi
Calcium physiology and clinical evaluation
John G. Toffaletti, PhD; Craig R. Rackley, MD
Blood Gases and Critical Care Testing, Chapter 5, 85-109
Giới thiệu và lịch sử
Năm 1883, Sydney Ringer đã chỉ ra rằng canxi là yếu tố cần thiết cho sự co bóp của cơ tim. Năm 1934, Franklin McLean và Baird Hastings đã công bố một báo cáo trên Tạp chí Hóa học Sinh học cho thấy nồng độ canxi ion hóa tỷ lệ thuận với biên độ co bóp của tim ếch, trong khi canxi liên kết với protein và citrate không có tác dụng. Sau nhiều nỗ lực phát triển phương pháp cải tiến, các điện cực chọn lọc ion đáng tin cậy để đo canxi ion hóa cuối cùng đã được phát triển và hiện đã có sẵn.
Các chất điện giải canxi, magie và phốt phát có nhiều vai trò trong cấu trúc và chức năng của xương, chức năng của màng tế bào, và sự kích hoạt của nhiều enzyme liên quan đến điều hòa di truyền, co cơ và sử dụng năng lượng. Hormone tuyến cận giáp, vitamin D và calcitonin điều chỉnh sự hấp thụ, phân phối và bài tiết các ion này trong ruột, thận, xương và các mô mềm.
Ngoài việc chẩn đoán rối loạn chức năng tuyến cận giáp và tăng canxi máu do bệnh ác tính, vai trò của các phép đo canxi trong các xét nghiệm chẩn đoán chỉ ở mức độ quan tâm vừa phải trong suốt những năm 1970. Trong 40 năm qua, một vai trò nổi bật đã phát triển cho việc theo dõi nồng độ canxi trong một số cuộc phẫu thuật và ở những bệnh nhân nặng.
Hầu hết các rối loạn canxi đều liên quan đến những điều sau đây, mà các phép đo canxi là hữu ích nhất:
- Thiếu hụt, hoặc khiếm khuyết trong chuyển hóa tuyến cận giáp hoặc vitamin D
- Bệnh ác tính, đặc biệt là với tăng canxi máu
- Bệnh thận
- Thiếu magie
- Đánh giá bệnh nhân trong tình trạng nguy kịch, chẳng hạn như nhiễm trùng huyết
- Đánh giá trẻ sơ sinh bị hạ canxi máu chưa được giải quyết
- Sử dụng quá nhiều citrate, canxi, hoặc nước muối
Ngoài ra, việc hiểu rõ sự điều hòa canxi và các chất điện giải khác bởi hormone tuyến cận giáp (PTH), vitamin D và calcitonin là hữu ích trong chẩn đoán phân biệt nhiều rối loạn canxi.
Một điểm quan trọng nhất cần lưu ý là việc điều chỉnh hạ canxi máu không phải lúc nào cũng cần thiết hoặc được đảm bảo. Nồng độ canxi huyết tương bất thường thường là một dấu hiệu cho thấy mức độ nghiêm trọng của bệnh và tự khỏi khi quá trình bệnh chính được giải quyết. Hơn nữa, nồng độ canxi ion hóa thấp có thể có tác dụng bảo vệ, do đó việc điều chỉnh thực sự có thể gây hại.
Sinh lý canxi
Khoảng 99% canxi cơ thể nằm trong bộ xương, trong đó một tỷ lệ nhỏ có thể trao đổi tự do với canxi ngoại bào. Mặc dù chỉ có 1% canxi trong cơ thể có mặt trong không gian ngoại bào và nội bào, sự trao đổi và cân bằng của các ion canxi là cực kỳ quan trọng trong các không gian này. Nồng độ canxi trong huyết tương được điều hòa chặt chẽ, với các ion canxi đóng một vai trò quan trọng trong việc truyền xung thần kinh, co cơ, đông máu, bài tiết hormone và kết dính giữa các tế bào.
Cân bằng canxi tổng thể được điều hòa bởi các hoạt động phối hợp của sự hấp thụ canxi ở ruột, tái hấp thu ở thận và trao đổi từ xương. Tất cả các quá trình này được kiểm soát bởi các hormone là một phần của cơ chế phức tạp điều chỉnh cả canxi toàn thân và ngoại bào.
Nồng độ canxi toàn phần bình thường trong huyết tương là khoảng 2,20-2,55 mmol/L. Mặc dù tất cả canxi trong huyết tương đều là ion canxi, nhưng phần lớn các ion này liên kết với các anion, với khoảng 40%-45% liên kết với protein (chủ yếu là albumin), và khoảng 10%-15% tạo phức với các anion nhỏ hơn, chủ yếu là bicarbonate, citrate, lactate và phốt phát. 45%-50% còn lại là các ion canxi tự do.
Nồng độ canxi trong bào tương của tế bào thấp hơn khoảng 15.000-20.000 lần so với nồng độ trong huyết tương ngoại bào. Gradient ngoại bào-nội bào này được duy trì bởi các phốt phát năng lượng cao cung cấp năng lượng cho các bơm ion khác nhau. Canxi ion hóa trong máu là phần canxi có hoạt tính sinh lý và kiểm soát nhiều quá trình thần kinh cơ và bài tiết.
Ví dụ, canxi ion hóa đóng một vai trò quan trọng trong chức năng tim mạch. Dòng ion canxi vào trong các tế bào tim giúp kiểm soát nhịp tim bằng cách liên kết với các protein co bóp trong tế bào cơ tim, khởi đầu quá trình co bóp. Tốc độ dòng ion canxi vào các tế bào cơ trơn ảnh hưởng đến sức căng của các tiểu động mạch điều hòa huyết áp. Các kênh canxi trong màng tế bào điều chỉnh dòng chảy này bằng cách mở ra khi màng bị khử cực. Các ion magie giúp ổn định các kênh canxi. Các loại thuốc tác động lên tim như epinephrine và isoproterenol tạo điều kiện cho việc vận chuyển các ion canxi qua các kênh này, thúc đẩy sự co bóp nhanh hơn hoặc mạnh hơn, làm tăng công của tim. Các thuốc chẹn kênh canxi, chẳng hạn như nifedipine, verapamil và diltiazem, làm giảm huyết áp bằng cách làm giãn mạch máu và làm chậm nhịp tim, giúp tăng lưu lượng máu và cung cấp oxy cho tim và giảm công của tim.
Các ion canxi cũng quan trọng như những người truyền tin thứ hai. Sau khi được kích thích ở bề mặt tế bào bởi một phân tử cụ thể (người truyền tin thứ nhất), dòng ion canxi vào trong (người truyền tin thứ hai) sẽ khởi đầu các hoạt động của tế bào, chẳng hạn như sản xuất các hormone như insulin, aldosterone, vasopressin và renin.
Điều hòa trong máu
Hấp thụ canxi qua ruột (GI). Hầu hết sự hấp thụ canxi qua đường tiêu hóa diễn ra ở tá tràng, hỗng tràng và hồi tràng. Sự hấp thụ xảy ra qua các con đường gian bào thông qua các kênh “liên kết chặt chẽ” giữa các tế bào, hoặc các con đường xuyên bào qua các tế bào.
Điều hòa canxi ở thận. Như được thể hiện trong Hình 5.1, 60%-70% ion Ca được tái hấp thu ở ống lượn gần (PCT), chủ yếu bằng các cơ chế thụ động, nhưng một lượng nhỏ được tái hấp thu bằng các cơ chế chủ động chủ yếu được điều hòa bởi PTH và calcitonin. Ở nhánh lên dày của quai Henle (TAL), sự hấp thụ ion Ca gian bào được thúc đẩy bởi đồng vận chuyển Na-K-2Cl (NKCC2) và kênh K ion tủy ngoài của thận (ROMK).
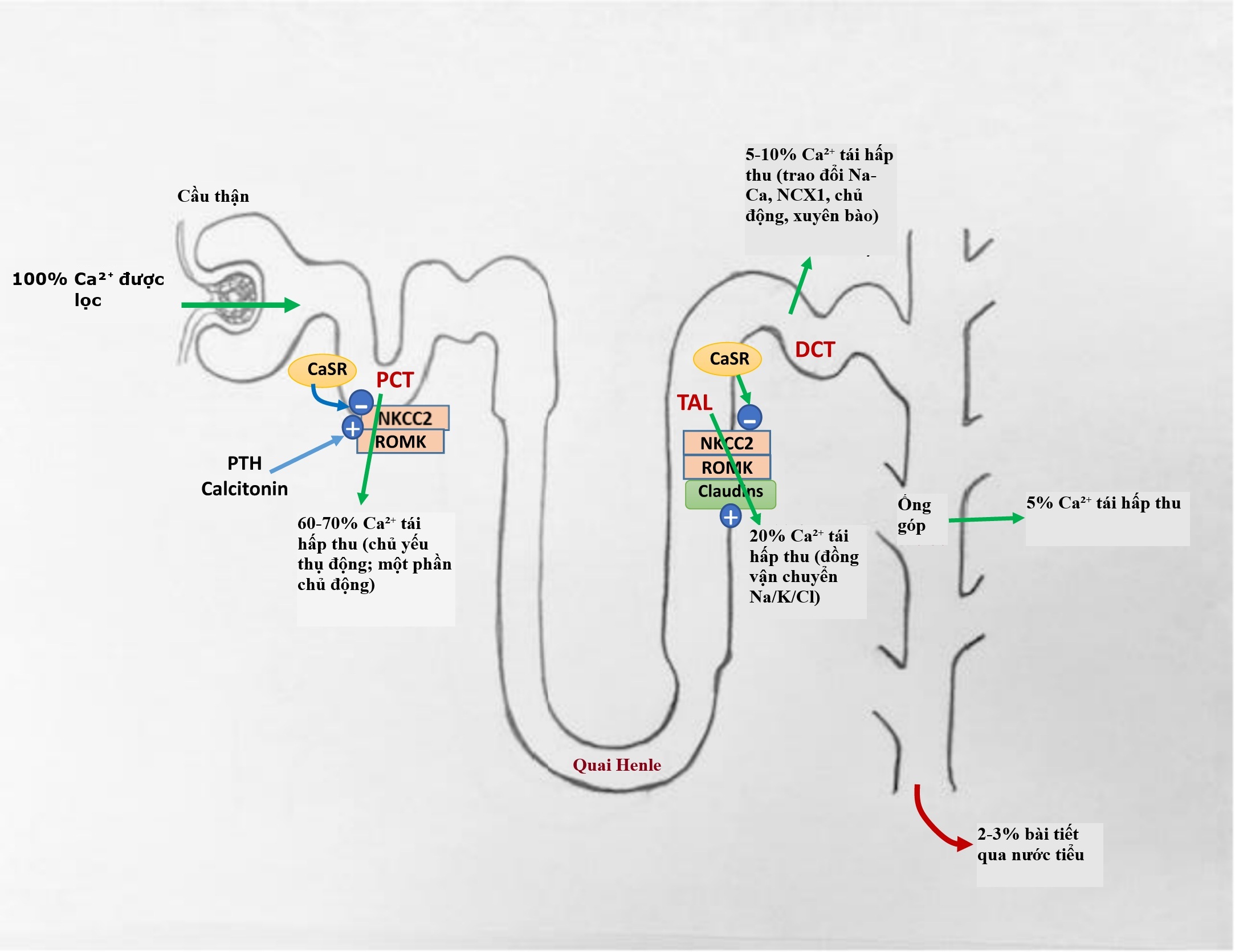 Hình 5.1 Quá trình xử lý các ion Ca trong các đoạn của nephron. 100% ion Ca được lọc qua cầu thận, với sự tái hấp thu xảy ra ở ống lượn gần (PCT), nhánh lên dày (TAL) của quai Henle, ống lượn xa (DCT), và ống góp (Coll Duct). CaSR, thụ thể cảm nhận canxi; NKCC2, đồng vận chuyển Na-K-2Cl; ROMK, kênh K màng ngoài của thận. Khi được kích hoạt, CaSR ức chế các chất vận chuyển (NKCC2 và Claudins) và các kênh ion (ROMK) tái hấp thu các ion Ca. Xuyên bào đề cập đến quá trình các ion di chuyển qua các tế bào. PTH và calcitonin thúc đẩy tái hấp thu các ion Ca ở ống lượn gần.
Hình 5.1 Quá trình xử lý các ion Ca trong các đoạn của nephron. 100% ion Ca được lọc qua cầu thận, với sự tái hấp thu xảy ra ở ống lượn gần (PCT), nhánh lên dày (TAL) của quai Henle, ống lượn xa (DCT), và ống góp (Coll Duct). CaSR, thụ thể cảm nhận canxi; NKCC2, đồng vận chuyển Na-K-2Cl; ROMK, kênh K màng ngoài của thận. Khi được kích hoạt, CaSR ức chế các chất vận chuyển (NKCC2 và Claudins) và các kênh ion (ROMK) tái hấp thu các ion Ca. Xuyên bào đề cập đến quá trình các ion di chuyển qua các tế bào. PTH và calcitonin thúc đẩy tái hấp thu các ion Ca ở ống lượn gần.
Các tế bào trong TAL cũng biểu hiện một số protein “liên kết chặt chẽ” được gọi là claudin. Claudin là các protein màng trong các liên kết chặt chẽ này giữa các tế bào, điều chỉnh dòng chảy của các phân tử và ion qua các không gian gian bào này.
Điều hòa hormon của canxi
Ba hormone điều hòa canxi huyết thanh bằng cách thay đổi tốc độ bài tiết của chúng để đáp ứng với những thay đổi của canxi ion hóa: PTH, vitamin D và calcitonin, mặc dù vai trò của calcitonin ít rõ ràng hơn. Hoạt động của chúng được thể hiện trong Bảng 5.1. Một phân tử có hoạt động giống PTH, được gọi là peptide liên quan đến PTH (PTHrP), dường như có tác dụng tăng canxi máu tương tự như của PTH, và có thể đặc biệt quan trọng trong tăng canxi máu do ác tính.
Bảng 5.1. Các hoạt động sinh lý của PTH, vitamin D và calcitonin
| Hormone | Hoạt động |
|---|---|
| PTH | • Thúc đẩy tái hấp thu ion Ca²⁺ ở ống thận bằng cách ức chế các thụ thể cảm nhận canxi (CaSR) • Thúc đẩy bài tiết ion PO₄³⁻ qua nước tiểu • Kích hoạt enzym 1-α-hydroxylase ở thận → tổng hợp vitamin D hoạt động (calcitriol) → tăng hấp thu canxi ở đường tiêu hóa • Kích thích hủy xương, giải phóng ion Ca²⁺ vào dịch ngoại bào |
| Vitamin D (calcitriol) | • Thúc đẩy hấp thu Ca²⁺ và PO₄³⁻ ở ruột • Thúc đẩy tái hấp thu Ca²⁺ và PO₄³⁻ ở ống thận • Điều hòa cân bằng nội môi bằng cách ức chế sản xuất 1-α-hydroxylase ở thận và kích hoạt sản xuất 25-α-hydroxylase |
| Calcitonin | • Được sản xuất tại tế bào C của tuyến giáp để đáp ứng với tăng canxi máu • Ức chế tế bào hủy xương, giảm giải phóng Ca²⁺ vào dịch ngoại bào • Giảm hấp thu Ca²⁺ ở thận và đường tiêu hóa |
Hormone tuyến cận giáp (PTH). Khi nồng độ canxi trong máu giảm, các tế bào trong tuyến cận giáp phản ứng bằng cách tổng hợp và bài tiết PTH, hoạt động hiệp đồng với vitamin D để tăng nồng độ canxi trong máu.
Vitamin D. Các dạng không hoạt động của vitamin D₃ được lấy từ chế độ ăn uống hoặc từ việc tiếp xúc của da với ánh sáng mặt trời. Chúng được chuyển hóa ở gan thành 25-hydroxycholecalciferol (25-OH-D₃), sau đó được kích hoạt bởi enzyme 1-α-hydroxylase ở thận để tạo thành 1,25-dihydroxycholecalciferol [1,25-(OH)₂-D₃; calcitriol], dạng có hoạt tính sinh học. Sự chuyển hóa của vitamin D được thể hiện trong Hình 5.2.
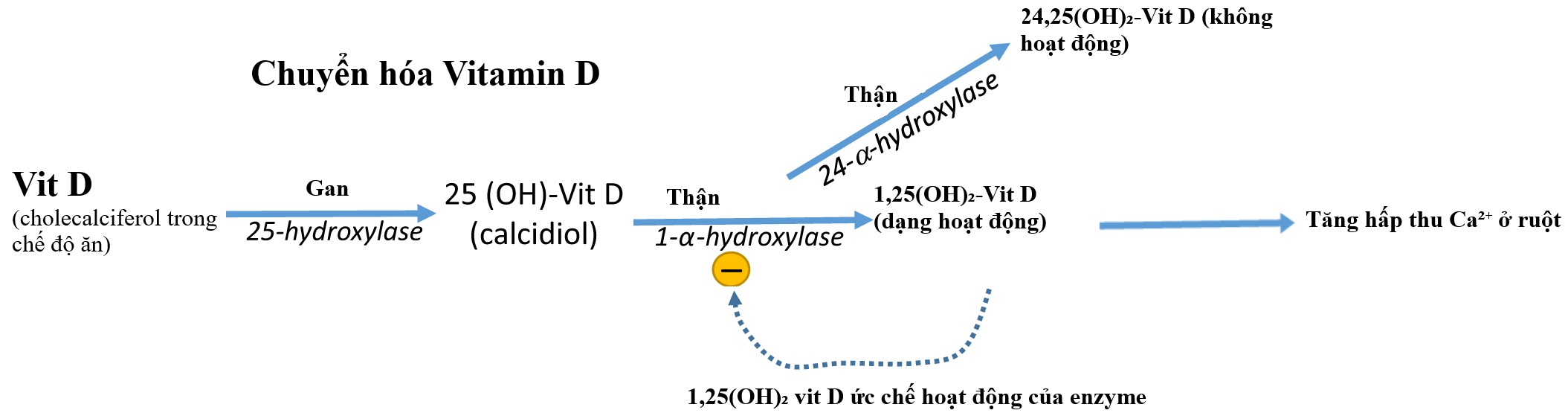
Hình 5.2 Tổng hợp và chuyển hóa vitamin D. Quá trình tổng hợp vitamin D hoạt động (1,25(OH)₂-vit D) bắt đầu bằng sự chuyển đổi tuần tự của cholecalciferol trong chế độ ăn uống bởi các enzyme hydroxylase ở gan và thận. Khi vitamin D hoạt động được hình thành, nó sẽ ức chế hoạt động của 1-α-hydroxylase ở thận.
Calcitonin. Nếu nồng độ canxi trong máu tăng lên, một số cơ chế hoạt động để đảo ngược sự gia tăng này: (1) các tế bào C trong tuyến giáp tổng hợp calcitonin, có tác dụng hạ canxi bằng cách ức chế các tế bào hủy xương, thúc đẩy sự lắng đọng canxi vào xương và làm giảm nồng độ canxi trong máu.
Phân bố trong tế bào và máu
Hơn 99% canxi trong cơ thể ở dạng hydroxyapatite trong xương. 1% còn lại chủ yếu ở trong máu và dịch ngoại bào. Canxi trong máu được phân bố dưới nhiều dạng: ion canxi tự do, liên kết với protein, và liên kết với các anion nhỏ hơn (Hình 5.3). Sự phân bố này có thể thay đổi trong nhiều bệnh lý, nhưng những thay đổi lớn có thể xảy ra trong quá trình phẫu thuật hoặc ở những bệnh nhân nặng do những thay đổi về citrate, bicarbonate, lactate và phốt phát.
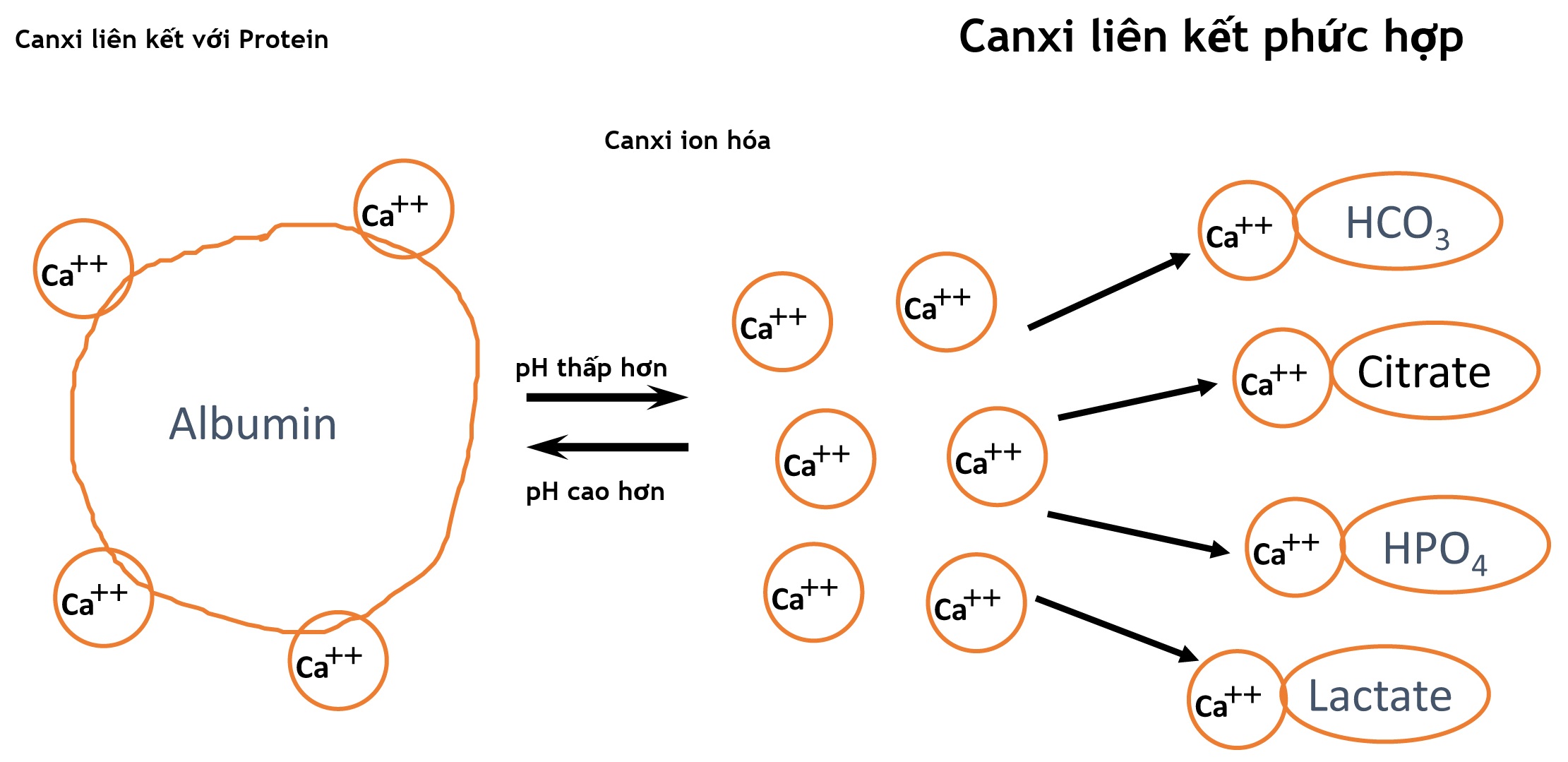
Hình 5.3 Sự cân bằng giữa canxi liên kết protein, liên kết phức hợp và canxi ion hóa. Các ion canxi liên kết với cả các protein lớn hơn, chủ yếu là albumin, và với các anion nhỏ hơn, chủ yếu là bicarbonate, citrate, phốt phát và lactate.
Hạ canxi máu
Dấu hiệu và triệu chứng của hạ canxi máu
Hạ canxi máu được coi là canxi toàn phần <8,5 mg/dL (<2,12 mmol/L) hoặc canxi ion hóa <1,00 mmol/L. Các triệu chứng của hạ canxi máu thường biểu hiện dưới dạng rối loạn tim mạch như suy tim, hạ huyết áp và rối loạn nhịp tim. Hạ canxi máu cũng có thể gây co thắt cơ không đều, gọi là tetany, và tê quanh miệng.
Nguyên nhân của hạ canxi máu
Việc nhận biết kịp thời canxi ion hóa bất thường đặc biệt quan trọng ở những bệnh nhân bị nhiễm trùng huyết, co giật, rối loạn nhịp tim, hạ huyết áp, suy tim, sốc, hoặc bỏng. Hạ canxi máu thường xảy ra ở những bệnh nhân có các tình trạng sau (Bảng 5.2):
Bảng 5.2. Các nguyên nhân thường gặp của hạ canxi máu
| Nguyên nhân | Nguyên nhân |
|---|---|
| Suy thận mạn | Bệnh gan |
| Thiếu hụt hoặc khiếm khuyết vitamin D | Hội chứng xương đói |
| Tăng phốt phát máu | Bệnh ở trẻ sơ sinh |
| Hạ magie máu | Tăng magie máu |
| Suy cận giáp (sau phẫu thuật hoặc giả suy cận giáp) | |
| Viêm tụy cấp | |
| Nhiễm trùng huyết, bỏng, hoặc bệnh nặng khác | |
| Sau phẫu thuật, đặc biệt khi truyền nhiều máu chứa citrate |
Đánh giá xét nghiệm về hạ canxi máu
Mặc dù canxi toàn phần thường là xét nghiệm ban đầu để phát hiện hạ canxi máu, canxi ion hóa là một thông số xác định hơn để khẳng định một bất thường về canxi. Khi hạ canxi máu được xác nhận bằng nồng độ canxi ion hóa thấp, trình tự các xét nghiệm để làm sáng tỏ nguyên nhân được thể hiện trong Hình 5.4.
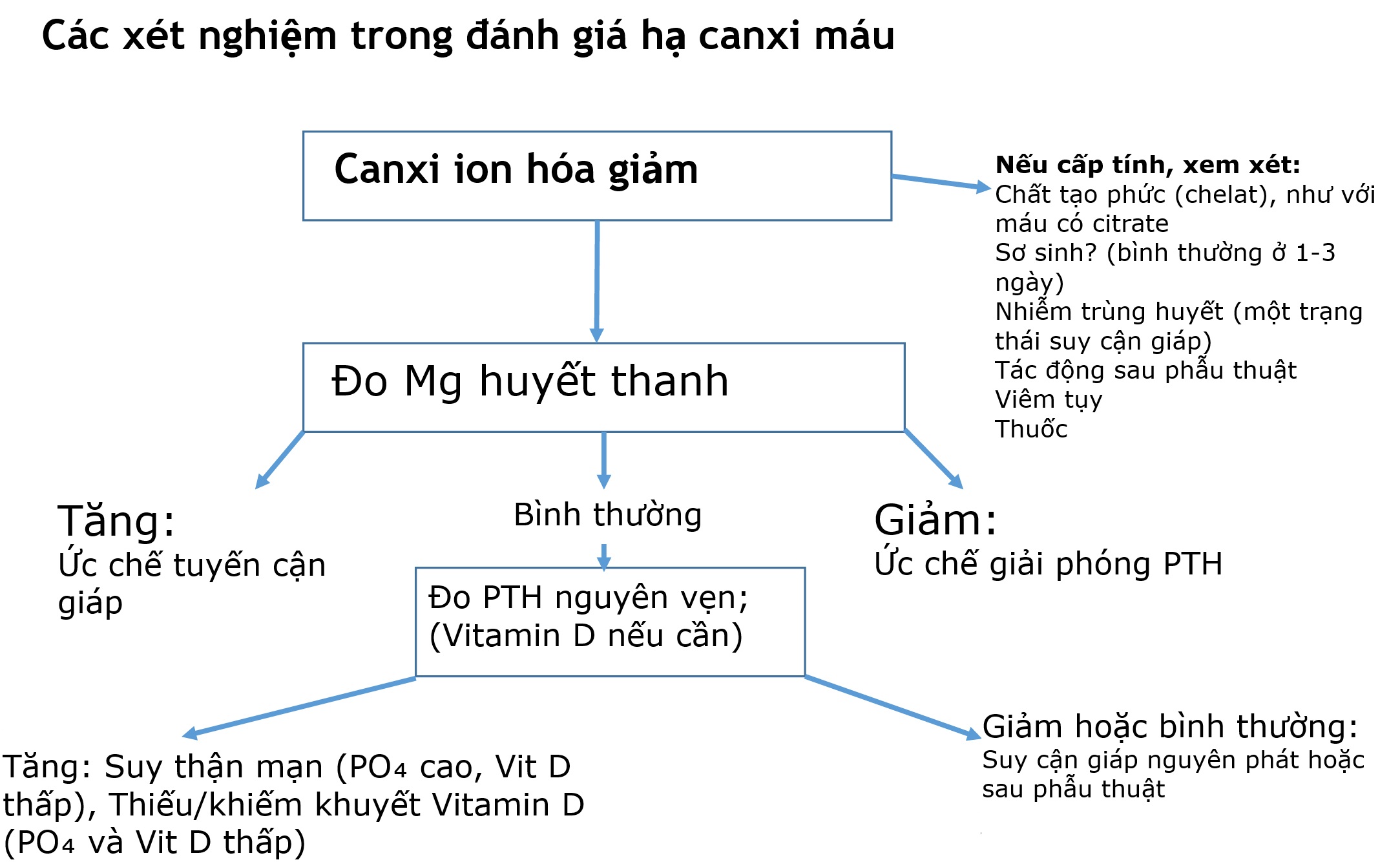
Hình 5.4 Các xét nghiệm trong việc đánh giá hạ canxi máu. Nếu canxi ion hóa giảm, tiền sử của bệnh nhân có thể chỉ ra nguyên nhân, chẳng hạn như truyền máu có citrate, nhiễm trùng huyết, hoặc sau phẫu thuật. Sau đó, Mg và PTH nên được đo.
Điều trị hạ canxi máu
Như đã lưu ý trước đó, việc điều chỉnh hạ canxi máu không phải lúc nào cũng cần thiết. Hầu hết các trường hợp hạ canxi máu đều nhẹ và chỉ cần điều trị hỗ trợ.
Tăng canxi máu
Dấu hiệu và triệu chứng của tăng canxi máu
Mức độ nghiêm trọng của tăng canxi máu có thể được phân loại theo nồng độ canxi toàn phần hoặc ion hóa:
- Nhẹ: Canxi toàn phần: 10,5–11,0 mg/dL (2,5–3,0 mmol/L); Canxi ion hóa: 1,4–2,0 mmol/L
- Trung bình: Canxi toàn phần: 12–13,9 mg/dL (3,0–3,5 mmol/L); Canxi ion hóa: 2,0–2,5 mmol/L
- Nặng: Canxi toàn phần: 14–16 mg/dL (3,5–4,0 mmol/L); Canxi ion hóa: 2,5–3,0 mmol/L
Nhìn chung, các triệu chứng của tăng canxi máu ít biểu hiện cho đến khi nồng độ ở mức trung bình và nặng. Tăng canxi máu có thể gây ra tình trạng lơ mơ chung ở bệnh nhân và có thể ảnh hưởng đến nhiều hệ cơ quan.
Các xét nghiệm để đánh giá nguyên nhân của tăng canxi máu được thể hiện trong Hình 5.5.
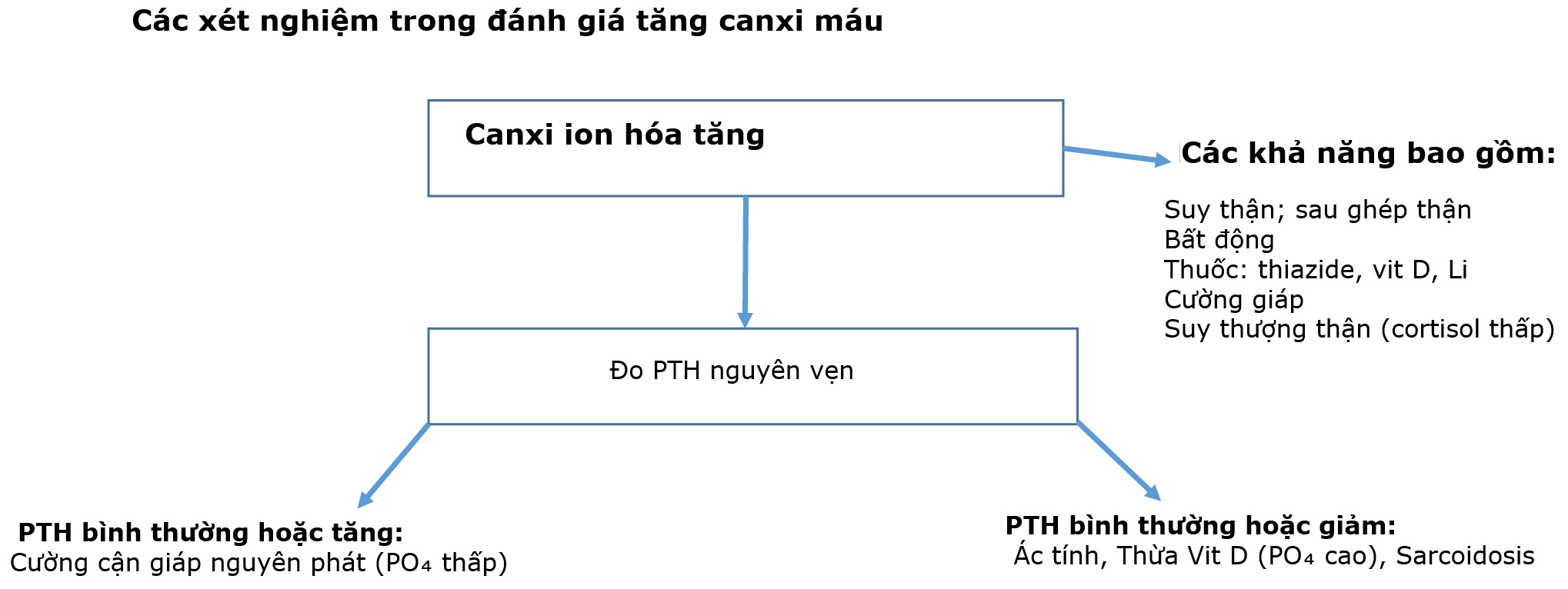
Hình 5.5 Các xét nghiệm trong việc đánh giá tăng canxi máu. Nếu canxi ion hóa tăng, tiền sử của bệnh nhân có thể chỉ ra nguyên nhân, đặc biệt là suy thận, bất động kéo dài, hoặc một số loại thuốc. Sau đó, PTH hữu ích trong việc phân biệt cường cận giáp với các nguyên nhân khác, chẳng hạn như bệnh ác tính.
Nguyên nhân của tăng canxi máu
Bệnh ác tính và cường cận giáp nguyên phát (HPTH) là những nguyên nhân phổ biến nhất của tăng canxi máu, chiếm 80%-90% tổng số bệnh nhân tăng canxi máu.
Các kết quả xét nghiệm điển hình trong việc phân biệt cường cận giáp nguyên phát với bệnh ác tính được thể hiện trong Bảng 5.3.
Bảng 5.3. Diễn giải các xét nghiệm trong việc phân biệt cường cận giáp nguyên phát với bệnh ác tính
| Xét nghiệm | Ủng hộ cường cận giáp nguyên phát (HPTH) | Ủng hộ ác tính |
|---|---|---|
| Canxi toàn phần | < 3,13 mmol/L (< 12,5 mg/dL) | > 3,13 mmol/L (> 12,5 mg/dL) |
| Clorua huyết thanh | > 103 mmol/L (> 103 mEq/L) | < 103 mmol/L (< 103 mEq/L) |
| PTH nguyên vẹn | Tăng (hoặc bình thường cao) | Bị ức chế |
| PO₄ huyết thanh | Bình thường đến thấp | Thay đổi |
| Hematocrit | Bình thường | Thấp |
| Canxi niệu | Cao | Rất cao |
| 1,25-(OH)₂ vitamin D | Cao | Thấp |
| PTHrP | Bình thường hoặc không phát hiện được | Tăng |
Điều trị tăng canxi máu Việc điều trị phụ thuộc vào nguyên nhân và mức độ nghiêm trọng của tăng canxi máu.
Diễn giải các phép đo canxi và PTH
Trong việc phân biệt các nguyên nhân khác nhau của hạ và tăng canxi máu, các phép đo đồng thời của PTH và canxi rất hữu ích. Hình 5.6 cho thấy mối quan hệ giữa canxi toàn phần và PTH nguyên vẹn được mong đợi cho suy và cường cận giáp nguyên phát, cường cận giáp thứ phát, và tăng canxi máu do ác tính.
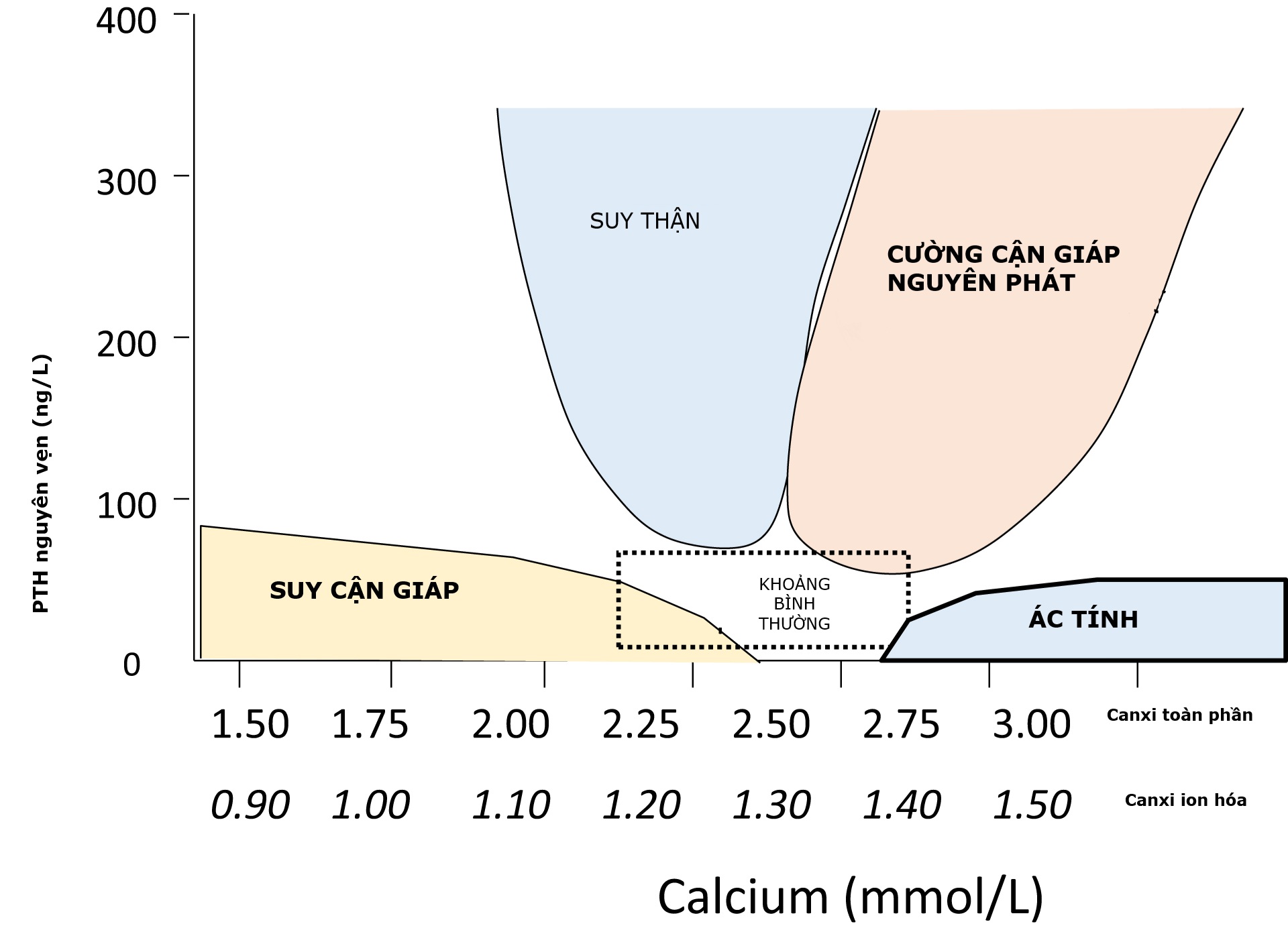
Hình 5.6 Mối quan hệ của canxi và PTH trong các rối loạn canxi khác nhau. Biểu đồ này thể hiện một biểu đồ của các phép đo canxi và PTH để giúp phân biệt giữa các nguyên nhân tiềm tàng của các rối loạn canxi. (Vùng bình thường, Suy cận giáp, Suy thận, Cường cận giáp nguyên phát, Ác tính)
Khoảng tham chiếu cho canxi
Đối với canxi toàn phần, khoảng tham chiếu thay đổi một chút theo tuổi, cao hơn một chút ở trẻ em và thanh thiếu niên khi xương phát triển mạnh nhất. Nhìn chung, nồng độ canxi ion hóa thay đổi nhanh chóng trong 1-3 ngày đầu đời sơ sinh. Sau đó, chúng giảm dần qua tuổi vị thành niên cho đến khi ổn định ở mức người lớn (xem Bảng 5.4).
Bảng 5.4. Khoảng tham chiếu cho canxi
| Thông số | Nhóm tuổi | Khoảng tham chiếu |
|---|---|---|
| Canxi toàn phần | Trẻ em – thanh thiếu niên | 2,20 – 2,68 mmol/L (8,8 – 10,7 mg/dL) |
| Người lớn (> 16 tuổi) | 2,10 – 2,55 mmol/L (8,4 – 10,2 mg/dL) | |
| Canxi ion hóa | Khi sinh | 1,30 – 1,60 mmol/L (5,2 – 6,4 mg/dL) |
| Trẻ sơ sinh (< 2 tuần) | 1,20 – 1,48 mmol/L (4,8 – 5,9 mg/dL) | |
| Trẻ em đến 16 tuổi | 1,20 – 1,38 mmol/L (4,8 – 5,5 mg/dL) | |
| Người lớn (> 16 tuổi) | 1,16 – 1,32 mmol/L (4,6 – 5,3 mg/dL) |
TỰ LƯỢNG GIÁ VÀ ÔN TẬP
Câu hỏi tự lượng giá
- Phát hiện lâm sàng nào là điển hình của cường cận giáp? a. tăng phốt phát máu b. hạ phốt phát máu c. hạ canxi máu d. tăng canxi máu e. b và d
- Lựa chọn nào sau đây KHÔNG phải là nguyên nhân của tăng canxi máu? a. cường cận giáp b. ác tính c. thiếu vitamin D d. thuốc e. rối loạn nội tiết
- Một bệnh nhân bị suy thận và có nồng độ phốt phát và PTH huyết thanh tăng và canxi huyết thanh thấp mạn tính. Chẩn đoán nào có khả năng nhất trong các lựa chọn sau? a. cường cận giáp nguyên phát b. cường cận giáp thứ phát c. một khối u sản xuất PTH d. cường cận giáp tam phát e. hạ magie máu
- Bệnh nhân nêu trên được ghép thận. Ba tháng sau, nồng độ canxi huyết tương của bệnh nhân tăng liên tục. Nguyên nhân có khả năng nhất là gì? a. cường cận giáp nguyên phát b. cường cận giáp thứ phát c. một khối u sản xuất PTH d. cường cận giáp tam phát e. hạ magie máu
- Phân bố bình thường gần đúng của các ion Ca trong máu là gì? CB, Ca phức hợp; PB, Ca liên kết protein. a. 25% PB, 10% CB, 65% ion hóa b. 10% PB, 3% CB, 87% ion hóa c. 50% PB, 3% CB, 47% ion hóa d. 40% PB, 10% CB, 50% ion hóa e. 60% PB, 5% CB, 35% ion hóa
- Hầu hết ion Ca được tái hấp thu ở đâu trong thận? a. Ống góp b. Ống lượn xa c. Ống lượn gần d. Nhánh lên của quai Henle e. Cầu thận
- Yếu tố nào liên quan đến việc tăng tái hấp thu ion Ca ở thận? a. Thụ thể cảm nhận Ca (CaSRs) b. thuốc lợi tiểu quai c. claudin d. giảm GFR e. tăng canxi máu
- Cholecalciferol được chuyển hóa thành vitamin D hoạt động như thế nào? a. Tuyến giáp hydroxyl hóa ở vị trí 1 và 25. b. Thận hydroxyl hóa ở vị trí 25, sau đó gan hydroxyl hóa ở vị trí 1. c. Thận hydroxyl hóa ở vị trí 1, sau đó ở vị trí 25. d. Gan hydroxyl hóa ở vị trí 1, sau đó thận hydroxyl hóa ở vị trí 25. e. Gan hydroxyl hóa ở vị trí 25, sau đó thận hydroxyl hóa ở vị trí 1.
Đáp án: 1-e, 2-c, 3-b, 4-d, 5-d, 6-c, 7-c, 8-e
TÀI LIỆU THAM KHẢO
1.Chapman R.A., Niedergerke R.: Effects of calcium on the contraction of the hypodynamic frog heart . J Physiol 1970; Dec;211(2):389-421:2.Mclean F.C., Hastings A.B.: A biological method for the estimation of calcium ion concentration . Journal of Biological Chemistry 1934; 107: pp. 337-350.3.Aberegg S.K.: Ionized Calcium in the ICU: Should It Be Measured and Corrected? . Chest 2016; 149 (3): pp. 846-855.4.Blaine J., Chonchol M., Levi M.: Renal Control of Calcium, Phosphate, and Magnesium Homeostasis . Clin. J. Am. Soc. Nephrol. 2015; 10: pp. 1257-1272.5.Toffaletti J., Gitelman H.J., Savory J.: Separation and Quantitation of Serum Constituents Associated with Calcium by Gel Filtration . Clin. Chem. 1976; 22: pp. 1968-1972.
6.Toffaletti J., Savory J., Gitelman H.J.: Use of Gel Filtration to Examine the Distribution of Calcium Among Serum Proteins . Clin. Chem. 1977; 23: pp. 2306-2310.
7.Sejersted O.M.: Calcium Controls Cardiac Function– by All Means! . J. Physiol. 2011; 589 (12): pp. 2919-2920.
8.Ariyan C.E., Sosa J.A.: Assessment and Management of Patients with Abnormal Calcium . Crit. Care Med. 2004; 32: pp. S146-S154.
9.Goldberg D.: Calcium, Ionized . November 2019 . Medscape , https://emedicine.medscape.com/article/2087469 .
10.Suneja M., Batuman V.: Hypocalcemia . August 2019 . Medscape , https://emedicine.medscape.com/article/241893 .
11.Beckerman J.: Heart Disease and Calcium Channel Blocker Drugs . 2020 . WebMD , https://www.webmd.com/heart-disease/guide/heart-disease-calcium-channel-blocker-drugs#1 .
12.Catterall W.A.: Regulation of Cardiac Calcium Channels in the Fight-or-Flight Response . Curr. Mol. Pharmacol. 2015; 8 (1): pp. 12-21.
13.Endo M.: Calcium Ion as a Second Messenger with Special Reference to Excitation-Contraction Coupling . J. Pharmacol. Sci. 2006; 100: pp. 519-524.
14.Agraharkar M.: Hypercalcemia . December 2020 . Medscape , pp. 1-14. https://emedicine.medscape.com/article/240681 .
15.Mundy G.R., Edwards J.R.: PTH-Related Peptide (PTHrP) in Hypercalcemia . J. Am. Soc. Nephrol. 2008; 19: pp. 672-675.
16.Toffaletti J., Nissenson R., Endres D., et al.: Influence of Continuous Infusion of Citrate on Responses of Immunoreactive PTH, Calcium and Magnesium Components, and Other Electrolytes in Normal Adults During Plateletapheresis . J. Clin. Endocrinol. Metab. 1985; 60: pp. 874-879.
17.Ahren B., Bergenfelz A.: Effects of Minor Increase in Serum Calcium on the Immunoheterogeneity of PTH in Healthy Subjects and in Patients with Primary Hyperparathyroidism . Horm. Res. 1995; 43: pp. 294-299.
18.Mundy G.R., Guise T.A.: Hormonal Control of Calcium Homeostasis . Clin. Chem. 1999; 45: pp. 1347-1352.
19.Felsenfeld A.J., Machado L., Rodriguez M.: The Relationship between Serum Calcitonin and Calcium in the Hemodialysis Patient . Am. J. Kidney Dis. 1993; 21: pp. 292-299.
20.Felsenfeld A.J., Levine B.S.: Calcitonin, the Forgotten Hormone: Does It Deserve to Be Forgotten? . Clin. Kidney J. 2015; 8: pp. 180-187.
21.Messa P., Mioni G., Turrin D., Guerra U.P.: The Calcitonin-Calcium Relation Curve and Calcitonin Secretory Parameters in Renal Patients with Variable Degrees of Renal Function . Nephrol. Dial. Transplant. 1995; 10: pp. 2259-2265.
22.Wang S., McDonnell B., Sedor F.S., Toffaletti J.G.: pH Effects on Measurements of Ionized Calcium and Ionized Magnesium in Blood . Clin. Chim. Acta 2002; 126: pp. 947-950.
23.Lewis J.L.: Hypocalcemia . April 2020 . Merck Manuals Professional Edition , https://www.merckmanuals.com/professional/endocrine-and-metabolic-disorders/electrolyte-disorders/hypocalcemia .
24.Carney S.L., Gillies A.H.G.: Effect of an Optimum Dialysis Fluid Calcium Concentration on Calcium Mass Transfer During Maintenance Hemodialysis . Clin. Nephrol. 1985; 24: pp. 28-30.
25.Anast C.S., Winnacker J.L., Forte L.F., Burns T.W.: Impaired Release of Parathyroid Hormone in Magnesium Deficiency . J. Clin. Endocrinol. Metab. 1976; 42: pp. 707-717.
26.Medalle R., Waterhouse C., Hahn T.J.: Vitamin D Resistance in Magnesium Deficiency . Am. J. Clin. Nutr. 1976; 29: pp. 854-858.
27.Eleraj D.M., Remaley A.T., Simonds W.F., Skarulis M.C., Libutti S.K., Bartlett D.L., et al.: Utility of Rapid Intraoperative Parathyroid Hormone Assay to Predict Severe Postoperative Hypocalcemia after Reoperation for Hyperparathyroidism . Surgery 2002; 132: pp. 1028-1034.
28.Sokoll L.J., Donovan P.I., Udelsman R.: The National Academy of Clinical Biochemistry Laboratory Medicine Practice Guidelines for Intraoperative Parathyroid Hormone . Point Care 2007; 6: pp. 253-260.
29.In Narins R.G. (eds): Maxwell and Kleeman’s Clinical Disorders of Fluid and Electrolyte Metabolism ., 5th ed. 1994. McGraw-Hill , New York pp. 1082.
30.Desai T.K., Carlson R.W., Thill-Baharozian M., Geheb M.A.: A Direct Relationship between Ionized Calcium and Arterial Pressure Among Patients in an Intensive Care Unit . Crit. Care Med. 1988; 16: pp. 578-582.
31.Vincent J.-L., Jankowski S.: Why Should Ionized Calcium Be Determined in Acutely Ill Patients? . Acta Anaesthesiol. Scand. 1995; 39 (Suppl. 107): pp. 281-286.
32.Zhang Z., Chen K., Ni H.: Calcium supplementation improves clinical outcome in intensive care unit patients: a propensity score matched analysis of a large clinical database MIMIC-II . SpringerPlus 2015; 4: pp. 594.
33.Dysart K.C.: Neonatal Hypocalcemia . December 2018 . Merck Manuals , https://www.merckmanuals.com/professional/pediatrics/metabolic-electrolyte-and-toxic-disorders-in-neonates/neonatal-hypocalcemia .
34.2021 . Stanford Children’s Health , https://www.stanfordchildrens.org/en/topic/default?id=hypocalcemia-90-P02376 .
35.Ladenson J.M., Lewis J.W., Boyd J.C.: Failure of Total Calcium Corrected for Protein, Albumin, and pH to Correctly Assess Free Calcium Status . J. Clin. Endocrinol. Metab. 1978; 46: pp. 986-993.
36.Dickerson R.N., Alexander K.H., Minard G., Croce M.A., Brown R.O.: Accuracy of Methods to Estimate Ionized and “Corrected” Serum Calcium Concentrations in Critically Ill Multiple Trauma Patients Receiving Specialized Nutrition Support . J. Parenter. Enteral Nutr. 2004; 28: pp. 133-141.
37.Jennichjen S., van der Voort P.H.J., Gerritsen R.T., Berk J.A.M., Bakker A.J.: Albumin-Adjusted Calcium is Not Suitable for Diagnosis of Hyper- and Hypocalcemia in the Critically Ill . Crit. Care Med. 2003; 31: pp. 1389-1393.
38.Ridefelt P., Helmersson-Karlqvist J.: Albumin Adjustment of Total Calcium Does Not Improve the Estimation of Calcium Status . Scand. J. Clin. Lab. Invest. 2017; 77: pp. 442-447.
39.Smith J.D., Wilson S., Schneider H.G.: Misclassification of Calcium Status Based on Albumin-Adjusted Calcium Studies in a Tertiary Hospital Setting . Clin. Chem. 2018; 64: pp. 1713-1722.
40.Toffaletti J.: Predicting Ionized Hypocalcemia with Total Calcium: Can “Correction” with Logistical Modeling of Multiple Analytes Do the Trick? . J. Appl. Lab. Med. January 2020; 5 (1): pp. 1-3.
41.Hamroun A., Pekara J.-D., Lionet A., Ghulam A., Maboudou P., Mercier A., Brousseau T., et al.: Ionized Calcium: Analytical Challenges and Clinical Relevance . J. Lab. Precis. Med. 2020; 5: pp. 22-37.
42.Lafferty F.W.: Differential Diagnosis of Hypercalcemia . J. Bone Miner. Res. 1991; 6 (Suppl. 2): pp. S51-S59.
43.Cafforio P., Savonarola A., Stucci S., De Matteo M., Tucci M., Brunetti A.E., et al.: PTHrP Produced by Myeloma Plasma Cells Regulates Their Survival and Pro-Osteoclast Activity for Bone Disease Progression . J. Bone Miner. Res. 2014; 29 (1): pp. 55-66.
44.Health H., Earll J.M., Schaaf M., Piechocki J.T., Li T.-K.: Serum Ionized Calcium During Bed Rest in Fracture Patients and Normal Man . Metabolism 1972; 21: pp. 633-640.
45.Ladenson J.H., Lewis J.W., McDonald J.M., Slatopolsky E., Boyd J.C.: Relationship of Free and Total Calcium in Hypercalcemic Conditions . J. Clin. Endocrinol. Metab. 1979; 48: pp. 393-397.
46.Ijaz A., Mehmood T., Qureshi A.H., Anwar M., Dilawar M., Hussain I., et al.: Estimation of Ionized Calcium, Total Calcium and Albumin Corrected Calcium for the Diagnosis of Hypercalcaemia of Malignancy . J. Coll. Phys. Surg. Pak. 2006; 16: pp. 49-52.
47.Triponez F., Kebebew E., Dosseh D., Duh Q.Y., Hazzan M., Noel C., et al.: Less-Than-Subtotal Parathyroidectomy Increases the Risk of Persistent/Recurrent Hyperparathyroidism after Parathyroidectomy in Tertiary Hyperparathyroidism after Renal Transplantation . Surgery 2006; 140: pp. 997-999.
48.Lewis J.L.: Hypercalcemia; Merck Manuals Professional Edition . April 2020 . https://www.merckmanuals.com/professional/endocrine-and-metabolic-disorders/electrolyte-disorders/hypercalcemia .
49.K. Miyashita, T. Yasuda, H. Kaneto, et al. A case of hypocalcemia with severe vitamin D deficiency following treatment for Graves’ Disease with methimazole. Case Reports in Endocrinology; volume 2013; article ID 512671: 1–4.
