SÁCH DỊCH: CÁC NGUYÊN LÝ Y HỌC HÔ HẤP, ẤN BẢN THỨ 8
Dịch và chú giải Tiếng Việt: Ts.Bs. Lê Nhật Huy, Ths.Bs. Lê Đình Sáng
CHƯƠNG 3. ĐÁNH GIÁ BỆNH NHÂN MẮC BỆNH LÝ PHỔI
Evaluation of the patient with pulmonary disease
Steven E. Weinberger MD, MACP, FRCP, Barbara A. Cockrill MD and Jess Mandel MD, MACP, FRCP
Principles of Pulmonary Medicine, 3, 28-58
MỤC LỤC CHƯƠNG
| Đánh giá ở Cấp độ Đại thể Khám thực thể X-quang ngực Chụp cắt lớp vi tính Chụp cộng hưởng từ Xạ hình phổi Radionuclide Chụp mạch phổi Siêu âm Nội soi phế quản Đánh giá ở Cấp độ Vi thể Đánh giá ở Cấp độ Chức năng |
Trong việc đánh giá một bệnh nhân mắc bệnh phổi, bác sĩ quan tâm đến ba cấp độ đánh giá: đại thể, vi thể và chức năng. Các phương pháp để đánh giá từng cấp độ này bao gồm từ những thăm dò đơn giản, sẵn có cho đến các kỹ thuật phức tạp và tinh vi đòi hỏi công nghệ hiện đại. Mỗi cấp độ sẽ được xem xét ở đây, với sự nhấn mạnh vào các nguyên tắc cơ bản và tính hữu dụng của các thăm dò. Các chương sau sẽ liên tục đề cập đến những phương pháp này vì chúng tạo thành nền tảng trong cách tiếp cận bệnh nhân của bác sĩ.
ĐÁNH GIÁ Ở CẤP ĐỘ ĐẠI THỂ
Khám thực thể
Phương pháp dễ tiếp cận và hiệu quả nhất để đánh giá bệnh nhân mắc bệnh hô hấp là khám thực thể, chỉ đòi hỏi một ống nghe; mắt, tai và tay của người khám; cùng với kỹ năng của người khám trong việc phát hiện và nhận biết các dấu hiệu bất thường. Vì mục đích của cuộc thảo luận này không phải là trình bày chi tiết về khám lồng ngực mà là xem xét một vài nguyên tắc cơ bản, nên trọng tâm chính sẽ là các khía cạnh chọn lọc của việc thăm khám và những gì đã biết về cơ chế gây ra các bất thường.
Ngoài việc quan sát tổng trạng bệnh nhân, đo chính xác tần số thở, và diễn giải kiểu thở cũng như mức độ khó thở của bệnh nhân, người khám chủ yếu dựa vào sờ và gõ lồng ngực, và nghe phổi bằng ống nghe.
Sờ rất hữu ích để so sánh sự giãn nở của hai bên lồng ngực. Người khám có thể xác định liệu hai phổi có giãn nở đối xứng hay không, hoặc liệu có một quá trình bệnh lý nào đó đang ảnh hưởng đến sự giãn nở ở một bên nhiều hơn bên còn lại. Sờ thành ngực cũng hữu ích để cảm nhận các rung động được tạo ra bởi âm thanh khi nói. Khi người khám đặt tay lên một vùng phổi và yêu cầu bệnh nhân nói (ví dụ, “nói từ một, hai, ba”), rung động thường sẽ được cảm nhận khi âm thanh được truyền đến thành ngực. Rung động này được gọi là rung thanh. Một số quá trình bệnh lý làm tăng sự truyền âm và tăng cường độ của rung động. Các tình trạng khác làm giảm sự truyền âm và giảm cường độ của rung động hoặc loại bỏ nó hoàn toàn. Việc làm rõ khái niệm truyền âm này và mối liên hệ của nó với các tình trạng cụ thể sẽ được trình bày trong phần thảo luận về nghe phổi.
Khi gõ lồng ngực, người khám ghi nhận chất lượng âm thanh được tạo ra bằng cách gõ một ngón tay của bàn tay này vào một ngón tay của bàn tay đối diện đang áp sát vào thành ngực bệnh nhân. Nguyên tắc này tương tự như việc gõ vào một bề mặt và phán đoán xem bên dưới là đặc hay rỗng. Thông thường, gõ lên thành ngực trên vùng phổi chứa khí sẽ cho âm trong, trong khi gõ trên một cơ quan đặc như gan sẽ tạo ra âm đục. Sự tương phản này cho phép người khám phát hiện các vùng có thứ gì đó khác ngoài phổi chứa khí bên dưới thành ngực, chẳng hạn như dịch trong khoang màng phổi (tràn dịch màng phổi) hoặc phổi không có khí (đông đặc), cả hai đều cho âm đục khi gõ. Ở thái cực khác, không khí trong khoang màng phổi (tràn khí màng phổi) hoặc phổi căng phồng (như trong khí phế thũng) có thể tạo ra âm vang hơn hoặc “rỗng” hơn, gần giống với những gì người khám nghe được khi gõ trên một tạng rỗng như dạ dày chứa một phần khí. Ngoài ra, người khám có thể xác định vị trí gần đúng của cơ hoành bằng sự thay đổi chất lượng của tiếng gõ, từ trong sang đục, ở đáy phổi. Một khía cạnh thuận lợi của việc khám toàn bộ lồng ngực là tính đối xứng phần lớn của hai bên lồng ngực; sự khác biệt trong các dấu hiệu giữa hai bên cho thấy một bất thường cục bộ.
Khi nghe phổi bằng ống nghe, người khám lắng nghe hai đặc điểm chính: chất lượng của tiếng thở và sự hiện diện của bất kỳ âm thanh bất thường nào (thường được gọi là âm bệnh lý). Khi bệnh nhân hít một hơi thật sâu, âm thanh của luồng không khí có thể được nghe thấy qua ống nghe. Khi ống nghe được đặt trên mô phổi bình thường, âm thanh chủ yếu được nghe thấy trong thì hít vào, và chất lượng âm thanh tương đối êm và nhẹ. Những tiếng thở nghe được trên mô phổi bình thường này được gọi là tiếng thở bình thường hoặc rì rào phế nang. Laennec, người phát minh ra ống nghe, cho rằng tiếng thở bình thường được tạo ra do sự di chuyển của không khí vào và ra khỏi các phế nang (“vesicles”), và do đó cụm từ rì rào phế nang thường được sử dụng để mô tả những âm thanh này. Tuy nhiên, hiểu biết hiện tại của chúng ta là những âm thanh này có nhiều khả năng được tạo ra ở các đường dẫn khí thùy hoặc phân thùy hơn là ở cấp độ phế nang, vì vậy đã có một xu hướng thay thế cụm từ rì rào phế nang bằng tiếng thở bình thường.
|
Mục tiêu của nghe phổi:
|
Khi người khám nghe trên vùng phổi đông đặc – tức là phổi không có khí và chứa đầy dịch hoặc các tế bào viêm – các dấu hiệu sẽ khác. Âm thanh thường to và thô ráp hơn, có chất lượng giống tiếng thổi ống hơn, và đặc điểm đặc trưng nhất là thì thở ra ít nhất cũng to và dài bằng thì hít vào. Những tiếng thở như vậy được gọi là tiếng thở phế quản, trái ngược với tiếng thở bình thường hoặc rì rào phế nang. Sự khác biệt về chất lượng âm thanh này là do khả năng truyền âm của phổi đông đặc tốt hơn so với phổi thông khí bình thường. Kết quả là, âm thanh được tạo ra bởi luồng không khí rối ở các đường dẫn khí trung tâm (khí quản và phế quản chính) được truyền đến ngoại vi của phổi và có thể được nghe thấy qua ống nghe. Thông thường, những âm thanh này không được nghe thấy ở ngoại vi phổi; tuy nhiên, chúng có thể được minh họa khá rõ ràng bằng cách lắng nghe gần vị trí xuất phát của chúng—ví dụ, trên phần trên của xương ức hoặc hõm ức. Những tiếng thở khí quản bình thường này gần giống với chất lượng của tiếng thở phế quản bất thường nghe được trên vùng phổi đông đặc. Cuối cùng, khi ống nghe được đặt trên các đường dẫn khí lớn không hoàn toàn ở trung tâm như khí quản, hoặc trên một vùng phổi đông đặc một phần, tiếng thở có chất lượng trung gian giữa tiếng thở phế quản và tiếng thở bình thường (rì rào phế nang) và do đó thường được gọi là tiếng thở phế quản-phế nang.
Phổi đông đặc không truyền âm thanh theo cách giống như phổi chứa khí.
Sự truyền âm tốt hơn qua phổi đông đặc so với phổi bình thường cũng có thể được chứng minh khi bệnh nhân thì thầm hoặc nói. Sự tăng cường truyền âm của tiếng thì thầm dẫn đến các âm tiết được nghe rõ ràng hơn và được gọi là tiếng ngực thầm. Các từ được nói có thể được nghe rõ hơn qua ống nghe đặt trên vùng bị tổn thương, một hiện tượng thường được gọi là tiếng vang phế quản. Do sự khác biệt trong việc lọc âm thanh giữa phổi bình thường và phổi đông đặc, khi bệnh nhân nói nguyên âm “I”, âm thanh kết quả qua phổi đông đặc có chất lượng giống âm “A” giọng mũi. “Sự thay đổi từ I sang A” này được gọi là tiếng dê kêu. Tất cả những dấu hiệu này là các biến thể của cùng một chủ đề—sự tăng cường truyền âm qua phổi đông đặc—và về cơ bản có cùng một ý nghĩa.
Hai điều kiện quan trọng trong việc diễn giải chất lượng của tiếng thở. Thứ nhất, sự truyền âm bình thường phụ thuộc vào sự thông suốt của đường dẫn khí. Nếu một phế quản tương đối lớn bị tắc, chẳng hạn như do khối u, chất tiết, hoặc dị vật, luồng không khí vào vùng phổi đó sẽ giảm hoặc không có, và người khám sẽ nghe thấy tiếng thở giảm hoặc mất ở vùng bị ảnh hưởng. Một đường dẫn khí bị tắc ở phía gần (proximal) so với vùng phổi đông đặc hoặc không có khí cũng sẽ loại bỏ sự tăng cường truyền âm đã được mô tả trước đó. Thứ hai, không khí hoặc dịch trong khoang màng phổi hoạt động như một rào cản đối với sự truyền âm, vì vậy tràn khí màng phổi hoặc tràn dịch màng phổi gây ra sự giảm tiếng thở.
Đặc điểm chính thứ hai mà người khám lắng nghe là các âm bệnh lý. Mặc dù có một số khác biệt trong cách mô tả các âm bệnh lý khác nhau, các thuật ngữ được sử dụng phổ biến nhất là ran nổ, ran rít/ran ngáy, và tiếng cọ màng phổi. Bởi vì một số thuật ngữ bổ sung—tiếng rít thanh quản, ran ngáy, và squawks—đôi khi cũng được sử dụng, chúng tôi cũng đã mô tả chúng.
Ran nổ (crackles), còn được gọi là rales, là một chuỗi các tiếng lách tách hoặc bốp bốp riêng lẻ được nghe bằng ống nghe trên một vùng phổi bị tổn thương. Chất lượng của chúng có thể từ âm thanh được tạo ra khi xoa các sợi tóc vào nhau đến âm thanh được tạo ra khi mở khóa dán (Velcro) hoặc vò một mảnh giấy bóng kính. Những âm thanh này là âm thanh “mở ra” của các đường dẫn khí nhỏ hoặc phế nang đã bị xẹp hoặc giảm thể tích trong thì thở ra do dịch, dịch tiết viêm, hoặc thông khí kém. Trong mỗi lần hít vào tiếp theo, việc mở các đơn vị phổi ở xa này tạo ra một chuỗi các tiếng lách tách hoặc bốp bốp được nghe thấy trong suốt hoặc ở phần sau của thì hít vào. Các rối loạn phổ biến nhất gây ra ran nổ là phù phổi, viêm phổi, một số nguyên nhân gây bệnh phổi mô kẽ lan tỏa (đặc biệt là xơ phổi tự phát), và xẹp phổi. Mặc dù một số bác sĩ lâm sàng tin rằng chất lượng của ran nổ (“ran ẩm” hay “ran thô”) giúp phân biệt các rối loạn khác nhau, những người khác cho rằng sự phân biệt về chất lượng như vậy có ít giá trị lâm sàng.
Ran nổ (crackles hay rales), nghe được trong thì hít vào, là âm thanh “mở ra” của các đường dẫn khí nhỏ và phế nang.
Ran rít (wheezes) là những âm thanh liên tục, có âm sắc cao được tạo ra bởi luồng không khí đi qua các đường dẫn khí bị thu hẹp. Nguyên nhân của sự thu hẹp như vậy bao gồm co thắt cơ trơn đường dẫn khí, phù nề, chất tiết, tắc nghẽn trong lòng ống, và xẹp do thành tiểu phế quản không được nâng đỡ tốt. Những đặc điểm sinh lý bệnh riêng lẻ này được thảo luận trong các Chương 4 đến 7. Vì những lý do cũng sẽ được mô tả sau, đường kính của các đường dẫn khí trong lồng ngực nhỏ hơn trong thì thở ra so với thì hít vào, và ran rít thường rõ rệt hơn hoặc chỉ nghe được trong thì thở ra. Tuy nhiên, vì cần có đủ luồng không khí để tạo ra tiếng ran rít, nên ran rít có thể không còn nghe được nếu đường dẫn khí bị hẹp nghiêm trọng. Trong các tình trạng như hen suyễn và bệnh phổi tắc nghẽn mạn tính, ran rít bắt nguồn từ nhiều đường dẫn khí bị hẹp và thường là đa âm sắc, nghĩa là chúng là sự kết hợp của các âm điệu khác nhau bắt đầu và kết thúc vào những thời điểm khác nhau trong chu kỳ thở ra. Ngược lại, tiếng ran rít có xu hướng đơn âm sắc khi chúng là kết quả của sự hẹp cục bộ của khí quản hoặc các phế quản lớn. Khi vị trí hẹp là đường dẫn khí ngoài lồng ngực (ví dụ, ở thanh quản hoặc phần ngoài lồng ngực của khí quản), thuật ngữ tiếng rít thanh quản (stridor) được sử dụng để mô tả âm thanh giống ran rít ở thì hít vào do sự hẹp đó gây ra. Các yếu tố sinh lý liên quan đến vị trí hẹp và giai đoạn của chu kỳ hô hấp bị ảnh hưởng nhiều nhất được mô tả sau trong chương này và được trình bày trong Hình 3.20 và 3.21.
Ran rít phản ánh luồng không khí đi qua các đường dẫn khí bị hẹp.
Các bác sĩ lâm sàng thường sử dụng thuật ngữ ran ngáy (rhonchi) khi đề cập đến một loạt các tiếng ồn và âm thanh có nhạc tính không thể dễ dàng phân loại vào các nhóm được chấp nhận rộng rãi hơn là ran nổ và ran rít, nhưng thường dường như có nguyên nhân cơ bản chung là do chất tiết trong đường thở. Thuật ngữ này đôi khi mô tả một âm thanh giống như tiếng ngáy, nhưng đôi khi cũng đề cập đến những âm thanh có thể được mô tả là ran rít thô, âm sắc thấp. Bởi vì chất tiết có thể di chuyển khi ho, ran ngáy thường sẽ thay đổi hoặc biến mất sau một cơn ho.
Thuật ngữ squawk được sử dụng để mô tả một âm thanh ngắn, ở thì hít vào, giống như tiếng ran rít, thường được cho là phản ánh bệnh ở các đường dẫn khí nhỏ hoặc ngoại vi. Nó được nghe thấy phổ biến nhất ở những bệnh nhân bị viêm phổi quá mẫn hoặc viêm phổi.
Tiếng cọ màng phổi (friction rub) là thuật ngữ chỉ những âm thanh được tạo ra bởi các bề mặt màng phổi bị viêm hoặc xù xì cọ xát vào nhau trong quá trình hô hấp. Nó mô tả một chuỗi các âm thanh lạo xạo hoặc rin rít được nghe thấy trong cả thì hít vào và thở ra. Các nguyên nhân phổ biến nhất là các bệnh viêm nguyên phát của màng phổi hoặc các quá trình ở nhu mô lan ra bề mặt màng phổi, chẳng hạn như viêm phổi và nhồi máu phổi.
Bảng 3.1 tóm tắt một số dấu hiệu phổi thường thấy trong các rối loạn chọn lọc ảnh hưởng đến hệ hô hấp. Nhiều trong số này sẽ được đề cập lại trong các chương tiếp theo khi các rối loạn cụ thể được thảo luận chi tiết hơn.
Mặc dù trọng tâm ở đây là khám lồng ngực như một chỉ số của bệnh phổi, các biểu hiện không thuộc lồng ngực khác của bệnh phổi nguyên phát có thể được phát hiện khi khám thực thể. Ngón tay dùi trống (có hoặc không có bệnh xương khớp phì đại) và tím tái sẽ được thảo luận ngắn gọn ở đây.
Ngón tay dùi trống là sự thay đổi hình dạng bình thường của móng tay và đốt ngón tay hoặc ngón chân xa (Hình 3.1). Một số đặc điểm có thể được nhìn thấy: (1) mất góc bình thường giữa móng và da, (2) tăng độ cong của móng, (3) tăng độ xốp của mô bên dưới phần gần của móng, và (4) bè ra hoặc rộng ra của đốt ngón xa. Mặc dù một số rối loạn không thuộc phổi có thể dẫn đến ngón tay dùi trống (ví dụ, bệnh tim bẩm sinh có shunt phải-trái, viêm nội tâm mạc, bệnh gan mạn tính, bệnh viêm ruột), nguyên nhân phổ biến nhất rõ ràng là do phổi. Đôi khi, ngón tay dùi trống có tính chất gia đình và không có ý nghĩa lâm sàng. Ung thư biểu mô phổi (hoặc u trung biểu mô màng phổi) là yếu tố nguyên nhân hàng đầu. Các nguyên nhân khác từ phổi bao gồm nhiễm trùng mưng mủ mạn tính trong lồng ngực (ví dụ, giãn phế quản, áp xe phổi, mủ màng phổi) và một số loại bệnh phổi mô kẽ lan tỏa. Bệnh phổi tắc nghẽn mạn tính không biến chứng không liên quan đến ngón tay dùi trống, vì vậy sự hiện diện của ngón tay dùi trống trong bối cảnh này nên gợi ý đến bệnh ác tính hoặc bệnh mưng mủ cùng tồn tại.
|
Các bệnh hệ hô hấp liên quan đến ngón tay dùi trống:
|
Ngón tay dùi trống có thể đi kèm với bệnh xương khớp phì đại, đặc trưng bởi sự hình thành xương mới ở màng xương, đặc biệt ở các xương dài, và đau khớp và viêm ở một số khớp. Khi có bệnh xương khớp phì đại cùng tồn tại, khối u ở phổi hoặc màng phổi có khả năng là nguyên nhân gây ra ngón tay dùi trống, vì bệnh xương khớp phì đại tương đối hiếm gặp với các nguyên nhân khác của ngón tay dùi trống.
Cơ chế của ngón tay dùi trống và bệnh xương khớp phì đại vẫn chưa rõ ràng. Người ta đã quan sát thấy rằng ngón tay dùi trống có liên quan đến sự gia tăng lưu lượng máu ở ngón tay, trong khi bệnh xương khớp được đặc trưng bởi sự phát triển quá mức của mô liên kết giàu mạch máu. Tại sao những thay đổi này xảy ra vẫn là một bí ẩn. Một giả thuyết thú vị cho rằng các kích thích đi qua dây thần kinh phế vị có vai trò quan trọng, vì phẫu thuật cắt dây phế vị thường làm giảm bớt một số thay đổi ở xương và móng. Một giả thuyết khác đề xuất rằng các mẫu tiểu cầu và các cụm tiểu cầu, đi qua giường mạch máu phổi và mắc kẹt trong tuần hoàn hệ thống ngoại vi, giải phóng các yếu tố tăng trưởng gây ra các thay đổi mô mềm của ngón tay dùi trống.
Tím tái, dấu hiệu thực thể ngoài phổi thứ hai phát sinh từ bệnh phổi, là sự đổi màu xanh của da (đặc biệt là dưới móng tay) và niêm mạc. Trong khi hemoglobin được oxy hóa mang lại màu hồng thông thường cho niêm mạc và giường móng, một lượng đủ hemoglobin khử oxy sẽ tạo ra màu tím. Tím tái có thể là toàn thân, do thấp hoặc lưu lượng máu hệ thống thấp dẫn đến tăng chiết xuất oxy từ máu, hoặc cục bộ, do lưu lượng máu thấp và tăng chiết xuất trong khu vực cục bộ. Trong bệnh phổi, yếu tố phổ biến gây ra tím tái là thấp, và một số loại bệnh phổi khác nhau có thể là nguyên nhân.
Tổng lượng hemoglobin ảnh hưởng đến khả năng phát hiện tím tái. Ở bệnh nhân thiếu máu, nếu tổng lượng hemoglobin khử oxy ít hơn lượng cần thiết để tạo ra màu xanh, ngay cả khi rất thấp cũng có thể không đi kèm với tím tái. Ngược lại, ở bệnh nhân đa hồng cầu, chỉ cần một sự giảm ít hơn nhiều là đủ để có đủ hemoglobin khử oxy tạo ra màu tím. Ở những bệnh nhân có da sẫm màu hơn, tím tái có thể chỉ rõ ràng ở niêm mạc hoặc giường móng, trong khi sự đổi màu xanh lan rộng hơn của da có thể rõ ràng ở những người có da sáng màu hơn.
BẢNG 3.1 Dấu hiệu Khám Lồng ngực Điển hình trong một số Tình trạng Lâm sàng Chọn lọc
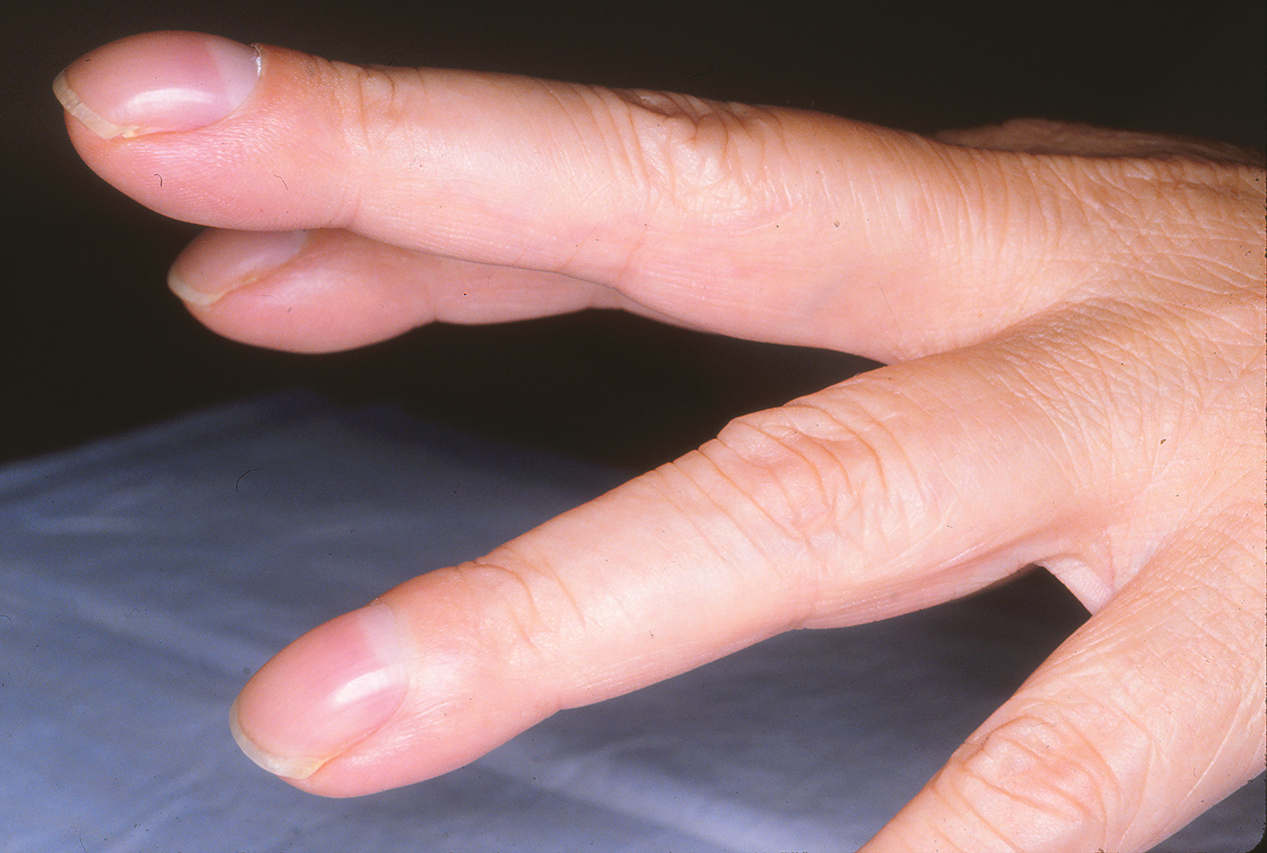
Hình 3.1 Ngón tay dùi trống. Có thể thấy độ cong của móng và mất góc giữa móng và da liền kề.
X-quang ngực
X-quang ngực được sử dụng để đánh giá bệnh nhân nghi ngờ mắc bệnh hô hấp và đôi khi cũng được dùng trong đánh giá định kỳ cho bệnh nhân không có triệu chứng. Trong tất cả các tạng, phổi là cơ quan phù hợp nhất để kiểm tra bằng X-quang. Lý do rất đơn giản: không khí trong phổi cung cấp một nền tuyệt vời để các bất thường có thể nổi bật lên. Ngoài ra, sự hiện diện của hai lá phổi cho phép mỗi lá phổi đóng vai trò là một đối chứng cho lá phổi kia, do đó các bất thường một bên có thể được nhận ra dễ dàng hơn.
Một mô tả chi tiết về việc diễn giải phim X-quang ngực nằm ngoài phạm vi của văn bản này. Tuy nhiên, một vài nguyên tắc có thể giúp người đọc xem các phim được trình bày trong chương này và các chương tiếp theo. Đầu tiên, sự xuất hiện của bất kỳ cấu trúc nào trên phim X-quang phụ thuộc vào mật độ của cấu trúc đó; cấu trúc càng đậm đặc, nó càng có màu trắng trên phim. Ở một cực là không khí, có tính thấu xạ và có màu đen trên phim. Ở cực kia là các mật độ kim loại, có màu trắng. Ở giữa là một phổ mật độ tăng dần từ mỡ đến nước đến xương. Trên phim X-quang ngực, các tạng và cơ bắp nằm trong phạm vi các mô có mật độ nước và không thể phân biệt được về mật độ X-quang với nước hoặc máu.
Thứ hai, để một đường hoặc một giao diện xuất hiện giữa hai cấu trúc liền kề trên phim X-quang, hai cấu trúc đó phải khác nhau về mật độ. Ví dụ, trong bóng tim, cơ tim không thể phân biệt được với máu chảy trong các buồng tim vì cả hai đều có mật độ nước. Ngược lại, các bờ của tim có thể nhìn thấy được trên nền phổi vì mật độ nước của tim tương phản với mật độ của phổi, vốn gần với mật độ của không khí. Tuy nhiên, nếu phổi liền kề với một cấu trúc bình thường đậm đặc hơn (ví dụ, tim hoặc cơ hoành) bị mất khí, do xẹp hoặc đông đặc, các cấu trúc lân cận bây giờ đều có cùng mật độ, và không có giao diện hoặc ranh giới nào có thể nhìn thấy để tách chúng ra. Nguyên tắc này là cơ sở của dấu hiệu bóng mờ (silhouette sign) hữu ích. Nếu một bờ mong đợi với một vùng phổi không được hình dung hoặc không rõ nét, thì phổi liền kề đó là bất thường và không được thông khí đầy đủ.
Phim X-quang ngực thường được chụp ở hai tư thế tiêu chuẩn—sau-trước (PA) và nghiêng (Hình 3.2). Đối với phim PA, chùm tia X đi từ sau ra trước của bệnh nhân, và ngực trước của bệnh nhân liền kề với bộ phận nhận ảnh (có thể là phim hoặc thiết bị kỹ thuật số). Phim nghiêng thường được chụp với bên trái của bệnh nhân áp vào bộ phận nhận ảnh, và chùm tia được hướng qua bệnh nhân đến bộ phận nhận ảnh. Nếu không thể chụp ảnh khi bệnh nhân đứng và ngực áp vào bộ phận nhận ảnh, như trong trường hợp bệnh nhân nằm liệt giường, thì phim trước-sau (AP) sẽ được chụp. Đối với phim này, thường được chụp bằng máy X-quang di động tại phòng bệnh của bệnh nhân, bộ phận nhận ảnh được đặt sau bệnh nhân (thường là giữa lưng bệnh nhân và giường), và chùm tia được hướng qua bệnh nhân từ trước ra sau. Phim nghiêng nằm (lateral decubitus), bên phải hoặc bên trái, được chụp khi bệnh nhân ở tư thế nằm nghiêng, với chùm tia được hướng theo chiều ngang. Phim nghiêng nằm đặc biệt hữu ích để phát hiện dịch chảy tự do trong khoang màng phổi và do đó thường được sử dụng khi nghi ngờ có tràn dịch màng phổi.
Kiến thức về giải phẫu X-quang là nền tảng để diễn giải tình trạng đông đặc hoặc xẹp phổi (atelectasis) và để xác định vị trí của các bất thường khác trên phim X-quang ngực. Giải phẫu thùy và vị trí của các rãnh liên thùy ngăn cách các thùy được thể hiện trong Hình 3.3. Việc xác định vị trí của một bất thường thường đòi hỏi thông tin từ cả phim PA và phim nghiêng, cả hai đều nên được chụp và diễn giải khi một bất thường đang được đánh giá. Như có thể thấy trong Hình 3.3, rãnh liên thùy lớn ngăn cách các thùy trên (và giữa) với thùy dưới chạy chéo qua lồng ngực. Do đó, rất dễ bị nhầm lẫn về vị trí chỉ dựa trên phim PA; một tổn thương ở thùy dưới có thể xuất hiện ở phần trên của lồng ngực, trong khi một tổn thương ở thùy trên có thể xuất hiện ở vị trí thấp hơn nhiều.
Cả phim X-quang sau-trước và nghiêng thường cần thiết để xác định vị trí của một bất thường.
Khi một thùy phổi bị lấp đầy bởi dịch hoặc dịch tiết viêm, như trong bệnh viêm phổi, nó chứa mật độ nước thay vì không khí và do đó dễ dàng được phác họa trên phim X-quang ngực. Với tình trạng đông đặc thuần túy, thùy phổi không bị mất thể tích, vì vậy nó chiếm vị trí thông thường và giữ nguyên kích thước. Một ví dụ về đông đặc thùy trên phim X-quang PA và nghiêng được thể hiện trong Hình 3.4. Ngược lại, khi một thùy có các phế nang không chứa khí và bị xẹp, nó không chỉ trở nên đậm đặc hơn mà còn có các đặc điểm mất thể tích đặc trưng cho từng thùy riêng biệt. Các đặc điểm mất thể tích như vậy bao gồm sự thay đổi vị trí của rãnh liên thùy hoặc các dấu hiệu gián tiếp về sự dịch chuyển của rốn phổi, cơ hoành, khí quản, hoặc trung thất về phía có sự mất thể tích (Hình 3.5). Một cơ chế phổ biến của xẹp phổi là tắc nghẽn đường dẫn khí đến vùng phổi bị xẹp, gây ra, ví dụ, bởi một khối u, dị vật hít phải, hoặc nút nhầy. Tất cả các ví dụ đã đề cập đều phản ánh tình trạng đông đặc thuần túy hoặc xẹp phổi thuần túy. Tuy nhiên, trong thực tế, một sự kết hợp của các quá trình này thường xảy ra, dẫn đến tình trạng đông đặc đi kèm với mất thể tích một phần.
Khi phim X-quang ngực cho thấy một dạng tổn thương lan tỏa hoặc rộng khắp với mật độ tăng trong nhu mô phổi, thường hữu ích khi mô tả thêm quá trình này, tùy thuộc vào dạng tổn thương X-quang. Hai dạng chính là mô kẽ và phế nang. Mặc dù việc đặt tên cho các dạng này gợi ý một mối tương quan với loại tổn thương bệnh lý (tức là, mô kẽ, ảnh hưởng đến thành phế nang và mô kẽ; phế nang, liên quan đến việc lấp đầy các khoang phế nang), các mối tương quan X-quang-bệnh lý như vậy thường thiếu. Tuy nhiên, nhiều bệnh phổi lan tỏa được đặc trưng bởi một trong những dạng X-quang này, và dạng cụ thể có thể cung cấp manh mối về loại hoặc nguyên nhân cơ bản của bệnh.
Sự tăng mật độ lan tỏa trên phim X-quang thường có thể được phân loại là dạng phế nang hoặc mô kẽ.
Một dạng tổn thương mô kẽ thường được mô tả là dạng lưới hoặc lưới-nốt, bao gồm một mạng lưới đan xen của các đường mờ và các nốt nhỏ. Ngược lại, một dạng tổn thương phế nang có vẻ bông hơn, và các đường viền của các phế quản chứa khí chạy qua các vùng đậm đặc phế nang thường được nhìn thấy. Dấu hiệu sau này được gọi là dấu hiệu phế quản hơi (air bronchogram) và là do không khí trong các phế quản được bao quanh và phác họa bởi các phế nang chứa đầy dịch. Dấu hiệu này không xảy ra với một dạng tổn thương mô kẽ thuần túy. Ví dụ về các phim X-quang ngực cho thấy bất thường lan tỏa do bệnh mô kẽ và lấp đầy phế nang được thể hiện trong Hình 3.6 và 3.7, tương ứng.
Hai thuật ngữ bổ sung mô tả các dạng tăng mật độ thường được sử dụng. Một dạng nốt đề cập đến sự hiện diện của nhiều nốt rời rạc, thường có hình cầu. Một dạng đồng nhất của các nốt tương đối nhỏ có đường kính vài milimet hoặc nhỏ hơn thường được gọi là dạng kê, như có thể thấy khi bệnh lao lan truyền theo đường máu khắp phổi. Ngoài ra, các nốt có thể lớn hơn (ví dụ, >1 cm đường kính), như thấy trong di căn ung thư biểu mô theo đường máu đến phổi (Hình 3.8). Một thuật ngữ phổ biến khác là kính mờ (ground-glass), được sử dụng để mô tả một vẻ ngoài mờ, trong mờ của vùng tăng mật độ. Không giống như vẻ ngoài mờ đục hơn của mô phổi đông đặc, vốn che khuất các vân phổi (chủ yếu là mạch máu), dạng kính mờ không che khuất các vân phổi bên dưới. Mặc dù thuật ngữ này có thể được sử dụng để mô tả một vùng hoặc một dạng tăng mật độ mờ trên phim X-quang ngực phẳng, nó thường được sử dụng hơn khi mô tả các bất thường được thấy trên chụp cắt lớp vi tính (CT) lồng ngực (Hình 3.9).
Việc tập trung vào một số bất thường điển hình trước đây cung cấp một sự giới thiệu về nhận dạng hình ảnh trên phim X-quang ngực. Tuy nhiên, người khám cẩn thận cũng phải sử dụng một cách tiếp cận có hệ thống trong việc phân tích hình ảnh. Một phim X-quang ngực không chỉ cho thấy phổi; kiểm tra X-quang cũng có thể tiết lộ những thay đổi trong xương, mô mềm, tim, các cấu trúc trung thất khác, và khoang màng phổi.
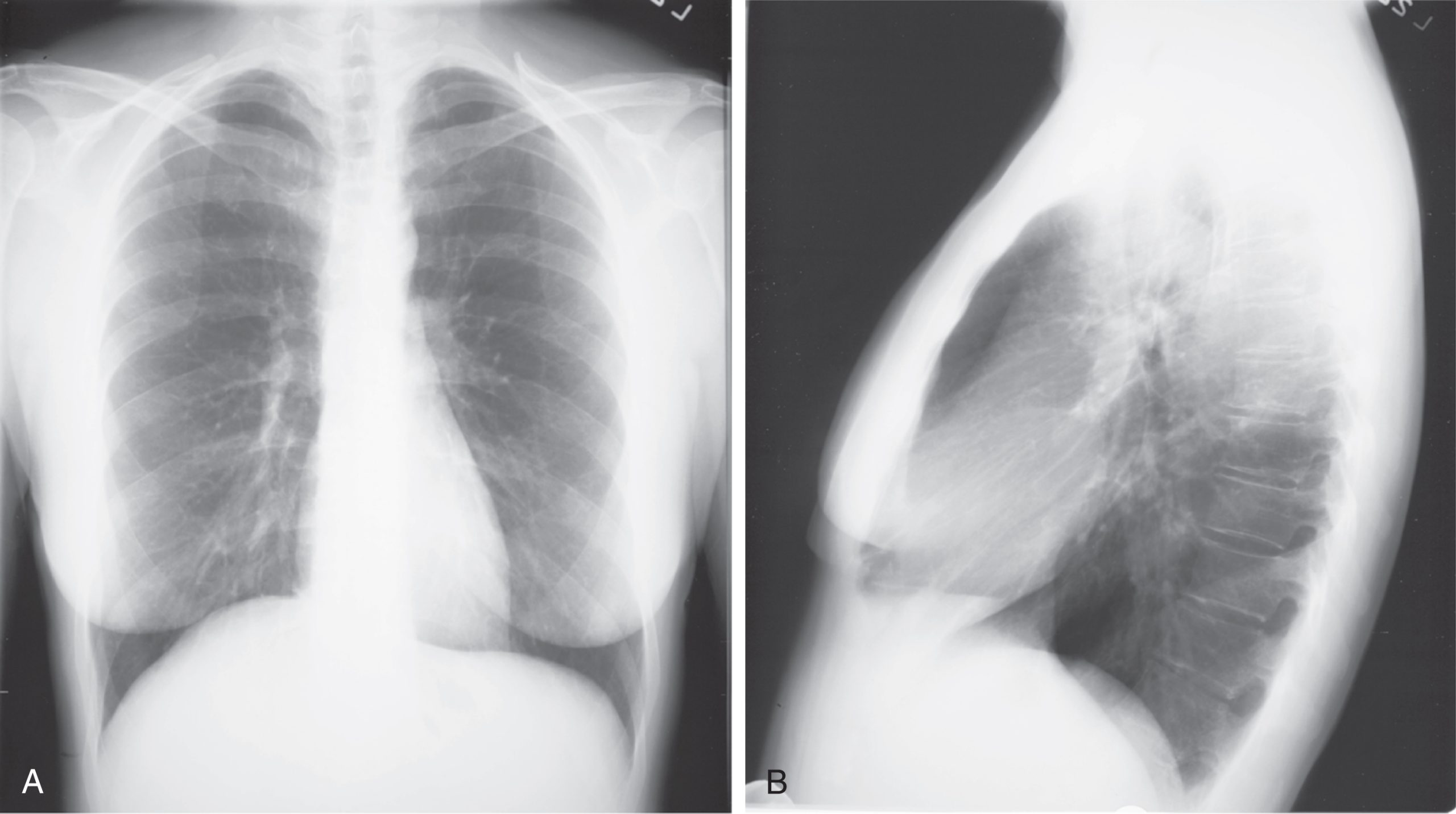
Hình 3.2 Phim X-quang ngực bình thường. A, Tư thế sau-trước. B, Tư thế nghiêng. So sánh với Hình 3.3 để biết vị trí của mỗi thùy.
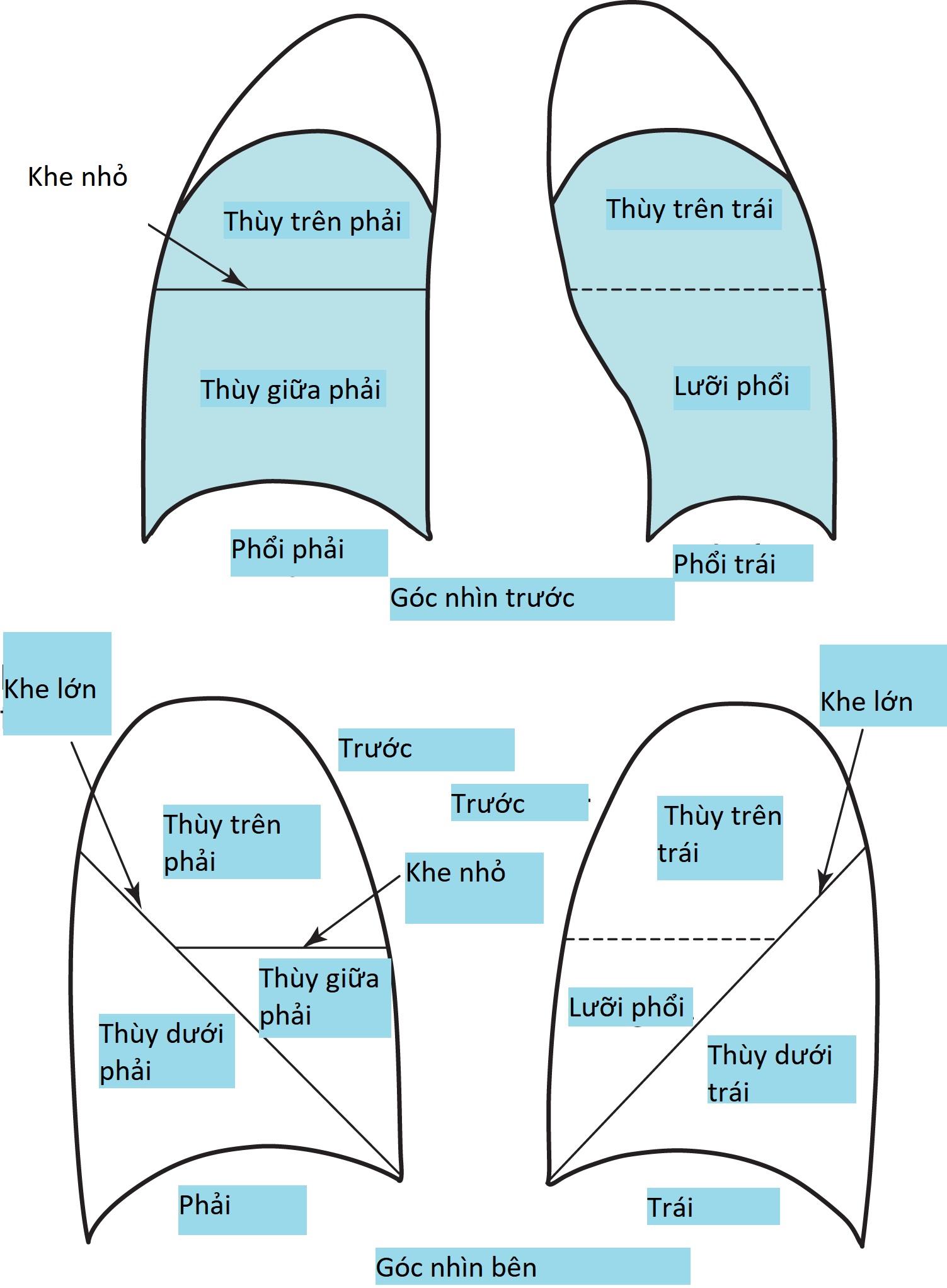
Hình 3.3 Giải phẫu thùy nhìn từ tư thế trước và nghiêng. Trong tư thế nhìn trước, các vùng tô bóng đại diện cho các thùy dưới và nằm sau các thùy trên và giữa. Thùy lưỡi là một phần của thùy trên trái; đường đứt nét giữa hai thùy không đại diện cho một rãnh liên thùy. LLL, thùy dưới trái; LUL, thùy trên trái; RLL, thùy dưới phải; RML, thùy giữa phải; RUL, thùy trên phải.
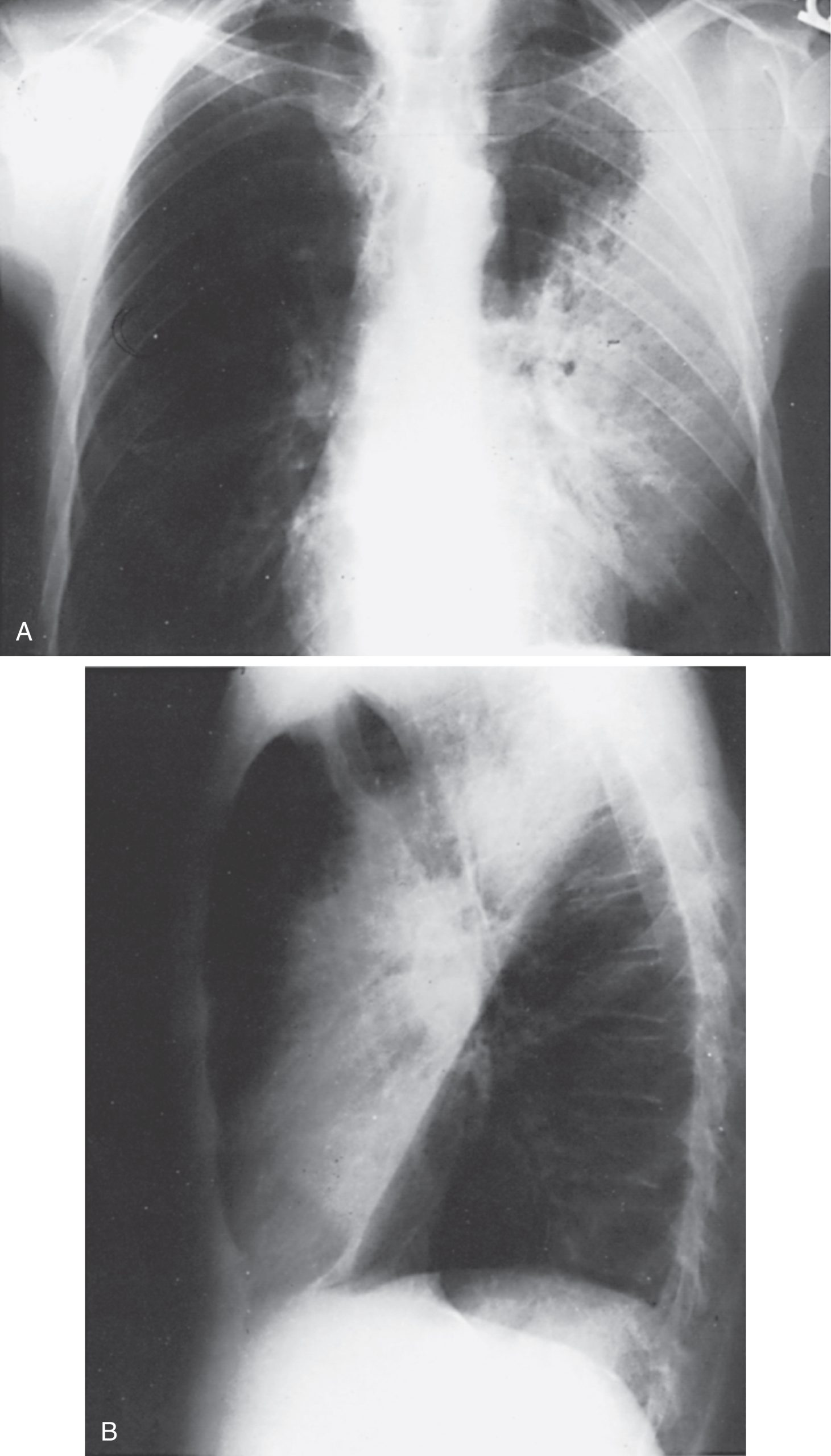
Hình 3.4 Phim X-quang ngực sau-trước (A) và nghiêng (B) của một bệnh nhân bị đông đặc thùy trên trái do viêm phổi. Ranh giới giải phẫu được đánh giá tốt nhất trên phim nghiêng, nơi dễ dàng thấy rằng rãnh liên thùy lớn ở vị trí bình thường xác định bờ dưới của vùng đông đặc (so sánh với Hình 3.5). Một phần của thùy trên trái không bị tổn thương. (Ảnh của Tiến sĩ T. Scott Johnson.)
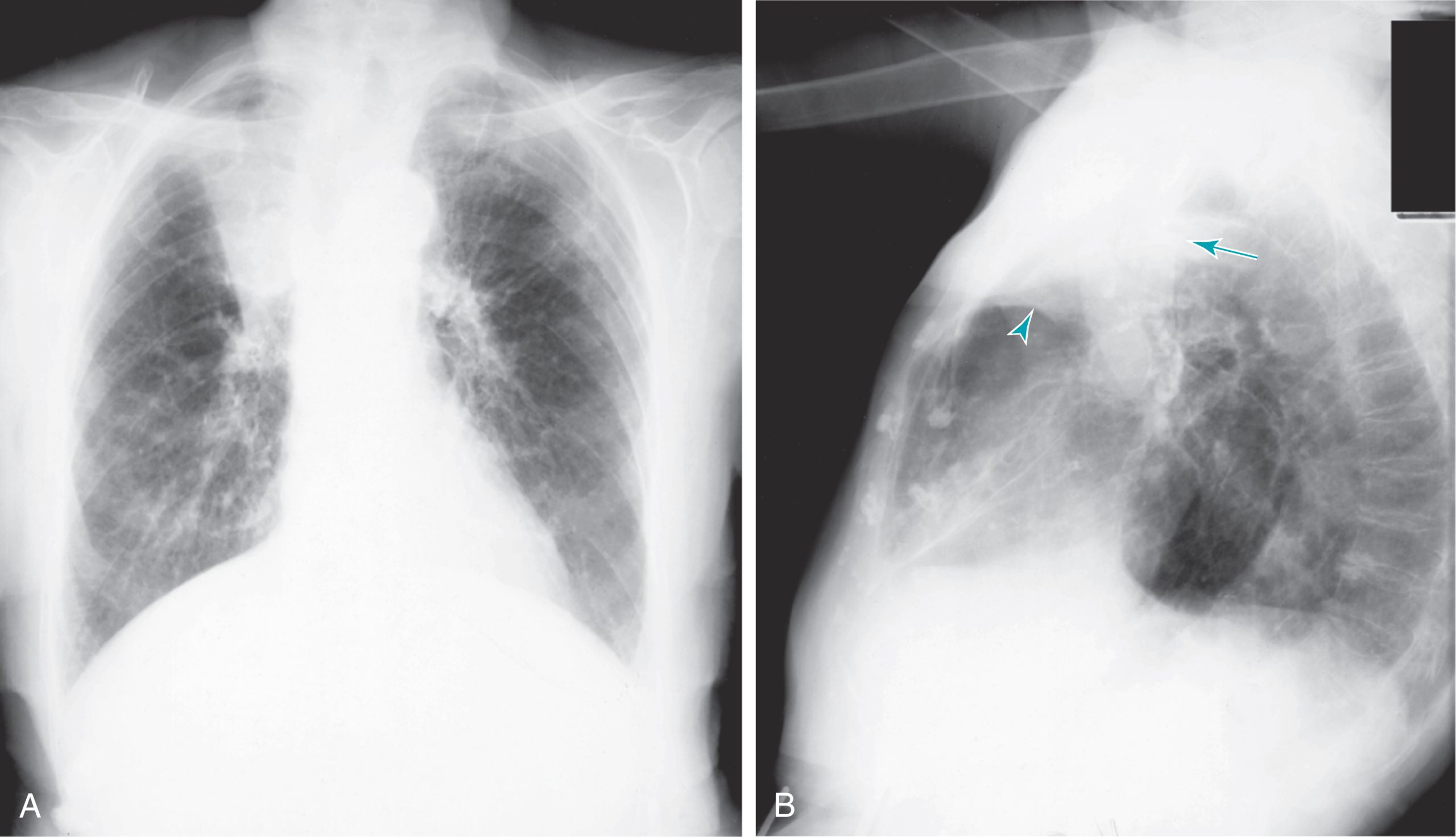
Hình 3.5 Phim X-quang ngực sau-trước (A) và nghiêng (B) cho thấy xẹp thùy trên phải. A, Rãnh liên thùy nhỏ bị dịch chuyển phác họa thùy trên phải không có khí (đậm đặc). B, Thùy trên phải được phác họa bởi một rãnh liên thùy nhỏ bị kéo lên cao (đầu mũi tên) và một rãnh liên thùy lớn bị dịch chuyển ra trước (mũi tên dài).
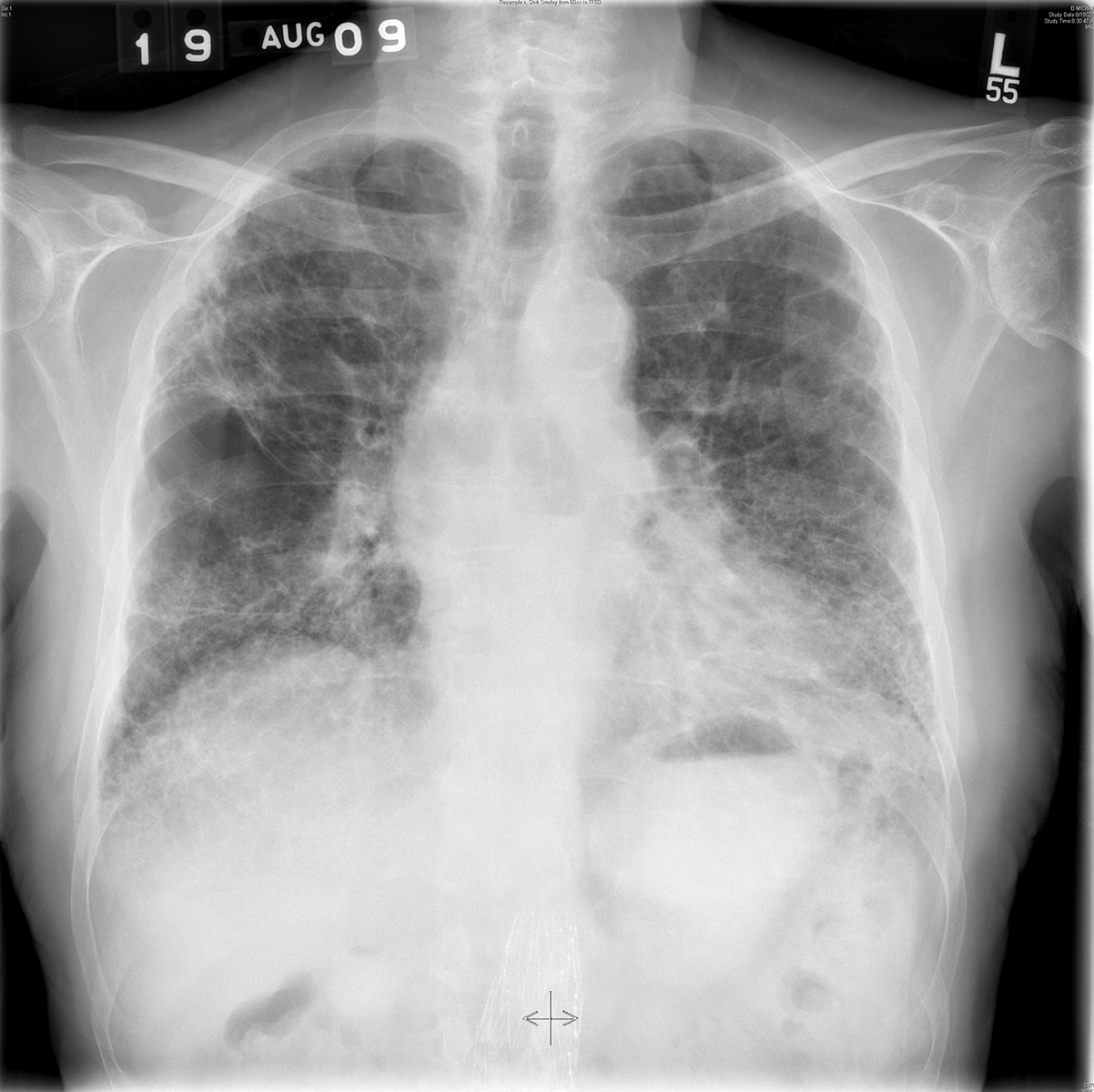
Hình 3.6 Phim X-quang ngực sau-trước (PA) cho thấy một dạng tổn thương mô kẽ (lưới-nốt) lan tỏa ở một bệnh nhân bị xơ phổi tự phát (IPF).
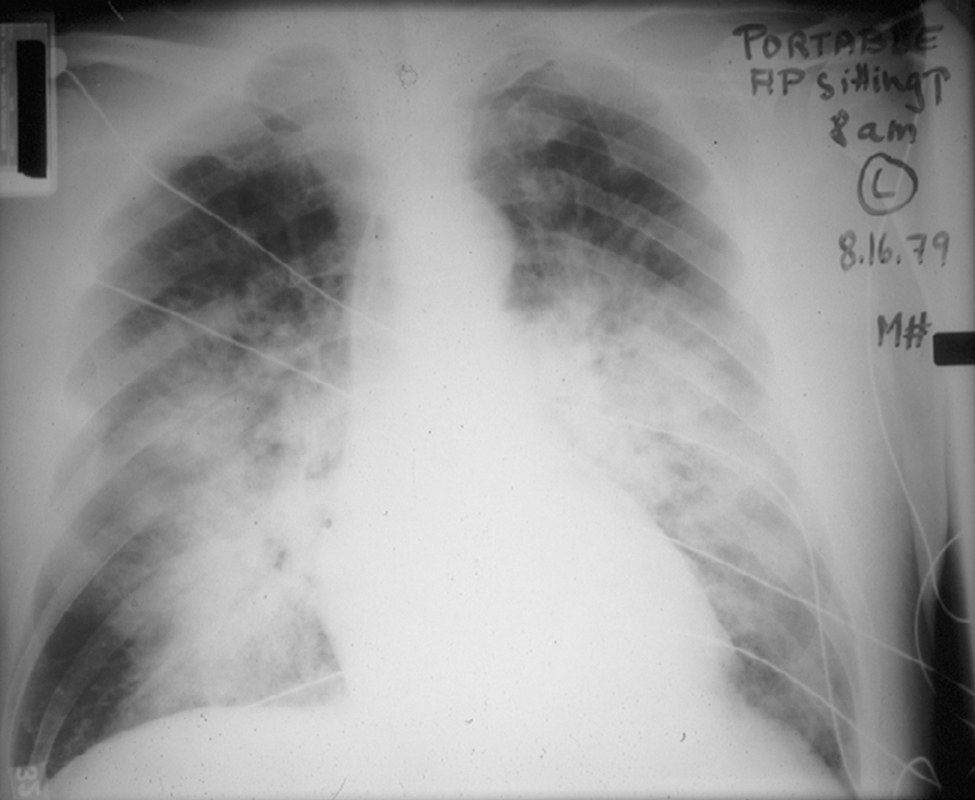
Hình 3.7 Phim X-quang ngực cho thấy một dạng tổn thương lấp đầy phế nang lan tỏa, nổi bật nhất ở các vùng phổi giữa và dưới.
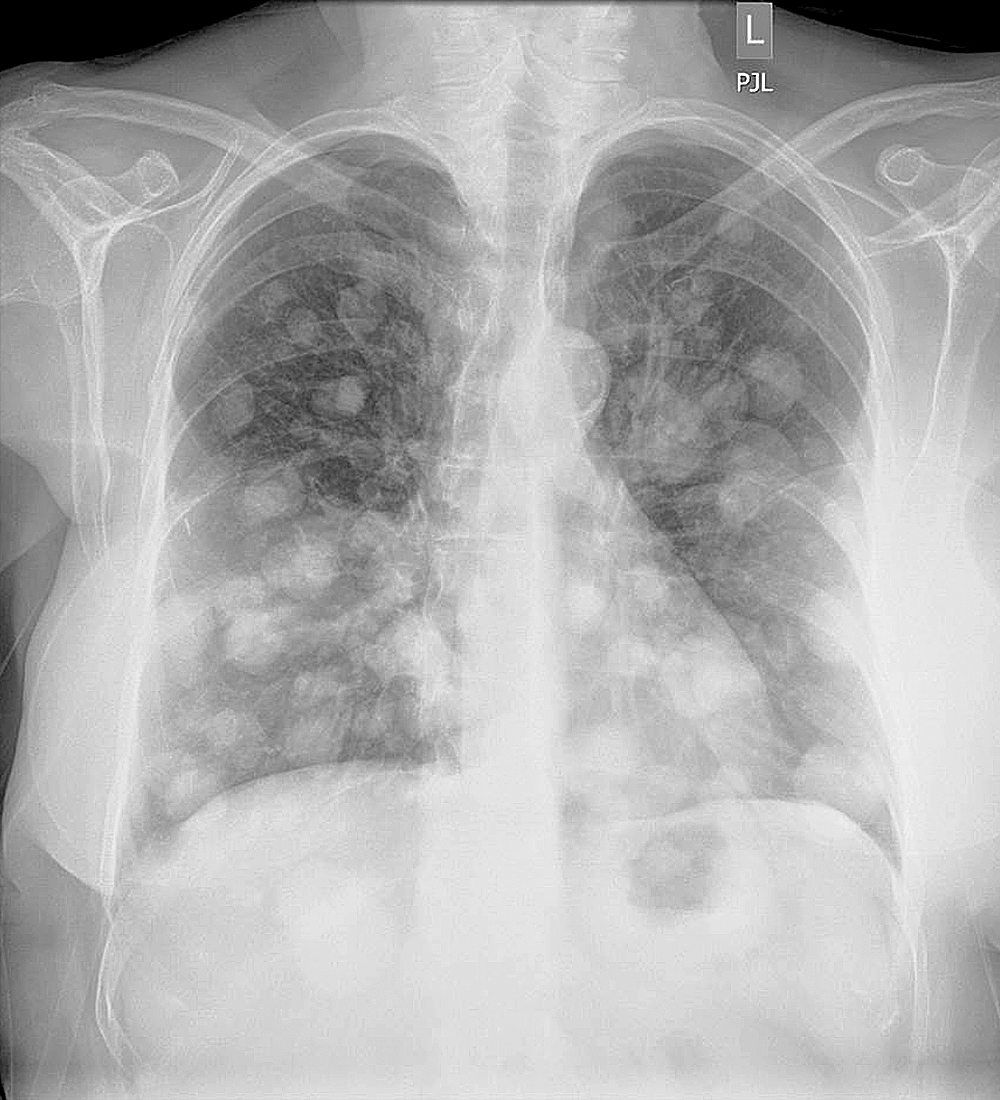
Hình 3.8 Phim X-quang ngực cho thấy một dạng tổn thương nốt lan tỏa ở một bệnh nhân bị u ác tính di căn. (Ảnh của Tiến sĩ Laura Avery, Bệnh viện Đa khoa Massachusetts.)
Chụp cắt lớp vi tính
So với phim X-quang ngực phẳng, chụp cắt lớp vi tính (CT) lồng ngực cung cấp chi tiết giải phẫu tốt hơn nhưng đắt hơn và khiến bệnh nhân tiếp xúc với liều bức xạ cao hơn đáng kể. Với kỹ thuật này, một chùm tia X hẹp được truyền qua bệnh nhân và được cảm nhận bởi một đầu dò quay ở phía bên kia của bệnh nhân. Chùm tia được hấp thụ một phần trong bệnh nhân, tùy thuộc vào mật độ của các mô xen kẽ. Phân tích bằng máy tính thông tin nhận được bởi đầu dò cho phép một loạt các hình ảnh cắt ngang được tái tạo. Việc sử dụng các “cửa sổ” khác nhau cho phép hiển thị dữ liệu thu thập được theo nhiều cách khác nhau, tùy thuộc vào mật độ của các cấu trúc quan tâm (Hình 3.10). Với kỹ thuật chụp CT xoắn ốc (helical CT), toàn bộ lồng ngực được quét liên tục (thường trong một lần nín thở và sử dụng nhiều đầu dò) khi cơ thể bệnh nhân được di chuyển qua máy CT (dàn máy).
CT đặc biệt hữu ích để phát hiện các khác biệt nhỏ về mật độ mô mà không thể phân biệt được bằng X-quang thông thường. Ngoài ra, độ phân giải của hình ảnh và các góc nhìn cắt ngang thu được từ các lát cắt cung cấp định nghĩa tốt hơn và vị trí không gian ba chiều chính xác hơn của các bất thường.
CT cung cấp các hình ảnh cắt ngang của lồng ngực và phát hiện các khác biệt tinh tế về mật độ mô.
CT ngực được sử dụng rộng rãi trong việc đánh giá các nốt phổi và trung thất. Nó cũng rất có giá trị trong việc mô tả bệnh ở thành ngực và màng phổi. Khi công nghệ phát triển, CT ngày càng trở nên hữu ích hơn trong việc chẩn đoán các bệnh khác nhau ảnh hưởng đến nhu mô phổi và đường thở. Với CT độ phân giải cao, độ dày của các hình ảnh cắt ngang riêng lẻ được giảm xuống còn 1 đến 2 mm thay vì 5 đến 10 mm truyền thống. Kết quả là, có thể nhìn thấy chi tiết cực kỳ tinh xảo, cho phép nhận biết sớm các bệnh tinh vi và mô tả tốt hơn các dạng bệnh cụ thể (xem Hình 3.9).
Trong nhiều năm, chụp cắt lớp vi tính mạch máu phổi (CTPA) đã trở thành xét nghiệm hình ảnh tiêu chuẩn để chẩn đoán thuyên tắc huyết khối phổi. Kỹ thuật này, trong đó hệ thống động mạch phổi được hình dung bằng chụp CT xoắn ốc sau khi tiêm thuốc cản quang vào tĩnh mạch ngoại vi, ngày càng được sử dụng thay thế cho cả xạ hình tưới máu phổi và chụp mạch phổi truyền thống (xem sau). Việc sử dụng nó hấp dẫn vì CTPA có nhiều khả năng chẩn đoán hơn so với xạ hình tưới máu, và nó ít xâm lấn hơn so với chụp mạch phổi truyền thống. Mặc dù CTPA có thể không nhạy bằng chụp mạch truyền thống để phát hiện các cục máu đông trong các động mạch phổi tương đối nhỏ, những cải tiến liên tục trong công nghệ máy quét CT đã dẫn đến việc xác định tốt hơn các cục huyết khối trong các động mạch phổi ngày càng nhỏ hơn.
Các giao thức phần mềm phức tạp hiện nay cho phép các hình ảnh thu được bằng chụp CT được tái tạo và trình bày ở bất kỳ mặt phẳng nào hiển thị tốt nhất các bất thường quan tâm. Ngoài ra, hình ảnh ba chiều được tạo ra từ dữ liệu thu được bằng chụp CT. Ví dụ, một hình ảnh ba chiều của đường thở có thể được hiển thị theo cách giống như những gì được thấy bên trong lòng đường thở trong quá trình nội soi phế quản (được mô tả sau trong chương này). Phương pháp này tạo ra một công cụ hình ảnh đã được đặt tên là nội soi phế quản ảo.
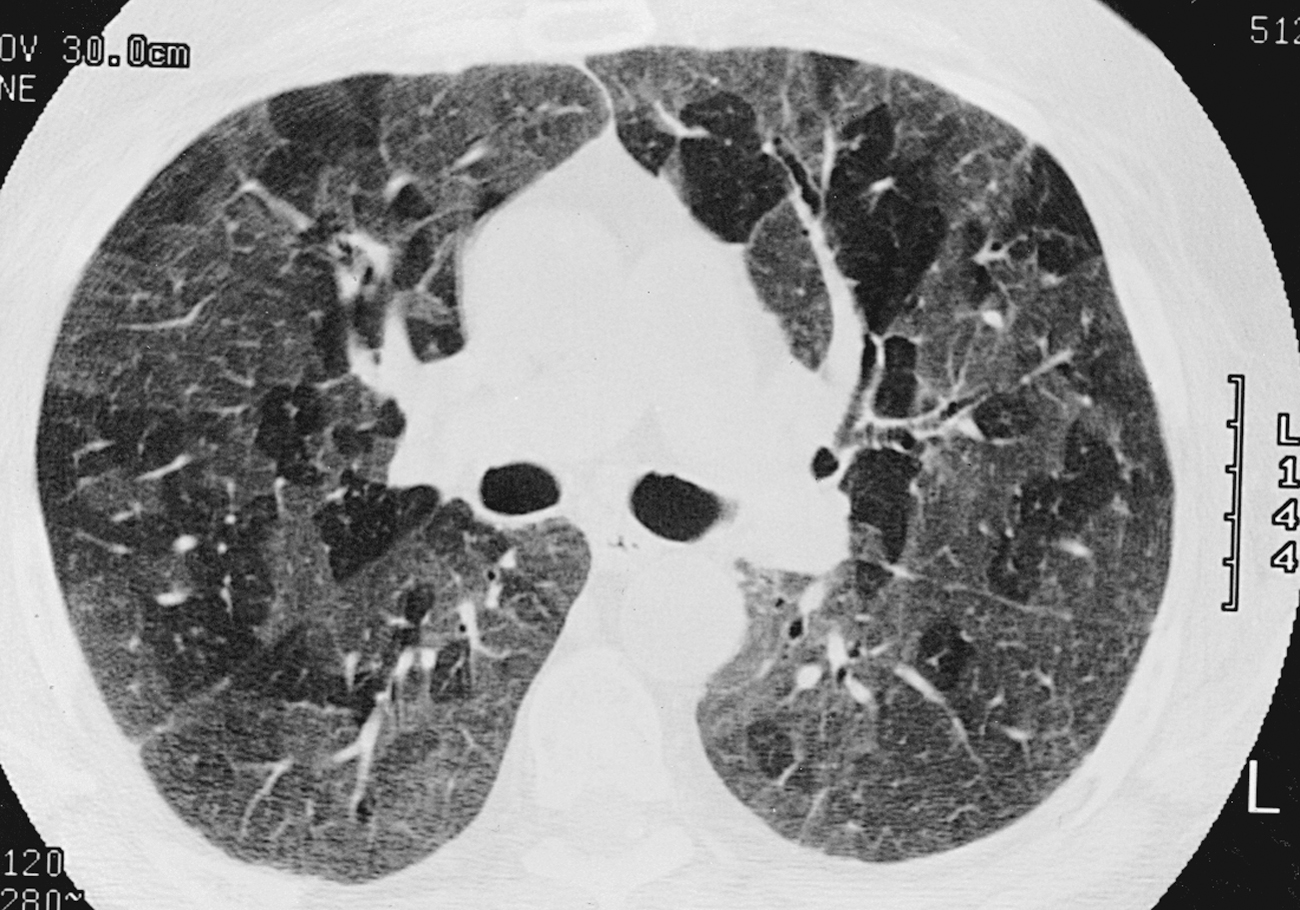
Hình 3.9 Chụp cắt lớp vi tính độ phân giải cao của bệnh nhân khó thở và phim X-quang ngực bình thường. Có các vùng mật độ thấp được phân định rõ ràng (có thể là phổi bình thường hoặc các vùng bẫy khí) xen kẽ giữa các vùng tăng mật độ mờ (“kính mờ”). Mẫu sinh thiết cho thấy các dấu hiệu của viêm phổi quá mẫn.
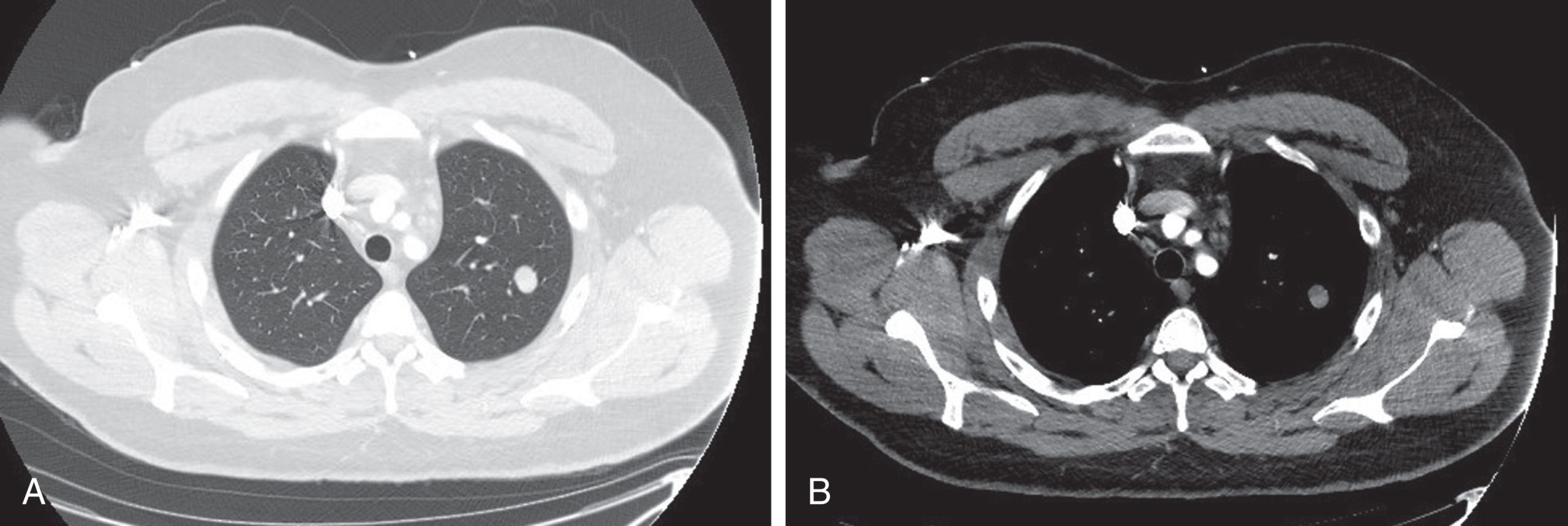
Hình 3.10 Hình ảnh cắt ngang (trục) từ một phim chụp cắt lớp vi tính (CT) cho thấy một nốt phổi đơn độc ở phổi trái. Các hình ảnh được hiển thị bằng cách sử dụng các “cửa sổ” khác nhau ở cùng một mặt cắt. A, Các cài đặt được chọn để tối ưu hóa việc quan sát nhu mô phổi. B, Các cài đặt được chọn để phân biệt các mật độ khác nhau của các mô mềm, chẳng hạn như các cấu trúc trong trung thất. Thuốc cản quang iod cho phép các cấu trúc mạch máu trong trung thất được xác định dễ dàng.
Chụp cộng hưởng từ
Một kỹ thuật khác có sẵn để đánh giá bệnh trong lồng ngực là chụp cộng hưởng từ (MRI). Các nguyên tắc vật lý của MRI rất phức tạp và nằm ngoài phạm vi đào tạo của hầu hết các bác sĩ và sinh viên, nhưng được thảo luận ngắn gọn ở đây. Độc giả quan tâm được giới thiệu đến các nguồn khác để thảo luận sâu về MRI (xem Tài liệu tham khảo). Tóm lại, kỹ thuật này phụ thuộc vào cách các hạt nhân trong một từ trường tĩnh thay đổi hướng và giải phóng năng lượng được cung cấp cho chúng bởi một xung tần số vô tuyến. Thời gian cần thiết để trở về trạng thái năng lượng ban đầu có thể được phân tích bằng một thuật toán máy tính phức tạp, và một hình ảnh trực quan được tạo ra.
MRI có một số đặc điểm quan trọng trong việc đánh giá bệnh trong lồng ngực. Thứ nhất, máu chảy tạo ra một “khoảng trống tín hiệu” và có màu đen, do đó các mạch máu có thể dễ dàng được phân biệt với các cấu trúc không phải mạch máu mà không cần sử dụng thuốc cản quang tiêm tĩnh mạch. Thứ hai, hình ảnh có thể được tái tạo ở bất kỳ mặt phẳng nào để thông tin thu được có thể được hiển thị dưới dạng các góc nhìn dọc (sagittal), vành (coronal), hoặc ngang (transverse). Thứ ba, có thể thấy sự khác biệt giữa các mô bình thường và mô bệnh lý liền kề nhau, ngay cả khi chúng có cùng mật độ và do đó không thể phân biệt được bằng X-quang thông thường hoặc CT. Một số đặc điểm này được minh họa trong Hình 3.11.
Chụp MRI đắt tiền và tốn thời gian, vì vậy nó thường được sử dụng khi có thể cung cấp thông tin không thể thu được bằng các phương tiện ít tốn kém hơn, ít xâm lấn hơn. MRI không thay thế CT; thay vào đó, nó thường cung cấp thông tin chẩn đoán bổ sung. Nó có thể là một công cụ có giá trị trong việc đánh giá bệnh ở rốn phổi và trung thất và trong việc xác định bệnh trong lồng ngực lan rộng đến cổ hoặc bụng. Mặt khác, nó ít hữu ích hơn CT trong việc đánh giá cả bệnh nhu mô phổi và thuyên tắc phổi. Tuy nhiên, kiến thức về sức mạnh và hạn chế của kỹ thuật này vẫn đang tiếp tục phát triển, và các ứng dụng có khả năng sẽ mở rộng với những cải tiến sâu hơn về công nghệ.
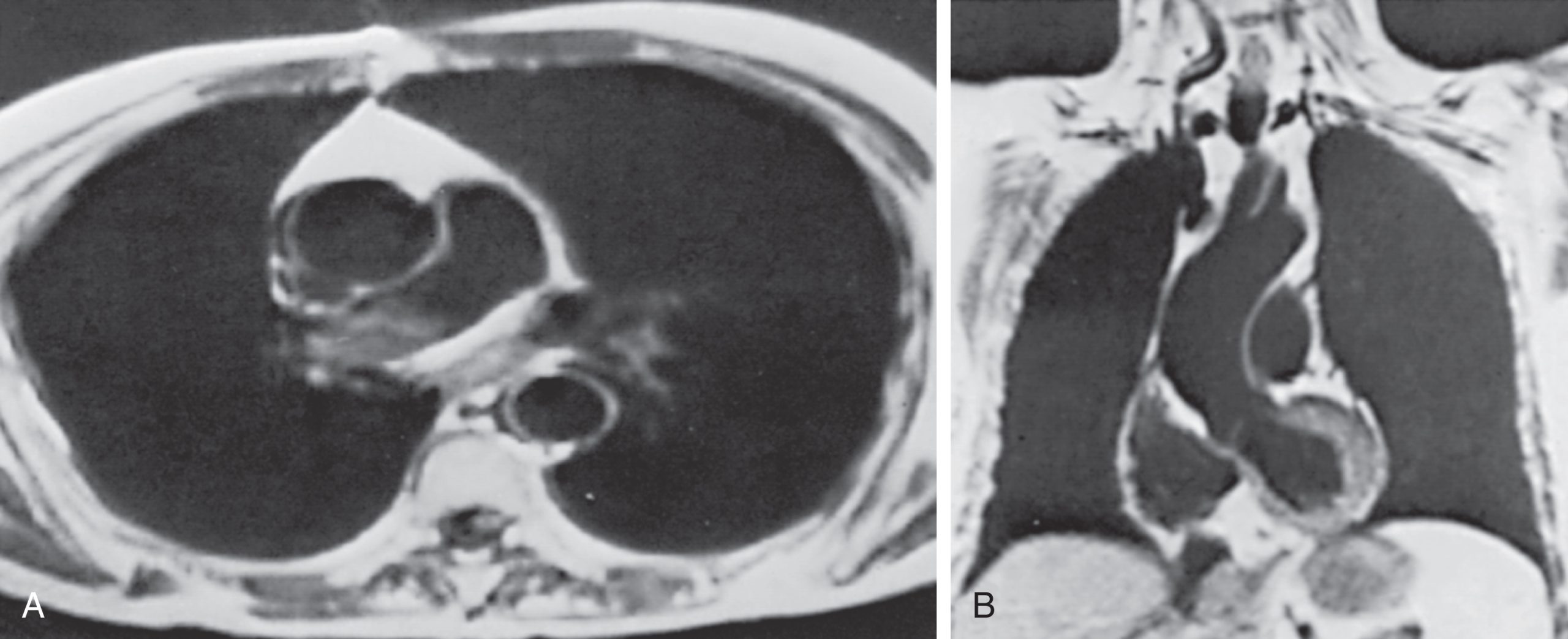
Hình 3.11 Hình ảnh cộng hưởng từ của lồng ngực bình thường ở các góc nhìn cắt ngang (A) và vành (B). Lòng của các cấu trúc chứa máu có màu đen vì máu chảy tạo ra một khoảng trống tín hiệu.
Xạ hình phổi Radionuclide
Các đồng vị phóng xạ được tiêm hoặc hít vào có thể dễ dàng cung cấp thông tin về lưu lượng máu phổi và thông khí. Việc chụp ảnh bức xạ γ từ các đồng vị này tạo ra một hình ảnh cho thấy sự phân bố của lưu lượng máu và thông khí trên cả hai lá phổi. Các đồng vị khác đã được sử dụng để phát hiện hoạt động chuyển hóa tăng ở các vị trí ác tính trong lồng ngực, tuy nhiên cần lưu ý rằng hoạt động tăng cũng có thể được thấy trong các quá trình nhiễm trùng và viêm.
Xạ hình tưới máu và thông khí
Để xạ hình tưới máu phổi, kỹ thuật phổ biến nhất bao gồm việc tiêm các tập hợp hoặc vi cầu albumin người được đánh dấu bằng một đồng vị phóng xạ, thường là technetium-99m, vào tĩnh mạch ngoại vi. Các hạt này, có đường kính khoảng 10 đến 60 µm, di chuyển qua tim phải, đi vào mạch máu phổi, và bị mắc kẹt trong các mạch máu phổi nhỏ (Hình 3.12). Chỉ những vùng phổi nhận được tưới máu từ hệ thống động mạch phổi mới cho thấy sự hấp thu của chất đánh dấu, trong khi các vùng không được tưới máu không cho thấy sự hấp thu của albumin được đánh dấu.
Để xạ hình thông khí, đồng vị phóng xạ dạng khí xenon-133 hoặc một bình xịt technetium-99m-diethylenetriamine pentaacetate (DTPA) được hít vào, và các hình ảnh tuần tự thu được cho thấy cách khí hoặc bình xịt phân bố trong phổi. Các hình ảnh thu được ở các thời điểm khác nhau sau khi hít vào cho thấy thông tin về sự phân bố khí sau hơi thở đầu tiên (pha hít vào), sau một thời gian dài thở khí (pha cân bằng), và sau khi bệnh nhân thở không khí trở lại để loại bỏ đồng vị phóng xạ (pha thải ra). Xạ hình thông khí cho thấy những vùng nào của phổi đang được thông khí và bất kỳ vấn đề cục bộ đáng kể nào với luồng khí thở ra và “bẫy khí” của đồng vị phóng xạ trong pha thải ra.
Xạ hình tưới máu và thông khí chủ yếu được thực hiện vì hai lý do: phát hiện thuyên tắc phổi và đánh giá chức năng phổi theo vùng. Khi một cục máu đông phổi làm tắc một động mạch phổi, lưu lượng máu sẽ ngừng đến vùng phổi thường được cung cấp bởi mạch máu đó, và một khiếm khuyết tưới máu tương ứng sẽ xuất hiện. Thông thường, thông khí được bảo tồn, và xạ hình thông khí không cho thấy một khiếm khuyết thông khí tương ứng. Trong thực tế, nhiều thông tin được xem xét trong việc diễn giải xạ hình, bao gồm cả hình ảnh X-quang ngực và kích thước cũng như sự phân bố của các khiếm khuyết trên xạ hình tưới máu. Những vấn đề này sẽ được thảo luận chi tiết hơn trong Chương 13.
Xạ hình tưới máu và thông khí phổi rất hữu ích để phát hiện thuyên tắc phổi và đánh giá chức năng phổi theo vùng.
Xạ hình để đánh giá chức năng phổi theo vùng đôi khi được thực hiện trước khi phẫu thuật cắt bỏ một phần phổi, thường là một hoặc nhiều thùy. Bằng cách hình dung những vùng phổi nào nhận được thông khí và tưới máu, bác sĩ có thể xác định mức độ đóng góp của vùng sẽ được cắt bỏ vào chức năng phổi tổng thể. Khi các kỹ thuật xạ hình được sử dụng kết hợp với đo chức năng hô hấp, bác sĩ có thể dự đoán gần đúng chức năng phổi sau phẫu thuật, đây là một hướng dẫn cho các vấn đề hô hấp và suy giảm chức năng sau phẫu thuật.
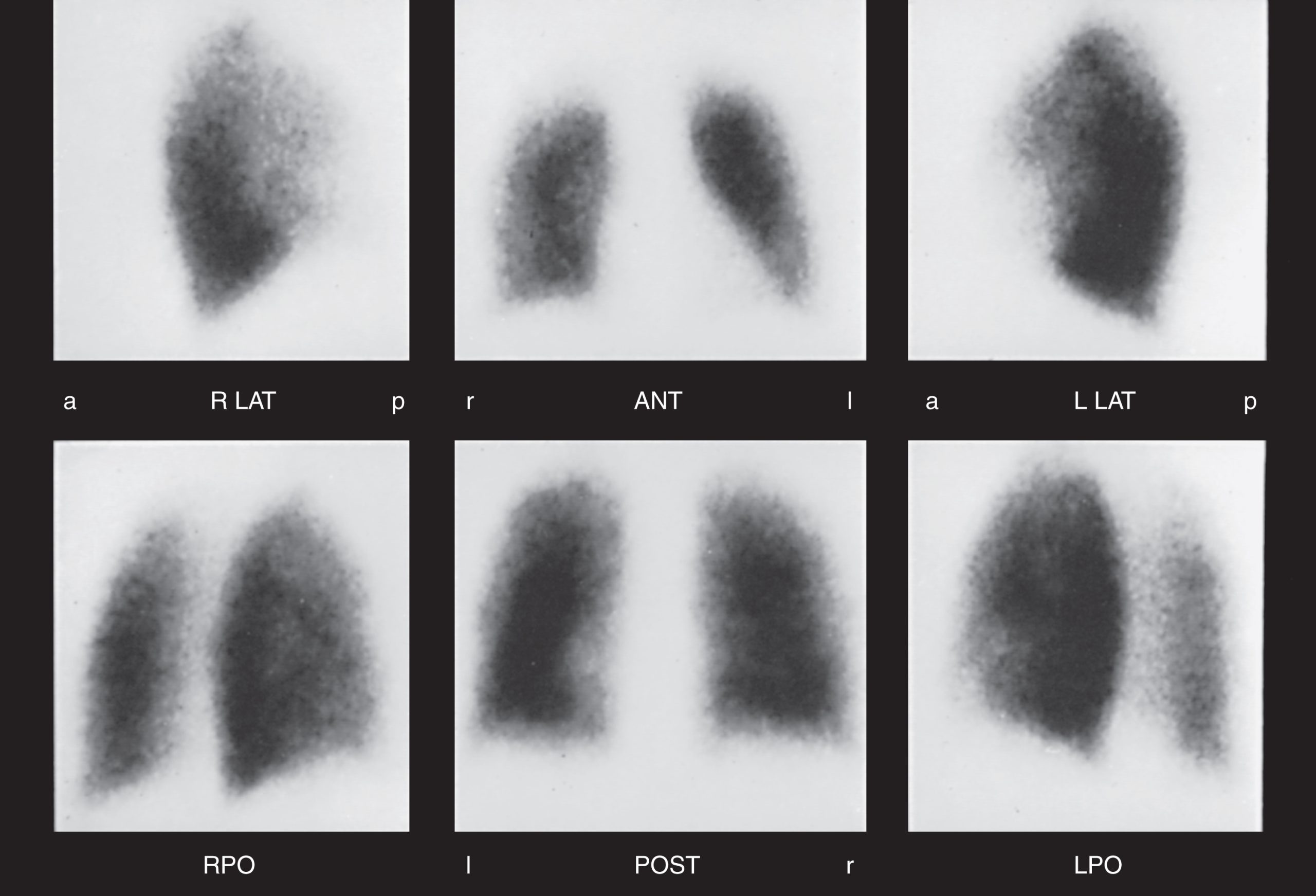
Hình 3.12 Xạ hình tưới máu phổi bình thường được thể hiện ở sáu góc nhìn. a, trước; ANT, tư thế trước; l, trái; LAT, tư thế nghiêng; LPO, tư thế sau-trái chếch; p, sau; POST, tư thế sau; r, phải; RPO, tư thế sau-phải chếch. (Ảnh của Tiến sĩ Henry Royal.)
Chụp cắt lớp phát xạ Positron (Xạ hình Fluorodeoxyglucose)
Chụp cắt lớp phát xạ positron (PET) phát hiện các vùng có hoạt động chuyển hóa tăng. Dựa trên nguyên tắc rằng các khối u ác tính thường có hoạt động chuyển hóa tăng, việc xạ hình sau khi tiêm chất tương tự glucose được đánh dấu phóng xạ là 18-fluorodeoxyglucose (FDG) đã được sử dụng như một cách để xác định các tổn thương ác tính trong phổi và trung thất (Hình 3.13). Các tế bào ác tính, do sự hấp thu và sử dụng glucose tăng, hấp thu FDG nhanh hơn các tế bào bình thường xung quanh. Bởi vì FDG đã được biến đổi hóa học, nó không thể được chuyển hóa vượt qua bước phosphoryl hóa ban đầu và bị giữ lại trong tế bào. FDG được đánh dấu phóng xạ phát ra các positron được PET phát hiện bằng một hệ thống hình ảnh chuyên dụng, hoặc bằng cách điều chỉnh một máy ảnh γ để chụp ảnh các hạt nhân phóng xạ phát ra positron.
Chụp PET với FDG chủ yếu được sử dụng để đánh giá các nốt phổi đơn độc và để phân giai đoạn ung thư phổi, đặc biệt là đối với sự liên quan của các hạch bạch huyết trung thất. Tuy nhiên, sự phân biệt giữa bệnh lành tính và ác tính không hoàn hảo, và có thể thấy kết quả âm tính giả và dương tính giả với các tổn thương ác tính phát triển chậm hơn và các tổn thương viêm hoạt động mạnh, tương ứng. Chụp PET có thể được thực hiện kết hợp với chụp CT, cho phép tương quan trực tiếp của các tổn thương cụ thể có thể nhìn thấy trên phim CT với sự hấp thu FDG tương ứng của chúng.
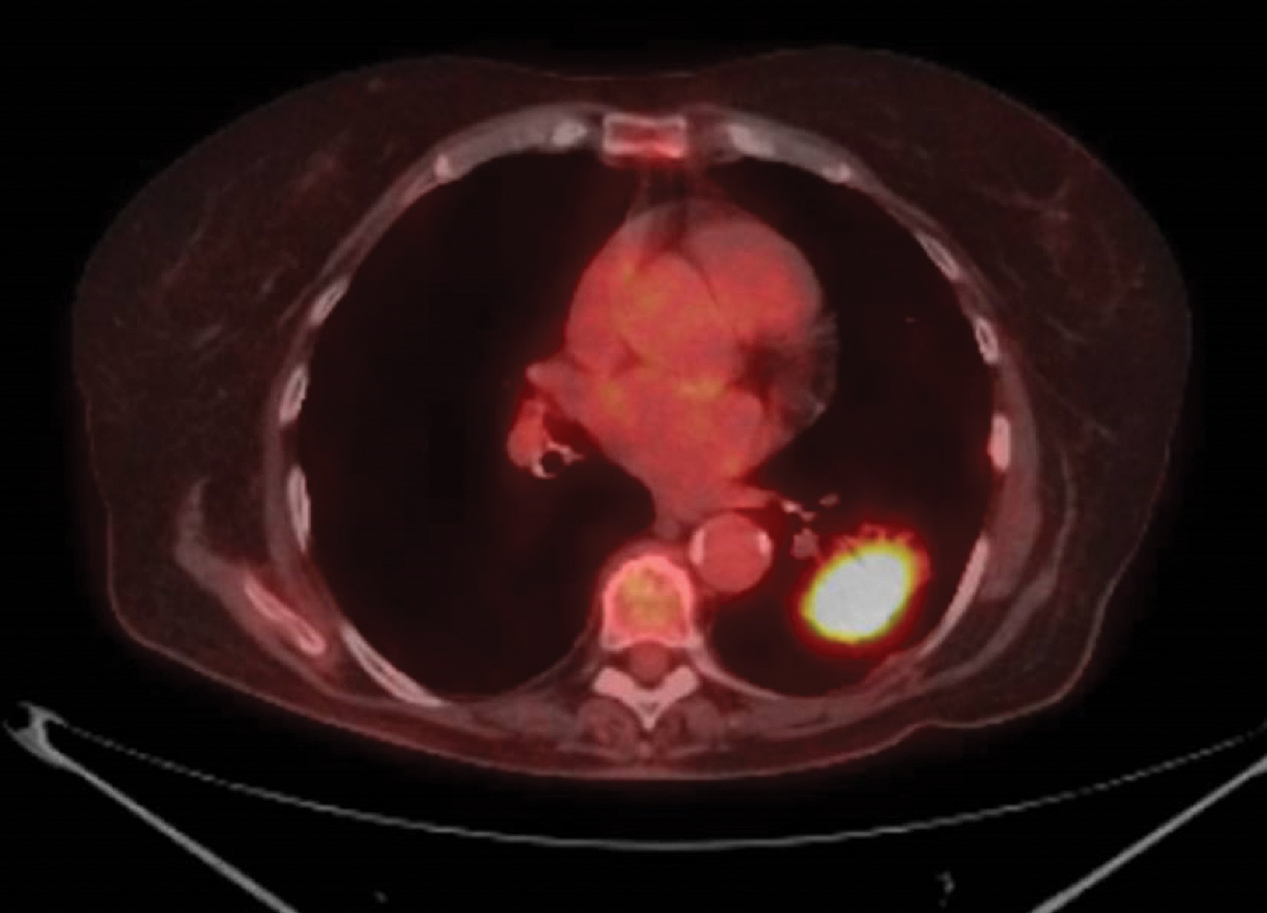
Hình 3.13 Phim chụp PET-CT kết hợp cho thấy sự hấp thu 18-fluorodeoxyglucose trong một khối u biểu mô tuyến thùy dưới trái của phổi.
Chụp mạch phổi
Chụp mạch phổi là một kỹ thuật X-quang trong đó một ống thông được dẫn từ một tĩnh mạch hệ thống qua tâm nhĩ phải và tâm thất phải và vào động mạch phổi chính hoặc một trong các nhánh của nó. Chất cản quang được tiêm vào, và cây động mạch phổi được hình dung qua chụp mạch số hóa (Hình 3.14). Xét nghiệm này trong quá khứ chủ yếu được sử dụng để chẩn đoán thuyên tắc phổi. Một cục huyết khối trong một mạch máu phổi xuất hiện dưới dạng một sự kết thúc đột ngột (“cụt”) của mạch máu hoặc một khiếm khuyết lấp đầy trong lòng mạch của nó.
Trước đây, chụp mạch phổi thường được sử dụng khi chẩn đoán thuyên tắc phổi cấp tính không chắc chắn sau khi xạ hình phổi, hoặc CTPA không kết luận được. Tuy nhiên, với những tiến bộ trong kỹ thuật CT, một phim chụp mạch phổi thông thường hiện nay hiếm khi cần thiết. Chụp mạch phổi có các công dụng khác, bao gồm điều tra các dị tật mạch máu bẩm sinh, bệnh huyết khối tắc mạch mạn tính, và sự xâm lấn của một khối u vào mạch máu. Tuy nhiên, việc sử dụng chụp mạch trong những tình huống này cũng khá hiếm.
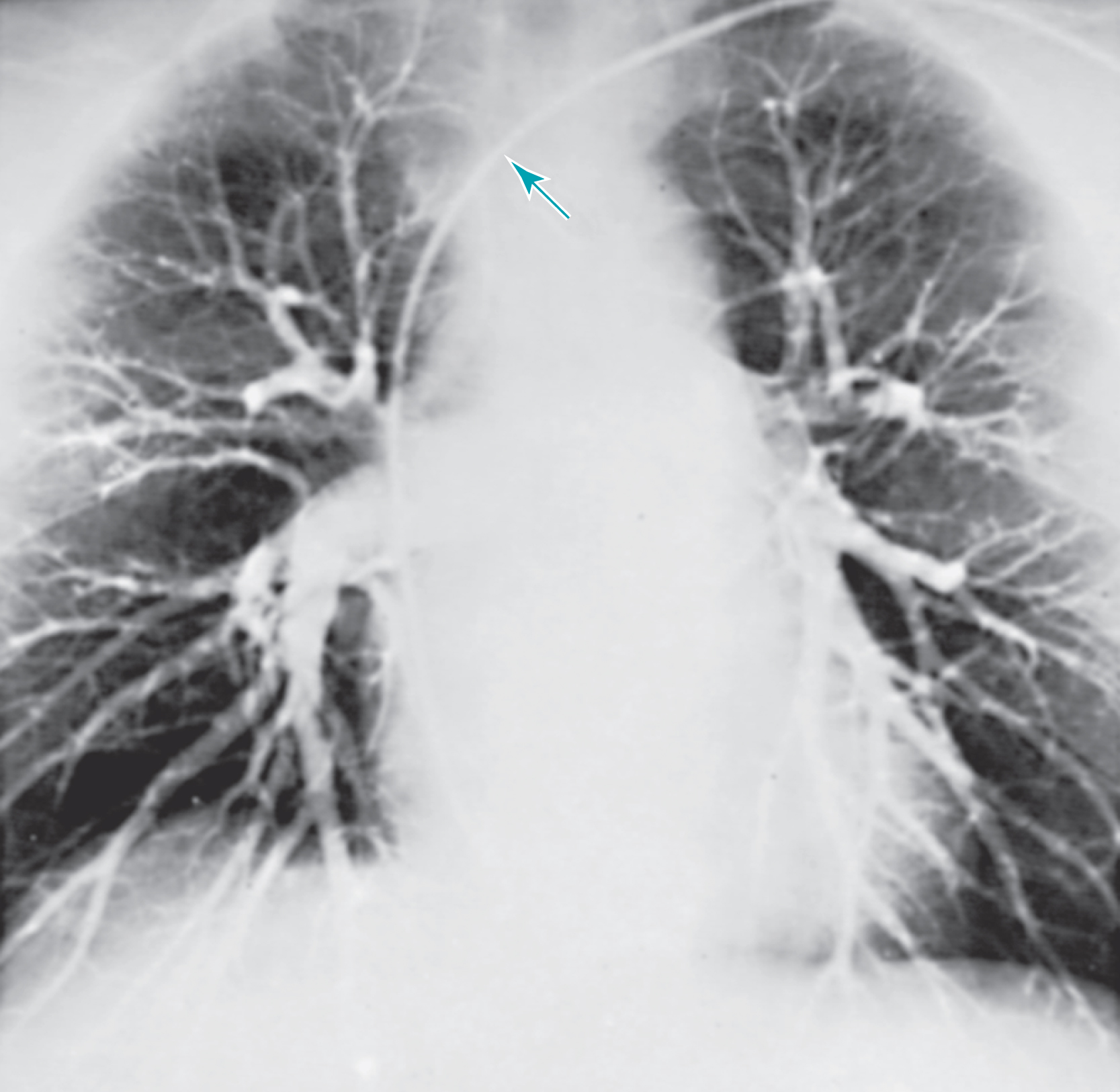
Hình 3.14 Phim chụp mạch phổi bình thường. Thuốc cản quang được tiêm trực tiếp vào động mạch phổi, và cây động mạch phổi được hình dung rõ ràng. Ống thông được sử dụng để tiêm thuốc được chỉ bởi mũi tên. (Ảnh của Tiến sĩ Morris Simon.)
Siêu âm
Khả năng của các loại mô khác nhau trong việc truyền âm thanh và của các giao diện mô trong việc phản xạ âm thanh đã làm cho siêu âm trở nên hữu ích để đánh giá nhiều cấu trúc cơ thể. Một tinh thể áp điện tạo ra sóng âm, và các tiếng vang phản xạ được phát hiện và ghi lại bởi cùng một tinh thể. Hình ảnh được hiển thị trên màn hình và có thể được lưu lại để làm hồ sơ vĩnh viễn.
Tim là cấu trúc trong lồng ngực được nghiên cứu thường xuyên nhất bằng siêu âm, nhưng kỹ thuật này cũng hữu ích trong việc đánh giá bệnh màng phổi và có thể được thực hiện tại giường bệnh của bệnh nhân (siêu âm tại điểm chăm sóc, hay POCUS). Cụ thể, siêu âm có thể phát hiện một lượng nhỏ dịch màng phổi và thường được sử dụng để hướng dẫn đặt kim lấy mẫu dịch. Ngoài ra, nó có thể phát hiện các khoang bị vách hóa (loculations) trong tràn dịch màng phổi, phân biệt dịch với dày màng phổi, xác định các nốt hoặc khối u dựa trên màng phổi, và phát hiện tràn khí màng phổi với độ nhạy cao. Siêu âm có thể xác định vị trí cơ hoành và phát hiện bệnh ngay dưới cơ hoành, chẳng hạn như áp xe dưới hoành. Siêu âm không hữu ích để xác định các cấu trúc hoặc tổn thương trong nhu mô phổi, vì chùm siêu âm xuyên qua không khí kém.
Nội soi phế quản
Việc quan sát trực tiếp đường thở có thể thực hiện được bằng nội soi phế quản, ban đầu được thực hiện bằng một ống kim loại cứng, rỗng, nhưng hiện nay chủ yếu bằng một dụng cụ mỏng, linh hoạt (Hình 3.15). Máy nội soi phế quản linh hoạt truyền hình ảnh qua các bó sợi quang linh hoạt (máy nội soi phế quản sợi quang truyền thống) hoặc phổ biến hơn là qua một máy ảnh kỹ thuật số ở đầu máy nội soi phế quản hiển thị hình ảnh trên màn hình. Bởi vì máy nội soi phế quản linh hoạt, người nội soi có thể uốn cong đầu ống bằng một cần điều khiển và điều khiển vào các đường thở ít nhất là đến cấp phân thùy. Người nội soi có thể có được một cái nhìn tuyệt vời về đường thở (Hình 3.16) và thu thập nhiều loại mẫu để kiểm tra tế bào học, bệnh học và vi sinh vật học.
Nước muối sinh lý vô trùng có thể được tiêm qua một kênh rỗng nhỏ trong máy nội soi phế quản và hút trở lại vào một buồng thu. Kỹ thuật này, được gọi là rửa phế quản, lấy mẫu các tế bào và, nếu có, vi sinh vật từ đường hô hấp dưới. Khi máy nội soi phế quản được đưa vào xa nhất có thể và được chèn vào một đường thở trước khi tiêm nước muối, dịch rửa có thể lấy mẫu các thành phần của các khoang phế nang; kỹ thuật này được gọi là rửa phế quản phế nang (BAL).
Với máy nội soi phế quản linh hoạt, đường thở được quan sát và các mẫu xét nghiệm được lấy.
Một dụng cụ dây dài, linh hoạt với một bàn chải nhỏ ở đầu có thể được đưa qua kênh rỗng của máy nội soi phế quản. Bề mặt của một tổn thương trong phế quản có thể được chải và các tế bào được thu thập hoặc phết lên một lam kính để kiểm tra tế bào học. Bàn chải thường được đưa vào các vùng bệnh lý của nhu mô phổi, và vật liệu được thu thập bởi các sợi lông được phân tích tế bào học và vi sinh vật học.
Một cây kim ở cuối một ống thông dài được đưa qua máy nội soi phế quản có thể đâm xuyên qua thành đường thở và lấy mẫu các tế bào từ các hạch bạch huyết hoặc các tổn thương liền kề với đường thở. Kỹ thuật này, được gọi là chọc hút bằng kim qua phế quản, có thể được sử dụng để lấy các tế bào ác tính từ các hạch bạch huyết trung thất trong việc phân giai đoạn ung thư phổi đã biết hoặc nghi ngờ. Việc sử dụng một đầu dò siêu âm trong đường thở trong quá trình nội soi phế quản (siêu âm qua nội soi phế quản hoặc EBUS) có thể giúp người nội soi xác định vị trí các hạch bạch huyết trung thất hoặc rốn phổi hoặc các tổn thương khối đặc liền kề với đường thở và do đó hỗ trợ rất nhiều cho việc đặt kim chính xác vào hạch hoặc tổn thương để chọc hút bằng kim qua phế quản.
Với một kìm sinh thiết nhỏ được đưa qua máy nội soi phế quản, bác sĩ lâm sàng có thể lấy một mẫu sinh thiết từ một tổn thương được nhìn thấy trên thành phế quản (sinh thiết nội phế quản). Kìm cũng có thể được đưa qua một phế quản nhỏ vào nhu mô phổi để lấy một mẫu nhỏ mô phổi. Thủ thuật này, được gọi là sinh thiết xuyên phế quản, mang lại các mẫu nhỏ nhưng có số lượng phế nang đáng kể. Chiếu X-quang (fluoroscopy) có thể được sử dụng trong quá trình thực hiện để xác định vị trí tốt hơn của kìm sinh thiết so với vị trí sinh thiết mong muốn, hoặc là một tổn thương rời rạc hoặc một khu vực đại diện cho bệnh lan tỏa hơn. EBUS cũng có thể được sử dụng để giúp hướng dẫn đặt kìm sinh thiết vào các tổn thương tương đối ngoại vi trong phổi.
Một kỹ thuật chuyên biệt bổ sung đã được phát triển trong thập kỷ qua được gọi là nội soi phế quản dẫn đường điện từ (thường được rút ngắn thành nội soi phế quản dẫn đường). Sử dụng một phim CT ngực đã được chụp trước đó, phần mềm tinh vi tạo ra một hình ảnh ba chiều của lồng ngực và một “bản đồ” với các hướng dẫn để dẫn đường một ống thông dẫn đường có thể điều khiển, được đưa qua một máy nội soi phế quản linh hoạt, vào một nốt ngoại vi nhỏ. Nếu không có loại hướng dẫn này, rất khó để người nội soi chọn đúng đường đi để điều khiển máy nội soi phế quản và bất kỳ công cụ lấy mẫu nào đến một tổn thương ngoại vi thông qua hệ thống đường thở phân nhánh ngày càng tăng. Do kích thước rất nhỏ của các đường thở ở xa, một kỹ thuật gọi là nội soi phế quản bằng robot đã được phát triển cho phép người nội soi thực hiện các thao tác nhỏ hơn, chính xác hơn bằng cách sử dụng một thiết bị hỗ trợ máy tính giữ và di chuyển trực tiếp máy nội soi phế quản.
Có nhiều chỉ định cho nội soi phế quản, thường là bằng một dụng cụ linh hoạt, mặc dù dụng cụ cứng được sử dụng trong một số trường hợp. Khi thích hợp, dụng cụ linh hoạt được ưu tiên vì thủ thuật có thể được thực hiện chỉ bằng cách sử dụng thuốc an thần nhẹ và bệnh nhân không cần phải nhập viện. Ngược lại, nội soi phế quản cứng chỉ được thực hiện dưới gây mê toàn thân. Một số chỉ định cho nội soi phế quản bao gồm (1) đánh giá một khối u nội phế quản nghi ngờ, (2) lấy mẫu một khu vực bệnh nhu mô bằng BAL, chải, hoặc sinh thiết, (3) đánh giá ho ra máu, và (4) lấy dị vật (với các dụng cụ đặc biệt có thể được đưa qua máy nội soi phế quản và có khả năng lấy các vật thể).
Một loạt các phương thức điều trị mới hơn đang được đưa đến đường thở thông qua các kỹ thuật nội soi phế quản linh hoạt hoặc cứng. Các phương thức này bao gồm các kỹ thuật laser để làm teo nhỏ các khối u nội phế quản gây tắc nghẽn đường thở; đặt stent để duy trì sự thông thoáng của các đường thở có lòng bị tổn thương hoặc tắc nghẽn; các thủ thuật nong các chỗ hẹp; đặt các hạt phóng xạ trực tiếp vào các tổn thương ác tính trong đường thở (xạ trị áp sát); và cung cấp dòng điện (đốt điện), nhiệt độ thấp (áp lạnh), hoặc các bước sóng ánh sáng nhất định (liệu pháp quang động) cho các khối u nội phế quản. Việc triển khai các cơ hội điều trị mới này đã tạo ra một lĩnh vực chuyên môn hóa tương đối mới và đang phát triển nhanh chóng trong y học phổi gọi là phổi học can thiệp.
Kể từ khi phát minh ra máy nội soi phế quản sợi quang vào năm 1966, nội soi phế quản linh hoạt đã trở thành một kỹ thuật phổ biến và hữu ích trong việc đánh giá và quản lý bệnh phổi. Mặc dù bác sĩ đầu tiên đề xuất đặt một ống vào thanh quản và phế quản đã bị khiển trách vào năm 1847 vì đề xuất một kỹ thuật “là một điều không thể về mặt giải phẫu và một sự đổi mới không chính đáng trong y học thực hành,” nội soi phế quản thường được dung nạp tốt, và các biến chứng không thường xuyên.
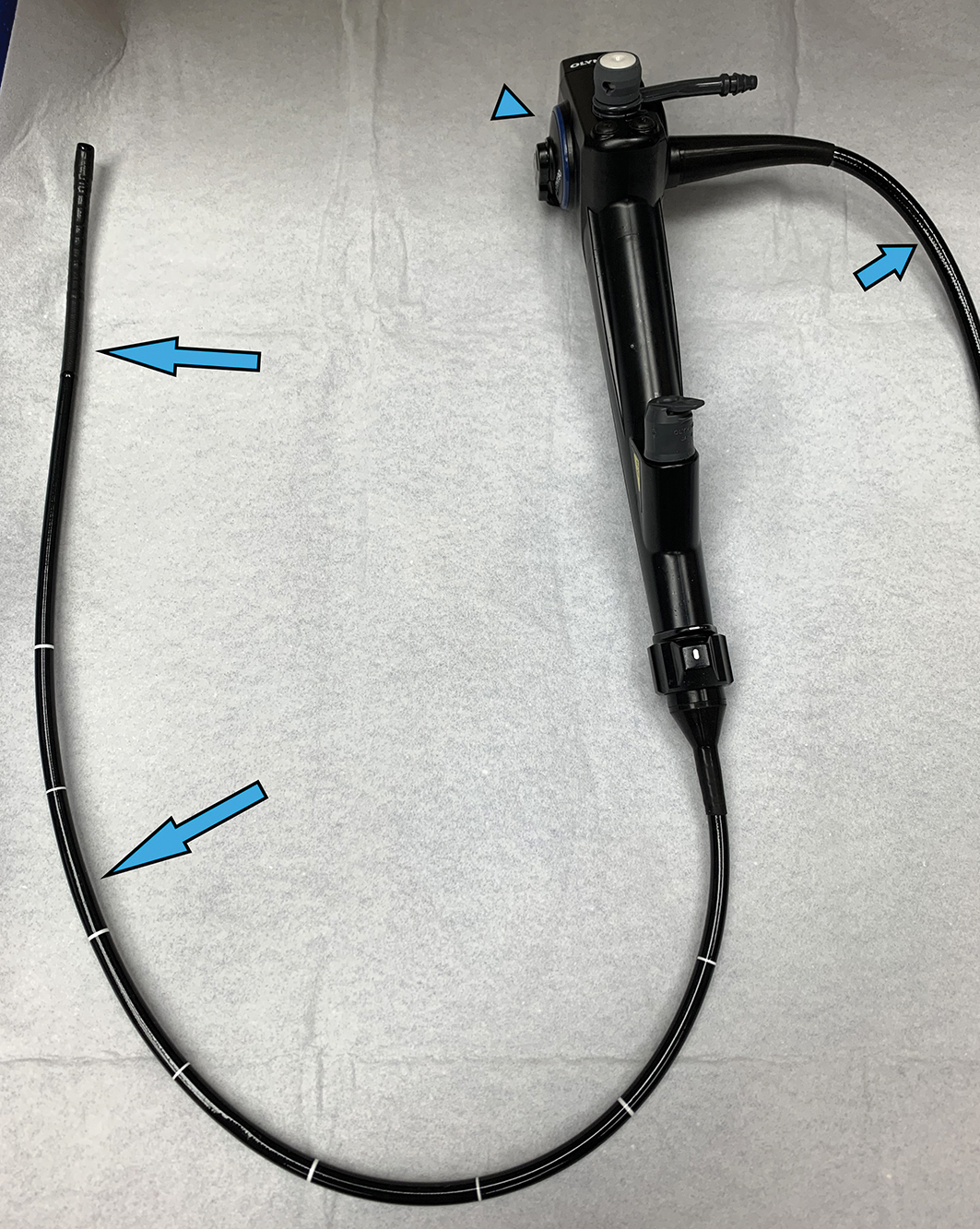
Hình 3.15 Máy nội soi phế quản linh hoạt. Các mũi tên dài chỉ vào phần linh hoạt được đưa vào đường thở của bệnh nhân. Mũi tên ngắn chỉ vào phần của máy nội soi phế quản được kết nối với nguồn sáng. Đầu mũi tên chỉ vào các bộ điều khiển cho bác sĩ lâm sàng thực hiện thủ thuật. (Ảnh của Tiến sĩ George Cheng.)
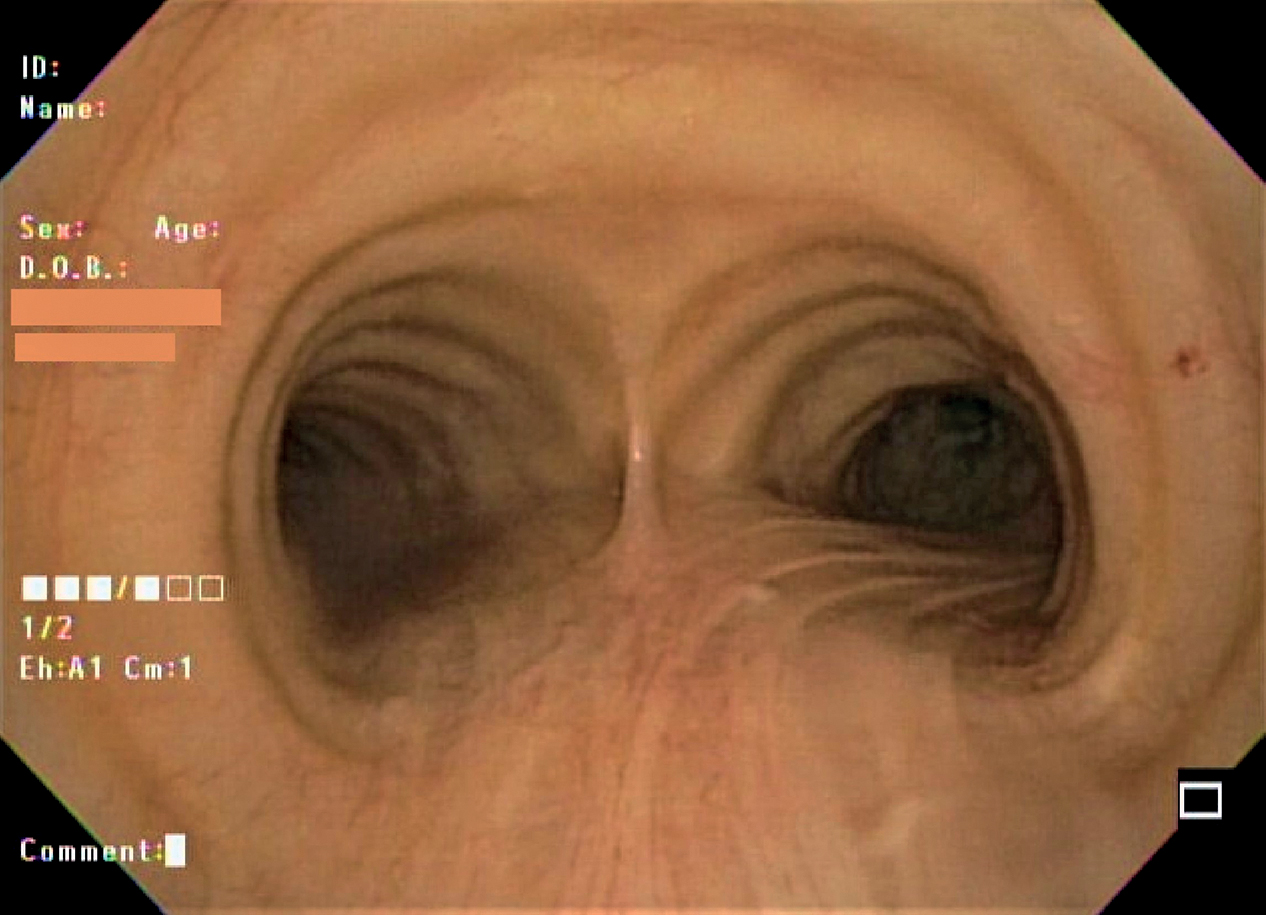
Hình 3.16 Đường thở nhìn qua máy nội soi phế quản sợi quang. Ở cấp độ này, có thể nhìn thấy cựa khí quản (carina) ngăn cách phế quản gốc phải và trái. (Ảnh của Tiến sĩ George Cheng.)
ĐÁNH GIÁ Ở CẤP ĐỘ VI THỂ
Kính hiển vi thường cung cấp chẩn đoán xác định cho bệnh phổi được gợi ý bởi bệnh sử, khám thực thể, hoặc hình ảnh học lồng ngực. Một số loại rối loạn đặc biệt phù hợp để chẩn đoán bằng kính hiển vi: khối u phổi (bằng cả mô học hoặc tế bào học), nhiễm trùng phổi (bằng cách xác định vi sinh vật cụ thể dưới kính hiển vi), và một loạt các bệnh phổi khác, đặc biệt là những bệnh ảnh hưởng đến mô kẽ của phổi (bằng mô học). Thường xuyên, khi một chẩn đoán không chắc chắn, các kỹ thuật tương tự được sử dụng để lấy các mẫu bệnh phẩm được xử lý cho cả kiểm tra mô học (hoặc tế bào học) và để xác định vi sinh vật. Phần này cung cấp một cuộc thảo luận về cách lấy mẫu bệnh phẩm và sau đó xem xét cách các mẫu bệnh phẩm được xử lý. Việc xác định và sử dụng gần đây hơn các dấu ấn khối u trên các mẫu ung thư phổi, vốn đã trở nên quan trọng để phát triển các kế hoạch điều trị nhắm mục tiêu, sẽ được thảo luận trong Chương 20 và 21.
Lấy mẫu bệnh phẩm
Ba loại mẫu bệnh phẩm chính mà bác sĩ sử dụng để phân tích vi thể trong chẩn đoán bệnh nhân mắc bệnh phổi là (1) dịch tiết khí-phế quản, (2) mô từ nhu mô phổi, và (3) dịch hoặc mô từ màng phổi. Có một số phương pháp để lấy từng loại mẫu bệnh phẩm này, và kiến thức về hiệu suất và các biến chứng sẽ quyết định phương pháp phù hợp nhất.
Cách dễ nhất để lấy một mẫu dịch tiết khí-phế quản là thu thập đờm do bệnh nhân khạc ra tự nhiên. Mẫu này có thể được sử dụng để xác định các tế bào viêm hoặc ác tính và để nhuộm (và nuôi cấy) vi sinh vật. Việc thu thập đờm nghe có vẻ đơn giản, nhưng nó có một số vấn đề tiềm ẩn. Thứ nhất, bệnh nhân có thể không ho và khạc đờm tự nhiên. Nếu vậy, một cơn ho mạnh tạo ra đờm thường có thể được gây ra bằng cách cho bệnh nhân hít một dung dịch khí dung gây kích ứng, chẳng hạn như nước muối ưu trương (“đờm kích thích”). Thứ hai, những gì được cho là đờm có nguồn gốc từ cây khí-phế quản thường là dịch tiết mũi hoặc “nước bọt” được khạc ra từ miệng hoặc phía sau cổ họng. Cuối cùng, do đi qua miệng, ngay cả một mẫu đờm sâu, tốt cũng bị nhiễm bởi vô số vi sinh vật cư trú trong miệng. Do sự nhiễm bẩn này, cần phải cẩn thận trong việc diễn giải kết quả nuôi cấy đờm, đặc biệt là đối với hệ vi sinh vật bình thường của đường hô hấp trên. Mặc dù có những hạn chế này, đờm vẫn là một nguồn tài nguyên quý giá khi tìm kiếm một quá trình nhiễm trùng như viêm phổi do vi khuẩn và bệnh lao. Vai trò của nó trong chẩn đoán ung thư phổi hạn chế hơn do độ nhạy thấp.
Dịch tiết khí-phế quản cũng có thể được lấy bằng hai con đường khác: chọc hút qua khí quản và nội soi phế quản. Với chọc hút qua khí quản, một ống thông nhựa nhỏ được đưa vào bên trong (hoặc qua) một cây kim được đưa qua màng nhẫn giáp và vào khí quản. Ống thông gây ho, và dịch tiết được thu thập có hoặc không có việc nhỏ thêm nước muối qua ống thông. Kỹ thuật này tránh được vấn đề nhiễm bẩn bởi hệ vi sinh vật ở miệng và đường hô hấp trên. Nó cũng cho phép thu thập mẫu ngay cả khi bệnh nhân không có sản xuất đờm tự nhiên. Tuy nhiên, kỹ thuật này không phải là không có rủi ro. Các biến chứng chảy máu và, ở mức độ thấp hơn, tràn khí dưới da (không khí len lỏi qua các mô ở cổ) là những hậu quả có thể nghiêm trọng. Do những biến chứng tiềm ẩn này, sự sẵn có của các phương pháp lấy mẫu thay thế, và sự thiếu kinh nghiệm của các bác sĩ với thủ thuật này, chọc hút qua khí quản hiện nay hiếm khi được thực hiện.
|
Dịch tiết khí-phế quản được cung cấp bởi:
|
Nội soi phế quản linh hoạt là một cách phù hợp và trực tiếp để lấy dịch tiết từ cây khí-phế quản. Nó có thêm lợi ích là cho phép quan sát đường thở. Nội soi phế quản có những lợi thế rõ rệt trong việc thu thập vật liệu để phân tích tế bào học vì các mẫu có thể được thu thập từ một khu vực cục bộ được quan sát trực tiếp bằng máy nội soi phế quản. Tuy nhiên, vì dụng cụ đi qua đường hô hấp trên, việc thu thập mẫu để nuôi cấy có thể bị nhiễm bẩn bởi hệ vi sinh vật đường hô hấp trên. Các hệ thống được thiết kế đặc biệt với một bàn chải được bảo vệ có thể làm giảm sự nhiễm bẩn, và việc định lượng vi khuẩn thu được có thể hữu ích trong việc phân biệt sự nhiễm bẩn từ đường hô hấp trên với nhiễm trùng đường hô hấp dưới thực sự.
Rửa phế quản phế nang (BAL) đã trở thành một phương pháp được sử dụng rộng rãi để lấy mẫu từ đường hô hấp dưới. Dịch thu được từ BAL đã được sử dụng khá hiệu quả để phát hiện Pneumocystis jirovecii, đặc biệt ở những bệnh nhân bị hội chứng suy giảm miễn dịch mắc phải (AIDS) hoặc các nguyên nhân suy giảm miễn dịch khác. Trong một số bệnh phổi mô kẽ lan tỏa (xem Chương 9 và 11), phân tích các thành phần tế bào và sinh hóa của BAL có thể cung cấp thông tin hữu ích cho chẩn đoán và cho nghiên cứu về các cơ chế bệnh cơ bản.
Cũng như dịch tiết khí-phế quản, các mẫu mô để kiểm tra vi thể có thể được thu thập bằng nhiều cách. Một bàn chải hoặc một kìm sinh thiết có thể được đưa qua máy nội soi phế quản. Bàn chải thường được sử dụng để cạo tế bào từ bề mặt của một tổn thương đường thở, nhưng nó cũng có thể được đưa sâu hơn vào nhu mô phổi để lấy mẫu trực tiếp từ một khu vực bị bệnh. Kìm sinh thiết được sử dụng theo cách tương tự để lấy mẫu mô từ một tổn thương trong đường thở (sinh thiết nội phế quản) hoặc từ một khu vực bệnh trong nhu mô (sinh thiết xuyên phế quản, được đặt tên như vậy vì kìm phải đâm thủng một phế quản nhỏ để lấy mẫu nhu mô). Trong trường hợp chải phế quản, mẫu dính vào bàn chải được phết lên một lam kính để nhuộm và kiểm tra dưới kính hiển vi. Đối với cả sinh thiết nội phế quản và xuyên phế quản, mô thu được có thể được cố định và cắt lát, và các lam kính có thể được tạo ra để kiểm tra dưới kính hiển vi sau đó.
Một tổn thương hoặc khu vực bệnh trong nhu mô phổi đôi khi cũng có thể được tiếp cận bằng một cây kim qua thành ngực, đặc biệt khi tổn thương ở gần ngoại vi của phổi. Loại sinh thiết này, được gọi là sinh thiết bằng kim xuyên da, thường được thực hiện bằng cách sử dụng hình ảnh CT đồng thời để đảm bảo đặt kim vào khu vực mong muốn. Tùy thuộc vào loại kim được sử dụng, một mẫu nhỏ có thể được chọc hút hoặc lấy bằng sinh thiết. Chảy máu và tràn khí màng phổi là những biến chứng tiềm ẩn, giống như đối với sinh thiết xuyên phế quản qua máy nội soi phế quản.
|
Mẫu sinh thiết phổi có thể được lấy bằng:
|
Mô phổi thường được lấy bằng một thủ thuật phẫu thuật bao gồm một đường vào qua thành ngực. Theo truyền thống, một bác sĩ phẫu thuật sẽ rạch một đường trên thành ngực, cho phép quan sát trực tiếp bề mặt phổi và lấy ra một mảnh nhỏ mô phổi. Loại sinh thiết phổi mở này phần lớn đã được thay thế bằng một thủ thuật ít xâm lấn hơn gọi là nội soi lồng ngực (phẫu thuật lồng ngực có hỗ trợ video hoặc VATS). VATS bao gồm việc đặt một máy nội soi lồng ngực và các dụng cụ sinh thiết qua các vết rạch nhỏ trên thành ngực; một hình ảnh chất lượng cao thu được qua máy nội soi lồng ngực có thể được hiển thị trên màn hình. Bác sĩ phẫu thuật sử dụng hình ảnh video làm hướng dẫn để điều khiển các dụng cụ lấy một mẫu sinh thiết của mô phổi ngoại vi hoặc để loại bỏ một nốt phổi ngoại vi.
Cuối cùng, dịch trong khoang màng phổi thường được lấy mẫu trong việc đánh giá một bệnh nhân bị tràn dịch màng phổi. Một cây kim nhỏ được đưa qua thành ngực và vào khoang màng phổi, thường với sự hướng dẫn của siêu âm, và dịch được rút ra. Dịch có thể được kiểm tra để tìm các tế bào ác tính và vi sinh vật. Phân tích hóa học của dịch (xem Chương 15) thường cung cấp thông tin chẩn đoán hữu ích bổ sung. Một mẫu sinh thiết của bề mặt màng phổi thành (lớp mô lót khoang màng phổi) cũng có thể được lấy một cách mù, với một cây kim đặc biệt được đưa qua thành ngực, hoặc dưới sự quan sát trực tiếp bằng máy nội soi lồng ngực. Mô có thể được sử dụng để kiểm tra vi thể và nghiên cứu vi sinh vật học.
Xử lý mẫu bệnh phẩm
Sau khi các mẫu bệnh phẩm được lấy, các kỹ thuật xử lý và các loại kiểm tra được thực hiện đều giống với những kỹ thuật được sử dụng cho nhiều loại mẫu mô và dịch.
Chẩn đoán nhiễm trùng phổi phụ thuộc vào việc phết và nuôi cấy vật liệu thu được, chẳng hạn như đờm, các mẫu dịch tiết khí-phế quản khác, hoặc dịch màng phổi. Kỹ thuật nhuộm Gram tiêu chuẩn thường cho phép xác định ban đầu các vi sinh vật, và việc kiểm tra có thể tiết lộ các tế bào viêm (đặc biệt là bạch cầu đa nhân trung tính) và các tế bào đường hô hấp trên (tế bào biểu mô vảy), dấu hiệu sau cho thấy sự nhiễm bẩn của đờm bởi dịch tiết đường hô hấp trên. Kết quả nuôi cấy cuối cùng cung cấp nhận dạng xác định của một sinh vật, nhưng kết quả phải luôn được diễn giải với kiến thức rằng mẫu bệnh phẩm có thể bị nhiễm bẩn và những gì được nuôi cấy không nhất thiết liên quan đến nguyên nhân của vấn đề lâm sàng.
Các mẫu bệnh phẩm có thể được xử lý để nhuộm và nuôi cấy vi sinh vật và để kiểm tra tế bào học và mô bệnh học.
Việc xác định vi khuẩn mycobacteria, bao gồm cả tác nhân gây bệnh lao, theo truyền thống đòi hỏi các kỹ thuật nhuộm và nuôi cấy đặc biệt. Vi khuẩn mycobacteria được nhuộm bằng các chất như carbolfuchsin hoặc auramine-rhodamine, và các sinh vật này gần như là duy nhất trong khả năng giữ lại thuốc nhuộm sau khi thêm axit. Do đó, thuật ngữ trực khuẩn kháng axit (acid-fast bacilli) thường được sử dụng khi đề cập đến mycobacteria. Các phương pháp nhuộm thường được sử dụng là nhuộm Ziehl-Neelsen hoặc một biến thể gọi là nhuộm Kinyoun. Một cách nhạy hơn và nhanh hơn để phát hiện mycobacteria bao gồm việc sử dụng một thuốc nhuộm huỳnh quang như auramine-rhodamine. Vi khuẩn mycobacteria hấp thụ thuốc nhuộm và phát huỳnh quang và có thể được phát hiện tương đối dễ dàng ngay cả khi có số lượng nhỏ. Vì mycobacteria phát triển chậm, chúng có thể cần 6 đến 8 tuần để phát triển và nhận dạng trên môi trường nuôi cấy. Gần đây hơn, các đầu dò di truyền đã được sử dụng để xác định sự hiện diện của các loài mycobacteria cụ thể với tốc độ và độ chính xác cao hơn nhiều (xem sau). Tuy nhiên, nuôi cấy thường vẫn được thực hiện để xác nhận kết quả xét nghiệm di truyền ban đầu và để cho phép kiểm tra độ nhạy cảm với thuốc.
Các sinh vật khác ngoài các mầm bệnh vi khuẩn thông thường và mycobacteria thường đòi hỏi các kỹ thuật nhuộm và nuôi cấy chuyên biệt khác. Nấm có thể được chẩn đoán bằng các thuốc nhuộm đặc biệt, chẳng hạn như nhuộm bạc methenamine hoặc nhuộm periodic acid-Schiff, áp dụng cho các mẫu mô. Nấm cũng có thể được nuôi cấy trên các môi trường đặc biệt thuận lợi cho sự phát triển của chúng. P. jirovecii, một mầm bệnh hiện được phân loại là một loại nấm độc nhất (xem Chương 26) và phổ biến nhất ở những bệnh nhân có cơ chế phòng vệ bị suy giảm, được nhuộm trong mô và dịch tiết khí-phế quản bằng nhuộm bạc methenamine, toluidine blue, hoặc Giemsa. Một phương pháp nhuộm miễn dịch huỳnh quang sử dụng kháng thể đơn dòng chống lại Pneumocystis đặc biệt nhạy để phát hiện sinh vật này trong đờm và dịch BAL.
Sinh vật được xác định vào năm 1976 là Legionella pneumophila, tác nhân gây bệnh Legionnaires, có thể được chẩn đoán bằng phương pháp tẩm bạc hoặc nhuộm miễn dịch huỳnh quang. Sinh vật này cũng có thể được nuôi cấy (khó khăn) trên một số môi trường đặc biệt.
Kiểm tra tế bào học để tìm các tế bào ác tính có sẵn cho đờm khạc ra, các mẫu thu được bằng chọc hút bằng kim, dịch rửa phế quản hoặc chải phế quản thu được bằng máy nội soi phế quản, và dịch màng phổi. Một mẫu có thể được phết trực tiếp lên một lam kính (như với chải phế quản), được cô đặc (dịch rửa phế quản, dịch màng phổi), hoặc được tiêu hóa (đờm) trước khi được phết lên lam kính. Lam kính sau đó được nhuộm bằng kỹ thuật Papanicolaou, và các tế bào được kiểm tra để tìm các dấu hiệu gợi ý hoặc chẩn đoán ác tính.
Kiểm tra bệnh học của các lát cắt mô thu được bằng sinh thiết là hữu ích nhất để chẩn đoán ác tính hoặc nhiễm trùng, cũng như cho một loạt các quá trình khác ảnh hưởng đến phổi và màng phổi. Trong nhiều trường hợp, kiểm tra mô thu được bằng sinh thiết là tiêu chuẩn vàng để chẩn đoán, mặc dù ngay cả kết quả sinh thiết cũng có thể cho thấy các kết quả âm tính giả hoặc mang lại thông tin gây hiểu lầm. Mô thu được bằng sinh thiết thường được nhuộm bằng hematoxylin và eosin để kiểm tra mô học. Có một loạt các loại thuốc nhuộm khác có sẵn để nhuộm đặc hiệu collagen, elastin, và một loạt các vi sinh vật. Các phương pháp nhuộm hóa mô miễn dịch được áp dụng cho các khối u mới trong phổi rất hữu ích để xác định và mô tả các khối u cụ thể, và việc xét nghiệm các đột biến di truyền có thể giúp định hướng điều trị một số loại ung thư phổi, như đã thảo luận trong Chương 21.
Gần đây, các kỹ thuật sinh học phân tử hiện đại đã được áp dụng cho các mẫu hô hấp để chẩn đoán một số loại nhiễm trùng đường hô hấp. Khi so sánh với các phương pháp nuôi cấy truyền thống, các ưu điểm của kỹ thuật phân tử bao gồm phát hiện nhanh và nhận dạng đặc hiệu của mầm bệnh, cũng như giảm thiểu nguy cơ cho nhân viên phòng thí nghiệm khi tiếp xúc với các mầm bệnh đang phát triển. Các kỹ thuật dựa trên khuếch đại axit nucleic có thể được sử dụng trực tiếp trên các mẫu hô hấp để phát hiện nhanh (3-4 giờ) DNA hoặc RNA của một số mầm bệnh. Ví dụ, phản ứng chuỗi polymerase (PCR) sử dụng các chuỗi “mồi” oligonucleotide tổng hợp đặc hiệu và DNA polymerase để khuếch đại DNA duy nhất cho một sinh vật cụ thể. Nếu chuỗi DNA mục tiêu cụ thể có mặt, ngay cả khi chỉ từ một sinh vật duy nhất, việc khuếch đại tuần tự cho phép sản xuất hàng triệu bản sao có thể được phát hiện bằng điện di gel. Kỹ thuật này có thể được áp dụng cho các mẫu như đờm và BAL, cung cấp một xét nghiệm cực kỳ nhạy để xác định các sinh vật như mycobacteria, P. jirovecii, và cytomegalovirus. Ngoài ra, các đầu dò lai oligonucleotide cho phép nhận dạng nhanh các sinh vật đã được nuôi cấy từ các mẫu lâm sàng. Các kỹ thuật phân tử mới hơn này đang trở nên sẵn có hơn và đã được sử dụng lâm sàng ngày càng nhiều theo thời gian.
ĐÁNH GIÁ Ở CẤP ĐỘ CHỨC NĂNG
Đánh giá phổi ở cấp độ đại thể hoặc vi thể nhằm mục đích chẩn đoán bệnh phổi, nhưng cả hai đều không thể xác định mức độ suy giảm chức năng phổi bình thường. Khía cạnh cuối cùng này của việc đánh giá bổ sung một chiều kích quan trọng cho việc đánh giá bệnh nhân tổng thể vì nó phản ánh mức độ bệnh có thể hạn chế các hoạt động hàng ngày. Hai phương pháp phổ biến nhất để xác định tình trạng chức năng của bệnh nhân là đo chức năng hô hấp và đánh giá trao đổi khí (sử dụng khí máu động mạch hoặc đo oxy qua mạch). Ngoài ra, một loạt các phép đo được thực hiện trong quá trình gắng sức có thể giúp xác định mức độ gắng sức mà bệnh nhân có thể thực hiện và những yếu tố nào góp phần vào bất kỳ sự hạn chế gắng sức nào.
Đo chức năng hô hấp
Đo chức năng hô hấp cung cấp một phương pháp khách quan để đánh giá những thay đổi chức năng ở một bệnh nhân đã biết hoặc nghi ngờ mắc bệnh phổi. Với kết quả của các xét nghiệm có sẵn rộng rãi, bác sĩ có thể trả lời một số câu hỏi: (1) Bệnh nhân có bệnh phổi đáng kể đủ để gây suy giảm hô hấp và giải thích cho các triệu chứng của họ không? (2) Bệnh nhân có dạng bệnh phổi chức năng nào—bệnh hạn chế hay bệnh tắc nghẽn? Ngoài ra, việc đánh giá hàng loạt chức năng phổi cho phép bác sĩ định lượng bất kỳ sự cải thiện hoặc xấu đi nào trong tình trạng chức năng của bệnh nhân. Thông tin thu được từ việc đánh giá khách quan như vậy có thể là cần thiết trong việc quyết định khi nào điều trị cho bệnh nhân mắc bệnh phổi và trong việc đánh giá xem bệnh nhân có đáp ứng với điều trị hay không. Đánh giá trước phẫu thuật của bệnh nhân có thể hữu ích trong việc dự đoán bệnh nhân nào có khả năng gặp các vấn đề hô hấp đáng kể sau phẫu thuật và bệnh nhân nào có khả năng có đủ chức năng phổi sau khi cắt phổi.
|
Ba loại thông tin chính có thể thu được bằng đo chức năng hô hấp thông thường:
|
Trước khi xem xét cách các xét nghiệm này chỉ ra loại bệnh phổi chức năng mà bệnh nhân mắc phải, chúng ta mô tả ngắn gọn về chính các xét nghiệm và cách chúng được thực hiện.
Thể tích phổi
Mặc dù phổi có thể được chia thành các khoang theo nhiều cách khác nhau, bốn thể tích đặc biệt quan trọng (Hình 3.17):
- Dung tích toàn phổi (TLC): tổng thể tích khí trong phổi sau một lần hít vào tối đa
- Thể tích khí cặn (RV): thể tích khí còn lại trong phổi sau một lần thở ra tối đa
- Dung tích sống (VC): thể tích khí thở ra khi đi từ TLC đến RV
- Dung tích cặn chức năng (FRC): thể tích khí trong phổi ở trạng thái nghỉ—nghĩa là, vào cuối thì thở ra trong kiểu thở thông thường
VC có thể được đo bằng cách cho bệnh nhân thở ra vào một phế dung kế từ TLC xuống RV. Theo định nghĩa, thể tích thở ra theo cách này là VC. Tuy nhiên, vì RV, FRC, và TLC đều bao gồm lượng khí còn lại trong phổi ngay cả sau một lần thở ra tối đa, những thể tích này không thể được xác định đơn giản bằng cách cho bệnh nhân thở vào một phế dung kế. Để định lượng những thể tích này, một loạt các phương pháp có thể đo một trong ba thể tích, và hai thể tích còn lại sau đó có thể được tính toán hoặc suy ra từ đường ghi phế dung. Hai phương pháp được mô tả ở đây:
- Xét nghiệm pha loãng: Một thể tích đã biết của một khí trơ (thường là heli) ở một nồng độ đã biết được hít vào phổi. Khí này được pha loãng bởi thể tích khí đã có sẵn trong phổi, và nồng độ của khí thở ra (so với khí hít vào), do đó, phản ánh thể tích khí ban đầu trong phổi.
- Phế thân ký (Body plethysmography): Bệnh nhân, ngồi trong một hộp kín khí, thực hiện một thao tác gây ra sự giãn nở và nén khí trong lồng ngực. Bằng cách đo những thay đổi về thể tích và áp suất và bằng cách áp dụng định luật Boyle, thể tích khí trong lồng ngực có thể được tính toán.
Thể tích phổi được xác định bằng phế dung kế và hoặc là pha loãng khí hoặc là phế thân ký.
Trong nhiều trường hợp, các phương pháp pha loãng là đủ để xác định thể tích phổi. Tuy nhiên, đối với những bệnh nhân có các khoảng không khí trong phổi không thông với cây phế quản (ví dụ, các bóng khí), khí hít vào không được pha loãng trong những khu vực không thông này, và các thể tích phổi được đo bằng các phương pháp pha loãng sẽ thấp giả. Trong những tình huống như vậy, phế thân ký cho một phản ánh chính xác hơn về thể tích khí trong lồng ngực vì nó không phụ thuộc vào sự thông thương sẵn sàng của tất cả các khoảng không khí ngoại vi với cây phế quản.
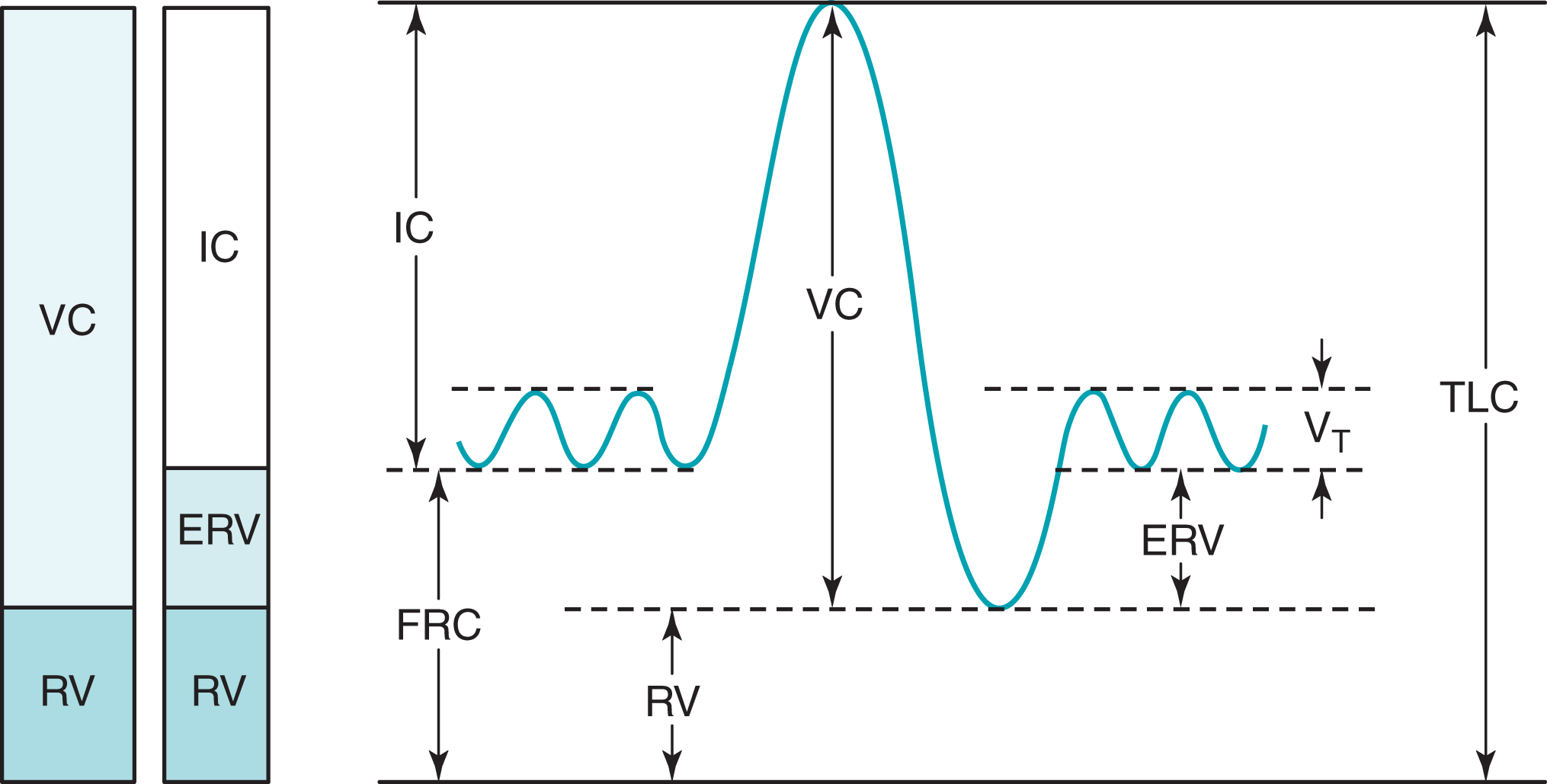
Hình 3.17 Các khoang phụ của phổi (thể tích phổi). Phải, Các thể tích phổi được ghi nhãn trên đường ghi phế dung. Trái, Các sơ đồ khối cho thấy hai cách mà dung tích toàn phổi có thể được chia nhỏ. ERV, thể tích dự trữ thở ra; FRC, dung tích cặn chức năng; IC, dung tích hít vào; RV, thể tích khí cặn; TLC, dung tích toàn phổi; VC, dung tích sống; , thể tích khí lưu thông.
Lưu lượng
Đo lường lưu lượng trong đo chức năng hô hấp thông thường bao gồm việc đánh giá luồng khí trong quá trình thở ra gắng sức tối đa—nghĩa là, với việc bệnh nhân thổi ra càng mạnh và càng nhanh càng tốt từ TLC xuống RV. Thể tích thở ra trong giây đầu tiên của một thao tác thở ra gắng sức như vậy được gọi là thể tích thở ra gắng sức trong 1 giây () (Hình 3.18). Khi diễn giải các kết quả đo chức năng hô hấp, thường được so sánh với VC, hoặc với VC được đo đặc biệt trong thao tác thở ra gắng sức, được gọi là dung tích sống gắng sức (FVC). Trong việc diễn giải lưu lượng, tỷ lệ giữa hai phép đo này (/VC hoặc /FVC) là con số quan trọng nhất được sử dụng để xác định sự hiện diện của tắc nghẽn luồng khí.
Một thông số khác thường được tính toán từ thao tác thở ra gắng sức là lưu lượng thở ra tối đa giữa kỳ (MMFR), là tốc độ luồng khí trong nửa giữa của quá trình thở ra (giữa 25% và 75% thể tích thở ra trong FVC). MMFR thường được gọi là lưu lượng thở ra gắng sức (FEF) giữa 25% và 75% của VC (). MMFR hoặc là một chỉ số tương đối nhạy của tắc nghẽn luồng khí và có thể bất thường khi tỷ lệ /FVC vẫn còn được bảo tồn.
Luồng khí thở ra tối đa được đánh giá bằng tỷ lệ /FVC (hoặc /VC) và MMFR ().
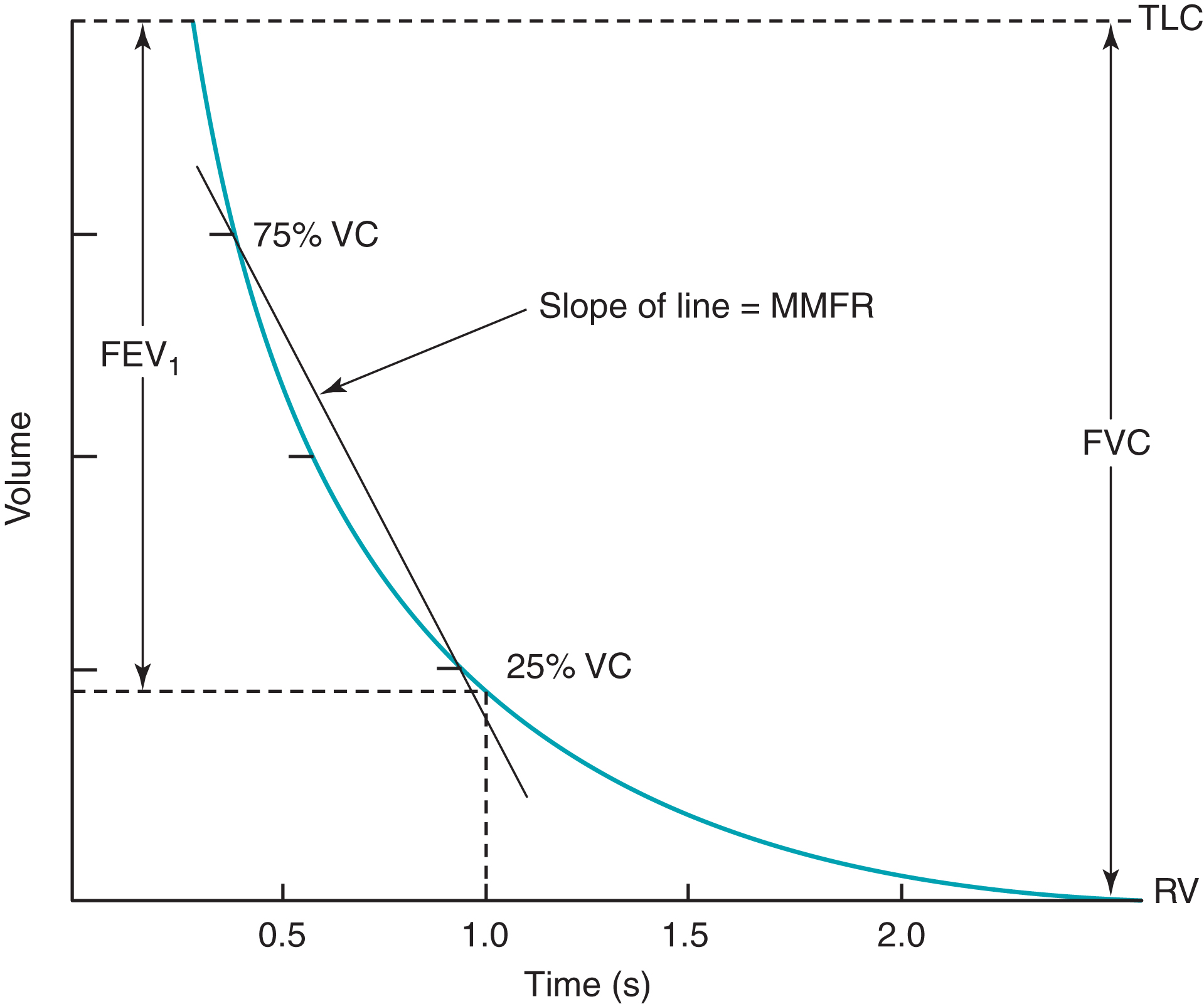
Hình 3.18 Biểu đồ phế dung gắng sức. Thể tích được vẽ theo thời gian trong khi bệnh nhân thở ra càng mạnh và càng nhanh càng tốt từ dung tích toàn phổi (TLC) đến thể tích khí cặn (RV). , thể tích thở ra gắng sức trong 1 giây; FVC, dung tích sống gắng sức; MMFR, lưu lượng thở ra tối đa giữa kỳ (còn được gọi là lưu lượng thở ra gắng sức từ 25%-75% []); VC, dung tích sống.
Khả năng khuếch tán
Khả năng khuếch tán là một phép đo tốc độ chuyển khí từ phế nang đến hemoglobin trong mao mạch, được đo liên quan đến áp suất thúc đẩy của khí qua màng phế nang-mao mạch. Nồng độ nhỏ của carbon monoxide thường được sử dụng cho mục đích này. Carbon monoxide kết hợp dễ dàng với hemoglobin, và tốc độ chuyển khí từ phế nang đến hemoglobin phụ thuộc vào sự di chuyển qua màng phế nang-mao mạch và lượng hemoglobin có sẵn để liên kết với carbon monoxide.
Phép đo thu được trong xét nghiệm khả năng khuếch tán chủ yếu phụ thuộc vào số lượng các đơn vị phế nang-mao mạch hoạt động—nghĩa là, diện tích bề mặt có sẵn cho trao đổi khí và thể tích máu (hemoglobin) trong các mao mạch phổi có sẵn để liên kết với carbon monoxide. Bởi vì sự hấp thu carbon monoxide của hemoglobin phụ thuộc vào nồng độ hemoglobin trong máu, bệnh nhân thiếu máu có thể có kết quả đo khả năng khuếch tán bị giảm ngay cả khi phổi bình thường. Do đó, giá trị quan sát được thường được hiệu chỉnh theo mức hemoglobin của bệnh nhân.
Trong thực hành, khả năng khuếch tán thường giảm trong ba loại bệnh trong đó diện tích bề mặt cho trao đổi khí bị mất, thể tích máu mao mạch phổi bị giảm, hoặc cả hai: (1) khí phế thũng, (2) bệnh phổi mô kẽ lan tỏa, và (3) bệnh mạch máu phổi. Trong các rối loạn chỉ ảnh hưởng đến đường thở mà không ảnh hưởng đến mô nhu mô phổi (ví dụ, hen suyễn, viêm phế quản mạn tính), khả năng khuếch tán thường được bảo tồn. Mặt khác, khả năng khuếch tán có thể tăng trong các trường hợp xuất huyết nội phế quản gần đây do sự hấp thu carbon monoxide của hemoglobin trong các hồng cầu trong các khoang phế nang.
Khả năng khuếch tán của carbon monoxide phần lớn phụ thuộc vào diện tích bề mặt cho trao đổi khí và thể tích máu mao mạch phổi.
Diễn giải tính Bình thường trong Đo chức năng hô hấp
Việc diễn giải các kết quả đo chức năng hô hấp nhất thiết phải bao gồm một sự phán đoán định tính về tính bình thường hoặc bất thường dựa trên dữ liệu định lượng thu được từ các xét nghiệm này. Để đi đến một phán đoán tương đối khách quan, các giá trị của bệnh nhân được so sánh với các tiêu chuẩn bình thường được thiết lập cho mỗi xét nghiệm, dựa trên các phép đo ở một số lượng lớn các đối tượng đối chứng không hút thuốc, không có triệu chứng và không có bệnh tim phổi đã biết. Các phương trình hồi quy riêng cho nam và nữ đã được xây dựng để phù hợp với dữ liệu thu được từ những đối tượng đối chứng bình thường này. Một giá trị “bình thường” hoặc dự đoán cho một xét nghiệm ở một bệnh nhân nhất định có thể được xác định bằng cách nhập tuổi và chiều cao của bệnh nhân vào phương trình hồi quy thích hợp. Các phương trình riêng biệt cho từng chủng tộc/sắc tộc có thể được sử dụng vì dữ liệu dân số cho thấy sự khác biệt nhỏ về chức năng phổi ở những người bình thường thuộc các chủng tộc và sắc tộc khác nhau. Mặc dù mục đích là để đảm bảo so sánh mỗi cá nhân với một tiêu chuẩn bình thường có liên quan, các nghiên cứu trước đây đã không giải thích rõ ràng sự đóng góp của các yếu tố xã hội quyết định sức khỏe. Do đó, tính hữu dụng của các phương trình theo chủng tộc/sắc tộc còn gây tranh cãi.
Các tiêu chuẩn để xác định những gì cấu thành “giới hạn dưới của bình thường” cho một xét nghiệm cụ thể khác nhau giữa các phòng thí nghiệm. Hầu hết các phòng thí nghiệm hiện nay coi các giá trị dưới bách phân vị thứ 5 của một nhóm tham chiếu bình thường (còn được gọi là “khoảng tin cậy 95%”) là bất thường, trong khi những phòng thí nghiệm khác coi một giá trị quan sát được là bất thường nếu nó nhỏ hơn 80% giá trị dự đoán. Bất kể tiêu chí nào được sử dụng, tất cả dữ liệu phải được xem xét để xác định xem các dạng nhất định có hiện diện một cách nhất quán hay không. Việc diễn giải bất kỳ xét nghiệm nào một cách riêng lẻ, với giả định rằng một bệnh nhân có giá trị 79% là mắc bệnh phổi, nhưng một bệnh nhân có giá trị 81% là không có bệnh, rõ ràng là nguy hiểm.
Theo quy tắc chung, tỷ lệ /VC hoặc /FVC bình thường là 0,70 hoặc lớn hơn. Điều này có nghĩa là một cá nhân không bị bệnh phổi tắc nghẽn, trong giây đầu tiên của một lần thở ra tối đa, có thể thở ra ít nhất 70% tổng thể tích thở ra. Tuy nhiên, vì tỷ lệ bình thường có thể giảm theo tuổi, giá trị thực tế lý tưởng nên được coi là bất thường nếu nó nhỏ hơn khoảng tin cậy 95% cho tuổi của bệnh nhân đó.
Các dạng Suy giảm Chức năng Phổi
Trong phân tích đo chức năng hô hấp, các bất thường thường được phân loại thành một trong hai dạng (hoặc một sự kết hợp của cả hai): (1) một dạng tắc nghẽn, đặc trưng chủ yếu bởi sự tắc nghẽn luồng khí, và (2) một dạng hạn chế, với bằng chứng về việc giảm thể tích phổi nhưng không có tắc nghẽn luồng khí.
Một dạng tắc nghẽn, như thấy ở những bệnh nhân bị hen suyễn, viêm phế quản mạn tính, và khí phế thũng, bao gồm sự giảm các tốc độ luồng khí thở ra và thường biểu hiện dưới dạng giảm tỷ lệ /FVC, đi kèm với sự giảm MMFR () (Hình 3.19). Thường có một RV cao và một tỷ lệ RV/TLC tăng, cho thấy sự bẫy khí do đóng cửa các đường thở trong quá trình thở ra gắng sức (Hình 3.20). Tăng thông khí, được phản ánh bởi TLC tăng, thường được tìm thấy ở những bệnh nhân bị khí phế thũng. Khả năng khuếch tán giảm ở những bệnh nhân bị mất giường mao mạch phế nang (như thấy trong khí phế thũng) nhưng không ở những người không bị mất diện tích bề mặt có sẵn cho trao đổi khí (như trong viêm phế quản mạn tính và hen suyễn).
Ở một bệnh nhân có bằng chứng về tắc nghẽn luồng khí, các xét nghiệm bổ sung thường được thực hiện để đánh giá xem sự tắc nghẽn có thể phục hồi ít nhất một phần với một thuốc giãn phế quản dạng hít hay không, điển hình là một chất chủ vận β. Sự cải thiện hoặc khả năng phục hồi có ý nghĩa lâm sàng với thuốc giãn phế quản được cho là có mặt nếu hoặc FVC cải thiện so với ban đầu ít nhất 10% giá trị dự đoán.
Một dạng hạn chế được xác định bởi TLC thấp, và dấu hiệu đặc trưng của bệnh hạn chế là sự giảm thể tích phổi, mặc dù luồng khí thở ra là bình thường (xem Hình 3.20). Do đó, ngoài TLC, các thể tích khác (RV, VC, và FRC) đều có xu hướng giảm, trong khi MMFR và /FVC được bảo tồn. Ở một số bệnh nhân bị mất thể tích đáng kể do bệnh hạn chế, MMFR bị giảm vì có ít thể tích hơn để tạo ra một lưu lượng cao. Việc diễn giải một MMFR thấp khi có bệnh hạn chế đáng kể là khó khăn trừ khi MMFR rõ ràng giảm không tương xứng với sự giảm thể tích phổi.
|
Các dạng suy giảm:
|
Một loạt các bệnh về nhu mô, màng phổi, thần kinh cơ, và thành ngực có thể cho thấy một dạng hạn chế. Một số manh mối hữu ích trong việc phân biệt giữa các nguyên nhân gây hạn chế này. Ví dụ, sự giảm khả năng khuếch tán của carbon monoxide cho thấy sự mất mát các đơn vị phế nang-mao mạch và hướng tới bệnh phổi mô kẽ lan tỏa là nguyên nhân của dạng hạn chế. Việc tìm thấy một RV tương đối cao có thể cho thấy hoặc là yếu cơ thở ra hoặc là một bất thường thành ngực làm cho lồng ngực đặc biệt cứng (kém giãn nở) ở các thể tích thấp.
Mặc dù các bệnh phổi thường xảy ra với một trong hai dạng này, một hình ảnh hỗn hợp của bệnh tắc nghẽn và hạn chế có thể hiện diện, làm cho việc diễn giải các xét nghiệm phức tạp hơn nhiều. Các xét nghiệm này không phản ánh trực tiếp khả năng tổng thể của bệnh nhân trong việc trao đổi và , vốn được đánh giá bằng cách đo khí máu động mạch. Một hướng dẫn đơn giản để diễn giải các kết quả đo chức năng hô hấp được trình bày cùng với một số bài toán mẫu trong Phụ lục B.
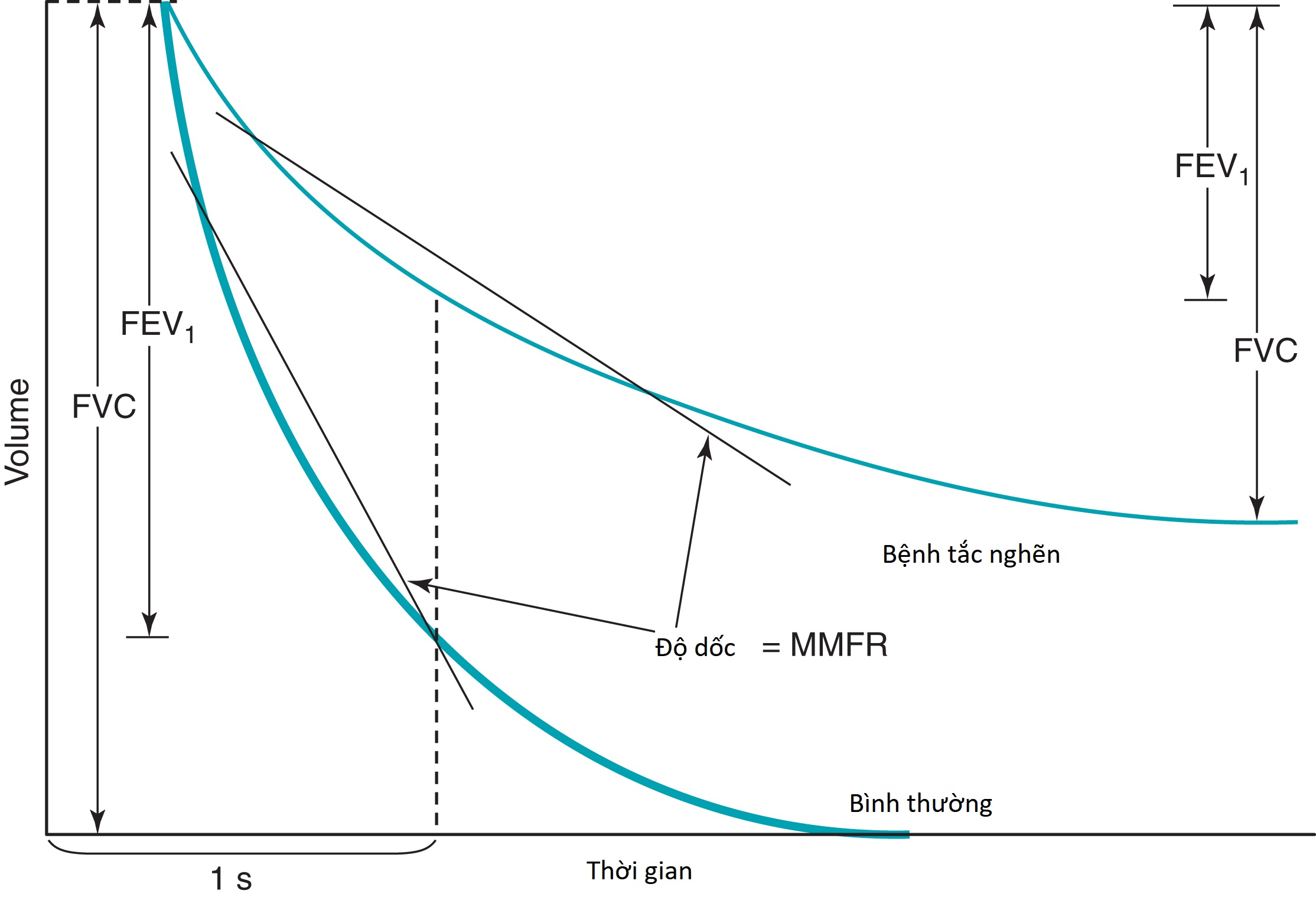
Hình 3.19 Biểu đồ phế dung gắng sức ở một người bình thường và một bệnh nhân bị tắc nghẽn luồng khí. Lưu ý thì thở ra kéo dài và những thay đổi trong dung tích sống gắng sức (FVC) và thể tích thở ra gắng sức trong 1 giây () ở một bệnh nhân bị bệnh tắc nghẽn. MMFR, lưu lượng thở ra tối đa giữa kỳ.
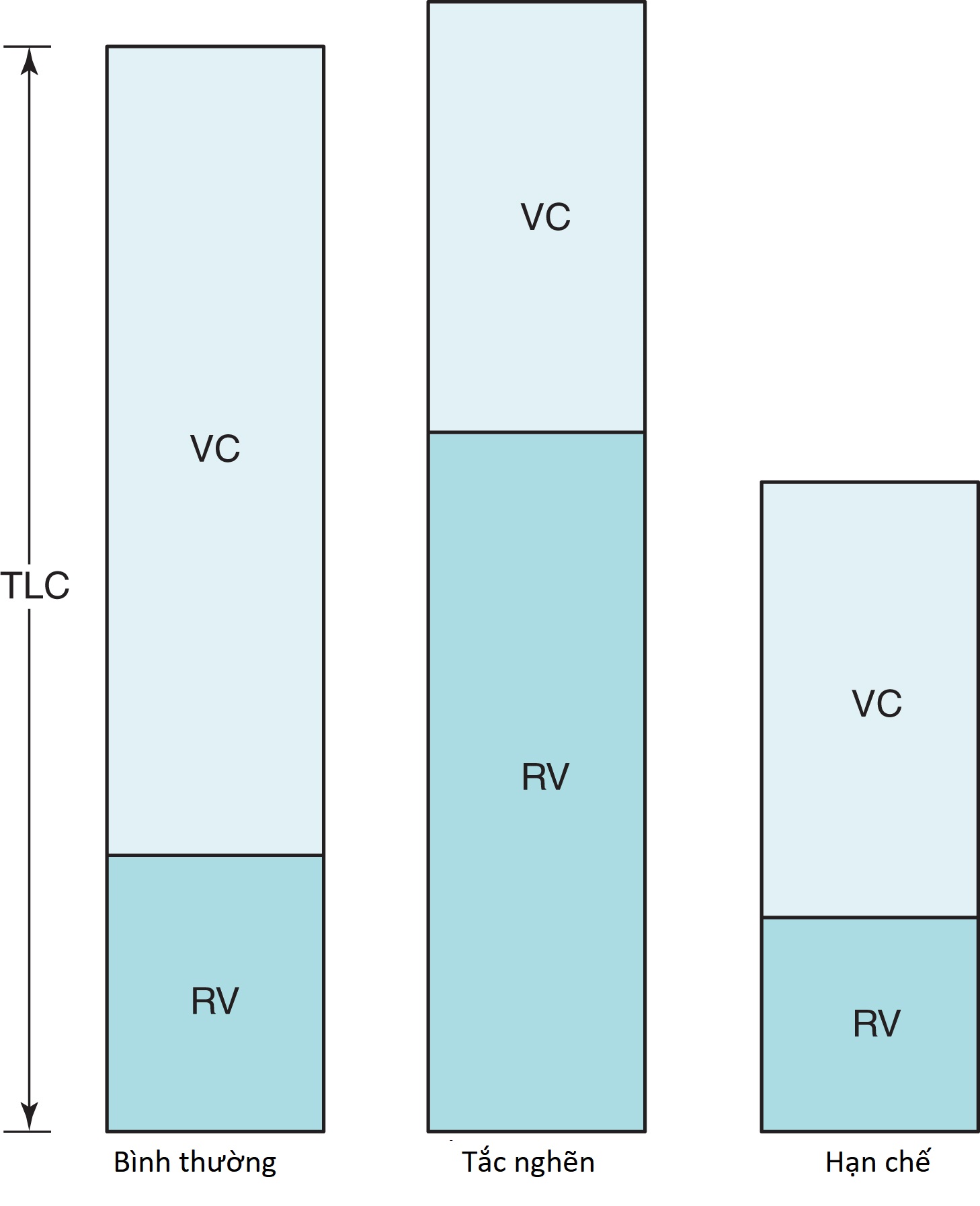
Hình 3.20 Sơ đồ các thể tích phổi (dung tích toàn phổi [TLC] và các khoang phụ của nó, dung tích sống (VC) và thể tích khí cặn (RV)) ở một người bình thường và các bệnh nhân bị bệnh tắc nghẽn và hạn chế.
Các xét nghiệm khác
Một lượng đáng kể công việc đã được thực hiện trong quá khứ để phát triển các xét nghiệm phát hiện sớm tắc nghẽn luồng khí, đặc biệt khi đó là do tắc nghẽn đường thở nhỏ hoặc ngoại vi. Các xét nghiệm như vậy bao gồm vòng lặp lưu lượng-thể tích thở ra tối đa, phân tích thể tích đóng, và độ giãn nở động phụ thuộc tần số. Thật không may, các nghiên cứu bệnh học đã cho thấy rằng mối tương quan giữa các xét nghiệm về “chức năng đường thở nhỏ” và sự hiện diện thực sự của bệnh trong các đường thở nhỏ (như được chứng minh bằng các mẫu mô bệnh học) là không nhất quán, làm cho giá trị của các xét nghiệm này không rõ ràng.
Mặc dù có hạn chế này, vòng lặp lưu lượng-thể tích thở ra tối đa là một xét nghiệm có đủ khả năng ứng dụng lâm sàng thông thường để đảm bảo một cuộc thảo luận ngắn ở đây. Vòng lặp lưu lượng-thể tích là một bản ghi đồ họa của các thao tác hít vào tối đa và thở ra tối đa. Tuy nhiên, thay vì biểu đồ thể tích theo thời gian được cung cấp với các xét nghiệm phế dung thông thường, vòng lặp lưu lượng-thể tích có một biểu đồ lưu lượng (trên trục Y) theo thể tích (trên trục X). Mặc dù các lưu lượng ban đầu thu được trong phần đầu của một thao tác thở ra gắng sức phụ thuộc vào nỗ lực, các lưu lượng trong phần sau của thao tác là độc lập với nỗ lực và chủ yếu phản ánh các đặc tính cơ học của phổi và sức cản đối với luồng khí. Ở những bệnh nhân có bằng chứng về tắc nghẽn luồng khí, các tốc độ lưu lượng ở một thể tích nhất định bị giảm, thường làm cho đường cong có dạng “lõm” hoặc cong. Dữ liệu lưu lượng thu được từ các vòng lặp lưu lượng-thể tích thở ra tối đa có thể được diễn giải một cách định lượng (so sánh các tốc độ lưu lượng quan sát được ở các thể tích cụ thể với các giá trị dự đoán) hoặc định tính (phân tích trực quan hình dạng và độ lõm của phần thở ra của đường cong). Khi các thông số phế dung thông thường phản ánh tắc nghẽn luồng khí (/FVC, MMFR) là bất thường, vòng lặp lưu lượng-thể tích thường là bất thường. Tuy nhiên, ở những bệnh nhân bị tắc nghẽn luồng khí sớm, có lẽ cục bộ ở các đường thở nhỏ, đường viền của phần cuối của đường cong thở ra có thể bất thường ngay cả khi tỷ lệ /FVC là bình thường. Ví dụ về các vòng lặp lưu lượng-thể tích ở một bệnh nhân bình thường và ở một bệnh nhân bị bệnh phổi tắc nghẽn được thể hiện trong Hình 3.21.
Trong bệnh phổi tắc nghẽn, phần thở ra của đường cong lưu lượng-thể tích thường có dạng “lõm” hoặc cong.
Một ứng dụng quan trọng khác của các vòng lặp lưu lượng-thể tích là để chẩn đoán và xác định vị trí tắc nghẽn đường thở trên. Bằng cách phân tích đường viền của các phần hít vào và thở ra của đường cong, sự tắc nghẽn có thể được phân loại là cố định hoặc thay đổi, cũng như trong lồng ngực hoặc ngoài lồng ngực. Trong một tổn thương cố định, những thay đổi trong áp suất màng phổi không ảnh hưởng đến mức độ tắc nghẽn, và một sự giới hạn trong lưu lượng không khí đỉnh (một cao nguyên) được thấy trên cả phần hít vào và thở ra của đường cong. Trong một tổn thương thay đổi, mức độ tắc nghẽn được xác định bởi vị trí của tổn thương và tác động của sự thay đổi áp suất màng phổi và đường thở khi hít vào và thở ra (Hình 3.22). Một tổn thương thay đổi trong lồng ngực được đặc trưng bởi sự giới hạn luồng khí thở ra và một cao nguyên trên phần thở ra của đường cong lưu lượng-thể tích, trong khi một tổn thương thay đổi ngoài lồng ngực cho thấy sự giới hạn luồng khí hít vào và một cao nguyên trên phần hít vào của đường cong lưu lượng-thể tích (Hình 3.23).
Tắc nghẽn đường thở trên có thể được đánh giá và mô tả bằng các đường cong lưu lượng-thể tích hít vào và thở ra tối đa.
Một xét nghiệm lưu lượng không khí dễ dàng và không tốn kém thường được sử dụng trong thực hành lâm sàng, đặc biệt ở những bệnh nhân bị hen suyễn như một phương pháp để theo dõi mức độ nghiêm trọng của bệnh, là lưu lượng đỉnh thở ra. Khi thực hiện xét nghiệm này, bệnh nhân thổi ra từ TLC càng mạnh và càng nhanh càng tốt vào một thiết bị đơn giản, sẵn có ghi lại lưu lượng thở ra tối đa (hoặc đỉnh) đạt được. Bệnh nhân bị hen suyễn thường thực hiện và ghi lại các phép đo hàng loạt của xét nghiệm tại nhà như một cách để tự theo dõi bệnh của mình. Một sự sụt giảm đáng kể trong lưu lượng đỉnh so với mức cơ bản thông thường thường cho thấy một đợt kịch phát của bệnh và sự cần thiết phải leo thang hoặc tăng cường chế độ điều trị.
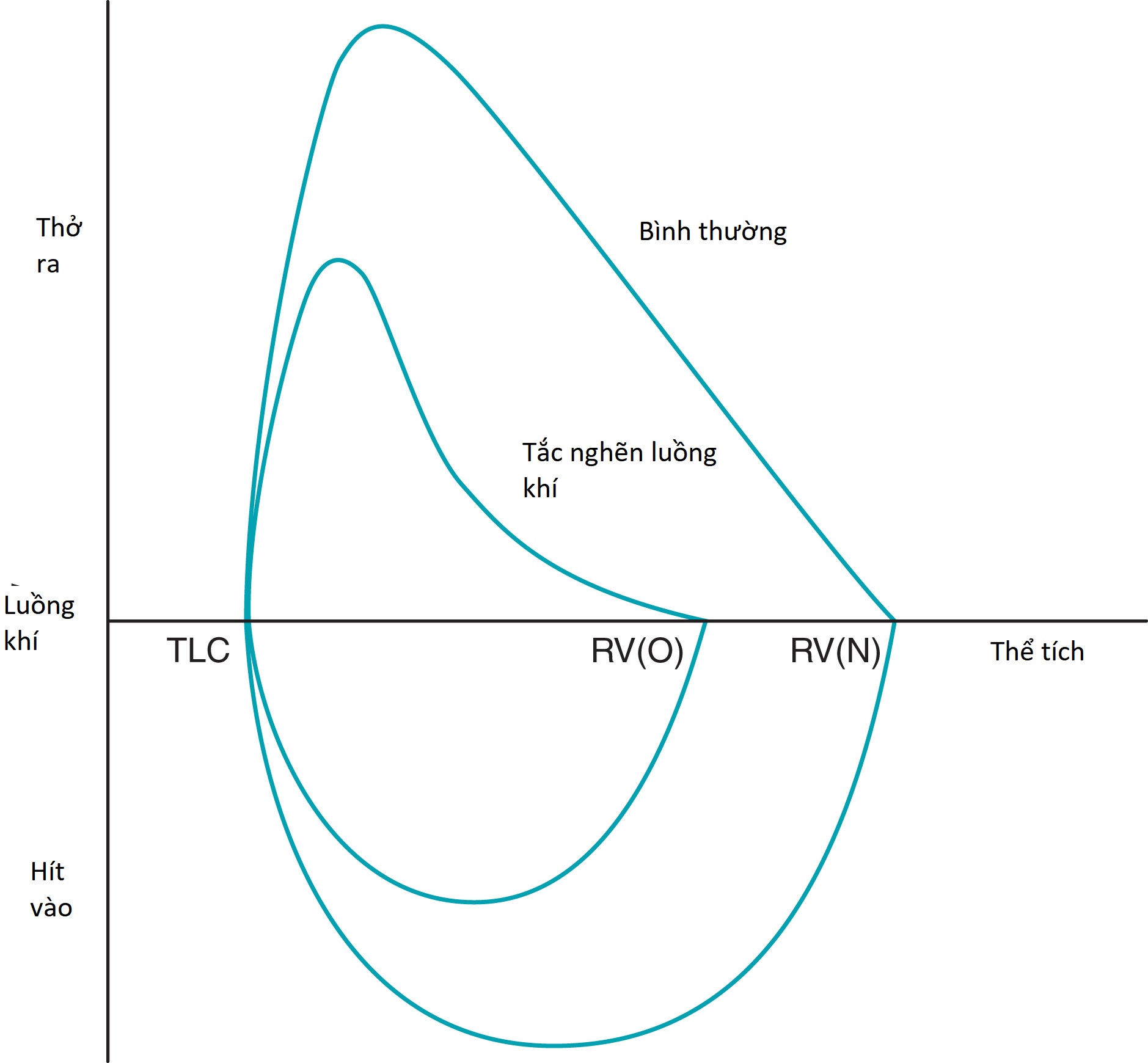
Hình 3.21 Vòng lặp lưu lượng-thể tích ở một người bình thường và một bệnh nhân bị tắc nghẽn luồng khí. Phần “lõm” thở ra rõ ràng trên đường ghi của một bệnh nhân bị tắc nghẽn luồng khí. , thể tích khí cặn ở người bình thường; , thể tích khí cặn ở bệnh nhân bị bệnh tắc nghẽn; TLC, dung tích toàn phổi.
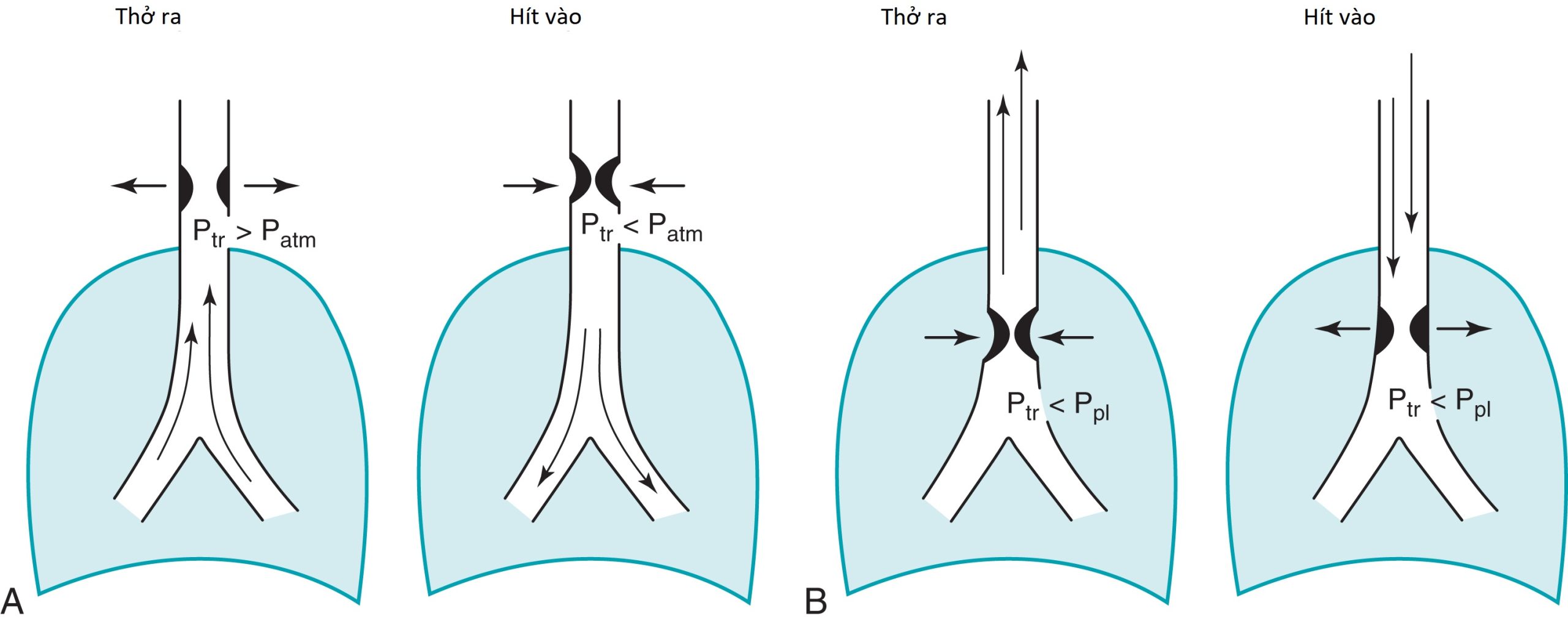
Hình 3.22 Ảnh hưởng của pha hô hấp đến tắc nghẽn đường thở trên. A, Tắc nghẽn thay đổi ngoài lồng ngực. Trong quá trình hít vào gắng sức, áp suất đường thở hoặc khí quản () trở nên âm hơn so với áp suất khí quyển xung quanh (), và đường kính đường thở giảm. Trong quá trình thở ra gắng sức, áp suất trong khí quản dương hơn làm giãn nở đường thở và giảm mức độ tắc nghẽn. B, Tắc nghẽn thay đổi trong lồng ngực. Áp suất màng phổi () bao quanh và tác động lên các đường thở lớn trong lồng ngực, ảnh hưởng đến đường kính đường thở. Trong quá trình thở ra gắng sức, áp suất màng phổi dương rõ rệt, và đường kính đường thở bị giảm. Trong quá trình hít vào gắng sức, áp suất màng phổi âm làm cho các đường thở trong lồng ngực tăng kích thước, và tắc nghẽn giảm. (Từ Kryger, M., Bode, F., Antic, R., & Anthonisen, N. (1976). Diagnosis of obstruction of the upper and lower airways. American Journal of Medicine, 61, 85-93, với sự cho phép của Excerpta Medica Inc.)
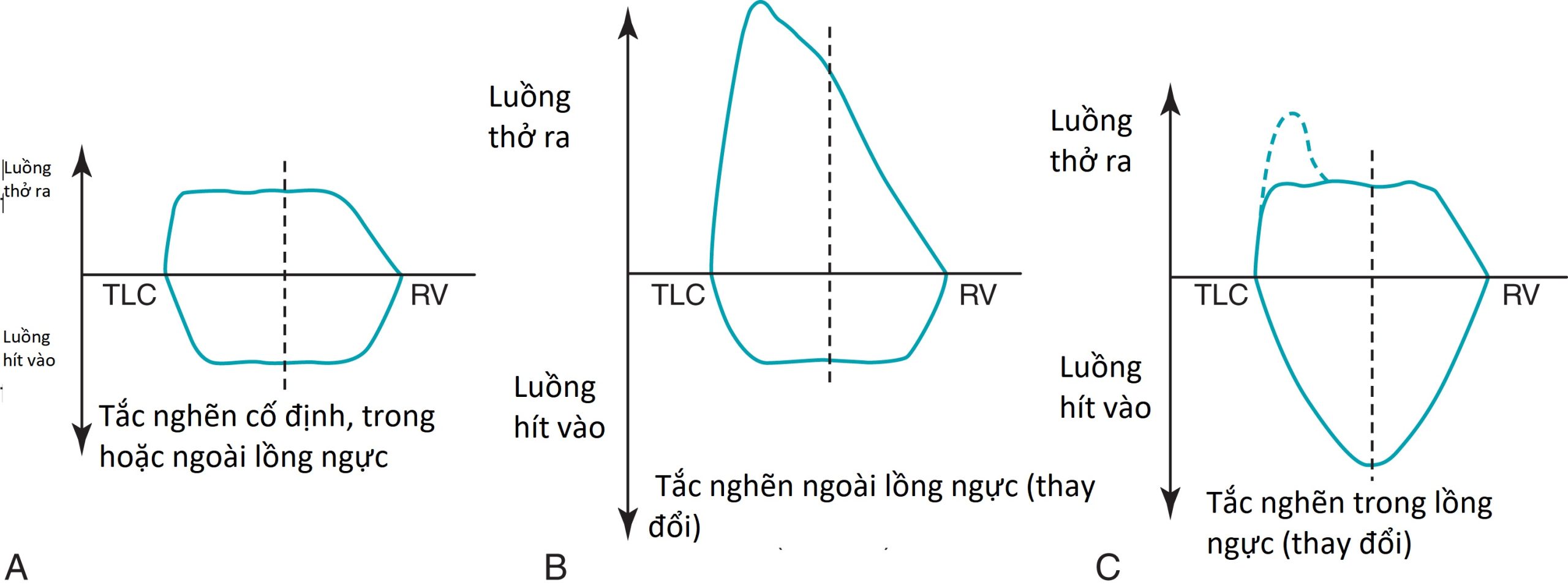
Hình 3.23 Các đường cong lưu lượng-thể tích hít vào và thở ra tối đa trong ba loại tắc nghẽn đường thở trên. A, Tắc nghẽn cố định, trong lồng ngực hoặc ngoài lồng ngực. Tắc nghẽn tương đương trong quá trình hít vào và thở ra, vì vậy lưu lượng hít vào và thở ra tối đa bị giới hạn ở cùng một mức độ. B, Tắc nghẽn thay đổi ngoài lồng ngực. Tắc nghẽn rõ rệt hơn trong quá trình hít vào, và chỉ phần hít vào của đường cong cho thấy một cao nguyên. C, Tắc nghẽn thay đổi trong lồng ngực. Tắc nghẽn rõ rệt hơn trong quá trình thở ra, và chỉ phần thở ra của đường cong cho thấy một cao nguyên. Đường đứt nét đại diện cho lưu lượng ban đầu cao hơn đôi khi được quan sát trước cao nguyên trong tắc nghẽn trong lồng ngực. (Từ Kryger, M., Bode, F., Antic, R., & Anthonisen, N. (1976). Diagnosis of obstruction of the upper and lower airways. American Journal of Medicine, 61, 85-93, với sự cho phép của Excerpta Medica Inc.)
Khí máu động mạch
Mặc dù đo chức năng hô hấp cung cấp nhiều thông tin, chúng không cho thấy hiệu quả ròng của bệnh phổi đối với trao đổi khí, vốn có thể dễ dàng đánh giá bằng các xét nghiệm thực hiện trên máu động mạch. Máu động mạch thường được lấy mẫu bằng cách chọc kim vào động mạch quay hoặc, ít phổ biến hơn và có nhiều rủi ro tiềm ẩn hơn, vào động mạch cánh tay hoặc động mạch đùi. Máu được thu thập vào một ống tiêm có chứa heparin (để ngăn đông máu), và cần cẩn thận để đẩy các bọt khí ra khỏi ống tiêm và phân tích mẫu nhanh chóng (hoặc giữ nó trên đá cho đến khi được phân tích).
Ba phép đo thường được thực hiện: , , và pH động mạch. động mạch bình thường từ 80 đến 100 mm Hg, nhưng giá trị mong đợi phụ thuộc đáng kể vào tuổi của bệnh nhân và mức đồng thời (phản ánh thông khí phế nang, một yếu tố quyết định quan trọng của phế nang và, thứ hai, của động mạch). Từ khí máu động mạch, chênh áp oxy phế nang-động mạch () có thể được tính toán, như đã thảo luận trong Chương 1. Bình thường, sự khác biệt giữa phế nang và động mạch là dưới 10 đến 15 mm Hg ở một người trẻ khỏe mạnh, và sự khác biệt này tăng theo tuổi của bệnh nhân. Hàm lượng oxy trong máu không bắt đầu giảm đáng kể cho đến khi động mạch giảm xuống dưới khoảng 60 mm Hg (xem Chương 1). Do đó, một thấp bất thường thường không ảnh hưởng đến việc vận chuyển đến các mô cho đến khi nó giảm xuống dưới mức này và độ bão hòa giảm.
Phạm vi động mạch bình thường là khoảng 36 đến 44 mm Hg, với pH tương ứng từ 7,44 đến 7,36. Các yếu tố hô hấp và chuyển hóa tương tác chặt chẽ trong việc xác định những con số này và tình trạng axit-bazơ của bệnh nhân. và pH nên được diễn giải đồng thời vì cả hai thông tin này đều cần thiết để phân biệt các bất thường hô hấp với các bất thường chuyển hóa. Khi tăng đột ngột, axit carbonic được hình thành và nồng độ cũng tăng; do đó pH giảm. Theo quy tắc chung, pH giảm khoảng 0,08 cho mỗi 10 mm Hg tăng . Một sự tăng như vậy với một sự giảm pH phù hợp cho thấy một tình trạng toan hô hấp cấp. Ngược lại, một sự giảm do tăng thông khí, với sự tăng pH đi kèm, cho thấy một tình trạng kiềm hô hấp cấp.
Theo thời gian (giờ đến ngày), thận cố gắng bù trừ cho một tình trạng toan hô hấp kéo dài bằng cách giữ lại bicarbonate (), hoặc bằng cách bài tiết bicarbonate trong trường hợp kiềm hô hấp kéo dài. Trong cả hai trường hợp, sự bù trừ đưa giá trị pH về gần nhưng không hoàn toàn về mức bình thường, và rối loạn được gọi là toan hoặc kiềm hô hấp mạn tính (tức là, đã bù).
Mặt khác, một bệnh nhân sản xuất quá nhiều (hoặc bài tiết quá ít) axit sẽ có một tình trạng toan chuyển hóa nguyên phát. Ngược lại, một sự dư thừa (tương đương với một sự giảm ) xác định một tình trạng kiềm chuyển hóa nguyên phát. Tương tự như cách thận cố gắng bù trừ cho một rối loạn axit-bazơ hô hấp nguyên phát, việc loại bỏ qua đường hô hấp được điều chỉnh để bù trừ cho các rối loạn axit-bazơ chuyển hóa. Do đó, toan chuyển hóa kích thích thông khí, loại bỏ , và một sự tăng pH về mức bình thường, trong khi kiềm chuyển hóa ức chế thông khí và loại bỏ , và pH giảm về phạm vi bình thường.
động mạch và pH cùng nhau xác định bản chất của một rối loạn axit-bazơ và sự hiện diện hay vắng mặt của sự bù trừ.
Trong thực hành, bác sĩ lâm sàng xem xét ba câu hỏi cơ bản trong việc xác định tất cả các rối loạn axit-bazơ: (1) Có tình trạng toan hay kiềm? (2) Rối loạn nguyên phát có nguồn gốc từ hô hấp hay chuyển hóa? (3) Có bằng chứng về sự bù trừ của hô hấp hay chuyển hóa không? Bảng 3.2 tóm tắt các dấu hiệu trong các loại rối loạn axit-bazơ chính. Thật không may, mọi việc không phải lúc nào cũng đơn giản như vậy trong thực hành lâm sàng, và khá phổ biến khi thấy các hỗn hợp phức tạp của các rối loạn axit-bazơ ở những bệnh nhân có nhiều bệnh và đang dùng nhiều loại thuốc.
Do sự khó chịu và nguy cơ nhỏ về tổn thương mạch máu khi chọc động mạch, một mẫu máu tĩnh mạch đôi khi được sử dụng thay thế cho phân tích khí máu động mạch. trong máu tĩnh mạch thường cao hơn một chút so với máu động mạch, trong khi pH tĩnh mạch thấp hơn một chút so với pH động mạch. Bởi vì tĩnh mạch phần lớn phụ thuộc vào lượng đã được chiết xuất ở cấp độ mô cục bộ, nó không phản ánh động mạch và do đó không hữu ích trên lâm sàng.
Một hướng dẫn đơn giản để diễn giải khí máu động mạch được trình bày cùng với một số bài toán mẫu trong Phụ lục C.
BẢNG 3.2 Rối loạn Axit-Bazơ
Đo oxy qua mạch
Mặc dù việc đo trực tiếp khí máu động mạch cung cấp phương pháp tốt nhất để đánh giá trao đổi khí, nó đòi hỏi phải lấy máu bằng cách chọc động mạch. Như đã lưu ý, việc lấy mẫu máu động mạch gây khó chịu cho bệnh nhân, và có một nguy cơ biến chứng nhỏ nhưng hữu hạn liên quan đến việc chọc động mạch. Do đó, đo oxy qua mạch, một phương pháp không xâm lấn để đánh giá độ bão hòa oxy động mạch của hemoglobin, đã được sử dụng rộng rãi, đặc biệt là đối với bệnh nhân nhập viện.
Thiết bị đo oxy qua mạch được kẹp vào ngón tay của bệnh nhân, và các bước sóng ánh sáng cụ thể được truyền qua ngón tay (Hình 3.24). Hemoglobin được oxy hóa và khử oxy có các kiểu hấp thụ ánh sáng khác nhau, và việc đo lường sự hấp thụ ánh sáng theo nhịp đập của máu động mạch nhỏ đi qua ngón tay cho phép định lượng hai dạng hemoglobin. Tuy nhiên, có những hạn chế cố hữu trong đo oxy qua mạch: (1) máy đo oxy đo độ bão hòa thay vì , (2) không có thông tin nào được cung cấp về việc loại bỏ và tình trạng axit-bazơ, và (3) kết quả thường không chính xác khi có một hemoglobin bất thường như carboxyhemoglobin, như thấy trong ngộ độc carbon monoxide. Về mặt lý thuyết, sắc tố da không nên ảnh hưởng đến việc đo oxy qua mạch vì nó đo sự khác biệt trong sự hấp thụ của hemoglobin được oxy hóa và khử oxy cho một bệnh nhân cá nhân. Tuy nhiên, các nghiên cứu gần đây đã cho thấy rằng việc đo oxy qua mạch kém chính xác hơn ở những bệnh nhân có da sẫm màu hơn so với da sáng màu hơn. Do đó, vì tất cả các lý do nêu trên, các giá trị đo oxy qua mạch phải được coi là chỉ một phần của bức tranh lâm sàng.
Hình 3.24 Máy đo oxy qua mạch (Máy đo SpO2). Hai con số hiển thị trên màn hình kỹ thuật số đại diện cho độ bão hòa oxy và nhịp tim.
Nghiệm pháp gắng sức
Bởi vì khả năng gắng sức hạn chế thường là triệu chứng nổi bật nhất của bệnh nhân mắc nhiều vấn đề về phổi, việc nghiên cứu bệnh nhân trong quá trình gắng sức có thể cung cấp thông tin quý giá về mức độ hạn chế của những bệnh nhân này và tại sao. Việc bổ sung các phép đo khí máu động mạch trong quá trình gắng sức cung cấp một chiều kích bổ sung và cho thấy liệu các vấn đề trao đổi khí (hoặc là giảm oxy máu hoặc tăng CO2 máu) có góp phần vào sự suy giảm hay không. Đo oxy qua mạch cũng thường được sử dụng trong quá trình gắng sức, đặc biệt là vì nó không xâm lấn, nhưng nó cung cấp ít thông tin hơn so với việc đo trực tiếp khí máu động mạch.
Mặc dù bất kỳ hình thức gắng sức nào về mặt lý thuyết đều có thể được sử dụng cho thủ tục xét nghiệm, bệnh nhân thường được nghiên cứu trong khi tập thể dục trên máy chạy bộ hoặc xe đạp tại chỗ. Các phép đo có thể được thực hiện ở các điểm khác nhau trong quá trình gắng sức bao gồm công suất làm việc, nhịp tim, thông khí, tiêu thụ , sản xuất , áp suất khí thở ra, và khí máu động mạch. Phân tích các dữ liệu này thường có thể phân biệt được liệu thông khí, cung lượng tim, hay các vấn đề về trao đổi khí (đặc biệt là giảm oxy máu) có phải là giới hạn chính đối với khả năng gắng sức hay không. Kết quả có thể hướng dẫn bác sĩ đến liệu pháp cụ thể dựa trên loại giới hạn được tìm thấy.
Một hình thức gắng sức đơn giản hơn thường được sử dụng để đánh giá giới hạn chức năng là nghiệm pháp đi bộ 6 phút. Nghiệm pháp này đo khoảng cách mà bệnh nhân có thể đi bộ (không phải chạy bộ hoặc chạy) trong 6 phút và liệu có sự thay đổi về độ bão hòa oxy của bệnh nhân (được đo bằng máy đo oxy qua mạch) trong quá trình gắng sức hay không. Tuy nhiên, ngoài việc có thể xác định sự giảm độ bão hòa oxy của bệnh nhân, nghiệm pháp này không cung cấp thông tin về cơ chế giới hạn gắng sức và không thể phân biệt giới hạn do bệnh phổi với giới hạn do các vấn đề y tế khác như bệnh tim, bệnh mạch máu ngoại vi, hoặc yếu cơ. Tuy nhiên, nó cung cấp một thước đo khách quan dễ thực hiện về khả năng gắng sức của bệnh nhân và có thể được sử dụng để theo dõi tình trạng của bệnh nhân theo thời gian, có hoặc không có điều trị.
TÀI LIỆU THAM KHẢO ĐỀ XUẤT
- Bohadana A., Izbicki G., Kraman S.S.: Fundamentals of lung auscultation. New England Journal of Medicine 2014; 370: pp. 744-751.
- Maitre B., Similowski T., Derenne J.P.: Physical examination of the adult patient with respiratory diseases: Inspection and palpation. European Respiratory Journal 1995; 8: pp. 1584-1593.
- Marrie T.J., Brown N.: Clubbing of the digits. American Journal of Medicine 2007; 120: pp. 940-941.
- Martin L., Khalil H.: How much reduced hemoglobin is necessary to generate central cyanosis?. Chest 1990; 97: pp. 182-185.
- Myers K.A., Farquhar D.R.: The rational clinical examination. Does this patient have clubbing?. JAMA 2001; 286: pp. 341-347.
- Pasterkamp H., Brand P.L., Everard M., Garcia-Marcos L., Melbye H., Priftis K.N.: Towards the standardization of lung sound nomenclature. European Respiratory Journal 2016; 47: pp. 724-732.
- Vyshedskiy A., Alhashem R.M., Paciej R., Ebril M., Rudman I., Fredberg J.J., et. al.: Mechanism of inspiratory and expiratory crackles. Chest 2009; 135: pp. 156-164.
- Chiles C.: A radiographic approach to diffuse lung disease. Radiologic Clinics of North America 1991; 29: pp. 919-929.
- Fraser R., Colman N., Müller N., Paré P.D.: 3rd ed.2005.ElsevierPhiladelphia
- Fraser R.S.Colman N.Müller N.L.Paré P.D.Fraser and Paré’s diagnosis of diseases of the chest.1999.WB SaundersPhiladelphia:
- Goodman L.R.: 4th ed.2015.ElsevierPhiladelphia
- McAdams H.P., Samei E., Dobbins J.III, Tourassi G.D., Ravin C.E.: Recent advances in chest radiography. Radiology 2006; 241: pp. 663-683.
- Raoof S., Feigin D., Sung A., Raoof S., Irugulpati L., Rosenow E.C.,III.: Interpretation of plain chest roentgenogram. Chest 2012; 141: pp. 545-558.
- Kumamaru K.K., Hoppel B.E., Mather R.T., Rybicki F.J.: CT angiography: current technology and clinical use. Radiologic Clinics of North America 2010; 48: pp. 213-235, vii.
- Little B.P.: Approach to chest computed tomography. Clinics in Chest Medicine 2015; 36: pp. 127-145.
- Naidich D.P., Webb W.R., Müller N.L., Vlahos I., Krinsky G.A.: 4th ed.2007.Lippincott Williams & WilkinsPhiladelphia
- Raju S., Ghosh S., Mehta A.C.: Chest CT signs in pulmonary disease. A pictorial review. Chest 2017; 151: pp. 1356-1374.
- Webb W.R., Müller N.L., Naidich D.P.: 5th ed.2015.Wolters KluwerPhiladelphia
- Hatabu H., Stock K.W., Sher S., Edinburgh K.J., Levin D.L., Garpestad E., et. al.: Magnetic resonance imaging of the thorax. Past, present, and future. Radiologic Clinics of North America 2000; 38: pp. 593-620.
- Müller N.L.: Computed tomography and magnetic resonance imaging: past, present and future. European Respiratory Journal 2002; 19: pp. 3s-12s.
- Naidich D.P., Webb W.R., Müller N.L., Vlahos I., Krinsky G.A.: 2007.Lippincott Williams & WilkinsPhiladelphia
- Wielpütz M., Kauczor H.U.: MRI of the lung: state of the art. Diagnostic and Interventional Radiology 2012; 18: pp. 344-353.
- Gould M.K., Maclean C.C., Kuschner W.G., Rydzak C.E., Owens D.K.: Accuracy of positron emission tomography for diagnosis of pulmonary nodules and mass lesions. A meta-analysis. JAMA 2001; 285: pp. 914-924.
- Kumar A., Dutta R., Kannan U., Kumar R., Khilnani G.C., Gupta S.D.: Evaluation of mediastinal lymph nodes using F-FDG PET-CT scan and its histopathologic correlation. Annals of Thoracic Medicine 2011; 6: pp. 11-16.
- Shreve P., Faasse T.: Role of positron emission tomography–computed tomography in pulmonary neoplasms. Radiologic Clinics of North America 2013; 51: pp. 767-779.
- Vansteenkiste J.F., Stroobants S.G.: The role of positron emission tomography with 18F-fluoro-2-deoxy-D-glucose in respiratory oncology. European Respiratory Journal 2001; 17: pp. 802-820.
- Pulmonary angiography
- Sadigh G., Kelly A.M., Cronin P.: Challenges, controversies, and hot topics in pulmonary embolism imaging. AJR American Journal of Roentgenology 2011; 196: pp. 497-515.
- Stein P.D., Fowler S.E., Goodman L.R., Gottschalk A., Hales C.A., Hull R.D., et. al.: Multidetector computed tomography for acute pulmonary embolism. New England Journal of Medicine 2006; 354: pp. 2317-2327.
- Corcoran J.P., Tazi-Mezalek R., Maldonado F., Yarmus L.B., Annema J.T., Koegelenberg C.F.N., et. al.: State of the art thoracic ultrasound: intervention and therapeutics. Thorax 2017; 72: pp. 840-849.
- Laursen C.B., Clive A., Hallifax R., Pietersen P.I., Asciak R., Davidsen J.R., et. al.: European Respiratory Society statement on thoracic ultrasound. European Respiratory Journal 2021; 57: pp. 2001519.
- Patel K.M., Ullah K., Patail H., Ahmad S.: Ultrasound for pleural disease. Beyond a pocket of pleural fluid. Annals of the American Thoracic Society 2021; 18: pp. 749-756.
- Becker H.D.: Bronchoscopy: the past, the present, and the future. Clinics in Chest Medicine 2010; 31: pp. 1-18.
- Casal R.F., Ost D.E., Eapen G.A.: Flexible bronchoscopy. Clinics in Chest Medicine 2013; 34: pp. 341-352.
- Criner G.J., Eberhardt R., Fernandez-Bussy S., Gompelmann D., Maldonado F., Patel N., et. al.: Interventional bronchoscopy. American Journal of Respiratory and Critical Care Medicine 2020; 202: pp. 29-50.
- Dooms C., Seijo L., Gasparini S., Trisolini R., Ninane V., Tournoy K.G.: Diagnostic bronchoscopy: State of the art. European Respiratory Review 2010; 19: pp. 229-236.
- Haas A.R., Vachani A., Sterman D.H.: Advances in diagnostic bronchoscopy. American Journal of Respiratory and Critical Care Medicine 2010; 182: pp. 589-597.
- Kinsey C.M., Arenberg D.A.: Endobronchial ultrasound-guided transbronchial needle aspiration for non-small cell lung cancer staging. American Journal of Respiratory and Critical Care Medicine 2014; 189: pp. 640-649.
- Meyer K.C., Raghu G., Baughman R.P., Brown K.K., Costabel U., du Bois R.M., et. al.: An official American Thoracic Society clinical practice guideline: The clinical utility of bronchoalveolar lavage cellular analysis in interstitial lung disease. American Journal of Respiratory and Critical Care Medicine 2012; 185: pp. 1004-1014.
- Wahidi M.M., Herth F.J.F., Chen A., Cheng G., Yarmus L.: State of the art: Interventional pulmonology. Chest 2020; 157: pp. 724-736.
- Obtaining and processing specimens
- Bartlett J.G.: Diagnostic tests for agents of community-acquired pneumonia. Clinical Infectious Diseases 2011; 52: pp. S296-S304.
- Dorman S.E.: New diagnostic tests for tuberculosis: bench, bedside, and beyond. Clinical Infectious Diseases 2010; 50: pp. S173-S177.
- Epstein R.L.: Constituents of sputum: a simple method. Annals of Internal Medicine 1972; 77: pp. 259-265.
- Leslie K.O., Helmers R.A., Lanza L.A., Colby T.V.: Processing and evaluation of lung biopsy specimens. Eur Respir Mon 2000; 5: pp. 55-62.
- Mahony J.B.: Detection of respiratory viruses by molecular methods. Clinical Microbiology Reviews 2008; 21: pp. 716-747.
- Mayaud C., Cadranel J.: A persistent challenge: the diagnosis of respiratory disease in the non-AIDS immunocompromised host. Thorax 2000; 55: pp. 511-517.
- Peterson L.R.: Molecular laboratory tests for the diagnosis of respiratory tract infection due to Staphylococcus aureus . Clinical Infectious Diseases 2011; 52: pp. S361-S366.
- Reynolds H.Y.: Use of bronchoalveolar lavage in humans: past necessity and future imperative. Lung 2000; 178: pp. 271-293.
- Talbot H.K., Falsey A.R.: The diagnosis of viral respiratory disease in older adults. Clinical Infectious Diseases 2010; 50: pp. 747-751.
- Agarwala P., Salzman S.H.: Six-minute walk test: clinical role, technique, coding, and reimbursement. Chest 2020; 157: pp. 603-611.
- American Thoracic Society, & American College of Chest Physicians.: ATS/ACCP statement on cardiopulmonary exercise testing. American Journal of Respiratory and Critical Care Medicine 2003; 167: pp. 211-277.
- Arena R., Sietsema K.E.: Cardiopulmonary exercise testing in the clinical evaluation of patients with heart and lung disease. Circulation 2011; 123: pp. 668-680.
- Braun L.: Race correction and spirometry: why history matters. Chest 2021; 159: pp. 1670-1675.
- Chupp G.L.: Pulmonary function testing. Clinics in Chest Medicine 2001; 22: pp. 599-859.
- Task Force ERS, Palange P., Ward S.A., Carlson K.H., Casaburi R., Gallagher C.G., et. al.: Recommendations on the use of exercise testing in clinical practice. European Respiratory Journal 2007; 29: pp. 185-209.
- Evans S.E., Scanlon P.D.: Current practice in pulmonary function testing. Mayo Clinic Proceedings 2003; 78: pp. 758-763.
- Flesch J.D., Dine C.J.: Lung volumes. Measurement, clinical use, and coding. Chest 2012; 142: pp. 506-510.
- Godfrey M.S., Jankowich M.D.: The vital capacity is vital: epidemiology and clinical significance of the restrictive spirometry pattern. Chest 2016; 149: pp. 238-251.
- Graham B.L., Brusasco V., Burgos F., Cooper B.G., Jensen R., Kendrick A., et. al.: 2017 ERS/ATS standards for single-breath carbon monoxide uptake in the lung. European Respiratory Journal 2017; 49: pp. 1600016.
- Heckman E.J., O’Connor G.T.: Pulmonary function tests for diagnosing lung disease. JAMA 2015; 313: pp. 2278-2279.
- Holland R, Bowerman C, Stanojevic S.: The contribution of anthropometry and socioeconomic status to racial differences in measures of lung function: A systematic review. Chest 2022; 162: pp. 635-646.
- Hughes J.M.B.: Pulmonary function: the basics. Medicine (Baltimore) 2008; 36: pp. 142-150. (UK ed)
- Hughes J.M.B., Pride N.B.: Examination of the carbon monoxide diffusing capacity (DL CO ) in relation to its K CO and V A components. American Journal of Respiratory and Critical Care Medicine 2012; 186: pp. 132-139.
- Miller M.R.: Choosing and using lung function prediction equations. European Respiratory Journal 2016; 48: pp. 1535-1537.
- Miller M.R., Crapo R., Hankinson J., Brusasco V., Burgos F., Casaburi R., et. al.: General considerations for lung function testing. European Respiratory Journal 2005; 26: pp. 153-161.
- Narins R.G., Emmett M.: Simple and mixed acid-base disorders: a practical approach. Medicine (Baltimore) 1980; 59: pp. 161-187.
- Neder J.A., Berton D.C., Muller P.T., O’Donnell D.E.: Incorporating lung diffusing capacity for carbon monoxide in clinical decision making in chest medicine. Clinics in Chest Medicine 2019; 40: pp. 285-305.
- Sietsema K.E., Sue D.Y., Stringer W.W., Ward S.A.: 6th ed.2021.Wolters KluwerPhiladelphia
- Sjoding M.W., Dickson R.P., Iwashyna T.J., Gay S.E., Valley T.S.: Racial bias in pulse oximetry measurement. New England Journal of Medicine 2020; 383: pp. 2477-2478.
- Stanojevic S, Kaminsky DA, Miller MR, et. al.: ERS/ATS technical standard on interpretive strategies for routine lung function tests. Eur Respir J 2022; 60: pp. 2101499.
- Wagner P.D.: The physiological basis of pulmonary gas exchange: implications for clinical interpretation of arterial blood gases. European Respiratory Journal 2015; 45: pp. 227-243.
- Wasserman K.: Diagnosing cardiovascular and lung pathophysiology from exercise gas exchange. Chest 1997; 112: pp. 1091-1101.
- Williams A.J.: ABC of oxygen: assessing and interpreting arterial blood gases and acid-base balance. BMJ 1998; 317: pp. 1213-1216.
Bảng chú giải thuật ngữ Y học Anh Việt, Chương 3.
| STT | Thuật ngữ tiếng Anh | Phiên âm | Nghĩa Tiếng Việt |
|---|---|---|---|
| 1 | Pulmonary disease | /ˈpʌlməneri dɪˈziːz/ | Bệnh phổi |
| 2 | Macroscopic | /ˌmækrəˈskɒpɪk/ | Đại thể (nhìn bằng mắt thường) |
| 3 | Microscopic | /ˌmaɪkrəˈskɒpɪk/ | Vi thể (nhìn bằng kính hiển vi) |
| 4 | Functional | /ˈfʌŋkʃənəl/ | Chức năng |
| 5 | Physical examination | /ˈfɪzɪkəl ɪɡˌzæmɪˈneɪʃən/ | Khám lâm sàng |
| 6 | Stethoscope | /ˈsteθəskəʊp/ | Ống nghe |
| 7 | Respiratory | /rɪˈspɪrətəri/ | (Thuộc về) hô hấp |
| 8 | Palpation | /pælˈpeɪʃən/ | Sờ nắn |
| 9 | Percussion | /pəˈkʌʃən/ | Gõ (khám) |
| 10 | Auscultation | /ˌɔːskəlˈteɪʃən/ | Nghe bằng ống nghe |
| 11 | Vocal fremitus | /ˈvəʊkəl ˈfremɪtəs/ | Rung thanh âm |
| 12 | Tactile fremitus | /ˈtæktaɪl ˈfremɪtəs/ | Rung xúc giác |
| 13 | Resonant | /ˈrezənənt/ | Cộng hưởng |
| 14 | Dull | /dʌl/ | Đục (âm gõ) |
| 15 | Pleural effusion | /ˈplʊərəl ɪˈfjuːʒən/ | Tràn dịch màng phổi |
| 16 | Consolidated | /kənˈsɒlɪdeɪtɪd/ | Đông đặc |
| 17 | Pneumothorax | /ˌnjuːməˈθɔːræks/ | Tràn khí màng phổi |
| 18 | Hyperresonant | /ˌhaɪpərˈrezənənt/ | Siêu cộng hưởng |
| 19 | Emphysema | /ˌemfɪˈsiːmə/ | Khí thũng |
| 20 | Breath sounds | /breθ saʊndz/ | Âm thở |
| 21 | Vesicular | /vɪˈsɪkjʊlər/ | Phế nang |
| 22 | Bronchial | /ˈbrɒŋkiəl/ | Phế quản |
| 23 | Bronchovesicular | /ˌbrɒŋkəʊvɪˈsɪkjʊlər/ | Phế quản-phế nang |
| 24 | Whispered pectoriloquy | /ˈwɪspərd ˌpektərɪˈləkwi/ | Thì thầm rõ ràng |
| 25 | Bronchophony | /ˌbrɒŋˈkɒfəni/ | Thanh âm rõ ràng |
| 26 | Egophony | /ˈiːɡəfəni/ | Âm dê |
| 27 | Adventitious sounds | /ædˈventɪʃəs saʊndz/ | Âm phụ |
| 28 | Crackles | /ˈkrækəlz/ | Ran |
| 29 | Rales | /rɑːlz/ | Ran (thuật ngữ cũ) |
| 30 | Wheezes | /wiːzəz/ | Thở khò khè |
| 31 | Friction rub | /ˈfrɪkʃən rʌb/ | Cọ xát màng phổi |
| 32 | Stridor | /ˈstraɪdər/ | Thở rít |
| 33 | Rhonchi | /ˈrɒŋkaɪ/ | Ran thô |
| 34 | Squawk | /skwɔːk/ | Tiếng kêu ngắn |
| 35 | Atelectasis | /ˌætəˈlektəsɪs/ | Xẹp phổi |
| 36 | Clubbing | /ˈklʌbɪŋ/ | Dùi trống |
| 37 | Hypertrophic osteoarthropathy | /ˌhaɪpərˈtrɒfɪk ˌɒstiəʊɑːˈθrɒpəθi/ | Bệnh xương khớp phì đại |
| 38 | Cyanosis | /ˌsaɪəˈnəʊsɪs/ | Tím tái |
| 39 | Carcinoma | /ˌkɑːsɪˈnəʊmə/ | Ung thư biểu mô |
| 40 | Mesothelioma | /ˌmezəʊˌθiːliˈəʊmə/ | U trung biểu mô |
| 41 | Bronchiectasis | /ˌbrɒŋkiˈektəsɪs/ | Giãn phế quản |
| 42 | Lung abscess | /lʌŋ ˈæbses/ | Áp xe phổi |
| 43 | Empyema | /ˌempɪˈiːmə/ | Mủ màng phổi |
| 44 | Hemoglobin | /ˌhiːməˈɡləʊbɪn/ | Hemoglobin |
| 45 | Polycythemia | /ˌpɒlɪsaɪˈθiːmiə/ | Đa hồng cầu |
| 46 | Chest radiography | /tʃest ˌreɪdiˈɒɡrəfi/ | X-quang ngực |
| 47 | Posteroanterior (PA) | /ˌpɒstərəʊænˈtɪəriər/ | Trước-sau |
| 48 | Anteroposterior (AP) | /ˌæntərəʊpɒsˈtɪəriər/ | Sau-trước |
| 49 | Lateral | /ˈlætərəl/ | Nghiêng |
| 50 | Decubitus | /dɪˈkjuːbɪtəs/ | Nằm nghiêng |
| 51 | Radiographic anatomy | /ˌreɪdiəˈɡræfɪk əˈnætəmi/ | Giải phẫu X-quang |
| 52 | Lobar | /ˈləʊbər/ | Thùy |
| 53 | Fissure | /ˈfɪʃər/ | Khe |
| 54 | Minor fissure | /ˈmaɪnər ˈfɪʃər/ | Khe nhỏ |
| 55 | Major fissure | /ˈmeɪdʒər ˈfɪʃər/ | Khe lớn |
| 56 | Upper lobe | /ˈʌpər ləʊb/ | Thùy trên |
| 57 | Middle lobe | /ˈmɪdəl ləʊb/ | Thùy giữa |
| 58 | Lower lobe | /ˈləʊər ləʊb/ | Thùy dưới |
| 59 | Lingula | /ˈlɪŋɡjʊlə/ | Lưỡi phổi |
| 60 | Consolidation | /kənˌsɒlɪˈdeɪʃən/ | Đông đặc |
| 61 | Volume loss | /ˈvɒljuːm lɒs/ | Mất thể tích |
| 62 | Silhouette sign | /ˌsɪluˈet saɪn/ | Dấu hiệu bóng |
| 63 | Hilum | /ˈhaɪləm/ | Rốn phổi |
| 64 | Mediastinum | /ˌmiːdiæˈstaɪnəm/ | Trung thất |
| 65 | Interstitial pattern | /ˌɪntərˈstɪʃəl ˈpætərn/ | Kiểu kẽ |
| 66 | Alveolar pattern | /ælˈviːələr ˈpætərn/ | Kiểu phế nang |
| 67 | Reticular | /rɪˈtɪkjʊlər/ | Lưới |
| 68 | Reticulonodular | /rɪˌtɪkjʊləʊˈnɒdjʊlər/ | Lưới-nốt |
| 69 | Air bronchogram | /eər ˈbrɒŋkəɡræm/ | Ảnh phế quản khí |
| 70 | Nodular pattern | /ˈnɒdjʊlər ˈpætərn/ | Kiểu nốt |
| 71 | Miliary pattern | /ˈmɪliəri ˈpætərn/ | Kiểu dạng kê |
| 72 | Ground-glass | /ɡraʊnd ɡlɑːs/ | Mờ kính |
| 73 | Computed tomography (CT) | /kəmˈpjuːtəd təˈmɒɡrəfi/ | Chụp cắt lớp vi tính |
| 74 | Cross-sectional | /krɒs ˈsekʃənəl/ | Cắt ngang |
| 75 | Helical CT | /ˈhelɪkəl siː tiː/ | CT xoắn ốc |
| 76 | High-resolution CT | /haɪ ˌrezəˈluːʃən siː tiː/ | CT độ phân giải cao |
| 77 | CT pulmonary angiography (CTPA) | /siː tiː ˈpʌlmənəri ˌændʒiˈɒɡrəfi/ | Chụp mạch phổi bằng CT |
| 78 | Thromboembolism | /ˌθrɒmbəʊˈembəlɪzəm/ | Thuyên tắc |
| 79 | Virtual bronchoscopy | /ˈvɜːtʃuəl brɒŋˈkɒskəpi/ | Nội soi phế quản ảo |
| 80 | Magnetic resonance imaging (MRI) | /mæɡˌnetɪk ˈrezənəns ˈɪmɪdʒɪŋ/ | Chụp cộng hưởng từ |
| 81 | Signal void | /ˈsɪɡnəl vɔɪd/ | Khoảng trống tín hiệu |
| 82 | Sagittal | /ˈsædʒɪtəl/ | Dọc |
| 83 | Coronal | /kəˈrəʊnəl/ | Vành |
| 84 | Transverse | /trænzˈvɜːs/ | Ngang |
| 85 | Radionuclide | /ˌreɪdiəʊˈnjuːklaɪd/ | Đồng vị phóng xạ |
| 86 | Perfusion | /pəˈfjuːʒən/ | Tưới máu |
| 87 | Ventilation | /ˌventɪˈleɪʃən/ | Thông khí |
| 88 | Technetium-99m | /tekˈniːʃiəm/ | Technetium-99m |
| 89 | Microspheres | /ˈmaɪkrəʊsfɪəz/ | Vi cầu |
| 90 | Xenon-133 | /ˈziːnɒn/ | Xenon-133 |
| 91 | DTPA | /diː tiː piː eɪ/ | DTPA |
| 92 | Wash-in phase | /wɒʃ ɪn feɪz/ | Pha rửa vào |
| 93 | Equilibrium phase | /ˌiːkwɪˈlɪbriəm feɪz/ | Pha cân bằng |
| 94 | Wash-out phase | /wɒʃ aʊt feɪz/ | Pha rửa ra |
| 95 | Pulmonary embolism | /ˈpʌlmənəri ˈembəlɪzəm/ | Thuyên tắc phổi |
| 96 | Positron emission tomography (PET) | /ˈpɒzɪtrɒn ɪˈmɪʃən təˈmɒɡrəfi/ | Chụp cắt lớp phát xạ positron |
| 97 | 18-Fluorodeoxyglucose (FDG) | /ˌfluːərəʊdiˌɒksiˈɡluːkəʊs/ | 18-Fluorodeoxyglucose |
| 98 | Metabolic activity | /ˌmetəˈbɒlɪk ækˈtɪvɪti/ | Hoạt động chuyển hóa |
| 99 | Malignant | /məˈlɪɡnənt/ | Ác tính |
| 100 | Solitary pulmonary nodule | /ˈsɒlɪtəri ˈpʌlmənəri ˈnɒdjuːl/ | Nốt phổi đơn độc |
| 101 | Staging | /ˈsteɪdʒɪŋ/ | Phân giai đoạn |
| 102 | Lymph node | /lɪmf nəʊd/ | Hạch lympho |
| 103 | False-negative | /fɔːls ˈneɡətɪv/ | Âm tính giả |
| 104 | False-positive | /fɔːls ˈpɒzətɪv/ | Dương tính giả |
| 105 | Pulmonary angiography | /ˈpʌlmənəri ˌændʒiˈɒɡrəfi/ | Chụp mạch phổi |
| 106 | Catheter | /ˈkæθətər/ | Ống thông |
| 107 | Contrast material | /ˈkɒntrɑːst məˈtɪəriəl/ | Chất cản quang |
| 108 | Digital angiography | /ˈdɪdʒɪtəl ˌændʒiˈɒɡrəfi/ | Chụp mạch kỹ thuật số |
| 109 | Filling defect | /ˈfɪlɪŋ ˈdiːfekt/ | Khuyết lấp đầy |
| 110 | Ultrasonography | /ˌʌltrəsəˈnɒɡrəfi/ | Siêu âm |
| 111 | Point-of-care ultrasound (POCUS) | /pɔɪnt əv keər ˈʌltrəsaʊnd/ | Siêu âm tại chỗ chăm sóc |
| 112 | Loculations | /ˌləkjʊˈleɪʃənz/ | Ngăn cách |
| 113 | Pneumothorax | /ˌnjuːməˈθɔːræks/ | Tràn khí màng phổi |
| 114 | Subphrenic abscess | /sʌbˈfrenɪk ˈæbses/ | Áp xe dưới cơ hoành |
| 115 | Bronchoscopy | /brɒŋˈkɒskəpi/ | Nội soi phế quản |
| 116 | Rigid bronchoscope | /ˈrɪdʒɪd ˈbrɒŋkəskəʊp/ | Nội soi phế quản cứng |
| 117 | Flexible bronchoscope | /ˈfleksəbəl ˈbrɒŋkəskəʊp/ | Nội soi phế quản mềm |
| 118 | Fiberoptic | /ˌfaɪbərˈɒptɪk/ | Sợi quang |
| 119 | Subsegmental | /sʌbseɡˈmentəl/ | Phân thùy |
| 120 | Bronchial washing | /ˈbrɒŋkiəl ˈwɒʃɪŋ/ | Rửa phế quản |
| 121 | Bronchoalveolar lavage (BAL) | /ˌbrɒŋkəʊælˈviːələr ləˈvɑːʒ/ | Rửa phế nang-phế quản |
| 122 | Transbronchial needle aspiration | /trænzˈbrɒŋkiəl ˈniːdəl ˌæspəˈreɪʃən/ | Chọc hút kim xuyên phế quản |
| 123 | Endobronchial ultrasound (EBUS) | /ˌendəʊˈbrɒŋkiəl ˈʌltrəsaʊnd/ | Siêu âm nội phế quản |
| 124 | Endobronchial biopsy | /ˌendəʊˈbrɒŋkiəl ˈbaɪɒpsi/ | Sinh thiết nội phế quản |
| 125 | Transbronchial biopsy | /trænzˈbrɒŋkiəl ˈbaɪɒpsi/ | Sinh thiết xuyên phế quản |
| 126 | Fluoroscopy | /flʊəˈrɒskəpi/ | Soi huỳnh quang |
| 127 | Electromagnetic navigational bronchoscopy | /ɪˌlektrəʊmæɡˈnetɪk ˌnævɪˈɡeɪʃənəl brɒŋˈkɒskəpi/ | Nội soi phế quản dẫn đường điện từ |
| 128 | Robotic bronchoscopy | /rəʊˈbɒtɪk brɒŋˈkɒskəpi/ | Nội soi phế quản robot |
| 129 | Hemoptysis | /hɪˈmɒptəsɪs/ | Ho ra máu |
| 130 | Foreign body | /ˈfɒrən ˈbɒdi/ | Dị vật |
| 131 | Laser technique | /ˈleɪzər tekˈniːk/ | Kỹ thuật laser |
| 132 | Stent | /stent/ | Stent (ống nong) |
| 133 | Stricture | /ˈstrɪktʃər/ | Chỗ hẹp |
| 134 | Brachytherapy | /ˌbrækɪˈθerəpi/ | Xạ trị nội |
| 135 | Electrocautery | /ɪˌlektrəʊˈkɔːtəri/ | Đốt điện |
| 136 | Cryotherapy | /ˌkraɪəʊˈθerəpi/ | Điều trị lạnh |
| 137 | Photodynamic therapy | /ˌfəʊtəʊdaɪˈnæmɪk ˈθerəpi/ | Liệu pháp quang động lực |
| 138 | Interventional pulmonology | /ˌɪntəˈvenʃənəl ˌpʌlməˈnɒlədʒi/ | Phổi can thiệp |
| 139 | Histology | /hɪˈstɒlədʒi/ | Mô học |
| 140 | Cytology | /saɪˈtɒlədʒi/ | Tế bào học |
| 141 | Tracheobronchial secretions | /ˌtreɪkiəʊˈbrɒŋkiəl sɪˈkriːʃənz/ | Tiết dịch khí quản-phế quản |
| 142 | Parenchyma | /pəˈreŋkɪmə/ | Nhu mô |
| 143 | Pleura | /ˈplʊərə/ | Màng phổi |
| 144 | Expectorated sputum | /ɪkˈspektəreɪtɪd ˈspjuːtəm/ | Đờm khạc ra |
| 145 | Induced sputum | /ɪnˈdjuːst ˈspjuːtəm/ | Đờm cảm ứng |
| 146 | Hypertonic saline | /ˌhaɪpərˈtɒnɪk ˈseɪlaɪn/ | Nước muối ưu trương |
| 147 | Transtracheal aspiration | /trænzˈtreɪkiəl ˌæspəˈreɪʃən/ | Chọc hút xuyên khí quản |
| 148 | Cricothyroid membrane | /ˌkraɪkəʊˈθaɪrɔɪd ˈmembreɪn/ | Màng nhẫn giáp |
| 149 | Subcutaneous emphysema | /ˌsʌbkjuːˈteɪniəs ˌemfɪˈsiːmə/ | Khí thũng dưới da |
| 150 | Protected brush | /prəˈtektɪd brʌʃ/ | Chổi được bảo vệ |
