SÁCH DỊCH “Y HỌC CHU PHẪU: QUẢN LÝ HƯỚNG ĐẾN KẾT QUẢ, ẤN BẢN THỨ 2”
Được dịch và chuyển thể sang tiếng Việt từ sách gốc “Perioperative Medicine: Managing for Outcome, 2nd Edition”
Dịch và chú giải: Ths.Bs. Lê Đình Sáng – Hiệu đính: Ts.Bs.Lê Nhật Huy
CHƯƠNG 12. PHÒNG NGỪA TỔN THƯƠNG THIẾU MÁU CỤC BỘ TRONG PHẪU THUẬT KHÔNG PHẢI TIM MẠCH
Prevention of Ischemic Injury in Noncardiac Surgery – Annemarie Thompson and Stephen Harrison Gregory
Perioperative Medicine, 12, 143-153
Giới thiệu
Nhồi máu cơ tim chu phẫu (NMCT) là nguyên nhân phổ biến nhất gây tử vong trong giai đoạn hậu phẫu sớm. Thiếu máu cục bộ chu phẫu có thể do huyết khối động mạch vành cấp tính hoặc do mất cân bằng giữa cung cấp và nhu cầu oxy cơ tim. Trong khi đáp ứng viêm với bản thân phẫu thuật có thể làm vỡ mảng xơ vữa cấp tính và gây NMCT, các rối loạn huyết động khác, bao gồm tăng/hạ huyết áp, nhịp tim nhanh, mất máu cấp tính và thiếu máu, cũng có thể dẫn đến các biến cố thiếu máu cục bộ ở người bệnh có nguy cơ.
Một cách tiếp cận toàn diện trong đánh giá và quản lý người bệnh có nguy cơ biến cố tim mạch bất lợi lớn (MACE) trong giai đoạn chu phẫu là điều cần thiết để tối ưu hóa kết quả ở nhóm đối tượng này. Trong chương này, chúng tôi thảo luận về quản lý chu phẫu cho người bệnh có nguy cơ NMCT, bao gồm tối ưu hóa nội khoa tiền phẫu, quản lý trong mổ và lựa chọn phương pháp gây mê. Chúng tôi cũng thảo luận về các khái niệm mới trong phòng ngừa thiếu máu cục bộ. Trọng tâm là hướng dẫn hiện tại của Trường Môn Tim mạch Hoa Kỳ/Hiệp hội Tim mạch Hoa Kỳ (ACC/AHA) về quản lý chu phẫu và hướng dẫn của Hội Tim mạch Châu Âu/Hội Gây mê Châu Âu (ESC/ESA) về phẫu thuật không phải tim mạch.
Bệnh sinh và Diễn biến Tự nhiên của Thiếu máu Cục bộ Chu phẫu
Bệnh sinh của NMCT chu phẫu rất phức tạp và thay đổi. Nhìn chung, có hai loại thiếu máu cục bộ chu phẫu: hội chứng động mạch vành cấp do tắc nghẽn động mạch vành bởi huyết khối và thiếu máu cục bộ do nhu cầu. Thiếu máu cục bộ do nhu cầu phổ biến hơn nhiều so với hội chứng động mạch vành cấp tính như là nguyên nhân của NMCT chu phẫu. NMCT chu phẫu thường xảy ra trong 4 ngày đầu sau phẫu thuật, mặc dù nó có thể xảy ra bất kỳ thời điểm nào trong thời gian nằm viện (Hình 12.1).
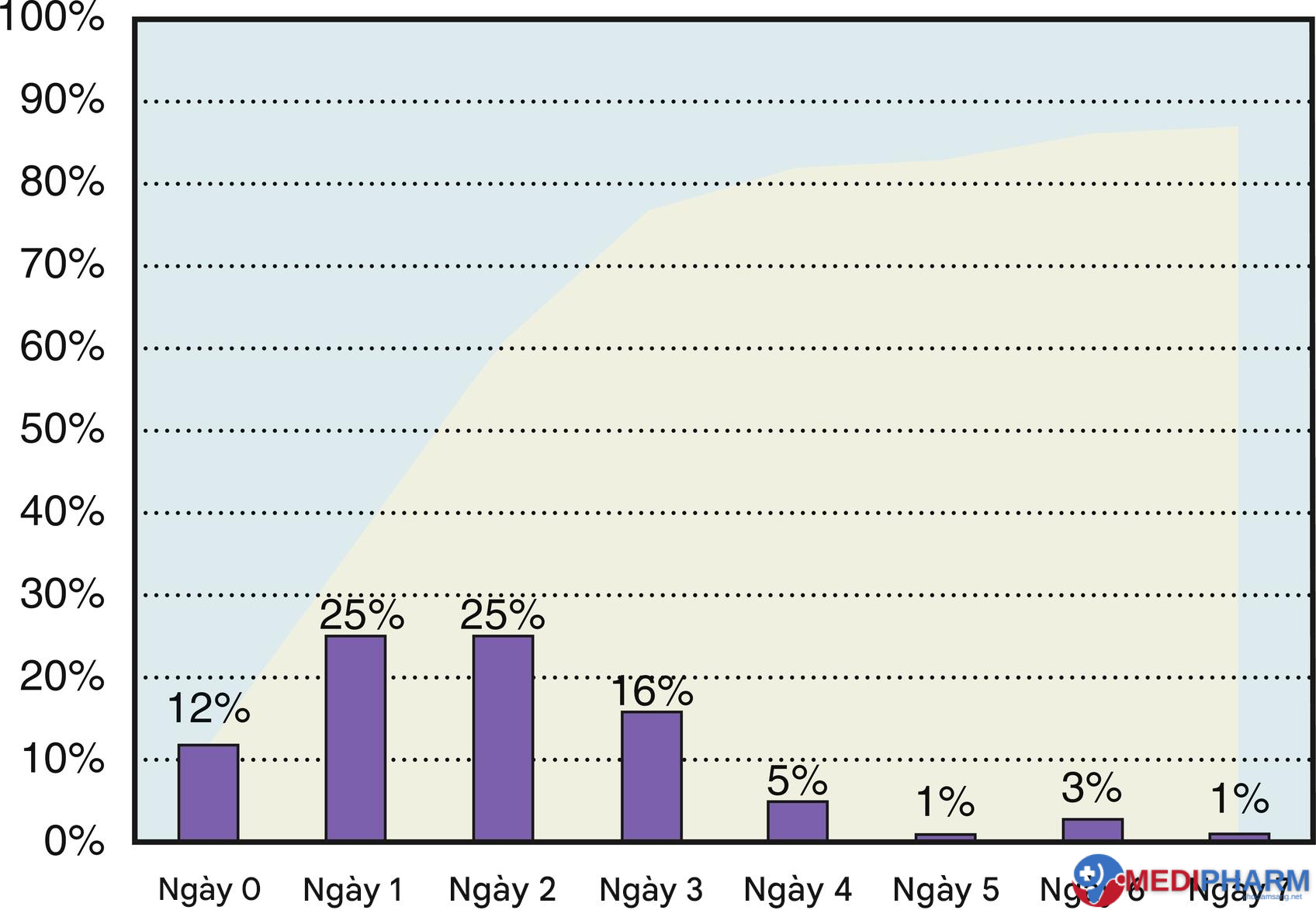
Hình 12.1 Tỷ lệ tích lũy (màu xám) và tỷ lệ theo tỷ lệ phần trăm (màu đen) của nhồi máu cơ tim chu phẫu theo từng ngày. (Được phép từ Biccard BM, Rodseth RN. The pathophysiology of peri-operative myocardial infarction. Anaesthesia. 2010;65(7):733–741.)
Trái ngược với người bệnh nội khoa bị NMCT, chủ yếu tử vong do tắc nghẽn động mạch vành bởi huyết khối, các nghiên cứu chụp mạch ở người bệnh tử vong do NMCT chu phẫu cho thấy tỷ lệ vỡ mảng bám thấp hơn nhiều. Điều này gợi ý rằng mất cân bằng giữa cung cấp và nhu cầu oxy cơ tim đóng vai trò nổi bật hơn nhiều trong NMCT chu phẫu. Điều dễ hiểu là người bệnh có gánh nặng bệnh động mạch vành cao trước phẫu thuật có nguy cơ cao bị NMCT chu phẫu. Số lượng và mức độ nghiêm trọng của tổn thương có liên quan đến nguy cơ tử vong chu phẫu ở người bệnh phẫu thuật mạch máu, và sự hiện diện của tắc nghẽn hoàn toàn mạn tính của động mạch vành với sự phát triển tuần hoàn bàng hệ là phổ biến ở người bệnh bị NMCT chu phẫu.
Tỷ lệ NMCT chu phẫu thay đổi, tùy thuộc vào định nghĩa được sử dụng, nhưng ngay cả khi có sự tăng nhẹ troponin huyết thanh cũng liên quan đến sự gia tăng đáng kể tỷ lệ tử vong trong 30 ngày, mặc dù mối quan hệ nhân quả chưa được xác lập chắc chắn. Điều quan trọng, các nghiên cứu cho thấy đa số người bệnh bị NMCT chu phẫu sẽ không biểu hiện triệu chứng thiếu máu cục bộ, và nên có ngưỡng thấp để bắt đầu đánh giá thiếu máu cục bộ ở người bệnh sau phẫu thuật có dấu hiệu suy giảm lâm sàng. Cuối cùng, người bệnh phát triển NMCT chu phẫu có nguy cơ tử vong tăng đáng kể, với nghiên cứu đoàn hệ lớn nhất cho đến nay xem xét kết quả ở nhóm người bệnh này cho thấy tăng gấp năm lần tỷ lệ tử vong trong 30 ngày ở người bệnh bị NMCT chu phẫu.
B. TỐI ƯU HÓA TRƯỚC MỔ
SÀNG LỌC VÀ PHÂN TẦNG NGUY CƠ
Thảo luận chi tiết về đánh giá tim mạch tiền phẫu có thể được tìm thấy trong Chương 5. Nhìn chung, phân tầng nguy cơ cho phẫu thuật không phải tim mạch được thực hiện bằng cách đánh giá tình trạng chức năng và sự hiện diện của các bệnh đồng mắc dự đoán nguy cơ tăng MACE. Tình trạng chức năng có thể được xác định chính thức, thông qua kiểm tra gắng sức hoặc một số chỉ số hoạt động được xác nhận hiện có, hoặc không chính thức, bằng cách đánh giá các hoạt động sinh hoạt hàng ngày. Người bệnh không thể thực hiện hơn 4 đơn vị tương đương chuyển hóa hoạt động có nguy cơ MACE tăng, độc lập với các bệnh đồng mắc khác. Tương tự, người bệnh cao tuổi có tình trạng yếu ớt đáng kể, được định nghĩa bởi một số hệ thống tính điểm, có nguy cơ cao bị biến cố bất lợi chu phẫu.
Đánh giá các bệnh đồng mắc sẵn có cũng hữu ích để xác định nguy cơ chu phẫu, và có một số công cụ có thể được sử dụng để giúp đánh giá nguy cơ MACE. Chỉ số nguy cơ tim mạch sửa đổi là một phương pháp đơn giản và dễ dàng để ước tính nguy cơ MACE. Người bệnh được đánh giá theo sáu tiêu chí: (1) bệnh tim thiếu máu cục bộ, (2) bệnh mạch máu não, (3) creatinin huyết thanh >2 mg/dL, (4) suy tim sung huyết, (5) đái tháo đường phụ thuộc insulin, và (6) phẫu thuật nguy cơ cao. Người bệnh có không hoặc một tiêu chí có nguy cơ MACE thấp, và người bệnh đáp ứng hai hoặc nhiều tiêu chí có nguy cơ tăng. Trong khi thuật toán này đóng vai trò trung tâm trong việc định hướng đánh giá tim mạch tiền phẫu trong hướng dẫn kiểm tra tiền phẫu AHA/ACC năm 2007, tính hữu ích của nó đã giảm nhẹ trong phiên bản 2014 của hướng dẫn để ủng hộ các chỉ số đánh giá nguy cơ tiền phẫu phức tạp hơn, như Chương trình Cải thiện Chất lượng Phẫu thuật Quốc gia của Trường Môn Phẫu thuật Hoa Kỳ, Nhồi máu Cơ tim hoặc Ngừng tim, và các máy tính nguy cơ phẫu thuật.
Thuật toán hiện tại từ hướng dẫn ACC/AHA cho đánh giá tiền phẫu chi tiết quá trình ra quyết định cho kiểm tra tim mạch tiền phẫu có thể tìm thấy trong Hình 12.2.

Hình 12.2 Thuật toán cho việc ra quyết định chu phẫu, phân tầng nguy cơ, và đánh giá tim mạch tiền phẫu. ACS, Hội chứng mạch vành cấp; CAD, bệnh động mạch vành; CPG, hướng dẫn thực hành lâm sàng; GDMT, liệu pháp y tế theo hướng dẫn; HF, suy tim; MACE, biến cố tim mạch bất lợi lớn; MET, đơn vị tương đương chuyển hóa; VHD, bệnh van tim. (Được phép từ Fleisher LA, Fleischmann KE, Auerbach AD, et al. 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines. J Am Coll Cardiol. 2014;64(22)
TÁI TƯỚI MÁU CƠ TIM
Vai trò của tái tưới máu cơ tim tiền phẫu ở người bệnh có bệnh động mạch vành đáng kể vẫn còn gây tranh cãi, và tài liệu hiện tại mâu thuẫn về lợi ích lâm sàng của nó. Hầu hết các nghiên cứu lớn đánh giá tính hữu ích của tái tưới máu tiền phẫu đã được thực hiện trong quần thể phẫu thuật mạch máu có nguy cơ cao. Năm 2004, thử nghiệm CARP (Dự phòng Tái tưới máu Động mạch Vành) đã chứng minh không có lợi ích đáng kể về tỷ lệ tử vong và không giảm NMCT 30 ngày ở người bệnh được tái tưới máu tiền phẫu bằng can thiệp động mạch vành qua da (PCI) hoặc bắc cầu động mạch vành (CABG).
Việc quản lý người bệnh đang được đánh giá tiền phẫu phát hiện có bệnh động mạch vành đáng kể phụ thuộc vào (1) tính khẩn cấp của phẫu thuật, (2) phân bố giải phẫu của bệnh động mạch vành, và (3) mức độ triệu chứng lâm sàng của họ. Khuyến nghị gần đây nhất cho thấy người bệnh dự kiến phẫu thuật có nguy cơ cao được phát hiện có bệnh động mạch vành mà CABG được chỉ định nên được CABG trước khi tiến hành thủ thuật ban đầu nếu thủ thuật không mang tính nhạy cảm về thời gian. Vai trò của PCI ít rõ ràng hơn trong môi trường chu phẫu và chỉ nên thực hiện ở những người bệnh có bệnh động mạch vành thân trái không phải là ứng cử viên cho CABG hoặc người bệnh có đau thắt ngực không ổn định hoặc NMCT.
Điều quan trọng, người bệnh trình diện phẫu thuật tự chọn với gánh nặng bệnh động mạch vành đáng kể nên được tham gia vào quá trình ra quyết định phẫu thuật, với việc xem xét hủy bỏ hoặc trì hoãn phẫu thuật nếu nguy cơ chu phẫu được cảm thấy cao. Quản lý chu phẫu và các quyết định liên quan đến tái tưới máu tiền phẫu nên được thực hiện với ý kiến từ một nhóm đa chuyên ngành, bao gồm bác sĩ tim mạch, nhóm phẫu thuật và bác sĩ gây mê của người bệnh.
TỐI ƯU HÓA THUỐC
Tối ưu hóa thuốc tiền phẫu vẫn là trọng tâm chính trong tài liệu gây mê, với nhiều thử nghiệm lâm sàng lớn cố gắng xác định tiềm năng của các loại thuốc khác nhau để ngăn ngừa các biến cố thiếu máu cục bộ chu phẫu. Mặc dù một số loại thuốc đã được đánh giá, việc xác định phác đồ thuốc tối ưu để ngăn ngừa các biến cố thiếu máu cục bộ chu phẫu vẫn đang được nghiên cứu. Ở đây, chúng tôi xem xét bằng chứng hiện tại cho các loại thuốc thông thường, cũng như các hướng dẫn hiện tại cho quản lý thuốc chu phẫu.
CHẸN BETA
Việc sử dụng thuốc chẹn thụ thể beta-adrenergic trong giai đoạn chu phẫu đã là chủ đề của nghiên cứu lâm sàng mạnh mẽ. Nhìn chung, nghiên cứu về quản lý thuốc chẹn beta trong giai đoạn chu phẫu tập trung vào việc quản lý người bệnh đã dùng thuốc chẹn beta với việc kiểm tra ảnh hưởng của việc ngừng thuốc chẹn beta và ở người bệnh không dùng thuốc chẹn beta trước phẫu thuật nhưng được coi là có nguy cơ cao bị MACE chu phẫu.
Việc tiếp tục chẹn beta ở người bệnh đã dùng thuốc chẹn beta trước đó là một biện pháp cốt lõi trong Dự án Cải thiện Chăm sóc Phẫu thuật, với khuyến nghị Loại I trong hướng dẫn ACC/AHA hiện tại. Đáng ngạc nhiên, mặc dù có một nhóm y văn tiền cứu lớn kiểm tra việc bắt đầu chẹn beta trong giai đoạn chu phẫu, bằng chứng cho việc tiếp tục chẹn beta vẫn đang phát triển. Một nghiên cứu năm 2001 trên 140 người bệnh phẫu thuật mạch máu cho thấy tỷ lệ tử vong 50% ở người bệnh đã ngừng thuốc chẹn beta trong giai đoạn hậu phẫu sớm, nhưng nhóm này chỉ chiếm 8 người bệnh trong một đoàn hệ 140 người. Hoeks và đồng nghiệp đã kiểm tra một đoàn hệ tương tự gồm 711 người bệnh phẫu thuật mạch máu và phát hiện sự gia tăng tỷ lệ tử vong 1 năm ở người bệnh đã ngừng thuốc chẹn beta của họ trong chu phẫu. Hai nghiên cứu này tạo nên cơ sở cho khuyến nghị ban đầu về việc tiếp tục chẹn beta trong hướng dẫn ACC/AHA năm 2007. Các nghiên cứu gần đây hơn kiểm tra các đoàn hệ lớn hơn cho thấy sự khác biệt ít kịch tính hơn nhưng cùng kết luận rằng việc tiếp tục thuốc chẹn beta có liên quan đến nguy cơ thấp hơn về các biến cố tim mạch và tỷ lệ tử vong nói chung ở người bệnh đang nhận chúng trước phẫu thuật.
Liên quan đến việc bắt đầu chẹn beta trong giai đoạn chu phẫu, bằng chứng hiện có cho thấy việc bắt đầu vào ngày phẫu thuật có thể gây hại. Nghiên cứu lớn nhất cho đến nay đánh giá việc sử dụng thuốc chẹn beta chu phẫu là thử nghiệm POISE (Đánh giá Thiếu máu cục bộ Chu phẫu). Thử nghiệm này đã ngẫu nhiên hóa hơn 8000 người bệnh để nhận liều cao, metoprolol phóng thích kéo dài hoặc giả dược bắt đầu vào buổi sáng phẫu thuật và tiếp tục trong 30 ngày. Trong khi việc sử dụng metoprolol được phát hiện có liên quan đến nguy cơ thấp hơn của NMCT, có sự gia tăng tổng thể về nguy cơ đột quỵ và tử vong. Năm 2014, Lực lượng Đặc nhiệm ACC/AHA về Hướng dẫn Thực hành đã ban hành một đánh giá hệ thống cụ thể cho liệu pháp chẹn beta chu phẫu. Nhất quán với thử nghiệm POISE, đánh giá hệ thống này kiểm tra hơn 12.000 người bệnh đã chứng minh rằng việc bắt đầu liệu pháp chẹn beta trong vòng 1 ngày phẫu thuật có liên quan đến sự giảm tổng thể về tỷ lệ NMCT nhưng tăng đột quỵ, hạ huyết áp, và nhịp tim chậm. Nghiên cứu này cũng gợi ý khả năng tăng tỷ lệ tử vong do tim mạch và tử vong do mọi nguyên nhân trong quần thể này. Cho đến nay, hiệu quả của việc bắt đầu thuốc chẹn beta vài ngày đến vài tuần trước một cuộc phẫu thuật chưa được đánh giá nghiêm ngặt và vẫn là trọng tâm của nghiên cứu liên tục.
Khuyến nghị Hiện tạiHướng dẫn ACC/AHA năm 2014 cho người bệnh trải qua phẫu thuật không phải tim mạch gợi ý rằng người bệnh đang nhận thuốc chẹn beta trước phẫu thuật nên tiếp tục chúng trong giai đoạn chu phẫu (Loại I). Người bệnh được coi là có nguy cơ cao bị MACE chu phẫu có thể hưởng lợi từ việc bắt đầu thuốc chẹn beta trước phẫu thuật, nhưng nên có đủ thời gian để đánh giá tính an toàn và khả năng dung nạp của chẹn beta (Loại IIB). Hướng dẫn cảnh báo chống lại việc bắt đầu liệu pháp chẹn beta vào ngày phẫu thuật (Loại III). Hướng dẫn ESC/ESA năm 2014 cũng nhấn mạnh tính hữu ích của việc tiếp tục chẹn beta ở người bệnh đang nhận chúng trước phẫu thuật (Loại I) và ủng hộ việc bắt đầu thuốc chẹn beta ở người bệnh dự kiến phẫu thuật nguy cơ cao với ít nhất hai yếu tố nguy cơ lâm sàng hoặc tình trạng thể chất của Hội Gây mê Hoa Kỳ >3 hoặc người bệnh đã biết bệnh tim thiếu máu cục bộ (Loại IIB). Tuy nhiên, những hướng dẫn này ủng hộ việc xem xét atenolol hoặc bisoprolol như thuốc chẹn beta lựa chọn đầu tiên (Loại IIB), trái ngược với hướng dẫn ACC/AHA, không chỉ định thuốc chẹn beta cụ thể nào nên được sử dụng. Hướng dẫn khuyến nghị chống lại việc bắt đầu liều cao thuốc chẹn beta chu phẫu hoặc bắt đầu ở người bệnh có phẫu thuật nguy cơ thấp (Loại III). |
STATIN
Cho đến gần đây, bằng chứng cho việc sử dụng liệu pháp statin chu phẫu để ngăn ngừa MACE chỉ giới hạn ở người bệnh nguy cơ cao trải qua phẫu thuật mạch máu hoặc tim ngực, với hướng dẫn chủ yếu nhấn mạnh tính hữu ích của việc tiếp tục statin ở người bệnh được điều trị với liệu pháp statin tiền phẫu. Gần đây, London và đồng nghiệp đã thực hiện một đánh giá quan sát hồi cứu lớn trên hơn 180.000 người bệnh trải qua phẫu thuật không phải tim mạch mà thông tin của họ được ghi lại trong Cơ sở dữ liệu Cải thiện Chất lượng Phẫu thuật của Cựu chiến binh (VA). Họ phát hiện ra rằng việc tiếp xúc với statin vào ngày hoặc ngày sau phẫu thuật có liên quan đến sự giảm đáng kể tỷ lệ tử vong 30 ngày cũng như biến chứng tim, hô hấp, thận, và nhiễm trùng.
Lợi ích của việc bắt đầu liệu pháp statin ở người bệnh chưa từng dùng statin trước đó ít được định nghĩa rõ ràng hơn. Một đánh giá hệ thống năm 2015 đã kiểm tra 16 thử nghiệm đối chứng ngẫu nhiên đánh giá việc bắt đầu liệu pháp statin tiền phẫu đối với bệnh tật và tử vong. Đáng chú ý, 13 trong số 16 thử nghiệm chỉ nhìn vào người bệnh đang có CABG. Các tác giả đã chứng minh sự giảm tỷ lệ tử vong, NMCT, rung nhĩ, và thời gian nằm viện, kết luận với khuyến nghị rằng việc bắt đầu liệu pháp statin nên được xem xét ở người bệnh chưa từng dùng statin đang có phẫu thuật tim mạch, mặc dù họ không thể đưa ra khuyến nghị dựa trên phân tích nhóm con của họ trong quần thể phẫu thuật không phải tim mạch. Ngược lại, một đánh giá hệ thống Cochrane năm 2013 kết luận rằng liệu pháp statin không liên quan đến bất kỳ sự giảm đáng kể nào về tỷ lệ tử vong, tử vong cụ thể do tim mạch, hoặc NMCT, mặc dù nên lưu ý rằng mẫu được xem xét trong phân tích này khá nhỏ. Thật không may, như các tác giả của phân tích này đã lưu ý, việc sử dụng thuốc statin trong quần thể có nguy cơ MACE đã phổ biến, làm cho các thử nghiệm đối chứng ngẫu nhiên lớn khó thực hiện.
Khuyến nghị Hiện tạiHướng dẫn ACC/AHA hiện tại khuyến nghị việc tiếp tục statin trong giai đoạn chu phẫu ở người bệnh đã dùng chúng trước phẫu thuật (Loại I). Hướng dẫn cũng gợi ý rằng việc bắt đầu statin tiền phẫu là hợp lý ở người bệnh đang trải qua phẫu thuật mạch máu (Loại IIA) và tiềm năng cho các thủ thuật nguy cơ cao khác, nếu các yếu tố nguy cơ cho MACE chu phẫu có mặt (Loại IIB). Hướng dẫn ESC/ESA phản ánh hướng dẫn ACC/AHA cho việc sử dụng statin. |
THUỐC ỨC CHẾ MEN CHUYỂN ANGIOTENSIN/THUỐC CHẸN THỤ THỂ ANGIOTENSIN
Thuốc ức chế men chuyển angiotensin (ACE) và thuốc chẹn thụ thể angiotensin (ARB) là các loại thuốc thường được kê đơn để quản lý tăng huyết áp và suy tim. Mặc dù sự phổ biến của các loại thuốc này, chúng không phải là chủ đề của một số lượng lớn các thử nghiệm đối chứng ngẫu nhiên, như các loại thuốc chẹn beta-adrenergic đã có. Thay vào đó, nghiên cứu về quản lý chu phẫu của thuốc ACE/ARB đã tiến hành chủ yếu thông qua các phân tích đoàn hệ hồi cứu lớn. Nghiên cứu hiện tại tập trung vào (1) liệu có nên tiếp tục hoặc dừng thuốc ức chế ACE và ARB trong giai đoạn chu phẫu và (2) lợi ích của việc khôi phục liệu pháp sớm sau phẫu thuật.
Mặc dù các hướng dẫn ACC/AHA hiện tại khuyến nghị tiếp tục sử dụng thuốc ức chế ACE hoặc ARB trong giai đoạn chu phẫu, bằng chứng gần đây cho thấy việc ngừng các thuốc này thực sự có thể liên quan đến nguy cơ thấp hơn về tử vong hoặc biến chứng mạch máu hậu phẫu. Phân tích này đã hồi cứu nghiên cứu 4802 người bệnh đang dùng thuốc ức chế ACE hoặc ARB trải qua phẫu thuật không phải tim mạch. 1245 người bệnh đã ngừng thuốc ức chế ACE/ARB trước phẫu thuật có tỷ lệ tử vong, đột quỵ và thiếu máu cơ tim thấp hơn, cũng như ít hạ huyết áp trong mổ hơn. Nghiên cứu này trái ngược với một nghiên cứu năm 2012 của Turan và đồng nghiệp cho thấy không có sự gia tăng bệnh tật hoặc tử vong chu phẫu ở người bệnh dùng thuốc ức chế ACE và ARB trong giai đoạn chu phẫu.
Tính hữu ích của việc khôi phục sớm liệu pháp ức chế ACE hậu phẫu đã được điều tra trong một nghiên cứu đoàn hệ hồi cứu lớn về người bệnh VA trải qua phẫu thuật không phải tim mạch. Trong nghiên cứu này, các tác giả đã chứng minh rằng việc không khôi phục liệu pháp ức chế ACE trong 14 ngày đầu hậu phẫu có liên quan đến sự gia tăng lớn về tỷ lệ tử vong hậu phẫu 30 ngày (tỷ số nguy cơ, 3,44). Mặc dù phân tích hồi cứu này về người bệnh không thiết lập mối quan hệ nhân quả giữa việc không khôi phục thuốc ức chế ACE trong giai đoạn hậu phẫu và tử vong cuối cùng, nghiên cứu lớn này đã tạo nên cơ sở cho các khuyến nghị về việc khôi phục sớm liệu pháp trong hướng dẫn ACC/AHA hiện tại.
Khuyến nghị Hiện tạiHướng dẫn ACC/AHA hiện tại cho thấy việc tiếp tục thuốc ức chế ACE và ARB trong giai đoạn chu phẫu là thích hợp (Loại IIA). Ở người bệnh mà thuốc ACE/ARB bị ngừng, hướng dẫn khuyến nghị khôi phục sớm liệu pháp (Loại IIA). Hướng dẫn ESC/ESA cũng khuyến nghị tiếp tục thuốc ức chế ACE và ARB ở người bệnh với suy tim ổn định hoặc rối loạn chức năng thất trái (Loại IIA), nhưng họ gợi ý rằng việc ngừng tạm thời ở người bệnh dùng thuốc ức chế ACE hoặc ARB cho tăng huyết áp có thể thích hợp (Loại IIA). Hướng dẫn ESC/ESA cũng khuyến nghị bắt đầu thuốc ức chế ACE hoặc ARB ít nhất 1 tuần trước phẫu thuật ở người bệnh có suy tim hoặc rối loạn chức năng thất (Loại IIA). Tuy nhiên, như đã thảo luận ở trên, việc ngừng thuốc ức chế ACE và ARB trong giai đoạn chu phẫu nên được xem xét, dựa trên dữ liệu lâm sàng mới. |
THUỐC CHỦ VẬN ALPHA-2
Thuốc chủ vận alpha-2 được sử dụng rộng rãi để kiểm soát tăng huyết áp, và tính chất ức chế giao cảm của chúng làm cho chúng trở thành ứng cử viên tiềm năng để ngăn ngừa NMCT chu phẫu. Ban đầu có sự hứng khởi cho việc sử dụng thuốc chủ vận alpha-2 để bảo vệ cơ tim dựa trên các nghiên cứu sớm cho thấy lợi ích tiềm năng trong việc giảm bệnh tật chu phẫu và thiếu máu cơ tim ở người bệnh phẫu thuật mạch máu. Điều này về mặt khái niệm đã tạo nên cơ sở cho thử nghiệm POISE-2 kiểm tra tính hữu ích của cả aspirin và clonidine trong việc ngăn ngừa NMCT chu phẫu.
Thử nghiệm POISE-2 đã ngẫu nhiên hóa hơn 10.000 người bệnh để nhận clonidine hoặc giả dược có hoặc không có aspirin trong một thiết kế 2-x-2. Thật không may, cả clonidine lẫn aspirin đều không giảm tỷ lệ NMCT hoặc tử vong trong vòng 30 ngày sau phẫu thuật. Một phân tích tiếp theo đã kiểm tra khả năng tiềm năng của clonidine hoặc aspirin để ngăn ngừa tổn thương thận cấp sau phẫu thuật không phải tim mạch và một lần nữa không tìm thấy lợi ích.
Khuyến nghị Hiện tạiViệc bắt đầu hoặc sử dụng thuốc chủ vận alpha-2 để ngăn ngừa MACE chu phẫu không được khuyến nghị trong hướng dẫn ACC/AHA hiện tại (Loại III) hoặc hướng dẫn ESC/ESA. |
ASPIRIN VÀ THUỐC CHỐNG TIỂU CẦU
Một số đáng kể người bệnh có nguy cơ NMCT chu phẫu trình diện phẫu thuật đang dùng một hoặc nhiều thuốc chống tiểu cầu. Những người bệnh này có thể được chia thành một số nhóm, sẽ được thảo luận ở đây: (1) người bệnh đang dùng aspirin để dự phòng nguyên phát các biến cố tim mạch, (2) người bệnh có tiền sử bệnh động mạch vành và đã đặt stent kim loại trần, (3) người bệnh có tiền sử bệnh động mạch vành và đã đặt stent phủ thuốc, và (4) người bệnh đã trải qua CABG gần đây.
Như đã thảo luận trước đó, việc bắt đầu hoặc tiếp tục liệu pháp aspirin để ngăn ngừa NMCT chu phẫu đã được điều tra như một phần của thử nghiệm POISE-2. Nghiên cứu này đã chứng minh không có sự giảm đáng kể các biến cố thiếu máu cục bộ chu phẫu nhưng đã cho thấy sự gia tăng đáng kể về nguy cơ chảy máu lớn ở người bệnh nhận aspirin so với giả dược. Nhìn chung, thử nghiệm này cho thấy rằng việc tiếp tục aspirin ở người bệnh không có stent động mạch vành gần đây để ngăn ngừa NMCT chu phẫu có lẽ không có lợi và có thể có hại. Có một số quần thể người bệnh quan trọng bị loại trừ trong thử nghiệm này, đáng chú ý nhất là người bệnh có stent phủ thuốc hoặc stent kim loại trần gần đây, trong đó việc quản lý thuốc chống tiểu cầu xứng đáng được xem xét đặc biệt.
Người bệnh có đặt stent gần đây có nguy cơ cao bị huyết khối trong stent, đặc biệt với việc ngừng liệu pháp chống tiểu cầu. Tuy nhiên, cách tiếp cận tối ưu cho việc quản lý liệu pháp chống tiểu cầu kép ở những người bệnh này trong giai đoạn chu phẫu vẫn chưa rõ ràng. Một cập nhật hướng dẫn ACC/AHA gần đây về quản lý liệu pháp chống tiểu cầu kép ủng hộ một cách tiếp cận tinh tế hơn đối với liệu pháp chống tiểu cầu ở người bệnh có bệnh động mạch vành, với thời gian liệu pháp dựa trên loại stent được đặt, liệu người bệnh có trình diện với bệnh tim thiếu máu cục bộ ổn định hoặc hội chứng mạch vành cấp, và đánh giá nguy cơ chảy máu tổng thể của người bệnh. Ở người bệnh có bệnh tim thiếu máu cục bộ ổn định và nguy cơ chảy máu cao, hướng dẫn gợi ý rằng có thể thích hợp để ngừng clopidogrel sớm nhất là 3 tháng sau khi đặt stent phủ thuốc.
Mối liên hệ giữa chỉ định stent và MACE chu phẫu gần đây đã được điều tra như một phần của một phân tích hồi cứu lớn về người bệnh VA ở Hoa Kỳ trải qua phẫu thuật không phải tim mạch. Trong nghiên cứu này, người bệnh có stent đặt cho NMCT có nguy cơ MACE chu phẫu tăng đáng kể, bất kể loại stent nào được đặt. Mặc dù những dữ liệu và khuyến nghị này chưa được đưa vào hướng dẫn cho quản lý chu phẫu, có vẻ như một cách tiếp cận có chọn lọc hơn đối với việc ngừng thuốc chống tiểu cầu có thể sắp tới.
Trong những khuyến nghị này, người bệnh trải qua CABG cũng có các khuyến nghị phân tầng dựa trên việc trình diện của họ, với khuyến nghị Loại I cho việc sử dụng chất ức chế P2Y12 ở người bệnh có hội chứng mạch vành cấp trải qua CABG và khuyến nghị Loại IIB cho 12 tháng liệu pháp chất ức chế P2Y12 ở người bệnh trình diện với bệnh tim thiếu máu cục bộ ổn định.
Cuối cùng, một người bệnh trình diện phẫu thuật không phải tim mạch đang dùng liệu pháp chống tiểu cầu nên trải qua đánh giá nguy cơ toàn diện với sự tham gia của bác sĩ tim mạch, bác sĩ gây mê, và nhóm phẫu thuật của người bệnh để thảo luận về các nguy cơ tương đối của chảy máu phẫu thuật và các biến cố tim mạch chu phẫu. Việc ngừng liệu pháp chống tiểu cầu, đặc biệt ở người bệnh có đặt stent tim gần đây, có thể làm tăng nguy cơ huyết khối/hẹp trong stent và NMCT chu phẫu. Tùy thuộc vào tính khẩn cấp của ca phẫu thuật, có thể thích hợp để trì hoãn phẫu thuật nhằm cố gắng giảm nguy cơ tiềm năng của việc ngừng liệu pháp chống tiểu cầu.
Khuyến nghị Hiện tạiHướng dẫn ACC/AHA hiện tại khuyến nghị tiếp tục liệu pháp chống tiểu cầu kép ở bất kỳ người bệnh nào trải qua phẫu thuật không phải tim mạch trong 4-6 tuần đầu tiên sau khi đặt stent kim loại trần hoặc stent phủ thuốc. Nếu cần thiết để ngừng chất ức chế P2Y12 của người bệnh, aspirin nên được tiếp tục và chất ức chế P2Y12 nên được bắt đầu lại ngay khi an toàn sau thủ thuật phẫu thuật (Loại I). Ở người bệnh không có stent mạch vành trước đó, các bác sĩ lâm sàng có thể tiếp tục aspirin khi nguy cơ chảy máu thấp hơn nguy cơ biến cố tim mạch (Loại IIb), nhưng việc bắt đầu hoặc tiếp tục aspirin không có lợi trong phẫu thuật không phải tim mạch tự chọn không liên quan đến can thiệp động mạch cảnh (Loại III) (Hình 12.3). Hướng dẫn ESC/ESA cũng khuyến nghị tiếp tục aspirin trong tối thiểu 4 tuần sau khi đặt stent kim loại trần hoặc 3-12 tháng sau khi đặt stent phủ thuốc, trừ khi nguy cơ chảy máu đe dọa tính mạng được coi là không thích hợp cao (Loại I) với một khung thời gian tương tự cho người bệnh dùng chất ức chế P2Y12 (Loại IIA). Ngoài những khoảng thời gian này, việc quản lý người bệnh dùng aspirin hoặc chất ức chế P2Y12 nên được thực hiện với xem xét nguy cơ tiềm năng của chảy máu cân bằng với nguy cơ MACE chu phẫu của người bệnh. Liên quan đến thời gian của phẫu thuật tự chọn sau khi đặt stent, hướng dẫn ACC/AHA khuyến nghị trì hoãn 14 ngày sau nong mạch bằng bóng, 30 ngày sau khi đặt stent kim loại trần, và 365 ngày sau khi đặt stent phủ thuốc (Loại I), mặc dù phẫu thuật không phải tim mạch tự chọn có thể được xem xét ở 180 ngày sau khi đặt stent phủ thuốc (Loại IIB). Phẫu thuật không phải tim mạch tự chọn không nên được thực hiện trong vòng 30 ngày đặt stent kim loại trần hoặc 365 ngày đặt stent phủ thuốc nếu yêu cầu ngừng liệu pháp chống tiểu cầu kép chu phẫu. Thời gian này phù hợp với thời gian được phác thảo trong hướng dẫn ESC/ESA. |
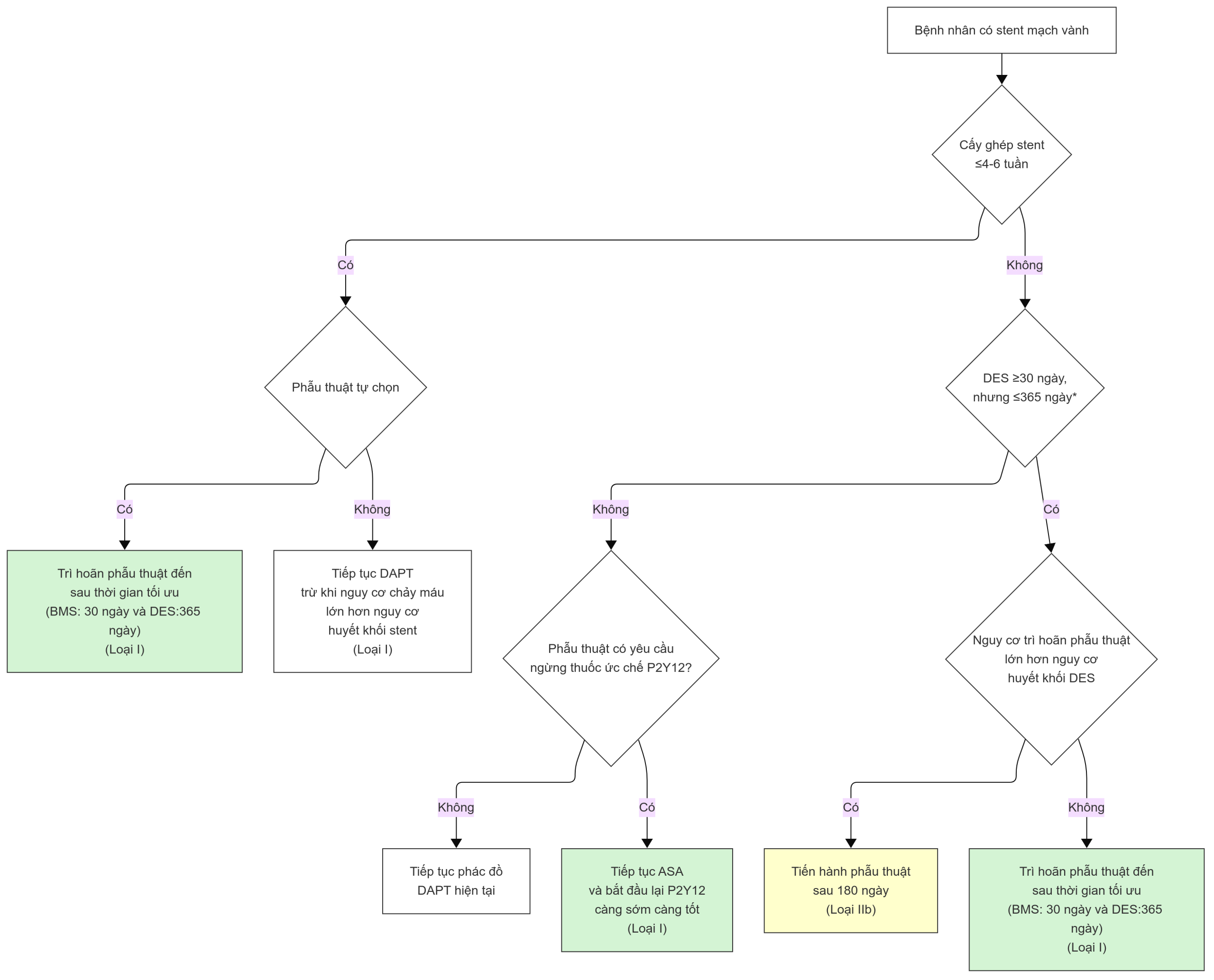
Hình 12.3 Thuật toán quản lý người bệnh đang dùng liệu pháp chống tiểu cầu kép sau khi đặt stent tim.
ASA, Acetylsalicylic acid (aspirin); BMS, stent kim loại trần; DES, stent phủ thuốc; DAPT, liệu pháp chống tiểu cầu kép; P2Y12, chất ức chế. (Được phép từ Fleisher LA, Fleischmann KE, Auerbach AD, et al. 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines. J Am Coll Cardiol. 2014;64(22)
B. QUẢN LÝ TRONG MỔ
LỰA CHỌN GÂY MÊ
Mặc dù có một lượng lớn bằng chứng kiểm tra các lợi ích tương đối của gây tê vùng trục thần kinh, gây tê vùng, và gây mê toàn thân ở người bệnh có nguy cơ biến cố bất lợi chu phẫu, kỹ thuật gây mê “lý tưởng” cho nhóm người bệnh này vẫn khó nắm bắt. Một đánh giá hệ thống Cochrane lớn về các đánh giá hệ thống trước đó đã kiểm tra các thử nghiệm đánh giá tính hữu ích của gây tê vùng trục thần kinh so với gây mê toàn thân trong việc cải thiện kết quả chu phẫu. Trong thử nghiệm này, các tác giả đã chứng minh sự giảm tổng thể về tỷ lệ tử vong (7,9% vs 5,2%) và viêm phổi hậu phẫu (16,8% vs 7,6%) trong nhóm gây tê vùng trục thần kinh, nhưng không có sự khác biệt về NMCT chu phẫu. Ngược lại, việc thêm một kỹ thuật gây tê vùng trục thần kinh vào gây mê toàn thân dường như không cải thiện tỷ lệ tử vong chu phẫu hoặc bệnh tật tim mạch, nhưng nó vẫn cho thấy lợi ích trong việc ngăn ngừa viêm phổi chu phẫu.
Tính hữu ích của gây mê hít so với gây mê tĩnh mạch cũng vẫn không chắc chắn. Dựa trên tài liệu hiện có, hướng dẫn ACC/AHA năm 2007 khuyến nghị xem xét việc sử dụng gây mê hít hơn gây mê tĩnh mạch ở người bệnh có nguy cơ thiếu máu cơ tim chu phẫu, mặc dù dữ liệu tại thời điểm xuất bản chủ yếu giới hạn ở quần thể phẫu thuật tim mạch, với sự ngoại suy đến người bệnh phẫu thuật không phải tim mạch. Nghiên cứu thêm trong quần thể phẫu thuật không phải tim mạch không chứng minh bất kỳ lợi thế nào từ gây mê hít so với gây mê tĩnh mạch. Dựa vào bằng chứng gần đây, hướng dẫn ACC/AHA năm 2014 không còn khuyến nghị việc sử dụng gây mê hít như một phương tiện để giảm thiếu máu cơ tim ở phẫu thuật không phải tim mạch.
THEO DÕI THIẾU MÁU CỤC BỘ
Đánh giá trong mổ về thiếu máu cơ tim cục bộ là một trách nhiệm quan trọng của bác sĩ gây mê chăm sóc người bệnh trong phòng mổ. Phương pháp phổ biến nhất để theo dõi thiếu máu cơ tim cục bộ trong giai đoạn chu phẫu là thông qua điện tâm đồ (ECG) thường quy. Theo dõi ECG là một tiêu chuẩn theo dõi của Hội Gây mê Hoa Kỳ và được sử dụng trong hầu hết mọi gây mê được thực hiện ở Hoa Kỳ. Thông thường, một ECG năm điện cực được sử dụng để cho phép theo dõi nhiều chuyển đạo trong quá trình gây mê, từ đó tăng độ nhạy của ECG đối với thiếu máu cơ tim cục bộ. Thật không may, các hạn chế phẫu thuật (thay đổi vị trí điện cực), lọc, và nhiễu có thể dẫn đến tín hiệu ECG không tối ưu, giảm độ nhạy của ECG đối với NMCT.
Đặt catheter động mạch phổi cũng có thể cung cấp bằng chứng về thiếu máu cơ tim cục bộ đang phát triển, mặc dù việc sử dụng nó bên ngoài phòng mổ phẫu thuật tim mạch đang trở nên ngày càng hiếm. Thiếu máu cơ tim cục bộ có thể biểu hiện như một sự giảm cấp tính chỉ số tim, thường đi kèm với sự tăng áp lực mao mạch phổi bít. Một đánh giá Cochrane lớn kiểm tra tính hữu ích tiềm năng của catheter động mạch phổi trong môi trường chăm sóc tích cực đã chứng minh không có sự thay đổi đáng kể về tỷ lệ tử vong, thời gian nằm viện, hoặc chi phí, mặc dù có thể lập luận rằng việc sử dụng catheter động mạch phổi như một máy theo dõi không nhất thiết dẫn đến cải thiện kết quả lâm sàng. Bất kể những cân nhắc này, việc đặt catheter động mạch phổi bên ngoài phẫu thuật tim và ghép gan thường được dành cho người bệnh có nguy cơ đặc biệt cao.
Siêu âm tim qua thực quản (TEE) là một phương thức hữu ích và nhạy cảm khác để phát hiện thiếu máu cơ tim cục bộ chu phẫu đang được sử dụng ngày càng nhiều trong phẫu thuật không phải tim mạch. Sự hiện diện của một bất thường vận động thành mới trên TEE thường là dấu hiệu sớm nhất của thiếu máu cơ tim cục bộ mới xuất hiện. Thú vị, có sự thiếu đồng thuận đáng kể giữa TEE và ECG, gợi ý rằng chúng là các phương thức bổ sung cho đánh giá thiếu máu cục bộ chu phẫu. Việc sử dụng TEE trong phẫu thuật tim mạch đã được thiết lập tốt, với hướng dẫn thực hành lâm sàng gợi ý việc sử dụng nó ở tất cả người bệnh trải qua phẫu thuật tim mở hoặc phẫu thuật động mạch chủ ngực.
Ngược lại, hướng dẫn cho việc sử dụng TEE trong phẫu thuật không phải tim mạch ít được định nghĩa rõ ràng hơn. Hướng dẫn Thực hành năm 2010 cho Siêu âm tim qua thực quản Chu phẫu gợi ý rằng TEE nên được sử dụng khi phẫu thuật được lên kế hoạch hoặc bệnh lý của người bệnh có thể dẫn đến rối loạn huyết động, hô hấp, hoặc thần kinh nghiêm trọng hoặc trong sự hiện diện của không ổn định huyết động không giải thích được.
Một đánh giá gần đây về 364 lần quét TEE cứu hộ được thực hiện cho không ổn định huyết động không giải thích được ở người bệnh phòng mổ thông thường phát hiện thấy bất thường vận động thành cơ tim mới là nguyên nhân phổ biến thứ tư của tình trạng mất bù chu phẫu (13,5%) sau giảm thể tích máu (24,5%) và suy thất trái toàn bộ (16,5%) hoặc thất phải (16,2%). Trong trường hợp nghi ngờ thiếu máu cục bộ trong mổ hoặc không ổn định huyết động dai dẳng, TEE là một phương tiện theo dõi xuất sắc để hướng dẫn điều trị.
QUẢN LÝ THIẾU MÁU CỤC BỘ TRONG MỔ
Một khi sự hiện diện của thiếu máu cục bộ trong mổ bị nghi ngờ hoặc xác nhận, bác sĩ gây mê phải thực hiện các bước để cố gắng giảm thiểu tổn thương cơ tim và hướng dẫn điều trị thích hợp. Cách tiếp cận đối với thiếu máu cục bộ trong mổ nên được hướng dẫn bởi (1) thời gian xuất hiện, (2) tính khẩn cấp của thủ thuật phẫu thuật, (3) loại thiếu máu cục bộ hoặc thay đổi ECG được quan sát thấy, và (4) mức độ không ổn định huyết động.
Nếu bằng chứng thiếu máu cơ tim cục bộ được quan sát thấy trước khi bắt đầu thủ thuật phẫu thuật, thủ thuật nên được trì hoãn để cho phép đánh giá thêm và can thiệp có thể. Nếu thủ thuật phẫu thuật là khẩn cấp hoặc cấp cứu, hoặc thiếu máu cục bộ xảy ra tại một điểm mà thủ thuật không thể bị hủy bỏ, bác sĩ gây mê nên cố gắng giảm thiểu thiếu máu cơ tim do nhu cầu bằng cách tối ưu hóa cung cấp và nhu cầu oxy cơ tim của người bệnh. Điều này được thực hiện bằng cách tăng huyết áp tâm trương (tăng cường áp lực tưới máu mạch vành), giảm nhịp tim, tăng phân số oxy hít vào, và tăng cung cấp oxy qua truyền máu, tùy thuộc vào mức độ mất máu phẫu thuật và nhu cầu hồi sức liên tục.
Nitroglycerin và heparin cũng có thể được sử dụng nếu người bệnh ổn định về huyết động và chống đông máu được chấp nhận bởi nhóm phẫu thuật.
Người bệnh có bằng chứng thiếu máu cơ tim cục bộ và không ổn định huyết động đòi hỏi hồi sức tích cực để cố gắng ngăn ngừa suy giảm thêm và ngừng tim. TEE có thể cung cấp hướng dẫn về nguyên nhân của không ổn định huyết động và mức độ rối loạn chức năng cơ tim. Những người bệnh này có thể cần hỗ trợ thuốc vận mạch ngoài hỗ trợ thuốc tăng co bóp cơ tim, mặc dù nên thận trọng khi sử dụng thuốc tăng co bóp ở người bệnh đang thiếu máu cục bộ vì nguy cơ làm trầm trọng thêm sự mất cân bằng cung cấp và nhu cầu oxy cơ tim cũng như nguy cơ rối loạn nhịp tim ác tính. Ở người bệnh có thiếu máu cơ tim cục bộ kháng trị và mất bù huyết động, việc sử dụng bóng đối xung động mạch chủ trong có thể được xem xét như một cầu nối đến liệu pháp dứt điểm (Hình 12.4).

Hình 12.4 Thuật toán đề xuất cho việc quản lý nhồi máu cơ tim không ST chênh lên chu phẫu.
ACE, Men chuyển angiotensin; IABP, bóng đối xung động mạch chủ trong; NSTEMI, nhồi máu cơ tim không ST chênh lên. (Được phép từ Adesanya AO, de Lemos JA, Greilich NB, et al. Management of perioperative myocardial infarction in noncardiac surgical patients. Chest. 2006;130(2):584–596.)RetryClaude can make mistakes. Please double-check responses.
Việc quản lý hậu phẫu người bệnh có thiếu máu cơ tim cục bộ chu phẫu là thách thức, vì các thuốc chống tiểu cầu và chống đông máu thường được sử dụng trong quản lý nội khoa cấp tính thiếu máu cơ tim cục bộ có thể làm trầm trọng thêm chảy máu phẫu thuật. Ngoại trừ người bệnh có chống chỉ định tuyệt đối với chống đông máu, người bệnh bị nhồi máu cơ tim cấp có đoạn ST chênh lên nên được chuyển đến PCI cấp cứu. Việc quản lý người bệnh có nhồi máu cơ tim không ST chênh lên ít rõ ràng hơn nhưng nên tiến hành với xem xét phân tầng nguy cơ của người bệnh và mức độ không ổn định huyết động. Người bệnh không ổn định về huyết động với nghi ngờ thiếu máu cục bộ thường cần PCI. Người bệnh ổn định về huyết động thường có thể ban đầu được quản lý bằng nội khoa, với việc sử dụng thuốc chống tiểu cầu, statin, chẹn beta-adrenergic được chuẩn độ, và thuốc ức chế ACE. Nếu người bệnh biểu hiện các đặc điểm nguy cơ cao khác cho sự tiến triển đến nhồi máu trầm trọng hơn hoặc tử vong, họ có thể được chuyển đến PCI. Người bệnh có nguy cơ thấp hơn có thể được quản lý bảo tồn hơn, với theo dõi hậu phẫu chặt chẽ.
Việc sử dụng thuốc chống đông máu để ngăn ngừa các biến cố lâm sàng bất lợi tiếp theo sau tổn thương cơ tim chu phẫu là một chiến lược mới nổi để giảm thiểu hậu quả lâm sàng của những biến cố này. Năm 2018, thử nghiệm MANAGE (Quản lý Tổn thương Cơ tim Sau Phẫu thuật Không phải Tim mạch) đã đánh giá tính hữu ích của dabigatran, một chất ức chế thrombin trực tiếp, để ngăn ngừa tổng hợp các biến chứng mạch máu hoặc tử vong, NMCT, đột quỵ không xuất huyết, huyết khối động mạch ngoại vi, cắt cụt, và thuyên tắc tĩnh mạch có triệu chứng sau phẫu thuật không phải tim mạch có biến chứng tổn thương cơ tim (được đánh giá bằng troponin hậu phẫu).
Thử nghiệm này cho thấy sự giảm tổng thể về tỷ lệ kết quả tổng hợp mà không tăng biến chứng chảy máu ở người bệnh nhận dabigatran hai lần mỗi ngày. Dựa trên những dữ liệu này, các tác giả của thử nghiệm đã khuyến nghị đo troponin ở người bệnh có nguy cơ trải qua phẫu thuật không phải tim mạch và điều trị người bệnh có tổn thương cơ tim bằng dabigatran sau phẫu thuật. Cho đến nay, quy trình này chưa được triển khai rộng rãi.
TIỀN ĐIỀU HÒA THIẾU MÁU CỤC BỘ
Việc sử dụng một giai đoạn ngắn thiếu máu cục bộ để cố gắng giảm thiểu tổn thương thiếu máu cục bộ tiếp theo được gọi là tiền điều hòa thiếu máu cục bộ. Các cơ chế cơ bản của tiền điều hòa thiếu máu cục bộ đã là chủ đề của điều tra mở rộng bắt đầu từ những năm 1980. Nghiên cứu ban đầu tập trung vào tiền điều hòa thiếu máu cục bộ trực tiếp, trong đó tắc nghẽn tạm thời của động mạch vành được sử dụng để cố gắng giảm tổn thương thiếu máu cục bộ tiếp theo. tiền điều hòa thiếu máu cục bộ cơ tim trực tiếp đã được chứng minh là có lợi trong việc giảm bằng chứng sinh hóa của thiếu máu cục bộ, cũng như giảm kích thước nhồi máu ở một số loài.
Điều thú vị là, tiền điều hòa thiếu máu cục bộ dường như liên quan đến một giai đoạn hai đỉnh bảo vệ. Sau tổn thương thiếu máu cục bộ ban đầu, có một giai đoạn bảo vệ thiếu máu cục bộ tạm thời 1-2 giờ, sau đó hồi phục và sau đó xuất hiện lại trong khoảng thời gian từ 24 đến 72 giờ sau sự kiện thiếu máu cục bộ. Việc áp dụng tiền điều hòa thiếu máu cục bộ trực tiếp trong phẫu thuật tim mạch đã được đánh giá trong một phân tích tổng hợp cho thấy ít rối loạn nhịp thất, yêu cầu thuốc tăng co bóp thấp hơn, và thời gian lưu trú tại đơn vị chăm sóc tích cực ngắn hơn. Các cơ chế cơ bản của tiền điều hòa thiếu máu cục bộ rất phức tạp, nhưng chúng chủ yếu liên quan đến sự hoạt hóa của nhiều con đường truyền tín hiệu điều chỉnh quá trình apoptosis và chuyển hóa năng lượng nội bào.
Trong giai đoạn đầu điều tra tiền điều hòa thiếu máu cục bộ, người ta đã phát hiện ra rằng những tác động bảo vệ tế bào này có thể được trung gian bởi một giai đoạn tạm thời thiếu máu cục bộ tại một vị trí xa với tim, hoặc một chi hoặc một cơ quan khác. Điều này được biết đến như “tiền điều hòa thiếu máu cục bộ từ xa.” Điều này mở rộng khả năng áp dụng tiềm năng đến các trường hợp phẫu thuật không phải tim mạch, vì thao tác trực tiếp của động mạch chủ và tim không còn cần thiết. Dữ liệu sơ bộ gợi ý rằng điều này có thể tiềm năng bảo vệ tương đương ở người bệnh phẫu thuật tim mạch, nhưng hai thử nghiệm lâm sàng lớn vào năm 2015 không thành công trong việc cho thấy bất kỳ lợi ích nào. Dựa vào kết quả của hai thử nghiệm này, các tác giả của văn bản này không khuyến nghị việc sử dụng thường quy tiền điều hòa thiếu máu cục bộ từ xa ở người bệnh phẫu thuật không phải tim mạch.
Hướng Đi Tương lai trong Phòng ngừa/Quản lý Thiếu máu Cục bộCho đến nay, phân tầng nguy cơ chu phẫu chủ yếu được thực hiện bằng cách đánh giá bệnh đồng mắc của người bệnh kết hợp với nguy cơ nhận thức của ca phẫu thuật của họ, được phân loại rộng rãi thành nguy cơ thấp, trung bình, hoặc cao. Bằng chứng gần đây cho thấy một cách tiếp cận chi tiết hơn đối với phân tầng nguy cơ có thể khả thi. Trong tương lai, việc phát triển các máy tính nguy cơ phẫu thuật ngày càng phức tạp để cho phép đánh giá nguy cơ tiền phẫu chính xác hơn sẽ khả thi, với việc ngày càng có sẵn các bộ dữ liệu chu phẫu lớn và đăng ký kết quả. Việc sử dụng máy học để cá nhân hóa các can thiệp y tế đã thu hút ngày càng nhiều sự chú ý trong cộng đồng y tế, mặc dù tính hữu ích của nó trong việc thay đổi quỹ đạo của người bệnh vẫn đang được tranh luận. Mặc dù việc áp dụng các công cụ hỗ trợ quyết định đơn giản để tăng cường quản lý chu phẫu đã được chứng minh là có lợi, vai trò của máy học trong việc cải thiện kết quả chu phẫu vẫn ít rõ ràng hơn. Trong tương lai, dự kiến rằng việc áp dụng các kỹ thuật phân tích dữ liệu phức tạp để phát triển một cách tiếp cận cá nhân hóa đối với quản lý chu phẫu có thể trở thành một thành phần của chăm sóc gây mê và có thể giúp giảm thiểu các biến cố thiếu máu cục bộ lớn và cải thiện kết quả của người bệnh. |
HẾT CHƯƠNG 12.
Chú giải Thuật ngữ Y học Anh – Việt – Chương 12 (Người Dịch)
| STT | Thuật ngữ tiếng Anh | Phiên âm | Nghĩa Tiếng Việt |
|---|---|---|---|
| 1 | Perioperative myocardial infarction | ˌpɛriˈɒpərətɪv maɪəˈkɑːdɪəl ɪnˈfɑːkʃən | Nhồi máu cơ tim chu phẫu |
| 2 | Major adverse cardiac events (MACE) | ˈmeɪdʒər ˈædvɜːs ˈkɑːdiæk ɪˈvɛnts | Biến cố tim mạch bất lợi lớn |
| 3 | Acute coronary thrombosis | əˈkjuːt ˈkɒrənəri θrɒmˈbəʊsɪs | Huyết khối động mạch vành cấp tính |
| 4 | Oxygen supply and demand mismatch | ˈɒksɪdʒən səˈplaɪ ænd dɪˈmɑːnd ˈmɪsmætʃ | Mất cân bằng cung cấp và nhu cầu oxy |
| 5 | Hemodynamic disturbances | ˌhiːməʊdaɪˈnæmɪk dɪˈstɜːbənsɪz | Rối loạn huyết động |
| 6 | Risk stratification | rɪsk ˌstrætɪfɪˈkeɪʃən | Phân tầng nguy cơ |
| 7 | Acute coronary syndrome | əˈkjuːt ˈkɒrənəri ˈsɪndrəʊm | Hội chứng mạch vành cấp |
| 8 | Demand ischemia | dɪˈmɑːnd ɪsˈkiːmiə | Thiếu máu cục bộ do nhu cầu |
| 9 | Plaque rupture | plæk ˈrʌptʃə | Vỡ mảng xơ vữa |
| 10 | Collateralization | kəˌlætərəlaɪˈzeɪʃən | Sự phát triển tuần hoàn bàng hệ |
| 11 | Metabolic equivalents (METs) | mɛtəˈbɒlɪk ɪˈkwɪvələnts | Đơn vị tương đương chuyển hóa |
| 12 | Frailty | ˈfreɪlti | Tình trạng yếu ớt |
| 13 | Revised cardiac risk index | rɪˈvaɪzd ˈkɑːdiæk rɪsk ˈɪndɛks | Chỉ số nguy cơ tim mạch sửa đổi |
| 14 | Myocardial revascularization | maɪəˈkɑːdiəl riːˌvæskjʊləraɪˈzeɪʃən | Tái tưới máu cơ tim |
| 15 | Percutaneous coronary intervention (PCI) | pəˈkjuːteɪniəs ˈkɒrənəri ˌɪntəˈvɛnʃən | Can thiệp động mạch vành qua da |
| 16 | Coronary artery bypass grafting (CABG) | ˈkɒrənəri ˈɑːtəri ˈbaɪpɑːs ˈgrɑːftɪŋ | Bắc cầu động mạch vành |
| 17 | Left main coronary artery disease | lɛft meɪn ˈkɒrənəri ˈɑːtəri dɪˈziːz | Bệnh động mạch vành thân trái |
| 18 | Unstable angina | ʌnˈsteɪbəl ænˈdʒaɪnə | Đau thắt ngực không ổn định |
| 19 | Beta-blockade | ˈbiːtə ˈblɒkeɪd | Chẹn beta |
| 20 | Beta-adrenergic blocking agents | ˈbiːtə ædrəˈnɜːdʒɪk ˈblɒkɪŋ ˈeɪdʒənts | Thuốc chẹn thụ thể beta-adrenergic |
| 21 | Surgical Care Improvement Project | ˈsɜːdʒɪkəl keə ɪmˈpruːvmənt ˈprɒdʒɛkt | Dự án Cải thiện Chăm sóc Phẫu thuật |
| 22 | POISE trial | pɔɪz ˈtraɪəl | Thử nghiệm POISE (Đánh giá Thiếu máu cục bộ Chu phẫu) |
| 23 | Extended-release metoprolol | ɪkˈstɛndɪd rɪˈliːs mɪˈtɒprəlɒl | Metoprolol phóng thích kéo dài |
| 24 | Hypotension | ˌhaɪpəʊˈtɛnʃən | Hạ huyết áp |
| 25 | Bradycardia | ˌbrædɪˈkɑːdiə | Nhịp tim chậm |
| 26 | Statins | ˈstætɪnz | Statin (thuốc ức chế HMG-CoA reductase) |
| 27 | ACE inhibitors | eɪs ɪnˈhɪbɪtəz | Thuốc ức chế men chuyển angiotensin |
| 28 | Angiotensin receptor blockers (ARBs) | ænˈdʒiəʊtɛnsɪn rɪˈsɛptə ˈblɒkəz | Thuốc chẹn thụ thể angiotensin |
| 29 | Alpha-2 agonists | ˈælfə tuː ˈægənɪsts | Thuốc chủ vận alpha-2 |
| 30 | POISE-2 trial | pɔɪz tuː ˈtraɪəl | Thử nghiệm POISE-2 |
| 31 | Clonidine | ˈklɒnɪdiːn | Clonidine |
| 32 | Aspirin | ˈæsprɪn | Aspirin |
| 33 | Antiplatelet agents | ˌæntiˈpleɪtlɪt ˈeɪdʒənts | Thuốc chống tiểu cầu |
| 34 | Bare metal stent | beə ˈmɛtl stɛnt | Stent kim loại trần |
| 35 | Drug-eluting stent | drʌg ɪˈluːtɪŋ stɛnt | Stent phủ thuốc |
| 36 | In-stent thrombosis | ɪn stɛnt θrɒmˈbəʊsɪs | Huyết khối trong stent |
| 37 | Dual antiplatelet therapy | ˈdjuːəl ˌæntiˈpleɪtlɪt ˈθɛrəpi | Liệu pháp chống tiểu cầu kép |
| 38 | P2Y12 inhibitor | piː tuː waɪ twɛlv ɪnˈhɪbɪtə | Chất ức chế P2Y12 |
| 39 | Clopidogrel | kləˈpɪdəgrɛl | Clopidogrel |
| 40 | Neuraxial anesthesia | njʊəˈræksɪəl ˌænɪsˈθiːzɪə | Gây tê vùng trục thần kinh |
| 41 | Regional anesthesia | ˈriːdʒənl ˌænɪsˈθiːzɪə | Gây tê vùng |
| 42 | General anesthesia | ˈdʒɛnərəl ˌænɪsˈθiːzɪə | Gây mê toàn thân |
| 43 | Volatile anesthesia | ˈvɒlətaɪl ˌænɪsˈθiːzɪə | Gây mê hít |
| 44 | Intravenous anesthesia | ˌɪntrəˈviːnəs ˌænɪsˈθiːzɪə | Gây mê tĩnh mạch |
| 45 | Electrocardiography (ECG) | ɪˌlɛktrəʊkɑːdiˈɒgrəfi | Điện tâm đồ |
| 46 | Pulmonary artery catheterization | ˈpʌlmənəri ˈɑːtəri kəˌθiːtəraɪˈzeɪʃən | Đặt catheter động mạch phổi |
| 47 | Cardiac index | ˈkɑːdiæk ˈɪndɛks | Chỉ số tim |
| 48 | Pulmonary capillary wedge pressure | ˈpʌlmənəri kəˈpɪləri wɛdʒ ˈprɛʃə | Áp lực mao mạch phổi bít |
| 49 | Transesophageal echocardiography (TEE) | trænzɪˈsɒfəgɪəl ˌɛkəʊkɑːdiˈɒgrəfi | Siêu âm tim qua thực quản |
| 50 | Regional wall motion abnormality | ˈriːdʒənl wɔːl ˈməʊʃən æbnɔːˈmælɪti | Bất thường vận động thành vùng |
| 51 | Nitroglycerin | ˌnaɪtrəʊˈglɪsərɪn | Nitroglycerin |
| 52 | Heparin | ˈhɛpərɪn | Heparin |
| 53 | Inotropic support | ˌɪnəˈtrɒpɪk səˈpɔːt | Hỗ trợ tăng co bóp |
| 54 | Vasopressor support | ˌveɪzəʊˈprɛsə səˈpɔːt | Hỗ trợ thuốc vận mạch |
| 55 | Intra-aortic balloon counterpulsation | ˌɪntrə eɪˈɔːtɪk bəˈluːn ˈkaʊntəpʌlˈseɪʃən | Bóng đối xung động mạch chủ trong |
| 56 | ST-elevation myocardial infarction | ɛs tiː ˌɛlɪˈveɪʃən maɪəˈkɑːdiəl ɪnˈfɑːkʃən | Nhồi máu cơ tim ST chênh lên |
| 57 | Non ST-elevation myocardial infarction | nɒn ɛs tiː ˌɛlɪˈveɪʃən maɪəˈkɑːdiəl ɪnˈfɑːkʃən | Nhồi máu cơ tim không ST chênh lên |
| 58 | Anticoagulant agents | ˌæntikoʊˈægjʊlənt ˈeɪdʒənts | Thuốc chống đông máu |
| 59 | MANAGE trial | ˈmænɪdʒ ˈtraɪəl | Thử nghiệm MANAGE |
| 60 | Dabigatran | dəˈbɪgətrən | Dabigatran (chất ức chế thrombin trực tiếp) |
| 61 | Ischemic preconditioning | ɪsˈkiːmɪk ˌpriːkənˈdɪʃənɪŋ | Tiền điều hòa thiếu máu cục bộ |
| 62 | Direct ischemic preconditioning | dəˈrɛkt ɪsˈkiːmɪk ˌpriːkənˈdɪʃənɪŋ | Tiền điều hòa thiếu máu cục bộ trực tiếp |
| 63 | Remote ischemic preconditioning | rɪˈməʊt ɪsˈkiːmɪk ˌpriːkənˈdɪʃənɪŋ | Tiền điều hòa thiếu máu cục bộ từ xa |
| 64 | Signal transduction pathways | ˈsɪgnəl trænzˈdʌkʃən ˈpɑːθweɪz | Con đường truyền tín hiệu |
| 65 | Apoptosis | ˌæpəpˈtəʊsɪs | Quá trình apoptosis (chết tế bào theo chương trình) |
| 66 | Intracellular energy metabolism | ˌɪntrəˈsɛljʊlə ˈɛnədʒi mɪˈtæbəlɪzəm | Chuyển hóa năng lượng nội bào |
| 67 | Machine learning | məˈʃiːn ˈlɜːnɪŋ | Máy học |
| 68 | Ventricular arrhythmias | vɛnˈtrɪkjʊlə əˈrɪðmiəz | Rối loạn nhịp thất |
| 69 | Atenolol | əˈtɛnəlɒl | Atenolol |
| 70 | Bisoprolol | baɪˈsɒprəlɒl | Bisoprolol |
| 71 | Troponin | ˈtrəʊpənɪn | Troponin |
| 72 | Balloon angioplasty | bəˈluːn ˈændʒiəʊˌplæsti | Nong mạch bằng bóng |
| 73 | Carotid artery intervention | kəˈrɒtɪd ˈɑːtəri ˌɪntəˈvɛnʃən | Can thiệp động mạch cảnh |
| 74 | Cardiogenic shock | ˌkɑːdɪəʊˈdʒɛnɪk ʃɒk | Sốc tim |
| 75 | HMG-CoA reductase inhibitors | eɪtʃ ɛm dʒiː koʊ eɪ rɪˈdʌkteɪs ɪnˈhɪbɪtəz | Thuốc ức chế HMG-CoA reductase |
| 76 | ACC/AHA guidelines | eɪ si: si:/ eɪ eɪtʃ eɪ ˈgaɪdlaɪnz | Hướng dẫn ACC/AHA |
| 77 | ESC/ESA guidelines | i: ɛs si:/ i: ɛs eɪ ˈgaɪdlaɪnz | Hướng dẫn ESC/ESA |
| 78 | Atherosclerotic lesions | ˌæθərəʊskləˈrɒtɪk ˈliːʒənz | Tổn thương xơ vữa động mạch |
| 79 | Necrotic core area | nɪˈkrɒtɪk kɔːr ˈeəriə | Vùng lõi hoại tử |
| 80 | Hypertension | ˌhaɪpəˈtɛnʃən | Tăng huyết áp |
| 81 | Tachycardia | ˌtækɪˈkɑːdiə | Nhịp tim nhanh |
| 82 | Acute blood loss | əˈkjuːt blʌd lɒs | Mất máu cấp tính |
| 83 | Anemia | əˈniːmiə | Thiếu máu |
| 84 | Inflammatory response | ɪnˈflæmətri rɪˈspɒns | Đáp ứng viêm |
| 85 | Chronic total occlusion | ˈkrɒnɪk ˈtəʊtl əˈkluːʒən | Tắc nghẽn hoàn toàn mạn tính |
| 86 | Risk factors | rɪsk ˈfæktəz | Yếu tố nguy cơ |
| 87 | Postoperative mortality | ˌpəʊstˈɒpərətɪv mɔːˈtælɪti | Tỷ lệ tử vong hậu phẫu |
| 88 | Clinical decompensation | ˈklɪnɪkəl ˌdiːkɒmpɛnˈseɪʃən | Suy giảm lâm sàng |
| 89 | Functional status | ˈfʌŋkʃənl ˈsteɪtəs | Tình trạng chức năng |
| 90 | Exercise testing | ˈɛksəsaɪz ˈtɛstɪŋ | Kiểm tra gắng sức |
| 91 | Activities of daily living | ækˈtɪvɪtiz ɒv ˈdeɪli ˈlɪvɪŋ | Hoạt động sinh hoạt hàng ngày |
| 92 | Elderly patients | ˈɛldəli ˈpeɪʃənts | Người bệnh cao tuổi |
| 93 | Ischemic heart disease | ɪsˈkiːmɪk hɑːt dɪˈziːz | Bệnh tim thiếu máu cục bộ |
| 94 | Cerebrovascular disease | ˌsɛrɪbrəʊˈvæskjʊlə dɪˈziːz | Bệnh mạch máu não |
| 95 | Serum creatinine | ˈsɪərəm kriˈætɪniːn | Creatinin huyết thanh |
| 96 | Congestive heart failure | kənˈdʒɛstɪv hɑːt ˈfeɪljə | Suy tim sung huyết |
| 97 | Insulin-dependent diabetes mellitus | ˈɪnsjʊlɪn dɪˈpɛndənt ˌdaɪəˈbiːtiːz ˈmɛlɪtəs | Đái tháo đường phụ thuộc insulin |
| 98 | High-risk surgery | haɪ rɪsk ˈsɜːdʒəri | Phẫu thuật nguy cơ cao |
| 99 | Left ventricular dysfunction | lɛft vɛnˈtrɪkjʊlə dɪsˈfʌŋkʃən | Rối loạn chức năng thất trái |
| 100 | Right ventricular failure | raɪt vɛnˈtrɪkjʊlə ˈfeɪljə | Suy thất phải |
| 101 | Global left ventricular failure | ˈgləʊbəl lɛft vɛnˈtrɪkjʊlə ˈfeɪljə | Suy thất trái toàn bộ |
| 102 | Hypovolemia | ˌhaɪpəʊvəˈliːmiə | Giảm thể tích máu |
| 103 | Diastolic blood pressure | daɪəˈstɒlɪk blʌd ˈprɛʃə | Huyết áp tâm trương |
| 104 | Coronary perfusion pressure | ˈkɒrənəri pəˈfjuːʒən ˈprɛʃə | Áp lực tưới máu mạch vành |
| 105 | Fraction of inspired oxygen | ˈfrækʃən ɒv ɪnˈspaɪəd ˈɒksɪdʒən | Phân số oxy hít vào |
| 106 | Oxygen delivery | ˈɒksɪdʒən dɪˈlɪvəri | Cung cấp oxy |
| 107 | Blood transfusion | blʌd trænsˈfjuːʒən | Truyền máu |
| 108 | Malignant arrhythmias | məˈlɪgnənt əˈrɪðmiəz | Rối loạn nhịp tim ác tính |
| 109 | Cardiac arrest | ˈkɑːdiæk əˈrɛst | Ngừng tim |
| 110 | Hemodynamic instability | ˌhiːməʊdaɪˈnæmɪk ˌɪnstəˈbɪlɪti | Không ổn định huyết động |
| 111 | Venous thromboembolism | ˈviːnəs ˌθrɒmbəʊˈɛmbəlɪzəm | Thuyên tắc tĩnh mạch |
| 112 | Amputation | ˌæmpjʊˈteɪʃən | Cắt cụt |
| 113 | Peripheral arterial thrombosis | pəˈrɪfərəl ɑːˈtɪəriəl θrɒmˈbəʊsɪs | Huyết khối động mạch ngoại vi |
| 114 | Non-hemorrhagic stroke | nɒn ˌhɛməˈrædʒɪk strəʊk | Đột quỵ không xuất huyết |
| 115 | Direct thrombin inhibitor | dəˈrɛkt ˈθrɒmbɪn ɪnˈhɪbɪtə | Chất ức chế thrombin trực tiếp |
| 116 | Perioperative datasets | ˌpɛriˈɒpərətɪv ˈdeɪtəsɛts | Bộ dữ liệu chu phẫu |
| 117 | Outcome registries | ˈaʊtkʌm ˈrɛdʒɪstriz | Đăng ký kết quả |
| 118 | Decision support tools | dɪˈsɪʒən səˈpɔːt tuːlz | Công cụ hỗ trợ quyết định |
| 119 | Heart Rhythm Society | hɑːt ˈrɪðəm səˈsaɪəti | Hội Nhịp tim |
| 120 | Society of Cardiovascular Anesthesiologists | səˈsaɪəti ɒv ˌkɑːdiəʊˈvæskjʊlə əˈnɛsθiːzɪɒlədʒɪsts | Hội Gây mê Tim mạch |
| 121 | Society for Vascular Surgery | səˈsaɪəti fɔː ˈvæskjʊlə ˈsɜːdʒəri | Hội Phẫu thuật Mạch máu |
| 122 | American Society of Echocardiography | əˈmɛrɪkən səˈsaɪəti ɒv ˌɛkəʊkɑːdiˈɒgrəfi | Hội Siêu âm tim Hoa Kỳ |
| 123 | American Society of Nuclear Cardiology | əˈmɛrɪkən səˈsaɪəti ɒv ˈnjuːkliə kɑːdiˈɒlədʒi | Hội Tim mạch Hạt nhân Hoa Kỳ |
| 124 | Society for Vascular Medicine and Biology | səˈsaɪəti fɔː ˈvæskjʊlə ˈmɛdɪsɪn ænd baɪˈɒlədʒi | Hội Y học và Sinh học Mạch máu |
| 125 | Society for Cardiovascular Angiography and Interventions | səˈsaɪəti fɔː ˌkɑːdiəʊˈvæskjʊlə ænʒiˈɒgrəfi ænd ˌɪntəˈvɛnʃənz | Hội Chụp và Can thiệp Mạch máu Tim |
| 126 | Multicenter Study of Perioperative Ischemia Research Group | ˌmʌltiˈsɛntə ˈstʌdi ɒv ˌpɛriˈɒpərətɪv ɪsˈkiːmiə rɪˈsɜːtʃ gruːp | Nhóm Nghiên cứu Thiếu máu cục bộ Chu phẫu Đa trung tâm |
| 127 | Veterans Affairs Surgical Quality Improvement Database | ˈvɛtərənz əˈfeəz ˈsɜːdʒɪkəl ˈkwɒlɪti ɪmˈpruːvmənt ˈdeɪtəbeɪs | Cơ sở dữ liệu Cải thiện Chất lượng Phẫu thuật của Cựu chiến binh |
| 128 | Aortic dissection | eɪˈɔːtɪk dɪˈsɛkʃən | Bóc tách động mạch chủ |
| 129 | Endothelial dysfunction | ˌɛndəʊˈθiːliəl dɪsˈfʌŋkʃən | Rối loạn chức năng nội mô |
| 130 | Cardiac tamponade | ˈkɑːdiæk ˌtæmpəˈneɪd | Chèn ép tim |
| 131 | Cardiac biomarkers | ˈkɑːdiæk ˈbaɪəʊˌmɑːkəz | Dấu ấn sinh học tim |
| 132 | Myocardial stunning | maɪəˈkɑːdiəl ˈstʌnɪŋ | Choáng váng cơ tim |
| 133 | Hibernating myocardium | ˈhaɪbəneɪtɪŋ maɪəˈkɑːdiəm | Cơ tim ngủ đông |
| 134 | Stress echocardiography | strɛs ˌɛkəʊkɑːdiˈɒgrəfi | Siêu âm tim gắng sức |
| 135 | Pharmacologic stress testing | ˌfɑːməkəˈlɒdʒɪk strɛs ˈtɛstɪŋ | Xét nghiệm gắng sức bằng thuốc |
| 136 | Dobutamine stress echocardiography | dəʊˈbjuːtəmiːn strɛs ˌɛkəʊkɑːdiˈɒgrəfi | Siêu âm tim gắng sức bằng dobutamine |
| 137 | Myocardial perfusion imaging | maɪəˈkɑːdiəl pəˈfjuːʒən ˈɪmɪdʒɪŋ | Chụp tưới máu cơ tim |
| 138 | Computed tomography coronary angiography | kəmˈpjuːtɪd təˈmɒgrəfi ˈkɒrənəri ˌænʒiˈɒgrəfi | Chụp mạch vành bằng chụp cắt lớp vi tính |
| 139 | Magnetic resonance imaging | mægˈnɛtɪk ˈrɛzənəns ˈɪmɪdʒɪŋ | Chụp cộng hưởng từ |
| 140 | Cardiovascular magnetic resonance | ˌkɑːdiəʊˈvæskjʊlə mægˈnɛtɪk ˈrɛzənəns | Cộng hưởng từ tim mạch |
| 141 | Multivessel coronary artery disease | ˌmʌltiˈvɛsl ˈkɒrənəri ˈɑːtəri dɪˈziːz | Bệnh động mạch vành nhiều nhánh |
TÀI LIỆU THAM KHẢO
- Landesberg G., Beattie W.S., Mosseri M., et. al.: Perioperative myocardial infarction. Circulation 2009; 119: pp. 2936-2944.
- Fuijkschot W.W., Morrison M.C., van der Linden R., et. al.: Orthopedic surgery increases atherosclerotic lesions and necrotic core area in ApoE-/- mice. Atherosclerosis 2016; 255: pp. 164-170.
- Priebe H.J.: Triggers of perioperative myocardial ischaemia and infarction. Br J Anaesth 2004; 93: pp. 9-20.
- Fleisher L.A., Fleischmann K.E., Auerbach A.D., et. al.: 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: A report of the American College of Cardiology/American Heart Association Task Force on practice guidelines. J Am Coll Cardiol 2014; 64: pp. e77-e137.
- Kristensen S.D., Knuuti J., Saraste A., et. al.: 2014 ESC/ESA Guidelines on non-cardiac surgery: Cardiovascular assessment and management: The joint task force on non-cardiac surgery: Cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA). Eur J Anaesthesiol 2014; 31: pp. 517-573.
- Biccard B.M., Rodseth R.N.: The pathophysiology of peri-operative myocardial infarction. Anaesthesia 2010; 65: pp. 733-741.
- Naghavi M., Libby P., Falk E., et. al.: From vulnerable plaque to vulnerable patient: A call for new definitions and risk assessment strategies: Part I. Circulation 2003; 108: pp. 1664-1672.
- Duvall W.L., Sealove B., Pungoti C., et. al.: Angiographic investigation of the pathophysiology of perioperative myocardial infarction. Catheter Cardiovasc Interv 2012; 80: pp. 768-776.
- Ellis S.G., Hertzer N.R., Young J.R., et. al.: Angiographic correlates of cardiac death and myocardial infarction complicating major nonthoracic vascular surgery. Am J Cardiol 1996; 77: pp. 1126-1128.
- van Waes J.A., Nathoe H.M., de Graaff J.C., et. al.: Myocardial injury after noncardiac surgery and its association with short-term mortality. Circulation 2013; 127: pp. 2264-2271.
- Devereaux P.J., Xavier D., Pogue J., et. al.: Characteristics and short-term prognosis of perioperative myocardial infarction in patients undergoing noncardiac surgery: A cohort study. Ann Intern Med 2011; 154: pp. 523-528.
- Reilly D.F., McNeely M.J., Doerner D., et. al.: Self-reported exercise tolerance and the risk of serious perioperative complications. Arch Intern Med 1999; 159: pp. 2185-2192.
- Buigues C., Juarros-Folgado P., Fernandez-Garrido J., et. al.: Frailty syndrome and pre-operative risk evaluation: A systematic review. Arch Gerontol Geriatr 2015; 61: pp. 309-321.
- Lee T.H., Marcantonio E.R., Mangione C.M., et. al.: Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation 1999; 100: pp. 1043-1049.
- Fleisher L.A., Beckman J.A., Brown K.A., et. al.: ACC/AHA 2007 Guidelines on perioperative cardiovascular evaluation and care for noncardiac surgery: Executive summary: A report of the American College of Cardiology/American Heart Association Task Force on practice guidelines (writing committee to revise the 2002 guidelines on perioperative cardiovascular evaluation for noncardiac surgery) developed in collaboration with the American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Rhythm Society, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, and Society for Vascular Surgery. J Am Coll Cardiol 2007; 50: pp. 1707-1732.
- Priebe H.J.: Preoperative cardiac management of the patient for non-cardiac surgery: An individualized and evidence-based approach. Br J Anaesth 2011; 107: pp. 83-96.
- McFalls E.O., Ward H.B., Moritz T.E., et. al.: Coronary-artery revascularization before elective major vascular surgery. N Engl J Med 2004; 351: pp. 2795-2804.
- Shammash J.B., Trost J.C., Gold J.M., et. al.: Perioperative beta-blocker withdrawal and mortality in vascular surgical patients. Am Heart J 2001; 141: pp. 148-153.
- Hoeks S.E., Scholte Op Reimer W.J., van Urk H., et. al.: Increase of 1-year mortality after perioperative beta-blocker withdrawal in endovascular and vascular surgery patients. Eur J Vasc Endovasc Surg 2007; 33: pp. 13-19.
- Kwon S., Thompson R., Florence M., et. al.: Beta-blocker continuation after noncardiac surgery: A report from the surgical care and outcomes assessment program. Arch Surg 2012; 147: pp. 467-473.
- van Klei W.A., Bryson G.L., Yang H., et. al.: Effect of beta-blocker prescription on the incidence of postoperative myocardial infarction after hip and knee arthroplasty. Anesthesiology 2009; 111: pp. 717-724.
- Group PS , Devereaux P.J., Yang H., et. al.: Effects of extended-release metoprolol succinate in patients undergoing non-cardiac surgery (POISE trial): A randomised controlled trial. Lancet 2008; 371: pp. 1839-1847.
- Wijeysundera D.N., Duncan D., Nkonde-Price C., et. al.: Perioperative beta-blockade in noncardiac surgery: A systematic review for the 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: A report of the American College of Cardiology/American Heart Association Task Force on practice guidelines. J Am Coll Cardiol 2014; 64: pp. 2406-2425.
- de Waal B.A., Buise M.P., van Zundert A.A.: Perioperative statin therapy in patients at high risk for cardiovascular morbidity undergoing surgery: A review. Br J Anaesth 2015; 114: pp. 44-52.
- London M.J., Schwartz G.G., Hur K., et. al.: Association of perioperative statin use with mortality and morbidity after major noncardiac surgery. JAMA Intern Med 2017; 177: pp. 231-242.
- Sanders R.D., Nicholson A., Lewis S.R., et. al.: Perioperative statin therapy for improving outcomes during and after noncardiac vascular surgery. Cochrane Database Syst Rev 2013; 7:
- Mudumbai S.C., Takemoto S., Cason B.A., et. al.: Thirty-day mortality risk associated with the postoperative nonresumption of angiotensin-converting enzyme inhibitors: A retrospective study of the Veterans Affairs Healthcare System. J Hosp Med 2014; 9: pp. 289-296.
- Railton C.J., Wolpin J., Lam-McCulloch J., et. al.: Renin-angiotensin blockade is associated with increased mortality after vascular surgery. Can J Anaesth 2010; 57: pp. 736-744.
- Turan A., You J., Shiba A., et. al.: Angiotensin converting enzyme inhibitors are not associated with respiratory complications or mortality after noncardiac surgery. Anesth Analg 2012; 114: pp. 552-560.
- Roshanov P.S., Rochwerg B., Patel A., et. al.: Withholding versus continuing angiotensin-converting enzyme inhibitors or angiotensin II receptor blockers before noncardiac surgery: An analysis of the vascular events in noncardiac surgery patients cohort evaluation prospective cohort. Anesthesiology 2017; 126: pp. 16-27.
- Wijeysundera D.N., Naik J.S., Beattie W.S.: Alpha-2 adrenergic agonists to prevent perioperative cardiovascular complications: A meta-analysis. Am J Med 2003; 114: pp. 742-752.
- Devereaux P.J., Sessler D.I., Leslie K., et. al.: Clonidine in patients undergoing noncardiac surgery. N Engl J Med 2014; 370: pp. 1504-1513.
- Garg A.X., Kurz A., Sessler D.I., et. al.: Perioperative aspirin and clonidine and risk of acute kidney injury: A randomized clinical trial. JAMA 2014; 312: pp. 2254-2264.
- Devereaux P.J., Mrkobrada M., Sessler D.I., et. al.: Aspirin in patients undergoing noncardiac surgery. N Engl J Med 2014; 370: pp. 1494-1503.
- Iakovou I., Schmidt T., Bonizzoni E., et. al.: Incidence, predictors, and outcome of thrombosis after successful implantation of drug-eluting stents. JAMA 2005; 293: pp. 2126-2130.
- van Werkum J.W., Heestermans A.A., Zomer A.C., et. al.: Predictors of coronary stent thrombosis. The dutch stent thrombosis registry. J Am Coll Cardiol 2009; 53: pp. 1399-1409.
- Levine G.N., Bates E.R., Bittl J.A., et. al.: 2016 ACC/AHA Guideline focused update on duration of dual antiplatelet therapy in patients with coronary artery disease: A report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines. J Am Coll Cardiol 2016; 68: pp. 1082-1115.
- Holcomb C.N., Hollis R.H., Graham L.A., et. al.: Association of coronary stent indication with postoperative outcomes following noncardiac surgery. JAMA Surg 2016; 151: pp. 462-469.
- Barbosa F.T., Castro A.A.: Neuraxial anesthesia versus general anesthesia for urological surgery: Systematic review. Sao Paulo Med J 2013; 131: pp. 179-186.
- Barbosa F.T., Castro A.A., Sousa-Rodrigues C.F.: Neuraxial anesthesia for orthopedic surgery: Systematic review and meta-analysis of randomized clinical trials. Sao Paulo Med J 2013; 131: pp. 411-421.
- Barbosa F.T., Juca M.J., Castro A.A., et. al.: Neuraxial anaesthesia for lower-limb revascularization. Cochrane Database Syst Rev 2013; 7:
- Bode R.H., Lewis K.P., Zarich S.W., et. al.: Cardiac outcome after peripheral vascular surgery. Comparison of general and regional anesthesia. Anesthesiology 1996; 84: pp. 3-13.
- Guay J., Choi P., Suresh S., et. al.: Neuraxial blockade for the prevention of postoperative mortality and major morbidity: An overview of Cochrane systematic reviews. Cochrane Database Syst Rev 2014; 1:
- Nash D.M., Mustafa R.A., McArthur E., et. al.: Combined general and neuraxial anesthesia versus general anesthesia: A population-based cohort study. Can J Anaesth 2015; 62: pp. 356-368.
- Landoni G., Fochi O., Bignami E., et. al.: Cardiac protection by volatile anesthetics in non-cardiac surgery? A meta-analysis of randomized controlled studies on clinically relevant endpoints. HSR Proc Intensive Care Cardiovasc Anesth 2009; 1: pp. 34-43.
- Lurati Buse G.A., Schumacher P., Seeberger E., et. al.: Randomized comparison of sevoflurane versus propofol to reduce perioperative myocardial ischemia in patients undergoing noncardiac surgery. Circulation 2012; 126: pp. 2696-2704.
- Mark J.B.: Multimodal detection of perioperative myocardial ischemia. Tex Heart Inst J 2005; 32: pp. 461-466.
- London M.J., Hollenberg M., Wong M.G., et. al.: Intraoperative myocardial ischemia: Localization by continuous 12-lead electrocardiography. Anesthesiology 1988; 69: pp. 232-241.
- Gidwani U.K., Mohanty B., Chatterjee K.: The pulmonary artery catheter. A critical reappraisal. Cardiol Clin 2013; 31: pp. 545-565. viii
- Rajaram S.S., Desai N.K., Kalra A., et. al.: Pulmonary artery catheters for adult patients in intensive care. Cochrane Database Syst Rev 2013; 2:
- Comunale M.E., Body S.C., Ley C., et. al.: The concordance of intraoperative left ventricular wall-motion abnormalities and electrocardiographic S-T segment changes: Association with outcome after coronary revascularization. Multicenter Study of Perioperative Ischemia (McSPI) Research Group. Anesthesiology 1998; 88: pp. 945-954.
- Singh A., Antognini J.F.: Perioperative hypotension and myocardial ischemia: Diagnostic and therapeutic approaches. Ann Card Anaesth 2011; 14: pp. 127-132.
- American Society of A : Society of Cardiovascular Anesthesiologists Task Force on Transesophageal E: Practice guidelines for perioperative transesophageal echocardiography. An updated report by the American Society of Anesthesiologists and the Society of Cardiovascular Anesthesiologists Task Force on Transesophageal Echocardiography. Anesthesiology. 2010; 112: pp. 1084-1096.
- Markin N.W., Gmelch B.S., Griffee M.J., et. al.: A review of 364 perioperative rescue echocardiograms: Findings of an anesthesiologist-staffed perioperative echocardiography service. J Cardiothorac Vasc Anesth 2015; 29: pp. 82-88.
- Francis G.S., Bartos J.A., Adatya S.: Inotropes. J Am Coll Cardiol 2014; 63: pp. 2069-2078.
- Adesanya A.O., de Lemos J.A., Greilich N.B., et. al.: Management of perioperative myocardial infarction in noncardiac surgical patients. Chest 2006; 130: pp. 584-596.
- Devereaux P.J., Duceppe E., Guyatt G., et. al.: Dabigatran in patients with myocardial injury after non-cardiac surgery (MANAGE): An international, randomised, placebo-controlled trial. Lancet 2018; 391: pp. 2325-2334.
- Alkhulaifi A.M., Jenkins D.P., Pugsley W.B., et. al.: Ischaemic preconditioning and cardiac surgery. Eur J Cardiothorac Surg 1996; 10: pp. 792-798.
- Murry C.E., Jennings R.B., Reimer K.A.: Preconditioning with ischemia: A delay of lethal cell injury in ischemic myocardium. Circulation 1986; 74: pp. 1124-1136.
- Iliodromitis E.K., Lazou A., Kremastinos D.T.: Ischemic preconditioning: Protection against myocardial necrosis and apoptosis. Vasc Health Risk Manag 2007; 3: pp. 629-637.
- Hausenloy D.J., Yellon D.M.: The therapeutic potential of ischemic conditioning: An update. Nat Rev Cardiol 2011; 8: pp. 619-629.
- Walsh S.R., Tang T.Y., Kullar P., et. al.: Ischaemic preconditioning during cardiac surgery: Systematic review and meta-analysis of perioperative outcomes in randomised clinical trials. Eur J Cardiothorac Surg 2008; 34: pp. 985-994.
- Hausenloy D.J., Candilio L., Evans R., et. al.: Remote ischemic preconditioning and outcomes of cardiac surgery. N Engl J Med 2015; 373: pp. 1408-1417.
- Meybohm P., Bein B., Brosteanu O., et. al.: A multicenter trial of remote ischemic preconditioning for heart surgery. N Engl J Med 2015; 373: pp. 1397-1407.
- Liu J.B., Liu Y., Cohen M.E., et. al.: Defining the intrinsic cardiac risks of operations to improve preoperative cardiac risk assessments. Anesthesiology 2018; 128: pp. 283-292.
- Helsten D.L., Ben Abdallah A., Avidan M.S., et. al.: Methodologic considerations for collecting patient-reported outcomes from unselected surgical patients. Anesthesiology 2016; 125: pp. 495-504.
- Chen J.H., Asch S.M.: Machine learning and prediction in medicine – beyond the peak of inflated expectations. N Engl J Med 2017; 376: pp. 2507-2509.
- Kooij F.O., Klok T., Hollmann M.W., et. al.: Decision support increases guideline adherence for prescribing postoperative nausea and vomiting prophylaxis. Anesth Analg 2008; 106: pp. 893-898. table of contents
- Nair B.G., Grunzweig K., Peterson G.N., et. al.: Intraoperative blood glucose management: Impact of a real-time decision support system on adherence to institutional protocol. J Clin Monit Comput 2016; 30: pp. 301-312.
- Sathishkumar S., Lai M., Picton P., et. al.: Behavioral modification of intraoperative hyperglycemia management with a novel real-time audiovisual monitor. Anesthesiology 2015; 123: pp. 29-37.

BÌNH LUẬN