Sperling Nội tiết học Nhi khoa, Ấn bản thứ 5 – Biên dịch: Ths.Bs. Lê Đình Sáng
Sperling Pediatric Endocrinology, Fifth Edition
Tác giả: Sperling, Mark A., MD – Nhà xuất bản: Elsevier Inc.
PHẦN III. NỘI TIẾT HỌC TRẺ EM VÀ THANH THIẾU NIÊN
Chương 25. Rối Loạn Lipid Máu ở Trẻ em và Thanh Thiếu niên
Stephen R. Daniels; Sarah C. Couch
Lipid Disorders in Children and Adolescents
Sperling Pediatric Endocrinology, 25, 1004-1021
Giới thiệu
Bệnh tim mạch do xơ vữa (Atherosclerotic cardiovascular disease – ASCVD) là nguyên nhân chính gây bệnh tật và tử vong ở người trưởng thành tại các nước công nghiệp hóa. Rối loạn lipid máu (cụ thể là tăng cholesterol lipoprotein tỷ trọng thấp (, giảm cholesterol lipoprotein tỷ trọng cao (, và tăng non-HDL cholesterol cùng triglycerides () đã được xác định là một yếu tố nguy cơ độc lập trong sự phát triển của ASCVD. Có bằng chứng mạnh mẽ cho thấy nồng độ lipoprotein duy trì từ thời thơ ấu đến tuổi trưởng thành và nồng độ bất thường của LDL cholesterol, và có thể cả các lipoprotein khác, có liên quan đến xơ vữa động mạch, và do đó dẫn đến các kết cục bất lợi liên quan.
Chương này tổng quan các bằng chứng về vai trò của những bất thường lipid trong lịch sử tự nhiên giai đoạn sớm của bệnh xơ vữa động mạch. Ngoài ra, chương sách cung cấp một cái nhìn tổng quan về chuyển hóa lipoprotein—sau đó là tổng quan về các rối loạn di truyền trong chuyển hóa lipoprotein. Các nguyên nhân thứ phát gây tăng cholesterol được giải thích, bao gồm cả sự gia tăng tỷ lệ béo phì và hội chứng chuyển hóa, là nguyên nhân gây ra các bất thường lipid ở nhóm dân số nhi khoa. Các tiêu chuẩn và phương pháp tiếp cận để sàng lọc tăng lipid máu ở trẻ em được xem xét, cũng như các phương pháp tiếp cận hiện tại trong việc quản lý rối loạn lipid máu ở trẻ em bằng chế độ ăn và dược lý.
Chuyển hóa
Rối loạn lipid máu ở trẻ em và thanh thiếu niên có thể là kết quả của các khiếm khuyết trong quá trình sản xuất, vận chuyển hoặc thoái giáng lipoprotein. Để hiểu được các nguyên nhân đa dạng của những bất thường lipoprotein, một tổng quan ngắn gọn về cấu trúc, chức năng và chuyển hóa lipoprotein được trình bày dưới đây. Bảng 25.1 tóm tắt các phân nhóm lipoprotein, nguồn gốc của mỗi loại, cùng các thành phần lipid và apolipoprotein liên quan đến mỗi hạt.
Bảng 25.1 Các Phân Nhóm Lipoprotein và các Apolipoprotein cùng Thành phần Lipid liên quan
| Lipoprotein | Apolipoprotein | Nguồn gốc | Thành phần Lipid |
|---|---|---|---|
| Chylomicron | ApoB-48, apoC-II, ᵃ apoC-III, apoE ᵃ | Ruột | Triglyceride từ chế độ ăn |
| VLDL | ApoB-100, C-II, ᵃ C-III, ᵃ apoE ᵃ | Gan | Cholesterol và triglyceride nội sinh |
| IDL | ApoB-100, apoE | Chuyển hóa VLDL | Cholesterol và triglyceride |
| LDL | ApoB-100 | Chuyển hóa VLDL | Cholesterol |
| HDL | ApoA-I, apoA-II, apoC-II, apoE | Gan và ruột | Cholesterol và phospholipid |
HDL, Lipoprotein tỷ trọng cao; IDL, lipoprotein tỷ trọng trung gian; LDL, lipoprotein tỷ trọng thấp; VLDL, lipoprotein tỷ trọng rất thấp.
Sau khi ăn, các TGs, este cholesterol, phospholipid và sterol thực vật trong thức ăn được tiêu hóa thành các acid béo, 2-monoglyceride, lysophospholipid, cholesterol không este hóa và sterol thực vật. Sự hấp thu các sản phẩm cuối cùng của quá trình tiêu hóa này diễn ra qua hai cơ chế: khuếch tán thụ động và vận chuyển qua trung gian chất mang. Trong khuếch tán thụ động, các lipid không phân cực được hòa tan với sự trợ giúp của acid mật và lysophospholipid thành các hạt mixen hỗn hợp có thể khuếch tán qua bề mặt đỉnh của màng tế bào ruột. Vận chuyển qua trung gian chất mang liên quan đến một số protein vận chuyển khác nhau cho các acid béo và sterol. CD 36/thụ thể scavenger B2 (SR-B2), một translocase acid béo, thúc đẩy sự hấp thu acid béo chuỗi dài và cholesterol ở đoạn gần ruột non. Ít nhất hai chất vận chuyển bổ sung, protein Niemann-Pick C1-like 1 (NPC1L1) và SR-B1, đóng vai trò trong việc hấp thu sterol. Do đó, NPC1L1 và SR-B1 là mục tiêu của thuốc hạ cholesterol ezetimibe, một chất ức chế mạnh sự hấp thu cholesterol và sterol thực vật.
Hầu hết các sterol thực vật được tiêu thụ và khoảng một nửa lượng cholesterol được hấp thu sẽ được bài tiết từ tế bào ruột trở lại lòng ruột bởi hai chất vận chuyển nửa ATP-binding cassette (ABC), G5 và G8, do đó hạn chế lượng sterol được hấp thu. Một đột biến hiếm gặp ở ABCG5 hoặc ABCG8, được gọi là bệnh sitosterol máu, dẫn đến nồng độ sterol thực vật cao bất thường trong huyết tương và các mô, cũng như sự lắng đọng sterol ở da và động mạch. Những người mắc rối loạn này có nguy cơ xơ vữa động mạch sớm cao hơn. Các sterol còn lại trong tế bào ruột được chuyển thành este sterol bởi acyl-CoA cholesterol acyl transferase (ACAT), enzyme này gắn một acid béo vào sterol để lưu trữ trong bào tương của tế bào. Bên trong tế bào ruột, các lipid được tập hợp thành các lipoprotein thông qua hoạt động của một protein chaperone, protein chuyển triglyceride ở microsome (MTTP), và có thể là một số protein bổ sung khác. MTTP liên hợp các TGs, phospholipid, cholesterol và este cholesterol với apolipoprotein B-48 (apoB-48) ở phía lòng của màng lưới nội chất (ER) để tạo ra một chylomicron trưởng thành. Một quá trình tương tự được sử dụng để tập hợp TG, phospholipid, cholesterol và este cholesterol với apoB-100 trong gan để hình thành các hạt lipoprotein tỷ trọng rất thấp (VLDL). Trong rối loạn di truyền bệnh abetalipoprotein máu, các đột biến trong gen mã hóa MTTP dẫn đến không có khả năng sản xuất chylomicron và VLDL, cho thấy vai trò thiết yếu của MTTP trong quá trình sinh tổng hợp chylomicron và VLDL. Thuốc lomitapide mới được phê duyệt có tác dụng ức chế MTTP, làm giảm sự lắp ráp và bài tiết lipoprotein, và hạ cholesterol huyết tương khoảng 50% ở những bệnh nhân bị tăng cholesterol máu gia đình thể đồng hợp tử.
Sau khi được hình thành, chylomicron quá lớn để xuyên qua màng mao mạch. Do đó, chúng được bài tiết vào hệ bạch huyết và đi vào khoang huyết tương tĩnh mạch qua ống bạch huyết ngực. Khi các hạt non được giải phóng vào huyết tương, một số apolipoprotein (bao gồm apoC-II, C-III và apoE) được ưu tiên chuyển đến các chylomicron từ các HDL lưu hành. Hình 25.1 mô tả quá trình chuyển hóa chylomicron.
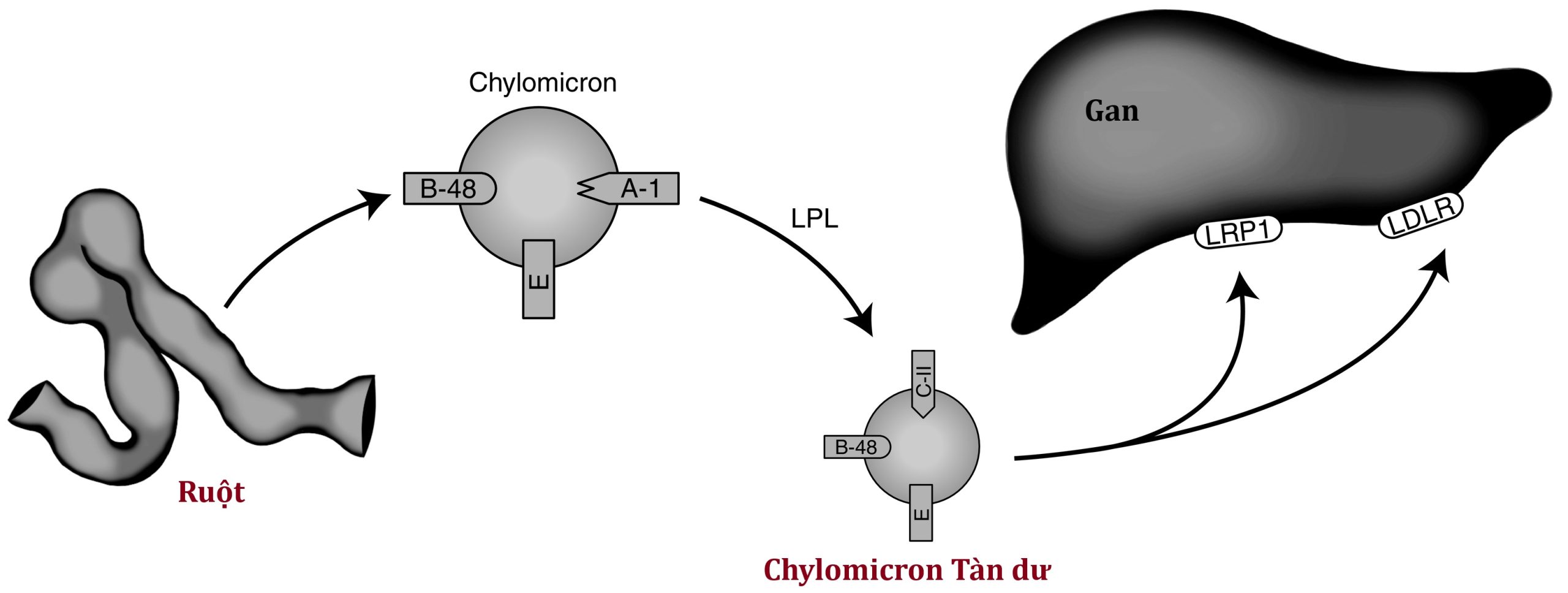
Hình 25.1 Chuyển hóa lipoprotein ngoại sinh. Xem chi tiết trong bài viết. A-1, Apolipoprotein A1; B-48, apolipoprotein B-48; C-II, apoliprotein C2; E, apolipoprotein E; LDLR, lipoprotein tỷ trọng thấp; LPL, lipoprotein lipase; LRP1, protein-1 liên quan đến thụ thể lipoprotein tỷ trọng thấp. (Tư liệu của Emilie Graham, Đại học Cincinnati.)
Các chylomicron vận chuyển TG và cholesterol từ chế độ ăn đến các vị trí lưu trữ hoặc chuyển hóa. Kích thước của các hạt thay đổi tùy thuộc vào lượng chất béo được ăn vào. Chúng được thanh thải nhanh chóng khỏi tuần hoàn thông qua hoạt động của lipoprotein lipase (LPL). LPL là một hydrolase TG được tìm thấy trên nội mô mao mạch của các mô khác nhau, với nồng độ cao nhất ở các mô cơ và mô mỡ. Protein 1 gắn HDL được neo bởi Glycosylphosphatidylinositol (GPIHBP1) giữ LPL trên nội mô mao mạch. LPL được hoạt hóa bởi apoC-II và bị ức chế bởi apoC-III trên chylomicron. Các đột biến mất chức năng ở LPL, apoC-II và GPIHPB1 có thể dẫn đến tăng triglyceride máu rõ rệt. Các đột biến mất chức năng ở apoC-III có liên quan đến tăng hoạt tính LPL và giảm nồng độ TG. Khi TG chứa trong chylomicron bị thủy phân, các acid béo tự do được giải phóng để oxy hóa bởi nhiều loại tế bào khác nhau và kích thước hạt giảm xuống. Khi khoảng 80% lượng TG ban đầu đã được loại bỏ, apoC-II tách ra khỏi bề mặt của nó. Việc chuyển apoC-II từ chylomicron sang HDL làm giảm khả năng của LPL trong việc phân hủy thêm các TGs. Các chylomicron đã cạn kiệt TG, nay được coi là tàn dư chylomicron, được gan hấp thu thông qua thụ thể LDL (LDLR), một thụ thể nhận diện apoE trên bề mặt chylomicron và apoB100 trên bề mặt của các lipoprotein có nguồn gốc từ gan. Một phần nhỏ hơn của các tàn dư cũng có thể được nội bào hóa thông qua quá trình nội bào qua trung gian protein-1 liên quan đến LDLR (LRP1).
VLDL có nguồn gốc từ gan, và giống như chylomicron, chúng là các hạt giàu TG (Hình 25.2). Trái ngược với các chylomicron có nguồn gốc từ ruột, các acid béo chứa trong VLDL TG đến từ quá trình tổng hợp de novo từ carbohydrate trong chế độ ăn, các tàn dư lipoprotein, hoặc các acid béo lưu hành được gan nội bào hóa từ huyết tương. Tương tự như chylomicron, kích thước của các hạt VLDL có thể thay đổi tùy thuộc vào lượng TG được mang trong hạt. Khi sản xuất TG trong gan tăng lên, các hạt VLDL được bài tiết có kích thước lớn. Bên trong tế bào gan, TG và este cholesterol được lắp ráp bởi một MTTP và được bao quanh bởi một màng phospholipid liên kết với apoB-100. Các hạt VLDL trưởng thành được giải phóng vào bạch huyết và cuối cùng vào không gian mạch máu, nơi các apolipoprotein khác (bao gồm apoC-II, apoC-III và apoE) hấp phụ lên bề mặt VLDL. Quá trình chuyển hóa của hạt VLDL theo một con đường tương tự như của chylomicron: apoC-II trên bề mặt của nó hoạt hóa LPL, LPL thủy phân VLDL TG, các acid béo tự do được giải phóng, kích thước hạt giảm (sau khi mất 80% TG), và cuối cùng apoC-II tách ra—dẫn đến sự hình thành các tàn dư VLDL (còn được gọi là lipoprotein tỷ trọng trung gian (). Khoảng một nửa IDL sau đó được loại bỏ khỏi huyết tương thông qua sự tương tác của apoE với LDLR và LRP1 trên bề mặt tế bào gan. Phần còn lại của IDL được chuyển đổi thành LDL thông qua quá trình thủy phân thêm các TGs và phospholipid bởi lipase triglyceride gan (HL). ApoE được chuyển từ IDL sang HDL trong quá trình chuyển đổi của tàn dư thành LDL.
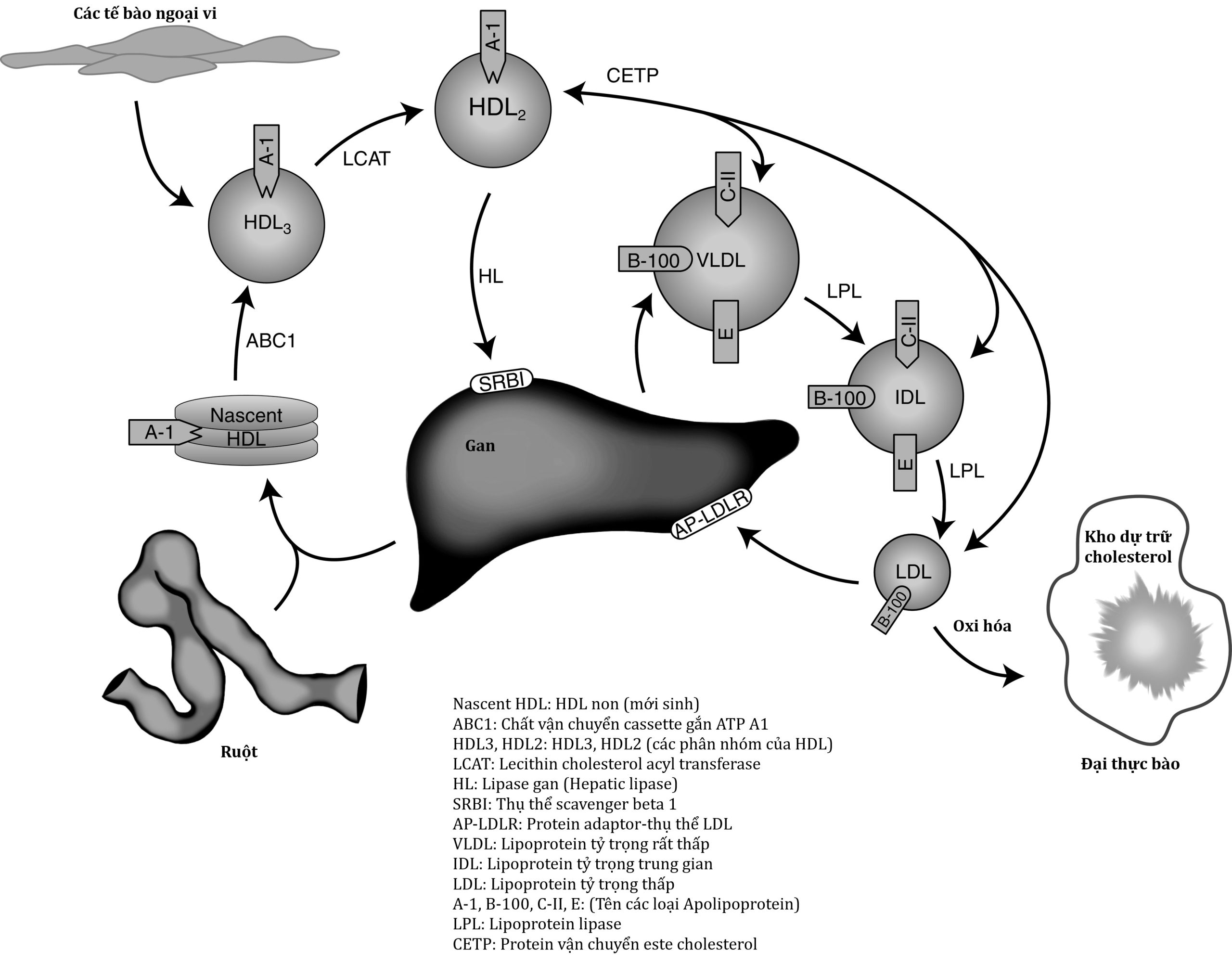
Hình 25.2 Chuyển hóa lipoprotein nội sinh. Xem chi tiết trong bài viết. A-1, Apolipoprotein A-1; ABC1, chất vận chuyển cassette gắn ATP A1; AP-LDLR, protein adaptor-thụ thể lipoprotein tỷ trọng thấp; B-100, apolipoprotein B100; C-II, apolipoprotein C2; CETP, protein vận chuyển este cholesterol; E, apolipoprotein E; HDL, lipoprotein tỷ trọng cao; HL, lipase triglyceride gan; LCAT, lecithin cholesteryl acyl transferase; LPL, lipoprotein lipase; SRBI, thụ thể scavenger beta 1. (Tư liệu của Emilie Graham, Đại học Cincinnati.)
LDL, chất mang cholesterol chính trong huyết tương, được hấp thu vào các mô ngoại vi và tế bào gan bởi LDLR với sự hỗ trợ của một protein adaptor (AP). AP liên kết với LDLR và clathrin, cho thấy vai trò của AP trong việc tuyển dụng và giữ lại LDLR trong các túi lõm được bao bọc bởi clathrin. Sau khi liên kết với thụ thể, hạt LDL gắn với LDLR/AP được nội bào hóa nhanh chóng vào các túi lõm được bao bọc bởi clathrin thông qua quá trình nội bào. Bên trong tế bào, túi nội bào mới hình thành trở nên acid hóa thông qua hoạt động của một bơm proton phụ thuộc ATP. Quá trình acid hóa gây ra sự thoái giáng của lớp vỏ clathrin, sự phân ly của LDLR khỏi LDL, và sự phân chia của các màng túi nội bào. Túi nội bào chứa LDLR tái tuần hoàn trở lại màng tế bào để hấp thu thêm LDL. Một cách khác, proprotein convertase subtilisin/kexin type 9 (PCSK9) liên kết với LDLR, và làm ngắn mạch quá trình tái chế LDLR từ túi nội bào, dẫn đến sự thoái giáng của nó. Túi nội bào còn lại chứa LDL hợp nhất với một lysosome, nơi các enzyme thủy phân tiêu hóa lipoprotein thành các thành phần của nó: cholesterol không este hóa, acid béo, và các acid amin tự do.
Lượng cholesterol được giải phóng từ quá trình hấp thu qua túi nội bào điều chỉnh sự tổng hợp LDLR và cholesterol của gan. Khi nồng độ cholesterol trong tế bào thấp, các protein gắn thụ thể sterol (SREBPs) di chuyển từ lưới nội chất đến bộ máy Golgi, nơi các protease phân cắt SREBPs thành các yếu tố phiên mã hoạt động. SREBPs di chuyển đến nhân, nơi chúng kích thích phiên mã của LDLR và hydroxymethylglutaryl (HMG) CoA reductase, enzyme giới hạn tốc độ của quá trình sinh tổng hợp cholesterol. Nếu nồng độ cholesterol trong tế bào cao, SREBPs vẫn ở lại lưới nội chất ở dạng không hoạt động và không kích thích tổng hợp LDLR. Bằng cách này, nồng độ cholesterol nội bào gan điều chỉnh lượng cholesterol được nội bào hóa và tổng hợp bởi tế bào.
Khi có dư thừa LDL và các lipoprotein chứa apoB nhỏ khác (tàn dư chylomicron và IDL) trong huyết tương, khả năng của LDLR để loại bỏ chúng bị vượt quá và các hạt này trở nên dễ bị oxy hóa hơn. Các lipoprotein chứa apoB bị oxy hóa có thể được hấp thu bởi các thụ thể scavenger trên các đại thực bào trong lớp dưới nội mạc của động mạch và có thể góp phần vào sự hình thành các tổn thương xơ vữa động mạch.
HDL vận chuyển cholesterol và các lipid khác từ các mô ngoại vi (bao gồm cả mảng xơ vữa động mạch) trở lại gan. Các hạt này được tổng hợp chủ yếu ở gan (và ở mức độ thấp hơn ở ruột) dưới dạng các hạt tiền chất nghèo lipid (pre-beta HDL) chứa apoA-I (xem Hình 25.2). HDL non tương tác với màng huyết tương của các tế bào, thu thập lipid thông qua cơ chế ABCA1. Cholesterol và phospholipid được chuyển qua quá trình này hấp phụ lên HDL, tạo thành một hạt hình đĩa được gọi là HDL3. Rối loạn chức năng của ABCA1 sẽ làm giảm đáng kể nồng độ HDL và do đó làm suy giảm nghiêm trọng chức năng vận chuyển cholesterol và lipid. Một rối loạn lặn trên nhiễm sắc thể thường hiếm gặp được gọi là bệnh Tangier là do thiếu protein ABCA1 chức năng và được đặc trưng bởi sự vắng mặt của HDL cùng với tăng triglyceride máu và nồng độ LDL thấp. Trong huyết tương, HDL3 tương tác với enzyme lecithin cholesterol acyl transferase (LCAT)—enzyme này xúc tác quá trình este hóa cholesterol liên kết với hạt. ApoA-I trên bề mặt HDL hoạt hóa LCAT. Sau khi được hình thành, este cholesterol trở nên kỵ nước hơn và di chuyển vào bên trong của hạt—tạo ra một hạt HDL hình cầu được gọi là HDL2.
Khi HDL2 tăng kích thước, hạt này trở thành cơ chất cho protein vận chuyển este cholesterol (CETP). Enzyme này thúc đẩy sự trao đổi của cholesterol este hóa trong HDL2 lấy TG chứa trong các lipoprotein liên kết với apoB-100. Sự trao đổi lipid này là cơ chế chính mà qua đó HDL tham gia vào quá trình vận chuyển ngược cholesterol từ các mô trở lại gan. Phần còn lại của este cholesterol được các tế bào gan hấp thu chọn lọc từ HDL thông qua một SR-B1, mà không có sự hấp thu đồng thời của toàn bộ hạt HDL. Quá trình sau này có thể cần đến hoạt động của HL. Hạt pre-beta HDL nghèo lipid sinh ra từ quá trình này được giải phóng để tái chế.
Rối loạn lipid máu nguyên phát
Quá trình tổng hợp, vận chuyển và chuyển hóa lipoprotein diễn ra qua nhiều bước và liên quan đến nhiều protein chuyên biệt. Một số khiếm khuyết di truyền đã được xác định trong các quá trình này và được gọi là rối loạn lipid máu nguyên phát. Hầu hết các khiếm khuyết di truyền này biểu hiện ở thời thơ ấu. Bảng 25.2 tóm tắt các rối loạn lipoprotein ở trẻ em cùng với hồ sơ lipoprotein đặc trưng của mỗi loại. Nguyên nhân di truyền và chuyển hóa của các rối loạn này được trình bày chi tiết trong phần sau.
Bảng 25.2 Các Rối Loạn Lipoprotein ở Trẻ em
| Rối loạn Lipoprotein | Phân tích Lipoprotein | Lipid máu | Khiếm khuyết di truyền |
|---|---|---|---|
| Tăng cholesterol máu gia đình | ↑︎↑︎LDL | ↑︎↑︎Cholesterol | Thụ thể LDL (LDLR) |
| Tăng cholesterol máu di truyền lặn trên NST thường | ↑︎↑︎LDL | ↑︎↑︎ Cholesterol | LDLRAP |
| Tăng cholesterol máu di truyền trội trên NST thường | ↑︎↑︎LDL (với các đột biến tăng chức năng) | ↑︎↑︎ Cholesterol | PCSK9 |
| Bệnh apoB-100 khiếm khuyết ligand có tính gia đình | ↑︎↑︎ LDL | ↑︎↑︎Cholesterol | ApoB-100 |
| Bệnh sitosterol máu | ↑︎ LDL | ↑︎ Cholesterol | ABCG5 hoặc ABCG8 |
| Tăng lipid máu hỗn hợp gia đình | ↑︎ VLDL, ↑︎ LDL, ↓︎ HDL | ↑︎ Cholesterol, ↑︎ triglyceride | Chưa rõ |
| Tăng triglyceride máu gia đình | ↑︎↑︎ VLDL, ↓︎ HDL | ↑︎ Triglyceride | Chưa rõ |
| Hội chứng chylomicron máu gia đình | ↑︎↑︎ Chylomicron ↑︎ VLDL | ↑︎↑︎Triglyceride | Lipoprotein lipase (LPL), ApoC-II, Apo A-V, GP1HBP1 |
| Giảm alpha-lipoprotein máu | ↓︎ HDL | Bình thường | ApoA-1 |
| Bệnh dysbetalipoprotein máu | ↑︎↑︎ Tàn dư Chylomicron, ↑︎↑︎ IDL | ↑︎↑︎ Cholesterol, ↑︎↑︎ triglyceride | ApoE |
↑︎↑︎ Rất cao; ↑︎ tăng vừa phải; và ↓︎ giảm. HDL, Lipoprotein tỷ trọng cao; IDL, lipoprotein tỷ trọng trung gian; LDL, lipoprotein tỷ trọng thấp; VLDL, lipoprotein tỷ trọng rất thấp. Xem chi tiết trong bài viết.
Các rối loạn chuyển hóa Cholesterol
Tăng cholesterol máu gia đình
Tăng cholesterol máu gia đình (Familial hypercholesterolemia – FH) là rối loạn đơn gen phổ biến nhất của chuyển hóa lipoprotein. FH di truyền theo kiểu trội trên nhiễm sắc thể thường với tỷ lệ tương đối thấp ở các nước phương Tây. Tỷ lệ này được báo cáo cao gấp 10 lần ở một số quần thể nhất định với hiệu ứng người sáng lập giả định, chẳng hạn như người Lebanon, người Canada gốc Pháp và người Nam Phi. Thể dị hợp tử được tìm thấy ở một trong 250 người, và thể đồng hợp tử được tìm thấy ở một trong 1 triệu người. Rối loạn này là do đột biến trong gen LDLR. Hơn 1200 đột biến trong gen này đã được xác định, bao gồm cả những đột biến ảnh hưởng đến quá trình tổng hợp thụ thể, vận chuyển nội bào, liên kết ligand, nội bào hóa và tái chế. Ở thể dị hợp tử, việc thừa hưởng một gen LDLR khiếm khuyết dẫn đến nồng độ LDL cholesterol trong huyết tương cao gấp 2 đến 3 lần so với bình thường. Nồng độ TG và HDL cholesterol thường không bị ảnh hưởng bởi các đột biến gen gây ra FH, nhưng có thể bị thay đổi do béo phì và kháng insulin.
Những người mắc FH dị hợp tử có nguy cơ cao phát triển ASCVD khởi phát sớm, thường ở độ tuổi từ 30 đến 60. Ở thể đồng hợp tử, các cá nhân thừa hưởng một alen đột biến cho FH từ cả cha và mẹ, dẫn đến nồng độ LDL cholesterol trong huyết tương cao gấp 4 đến 6 lần so với bình thường. Một kiểu hình nặng hơn được tìm thấy ở những người có đột biến thụ thể âm tính (những người có hoạt tính thụ thể LDL còn lại <5%) so với những người có đột biến thụ thể khiếm khuyết (5%–30% hoạt tính thụ thể LDL bình thường). Do nồng độ cholesterol huyết tương quá cao ở những người mắc FH đồng hợp tử, sự lắng đọng cholesterol thường xuất hiện ở gân (u vàng – xanthoma) và mí mắt (ban vàng – xanthelasma)—thường trước 5 tuổi. Ở thể dị hợp tử, u vàng xuất hiện ít thường xuyên hơn và thường không xuất hiện cho đến khi đến tuổi trưởng thành. Trẻ em mắc FH đồng hợp tử bị xơ vữa động mạch khởi phát sớm và thường bị nhồi máu cơ tim trong thập kỷ đầu tiên của cuộc đời, và tử vong do ASCVD trong thập kỷ thứ hai.
Tăng cholesterol máu di truyền trội và lặn trên nhiễm sắc thể thường
Tăng cholesterol máu di truyền trội trên nhiễm sắc thể thường (Autosomal-dominant hypercholesterolemia – ADH) là một rối loạn di truyền khác dẫn đến một kiểu hình biểu hiện là tăng hoặc giảm rõ rệt nồng độ LDL cholesterol. ADH là do các đột biến trong một serine protease, PCSK9. Protein này liên kết và thúc đẩy sự thoái giáng của LDLR và do đó điều chỉnh nồng độ LDL cholesterol trong huyết tương. Một số đột biến PCSK9 tự nhiên dẫn đến sự tăng chức năng của protein và gây ra tăng cholesterol máu bằng cách tăng cường sự thoái giáng của LDLR, trong khi các đột biến khác dẫn đến mất chức năng, và do đó làm tăng số lượng LDLR, và có liên quan đến LDL cholesterol thấp. Các đột biến sau dường như mang lại sự bảo vệ khỏi việc phát triển ASCVD.
Tăng cholesterol máu di truyền lặn trên nhiễm sắc thể thường (Autosomal recessive hypercholesterolemia – ARH) là do các đột biến trong gen ARH, gen này mã hóa protein adaptor cần thiết cho quá trình nội bào bình thường qua trung gian LDLR trong tế bào gan. Một số đột biến khác nhau trong protein này đã được xác định, tất cả đều dẫn đến việc thiếu hoặc nội bào hóa LDLR dưới mức tối ưu. Nồng độ cholesterol ở những người mắc ARH cao gấp 5 đến 6 lần so với bình thường. Trẻ em mắc rối loạn này về mặt lâm sàng tương tự như những trẻ mắc FH đồng hợp tử. Tuy nhiên, cha mẹ của chúng thường có hồ sơ lipoprotein bình thường.
Bệnh apoB-100 khiếm khuyết ligand có tính gia đình
Bệnh apoB-100 khiếm khuyết ligand có tính gia đình (Familial ligand-defective apoB-100 – FDB) là một rối loạn đơn gen có biểu hiện lâm sàng giống với FH dị hợp tử. Bệnh được đặc trưng bởi nồng độ LDL cholesterol trong huyết tương tăng từ trung bình đến rõ rệt, TGs bình thường và u vàng ở gân. Rối loạn này là do sự liên kết kém của hạt LDL với LDLR, do một đột biến trong apoB-100. Cụ thể, hai đột biến, R3500Q và R3500W vẫn là những đột biến được xác định thường xuyên nhất gây ra FDB. Sự liên kết LDLR khiếm khuyết dẫn đến giảm thanh thải LDL khỏi huyết tương. Rối loạn này phổ biến nhất ở những người gốc châu Âu (một trên 1000). Bệnh nhân FDB có nguy cơ phát triển ASCVD từ trung bình đến cao.
Bệnh sitosterol máu
Bệnh sitosterol máu là một bệnh di truyền lặn trên nhiễm sắc thể thường hiếm gặp do đột biến ở một trong hai gen (ABCG5 hoặc ABCG8) mã hóa các chất vận chuyển nửa ABC. Các gen này được biểu hiện trong tế bào ruột và tế bào gan. Các chất vận chuyển nửa ABC giới hạn sự hấp thu cholesterol và sterol thực vật (và có thể cả sterol từ động vật có vỏ) trong ruột. Chúng cũng thúc đẩy bài tiết cholesterol và phytosterol qua mật và phân. Các protein khiếm khuyết dẫn đến sự hấp thu cao bất thường của sterol thực vật (và, ở mức độ thấp hơn, cholesterol) vào tế bào ruột, và giảm bài tiết các sterol này từ gan vào mật. Cholesterol huyết tương có thể tăng nhẹ, trung bình hoặc rõ rệt, trong khi nồng độ sterol thực vật trong huyết tương tăng rõ rệt. Bệnh nhân mắc bệnh sitosterol máu phát triển ASCVD sớm và u vàng ở thời thơ ấu, và có thể phát triển hẹp van động mạch chủ.
Các rối loạn do sản xuất quá mức Lipoprotein tỷ trọng rất thấp
Tăng lipid máu hỗn hợp gia đình (Familial combined hyperlipidemia – FCHL) là một rối loạn di truyền trội trên nhiễm sắc thể thường với tỷ lệ từ 1% đến 2% ở các quần thể phương Tây. Có sự chồng chéo về kiểu hình lipid giữa FCHL và rối loạn lipid máu hỗn hợp (combined dyslipidemia – CD) do béo phì, mà có khả năng có nền tảng di truyền nhưng chủ yếu bị ảnh hưởng bởi các yếu tố lối sống. CD rất phổ biến ở thanh thiếu niên, xảy ra ở 30% đến 60% trẻ em và thanh thiếu niên béo phì. Những người mắc FCHL và CD thường có cùng một khiếm khuyết chuyển hóa, đó là sản xuất quá mức VLDL ở gan. Các gia đình mắc FCHL có nhiều kiểu tăng lipid máu, bao gồm tăng cholesterol máu, tăng triglyceride máu và tăng nồng độ apoB. Chẩn đoán FCHL dựa trên sự hiện diện của nồng độ cholesterol, TG hoặc apoB tăng ở bệnh nhân và người thân thế hệ thứ nhất của họ. Veerkamp và các đồng nghiệp đã phát triển một biểu đồ nomogram để tính toán xác suất một người có khả năng bị ảnh hưởng bởi FCHL. FCHL có thể biểu hiện ở thời thơ ấu, nhưng thường không biểu hiện đầy đủ cho đến tuổi trưởng thành. Bệnh nhân FCHL và CD thường có các vấn đề đồng thời với kháng insulin, béo phì trung tâm và tăng huyết áp và có nguy cơ cao bị ASCVD sớm.
Các hội chứng có kiểu hình tương tự như FCHL và CD là tăng apobeta-lipoprotein máu, kiểu phân nhóm LDL B, và sự tập hợp các yếu tố nguy cơ ASCVD được gọi là hội chứng chuyển hóa ở người lớn. Trong ba hội chứng này, hội chứng sau phổ biến hơn nhiều ở trẻ em. Tỷ lệ mắc hội chứng chuyển hóa đang tiếp tục tăng cùng với sự gia tăng của béo phì trong dân số nhi khoa. Dường như có một mối liên hệ cơ học giữa béo phì trung tâm, kháng insulin và rối loạn lipid máu—với béo phì trung tâm thường đi trước cả những bất thường về glucose và lipid. Hiện tại, không có định nghĩa thống nhất nào cho hội chứng chuyển hóa ở thời thơ ấu.
Các rối loạn có tăng Triglyceride máu rõ rệt
Tăng triglyceride máu gia đình
Tăng triglyceride máu gia đình (Familial hypertriglyceridemia – FHTG) theo kiểu di truyền trội trên nhiễm sắc thể thường biểu hiện chủ yếu ở tuổi trưởng thành, với tỷ lệ dân số khoảng 5% đến 10%. Tỷ lệ này ở trẻ em đang tăng lên. Béo phì là một yếu tố quan trọng có thể thúc đẩy sự biểu hiện của FHTG, và bệnh nhân thường có tình trạng không dung nạp glucose đồng thời. Kiểu hình của FHTG là nồng độ TGs huyết thanh tăng từ trung bình đến rõ rệt (trong khoảng 200–500 mg/dL [khoảng 2,26–5,65 mmol/L]) và nồng độ LDL và HDL cholesterol từ thấp đến bình thường. Nguyên nhân chuyển hóa của rối loạn này là do gan bài tiết các hạt VLDL lớn, giàu TG, được dị hóa chậm. Khiếm khuyết di truyền cơ bản của FHTG vẫn chưa được xác định.
Hội chứng chylomicron máu gia đình
Hội chứng chylomicron máu là một tập hợp các rối loạn đơn gen hiếm gặp gây suy giảm rõ rệt hoạt tính của LPL. Các rối loạn này được biểu hiện kiểu hình là tăng triglyceride máu (thường TGs > 1000 mg/dL [> 11,3 mmol/L]), do giảm hoặc không có sự thủy phân các TGs liên quan đến chylomicron và VLDL bởi LPL. Tỷ lệ ước tính là một trên 500.000 đến 1.000.000. Suy giảm hoạt tính LPL có thể liên quan đến thiếu hụt LPL, thiếu hụt apoC-II (đồng yếu tố của LPL), hoặc các đột biến mất chức năng của apoA5 và GPIHBP1 được mô tả gần đây hơn, dẫn đến thủy phân kém các TGs liên quan đến chylomicron và VLDL.
Trong bệnh chylomicron máu đồng hợp tử, huyết tương lúc đói cóลักษณะ sệt, màu kem do sự hiện diện của một số lượng lớn các hạt chylomicron. Nguy cơ viêm tụy và gan lách to tăng lên do nồng độ TGs huyết thanh tăng rõ rệt. Ngoài ra, có thể xuất hiện u vàng phát ban và các triệu chứng thần kinh. Các cá nhân dị hợp tử với hội chứng này có thể có nồng độ TGs huyết tương tăng từ nhẹ đến trung bình, có thể dao động từ 200 đến 750 mg/dL (khoảng 2,26 đến 8,48 mmol/L). Các yếu tố môi trường, chẳng hạn như tăng cân, có thể làm trầm trọng thêm tình trạng tăng triglyceride máu. Bệnh tim mạch (CVD) sớm thường không phải là một đặc điểm của bệnh chylomicron máu, nhưng các trường hợp đã được báo cáo.
Giảm lipid máu
Giảm Cholesterol Lipoprotein tỷ trọng cao
Trong thực hành lâm sàng, bệnh nhân có nồng độ HDL cholesterol thấp thường có TGs cao đồng thời, có hoặc không có sự gia tăng của LDL cholesterol đậm đặc và nhỏ. Những bệnh nhân này thường béo phì, và giải thích cơ học cho bộ ba rối loạn lipid máu này là do sản xuất quá mức VLDL. Ít phổ biến hơn là các rối loạn HDL có tính gia đình, bao gồm giảm alpha-lipoprotein máu gia đình, các đột biến của protein apoA-1, bệnh Tangier và thiếu hụt LCAT. Các rối loạn này được đặc trưng bởi nồng độ HDL cholesterol thấp, không có bất thường lipid nào khác. Giảm alpha-lipoprotein máu gia đình theo kiểu di truyền trội trên nhiễm sắc thể thường. Nồng độ ApoA-1 cũng thường thấp do giảm sản xuất HDL.
Một số đột biến đã được mô tả trong gen apoA-1 và có liên quan đến HDL cholesterol thấp và apoA-1 thấp. Bệnh Tangier là do các đột biến trong gen ABCA1. Bệnh nhân bị ảnh hưởng bởi bệnh này không thể chủ động rút cholesterol từ tế bào lên các hạt HDL non, gây ra sự thoái giáng nhanh chóng của HDL non. ApoA-1 bị thanh thải nhanh chóng trước khi nó có thể thu nhận cholesterol. Trong bệnh Tangier, nồng độ HDL cholesterol gần bằng không và nồng độ apoA-1 dưới 5 mg/dL (< 50 mg/L). Nguy cơ ASCVD sớm ở những bệnh nhân này là từ nhẹ đến trung bình. Thiếu hụt LCAT là một rối loạn di truyền lặn trên nhiễm sắc thể thường rất hiếm gặp do các đột biến trong LCAT, một enzyme được gan tổng hợp và bài tiết vào huyết tương, nơi nó liên kết với các lipoprotein. LCAT este hóa cholesterol tự do trên bề mặt HDL và cho phép sự tích tụ của các este cholesteryl trong lõi của HDL. Trong tình trạng thiếu hụt LCAT, việc thiếu este hóa cholesterol bình thường làm suy giảm sự hình thành các hạt HDL trưởng thành, chúng dễ dàng bị dị hóa cùng với apoA-1. Đáng chú ý, mặc dù nồng độ HDL cholesterol trong huyết tương cực kỳ thấp (thường < 10 mg/dL [< 0,26 mmol/L]) và apoA-1, CVD sớm không phải là một đặc điểm nhất quán của rối loạn này.
Bệnh abetalipoprotein máu
Bệnh abetalipoprotein máu có liên quan đến cholesterol huyết thanh thấp (< 50 mg/dL [< 1,3 mmol/L]) và TGs (~ 2–45 mg/dL [khoảng 0,02–0,51 mmol/L]). Bệnh nhân mắc rối loạn này có biểu hiện tiêu chảy phân mỡ và gan nhiễm mỡ. Nếu không điều trị, sẽ dẫn đến thất điều (với hồng cầu gai và viêm võng mạc sắc tố). Bệnh abetalipoprotein máu là do một khiếm khuyết trong MTTP. Nếu không có MTTP, không có chylomicron, VLDL hoặc LDL xuất hiện trong huyết tương. Ở những bệnh nhân này, HDL đảm nhận vai trò là chất mang cholesterol chính. Do đó, khiếm khuyết này không gây tử vong vì kém hấp thu chất béo đáng kể, tình trạng vitamin tan trong chất béo bị suy giảm.
Cụ thể, vì sự hấp thu vitamin E và sự hấp thu của tế bào đòi hỏi sự vận chuyển của chylomicron và LDL, nên cần dùng liều cao vitamin E để ngăn ngừa thoái hóa võng mạc và tế bào thần kinh cảm giác. Các cân nhắc về chế độ ăn uống bổ sung bao gồm hạn chế TGs chuỗi dài trong chế độ ăn xuống dưới 15 g/ngày để giảm bớt tiêu chảy phân mỡ. Triglyceride chuỗi trung bình (dầu MCT) có thể được sử dụng như một nguồn năng lượng thay thế.
Bệnh giảm betalipoprotein máu
Bệnh giảm betalipoprotein máu là một rối loạn di truyền trội trên nhiễm sắc thể thường do một khiếm khuyết trong gen apoB tạo ra một apolipoprotein B bị cắt ngắn. Nồng độ cholesterol ở những bệnh nhân mắc bệnh giảm betalipoprotein máu dị hợp tử thường bằng 50% so với một thành viên gia đình không bị ảnh hưởng. Thể dị hợp tử của tình trạng này là lành tính. Tuy nhiên, bệnh giảm betalipoprotein máu đồng hợp tử có liên quan đến giảm cholesterol máu nặng, tiêu chảy phân mỡ đáng kể, gan nhiễm mỡ, bệnh võng mạc do hồng cầu gai và bệnh thần kinh ngoại biên.
Các đột biến mất chức năng của PCSK9
Các đột biến mất chức năng của PCSK9 có liên quan đến nồng độ LDL-cholesterol rất thấp và giảm nguy cơ ASCVD (xem phần về Tăng cholesterol máu di truyền trội và lặn trên nhiễm sắc thể thường để biết cơ chế gây ra nồng độ LDL-cholesterol thấp). Các đột biến này được tìm thấy ở khoảng 2% dân số. So với những người không mang gen, những người mang gen dị hợp tử có mức giảm 28% nồng độ LDL-C và giảm 88% nguy cơ ASCVD, và cũng có thể bảo vệ những người mang gen khỏi nhồi máu cơ tim. Việc ngăn chặn sự thoái giáng LDLR qua trung gian PCSK9 bằng các kháng thể đơn dòng là một chiến lược mới để giảm LDL-cholesterol, ở những bệnh nhân bị các dạng tăng cholesterol máu nặng.
Các rối loạn có thanh thải Lipoprotein qua con đường ApoE
Bệnh dysbetalipoprotein máu được đặc trưng bởi nồng độ cholesterol và TG tăng. Rối loạn này là kết quả của sự hiện diện của một đa hình của alen apoE (apoE2, thay vì apoE3 phổ biến hơn hoặc apoE4 ít phổ biến hơn). Về mặt chuyển hóa, khiếm khuyết này dẫn đến sự hấp thu kém của các hạt tàn dư và dị hóa tàn dư bất thường do apoE bất thường. Tăng tàn dư, VLDL, chylomicron và apoE đều hiện diện. U vàng có thể xuất hiện, và ASCVD sớm đã được báo cáo. Rối loạn lipoprotein này hiếm gặp ở trẻ em và thường xuất hiện ở tuổi thanh niên.
Các nguyên nhân thứ phát
Rối loạn lipid máu thứ phát có thể là kết quả của nhiều bệnh và tình trạng khác nhau (Hộp 25.1). Tại Hoa Kỳ, nguyên nhân phổ biến nhất của rối loạn lipid máu thứ phát là thừa cân và béo phì. Bộ ba rối loạn lipid máu (cụ thể là tăng TGs và LDL nhỏ, đậm đặc và HDL cholesterol thấp) thường liên quan đến thừa cân (đặc biệt là với béo phì trung tâm). Ngoài rối loạn lipid máu, có thể có kháng insulin và tăng huyết áp. Cụm bất thường này được biết đến ở người lớn là hội chứng chuyển hóa. Bằng chứng thực nghiệm ở trẻ em cũng cho thấy rằng béo phì trong thời thơ ấu có liên quan đến cùng một cụm yếu tố nguy cơ được thấy ở người lớn, rằng nó tiếp tục kéo dài đến tuổi trưởng thành, và nó có liên quan đến tăng nguy cơ xơ vữa động mạch sớm nhanh chóng. Phương pháp tiếp cận chính để điều trị rối loạn này ở cả người lớn và trẻ em là quản lý cân nặng. Cải thiện tình trạng cân nặng và giảm lượng mỡ trong cơ thể đã được chứng minh là có liên quan đến những cải thiện trong rối loạn lipid máu và các bệnh đi kèm khác liên quan đến béo phì.
| Hộp 25.1 Các nguyên nhân thứ phát chọn lọc của tăng lipoprotein máu ở trẻ em
Nội tiết |
Những rối loạn chuyển hóa lipid ở bệnh nhân trưởng thành mắc đái tháo đường type 1 và 2 tương tự như những rối loạn được tìm thấy ở bệnh nhân mắc hội chứng chuyển hóa, nhưng thường nghiêm trọng hơn. Nói chung, ở người lớn mắc đái tháo đường, TGs tăng và HDL cholesterol thấp—và LDL cholesterol có thể bình thường, tăng nhẹ hoặc trung bình. Đái tháo đường ở người lớn được coi là một yếu tố nguy cơ tương đương với ASCVD theo Chương trình Giáo dục về Cholesterol Quốc gia (NCEP). Điều này có nghĩa là nguy cơ phát triển ASCVD ở bệnh nhân đái tháo đường được kiểm soát kém tương đương với những người đã có ASCVD. Vì lý do này, NCEP khuyến nghị điều trị tích cực rối loạn lipid máu ở bệnh nhân trưởng thành mắc đái tháo đường.
Mặc dù đái tháo đường type 1 hiện là dạng đái tháo đường chính được thấy ở trẻ em, tại Hoa Kỳ, ngày càng có nhiều bệnh nhân đái tháo đường type 2 dưới 18 tuổi. Sự thay đổi về tỷ lệ mắc đái tháo đường type 2 ở thanh thiếu niên có khả năng liên quan đến dịch bệnh béo phì ngày càng tăng trong dân số nhi khoa. Dữ liệu về nồng độ lipid ở trẻ em và thanh thiếu niên mắc đái tháo đường còn ít, đặc biệt là ở những người mắc đái tháo đường type 2.
Nghiên cứu Tìm kiếm Đái tháo đường ở Thanh thiếu niên đã đánh giá tỷ lệ bất thường lipid huyết thanh trong một mẫu đại diện của trẻ em và thanh thiếu niên Hoa Kỳ mắc đái tháo đường type 1 và type 2. Kết quả từ nghiên cứu này cho thấy một số lượng đáng kể trẻ em mắc đái tháo đường trên 10 tuổi có lipid huyết thanh bất thường: gần 50% có nồng độ LDL cholesterol trên mức tối ưu là 100 mg/dL (> 2,6 mmol/L). Đối với trẻ em mắc đái tháo đường type 2, 37% có nồng độ TG tăng và 44% có HDL cholesterol thấp. Những dữ liệu này nhấn mạnh tầm quan trọng của việc sàng lọc lipid huyết thanh ở trẻ em mắc đái tháo đường. Ngày càng có nhiều tài liệu cũng cho thấy rối loạn chức năng mạch máu sớm ở trẻ em mắc đái tháo đường, bất kể type nào. Điều này được cho là do các bất thường về đường huyết và lipid liên quan đến việc quản lý đái tháo đường kém. Vì lý do này, các hướng dẫn điều trị mới khuyến nghị quản lý tích cực glucose và lipid cho trẻ em mắc đái tháo đường. Các hướng dẫn này sẽ được thảo luận sau trong chương.
Các nguyên nhân khác của rối loạn lipid máu thứ phát bao gồm suy giáp, hội chứng thận hư, các bệnh thận khác, bệnh gan và nhiễm trùng. Nguy cơ phát triển xơ vữa động mạch với những tình trạng này chưa được biết nhưng có khả năng tỷ lệ thuận với thời gian tiếp xúc và mức độ tăng nồng độ LDL cholesterol huyết thanh. Bệnh tim mạch thường gặp ở bệnh nhân suy thận mạn. Rối loạn lipid máu cũng có thể là kết quả của việc sử dụng nhiều loại thuốc. Các loại thuốc này bao gồm progestin, estrogen, androgen, steroid đồng hóa, corticosteroid, cyclosporine và retinoid. Các nguyên nhân thứ phát của rối loạn lipid máu nên được xác định bằng dữ liệu bệnh sử của bệnh nhân và khám thực thể cẩn thận. Các xét nghiệm (bao gồm các bảng chức năng tuyến giáp, thận và gan) có thể xác nhận chẩn đoán.
Việc điều trị rối loạn lipid máu ở bệnh nhân có nguyên nhân thứ phát tập trung vào việc quản lý bệnh nền. Thay đổi chế độ ăn uống và hoạt động thể chất cũng có thể được khuyến nghị để giảm nồng độ LDL cholesterol và TG tăng.
Thay đổi mạch máu và rối loạn lipid máu
Đã được xác lập rõ ràng rằng nồng độ cholesterol toàn phần và LDL cholesterol tăng trong cuộc sống trưởng thành là những yếu tố nguy cơ mạnh và có thể đảo ngược đối với ASCVD. Liệu rối loạn lipid máu trong thời thơ ấu có góp phần vào các tổn thương xơ vữa động mạch vành và các động mạch khác hay không đã là một chủ đề tranh luận, nhưng các bằng chứng tích lũy từ các nghiên cứu bệnh học và hình ảnh học in vivo ủng hộ một mối quan hệ. Các tổn thương xơ vữa động mạch là kết quả của sự lắng đọng lipid và cholesterol trong lớp nội mạc của thành động mạch. Các tổn thương sớm, được gọi là vệt mỡ, được hình thành từ sự tích tụ của các đại thực bào chứa đầy các giọt lipid (tế bào bọt).
Vệt mỡ không làm xáo trộn cấu trúc bình thường của lớp nội mạc, không làm biến dạng hoặc tắc nghẽn động mạch, và bản thân chúng không được coi là có hại. Tuy nhiên, một số tiếp tục tích tụ các tế bào bọt đại thực bào và lipid ngoại bào cùng các tế bào cơ trơn—tạo thành các mảng xơ vữa nổi lên. Từ đó, các tổn thương tiến triển hơn có thể phát triển—với sự lắng đọng thêm của lipid ngoại bào, tinh thể cholesterol, collagen và có thể cả canxi. Chính những tổn thương nổi lên này dẫn đến nhồi máu cơ tim do kích thước ngày càng tăng và tắc nghẽn lòng động mạch hoặc do vỡ mảng xơ vữa, dẫn đến giải phóng các chất gây huyết khối từ lõi hoại tử.
Các nghiên cứu bệnh học sinh học của các động mạch vành của những người trẻ tuổi chết vì những nguyên nhân không liên quan đến bệnh tim đã hữu ích trong việc ghi nhận sự tiến triển của xơ vữa động mạch theo tuổi và các yếu tố nguy cơ quyết định. Stary và các đồng nghiệp đã nghiên cứu hơn 500 mẫu tử thi của các động mạch vành từ những người dưới 30 tuổi và tìm thấy sự hiện diện của các vệt mỡ ở phần lớn trẻ em dưới 9 tuổi, các tổn thương nổi lên ở khoảng một nửa thanh thiếu niên, và các tổn thương tiến triển hơn ở khoảng một phần ba số thanh niên được nghiên cứu. Trong 93 ca tử thi của những người trẻ tuổi có sẵn dữ liệu về yếu tố nguy cơ thời thơ ấu, Berenson và các đồng nghiệp đã phát hiện ra rằng mức độ bề mặt của các động mạch bị bao phủ bởi các vệt mỡ và mảng xơ vữa có liên quan dương với LDL cholesterol, TGs, huyết áp và chỉ số khối cơ thể (BMI), và liên quan âm với nồng độ HDL cholesterol trong thời thơ ấu.
Nghiên cứu Các Yếu tố Quyết định Bệnh học Sinh học của Xơ vữa động mạch ở Thanh niên đã đi đến kết luận tương tự từ việc kiểm tra hơn 3000 mẫu tử thi của các động mạch vành của những người trẻ tuổi chết vì các sự kiện không liên quan đến tim mạch và cũng có sẵn một loạt các chỉ số thay thế cho các phép đo yếu tố nguy cơ trước khi chết. Nói chung, các nghiên cứu bệnh học đã có những đóng góp quan trọng vào việc xác định các yếu tố nguy cơ cho các khía cạnh sớm của quá trình xơ vữa động mạch. Cùng với những phát hiện từ các nghiên cứu theo chiều dọc, chẳng hạn như Nghiên cứu Tim Framingham (trong đó các đánh giá yếu tố nguy cơ của những người tham gia có trước sự phát triển của CVD), một nhóm các yếu tố nguy cơ, thường được gọi là các yếu tố nguy cơ truyền thống đối với ASCVD đã được thiết lập. Một danh sách đầy đủ các yếu tố nguy cơ nhi khoa đối với ASCVD được tìm thấy trong Hộp 25.2.
| Hộp 25.2 Các Yếu tố Nguy cơ Nhi khoa đối với Bệnh Tim mạch do Xơ vữa
Các yếu tố nguy cơ dương tính Các yếu tố nguy cơ âm tính CVD, Bệnh tim mạch, HDL, lipoprotein tỷ trọng cao, LDL, lipoprotein tỷ trọng thấp. |
Những tiến bộ trong công nghệ hình ảnh mạch máu đã cung cấp một phương tiện để đo lường những thay đổi bệnh lý sớm và những bất thường chức năng đối với các động mạch vành và các động mạch khác để đáp ứng với những thay đổi bất lợi trong các yếu tố nguy cơ CVD. Ưu điểm của việc sử dụng công nghệ này là thành của các động mạch nông có thể được chụp ảnh không xâm lấn trong thời gian thực ở độ phân giải cao, và những thay đổi đối với thành động mạch có thể được đo lường như một biến liên tục từ thời thơ ấu đến tuổi trưởng thành ở những bệnh nhân có và không có sự hiện diện của các yếu tố nguy cơ đối với ASCVD. Chụp cắt lớp vi tính (CT) được coi là một trong những công cụ không xâm lấn nhạy nhất để chụp ảnh mức độ và vị trí của canxi động mạch vành hiện diện trong mảng xơ vữa.
Sự hiện diện của canxi động mạch vành có liên quan đến các kết cục CVD bất lợi ở người lớn. Ở thanh thiếu niên, một số nghiên cứu tiền cứu đã cho thấy mối liên quan giữa các yếu tố nguy cơ đối với ASCVD ở thanh niên và canxi động mạch vành ở tuổi thanh niên. Trong Nghiên cứu Muscatine, trong đó những người tham gia được đánh giá về các yếu tố nguy cơ CVD trong những năm đi học, và sau đó được đánh giá về những thay đổi tim mạch bằng chụp CT, 31% nam và 10% nữ trong độ tuổi từ 29 đến 37 có vôi hóa động mạch vành đáng kể. Trong nghiên cứu này, các yếu tố nguy cơ thời thơ ấu liên quan đến vôi hóa là béo phì, tăng huyết áp và HDL cholesterol thấp. Trong Nghiên cứu Nguy cơ Tim mạch ở Thanh niên Phần Lan, cholesterol toàn phần và LDL tăng, nồng độ Apo-B và huyết áp tâm thu được đo ở tuổi vị thành niên có liên quan đến canxi động mạch vành ở tuổi trung niên, nhấn mạnh vai trò của việc tiếp xúc với yếu tố nguy cơ suốt đời đối với sinh lý bệnh của CVD. Gidding và các đồng nghiệp đã cho thấy canxi động mạch vành đáng kể bằng CT chùm tia điện tử ở 7 trong số 29 thanh niên mắc tăng cholesterol máu gia đình dị hợp tử. Thừa cân được phát hiện làm tăng khả năng có canxi ở những người đã có nguy cơ cao.
Hình ảnh siêu âm mạch máu đã được sử dụng để đánh giá những thay đổi trong giãn mạch qua trung gian dòng chảy của động mạch cánh tay, đây là một thước đo chức năng nội mô, và bề dày lớp nội trung mạc động mạch cảnh (intima-media thickness – IMT). Ở người lớn, cả hai phép đo này đều có liên quan đến những thay đổi bất lợi trong các yếu tố nguy cơ ASCVD truyền thống, đáp ứng với việc bình thường hóa các yếu tố nguy cơ, và được coi là những dấu hiệu sớm quan trọng cho sự tiến triển của bệnh xơ vữa động mạch. Mặc dù có ít nghiên cứu hơn sử dụng công nghệ siêu âm để đánh giá các động mạch vành ở người trẻ, trẻ em bị tăng cholesterol máu đã được đánh giá bằng các phép đo của động mạch cảnh và động mạch cánh tay và đã được phát hiện có những bất thường về IMT động mạch cảnh và giãn mạch động mạch cánh tay. Việc bắt đầu sớm và thời gian điều trị statin kéo dài hơn ở thanh thiếu niên mắc FH có liên quan đến IMT động mạch cảnh tốt hơn sau 10 năm theo dõi, được chứng minh bằng việc không có sự khác biệt về tốc độ tăng IMT động mạch cảnh giữa thanh thiếu niên mắc FH so với anh chị em không bị ảnh hưởng của họ. Sự thoái triển của IMT động mạch cảnh cũng đã được chứng minh ở thanh thiếu niên khi điều trị rối loạn lipid máu, trong khi một nghiên cứu về liệu pháp statin ở người lớn có nguy cơ thấp đã chứng minh sự không tiến triển của IMT động mạch cảnh nhưng không dẫn đến sự thoái triển của xơ vữa động mạch. Trong một tổng quan hệ thống gồm 51 nghiên cứu đánh giá hơn 4000 bệnh nhân FH và 700 bệnh nhân FCHL, chức năng nội mô bị suy giảm, được đo bằng giãn mạch qua trung gian dòng chảy (FMD) của động mạch cánh tay giảm, đã được cải thiện đáng kể với statin. Phù hợp với các nghiên cứu về IMT động mạch cảnh, sự cải thiện tỷ lệ thuận với thời gian và cường độ của liệu pháp statin.
Tóm lại, những nghiên cứu này xác nhận tính hữu dụng của hình ảnh mạch máu trong việc phát hiện những thay đổi bệnh lý và chức năng sớm đối với các mạch vành, và các mối liên quan với các yếu tố nguy cơ CVD có thể thay đổi ở người trẻ. Về mặt lâm sàng, hình ảnh mạch máu bằng siêu âm có thể là một phương tiện có giá trị để ước tính lợi ích của việc điều trị nhiều yếu tố nguy cơ CVD ở trẻ em và thanh thiếu niên. Tuy nhiên, cần thu thập thêm dữ liệu tiêu chuẩn trên các nhóm tuổi, chủng tộc và giới tính, và các nghiên cứu theo chiều dọc để xác định những thay đổi liên quan đến tuổi và dậy thì trong các phép đo này trước khi các phương pháp này có thể được áp dụng trong đánh giá lâm sàng. Nói chung, chụp CT có thể ít hữu ích hơn ở những bệnh nhân trẻ tuổi vì sự lắng đọng canxi không phổ biến trước tuổi thanh niên.
Sàng lọc rối loạn lipid máu
Sàng lọc thường quy
Phương pháp tiếp cận sàng lọc rối loạn lipid máu ở trẻ em đã gây nhiều tranh cãi. Kể từ những năm 1990, các hướng dẫn nhi khoa do Chương trình Giáo dục Cholesterol Quốc gia (NCEP) thiết lập đã cung cấp tiêu chuẩn chăm sóc, liên quan đến sàng lọc lipid và điều trị rối loạn lipid máu ở trẻ em. Các hướng dẫn này khuyến nghị sàng lọc cholesterol máu có chọn lọc ở trẻ em, dựa trên tiền sử gia đình có người mắc bệnh tim mạch (CVD) sớm (trước 55 tuổi), cha hoặc mẹ có rối loạn lipid máu (cholesterol toàn phần > 240 mg/dL [> 6,2 mmol/L]), hoặc trẻ có thêm các yếu tố nguy cơ CVD khác, chẳng hạn như tăng huyết áp, đái tháo đường và béo phì. Nếu không rõ tiền sử gia đình, các khuyến nghị đề nghị việc sàng lọc lipid cho trẻ được thực hiện theo quyết định của nhà cung cấp dịch vụ chăm sóc ban đầu. Sàng lọc chọn lọc được Hội đồng Chuyên gia của Viện Tim, Phổi và Máu Quốc gia (NHLBI) về Hướng dẫn Tích hợp về Sức khỏe Tim mạch và Giảm thiểu Nguy cơ ở Trẻ em và Thanh thiếu niên tán thành cho trẻ nhỏ từ 2 đến < 9 tuổi.
Đối với trẻ lớn hơn từ 9 đến 11 tuổi và một lần nữa sau tuổi dậy thì (từ 17–21 tuổi), Hội đồng Chuyên gia NHLBI khuyến nghị sàng lọc rối loạn lipid máu toàn dân. Điều này dựa trên bằng chứng cho thấy sàng lọc có mục tiêu đối với rối loạn lipid máu được báo cáo đã bỏ sót nhiều trẻ em bị rối loạn lipid máu trung bình (tới 30%–60%) và không phát hiện được một số lượng đáng kể những trẻ có khả năng bị rối loạn lipid máu di truyền và có thể cần điều trị tích cực hơn. Tăng cholesterol máu gia đình (FH) là một vấn đề tương đối phổ biến, với thể dị hợp tử xảy ra ở một trong 250 cá nhân. FH đã được chứng minh rõ ràng có liên quan đến việc tăng nguy cơ ASCVD suốt đời, và việc điều trị sớm hơn có liên quan đến việc giảm các bằng chứng cận lâm sàng của xơ vữa động mạch. Để tăng khả năng phát hiện những bệnh nhân trẻ tuổi mắc FH và các rối loạn lipid máu di truyền khác, Hiệp hội Tim mạch Hoa Kỳ (AHA) và Hiệp hội Lipid Quốc gia cũng tán thành việc sàng lọc lipid trong thời thơ ấu và thanh thiếu niên. Hướng dẫn năm 2016 của Lực lượng Đặc nhiệm Dịch vụ Dự phòng Hoa Kỳ về sàng lọc lipid ở trẻ em không đặc biệt ủng hộ hay phản đối việc sàng lọc lipid ở trẻ em, nhưng trích dẫn sự thiếu hụt kiến thức về mối quan hệ giữa nồng độ lipid thời thơ ấu và các kết cục tim mạch nặng, và sự cần thiết phải có thêm bằng chứng về vấn đề này.
Các khuyến nghị của Hội đồng Chuyên gia NHLBI đã công nhận rằng có sự thay đổi đáng kể về LDL cholesterol theo tuổi trong quá trình tăng trưởng và phát triển, đặc biệt là trong giai đoạn dậy thì. Nồng độ cholesterol toàn phần và LDL có xu hướng giảm trong tuổi dậy thì, có nghĩa là một số thanh thiếu niên sẽ có vẻ bình thường, trong khi thực tế họ sẽ có nồng độ tăng cao sau tuổi dậy thì. Vì lý do này, độ tuổi từ 9 đến 11 được chọn là độ tuổi tốt để sàng lọc, trước khi ảnh hưởng của tuổi dậy thì làm giảm nồng độ LDL cholesterol, nhưng gần hơn với độ tuổi mà liệu pháp dùng thuốc có thể phù hợp.
Hội đồng Chuyên gia cũng đưa non-HDL cholesterol vào như một công cụ sàng lọc để xác định rối loạn lipid máu ở trẻ em. Non-HDL cholesterol được tính bằng cách trừ HDL cholesterol khỏi cholesterol toàn phần. Phép đo này phản ánh lượng cholesterol được mang bởi các lipoprotein chứa apolipoprotein B gây xơ vữa (VLDL, IDL và LDL). Ở cả người lớn và trẻ em, non-HDL cholesterol đã được xác định là có khả năng dự đoán rối loạn lipid máu dai dẳng và do đó là xơ vữa động mạch và các biến cố CVD trong tương lai tốt hơn so với cholesterol toàn phần, LDL cholesterol hoặc HDL cholesterol đơn thuần. Một ưu điểm lớn của non-HDL cholesterol là nó có thể được tính toán chính xác ở trạng thái không nhịn ăn và do đó thực tế để thực hiện trong môi trường chăm sóc ban đầu. Các phân vị cho non-HDL cholesterol đã được thiết lập (Bảng 25.3) và dựa trên dữ liệu từ Nghiên cứu Tim Bogalusa, trong đó non-HDL cholesterol lớn hơn hoặc bằng phân vị thứ 95 được coi là “bất thường/cao” và giữa phân vị thứ 75 đến 95 được coi là “ranh giới”.
Bảng 25.3 Nồng độ Lipid và Lipoprotein Huyết tương Bình thường (mg/dL) cho Trẻ em và Thanh thiếu niên
| Phân loại | Thấp | Chấp nhận được | Ranh giới | Cao |
|---|---|---|---|---|
| Cholesterol toàn phần | — | < 170 (< 4,4) | 170–199 (4,4–5,15) | ≥ 200 (≥ 5,17) |
| LDL cholesterol | — | < 110 (< 2,8) | 110–129 (2,8–3,3) | ≥ 130 (≥ 3,4) |
| Non-HDL cholesterol | — | < 120 (< 3,1) | 120–144 (3,1–3,7) | ≥ 145 (≥ 3,8) |
| Apolipoprotein B | — | < 90 (< 0,9) | 90–109 (0,9–1,09) | ≥ 110 (≥ 1,1) |
| Triglyceride | — | |||
| 0–9 tuổi | < 75 (< 0,85) | 75–99 (0,85–1,12) | ≥ 100 (≥ 1,13) | |
| 10–19 tuổi | < 90 (< 1,02) | 90–129 (1,02–1,46) | ≥ 130 (≥ 1,47) | |
| HDL cholesterol | < 40 (< 1,03) | > 45 (> 1,16) | 40–45 (1,03–1,16) | |
| Apolipoprotein A-1 | < 115 (< 1,15) | < 120 (< 1,2) | 115–120 (1,15–1,2) | — |
| Đơn vị trong ngoặc là mmol/L cho cholesterol và triglyceride, và g/L cho apolipoprotein. HDL, Lipoprotein tỷ trọng cao; LDL, lipoprotein tỷ trọng thấp. | ||||
Các giá trị cho lipid và lipoprotein huyết tương được lấy từ Báo cáo tóm tắt của Hội đồng Chuyên gia về Hướng dẫn Tích hợp Sức khỏe Tim mạch và Giảm thiểu Nguy cơ ở Trẻ em và Thanh thiếu niên (2011). Pediatrics, 128, S1–S44.
Nếu non-HDL cholesterol lúc không đói được phát hiện là bất thường, một phân tích lipoprotein lúc đói (12 giờ) được khuyến nghị để cho phép định lượng cholesterol toàn phần, HDL cholesterol, TGs và tính toán LDL cholesterol. Công thức Friedewald—LDL cholesterol = cholesterol toàn phần − (HDL cholesterol + TGs/5)—có thể được sử dụng để tính LDL cholesterol, miễn là nồng độ TG huyết thanh dưới 400 mg/dL (< 4,5 mmol/L). Việc đo trực tiếp nồng độ LDL cholesterol có sẵn thông qua một số phòng thí nghiệm thương mại và được chỉ định cho những người có nồng độ TG lúc đói từ 400 mg/dL trở lên (≥ 4,5 mmol/L).
Các ngưỡng cắt lipid/lipoprotein được sử dụng trong sàng lọc được trình bày trong Bảng 25.3. Các ngưỡng cắt cho cholesterol toàn phần và LDL cholesterol ở trẻ em là từ Nghiên cứu Tỷ lệ Hiện mắc của các Phòng khám Nghiên cứu Lipid. Phân vị thứ 75 và 95 cho các giá trị lipid từ nghiên cứu này đã được sử dụng để xác định các loại nguy cơ “ranh giới” và “cao”. Nếu một phân tích lipoprotein cho thấy LDL cholesterol ở mức ranh giới hoặc cao, có sự đồng thuận giữa các hướng dẫn rằng xét nghiệm nên được lặp lại và giá trị trung bình của hai lần xét nghiệm được xem xét để ra quyết định lâm sàng.
Mặc dù Nghiên cứu Tỷ lệ Hiện mắc của các Phòng khám Nghiên cứu Lipid đã cung cấp các phân vị dân số cho nồng độ TG và HDL-C, các ngưỡng cắt được khuyến nghị cho các biến này đã không được thiết lập vào năm 1992. Việc đo lường các biến này đã trở nên quan trọng hơn vì chúng là một phần của cụm các yếu tố nguy cơ liên quan đến dịch bệnh béo phì nhi khoa ngày càng tăng ở Hoa Kỳ. Dữ liệu từ các nghiên cứu bệnh học và hình ảnh học cho thấy những thay đổi bất lợi trong cấu trúc và chức năng mạch máu ở tuổi trưởng thành liên quan đến HDL cholesterol thấp và nồng độ TG cao trong thời thơ ấu. Do đó, hướng dẫn mới nhất khuyến nghị các ngưỡng cắt cho TGs và HDL cholesterol dựa trên các phân vị được cung cấp bởi NCEP. Phân vị thứ 75 và 95 cho các giá trị TG đã được sử dụng để xác định các loại nguy cơ ranh giới và cao, và phân vị thứ 25 và thứ 10 đã được sử dụng để xác định các nhóm nguy cơ ranh giới và cao cho HDL cholesterol (xem Bảng 25.3).
Mặc dù các phương pháp miễn dịch hóa học được tiêu chuẩn hóa tốt có sẵn để xác định các phép đo apoB và apoA-1, các hướng dẫn cho rằng việc đo apolipoprotein để sàng lọc toàn dân không mang lại lợi thế bổ sung nào so với việc đo nồng độ non-HDL cholesterol, LDL cholesterol và HDL cholesterol, ngoại trừ ở thanh thiếu niên có cha mẹ mắc CVD sớm. Các ngưỡng cắt cho apoB và apoA-1 từ Khảo sát Kiểm tra Sức khỏe và Dinh dưỡng Quốc gia nên được sử dụng trong những trường hợp này (xem Bảng 25.3). Việc đo lường các phân nhóm lipoprotein và kích thước của chúng ở trẻ em và thanh thiếu niên, bằng xét nghiệm lipoprotein tiên tiến, đã được phát hiện là không có đủ tiện ích lâm sàng để đảm bảo việc sử dụng thường quy.
Đánh giá lâm sàng trẻ em và thanh thiếu niên có nguy cơ cao bị ASCVD, dựa trên nồng độ lipid bất thường, nên bao gồm việc xem xét cẩn thận bệnh sử và tiền sử gia đình của bệnh nhân, và khám thực thể để xác định các yếu tố nguy cơ bổ sung và các nguyên nhân thứ phát của rối loạn lipid máu. Đánh giá nên bao gồm những điều sau: xem xét bệnh sử hoặc tiền sử gia đình về tăng huyết áp, đái tháo đường, sử dụng thuốc, béo phì, thói quen ăn uống kém (bao gồm cả việc tiêu thụ quá nhiều chất béo bão hòa), hành vi tĩnh tại và sử dụng thuốc lá; đo chiều cao, cân nặng và tính chỉ số khối cơ thể (BMI); phân độ Tanner để đánh giá sự tăng trưởng dậy thì; đo huyết áp; kiểm tra thực thể da, mắt và gân để tìm sự lắng đọng lipid và sờ nắn tuyến giáp và gan để tìm các dấu hiệu phì đại; và các xét nghiệm (bao gồm các bảng chức năng tuyến giáp, thận và gan). Nồng độ glucose và insulin nên được đo để đánh giá sự hiện diện của hội chứng chuyển hóa hoặc đái tháo đường.
Xét nghiệm di truyền
Ngày càng có nhiều xét nghiệm dựa trên DNA được sử dụng để xác nhận chẩn đoán FH ở những bệnh nhân có thành viên gia đình mang đột biến hoặc ở một bệnh nhân trẻ có LDL cholesterol cao, với u vàng ở gân hoặc bệnh xơ vữa động mạch. Hiện tại, ba gen (LDLR, apoB, và PCSK9) đã được xác định có liên quan đến các đột biến gây ra rối loạn này. Ngoài LDLR, hầu hết các phòng thí nghiệm đều xét nghiệm đột biến r500Q của gen apolipoprotein B. Các phương pháp nhanh chóng và tương đối rẻ tiền đã được phát triển để xét nghiệm một tập hợp con được chọn lọc của các đột biến LDLR. Tuy nhiên, cần có các phương pháp “quét toàn bộ gen” đắt tiền hơn cho các mẫu âm tính với đột biến. Một khi một đột biến được xác định, người thân có thể được xét nghiệm nhanh chóng và rẻ tiền.
Dự kiến rằng xét nghiệm di truyền sẽ tạo điều kiện thuận lợi cho việc chẩn đoán FH và việc bắt đầu cũng như cường độ của liệu pháp hạ lipid được khuyến nghị. Các nghiên cứu đã chỉ ra rằng mức độ hạ cholesterol đạt được bởi statin bị ảnh hưởng bởi loại đột biến (ví dụ, những người có đột biến APOB r3500Q cho thấy phản ứng tích cực mạnh mẽ với liệu pháp statin). Ngoài ra, việc chẩn đoán FH dựa trên xét nghiệm di truyền đã cải thiện việc tiếp nhận và tuân thủ điều trị trong một số nghiên cứu. Dữ liệu từ Sổ bộ CASCADE FH (Sàng lọc Theo tầng để Nâng cao Nhận thức và Phát hiện FH) chỉ ra rằng xét nghiệm di truyền FH chưa được sử dụng đúng mức cho bệnh nhân ở Hoa Kỳ, với xét nghiệm di truyền được báo cáo ở 3,9% cá nhân trong sổ bộ có chẩn đoán lâm sàng FH. Vẫn còn những lo ngại về lợi ích lâu dài và các tác dụng phụ tiềm tàng từ việc điều trị suốt đời bằng statin cho trẻ em được xác định. Khi tiến bộ trong lĩnh vực này tiếp tục, các thuật toán điều trị hiện tại có thể cần được sửa đổi để mô tả vai trò của xét nghiệm di truyền trong thực hành lâm sàng.
Liệu pháp ăn uống trong quản lý rối loạn lipid máu
Các khuyến nghị dinh dưỡng nhi khoa mới từ Hội đồng Chuyên gia ủng hộ một phương pháp tiếp cận ăn uống hai hướng để quản lý tăng cholesterol máu ở trẻ em: một hướng dành cho dân số nói chung và hướng thứ hai tập trung vào điều trị cá nhân hóa rối loạn lipid máu, bao gồm một phương pháp tiếp cận cho LDL-C tăng và một phương pháp tiếp cận cho TGs tăng. Ở cấp độ dân số đối với trẻ sơ sinh khỏe mạnh, Hội đồng Chuyên gia đã khuyến nghị nuôi con bằng sữa mẹ là tối ưu đến 12 tháng tuổi nếu có thể cùng với việc bổ sung thực phẩm bổ sung khi thích hợp; việc giới thiệu sữa công thức tăng cường sắt được khuyến nghị nếu việc cho con bú bị dừng hoặc giảm trước 1 tuổi. Các khuyến nghị dinh dưỡng trước đây từ NCEP không bao gồm các khuyến nghị cho trẻ sơ sinh; tuy nhiên, bằng chứng ủng hộ lợi ích tim mạch bền vững của việc cho con bú, bao gồm cholesterol toàn phần, BMI và IMT động mạch cảnh thấp hơn khi trưởng thành, hiện nay rất mạnh mẽ. Các hướng dẫn này phù hợp với Văn phòng Tổng Y sĩ, Tổ chức Y tế Thế giới, Học viện Nhi khoa Hoa Kỳ và Học viện Bác sĩ Gia đình Hoa Kỳ.
Hướng dẫn Chế độ ăn uống cho người Mỹ năm 2015 (DGA) cung cấp hướng dẫn dinh dưỡng tối ưu để các nhà cung cấp dịch vụ chăm sóc ban đầu sử dụng trong việc thúc đẩy sự đầy đủ chất dinh dưỡng và giảm nguy cơ CVD ở trẻ em trên 2 tuổi. Để phù hợp với mục tiêu giảm nguy cơ bệnh mạn tính trong tất cả người Mỹ, DGA hỗ trợ thành phần chất béo trong chế độ ăn chiếm 25% đến 35% lượng calo, với ít hơn 10% lượng calo từ chất béo bão hòa và không có hoặc có rất ít chất béo chuyển hóa. Đáng chú ý, DGA 2015 không còn chỉ định cholesterol trong chế độ ăn là một chất dinh dưỡng cần quan tâm về việc tiêu thụ quá mức. Điều này dựa trên bằng chứng hiện có cho thấy không có mối quan hệ đáng kể nào giữa lượng cholesterol trong chế độ ăn và cholesterol huyết thanh. DGA cũng nhấn mạnh việc đặt ra một mục tiêu calo hàng ngày phù hợp để ổn định cân nặng khỏe mạnh. Mô hình ăn uống này gần như khớp với chế độ ăn Bước 1 trước đây của NCEP, và được xem như một biện pháp phòng ngừa ban đầu để tối ưu hóa lipid huyết thanh, qua đó giảm nguy cơ ASCVD trong dân số nhi khoa nói chung. Các khuyến nghị ăn uống dựa trên thực phẩm tương tự có sẵn thông qua Tổ chức Y tế Thế giới.
Trong phạm vi các yêu cầu cụ thể theo giới tính và độ tuổi để tăng trưởng và phát triển ở trẻ em bình thường và trẻ em bị rối loạn lipid máu, Hội đồng Chuyên gia đã khuyến nghị chuyển đổi sớm (từ 1 đến 2 tuổi) sang sữa không hương vị, giảm béo (từ sữa nguyên kem sang sữa 2%), và một thành phần chế độ ăn phù hợp với khuyến nghị của DGA. Lời khuyên chuyển đổi sớm sang chế độ ăn ít chất béo (tối thiểu 30% tổng lượng calo đến 2 tuổi) được hỗ trợ bởi dữ liệu từ nghiên cứu Chương trình Can thiệp Nguy cơ Đặc biệt Turku đang diễn ra, nghiên cứu này cho thấy rằng việc hạn chế tổng chất béo và chất béo bão hòa đến mức của DGA có thể được thực hiện một cách an toàn sau 6 tháng tuổi, dưới sự giám sát y tế và làm giảm cholesterol toàn phần, LDL cholesterol và BMI nhiều hơn so với một chế độ ăn thông thường có hàm lượng chất béo cao hơn. Hội đồng Chuyên gia đã cảnh báo rằng bất kỳ thay đổi chế độ ăn nào được bắt đầu trong thời thơ ấu nên được điều chỉnh cho phù hợp với trẻ để đảm bảo sự tăng trưởng và phát triển tối ưu và được thực hiện dưới sự hướng dẫn của bác sĩ chăm sóc chính của trẻ. Nhu cầu calo ước tính dựa trên độ tuổi và giới tính ở ba mức độ hoạt động thể chất từ Viện Y học được tìm thấy trong Bảng 25.4.
Bảng 25.4 Nhu cầu Calo Ước tính mỗi ngày theo Độ tuổi, Giới tính và Mức độ Hoạt động Thể chất
| Giới tính | Tuổi (Năm) | Nhu cầu Calo (kcals) theo Mức độ Hoạt động | ||
|---|---|---|---|---|
| Tĩnh tại | Hoạt động vừa phải | Năng động | ||
| Trẻ em | 2–3 | 1000–1200 | 1000–1400 | 1000–1400 |
| Nữ | 4–8 | 1200–1400 | 1400–1600 | 1400–1800 |
| 9–13 | 1400–1600 | 1600–2000 | 1800–2200 | |
| 14–18 | 1800 | 2000 | 2400 | |
| Nam | 4–8 | 1200–1400 | 1400–1600 | 1600–2000 |
| 9–13 | 1600–2000 | 1800–2200 | 2000–2600 | |
| 14–18 | 2000–2400 | 2400–2800 | 2800–3200 |
Lượng calo ước tính cần thiết để duy trì cân bằng calo cho các nhóm tuổi và giới tính khác nhau ở ba mức độ hoạt động thể chất khác nhau được lấy từ Báo cáo tóm tắt của Hội đồng Chuyên gia về Hướng dẫn Tích hợp Sức khỏe Tim mạch và Giảm thiểu Nguy cơ ở Trẻ em và Thanh thiếu niên (2011). Pediatrics, 128, S1–S44.
Phương pháp tiếp cận dân số của Hội đồng Chuyên gia cho thanh thiếu niên từ 4 tuổi trở lên khuyến khích tiêu thụ một chế độ ăn dựa trên thực vật tương đương với mô hình ăn uống của Chế độ ăn Tiếp cận Ngừng Tăng huyết áp (DASH). Mô hình ăn uống này khuyến nghị 7 đến 10 khẩu phần/ngày trái cây và rau quả và 6 đến 10 khẩu phần bánh mì, ngũ cốc và các loại hạt. Trái cây và rau quả nguyên chất thay vì nước ép, và ngũ cốc nguyên hạt thay vì ngũ cốc đã qua chế biến được khuyến khích. Các nguồn chính của chất béo bão hòa và cholesterol được kiểm soát trong kế hoạch ăn uống DASH. Ví dụ, thịt đỏ được giới hạn ở lượng vừa phải các miếng nạc (ví dụ: 140 đến 170 g mỗi ngày), và các sản phẩm từ sữa được giới hạn ở các loại không béo hoặc ít béo (470–710 ml/ngày). Thực phẩm có nguồn gốc thực vật nên chiếm tỷ lệ năng lượng lớn nhất trong chế độ ăn của trẻ. Hầu hết các lựa chọn trong các nhóm thực phẩm này đều ít chất béo, không chứa cholesterol và giàu chất xơ—và sẽ giúp thay thế các nguồn năng lượng chứa chất béo bão hòa. Lợi ích sức khỏe chính của kiểu ăn DASH là giảm huyết áp, cải thiện lipid và cải thiện tình trạng cân nặng. Hộp 25.3 nêu bật một số chiến lược ăn uống thực tế để giảm chất béo bão hòa và cholesterol trong chế độ ăn của người trẻ.
| Hộp 25.3 Các Chiến lược Ăn uống Thực tế để Giảm Chất béo Bão hòa và Cholesterol
• Ăn 7 đến 10 khẩu phần trái cây và rau quả tươi, đông lạnh hoặc đóng hộp hàng ngày. |
Trong một tổng quan hệ thống gần đây về các thử nghiệm đối chứng ngẫu nhiên, nhằm mục đích giảm chất béo bão hòa trong chế độ ăn để điều chỉnh các yếu tố nguy cơ CVD ở trẻ em, việc giảm LDL-C lớn nhất đã đạt được bằng cách thay thế chất béo bão hòa bằng chất béo không bão hòa đa (PUFA) hoặc hỗn hợp PUFA và chất béo không bão hòa đơn. Tương tự như DASH, chế độ ăn kiểu Địa Trung Hải, nếu được lên kế hoạch phù hợp, cũng nhấn mạnh các loại thực phẩm nguyên chất, chưa qua chế biến, hỗn hợp PUFA và chất béo không bão hòa đơn, và các nguồn protein thực vật. Mô hình thực phẩm này đã được công nhận là có hiệu quả trong việc điều chỉnh các yếu tố nguy cơ tim mạch, bao gồm giảm huyết áp, cải thiện lipid máu và thúc đẩy giảm cân. Những cải thiện lớn hơn trong các chỉ số đo độ giãn nở của động mạch đã được báo cáo ở những thanh thiếu niên béo phì bị tăng cholesterol máu sau 12 tuần can thiệp bằng chế độ ăn kiểu Địa Trung Hải so với nhóm đối chứng.
Đối với từng trẻ bị rối loạn lipid máu, có tiền sử gia đình mắc CVD sớm, béo phì hoặc tăng huyết áp, Hội đồng Chuyên gia đã khuyến nghị bắt đầu áp dụng cùng một phương pháp ăn uống được khuyến nghị cho dân số chung (như đã mô tả trước đây). Hội đồng Chuyên gia đã đặt tên cho kế hoạch này là Chế độ ăn Lối sống Tích hợp Sức khỏe Tim mạch (CHILD-1) và coi đây là liệu pháp đầu tay để khắc phục các yếu tố nguy cơ CVD, với mục tiêu chính là giảm nồng độ LDL cholesterol. Các kế hoạch bữa ăn cho các mức calo khác nhau đã được công bố cho các mô hình chế độ ăn DASH và kiểu Địa Trung Hải phù hợp với chế độ ăn CHILD-1 và có thể được điều chỉnh để giảm dần chất béo bão hòa và đảm bảo đủ calo và chất dinh dưỡng cho trẻ em. Nếu nồng độ LDL cholesterol vẫn bất thường (LDL cholesterol ≥ 130 mg/dL [≥ 3,4 mmol/L]) sau 3 đến 6 tháng tuân thủ chế độ ăn CHILD-1, việc hạn chế thêm chất béo bão hòa trong chế độ ăn (< 7% tổng lượng calo) và cholesterol (< 200 mg/ngày), được gọi là CHILD-2 (LDL), được khuyến nghị. Các nghiên cứu lặp đi lặp lại đã chỉ ra rằng việc giảm chất béo bão hòa trong chế độ ăn xuống 7% tổng lượng calo và cholesterol xuống 200 mg/ngày là an toàn và hiệu quả trong việc giảm LDL cholesterol ở trẻ em bị tăng cholesterol máu.
Chế độ ăn ít chất béo nên được thiết kế để đảm bảo đủ dinh dưỡng và việc tham khảo ý kiến của một chuyên gia dinh dưỡng đã đăng ký đặc biệt hữu ích về mặt đó. Trong một số nghiên cứu, lượng canxi, kẽm, vitamin E và phốt pho thấp hơn trong chế độ ăn ít chất béo đã được báo cáo đối với các chế độ ăn được bắt đầu mà không có sự giám sát y tế. Để ngăn chặn việc thực hiện quá mức một chế độ ăn rất ít chất béo cho trẻ em bị rối loạn lipid máu, điều này có thể dẫn đến chậm phát triển, Hội đồng Chuyên gia đã khuyến nghị 25% là giới hạn dưới của phạm vi calo từ chất béo tổng, phù hợp với phạm vi phân bố dinh dưỡng đa lượng được chấp nhận do DGA quy định cho trẻ từ 2 tuổi trở lên. Trong hầu hết các trường hợp, việc tuân thủ chế độ ăn CHILD-2 sẽ bình thường hóa nồng độ LDL cholesterol ở mức ranh giới cao. Phản ứng được báo cáo đối với các chế độ ăn có thành phần chất béo tổng, chất béo bão hòa và cholesterol này ở trẻ em có nồng độ LDL cholesterol trên 130 mg/dL (3,4 mmol/L) dao động từ 3% đến 12%.
Đối với trẻ em trên 2 tuổi, có nồng độ LDL cholesterol cao dai dẳng, có thể sử dụng thêm các biện pháp bổ trợ trong chế độ ăn. Chúng có thể bao gồm bơ thực vật chứa este stanol/sterol thực vật hoặc các chất xơ hòa tan trong nước, chẳng hạn như psyllium. Khoảng ba khẩu phần bơ thực vật chứa stanol hàng ngày (tương đương khoảng 2 g/ngày), được tiêu thụ như một phần của chế độ ăn ít chất béo, có thể giảm LDL cholesterol từ 5% đến 15%. Psyllium với liều lượng 6 g/ngày được thêm vào chế độ ăn ít chất béo có thể giúp giảm thêm 5% đến 10% LDL cholesterol. Mức độ giảm LDL cholesterol có thể phụ thuộc vào lượng ăn trước đó và nồng độ LDL cholesterol ban đầu. Các chất bổ sung trong chế độ ăn sẽ được đề cập chi tiết hơn ở phần sau của chương (xem phần Các chất phụ gia và bổ sung trong chế độ ăn).
Đối với trẻ em có TGs tăng hoặc HDL cholesterol thấp, Hội đồng Chuyên gia đã khuyến nghị tuân theo mô hình ăn uống CHILD-2 (TG), bao gồm giảm lượng đường đơn từ các món tráng miệng, đồ ăn nhẹ đã qua chế biến và đồ uống có đường. Hướng dẫn CHILD-2 (TG) để giảm thiểu đường bổ sung phù hợp với một tuyên bố khoa học gần đây từ AHA dành cho trẻ em không tiêu thụ quá 25 g (100 calo hoặc 6 muỗng cà phê) đường bổ sung mỗi ngày để giảm các yếu tố nguy cơ tim mạch. Thực phẩm có hàm lượng đường đơn cao thường bổ sung thêm calo dư thừa vào chế độ ăn, có thể góp phần gây tăng cân và làm tăng TGs huyết thanh. Quản lý cân nặng nên là một mục tiêu của liệu pháp ăn uống cho trẻ em có chỉ số BMI lớn hơn hoặc bằng phân vị thứ 85. Các phương pháp tiếp cận giảm cân nên tập trung vào việc giảm phân vị cân nặng theo chiều cao của trẻ, đồng thời duy trì sự tăng trưởng theo chiều dài. Mặc dù giảm cân có thể tạm thời làm giảm HDL cholesterol, việc ổn định cân nặng ở một mức thấp hơn mới sẽ dẫn đến sự gia tăng dần dần HDL cholesterol theo thời gian. Dầu cá từ các loại cá béo, chẳng hạn như cá hồi và cá ngừ, chứa các acid béo omega-3, cũng có thể giúp giảm TGs huyết thanh. Nên khuyến khích tăng cường hoạt động thể chất với mục tiêu 1 giờ mỗi ngày hoạt động từ trung bình đến mạnh, và các hoạt động tĩnh tại (chẳng hạn như xem tivi và chơi game trên máy tính và video) nên được giới hạn không quá 2 giờ mỗi ngày.
Đối với trẻ em có TG rất cao, chẳng hạn như những trẻ bị tăng cholesterol máu, chế độ ăn CHILD-2 (TG) và hạn chế chất béo xuống mức thấp nhất là 15% lượng calo hàng ngày có thể hữu ích trong việc giảm TG và tránh viêm tụy. MCT cũng có thể được xem xét như một nguồn calo trong những trường hợp này. MCT bao gồm các acid béo, với chiều dài chuỗi từ 10 đến 12 carbon. MCT được hấp thu hiệu quả, không cần nhũ hóa, và không yêu cầu đóng gói lại thành các chylomicron để vận chuyển; do đó MCT đặc biệt có lợi cho các rối loạn có khiếm khuyết trong quá trình bài tiết mật hoặc các quá trình tập hợp hoặc thanh thải chylomicron.
Quản lý bằng dược lý
Đối với nhiều trẻ em có LDL cholesterol tăng vừa hoặc nặng, thường là do rối loạn lipid máu di truyền, chỉ riêng chế độ ăn sẽ không làm giảm nồng độ cholesterol của chúng xuống mức chấp nhận được hoặc thậm chí là mức ranh giới. Trong những trường hợp này, liệu pháp dùng thuốc hạ lipid sẽ được yêu cầu để đạt được mục tiêu điều trị LDL cholesterol ở trẻ từ 10 tuổi trở lên. Liệu pháp dùng thuốc dài hạn có liên quan đến việc giảm tỷ lệ mắc bệnh tim và tử vong chung ở người lớn. Mặc dù không có nghiên cứu nào chứng minh trực tiếp hiệu quả của việc sử dụng liệu pháp dùng thuốc hạ lipid ở trẻ em để ngăn ngừa CVD, nhưng có bằng chứng từ các nghiên cứu hình ảnh mạch máu cho thấy statin có thể làm chậm quá trình bệnh xơ vữa động mạch.
Hội đồng Chuyên gia đã khuyến nghị sử dụng thuốc ở những bệnh nhân ít nhất 10 tuổi và có nồng độ LDL cholesterol sau chế độ ăn (ví dụ: CHILD-1 → CHILD-2 sau 6 tháng) là 190 mg/dL (≥ 4,9 mmol/L) trở lên hoặc có nồng độ LDL cholesterol là 160 mg/dL (≥ 4,1 mmol/L) trở lên, và có tiền sử gia đình mắc CVD sớm, với ít nhất một yếu tố nguy cơ mức độ cao hoặc ít nhất hai yếu tố nguy cơ mức độ trung bình đối với CVD. Ở trẻ em mắc FH có LDL cholesterol tăng đáng kể, việc quản lý bằng thuốc có thể cần được bắt đầu sớm hơn 10 tuổi. Nên tham khảo ý kiến của một chuyên gia về lipid trong những trường hợp này. Việc đánh giá lại LDL cholesterol được khuyến nghị sau 6 tuần bắt đầu điều trị bằng thuốc và 3 tháng một lần sau đó, cho đến khi đạt được mục tiêu LDL cholesterol. Sau đó, việc theo dõi có thể ít thường xuyên hơn.
Đối với trẻ em nói chung, mục tiêu cho LDL cholesterol là dưới 130 mg/dL (< 3,4 mmol/L). Đối với trẻ em mắc đái tháo đường, mục tiêu cho LDL cholesterol là dưới 100 mg/dL (< 2,6 mmol/L). Mục tiêu LDL cholesterol thấp hơn cho trẻ em mắc đái tháo đường phản ánh sự tổng hợp của các hướng dẫn nhi khoa và các khuyến nghị điều trị cho người lớn mắc đái tháo đường mà hiện nay coi sự hiện diện của đái tháo đường là một yếu tố nguy cơ tương đương với bệnh mạch vành. Bảng 25.5 tóm tắt các khuyến nghị của Hội đồng Chuyên gia về sàng lọc và quản lý lipid ở trẻ em và thanh thiếu niên mắc đái tháo đường. Các loại thuốc được sử dụng trong điều trị các bất thường lipid cụ thể được tóm tắt trong Bảng 25.6 và được xem xét trong phần sau.
Bảng 25.5 Khuyến nghị của Hội đồng Chuyên gia về Hướng dẫn Tích hợp Sức khỏe Tim mạch và Giảm thiểu Nguy cơ ở Trẻ em và Thanh thiếu niên về Quản lý Lipid ở Trẻ em và Thanh thiếu niên mắc Đái tháo đường
| Đái tháo đường Type 1 và Type 2 | |
|---|---|
| Sàng lọc | Sau khi kiểm soát đường huyết > 2 năm lúc chẩn đoán nếu có các yếu tố nguy cơ CVD khác; nếu không thì lúc 10 tuổi; nếu bình thường, sàng lọc lại mỗi 5 năm. Lúc chẩn đoán bất kể tuổi; nếu bình thường, sàng lọc lại mỗi 2 năm. |
| Mục tiêu Lipid | LDL-C ≤ 100 mg/dL (≤ 2,6 mmol/L). Non-HDL-C < 120 mg/dL (< 3,1 mmol/L). Triglyceride < 90 mg/dL (< 1,02 mmol/L). |
| Chiến lược Điều trị | Kiểm soát đường huyết. Chế độ ăn (CHILD-1 → CHILD-2). Hoạt động thể chất. Giảm cân nếu phù hợp. Chỉ định dùng thuốc nếu quản lý ban đầu thất bại: • Tuổi ≥ 10. • Nếu LDL > 160 mg/dL (> 4,1 mmol/L). • Nếu LDL 130–159 mg/dL (3,4–4,1 mmol/L) xem xét dựa trên hồ sơ nguy cơ CVD. • Statin có hoặc không có resin. • Fibrate nếu TG > 1000 mg/dL (> 11,3 mmol/L). • Quản lý các yếu tố nguy cơ CVD khác (xem Hộp 25.2) nếu phù hợp. |
CVD, Bệnh tim mạch; CHILD, Chế độ ăn Lối sống Tích hợp Sức khỏe Tim mạch; HDL, lipoprotein tỷ trọng cao; LDL, lipoprotein tỷ trọng thấp; TG, triglyceride.
Các khuyến nghị được lấy từ Báo cáo tóm tắt của Hội đồng Chuyên gia về Hướng dẫn Tích hợp Sức khỏe Tim mạch và Giảm thiểu Nguy cơ ở Trẻ em và Thanh thiếu niên (2011). Pediatrics, 128, S1–S44.
Bảng 25.6 Các loại thuốc được sử dụng trong điều trị rối loạn lipid máu ở trẻ em
| Nhóm thuốc | Tên thông thường | Cơ chế tác động | Thay đổi Hồ sơ Lipid | Tác dụng phụ |
|---|---|---|---|---|
| Chất gắn acid mật | Cholestyramine, Colestipol, Colesevelam | Gắn với acid mật trong ruột; nhiều cholesterol được chuyển thành acid mật; giảm lượng cholesterol trong gan | ↓︎ LDL, ↑︎ TG | Táo bón, Đau quặn bụng |
| Chất ức chế HMG Co-A reductase | Atorvastatin, Simvastatin, Pravastatin, Rosuvastatin, Lovastatin, Fluvastatin | Ức chế tổng hợp cholesterol trong tế bào gan; giảm lượng cholesterol dẫn đến tăng điều hòa LDLR | ↓︎ LDL, ↓︎ TG, ↑︎ HDL | Khó tiêu, ↑︎ Transaminase gan, ↑︎ CK, Viêm cơ |
| Fibrate ᵃ | Fenofibrate | Tăng cường sự thoái giáng của cholesterol và TG của VLDL; tổng hợp VLDL ở gan có thể giảm. Gemfibrozil | ↓︎ TG, ↑︎ HDL | Táo bón, Viêm cơ, Thiếu máu |
| Niacin ᵃ | Niacin giải phóng kéo dài | Ức chế giải phóng acid béo tự do từ mô mỡ; giảm sản xuất cholesterol VLDL và LDL và thoái giáng cholesterol HDL | ↓︎ LDL, ↓︎ TG, ↑︎ HDL | Đỏ bừng mặt, Đau đầu, ↑︎ Transaminase gan |
| Chất ức chế PCSK9 ᵃ | Alirocumab | Gắn vào miền ngoại bào của thụ thể LDL và nhắm mục tiêu thụ thể để thoái giáng | ↓︎ LDL | Không được báo cáo ở trẻ em hoặc thanh thiếu niên |
| Chất chặn hấp thu cholesterol | Ezetimibe | Ức chế sự hấp thu cholesterol và sterol thực vật ở ruột | ↓︎ LDL | Không được báo cáo ở trẻ em hoặc thanh thiếu niên |
CK, Creatine kinase; HDL, lipoprotein tỷ trọng cao; HMG CoA, hydroxymethylglutaryl CoA; LDL, lipoprotein tỷ trọng thấp; LDLR, thụ thể lipoprotein tỷ trọng thấp; PCSK9, proprotein convertase subtilisin/kexin type 9; TG, triglyceride; VLDL, lipoprotein tỷ trọng rất thấp.
Các chất gắn Acid mật
Các chất gắn acid mật làm giảm cholesterol huyết thanh một cách gián tiếp bằng cách gắn với các acid mật trong đường tiêu hóa. Hành động này ngăn cản sự tái hấp thu của chúng vào tuần hoàn gan ruột, dẫn đến sự mất mát của chúng khỏi cơ thể và loại bỏ khỏi kho cholesterol. Để bù đắp cho sự mất mát này, gan tăng tổng hợp cholesterol nội sinh và tăng cường tổng hợp thụ thể LDL—qua đó làm giảm nồng độ LDL cholesterol trong máu. Trong các thử nghiệm resin gắn acid mật ở trẻ em, liều 8 g/ngày, trong khi đang theo chế độ ăn giảm cholesterol, đã dẫn đến giảm LDL cholesterol từ 10% đến 20%.
Resin gắn acid mật có dạng bột và viên nén. Dạng bột thường được uống hai lần mỗi ngày (muỗng 4g) pha với nước hoặc nước trái cây. Resin ở dạng này có xu hướng có kết cấu sạn và trẻ em phàn nàn rằng chúng khó uống. Viên nén dễ uống hơn nhưng to và khó nuốt đối với một số trẻ. Nhìn chung, các nghiên cứu báo cáo sự tuân thủ kém đến trung bình với thuốc. Các tác dụng phụ rất ít và chủ yếu là về đường tiêu hóa, bao gồm táo bón và đầy hơi. Những tác dụng này có thể được giảm thiểu bằng cách tăng lượng nước và chất xơ. Resin có thể làm tăng nồng độ TG và có thể cản trở sự hấp thu của một số loại thuốc và các vitamin tan trong chất béo. Việc bổ sung một loại vitamin tổng hợp và folate (1 mg mỗi ngày) thường được khuyến nghị.
Các chất ức chế HMG-CoA Reductase
Các chất ức chế HMG-CoA reductase (còn được gọi là statin) làm giảm LDL cholesterol trong máu bằng cách ngăn chặn HMG Co-A reductase ở gan, enzyme giới hạn tốc độ trong sinh tổng hợp cholesterol. Hành động này làm cạn kiệt kho cholesterol nội bào, dẫn đến sự tăng cường biểu hiện của các thụ thể LDL và giảm cholesterol huyết thanh. Liều lượng từ 5 đến 40 mg/ngày ở trẻ em mắc FH đã dẫn đến giảm LDL cholesterol từ 23% đến 40%. Statin có thể được dùng kết hợp với các chất gắn acid mật cho những bệnh nhân không đạt được mục tiêu LDL cholesterol với liệu pháp statin đơn trị. Không có tác dụng phụ nào của các liệu pháp kết hợp được ghi nhận trong một thử nghiệm nhi khoa về các loại thuốc này, và hiệu quả của hai loại thuốc được dùng cùng nhau có tính cộng hưởng.
Các nghiên cứu hình ảnh in vivo đã chứng minh sự cải thiện các dấu ấn thay thế cho xơ vữa động mạch với liệu pháp statin. Sự đảo ngược của rối loạn chức năng nội mô và sự thoái triển của IMT động mạch cảnh đã được báo cáo ở trẻ em được điều trị bằng statin trong khoảng thời gian 2 năm. Phát hiện sau này cho thấy rằng việc bắt đầu sử dụng statin hạ lipid trong thời thơ ấu có thể ức chế sự tiến triển hoặc thậm chí có thể dẫn đến sự thoái triển của xơ vữa động mạch.
Các tác dụng phụ của thuốc rất ít nhưng đã bao gồm các than phiền về đường tiêu hóa, tăng transaminase gan và nồng độ creatine kinase (CK), và viêm cơ. Vì lý do này, statin sẽ không được khuyến nghị cho bệnh nhân mắc bệnh gan. Theo dõi bệnh nhân được điều trị bằng statin nên bao gồm đánh giá xét nghiệm về transaminase gan và nồng độ CK, và xác định các triệu chứng thực thể bất lợi, chẳng hạn như chuột rút cơ bắp.
Vì statin có khả năng gây quái thai, điều cần thiết là các bác sĩ phải xác định rằng các bé gái vị thành niên không mang thai hoặc có khả năng mang thai trước khi bắt đầu điều trị. Các thử nghiệm statin dài nhất đã kéo dài 2 năm. Do đó, liệu statin có ảnh hưởng xấu đến sự tăng trưởng và phát triển lâu dài và có an toàn để sử dụng suốt đời hay không vẫn chưa được xác định. Cần có các nghiên cứu về an toàn và hiệu quả dài hạn hơn, đặc biệt là với việc theo dõi các điểm cuối mạch máu.
Các chất ức chế hấp thu Cholesterol
Ezetimibe là một tác nhân hạ cholesterol ngăn cản sự hấp thu cholesterol và sterol thực vật bằng cách ức chế sự đi qua của các sterol qua thành ruột. Việc giảm hấp thu cholesterol dẫn đến giảm sự hấp thu và sẵn có của cholesterol ở gan. Kết quả là, có sự gia tăng bù trừ trong sinh tổng hợp cholesterol ở gan, sự tăng cường biểu hiện của thụ thể LDL, và sự giảm tổng thể nồng độ LDL cholesterol trong máu. Ở trẻ em và thanh thiếu niên, liều lượng hàng ngày 10 mg/ngày đã làm giảm LDL cholesterol khoảng 20%. Kusters và cộng sự đã nghiên cứu sự an toàn và hiệu quả của ezetimibe ở trẻ em từ 6 đến 10 tuổi. Họ phát hiện ra rằng sau 12 tuần điều trị, LDL-C đã giảm 27% và non-HDL-C đã giảm 26%. Ezetimibe được dung nạp tốt với ít tác dụng phụ. Họ kết luận rằng ezetimibe có thể được sử dụng như một liệu pháp đơn trị để giảm LDL-C ở một số trẻ em. Ezetimibe được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) chấp thuận để sử dụng cho những người từ 10 tuổi trở lên.
Các chất ức chế Proprotein Convertase Subtilisin/Kexin Type 9
Vào đầu những năm 2000, người ta phát hiện ra rằng sự tăng chức năng của gen PCSK9 dẫn đến tăng cholesterol máu di truyền trội trên nhiễm sắc thể thường. PCSK9 gắn vào miền ngoại bào của thụ thể LDL và nhắm mục tiêu thụ thể để thoái giáng. Các đột biến mất chức năng dẫn đến LDL-C lưu hành rất thấp và cũng có nguy cơ CVD rất thấp. Những phát hiện này đã dẫn đến sự phát triển của các tác nhân ức chế PCSK9 và làm giảm LDL-C lưu hành. Các tác nhân này sử dụng các kháng thể đơn dòng, là các phân nhóm immunoglobulin G hoàn toàn của người, gắn với tỷ lệ phân tử lượng xấp xỉ 1:1 với PCSK9 lưu hành, điều này ngăn cản sự gắn kết của nó với thụ thể LDL. Điều này dẫn đến sự tích tụ các thụ thể LDL trên màng tế bào gan. Điều này làm tăng thanh thải các hạt LDL và giảm nồng độ LDL-C trong huyết tương.
Các chất ức chế PCSK9 đã được nghiên cứu ở các quần thể người lớn, đặc biệt là những người có tiền sử CVD. Chúng dẫn đến giảm LDL-C từ 55% đến 72%, dẫn đến nồng độ LDL-C trong huyết tương rất thấp. Sự giảm LDL-C này có liên quan đến việc giảm tỷ lệ mắc bệnh tim mạch do xơ vữa.
Các chất ức chế PCSK9 chưa được nghiên cứu rộng rãi ở trẻ em và thanh thiếu niên. Chúng yêu cầu tiêm, điều này có thể cản trở việc sử dụng chúng ở bệnh nhân nhi. Các tác nhân này cũng tốn kém và việc được các nhà cung cấp bảo hiểm chấp thuận đã được chứng minh là khó khăn ở bệnh nhân người lớn. Tuy nhiên, đối với những bệnh nhân bị rối loạn lipid máu di truyền và tăng LDL-C rõ rệt, những người có thể cần điều trị tích cực hơn bằng phương pháp lọc LDL, các chất ức chế PCSK9 có thể tỏ ra có giá trị. Các nghiên cứu nhi khoa với các chất ức chế PCSK9 đang được tiến hành, nhưng dữ liệu về hiệu quả và an toàn lâu dài sẽ mất một thời gian để thu thập.
Các dẫn xuất của Acid Fibric
Các dẫn xuất của acid fibric (còn được gọi là fibrate) làm giảm nồng độ TG trong máu bằng cách tăng cường sự thoái giáng và giảm sản xuất VLDL ở gan. Thuốc cũng làm tăng sản xuất apoA-I, dẫn đến nồng độ HDL cholesterol cao hơn. Các tác dụng phụ tương tự như của statin và bao gồm các than phiền về đường tiêu hóa, tăng hoạt tính transaminase gan và bệnh cơ. Vì lý do này, fibrate không được khuyến nghị sử dụng cùng với statin. Các loại thuốc này không được FDA chấp thuận để sử dụng cho trẻ em và thanh thiếu niên và chỉ nên được sử dụng khi có sự tư vấn của một chuyên gia về lipid cho thanh thiếu niên bị tăng triglyceride máu di truyền.
Niacin
Niacin làm giảm sản xuất VLDL ở gan, dẫn đến giảm sản xuất LDL cholesterol. Trẻ em mắc FH dị hợp tử được điều trị với 1000 đến 2250 mg niacin mỗi ngày, trong trung bình 8 tháng, cho thấy giảm LDL cholesterol từ 23% đến 30%. Tuy nhiên, 76% trẻ em có tác dụng phụ từ liệu pháp (ví dụ: đỏ bừng mặt, đau đầu, buồn nôn, không dung nạp glucose, bệnh cơ, chức năng gan bất thường) và 38% đã ngừng thuốc. Niacin không được khuyến nghị cho trẻ em dưới 2 tuổi và thường không được sử dụng để điều trị cho trẻ em mắc FH, trừ khi LDL cholesterol tăng dai dẳng hoặc có tình trạng tăng triglyceride máu bất thường và HDL cholesterol thấp. Niacin được dùng kết hợp với statin đã được sử dụng để điều trị FH đồng hợp tử. Niacin có sẵn ở dạng giải phóng tức thì và giải phóng chậm (Niaspan, Slo-Niacin).
Các chất phụ gia và bổ sung trong chế độ ăn
Sterol và stanol thực vật được tiêu thụ ở mức 2 g mỗi ngày đã được chứng minh là làm giảm nồng độ LDL cholesterol từ 9% đến 20% ở người lớn. Thực phẩm chứa các chất phụ gia này (ví dụ: bơ thực vật và nước sốt salad) làm giảm cholesterol huyết thanh bằng cách ngăn cản sự hấp thu cholesterol trong chế độ ăn ở đường tiêu hóa. Ở trẻ em mắc FH, việc sử dụng 2 g/ngày sterol thực vật đã làm giảm LDL cholesterol từ 5% đến 15%, nhưng không cải thiện chức năng nội mô. Điều này cho thấy rằng LDL cholesterol phải được giảm xuống một mức ngưỡng nhất định trước khi sự cải thiện chức năng nội mô có thể xảy ra.
Cần có thêm các nghiên cứu kiểm tra tác động lâu dài của sterol thực vật đối với nội mô mạch máu. Đã có những lo ngại về khả năng kém hấp thu chất béo và các vitamin tan trong chất béo ở trẻ em tiêu thụ sterol thực vật một cách mạn tính. Hội đồng Chuyên gia khuyến nghị dành việc sử dụng các loại thực phẩm được bổ sung sterol/stanol thực vật cho trẻ em bị tăng cholesterol từ trung bình đến nặng, và theo dõi tình trạng vitamin tan trong chất béo.
Các chất bổ sung trong chế độ ăn chứa chất xơ hòa tan, tỏi và dầu cá đã được sử dụng để điều trị rối loạn lipid máu ở trẻ em với hiệu quả từ hạn chế đến trung bình. Trong một thử nghiệm đối chứng ngẫu nhiên, Davidson và các đồng nghiệp đã nghiên cứu tác động của chất xơ psyllium so với giả dược đối với sự thay đổi nồng độ cholesterol trong máu của trẻ em từ 6 đến 18 tuổi bị tăng cholesterol máu. Chất xơ psyllium (6 g/ngày) và giả dược được thêm vào một loại ngũ cốc ăn liền. Sự tuân thủ điều trị là tuyệt vời; việc tiêu thụ ngũ cốc được làm giàu đã dẫn đến giảm khiêm tốn 7% nồng độ LDL cholesterol so với ngũ cốc đối chứng.
Liệu pháp chiết xuất tỏi đã được nghiên cứu trong một thử nghiệm đối chứng ngẫu nhiên về tác động đối với các lipoprotein huyết thanh ở trẻ em từ 8 đến 18 tuổi mắc FH. Chiết xuất được cho dùng ba liều 300 mg mỗi ngày so với giả dược trong 8 tuần. Không có tác động đáng kể nào của việc điều trị bằng tỏi so với giả dược được ghi nhận đối với cholesterol toàn phần, LDL hoặc HDL.
Gạo men đỏ, một sản phẩm ẩm thực truyền thống của Trung Quốc, đã được tiếp thị để giảm cholesterol trong máu. Mặc dù một thử nghiệm nhi khoa đã cho thấy sự giảm LDL-C đáng kể với sản phẩm này, gạo men đỏ chứa monacolin K, có cấu trúc hóa học giống hệt với thuốc hạ cholesterol lovastatin. Do đó, các sản phẩm gạo men đỏ có thể không an toàn và không được khuyến nghị cho trẻ em.
Các acid béo omega-3, như được tìm thấy trong dầu cá, được biết là làm giảm nồng độ TG huyết thanh ở người lớn. Trong một nghiên cứu chéo ngẫu nhiên, trẻ em mắc FH và FCHL được bổ sung 1,2 g/ngày acid docosahexaenoic (DHA) hoặc giả dược trong 6 tuần. Tất cả trẻ em đều được tư vấn về chế độ ăn để giảm lượng chất béo bão hòa xuống dưới 7% lượng calo. Các kết quả được nghiên cứu bao gồm TGs, LDL và HDL cholesterol, và chức năng nội mô, được đo bằng FMD của động mạch cánh tay. Các phát hiện cho thấy rằng việc bổ sung DHA có liên quan đến việc tăng nồng độ cholesterol toàn phần, LDL và HDL, nhưng không có sự thay đổi về TGs so với nhóm dùng giả dược. FMD cải thiện đáng kể sau khi bổ sung DHA so với ban đầu ở cả hai nhóm, và sự thay đổi lớn hơn ở nhóm được điều trị bằng DHA so với nhóm đối chứng. Phát hiện này cho thấy rằng ở trẻ em, DHA có thể không hiệu quả trong việc điều chỉnh tích cực lipid huyết thanh. Tuy nhiên, nội mô có thể là một mục tiêu điều trị cho DHA ở trẻ em bị tăng lipid máu.
Lọc Lipoprotein tỷ trọng thấp
Đối với trẻ em mắc FH đồng hợp tử và LDL cholesterol tăng cực cao (> 500 mg/dL [> 12,9 mmol/L]), nơi LDL cholesterol không thể giảm thông qua sự kết hợp của liệu pháp ăn uống và quản lý bằng nhiều loại thuốc, việc lọc LDL hai tuần một lần đã được sử dụng thành công để đạt được sự giảm lipid đáng kể, dưới sự chăm sóc của một chuyên gia về lipid. Trong quá trình này, các hạt chứa apoB được loại bỏ một cách chọn lọc khỏi tuần hoàn thông qua sự kết tủa ngoài cơ thể. Lọc máu đã làm giảm nồng độ LDL tới 72% so với liệu pháp dùng thuốc tối đa ở bệnh nhân mắc FH đồng hợp tử. Thủ thuật này đã được FDA chấp thuận, và các cơ sở y tế đủ điều kiện thực hiện thủ thuật này được liệt kê trên trang web của Hiệp hội Lipid Quốc gia.
Kết luận và định hướng tương lai
Ngày càng có nhiều bằng chứng cho thấy sự gia tăng cực độ của LDL cholesterol có liên quan đến bệnh lý mạch máu ở thanh thiếu niên. Với các khuyến nghị mới về sàng lọc toàn dân cho bệnh nhân nhi từ Hội đồng Chuyên gia NHLBI, nhiều bệnh nhân bị tăng cholesterol máu đáng kể có khả năng được xác định hơn. May mắn thay, có sẵn liệu pháp thích hợp để điều chỉnh và có khả năng đảo ngược các bất thường mạch máu. Các thử nghiệm lâm sàng nhi khoa về lối sống và liệu pháp dùng thuốc để điều trị rối loạn lipid máu cho thấy hiệu quả và độ an toàn tương tự như quan sát thấy ở người lớn. Tuy nhiên, hầu hết các nghiên cứu đều có thiết kế ngắn hạn hoặc trung hạn. Cần có các nghiên cứu về an toàn và hiệu quả dài hạn hơn, đặc biệt là với việc theo dõi các điểm cuối mạch máu. Cũng có ít dữ liệu lâm sàng có sẵn để ghi nhận ở độ tuổi nào liệu pháp dùng thuốc nên được bắt đầu một cách phù hợp và an toàn. Cần có thêm nhiều công trình nghiên cứu về vấn đề này để hỗ trợ các phán đoán lâm sàng về độ tuổi và liều lượng nên được sử dụng ở trẻ em có nguy cơ cao bị ASCVD.
Bảng Chú giải Thuật ngữ Y học Anh-Việt – Chương 25
| STT | Thuật ngữ tiếng Anh | Phiên âm IPA | Nghĩa Tiếng Việt |
|---|---|---|---|
| 1 | Lipid Disorders | /ˈlɪpɪd dɪsˈɔːrdərz/ | Rối Loạn Lipid |
| 2 | Atherosclerotic cardiovascular disease (ASCVD) | /ˌæθəroʊskləˈrɒtɪk ˌkɑːrdioʊˈvæskjələr dɪˈziːz/ | Bệnh tim mạch do xơ vữa |
| 3 | Morbidity | /mɔːrˈbɪdɪti/ | Bệnh suất (Tỷ lệ mắc bệnh) |
| 4 | Mortality | /mɔːrˈtæləti/ | Tử suất (Tỷ lệ tử vong) |
| 5 | Dyslipidemia | /ˌdɪslɪpɪˈdiːmiə/ | Rối loạn lipid máu |
| 6 | low-density lipoprotein (LDL) | /ˌloʊˈdɛnsɪti ˌlaɪpoʊˈproʊtiːn/ | Lipoprotein tỷ trọng thấp |
| 7 | high-density lipoprotein (HDL) | /ˌhaɪˈdɛnsɪti ˌlaɪpoʊˈproʊtiːn/ | Lipoprotein tỷ trọng cao |
| 8 | non-HDL cholesterol | /nɒn-ˌeɪtʃdiːˈɛl kəˈlɛstərɒl/ | Non-HDL cholesterol |
| 9 | triglycerides (TGs) | /traɪˈɡlɪsəraɪdz/ | Triglyceride |
| 10 | risk factor | /rɪsk ˈfæktər/ | Yếu tố nguy cơ |
| 11 | lipoprotein | /ˌlaɪpoʊˈproʊtiːn/ | Lipoprotein |
| 12 | atherosclerosis | /ˌæθəroʊskləˈroʊsɪs/ | Xơ vữa động mạch |
| 13 | Metabolism | /məˈtæbəlɪzəm/ | Chuyển hóa |
| 14 | degradation | /ˌdɛɡrəˈdeɪʃən/ | Sự thoái giáng |
| 15 | apolipoproteins | /ˌæpoʊˌlaɪpoʊˈproʊtiːnz/ | Apolipoprotein |
| 16 | Chylomicrons | /ˌkaɪloʊˈmaɪkrɒnz/ | Chylomicron |
| 17 | very low-density lipoprotein (VLDL) | /ˈvɛri ˌloʊˈdɛnsɪti ˌlaɪpoʊˈproʊtiːn/ | Lipoprotein tỷ trọng rất thấp |
| 18 | intermediate-density lipoprotein (IDL) | /ˌɪntərˈmiːdiətˈdɛnsɪti ˌlaɪpoʊˈproʊtiːn/ | Lipoprotein tỷ trọng trung gian |
| 19 | cholesterol esters | /kəˈlɛstərɒl ˈɛstərz/ | Este cholesterol |
| 20 | phospholipids | /ˌfɒsfoʊˈlɪpɪdz/ | Phospholipid |
| 21 | plant sterols | /plænt ˈstɛrɒlz/ | Sterol thực vật |
| 22 | fatty acids | /ˈfæti ˈæsɪdz/ | Acid béo |
| 23 | 2-monoglycerides | /tuː ˌmɒnoʊˈɡlɪsəraɪdz/ | 2-monoglyceride |
| 24 | lysophospholipids | /ˌlaɪsoʊˌfɒsfoʊˈlɪpɪdz/ | Lysophospholipid |
| 25 | unesterified cholesterol | /ʌnɛˈstɛrɪfaɪd kəˈlɛstərɒl/ | Cholesterol không este hóa |
| 26 | passive diffusion | /ˈpæsɪv dɪˈfjuːʒən/ | Khuếch tán thụ động |
| 27 | carrier-mediated transport | /ˈkæriər ˈmiːdiˌeɪtɪd ˈtrænspɔːrt/ | Vận chuyển qua trung gian chất mang |
| 28 | bile acids | /baɪl ˈæsɪdz/ | Acid mật |
| 29 | mixed micelles | /mɪkst maɪˈsɛlz/ | Hạt mixen hỗn hợp |
| 30 | enteric membrane | /ɛnˈtɛrɪk ˈmɛmbreɪn/ | Màng tế bào ruột |
| 31 | translocase | /trænzˈloʊkeɪs/ | Translocase |
| 32 | Niemann-Pick C1-like 1 protein (NPC1L1) | /ˈniːmən pɪk siː wʌn laɪk wʌn ˈproʊtiːn/ | Protein Niemann-Pick C1-like 1 |
| 33 | scavenger receptor | /ˈskævɪndʒər rɪˈsɛptər/ | Thụ thể scavenger |
| 34 | adenosine triphosphate (ATP) | /əˈdɛnəˌsiːn traɪˈfɒsfeɪt/ | Adenosine triphosphate |
| 35 | ATP-binding cassette (ABC) | /ˌeɪtiːˈpiː ˈbaɪndɪŋ kæˈsɛt/ | Cassette gắn ATP |
| 36 | sitosterolemia | /ˌsaɪtoʊstəroʊˈliːmiə/ | Bệnh sitosterol máu |
| 37 | acyl-CoA cholesterol acyl transferase (ACAT) | /ˈeɪsɪl koʊˈeɪ kəˈlɛstərɒl ˈeɪsɪl ˈtrænsfəreɪs/ | Acyl-CoA cholesterol acyl transferase |
| 38 | chaperone protein | /ˈʃæpəroʊn ˈproʊtiːn/ | Protein chaperone |
| 39 | microsomal triglyceride transfer protein (MTTP) | /ˌmaɪkrəˈsoʊməl traɪˈɡlɪsəraɪd ˈtrænsfər ˈproʊtiːn/ | Protein chuyển triglyceride ở microsome |
| 40 | endoplasmic reticulum (ER) | /ˌɛndoʊˈplæzmɪk rɪˈtɪkjələm/ | Lưới nội chất |
| 41 | abetalipoproteinemia | /əˌbeɪtəˌlaɪpoʊˌproʊtiːˈniːmiə/ | Bệnh abetalipoprotein máu |
| 42 | biogenesis | /ˌbaɪoʊˈdʒɛnɪsɪs/ | Sinh tổng hợp |
| 43 | homozygous | /ˌhoʊmoʊˈzaɪɡəs/ | Đồng hợp tử |
| 44 | familial hypercholesterolemia | /fəˈmɪliəl ˌhaɪpərkəˌlɛstərəˈliːmiə/ | Tăng cholesterol máu gia đình |
| 45 | capillary membrane | /ˈkæpɪlɛri ˈmɛmbreɪn/ | Màng mao mạch |
| 46 | lymphatic system | /lɪmˈfætɪk ˈsɪstəm/ | Hệ bạch huyết |
| 47 | venous plasma compartment | /ˈviːnəs ˈplæzmə kəmˈpɑːrtmənt/ | Khoang huyết tương tĩnh mạch |
| 48 | thoracic lymph duct | /θɔːˈræsɪk lɪmf dʌkt/ | Ống bạch huyết ngực |
| 49 | TG hydrolase | /ˌtiːˈdʒiː ˈhaɪdrəleɪs/ | Hydrolase TG |
| 50 | capillary endothelium | /ˈkæpɪlɛri ˌɛndoʊˈθiːliəm/ | Nội mô mao mạch |
| 51 | muscle tissues | /ˈmʌsəl ˈtɪʃuːz/ | Mô cơ |
| 52 | adipose tissues | /ˈædɪpoʊs ˈtɪʃuːz/ | Mô mỡ |
| 53 | Glycosylphosphatidylinositol-anchored protein | /ˌɡlaɪkoʊsɪlˌfɒsfəˌtaɪdəlɪˈnɒsɪtɒl ˈæŋkərd ˈproʊtiːn/ | Protein được neo bởi Glycosylphosphatidylinositol |
| 54 | hypertriglyceridemia | /ˌhaɪpərˌtraɪɡlɪsərɪˈdiːmiə/ | Tăng triglyceride máu |
| 55 | chylomicron remnants | /ˌkaɪloʊˈmaɪkrɒn ˈrɛmnənts/ | Tàn dư chylomicron |
| 56 | LDL receptor (LDLR) | /ˌɛlˌdiːˈɛl rɪˈsɛptər/ | Thụ thể LDL |
| 57 | LDLR-related protein-1 (LRP1) | /ˌɛlˌdiːˌɛlɑːr rɪˈleɪtɪd ˈproʊtiːn wʌn/ | Protein-1 liên quan đến LDLR |
| 58 | endocytosis | /ˌɛndoʊsaɪˈtoʊsɪs/ | Quá trình nội bào |
| 59 | hepatocyte | /hɪˈpætoʊsaɪt/ | Tế bào gan |
| 60 | hepatic TG lipase (HL) | /hɪˈpætɪk ˌtiːˈdʒiː ˈlaɪpeɪs/ | Lipase triglyceride gan |
| 61 | clathrin-coated pits | /ˈklæθrɪn ˈkoʊtɪd pɪts/ | Túi lõm được bao bọc bởi clathrin |
| 62 | endosome | /ˈɛndoʊsoʊm/ | Túi nội bào |
| 63 | ATP-dependent proton pump | /ˌeɪtiːˈpiː dɪˈpɛndənt ˈproʊtɒn pʌmp/ | Bơm proton phụ thuộc ATP |
| 64 | lysosome | /ˈlaɪsoʊsoʊm/ | Lysosome |
| 65 | hydrolytic enzymes | /ˌhaɪdrəˈlɪtɪk ˈɛnzaɪmz/ | Enzyme thủy phân |
| 66 | free amino acids | /friː əˈmiːnoʊ ˈæsɪdz/ | Acid amin tự do |
| 67 | sterol receptor binding proteins (SREBPs) | /ˈstɛrɒl rɪˈsɛptər ˈbaɪndɪŋ ˈproʊtiːnz/ | Protein gắn thụ thể sterol |
| 68 | Golgi | /ˈɡoʊldʒi/ | Bộ máy Golgi |
| 69 | proteases | /ˈproʊtiːeɪsɪz/ | Protease |
| 70 | transcription factors | /trænˈskrɪpʃən ˈfæktərz/ | Yếu tố phiên mã |
| 71 | hydroxymethylglutaryl (HMG) CoA reductase | /haɪˌdrɒksiˌmɛθɪlˈɡluːtərɪl koʊˈeɪ rɪˈdʌkteɪs/ | HMG-CoA reductase |
| 72 | cholesterol biosynthesis | /kəˈlɛstərɒl ˌbaɪoʊˈsɪnθəsɪs/ | Sinh tổng hợp cholesterol |
| 73 | macrophages | /ˈmækroʊfeɪdʒɪz/ | Đại thực bào |
| 74 | subendothelium | /ˌsʌbˌɛndoʊˈθiːliəm/ | Lớp dưới nội mạc |
| 75 | atherosclerotic lesions | /ˌæθəroʊskləˈrɒtɪk ˈliːʒənz/ | Tổn thương xơ vữa động mạch |
| 76 | atheroma | /ˌæθəˈroʊmə/ | Mảng xơ vữa |
| 77 | pre-beta HDL | /priːˈbeɪtə ˌeɪtʃdiːˈɛl/ | Pre-beta HDL |
| 78 | Tangier disease | /tænˈdʒɪər dɪˈziːz/ | Bệnh Tangier |
| 79 | lecithin cholesterol acyl transferase (LCAT) | /ˈlɛsɪθɪn kəˈlɛstərɒl ˈeɪsɪl ˈtrænsfəreɪs/ | Lecithin cholesterol acyl transferase |
| 80 | cholesterol ester transfer protein (CETP) | /kəˈlɛstərɒl ˈɛstər ˈtrænsfər ˈproʊtiːn/ | Protein vận chuyển este cholesterol |
| 81 | reverse cholesterol transport | /rɪˈvɜːrs kəˈlɛstərɒl ˈtrænspɔːrt/ | Vận chuyển ngược cholesterol |
| 82 | Primary dyslipidemias | /ˈpraɪməri ˌdɪslɪpɪˈdiːmiəz/ | Rối loạn lipid máu nguyên phát |
| 83 | autosomal-dominant | /ˌɔːtəˈsoʊməl ˈdɒmɪnənt/ | Trội trên nhiễm sắc thể thường |
| 84 | heterozygous | /ˌhɛtəroʊˈzaɪɡəs/ | Dị hợp tử |
| 85 | xanthomas | /zænˈθoʊməz/ | U vàng |
| 86 | xanthelasmas | /ˌzænθəˈlæzməz/ | Ban vàng |
| 87 | myocardial infarction | /ˌmaɪəˈkɑːrdiəl ɪnˈfɑːrkʃən/ | Nhồi máu cơ tim |
| 88 | Autosomal-dominant hypercholesterolemia (ADH) | /ˌɔːtəˈsoʊməl ˈdɒmɪnənt ˌhaɪpərkəˌlɛstərəˈliːmiə/ | Tăng cholesterol máu di truyền trội trên NST thường |
| 89 | serine protease | /ˈsɛriːn ˈproʊtiːeɪs/ | Serine protease |
| 90 | proprotein convertase subtilisin/kexin type 9 (PCSK9) | /proʊˈproʊtiːn kənˈvɜːrteɪs səbˈtɪlɪsɪn ˈkɛksɪn taɪp naɪn/ | Proprotein convertase subtilisin/kexin type 9 |
| 91 | Autosomal recessive hypercholesterolemia (ARH) | /ˌɔːtəˈsoʊməl rɪˈsɛsɪv ˌhaɪpərkəˌlɛstərəˈliːmiə/ | Tăng cholesterol máu di truyền lặn trên NST thường |
| 92 | Familial ligand-defective apoB-100 (FDB) | /fəˈmɪliəl ˈlaɪɡænd dɪˈfɛktɪv ˌeɪpoʊˌbiː wʌn ˈhʌndrəd/ | Bệnh apoB-100 khiếm khuyết ligand có tính gia đình |
| 93 | monogenic disorder | /ˌmɒnoʊˈdʒɛnɪk dɪsˈɔːrdər/ | Rối loạn đơn gen |
| 94 | phytosterols | /ˌfaɪtoʊˈstɛrɒlz/ | Phytosterol |
| 95 | aortic stenosis | /eɪˈɔːrtɪk stəˈnoʊsɪs/ | Hẹp van động mạch chủ |
| 96 | Familial combined hyperlipidemia (FCHL) | /fəˈmɪliəl kəmˈbaɪnd ˌhaɪpərlɪpɪˈdiːmiə/ | Tăng lipid máu hỗn hợp gia đình |
| 97 | combined dyslipidemia (CD) | /kəmˈbaɪnd ˌdɪslɪpɪˈdiːmiə/ | Rối loạn lipid máu hỗn hợp |
| 98 | insulin resistance | /ˈɪnsəlɪn rɪˈzɪstəns/ | Kháng insulin |
| 99 | central obesity | /ˈsɛntrəl oʊˈbiːsəti/ | Béo phì trung tâm |
| 100 | hypertension | /ˌhaɪpərˈtɛnʃən/ | Tăng huyết áp |
| 101 | hyperapobeta-lipoproteinemia | /ˌhaɪpərˌeɪpoʊˌbeɪtəˌlaɪpoʊˌproʊtiːˈniːmiə/ | Tăng apobeta-lipoprotein máu |
| 102 | metabolic syndrome | /ˌmɛtəˈbɒlɪk ˈsɪndroʊm/ | Hội chứng chuyển hóa |
| 103 | Familial hypertriglyceridemia (FHTG) | /fəˈmɪliəl ˌhaɪpərˌtraɪɡlɪsərɪˈdiːmiə/ | Tăng triglyceride máu gia đình |
| 104 | glucose intolerance | /ˈɡluːkoʊs ɪnˈtɒlərəns/ | Không dung nạp glucose |
| 105 | Familial chylomicronemia syndrome | /fəˈmɪliəl ˌkaɪloʊˌmaɪkrəˈniːmiə ˈsɪndroʊm/ | Hội chứng chylomicron máu gia đình |
| 106 | pancreatitis | /ˌpæŋkriəˈtaɪtɪs/ | Viêm tụy |
| 107 | hepatosplenomegaly | /hɪˌpætoʊˌspliːnoʊˈmɛɡəli/ | Gan lách to |
| 108 | eruptive xanthomas | /ɪˈrʌptɪv zænˈθoʊməz/ | U vàng phát ban |
| 109 | neurologic symptoms | /ˌnʊrəˈlɒdʒɪk ˈsɪmptəmz/ | Triệu chứng thần kinh |
| 110 | Hypolipidemias | /ˌhaɪpoʊˌlɪpɪˈdiːmiəz/ | Giảm lipid máu |
| 111 | familial hypoalphalipoproteinemia | /fəˈmɪliəl ˌhaɪpoʊˌælfəˌlaɪpoʊˌproʊtiːˈniːmiə/ | Giảm alpha-lipoprotein máu gia đình |
| 112 | autosomal recessive | /ˌɔːtəˈsoʊməl rɪˈsɛsɪv/ | Lặn trên nhiễm sắc thể thường |
| 113 | steatorrhea | /ˌstiːətəˈriːə/ | Tiêu chảy phân mỡ |
| 114 | fatty liver | /ˈfæti ˈlɪvər/ | Gan nhiễm mỡ |
| 115 | ataxia | /əˈtæksiə/ | Thất điều |
| 116 | acanthocytosis | /əˌkænθoʊsaɪˈtoʊsɪs/ | Hồng cầu gai |
| 117 | retinitis pigmentosa | /ˌrɛtɪˈnaɪtɪs ˌpɪɡmɛnˈtoʊsə/ | Viêm võng mạc sắc tố |
| 118 | fat malabsorption | /fæt ˌmæləbˈsɔːrpʃən/ | Kém hấp thu chất béo |
| 119 | fat-soluble vitamin | /ˈfætˌsɒljəbəl ˈvaɪtəmɪn/ | Vitamin tan trong chất béo |
| 120 | Medium-chain triglycerides (MCT) | /ˈmiːdiəm tʃeɪn traɪˈɡlɪsəraɪdz/ | Triglyceride chuỗi trung bình |
| 121 | Hypobetalipoproteinemia | /ˌhaɪpoʊˌbeɪtəˌlaɪpoʊˌproʊtiːˈniːmiə/ | Bệnh giảm betalipoprotein máu |
| 122 | hypocholesterolemia | /ˌhaɪpoʊkəˌlɛstərəˈliːmiə/ | Giảm cholesterol máu |
| 123 | peripheral neuropathy | /pəˈrɪfərəl nʊˈrɒpəθi/ | Bệnh thần kinh ngoại biên |
| 124 | Dysbetalipoproteinemia | /ˌdɪsˌbeɪtəˌlaɪpoʊˌproʊtiːˈniːmiə/ | Bệnh dysbetalipoprotein máu |
| 125 | polymorphism | /ˌpɒliˈmɔːrfɪzəm/ | Tính đa hình |
| 126 | Secondary dyslipidemias | /ˈsɛkənˌdɛri ˌdɪslɪpɪˈdiːmiəz/ | Rối loạn lipid máu thứ phát |
| 127 | Hypothyroidism | /ˌhaɪpoʊˈθaɪrɔɪdɪzəm/ | Suy giáp |
| 128 | Diabetes | /ˌdaɪəˈbiːtiːz/ | Đái tháo đường |
| 129 | Pregnancy | /ˈprɛɡnənsi/ | Thai kỳ |
| 130 | Nephrotic syndrome | /nəˈfrɒtɪk ˈsɪndroʊm/ | Hội chứng thận hư |
| 131 | Chronic renal failure | /ˈkrɒnɪk ˈriːnəl ˈfeɪljər/ | Suy thận mạn |
| 132 | Cholestasis | /ˌkoʊlɪˈsteɪsɪs/ | Ứ mật |
| 133 | Biliary atresia | /ˈbɪliɛri əˈtriːʒə/ | Teo đường mật |
| 134 | Hepatitis | /ˌhɛpəˈtaɪtɪs/ | Viêm gan |
| 135 | Biliary cirrhosis | /ˈbɪliɛri sɪˈroʊsɪs/ | Xơ gan mật |
| 136 | Human immunodeficiency virus (HIV) | /ˈhjuːmən ˌɪmjʊnoʊdɪˈfɪʃənsi ˈvaɪrəs/ | Virus suy giảm miễn dịch ở người |
| 137 | acquired immunodeficiency syndrome (AIDS) | /əˈkwaɪərd ˌɪmjʊnoʊdɪˈfɪʃənsi ˈsɪndroʊm/ | Hội chứng suy giảm miễn dịch mắc phải |
| 138 | overweight | /ˌoʊvərˈweɪt/ | Thừa cân |
| 139 | obesity | /oʊˈbiːsəti/ | Béo phì |
| 140 | central adiposity | /ˈsɛntrəl ˌædɪˈpɒsəti/ | Béo phì trung tâm |
| 141 | blood pressure | /blʌd ˈprɛʃər/ | Huyết áp |
| 142 | type 1 diabetes | /taɪp wʌn ˌdaɪəˈbiːtiːz/ | Đái tháo đường type 1 |
| 143 | type 2 diabetes | /taɪp tuː ˌdaɪəˈbiːtiːz/ | Đái tháo đường type 2 |
| 144 | glycemic | /ɡlaɪˈsiːmɪk/ | Đường huyết |
| 145 | vascular dysfunction | /ˈvæskjələr dɪsˈfʌŋkʃən/ | Rối loạn chức năng mạch máu |
| 146 | progestins | /proʊˈdʒɛstɪnz/ | Progestin |
| 147 | estrogens | /ˈɛstrədʒənz/ | Estrogen |
| 148 | androgens | /ˈændrədʒənz/ | Androgen |
| 149 | anabolic steroids | /ˌænəˈbɒlɪk ˈstɛrɔɪdz/ | Steroid đồng hóa |
| 150 | corticosteroids | /ˌkɔːrtɪkoʊˈstɛrɔɪdz/ | Corticosteroid |
| 151 | cyclosporine | /ˌsaɪkloʊˈspɔːriːn/ | Cyclosporine |
| 152 | retinoids | /ˈrɛtɪnɔɪdz/ | Retinoid |
| 153 | intima | /ˈɪntɪmə/ | Lớp nội mạc |
| 154 | arterial wall | /ɑːrˈtɪəriəl wɔːl/ | Thành động mạch |
| 155 | fatty streaks | /ˈfæti striːks/ | Vệt mỡ |
| 156 | foam cells | /foʊm sɛlz/ | Tế bào bọt |
| 157 | extracellular lipid | /ˌɛkstrəˈsɛljələr ˈlɪpɪd/ | Lipid ngoại bào |
| 158 | smooth muscle cells | /smuːð ˈmʌsəl sɛlz/ | Tế bào cơ trơn |
| 159 | raised plaques | /reɪzd plæks/ | Mảng xơ vữa nổi lên |
| 160 | cholesterol crystals | /kəˈlɛstərɒl ˈkrɪstəlz/ | Tinh thể cholesterol |
| 161 | collagen | /ˈkɒlədʒən/ | Collagen |
| 162 | calcium | /ˈkælsiəm/ | Canxi |
| 163 | fibrous plaque | /ˈfaɪbrəs plæk/ | Mảng xơ vữa |
| 164 | thrombogenic substances | /ˌθrɒmboʊˈdʒɛnɪk ˈsʌbstənsɪz/ | Chất gây huyết khối |
| 165 | necrotic core | /nəˈkrɒtɪk kɔːr/ | Lõi hoại tử |
| 166 | coronary arteries | /ˈkɒrənəri ˈɑːrtəriz/ | Động mạch vành |
| 167 | postmortem | /poʊstˈmɔːrtəm/ | Tử thi |
| 168 | body mass index (BMI) | /ˈbɒdi mæs ˈɪndɛks/ | Chỉ số khối cơ thể |
| 169 | fibrous plaques | /ˈfaɪbrəs plæks/ | Mảng xơ vữa (số nhiều) |
| 170 | antimortem | /ˌæntiˈmɔːrtəm/ | Trước khi chết |
| 171 | longitudinal studies | /ˌlɒndʒɪˈtjuːdɪnəl ˈstʌdiz/ | Nghiên cứu theo chiều dọc |
| 172 | vascular imaging | /ˈvæskjələr ˈɪmɪdʒɪŋ/ | Hình ảnh mạch máu |
| 173 | Computed tomography (CT) | /kəmˈpjuːtɪd təˈmɒɡrəfi/ | Chụp cắt lớp vi tính |
| 174 | coronary artery calcium | /ˈkɒrənəri ˈɑːrtəri ˈkælsiəm/ | Canxi động mạch vành |
| 175 | calcification | /ˌkælsɪfɪˈkeɪʃən/ | Sự vôi hóa |
| 176 | systolic blood pressure | /sɪsˈtɒlɪk blʌd ˈprɛʃər/ | Huyết áp tâm thu |
| 177 | electron beam CT | /ɪˈlɛktrɒn biːm ˌsiːˈtiː/ | CT chùm tia điện tử |
| 178 | Vascular ultrasound imaging | /ˈvæskjələr ˈʌltrəsaʊnd ˈɪmɪdʒɪŋ/ | Hình ảnh siêu âm mạch máu |
| 179 | brachial artery | /ˈbreɪkiəl ˈɑːrtəri/ | Động mạch cánh tay |
| 180 | flow-mediated dilation (FMD) | /floʊ ˈmiːdiˌeɪtɪd daɪˈleɪʃən/ | Giãn mạch qua trung gian dòng chảy |
| 181 | endothelial function | /ˌɛndoʊˈθiːliəl ˈfʌŋkʃən/ | Chức năng nội mô |
| 182 | carotid intima-media thickness (IMT) | /kəˈrɒtɪd ˈɪntɪmə ˈmiːdiə ˈθɪknəs/ | Bề dày lớp nội trung mạc động mạch cảnh |
| 183 | statin therapy | /ˈstætɪn ˈθɛrəpi/ | Liệu pháp statin |
| 184 | regression | /rɪˈɡrɛʃən/ | Sự thoái triển |
| 185 | puberty | /ˈpjuːbərti/ | Tuổi dậy thì |
| 186 | Routine Screening | /ruːˈtiːn ˈskriːnɪŋ/ | Sàng lọc thường quy |
| 187 | selective screening | /sɪˈlɛktɪv ˈskriːnɪŋ/ | Sàng lọc có chọn lọc |
| 188 | universal screening | /ˌjuːnɪˈvɜːrsəl ˈskriːnɪŋ/ | Sàng lọc toàn dân |
| 189 | genetic dyslipidemia | /dʒəˈnɛtɪk ˌdɪslɪpɪˈdiːmiə/ | Rối loạn lipid máu di truyền |
| 190 | subclinical | /ˌsʌbˈklɪnɪkəl/ | Cận lâm sàng |
| 191 | fasting | /ˈfɑːstɪŋ/ | (Lúc) đói |
| 192 | nonfasting | /nɒnˈfɑːstɪŋ/ | (Lúc) không đói |
| 193 | Friedewald equation | /ˈfriːdwɔːld ɪˈkweɪʒən/ | Công thức Friedewald |
| 194 | borderline | /ˈbɔːrdərlaɪn/ | Ranh giới |
| 195 | immunochemical methods | /ˌɪmjʊnoʊˈkɛmɪkəl ˈmɛθədz/ | Phương pháp miễn dịch hóa học |
| 196 | advanced lipoprotein testing | /ədˈvænst ˌlaɪpoʊˈproʊtiːn ˈtɛstɪŋ/ | Xét nghiệm lipoprotein tiên tiến |
| 197 | Tanner staging | /ˈtænər ˈsteɪdʒɪŋ/ | Phân độ Tanner |
| 198 | thyroid gland | /ˈθaɪrɔɪd ɡlænd/ | Tuyến giáp |
| 199 | Genetic Testing | /dʒəˈnɛtɪk ˈtɛstɪŋ/ | Xét nghiệm di truyền |
| 200 | deoxyribonucleic acid (DNA) | /diːˌɒksiˌraɪboʊnjuːˌkliːɪk ˈæsɪd/ | Acid deoxyribonucleic |
| 201 | Diet therapy | /ˈdaɪət ˈθɛrəpi/ | Liệu pháp ăn uống |
| 202 | breastfeeding | /ˈbrɛstˌfiːdɪŋ/ | Nuôi con bằng sữa mẹ |
| 203 | complementary foods | /ˌkɒmplɪˈmɛntəri fuːdz/ | Thực phẩm bổ sung |
| 204 | iron-fortified formula | /ˈaɪərn ˈfɔːrtɪfaɪd ˈfɔːrmjələ/ | Sữa công thức tăng cường sắt |
| 205 | Dietary Guidelines for Americans (DGA) | /ˈdaɪəˌtɛri ˈɡaɪdlaɪnz fər əˈmɛrɪkənz/ | Hướng dẫn Chế độ ăn uống cho người Mỹ |
| 206 | saturated fat | /ˈsæʧəˌreɪtɪd fæt/ | Chất béo bão hòa |
| 207 | trans fats | /træns fæts/ | Chất béo chuyển hóa |
| 208 | nutrient adequacy | /ˈnjuːtriənt ˈædɪkwəsi/ | Sự đầy đủ chất dinh dưỡng |
| 209 | Special Turku Risk Intervention Program | /ˈspɛʃəl ˈtʊərkuː rɪsk ˌɪntərˈvɛnʃən ˈproʊɡræm/ | Chương trình Can thiệp Nguy cơ Đặc biệt Turku |
| 210 | calorie requirements | /ˈkæləri rɪˈkwaɪərmənts/ | Nhu cầu calo |
| 211 | physical activity | /ˈfɪzɪkəl ækˈtɪvəti/ | Hoạt động thể chất |
| 212 | Dietary Approaches to Stop Hypertension (DASH) | /ˈdaɪəˌtɛri əˈproʊʧɪz tu stɒp ˌhaɪpərˈtɛnʃən/ | Chế độ ăn Tiếp cận Ngừng Tăng huyết áp |
| 213 | servings | /ˈsɜːrvɪŋz/ | Khẩu phần |
| 214 | whole grains | /hoʊl ɡreɪnz/ | Ngũ cốc nguyên hạt |
| 215 | processed grains | /ˈproʊsɛst ɡreɪnz/ | Ngũ cốc đã qua chế biến |
| 216 | polyunsaturated fats (PUFA) | /ˌpɒliʌnˈsæʧəˌreɪtɪd fæts/ | Chất béo không bão hòa đa |
| 217 | monounsaturated fats | /ˌmɒnoʊʌnˈsæʧəˌreɪtɪd fæts/ | Chất béo không bão hòa đơn |
| 218 | Mediterranean-style diet | /ˌmɛdɪtəˈreɪniən staɪl ˈdaɪət/ | Chế độ ăn kiểu Địa Trung Hải |
| 219 | arterial distensibility | /ɑːrˈtɪəriəl dɪˌstɛnsəˈbɪləti/ | Độ giãn nở của động mạch |
| 220 | Cardiovascular Health Integrated Lifestyle Diet (CHILD-1) | /ˌkɑːrdioʊˈvæskjələr hɛlθ ˈɪntɪˌɡreɪtɪd ˈlaɪfstaɪl ˈdaɪət/ | Chế độ ăn Lối sống Tích hợp Sức khỏe Tim mạch (CHILD-1) |
| 221 | CHILD-2 (LDL) | /tʃaɪld tuː ɛl diː ɛl/ | CHILD-2 (LDL) |
| 222 | failure to thrive | /ˈfeɪljər tu θraɪv/ | Chậm phát triển |
| 223 | plant stanol/sterol esters | /plænt ˈstænoʊl ˈstɛrɒl ˈɛstərz/ | Este stanol/sterol thực vật |
| 224 | water-soluble fibers | /ˈwɔːtər ˈsɒljəbəl ˈfaɪbərz/ | Chất xơ hòa tan trong nước |
| 225 | psyllium | /ˈsɪliəm/ | Psyllium (Mã đề) |
| 226 | CHILD-2 (TG) | /tʃaɪld tuː tiː dʒiː/ | CHILD-2 (TG) |
| 227 | sugared-sweetened beverages | /ˈʃʊɡərd ˈswiːtənd ˈbɛvərɪdʒɪz/ | Đồ uống có đường |
| 228 | omega-3 fatty acids | /oʊˈmeɪɡə θriː ˈfæti ˈæsɪdz/ | Acid béo omega-3 |
| 229 | emulsification | /ɪˌmʌlsɪfɪˈkeɪʃən/ | Sự nhũ hóa |
| 230 | Pharmacologic management | /ˌfɑːrməkəˈlɒdʒɪk ˈmænɪdʒmənt/ | Quản lý bằng dược lý |
| 231 | lipid-lowering drug therapy | /ˈlɪpɪd ˈloʊərɪŋ drʌɡ ˈθɛrəpi/ | Liệu pháp dùng thuốc hạ lipid |
| 232 | lipid specialist | /ˈlɪpɪd ˈspɛʃəlɪst/ | Chuyên gia về lipid |
| 233 | Bile acid–binding agents | /baɪl ˈæsɪd ˈbaɪndɪŋ ˈeɪdʒənts/ | Các chất gắn Acid mật |
| 234 | gastrointestinal tract | /ˌɡæstroʊɪnˈtɛstɪnəl trækt/ | Đường tiêu hóa |
| 235 | enterohepatic circulation | /ˌɛntəroʊhɪˈpætɪk ˌsɜːrkjəˈleɪʃən/ | Tuần hoàn gan ruột |
| 236 | HMG-CoA Reductase Inhibitors | /ˌeɪtʃɛmˈdʒiː koʊˈeɪ rɪˈdʌkteɪs ɪnˈhɪbɪtərz/ | Các chất ức chế HMG-CoA Reductase |
| 237 | teratogenic | /ˌtɛrətoʊˈdʒɛnɪk/ | Gây quái thai |
| 238 | Inhibitors of Cholesterol Absorption | /ɪnˈhɪbɪtərz əv kəˈlɛstərɒl əbˈsɔːrpʃən/ | Các chất ức chế hấp thu Cholesterol |
| 239 | Proprotein Convertase Subtilisin/Kexin Type 9 Inhibitors | /proʊˈproʊtiːn kənˈvɜːrteɪs səbˈtɪlɪsɪn ˈkɛksɪn taɪp naɪn ɪnˈhɪbɪtərz/ | Các chất ức chế PCSK9 |
| 240 | monoclonal antibodies | /ˌmɒnoʊˈkloʊnəl ˈæntɪˌbɒdiz/ | Kháng thể đơn dòng |
| 241 | immunoglobulin G | /ˌɪmjʊnoʊˈɡlɒbjəlɪn dʒiː/ | Immunoglobulin G |
| 242 | LDL apheresis | /ˌɛlˌdiːˈɛl ˌæfəˈriːsɪs/ | Lọc LDL |
| 243 | Fibric Acid Derivatives | /ˈfaɪbrɪk ˈæsɪd dɪˈrɪvətɪvz/ | Các dẫn xuất của Acid Fibric |
| 244 | myopathy | /maɪˈɒpəθi/ | Bệnh cơ |
| 245 | Niacin | /ˈnaɪəsɪn/ | Niacin |
| 246 | Dietary Additives and Supplements | /ˈdaɪəˌtɛri ˈædɪtɪvz ænd ˈsʌplɪmənts/ | Các chất phụ gia và bổ sung trong chế độ ăn |
| 247 | garlic | /ˈɡɑːrlɪk/ | Tỏi |
| 248 | fish oils | /fɪʃ ɔɪlz/ | Dầu cá |
| 249 | placebo | /pləˈsiːboʊ/ | Giả dược |
| 250 | garlic extract | /ˈɡɑːrlɪk ɪkˈstrækt/ | Chiết xuất tỏi |
| 251 | Red yeast rice | /rɛd jiːst raɪs/ | Gạo men đỏ |
| 252 | monacolin K | /ˌmɒnəˈkoʊlɪn keɪ/ | Monacolin K |
| 253 | lovastatin | /ˌloʊvəˈstætɪn/ | Lovastatin |
| 254 | docosahexaenoic acid (DHA) | /ˌdoʊkoʊsəˌhɛksəɪˈnoʊɪk ˈæsɪd/ | Acid docosahexaenoic |
| 255 | Low-Density Lipoprotein Apheresis | /ˌloʊˈdɛnsɪti ˌlaɪpoʊˈproʊtiːn ˌæfəˈriːsɪs/ | Lọc Lipoprotein tỷ trọng thấp |
| 256 | extracorporeal precipitation | /ˌɛkstrəkɔːrˈpɔːriəl prɪˌsɪpɪˈteɪʃən/ | Kết tủa ngoài cơ thể |
| 257 | vascular end points | /ˈvæskjələr ɛnd pɔɪnts/ | Điểm cuối mạch máu |
| 258 | Pediatric | /ˌpiːdiˈætrɪk/ | Nhi khoa |
| 259 | Endocrinology | /ˌɛndoʊkrɪˈnɒlədʒi/ | Nội tiết học |
| 260 | Industrialized countries | /ɪnˈdʌstriəlaɪzd ˈkʌntriz/ | Các nước công nghiệp hóa |
| 261 | Natural history | /ˈnæʧərəl ˈhɪstəri/ | Lịch sử tự nhiên |
| 262 | Genetic disorders | /dʒəˈnɛtɪk dɪsˈɔːrdərz/ | Rối loạn di truyền |
| 263 | Secondary causes | /ˈsɛkənˌdɛri ˈkɔːzɪz/ | Nguyên nhân thứ phát |
| 264 | Pharmacologic management | /ˌfɑːrməkəˈlɒdʒɪk ˈmænɪdʒmənt/ | Quản lý bằng dược lý |
| 265 | Digestive end products | /daɪˈdʒɛstɪv ɛnd ˈprɒdʌkts/ | Sản phẩm cuối của quá trình tiêu hóa |
| 266 | Apical surface | /ˈeɪpɪkəl ˈsɜːrfɪs/ | Bề mặt đỉnh |
| 267 | Sterol uptake | /ˈstɛrɒl ˈʌpteɪk/ | Hấp thu sterol |
| 268 | Biliary excretion | /ˈbɪliɛri ɛkˈskriːʃən/ | Bài tiết qua mật |
| 269 | Fecal excretion | /ˈfiːkəl ɛkˈskriːʃən/ | Bài tiết qua phân |
| 270 | Cytoplasm | /ˈsaɪtoʊˌplæzəm/ | Bào tương |
| 271 | Luminal side | /ˈluːmɪnəl saɪd/ | Phía lòng (ống) |
| 272 | Nascent particles | /ˈnæsənt ˈpɑːrtɪkəlz/ | Hạt non |
| 273 | Oxidation | /ˌɒksɪˈdeɪʃən/ | Sự oxy hóa |
| 274 | Free fatty acids | /friː ˈfæti ˈæsɪdz/ | Acid béo tự do |
| 275 | De novo synthesis | /deɪ ˈnoʊvoʊ ˈsɪnθəsɪs/ | Tổng hợp de novo (tổng hợp mới) |
| 276 | Circulating fatty acids | /ˈsɜːrkjəˌleɪtɪŋ ˈfæti ˈæsɪdz/ | Acid béo lưu hành |
| 277 | Vascular space | /ˈvæskjələr speɪs/ | Không gian mạch máu |
| 278 | Adaptor protein (AP) | /əˈdæptər ˈproʊtiːn/ | Protein adaptor |
| 279 | Acidification | /əˌsɪdɪfɪˈkeɪʃən/ | Sự acid hóa |
| 280 | Lipid-poor precursor particles | /ˈlɪpɪd pʊər priˈkɜːrsər ˈpɑːrtɪkəlz/ | Hạt tiền chất nghèo lipid |
| 281 | Disk-shaped particle | /dɪsk ʃeɪpt ˈpɑːrtɪkəl/ | Hạt hình đĩa |
| 282 | Sphere-shaped particle | /sfɪər ʃeɪpt ˈpɑːrtɪkəl/ | Hạt hình cầu |
| 283 | Founder effect | /ˈfaʊndər ɪˈfɛkt/ | Hiệu ứng người sáng lập |
| 284 | Mutant allele | /ˈmjuːtənt əˈliːl/ | Alen đột biến |
| 285 | Receptor-negative mutations | /rɪˈsɛptər ˈnɛɡətɪv mjuːˈteɪʃənz/ | Đột biến thụ thể âm tính |
| 286 | Receptor-defective mutations | /rɪˈsɛptər dɪˈfɛktɪv mjuːˈteɪʃənz/ | Đột biến thụ thể khiếm khuyết |
| 287 | First-degree relatives | /fɜːrst dɪˈɡriː ˈrɛlətɪvz/ | Người thân thế hệ thứ nhất |
| 288 | Nomogram | /ˈnoʊmoʊɡræm/ | Biểu đồ Nomogram |
| 289 | Central obesity | /ˈsɛntrəl oʊˈbiːsəti/ | Béo phì trung tâm |
| 290 | Viscous, creamy appearance | /ˈvɪskəs ˈkriːmi əˈpɪərəns/ | Dạng sệt, màu kem |
| 291 | Truncated apolipoprotein B | /trʌŋˈkeɪtɪd ˌeɪpoʊˌlaɪpoʊˈproʊtiːn biː/ | Apolipoprotein B bị cắt ngắn |
| 292 | Sedentary behavior | /ˈsɛdənˌtɛri bɪˈheɪvjər/ | Hành vi tĩnh tại |
| 293 | Tobacco use | /təˈbækoʊ juːs/ | Sử dụng thuốc lá |
| 294 | Linear growth | /ˈlɪniər ɡroʊθ/ | Tăng trưởng theo chiều dài |
| 295 | Randomized controlled trials | /ˈrændəmaɪzd kənˈtroʊld ˈtraɪəlz/ | Thử nghiệm đối chứng ngẫu nhiên |
| 296 | Systematic review | /ˌsɪstəˈmætɪk rɪˈvjuː/ | Tổng quan hệ thống |
| 297 | Primary care provider | /ˈpraɪməri kɛər prəˈvaɪdər/ | Nhà cung cấp dịch vụ chăm sóc ban đầu |
| 298 | Hard cardiovascular outcomes | /hɑːrd ˌkɑːrdioʊˈvæskjələr ˈaʊtˌkʌmz/ | Các kết cục tim mạch nặng |
| 299 | CASCADE FH Registry | /kæˈskeɪd ɛf eɪʧ ˈrɛʤɪstri/ | Sổ bộ CASCADE FH |
| 300 | Crossover study | /ˈkrɒsˌoʊvər ˈstʌdi/ | Nghiên cứu chéo |
