Ngoại khoa Căn bản: Vấn đề, Chẩn đoán và Quản lý, ấn bản thứ 7 (2026)
Essential Surgery: Problems, Diagnosis and Management, 7th Edition
Biên tập viên chính: Clive R. G. Quick, Suzanne Biers, Tan Arulampalam, Philip J. Deakin
Dịch & Chú giải: Ths.Bs. Lê Đình Sáng – (C) 2026 Elsevier Limited
CHƯƠNG 3. MIỄN DỊCH, VIÊM VÀ NHIỄM KHUẢN
Immunity, inflammation and infection
Clive R.G. Quick, MBBS(London), FDS, FRCS(England), MS(London), MA(Cantab); Suzanne M. Biers, BSc, MBBS, MD, FRCS; Tan H.A. Arulampalam, MBBS, MD, FRCS
Essential Surgery: Problems, Diagnosis and Management, 3, 34-54
ĐÁP ỨNG MIỄN DỊCH
Giới thiệu
Đáp ứng miễn dịch bẩm sinh (innate immune response) tạo nên hàng rào phòng thủ đầu tiên chống lại vi sinh vật xâm nhập. Cơ chế then chốt là khả năng cơ thể nhận diện các phân tử có nguồn gốc từ mầm bệnh thông qua các thụ thể giống Toll (Toll-like receptors – TLRs) trên bề mặt tế bào tua (dendritic cells). Điều này kích hoạt các đáp ứng viêm để giới hạn nhiễm khuẩn. Hệ thống miễn dịch thích ứng (adaptive immune system), liên quan đến tế bào T và B, mang tính đặc hiệu cao hơn với từng vi sinh vật. Nó tiến triển trong suốt quá trình nhiễm khuẩn để xử lý tối ưu (các) vi sinh vật liên quan. Một khi đã được tạo ra cho một nhiễm khuẩn cụ thể, một số tế bào T và B ghi nhớ (memory T and B cells) sẽ tồn tại, giúp cơ thể chuẩn bị sẵn sàng cho bất kỳ cuộc tấn công nào sau này của cùng một sinh vật đó. Vắc-xin hoạt động bằng cách thúc đẩy hệ thống thích ứng này.
Miễn dịch bẩm sinh
Hệ thống bẩm sinh tạo ra một đáp ứng bán đặc hiệu (semispecific response) đối với các sinh vật mới gặp. Nó cũng thiết yếu cho việc kích hoạt các đáp ứng thích ứng thông qua các cytokine truyền tín hiệu. Các đại thực bào (macrophages) và tế bào tua liên tục tuần tra các mô để tìm kiếm protein lạ có khả năng chỉ thị nhiễm khuẩn. Những kẻ xâm nhập mang protein lạ sẽ bị nuốt và phá hủy bởi các phân tử kháng khuẩn và hệ thống bổ thể (complement system) được kích hoạt. Một khi đã gắn kết, các TLR trên bề mặt tế bào thúc đẩy tế bào giải phóng các bộ cytokine đặc hiệu, sau đó huy động thêm đại thực bào, tế bào tua và các tế bào miễn dịch khác để ngăn chặn và tiêu diệt các sinh vật gây bệnh. Tế bào tua chứa protein đã bị nuốt sau đó di chuyển đến các hạch bạch huyết, nơi chúng trình diện các mảnh protein của mầm bệnh cho một loạt tế bào T và giải phóng thêm cytokine. Lipopolysaccharide (LPS) do vi khuẩn Gram âm sản xuất là một chất kích thích miễn dịch đặc biệt mạnh. Nó thúc đẩy các tế bào viêm giải phóng yếu tố hoại tử u-alpha (Tumour Necrosis Factor-alpha – TNF-alpha), interferon và interleukin-1 (IL1). Những cytokine này có lẽ là quan trọng nhất trong việc kiểm soát đáp ứng viêm và, nếu không được kiểm soát, cũng là nguyên nhân gây ra các rối loạn tự miễn (autoimmune disorders) như viêm khớp dạng thấp.
Ít nhất 10 loại TLR ở người đã được biết đến. Chúng hoạt động theo cặp, và mỗi cặp gắn với một loại protein khác nhau, đặc trưng cho một loại hoặc một nhóm sinh vật, ví dụ, vi khuẩn Gram âm, virus DNA sợi đơn hoặc flagellin. Các cytokine được giải phóng tạo ra các triệu chứng điển hình của nhiễm khuẩn—sốt và các triệu chứng giống cúm.
Sự hoạt động quá mức của hệ thống bẩm sinh này có thể dẫn đến nhiễm khuẩn huyết (sepsis) gây tử vong. Các TLR cũng có thể liên quan đến bệnh tự miễn bằng cách đáp ứng không phù hợp, ví dụ, với các tế bào bị tổn thương. Một loạt các loại thuốc kích hoạt các TLR cụ thể đang trong giai đoạn thử nghiệm tiên tiến như là chất bổ trợ vắc-xin hoặc tác nhân kháng virus. Các chất ức chế cũng đang được phát triển để điều trị nhiễm khuẩn huyết, bệnh viêm ruột (inflammatory bowel disease) và các bệnh tự miễn, nhưng cho đến nay thành công còn hạn chế.
Miễn dịch thích ứng
Đại thực bào và các tế bào trình diện kháng nguyên (antigen-presenting cells) khác, sau khi ‘xử lý’ một mầm bệnh, sẽ trưng bày các mảnh vỡ trên bề mặt của chúng. Điều này cuối cùng kích hoạt các tế bào B và T nhận diện mảnh vỡ cụ thể đó tăng sinh, và qua đó, khởi đầu một đáp ứng miễn dịch mạnh mẽ và tập trung cao độ. Các tế bào B được hoạt hóa sẽ tiết ra các phân tử kháng thể (antibody molecules) gắn vào các thành phần kháng nguyên (antigen) duy nhất và phá hủy mục tiêu hoặc đánh dấu nó để bị phá hủy. Tế bào T nhận diện các kháng nguyên được trưng bày trên các tế bào. Một số kích hoạt thêm tế bào B và T, trong khi những tế bào khác trực tiếp tấn công các tế bào bị nhiễm. Sau khi hồi phục từ nhiễm khuẩn ban đầu, đủ lượng tế bào T và B ghi nhớ còn lại để xử lý hiệu quả sinh vật đó nếu nó quay trở lại. Điều này có thể xảy ra nhanh đến mức các dấu hiệu lâm sàng của viêm có thể không xuất hiện.
HỆ VI SINH ĐƯỜNG RUỘT
Giới thiệu
Hệ vi sinh (microbiota) mô tả một loạt các vi sinh vật được tìm thấy trong và trên bất kỳ sinh vật đa bào nào giống như chúng ta. Những vi khuẩn này có thể là hội sinh (commensal), cộng sinh (mutualistic) hoặc gây bệnh (pathogenic). Một hệ vi sinh (microbiome) mô tả toàn bộ thành phần bộ gen kết hợp của các vi sinh vật trong một hệ sinh thái cụ thể như đại tràng; hai thuật ngữ này thường được sử dụng thay thế cho nhau, mặc dù không chính xác. Một số dự án đã điều tra các hệ vi sinh khác nhau của con người bao gồm da, khoang miệng, âm đạo và khoang mũi, nhưng hầu hết nghiên cứu đã tập trung vào hệ vi sinh đường ruột, nơi có số lượng lớn nhất cư trú. Dữ liệu được lấy từ các mẫu phân và một số từ sinh thiết niêm mạc.
Hệ vi sinh đường ruột rất lớn, chứa hàng ngàn loài và hơn 20 triệu gen, vượt xa bộ gen của con người. Ruột non chứa một thành phần rất khác biệt với sự biến đổi năng động hơn. Hệ vi sinh đại tràng chủ yếu được thúc đẩy bởi sự phân hủy hiệu quả các carbohydrate phức tạp không tiêu hóa được.
Hệ vi sinh và bệnh lý ngoại khoa
Hệ vi sinh đường ruột hiện được cho là đóng một vai trò quan trọng trong nguyên nhân bệnh sinh của một số tình trạng bệnh mạn tính. Hệ vi sinh ngụ ý một hiệu ứng mạng lưới của các sinh vật tương tác với nhau thay vì mối quan hệ trực tiếp giữa các sinh vật đơn lẻ và các tình trạng bệnh như đã được mô tả trong các định đề Koch. Hệ vi sinh đường ruột của một cá nhân là rất đặc hiệu và thay đổi theo tuổi, đạt đến cấu trúc trưởng thành vào lúc 3 tuổi. Những bất thường trong hệ vi sinh đã bị quy kết trong một loạt các tình trạng bao gồm ung thư, béo phì, đái tháo đường, các bệnh tự miễn và rối loạn tâm thần kinh. Việc sử dụng rộng rãi thuốc kháng sinh và thuốc ức chế bơm proton (proton-pump inhibitors) làm thay đổi cấu trúc và chức năng của hệ vi sinh đường ruột, qua đó ảnh hưởng đến sức khỏe ở tuổi trưởng thành, mặc dù mức độ và cơ chế của những thay đổi này vẫn chưa được hiểu rõ nhưng không chắc là có lợi.
Đối với các bác sĩ phẫu thuật, hệ vi sinh đường ruột dường như có liên quan đến nguyên nhân bệnh sinh của các bệnh lý đại tràng như bệnh túi thừa (viêm túi thừa) [diverticulosis(itis)], các rối loạn viêm ruột và ung thư. Ung thư đại trực tràng (Colorectal cancer – CRC) không có tính gia đình là nguyên nhân phổ biến thứ ba gây tử vong liên quan đến ung thư trên toàn thế giới và tỷ lệ mắc bệnh đang gia tăng. Có bằng chứng dịch tễ học mạnh mẽ cho thấy chế độ ăn uống có thể là một yếu tố nguy cơ quan trọng (nhiều thịt đỏ và chất béo và ít chất xơ), nhưng dữ liệu hiện nay cho thấy hệ vi sinh đại tràng và chất chuyển hóa của nó (metabolome) là một động lực quan trọng hơn của nguy cơ CRC. Một cơ chế là thông qua sự điều chỉnh của nó đối với chất xơ trong chế độ ăn, dẫn đến tăng cường chuyển hóa butyrate và giảm chuyển hóa axit mật thứ cấp. Một ý tưởng khác là một số thành viên của hệ vi sinh có thể sản xuất các chất gây ung thư tiền u (pro-oncogenic carcinogens) và thúc đẩy đáp ứng miễn dịch niêm mạc và những thay đổi tế bào biểu mô đại tràng, khởi đầu cho sự sinh ung thư đại trực tràng.
Các siêu hệ thống và phẫu thuật
Hệ vi sinh đường ruột là một siêu hệ thống phức tạp, và tất cả các can thiệp liên quan đến phẫu thuật làm xáo trộn nó đều có ý nghĩa đối với vật chủ. Ví dụ, hệ vi sinh có thể đóng một vai trò quan trọng trong việc lành miệng nối (anastomotic healing), liệt ruột sau mổ (postoperative ileus), tình trạng dinh dưỡng trong phẫu thuật và hội chứng đáp ứng viêm hệ thống (Systemic Inflammatory Response Syndrome – SIRS) và nhiễm khuẩn huyết.
Hệ vi sinh đường ruột có lẽ cũng đóng một vai trò cơ bản trong đáp ứng của vật chủ với các loại thuốc hóa trị (chemotherapeutic drugs) cho các loại khối u ở bất kỳ đâu trong cơ thể, bằng cách tạo điều kiện cho hiệu quả của thuốc, đôi khi làm tổn hại đến tác dụng chống ung thư và trung gian gây độc tính. Bác sĩ ngoại khoa hiện đại cần nhận thức được tác động tiềm tàng của việc chuẩn bị ruột, thuốc kháng sinh và phẫu thuật cắt bỏ đối với chức năng ung thư của ruột.
VIÊM
Viêm cấp
Giới thiệu
Viêm cấp (Acute inflammation) là cơ chế chính mà các mô sống đáp ứng với tổn thương. Mục đích là để trung hòa tác nhân gây hại, loại bỏ mô bị tổn thương hoặc hoại tử và phục hồi mô về chức năng hữu ích. Đặc điểm trung tâm là sự hình thành dịch rỉ viêm (inflammatory exudate) với ba thành phần chính: huyết thanh, bạch cầu (chủ yếu là bạch cầu trung tính – neutrophils) và fibrinogen.
Sự hình thành dịch rỉ viêm liên quan đến những thay đổi mạch máu tại chỗ, chịu trách nhiệm chung cho bốn ‘dấu hiệu chính của Celsus’—rubor (đỏ), tumor (sưng), calor (nóng) và dolor (đau)—cũng như mất chức năng (loss of function). Những hiện tượng mạch máu này được mô tả trong Hình 3.1. Các kết quả của viêm cấp được tóm tắt trong Hình 3.2.
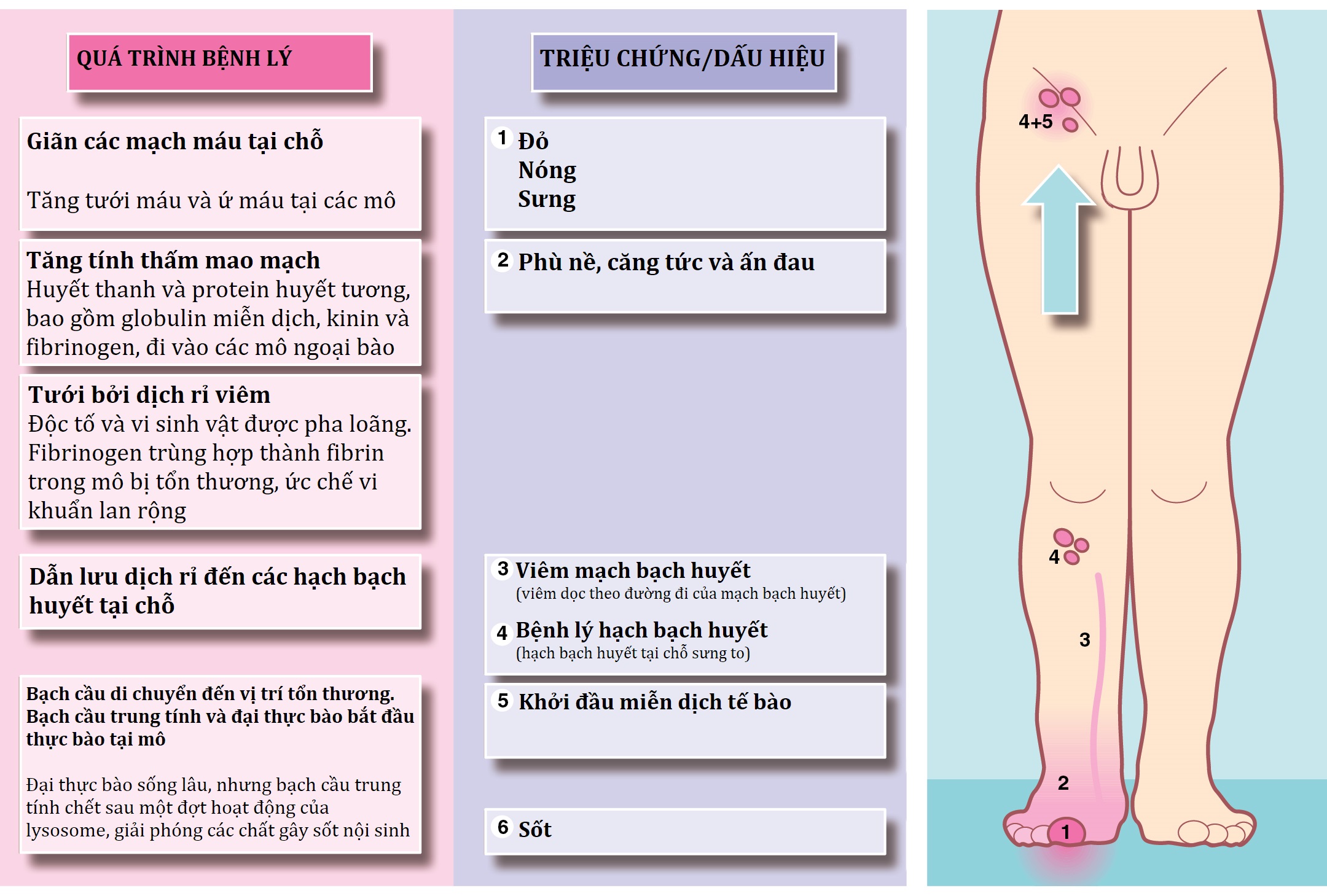
Hình 3.1 Viêm cấp—Sinh lý bệnh và đặc điểm lâm sàng.
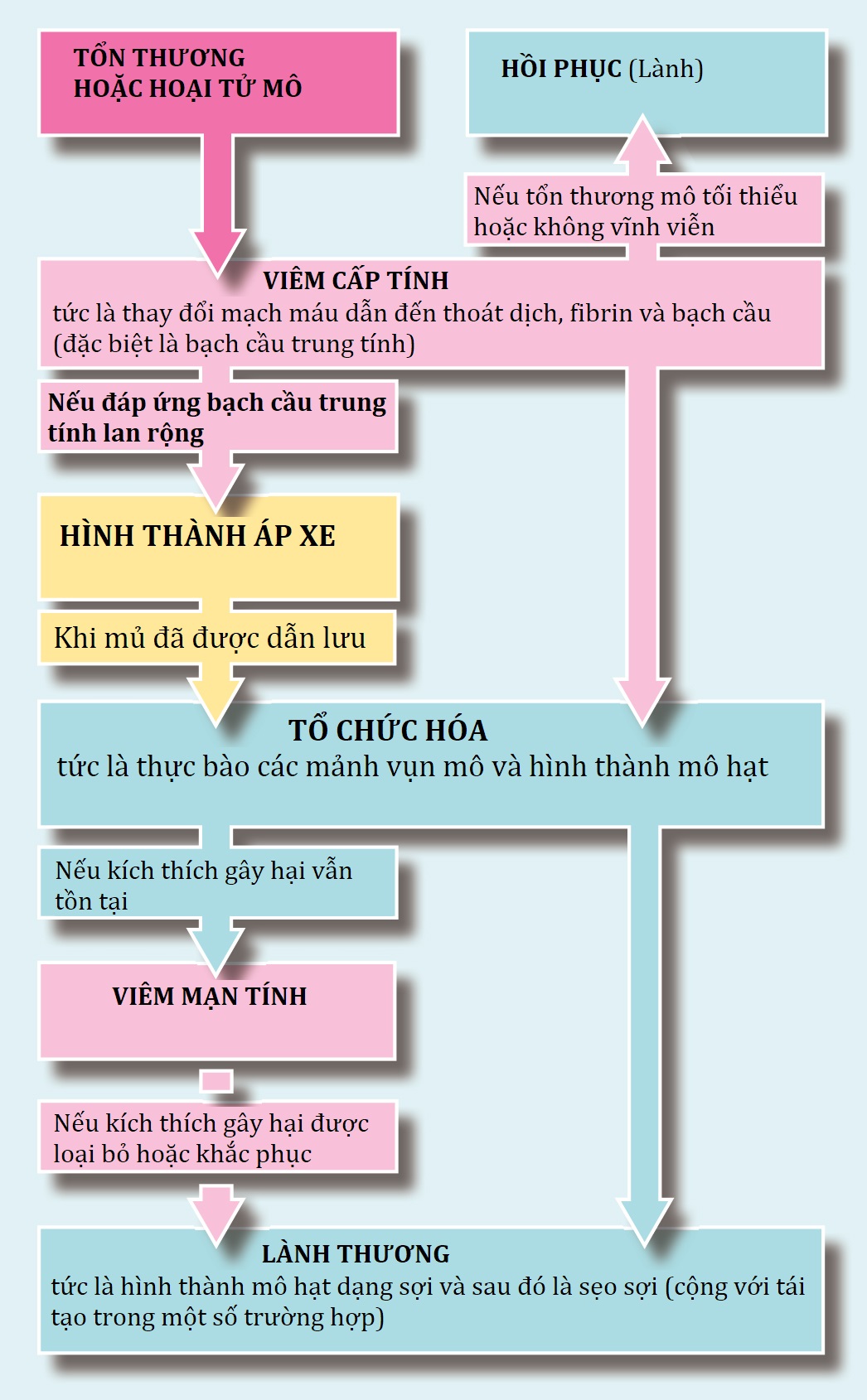
Hình 3.2 Viêm cấp và các di chứng của nó.
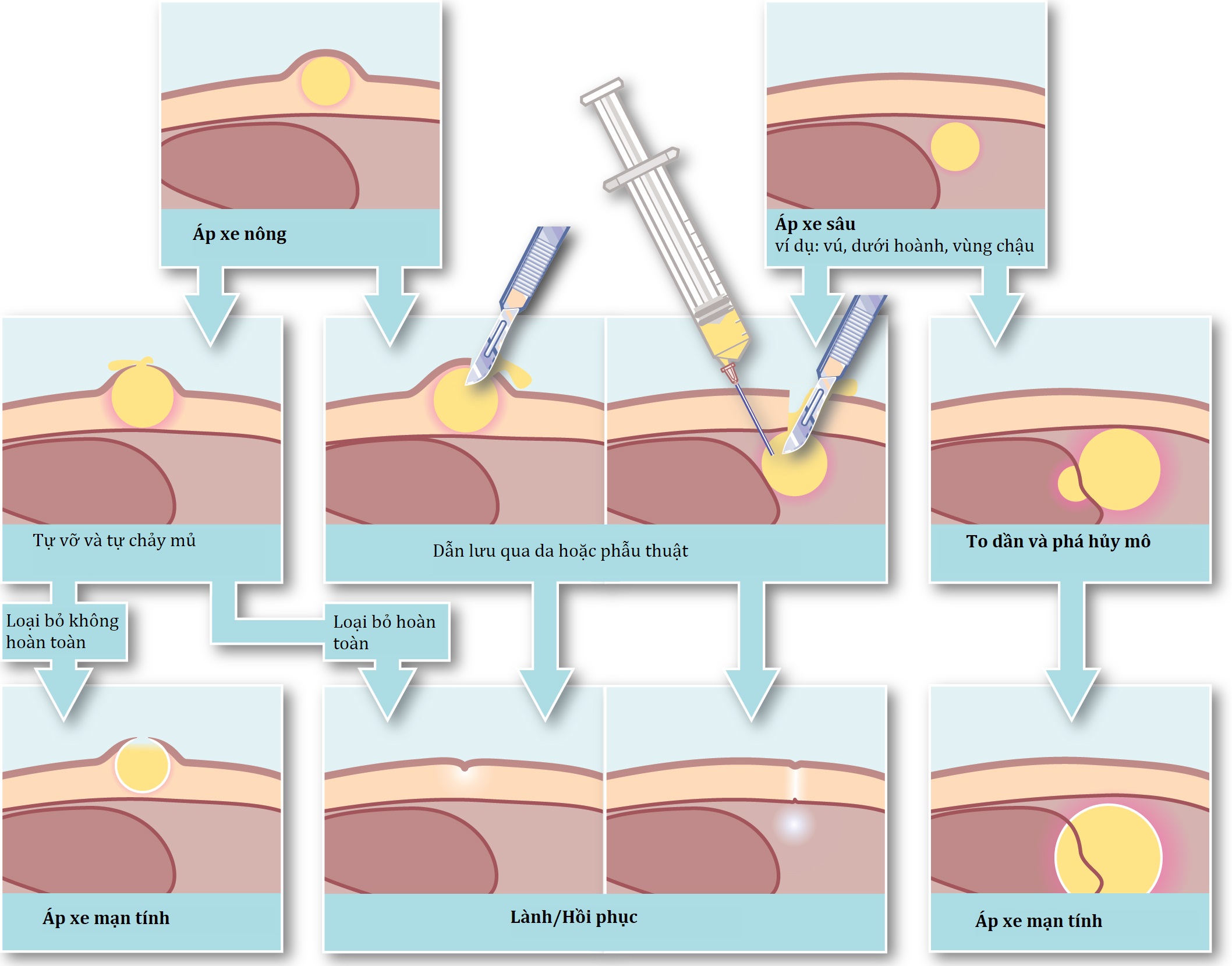
Hình thành áp-xe (Abscess formation) (Hình 3.3)
Áp-xe (abscess) là một ổ tụ mủ (pus) (bạch cầu trung tính chết và đang chết bao gồm dịch rỉ giàu protein) được bao bọc bởi một vùng viêm cấp. Hình thành áp-xe cấp đặc biệt xảy ra để đáp ứng với một số vi sinh vật sinh mủ (pyogenic microorganisms) thu hút bạch cầu trung tính nhưng lại đề kháng với thực bào (phagocytosis) và phá hủy lysosome. Áp-xe cũng hình thành để đáp ứng với hoại tử mô cục bộ và một số dị vật hữu cơ (ví dụ như dằm gỗ và vật liệu chỉ khâu bằng vải lanh). Các sinh vật sinh mủ chính có tầm quan trọng trong phẫu thuật là Staphylococcus aureus, một số liên cầu (đặc biệt là Streptococcus pyogenes), Escherichia coli và các trực khuẩn Gram âm liên quan (‘coliforms’), và các loài Bacteroides (spp.).
Nếu không điều trị, các ổ áp-xe cuối cùng có xu hướng ‘vỡ’ ra một bề mặt biểu mô gần đó (ví dụ: da, ruột và phế quản) và sau đó giải phóng các chất chứa bên trong. Nếu tác nhân gây hại qua đó được loại bỏ, việc dẫn lưu tự nhiên sẽ dẫn đến lành thương. Nếu một ổ áp-xe ở xa bề mặt (ví dụ: sâu trong vú), nó sẽ dần dần to ra, gây phá hủy mô nhiều. Đôi khi, các cơ chế bảo vệ tại chỗ bị áp đảo, dẫn đến nhiễm khuẩn tại chỗ lan rộng (viêm mô tế bào – cellulitis) và đôi khi là nhiễm khuẩn huyết.
Ngay cả với các ổ áp-xe nhỏ, khu trú tốt, các đợt vi khuẩn có thể xâm nhập vào tuần hoàn chung (vãng khuẩn huyết – bacteraemia) nhưng bị các tế bào thực bào của gan và lách dọn sạch trước khi chúng có thể tăng sinh. Điều này chịu trách nhiệm cho tình trạng sốt dao động (swinging pyrexia) đặc trưng của áp-xe. Vị trí áp-xe có thể không rõ ràng trên lâm sàng nếu nằm sâu (ví dụ: áp-xe dưới hoành hoặc tiểu khung) và bệnh nhân có thể vẫn khỏe mạnh. Khi có áp-xe, bạch cầu trung tính lưu hành tăng lên đáng kể khi chúng được giải phóng từ tủy xương; do đó, tình trạng tăng bạch cầu trung tính (neutrophil leucocytosis) rõ rệt (tức là Bạch cầu >15×10⁹/L [tương đương >15.000/mm³] với >80% là bạch cầu trung tính) thường cho thấy nhiễm khuẩn sinh mủ. Nhiễm khuẩn nặng gây ra các đáp ứng cytokine quá mức tràn vào tuần hoàn hệ thống gây nhiễm khuẩn huyết và suy giảm lâm sàng nhanh chóng.
Trạng thái mạn tính
Xem phần Viêm mạn tính tại chỗ, ở phần sau của chương này. Bản chất của việc quản lý bất kỳ ổ áp-xe nào là thiết lập dẫn lưu hoàn toàn, thường bằng cách rạch hoặc chọc hút. Bất kỳ vật liệu hoại tử hoặc dị vật còn sót lại nào cũng cần được loại bỏ bằng cách nạo hoặc cắt bỏ. Nếu việc dẫn lưu áp-xe không loại bỏ được tác nhân gây hại, đáp ứng bạch cầu trung tính vẫn tồn tại và mủ tiếp tục được hình thành, dẫn đến áp-xe mạn tính (chronic abscess).
Kháng sinh và áp-xe
Nếu kháng sinh thích hợp được dùng đủ sớm, các sinh vật có thể bị loại bỏ trước khi hình thành áp-xe. Trong các cuộc phẫu thuật có nguy cơ nhiễm khuẩn đặc biệt, kháng sinh dự phòng (prophylactic antibiotics) làm giảm đáng kể sự hình thành áp-xe và các biến chứng nhiễm khuẩn khác. Tuy nhiên, một khi áp-xe đã hình thành hoàn toàn, kháng sinh hiếm khi chữa khỏi vì mủ và vật liệu hoại tử vẫn còn, và thuốc không thể tiếp cận được vi khuẩn bên trong. Tuy nhiên, kháng sinh có thể ngăn chặn sự mở rộng hoặc thậm chí làm vô trùng mủ; ổ áp-xe vô trùng còn sót lại được gọi là antibioma.
Tổ chức hoá và sửa chữa
Di chứng phổ biến nhất của viêm cấp là tổ chức hoá (organisation), trong đó mô chết được loại bỏ bằng thực bào và khuyết hổng ban đầu được lấp đầy bởi mô liên kết mạch máu được gọi là mô hạt (granulation tissue). Mô này dần dần được ‘sửa chữa’ để tạo thành sẹo xơ. Đôi khi, mô ban đầu tái tạo (regenerates), tức là, xây dựng lại các tế bào và cấu trúc chuyên biệt của nó.
Lành thương
Lành thương kỳ đầu (Healing by primary intention)
Ví dụ đơn giản nhất về tổ chức hoá và sửa chữa là sự lành của một vết mổ da không biến chứng (Hình 3.4). Không có mô hoại tử, và các mép vết thương được đưa vào áp sát nhau bằng chỉ khâu, kẹp ghim (staples) hoặc keo dán. Một đáp ứng viêm cấp phát triển ở vùng lân cận vết mổ, và đến ngày thứ ba, mô hạt bắc cầu qua khuyết hổng ở lớp bì. Trong khi đó, biểu mô tăng sinh nhanh chóng từ các mép vết thương phục hồi lớp biểu bì. Các nguyên bào sợi (fibroblasts) xâm nhập vào mô hạt, đẻ ra collagen để vết sửa chữa đủ mạnh cho việc cắt chỉ sau 5–10 ngày. Vết sẹo vẫn còn đỏ, nhưng các mạch máu dần dần thoái lui và nó trở thành một vết sẹo thẳng, nhạt màu trong vòng vài tháng. Điều này được gọi là lành thương kỳ đầu (hay lành thương nguyên phát).
Lành thương kỳ hai (Healing by secondary intention)
Nếu mất mô ngăn cản các mép vết thương đến với nhau, quá trình lành thương phải bắc cầu qua khuyết hổng, nơi ban đầu được lấp đầy bởi cục máu đông. Cục máu đông này sau đó bị xâm nhập bởi mô hạt mạch máu từ nền vết thương khỏe mạnh. Dịch rỉ viêm đông đặc lại, tạo thành một lớp vảy (scab) bảo vệ. Các nguyên bào sợi xâm nhập và đẻ ra collagen trong các không gian ngoại bào; sau khoảng một tuần, một số nguyên bào sợi biệt hóa thành nguyên bào sợi cơ (myofibroblasts) và sự co lại của các sợi cơ (myofibrils) của chúng cuối cùng làm co nhỏ khuyết hổng vết thương khoảng 40%–80%, bắt đầu khoảng 2 tuần sau khi bị thương. Qua nhiều tuần và nhiều tháng, các mạch máu thoái lui và nhiều collagen hơn được hình thành, để lại một vết sẹo tương đối vô mạch; sự co lại dần dần của collagen trưởng thành (sự co sẹo – cicatrisation), kết hợp với sự co vết thương (wound contraction), đảm bảo vết sẹo cuối cùng nhỏ hơn nhiều so với khuyết hổng ban đầu. Khuyết hổng biểu bì dần dần được bắc cầu bởi sự tăng sinh biểu mô từ các mép vết thương. Các tế bào biểu mô trượt qua nhau bên dưới các mép vảy trên bề mặt mô hạt, và vảy cuối cùng bị bong ra. Toàn bộ quá trình này được gọi là lành thương kỳ hai (hay lành thương thứ phát) (xem Hình 3.4).

Hình 3.4 Lành thương kỳ đầu và kỳ hai.
Các yếu tố cản trở lành thương
Tốc độ và sự thành công của quá trình lành thương có thể bị cản trở bởi nhiều yếu tố tại chỗ, tại vùng và toàn thân (Hình 3.5).
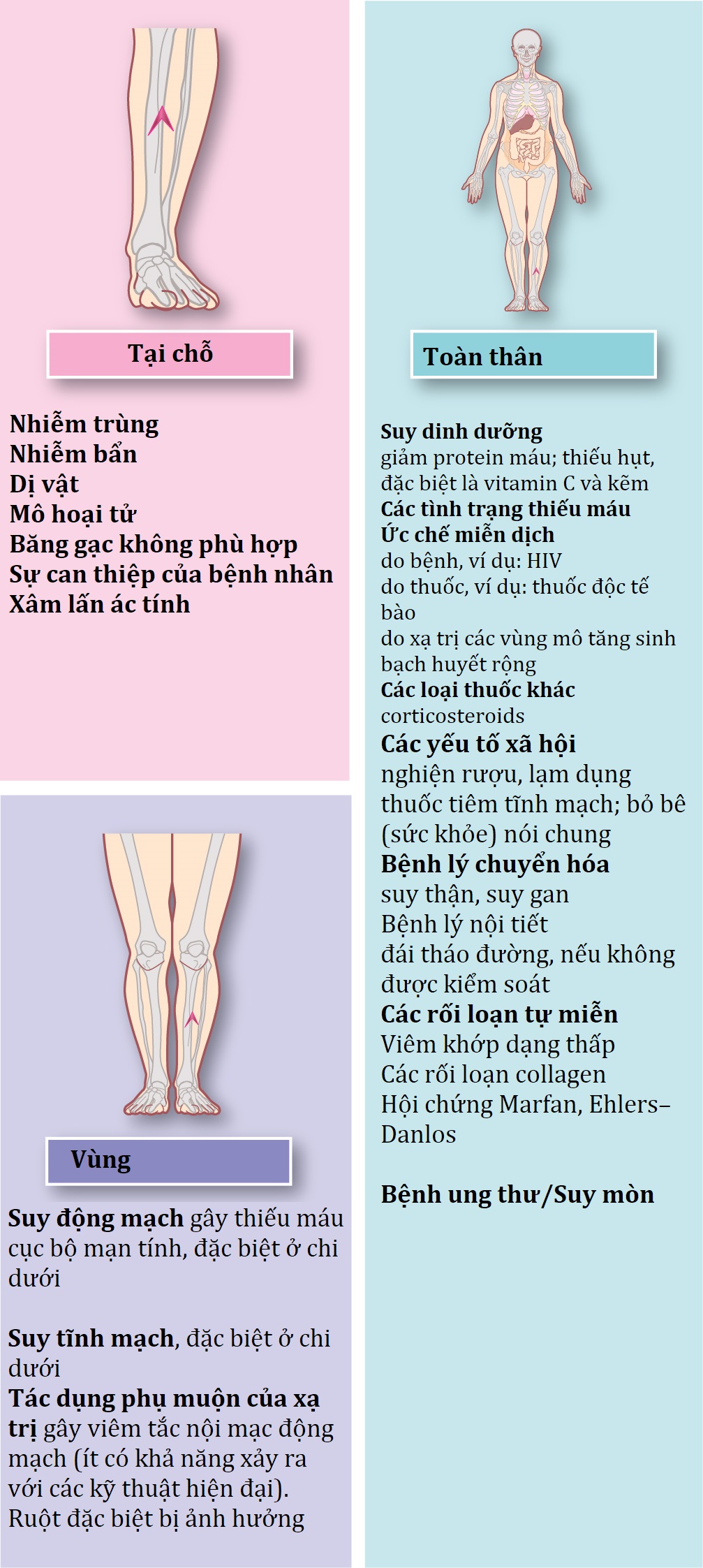
Hình 3.5 Các yếu tố ảnh hưởng đến lành thương.
Viêm mạn tính tại chỗ
Đôi khi, một tác nhân gây hại tồn tại trong một thời gian dài gây phá hủy mô liên tục. Cơ thể cố gắng đối phó với tổn thương ban đầu cũng như tổn thương đang tiếp diễn bằng các biện pháp viêm cấp, tổ chức hoá và sửa chữa, tất cả cùng một lúc. Khu vực bị tổn thương có thể hiển thị một số quá trình bệnh lý cùng một lúc, tức là hoại tử mô, đáp ứng viêm, hình thành mô hạt và sẹo xơ. Điều này được gọi là viêm mạn tính (chronic inflammation) và được đặc trưng về mặt mô học bởi sự chiếm ưu thế của các đại thực bào (đôi khi tạo thành các tế bào khổng lồ – giant cells), trong số các chức năng khác, chịu trách nhiệm thực bào các mảnh vỡ hoại tử. Tế bào lympho (lymphocytes) và tương bào (plasma cells) cũng có mặt, cho thấy sự tham gia của miễn dịch trong viêm mạn tính.
Viêm mạn tính đại diện cho sự cân bằng mong manh giữa một tác nhân gây hại dai dẳng và các đáp ứng sửa chữa của cơ thể. Sự lành thương chỉ xảy ra nếu tác nhân gây hại được loại bỏ. Sau đó, nó tiến hành theo cách thông thường nhưng thường với nhiều sẹo hơn.
Một loạt các tác nhân có thể dẫn đến viêm mạn tính. Các dạng lâm sàng có thể được nhóm thành ba loại:
- Áp-xe mạn tính
- Loét mạn tính
- Nhiễm khuẩn và viêm hạt đặc hiệu
Áp-xe mạn tính (Chronic abscesses)
Một ổ áp-xe mạn tính phát sinh nếu tác nhân gây ra áp-xe cấp không được loại bỏ hoàn toàn. Mủ tiếp tục được hình thành và ổ áp-xe tồn tại, nó chảy mủ liên tục qua một đường rò (sinus) hoặc ‘vỡ’ và chảy mủ định kỳ rồi đường rò tự liền lại giữa các đợt. Một thành áp-xe mạn tính bao gồm mô sẹo xơ được lót bằng mô hạt.
Nguyên nhân của áp-xe mạn tính bao gồm:
- Dị vật (Foreign bodies) bị nhiễm khuẩn—có lẽ là nguyên nhân phổ biến nhất trong thực hành phẫu thuật hiện đại. Các dị vật được cấy ghép cố ý có thể bị nhiễm khuẩn (ví dụ: lưới tổng hợp để sửa chữa thoát vị bẹn và khớp háng nhân tạo); những dị vật khác bị găm vào trong chấn thương (ví dụ: mảnh gỗ)
- Mô chết (hoại tử) có thể hoạt động như một dị vật, tạo thành một ổ cho nhiễm khuẩn. Ví dụ, bệnh đái tháo đường có thể bị biến chứng bởi nhiễm khuẩn bàn chân sâu với hoại tử gân và xương dẫn đến áp-xe và loét mạn tính. Lông bị găm sâu vào da khe mông có thể gây ra rò/áp-xe xoang lông (pilonidal sinus/abscess). Một chiếc răng chết hoặc mảnh chân răng bị nhiễm khuẩn có thể chảy mủ không liên tục qua một ‘nướu sưng’ (gum boil) liên quan (Hình 3.6). Viêm xương tủy mạn tính (Chronic osteomyelitis) có liên quan đến các mảnh xương chết còn sót lại được gọi là mảnh xương chết (sequestra)
- Áp-xe sâu: Một ổ áp-xe mạn tính có thể phát sinh mà không cần dị vật nếu ổ áp-xe cấp quá sâu để ngăn cản sự dẫn lưu tự nhiên. Áp-xe dưới hoành là một ví dụ điển hình
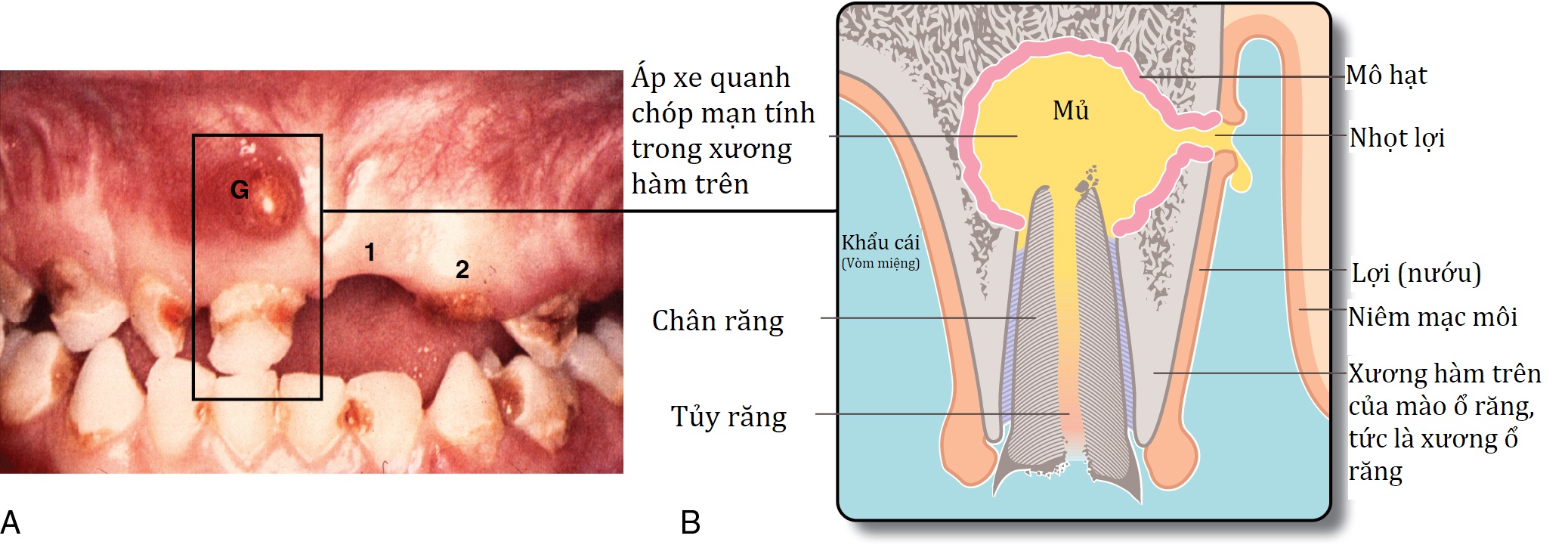
Hình 3.6 ‘Nướu sưng’ (gum boil) là một ví dụ về áp-xe mạn tính. (A) Miệng bị bỏ bê nặng cho thấy sâu răng lan rộng. Có một khối sưng viêm ở mặt má của xương ổ răng (G) gây ra bởi áp-xe chóp răng mạn tính ở răng cửa bên phải hàm trên. Lưu ý răng cửa giữa bên trái (1) bị mất và răng cửa bên trái (2) đã bị gãy ngang mức nướu do sâu răng. (B) Mặt cắt đứng dọc qua ‘nướu sưng’ (2) của một răng cửa hàm trên. ‘Nướu sưng’ thực chất là một đường rò trên nướu, chảy mủ mạn tính hoặc không liên tục. Bị phơi nhiễm với nhiễm khuẩn, tủy răng đã trở nên hoại tử trong khi áp-xe chóp răng đang từ từ mở rộng do sự hiện diện liên tục của mô hoại tử bị nhiễm khuẩn (tức là tủy răng). Chân răng là tất cả những gì còn lại sau khi thân răng đã bị gãy do sâu răng.
Loét mạn tính (Chronic ulcers)
Loét (ulcer) được định nghĩa là một khuyết hổng dai dẳng trên bề mặt biểu mô của da hoặc niêm mạc. Ngoại trừ loét ác tính (malignant ulcers), loét thường là kết quả của tổn thương cơ học hoặc hóa học cấp độ thấp đối với biểu mô và mô nâng đỡ, cùng với đáp ứng sửa chữa bị suy giảm. Ví dụ, bệnh nhân lớn tuổi, suy nhược dễ bị loét do tì đè (pressure sores) (‘loét giường’) phát triển trên các mỏm xương như xương cùng và gót chân. Trong những trường hợp này, việc bất động hoặc giảm đáp ứng đau bảo vệ ngăn cản bệnh nhân thường xuyên thay đổi vị trí để giảm áp lực của trọng lượng cơ thể. Hoại tử mô xảy ra và sau đó quá trình lành thương bị cản trở bởi sự hiện diện của mô hoại tử và thiếu máu cục bộ do áp lực tiếp tục. Các yếu tố góp phần khác có thể bao gồm tưới máu mô kém do bệnh tim hoặc bệnh mạch máu ngoại biên và suy dinh dưỡng.
Một vết loét phổ biến khác là loét chân lâu ngày trong suy tĩnh mạch mạn tính (chronic venous insufficiency); vết loét này không lành được do suy dinh dưỡng tại chỗ gây ra bởi áp lực tĩnh mạch cao và phù nề, và thường bị nặng thêm do nhiễm khuẩn thứ phát. Loét chân do thiếu máu (Ischaemic leg ulcers) không lành được do lưu lượng máu động mạch không đủ.
Tóm lại, một vết loét mạn tính đại diện cho sự mất cân bằng chưa được giải quyết giữa các yếu tố gây hại dai dẳng và các đáp ứng sửa chữa không đầy đủ. Nguyên tắc quản lý loét là loại bỏ các yếu tố gây hại và thúc đẩy các cơ chế lành thương bất cứ khi nào có thể.
Nhiễm khuẩn và viêm hạt đặc hiệu (Specific granulomatous infections and inflammations)
Một số vi sinh vật nhất định gây ra đáp ứng viêm cấp tối thiểu trong khi kích thích đáp ứng viêm mạn tính gần như ngay từ đầu. Chúng bao gồm Mycobacterium tuberculosis, Mycobacterium leprae và Treponema pallidum (gây bệnh lao [TB], bệnh phong và bệnh giang mai, tương ứng). Các tổn thương được đặc trưng bởi sự tích tụ của các đại thực bào tạo thành các u hạt (granulomas); các bệnh này được gọi là nhiễm khuẩn hạt (granulomatous infections).
Áp-xe lạnh do lao (tuberculous cold abscess) là sự tích tụ giống như mủ của vật liệu bã đậu (caseous material) hóa lỏng có chứa vi khuẩn lao không thường xuyên. Trái ngược với áp-xe sinh mủ (pyogenic abscess), tổn thương khi chạm vào thấy lạnh—một áp-xe lạnh (cold abscess) vì không có đáp ứng mạch máu viêm cấp. Lao hạch bạch huyết cổ (‘scrofula’) thường tạo ra ‘áp-xe hình khuy măng sét’ (‘collar-stud’ abscess), tức là một ổ áp-xe nông, bùng nhùng thông với một ổ áp-xe hạch bạch huyết sâu (và thường lớn hơn) qua một khuyết hổng cân (fascial defect) nhỏ. Lao cột sống ngực-thắt lưng (TB of the thoracolumbar spine) gây phá hủy và biến dạng tại chỗ và có thể lan xuống dưới dây chằng bẹn trong bao cơ thắt lưng chậu (psoas sheath), biểu hiện như một ‘áp-xe cơ thắt lưng chậu do lao’ (‘TB psoas abscess’) ở bẹn. Bệnh lao (và cả các bệnh nhiễm khuẩn do vi khuẩn lao không điển hình [Nontuberculous Mycobacteria – NTM]) đang gia tăng tần suất ở Vương quốc Anh. Nhiều bệnh nhân là người nhập cư, đặc biệt là từ Ấn Độ/Pakistan và Đông Âu (ví dụ: Lithuania và Latvia). Điều quan trọng là phải xem xét bệnh lao trong chẩn đoán phân biệt, vì cần có các kỹ thuật chuyên biệt để nuôi cấy mycobacteria. Nuôi cấy và xét nghiệm độ nhạy cảm (sensitivity testing) sau đó ngày càng trở nên quan trọng trong bối cảnh tỷ lệ kháng thuốc trong bệnh lao ngày càng tăng. Một vết loét do lao trên các hạch bẹn bị lao được thể hiện trong Hình 3.7.
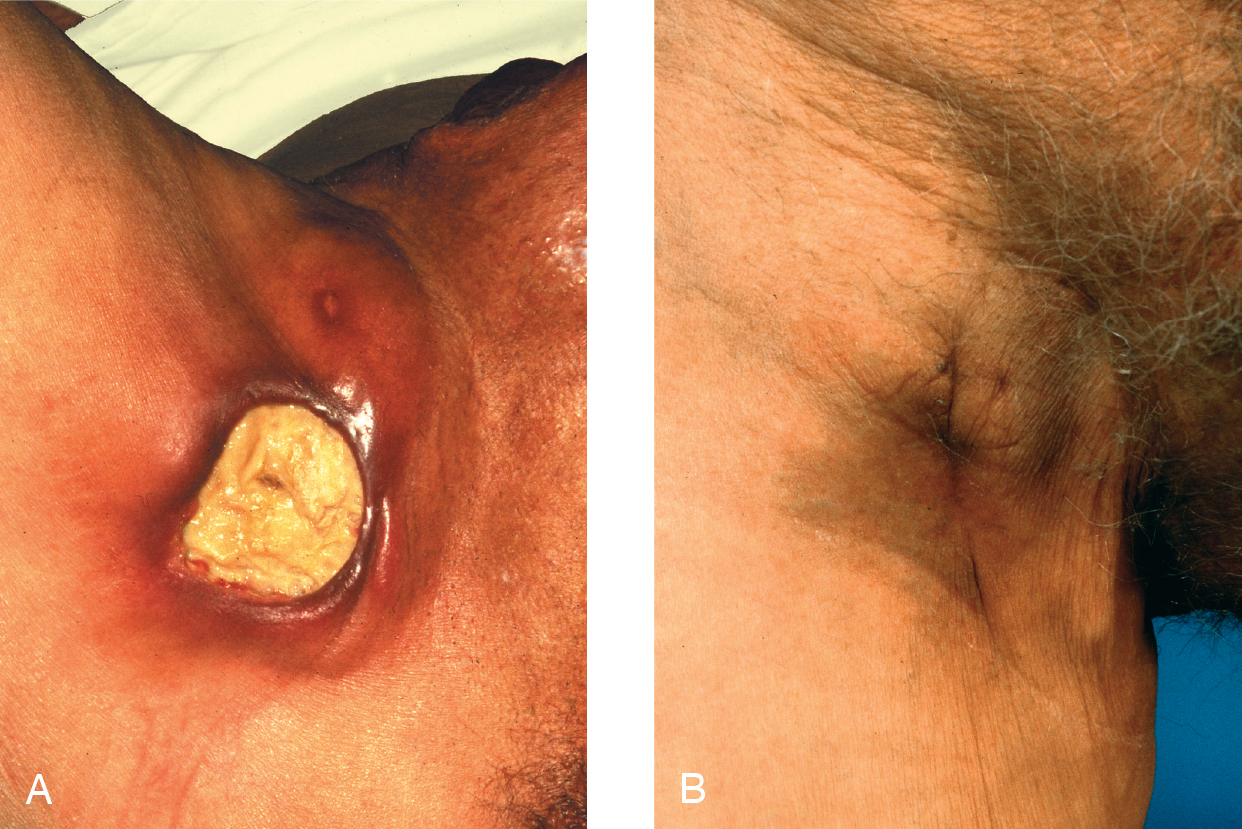
Hình 3.7 Loét do lao. (A) Bệnh nhân này đã sống ở Nam Phi và đã phát triển vết loét không đau và to ra chậm này khoảng 3 tháng trước đó. Nó bắt nguồn từ các hạch bạch huyết bị nhiễm khuẩn gần đó và cho thấy hình ảnh điển hình của ‘đáy loét màu da lộn’ (wash leather base) và ‘bờ loét nham nhở’ (undercut edge). Chẩn đoán dựa trên sinh thiết và điều trị bao gồm dẫn lưu các hạch bạch huyết liên quan có thể nhìn thấy phía trên vết loét và một liệu trình hóa trị liệu kháng lao. (B) Tổn thương đã lành 2 tháng sau đó.
Một số vật liệu dạng hạt cực kỳ mịn như talc và beryllium tạo ra các phản ứng dạng u hạt tương tự được gọi là u hạt dị vật (foreign body granulomas). Talc theo truyền thống được sử dụng làm bột bôi trơn trong găng tay phẫu thuật và đôi khi gây ra các phản ứng u hạt phúc mạc nghiêm trọng. Ngay cả chất thay thế nó, tức là tinh bột, thỉnh thoảng cũng tạo ra các phản ứng dữ dội. Vì lý do này, khi mở các khoang cơ thể, thực hành tốt nhất là sử dụng găng tay không có bột.
NHIỄM KHUẨN
Nguyên tắc chung
Điều quan trọng là phải phân biệt giữa khuẩn lạc (colonisation), nhiễm khuẩn (infection) và nhiễm khuẩn huyết (sepsis):
- Khuẩn lạc là khi vi khuẩn có mặt trong hoặc trên vật chủ nhưng không gây ra đáp ứng miễn dịch hoặc dấu hiệu bệnh tật
- Nhiễm khuẩn xảy ra khi vi sinh vật kích động một đáp ứng miễn dịch kéo dài và các dấu hiệu bệnh tật, ví dụ, khi vi khuẩn hội sinh bình thường trong đại tràng như Escherichia coli làm nhiễm bẩn khoang phúc mạc
- Nhiễm khuẩn huyết (trước đây gọi là nhiễm khuẩn huyết hệ thống) là kết quả của việc sản xuất cytokine quá mức để đáp ứng với nhiễm khuẩn nặng hoặc hoại tử mô (ví dụ: một chi bị hoại thư) có thể dẫn đến rối loạn chức năng cơ quan và suy cơ quan tiến triển
Nhiễm khuẩn có ý nghĩa lâm sàng phát sinh khi kích thước của một ổ cấy (inoculum) hoặc độc lực (virulence) của một vi sinh vật đủ để vượt qua các đáp ứng miễn dịch bẩm sinh và thích ứng và dẫn đến các triệu chứng. Độc lực của một sinh vật phụ thuộc vào các phẩm chất bám dính (adherence) và xâm lấn (invasiveness) của nó và khả năng sản xuất độc tố (toxins). Sự xâm lấn mô của vi sinh vật có thể được tăng cường bởi sự tiết ra các enzyme của chúng như hyaluronidase và streptokinase, bởi các cơ chế tránh thực bào (ví dụ: tạo vỏ bọc hoặc hình thành nha bào), bởi khả năng đề kháng vốn có đối với sự phá hủy của lysosome, hoặc bởi khả năng tiêu diệt các tế bào thực bào. Độc tố có thể được tiết ra bởi sinh vật (ngoại độc tố – exotoxins) hoặc được giải phóng khi sinh vật chết (nội độc tố – endotoxins). Trong cả hai trường hợp, độc tố có thể gây tổn thương mô tại chỗ (ví dụ: hoại thư sinh hơi), gây ra các tác dụng độc hại ở xa (ví dụ: uốn ván mà còn cả hoại thư sinh hơi), hoặc kích hoạt các hệ thống cytokine gây nhiễm khuẩn huyết (ví dụ: suy đa cơ quan hoặc đông máu nội mạch lan tỏa).
Nhiễm khuẩn có thể mắc phải tại cộng đồng (community acquired) (ví dụ: viêm phổi thùy do phế cầu ở một người trẻ khỏe mạnh) hoặc mắc phải tại bệnh viện (hospital acquired). Loại sau còn được gọi là nhiễm khuẩn bệnh viện (nosocomial infections), được định nghĩa là các nhiễm khuẩn không có mặt hoặc không ủ bệnh tại thời điểm nhập viện. Một loại thứ ba là nhiễm khuẩn liên quan đến chăm sóc y tế (Healthcare-Associated Infection – HCAI) ở những bệnh nhân thường xuyên tiếp xúc với các cơ sở y tế hoặc được chăm sóc dài hạn. Nhiễm khuẩn bệnh viện và HCAI có thể bị lây nhiễm qua nhiễm khuẩn chéo (cross-infection) từ bệnh nhân bị nhiễm khuẩn/mang khuẩn lạc, từ đồ đạc bị ô nhiễm, hoặc từ ‘người mang mầm bệnh’ (carriers) trong số nhân viên y tế qua đường hô hấp, tiêu hóa hoặc qua ô nhiễm thiết bị y tế và dụng cụ như ống thông (cannulas) tĩnh mạch hoặc ống thông tiểu. Những nhiễm khuẩn này thường do vi khuẩn kháng kháng sinh, chẳng hạn như Staphylococcus aureus kháng methicillin (Methicillin-Resistant Staphylococcus aureus – MRSA). Nguy cơ mắc các bệnh nhiễm khuẩn này có thể giảm đáng kể bằng biện pháp đơn giản là mọi người tiếp xúc với bệnh nhân đều rửa tay bằng xà phòng và nước hoặc sử dụng gel chứa cồn sau mỗi lần tiếp xúc với bệnh nhân. Bệnh nhân hoặc người mang mầm bệnh đa kháng thuốc nên được cách ly khi ở bệnh viện. Bệnh nhân trải qua các cuộc phẫu thuật mà nhiễm khuẩn có nguy cơ rất cao lý tưởng nên được điều trị ở các khu vực tách biệt với bệnh nhân ốm, đặc biệt là các trường hợp nhập viện cấp cứu từ các cơ sở chăm sóc dài hạn. Nguy cơ đặc biệt liên quan đến phẫu thuật mắt, thay khớp và ghép mạch máu nhân tạo.
Bệnh nhân sau phẫu thuật có nguy cơ đặc biệt mắc các bệnh nhiễm khuẩn bệnh viện (ví dụ: viêm phổi hoặc nhiễm khuẩn đường tiết niệu) vì hệ thống phòng thủ của vật chủ bị suy giảm do cuộc mổ, và các cơ chế bảo vệ sinh lý bị phá vỡ cho phép nhiễm khuẩn chiếm ưu thế. Ví dụ, giảm bạch cầu trung tính (neutropenia) dẫn đến nhiễm khuẩn, và những người hút thuốc có nhiều khả năng phát triển viêm phế quản phổi (bronchopneumonia) sau gây mê toàn thân. Sức đề kháng chung của bệnh nhân phẫu thuật có thể bị suy giảm thêm do suy dinh dưỡng, bệnh ác tính, bệnh dạng thấp, corticosteroid hoặc các loại thuốc ức chế miễn dịch khác.
Trong các nhiễm khuẩn sau phẫu thuật (‘nhiễm khuẩn vết mổ – surgical site infections’), các sinh vật xâm nhập vào các mô thông qua một sự phá vỡ bất thường của biểu mô. Đây có thể là tổn thương bề mặt như vết thương phẫu thuật hoặc chấn thương, vết tiêm, hoặc kết quả từ một tạng rỗng bị thủng. Các sinh vật gây bệnh thường là một phần của hệ vi sinh vật (flora) bình thường trên da, ruột hoặc đường hô hấp của bệnh nhân hoặc thường có mặt trong môi trường bên ngoài. Ví dụ, Staphylococcus epidermidis thường có mặt trên da nhưng gây nhiễm khuẩn mạn tính nghiêm trọng cho các mảnh ghép động mạch được cấy ghép.
Các phương pháp kiểm soát nhiễm khuẩn bệnh viện
- Môi trường: Khu vực bệnh nhân trong bệnh viện phải sạch sẽ và không có vi khuẩn gây ô nhiễm, bao gồm Clostridium difficile và MRSA, đặc biệt là nơi diễn ra các thủ thuật xâm lấn như trong phòng mổ và các đơn vị chăm sóc đặc biệt (high-dependency units). Các biện pháp phòng ngừa đặc biệt được thực hiện trong các phòng mổ.
- Nhân viên y tế: Nhân viên y tế phải được tiêm phòng viêm gan B. Những cá nhân dương tính với HIV nên thảo luận về tình trạng của họ với bộ phận sức khỏe nghề nghiệp trước khi thực hiện các thủ thuật xâm lấn. Vết thương hở phải được băng kín an toàn, và nhân viên y tế có tổn thương da nhiễm khuẩn nên tránh tiếp xúc với bệnh nhân. Cần thực hiện các biện pháp phòng ngừa phổ cập đối với máu và dịch tiết cơ thể (universal blood and body fluid precautions) để ngăn ngừa lây truyền virus, và cần tuân thủ các hướng dẫn xử lý các tổn thương do kim đâm. Như đã đề cập trước đó, nguy cơ MRSA và các bệnh nhiễm khuẩn khác có thể giảm đáng kể bằng các biện pháp đơn giản như rửa tay bằng xà phòng và nước hoặc gel chứa cồn giữa mỗi lần tiếp xúc với bệnh nhân.
- Bệnh nhân: Lý tưởng nhất là nên lấy gạc vi khuẩn (bacterial swabs) để xét nghiệm MRSA từ tất cả các bệnh nhân phẫu thuật chương trình trước khi cho họ nhập viện, và những bệnh nhân dương tính với MRSA nên được điều trị khử khuẩn lạc tại chỗ (topical decolonisation therapy) và cấy vi khuẩn sàng lọc theo dõi để đánh giá tình trạng MRSA trước khi phẫu thuật. Bệnh nhân được biết là mắc các bệnh nhiễm khuẩn lây truyền hoặc là người mang mầm bệnh, ví dụ, MRSA, nên được điều dưỡng cách ly. Lý tưởng nhất là phẫu thuật nên được hoãn lại đối với những bệnh nhân bị nhiễm khuẩn đường hô hấp hoặc đường tiết niệu cấp tính. Một số đơn vị cũng sàng lọc các sinh vật đa kháng thuốc khác, chẳng hạn như Enterobacteriaceae sinh carbapenemase (Carbapenemase-Producing Enterobacteriaceae – CPE) hoặc enterococci kháng vancomycin (Vancomycin-Resistant Enterococci – VRE).
- Thủ thuật: Thiết bị—bao gồm dụng cụ, kim tiêm, áo choàng phòng mổ và khăn trải—phải vô trùng, trong bao bì an toàn hoặc là các vật dụng dùng một lần.
Phòng ngừa phổ cập đối với máu và dịch tiết cơ thể
Nhận thức ngày càng tăng về các bệnh nhiễm virus lây truyền qua đường máu, chẳng hạn như viêm gan B và C và sự phổ biến của HIV, đã dẫn đến khái niệm phòng ngừa phổ cập đối với máu và dịch tiết cơ thể trong việc chống lây nhiễm chéo giữa bệnh nhân và nhân viên y tế. Nhân viên y tế thường cố gắng cảnh giác với những bệnh nhân có nguy cơ cao nhưng lại lơ là vào những lúc khác, và sự cẩn thận đặc biệt này sớm không còn nữa. Vì lý do này, mọi bệnh nhân nên được giả định là một người mang mầm bệnh virus lây truyền qua đường máu tiềm ẩn và các biện pháp phòng ngừa nên được sử dụng bất cứ khi nào da có khả năng bị xuyên thủng và bất cứ khi nào xử lý các dụng cụ bị nhiễm máu hoặc các dịch tiết cơ thể khác. Lây truyền nhiễm khuẩn xảy ra trong các tình huống rõ ràng như tổn thương do kim đâm (xem bên dưới) và cả với các sự kiện ít rõ ràng hơn như các vật liệu bị nhiễm khuẩn bắn vào mắt.
Cần đeo găng tay dùng một lần cho tất cả các thủ thuật y tế và khám thực thể ngoại trừ việc sờ nắn da không có tổn thương hở rõ ràng ở bệnh nhân hoặc người khám. Nhân viên y tế có da bị tổn thương nên băng kín. Cần đeo kính bảo vệ mắt trong các thủ thuật xâm lấn để ngăn ngừa bắn vào kết mạc.
Tiêm chủng viêm gan B
Nhân viên y tế trực tiếp tham gia chăm sóc bệnh nhân nên được tiêm phòng viêm gan B. Huyết thanh học viêm gan B nên được kiểm tra 2 tháng sau khi hoàn thành tiêm chủng. Khoảng 5% người trẻ khỏe mạnh không chuyển đổi huyết thanh (seroconvert) và nên được tiêm phòng lại. Một nửa trong số này sẽ chuyển đổi huyết thanh và phần còn lại là những người không đáp ứng di truyền (genetic nonresponders).
Tổn thương do kim đâm và các tổn thương xuyên thấu khác
Tổn thương do vật sắc nhọn, đặc biệt là từ kim rỗng bị ô nhiễm (tổn thương do kim đâm – needle-stick injury), có thể dẫn đến lây truyền nhiễm khuẩn nếu bệnh nhân mang virus lây truyền qua đường máu. Những tổn thương như vậy có khả năng lây truyền viêm gan B và C, nhưng nguy cơ lây truyền HIV thấp hơn nhiều vì nồng độ virus trong dịch tiết của người dương tính với HIV thấp hơn nhiều và thể tích lây truyền nhỏ.
Tổn thương do kim đâm là phổ biến nhưng phần lớn có thể tránh được: việc đậy nắp lại kim đã qua sử dụng gây ra khoảng 40% các tổn thương do kim đâm và nên tránh. Lấy máu tĩnh mạch là một thủ thuật có nguy cơ cao và cần được thực hiện một cách thận trọng. Kim tiêm, lưỡi dao mổ và các dụng cụ dùng một lần khác bị nhiễm máu cần được xử lý cẩn thận và vứt bỏ ngay lập tức vào các hộp nhựa ‘vật sắc nhọn’ (sharps containers) đặc biệt.
Nhiễm virus sau tổn thương do vật sắc nhọn
Nếu một tổn thương do vật sắc nhọn rõ ràng có liên quan đến việc máu được truyền từ một người bị nhiễm bệnh đã xảy ra, nguy cơ nhiễm viêm gan B đối với người nhận không có hoặc chỉ có miễn dịch một phần với viêm gan B (tức là chưa được tiêm phòng đầy đủ hoặc không đáp ứng) là khoảng 30%. Đối với viêm gan C, nguy cơ là 3% và đối với HIV là 0,3%. Cũng có nguy cơ rất cao sau tổn thương do vật sắc nhọn trong môi trường giải trí (ví dụ: kim tiêm do người nghiện ma túy tiêm tĩnh mạch để lại trên bãi biển) vì viêm gan B và HIV tồn tại tốt trong điều kiện ấm, ẩm, đặc biệt là trong huyết thanh và các mảnh vỡ mô. Do đó, tất cả các tổn thương do vật sắc nhọn cần được xử lý với sự quan tâm cao nhất. Một quy trình được khuyến nghị được trình bày trong Hộp 3.1.
Sau khi phơi nhiễm đáng kể với HIV, thuốc kháng retrovirus (antiretroviral drugs) nên được dùng kịp thời để dự phòng sau phơi nhiễm (postexposure prophylaxis), lý tưởng nhất là trong vòng 24 giờ. Một sự kết hợp của các loại thuốc kháng retrovirus được dùng trong 4 tuần; nên tìm kiếm lời khuyên của chuyên gia. Các tác dụng phụ thường rất khó chịu và bao gồm buồn nôn và các triệu chứng tiêu hóa (GI) khác, và nhức đầu. Đối với nhân viên y tế phơi nhiễm với viêm gan C, vẫn chưa có khuyến nghị về tiêm chủng hoặc điều trị dự phòng. Các hướng dẫn quản lý sau phơi nhiễm là để có thể xác định sớm nhiễm khuẩn và chuyển gửi chuyên khoa.
HỘP 3.1: Quy trình xử lý tổn thương do ‘vật sắc nhọn’
HCV, Virus viêm gan C; HIV, virus gây suy giảm miễn dịch ở người; PCR, phản ứng chuỗi polymerase. |
Sử dụng xét nghiệm vi sinh trong quản lý nhiễm khuẩn ngoại khoa
Nhiễm khuẩn ngoại khoa nên được chẩn đoán trên lâm sàng và phòng xét nghiệm nên được sử dụng để xác định bản chất của nó và hướng dẫn liệu pháp kháng sinh. Nhân viên y tế cấp dưới thiếu kinh nghiệm thường lấy gạc cấy mọc vi sinh vật trong phòng xét nghiệm nhưng không nhận ra rằng đây có thể là từ khuẩn lạc chứ không phải là một nhiễm khuẩn quan trọng về mặt lâm sàng. Bức tranh lâm sàng phải luôn quyết định các quyết định điều trị, mặc dù các sinh vật như Strep. pyogenes có thể cần điều trị để ngăn ngừa lây nhiễm chéo ngay cả khi tổn thương nhẹ.
Kết quả của các mẫu bệnh phẩm từ các vị trí bị ô nhiễm phải được diễn giải một cách thận trọng. Hoại tử bề mặt hoặc dịch tiết thường chỉ chứa các sinh vật khuẩn lạc. Ví dụ, trong viêm xương tủy do Staph. aureus, lỗ rò có thể bị khuẩn lạc bởi các loài Proteus hoặc Pseudomonas. Sinh vật gây bệnh có thể không được nuôi cấy trong phòng xét nghiệm trừ khi vết thương được làm sạch trước bằng nước muối sinh lý và sau đó lấy gạc cấy sâu. Nếu có thể, nên gửi một ống tiêm mủ hoặc một mẫu mô nhiễm khuẩn đã được cắt bỏ để nuôi cấy. Các mẫu bệnh phẩm lý tưởng nên được lấy trước khi dùng kháng sinh. Để có kết quả tốt nhất, các mẫu bệnh phẩm vi sinh nên được vận chuyển đến phòng xét nghiệm trong vòng 2 giờ hoặc giữ ở 4°C.
Xét nghiệm vi sinh cho TB và NTM đòi hỏi các kỹ thuật cụ thể bao gồm nuôi cấy kéo dài. Như đã mô tả trước đó, nuôi cấy và xét nghiệm độ nhạy cảm sau đó ngày càng quan trọng trong kỷ nguyên gia tăng kháng thuốc. Phản ứng chuỗi polymerase (Polymerase Chain Reaction – PCR) có thể được sử dụng, nhưng độ nhạy và độ đặc hiệu vẫn chưa phải là 100%. Việc xác định vi khuẩn được nuôi cấy hiện nay thường được thực hiện bằng phương pháp khối phổ (mass spectrometry), trong khi các kỹ thuật phân tử như 16S PCR cho phép xác định các vi khuẩn từ các mẫu cấy âm tính. PCR đã được sử dụng rộng rãi để phát hiện các mầm bệnh virus nhưng hiện đang được sử dụng ngày càng nhiều để phát hiện vi khuẩn. Giải trình tự bộ gen (Genome sequencing) cũng có thể được sử dụng để suy ra xét nghiệm độ nhạy cảm. Lưu ý rằng, nói chung, phòng xét nghiệm vi sinh hoạt động hiệu quả nhất khi tất cả các thông tin lâm sàng liên quan được cung cấp.
Nguyên tắc điều trị nhiễm khuẩn ngoại khoa
Loại bỏ ổ nhiễm khuẩn
Một khu vực bị nhiễm khuẩn có mạch máu nuôi dưỡng kém thực sự bị cô lập khỏi các cơ chế bảo vệ dịch thể và tế bào và khỏi các kháng sinh lưu hành. Vật liệu bị nhiễm khuẩn bị giữ lại có thể kích hoạt quá mức các cơ chế cytokine và do đó thúc đẩy nhiễm khuẩn huyết. Một bước đầu tiên quan trọng là loại bỏ mô hoại tử bị nhiễm khuẩn và dẫn lưu các ổ tụ mủ. Điều này được áp dụng ngay cả khi bệnh nhân có vẻ quá yếu để phẫu thuật vì bệnh nhân rất yếu có thể hồi phục đáng kể sau loại phẫu thuật này. Các ví dụ phổ biến bao gồm dẫn lưu áp-xe, cắt cụt các chi bị hoại tử nhiễm khuẩn, loại bỏ các dị vật bị nhiễm khuẩn (ví dụ: ống thông, bộ phận giả và các mảnh vỡ chấn thương), và dẫn lưu các chất chứa bị nhiễm khuẩn của các tạng rỗng như đường mật, thận và niệu quản.
Liệu pháp kháng sinh (Xem Bảng 3.1)
Liệu pháp kháng sinh theo kinh nghiệm
Nếu việc điều trị là khẩn cấp, kháng sinh được chọn theo các mầm bệnh có khả năng nhất và hồ sơ nhạy cảm kháng sinh tại địa phương. Nhuộm Gram trên vật liệu lấy từ một vị trí thường vô trùng có thể hướng dẫn điều trị ban đầu cho đến khi có kết quả chi tiết. Trong các nhiễm khuẩn vết mổ bụng nơi các tạng rỗng chưa bị mở, Staph. aureus là sinh vật có khả năng và có thể bắt đầu dùng flucloxacillin. Nếu bệnh nhân được biết là người mang MRSA, vancomycin có thể được chỉ định. Nếu ruột đã bị mở, các sinh vật Gram âm (ví dụ: Enterobacteriaceae) và vi khuẩn kỵ khí có khả năng và một phác đồ kháng sinh được chọn để bao gồm cả những vi khuẩn này. Thiết bị xét nghiệm tại chỗ (Point-of-care equipment) đang cải thiện nhanh chóng, hứa hẹn nhận dạng nhanh chóng và đáng tin cậy các sinh vật gây bệnh bên ngoài phòng xét nghiệm và gần bệnh nhân.
BẢNG 3.1: Các nhiễm khuẩn ngoại khoa chính, nguyên nhân vi sinh vật thường gặp và liệu pháp theo kinh nghiệm
| Tình trạng lâm sàng | Mầm bệnh thường gặp | Kháng sinh thường dùng |
|---|---|---|
| Đường tiêu hóa | ||
| Viêm dạ dày-ruột | Vi khuẩn:
Salmonella Shigella và các loại khác Campylobacter |
Thường không cần dùng kháng sinh.
Nếu nặng hoặc kéo dài 48 giờ, cân nhắc: ciprofloxacin hoặc clarithromycin |
| Virus:
Norovirus Adenovirus Rotavirus |
Điều trị hỗ trợ | |
| Liên quan đến du lịch:
Entamoeba histolytica |
Metronidazole | |
| Viêm đại tràng giả mạc (mắc phải tại bệnh viện) | Clostridium difficile | Vancomycin tiêm tĩnh mạch hoặc uống (uống) Fidaxomicin |
| Viêm phúc mạc
Đường mật |
Enterobacteriaceae
E. coli Klebsiella spp. Vi khuẩn kỵ khí Bacteroides spp. Clostridium spp. Enterococcus spp. Pseudomonas spp. |
Co-amoxiclav +/- gentamicin (ciprofloxacin + metronidazole cho dị ứng penicillin) hoặc amoxicillin + gentamicin + metronidazole
Piperacillin-tazobactam (cho Ps. aeruginosa) |
| Thủng thực quản | Candida albicans và
Enterobacteriaceae |
Fluconazole + co-amoxiclav |
| Nhiễm khuẩn bề mặt và vết mổ | ||
| Áp-xe vú hoặc viêm vú | Staphylococcus aureus | Flucloxacillin hoặc clarithromycin. |
| Nhọt cụm (Carbuncle), bệnh nhọt (furunculosis) | Staphylococcus aureus | Tránh kháng sinh trừ khi có dấu hiệu nhiễm khuẩn toàn thân
Flucloxacillin hoặc clarithromycin Nếu tái phát, cân nhắc kem bôi mũi mupirocin và cân nhắc xét nghiệm độc tố PVL |
| Viêm mô tế bào (Cellulitis) | Staphylococcus aureus, Streptococcus pyogenes (Liên cầu nhóm A) | Flucloxacillin hoặc clarithromycin. Nếu đái tháo đường, thêm ciprofloxacin hoặc gentamicin |
| Hoại thư sinh hơi (Gas gangrene) | Clostridium perfringens và các loài khác
Bacteroides spp. và các vi khuẩn kỵ khí khác Coliforms |
Phẫu thuật là cần thiết
Benzylpenicillin + clindamycin |
| Vết mổ nhiễm khuẩn
6-72 giờ
3-7 ngày
>7 ngày |
Streptococcus pyogenes (nhóm A)
Clostridium spp. Staphylococcus aureus Streptococcus pyogenes (nhóm A) Pseudomonas aeruginosa Coliforms |
Phẫu thuật là cần thiết
Co-amoxiclav Co-amoxiclav Dẫn lưu/cắt lọc nếu cần. Kháng sinh nếu nhiễm khuẩn lan rộng |
| Vết thương chấn thương nhiễm khuẩn | Staphylococcus aureus
Streptococcus pyogenes (nhóm A) |
Flucloxacillin hoặc clarithromycin |
| Viêm cân mạc hoại tử (Necrotising fasciitis) | Streptococcus pyogenes (nhóm A)
Nhiễm khuẩn hỗn hợp với vi khuẩn kỵ khí và coliforms |
Phẫu thuật là cần thiết
Piperacillin-tazobactam + clindamycin |
| Vết cắn (mèo, chó, người) | Vi khuẩn kỵ khí
Pasteurella spp. Streptobacillus moniliformis |
Co-amoxiclav hoặc doxycycline (lưu ý: Pasteurella kháng với các macrolide như clarithromycin) |
| Phổi | ||
| Viêm phổi mắc phải tại cộng đồng | Phế cầu (Pneumococcus)
Staphylococcus aureus Chlamydia psittaci Mycoplasma Legionella pneumophila |
Co-amoxiclav + clarithromycin |
| Viêm phổi mắc phải tại bệnh viện | Pseudomonas aeruginosa
Staphylococcus aureus Enterobacteriaceae |
Piperacillin-tazobactam
Meropenem Vancomycin và ciprofloxacin |
| Phẫu thuật thần kinh | Staphylococcus aureus
Tụ cầu coagulase âm tính Hiếm hơn: Pseudomonas aeruginosa Enterobacteriaceae |
Vancomycin
+/- ceftazidime HOẶC meropenem |
| Chỉnh hình | Staphylococcus aureus
Tụ cầu coagulase âm tính |
Vancomycin*
+/- gentamicin |
| Tim mạch – lồng ngực | Staphylococcus aureus
Hiếm hơn: Pseudomonas aeruginosa Enterobacteriaceae |
Vancomycin*
+/- gentamicin |
*Có thể chuyển sang flucloxacillin sau khi có kết quả xét nghiệm độ nhạy cảm. co-amoxiclav, kết hợp Amoxicillin-clavulanate; PVL, Panton-Valentine leucocidin.
Liệu pháp kháng sinh đặc hiệu
Khi có kết quả vi sinh, liệu pháp được điều chỉnh để đối phó với các sinh vật và độ nhạy cảm của chúng. Liệu pháp ‘phổ hẹp’ (Narrow-spectrum) hiệu quả hơn và có ít tác dụng phụ hơn so với liệu pháp ‘theo kinh nghiệm’ phổ rộng. Nó cũng giảm thiểu bội nhiễm (superinfection) với các sinh vật, chẳng hạn như C. difficile và nấm men. Nhiễm khuẩn C. difficile đã trở thành một tai họa lớn của các bệnh viện ở Bắc Mỹ và Châu Âu, chủ yếu do dân số già hóa dễ bị nhiễm khuẩn hơn và sự xuất hiện của một dòng (clone) có độc lực cao. Các biện pháp cực đoan để kiểm soát sự lây lan của nó đã được yêu cầu bao gồm cách ly nghiêm ngặt bệnh nhân, làm sạch môi trường ở mức độ cao và kiểm soát kháng sinh nghiêm ngặt.
Hỗ trợ dinh dưỡng
Nhiễm khuẩn nặng và nhiễm khuẩn huyết dẫn đến dị hoá (catabolism) nghiêm trọng, thường liên quan đến giảm albumin máu (hypoalbuminaemia) và suy dinh dưỡng. Trong những trường hợp này, hỗ trợ dinh dưỡng như cho ăn qua ống thông mũi-dạ dày hoặc (hiếm khi) dinh dưỡng ngoài đường tiêu hóa (parenteral nutrition) có thể là thích hợp.
VI KHUẨN CÓ TẦM QUAN TRỌNG ĐẶC BIỆT TRONG NGOẠI KHOA
Tụ cầu (Staphylococci)
Sinh lý bệnh
Tụ cầu là các cầu khuẩn Gram dương (gram-positive cocci) xuất hiện thành cụm giống như chùm nho. Staph. aureus là loài gây bệnh chính. Nó là một phần của hệ vi khuẩn bình thường của con người, với khoảng 30% dân số là người mang mầm bệnh ở mũi và 10% mang nó trên da vùng đáy chậu. Staph. aureus thường gây ra mụn mủ (pustules), nhọt (boils), áp-xe vú, nhiễm khuẩn vết mổ và viêm xương tủy. Chúng có khả năng gây vãng khuẩn huyết và hiện là nguyên nhân phổ biến nhất của viêm nội tâm mạc nhiễm khuẩn (infective endocarditis). Chúng cũng có thể gây viêm phổi ở bệnh nhân thở máy hoặc sau nhiễm virus (ví dụ: sau cúm). Độc lực của chúng một phần là do các enzyme và độc tố mà chúng tạo ra. Tất cả các tụ cầu đều sản xuất catalase, một enzyme phá hủy hydro peroxide. Bạch cầu trung tính thường sử dụng hydro peroxide để tiêu diệt vi khuẩn vì vậy tụ cầu tương đối kháng với hình thức tấn công miễn dịch này. Một số ít bệnh nhân mang các chủng độc lực cao sản xuất độc tố hội chứng sốc nhiễm độc (Toxic Shock Syndrome Toxin – TSST-1). Độc tố này có các tác dụng toàn thân nghiêm trọng, chẳng hạn như hạ huyết áp, sốc và suy đa cơ quan (Multiorgan Failure – MOF). Một độc tố quan trọng khác là Panton-Valentine leucocidin (PVL). Độc tố này có khả năng phá hủy bạch cầu, vì vậy các tụ cầu mang độc tố này cũng tương đối kháng với sự tấn công của bạch cầu trung tính. Các chủng Staph. aureus sản xuất PVL thường biểu hiện bằng nhọt và áp-xe tái phát hoặc viêm phổi hoại tử (necrotising pneumonia).
Các tụ cầu coagulase âm tính (Coagulase-negative staphylococci) (ví dụ: Staph. epidermidis) thường là vi khuẩn hội sinh trên da. Chúng hiếm khi gây nhiễm khuẩn đáng kể nhưng gây ra các vấn đề nghiêm trọng khi các vật liệu ngoại sinh bị nhiễm khuẩn. Điều này bao gồm các bộ phận cấy ghép giả (ví dụ: thay khớp háng và van tim) nơi điều trị nhiễm khuẩn thường đòi hỏi bước đi quan trọng là tháo bỏ bộ phận cấy ghép và cả các ống thông tĩnh mạch trung ương dài ngày (long-line intravenous catheters).
Một số chủng Staphylococcus, bao gồm MRSA, có thể truyền từ bệnh nhân này sang bệnh nhân khác qua bàn tay của nhân viên y tế nếu việc rửa tay kỹ lưỡng không được thực hiện sau mỗi lần tiếp xúc với bệnh nhân. Điều này đáng để nhắc lại lời khuyên.
Độ nhạy cảm với kháng sinh
Hầu hết các chủng Staphylococcus từng nhạy cảm với penicillin nhưng >90% hiện đã kháng. Sự đề kháng phần lớn là do việc sản xuất enzyme beta-lactamase (còn được gọi là penicillinase). Hầu hết các chủng vẫn nhạy cảm với một loạt các kháng sinh thông thường, ví dụ, flucloxacillin, erythromycin và một số cephalosporin. Gentamicin thường cũng giữ được hoạt tính.
MRSA (Staphylococcus Aureus kháng Methicillin)
Một số chủng Staph. aureus kháng với flucloxacillin, co-amoxiclav và các cephalosporin; đây là MRSA. Methicillin đã được sử dụng trong phòng xét nghiệm để dự đoán sự kháng flucloxacillin. Những sinh vật này thường cũng kháng với các macrolide (ví dụ: clarithromycin) và fluoroquinolone (ví dụ: ciprofloxacin). MRSA chiếm 40% tổng số các chủng Staph. aureus phân lập được trong các bệnh viện vào những năm 1990/2000, nhưng con số này đã giảm đáng kể sau các can thiệp kiểm soát nhiễm khuẩn chuyên sâu. Các khu vực khoa phòng có nguy cơ cao nhất là các đơn vị bỏng, đơn vị chăm sóc tích cực (Intensive Care Units – ICUs) và các khoa tim-lồng ngực, sơ sinh, chỉnh hình và chăm sóc người lớn tuổi. Công chúng thường lầm tưởng rằng MRSA có khả năng gây bệnh cao hơn các chủng khác. Trên thực tế, các sinh vật này kích thích các đáp ứng viêm tương tự, nhưng nhiễm khuẩn MRSA khó điều trị hơn. Các glycopeptide (ví dụ: vancomycin và teicoplanin), daptomycin, dalbavancin, linezolid, tetracycline, co-trimoxazole hoặc sự kết hợp của rifampicin và axit fusidic vẫn giữ được hoạt tính chống lại hầu hết các chủng; sự kết hợp này ngăn ngừa sự phát triển nhanh chóng của đề kháng với từng tác nhân riêng lẻ.
Một diễn biến đáng lo ngại là sự xuất hiện của Staph. aureus không nhạy cảm với vancomycin (Vancomycin-Insensitive Staph. aureus – VISA). Phải tránh sử dụng vancomycin không phù hợp để ngăn ngừa sự chọn lọc các đột biến như vậy.
Liên cầu (Streptococci)
Sinh lý bệnh
Liên cầu là các cầu khuẩn Gram dương xuất hiện thành chuỗi. Chúng được Billroth mô tả lần đầu tiên trong các vết thương phẫu thuật bị nhiễm khuẩn vào năm 1874. Liên cầu được phân loại theo yêu cầu oxy của chúng thành hiếu khí (aerobic), kỵ khí (anaerobic) và vi hiếu khí (microaerophilic) và được phân nhóm nhỏ theo kiểu tan máu (haemolysis) của chúng trên đĩa thạch máu. Chúng không biểu hiện enzyme catalase. Các liên cầu tan máu alpha (Alpha-haemolytic streptococci) gây tan máu một phần trên đĩa thạch máu với sự đổi màu xanh lá cây; các mầm bệnh quan trọng bao gồm nhóm viridans và Streptococcus pneumoniae. Các liên cầu tan máu beta (Beta-haemolytic streptococci) tạo ra sự tan máu hoàn toàn (trong suốt) trên đĩa thạch máu và có thể được phân nhóm huyết thanh học thành các nhóm Lancefield từ A đến O. Các mầm bệnh quan trọng ở người là nhóm A (Strep. pyogenes có tầm quan trọng lớn trong phẫu thuật) và nhóm B (Strep. agalactiae là nguyên nhân phổ biến gây nhiễm khuẩn huyết sơ sinh nghiêm trọng). Liên cầu nhóm C và G là nguyên nhân không thường xuyên gây viêm mô tế bào và vãng khuẩn huyết. Các liên cầu vi hiếu khí, chẳng hạn như Strep. milleri, mang kháng nguyên nhóm F.
Các liên cầu có ý nghĩa đặc biệt trong ngoại khoa
Streptococcus pyogenes (Liên cầu nhóm A và các liên cầu tan máu beta khác)
Đây là vi khuẩn Streptococcus gây bệnh chính ở người và được mang ở đường hô hấp trên bởi khoảng 10% trẻ em nhưng ít thường xuyên hơn ở người lớn. Nó có thể gây viêm mô tế bào (cellulitis) và là nguyên nhân phổ biến gây đau họng cũng như các hội chứng sau nhiễm liên cầu (post-streptococcal syndromes), chẳng hạn như sốt thấp khớp (rheumatic fever) (dẫn đến tổn thương van tim và nguy cơ viêm nội tâm mạc nhiễm khuẩn). Các đợt bùng phát thường xuyên xảy ra.
Viêm mô tế bào cấp là một nhiễm khuẩn lan rộng tại chỗ của lớp bì và hạ bì, được tạo điều kiện bởi việc sản xuất hyaluronidase và streptokinase. Trong các nhiễm khuẩn ở chi, các sinh vật dẫn lưu về các hạch bạch huyết có thể tạo ra tình trạng viêm quanh bạch huyết và các vệt đỏ đau dọc theo chi, tức là viêm bạch mạch (lymphangitis). Các hạch trong vùng phản ứng mạnh mẽ, trở nên to, đau và ấn đau. Đây là viêm hạch bạch huyết (lymphadenitis). Cả hai cũng có thể xảy ra trong các nhiễm khuẩn do tụ cầu (Hình 3.1).
Các chủng Strep. pyogenes xâm lấn mạnh có thể gây viêm cân mạc hoại tử (necrotising fasciitis), một nhiễm khuẩn nằm sâu ở mô dưới da, phá hủy nhanh chóng và tiến triển cân mạc và mỡ. Các ngoại độc tố (exotoxins) do một số chủng nhất định sản xuất có thể dẫn đến hội chứng sốc nhiễm độc do liên cầu (streptococcal toxic shock syndrome) đe dọa tính mạng, với nhiễm khuẩn mô mềm tối cấp, sốc, hội chứng suy hô hấp cấp tính (Acute Respiratory Distress Syndrome – ARDS) và suy thận; 30%–70% bệnh nhân tử vong bất chấp các phương pháp điều trị hiện đại tích cực.
Liên cầu Viridans
Nhóm viridans là vi khuẩn hội sinh trong miệng có độc lực thấp nhưng có khả năng gây viêm nội tâm mạc nhiễm khuẩn.
Streptococcus pneumoniae (phế cầu – pneumococcus)
Đây là nguyên nhân phổ biến nhất gây viêm phổi thùy (lobar pneumonia) và có thể gây viêm phế quản phổi ở những bệnh nhân sau phẫu thuật dễ bị tổn thương, cũng như nhiễm khuẩn tai giữa (viêm tai giữa – otitis media), viêm xoang (sinusitis) và các đợt cấp của viêm phế quản mạn tính. Viêm màng não do phế cầu (Pneumococcal meningitis) có thể xảy ra ở người trẻ và người lớn tuổi và có thể là biến chứng của chấn thương đầu. Nhiễm khuẩn huyết nặng do phế cầu đặc biệt có khả năng xảy ra sau khi cắt lách (splenectomy) nhưng có thể được ngăn ngừa bằng cách tiêm phòng theo kế hoạch và dự phòng bằng penicillin.
Các liên cầu khác
Nhiều vi khuẩn trong nhóm Strep. milleri có yêu cầu nuôi cấy vi hiếu khí. Chúng thường được tìm thấy trong các ổ áp-xe ở vùng ruột thừa, gan, phổi và não. Strep. gallolyticus (trước đây là Strep. bovis) thường được nhóm vào Nhóm Lancefield D và có liên quan đến viêm nội tâm mạc và ung thư đại trực tràng (CRC). Vẫn chưa biết liệu mối liên quan với CRC là nguyên nhân hay cơ hội.
Liên cầu kỵ khí (Anaerobic streptococci)
Đây là vi khuẩn hội sinh trong ruột và có thể tạo thành một phần của hệ vi khuẩn hỗn hợp trong các ổ áp-xe trong phúc mạc hoặc các nhiễm khuẩn liên quan đến mô hoại tử, ví dụ, loét bàn chân đái tháo đường.
Độ nhạy cảm với kháng sinh
Penicillin vẫn là thuốc được lựa chọn cho hầu hết các nhiễm khuẩn do liên cầu. Ở những bệnh nhân bị bệnh nặng, benzylpenicillin được dùng qua đường tiêm. Đối với các nhiễm khuẩn ít nghiêm trọng hơn ở những bệnh nhân có thể dung nạp liệu pháp đường uống, penicillin V (phenoxymethylpenicillin) hoặc amoxicillin là thuốc được lựa chọn. Nhiều liên cầu cũng nhạy cảm với các macrolide (ví dụ: erythromycin và clarithromycin). Một số phế cầu hiện đã kháng một phần với penicillin; hầu hết các nhiễm khuẩn như vậy vẫn có thể được điều trị sạch bằng benzylpenicillin liều cao, nhưng viêm màng não cần các kháng sinh thay thế như ceftriaxone hoặc vancomycin.
Cầu khuẩn đường ruột (Enterococci)
Sinh lý bệnh
Enterococci là các cầu khuẩn Gram dương có liên quan chặt chẽ với liên cầu. Enterococcus faecalis và E. faecium là các loài được xác định phổ biến nhất. Enterococci là một phần của hệ vi khuẩn đường ruột bình thường và có thể gây nhiễm khuẩn khi ruột đã bị mở hoặc nhiễm khuẩn đường tiết niệu, đường mật hoặc đường sinh dục. Chúng cũng có khả năng gây viêm nội tâm mạc nhiễm khuẩn.
Độ nhạy cảm với kháng sinh
Penicillin, amoxicillin và vancomycin có hoạt tính chống lại E. faecalis trong khi E. faecium kháng với penicillin và amoxicillin (và do đó cũng kháng với piperacillin-tazobactam và các carbapenem như meropenem). Trong các nhiễm khuẩn nghiêm trọng như viêm nội tâm mạc, sự kết hợp của benzylpenicillin liều cao và gentamicin đảm bảo hoạt tính diệt khuẩn. Các cephalosporin và fluoroquinolone đều không hiệu quả. Trong các bệnh viện nơi các cephalosporin phổ rộng được sử dụng theo kinh nghiệm cho các nhiễm khuẩn liên quan đến ruột hoặc nhiễm khuẩn huyết, enterococci là nguyên nhân thường xuyên gây nhiễm khuẩn bệnh viện (nosocomial). Các VRE (Enterococci kháng Vancomycin) ngày càng được tìm thấy nhiều hơn. Chúng thường là các mầm bệnh cấp độ thấp lây nhiễm vào các đường truyền nội mạch ở bệnh nhân cấy ghép và huyết học và trong các ICU. Viêm nội tâm mạc do VRE rất khó điều trị, nhưng các kháng sinh mới hơn như linezolid, daptomycin và tigecycline có hoạt tính chống lại hầu hết các chủng.
Họ vi khuẩn đường ruột (Enterobacteriaceae)
Sinh lý bệnh
Enterobacteriaceae là một họ lớn gồm các trực khuẩn Gram âm (gram-negative bacilli – rods) và thường chiếm khoảng 1% hệ vi khuẩn đường ruột (xem Bảng 3.2); chúng được gọi là coliforms và có thể được nuôi cấy trong điều kiện hiếu khí và kỵ khí và, giống như các hệ vi khuẩn đường ruột khác, phát triển trong môi trường chứa muối mật như thạch MacConkey; điều này giúp nhận dạng.
Các nhiễm khuẩn có tầm quan trọng trong phẫu thuật thường là cơ hội, với vi khuẩn bắt nguồn từ ruột của bệnh nhân. Nhiễm khuẩn là kết quả của sự ô nhiễm trực tiếp (ruột bị thủng hoặc bị mở do phẫu thuật), lây lan ở đáy chậu (đến các vết thương gần đó hoặc đường tiết niệu) hoặc lây lan theo đường máu. Những sinh vật Gram âm này và các sinh vật Gram âm khác chứa đường lipopolysaccharide (LPS), một chất kích thích mạnh mẽ của viêm và sản xuất cytokine TNF-alpha và IL1 bởi các đại thực bào.
E. coli là mầm bệnh phổ biến nhất trong nhóm và gây ra nhiều nhiễm khuẩn ngoại khoa, thường là hiệp đồng với các vi khuẩn khác. E. coli gây nhiễm khuẩn huyết Gram âm và khoảng 80% các trường hợp nhiễm khuẩn đường tiết niệu. Viêm phế quản phổi do Enterobacteriaceae thỉnh thoảng xảy ra ở những bệnh nhân suy nhược, ức chế miễn dịch hoặc bị bệnh nặng. Klebsiella, Enterobacter và Serratia được tìm thấy thường xuyên hơn trong các nhiễm khuẩn vết mổ liên quan đến ruột. Proteus là nguyên nhân phổ biến gây nhiễm khuẩn đường tiết niệu nhưng thỉnh thoảng gây ra các nhiễm khuẩn ngoại khoa khác, thường bắt nguồn từ đường tiết niệu. Các loài Proteus có khả năng sản xuất enzyme urease, enzyme này phânще urê. Điều này làm tăng độ pH của nước tiểu, tạo điều kiện cho sỏi thận có thể hình thành. Những viên sỏi này sau đó có thể trở thành một ổ cho các nhiễm khuẩn tiếp theo.
BẢNG 3.2: Vi khuẩn thuộc họ Enterobacteriaceae
| Nhóm | Sinh vật | Nhiễm khuẩn lâm sàng |
|---|---|---|
| Mầm bệnh đường ruột nguyên phát | Salmonella (ví dụ: S. typhi, S. enteritidis)
Shigella (ví dụ: S. dysenteriae, S. sonnei) Một số chủng Escherichia coli (ví dụ: O157:H7) |
– Sốt thương hàn – Viêm dạ dày – ruột – Lỵ – Tiêu chảy của khách du lịch – Hội chứng tan máu – urê huyết |
| Vi khuẩn thường trú ở ruột có thể gây nhiễm khuẩn | Escherichia coli Klebsiella pneumoniae Proteus spp. Enterobacter spp. Citrobacter spp. Morganella spp. |
– Viêm phúc mạc và áp-xe trong phúc mạc (thường phối hợp với vi khuẩn kỵ khí) – Nhiễm khuẩn đường tiết niệu – Viêm đường mật tăng dần – Nhiễm khuẩn bệnh viện (sau thủ thuật, ống thông tĩnh mạch trung ương, viêm phổi trong chăm sóc tích cực) |
| Vi khuẩn thường trú ở ruột hiếm khi gây nhiễm khuẩn | Enterobacter spp. Serratia spp. Morganella spp. Citrobacter spp. |
– Thường là nhiễm khuẩn bệnh viện (sau thủ thuật, ống thông tĩnh mạch trung ương, trong chăm sóc tích cực) |
Độ nhạy cảm với kháng sinh
Nhiều coliforms hiện đã kháng với amoxicillin và các cephalosporin thế hệ đầu tiên (ví dụ: cephalexin) nhưng hầu hết đều nhạy cảm với các cephalosporin thế hệ thứ hai và thứ ba (ví dụ: cefuroxime và cefotaxime/ceftriaxone). Gentamicin vẫn là một tác nhân rất hiệu quả. Nhiều loại nhạy cảm với các fluoroquinolone (ciprofloxacin, levofloxacin, và moxifloxacin) nhưng sự đề kháng đang xuất hiện. Để dự phòng trong phẫu thuật đường ruột và đường mật và cho các nhiễm khuẩn tại chỗ và toàn thân liên quan, gentamicin hoặc sự kết hợp amoxicillin-clavulanate (co-amoxiclav) được khuyến nghị vì hoạt tính kỵ khí bổ sung của nó. Các kháng sinh kết hợp beta-lactam và chất ức chế beta-lactamase, chẳng hạn như co-amoxiclav hoặc piperacillin-tazobactam rất có hoạt tính chống lại hệ vi khuẩn đường ruột và có hoạt tính tốt chống lại vi khuẩn kỵ khí. Vi khuẩn kỵ khí là những sinh vật chiếm ưu thế chính của ruột và thường đi kèm với Enterobacteriaceae trong các nhiễm khuẩn.
Các chủng Enterobacteriaceae kháng thuốc thường xuyên hơn nhiều ở các bệnh viện (thường ở các ICU) so với trong cộng đồng. Chúng thường gây nhiễm khuẩn đường tiết niệu ở những bệnh nhân được đặt ống thông sau các đợt dùng kháng sinh lặp đi lặp lại. Các chủng E. coli và Klebsiella spp. đa kháng thuốc đã xuất hiện trong các bệnh viện trên toàn thế giới từ những năm 1980 và hiện đã phổ biến trong các cơ sở cộng đồng. Một số Enterobacteriaceae sản xuất enzyme beta-lactamase phổ rộng (Extended-Spectrum Beta-Lactamase – ESBL) được mã hóa trên một plasmid có khả năng lây truyền cao. ESBL phá hủy các cephalosporin thế hệ thứ hai và thứ ba và thường kháng với các quinolone, trimethoprim và hầu hết các aminoglycoside. Điều này hạn chế nghiêm trọng số lượng kháng sinh có hoạt tính. Nhiễm khuẩn đường tiết niệu do Enterobacteriaceae sản xuất ESBL có thể được điều trị bằng nitrofurantoin, pivmecillinam hoặc fosfomycin nhưng các nhiễm khuẩn toàn thân (ví dụ: vãng khuẩn huyết) đòi hỏi điều trị bằng các carbapenem (meropenem, imipenem, và ertapenem), temocillin hoặc amikacin.
Các carbapenem có phổ rất rộng nhưng phải được dùng qua đường tiêm. Việc sử dụng trong bệnh viện bị hạn chế để ngăn ngừa sự phát triển của đề kháng. Sự xuất hiện của Enterobacteriaceae sinh carbapenemase (Carbapenemase Producing Enterobacteriaceae – CPE) trong đó có một số loại khác nhau (KPC, OXA-48, VIM, IMP và NDM) là một vấn đề ngày càng tăng, vì điều trị phần lớn bị giới hạn trong các kháng sinh cũ và độc hại như colistin (mặc dù sự đề kháng với colistin hiện cũng đang xuất hiện). Một số CPE thậm chí còn kháng với các kháng sinh được giới thiệu gần đây như ceftolozane-tazobactam hoặc ceftazidime-avibactam. CPE, giống như ESBL, cũng lây lan qua các plasmid và do đó dễ dàng lây truyền. Một số quốc gia có tỷ lệ CPE rất cao gây ra các nhiễm khuẩn nghiêm trọng và có tỷ lệ tử vong cao. Vi khuẩn kháng thuốc hiện đã lan rộng khắp thế giới và đặt ra mối đe dọa nhiễm khuẩn lớn nhất hiện nay cho bệnh nhân trong bệnh viện.
Enterobacteriaceae ‘không liên quan phẫu thuật’
Các thành viên khác của họ gây nhiễm khuẩn đường ruột nguyên phát. Salmonella typhi gây bệnh thương hàn, có thể gây thủng ruột và Shigella gây lỵ trực khuẩn (bacillary dysentery). Hiếm khi, Salmonella bị quy kết trong viêm ruột thừa cấp và phình động mạch ‘do nấm’ (mycotic’ aneurysms) nguyên phát. Một nguyên nhân ngày càng quan trọng của viêm đại tràng xuất huyết cấp là E. coli O157:H7 và các vi khuẩn E. coli sản xuất verotoxin khác. Bệnh này không thể phân biệt được với viêm loét đại tràng xuất huyết cấp và cần được tìm kiếm về mặt vi khuẩn học trong tất cả các trường hợp. Những chủng này cũng đã gây ra các vụ dịch lớn về bệnh do thực phẩm và sản xuất một verotoxin (độc tố giống Shiga) chịu trách nhiệm cho hội chứng tan máu-urê huyết (haemolytic uraemic syndrome) dẫn đến suy thận cấp. Yersinia đôi khi tạo ra một tình trạng viêm hồi tràng cấp tính có thể giống viêm ruột thừa cấp và có biểu hiện tương tự như bệnh Crohn khi mở bụng thăm dò (laparotomy).
Campylobacter jejuni, nguyên nhân phổ biến nhất gây nhiễm khuẩn do thực phẩm, cũng có thể gây ‘viêm ruột thừa giả’ (pseudo-appendicitis) bằng cách khởi phát viêm hồi tràng đoạn cuối (terminal ileitis) và viêm hạch bạch huyết mạc treo (mesenteric lymph node inflammation).
Pseudomonas
Sinh lý bệnh
Mầm bệnh chính trong nhóm trực khuẩn Gram âm hiếu khí này là Pseudomonas aeruginosa, một nguyên nhân không phổ biến gây nhiễm khuẩn ngoại khoa ngoại trừ ở những bệnh nhân suy nhược, nhập viện. Nó được tìm thấy trong nhiều loại môi trường sống bao gồm đất, nước, thực vật và động vật, phản ánh sở thích của nó đối với môi trường ẩm ướt. Nó thường được tìm thấy trên các thiết bị bệnh viện và làm sạch và ngay cả trong các chất khử trùng và sát trùng hóa học. Ps. aeruginosa là một vi khuẩn hội sinh đường ruột bình thường ở khoảng 10% dân số và chủ yếu là mầm bệnh trong bệnh viện (bệnh viện). Sinh vật này kháng với nhiều loại kháng sinh và do đó có xu hướng tăng sinh khi các hệ vi khuẩn khác bị ức chế bởi kháng sinh phổ rộng.
Pseudomonas là một sinh vật khuẩn lạc phổ biến trong các vết thương lâu ngày như gãy xương hở, loét chân mạn tính và các ống thông tiểu lưu, nhưng sự hiện diện của nó không phải lúc nào cũng có ý nghĩa lâm sàng. Trong các vết thương và vết loét, nó có thể được nhận ra bởi dịch tiết màu xanh lam-lục đặc trưng. Nó tạo khuẩn lạc trên các vết bỏng và có thể trở thành mầm bệnh ở những bệnh nhân bị bỏng rộng, dẫn đến nhiễm khuẩn huyết gây tử vong. Nhiễm khuẩn Pseudomonas có thể nghiêm trọng trong phẫu thuật nhãn khoa và có thể dẫn đến mất mắt bị nhiễm khuẩn và thường chịu trách nhiệm cho các nhiễm khuẩn tai ngoài (viêm tai ngoài – otitis externa) mạn tính và tái phát. Cuối cùng, Ps. aeruginosa có thể chịu trách nhiệm cho các bệnh viêm phổi mắc phải tại bệnh viện ở những bệnh nhân thở máy hoặc cho nhiễm khuẩn huyết toàn thân gây tử vong ở những bệnh nhân giai đoạn cuối.
Độ nhạy cảm với kháng sinh
Nhiễm khuẩn thực sự phải luôn được phân biệt với khuẩn lạc, nơi mà việc điều trị không được chỉ định và sẽ khuyến khích sự phát triển của đề kháng. Ps. aeruginosa vốn đã kháng với hầu hết các loại kháng sinh; những loại có hoạt tính bao gồm các aminoglycoside (gentamicin, amikacin và tobramycin), một số kháng sinh beta-lactam phổ mở rộng—ceftazidime, cefepime, ceftolozane-tazobactam (nhưng lưu ý rằng ceftriaxone không có hoạt tính chống lại Ps. aeruginosa), piperacillin-tazobactam và các carbapenem (imipenem hoặc meropenem; lưu ý rằng ertapenem, một carbapenem dùng một lần mỗi ngày, không có hoạt tính chống lại Ps. aeruginosa). Các quinolone, ciprofloxacin và ofloxacin, là những tác nhân chống Pseudomonas duy nhất có hiệu quả qua đường uống.
Acinetobacter
Đây là các trực khuẩn cầu (coccobacilli) Gram âm, hiếu khí nghiêm ngặt, không lên men và thường không gây bệnh cho những người khỏe mạnh. Tầm quan trọng của chúng nằm ở việc gây nhiễm khuẩn ở những bệnh nhân dễ bị tổn thương, đặc biệt là trong các ICU và các đơn vị bỏng, và tỷ lệ kháng kháng sinh nội tại cao của chúng bao gồm cả các carbapenem; các lựa chọn điều trị thường bị giới hạn trong amikacin, tigecycline hoặc colistin. Loài được xác định phổ biến nhất là Acinetobacter baumanii.
Vi khuẩn kỵ khí (Anaerobes)
Vi khuẩn kỵ khí (Anaerobic bacteria) tạo thành một phần chính của hệ vi khuẩn đường tiêu hóa, vượt trội hơn E. coli và các coliforms liên quan từ 1000 đến 1. Nhiều bộ phận của cơ thể bị khuẩn lạc bởi vi khuẩn kỵ khí, ngay cả những bộ phận tiếp xúc với không khí, bao gồm da, miệng, đường hô hấp trên, cơ quan sinh dục ngoài và âm đạo. Những sinh vật khuẩn lạc này trở nên quan trọng trong phẫu thuật vì chúng phá vỡ các hàng rào giải phẫu để cho phép ô nhiễm và nhiễm khuẩn. Các yếu tố quan trọng khác thúc đẩy sự phát triển của vi khuẩn kỵ khí bao gồm tắc ruột, phá hủy mô và thiếu oxy (như trong bỏng và suy mạch máu), và các dị vật. Nhiễm khuẩn kỵ khí có thể đe dọa tính mạng và thường cần phải quản lý phẫu thuật. Một số vi khuẩn kỵ khí gây ra các bệnh liên quan đến độc tố bao gồm uốn ván. Các vi khuẩn kỵ khí thường gặp nhất là:
- Trực khuẩn Gram âm—Bacteroides fragilis và các loài Bacteroides (spp.) khác, Porphyromonas spp., Prevotella spp., Fusobacterium spp. và Bilophila wadsworthia
- Cầu khuẩn Gram dương—Peptostreptococcus và liên cầu vi hiếu khí
- Trực khuẩn Gram dương—Clostridium spp. (sinh nha bào – spore forming), Actinomyces spp., Propionibacterium spp. và Bifidobacterium spp.
Độ nhạy cảm với kháng sinh
Hầu hết các vi khuẩn kỵ khí đều rất nhạy cảm với metronidazole. Metronidazole có thể được dùng qua đường uống, tiêm tĩnh mạch hoặc trực tràng, với đường trực tràng dẫn đến nồng độ trong huyết tương tương đương với đường tiêm tĩnh mạch. Metronidazole là kháng sinh dự phòng tiêu chuẩn trước khi cắt ruột thừa và phẫu thuật đại tràng và đã làm giảm đáng kể các nhiễm khuẩn phúc mạc và vết mổ. Các kháng sinh khác có hoạt tính kỵ khí rộng là co-amoxiclav, piperacillin/tazobactam (Tazocin), clindamycin, tigecycline, các carbapenem (imipenem và meropenem) và chloramphenicol. Những loại này thường không cần phải được dùng thêm cùng với metronidazole.
Bacteroides
Sinh lý bệnh
Bacteroides gây nhiễm khuẩn sinh mủ sau khi ô nhiễm phân vào khoang phúc mạc, cùng với các vi khuẩn hội sinh khác trong ruột, và thỉnh thoảng gây nhiễm khuẩn huyết ở những bệnh nhân suy nhược. Bacteroides không được xác định là mầm bệnh cho đến đầu những năm 1970 vì các yêu cầu nuôi cấy kỵ khí nghiêm ngặt của chúng không được công nhận. Thật vậy, các loài Bacteroides có lẽ chịu trách nhiệm cho nhiều cái gọi là áp-xe vô trùng trong ổ bụng. Tầm quan trọng của B. fragilis như là một nguyên nhân gây nhiễm khuẩn ngoại khoa có lẽ vẫn bị đánh giá thấp.
Clostridia
Clostridia là các trực khuẩn Gram dương phân bố rộng rãi trong đất và là vi khuẩn hội sinh trong đường ruột. Clostridia tạo thành các nha bào (spores) kháng với khô, nhiệt và các chất sát trùng và có thể tồn tại trong thời gian dài. Chúng hầu hết là vi khuẩn kỵ khí bắt buộc, chỉ có thể tăng sinh trong điều kiện không có oxy; chúng gây ra phần lớn sự thối rữa và phân hủy vật chất động vật trong tự nhiên. Các tác dụng bệnh lý chính là do các ngoại độc tố (exotoxins) mạnh. Những bệnh có tầm quan trọng trong phẫu thuật là hoại thư sinh hơi, uốn ván và viêm đại tràng giả mạc do C. difficile.
Hoại thư sinh hơi (Gas gangrene)
Hoại thư sinh hơi là kết quả khi Clostridium perfringens (trước đây là C. welchii) và các vi khuẩn kỵ khí khác (ví dụ: Bacteroides spp. và streptococci) tăng sinh trong mô hoại tử, tiết ra các độc tố mạnh gây nhiễm độc toàn thân nghiêm trọng. Các độc tố lây lan nhanh chóng tại chỗ và phá hủy các mô lân cận, tạo ra khí gây ra dấu hiệu đặc trưng là tiếng lép bép (crepitus) khi sờ và hình ảnh X-quang điển hình (xem Hình 3.8). Các vết thương chấn thương sâu liên quan đến cơ và các vết thương bị ô nhiễm đất, quần áo hoặc phân là dễ bị tổn thương nhất. Tình trạng này rất phổ biến trong các vết thương chiến tranh—hoại thư sinh hơi chịu trách nhiệm cho số lượng lớn các ca tử vong trong Chiến tranh thế giới thứ nhất.
Bệnh sử
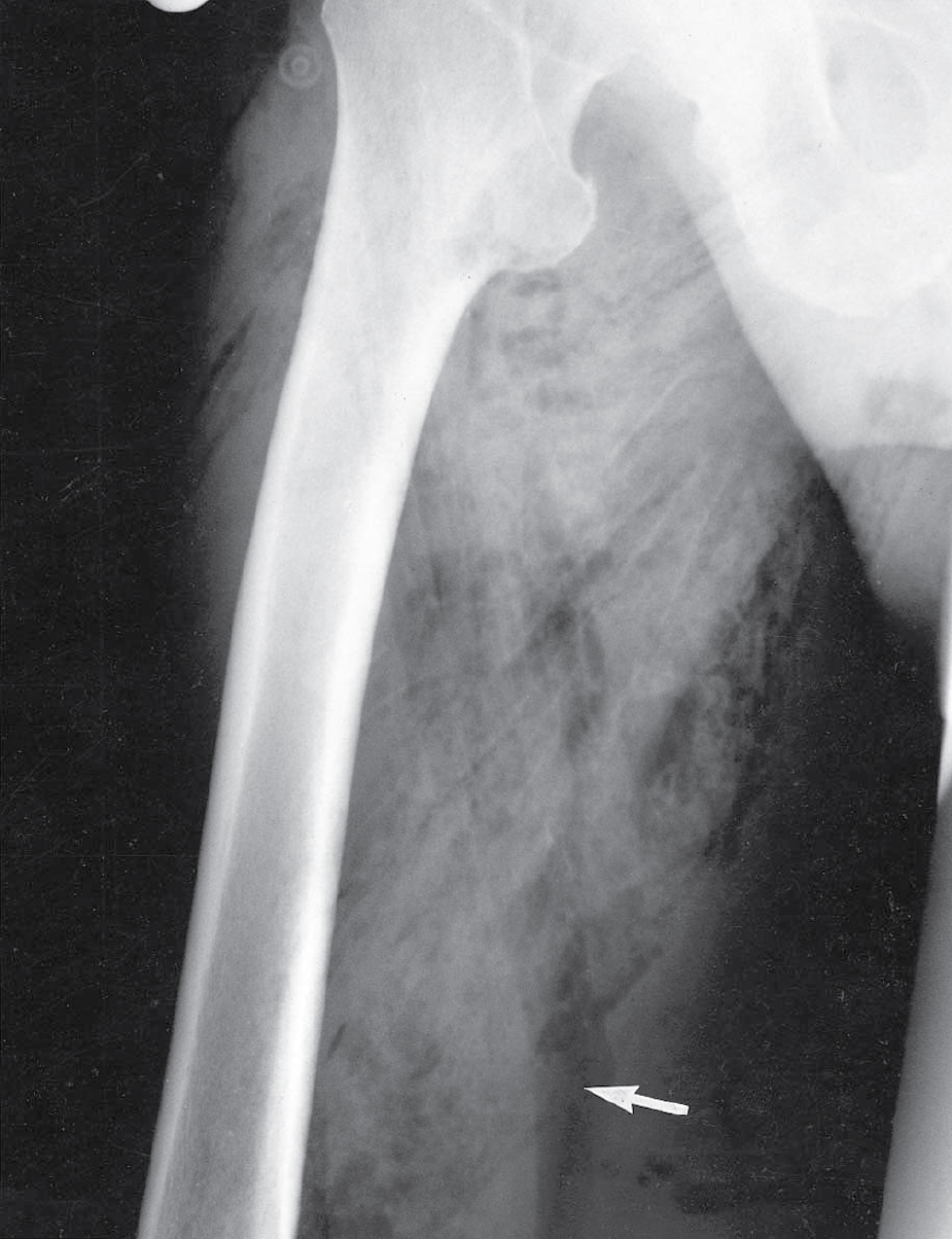
Hình 3.8 Hoại thư sinh hơi. Người đàn ông 46 tuổi này bị các vết rách rộng, bị ô nhiễm ở mặt trong đùi phải (mũi tên) trong một vụ va chạm giao thông đường bộ. Hoại thư sinh hơi đã phát triển, nhanh chóng liên quan đến tất cả các cơ của đùi vì tình trạng này không được nhận ra sớm và mô cơ hoại tử không được cắt bỏ ngay lập tức và hoàn toàn. Lưu ý các vệt bong bóng khí thấu quang (radiolucent) lan rộng dọc theo các mặt phẳng cơ. Bệnh nhân này đã tử vong vì nhiễm độc (toxaemia) mặc dù đã dùng kháng sinh, phẫu thuật và liệu pháp oxy cao áp.
Trong thực hành phẫu thuật, nguy cơ cao nhất của hoại thư sinh hơi là trong các trường hợp cắt cụt chi dưới do thiếu máu cục bộ (do nhiễm khuẩn từ ruột của bệnh nhân) và trong các vết thương do đạn bắn tốc độ cao (từ ruột bị thủng hoặc do ô nhiễm bên ngoài). Hoại thư sinh hơi thỉnh thoảng xảy ra trong các vết mổ khi mô thiếu máu cục bộ bị ô nhiễm bởi hệ vi khuẩn đường ruột. Khu vực hoại tử cơ ban đầu có thể nhỏ. Hoại thư sinh hơi được nhận ra khi da bên trên chuyển sang màu đen và lan rộng với tốc độ đáng báo động. Trong vòng vài giờ, hoại tử bùng phát dọc theo các mặt phẳng cơ. Sau đó, da bị vỡ và một dịch tiết mủ mỏng, có mùi hôi thối rỉ ra. Các độc tố được hấp thụ và gây suy sụp lâm sàng nhanh chóng và tử vong trong vòng 24–48 giờ trừ khi quá trình này có thể được ngăn chặn bằng sự can thiệp kịp thời và mạnh mẽ.
C. perfringens rất nhạy cảm với benzylpenicillin, loại thuốc này nên được dùng dự phòng bằng đường tiêm càng sớm càng tốt sau chấn thương liên quan đến cơ hoặc <1 giờ trước khi cắt cụt chi do thiếu máu cục bộ (metronidazole phù hợp cho bệnh nhân dị ứng với penicillin). Trong phẫu thuật các vết thương bị ô nhiễm, việc ngăn ngừa nhiễm khuẩn clostridial đòi hỏi phải cắt lọc tỉ mỉ tất cả các mô hoại tử, sau đó là nhồi gạc vào vết thương thay vì khâu lại. Có khả năng cần phải cắt lọc thêm, và việc đóng vết thương trì hoãn kỳ đầu (delayed primary closure) được thực hiện khi nguy cơ nhiễm khuẩn đã qua, vài ngày sau đó.
Điều trị hoại thư sinh hơi
Điều trị hoại thư sinh hơi đã hình thành là khẩn cấp và phải tiến hành mạnh mẽ để có bất kỳ hy vọng sống sót nào. Điều trị bằng benzylpenicillin tiêm tĩnh mạch liều cao để tiêu diệt các sinh vật trong mô còn sống và có mạch máu nuôi dưỡng và cắt lọc triệt để khẩn cấp tất cả các mô hoại tử. Điều này liên quan đến việc khoét bỏ mô cơ hoại tử trở lại mô khỏe mạnh đang chảy máu; cơ bị ảnh hưởng được nhận ra bởi màu đỏ gạch của nó và không co lại khi bị cắt. Trong phẫu thuật các vết thương bị ô nhiễm, việc ngăn ngừa nhiễm khuẩn clostridial đòi hỏi phải cắt lọc tỉ mỉ tất cả các mô hoại tử, sau đó là nhồi gạc vào vết thương thay vì khâu lại. Có khả năng cần phải cắt lọc thêm, và việc đóng vết thương trì hoãn kỳ đầu được thực hiện vài ngày sau đó.
Liệu pháp oxy cao áp (Hyperbaric oxygen therapy) có thể làm tăng trương lực oxy trong các mô hoại tử, ức chế sự phát triển của sinh vật. Bệnh nhân được đặt trong buồng cao áp với oxy nguyên chất ở khoảng 3 atmosphere trong vài giờ mỗi ngày. Tuy nhiên, hoại thư sinh hơi vẫn có thể lan rộng, đòi hỏi phải can thiệp phẫu thuật anh hùng hơn nữa. Ngay cả với điều trị tích cực, tiên lượng cho hoại thư sinh hơi đã hình thành vẫn còn ảm đạm.
Uốn ván (Tetanus)
Uốn ván là do Clostridium tetani, cũng lây nhiễm vào các vết thương bẩn. Vết thương xâm nhập có thể rất nhỏ, có lẽ do gai hoa hồng hoặc dằm gỗ gây ra. Sinh vật này tạo ra một ngoại độc tố có ít tác dụng tại chỗ, nhưng ngay cả với số lượng rất nhỏ, nó cũng có tác dụng thần kinh-cơ mạnh mẽ gây co cứng cơ lan rộng. Các dấu hiệu đầu tiên thường là co cứng cơ cấp tính và cứng cổ hoặc khít hàm (trismus – ‘lockjaw’). Nếu không được điều trị, những triệu chứng này tiến triển đến uốn cong lưng (opisthotonus) (do co cứng cơ duỗi), co giật toàn thân và cuối cùng là tử vong do kiệt sức và suy hô hấp vài ngày sau đó.
Uốn ván hiện nay hiếm gặp ở các nước có thu nhập cao do tiêm chủng giải độc tố uốn ván (tetanus toxoid) trong thời thơ ấu, sau đó là các liều tăng cường (boosters) cách nhau 10 năm. Ở Vương quốc Anh, các liều tăng cường không còn cần thiết nếu đã hoàn thành lịch tiêm chủng năm liều ban đầu. Ở Úc và New Zealand, một liều tăng cường duy nhất được khuyến nghị ở những bệnh nhân trong độ tuổi 45–50. Ở các nước phát triển, tỷ lệ mắc uốn ván hàng năm là khoảng một phần triệu và phổ biến nhất sau các chấn thương làm vườn nhỏ ở người lớn tuổi. Nếu tình trạng tiêm chủng sau một chấn thương bị ô nhiễm nặng không rõ, nên dùng benzylpenicillin bao gồm tiêm chủng thụ động với globulin miễn dịch uốn ván (Tetanus Immune Globulin – TIG). Điều trị uốn ván đã hình thành thường đòi hỏi thông khí nhân tạo với thuốc làm liệt cơ, kháng sinh và tiêm chủng thụ động. Cắt lọc vết thương cũng hữu ích cho mục đích chẩn đoán (nuôi cấy và PCR) và điều trị (tức là kiểm soát nguồn). Huyết thanh học uốn ván cũng nên được lấy trước khi tiêm TIG, nếu có thể, cho mục đích chẩn đoán. Tỷ lệ tử vong vẫn còn cao, đặc biệt là ở người lớn tuổi.
Trên toàn cầu, uốn ván sau chấn thương vẫn là một vấn đề lớn. Ở một số nước thu nhập thấp, uốn ván sơ sinh là kết quả của việc áp dụng phân bò làm băng gạc cho gốc rốn.
Viêm đại tràng giả mạc (Pseudomembranous colitis)
Viêm đại tràng giả mạc có thể là dạng nghiêm trọng nhất của tiêu chảy liên quan đến kháng sinh và là do sự phát triển quá mức của C. difficile sinh độc tố. Sinh vật này có tên từ sự khó khăn khi nuôi cấy nó. Nhiễm khuẩn tạo ra một ‘màng’ dày, dạng fibrin trên niêm mạc đại tràng, bên trong đó sinh vật tăng sinh. Độc tố của nó gây tiêu chảy nước nhiều và đôi khi có máu, dẫn đến mất nước và mất điện giải.
Viêm đại tràng giả mạc có thể phát triển chỉ sau một liều duy nhất của bất kỳ loại kháng sinh nào. Các cephalosporin và ciprofloxacin là những kháng sinh thường bị quy kết nhất, nhưng bất kỳ loại kháng sinh nào được sử dụng thường xuyên đều có thể gây ra bệnh này. Chẩn đoán có thể được thực hiện bằng nội soi đại tràng sigma (sigmoidoscopy) và sinh thiết ở 50% bệnh nhân có tổn thương đại tràng bên trái, nhưng hãy coi chừng nguy cơ thủng ruột tăng lên khi lấy sinh thiết từ bệnh nhân bị nhiễm C. difficile đang hoạt động.
Các trường hợp nhiễm khuẩn giả mạc ngày càng được công nhận ở những bệnh nhân sau phẫu thuật cắt toàn bộ đại tràng, và C. difficile nên bị nghi ngờ trong các trường hợp có lượng dịch ra qua lỗ mở thông (stoma output) lớn, không giải thích được và số lượng bạch cầu tăng lên. Chẩn đoán tốt nhất được thực hiện bằng cách phát hiện độc tố đặc hiệu trong phân, thường bằng xét nghiệm kháng nguyên, mặc dù PCR cũng có thể được sử dụng. C. difficile có thể được nuôi cấy từ phân. Tỷ lệ tử vong cao, cũng như tỷ lệ tái phát. Mặc dù sinh vật này nhạy cảm với penicillin, nhưng thuốc này không thể thâm nhập vào giả mạc. Vancomycin đường uống hiện là lựa chọn điều trị và nên được sử dụng nếu nghi ngờ bệnh nặng (gợi ý bởi các dấu hiệu viêm tăng cao, chức năng thận suy giảm, phình đại tràng nhiễm độc – toxic megacolon, và albumin thấp); dạng tiêm tĩnh mạch có thể được đưa qua ống thông trực tràng ở những bệnh nhân không thể dùng thuốc đường uống, đặc biệt là trong ICU. Metronidazole vẫn giữ được hoạt tính nhưng được coi là kém hơn vancomycin trong hầu hết các hướng dẫn. Fidaxomicin gần đây đã được cấp phép cho nhiễm khuẩn C. difficile và dường như có tỷ lệ tái phát thấp hơn so với điều trị truyền thống. Các lựa chọn điều trị khác được giới thiệu gần đây bao gồm bezlotuxumab (một kháng thể đơn dòng đã được chứng minh là làm giảm tái phát) và ghép phân (faecal transplantation) (cũng có thể được sử dụng để điều trị tái phát).
Mycobacteria
Mycobacteria (ví dụ: M. tuberculosis và NTM – vi khuẩn lao không điển hình) như đã mô tả trước đó, đang gia tăng tần suất do tăng cường đi lại và tăng cường ức chế miễn dịch. Chúng nên được coi là ‘kẻ bắt chước vĩ đại’ vì chúng có thể lây nhiễm vào bất kỳ vị trí nào ngoài phổi (ví dụ: hạch bạch huyết, bụng, xương và khớp) và gây ra nhiều tình trạng. Gạc cấy không phải là mẫu thích hợp—sinh thiết thường được yêu cầu (ví dụ: phúc mạc và hạch bạch huyết) và nên yêu cầu cấy TB/NTM. Điều trị kéo dài (tối thiểu 6 tháng) với nhiều loại thuốc và thường đòi hỏi một phương pháp tiếp cận đa chuyên khoa. Đồng nhiễm HIV cũng cần được loại trừ. Nuôi cấy và xét nghiệm độ nhạy cảm thậm chí còn quan trọng hơn hiện nay do sự phát triển của các chủng kháng thuốc.
VIRUS CÓ TẦM QUAN TRỌNG ĐẶC BIỆT TRONG NGOẠI KHOA
Các nhiễm virus mạn tính lây truyền qua đường máu như viêm gan B và C và HIV rất quan trọng trong thực hành phẫu thuật vì nguy cơ lây truyền virus từ bệnh nhân sang bác sĩ phẫu thuật trong quá trình phẫu thuật và ngược lại, cũng như lây nhiễm chéo giữa các bệnh nhân. Bệnh nhân cũng có thể cần can thiệp phẫu thuật cho các biến chứng của viêm gan hoặc nhiễm HIV.
Virus gây suy giảm miễn dịch ở người (Human immunodeficiency virus – HIV)
Phân loại nhiễm HIV
HIV gây nhiễm khuẩn mạn tính có thể tiến triển thành AIDS. Bệnh tiến triển qua nhiều giai đoạn hoặc nhóm, được phân loại bởi Trung tâm Kiểm soát Dịch bệnh Hoa Kỳ, vào năm 1986, như sau:
- Nhóm I: Bệnh cấp tính khi chuyển đổi huyết thanh (seroconversion). Chuyển đổi huyết thanh xảy ra muộn nhất là 3 tháng sau khi nhiễm bệnh, và có tới 70% bệnh nhân bị nhiễm bệnh không có triệu chứng tại thời điểm chuyển đổi huyết thanh. Bệnh nhân thường xét nghiệm âm tính với kháng thể chống HIV trước và trong khi bị bệnh chuyển đổi huyết thanh. Hầu hết các bộ dụng cụ chẩn đoán hiện đại được sử dụng ở Vương quốc Anh đều xét nghiệm kháng nguyên và kháng thể, vì vậy kết quả ‘âm tính giả’ hiện nay ít có khả năng xảy ra hơn
- Nhóm II: Giai đoạn không có triệu chứng (asymptomatic period) trong đó bệnh nhân thường cảm thấy hoàn toàn khỏe mạnh
- Nhóm III: Khi bệnh tiến triển, bệnh nhân có thể phát triển hạch to toàn thân (generalised lymphadenopathy) và gầy sút (hội chứng liên quan đến AIDS)
- Nhóm IV: AIDS được biểu hiện bằng sự phát triển của các nhiễm khuẩn cơ hội (opportunistic infections) bất thường (ví dụ: viêm phổi do Pneumocystis, nhiễm cytomegalovirus (CVM), bệnh toxoplasma não, và nhiễm mycobacteria không điển hình), một số bệnh ác tính nhất định (sarcoma Kaposi, u lympho toàn thân hoặc não, và ung thư cổ tử cung xâm lấn tích cực) và bệnh thần kinh (hội chứng sa sút trí tuệ do AIDS)
Việc sử dụng các kết hợp thuốc kháng retrovirus (‘liệu pháp kháng retrovirus hoạt tính cao’ – ‘high activity antiretroviral therapy’ – HAART) đã ảnh hưởng đáng kể đến lịch sử tự nhiên của AIDS, với sự giảm sút lớn và bền vững về tỷ lệ tử vong do các nhiễm khuẩn cơ hội.
Sự liên quan của phẫu thuật trong các trường hợp HIV
Các bác sĩ phẫu thuật có thể tham gia vào việc chẩn đoán các vấn đề liên quan đến ruột (ví dụ: nhiễm nấm Candida thực quản) bằng nội soi thực quản-dạ dày-tá tràng. Trong giai đoạn cuối của bệnh, nhiễm CMV có thể liên quan đến bất kỳ phần nào của đường tiêu hóa, từ loét miệng, đến loét ở hỗng tràng có thể thủng, đến viêm đại tràng. Đối với viêm đại tràng do AIDS, nội soi đại tràng và sinh thiết thường được yêu cầu để chẩn đoán. Điều trị bao gồm thuốc kháng virus tiêm tĩnh mạch.
Những người bị AIDS có thể phát triển herpes quanh hậu môn (perianal herpes) nghiêm trọng với sự hình thành rò hoặc áp-xe hậu môn thứ phát. Ở một bệnh nhân đã biết bị AIDS, các tổn thương quanh hậu môn nên được giả định là herpes cho đến khi được chứng minh ngược lại vì biểu hiện thường không điển hình. Sarcoma Kaposi (Kaposi’s sarcomas) có thể cần cắt bỏ tại chỗ. Các ví dụ khác về sự liên quan của phẫu thuật với bệnh nhân nhiễm HIV bao gồm đặt ống thông tĩnh mạch trung ương dài hạn (ví dụ: catheter Hickman), đặt ống mở thông dạ dày qua da nội soi (percutaneous endoscopic gastrostomy – PEG) để nuôi ăn, hoặc thay khớp ở những bệnh nhân ưa chảy máu (haemophiliacs) bị nhiễm HIV.
Viêm gan siêu vi (Viral hepatitis)
Viêm gan siêu vi biểu hiện bằng chán ăn, buồn nôn và đôi khi khó chịu ở bụng ở góc phần tư trên bên phải, sau đó là vàng da (jaundice). Nhiều virus gây viêm gan cấp, thường có các phương thức lây truyền, thời gian ủ bệnh, tiên lượng và biến chứng khác nhau. Chúng bao gồm CMV, virus Epstein-Barr (EBV) và các virus viêm gan.
Viêm gan A (Hepatitis A)
Viêm gan A lây truyền qua đường phân-miệng và có thời gian ủ bệnh từ 2–6 tuần. Bệnh hiếm khi gây bệnh tối cấp và không bao giờ dẫn đến viêm gan mạn tính hoặc xơ gan. Tầm quan trọng phẫu thuật duy nhất của nó là trong chẩn đoán phân biệt vàng da. Đã có vắc-xin phòng viêm gan A.
Viêm gan B (Hepatitis B)
Viêm gan B lây truyền qua máu hoặc dịch tiết cơ thể, bao gồm quan hệ tình dục, hoặc từ mẹ sang thai nhi hoặc em bé (gọi là lây truyền dọc – vertical transmission). Thời gian ủ bệnh là 6 tuần đến 6 tháng. Nhiễm viêm gan B dẫn đến viêm gan mạn tính và xơ gan ở 5%–10% các trường hợp; loại xơ gan này có thể tiến triển thành ung thư biểu mô tế bào gan (hepatocellular carcinoma) (nguyên nhân phổ biến nhất của bệnh này trên toàn thế giới). Viêm gan B có thể phòng ngừa được bằng cách tiêm phòng, và điều này được chỉ định cho trẻ sơ sinh của các bà mẹ mang virus, tất cả nhân viên y tế và những người sống ở các khu vực có nguy cơ cao.
Phơi nhiễm với virus viêm gan B có một số kết quả có thể xảy ra:
- Viêm gan tối cấp (Acute fulminant hepatitis)—hiếm gặp nhưng gây tử vong (hoặc có thể cần ghép gan)
- Viêm gan cấp -> loại bỏ virus -> dẫn đến miễn dịch suốt đời
- Nhiễm khuẩn mạn tính—có thể dẫn đến viêm gan mạn tính/xơ gan (và ung thư biểu mô tế bào gan)
- Tình trạng người mang mầm bệnh mạn tính—chủ yếu do nhiễm bệnh khi sinh nhưng có thể xảy ra sau này với sự phát triển của dung nạp miễn dịch và không có bệnh hoạt động rõ ràng
Chẩn đoán viêm gan B
Kháng nguyên bề mặt viêm gan B (Hepatitis B surface antigen – HBsAg) có thể được phát hiện trong máu trong giai đoạn đầu. Bệnh nhân sau đó phát triển kháng thể kháng lõi virus (anti-HBc), đây là một dấu hiệu của việc đã phơi nhiễm với virus nhưng không mang lại miễn dịch. Muộn hơn, khi đã loại bỏ virus, bệnh nhân phát triển kháng thể bề mặt (anti-HBs) mang lại miễn dịch suốt đời. Những bệnh nhân không loại bỏ được virus vẫn dương tính với kháng nguyên bề mặt (HBsAg) và có thể trở thành người mang mầm bệnh mạn tính, tức là, vẫn có khả năng lây nhiễm cho người khác và có nguy cơ bị biến chứng.
Bệnh nhân HBsAg dương tính có thể lây truyền virus nếu có sự phơi nhiễm của người nhận với đủ lượng vật liệu, ví dụ, bằng cách truyền máu. Trường hợp đặc biệt là dương tính với kháng nguyên e (e antigen positivity) chỉ ra những bệnh nhân có khả năng lây nhiễm cao hơn.
Vắc-xin viêm gan B chứa các kháng nguyên bề mặt tái tổ hợp bất hoạt và gây miễn dịch bằng cách kích thích sản xuất kháng thể bề mặt; đây là dấu hiệu huyết thanh học dương tính duy nhất ở những người đã được tiêm phòng.
Điều trị viêm gan B
DNA của viêm gan B hiện có thể được phát hiện trong máu, đưa ra chẩn đoán xác định và ước tính số lượng virus trong dòng máu (tải lượng virus – viral load) để hướng dẫn điều trị. Liệu pháp với interferon (thường là các dạng pegyl hóa được dung nạp tốt hơn) và các thuốc kháng virus (ví dụ: lamivudine, telbivudine, entecavir, adefovir hoặc tenofovir) đã thành công một phần trong việc điều trị các nhiễm khuẩn mạn tính, giảm khả năng lây nhiễm và nguy cơ ung thư biểu mô tế bào gan. Những người mang mầm bệnh mạn tính thất bại với điều trị nên được theo dõi ung thư biểu mô tế bào gan bằng cách ước tính alpha-fetoprotein huyết thanh hàng năm và siêu âm gan 2 năm một lần, vì cắt gan một phần (partial hepatectomy) đôi khi có thể chữa khỏi các trường hợp sớm.
Viêm gan C (Hepatitis C)
Viêm gan C lây truyền qua các con đường tương tự như viêm gan B, nhưng lây truyền qua đường tình dục được cho là ít phổ biến hơn. Thời gian ủ bệnh là khoảng 2 tháng. Bệnh gan mạn tính phát triển ở tỷ lệ các trường hợp cao hơn (30%–50%) nhưng thường ở cấp độ thấp. Viêm gan C cũng là một nguyên nhân quan trọng gây ung thư biểu mô tế bào gan trên toàn thế giới.
Chẩn đoán huyết thanh học gặp rắc rối vì các xét nghiệm kháng thể virus viêm gan C (Hepatitis C Virus – HCV) thường cho kết quả dương tính giả. Chuyển đổi huyết thanh xảy ra muộn, thường là vài tuần đến vài tháng sau khi bị bệnh cấp tính. Chẩn đoán xác định được thực hiện bằng cách phát hiện RNA của viêm gan C trong huyết thanh. Giống như trong viêm gan B, các xét nghiệm tải lượng virus được sử dụng để theo dõi đáp ứng với điều trị và khả năng lây nhiễm. Điều trị thay đổi theo kiểu gen (genotype), nhưng các lựa chọn bao gồm interferon với ribavirin; simeprevir; sofosbuvir; daclatasvir; sự kết hợp của ledipasvir và sofosbuvir; sự kết hợp của ombitasvir, paritaprevir và ritonavir, dùng cùng hoặc không cùng dasabuvir; và sự kết hợp của sofosbuvir và velpatasvir hiện đã có sẵn. Trong hầu hết các trường hợp, xét nghiệm kháng thể viêm gan C dương tính có khả năng có nghĩa là nhiễm khuẩn vẫn tiếp diễn.
Viêm gan D (Hepatitis D)
Đây là một virus khiếm khuyết (defective virus) đòi hỏi kháng nguyên bề mặt của viêm gan B để biểu hiện đầy đủ; nó chỉ xảy ra như một đồng nhiễm (coinfection) với viêm gan B và có thể được ngăn ngừa bằng cách tiêm phòng viêm gan B.
Viêm gan E (Hepatitis E)
Viêm gan E lây truyền qua đường phân-miệng và thường tự giới hạn. Tuy nhiên, nó có thể gây suy gan tối cấp, đặc biệt là ở phụ nữ mang thai.
NHIỄM KHUẨN HUYẾT (SEPSIS)
Nhiễm khuẩn huyết là một đáp ứng miễn dịch cực đoan với nhiễm khuẩn có thể gây tổn thương mô, suy cơ quan và tử vong nếu không được điều trị kịp thời và hiệu quả.
Rối loạn chức năng đa cơ quan và hội chứng đáp ứng viêm hệ thống (SIRS)
Hội chứng rối loạn chức năng đa cơ quan (Multiple Organ Dysfunction Syndrome – MODS), trước đây là Suy đa tạng (Multiple Organ Failure – MOF), được công nhận là một thực thể lâm sàng vào giữa những năm 1970 khi người ta nhận ra rằng bất kỳ một sự xúc phạm sinh lý lớn nào cũng có thể dẫn đến suy yếu của các cơ quan ở xa quá trình bệnh lý khởi đầu. Sau đó, tình trạng cơ bản được phát hiện là một hội chứng đáp ứng viêm hệ thống (Systemic Inflammatory Response Syndrome – SIRS) không được kiểm soát, được khởi đầu bởi các biến cố bất lợi như chấn thương, nhiễm khuẩn, viêm, thiếu máu cục bộ hoặc tổn thương do thiếu máu cục bộ-tái tưới máu (ischaemia-reperfusion injury). MODS là lý do phổ biến nhất khiến bệnh nhân phẫu thuật phải ở lại chăm sóc tích cực lâu hơn 5 ngày (xem Hộp 3.2).
Nhiễm khuẩn huyết (cũng được biết đến bởi hoặc được kết hợp trong các thuật ngữ sốc nhiễm khuẩn – septic shock, nhiễm khuẩn huyết hệ thống – systemic sepsis, nhiễm trùng huyết – septicaemia và hội chứng nhiễm khuẩn huyết – sepsis syndrome) mô tả các đặc điểm lâm sàng khi nhiễm khuẩn là yếu tố khởi đầu của MODS. Giai đoạn sớm, tình trạng này có thể đảo ngược được. Lưu ý rằng nhiễm khuẩn huyết (sepsis) hiện có một ý nghĩa rất cụ thể và không đồng nghĩa với thuật ngữ nhiễm khuẩn (infection). Trong MODS, trình tự suy yếu của từng cơ quan riêng lẻ thường theo một mô hình có thể dự đoán được, với suy hô hấp (pulmonary failure) trước tiên, tiếp theo là suy gan (hepatic), ruột (intestinal), thận (renal), não (cerebral) và cuối cùng là suy tim (cardiac failure). Suy hô hấp có liên quan đến ARDS (hội chứng suy hô hấp cấp tính – acute respiratory distress syndrome). Trong suy gan, bệnh nhân có nồng độ bilirubin tăng, rối loạn đông máu (thời gian prothrombin tăng), albumin thấp (do suy giảm chức năng tổng hợp của gan), giảm tiểu cầu (thrombocytopenia), transaminase alanine huyết thanh và lactate dehydrogenase tăng (do tổn thương gan). Suy ruột (Intestinal failure) được nhận ra bởi chảy máu do stress (stress bleeding) cần truyền máu, suy thận (renal failure) được nhận ra bởi creatinine huyết tương tăng và lượng nước tiểu thấp, và suy tim (cardiac failure) được nhận ra bởi cung lượng tim thấp và hạ huyết áp. Các trạng thái tinh thần bị thay đổi, chẳng hạn như lú lẫn và mê sảng cũng thường xảy ra (suy não – cerebral failure), cũng như đông máu nội mạch lan tỏa (disseminated intravascular coagulopathy).
Tỷ lệ tử vong của MODS có liên quan đến cơ quan cụ thể bị liên quan, số lượng cơ quan bị suy, thời gian của sự xúc phạm và sự hiện diện của nhiễm khuẩn huyết đồng thời: tỷ lệ tử vong là khoảng 20% với một cơ quan; 45% với hai cơ quan; 65% với ba cơ quan; và >75% với bốn cơ quan.
HỘP 3.2: Định nghĩa SIRS, hội chứng rối loạn chức năng đa cơ quan và nhiễm khuẩn huyết
| Hội chứng đáp ứng viêm hệ thống (SIRS)
Hiện diện nếu có ≥2 trong số những điều sau:
Hội chứng rối loạn chức năng đa cơ quan (Multiple organ dysfunction syndrome – MODS) Hiện diện nếu SIRS có liên quan đến rối loạn chức năng cơ quan (ví dụ: thiểu niệu và thiếu oxy) Nhiễm khuẩn huyết (Sepsis) Được định nghĩa là SIRS liên quan đến nhiễm vi khuẩn được chứng minh bằng nuôi cấy Nhiễm khuẩn huyết nặng (Severe sepsis) Được định nghĩa là nhiễm khuẩn huyết liên quan đến các dấu hiệu rối loạn chức năng cơ quan (ví dụ: suy thận) Sốc nhiễm khuẩn (Septic shock) Được định nghĩa là SIRS liên quan đến hạ huyết áp kháng trị với việc bù dịch và đòi hỏi thuốc vận mạch Vãng khuẩn huyết (Bacteraemia) Sự hiện diện của vi khuẩn trong dòng máu Nhiễm trùng huyết (Septicaemia) Sự hiện diện của vi khuẩn trong dòng máu với sự hiện diện của nhiễm khuẩn huyết PaCO₂, Áp suất riêng phần của carbon dioxide trong máu động mạch. |
Sinh lý bệnh của hội chứng đáp ứng viêm hệ thống và hội chứng rối loạn chức năng đa cơ quan
SIRS liên quan đến những thay đổi lan rộng, bao gồm hoạt hóa tế bào viêm dẫn đến giải phóng cytokine, tổn thương nội mô (endothelial injury), rối loạn huyết động và suy giảm chiết xuất oxy ở mô. Các đại thực bào có thể chứng minh là yếu tố quan trọng nhất của điều này và bệnh tự miễn. Do đó, nó đại diện cho sự hoạt hóa bị phóng đại quá mức của các đáp ứng miễn dịch bẩm sinh chủ yếu nhằm mục đích bảo vệ vật chủ. Sự giải phóng không được kiểm soát của các chất trung gian gây viêm gây ra những thay đổi vi mạch, huyết động và ty thể lan rộng, cuối cùng dẫn đến suy cơ quan.
Sau tổn thương mô ban đầu, một đáp ứng viêm tại chỗ xảy ra với sự cảm ứng cytokine (xem Đáp ứng miễn dịch ở đầu chương này). Đáp ứng với điều này là sự huy động các tế bào viêm bao gồm các đại thực bào và bạch cầu trung tính, chúng xuyên mạch (diapedese) ra khỏi mao mạch và đi vào các mô. Ngoài ra, các cytokine kích động các yếu tố toàn thân của viêm bao gồm sự hoạt hóa của nội mô, hệ thống bổ thể và đông máu, khuếch đại đáp ứng viêm ban đầu. Trình tự này là một phần của đáp ứng viêm bình thường và thích hợp. Tuy nhiên, nếu tổn thương nghiêm trọng hoặc dai dẳng, phản ứng tại chỗ có thể mở rộng quá mức vào tuần hoàn hệ thống, tạo ra một đáp ứng viêm hệ thống hoặc, nếu được khởi đầu bởi nhiễm khuẩn, là nhiễm khuẩn huyết.
Các chất trung gian của hội chứng đáp ứng viêm hệ thống và hội chứng rối loạn chức năng đa cơ quan
SIRS và MODS liên quan đến các tương tác phức tạp của các chất trung gian nội sinh và đôi khi là ngoại sinh. Một loạt các cytokine được giải phóng từ các đại thực bào được hoạt hóa và từ các tế bào nội mô và các tế bào lưới-nội mô (reticulo-endothelial cells) khác. Bộ cytokine được giải phóng phụ thuộc vào bản chất của tác nhân kích động và được chi phối bởi loại TLR cụ thể nhận ra kẻ xâm lược. Các cytokine được giải phóng bao gồm TNF-alpha, các interleukin (đặc biệt là IL1 mà còn cả IL2 và IL6) và yếu tố hoạt hóa tiểu cầu. Các nỗ lực dược lý để ức chế các đáp ứng cytokine quá mức để điều trị bệnh nhân cho đến nay vẫn không hiệu quả.
Nhiễm khuẩn huyết (Sepsis)
Đáp ứng nhiễm khuẩn huyết cổ điển, với tuần hoàn tăng động (hyperdynamic circulation), các dấu hiệu viêm toàn thân và chuyển hóa trung gian bị gián đoạn, có thể được gây ra ở những người tình nguyện khỏe mạnh bằng cách tiêm LPS (từ thành tế bào của vi khuẩn Gram âm) hoặc các cytokine TNF-alpha hoặc IL1. Trong nhiễm khuẩn huyết Gram âm, thành phần LPS của các sinh vật này kích hoạt mạnh mẽ các TLR trên các tế bào tua và do đó là toàn bộ chuỗi viêm. Điều này dẫn đến hoạt hóa nội mô làm tăng tính thấm mạch máu và tương tác bạch cầu trung tính-nội mô. Con đường chung cuối cùng có thể liên quan đến các bạch cầu trung tính được hoạt hóa di chuyển vào không gian kẽ của cơ quan bị ảnh hưởng và tình trạng thiếu oxy ở mô. Trong nhiễm khuẩn huyết, những yếu tố này và các yếu tố lưu hành khác hoạt động hiệp đồng mang lại các tác động tàn phá của MODS.
Các tình trạng lâm sàng dẫn đến hội chứng đáp ứng viêm hệ thống và hội chứng rối loạn chức năng đa cơ quan
Chúng bao gồm nhiễm khuẩn và nội độc tố máu (endotoxaemia) (nhiễm khuẩn huyết Gram âm) trong 50%–70% các trường hợp, mô hoại tử bị giữ lại và sốc. Bất kỳ yếu tố nào trong số này cũng có thể khởi đầu suy cơ quan ở xa bằng các cơ chế sau:
- Gây giải phóng quá mức các cytokine nội sinh
- Làm gián đoạn việc cung cấp oxy đến các mô
- Làm suy giảm chức năng hàng rào ruột (intestinal barrier function) cho phép vi khuẩn đường ruột và nội độc tố chuyển vị (translocation) đến tuần hoàn cửa và tuần hoàn hệ thống
- Làm tổn thương hệ thống lưới-nội mô
Suy cơ quan do viêm tụy cấp (acute pancreatitis) là do sự kết hợp của các yếu tố này.
Nhiễm khuẩn Nguồn nhiễm khuẩn dẫn đến MODS có thể là mắc phải (ví dụ: áp-xe trong ổ bụng) hoặc nội sinh từ ruột của bệnh nhân. Nhiễm khuẩn tại chỗ, đặc biệt là với vi khuẩn Gram âm, kích thích giải phóng các cytokine gây viêm. Một đáp ứng tương tự bị kích động bởi một khối lượng đáng kể mô hoại tử, ví dụ, một chân bị hoại thư và còn tệ hơn nếu mô đó bị nhiễm khuẩn. Những đáp ứng cận tiết (paracrine responses) này có lợi về mặt tại chỗ, chống lại nhiễm khuẩn bằng cách tăng lưu lượng máu và tính thấm mạch máu để cho phép dòng tế bào tua và đại thực bào tràn vào và hoạt hóa các bạch cầu trung tính để khử hạt và giải phóng các gốc oxy độc tế bào. Tuy nhiên, nếu yếu tố kích thích là lớn, một chuỗi phản ứng có thể được khởi đầu dẫn đến nhiễm khuẩn huyết và MODS. Các gốc superoxide và các yếu tố lưu hành khác sau đó làm hỏng các tế bào ở nơi khác, gây giãn mạch lan rộng và tăng tính thấm mạch máu dẫn đến hạ huyết áp và trụy tuần hoàn. Cơ tim bị ức chế và các chức năng trao đổi chất của tế bào bị gián đoạn.
Các nguồn nhiễm khuẩn nội sinh Đại tràng là một kho chứa vi khuẩn và nội độc tố, thường được chứa đựng một cách an toàn. Nếu hàng rào ruột bị phá vỡ (ví dụ: do thiếu máu cục bộ tạng – splanchnic ischaemia, dinh dưỡng trong lòng ruột của các tế bào ruột (enterocytes) bị suy giảm hoặc hệ vi khuẩn đường ruột bị thay đổi), sự chuyển vị của vi khuẩn vào tuần hoàn cửa có thể xảy ra chỉ trong 30 phút. Nếu các tế bào Kupffer của gan cũng bị suy giảm, vi khuẩn đường ruột và nội độc tố không bị loại bỏ và không bị ngăn cản đến tuần hoàn hệ thống theo cách thông thường. Điều này có thể giải thích khả năng suy thận ở những bệnh nhân bị vàng da trải qua phẫu thuật (hội chứng gan thận – hepatorenal syndrome). Nguồn nội sinh này có lẽ giải thích cho 30% bệnh nhân bị rối loạn chức năng cơ quan mà không có nguồn nhiễm khuẩn rõ ràng. Thông thường, những bệnh nhân như vậy bị ảnh hưởng sau khi hạ huyết áp kéo dài (sốc giảm thể tích hoặc sốc tim) hoặc thiếu oxy máu (ví dụ: nạn nhân đa chấn thương) hoặc là kết quả của thiếu máu cục bộ tạng trực tiếp (ví dụ: kẹp động mạch chủ kéo dài và hạ huyết áp ở bệnh nhân vỡ phình động mạch chủ).
HỘP 3.3: Dự phòng và điều trị sớm nhiễm khuẩn huyết và hội chứng rối loạn chức năng đa cơ quan
Dự phòng chung
Dự phòng cho bệnh nhân có nguy cơ và điều trị các dấu hiệu sớm
Sáu bước xử trí nhiễm khuẩn huyết (The sepsis six) Tất cả trong vòng 1 giờ:
IV, Tiêm tĩnh mạch; PO₂, áp suất riêng phần của oxy. |
Các khía cạnh phẫu thuật
Ở bệnh nhân phẫu thuật, rối loạn chức năng đa cơ quan thường là kết quả của một biến chứng như bục miệng nối ruột (bowel anastomotic leak) hoặc từ viêm tụy cấp nặng (có thể là vô trùng nhưng trở nên tàn khốc nếu bị nhiễm khuẩn). Hoại tử mô sau chấn thương hoặc cái chết của một chi bị thiếu máu cục bộ cũng có thể thúc đẩy hội chứng này.
Rối loạn chức năng cơ quan thường bắt đầu một cách âm thầm. Ở giai đoạn sớm, rối loạn chức năng có thể được xác nhận bằng thăm dò và hồi sức tích cực và điều trị các yếu tố nguyên nhân có khả năng mang lại hiệu quả có lợi. Đến 7–10 ngày mà không có điều trị hiệu quả, suy hô hấp (ví dụ: ARDS) và suy gan và thận xuất hiện; MODS hiện đã hiện diện, và tiên lượng trở nên xấu đi đáng kể.
Ngăn ngừa nhiễm khuẩn huyết và quản lý sớm nhiễm khuẩn lớn liên quan đến ruột trước khi nó kích động chuỗi SIRS-MODS là rất quan trọng. Việc sử dụng kháng sinh dự phòng thích hợp trong phẫu thuật đường ruột hoặc chấn thương sẽ hữu ích, nhưng các lỗi kỹ thuật trong và sau phẫu thuật, đặc biệt là bục miệng nối hoặc phán đoán lâm sàng kém, là những yếu tố chính ở >50% bệnh nhân bị rối loạn chức năng đa cơ quan. Phán đoán lâm sàng tốt, hồi sức hiệu quả, kỹ thuật phẫu thuật tốt, cắt lọc hiệu quả mô hoại tử, giảm thiểu ô nhiễm vi khuẩn và ngăn ngừa sự tích tụ của các ổ dịch sau phẫu thuật (huyết thanh hoặc máu) đều cần thiết để phòng ngừa. Mục đích là để loại bỏ môi trường trong đó vi khuẩn nhân lên và cải thiện việc cung cấp các biện pháp bảo vệ kháng khuẩn của vật chủ.
Các biến chứng phẫu thuật có khả năng gây nhiễm khuẩn huyết nên được điều trị sớm, thường bằng phẫu thuật dứt điểm, ví dụ, loại bỏ mô hoại tử, dẫn lưu áp-xe và kiểm soát ô nhiễm phúc mạc bằng cách đưa miệng nối bị bục ra ngoài (exteriorising leaking anastomoses). Điều này giúp giảm nồng độ lưu hành của các chất trung gian gây viêm và giới hạn thời gian stress. Thường thì tốt hơn là thực hiện một cuộc mở bụng thăm dò khi nghi ngờ và thấy bình thường còn hơn là ‘chờ xem’ và có nguy cơ suy sụp nhanh chóng và tử vong.
Các yếu tố dự phòng khác ở bệnh nhân có nguy cơ
Bù dịch đầy đủ và sớm là rất quan trọng ở những bệnh nhân bị giảm thể tích tuần hoàn, bao gồm cả nạn nhân chấn thương, viêm tụy cấp hoặc tắc ruột, vì mất thể tích nội mạch dẫn đến tưới máu mô bị thiếu hụt (tức là sốc) và thiếu máu cục bộ tạng. Duy trì oxy hóa mô cũng rất quan trọng; bệnh nhân có nguy cơ phải được ước tính khí máu động mạch và pH và nhận oxy bổ sung hoặc hỗ trợ thông khí khi cần thiết. Để giúp ngăn ngừa sự chuyển vị của vi khuẩn đường ruột, các tế bào ruột (enterocytes) và tế bào đại tràng (colonocytes) được hỗ trợ tốt nhất bằng cách cho ăn qua đường tiêu hóa (enteral feeding), nếu cần, bằng ống thông hỗng tràng nuôi ăn (feeding jejunostomy) hoặc ống thông mũi-dạ dày lòng nhỏ (fine-bore nasogastric tube). Glutamine, arginine và axit béo omega-3 được cho là quan trọng.
