SÁCH DỊCH “Y HỌC CHU PHẪU: QUẢN LÝ HƯỚNG ĐẾN KẾT QUẢ, ẤN BẢN THỨ 2”
Được dịch và chuyển thể sang tiếng Việt từ sách gốc “Perioperative Medicine: Managing for Outcome, 2nd Edition”
Dịch và chú giải: Ths.Bs. Lê Đình Sáng – Hiệu đính: Ts.Bs.Lê Nhật Huy
Chương 31. Phẫu thuật Tim
Cardiac Surgery – Pingping Song, Michael Holmes and G. Burkhard Mackensen
Perioperative Medicine, 31, 487-504
Mỗi năm, có hơn 500.000 ca phẫu thuật tim được thực hiện tại Hoa Kỳ, và cho đến gần đây, con số này vẫn tiếp tục tăng hàng năm. Người bệnh phẫu thuật tim thường được nhập vào đơn vị chăm sóc tích cực (ICU) để theo dõi quá trình hồi phục sau gây mê và phẫu thuật, tối ưu hóa huyết động, cai thở máy và theo dõi các biến chứng có thể xảy ra. ICU đã trở thành khu vực chính yếu nơi diễn ra quá trình chuyển tiếp phức tạp từ phòng mổ đến chăm sóc chuyên sâu. Với số lượng lớn các ca phẫu thuật tim, việc chăm sóc hậu phẫu cho những người bệnh này chiếm một tỷ lệ đáng kể trong các ca nhập ICU tại nhiều cơ sở y tế.
Các đơn vị chăm sóc tích cực phẫu thuật tim ngực (CT-ICU) đã phát triển thành một thực thể riêng biệt so với ICU ngoại khoa thông thường do việc quản lý người bệnh phẫu thuật tim đã trở nên thuận tiện hơn và được điều trị theo thuật toán. Chăm sóc tích cực được quản lý tốt nhất khi dịch vụ được thiết kế cho một quần thể đồng nhất với các vấn đề y tế và phẫu thuật được xác định rõ ràng.
Theo truyền thống, người bệnh phẫu thuật tim thường ở lại ICU trong vài ngày trước khi xuất viện đến khoa thường hoặc đơn vị chăm sóc trung gian. Trong thập kỷ qua, quản lý ICU đã thay đổi để đáp ứng với sự thay đổi của quần thể người bệnh, kỹ thuật phẫu thuật và gây mê mới, cũng như sự phát triển của chăm sóc y tế quản lý. Người bệnh được phẫu thuật tim hiện nay có tuổi cao hơn đáng kể do số lượng người bệnh được nong mạch và đặt stent tăng lên. Liệu pháp nội khoa tích cực và kỹ thuật tái tưới máu không phẫu thuật cũng dẫn đến việc người bệnh đến phẫu thuật ở giai đoạn bệnh tiến triển hơn và có nhiều bệnh đồng mắc hơn. Hơn nữa, với thị trường hiện tại của các tổ chức bảo trì sức khỏe (HMO) và các chiến lược kiềm chế chi phí khác, có xu hướng ngày càng tăng hướng tới cải thiện phục hồi sau phẫu thuật tim (ERAS), thúc đẩy việc trở lại các hoạt động bình thường sớm hơn. Những sáng kiến này nhằm mục đích giảm biến chứng, tăng tốc chăm sóc (ví dụ: fast track), đường dẫn chăm sóc lâm sàng, và xuất viện sớm hơn từ chăm sóc tích cực.
Với sự phát triển của phẫu thuật tim xâm lấn tối thiểu, tuần hoàn ngoài cơ thể ấm và kỹ thuật bắc cầu không dùng tuần hoàn ngoài cơ thể, các phẫu thuật viên tim đã thay đổi các yêu cầu về quy trình hồi phục hậu phẫu thông thường. Xu hướng chung là chuyển từ kỹ thuật gây mê dựa trên liều cao opioid trong quá khứ sang các hình thức gây mê cân bằng mới với các thuốc khởi mê tác dụng ngắn hơn (propofol và etomidate), các thuốc mê hô hấp (isoflurane và sevoflurane), và giảm liều opioid cho phép người bệnh hồi phục nhanh hơn từ gây mê. Xu hướng này đi kèm với việc áp dụng giảm đau đa phương thức sau phẫu thuật bao gồm thuốc giảm đau không steroid đường tĩnh mạch và gây tê vùng (cả thần kinh và tê mặt phẳng). Do đó, các bác sĩ hồi sức cần phát triển các chiến lược để quản lý quần thể người bệnh luôn thay đổi này một cách hiệu quả và tiết kiệm chi phí trong khi vẫn duy trì chất lượng và giảm thiểu tỷ lệ mắc bệnh và tử vong. Quản lý hậu phẫu hiệu quả phụ thuộc rất nhiều vào tình trạng tiền phẫu của từng người bệnh, các sự kiện trong quá trình phẫu thuật, và tình trạng khi đến ICU.
Mặc dù phần lớn các cơ sở sử dụng ICU phẫu thuật hoặc CT-ICU chuyên biệt để chăm sóc hậu phẫu, việc tránh nhập ICU hoàn toàn có thể là tương lai cho một số quần thể người bệnh được lựa chọn: một số cơ sở sử dụng các đơn vị chăm sóc trung gian hoặc chăm sóc tích cực lưu trú ngắn cho quá trình cai thở máy và chăm sóc phụ thuộc cao.
Vận chuyển và Đánh giá ban đầu
Việc vận chuyển người bệnh vừa phẫu thuật tim từ phòng mổ đến ICU không phải không có rủi ro và nên được thực hiện một cách nhẹ nhàng nhất có thể. Các vấn đề gặp phải trong quá trình vận chuyển bao gồm thay đổi sinh lý cấp tính (giảm thể tích máu là phổ biến nhất), tỉnh đột ngột, hoặc chảy máu nghiêm trọng. Sau khi phẫu thuật hoàn tất và người bệnh được ổn định trong phòng mổ, người bệnh được vận chuyển đến ICU trong khi vẫn đang thoát mê. Để cải thiện sự thoải mái và an toàn, người bệnh thường được theo dõi (điện tâm đồ [ECG], theo dõi huyết áp xâm lấn [BP], và đo oxy mạch) và duy trì an thần với các thuốc tác dụng ngắn như propofol hoặc dexmedetomidine bổ sung với opioid khi cần thiết. Điều này cho phép người bệnh tỉnh dần trong ICU trong khi nhóm chuyên gia hồi sức tiếp tục theo dõi tưới máu các cơ quan và biến chứng sau phẫu thuật.
NHẬP ICU
Trong quá trình chuyển giao chăm sóc từ bác sĩ gây mê sang nhóm ICU, bác sĩ hồi sức phải làm quen với tiền sử bệnh và diễn biến trong quá trình phẫu thuật của người bệnh. Lý tưởng nhất, quy trình bàn giao đa chuyên khoa nên tuân theo một danh sách kiểm tra có cấu trúc và có sự tham gia của các thành viên từ nhóm gây mê, nhóm phẫu thuật và nhóm ICU. Các sự kiện trước phẫu thuật và trong phẫu thuật khác nhau về mức độ và thời gian nhưng thường dẫn đến cơ tim có khả năng co bóp và độ giãn nở giảm, điều này ảnh hưởng đến quản lý hậu phẫu và kết quả cuối cùng. Dữ liệu thiết yếu bao gồm chỉ định phẫu thuật, chức năng tim trước phẫu thuật và các bệnh đồng mắc chính, chi tiết về quy trình phẫu thuật (cầu nối động mạch vành và tĩnh mạch, van được sửa chữa hoặc thay thế, phẫu thuật động mạch chủ, v.v.), thời gian tuần hoàn ngoài cơ thể và kẹp chéo động mạch chủ, khó khăn khi cai tuần hoàn ngoài cơ thể, và đánh giá chức năng tim sau tuần hoàn ngoài cơ thể. Cũng rất quan trọng để biết phản ứng cá nhân của người bệnh đối với việc bổ sung dịch và các thuốc tác động mạch máu, số lượng và vị trí của dẫn lưu ngực, nhu cầu đặt máy tạo nhịp tim, và cầm máu trước khi đóng ngực. Cần chú ý đặc biệt đến các thủ thuật “tái phẫu” (mở xương ức hoặc mở ngực lặp lại). Chúng có kỹ thuật khó khăn hơn và thường dẫn đến mất máu nhiều hơn và tỷ lệ biến chứng cao hơn. Cuối cùng, lượng và loại dịch và các chế phẩm máu đã được sử dụng, diễn biến hậu phẫu dự kiến, và hướng dẫn cụ thể sau phẫu thuật (mục tiêu BP, thời gian cai thở máy, bắt đầu chống đông máu, v.v.) nên được truyền đạt cho nhóm ICU.
Khi người bệnh đến ICU, bác sĩ lâm sàng nên chú ý cẩn thận đến vị trí của ống nội khí quản và thực hiện kiểm tra tất cả các vị trí phẫu thuật, dẫn lưu và ống thông đặt trong lòng mạch. Các kiểm tra thể chất quan trọng tập trung cụ thể vào các biến chứng tiềm ẩn của phẫu thuật tim bao gồm phản ứng đồng tử, nghe phổi, nghe tim, lượng dịch từ dẫn lưu ngực và lượng nước tiểu. Người bệnh có thể bị hạ thân nhiệt khi đến, vì vậy cần nhanh chóng đánh giá nhiệt độ và bắt đầu làm ấm nếu cần thiết. Điện tâm đồ 12 chuyển đạo cung cấp thông tin có giá trị về nhịp tim cơ bản và tình trạng thiếu máu cục bộ tiềm ẩn.
Chụp X-quang ngực (CXR) khi nhập viện kiểm tra hiệu quả vị trí phù hợp của tất cả các ống và đường thông, đồng thời cung cấp đánh giá về thể tích phổi, phù phổi và các biến chứng phẫu thuật tiềm ẩn như tràn khí màng phổi và tràn máu màng phổi. CXR cũng cung cấp hình ảnh đường viền tim cơ bản để so sánh sau này nếu ép tim xảy ra. Mức độ theo dõi huyết động phụ thuộc vào tình trạng người bệnh trước và trong phẫu thuật, diễn biến trong quá trình phẫu thuật và các biến chứng dự đoán sau phẫu thuật tim. Tối thiểu, người bệnh nên có một đường động mạch, một đường đo áp lực tĩnh mạch trung tâm (CVP) và một ống thông tiểu. Việc sử dụng ống thông động mạch phổi (PAC) vẫn còn tranh cãi. Kể từ khi Connors và đồng nghiệp ban đầu đặt câu hỏi về tính hữu ích của PAC ở người bệnh nặng, đã có nhiều nghiên cứu điều tra tác động của PAC trong các quần thể người bệnh khác nhau với các kết luận khác nhau về kết quả của người bệnh. Mặc dù thiếu sự đồng thuận, có báo cáo về việc tăng sử dụng PAC trong phẫu thuật tim từ năm 2010 đến năm 2014. Một phân tích đoàn hệ gần đây sử dụng so khớp xu hướng cho thấy việc sử dụng PAC có liên quan đến giảm bệnh tật tim phổi, giảm thời gian nằm viện và tăng nguy cơ nhiễm trùng. Không có sự khác biệt về tỷ lệ tử vong 30 ngày giữa nhóm PAC và nhóm đối chứng. Việc sử dụng siêu âm tim qua thực quản (TEE) trong quá trình phẫu thuật ngày càng tăng đã dẫn đến việc PAC ít được sử dụng hơn trong quá trình phẫu thuật. Tuy nhiên, trong giai đoạn ngay sau phẫu thuật, dữ liệu PAC có thể hướng dẫn điều trị ở người bệnh bị tăng áp phổi nặng, suy tim phải, cung lượng tim (CO) thấp, bệnh thận giai đoạn cuối cần liệu pháp thay thế thận, hoặc người bệnh bị rối loạn chức năng tâm trương nặng.
Phân tích xét nghiệm thường quy khi nhập viện bao gồm khí máu động mạch (ABG), điện giải, công thức máu toàn bộ (CBC) và các thông số đông máu. Dữ liệu ABG và điện giải cung cấp thông tin về rối loạn cân bằng axit-bazơ, tình trạng thể tích nội mạch và tối ưu hóa hỗ trợ thở máy. Nồng độ kali và magiê trong huyết tương cần được duy trì trên 4,0 và 2,0 mmol/L, tương ứng, để giảm thiểu tỷ lệ rối loạn nhịp tim. Việc bổ sung kali có thể không thành công nếu không phục hồi dự trữ magiê. Các xét nghiệm ABG, hemoglobin/hematocrit và điện giải nên được thực hiện mỗi 4 đến 8 giờ hoặc thường xuyên hơn khi có chỉ định lâm sàng, cho đến khi tình trạng người bệnh ổn định và dữ liệu có thể được thu thập ít thường xuyên hơn. Do mất máu và viêm đáng kể liên quan đến phẫu thuật tim mạch có thể dẫn đến rối loạn đáng kể về hemoglobin, tiểu cầu và hoạt động yếu tố đông máu, một CBC và các xét nghiệm đông máu tiêu chuẩn là cần thiết để hướng dẫn liệu pháp truyền máu. Nếu ban đầu nghi ngờ rối loạn đông máu đáng kể khi đến ICU qua lượng dịch nhiều từ dẫn lưu ngực, thời gian đông máu hoạt hóa cũng có thể được sử dụng như một xét nghiệm tại chỗ nhanh chóng để kiểm tra việc đảo ngược heparin đầy đủ đã được sử dụng trong phẫu thuật. Việc kết hợp đàn hồi đồ cục máu đông (TEG) hoặc đo đàn hồi huyết khối quay(ROTEM) như một máy theo dõi tại chỗ vào một thuật toán truyền máu cho phép chẩn đoán cụ thể hơn về rối loạn đông máu và giảm các phương pháp truyền máu bừa bãi (Hình 31.1).
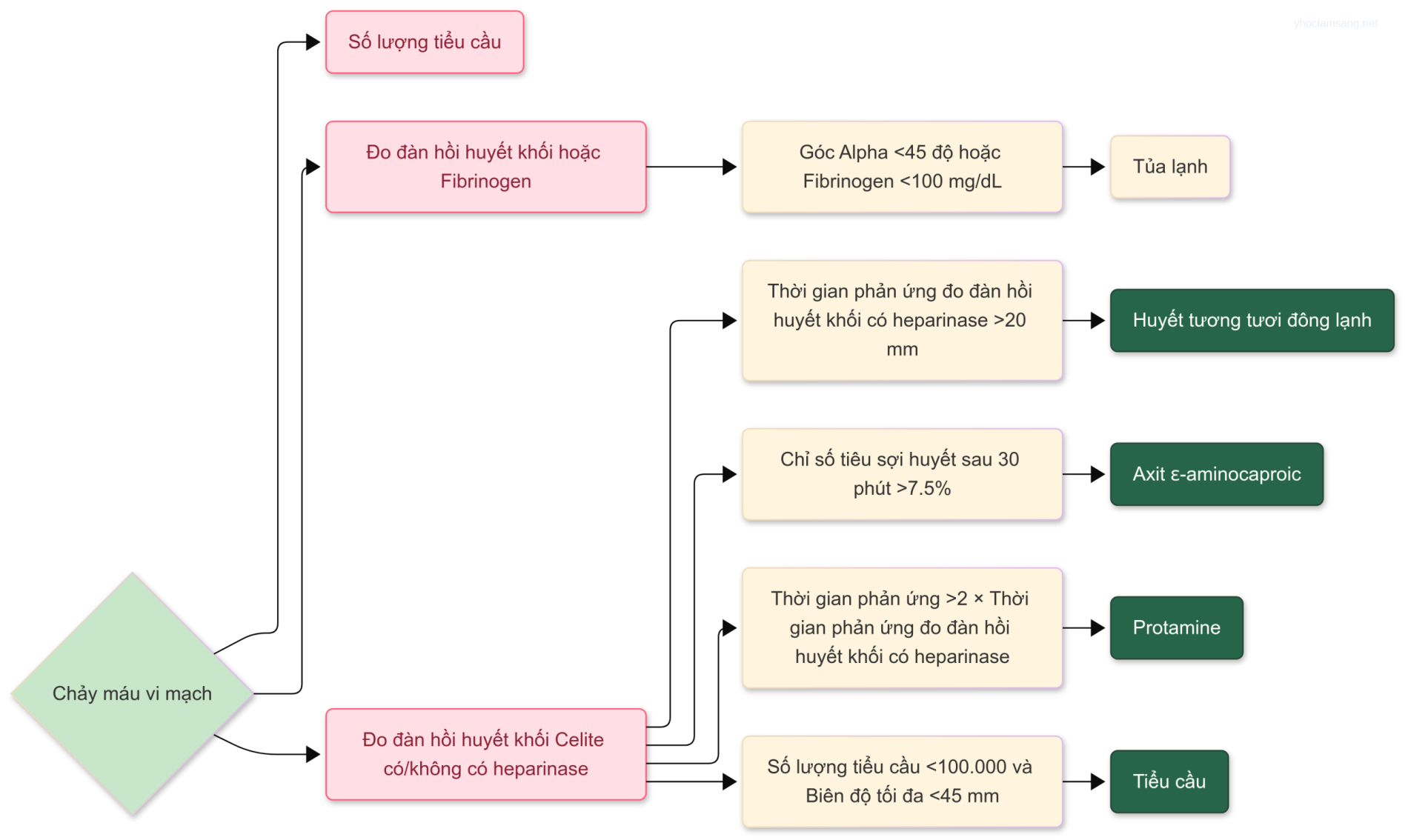
Hình 31.1 Thuật toán truyền máu trong phẫu thuật tim dựa trên kết quả số lượng tiểu cầu, đàn hồi đồ cục máu đông (TEG) và mức fibrinogen. EACA, axit ε-aminocaproic; HTTĐL, huyết tương tươi đông lạnh; hTEG, TEG hoạt hóa bởi heparinase; LY30, chỉ số ly giải ở 30 phút; MA, biên độ tối đa; R, thời gian phản ứng. (Điều chỉnh với sửa đổi và cho phép từ Shore-Lesserson L, Manspeizer HE, DePerio M, et al. Anesth Analg 1999;88:312-319.)
Quản lý Hô hấp
THÔNG KHÍ CƠ HỌC
Những thay đổi tức thì trong chức năng hô hấp do hậu quả của phẫu thuật tim và CPB bao gồm giảm đáng kể dung tích sống, dung tích phổi toàn bộ và dung tích cặn chức năng, cũng như xẹp phổi đáng kể. Cũng có tăng phù phổi tương quan với thời gian CPB. Những rối loạn này có thể bắt nguồn từ một hỗn hợp của căng thẳng phẫu thuật, xẹp hoàn toàn phổi trong quá trình tuần hoàn ngoài cơ thể và đau do vết mổ. Ở người bệnh trải qua phẫu thuật bắc cầu động mạch vành (CABG), thời gian thông khí cơ học trung bình sau phẫu thuật thường từ 1 đến 2 ngày khi sử dụng thuốc gây mê dựa trên opioid liều cao. Với kỹ thuật gây mê cân bằng hiện đại, đường dẫn chăm sóc lâm sàng “fast track” hướng đến rút ống nội khí quản sớm, với thời gian thông khí cơ học trung bình từ 6 giờ hoặc ít hơn đến 24 giờ sau phẫu thuật. So với rút ống nội khí quản muộn (>24 giờ sau phẫu thuật), rút ống nội khí quản sớm sau phẫu thuật tim đã được chứng minh là làm giảm cả thời gian nằm ICU và thời gian nằm viện, tiết kiệm chi phí hơn, cải thiện chức năng tâm thất trái và giảm bệnh tật tim phổi.
Truyền thống, thông khí với thể tích khí lưu thông cao (10 mL/kg trở lên) được sử dụng để giảm xẹp phổi. Tuy nhiên, bằng chứng hiện tại cho thấy thể tích khí lưu thông thấp hơn (6-8 mL/kg trọng lượng cơ thể lý tưởng) có lợi, với mục tiêu giảm chấn thương áp lực và chấn thương thể tích trong phổi vốn đã dễ bị tổn thương do căng thẳng phẫu thuật. Thể tích khí lưu thông thấp hơn đã được chứng minh là cung cấp tỷ lệ thành công cao hơn của việc thoát máy thở 6 giờ sau phẫu thuật tim cũng như tỷ lệ đặt lại ống nội khí quản thấp hơn. Ngược lại, thể tích khí lưu thông cao là yếu tố nguy cơ của suy cơ quan và kéo dài thời gian nằm ICU sau phẫu thuật tim. Áp lực dương cuối thì thở ra (PEEP) thường bắt đầu ở 5 cm H2O và được chuẩn độ lên đến oxy hóa đầy đủ. Trong khi các chiến lược PEEP cao so với thấp vẫn còn tranh cãi trong suốt thực hành chăm sóc tích cực, PEEP thấp hơn ở người bệnh phẫu thuật tim sau phẫu thuật có thể tạo điều kiện cải thiện huyết động học miễn là duy trì được sự mở lại phế nang và oxy hóa đầy đủ. Vì tăng oxy máu (PaO2 >120 mmHg) có hại cho chức năng cơ quan với kết quả lâm sàng xấu hơn do sản xuất các loài gốc tự do oxy và các phản ứng viêm tiếp theo, điều quan trọng là giảm phần trăm oxy hít vào (FIO2) càng nhanh càng tốt miễn là duy trì được oxy hóa đầy đủ (PaO2 >60 mmHg). Áp lực carbon dioxide động mạch một phần (PaCO2) nên được chuẩn độ để bù đắp cho bất kỳ tình trạng toan chuyển hóa đồng thời nào, với mục tiêu là bình thường hóa pH. Khi đáp ứng các tiêu chí để rút ống nội khí quản, người bệnh có thể được chuyển sang chế độ thông khí hỗ trợ áp lực (PSV). Rút ống nội khí quản sớm sau khi nhập ICU là một thành phần thiết yếu của các giao thức fast-track.
Thông thường, cai thở máy có thể bắt đầu khi người bệnh bắt đầu thở vượt qua tần số được thiết lập trên máy thở. Cai không nên tích cực cho đến khi người bệnh đáp ứng các tiêu chí đã được thiết lập (Bảng 31.1). Các tiêu chí này liên quan đến tình trạng thần kinh, tim, hô hấp và thận của người bệnh. Chúng xác định một người bệnh tỉnh táo, thân nhiệt bình thường và ổn định về huyết động học mà rất có thể sẽ không cần phải quay lại phòng mổ vì chảy máu do phẫu thuật. Một phương pháp cai là giảm dần tần số thiết lập trên máy thở cho đến khi người bệnh liên tục kích hoạt nhịp thở, sau đó máy thở có thể được chuyển sang mức hỗ trợ áp lực thấp (thường là 5 cm PEEP và 5 cm hỗ trợ) cho một thử nghiệm thở tự nhiên chính thức (SBT). Người bệnh có thể duy trì trao đổi khí hợp lý và không thở nhanh sau 30 phút với hỗ trợ áp lực thì sẵn sàng để rút ống nội khí quản. Tại một số cơ sở, cơ học phổi của người bệnh (Hộp 31.1) được đánh giá để xác nhận thêm. Một chiến lược cai thở thay thế là thử SBT mỗi 30 phút khi người bệnh tiếp tục hồi phục từ gây mê cho đến khi đáp ứng một tiêu chí nhất định (xem Bảng 31.1). Cả hai phương pháp đều an toàn và không có phương pháp nào có lợi thế rõ ràng hơn phương pháp kia. Hầu hết người bệnh trải qua phẫu thuật tim với chức năng phổi bình thường trước phẫu thuật không yêu cầu cai dần từ máy thở. Nếu người bệnh vẫn ổn định trong quá trình hồi phục từ gây mê và không có bệnh phổi đáng kể, việc giảm nhanh chóng hỗ trợ máy thở xuống mức tối thiểu có thể được thực hiện an toàn dưới sự quan sát chặt chẽ, và người bệnh có thể được đánh giá để rút ống nội khí quản. Phương pháp rút khỏi hỗ trợ thông khí khác nhau giữa các cơ sở tùy thuộc vào đặc điểm của từng ICU.
Bảng 31.1 Tiêu chí để rút ống nội khí quản sau phẫu thuật tim.
| Tiêu chí chung | Tỉnh táo và làm theo lệnh; giảm đau đầy đủ
Ổn định huyết động họca: MAP >65 mmHg, CI >2 L/phút/m^2^ Tình trạng axit-bazơ bình thường: pH 7.32 Dẫn lưu ngực <50 mL/giờ Lượng nước tiểu >0,5 mL/kg/phút Nhiệt độ trung tâm >36°C, không run |
| Tiêu chí đường thở | Ho và phản xạ hầu họng còn nguyên vẹn
Giãn cơ thần kinh được đảo ngược hoàn toàn Dịch tiết phổi có thể kiểm soát được X-quang ngực trong phạm vi dự kiến |
| Tiêu chí trao đổi khí | PaO2 >70 mmHg với 40% FIO2; PaCO2 <50 mmHg;
PEEP ở 5 cm H2O Không có dấu hiệu suy hô hấp: f/VT <100 trên PSV hoặc T-piece; RR 10–30/phút NIF ≤ -25 cmH2O FVC >10 mL/kg |
a Cho phép sử dụng thuốc co mạch, tăng co bóp và các thiết bị hỗ trợ tuần hoàn (bơm bóng đối xung động mạch chủ) miễn là không có sự tăng mức độ hỗ trợ.
CI, Chỉ số tim; FiO2, phần trăm oxy hít vào; FVC, dung tích sống thở mạnh; f/VT, tần số hô hấp/thể tích khí lưu thông; MAP, áp lực động mạch trung bình; NIF, lực hít vào âm; PaCO2, áp lực riêng phần carbon dioxide động mạch; PaO2, áp lực riêng phần oxy động mạch; RR, tần số hô hấp.
Hộp 31.1. Các yếu tố dự đoán thành công khi cai thở máy
Cơ học
Trao đổi khí
FIO2, Phần trăm oxy hít vào; PAO2, áp lực oxy phế nang một phần; PaO2, áp lực oxy động mạch một phần. |
THÔNG KHÍ KÉO DÀI VÀ CAI THÔNG KHÍ
Sự xuất hiện các biến chứng hô hấp và thời gian đặt nội khí quản đã được chứng minh là có tương quan với tỷ lệ tử vong ở người bệnh đã trải qua các phẫu thuật tim. Vì thông khí cơ học có thể có biến chứng đe dọa tính mạng, nên cần ngừng càng sớm càng tốt. Điều quan trọng là nhận ra rằng thời gian đặt nội khí quản kéo dài có thể dẫn đến rối loạn chức năng lông chuyển của đường hô hấp, giảm khả năng làm sạch chất tiết, xẹp phổi, mê sảng và viêm phổi liên quan đến thở máy. Quá trình ngừng thông khí cơ học, gọi là cai thở máy, là một trong những vấn đề thách thức nhất trong chăm sóc tích cực, và chiếm một tỷ lệ đáng kể trong khối lượng công việc của nhân viên ICU.
Hầu hết người bệnh phẫu thuật tim được cai thở máy nhanh chóng, nhưng có tới 6% tất cả người bệnh trải qua phẫu thuật CABG cần thông khí cơ học trong hơn 1 ngày và khoảng 2% vẫn phải thở máy trong hơn 2 tuần. Việc xác định các yếu tố nguy cơ trước phẫu thuật hạn chế khả năng cai thở máy đã gặp khó khăn, nhưng các yếu tố phổ biến bao gồm tuổi cao, thiếu hụt thần kinh rõ rệt, suy thận cấp tính với quá tải thể tích, chức năng tim hạn chế trong giai đoạn quanh phẫu thuật, huyết động không ổn định, và nhiễm trùng huyết. Các yếu tố dự báo thất bại cai thở máy khác trong và sau phẫu thuật bao gồm CPB kéo dài, bệnh phổi có sẵn từ trước (ví dụ: bệnh phổi tắc nghẽn mạn tính [COPD]), liệt cơ hoành, suy dinh dưỡng và nhu cầu oxy cao.
Sự khác biệt về tiêu thụ oxy giữa thở tự nhiên và thông khí cơ học hoàn toàn có thể đáng kể. Các xét nghiệm chức năng phổi trước phẫu thuật thường quy đã không thành công trong việc làm yếu tố dự báo cho thông khí cơ học kéo dài. Phân tầng nguy cơ với các hệ thống tính điểm đã thiết lập đã dẫn đến kết quả hỗn hợp khi dự đoán thời gian đặt nội khí quản sau phẫu thuật tim.
Các phương pháp được sử dụng để cai thở máy bao gồm thông khí bắt buộc ngắt quãng đồng bộ (SIMV), thông khí hỗ trợ áp lực (PSV), và thử nghiệm T-piece với thở tự nhiên. Cho đến đầu những năm 1990, tất cả các phương pháp cai thở được coi là có hiệu quả như nhau, và phán đoán của bác sĩ hồi sức được coi là yếu tố quyết định quan trọng. Điều này đã thay đổi với kết quả của các thử nghiệm đối chứng ngẫu nhiên cho thấy thời gian cai thở dài gấp ba lần với SIMV so với SBT. SBT có thể ngắn chỉ 30 phút và dường như hiệu quả khi thực hiện một lần mỗi ngày như là nhiều lần một ngày.
Giao thức cai thở máy hoặc giao thức cai thở tự động có thể tạo điều kiện thuận lợi cho nhiệm vụ thách thức của việc cai thở. Đánh giá cơ học hô hấp theo lịch trình cũng có thể dự đoán thành công khi cai thở. Trong số người bệnh không thể cai thở, việc ngắt kết nối khỏi máy thở gần như ngay lập tức được theo sau bởi sự gia tăng tần số hô hấp và giảm thể tích khí lưu thông. Tỷ lệ tần số hô hấp/thể tích khí lưu thông (f/VT), còn được gọi là chỉ số thở nhanh nông, đã được sử dụng với một số thành công như một yếu tố dự báo thất bại cai thở. Tỷ lệ f/VT lớn hơn 105 dẫn đến 95% người bệnh thất bại trong việc cai thở, trong khi tỷ lệ f/VT nhỏ hơn 105 dẫn đến thành công cai thở là 80%. Trong một thử nghiệm ngẫu nhiên, một phương pháp tiếp cận hai giai đoạn đối với việc cai thở – đo lường có hệ thống các yếu tố dự báo, bao gồm f/VT, tiếp theo là một thử nghiệm thở tự nhiên hàng ngày duy nhất – được so sánh với quản lý thông thường. Mặc dù các người bệnh được chỉ định cho phương pháp tiếp cận hai giai đoạn thường bệnh nặng hơn những người được chỉ định cai thở thông thường, họ đã được cai thở nhanh gấp đôi. Phương pháp này không chỉ tiết kiệm chi phí mà còn làm giảm tỷ lệ biến chứng khi so sánh với quản lý thông thường.
Ngoài việc tăng nỗ lực hô hấp, một nỗ lực thở tự nhiên không thành công gây ra căng thẳng tim mạch đáng kể. Người bệnh có thể có sự gia tăng đáng kể về hậu tải tâm thất phải và trái, với mức tăng 39% và 27% trong áp lực động mạch phổi và động mạch hệ thống, tương ứng, rất có thể vì các dao động âm trong áp lực lồng ngực cực đoan hơn. Mặc dù hầu hết người bệnh cho thấy cải thiện huyết động học với việc cai thở máy áp lực dương thứ phát do cải thiện tiền tải và ngừng an thần, những tăng hậu tải như vậy có thể được dung nạp rất kém ở những người bị suy tim nặng. Một trong những lý do phổ biến nhất của việc thất bại cai thở là phù phổi, làm xấu đi trao đổi khí và tăng công thở. Chẩn đoán chính xác được thực hiện bằng khám lâm sàng cẩn thận, đánh giá cân bằng dịch ròng và xem xét X-quang ngực. Nguyên nhân của phù phổi sẽ hướng dẫn điều trị. Chú ý cẩn thận đến cân bằng dịch và sử dụng lợi tiểu tích cực hoặc siêu lọc khi được chỉ định cho người bệnh có chức năng tim tốt là các thành phần thiết yếu của liệu pháp. Người bệnh có chức năng tim kém và phù phổi cần giảm hậu tải và/hoặc liệu pháp tăng co bóp và giãn mạch kết hợp với lợi tiểu để chuẩn bị cho việc rút ống nội khí quản thành công.
Quản lý dài hạn thất bại cai thở được tạo điều kiện bằng cách thực hiện mở khí quản, cho phép giảm an thần, cải thiện vệ sinh phổi và sử dụng thông khí ngắt quãng, nhưng có nguy cơ tỷ lệ viêm trung thất cao hơn. So sánh giữa mở khí quản mở và mở khí quản qua da giãn nở tại giường ở người bệnh phẫu thuật tim ngực cho thấy không có sự khác biệt lâm sàng đáng kể nhưng có tiềm năng tiết kiệm chi phí đáng kể với phương pháp sau.
Giai đoạn ổn định
ÁP LỰC TƯỚI MÁU
Sự đầy đủ của tưới máu mô và cung lượng tim (CO) thường được đánh giá bằng đánh giá lâm sàng về nhịp tim (HR), nhịp tim, huyết áp (BP), tưới máu da, thời gian làm đầy mao mạch và lượng nước tiểu. Một người bệnh có tưới máu da tốt và các giá trị bình thường cho áp lực động mạch trung bình (MAP), HR và lượng nước tiểu có thể có CO bình thường và tưới máu mô đầy đủ. Tuy nhiên, các thông số này vẫn không nhạy đối với rối loạn oxy hóa (sử dụng oxy mô bất thường) và được coi là các chỉ số thay thế kém của các dấu hiệu cung cấp oxy ở mức mô, vì oxy hóa mô được xác định bởi cân bằng ròng giữa cung cấp oxy tế bào và nhu cầu oxy. Các phép đo gián tiếp về tưới máu mô và oxy hóa bao gồm tính toán cung cấp oxy hoặc đo bão hòa oxy máu tĩnh mạch hỗn hợp (SvO2). SvO2 có thể được đo dễ dàng hoặc ngắt quãng từ phân tích khí máu hoặc liên tục với ống thông động mạch phổi sợi quang. Tầm quan trọng của việc theo dõi nồng độ lactate động mạch ở người bệnh nặng đã được ủng hộ, và nồng độ lớn hơn 2 mmol/L thường được coi là một dấu hiệu sinh hóa của oxy hóa không đầy đủ. Tuy nhiên, cần nhớ rằng việc sử dụng thuốc tăng co bóp beta-adrenergic có thể tạo ra tình trạng toan lactic loại B thông qua hoạt động glycolytic tăng lên trong cơ xương, điều này có thể gây nhầm lẫn trong việc sử dụng lactate tăng để phát hiện tình trạng tưới máu kém. Các phương pháp khác để đánh giá tưới máu mô bao gồm quang phổ cận hồng ngoại, đo pH dạ dày ruột và theo dõi trực tiếp oxy hóa mô với điện cực Clark thu nhỏ có thể cấy ghép. Một nghiên cứu gần đây đã so sánh việc sử dụng thời gian làm đầy mao mạch bình thường (CRT) với mức lactate huyết thanh như một mục tiêu hồi sức ở người bệnh sốc nhiễm trùng. Có sự giảm 8,5% nguy cơ tử vong sau 28 ngày trong nhóm CRT so với nhóm lactate; tuy nhiên, không có sự khác biệt đáng kể giữa hai nhóm. Trong thực hành lâm sàng, sự kết hợp của cả theo dõi trực tiếp tưới máu mô và các dấu ấn sinh học gián tiếp có thể cung cấp chiến lược hồi sức tốt nhất ở người bệnh nặng.
HUYẾT ÁP
Một trong những biến số sinh lý năng động nhất trong giờ đầu tiên của chăm sóc ICU hậu phẫu là MAP, thay đổi nhanh chóng do những thay đổi động trong tiền tải, hậu tải và chức năng tâm thất. Dịch chuyển và giãn tĩnh mạch dẫn đến giảm tiền tải, trong khi giãn tiểu động mạch do viêm lan rộng và thuốc an thần dẫn đến giảm hậu tải. Choáng tim từ thiếu máu cục bộ, tuần hoàn ngoài cơ thể hoặc ngưng tuần hoàn hạ thân nhiệt sâu có thể dẫn đến cả độ giãn nở và khả năng co bóp tâm thất kém. Rối loạn loạn nhịp cũng có thể có tác động đáng kể đến MAP. Nhịp chậm có thể do phù nề hệ thống dẫn truyền, tổn thương do phẫu thuật hoặc tác dụng của thuốc, trong khi rung nhĩ hoặc mất đồng bộ nhĩ thất khác cản trở việc đổ đầy của tâm thất sau phẫu thuật cứng. Mặc dù hạ huyết áp không có định nghĩa cụ thể, sự đồng thuận chung là mục tiêu MAP từ 60 đến 80 mmHg là lý tưởng và huyết áp tâm thu dưới 90 mmHg hoặc MAP dưới 60 mmHg biểu thị hạ huyết áp. Tuy nhiên, huyết áp cơ bản của người bệnh phải được xem xét vì điều đó xác định phạm vi tự điều hòa cho các cơ quan cuối như não hoặc thận. Ở người bệnh người lớn tuổi và những người có bệnh mạch máu não hoặc bệnh thận từ trước, có thể cần MAP cao hơn để tưới máu đầy đủ cho các mô quen với tình trạng tăng huyết áp mạn tính. Huyết áp tâm trương là yếu tố quyết định chính của dòng máu cơ tim, do đó phải chú ý đến huyết áp tâm trương nếu có bằng chứng thiếu máu cục bộ cơ tim. Thỉnh thoảng, phẫu thuật viên tim có thể yêu cầu mục tiêu BP thấp hơn nếu họ cho rằng nguy cơ chảy máu đặc biệt cao. Những trường hợp như vậy đòi hỏi sự cân bằng cẩn thận giữa đảm bảo tưới máu cơ quan đầy đủ đồng thời giảm thiểu nguy cơ chảy máu.
Giảm thể tích máu là nguyên nhân phổ biến nhất của hạ huyết áp ở người bệnh sau phẫu thuật. Làm ấm ngoại vi gây ra giãn mạch, đòi hỏi mở rộng thể tích máu lưu thông để điều trị. Chảy máu tiếp diễn đòi hỏi thay thế thể tích trong lòng mạch. Chẩn đoán giảm thể tích máu dựa vào quan sát lâm sàng (dấu hiệu sinh tồn, lượng dịch từ dẫn lưu ngực, lượng nước tiểu), X-quang ngực và siêu âm tại điểm chăm sóc (POCUS).
Mặc dù việc đo lường CVP và áp lực bít mao mạch phổi (PCOP) đã thường được sử dụng để xác định nhu cầu đáp ứng dịch, dữ liệu ngày càng tăng cho thấy cả giá trị tuyệt đối và xu hướng của chúng có thể gây hiểu lầm, với giá trị dự đoán âm và dương kém. Khi được sử dụng trong các tình huống lâm sàng thích hợp, thông tin chính xác hơn được thu được từ các chỉ số động như biến thiên áp lực mạch (PPV), biến thiên thể tích tâm thu (SVV), và khả năng giãn nở/xẹp của tĩnh mạch chủ dưới (IVC). Bởi vì mỗi phương pháp này cố gắng ước tính phản ứng của hệ thống tim mạch đối với thay đổi dịch, sự xác nhận tốt nhất về đáp ứng dịch có thể là sự cải thiện trong thể tích tâm thu (và do đó CO) đo bằng ống thông động mạch phổi, siêu âm tim, hoặc tích phân vận tốc-thời gian động mạch cảnh (VTI) ngay sau khi áp dụng một lượng nhỏ tinh thể hoặc một thử nghiệm nâng chân thụ động. Người bệnh không đáp ứng với lượng nhỏ dịch không có khả năng đáp ứng với nhiều thể tích hơn.
Dịch hồi sức tốt nhất để sử dụng cho người bệnh phẫu thuật tim phụ thuộc vào tình huống lâm sàng. Người bệnh trong sốc do mất máu từ mất máu nhanh chóng cần truyền máu nhanh chóng bằng các chế phẩm máu, ban đầu được đưa ra ở tỷ lệ 1:1:1 của hồng cầu khối, huyết tương và tiểu cầu để giảm rối loạn đông máu. Các phép đo thường xuyên về hemoglobin, tiểu cầu, thời gian prothrombin (PT), thời gian thromboplastin một phần (PTT), và fibrinogen sẽ giúp hướng dẫn liệu pháp ban đầu, trong khi việc sử dụng TEG hoặc ROTEM có thể cung cấp thêm thông tin về chức năng của toàn bộ thác đông máu và cung cấp đánh giá chính xác về nhu cầu sản phẩm thêm.
Người bệnh được coi là đáp ứng với thể tích nhưng có số lượng máu và thông số đông máu bình thường và không có lượng chảy máu tích cực đáng kể có thể được phục vụ tốt hơn bằng hồi sức với dung dịch tinh thể để tránh nguy cơ phản ứng truyền máu, nhiễm trùng và điều hòa miễn dịch liên quan đến các chế phẩm máu. Về lựa chọn tinh thể, bằng chứng gần đây cho thấy việc sử dụng Ringer lactat và Plasmalyte thay vì nước muối sinh lý dẫn đến tránh toan chuyển hóa tăng clo và cải thiện kết quả thận. Việc sử dụng dịch có chứa keo trong hồi sức tiếp tục là một chủ đề tranh luận. Mặc dù việc sử dụng keo có thể dẫn đến nhu cầu ít hơn về dịch truyền để đạt được kết quả có ý nghĩa lâm sàng, chúng đắt tiền hơn nhiều, không cho thấy lợi ích nhất quán trong các thử nghiệm lâm sàng lớn của người bệnh nặng, và có nguy cơ lý thuyết về việc phân phối các chất có hoạt tính thẩm thấu trên khắp cơ thể nơi chúng hoạt động như một ổ cho sự phát triển của phù mô. Nếu hồi sức keo được chọn trong quần thể phẫu thuật tim, việc sử dụng albumin được ưa thích hơn hetastarch vì những liên kết với tăng tổn thương thận từ cái sau.
Các lựa chọn chẩn đoán và điều trị thay thế cần được xem xét nếu hồi sức tiền tải không thành công trong việc cải thiện MAP. Giãn mạch với hạ huyết áp liên quan, thường nghiêm trọng, là một biến chứng thường gặp xảy ra ở tới 8% người bệnh sau CPB và phẫu thuật tim. Mặc dù các cơ chế cơ bản của sốc giãn mạch này vẫn chưa rõ ràng, phân số tống máu thấp và sử dụng thuốc ức chế men chuyển angiotensin đã được xác định là các yếu tố tiền đề, và thuốc gây mê, làm ấm ngoại vi, thiếu máu, và các mức độ khác nhau của đáp ứng viêm hệ thống với mạch ngoài cơ thể cũng có thể đóng góp. Bằng cách đo trực tiếp CO và CVP, ống thông động mạch phổi cho phép tính toán kháng lực mạch máu hệ thống (SVR) và chẩn đoán nhanh chóng giãn động mạch như nguyên nhân của MAP thấp. Trước khi thực hiện các biện pháp tích cực để tăng SVR, điều quan trọng là đảm bảo rằng người bệnh được bổ sung đủ thể tích và có khả năng co bóp tim đầy đủ. Thuốc co mạch có thể cung cấp một biện pháp tạm thời quan trọng để duy trì áp lực tưới máu vành trong khi các quá trình này đang được điều chỉnh, nhưng sau đó nên được đánh giá lại.
Lựa chọn đầu tiên thường gặp của các thuốc bao gồm norepinephrine và vasopressin. Hai loại này đã được so sánh trực tiếp như một thuốc co mạch đầu tay trong cả hai quần thể hậu phẫu tim và nhiễm trùng huyết. Mặc dù tỷ lệ tử vong và kết quả tổng hợp chính tương tự giữa các thuốc, vasopressin dẫn đến ít nhu cầu liệu pháp thay thế thận hơn và giảm tỷ lệ rung nhĩ. Khi cần norepinephrine liều cao (>0,1 μg/kg/phút), arginine vasopressin đã được chứng minh là hữu ích trong việc tăng BP và giảm yêu cầu norepinephrine, đặc biệt là ở người bệnh trải qua đặt thiết bị hỗ trợ tâm thất trái (LVAD). Phenylephrine là một lựa chọn khác nếu cần một thuốc co mạch thuần túy, trong khi epinephrine và dopamine là các thuốc hữu ích để cung cấp cả tăng co bóp và hỗ trợ SVR. Trong trường hợp giãn mạch nặng, khó kiểm soát, xanh methylen và hydroxocobalamin có thể hữu ích để giảm mức nitric oxide tiểu động mạch. Khi sử dụng các thuốc này, cần lưu ý rằng xanh methylen có thể gây tan máu ở người bệnh thiếu enzyme G6PD và hội chứng serotonin ở người bệnh dùng thuốc serotonergic. Tương tự, hydroxocobalamin cũng can thiệp vào các xét nghiệm trong phòng thí nghiệm dựa trên phân tích màu sắc và có thể gây báo động rò rỉ máu trong máy lọc máu. Bất kể lựa chọn thuốc nào, khi thuốc co mạch được sử dụng trong thời gian kéo dài, điều cần thiết là tránh giảm thể tích máu vì có thể dẫn đến tưới máu ngoại vi nặng nề với hoại tử.
Canxi làm tăng BP mà không làm giảm CO và có tác động không đáng kể đến HR. Tuy nhiên, việc sử dụng thường xuyên canxi để điều trị hạ huyết áp và CO thấp sau phẫu thuật tim vẫn còn gây tranh cãi. Dùng canxi dạng bolus có thể làm suy giảm dòng chảy động mạch vú trong (IMA) và có khả năng kích hoạt co thắt mạch. Hơn nữa, không mong muốn mức canxi ion hóa cao bất thường, do đó việc sử dụng lặp lại nên được hướng dẫn bởi mức trong máu. Mức máu thấp có thể do tích tụ citrate khi truyền các sản phẩm máu nhanh và có thể làm giảm đáp ứng mạch máu với catecholamine. Người bệnh bị suy gan đáng kể đặc biệt dễ bị hạ canxi máu do truyền sản phẩm vì không có khả năng chuyển hóa citrate nhanh chóng. Nếu cần tiếp tục truyền sản phẩm máu, cần kiểm tra mức canxi thường xuyên để duy trì mức canxi ion hóa bình thường.
Thông khí áp lực dương có thể gây ra giảm thể tích máu tương đối bằng cách loại bỏ độ chênh lệch áp lực tĩnh mạch bình thường cho việc đổ đầy tâm nhĩ phải. Áp lực điều khiển và PEEP cao hơn sẽ cản trở dòng máu vào lồng ngực, đặc biệt là khi có tình trạng giảm thể tích máu và do đó áp lực đổ đầy thấp. Tác động này có thể được phóng đại ở người bệnh bị COPD do tăng căng động, nơi sự giữ khí ngăn cản sự thở ra hoàn toàn trước khi nhịp thở tiếp theo được máy thở cung cấp. Sự hiện diện của áp lực dương cuối thì thở ra nội tại (auto-PEEP) là chẩn đoán của tình trạng này. Điều chỉnh cài đặt máy thở để tăng thời gian thở ra sẽ giúp giảm nhẹ vấn đề này. Sự phát triển của tràn khí màng phổi áp lực do tắc nghẽn ống dẫn lưu ngực hoặc tổn thương phổi ẩn trong quá trình phẫu thuật không được dẫn lưu bởi ống dẫn lưu ngực (thường là bên phải) cũng có thể làm suy giảm cấp tính đổ đầy tim phải. Đảm bảo rằng nghe được âm thở và đối xứng khi đến ICU, cũng như kiểm tra kỹ lưỡng X-quang ngực ban đầu sau phẫu thuật, sẽ xác định biến chứng tiềm ẩn này và hướng dẫn liệu pháp (ví dụ: đặt ống dẫn lưu ngực). Siêu âm ngực cũng rất nhạy đối với chẩn đoán tràn khí màng phổi trong tay của người vận hành được đào tạo. Nó có thể cho phép chẩn đoán ở người bệnh không ổn định nhanh hơn khi chờ đợi X-quang ngực.
Một số người bệnh có tăng huyết áp sau phẫu thuật thay vì hạ huyết áp trong ICU. Huyết áp hệ thống cần được kiểm soát ở phạm vi MAP từ 70 đến 80 mmHg vì MAP quá cao có thể làm tăng chảy máu và tạo ra hậu tải quá mức, sau đó khả năng co bóp và độ giãn nở cơ tim bị tổn hại và nhu cầu oxy cơ tim tăng lên. Tăng huyết áp sau phẫu thuật có thể do thiếu oxy, tăng carbon dioxide, đau, an thần không đầy đủ hoặc run. Trước khi liệu pháp với các thuốc giãn mạch được bắt đầu, các nguyên nhân này cần được loại trừ. Nitroprusside và nitroglycerin thường được sử dụng và các thuốc thay thế bao gồm nicardipine, labetalol, hydralazine và esmolol. Sự giãn mạch do propofol cũng có thể hữu ích để điều chỉnh BP nhanh chóng ở người bệnh đặt ống nội khí quản. Nitroprusside được sử dụng rộng rãi vì nó tác động nhanh chóng và có thể dễ dàng chuẩn độ để có hiệu quả và đáp ứng với những thay đổi đột ngột trong tiền tải và hậu tải. Tuy nhiên, việc sử dụng nó có liên quan đến nhu cầu thay thế thể tích bù trừ, nhịp tim nhanh phản xạ, nhiễm độc cyanide và methemoglobinemia. Đặc điểm của nicardipine tiêm tĩnh mạch là tính đặc hiệu động mạch, cho phép chuẩn độ chính xác huyết áp mà không ảnh hưởng đến thể tích trong lòng mạch. Tính chất này là quan trọng trong tăng huyết áp quanh phẫu thuật, vì co thắt động mạch với các mức độ giảm thể tích trong lòng mạch khác nhau là đặc điểm trung tâm của những người bệnh đó. Nicardipine dẫn đến giảm áp lực động mạch trung bình và kháng lực mạch máu hệ thống, cũng như tăng CO, nhưng nó không ảnh hưởng đến áp lực đổ đầy.
CUNG LƯỢNG TIM
Việc sử dụng thường xuyên của các phép đo liên tục hoặc ngắt quãng của các chỉ số huyết động tính toán không cần thiết cho người bệnh có nguy cơ thấp trải qua CABG tự nguyện. Khi ống thông động mạch phổi được sử dụng ở người bệnh phẫu thuật tim nguy cơ cao hoặc phức tạp, chỉ số tim mục tiêu (CI, bằng CO trên diện tích cơ thể) lớn hơn 2,0 L/phút/m². Tối ưu hóa CI nhằm tối đa hóa khả năng bơm của hệ thống tim mạch. CI giảm nên được giải quyết trước khi các dấu hiệu tưới máu kém rõ ràng và thiếu oxy mô phát triển, ngay cả khi CI cơ bản thấp. Các phép đo lâm sàng về hiệu suất tâm thất phải và trái, như tiền tải hoặc tình trạng thể tích, hậu tải (SVR), HR và khả năng co bóp cơ tim, là thiết yếu để hướng dẫn liệu pháp hướng tới trạng thái huyết động ổn định. Máu, dung dịch tinh thể hoặc keo có thể được truyền để tăng tiền tải. CI cũng có thể được cải thiện bằng cách tối ưu hóa hậu tải với một thuốc giãn mạch như nitroprusside. Với tiền tải và hậu tải được tối ưu hóa, CI đôi khi có thể tăng lên bằng cách tạo nhịp nhĩ hoặc nhĩ thất (AV) tuần tự sử dụng dây tạo nhịp ngoại tâm mạc ở tần số cao hơn so với HR nội tại. Nếu tiền tải và hậu tải được tối ưu hóa, thể tích tâm thu (SV) thường sẽ giữ nguyên và HR cao hơn sẽ làm tăng CI. Nếu CI mục tiêu lớn hơn 2,0 L/phút/m² không đạt được với việc tối ưu hóa tiền tải, hậu tải và HR, thuốc tăng co bóp thường được yêu cầu để cải thiện khả năng co bóp tim. Dường như không có sự khác biệt đáng kể về kết quả của người bệnh giữa các thuốc tăng co bóp thường được sử dụng, nhưng các phẫu thuật viên tim và bác sĩ hồi sức thường có sở thích cá nhân dựa trên sự quen thuộc với thuốc và kinh nghiệm lâm sàng. Một sự phân biệt quan trọng cần làm ở người bệnh hạ huyết áp là giữa sự giảm thể tích máu trong lòng mạch tương đối do giãn mạch trong quá trình làm ấm và giảm thể tích máu thứ phát do chảy máu. Khả năng co bóp cơ tim có thể giảm thêm trong giai đoạn hậu phẫu ngay lập tức, đòi hỏi tiếp tục hỗ trợ tăng co bóp hoặc tăng cường hỗ trợ bằng hỗ trợ cơ học (ví dụ: bơm bóng đối xung động mạch chủ [IABP]).
Có một loạt các thuốc tăng co bóp, bao gồm epinephrine, milrinone, dobutamine và dopamine. Kiến thức sâu sắc về hồ sơ tăng co bóp, giãn mạch hoặc co mạch và tăng nhịp tim của mỗi loại thuốc là cần thiết để đạt được hiệu quả mong muốn. Kết hợp các thuốc tăng co bóp và co mạch được lựa chọn khi khả năng co bóp giảm đáng kể kết hợp với hạ huyết áp nghiêm trọng. Điều này điển hình cho các chất ức chế phosphodiesterase như milrinone thường cung cấp hiệu quả tăng co bóp mong muốn nhưng không phải không có giãn mạch đáng kể. Do đó, norepinephrine hoặc vasopressin có thể được yêu cầu kết hợp với milrinone để giải quyết giãn mạch điển hình sau phẫu thuật có liên quan đến milrinone. Kết hợp milrinone và epinephrine cho phép sử dụng các tác động tăng co bóp khác nhau của chúng cùng với tác dụng co mạch của epinephrine để điều trị hạ huyết áp. Nếu nhu cầu milrinone được dự đoán trong phòng mổ, lý tưởng nhất là bắt đầu trong quá trình CPB để tránh liều nạp với hạ huyết áp vốn có của nó. Ngoài tác dụng tăng co bóp, milrinone cũng cung cấp tác dụng tăng giãn cơ (lusitropy), có lợi ở người bệnh bị rối loạn chức năng tâm trương nặng. Dopamine có thể được chọn như một thuốc thay thế hoặc để tăng CO hoặc để cho phép cai epinephrine, nhưng nó có thể dẫn đến nhịp tim nhanh quá mức và tăng nguy cơ rung nhĩ. Dobutamine thường liên quan đến đáp ứng tăng nhịp tim tích cực và có thể là một lựa chọn tốt để tăng CO nếu áp lực động mạch phổi tăng cao và HR cơ bản thấp.
CÁC PHƯƠNG THỨC HỖ TRỢ CƠ HỌC
Hỗ trợ tuần hoàn cơ học (MCS) được bắt đầu một cách chủ động trong phòng mổ hoặc được cung cấp trong ICU khi CO thấp vẫn tồn tại mặc dù có tiền tải đầy đủ, kháng lực mạch máu hệ thống tối ưu và hỗ trợ tăng co bóp tối đa. Các hình thức MCS ngắn hạn bao gồm IABP, bơm vi trục ống đơn (Impella, [Abiomed Inc., Danvers, MA]), bơm ngoài cơ thể nhiều ống thông (TandemHeart [Cardiac Assist Inc., Pittsburgh, PA], CentriMag [Thoratec, Pleasanton, CA]), và hỗ trợ sự sống ngoài cơ thể tĩnh mạch-động mạch (VA ECLS). Các thiết bị “bền vững” dài hạn bao gồm LVAD có thể cấy ghép và tim nhân tạo toàn phần (SynCardia [SynCardia Systems, Inc, Tucson, AZ]). Mô tả chi tiết về các thiết bị này và quản lý chúng nằm ngoài phạm vi của văn bản này, nhưng một tóm tắt ngắn gọn được trình bày.
Quyết định bắt đầu MCS phải được cá nhân hóa cho từng người bệnh. CO thấp dai dẳng và hạ huyết áp kết hợp với SVR tăng cao, không đáp ứng với dịch, đáp ứng không đầy đủ với thuốc tăng co bóp, và dấu hiệu tưới máu mô kém thường nên thúc đẩy xem xét các lựa chọn MCS. Một công cụ có thể hữu ích là chỉ số công suất tim (CPI), chuẩn hóa công suất tim với diện tích bề mặt cơ thể (BSA) với công thức sau: CPI = (MAP × CI)/451. CPI đã được tìm thấy tương quan với tỷ lệ tử vong trong sốc tim trong nhiều nghiên cứu. Dữ liệu hồi cứu cho thấy giá trị dưới 0,34 watts/m² tại thời điểm cấy ghép thiết bị có liên quan đến tăng tỷ lệ tử vong 90 ngày. Do đó, CPI dưới mức đó nên gợi ý khởi đầu hỗ trợ cơ học nhanh chóng.
Một khi quyết định thực hiện MCS được đưa ra, thiết bị cụ thể được chọn qua tham vấn với các nhóm phẫu thuật và can thiệp tim mạch. Nếu chức năng tim phải được coi là đầy đủ, các thiết bị bên trái thường được sử dụng là IABP và Impella. IABP tăng áp lực tưới máu vành bằng cách bơm phồng trong suốt tâm trương và cũng giảm hậu tải bằng cách xẹp trong suốt tâm thu. Sự cải thiện kết quả về cung cấp oxy cơ tim và giảm nhu cầu có tiềm năng làm tăng CO đáng kể. Tuy nhiên, thiết bị yêu cầu nhịp xoang mà không có nhịp tim nhanh đáng kể để định thời điểm bơm phồng thích hợp khi van động mạch chủ đóng, cũng như van động mạch chủ thông thoáng (không có hở động mạch chủ nhiều hơn mức nhẹ). Nó cũng cung cấp rất ít hỗ trợ huyết động trực tiếp. Impella, mặt khác, bơm máu trực tiếp từ tâm thất trái (LV) vào động mạch chủ đi lên và làm như vậy bất kể HR hoặc nhịp. Bằng chứng hiện tại không hỗ trợ lợi ích về tỷ lệ tử vong của thiết bị này so với thiết bị kia trong sốc tim không phân biệt. Nếu cần, tốc độ dòng chảy cao hơn có thể đạt được thông qua việc sử dụng các thiết bị ly tâm ngoài cơ thể sử dụng các ống thông vào và ra riêng biệt như CentriMag và TandemHeart. Các thiết bị này cũng có thể được cấu hình để cung cấp hỗ trợ tâm thất phải (CentriMag) hoặc cung cấp hỗ trợ hai tâm thất đầy đủ (TandemHeart).
Nếu có suy hai tâm thất, MCS tạm thời được cung cấp tốt nhất bởi VA ECLS. Các ống thông tĩnh mạch và động mạch có thể được đặt trung tâm trong phòng mổ hoặc ngoại vi tại giường bệnh. Bằng cách lấy máu từ tâm nhĩ phải, bơm nó qua một bộ oxy hóa và tiêm lại vào hệ thống động mạch (động mạch chủ trong ống thông trung tâm; thường là động mạch đùi trong ống thông ngoại vi), VA ECLS cho phép giảm tải tạm thời, gần như toàn bộ một hệ thống tim phổi đang suy yếu. Giống như tất cả các thiết bị hỗ trợ dòng chảy liên tục khác, dòng chảy đầy đủ phụ thuộc cao vào tiền tải và nhạy cảm với hậu tải. Các biến chứng phổ biến bao gồm chảy máu, huyết khối và thiếu máu chi. VA ECLS cũng có thể dẫn đến giãn LV, với tạo huyết khối LV tương ứng và thiếu máu cục bộ thành tim, nếu thiếu giảm tải LV và khả năng co bóp bản địa vẫn kém. Các lựa chọn để giảm tải LV bao gồm Impella, IABP, tạo lỗ thông liên nhĩ, hoặc dẫn lưu phẫu thuật trực tiếp qua mỏm tim hoặc tâm nhĩ trái. Ống thông ngoại vi có thêm biến chứng là thiếu oxy phân biệt, nơi máu được oxy hóa kém từ phổi được đẩy ra khỏi tâm thất đang hồi phục và cạnh tranh với máu được oxy hóa tốt từ ống thông đùi, có khả năng gây ra tình trạng thiếu oxy ở bên phải cung động mạch chủ. Phát hiện được tạo điều kiện bằng cách theo dõi độ bão hòa oxy mạch và khí máu động mạch từ chi trên bên phải.
Cai khỏi các thiết bị hỗ trợ tạm thời trong bối cảnh hậu phẫu thuật tim được tạo điều kiện bởi siêu âm tim qua thực quản (TEE). Lưu lượng thiết bị có thể được giảm dần trong khi chú ý cẩn thận đến chức năng tâm thất và các giá trị huyết động. Cần lưu ý rằng hầu hết các thiết bị đều có cài đặt lưu lượng tối thiểu được khuyến nghị để ngăn ngừa huyết khối và lưu lượng không nên giảm xuống dưới mức như vậy trừ khi việc rút ống thông ngay lập tức được lên kế hoạch.
Mặc dù bác sĩ hồi sức tại giường bệnh không có khả năng tham gia vào quyết định đặt các thiết bị hỗ trợ bền vững dài hạn, kiến thức về chức năng, quản lý và các biến chứng phổ biến của chúng là cần thiết trong thời gian nằm ICU sau cấy ghép. LVAD lấy máu từ một ống thông đầu vào tại mỏm LV và tiêm lại vào một ống thông đầu ra động mạch chủ. Chúng có thể được đặt như một cầu nối đến ghép tim (BTT), cầu nối đến phục hồi, hoặc liệu pháp đích (DT). Trong khi LVAD thế hệ đầu tiên tạo ra dòng chảy có mạch, các thiết bị thế hệ thứ ba hiện đại tạo ra dòng chảy liên tục thông qua một bơm ly tâm sử dụng một cánh quạt được treo từ tính. HeartMate 3 (Abbott, Abbott Park, IL) và Heartware HVAD (Medtronic, HeartWare, Miami Lakes, FL) là hai thiết bị ly tâm hiện có trên thị trường. HeartMate II là một thiết bị dòng trục, không mạch, thế hệ thứ hai, mà cho đến gần đây là thiết bị ưa thích cho DT. Hiện tại, HeartMate 3, HVAD và HeartMate II đều là các thiết bị được Cơ quan Quản lý Thực phẩm và Dược phẩm phê duyệt cho cả BTT và DT. Một biến chứng đáng chú ý của việc đặt LVAD là suy tim phải, có thể xảy ra do cả hình thái thay đổi và khả năng co bóp từ sự dịch chuyển vách liên thất, cũng như do tăng tiền tải tâm thất phải thứ phát sau sự gia tăng CO và do đó tăng trở về tĩnh mạch. Cần chú ý cẩn thận đến CVP, áp lực động mạch phổi và các dấu hiệu ứ máu tĩnh mạch trong giai đoạn ngay sau cấy ghép. Điều trị thông qua thuốc tăng co bóp, lợi tiểu, thuốc giãn mạch phổi và giảm tốc độ bơm để giảm thiểu sự dịch chuyển vách ngăn. Các biến chứng khác bao gồm huyết khối thiết bị, nhiễm trùng và tan máu.
BIẾN CHỨNG HẬU PHẪU
CHẢY MÁU
Người bệnh trải qua phẫu thuật tim với CPB thường có nhiều rối loạn khác nhau về cầm máu (với sự khác biệt đáng kể giữa các người bệnh được giải thích kém bởi các dấu hiệu lâm sàng, quy trình, sinh học và di truyền) thường dẫn đến truyền các sản phẩm máu đồng gen. Hơn 12 triệu đơn vị hồng cầu đồng gen được sử dụng tại Hoa Kỳ hàng năm, với hơn 2 triệu đơn vị được sử dụng cho người bệnh trải qua phẫu thuật tim mạch. Các cơ sở khác nhau đáng kể trong bảo tồn máu quanh phẫu thuật và thực hành truyền máu cho người bệnh phẫu thuật tim. Tùy thuộc vào cơ sở, giữa 27% và 92% người bệnh CABG được truyền máu, và số lượng đơn vị hồng cầu khối nhận được từ 0 đến 4. Người bệnh trải qua mở xương ức lại để phẫu thuật tim có khả năng nhận truyền máu quanh phẫu thuật gấp khoảng ba lần so với những người trải qua phẫu thuật tim lần đầu. Các biến chứng liên quan đến truyền máu đã giảm đáng kể trong 10 đến 15 năm qua nhưng vẫn là một mối quan tâm.
Việc truyền hồng cầu đồng gen gần đây đã được mô tả là một yếu tố nguy cơ cho sự sống sót giảm lâu dài sau phẫu thuật CABG. Một nghiên cứu gần đây khác cho thấy thời gian lưu trữ của RBC được truyền trong giai đoạn quanh phẫu thuật có liên quan đến tăng nguy cơ tử vong ngắn hạn trong bệnh viện và dài hạn ngoài bệnh viện, độc lập với số lượng truyền máu được thực hiện và các yếu tố gây nhiễu khác. Các nguy cơ khác bao gồm nhiễm virus viêm gan C (khoảng 1 trong 50.000), truyền virus suy giảm miễn dịch ở người (ít hơn 1 trong 500.000), không tương hợp nhóm ABO chính (ít hơn 1 trong 33.000), và các phản ứng truyền máu nhỏ (khoảng 1 trong 5).
Theo Hiệp hội Bác sĩ Gây mê Hoa Kỳ (ASA), chi phí của liệu pháp truyền máu tiếp cận 5 đến 7 tỷ đô la mỗi năm tại Hoa Kỳ, với tới 25% truyền RBC được đánh giá là không cần thiết. ASA mạnh mẽ ủng hộ việc sử dụng thận trọng các sản phẩm máu và đã xuất bản một bộ hướng dẫn thực hành. Mặc dù hướng dẫn thực hành không hoàn hảo và không được thay thế cho đánh giá lâm sàng, hướng dẫn ASA cung cấp một mô hình dựa trên khoa học để hỗ trợ ra quyết định. Tuy nhiên, trong quần thể người bệnh phẫu thuật tim, hướng dẫn ASA không tính đến rối loạn chức năng tiểu cầu được biết là xảy ra sau CPB. Khi chảy máu lớn xảy ra trong nhóm người bệnh này, truyền tiểu cầu được chỉ định ngay cả khi số lượng tiểu cầu lớn hơn 100.000.
Đáng tiếc là các hướng dẫn thực hành như của ASA và Hiệp hội Giải phẫu Bệnh học Hoa Kỳ dường như không thay đổi thói quen truyền máu cũ và việc sử dụng không thích hợp các sản phẩm máu không được hạn chế, đặc biệt là trong quần thể phẫu thuật tim. Một lý do có thể cho sự thiếu thành công là thời gian chậm trễ cho đến khi kết quả đông máu trở về từ phòng thí nghiệm làm cho liệu pháp truyền máu trực tiếp khó khăn ở người bệnh đang chảy máu. Để đáp ứng vấn đề này, một số thiết bị xét nghiệm nhanh đang được phát triển. Khi kết hợp với các thuật toán truyền máu theo mục tiêu, các xét nghiệm tại chỗ như vậy có thể cải thiện chăm sóc và hạn chế truyền máu không cần thiết. Các thuật toán này thường kết hợp một số đo lường chức năng tiểu cầu, hoạt động yếu tố đông máu và tiêu sợi huyết làm kích thích cho liệu pháp. Mặc dù không hoàn hảo, đàn hồi đồ cục máu đông dường như là một thành phần chính của các thuật toán như vậy.
Vì giá trị dự đoán âm tính của nó lớn hơn 90%, một TEG bình thường ngụ ý với độ chắc chắn hơn 90% rằng một người bệnh đang chảy máu cần quay lại phòng mổ và sẽ tìm thấy một vị trí chảy máu do phẫu thuật. Việc kết hợp TEG đã tạo ra tỷ lệ phẫu thuật lại đáng kể do chảy máu trong một nghiên cứu đơn trung tâm.
Các chiến lược khác để hạn chế yêu cầu sản phẩm máu cho thấy một số lợi ích trong các thử nghiệm lâm sàng. Liệu pháp chống tiêu sợi huyết làm giảm tỷ lệ chảy máu quá mức sau phẫu thuật do tiêu sợi huyết. Các thuốc chống tiêu sợi huyết hiệu quả bao gồm axit ε-aminocaproic (Amicar [nhiều nguồn]), axit tranexamic và aprotinin. Aprotinin là thuốc duy nhất có bằng chứng cấp độ A mức 1 về việc giảm tỷ lệ truyền máu và quay lại phòng mổ để kiểm soát chảy máu sau phẫu thuật tim. Tuy nhiên, do tăng nguy cơ huyết khối và rối loạn chức năng thận, aprotinin đã bị rút khỏi thị trường vào năm 2007. Amicar và axit tranexamic đã được chứng minh là làm giảm tổng lượng mất máu và giảm số lượng người bệnh cần truyền máu trong quá trình phẫu thuật tim. Trong bản cập nhật năm 2011 cho Hướng dẫn Thực hành Lâm sàng Bảo tồn Máu của Hiệp hội Phẫu thuật Lồng ngực và Hiệp hội Gây mê Tim mạch, các thuốc chống tiêu sợi huyết được khuyến nghị mạnh mẽ (mức độ bằng chứng A) cho việc bảo tồn máu.
Pha loãng máu tự thân trong quá trình phẫu thuật cũng đã chứng minh tác dụng tiết kiệm máu trong một số nghiên cứu, nhưng việc sử dụng thu hồi tế bào sau phẫu thuật không chứng minh được hiệu quả trong việc hạn chế sử dụng các sản phẩm máu trong phẫu thuật tim. Tái truyền máu từ trung thất có thể liên quan đến tần suất nhiễm trùng vết thương cao hơn và không được khuyến nghị.
Trong thực hành hậu phẫu hiện tại, cầm máu được đánh giá bằng cách đo lượng máu chảy ra từ dẫn lưu ngực. Thời gian prothrombin và thời gian thromboplastin một phần hoạt hóa thường tăng nhẹ sau phẫu thuật tim. Thời gian đông máu hoạt hóa cũng có thể được sử dụng như một xét nghiệm tại chỗ để đảo ngược heparin đầy đủ đã được sử dụng trong phẫu thuật. Như đã nêu trước đó, việc kết hợp TEG như một thiết bị theo dõi tại chỗ vào một thuật toán truyền máu cụ thể cho phép chẩn đoán cụ thể hơn về các vấn đề chảy máu và giảm các phương pháp truyền máu bừa bãi. Huyết tương tươi đông lạnh (HTTĐL) không bắt buộc khi không có dẫn lưu đáng kể từ dẫn lưu ngực; nếu dẫn lưu từ dẫn lưu ngực vượt quá 400 mL trong 2 giờ đầu tiên và 100 đến 150 mL/h sau 2 giờ đầu tiên, HTTĐL có thể cần thiết để ngừng chảy máu. Truyền 10 mL/kg HTTĐL thường khôi phục các yếu tố đông máu đến mức đầy đủ. Cũng rất quan trọng để xem xét truyền tiểu cầu ở người bệnh đang chảy máu sau CPB ngay cả khi số lượng tiểu cầu lớn hơn 100.000/μL, vì chức năng tiểu cầu có thể bị suy yếu do tiếp xúc với CPB. Bổ sung tủa lạnh khi mức fibrinogen thấp.
Trong trường hợp chảy máu nghiêm trọng liên tục mặc dù đã truyền các sản phẩm máu, có thể xem xét sử dụng phức hợp prothrombin đậm đặc (PCC). PCC chứa mức tương đối cao của các yếu tố II, IX và X, và trong một số chế phẩm, còn có dạng không hoạt động hoặc hoạt động của yếu tố VII. So với huyết tương, PCC được sử dụng với thể tích nhỏ hơn nhiều, không có phản ứng truyền liên quan đến huyết tương, và tác động nhanh hơn. PCC ban đầu được phê duyệt cho việc đảo ngược khẩn cấp liệu pháp warfarin hoặc thuốc chống đông máu đường uống mới (NOAC) khi không có thuốc giải độc. Việc sử dụng không theo chỉ định của PCC cho chảy máu vi mạch do thiếu hụt yếu tố đông máu gần đây đã chuyển từ liệu pháp cứu hộ sang liệu pháp sớm hơn và thậm chí là liệu pháp đầu tay ở một số trung tâm. Hiện tại không có đủ bằng chứng để khuyến nghị chuyển đổi phổ biến hướng tới việc sử dụng PCC thay thế cho liệu pháp huyết tương đối với chảy máu vi mạch liên quan đến phẫu thuật tim. Khi sử dụng, PCC không hoạt động (Kcentra; CSL Behring, King of Prussia, PA) được khuyến nghị hơn các yếu tố đậm đặc hoạt động như yếu tố VII tái tổ hợp hoạt hóa (rFVIIa, NovoSeven) hoặc phức hợp chống chất ức chế đông máu (FEIBA, Shire, Dublin, Ireland) vì lo ngại về các biến chứng huyết khối liên quan đến cái sau.
Các dẫn lưu ngực cần được đánh giá thường xuyên để tránh tắc nghẽn do cục máu đông. Khi có sự giảm đột ngột lượng dịch từ dẫn lưu ngực, bác sĩ hồi sức nên loại trừ khả năng chảy máu ẩn trong trung thất và túi màng ngoài tim, có thể dẫn đến ép tim. Nếu đáp ứng với truyền máu không thỏa đáng, nên xem xét nghiêm túc việc mở xương ức khám.
RỐI LOẠN NHỊP TIM
Các thay đổi tạm thời về HR hoặc dẫn truyền có thể góp phần vào hạ huyết áp hoặc CO thấp sau phẫu thuật. Khi BP hoặc CO không ổn định, tăng HR nên được xem xét, ngay cả khi nó đã ở mức bình thường. Các mẫu bất thường trong 24 giờ đầu tiên bao gồm loạn nhịp chậm tạm thời, nhịp nhanh xoang (>110 nhịp/phút), và trong trường hợp phẫu thuật van, nhịp nhanh nút với can thiệp nhĩ thất hoặc thậm chí là blốc tim. Rối loạn nhịp thất đáng kể hiếm gặp nhưng nếu có thể gây thách thức trong điều trị.
Loạn nhịp chậm phổ biến sau phẫu thuật tim, và dây tạo nhịp ngoại tâm mạc nhĩ và thất thường được đặt để tạo điều kiện cho tạo nhịp tạm thời trong giai đoạn ngay sau phẫu thuật. Phương thức tạo nhịp tối ưu đã được điều tra. Tạo nhịp hai buồng tối đa hóa CO trong một phạm vi rộng độ trễ AV (100 đến 225 mili giây). Các tình trạng làm suy giảm đổ đầy tâm trương (phì đại tâm thất, bệnh cơ tim, xơ hóa) có thể được hưởng lợi bằng cách kéo dài độ trễ AV.
Tỷ lệ phụ thuộc máy tạo nhịp sau phẫu thuật tim khác nhau giữa các nghiên cứu và khoảng 1% sau CABG, 2% sau thay van lần đầu, 7% sau thay van lặp lại, và 10% sau ghép tim chính vị (OHT). Các yếu tố nguy cơ đã xác định bao gồm vôi hóa vòng van, tuổi cao, blốc nhánh trái trước phẫu thuật, và tăng thời gian CPB. Nguyên nhân của loạn nhịp chậm bao gồm thiếu máu cục bộ, phù nề, và phá hủy không thể phục hồi hệ thống dẫn truyền do phẫu thuật. Sự phục hồi từ các nguyên nhân có thể đảo ngược có thể bị trì hoãn đáng kể. Máy tạo nhịp vĩnh viễn thường được cấy ghép cho rối loạn chức năng nút xoang hoặc blốc AV có triệu chứng kéo dài quá ngày thứ năm sau phẫu thuật. Về lâu dài, tới 40% người bệnh có rối loạn chức năng nút xoang và tới 100% người bệnh có blốc AV hoàn toàn sau ngày 5 vẫn phụ thuộc máy tạo nhịp.
Đối với người bệnh ghép tim, thuốc điều chỉnh nhịp tim có thể tránh được nhu cầu máy tạo nhịp vĩnh viễn. Rối loạn chức năng nút xoang có khả năng dẫn đến cấy ghép máy tạo nhịp vĩnh viễn cao gấp năm lần so với blốc AV trong nhóm này. Cả hai loại rối loạn chức năng có thể được giảm đáng kể với phương pháp nối liền hai tĩnh mạch chủ thay vì nối hai nhĩ.
Rối loạn nhịp nhĩ (chủ yếu là rung nhĩ [AF]) là biến chứng phổ biến nhất sau phẫu thuật tim, với tỷ lệ mắc được báo cáo nhất quán từ 27% đến 40% và có ít thay đổi trong 2 thập kỷ qua. AF thường xảy ra nhất vào 2 đến 3 ngày sau phẫu thuật và có thể kéo dài thời gian nằm viện, tăng nguy cơ đột quỵ, tăng nguy cơ suy giảm thần kinh nhận thức, và tỷ lệ tử vong. Những người đã trải qua phẫu thuật van có nguy cơ cao nhất. Người bệnh có AF từ trước có thể trở về từ phòng mổ trong nhịp xoang và sớm quay lại AF. Nếu một dây dẫn nhĩ ngoại tâm mạc được đặt, một điện tâm đồ nhĩ có thể được thực hiện khi nhịp hoặc dẫn truyền không thể được chẩn đoán bằng cách khác. Sử dụng adenosine là một lựa chọn khác cho chẩn đoán và có thể là liệu pháp khi loạn nhịp nhĩ không phải là AF. Cơ chế chính xác của AF sau phẫu thuật vẫn chưa rõ ràng. Những thay đổi cấu trúc trong nhĩ, giảm ngưỡng cho việc tạo ra loạn nhịp, và trạng thái tăng adrenergic sau CPB và phẫu thuật đều được đề xuất là cơ chế. Các yếu tố nguy cơ liên quan đến sự phát triển của AF bao gồm tuổi cao, tiền sử rung nhĩ hoặc bệnh phổi tắc nghẽn mạn tính, kéo dài thời gian CPB và kẹp động mạch chủ, phì đại nhĩ trái, tim to, phẫu thuật van, và ngừng sử dụng beta blocker hoặc thuốc ức chế men chuyển angiotensin (ACE) sau phẫu thuật.
Dự phòng dược lý chống lại AF còn gây tranh cãi. Liệu pháp dự phòng bao gồm bổ sung magiê, kali, và sử dụng chẹn beta trong giai đoạn quanh phẫu thuật để giảm tỷ lệ AF. Các khuyến nghị đồng thuận của lực lượng nhiệm vụ Hội Tim mạch học Hoa Kỳ và Hiệp hội Tim Hoa Kỳ cho việc phòng ngừa và quản lý AF được tóm tắt trong Hộp 31.2. Trong thử nghiệm lớn nhất về amiodarone ở người bệnh trải qua phẫu thuật CABG hoặc thay thế hoặc sửa chữa van được báo cáo cho đến nay, amiodarone dự phòng đã được chứng minh là làm giảm hiệu quả tỷ lệ AF sau phẫu thuật. Quản lý nhịp nhanh trên thất (SVT) sau phẫu thuật phụ thuộc vào tình trạng lâm sàng của người bệnh. Nếu thích hợp, một ECG 12 chuyển đạo và một dải nhịp nhĩ thông qua các điện cực tạo nhịp nhĩ giúp chẩn đoán nhịp chính xác. Liệu pháp sau phẫu thuật của AF bao gồm điều chỉnh bất thường điện giải, sử dụng thực nghiệm magiê và kali, và amiodarone hoặc chẹn beta. Nếu khôi phục nhịp xoang bằng dược lý thất bại hoặc nếu bất ổn huyết động đảm bảo tim mạch điện đồng bộ trực tiếp (DC) ngay lập tức, tim mạch điện được thử nghiệm với năng lượng ban đầu là 200 J cho AF và 50 đến 100 J cho cuồng nhĩ. Khôi phục nhịp xoang chứ không chỉ đơn giản kiểm soát tần số là mục tiêu cuối cùng. Sau khi AF kéo dài hơn 48 giờ (AF dai dẳng hoặc kịch phát), hoặc AF không rõ thời gian, hợp lý để bắt đầu chống đông máu mặc dù phẫu thuật tim gần đây.
Hộp 31.2 Khuyến nghị phòng ngừa và quản lý rung nhĩ sau phẫu thuật.
Nhóm I
Nhóm IIa
|
Được in lại với sự cho phép từ Fuster V, Ryden LE, Cannom DS, et al: ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation. Được phát triển với sự hợp tác của Hiệp hội Nhịp tim Châu Âu và Hiệp hội Nhịp tim. Được in lại với sự cho phép Circulation 2006;114. © 2006 American Heart Association, Inc.
Phức bộ thất sớm hoặc loạn nhịp thất cũng phổ biến sau phẫu thuật và thường liên quan đến mất cân bằng điện giải hoặc có thể được đưa vào trong quá trình đặt ống thông động mạch phổi. Các nguyên nhân khác bao gồm mất ổn định huyết động, thiếu oxy, giảm thể tích máu, thiếu máu cục bộ, nhồi máu cơ tim, đóng cấp tính mảnh ghép, tác dụng gây loạn nhịp của thuốc tăng co bóp, và tác dụng của thuốc chống loạn nhịp. Loạn nhịp thất dai dẳng sau phẫu thuật tim không phổ biến, với tỷ lệ mắc khoảng 1%. Điều trị ban đầu của loạn nhịp thất có ý nghĩa huyết động là khử rung tim ngay lập tức và sử dụng amiodarone hoặc lidocaine. Tiên lượng của phức bộ thất sớm thường xuyên sau phẫu thuật và nhịp nhanh thất không dai dẳng ở người bệnh có chức năng tâm thất bình thường không khác so với nhóm đối chứng. Tuy nhiên, người bệnh có loạn nhịp thất không dai dẳng và phân số tống máu thất trái dưới 40% cho thấy tỷ lệ tử vong 75% sau 15 tháng theo dõi. Người bệnh có loạn nhịp thất dai dẳng có tiên lượng ngắn hạn và dài hạn kém, với tỷ lệ tử vong tại bệnh viện là 50%. Thêm 20% người sống sót bị tử vong do tim trong vòng 24 tháng. Những kết quả kém này xứng đáng với liệu pháp tích cực, đặc biệt là ở người bệnh có nguy cơ cao hơn với rối loạn chức năng LV. Tất cả các bất thường điện giải nên được điều chỉnh nhanh chóng. Rung thất và nhịp nhanh thất không mạch đòi hỏi khử rung tim hoặc tim mạch điện ngay lập tức theo hướng dẫn hỗ trợ sự sống tim mạch nâng cao (ACLS). Tim mạch điện đồng bộ với 200 đến 360 J được sử dụng cho nhịp nhanh thất có triệu chứng dai dẳng với mạch. Nhịp nhanh thất đơn hình dai dẳng ổn định có thể được điều trị ban đầu bằng thuốc chống loạn nhịp tiêm tĩnh mạch. Procainamide có thể được truyền với tốc độ 30 đến 50 mg/phút lên đến liều tối đa 17 mg/kg hoặc một sự mở rộng phức bộ QRS 50%. Liều nạp được theo sau bởi một truyền liên tục tiêm tĩnh mạch 1 đến 4 mg/phút. Giảm liều thích hợp cho người bệnh người cao tuổi và người bệnh có suy tim sung huyết hoặc rối loạn chức năng gan. Lidocaine hoặc amiodarone là những lựa chọn thay thế tốt, đặc biệt là ở người bệnh có rối loạn chức năng LV.
Đối với người bệnh có dây tạo nhịp thất ngoại tâm mạc, chuyển đổi nhịp nhanh thất ổn định bằng cách sử dụng tạo nhịp thất vượt tốc có thể được thử bằng cách tạo nhịp thất với tần số lớn hơn tần số tự nhiên. Đôi khi tăng tốc nhịp nhanh thất có thể kết thúc bằng rung thất và điều quan trọng là phải có sẵn máy khử rung tim ngay lập tức.
Quản lý dài hạn người bệnh có loạn nhịp phụ thuộc vào mức độ nghiêm trọng của tình trạng. Với loạn nhịp thất dai dẳng, kiểm tra điện sinh lý được thực hiện để đánh giá liệu thuốc chống loạn nhịp hoặc cấy ghép máy khử rung tim cấy ghép được (ICD) có thể có lợi cho người bệnh. Một nghiên cứu gần đây đã chứng minh rằng ICD vượt trội hơn liệu pháp thuốc đối với người bệnh có loạn nhịp thất có ý nghĩa huyết động.
ÉP TIM
Các đặc điểm lâm sàng của ép tim (không giống như ép tim “nguyên phát” kinh điển hơn) sau phẫu thuật tim không cụ thể và điều này có thể làm chậm chẩn đoán. Trong thực tế, ngưỡng cho việc điều tra phải thấp, và siêu âm tim (cả qua thực quản và qua thành ngực) đã vô giá trong việc phát hiện và định vị các ổ dịch màng ngoài tim. Các phát hiện lâm sàng và huyết động bao gồm hạ huyết áp, CO thấp, lượng nước tiểu thấp và CVP tăng cao. Điều này có thể đi kèm với sự giảm đột ngột lượng dịch từ dẫn lưu ngực. Chảy máu ẩn trong trung thất và túi màng ngoài tim sau chảy máu quá mức sau phẫu thuật là nguyên nhân có khả năng nhất cho ép tim sau phẫu thuật tim. Mở lại ngực ngay lập tức và lấy cục máu đông thường cung cấp sự cải thiện huyết động đáng kể. Ép tim thường xảy ra trong 12 giờ đầu tiên sau phẫu thuật tim, mặc dù ép tim khởi phát muộn có thể xuất hiện một tuần hoặc hơn sau đó, đặc biệt là khi người bệnh được chống đông.
NHỒI MÁU CƠ TIM SAU PHẪU THUẬT
Nguy cơ nhồi máu cơ tim (NMCT) sau phẫu thuật tồn tại từ ngay sau phẫu thuật cho đến khi xuất viện và sau đó. Thiếu máu cục bộ cơ tim sau phẫu thuật do tái tưới máu không hoàn toàn hoặc tắc nghẽn cấp tính của các động mạch vành bản địa hoặc các mảnh ghép bắc cầu có thể dẫn đến tình trạng CO thấp. Tình trạng này được chẩn đoán bằng các bất thường vận động thành tim mới trên TEE hoặc thay đổi ECG khu vực. Tuy nhiên, mức enzyme đỉnh của creatine kinase MB (CK-MB) sau phẫu thuật, đặc biệt khi gấp 20 lần giới hạn trên của bình thường (hoặc hơn), là một yếu tố dự báo mạnh hơn về kết quả bất lợi so với nhồi máu cơ tim sóng Q sau phẫu thuật và cũng dự báo tăng tỷ lệ tử vong trong quần thể này. Mức troponin I thường vượt quá những gì thấy trong nhồi máu cơ tim trong bối cảnh phẫu thuật không phải tim. Kết hợp giữa ECG nối tiếp và hồ sơ enzyme thường giúp chẩn đoán, nhưng không tồn tại tiêu chí chẩn đoán cụ thể. Các thuốc tăng co bóp có xu hướng kém hiệu quả hơn và gây loạn nhịp trong các vùng thiếu máu cục bộ. Nitroglycerin, milrinone hoặc IABP có thể cải thiện đủ tưới máu cơ tim, nhưng thăm dò lại (có hoặc không có chụp mạch chẩn đoán) vẫn là phương pháp dứt điểm cho mảnh ghép bắc cầu bị tắc nghẽn.
TỔN THƯƠNG THẬN CẤP
Suy giảm chức năng thận cấp tính và suy thận vẫn là vấn đề y tế đáng kể, xảy ra ở 7,2% tất cả người bệnh nằm viện và 30% những người nhập ICU. Tỷ lệ suy thận cấp (ARF) cần chạy thận sau phẫu thuật tim khoảng 1% đến 4%. Sự xấu đi đáng kể của chức năng thận sau phẫu thuật được quan sát thấy ở khoảng 7% người bệnh, và khoảng 15% trong số những người bệnh này cần chạy thận.
Tầm quan trọng của rối loạn chức năng thận sau phẫu thuật nằm ở mối liên hệ nhất quán của nó với tỷ lệ tử vong trong bệnh viện cao hơn, chi phí quanh phẫu thuật và thời gian nằm ICU lâu hơn, ngay cả sau khi điều chỉnh các yếu tố đóng góp khác. Người bệnh có rối loạn chức năng thận cũng có nhiều khả năng được xuất viện đến một cơ sở chăm sóc kéo dài, với chi phí tài chính và cảm xúc liên quan.
Nhiều vấn đề liên quan đến bảo vệ thận sau phẫu thuật tương tự như những vấn đề được thảo luận cho giai đoạn trong phẫu thuật (ví dụ: đảm bảo tưới máu thận đầy đủ và tránh các chất độc thận). Một số thuốc bao gồm dopamine, fenoldopam (một chất chủ vận thụ thể dopamine-1 chọn lọc), thuốc lợi tiểu (furosemide, mannitol) và nesiritide (một peptide lợi niệu) đã được đề xuất là có tác dụng bảo vệ thận. Tuy nhiên, dữ liệu hiện tại không ủng hộ việc sử dụng chúng để dự phòng chống tổn thương thận trong phẫu thuật tim.
Thật không may, một khi rối loạn chức năng thận đã xảy ra, không có liệu pháp cụ thể nào để cải thiện nó; điều trị chỉ là hỗ trợ bằng cách đảm bảo tưới máu thận đầy đủ và tránh các chất độc thận. Trong trường hợp không có chiến lược điều trị hiệu quả để đảo ngược tổn thương thận, trọng tâm chính là phòng ngừa (xem Chương 17). Xác định các yếu tố nguy cơ đóng vai trò quan trọng trong việc bảo vệ thận trong quá trình phẫu thuật tim. Một trong những yếu tố dự báo sau phẫu thuật mạnh nhất về rối loạn chức năng thận là chức năng tim suy giảm sau CPB. Bằng chứng sau phẫu thuật về rối loạn chức năng cơ tim, bao gồm tình trạng CO thấp và nhu cầu hỗ trợ tăng co bóp, có liên quan đến nguy cơ tổn thương thận tăng gấp hai đến bốn lần. Thông khí áp lực dương kéo dài, nhiễm cytomegalovirus từ trước và nhiễm trùng huyết sau phẫu thuật gây thêm nguy cơ rối loạn chức năng thận và suy thận cấp.
Theo dõi chức năng thận vẫn là một thách thức và không có xét nghiệm đơn lẻ nào đánh giá tất cả hoạt động của thận. Mặc dù có mối quan hệ phi tuyến tính với tốc độ lọc cầu thận (GFR), xét nghiệm creatinine huyết thanh thường được sử dụng nhất để đánh giá chức năng thận quanh phẫu thuật. Creatinine huyết tương phản ánh trạng thái cân bằng giữa sản xuất và bài tiết creatinine và bị ảnh hưởng bởi giới tính, cân nặng và đặc biệt là tuổi tác. Độ thanh thải creatinine và bài tiết natri phân đoạn có lẽ phản ánh tốt hơn chức năng thận thực sự.
Trong khi việc tìm kiếm các thuốc bảo vệ thận đã được chứng minh lâm sàng vẫn tiếp tục, quản lý quanh phẫu thuật hiện tại của người bệnh phẫu thuật tim nên bao gồm các biện pháp để đảm bảo căng thẳng thận tối thiểu, chẳng hạn như duy trì tưới máu và thể tích trong lòng mạch đầy đủ và ngăn ngừa thiếu oxy máu. Mặc dù không có bằng chứng vững chắc ủng hộ việc sử dụng bất kỳ loại thuốc nào để bảo vệ thận, một số phác đồ “bảo vệ thận” đã được đề xuất. Những điều này bao gồm dopamine, fenoldopam (một chất chủ vận thụ thể dopamine-1 chọn lọc), thuốc lợi tiểu (furosemide, mannitol) và nesiritide (một peptide lợi niệu).
Cơ chế đề xuất của bảo vệ thận bằng dopamine là thông qua việc kích hoạt thụ thể dopaminergic ngoại biên (DA1) với “liều thận” từ 0,5 đến 3,0 μg/kg/phút, dẫn đến các tính chất lợi natri, lợi tiểu và giãn mạch thận qua trung gian DA1. Mặc dù dopamine đã được chứng minh trên các mô hình động vật là cung cấp những cải thiện đáng kể trong chức năng thận sau tổn thương thận, các nghiên cứu lâm sàng trên người không chứng minh được lợi ích tương tự. Dopamine làm tăng lưu lượng máu thận toàn cục mà không tăng lưu lượng máu tủy và do đó không ngăn ngừa thiếu oxy tủy. Các biến chứng đáng kể như nhịp tim nhanh, rung nhĩ, thiếu máu cục bộ cơ tim và thiếu máu cục bộ ruột có liên quan đến dopamine tiêm tĩnh mạch, ngay cả ở liều thấp. Hướng dẫn KIDGO 2012 khuyến nghị không sử dụng dopamine để ngăn ngừa hoại tử ống thận do thiếu máu cục bộ.
Tiện ích tiềm năng của các chất chủ vận thụ thể DA1 chọn lọc, như fenoldopam và dopexamine (không có sẵn ở Hoa Kỳ), như các thuốc bảo vệ thận vẫn chưa được xác định. Thử nghiệm đối chứng ngẫu nhiên lớn nhất được thực hiện trên fenoldopam ở người bệnh sau phẫu thuật tim bị AKI không tìm thấy sự khác biệt về nhu cầu RRT hoặc tỷ lệ tử vong so với giả dược. Hơn nữa, việc sử dụng fenoldopam có liên quan đến tỷ lệ hạ huyết áp cao hơn. Phân tích tổng hợp cho thấy trong số người bệnh được điều trị bằng fenoldopam, có sự giảm AKI và tăng tỷ lệ mắc hạ huyết áp, và không có tác động đáng kể đến RRT hoặc tỷ lệ tử vong. Do hầu hết các nghiên cứu đều nhỏ và định nghĩa về AKI khác nhau giữa các nghiên cứu, không có đủ bằng chứng để ủng hộ việc sử dụng fenoldopam một cách hệ thống trong phẫu thuật tim. Tương tự, bằng chứng hiện có không nhất quán và không đủ để khuyến nghị dopexamine để bảo vệ thận cho cả người bệnh phẫu thuật có nguy cơ cao hoặc người bệnh nặng.
Lý do cơ bản cho việc bảo vệ thận từ thuốc lợi tiểu liên quan đến sự lợi tiểu và lợi niệu được tạo ra và khả năng giảm tắc nghẽn ống thận do các mảnh tế bào sau tổn thương thận. Điều này có thể duy trì độ thông thoáng của ống thận và tránh thiểu niệu hoặc vô niệu và nhu cầu chạy thận. Các thuốc lợi tiểu thẩm thấu, như mannitol, cũng làm giảm phù nề ống thận để đạt được mục tiêu này, nhưng một tính chất bảo vệ thứ hai được đề xuất độc đáo cho các thuốc lợi tiểu quai, như furosemide, là giảm tiêu thụ oxy ống thận tủy và tác dụng chống oxy hóa được đề xuất. Các mô hình động vật về suy thận do myoglobin và thiếu máu cục bộ chứng minh tác dụng bảo vệ từ mannitol. Tuy nhiên, ngoại trừ tính hữu ích trong bối cảnh ARF do myoglobin sớm và ghép thận, các tác dụng bảo vệ thận lâm sàng của mannitol vẫn chưa được xác nhận. Tương tự, không có bằng chứng lâm sàng thuyết phục nào ủng hộ việc sử dụng furosemide để bảo vệ thận. Quan trọng là lượng nước tiểu tăng lên từ thuốc lợi tiểu không đảm bảo cải thiện chức năng thận. Ngược lại, cả furosemide và mannitol đều bị quy trách nhiệm làm trầm trọng thêm tổn thương thận trong một số bối cảnh. Một tính chất có hại phổ biến với việc sử dụng tất cả các thuốc lợi tiểu là chúng có thể gây mất nước nếu tình trạng thể tích trong lòng mạch không được theo dõi cẩn thận. Mặc dù có một số bằng chứng cho thấy suy thận thiểu niệu có thể được chuyển đổi thành suy thận không thiểu niệu bằng cách sử dụng thuốc lợi tiểu, không có bằng chứng nào cho thấy tỷ lệ tử vong giảm xuống được thấy với suy thận không thiểu niệu áp dụng cho người bệnh nhận thuốc lợi tiểu sau phẫu thuật tim.
Nesiritide, một peptide lợi niệu, đã được chứng minh là có lợi trong điều trị suy tim mất bù và có thể có tiềm năng trong điều trị người bệnh sau phẫu thuật với suy tim sung huyết và rối loạn chức năng thận đồng thời. Các peptide lợi niệu chặn tái hấp thu natri ở ống thận, giãn tiểu động mạch đến và ức chế hệ thống renin-angiotensin. Tuy nhiên, tại thời điểm này, lợi ích của nó vẫn chưa rõ ràng và chi phí và nguy cơ liên quan đến việc sử dụng nó (hạ huyết áp nặng) có thể lớn hơn bất kỳ lợi ích nào thu được.
Liệu pháp insulin tích cực đã được chứng minh là làm giảm suy thận cấp cần liệu pháp thay thế thận (RRT) trong một thử nghiệm sớm. Tuy nhiên, thử nghiệm NICE-SUGAR (Normoglycemia in Intensive Care Evaluation Survival Using Glucose Algorithm Regulation) sau đó đã so sánh người bệnh nhận liệu pháp insulin tích cực (mục tiêu glucose máu từ 81-108 mg/dL) với kiểm soát glucose thông thường (mục tiêu glucose máu <180 mg/dL). Không có sự khác biệt về tỷ lệ phần trăm người bệnh cần RRT hoặc thời gian RRT.
Chỉ định tuyệt đối để bắt đầu liệu pháp thay thế thận bao gồm quá tải dịch, tăng kali máu kháng trị hoặc toan máu, và các triệu chứng urê máu nặng.
BIẾN CHỨNG THẦN KINH
Tổn thương thần kinh sau phẫu thuật tim dao động từ đột quỵ làm mất khả năng hoặc kết thúc tính mạng và hôn mê đến bệnh não, mê sảng và suy giảm thần kinh nhận thức, đã được mô tả bởi nhiều nhà nghiên cứu. Mặc dù đột quỵ sau phẫu thuật tim là một mối quan tâm quan trọng cho cả khuyết tật ngắn và dài hạn, các thiếu sót thần kinh tinh tế hơn như bệnh não và rối loạn chức năng thần kinh nhận thức cũng có liên quan đến sự gia tăng chi phí y tế và giảm chức năng nhận thức và chất lượng cuộc sống ngắn và dài hạn. Các chiến lược thành công để bảo vệ não quanh phẫu thuật bắt đầu với đánh giá nguy cơ người bệnh cá nhân chính xác. Mặc dù các nghiên cứu khác nhau đôi chút về tất cả các yếu tố nguy cơ, một số đặc điểm người bệnh nhất quán chứng minh tăng nguy cơ tổn thương thần kinh liên quan đến phẫu thuật tim. Các yếu tố đại diện cho các biến dự đoán chính trong một mô hình mới được xác nhận bao gồm tuổi cao, tiền sử bệnh thần kinh có triệu chứng, phẫu thuật CABG trước đó, bệnh mạch máu, đau thắt ngực không ổn định, tiểu đường và bệnh phổi.
Thích hợp, hầu hết các chiến lược hiện tại nhằm giảm nguy cơ liên quan đến các biện pháp trong quá trình phẫu thuật và dự phòng. Tuy nhiên, điều chỉnh kỹ thuật gây mê để cho phép tỉnh dậy sau phẫu thuật sớm hơn có thể đóng vai trò quan trọng trong việc đánh giá và điều trị người bệnh có rối loạn chức năng thần kinh sau phẫu thuật. Người bệnh vẫn hôn mê sau phẫu thuật cần được chú ý sớm và bắt đầu các bước chẩn đoán. Bất thường chuyển hóa, tác dụng phụ hoặc quá liều thuốc, và tổn thương hệ thần kinh trung ương nguyên phát cần được loại trừ. Quản lý bao gồm ngừng tất cả các thuốc an thần, opioid và thuốc giãn cơ, và đánh giá chức năng thần kinh cơ ngoại vi. Quét cắt lớp vi tính sớm (CT) hoặc chụp cộng hưởng từ (MRI) để loại trừ tổn thương cấu trúc hoặc xuất huyết não là cần thiết nếu người bệnh đủ ổn định cho xét nghiệm. Đánh giá điện sinh lý bao gồm điện não đồ (EEG) và theo dõi điện thế kích thích. Đánh giá sớm cũng có thể cho phép can thiệp ngay lập tức.
Mê sảng sau phẫu thuật xảy ra ở 32% đến 73% tất cả người bệnh trải qua phẫu thuật tim, và tỷ lệ mắc khác nhau tùy thuộc vào các yếu tố nguy cơ của người bệnh, loại phẫu thuật và phương pháp đánh giá. Mê sảng đã được liên kết với tăng tỷ lệ tử vong 5 năm sau phẫu thuật. Quản lý ban đầu bao gồm trấn an và định hướng lại người bệnh, và kiểm soát đau đầy đủ. Một số loại thuốc đã được liên kết với tăng nguy cơ mê sảng và nên tránh. Những loại thuốc này bao gồm benzodiazepine, một số opioid (meperidine), thuốc kháng cholinergic (scopolamine), ketamine và metoclopramide, v.v. Dexmedetomidine đã được chứng minh là làm giảm tỷ lệ mê sảng ở người bệnh cao tuổi sau phẫu thuật không phải tim. Đối với người bệnh vẫn kích động và lú lẫn, haloperidol có thể hữu ích. Tuy nhiên, không khuyến nghị haloperidol dự phòng để ngăn ngừa mê sảng. Khi kích động vẫn tồn tại mặc dù đã dùng nhiều liều haloperidol (tổng liều lên đến 5-10 mg), có thể xem xét truyền dexmedetomidine để điều trị mê sảng dai dẳng.
SỐT SAU PHẪU THUẬT VÀ NHIỄM TRÙNG
Tỷ lệ nhiễm trùng ở người bệnh trải qua phẫu thuật tim có xu hướng cao hơn so với người bệnh trải qua phẫu thuật tổng quát. Một số yếu tố có liên quan, bao gồm thời gian phẫu thuật kéo dài, sự hiện diện của ống thông đặt trong lòng mạch, tác động có hại của CPB trên hệ thống miễn dịch, tưới máu mô kém, tăng đường huyết và cấy ghép vật liệu ngoại lai. Quy mô của vấn đề là đáng kể, với một loạt báo cáo 71% cấy vị trí phẫu thuật quanh phẫu thuật ở người bệnh trải qua các thủ thuật tim mở là dương tính.
Tỷ lệ nhiễm trùng hậu phẫu tổng thể đã được báo cáo là giữa 2% và 20%, dẫn đến thời gian nằm viện kéo dài đáng kể và tăng chi phí đáng kể.
Các biến chứng nhiễm trùng nghiêm trọng bao gồm nhiễm trùng huyết và nhiễm trùng vết thương xương ức sâu (DSWI) với viêm trung thất liên quan. DSWI là một trong những biến chứng nhiễm trùng nghiêm trọng nhất của phẫu thuật tim. Nó xảy ra ở khoảng 1% đến 2% các ca phẫu thuật tim, với tỷ lệ tử vong kết quả tiếp cận 10%. Các đặc điểm lâm sàng bao gồm đỏ và đau trên xương ức, dẫn lưu hoặc tiết dịch vết thương (70%-90% các trường hợp), không thể cai thuốc co mạch hoặc máy thở, mất ổn định xương ức, sốt và tăng bạch cầu. Liệu pháp kháng sinh nên được hướng dẫn bởi kết quả nuôi cấy, nhưng cắt lọc và đóng vạt đạt được sự lành thương trong hầu hết các trường hợp. Chỉ định mổ lại phụ thuộc vào độ sâu và mức độ nghiêm trọng của nhiễm trùng. Các yếu tố nguy cơ đối với DSWI bao gồm tiểu đường, béo phì, bệnh động mạch ngoại vi, sử dụng thuốc lá, CO thấp, sử dụng cả hai động mạch vú trong và mổ lại để kiểm soát chảy máu. Một nghiên cứu gần đây cho thấy rằng tăng đường huyết không kiểm soát ở người bệnh tiểu đường sau phẫu thuật tim, chứ không phải bản thân tiểu đường, mới là yếu tố nguy cơ thực sự đối với DSWI. Hơn nữa, nghiên cứu này đã chứng minh rằng kiểm soát chặt chẽ hơn mức glucose máu trong suốt giai đoạn quanh phẫu thuật (mức duy trì dưới 200 mg/dL) làm giảm độc lập nguy cơ DSWI lên đến 66%. Năm 2009, Hiệp hội Phẫu thuật Lồng ngực đã xuất bản hướng dẫn cập nhật khuyến nghị duy trì mức glucose máu dưới 180 mg/dL trong quá trình phẫu thuật và ngay sau phẫu thuật để ngăn ngừa biến chứng, đặc biệt là nhiễm trùng vết thương xương ức sâu.
Các biến chứng nhiễm trùng huyết khó dự đoán hoặc chẩn đoán sớm trong giai đoạn ngay sau phẫu thuật tim. Trạng thái viêm tiền, do CPB kích hoạt, gây ra một số thay đổi có thể bắt chước một bức tranh nhiễm trùng huyết. Sốt và nhiệt độ vượt quá 38,5°C là phổ biến trong 24 giờ đầu tiên sau phẫu thuật tim, xảy ra ở gần 40% người bệnh. Điều này thường đại diện cho một phổ các tổn thương sinh lý như sự kích hoạt của các dòng thác viêm từ CPB, xẹp phổi và làm ấm quá tích cực. Có một số gợi ý rằng điểm số như điểm Đánh giá Sinh lý Cấp tính và Sức khỏe Mạn tính II (APACHE II) hoặc điểm EuroSCORE, hoặc các dấu ấn như procalcitonin có thể giúp dự đoán một nhiễm trùng đáng kể. Cho đến khi giá trị dự đoán của những điều này được xác nhận, hợp lý để điều trị nhiệt độ tăng cao với một thuốc hạ sốt trong 24 giờ đầu tiên sau phẫu thuật. Điều này dường như thậm chí còn quan trọng hơn vì tăng thân nhiệt sau phẫu thuật đã được liên kết với các biến chứng đáng kể như rối loạn chức năng nhận thức. Nếu người bệnh sốt quá 24 giờ, nên lấy mẫu nuôi cấy nước tiểu, máu và đờm cũng như kiểm tra số lượng bạch cầu. Các nguyên nhân nhiễm trùng phổ biến của sốt sau phẫu thuật tim bao gồm nhiễm trùng vết thương xương ức, nhiễm trùng đường tiết niệu, viêm phổi, nhiễm trùng huyết do ống thông, và các khu vực tích tụ máu nhiễm bẩn có vùng giới hạn (ví dụ: màng ngoài tim, màng phổi, sau phúc mạc và khoang vết thương chân). Điều trị kháng sinh sớm được đảm bảo nếu người bệnh có vật liệu nhân tạo (van hoặc mảnh ghép) hoặc nhiễm trùng có sẵn (như viêm nội tâm mạc do vi khuẩn). Nhiễm trùng bệnh viện có liên quan đến thời gian nằm viện kéo dài, sự phát triển của rối loạn chức năng đa cơ quan và tăng tỷ lệ tử vong trong bệnh viện.
Biến chứng đường tiêu hóa
Các biến chứng đường tiêu hóa (GI) xảy ra ở khoảng 2,5% người bệnh trải qua phẫu thuật tim, có liên quan đến tỷ lệ tử vong cao (lên đến 33%), và chiếm gần 15% tất cả các trường hợp tử vong sau phẫu thuật. Biến chứng GI phổ biến nhất sau phẫu thuật tim là chảy máu đường tiêu hóa trên, thường từ loét dạ dày hoặc tá tràng. Liệt ruột, viêm tụy và thiếu máu cục bộ mạc treo cũng có thể xảy ra. Cơ chế được đề xuất là tưới máu tạng kém trong quá trình CPB hoặc thuyên tắc mạch tạng trong quá trình thao tác động mạch chủ. Tỷ lệ tử vong cao ở người bệnh phát triển thiếu máu cục bộ mạc treo. Trong một nghiên cứu lớn gần đây trên 11.058 người bệnh trải qua phẫu thuật tim, sáu yếu tố dự đoán độc lập cho biến chứng GI đã được xác định. Đó là thông khí cơ học kéo dài, suy thận sau phẫu thuật, nhiễm trùng huyết, phẫu thuật van, suy thận mạn tính trước phẫu thuật và nhiễm trùng vết thương xương ức. Các yếu tố khác như thời gian CPB, thời gian thiếu máu cục bộ và sử dụng IABP chỉ có tầm quan trọng rất nhỏ. Theo dõi các biến chứng GI với mức độ cảnh giác cao và chẩn đoán và điều trị ngay lập tức các biến chứng GI là phương tiện quan trọng để giảm bệnh tật và tử vong liên quan. Các biện pháp dự phòng như dự phòng loét do căng thẳng, tối ưu hóa huyết động học sau phẫu thuật, thích ứng với các giao thức rút ống nội khí quản sớm (ví dụ: fast tracking) và vận động sớm đều có thể góp phần ngăn ngừa các biến chứng GI nghiêm trọng. Phòng ngừa nhiễm trùng quanh phẫu thuật và rối loạn chức năng thận, cũng như kiểm soát chặt chẽ và theo dõi chống đông máu quanh phẫu thuật, cũng nên được xem xét.
Fast-Tracking
Trong quá khứ, người bệnh phẫu thuật tim có thể phải thông khí cơ học trong 12 đến 24 giờ. Tuy nhiên, với những tiến bộ trong kỹ thuật làm mê, đánh giá trước phẫu thuật tốt hơn và các chiến lược quản lý đường thở hiệu quả, hiện nay người bệnh phẫu thuật tim có thể được rút ống nội khí quản sớm hơn, thường là trong vòng vài giờ sau khi vào ICU. Thuật ngữ fast-tracking đề cập đến việc rút ống nội khí quản thành công trong vòng 6 giờ sau khi hoàn thành phẫu thuật. Khái niệm này thậm chí đã được mở rộng đến việc rút ống nội khí quản trên bàn mổ ở một số người bệnh chọn lọc. Chọn lọc người bệnh thích hợp, đánh giá trước phẫu thuật cẩn thận và làm mê thích hợp tạo điều kiện cho sự thành công của fast-tracking.
Các yếu tố cần xem xét và loại trừ khi chọn lọc người bệnh cho fast-tracking bao gồm chức năng tim kém, các chất hỗ trợ tăng co bóp liều cao, tiền sử hen suyễn bất ổn và đường thở cấp ở quy trình phẫu thuật tim có liên quan đến phẫu thuật phức tạp, chảy máu đáng kể, và thông khí kéo dài. Quản lý thuốc mê thích hợp được thúc đẩy bởi sử dụng tốt phương tiện theo dõi, đặc biệt là theo dõi hô hấp, động học và huyết động nâng cao, cũng như theo dõi thần kinh, cùng với các phương pháp theo dõi nhiệt độ cơ thể và nước tiểu. Với sự lựa chọn người bệnh thích hợp, kỹ thuật làm mê thích hợp và theo dõi đầy đủ, fast-tracking góp phần vào việc chuyển viện sớm hơn từ ICU và xuất viện sớm hơn từ bệnh viện. Hầu hết các nghiên cứu đều cho thấy sự cải thiện rõ ràng trong kết quả hoặc ít nhất là không thay đổi độc hại.
Việc kiểm soát thành công hạ thân nhiệt quanh phẫu thuật, quản lý độ mê tối ưu trong quá trình phẫu thuật có thời gian làm mê kéo dài, và kiểm soát đau thích hợp là những biện pháp bổ sung giúp rút ống nội khí quản sớm và tạo điều kiện cho fast-tracking. Có sẵn nhiều phương pháp khác nhau để đạt được các mục tiêu này.
Tóm tắt
Ngày càng có nhiều thảo luận về việc mở rộng các giao thức ERAS (Enhanced Recovery After Surgery – Hồi phục nâng cao sau phẫu thuật) hiện có cho người bệnh phẫu thuật tim với mục tiêu cuối cùng là cải thiện chăm sóc người bệnh thông qua việc tạo ra các lộ trình điều trị, hướng dẫn và sáng kiến. Một mô hình khác để mở rộng việc thực hiện các lộ trình điều trị đã được chú ý gọi là Perioperative Surgical Home (Ngôi nhà phẫu thuật quanh phẫu thuật). Mặc dù những khái niệm này bổ sung cho nhau, chính sự phối hợp tốt hơn và giảm sự khác biệt trong việc cung cấp dịch vụ chăm sóc sẽ cải thiện chất lượng chăm sóc quanh phẫu thuật và dịch vụ, đồng thời cuối cùng làm giảm chi phí.
Độc lập với cách tiếp cận của từng cơ sở, việc quản lý hậu phẫu thuật cho người bệnh phẫu thuật tim phức tạp ngày nay đòi hỏi một đội ngũ ICU được chuẩn bị tốt và cảnh giác với sự chú ý đến chi tiết, cơ sở hạ tầng theo dõi đa phương thức, và việc thực hiện các lộ trình chăm sóc lâm sàng của cơ sở. Những người bệnh này trải qua căng thẳng sinh lý lớn với dự trữ quanh phẫu thuật hạn chế, làm cho việc chăm sóc ICU hiệu quả trở nên thiết yếu cho sự hồi phục của họ. Kiến thức chi tiết về tiền sử trước phẫu thuật và tình trạng cơ bản của người bệnh, đánh giá tức thời và chính xác về tác động sinh lý của các sự kiện quanh phẫu thuật, diễn giải ngay lập tức các xu hướng trong dữ liệu theo dõi xâm lấn, và đưa ra phán đoán lâm sàng hợp lý và bắt đầu điều trị là những yếu tố cần thiết để tối ưu hóa chăm sóc người bệnh. Những tiến bộ trong nghiên cứu và khám phá đang diễn ra, cùng với việc cải thiện phân tầng nguy cơ và cải tiến liên tục các lộ trình chăm sóc lâm sàng, sẽ cho phép các bác sĩ quanh phẫu thuật cung cấp dịch vụ chăm sóc tối ưu với chi phí hợp lý và kết quả được cải thiện.
HẾT CHƯƠNG 31.
Bảng chú giải thuật ngữ Anh-Việt – Chương 31
| STT | Thuật ngữ tiếng Anh | Cách phát âm | Nghĩa Tiếng Việt |
|---|---|---|---|
| 1 | Cardiac Surgery | /ˈkɑːdiæk ˈsɜːdʒəri/ | Phẫu thuật tim |
| 2 | Intensive care unit (ICU) | /ɪnˈtɛnsɪv kɛər ˈjuːnɪt/ | Đơn vị chăm sóc tích cực |
| 3 | Cardiothoracic surgery | /ˈkɑːdiəʊθəˈræsɪk ˈsɜːdʒəri/ | Phẫu thuật tim ngực |
| 4 | Enhanced recovery after cardiac surgery (ERAS) | /ɪnˈhɑːnst rɪˈkʌvəri ˈɑːftər ˈkɑːdiæk ˈsɜːdʒəri/ | Hồi phục nâng cao sau phẫu thuật tim |
| 5 | Cardiopulmonary bypass (CPB) | /ˌkɑːdiəʊˈpʌlmənəri ˈbaɪpɑːs/ | Tuần hoàn ngoài cơ thể |
| 6 | Opioid | /ˈəʊpiɔɪd/ | Thuốc giảm đau họ opioid |
| 7 | Multimodal analgesia | /ˌmʌltiˈməʊdl ænəlˈdʒiːziə/ | Giảm đau đa phương thức |
| 8 | Electrocardiography (ECG) | /ɪˌlɛktrəʊkɑːdiˈɒɡrəfi/ | Điện tâm đồ |
| 9 | Blood pressure (BP) | /blʌd ˈprɛʃər/ | Huyết áp |
| 10 | Pulse oximetry | /pʌls ɒkˈsɪmɪtri/ | Đo oxy mạch |
| 11 | Propofol | /ˈprəʊpəfɒl/ | Propofol (thuốc mê tĩnh mạch) |
| 12 | Dexmedetomidine | /dɛksˌmɛdɪˈtɒmɪdiːn/ | Dexmedetomidine (thuốc an thần) |
| 13 | Endotracheal tube | /ˌɛndəʊˈtreɪkiəl tjuːb/ | Ống nội khí quản |
| 14 | Chest tube | /tʃɛst tjuːb/ | Ống dẫn lưu ngực |
| 15 | Central venous pressure (CVP) | /ˈsɛntrəl ˈviːnəs ˈprɛʃər/ | Áp lực tĩnh mạch trung tâm |
| 16 | Pulmonary artery catheter (PAC) | /ˈpʌlmənəri ˈɑːtəri ˈkæθɪtər/ | Ống thông động mạch phổi |
| 17 | Transesophageal echocardiography (TEE) | /trænzɪˈsɒfəɡiːəl ˌɛkəʊkɑːdiˈɒɡrəfi/ | Siêu âm tim qua thực quản |
| 18 | Arterial blood gases (ABG) | /ɑːˈtɪəriəl blʌd ˈɡæsɪz/ | Khí máu động mạch |
| 19 | Complete blood count (CBC) | /kəmˈpliːt blʌd kaʊnt/ | Công thức máu toàn bộ |
| 20 | Thromboelastography (TEG) | /ˌθrɒmbəʊɪlæsˈtɒɡrəfi/ | Đo đàn hồi huyết khối |
| 21 | Rotational thromboelastometry (ROTEM) | /rəʊˈteɪʃənl ˌθrɒmbəʊɪlæsˈtɒmɪtri/ | Đo đàn hồi huyết khối quay |
| 22 | Vital capacity | /ˈvaɪtl kəˈpæsɪti/ | Dung tích sống |
| 23 | Functional residual capacity | /ˈfʌŋkʃənl rɪˈzɪdjʊəl kəˈpæsɪti/ | Dung tích cặn chức năng |
| 24 | Atelectasis | /ˌætɪˈlɛktəsɪs/ | Xẹp phổi |
| 25 | Tidal volume | /ˈtaɪdl ˈvɒljuːm/ | Thể tích khí lưu thông |
| 26 | Positive end-expiratory pressure (PEEP) | /ˈpɒzɪtɪv ɛnd-ɪkˈspaɪərətəri ˈprɛʃər/ | Áp lực dương cuối thì thở ra |
| 27 | Fraction of inspired oxygen (FiO2) | /ˈfrækʃən ɒv ɪnˈspaɪəd ˈɒksɪdʒən/ | Phần trăm oxy hít vào |
| 28 | Pressure support ventilation (PSV) | /ˈprɛʃər səˈpɔːt ˌvɛntɪˈleɪʃən/ | Thông khí hỗ trợ áp lực |
| 29 | Spontaneous breathing trial (SBT) | /spɒnˈteɪniəs ˈbriːðɪŋ ˈtraɪəl/ | Thử nghiệm thở tự nhiên |
| 30 | Forced vital capacity (FVC) | /fɔːst ˈvaɪtl kəˈpæsɪti/ | Dung tích sống thở mạnh |
| 31 | Negative inspiratory force (NIF) | /ˈnɛɡətɪv ɪnˈspaɪərətəri fɔːs/ | Lực hít vào âm |
| 32 | Rapid shallow breathing index (f/VT) | /ˈræpɪd ˈʃæləʊ ˈbriːðɪŋ ˈɪndɛks/ | Chỉ số thở nhanh nông |
| 33 | Synchronized intermittent mandatory ventilation (SIMV) | /ˈsɪŋkrənaɪzd ˌɪntəˈmɪtənt ˈmændətəri ˌvɛntɪˈleɪʃən/ | Thông khí bắt buộc ngắt quãng đồng bộ |
| 34 | T-piece | /tiː piːs/ | Thiết bị T-piece (dùng để cai thở máy) |
| 35 | Tracheostomy | /ˌtreɪkiˈɒstəmi/ | Mở khí quản |
| 36 | Perfusion pressure | /pəˈfjuːʒən ˈprɛʃər/ | Áp lực tưới máu |
| 37 | Cardiac output (CO) | /ˈkɑːdiæk ˈaʊtpʊt/ | Cung lượng tim |
| 38 | Mixed venous oxygen saturation (SvO2) | /mɪkst ˈviːnəs ˈɒksɪdʒən ˌsætʃəˈreɪʃən/ | Bão hòa oxy máu tĩnh mạch hỗn hợp |
| 39 | Near-infrared spectroscopy | /nɪər ˈɪnfrəˌrɛd spɛkˈtrɒskəpi/ | Quang phổ cận hồng ngoại |
| 40 | Mean arterial pressure (MAP) | /miːn ɑːˈtɪəriəl ˈprɛʃər/ | Áp lực động mạch trung bình |
| 41 | Diastolic blood pressure | /ˌdaɪəˈstɒlɪk blʌd ˈprɛʃər/ | Huyết áp tâm trương |
| 42 | Hypovolemia | /ˌhaɪpəvəˈliːmiə/ | Giảm thể tích máu |
| 43 | Point of care ultrasound (POCUS) | /pɔɪnt ɒv kɛər ˈʌltrəsaʊnd/ | Siêu âm tại điểm chăm sóc |
| 44 | Pulse pressure variation (PPV) | /pʌls ˈprɛʃər ˌveəriˈeɪʃən/ | Biến thiên áp lực mạch |
| 45 | Stroke volume variation (SVV) | /strəʊk ˈvɒljuːm ˌveəriˈeɪʃən/ | Biến thiên thể tích tâm thu |
| 46 | Inferior vena cava (IVC) | /ɪnˈfɪəriər ˈviːnə ˈkeɪvə/ | Tĩnh mạch chủ dưới |
| 47 | Crystalloid | /ˈkrɪstəlɔɪd/ | Dung dịch tinh thể |
| 48 | Vasodilation | /ˌveɪzəʊdaɪˈleɪʃən/ | Giãn mạch |
| 49 | Systemic vascular resistance (SVR) | /sɪˈstɛmɪk ˈvæskjʊlər rɪˈzɪstəns/ | Kháng lực mạch máu hệ thống |
| 50 | Norepinephrine | /ˌnɔːrɛpɪˈnɛfriːn/ | Norepinephrine (thuốc co mạch) |
| 51 | Vasopressin | /ˌveɪzəʊˈprɛsɪn/ | Vasopressin (thuốc co mạch) |
| 52 | Phenylephrine | /ˌfɛnɪlˈɛfriːn/ | Phenylephrine (thuốc co mạch) |
| 53 | Epinephrine | /ˌɛpɪˈnɛfriːn/ | Epinephrine (adrenaline) |
| 54 | Dopamine | /ˈdəʊpəmiːn/ | Dopamine (thuốc tăng co bóp và co mạch) |
| 55 | Internal mammary artery (IMA) | /ɪnˈtɜːnl ˈmæməri ˈɑːtəri/ | Động mạch vú trong |
| 56 | Auto-PEEP | /ˈɔːtəʊ piːp/ | Áp lực dương cuối thì thở ra nội tại |
| 57 | Pneumothorax | /ˌnjuːməʊˈθɔːræks/ | Tràn khí màng phổi |
| 58 | Nitroprusside | /ˌnaɪtrəʊˈprʌsaɪd/ | Nitroprusside (thuốc giãn mạch) |
| 59 | Nitroglycerin | /ˌnaɪtrəʊˈɡlɪsərɪn/ | Nitroglycerin (thuốc giãn mạch) |
| 60 | Nicardipine | /naɪˈkɑːdɪpiːn/ | Nicardipine (thuốc chẹn kênh canxi) |
| 61 | Cardiac index (CI) | /ˈkɑːdiæk ˈɪndɛks/ | Chỉ số tim |
| 62 | Stroke volume (SV) | /strəʊk ˈvɒljuːm/ | Thể tích tâm thu |
| 63 | Atrioventricular (AV) | /ˌeɪtriəʊvɛnˈtrɪkjʊlər/ | Nhĩ thất |
| 64 | Milrinone | /ˈmɪlrɪnəʊn/ | Milrinone (thuốc tăng co bóp) |
| 65 | Dobutamine | /dəʊˈbjuːtəmiːn/ | Dobutamine (thuốc tăng co bóp) |
| 66 | Lusitropy | /luːˈsɪtrəpi/ | Tác dụng tăng giãn cơ |
| 67 | Mechanical circulatory support (MCS) | /mɪˈkænɪkl ˈsɜːkjʊlətəri səˈpɔːt/ | Hỗ trợ tuần hoàn cơ học |
| 68 | Intra-aortic balloon pump (IABP) | /ˌɪntrə-eɪˈɔːrtɪk bəˈluːn pʌmp/ | Bơm bóng đối xung động mạch chủ |
| 69 | Impella | /ɪmˈpɛlə/ | Impella (thiết bị hỗ trợ tim) |
| 70 | TandemHeart | /ˈtændəm hɑːt/ | TandemHeart (thiết bị hỗ trợ tim) |
| 71 | Venoarterial extracorporeal life support (VA ECLS) | /ˌviːnəʊɑːˈtɪəriəl ˌɛkstrəkɔːˈpɔːriəl laɪf səˈpɔːt/ | Hỗ trợ sự sống ngoài cơ thể tĩnh mạch-động mạch |
| 72 | Left ventricular assist device (LVAD) | /lɛft vɛnˈtrɪkjʊlər əˈsɪst dɪˈvaɪs/ | Thiết bị hỗ trợ tâm thất trái |
| 73 | Bridge to transplant (BTT) | /brɪdʒ tuː ˈtrænzplɑːnt/ | Cầu nối đến ghép tim |
| 74 | Destination therapy (DT) | /ˌdɛstɪˈneɪʃən ˈθɛrəpi/ | Liệu pháp đích |
| 75 | Prothrombin time (PT) | /prəʊˈθrɒmbɪn taɪm/ | Thời gian prothrombin |
| 76 | Partial thromboplastin time (PTT) | /ˈpɑːʃəl θrɒmbəˈplæstɪn taɪm/ | Thời gian thromboplastin một phần |
| 77 | Fresh frozen plasma (FFP) | /frɛʃ ˈfrəʊzən ˈplæzmə/ | Huyết tương tươi đông lạnh |
| 78 | Cryoprecipitate | /ˌkraɪəʊprɪˈsɪpɪteɪt/ | Cryoprecipitate (kết tủa lạnh) |
| 79 | Prothrombin complex concentrate (PCC) | /prəʊˈθrɒmbɪn ˈkɒmplɛks ˈkɒnsəntreɪt/ | Phức hợp prothrombin đậm đặc |
| 80 | Recombinant activated factor VII (rFVIIa) | /rɪˈkɒmbɪnənt ˈæktɪveɪtɪd ˈfæktər sɛvn/ | Yếu tố VII hoạt hóa tái tổ hợp |
| 81 | Anti-inhibitor coagulant complex (FEIBA) | /ænti-ɪnˈhɪbɪtər kəʊˈæɡjʊlənt ˈkɒmplɛks/ | Phức hợp chống chất ức chế đông máu |
| 82 | Cardiac tamponade | /ˈkɑːdiæk ˌtæmpəˈneɪd/ | Ép tim |
| 83 | Bradyarrhythmia | /ˌbreɪdiəˈrɪðmiə/ | Loạn nhịp chậm |
| 84 | Junctional tachycardia | /ˈdʒʌŋkʃənl ˌtækiˈkɑːdiə/ | Nhịp nhanh nút |
| 85 | Heart block | /hɑːt blɒk/ | Blốc tim |
| 86 | Atrial fibrillation (AF) | /ˈeɪtriəl fɪbrɪˈleɪʃən/ | Rung nhĩ |
| 87 | Supraventricular tachycardia (SVT) | /ˌsuːprəvɛnˈtrɪkjʊlər ˌtækiˈkɑːdiə/ | Nhịp nhanh trên thất |
| 88 | Direct current (DC) cardioversion | /dəˈrɛkt ˈkʌrənt ˌkɑːdiəʊˈvɜːʃən/ | Tim mạch điện dòng trực tiếp |
| 89 | Atrial flutter | /ˈeɪtriəl ˈflʌtər/ | Cuồng nhĩ |
| 90 | Ventricular arrhythmias | /vɛnˈtrɪkjʊlər əˈrɪðmiəz/ | Loạn nhịp thất |
| 91 | Premature ventricular complexes | /prɪˈmætʃər vɛnˈtrɪkjʊlər ˈkɒmplɛksɪz/ | Phức bộ thất sớm |
| 92 | Ventricular tachycardia | /vɛnˈtrɪkjʊlər ˌtækiˈkɑːdiə/ | Nhịp nhanh thất |
| 93 | Ventricular fibrillation | /vɛnˈtrɪkjʊlər fɪbrɪˈleɪʃən/ | Rung thất |
| 94 | Advanced cardiac life support (ACLS) | /ədˈvɑːnst ˈkɑːdiæk laɪf səˈpɔːt/ | Hỗ trợ sự sống tim mạch nâng cao |
| 95 | Procainamide | /prəˈkeɪnəmaɪd/ | Procainamide (thuốc chống loạn nhịp) |
| 96 | Lidocaine | /ˈlaɪdəkeɪn/ | Lidocaine (thuốc chống loạn nhịp) |
| 97 | Amiodarone | /əˈmaɪədərəʊn/ | Amiodarone (thuốc chống loạn nhịp) |
| 98 | Implantable cardioverter-defibrillator (ICD) | /ɪmˈplɑːntəbl ˌkɑːdiəʊˈvɜːtərˌdɪˈfɪbrɪleɪtər/ | Máy khử rung tim cấy ghép được |
| 99 | Postoperative myocardial infarction (MI) | /ˌpəʊstˈɒpərətɪv ˌmaɪəˈkɑːdiəl ɪnˈfɑːkʃən/ | Nhồi máu cơ tim sau phẫu thuật |
| 100 | Creatine kinase MB (CK-MB) | /ˈkriːətiːn kaɪˈneɪz ɛm biː/ | Creatine kinase MB (men tim) |
| 101 | Troponin I | /ˈtrəʊpənɪn aɪ/ | Troponin I (dấu ấn tim) |
| 102 | Acute kidney injury (AKI) | /əˈkjuːt ˈkɪdni ˈɪndʒəri/ | Tổn thương thận cấp |
| 103 | Acute renal failure (ARF) | /əˈkjuːt ˈriːnl ˈfeɪljər/ | Suy thận cấp |
| 104 | Renal replacement therapy (RRT) | /ˈriːnl rɪˈpleɪsmənt ˈθɛrəpi/ | Liệu pháp thay thế thận |
| 105 | Glomerular filtration rate (GFR) | /ɡləˈmɛrjʊlər fɪlˈtreɪʃən reɪt/ | Tốc độ lọc cầu thận |
| 106 | Fenoldopam | /fɪˈnɒldəpæm/ | Fenoldopam (thuốc chủ vận thụ thể dopamine-1) |
| 107 | Nesiritide | /nɛˈsɪrɪtaɪd/ | Nesiritide (peptide lợi niệu) |
| 108 | Intensive insulin therapy | /ɪnˈtɛnsɪv ˈɪnsjʊlɪn ˈθɛrəpi/ | Liệu pháp insulin tích cực |
| 109 | Delirium | /dɪˈlɪriəm/ | Mê sảng |
| 110 | Encephalopathy | /ɛnˌsɛfəˈlɒpəθi/ | Bệnh não |
| 111 | Neurocognitive dysfunction | /ˌnjʊrəʊˈkɒɡnɪtɪv dɪsˈfʌŋkʃən/ | Rối loạn chức năng thần kinh nhận thức |
| 112 | Computerized tomographic (CT) | /kəmˈpjuːtəraɪzd ˌtəməˈɡræfɪk/ | Cắt lớp vi tính |
| 113 | Magnetic resonance imaging (MRI) | /mæɡˈnɛtɪk ˈrɛzənəns ˈɪmɪdʒɪŋ/ | Chụp cộng hưởng từ |
| 114 | Electroencephalography (EEG) | /ɪˌlɛktrəʊɛnˌsɛfəˈlɒɡrəfi/ | Điện não đồ |
| 115 | Haloperidol | /ˌhæləˈpɛrɪdɒl/ | Haloperidol (thuốc an thần) |
| 116 | Deep sternal wound infections (DSWI) | /diːp ˈstɜːnl wuːnd ɪnˈfɛkʃənz/ | Nhiễm trùng vết thương xương ức sâu |
| 117 | Mediastinitis | /ˌmiːdiəstɪˈnaɪtɪs/ | Viêm trung thất |
| 118 | Procalcitonin | /prəʊˌkælsɪˈtəʊnɪn/ | Procalcitonin (dấu ấn nhiễm trùng) |
| 119 | Gastrointestinal complications | /ˌɡæstrəʊɪnˈtɛstɪnl ˌkɒmplɪˈkeɪʃənz/ | Biến chứng đường tiêu hóa |
| 120 | Mesenteric ischemia | /ˌmɛzənˈtɛrɪk ɪsˈkiːmiə/ | Thiếu máu cục bộ mạc treo |
| 121 | Fast-tracking | /fɑːst ˈtrækɪŋ/ | Rút ngắn thời gian (các bước điều trị) |
| 122 | Coronary artery bypass grafting (CABG) | /ˈkɒrənəri ˈɑːtəri ˈbaɪpɑːs ˈɡrɑːftɪŋ/ | Phẫu thuật bắc cầu động mạch vành |
| 123 | Off-pump coronary artery bypass (OPCAB) | /ɒf pʌmp ˈkɒrənəri ˈɑːtəri ˈbaɪpɑːs/ | Phẫu thuật bắc cầu động mạch vành không dùng tuần hoàn ngoài cơ thể |
| 124 | Minimally invasive valvular surgery | /ˈmɪnɪməli ɪnˈveɪsɪv ˈvælvjʊlər ˈsɜːdʒəri/ | Phẫu thuật van xâm lấn tối thiểu |
| 125 | Port-access surgery | /pɔːt ˈæksɛs ˈsɜːdʒəri/ | Phẫu thuật tiếp cận qua cổng |
| 126 | Perioperative Surgical Home | /ˌpɛriˈɒpərətɪv ˈsɜːdʒɪkəl həʊm/ | Ngôi nhà phẫu thuật quanh phẫu thuật |
| 127 | Clinical care pathways | /ˈklɪnɪkəl kɛər ˈpɑːθweɪz/ | Lộ trình chăm sóc lâm sàng |
| 128 | Vital signs | /ˈvaɪtl saɪnz/ | Dấu hiệu sinh tồn |
| 129 | Capillary refill | /kəˈpɪləri riːˈfɪl/ | Thời gian làm đầy mao mạch |
| 130 | Dysoxia | /dɪsˈɒksiə/ | Rối loạn oxy hóa (sử dụng oxy mô bất thường) |
| 131 | Proinflammatory state | /prəʊɪnˈflæmətəri steɪt/ | Trạng thái tiền viêm |
| 132 | G6PD deficiency | /dʒiː sɪks piː diː dɪˈfɪʃənsi/ | Thiếu enzyme G6PD |
| 133 | Methylene blue | /ˈmɛθɪliːn bluː/ | Xanh methylen (thuốc) |
| 134 | Hydroxocobalamin | /haɪˌdrɒksəkəʊˈbæləmɪn/ | Hydroxocobalamin (vitamin B12) |
| 135 | Serotonin syndrome | /ˌsɛrəˈtəʊnɪn ˈsɪndrəʊm/ | Hội chứng serotonin |
| 136 | Hyperchloremic metabolic acidosis | /ˌhaɪpəklɔːˈriːmɪk ˌmɛtəˈbɒlɪk əˈsɪdəʊsɪs/ | Toan chuyển hóa tăng clo |
| 137 | Myocardial stunning | /maɪəˈkɑːdiəl ˈstʌnɪŋ/ | Choáng tim |
| 138 | Cardiac contusion | /ˈkɑːdiæk kənˈtjuːʒən/ | Bầm dập cơ tim |
| 139 | Cardiac power index (CPI) | /ˈkɑːdiæk ˈpaʊər ˈɪndɛks/ | Chỉ số công suất tim |
| 140 | Cerebrovascular | /ˌsɛrɪbrəʊˈvæskjʊlər/ | Mạch máu não |
| 141 | Pulmonary edema | /ˈpʌlmənəri ɪˈdiːmə/ | Phù phổi |
